ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится к устройствам для культивирования клеток, способам и их применениям. Одним конкретным типом клеточной культуры для применения в настоящем изобретении являются трехмерные органотипические клетки или ткани, также известные как сфероиды.
УРОВЕНЬ ТЕХНИКИ
Для изучения влияний одного или более веществ (например, лекарственных средств) на жизнестойкость и ферментативную активность клеток, и т.д. применяли токсикологические исследования с использованием 2-мерных систем клеточных культур. Хотя возможность выращивания клеток плоскими слоями на поверхностях пластмассовых материалов является несложной и позволяет изучать некоторые аспекты клеточной физиологии и реакции на раздражители, такие клеточные культуры не отражают реальную структуру и строение органа. В 2-мерных монослоях исследование внеклеточного матрикса, межклеточных взаимодействий и взаимодействий клеток с матриксом, которые являются существенными для дифференциации, пролиферации и клеточных функций, не представляется возможным.
В 3-мерных системах для культивирования может образовываться функциональная ткань с признаками, сходными с наблюдаемыми in vivo. По сравнению с 2-мерными системами культивирования 3-мерная клеточная культура обеспечивает взаимодействие клеток с окружающей их средой во всех трех измерениях и является физиологически более релевантной. Такие клеточные культуры могут демонстрировать лучшую жизнеспособность, пролиферацию, дифференциацию, морфологические характеристики, реакции на раздражители, метаболизм лекарственных веществ, экспрессию генов и синтез белка, и т.п. 3-мерная клеточная культура может образовывать специфические тканеподобные структуры, а также имитировать функции и реакции реальных тканей физиологически более релевантно, чем традиционные 2-мерные клеточные монослои.
Для 2-мерных и 3-мерных клеточных культур были разработаны разные технологии. Способы выращивания 3-мерной клеточной культуры включают применение планшетов с «висячей каплей», магнитного подвешивания или клеточных каркасов из биоматериалов.
Согласно одному способу получения сфероидов клетки высевают в лунки, в которых им дают агломерироваться на дне лунки. Когда клетки образуют агломерат, они будут образовывать один или множество сфероидов в каждой лунке. Затем сфероиды могут быть использованы для любой требуемой цели, например, в экспериментах по оценке сфероидов, которые могут включать определение их жизнеспособности, морфологических характеристик или функциональных возможностей, и т.п.
Настоящее изобретение выполнено с возможностью обеспечения улучшения 3-мерных клеточных культур.
РАСКРЫТИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Авторы настоящего изобретения исследовали процесс 3-мерного культивирования клеток. Неожиданно они обнаружили, что сфероиды могут иметь склонность к агломерированию или слиянию друг с другом в одном и том же месте во время 3-мерного культивирования клеток с образованием одного большого куска ткани. Это может быть проблематичным, поскольку сфероиды сливаются друг с другом, они образуют более крупный кусок ткани. Это означает, что практически невозможно определить точное число сфероидов, присутствующих в указанном более крупном куске ткани, а это означает, что ткань не может быть использована для других экспериментов, в которых важно знать точное число сфероидов. Без ограничения какой-либо теорией авторы настоящего изобретения заметили, что клетки в середине сфероида имеют меньший доступ к питательным веществам по сравнению с клетками, расположенными вблизи наружной части сфероида, так что клетки, расположенные вблизи середины сфероида, имеют склонность к гибели. Если сфероиды агломерируют (что может происходить спустя 5 часов культивирования клеток), то это становится проблематичным, поскольку большее количество клеток в сфероиде будет иметь меньший доступ к питательным веществам. Это также приводит к дополнительному увеличению количества погибших клеток в сфероиде. Это может быть проблематичным по ряду причин, включая следующие: (1) молекулы, высвобождаемые из погибших клеток, могут оказывать отрицательное влияние на другие клетки в сфероиде; (2) погибшие клетки не являются метаболически активными, поэтому метаболическая активность сфероида будет снижена; и (3) многие анализы требуют применения одного сфероида или известного количества сфероидов. Авторы настоящего изобретения попытались решить проблему агломерирования сфероидов в 3-мерных клеточных культурах. Авторы настоящего изобретения неожиданно обнаружили, что эта проблема может быть легко решена за счет образования прерывистой поверхности на основании камеры для культивирования клеток, такой как лунка многолуночного планшета, таким образом, чтобы сфероиды, находящиеся на прерывистой поверхности в камере, захватывались прерывистой поверхностью. Это обеспечивает эффективное снижение степени агломерирования или слияния сфероидов или же предотвращает его. Положительным моментом является то, что авторы настоящего изобретения обнаружили, что сфероиды можно поддерживать в виде одиночных сфероидов отдельно от других сфероидов.
В соответствии с одним аспектом настоящего изобретения раскрыт способ уменьшения или предотвращения агломерирования сфероидов, включающий использование устройства для культивирования клеток, содержащего: камеру для культивирования клеток, содержащую основание и боковые стенки, проходящие от основания и ограничивающие объем камеры для культивирования клеток; впускное отверстие в основании или боковых стенках камеры для культивирования клеток, выполненное с возможностью передачи текучей среды в камеру; и выпускное отверстие в основании или боковых стенках камеры для культивирования клеток, выполненное с возможностью передачи текучей среды из камеры; причем основание камеры для культивирования клеток имеет прерывистую поверхность, выполненную с возможностью уменьшения или предотвращения агломерирования сфероидов.
В одном варианте осуществления настоящего изобретения способ включает (i) обеспечение наличия одного или более отдельных сфероидов; (ii) перенос отдельного сфероида (-ов) в камеру для культивирования клеток устройства для культивирования клеток; (iii) инкубирование отдельного сфероида (-ов) в устройстве для культивирования клеток; и (iv)получение отдельного сфероида (-ов) на прерывистой поверхности устройства для культивирования клеток.
В одном варианте осуществления настоящего изобретения известное количество отдельных сфероидов переносят на этапе (ii) и известное количество отдельных сфероидов затем получают на этапе (iv).
В одном варианте осуществления настоящего изобретения прерывистая поверхность содержит множество канавок, причем глубина и ширина указанных канавок составляют от приблизительно 200 до приблизительно 1000 мкм, более предпочтительно от приблизительно 200 до приблизительно 600 мкм.
В одном варианте осуществления настоящего изобретения канавки образуют множество концентрических колец на основании камеры для культивирования клеток.
В одном варианте осуществления настоящего изобретения прерывистая поверхность содержит множество отверстий, имеющих закрытое дно и открытую верхнюю часть, причем размеры отверстий, соответствующих по глубине и ширине, приблизительно на 10% больше, чем максимальный диаметр сфероида.
В одном варианте осуществления настоящего изобретения камера для культивирования клеток изготовлена из полиэфирэфиркетона.
В одном варианте осуществления настоящего изобретения камера для культивирования клеток имеет покрытие, причем предпочтительно это покрытие представляет собой покрытие из поли(п-ксилилен) полимера.
В одном варианте осуществления настоящего изобретения в камеру для культивирования клеток устройства для культивирования клеток переносят от приблизительно 40 до приблизительно 100 сфероидов.
В одном варианте осуществления настоящего изобретения поток среды подают в камеру для культивирования клеток устройства для культивирования клеток, причем расход составляет от приблизительно 10 до приблизительно 1000 мкл/мин.
В соответствии с другим аспектом настоящего изобретения раскрыто применение устройства для культивирования клеток для уменьшения или предотвращения агломерирования сфероидов, причем указанное устройство для культивирования клеток содержит: камеру для культивирования клеток, содержащую основание и боковые стенки, проходящие от основания и ограничивающие объем камеры для культивирования клеток; впускное отверстие в основании или боковых стенках камеры для культивирования клеток, выполненное с возможностью передачи текучей среды в камеру; и выпускное отверстие в основании или боковых стенках камеры для культивирования клеток, выполненное с возможностью передачи текучей среды из камеры; причем основание камеры для культивирования клеток имеет прерывистую поверхность, выполненную с возможностью уменьшения или предотвращения агломерирования сфероидов.
В соответствии с другим аспектом настоящего изобретения раскрыт многолуночный планшет для культивирования клеток, причем по меньшей мере одна из лунок многолуночного планшета для культивирования клеток и/или вставка, содержащаяся по меньшей мере в одной из лунок многолуночного планшета для культивирования клеток, имеет прерывистую поверхность, выполненную с возможностью уменьшения или предотвращения агломерирования сфероидов.
В соответствии с другим аспектом настоящего изобретения раскрыта вставка для применения в многолуночном планшете для культивирования клеток, имеющая прерывистую поверхность, выполненную с возможностью уменьшения или предотвращения агломерирования сфероидов.
В одном варианте осуществления планшет и/или вставку изготавливают из полиэфирэфиркетона.
В одном варианте осуществления по меньшей мере одно из лунок или вставки имеет покрытие, причем предпочтительно указанное покрытие представляет собой покрытие из поли(п-ксилилен) полимера.
В одном варианте осуществления по меньшей мере одна лунка и/или вставка содержит отдельный одиночный сфероид.
В одном варианте осуществления основание камеры для культивирования клеток имеет по существу круглую форму.
В одном варианте осуществления диаметр указанного основания составляет от приблизительно 6 мм ± 5% до приблизительно 22 мм ± 5%, предпочтительно диаметр основания составляет приблизительно 6 мм ± 5%, приблизительно 11 мм ± 5%, приблизительно 16 мм ± 5% или приблизительно 22 мм ± 5%.
В одном варианте осуществления прерывистая поверхность содержит множество канавок, причем глубина и ширина канавок соответствует максимальному диаметру сфероида ±10%.
В одном варианте осуществления глубина и ширина множества канавок составляет от приблизительно 200 до приблизительно 1000 мкм, предпочтительно от приблизительно 600 до приблизительно 1000 мкм.
В одном варианте осуществления канавки образуют множество концентрических колец на основании камеры для культивирования клеток.
В одном варианте осуществления прерывистая поверхность содержит множество отверстий, имеющих закрытое дно и открытую верхнюю часть, причем размеры отверстий, соответствующих по глубине и ширине, приблизительно на 10% больше, чем максимальный диаметр сфероида.
В одном варианте осуществления камера для культивирования клеток содержит среду для культивирования клеток для культивирования сфероидов.
В одном варианте осуществления камера для культивирования клеток содержит отдельные сфероиды, захваченные прерывистой поверхностью камеры для культивирования клеток.
В одном варианте осуществления сфероиды представляют собой сфероиды из клеток легкого.
В одном варианте осуществления поток текучей среды от впускного отверстия до выпускного отверстия камеры для культивирования клеток при присутствии в ней текучей среды составляет от приблизительно 10 до приблизительно 1000 мкл/мин, предпочтительно от приблизительно 1 до приблизительно 500 мкл/мин, предпочтительно приблизительно 40 мкл/мин.
В одном варианте осуществления напряжение сдвига в камере для культивирования клеток составляет менее приблизительно 0,1 дин/см2, например, приблизительно 0,08 дин/см2 или менее или же приблизительно 0,04 дин/см2.
В одном варианте осуществления устройство для культивирования клеток представляет собой многолуночный планшет, а каждая камера многолуночного планшета представляет собой лунку, причем указанный многолуночный планшет содержит по меньшей мере две лунки.
В одном варианте осуществления основание по меньшей мере одной из камер имеет плоскую поверхность, на которой отсутствуют разрывы непрерывности.
В одном варианте осуществления по меньшей мере одна камера содержит вставку, расположенную выше основания камеры, причем предпочтительно вставка размещена на верхней части проницаемой мембраны, расположенной внутри указанной камеры, с образованием поверхности, которая способна обеспечивать культивирование клетки на границе раздела воздух/жидкость.
В одном варианте осуществления глубина по меньшей мере одной камеры, имеющей плоскую поверхность, на которой отсутствуют разрывы непрерывности, отличается от глубины по меньшей мере одной камеры, имеющей прерывистую поверхность, причем предпочтительно глубина по меньшей мере одной камеры, имеющей плоскую поверхность, на которой отсутствуют разрывы непрерывности, является меньшей, чем глубина по меньшей мере одной камеры, имеющей прерывистую поверхность.
В одном варианте осуществления камера для культивирования клеток содержит среду для культивирования клеток для культивирования клетки на границе раздела воздух-жидкость.
В одном варианте осуществления камера для культивирования клеток содержит клетки, расположенные на проницаемой мембране, причем указанные клетки способны расти на поверхности раздела воздух-жидкость.
В одном варианте осуществления клетки представляют собой клетки легкого.
В одном варианте осуществления по меньшей мере две лунки сообщаются по текучей среде друг с другом.
Предпочтительно, прерывистая поверхность является такой, как определено в данном документе.
Предпочтительно, прерывистую поверхность обеспечивают на основании с использованием механической обработки на станке с числовым программным управлением или литья под давлением.
Предпочтительно, устройство представляет собой многолуночный планшет.
Предпочтительно, камера представляет собой лунку.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
На фиг. 1 представлено поперечное сечение лунки с множеством концентрических канавок для захвата отдельных сфероидов (обозначенной как «см. деталь B» на фиг. 4). Размеры указаны в миллиметрах.
На фиг. 2 представлен вид сверху лунки с множеством концентрических канавок для захвата отдельных сфероидов (обозначенной как «см. деталь B» на фиг. 4). Размеры указаны в миллиметрах.
На фиг. 3 представлен вид сверху лунки, содержащей микрожидкостный канал (обозначенной как «см. деталь С» на фиг. 4). Размеры указаны в миллиметрах.
На фиг. 4 представлен вид сверху многолуночного планшета, содержащего лунки с множеством концентрических канавок для захвата отдельных сфероидов (обозначенные как «см. деталь B») и лунки, содержащие вставку (обозначенные как «см. деталь С»). Лунки соединены посредством канала таким образом, что каждая из первой лунки («см. деталь B») и второй лунки («см. деталь C») сообщаются друг с другом по текучей среде. Размеры указаны в миллиметрах.
На фиг. 5 представлен вид в поперечном сечении по линии C-C на фиг. 4.
На фиг. 6 представлено поперечное сечение лунки с множеством отверстий на ее основании для обеспечения функции захвата отдельных сфероидов (обозначенной как «см. деталь B» на фиг. 8).
На фиг. 7 представлен вид сверху лунки с множеством отверстий для захвата отдельных сфероидов на ее основании, как показано на фиг. 6. Размеры указаны в миллиметрах.
На фиг. 8 представлен вид сверху многолуночного планшета, содержащего лунки с множеством отверстий для захвата отдельных сфероидов (обозначенные как «см. деталь B») и лунки, содержащие вставку (обозначенные как «см. деталь С»). Лунки соединены посредством канала таким образом, что каждая из первой лунки («см. деталь B») и второй лунки («см. деталь C») сообщаются друг с другом по текучей среде. Размеры указаны в миллиметрах.
На фиг. 9 представлен вид в поперечном сечении по линии C-C на фиг. 8.
На фиг. 10 представлены результаты определения напряжения сдвига, вычисленного для каждой из двух разных лунок, показанных на фигуре, и параметры, используемые для вычисления напряжения сдвига.
На фиг. 11(a) показаны агломерированные сфероиды. На фиг. 11(b) показаны расположенные отдельно неагломерированные сфероиды, полученные в соответствии с настоящим изобретением.
На фиг. 12 показан график, на котором представлено сравнение количества никотина, оставшегося в планшете из полиэфирэфиркетона (PEEK) и планшете из полидиметилсилоксана (PDMS) после 8 часов инкубации при 4 °C.
ОСУЩЕСТВЛЕНИЕ ИЗОБРЕТЕНИЯ
При осуществлении на практике настоящего изобретения применяют, если не указано иное, традиционные методики инженерии, микроинженерии, микробиологии, клеточной биологии и биохимии. Такие методики подробно описаны в литературе, такой как Molecular Cloning: A Laboratory Manual (Молекулярное клонирование: инструкция по проведению лабораторных работ), второе издание (Самбрук (Sambrook) и др., 1989 г.) Cold Spring Harbor Press; Oligonucleotide Synthesis (Олигонуклеотидный синтез) (М.Дж. Гейт (MJ. Gait), ред., 1984 г.); Methods in Molecular Biology (Методы в молекулярной биологии), Humana Press; Cell Biology: A Laboratory Notebook (Клеточная биология: лабораторный журнал) (J. E. CeIMs, ред., 1998 г.) Academic Press; Animal Cell Culture (Клеточная культура животных) (Р.И. Фрешни (R.I. Freshney), ред., 1987 г.); Introduction to Cell and Tissue Culture (Введение в клеточную и тканевую культуру) (Дж. П. Мазер (J. P. Mather) и П.Э. Робертс (P.E. Roberts), 1998 г.) Plenum Press; Cell and Tissue Culture: Laboratory Procedures (Клеточная и тканевая культура: лабораторные процедуры) (А. Дойл (A. Doyle), И.Б. Гриффитс (IB. Griffiths) и Д.Г. Ньювелл (D.G. Newell), ред., 1993-8 гг.) J. Wiley and Sons; Methods in Enzymology (Методы в энзимологии) (Academic Press, Inc.); Current Protocols in Molecular Biology (Современные протоколы в молекулярной биологии) (Ф.М. Аусубель (F.M. Ausubel) и др., ред., 1987 г.); PCR: The Polymerase Chain Reaction (Полимеразная цепная реакция), (Маллис (Mullis) и др., ред., 1994 г.). Процедуры, в которых используют коммерчески доступные наборы и реагенты, как правило, применяют в соответствии с протоколами, определенными производителем, если не указано иное.
Используемые в данном документе технические термины и выражения имеют значение, которое они обычно имеют в соответствующей области молекулярной биологии, микробиологии, клеточной биологии и биохимии. Все нижеследующие определения терминов применимы ко всему содержанию настоящей заявки.
Используемые в данном документе формы единственного числа включают формы единственного и множественного числа, если из контекста явно не следует иное.
Термин «и/или» означает (а) или (b) или же как (а), так и (b).
Термины «содержащий», «содержит» и «состоящий из», используемые в данном документе, являются синонимами терминов «включающий», «включает» или «содержащий в себе», «содержит в себе» и являются включающими или неограничивающими и не исключают дополнительные, не перечисленные детали, элементы или этапы способа.
Термин «состоящий из» означает, что дополнительные компоненты исключены и имеются только упомянутые элементы и ничего больше.
Перечисление числовых диапазонов с помощью конечных точек включает все числа и дробные значения, включенные в соответствующие диапазоны, а также перечисленные конечные точки.
Предусматривается, что термин «приблизительно», используемый в данном документе в отношении измеряемого значения, такого как параметр, количество, продолжительность и т.п., охватывает изменение указанного значения и отклонения от него, в частности, изменение на +/-10% или менее, предпочтительно на +/-5% или менее, более предпочтительно на +/-1% или менее и еще более предпочтительно на +/-0,1% или менее от указанного значения, если такие изменения являются допустимыми при осуществлении настоящего изобретения. Следует понимать, что значение, к которому относится модификатор «приблизительно», также конкретно и предпочтительно раскрыто само по себе.
Принимая во внимание, что термин «один или более», как, например, один или более членов из группы членов, является ясным сам по себе, с целью дополнительного пояснения термин охватывает, среди прочего, ссылку на любой из указанных членов или на любые два или более из указанных членов, как, например, любые ≥3, ≥4, ≥5, ≥6 или ≥7 и т.д. из указанных членов и вплоть до всех указанных членов.
Культивирование клеток
Культивирование клеток в целом относится к извлечению клеток из ткани перед их выращиванием в искусственной среде. Клетки, подлежащие культивированию, могут быть извлечены непосредственно из ткани, содержащей клетки, подлежащие культивированию, и, необязательно, обработаны ферментными или механическими средствами перед культивированием. В качестве альтернативы, клетки, подлежащие культивированию, могут быть получены из ранее образованного штамма или линии клеток.
Культивирование клеток in vitro позволяет получить материал для изучения различных аспектов клетки, в том числе физиологии; биохимии; влияния веществ, в том числе аэрозолей; скрининга и разработки или оптимизации веществ; изучения эффективности веществ; изучения поглощения веществ; скрининговых исследований токсичности; токсикологии; выявления мишеней; фармакокинетики; фармакодинамики и регенеративной медицины, необязательно в режиме реального времени.
Клетки обычно выращивают в устройстве для культивирования клеток, содержащем камеру или емкость. Примеры таких устройств для культивирования клеток включают бутылки, чашки и планшеты, такие как микротитрационные планшеты или многолуночные планшеты или микропланшеты, колбы, такие как обычные колбы и многослойные колбы для выращивания для выращивания, сосуды и биореакторы. Клетки в культуре, как правило, будут прикрепляться к емкости и расти на дне емкости, погруженной в пригодную клеточную культуру или поддерживающую среду. Камера или емкость содержит отверстия для направления потока среды для культивирования клеток в камеру или емкость или же из камеры или емкости.
Устройство для культивирования клеток согласно настоящему изобретению включает камеру для культивирования клеток, содержащую основание и боковые стенки, проходящие от основания и ограничивающие объем камеры для культивирования клеток. Отверстия для направления потока среды для культивирования клеток в камеру и из нее могут включать: (1) впускное отверстие в основании или боковых стенках камеры для культивирования клеток, выполненное с возможностью передачи текучей среды в камеру; и (2) выпускное отверстие в основании или боковых стенках камеры для культивирования клеток, выполненное с возможностью передачи текучей среды из камеры. Камера для культивирования клеток имеет прерывистую поверхность, выполненную с возможностью уменьшения или предотвращения агломерирования сфероидов, как описано ниже. Предпочтительно, впускное отверстие и выпускное отверстие расположены над указанной прерывистой поверхностью.
Устройство для культивирования клеток
В одном варианте осуществления устройство для культивирования клеток представляет собой многолуночный планшет в форме плоского планшета, содержащего по меньшей мере две камеры в форме лунок (например, нескольких или множества лунок). В целом, весь планшет является прямоугольным и емкость лунки может составлять от нескольких мкл до нескольких мл, по необходимости.
По меньшей мере в одной из по меньшей мере двух лунок основание лунки имеет прерывистую поверхность, выполненную с возможностью уменьшения или предотвращения агломерирования сфероидов.
Многолуночный планшет может быть изготовлен в различных форматах, например, он может быть 24-, 48-, 96-, 384- или 1536-луночным/камерным и может быть легко выбран специалистом в данной области техники в зависимости от размера и выбора эксперимента, подлежащего проведению. Многолуночный планшет может представлять собой стандартный планшет, который коммерчески доступен и очень хорошо известен специалистам в данной области техники.
Предпочтительно, если камера имеет форму лунки, ее основание имеет по существу круглую форму.
Предпочтительно, диаметр указанного основания составляет от приблизительно 6 мм ± 5% до приблизительно 22 мм ± 5%, предпочтительно диаметр основания составляет приблизительно 6 мм ± 5%, приблизительно 11 мм ± 5%, приблизительно 16 мм ± 5% или приблизительно 22 мм ± 5%.
Многолуночный планшет может содержать по меньшей мере две последовательно расположенных лунки. Многолуночный планшет может содержать по меньшей мере две линейно расположенных лунки.
Лунки в многолуночном планшет расположены в виде рядов. Например, 8-луночный планшет может быть выполнен в виде 2 линейных рядов из 4 смежных лунок в каждом ряду. В качестве другого примера, 24-луночный планшет может быть выполнен в виде 4 линейных рядов из 6 смежных лунок в каждом ряду. В качестве другого примера, 48-луночный планшет может быть выполнен в виде 6 линейных рядов из 8 смежных лунок в каждом ряду. В качестве другого примера, 96-луночный планшет может быть выполнен в виде 8 линейных рядов из 12 смежных лунок в каждом ряду. При необходимости, многолуночные планшеты даже могут быть изготовлены по индивидуальному заказу с требуемым количеством лунок в планшете.
Устройство для культивирования клеток может быть оснащено крышкой на верхней части устройства, которая позволяет уменьшить испарение среды для культивирования клеток и уменьшить риск загрязнения. Крышку предпочтительно не герметизируют, чтобы воздух мог циркулировать внутри устройства, что может способствовать культивированию/поддержке клеток.
Структура устройства для культивирования клеток конкретно не ограничена при условии, что оно не является цитотоксичным и пригодно для культивирования клеток. Оно может быть изготовлено из акриловой смолы, полигликолевой кислоты, смолы стирольного типа, полимолочной кислоты, сополимерной смолы акрилового или стиролового типа, поликарбонатной смолы, смолы на основе поливинилового спирта, смолы на основе сложного полиэфира, сополимерной смолы этилена или винилового спирта, винилхлоридной смолы, термопластичного эластомера, силиконовой смолы или любой их комбинации. Оно может быть изготовлено из политетрафторэтилена (ПТФЭ), нержавеющей стали (например, 316L/1.4435), полиэфирэфиркетона (PEEK), полипропилена, полисульфона или комбинации двух или более из них. При необходимости, может быть применено покрытие, такое как покрытие из поли(п-ксилиленовых) полимеров или поли-2-гема.
В некоторых вариантах осуществления применение полиэфирэфиркетона является очень предпочтительным, поскольку он обладает тем преимуществом, что не поглощает малые молекулы, такие как молекулы никотина и NNK, как описано ниже.
При необходимости, устройство для культивирования клеток может быть спроектировано с помощью системы автоматизированного проектирования (САПР) или, если устройство для культивирования клеток основано на стандартном многолуночном планшете, можно использовать коммерчески доступный стандартный многолуночный планшет. Спроектированные в САПР планшеты могут быть изготовлены путем микромеханической обработки с применением способов, которые хорошо известны из уровня техники.
Устройство для культивирования клеток, такое как многолуночный планшет, содержит впускное отверстие в основании или боковых стенках камеры для культивирования клеток, выполненное с возможностью передачи текучей среды в камеру, и выпускное отверстие в основании или боковых стенках камеры для культивирования клеток, выполненное с возможностью передачи текучей среды из камеры, в некоторых случаях в соседнюю лунку. Это позволяет обеспечить поток текучей среды, такой как среда для культивирования клеток, над сфероидами и их воздействие на поток текучей среды. В некоторых вариантах осуществления это может быть достигнуто, например, путем образования по меньшей мере одного отверстия в одной или более лунках планшета для культивирования клеток, а затем соединения одной или более лунок посредством отверстия(-й) с каналом (например, трубопроводом или трубкой). В одном варианте осуществления канал (каналы) непосредственно выточен или вдавлен в планшете для культивирования клеток для обеспечения соединения по меньшей мере двух лунок. Предпочтительно, канал (каналы) проходит под камерой для культивирования клеток. Канал может содержать проходы на каждом конце. Канал может представлять собой микрожидкостный канал. Как правило, по меньшей мере один конец прохода соединен с насосом. Каждый конец отверстия может заканчиваться в одном и том же насосе или другом насосе.
Для соединения канала с первым насосом могут быть применены соединители разных видов. Один пример представляет собой люэровский соединитель, такой как люэровский соединитель с фиксатором или простой трубный соединитель.
Канал может быть выполнен с возможностью соединения с сообщением по текучей среде с первым рядом лунок и вторым рядом лунок, и, необязательно, с третьим рядом лунок и т.д., по необходимости. Канал может быть выполнен в виде U-образного изгиба для соединения разных рядов лунок. U-образный изгиб может быть расположен внутри или снаружи устройства для культивирования клеток. Если петля расположена снаружи устройства для культивирования клеток, то соединитель, такой как люэровский соединитель, или люэровский соединитель с фиксатором, или простой трубный соединитель, может быть применен для обеспечения герметичности и включения U-образного изгиба в устройство для культивирования клеток.
Для соединения разных каналов друг с другом может быть применена трубка, такая как силиконовая трубка или трубка PharMed®.
При переносе текучей среды по каналу она может выходить из насоса, а затем возвращаться обратно в насос. При необходимости текучая среда может циркулировать через лунки по часовой или против часовой стрелки. При необходимости может быть использовано более одного насоса.
В некоторых вариантах осуществления поток текучей среды от впускного отверстия до выпускного отверстия камеры для культивирования клеток при присутствии в ней текучей среды составляет от приблизительно 10 до приблизительно 1000 мкл/мин, предпочтительно от приблизительно 1 до приблизительно 500 мкл/мин, предпочтительно от приблизительно 10 до приблизительно 500 мкл/мин, предпочтительно приблизительно 40 мкл/мин или, предпочтительно от приблизительно 1 до приблизительно 60 мкл/мин. Как будет очевидно для специалиста в данной области техники, когда текучая среда протекает через сплошную границу, она будет создавать напряжение сдвига на этой границе, что может привести к нарушению спокойного состояния клеток, подверженных воздействию указанного напряжения сдвига. В контексте настоящего изобретения при перемещении текучей среды по устройству для культивирования клеток будет возникать напряжение сдвига. Требуется, чтобы напряжение сдвига в камере для культивирования клеток составляло менее приблизительно 0,1 дин/см2, например, приблизительно 0,08 дин/см2 или меньше, или 0,04 дин/см2 или меньше, поскольку оно не вызывает нарушения спокойного состояния клеток, подвергающихся воздействию напряжения сдвига. Напряжение сдвига может отличаться в камерах для культивирования клеток различных типов. Например, камера для культивирования клеток с прерывистой поверхностью может характеризоваться напряжением сдвига, составляющим приблизительно 0,04 дин/см2. Например, камера для культивирования клеток с плоской и неразрывной поверхностью может характеризоваться напряжением сдвига, составляющим приблизительно 0,08 дин/см2. Предпочтительно, напряжение сдвига в камере для культивирования клеток с прерывистой поверхностью является более низким, чем в камере для культивирования клеток с плоской и неразрывной поверхностью.
Чтобы для скрининга можно было применять оптический анализ, дно камеры, емкости или лунки может быть выполнено из материала, характеризующегося общим светопропусканием, равным 70%, 80%, 90% или более.
В одном варианте осуществления в устройстве для культивирования клеток используют микрожидкостный планшет для культивирования клеток, который хорошо известен из уровня техники. Например, микрожидкостный планшет для культивирования клеток M04S, производимый компанией Cellasic (Калифорния, США), содержит 4 независимые лунки/камеры, причем диаметр каждой лунки/камеры составляет 2,8 мм при высоте 120 микрон.
В одном аспекте устройство для культивирования клеток согласно настоящему изобретению выполнено в виде многолуночного планшета для культивирования клеток. По меньшей мере одна из лунок многолуночного планшета для культивирования клеток может иметь прерывистую поверхность, выполненную с возможностью уменьшения или предотвращения агломерирования сфероидов. Как будет очевидно для специалиста в данной области техники, устройство для культивирования клеток, такое как многолуночный планшет для культивирования клеток, может содержать различные составные части, которые могут быть соединены друг с другом с образованием полного устройства для культивирования клеток. В процессе эксплуатации не все эти составные части должны присутствовать в устройстве. Таким образом, например, некоторые клетки для использования в настоящем изобретении в некоторых случаях могут быть культивированы во вставках, которые могут быть размещены в лунках планшета для культивирования клеток, как описано ниже в данном документе. Таким образом, в другом аспекте также описана вставка для применения в устройстве для культивирования клеток, таком как многолуночный планшет для культивирования клеток, имеющая прерывистую поверхность, выполненную с возможностью уменьшения или предотвращения агломерирования сфероидов. Устройство для культивирования клеток и/или вставка могут быть изготовлены из полиэфирэфиркетона, как подробно описано в данном документе. Устройство для культивирования клеток и/или вставка могут иметь покрытие, как подробно описано в данном документе, причем предпочтительно указанное покрытие состоит из поли(п-ксилилен) полимера. Устройство для культивирования клеток и/или вставка могут содержать отдельный одиночный сфероид, как подробно описано в данном документе.
Насос
Один или более насосов, применяемые в настоящем изобретении, могут представлять собой поршневые насосы прямого вытеснения, выполненные с возможностью обеспечения циркуляции текучей среды, такие как перистальтические насосы. Как известно из уровня техники, перистальтический насос представляет собой насос, применяемый для перемещения текучей среды. Текучая среда может содержаться в канале, описанном в данном документе, причем указанный канал может представлять собой гибкую трубу, установленную внутри корпуса насоса. В качестве альтернативы, если канал непосредственно выточен (например, вдавлен) в планшете, для соединения выточенного или вдавленного канала с насосом может быть использован переходник. Ротор, прикрепленный к его внешней окружности, сжимает гибкую трубку или канал. При повороте ротора часть трубы или канала при их сжатии сдавливаются и перекрываются, при этом происходит проталкивание текучей среды через трубу или канал.
В одном варианте осуществления насос (насосы) содержит шаговый двигатель или бесщеточный двигатель, содержащий кодирующее устройство.
Каждым двигателем можно управлять с помощью контроллера двигателя, функционированием и датчиками которого можно управлять с помощью микроконтроллера.
Вставки
Некоторые клетки для использования в настоящем изобретении могут быть культивированы во вставках, которые могут быть размещены в лунках устройства для культивирования клеток, по необходимости. Клетки, как правило, выращивают на проницаемой мембране, содержащейся во вставке. Как правило, клетки будут расти на верхней части проницаемой мембраны. Вставку помещают в лунку или камеру. Когда лунку или камеру заполняют текучей средой, такой как среда для культивирования клеток, то текучая среда будет проходить через проницаемую мембрану и вступать в контакт с клетками таким образом, что они могут быть культивированы во вставке. Во вставке можно культивировать клетки разных типов, как описано в данном документе. Вставки коммерчески доступны. В качестве примера могут быть использованы проницаемые вставки для культивирования клеток ThinCertTM (USA Scientific, Флорида, США). Они доступны с различными размерами и различным внешним покрытием, и могут быть легко выбраны специалистом в данной области техники для применения в настоящем изобретении. Каждая вставка может иметь самоустанавливающиеся крепления, которые обеспечивают устранение капиллярных эффектов и максимальный доступ микродозатора в лунку за счет расположения вставки с небольшим смещением относительно центра. Вставки для культивирования клеток ThinCertTM совместимы со стандартными многолуночными планшетами. В качестве другого примера могут быть использованы проницаемые подложки Corning® HTS Transwell® (Sigma Aldrich, Дорсет, Великобритания). Проницаемые подложки Corning® HTS Transwell® содержат матрицу из 24 или 96 лунок с проницаемыми вставками, соединенными жестким желобом. В данном документе раскрыта вставка для применения в многолуночном планшете для культивирования клеток, имеющая прерывистую поверхность, выполненную с возможностью уменьшения или предотвращения агломерирования сфероидов.
Прерывистая поверхность
Согласно настоящему изобретению основание камеры для культивирования клеток, такое как основание лунки в многолуночном планшете, или вставка имеет прерывистую поверхность, выполненную с возможностью уменьшения или предотвращения агломерирования сфероидов. Следует понимать, что не каждая камера, или лунка или вставка, которые могут содержаться в устройстве для культивирования клеток, должны иметь прерывистую поверхность, поскольку не все камеры или лунки могут быть использованы для культивирования сфероидов, а вставка может присутствовать не в каждой лунке. Например, некоторые лунки могут быть использованы для культивирования клеток других типов, которые не требуют применения прерывистой поверхности или вставки. Например, некоторые лунки могут быть использованы для культивирования клеток других типов, которые требуют или не требуют применения вставки для создания поверхности раздела воздух-жидкость.
Предпочтительно, прерывистая поверхность удерживает сфероиды, обеспечивая уменьшение или предотвращение их агломерирования или слияния. Предпочтительно, прерывистая поверхность удерживает одиночные сфероиды, обеспечивая уменьшение или предотвращение их агломерирования или слияния.
В некоторых вариантах осуществления прерывистая поверхность образована одной или более канавками. Канавки могут быть выполнены с возможностью удерживания сфероидов, уменьшая или предотвращая их агломерирование. Размер канавки(-ок) будет, как правило, соответствовать максимальному диаметру сфероида ±10%, так что сфероиды могут быть захвачены или могут удерживаться в канавке(-ах). Предпочтительно, канавка(-и) будет покрывать большую часть основания камеры для культивирования клеток или вставки, поскольку, если поверхность основания камеры для культивирования клеток или вставки будет плоской, может происходить агломерирование сфероидов, что может приводить к образованию больших клеточных агрегатов, что является нежелательным. В некоторых вариантах осуществления по меньшей мере 70%, 80%, 90%, 95%, 99% или 100% основания камеры для культивирования клеток или вставки будет содержать прерывистую поверхность, такую как канавка(-и).
Предпочтительно, глубина и ширина прерывистой поверхности, такой как множество канавок, в основании камеры для культивирования клеток или вставки, составляют от приблизительно 200 мкм до приблизительно 1000 мкм, предпочтительно от приблизительно 200 мкм до приблизительно 600 мкм. Также раскрыты глубина и ширина от приблизительно 600 мкм до приблизительно 1000 мкм. Фактическая глубина и ширина будут определяться размером сфероидов, которые предполагается использовать и захватывать в камере для культивирования клеток или вставке. Таким образом, например, некоторые сфероиды имеют максимальный диаметр приблизительно 600 мкм и в этом случае глубина и ширина прерывистой поверхности, например, представляющей собой множество канавок, будет равна приблизительно 600 мкм ±10%. В некоторых вариантах осуществления требуется, чтобы глубина и ширина прерывистой поверхности, такой как множество канавок, были больше максимального диаметра сфероида, например, на 20%, 30%, 40%, 50% или 60% больше максимального диаметра сфероида. В одном варианте осуществления сфероид имеет максимальный диаметр, составляющий 600 мкм, а прерывистая поверхность, такая как множество канавок, имеет высоту приблизительно 1 мм и ширину приблизительно 1 мм или ширину приблизительно 2 мм.
Как правило, что касается формы канавок, они могут иметь плоское дно, могут быть U-образными, V-образными или V-образными с плоским дном и т.п. В одном варианте осуществления канавки имеют V-образную форму и плоское дно. В одном варианте осуществления максимальная ширина прохода канавки составляет приблизительно 2,4 мм, глубина канавки составляет приблизительно 1 мм и ширина плоского дна в основании канавки составляет приблизительно 400 мкм. Угол между противоположными сторонами канавки в соответствии с данным вариантом осуществления составляет приблизительно 90 градусов.
На фиг. 1 показано устройство 10 для культивирования клеток, содержащее камеру 12 для культивирования клеток с множеством канавок 16 на его основании, содержащем V-образные канавки, каждая из которых имеет плоское дно. Максимальная ширина прохода в канавках составляет приблизительно 2,4 мм, глубина канавок составляет приблизительно 1 мм и ширина плоского дна в основании канавок составляет приблизительно 400 мкм. Угол между противоположными сторонами канавок составляет приблизительно 90 градусов. Хотя множество канавок показано таким образом, что они имеют одинаковую форму, предполагается, что могут быть использованы канавки разной формы. Например, основание камеры для культивирования клеток или вставки может содержать множество канавок, причем форма одной или более канавок отличается. Таким образом, основание камеры для культивирования клеток или вставки может содержать множество канавок, имеющих два или более признаков из плоского дна, U-образной формы, V-образной формы или V-образной формы и плоского дна и т.п.
В некоторых вариантах осуществления канавки образуют множество концентрических колец на основании камеры для культивирования клеток или вставки. В одном варианте осуществления радиус концентрических колец составляет приблизительно 1,05 мм, приблизительно 3,45 и приблизительно 5,85 мм. На фиг. 2 показано основание камеры 12 для культивирования клеток с множеством концентрических колец 17, образованных канавками 16, причем радиус концентрических колец составляет приблизительно 1,05 мм, приблизительно 3,45 и приблизительно 5,85 мм.
На фиг. 4 представлен вид сверху устройства 10 для культивирования клеток в виде многолуночного планшета. Устройство 10 для культивирования клеток содержит множество камер 12 для культивирования клеток в виде лунок, причем лунки содержат либо множество концентрических канавок 17, либо микрожидкостный канал 18. Лунки линейно расположены по рядам. Ряд может содержать по меньшей мере одну лунку, содержащую концентрические канавки 17. Ряд может содержать по меньшей мере одну лунку, содержащую концентрические канавки 17, и по меньшей мере одну лунку, содержащую микрожидкостный канал 18, как показано на фиг. 4.
Канал 19 соединяет лунку, содержащую множество концентрических канавок 17, и лунку, содержащую микрожидкостный канал 18. Каждая лунка имеет впускное отверстие и выпускное отверстие для обеспечения сообщения по текучей среде с возможностью переноса текучей среды в каждую лунку и из каждой лунки. Хотя на фиг. 4 показано, что каждая камера 12 для культивирования клеток в устройстве 10 для культивирования клеток содержит либо концентрические канавки 17, либо микрожидкостный канал 18, для специалиста в данной области техники будет очевидно, что каждая камера 12 для культивирования клеток необязательно должна быть выполнена таким образом и что одна или более камер 12 для культивирования клеток могут не содержать концентрические канавки 17 и/или могут не содержать микрожидкостный канал 18. При необходимости некоторые из камер 12 для культивирования клеток могут быть пустыми и могут не использоваться.
В некоторых вариантах осуществления прерывистая поверхность образована одной или более канавками, которые имеют форму волн, проходящих по всему основанию камеры для культивирования клеток или вставки.
В некоторых вариантах осуществления прерывистая поверхность содержит множество отверстий. Как правило, эти отверстия имеют закрытое дно и открытую верхнюю часть. Указанные отверстия выполнены с возможностью удерживания отдельных сфероидов, уменьшая или предотвращая их агломерирование. Размер отверстий, как правило, будет соответствовать максимальному диаметру сфероида ±10%, так что сфероиды могут быть захвачены или могут удерживаться в отверстиях. Прерывистая поверхность может содержать 10, 20, 30, 40, 50, 60, 70, 80, 90, 100, 110, 120, 130, 140, 150, 160, 170, 180, 190 или 200 или же более отверстий, распределенных по всему дну камеры для культивирования клеток. Прерывистая поверхность может содержать от 130 до 160 отверстий, распределенных по всему дну камеры для культивирования клеток. Прерывистая поверхность может содержать от 130 до 150 отверстий, распределенных по всему дну камеры для культивирования клеток. Прерывистая поверхность может содержать от 130 до 140 отверстий, распределенных по всему дну камеры для культивирования клеток. Как правило, что касается формы отверстий, они могут иметь плоское дно, могут быть U-образными, V-образными или V-образными с плоским дном и т.п. Форма отверстий, в частности, не ограничена при условии, что отверстия способны вместить сфероид с максимальным диаметром ±10% для возможности захвата отдельных сфероидов. В некоторых вариантах осуществления глубина и ширина отверстий составляет от приблизительно 200 до приблизительно 1000 мкм, предпочтительно от приблизительно 600 до приблизительно 1000 мкм. В некоторых вариантах осуществления по меньшей мере 70%, 80% или 90% или более основания камеры для культивирования клеток будет занято отверстиями.
На фиг. 6 показано устройство 20 для культивирования клеток, содержащее камеру (лунку) 22 для культивирования клеток с множеством отверстий 26 на его основании. Указанные отверстия имеют закрытое дно и открытую верхнюю часть. Максимальная ширина каждого отверстия составляет приблизительно 0,8 мм, глубина канавок составляет приблизительно 0,5 мм. Угол между противоположными сторонами отверстий составляет приблизительно 118 градусов. Хотя множество отверстий показано таким образом, что они имеют одинаковую форму, предполагается, что могут быть использованы отверстия разной формы. Например, основание камеры для культивирования клеток или вставки может содержать множество отверстий, причем форма одного или более отверстий отличается. Таким образом, основание камеры для культивирования клеток или вставки может содержать множество отверстий, имеющих два или более признаков из плоского дна, U-образной формы, V-образной формы или V-образной формы и плоского дна и т.п.
На фиг. 7 представлен вид сверху устройства 20 для культивирования клеток, показанного на фиг. 6. Радиус камеры 22 для культивирования клеток составляет приблизительно 8 мм. Радиус основания камеры 22, содержащей множество отверстий 26, составляет приблизительно 5,8 мм. Радиус каждого отверстия 26 составляет приблизительно 0,4 мм.
На фиг. 8 представлен вид сверху устройства 20 для культивирования клеток в виде многолуночного планшета. Устройство 21 для культивирования клеток содержит множество камер 22 для культивирования клеток в виде лунок, причем лунки содержат либо множество отверстий 27, либо микрожидкостный канал 28. Лунки 22 линейно расположены по рядам. Ряд может содержать по меньшей мере одну лунку, содержащую множество отверстий 27. Ряд может содержать по меньшей мере одну лунку, содержащую множество отверстий 27, и по меньшей мере одну лунку, содержащую микрожидкостный канал 28. Канал 29 соединяет лунку, содержащую множество отверстий 27, и лунку, содержащую микрожидкостный канал 28. Каждая лунка имеет впускное отверстие и выпускное отверстие для обеспечения сообщения по текучей среде с возможностью переноса текучей среды в каждую лунку и из каждой лунки.
Хотя на фиг. 8 показано, что каждая камера 22 для культивирования клеток в устройстве 21 для культивирования клеток содержит либо отверстия 27, либо микрожидкостный канал 28, для специалиста в данной области техники будет очевидно, что каждая камера 22 для культивирования клеток необязательно должна быть выполнена таким образом и что одна или более камер 22 для культивирования клеток могут не содержать отверстия 27 и/или могут не содержать микрожидкостный канал 28. При необходимости некоторые из камер 22 для культивирования клеток могут быть пустыми и могут не использоваться.
Глубина множества камер для культивирования клеток при использовании в соответствии с настоящим изобретением не обязательно должна быть одинаковой по всему устройству для культивирования клеток, и предполагается, что камеры для культивирования клеток, такие как лунки многолуночного планшета, могут иметь различную глубину. В одном варианте осуществления камера для культивирования клеток, имеющая прерывистую поверхность или отверстия, имеет глубину, которая больше, чем у камеры для культивирования клеток, содержащей вставку. Канал, соединяющий по меньшей мере две камеры для культивирования клеток, может быть расположен на одной и той же высоте, так что этот канал расположен на разных расстояниях от основания по меньшей мере двух камер для культивирования клеток. Благодаря такой конфигурации поток текучей среды, поступающий в камеру, не нарушает спокойного состояния сфероидов, удерживаемых на прерывистой поверхности, и в то же время текучая среда все еще может проходить через проницаемую мембрану вставки.
Данная конфигурация представлена на фиг. 5, на которой показано устройство 10 для культивирования клеток, содержащее первую камеру 12a для культивирования клеток, с множеством канавок 16 в ее основании и вторую камеру 12b для культивирования клеток с микрожидкостным каналом 18 в ней. Первая камера 12a для культивирования клеток имеет глубину, которая превышает глубину второй камеры 12b для культивирования клеток. Первая камера 12a для культивирования клеток имеет глубину приблизительно 20 мм, а вторая камера 12b для культивирования клеток имеет глубину приблизительно 18,3 мм. Канал 19 сообщается по текучей среде с каждой из камер 12a и 12b для культивирования клеток. Канал 19 расположен дальше от основания первой камеры 12a для культивирования клеток по сравнению со второй камерой 12b для культивирования клеток.
Аналогичная конфигурация также представлена на фиг. 9, на которой показано устройство 20 для культивирования клеток, содержащее первую камеру 22a для культивирования клеток, с множеством отверстий 26 в ее основании и вторую камеру 22b для культивирования клеток с микрожидкостным каналом 28 в ней. Первая камера 22a для культивирования клеток имеет глубину, которая превышает глубину второй камеры 22b для культивирования клеток. Первая камера 22a для культивирования клеток имеет глубину приблизительно 20 мм, а вторая камера 12b для культивирования клеток имеет глубину приблизительно 18,3 мм. Канал 29 сообщается по текучей среде с каждой из камер 22a и 22b для культивирования клеток. Канал 29 расположен дальше от основания первой камеры 22a для культивирования клеток, чем от основания второй камеры 22b для культивирования клеток.
Сфероиды могут быть использованы в различных экспериментах для оценки одного или более из их жизнеспособности, их морфологических характеристик или функциональных возможностей и т.п. В таких экспериментах может быть важно обеспечить, чтобы в каждом эксперименте было использовано одинаковое количество клеток (а значит и одинаковое количество сфероидов). В случае применения поверхности, отличной от прерывистой, в соответствии с настоящим изобретением несколько сфероидов могут сливаться друг с другом с образованием укрупненной ткани. Может быть сложно определить точное количество сфероидов, присутствующих в указанной укрупненной ткани, а это означает, что ткань не может быть использована для других экспериментов. Использование прерывистой поверхности позволяет увеличить расстояние между сфероидами и уменьшить или предотвратить их слияние, а это означает, что их можно использовать для других экспериментов, поскольку известно количество сфероидов.
Таким образом, в соответствии с одним аспектом настоящего изобретения раскрыт способ уменьшения или предотвращения агломерирования сфероидов, включающий использование устройства для культивирования клеток, содержащего: камеру для культивирования клеток, содержащую основание и боковые стенки, проходящие от основания и ограничивающие объем камеры для культивирования клеток; впускное отверстие в основании или боковых стенках камеры для культивирования клеток, выполненное с возможностью передачи текучей среды в камеру; и выпускное отверстие в основании или боковых стенках камеры для культивирования клеток, выполненное с возможностью передачи текучей среды из камеры; причем основание камеры для культивирования клеток имеет прерывистую поверхность, выполненную с возможностью уменьшения или предотвращения агломерирования сфероидов.
В одном варианте осуществления способ включает: (i) обеспечение наличия одного или более отдельных сфероидов; (ii) перенос отдельного сфероида(-ов) в камеру для культивирования клеток устройства для культивирования клеток; (iii) инкубирование отдельного сфероида(-ов) в устройстве для культивирования клеток; и (iv) получение отдельного сфероида(-ов) на прерывистой поверхности устройства для культивирования клеток.
Отдельные обеспечиваемые сфероиды могут быть перенесены из одного объекта, такого как лунка или планшет для культивирования клеток. Указанный объект может быть отделен от камеры для культивирования клеток устройства для культивирования клеток, в которую будут перенесены отдельные сфероиды. Другими словами, указанный объект может быть физически отделен от камеры для культивирования клеток устройства для культивирования клеток. После инкубации в течение некоторого периода времени в каждой лунке многолуночного планшета присутствует или образуется отдельный сфероид или множество отдельных сфероидов. Отсюда отдельные сфероиды можно перенести в камеру для культивирования клеток устройства для культивирования клеток, имеющую описанную в данном документе прерывистую поверхность, которая, необязательно, имеет покрытие. Предпочтительно, известное количество отдельных сфероидов может быть перенесено на этапе (ii) и известное количество отдельных сфероидов затем может быть получено на этапе (iv). В одном варианте осуществления в камеру для культивирования клеток устройства для культивирования клеток переносят от приблизительно 40 до приблизительно 100 сфероидов. Известное количество отдельных сфероидов, полученных на этапе (iv), могут инкубировать в течение некоторого периода времени. Известное количество отдельных сфероидов, полученных на этапе (iv), при необходимости могут подвергать дополнительному экспериментальному анализу. В одном примере настоящего изобретения клетки высевают в каждую лунку многолуночного планшета с необязательной незначительной обработкой для прикрепления и необязательным U-образным дном. Клеткам дают агломерироваться на дне лунки. Как только клетки образуют агломерат, затем они, например, в течение приблизительно 3 дней, будут образовывать сфероид. После инкубации в каждой лунке многолуночного планшета образуется один сфероид или множество сфероидов. Размер сфероида определяется количеством клеток, высеянных в каждую лунку. Отсюда отдельные сфероиды переносят в камеру для культивирования клеток устройства для культивирования клеток, имеющую описанную в данном документе прерывистую поверхность, которая, необязательно, имеет покрытие. Каждый отдельный сфероид независимо переносят из многолуночного планшета в камеру для культивирования клеток устройства для культивирования клеток. В одном варианте осуществления в камеру для культивирования клеток устройства для культивирования клеток переносят от приблизительно 40 до 100 отдельных сфероидов. Наконец, устройство для культивирования клеток присоединяют к насосу, который создает поток среды. Отдельные сфероиды, количество которых известно, могут оставаться в данном состоянии в течение от приблизительно 1 до приблизительно 28 дней перед использованием в других экспериментах.
Источники клеток
В настоящем изобретении используют разные источники клеток. В одном варианте осуществления настоящее изобретение не включает этап выделения или получения образца клеток из объекта. Клетки могут быть криоконсервированными. Клетки могут находиться в 3-мерной клеточной культуре. Клетки могут быть представлены в форме тканей. Клетки могут быть представлены в форме сфероидов. Клетки могут активно делиться. Клетки могут быть культивированы в устройстве для культивирования клеток в присутствии среды для культивирования клеток (например, содержащей питательные вещества (например, белки, пептиды, аминокислоты), источник энергии (например, углеводы), незаменимые металлы и минералы (например, кальций, магний, железо, фосфаты, сульфаты), буферные вещества (например, фосфаты, ацетаты), индикаторы изменения pH (например, феноловый красный, бромкрезоловый пурпурный), селективные вещества (например, химические вещества, противомикробные вещества), и т.д.). Среда для культивирования одиночных клеток может быть использована для выращивания клеток одного типа или разных типов. Для выращивания клеток разных типов могут быть использованы разные среды для культивирования клеток. При циркулировании сред для культивирования клеток в соответствии с настоящим изобретением будет происходить смешивание разных сред для культивирования клеток.
В некоторых вариантах осуществления в среду для культивирования клеток или среды для культивирования клеток добавляют одно или более веществ. Клетки могут быть выделены из ткани или текучей среды с применением способов, хорошо известных в данной области техники. Клетки могут быть отдифференцированы из стволовых клеток, таких как эмбриональные стволовые клетки или индуцированные плюрипотентные стволовые клетки, или непосредственно отдифференцированы из соматических клеток. Клетки могут представлять собой встречающиеся в природе клетки или измененные клетки (например, клетки, содержащие одно или более не встречающихся в природе генетических изменений). Клетка может представлять собой клетку с патологией или клетку с моделью патологии. Например, клетка может представлять собой раковую клетку или клетку, которая может быть индуцирована в гиперпролиферативное состояние (например, трансформированная клетка).
Клетки могут представлять собой клетки людей или животных или могут быть получены из клеток человека или животных, включая любой из множества видов млекопитающих, предпочтительно человека, но включая крыс, мышей, свиней, кроликов и нечеловекообразных приматов, и т.п. Клетки и линии клеток могут быть получены из коммерческих источников. Клетки могут быть получены из ткани или органа любого требуемого типа, в том числе, без ограничения, из надпочечных желез, мочевого пузыря, кровеносного сосуда, кости, костного мозга, головного мозга, хряща, шейки матки, роговицы, эндометрия, пищевода, желудочно-кишечного тракта, иммунной системы (например, T-лимфоциты, B-лимфоциты, лейкоциты, макрофаги и дендритные клетки), печени, легкого, лимфатической системы, мышцы (например, сердечной мышцы), нервной ткани, яичников, поджелудочной железы (например, островковые клетки), гипофиза, предстательной железы, почки, слюнной железы, кожи, сухожилия, яичка и щитовидной железы, или происходить из них.
Одним типом клеток, представляющим особый интерес, являются клетки легкого, в том числе клетки легочного эпителия. Клетки бронхиального эпителия и/или эпителия дыхательных путей, в частности, являются применимыми для настоящего изобретения. Клетки бронхиального эпителия человека могут быть отобраны путем соскабливания с легких донора в ходе процедуры бронхоскопии. В одном варианте осуществления клетки легкого представляют собой нормальные клетки бронхиального эпителия человека (Normal Human Bronchial Epithelial, NHBE). Клетки легочного эпителия могут быть культивированы в виде монослоя недифференцированных клеток или из них можно дополнительно вырастить органотипическую ткань, подобную легочному эпителию, на поверхности раздела воздух-жидкость. Клетки легочного эпителия могут быть получены от исследуемых людей или животных с разными патологиями, в том числе от исследуемых людей, классифицированных как курящие или некурящие.
Другим типом клеток, представляющим особый интерес, являются клетки печени. В одном варианте осуществления используемыми клетками являются гепатоциты. Гепатоциты представляют собой клетки печени, которые составляют 70-85% цитоплазматической массы печени. Функциональные возможности гепатоцитов сильно зависят от их способности образовывать фенотип полярности, который устанавливается только при 3-мерном культивировании. Одним из источников клеток печени являются первичные гепатоциты, которые представляют собой модель in vitro, широко используемую для исследования многочисленных аспектов физиологии и патологии печени. Способ, используемый для выделения гепатоцитов человека, может быть основан на двухэтапной перфузии донорской печени коллагеназой. Однако данные клетки не экспрессируют ферменты метаболизма в течение более чем 5 дней. Другим ограничением является их низкая жизнеспособность. Эти недостатки могут быть преодолены за счет применения альтернативных, долгоживущих линий клеток печени, таких как линии клеток-предшественников печени человека или животного. Одним таким примером линии клеток-предшественников печени человека является линия клеток HepaRG™ (ThermoFisher Scientific). Клетки HepaRG™ имеют многие характеристики первичных гепатоцитов человека. Они характеризуются более высокой экспрессией печеночноспецифических генов и генов метаболизма по сравнению с первичными гепатоцитами и большей продолжительностью жизни. Реорганизация клеток HepaRG™ в 3-мерные сфероиды дополнительно увеличивает как продолжительность их жизни, так и возможности, касающиеся метаболизма, что позволяет предположить, что сфероиды могут обеспечить лучшую альтернативную модель печени in vitro для токсикологического тестирования. Сфероиды из клеток печени также могут быть созданы из смеси первичных гепатоцитов и звездчатых клеток печени или первичных гепатоцитов и стволовых клеток, полученных из жировой ткани.
В одном варианте осуществления клетка легкого представляет собой клетку легочного эпителия, такую как клетка бронхиального эпителия и/или эпителия дыхательных путей.
В одном варианте осуществления клетка печени представляет собой клетку гепатоцита, предпочтительно клетку HepaRG.
Комбинации клеток
Также рассматривается применение комбинаций любых клеток, описанных в данном документе. Рассматривается применение комбинаций любых клеток, описанных в данном документе, в устройстве для культивирования клеток или же в системе или устройстве, содержащих указанное устройство для культивирования клеток. Одним примером комбинации клеток является комбинация клеток печени и клеток легкого. Рассматривается комбинация клетки легочного эпителия, такой как клетка бронхиального эпителия и/или эпителия дыхательных путей, и клетки печени, такой как клетка HepaRG™. При необходимости, вместе с указанной комбинацией могут быть использованы дополнительные клетки.
Разные клетки комбинации могут быть культивированы в отдельных лунках.
3-мерное культивирование клеток
Настоящее изобретение включает применение «3-мерного культивирования клеток», которое включает любой способ, обеспечивающий культивирование клетки в 3-х измерениях с применением или без применения матрикса или клеточного каркаса, такого как проницаемая мембрана во вставке. Был разработан ряд разных способов 3-мерного культивирования клеток, в том числе сфероидных культур и органотипических культур. 3-мерные клетки можно выращивать и/или поддерживать в устройстве для культивирования клеток, описанном в данном документе.
Термин «сфероид» предполагает значение, которое он обычно имеет в данной области техники, а именно он представляет собой либо одиночную клетку, делящуюся с образованием 3-мерной шарообразной структуры, либо 3-мерный агрегат из множества клеток, с применением или без применения матрикса или клеточного каркаса для поддержания 3-мерного роста клеток в пределах сфероида. 3-мерный сфероид может представлять собой адгезивный сфероид или сфероид, растущий в суспензии.
В некоторых вариантах осуществления сфероид содержит клетки одного типа. В некоторых вариантах осуществления сфероид содержит клетки более чем одного типа. В некоторых вариантах осуществления, в которых выращивают более одного сфероида, каждый сфероид может принадлежать к одному и тому же типу, в то время как в других вариантах осуществления выращивают сфероиды двух или более разных типов.
3-мерные сфероиды в большей степени похожи на ткань in vivo в том, что касается их клеточной коммуникации и формирования внеклеточного матрикса. Указанный матрикс позволяет клеткам перемещаться в пределах сфероида подобно тому, как клетки перемещаются в живой ткани. Таким образом, сфероиды представляют собой значительно улучшенные модели дифференциации, выживаемости, миграции клеток, поляризации клеток, экспрессии генов и роста.
Сфероиды можно собирать и изучать с применением разных способов, хорошо известных в данной области техники, в том числе колориметрического, флуоресцентного и люминесцентного способов анализа с выполнением измерений с помощью планшет-ридера или их можно легко исследовать с применением микроскопии. Дополнительные способы включают вестерн-, нозерн- или саузерн-блоттинг, гистологические методики (например, иммуногистохимический анализ, гибридизацию in situ, иммунофлуоресценцию) и т.п. Также рассматривается применение способов оптической визуализации, таких как обращенная светлопольная микроскопия и флуоресцентная микроскопия.
Варианты применения 3-мерных сфероидов включают изучение пролиферации клеток и тканей in vitro в среде, которая наиболее приближена к существующей in vivo, скрининг соединений, токсикологические анализы, клеточную терапию, доставку клеток, доставку веществ, биохимическое замещение, получение биологически активных молекул, тканевую инженерию, получение биоматериалов и клинические испытания и т.п.
Применение сфероидов в 3-мерном культивировании клеток в целом рассматривается в Expert Opin. Drug Discov. (2015) 10, 519-540.
3-мерные системы культивирования органов, в частности, в миниатюризированной форме, могут быть применены в настоящем изобретении, поскольку они позволяют изучать функционирование органов в микромасштабе. Может быть изучена реакция на определенные раздражители, реакция на одно или более веществ и фармакокинетическое поведение таких веществ. Миниатюризированные системы для 3-мерного культивирования клеток обеспечивают возможность комплексного изучения групп клеток или органов. Это позволяет воспроизводить вариабельность взаимодействия между разными тканями. 3-мерноекультивирование органов может быть органотипическим, т.е. оно направлено на воспроизведение основных функций органа или системы органов. Также рассматривается миниатюризированная жидкостная система, соединяющая лунки друг с другом.
В одном аспекте предложено культивирование сфероидов, при котором сфероиды принимают форму отдельных одиночных сфероидов через 5 часов культивирования или через 5 дней культивирования. Другими словами, сфероиды не агломерируют или не сливаются друг с другом.
3-мерные культуры на основе клеток печени
Печень играет основную роль в детоксикации, метаболизме углеводов, липидов и белков, а также в биотрансформации эндогенных и экзогенных веществ. Функциональные возможности печени тесно связаны с комплексом высокоспециализированных клеток, большинство из которых представляют собой гепатоциты, включенные в сложную 3-мерную структуру, состоящую из так называемых долек. В результате биотрансформации соединений обычно образуются нетоксичные и лучше растворимые метаболиты, однако иногда могут образовываться более токсичные метаболиты, вызывающие гепатотоксичность.
Гепатоциты можно поддерживать в виде 3-х мерных структур с применением различных способов, в том числе путем применения многослойной культуры, клеточного каркаса из твердых материалов, такого как полистирольные клеточные каркасы, гидрогелей, таких как коллаген I типа, или самосборки гепатоцитов в сфероиды.
Хотя свежевыделенные первичные гепатоциты человека могут представлять собой тип клеток печени, предпочтительный для использования, их доступность ограничена. Другие варианты линий клеток печени человека включают клетки HepG2 и Hep2/C3A. Наиболее подходящим источником клеток является линия клеток HepaRG™. Другими источниками гепатоцитов человека являются гепатоциты, полученные из эмбриональных стволовых клеток человека (hESC), и гепатоциты, полученные из индуцированных плюрипотентных стволовых клеток (iPSC).
В одном варианте осуществления сфероид представляет собой клетку печени или получен из нее с образованием 3-мерного сфероида из клеток печени. Такие сфероиды из клеток печени могут быть получены с использованием различных способов, известных из уровня техники и описанных, например, в ALTEX (2014) 31, 441-477 и Toxicol. Sci.(2013) 133, 67-78.
3-мерные культуры на основе клеток легкого
Поскольку морфологические характеристики дыхательного тракта изменяются от верхних к нижним дыхательным путям, было получено множество разных моделей клеточных культур с применением первичных клеток эпителия дыхательных путей или линий клеток, и их применение рассматривается в настоящем раскрытии. Выбор конкретной клетки или линии клеток для применения будет зависеть от участка дыхательного тракта, представляющего интерес для данного исследования.
Поскольку поверхность легкого подвергается воздействию воздуха, клеточную модель можно культивировать на поверхности раздела воздух-жидкость с целью более реалистичной имитации легкого.
В одном варианте осуществления 3-мерная культура легкого представляет собой клетку легкого или получена из нее с образованием 3-мерной органотипической ткани. Такие легочные ткани могут быть получены с использованием различных способов, известных из уровня техники и описанных, например, в ALTEX (2014) 31, 441-477 и Toxicol.(2013) 133, 67-78.
Скрининг
Устройство для культивирования клеток согласно настоящему изобретению может быть использовано при отборе образцов или скрининге, в некоторых случаях в режиме реального времени. Влияние одного или более веществ на клетки, содержащиеся в устройстве для культивирования клеток, в некоторых случаях может быть определено в режиме реального времени. Планшет для культивирования клеток и/или устройство для отбора образцов можно использовать, например, в разработке средств/лекарственных средств, определении характеристик средств/лекарственных средств, исследовании эффективности и исследовании токсичность и т.п. Его можно использовать в качестве части устройства для отбора образцов или скрининга. Такое исследование включает, без ограничения, оценку фармакологического эффекта, оценку канцерогенности, оценку характеристик средств для медицинской визуализации, оценку периода полувыведения, оценку радиационной безопасности, исследование генотоксичности, исследование иммунотоксичности, исследование воздействия на репродуктивность и развитие, оценку взаимодействий лекарственных средств/веществ, оценку дозы, оценку поглощения, оценку распределения, оценку метаболизма, исследования удаления из организма и т.п. Для определенных исследований могут быть использованы определенные типы клеток (например, гепатоциты для исследования гепатотоксичности, клетки эпителия проксимальных почечных канальцев для исследования нефротоксичности, клетки сосудистого эндотелия для исследования ангитоксичности, нейроны и клетки глии для исследования нейротоксичности, кардиомиоциты для исследования кардиотоксичности).
В одном аспекте описан способ in vitro оценки реакции клетки или ткани на определенное вещество, включающий: (i) приведение клетки или ткани, содержащейся в устройстве для культивирования клеток, описанном в данном документе, в контакт по меньшей мере с одним веществом; и (ii) измерение одной или более реакций после контакта по меньшей мере с одним веществом; причем различие в одной или более реакциях до и после контакта по меньшей мере с одним веществом указывает на то, что это вещество модулирует реакцию клетки или ткани.
В другом аспекте описан способ in vitro оценки реакции двух или более клеток, тканей или органов на некоторое вещество, включающий: (i) приведение по меньшей мере одного из клеток, тканей или органов, содержащихся в устройстве для культивирования клеток, описанном в данном документе, в контакт по меньшей мере с одним веществом; и (ii) измерение одной или более реакций в одном или более из клеток, тканях или органах после контакта по меньшей мере с одним средством; причем различие в одной или более реакциях в одной или более клетках до и после контакта по меньшей мере с одним веществом указывает на то, что это вещество модулирует реакцию по меньшей мере одной клетки, ткани или одного органа.
Предпочтительно, измеряют или определяют влияние или проникновение по меньшей мере одного вещества в клетку или ткань. Предпочтительно, измеряют или определяют биоактивацию по меньшей мере одного вещества в клетке или ткани. Предпочтительно, измеряют или определяют метаболизм по меньшей мере одного вещества в клетке или ткани. Указанные этапы можно выполнять одновременно или последовательно относительно друг друга.
Влияние одного или более веществ на проникновение некоторого вещества, такого как аэрозоль, в одну (один) или более клеток, тканей или органов, а также его биоактивацию или метаболизм в другой клетке или ткани может быть определено с использованием различных способов, хорошо известных в данной области техники.
Вещество может быть добавлено в устройство для культивирования клеток и его влияние на культивированную клетку или ткань, содержащуюся в указанном устройстве, можно контролировать или определять. Примеры влияний, которые могут быть измерены, включают расход кислорода, выделение углекислого газа, жизнеспособность клеток, экспрессию белка, активность фермента, проникновение, проницаемость/барьерную функцию, выработку поверхностно-активного вещества, реакцию на цитокины, функцию переносителя, экспрессию цитохрома P450, секрецию альбумина и т.п.
Устройство для культивирования клеток могут подвергать воздействию аэрозоля и его влияние на культивируемую клетку или ткань, содержащуюся в нем, можно отслеживать или определять. Примеры влияний, которые могут быть измерены, включают расход кислорода, выделение углекислого газа, жизнеспособность клеток, экспрессию белка, активность фермента, проникновение, проницаемость/барьерную функцию, выработку поверхностно-активного вещества, реакцию на цитокины, функцию переносителя, экспрессию цитохрома P450, секрецию альбумина и т.п.
Параллельно можно проводить множество анализов с разными концентрациями вещества с получением отличающейся реакции на разные концентрации. Как известно из уровня техники, в способе определения эффективной концентрации вещества, как правило, используют диапазон концентраций, получаемый в результате разбавления 1:10 или с применением другой степени разбавления в соответствии с логарифмической шкалой. В случае необходимости концентрации можно дополнительно скорректировать путем выполнения второй серии разведений. Как правило, одну из этих концентраций применяют для регулирования с понижением.
Вещество
Вещество может представлять собой любое представляющее интерес соединение и включает низкомолекулярные органические соединения, полипептиды, пептиды, относительно высокомолекулярные углеводы, полинуклеотиды, жирные кислоты и липиды, наночастицы, аэрозоль или же один или более компонентов аэрозоля и т.п., лекарственное средство, токсин, патоген, антиген, антитело и малую молекулу и т.п. Вещества могут быть подвергнуты скринингу по отдельности или же в наборах или комбинаторных библиотеках соединений. Вещества могут быть получены из широкого спектра источников, включая библиотеки синтетических или природных соединений. Могут быть использованы библиотеки природных соединений в виде бактериальных, грибных, растительных и животных экстрактов. Природные или полученные синтетическим путем библиотеки и соединения, модифицированные с применением традиционных химических, физических и биохимических способов, могут быть использованы для получения комбинаторных библиотек. Известные фармакологические вещества могут быть подвергнуты направленным или случайным химическим модификациям, таким как ацилирование, алкилирование, этерификация, превращение в кислоту с получением структурных аналогов для скрининга. При скрининге с применением комбинаторной библиотеки скрининг может быть осуществлен в отношении большой библиотеки химически сходных или отличающихся веществ. При комбинаторном скрининге количество обнаруженных совпадений пропорционально количеству исследуемых веществ. В отношении большого количества соединений, которое может достигать нескольких тысяч исследуемых в день соединений, можно провести скрининг, в ходе которого может быть использована автоматизированная лабораторная система и робототехника. В уровне техники можно найти много примеров способов синтеза молекулярных библиотек. Низкомолекулярное органическое соединение включает соединение с молекулярной массой, которая меньше приблизительно 5000 дальтонов, обычно менее, чем приблизительно 2500, обычно менее, чем приблизительно 2000, еще чаще менее, чем приблизительно 1500, предпочтительно от приблизительно 100 до приблизительно 1000 дальтонов. Низкомолекулярные органические соединения могут представлять собой биологические или синтетические органические соединения. Атомы, присутствующие в низкомолекулярном органическом соединении, как правило, входят в группу, состоящую из атомов углерода, водорода, кислорода и азота, и могут включать атомы галогенов, бора, фосфора, селена и серы, если они представлены в фармацевтически приемлемой форме. Как правило, кислород, азот, сера или фосфор, если они присутствуют, связаны с углеродом, или же с одним или более из них, или с водородом с образованием различных функциональных групп, таких как, например, карбоновые кислоты, спирты, тиолы, карбоксамиды, карбаматы, сложные эфиры карбоновых кислот, амиды, простые эфиры, тиоэфиры, сложные тиоэфиры, фосфаты, фосфонаты, олефины, кетоны, амины, альдегиды и т.п. Низкомолекулярные органические соединения в качестве термина, используемого в данном документе, также включают низкомолекулярные пептиды, низкомолекулярные олигонуклеотиды, низкомолекулярные полисахариды, жирные кислоты, липиды и т.п., имеющие молекулярную массу менее, чем приблизительно 5000 дальтонов.
Примеры фармацевтических веществ описаны в The Pharmacological Basis of Therapeutics (Фармакологическая основа терапии), Goodman and Gilman, McGraw-Hill, Нью-Йорк, N.Y., (1996 г.), девятое издание. Вещество может представлять собой токсин.
Анализу могут быть подвергнуты вещества в растворе и твердых образцах, которые могут быть растворены в пригодном растворителе. Вещества в газообразной форме также могут быть подвергнуты анализу путем воздействия на образцы газом в течение некоторого периода времени. Образцы, представляющие интерес, включают образцы окружающей среды, биологические образцы, производственные образцы, библиотеки соединений, а также синтетические и встречающиеся в природе соединения.
Кроме того, скрининг может быть проведен в отношении полипептидов, которые имеют молекулярную массу, равную по меньшей мере приблизительно 5000 дальтонов, еще чаще по меньшей мере приблизительно 10 000 дальтонов. Исследуемые полипептиды, как правило, будут иметь молекулярную массу от приблизительно 5000 до приблизительно 5 000 000 дальтонов или больше, еще чаще будут иметь молекулярную массу от приблизительно 20 000 до приблизительно 1 000 000 дальтонов. Может быть проанализирован широкий спектр полипептидов, таких как, например, семейство полипептидов, имеющих сходные характерные структурные признаки, полипептидов, имеющих конкретные биологические функции, полипептидов, связанных с определенными микроорганизмами, в частности болезнетворными микроорганизмами. Такие полипептиды включают цитокины или интерлейкины, ферменты, протамины, гистоны, альбумины, иммуноглобулины, склерополипептиды, фосфополипептиды, мукополипептиды, хромополипептиды, липополипептиды, нуклеополипептиды, гликополипептиды, T-клеточные рецепторы, протеогликаны, соматотропин, пролактин, инсулин, пепcин, полипептиды, имеющиеся в плазме крови человека, факторы свертывания крови, факторы, определяющие группу крови, пептидные и полипептидные гормоны, раковые антигены, тканеспецифические антигены, маркеры алиментарного статуса, связанные с питанием маркеры и синтетические пептиды, которые могут быть или не быть гликированными.
Скрининг может быть проведен для полинуклеотидов. Исследуемый полинуклеотид может представлять собой природное соединение или синтетическое соединение. Полинуклеотиды включают олигонуклеотиды и состоят из природных нуклеотидов, таких как рибонуклеотиды и дезоксирибонуклеотиды, и их производных, хотя также рассматриваются неприродные миметики нуклеотидов, такие как 2'-модифицированные нуклеозиды, пептидные нуклеиновые кислоты и олигомерные нуклеозидфосфонаты. Полинуклеотиды с более высокой молекулярной массой могут иметь от приблизительно 20 до приблизительно 5 000 000 или более нуклеотидов.
Одна или более переменных величин, которые могут быть измерены, включают поддающиеся количественному определению элементы клеток, субклеточный материал, субклеточные компоненты или клеточные продукты, в частности, элементы, которые могут быть точно измерены с применением высокопроизводительной аналитической системы или устройства. Выходные данные могут представлять собой признак, условие, состояние или функцию любой клетки, клеточного компонента или клеточного продукта, в том числе жизнеспособность, дыхание, метаболизм, детерминанту клеточной поверхности, рецептор, белок или его конформационную или посттрансляционную модификацию, липид, углевод, органическую или неорганическую молекулу, ДНК, РНК и т.п. или часть, полученную из такого клеточного компонента. Хотя переменная(-ые) величина(-ы) может (могут) обеспечивать количественные считываемые данные, в некоторых случаях может быть получен полуколичественный или качественный результат. Считываемые переменные величины могут включать, например, одиночное значение, или среднее значение, или медианное значение, или их дисперсию.
Могут быть использованы разные способы измерения переменной(-ых) величины (величин) для определения реакции клетки, ткани или органа на вещество. Одним из способов измерения количества присутствующего вещества является мечение вещества поддающимся выявлению компонентом, который может быть флуоресцентным, люминесцентным, радиоактивным, ферментативно активным и т.п. Для мечения биомолекулы, структуры или типа клетки доступны флуоресцентные и люминесцентные компоненты. Иммунофлуоресцентные компоненты могут быть выполнены с возможностью связывания не только с конкретными белками, но и также с конкретными конформациями, продуктами расщепления или модификациями участка, такими как фосфорилирование. Отдельные пептиды и белки могут быть созданы для выполнения автофлуоресценции. Могут быть использованы способы иммунологического анализа, такие как иммуногистохимический анализ, радиоиммунологический анализ (radioimmunoassay, RIA) или твердофазный иммуноферментный анализ (ELISA), а также связанные неферментативные способы. В этих способах используют определенные антитела в качестве репортерных молекул, которые, в частности, являются применимыми из-за их высокой степени специфичности прикрепления к одной молекулярной мишени. Клеточный твердофазный иммуноферментный анализ или соответствующие неферментативные или флуоресцентные способы обеспечивают измерение параметров клеточной поверхности.
Результаты скрининговых анализов могут быть сравнены с результатами, полученными для эталонных соединений, кривых изменения концентрации, контролей и т.п. Вещество может представлять собой аэрозоль, такой как дым или аэрозоль, полученный из дыма.
Аэрозоль
Варианты осуществления настоящего изобретения могут быть использованы для изучения влияния аэрозоля на клетки, органы или ткани или же проникновения аэрозоля в клетки, органы или ткани, когда они содержатся в устройстве для культивирования клеток согласно настоящему изобретению. Аэрозоль может быть получен или образован с помощью устройства, образующего аэрозоль. Курительные изделия и изделия для курения относятся к типам устройств, образующих аэрозоль. Примеры курительных изделий или изделий для курения включают без ограничения сигареты, сигариллы и сигары. В некоторых устройствах, образующих аэрозоль, табачную композицию или другой материал, образующий аэрозоль, вместо сжигания нагревают с помощью одного или более электрических нагревательных элементов для получения аэрозоля. В нагреваемом устройстве, образующем аэрозоль, другого типа аэрозоль образуется в результате передачи тепла от горючего топливного элемента или источника тепла к физически отделенному материалу, образующему аэрозоль, который может быть расположен внутри, вокруг или ниже по потоку относительно источника тепла. Как правило, в нагреваемых курительных изделиях аэрозоль образуется в результате передачи тепла от источника тепла к физически отделенному субстрату или материалу, образующему аэрозоль, который может быть расположен внутри, вокруг или ниже по потоку относительно источника тепла. При курении летучие соединения высвобождаются из материала, образующего аэрозоль, за счет передачи тепла от источника тепла и захватываются воздухом, втягиваемым через курительное изделие. По мере охлаждения высвобождаемых соединений, они конденсируются с образованием аэрозоля, который вдыхается пользователем. Используемый в данном документе термин «материал, образующий аэрозоль» используется для описания материала, способного при нагревании высвобождать летучие соединения, которые могут образовывать аэрозоль. Материал, образующий аэрозоль, может быть растительного происхождения. Примеры материалов, образующих аэрозоль, включают, без ограничения, табачные композиции, табаки, табачный экстракт, резаный табак, резаный наполнитель, сушеный табак, взорванный табак, гомогенизированный табак, восстановленный табак и табак для трубки. Материал, образующий аэрозоль, в качестве альтернативы может содержать материал нерастительного происхождения.
Аэрозоль может присутствовать в виде дыма. Используемый в данном документе термин «дым» используют для описания типа аэрозоля, получаемого при сгорании, например, при курении сигарет, или при сгорании материала, образующего аэрозоль. Дым содержит различные средства, которые в случае необходимости могут быть обеспечены в виде отдельных соединений для исследования. Примеры таких средств включают сухие твердые частицы, не содержащие никотин, монооксид углерода, формальдегид, ацетальдегид, ацетон, акролеин, пропионовый альдегид, кротоновый альдегид, метилэтилкетон, бутиральдегид, бензо[a]пирен, фенол, м-крезол, o-крезол, п-крезол, катехол, резорцин, гидрохинон, 1,3-бутадиен, изопрен, акрилонитрил, бензол, толуол, пиридин, хинолин, стирол, Н'-нитрозонорникотин (NNN), Н′-нитрозоанатабин (NAT), Н′-нитрозоанабазин (NAB), 4-(метилнитрозамино)-1-(3-пиридил)-1-бутанон (NNK), 1-аминонафталин, 2-аминонафталин, 3-аминобифенил, 4-аминобифенил, оксид азота (NOx), цианистоводородную кислоту, аммиак, мышьяк, кадмий, хром, свинец, никель, селен и ртуть.
Устройство для культивирования клеток, описанное в данном документе, могут подвергать воздействию дыма в течение разной продолжительности времени. Дым может быть доставлен с помощью модуля Vitrocell Exposure (см. Chem Cent J. (2014) 8(1):62). Может быть выполнено определенное количество затяжек одной сигареты и определенное количество затяжек за минуту воздействия, а количество сигарет может быть изменено для регулирования концентрации воздействия. Эталонные сигареты, такие как эталонные сигареты 3R4F, могут быть использованы в качестве источника дыма и могут быть выкурены на курящем роботе в базовом соответствии с режимом курения, установленным Международной организацией по стандартизации (ISO 2000).
Производство
Устройство для культивирования клеток может быть изготовлено с использованием различных способов изготовления. Например, устройство может быть собрано с использованием деталей, изготовленных способом литья под давлением, или изготовлено в виде однокомпонентной детали. Прерывистая поверхность может быть изготовлена или нанесена с применением механической обработки на станке с числовым программным управлением или литья под давлением. Хотя это и не обязательно, для обеспечения оптической прозрачности предпочтительной является толщина не более 2 мм. Отдельные детали могут быть собраны с применением различных способов, включая, но без ограничения: адгезионное соединение или соединение растворителем, термосваривание или спаивание, обжим, ультразвуковую сварку, лазерную сварку и/или любой другой способ, обычно применяемый для обеспечения герметизации между деталями.
Полиэфирэфиркетон
Как описано в данном документе, устройство для культивирования клеток может быть изготовлено из полиэфирэфиркетона, поскольку он обладает преимуществом, состоящим в том, что он не поглощает малые молекулы. Было исследовано, например, поглощение полиэфирэфиркетоном никотина и NNK, и было установлено, что указанные молекулы не захватываются этим материалом. Это может быть важно, поскольку в случае использования полиэфирэфиркетона не будет происходить захват малых гидрофобных молекул. Таким образом, такие устройства для культивирования клеток, в частности, пригодны для исследования действия лекарственных средств на клетки или ткани, помещенные в это устройство или другие подобные устройства, без какого-либо риска изменения концентрации лекарственного средства (или концентрации его метаболитов) материалом. Соответственно, раскрыто устройство для культивирования клеток или вставка для использования в устройстве для культивирования клеток, содержащем полиэфирэфиркетон или состоящем из него.
Соответственно, также раскрыто устройство для культивирования клеток, изготовленное (исключительно) из полиэфирэфиркетона.
Также раскрыт планшет для культивирования клеток, содержащий полиэфирэфиркетон или состоящий из него.
Также раскрыт планшет для культивирования клеток, изготовленный (исключительно) из полиэфирэфиркетона.
Также раскрыта лунка планшета для культивирования клеток, содержащая полиэфирэфиркетон или состоящая из него.
Также раскрыта лунка планшета для культивирования клеток, изготовленная (исключительно) из полиэфирэфиркетона.
Также раскрыта вставка, содержащая полиэфирэфиркетон или состоящая из него.
Также раскрыта вставка, изготовленная (исключительно) из полиэфирэфиркетона.
Также раскрыт многолуночный планшет для культивирования клеток, содержащий полиэфирэфиркетон или состоящий из него.
Также раскрыт многолуночный планшет для культивирования клеток, изготовленный (исключительно) из полиэфирэфиркетона.
Предпочтительно, устройство для культивирования клеток, планшет для культивирования клеток, лунка, многолуночный планшет для культивирования клеток или вставка содержат одну или более малых гидрофобных молекул, например, одно или более низкомолекулярных гидрофобных веществ. В одном варианте осуществления вещество содержит алкалоид табака или состоит из него.
В одном варианте осуществления вещество имеет структуру согласно формуле 1:

или его фармацевтически приемлемую соль или их смеси;
или, более предпочтительно, структуру согласно формуле 2:

или его фармацевтически приемлемую соль или их смеси;
причем:
z равно 0 или 1;
R1 представляет собой Н или C1-C7алкил;
R2 представляет собой H, =O или C1-C7алкил;
R3 представляет собой H, галоген или C1-C7алкил;
а пунктирной линией обозначены либо
(a) одинарные связи;
(b) одна углерод-углеродная или углерод-азотная двойная связь и остальные одинарные связи; или
(c) две конъюгированные двойные связи, независимо выбранные из углерод-азотной двойной связи и углерод-углеродной двойной связи, и остальные одинарные связи.
Предпочтительно, вещество согласно формуле 2 представляет собой:
или

или его фармацевтически приемлемую соль или их смеси.
Предпочтительно, вещество согласно формуле 2 представляет собой:
или
или его фармацевтически приемлемую соль или их смеси.
Более предпочтительно средство согласно формуле 1 или формуле 2 представляет собой алкалоид табака.
Более предпочтительно вещество согласно формуле 1 или формуле 2 представляет собой никотин, анабазин, норникотин, анатабин, котинин, миосмин или их фармацевтически приемлемую соль, или их смеси.
Термин «алкалоид табака» относится к алкалоиду, который происходит или получен из растения табака, а также может включать синтетический алкалоид табака. Термин «растение табака» относится к растению, принадлежащему к роду Nicotiana, в том числе N. rustica и N. tabacum (например, LA B21, LN KY171, TI 1406, Basma, Galpao, Perique, Beinhart 1000-1 и Petico). Другие виды включают N. acaulis, N. acuminata, N. africana, N. alata, N. ameghinoi, N. amplexicaulis, N. arentsii, N. attenuata, N. azambujae, N. benavidesii, N. benthamiana, N. bigelovii, N. bonariensis, N. cavicola, N. clevelandii, N. cordifolia, N. corymbosa, N. debneyi, N. excelsior, N. forgetiana, N. fragrans, N. glauca, N. glutinosa, N. goodspeedii, N. gossei, N. hybrid, N. ingulba, N. kawakamii, N. knightiana, N. langsdorffii, N. linearis, N. longiflora, N. maritima, N. megalosiphon, N. miersii, N. noctiflora, N. nudicaulis, N. obtusifolia, N. occidentalis, N. occidentalis subsp. hesperis, N. otophora, N. paniculata, N. pauciflora, N. petunioides, N. plumbaginifolia, N. quadrivalvis, N. raimondii, N. repanda, N. rosulata, N. rosulata subsp. ingulba, N. rotundifolia, N. setchellii, N. simulans, N. solanifolia, N. spegazzinii, N. stocktonii, N. suaveolens, N. sylvestris, N. thyrsiflora, N. tomentosa, N. tomentosiformis, N. trigonophylla, N. umbratica, N. undulata, N. velutina, N. wigandioides и N. x sanderae. Предпочтительно, растение табака представляет собой N. tabacum.
Термин «C1-C7алкил» относится к прямой цепи и разветвленным насыщенным углеводородным группам, как правило, имеющим от 1 до 7 атомов углерода; более предпочтительно к C1-C6алкилу; более предпочтительно C1-C3алкилу. Примеры алкильных групп включают метил, этил, н-пропил, изо-пропил, н-бутил, втор-бутил, изо-бутил, т-бутил, пент-1-ил, пент-2-ил, пент-3-ил, 3-метилбут-1-ил, 3-метилбут-2-ил, 2-метилбут-2-ил, 2,2,2-триметилэт-1-ил, н-гексил, н-гептил и т.п. Предпочтительно, алкильной группой является метил.
Термин «галоген» относится к фтору F, хлору Cl, брому Br или йоду I. Подходящим галогеном является Cl.
В другом варианте осуществления вещество представляет собой табак- специфический нитрозамин (TSNA), который представляет собой химическое соединение, образованное путем нитрозирования вторичных и третичных аминов алкалоидов табака, в том числе никотина, норникотина, анатабина и анабазина. TSNA встречаются в табаке и табачных продуктах. Предпочтительно TSNA представляет собой N-нитрозоникотин (NNN), 4-(метилнитрозамино)-1-(3-пиридил)-1-бутанон (NNK), N-нитрозоанабазин (NAB), N-нитрозоанатабин (NAT), 4-(метилнитрозамино)4-(3-пиридил)бутаналь (NNA), 4-(метилнитрозамино)-1-(3-пиридил)-1-бутанол (NNAL), 4-(метилнитрозамино)4-(3-пиридил)-1-бутанол (изо-NNAL) или 4-(метилнитрозамино)-4-(3-пиридил)-1-масляную кислоту (изо-NNAC), или их фармацевтически приемлемые соли, или их смеси. Более предпочтительно TSNA представляет собой 4-(метилнитрозамино)-1-(3-пиридил)-1-бутанон (NNK) или его фармацевтически приемлемую соль.
Предпочтительно, органический растворитель выбран из насыщенных алифатических углеводородов (например, н-пентана, н-гексана, н-гептана, н-октана); ароматических углеводородов (например, бензола, толуола, ксилолов); алифатических спиртов (например, метанола, этанола, пропан-1-ола, пропан-2-ола, бутан-1-ола, 2-метилпропан-1-ола, бутан-2-ола, 2-метилпропан-2-ола, пентан-1-ола, 3-метилбутан-1-ола, гексан-1-ола, 2-метоксиэтанола, 2-этоксиэтанола, 2-бутоксиэтанола, 2-(2-метоксиэтокси)-этанола, 2-(2-этоксиэтокси)-этанола, 2-(2-бутоксиэтокси)-этанола); простых эфиров, при условии, что простой эфир не представляет собой тетрагидрофуран (например, простой диэтиловый эфир, простой диизопропиловый эфир, простой дибутиловый эфир, 1,2-диметоксиэтан, 1,2-диэтоксиэтан, 1-метокси-2-(2-метоксиэтокси)-этан, 1-этокси-2-(2-этоксиэтокси)-этан, 1,4-диоксан); кетонов (например, ацетона, метилэтилкетона); сложных эфиров (метилацетата, этилацетата); азотсодержащих растворителей (например, формамида, N, N-диметилформамида, ацетонитрила, N-метилпирролидона, пиридина, хинолина, нитробензола); серосодержащих растворителей, при условии, что серосодержащий растворитель не представляет собой диметилсульфоксид (например, дисульфид углерода, тетрагидротиофен-1,1-диоксид); и фосфорсодержащих растворителей (например, гексаметилфосфортриамида).
В одном варианте осуществления органический растворитель представляет собой насыщенный алифатический углеводород (например, н-пентан, н-гексан, н-гептан, н-октан).
В одном варианте осуществления органический растворитель представляет собой ароматический углеводород (например, бензол, толуол, ксилолы).
В одном варианте осуществления органический растворитель представляет собой алифатический спирт (например, метанол, этанол, пропан-1-ол, пропан-2-ол, бутан-1-ол, 2-метилпропан-1-ол, бутан-2-ол, 2-метилпропан-2-ол, пентан-1-ол, 3-метилбутан-1-ол, гексан-1-ол, 2-метоксиэтанол, 2-этоксиэтанол, 2-бутоксиэтанол, 2-(2-метоксиэтокси)-этанол, 2-(2-этоксиэтокси)-этанол, 2-(2-бутоксиэтокси)-этанол).
В одном варианте осуществления органический растворитель представляет собой простой эфир при условии, что этот простой эфир не представляет собой тетрагидрофуран (например, простой диэтиловый эфир, простой диизопропиловый эфир, простой дибутиловый эфир, 1,2-диметоксиэтан, 1,2-диэтоксиэтан, 1-метокси-2-(2-метоксиэтокси)-этан, 1-этокси-2-(2-этоксиэтокси)-этан, 1,4-диоксан).
В одном варианте осуществления органический растворитель представляет собой кетон (например, ацетон, метилэтилкетон).
В одном варианте осуществления органический растворитель представляет собой сложный эфир (метилацетат, этилацетат).
В одном варианте осуществления органический растворитель представляет собой азотсодержащий растворитель (например, формамид, N, N-диметилформамид, ацетонитрил, N-метилпирролидон, пиридин, хинолин, нитробензол).
В одном варианте осуществления органический растворитель представляет собой серосодержащий растворитель, при условии, что серосодержащий растворитель не представляет собой диметилсульфоксид (например, дисульфид углерода, тетрагидротиофен-1,1-диоксид).
В одном варианте осуществления органический растворитель представляет собой фосфорсодержащий растворитель (например, гексаметилфосфорный триамид).
В одном варианте осуществления органический растворитель не представляет собой простой петролейный эфир.
В одном варианте осуществления органический растворитель не представляет собой толуол.
В одном варианте осуществления органический растворитель не представляет собой ацетон.
В одном варианте осуществления органический растворитель не представляет собой этанол. В одном варианте осуществления средство представляет собой никотин или NNK или их комбинацию.
Предпочтительно, способы, которые были обсуждены выше, включают дополнительный этап приведения клетки в устройстве для культивирования клеток в контакт с одной или более малыми гидрофобными молекулами или одним или более органическими растворителями, которые обсуждались выше.
Предпочтительно, устройство для культивирования клеток может содержать клетку, содержащуюся в среде для культивирования клеток, и, необязательно, одну или более малых гидрофобных молекул или же один или более органических растворителей, которые обсуждались выше.
Также раскрыт способ определения влияния (например, реакции на воздействие) одного или более веществ на клетку, включающий: (i) приведение клетки в контакт с устройством для культивирования клеток, описанным в данном документе, таким как планшет для культивирования клеток, или многолуночный планшет для культивирования клеток или вставка, содержащим полиэфирэфиркетон или состоящим из него; (ii) воздействие на клетку одной или более малыми гидрофобными молекулами или органическими растворителями, которые обсуждались выше; и (iii) определение влияния вещества (веществ) на клетку.
Также раскрыт способ определения влияния (например, реакции на воздействие) одного или более веществ на клетку, включающий (i) приведение клетки в контакт с устройством для культивирования клеток, описанным в данном документе, таким как планшет для культивирования клеток или многолуночный планшет для культивирования клеток или вставка, изготовленным (исключительно) из полиэфирэфиркетона; (ii) воздействие на клетку одной или более малыми гидрофобными молекулами или органическими растворителями, которые обсуждались выше; и (iii) определение влияния; малых гидрофобных молекул или органических растворителей, которые обсуждались выше, на клетку.
Кроме того, раскрыт способ уменьшения или замедления поглощения одной или более малых гидрофобных молекул или органических растворителей, обсуждаемых выше, в устройстве для культивирования клеток, описанном в данном документе, включающий приведение вещества в контакт с устройством для культивирования клеток, содержащим полиэфирэфиркетон или состоящим из него. Настоящее изобретение также описано в примере ниже, который представлен для более подробного описания настоящего изобретения. Данный пример, в котором изложен вариант, рассматриваемый в настоящее время как предпочтительный вариант осуществления настоящего изобретения, предназначен для иллюстрации, но не для ограничения настоящего изобретения.
ПРИМЕРЫ
Пример 1
Для предотвращения агломерирования сфероидов лунка, разработанная для сфероидов из клеток печени, была выполнена таким образом, что она содержала концентрические канавки на дне лунки. Целью образования данных канавок было создание пространственного разделения между тканями для предотвращения их агломерирования или слияния друг с другом. Для демонстрации функции канавок 40 сфероидов, каждый из которых состоял из приблизительно 25 000 клеток, помещали либо в лунку с канавками, либо в лунку с плоской поверхностью (т.е. без канавок). Через 5 дней сфероиды, присутствующие в лунке с плоской поверхностью, начинали агломерировать друг с другом (см. фиг. 11A), образуя агрегаты. Этого не наблюдалось в лунке с канавками (см. фиг. 11B). Ткань, показанная на фиг. 11A (3 сфероида, агломерировавшиеся или слившиеся с образованием одного агрегата), была непригодной для использования для дальнейших экспериментов, обычно проводимых на сфероидах, таких как измерение содержания аденозинтрифосфата (АТФ), поскольку агломерирование или слияние нескольких сфероидов негативно влияли на получаемые результаты. В культивированной ткани, показанной на фиг. 11B, не происходило агломерирование или слияние и ее использовали для дальнейших экспериментов.
Пример 2
Были протестированы различные материалы, используемые для изготовления устройства для культивирования клеток. Один из материалов, используемых для устройства для культивирования клеток, полиэфирэфиркетон, представляет собой прочный износостойкий пластмассовый полимер. Полиэфирэфиркетон является предпочтительным при тестировании лекарственных средств, поскольку он является непоглощающим в отличие, например, от широко используемого поли(диметилсилоксана) (PDMS), который, как известно, удерживает малые гидрофобные молекулы, такие как молекулы никотина. Было установлено, что полиэфирэфиркетон не удерживает никотин или NNK, а также другие малые гидрофобные молекулы. Таким образом, устройство для культивирования клеток пригодно для тестирования влияния лекарственных средств на ткани, помещенные в устройство для культивирования клеток, при этом отсутствует риск того, что концентрация лекарственного средства (или концентрация его метаболитов) будет изменена материалом.
Биосовместимость устройства из полиэфирэфиркетона тестировали с органотипическими моделями легкого и печени.
Модель легкого состоит из нормальных клеток бронхиального эпителия человека (NHBE), высеянных на вставку Transwell™ и дополнительно культивированных на поверхности раздела воздух-жидкость с целью обеспечения дифференциации клеток в бокаловидные или реснитчатые клетки. Используя указанные ткани можно показать, что ткани легкого могут оставаться живыми в течение 4 недель в планшете из полиэфирэфиркетона, что подтверждается нижеследующим.
Присутствие реснитчатых и бокаловидных эпителиальных клеток в пропорции, аналогичной пропорции, наблюдаемой в контрольных тканях (из той же партии), поддерживаемых в 24-луночных поликарбонатных планшетах в течение того же периода времени.
Неизменившиеся морфологические характеристики. Гистологический анализ тканей, поддерживаемых в планшете, и тканей, поддерживаемых в 24-луночном планшете в течение 4 недель, подтвердил, что морфологические характеристики являются аналогичными. Толщина эпителия, состояние дифференциации и пропорция бокаловидных, базальных и реснитчатых клеток были аналогичными между тканями, поддерживаемыми в указанных двух условиях.
Стабильная концентрация аденозинтрифосфата (АТФ). Аденозинтрифосфат (АТФ) используют для ряда процессов в клетках и все метаболически активные клетки содержат АТФ, благодаря чему измерения содержания АТФ являются эффективным показателем состояния тканей. Ткани, поддерживаемые в планшете в течение 4 недель, характеризовались аналогичным содержанием АТФ (приблизительно на 10% меньшим содержанием АТФ) по сравнению с контрольными тканями.
Активное колебательное движение ресничек. Реснитчатые клетки не только присутствовали в той же самой пропорции, что и в контрольных тканях, но также они по-прежнему совершали активные колебательные движения ресничками с частотой, аналогичной частоте, наблюдаемой в контрольных тканях.
Более высокое трансэпителиальное электрическое сопротивление (TEER). Трансэпителиальное электрическое сопротивление является мерой целостности плотных соединений в эпителиальных тканях и, таким образом, является надежным показателем целостности барьера. Ткани, поддерживаемые в планшете из полиэфирэфиркетона, характеризовались на 50% большим значением трансэпителиального электрического сопротивления, чем контрольные ткани.
Неизменившаяся метаболическая емкость. Способность к индуцированию цитохрома P450 (CYP), ключевого показателя метаболической емкости, исследовали путем воздействия на ткани специфическими индукторами ферментов CYP. Было установлено, что после 48-часовой индукции активность CYP1A1 повышалась в 100 раз, что указывало на неизменившуюся метаболическую емкость тканей, содержащихся в планшете.
В качестве модели печени использовали сфероиды, состоящие из клеток HepaRG™. Первые результаты, полученные с использованием указанных сфероидов из клеток печени после 4 недель культивирования в планшете из полиэфирэфиркетона, показали следующее.
Стабильная секреция альбумина в циркулирующей среде. Альбумин является основным маркером функции печени. Было обнаружено, что секреция альбумина в планшете из полиэфирэфиркетона была стабильной в течение 4 недель с такой же концентрацией альбумина, что и в контрольных тканях.
Неизменившаяся метаболическая емкость. Способность к индуцированию цитохрома P450 (CYP), ключевого показателя метаболической емкости, исследовали путем воздействия на ткани специфическими индукторами ферментов CYP. Было установлено, что после 48-часовой индукции активность CYP1A1 была аналогичной активности, наблюдаемой в контрольных тканях.
Преимущество полиэфирэфиркетона заключается в том, что он не абсорбирует малые молекулы. Было исследовано поглощение полиэфирэфиркетоном никотина и NNK, и было установлено, что молекулы не захватывались указанным материалом. Это имеет важное значение, поскольку известно, что материалы, используемые для изготовления коммерчески доступных планшетов, такие как поли(диметилсилоксан) (PDMS), захватывают малые гидрофобные молекулы. На фиг. 12 в виде графика показаны результаты сравнения количества никотина, оставшегося в планшете из полиэфирэфиркетона и планшете из поли(диметилсилоксана) после 8 часов инкубации при 4°C. Как можно видеть, приблизительно 100% никотина осталось в планшете из политетрафторэтилена по сравнению лишь с приблизительно 35% в планшете из поли(диметилсилоксана). Таким образом, материалы, используемые для коммерчески доступных планшетов с использованием поли(диметилсилоксана), будут захватывать малые гидрофобные молекулы.
Пример 3
Клетки HeparG® поставляются в криоконсервированных флаконах, содержащих приблизительно 10 миллионов клеток. Первым этапом получения сфероидов является размораживание криоконсервированных флаконов и высевание клеток (приблизительно 1000-50 000 клеток в одну лунку) в каждую лунку многолуночного планшета. В этом эксперименте лунки планшета покрыты оболочкой со сверхслабым прикреплением и лунки имеют U-образное дно для обеспечения того, чтобы клетки, высеянные в одну лунку, не прикреплялись к стенкам. Клеткам дают агломерироваться на дне лунки. Приблизительно через 3 дня они образуют один сфероид или множество сфероидов в каждой лунке многолуночного планшета, в зависимости от выбора лунки для использования.
Камера для культивирования клеток устройства для культивирования клеток, в которой расположены сфероиды из клеток печени, имеет прерывистую поверхность, описанную в данном документе, которая в данном примере имеет покрытие. Каждый сфероид переносят независимо от многолуночного планшета в камеру для культивирования клеток. В каждое отделение переносят приблизительно от 40 до 100 сфероидов. Устройство для культивирования клеток присоединяют к насосу, который создает поток среды. Перед применением в других экспериментах сфероиды могут оставаться в устройстве для культивирования клеток на протяжении от 1 до 28 дней.
Другие аспекты настоящего изобретения изложены в нижеследующих пронумерованных пунктах.
1. Устройство для культивирования клеток, содержащее:
камеру для культивирования клеток, содержащую основание и боковые стенки, проходящие от основания и ограничивающие объем камеры для культивирования клеток,
впускное отверстие в основании или боковых стенках камеры для культивирования клеток, выполненное с возможностью передачи текучей среды в камеру; и
выпускное отверстие в основании или боковых стенках камеры для культивирования клеток, выполненное с возможностью передачи текучей среды из камеры;
причем основание камеры для культивирования клеток имеет прерывистую поверхность, выполненную с возможностью уменьшения или предотвращения агломерирования сфероидов.
2. Устройство для культивирования клеток по п. 1, в котором основание камеры для культивирования клеток имеет по существу круглую форму, причем предпочтительно диаметр указанного основания составляет от приблизительно 6 мм ± 5% до приблизительно 22 мм ± 5%, предпочтительно диаметр основания составляет приблизительно 6 мм ± 5%, приблизительно 11 мм ± 5%, приблизительно 16 мм ± 5% или приблизительно 22 мм ± 5%.
3. Устройство для культивирования клеток по п. 1 или 2, в котором прерывистая поверхность содержит множество канавок, в которых глубина и ширина канавок соответствует максимальному диаметру сфероида ±10%.
4. Устройство для культивирования клеток по п. 3, в котором глубина и ширина множества канавок составляет от приблизительно 200 до приблизительно 1000 мкм, предпочтительно от приблизительно 600 до приблизительно 1000 мкм.
5. Устройство для культивирования клеток по п. 3 или 4, в котором канавки образуют множество концентрических колец на основании камеры для культивирования клеток
6. Устройство для культивирования клеток по п. 1 или 2, в котором прерывистая поверхность содержит множество отверстий, имеющих закрытое дно и открытую верхнюю часть, причем размеры отверстий, соответствующих по глубине и ширине, приблизительно на 10% больше, чем максимальный диаметр сфероида.
7. Устройство для культивирования клеток по любому из предшествующих пунктов, в котором камера для культивирования клеток содержит среду для культивирования клеток для культивирования сфероидов.
8. Устройство для культивирования клеток по любому из предшествующих пунктов, в котором камера для культивирования клеток содержит отдельные сфероиды, захваченные прерывистой поверхностью камеры для культивирования клеток.
9. Устройство для культивирования клеток по п. 8, в котором сфероиды представляют собой сфероиды из клеток легкого.
10. Устройство для культивирования клеток по любому из предшествующих пунктов, в котором поток текучей среды от впускного отверстия до выпускного отверстия камеры для культивирования клеток при присутствии в ней текучей среды составляет от приблизительно 10 до приблизительно 1000 мкл/мин, предпочтительно от приблизительно 1 до приблизительно 500 мкл/мин, предпочтительно приблизительно 40 мкл/мин.
11. Устройство для культивирования клеток по п. 10, в котором напряжение сдвига в камере для культивирования клеток составляет менее 0,1 дин/см2.
12. Устройство для культивирования клеток по любому из предшествующих пунктов, в котором устройство для культивирования клеток представляет собой многолуночный планшет, а каждая камера многолуночного планшета представляет собой лунку, причем указанный многолуночный планшет содержит по меньшей мере две лунки.
13. Устройство для культивирования клеток по любому из предшествующих пунктов, в котором основание по меньшей мере одной из камер имеет плоскую поверхность, на которой отсутствуют разрывы непрерывности.
14. Устройство для культивирования клеток по п. 13, в котором по меньшей мере одна камера содержит вставку, расположенную выше основания камеры, причем предпочтительно вставка расположена на верхней части проницаемой мембраны, расположенной внутри указанной камеры, с образованием поверхности, которая способна обеспечивать культивирование клетки на границе раздела воздух/жидкость.
15. Устройство для культивирования клеток по п. 13 или 14, в котором глубина по меньшей мере одной камеры, имеющей плоскую поверхность, на которой отсутствуют разрывы непрерывности, отличается от глубины по меньшей мере одной камеры, имеющей прерывистую поверхность, причем предпочтительно глубина по меньшей мере одной камеры, имеющей плоскую поверхность, на которой отсутствуют разрывы непрерывности, является меньшей, чем глубина по меньшей мере одной камеры, имеющей прерывистую поверхность.
16. Устройство для культивирования клеток по любому из пп. 13-15, в котором камера для культивирования клеток содержит среду для культивирования клеток для культивирования клетки на поверхности раздела воздух-жидкость.
17. Устройство для культивирования клеток по п. 16, в котором камера для культивирования клеток содержит клетки, расположенные на проницаемой мембране, причем указанные клетки способны расти на поверхности раздела воздух-жидкость.
18. Устройство для культивирования клеток по п. 17, в котором клетки представляют собой клетки легкого.
19. Устройство для культивирования клеток по любому из пп. 12-18, в котором по меньшей мере две лунки сообщаются по текучей среде друг с другом.
20. Способ культивирования клетки, включающий:
обеспечение наличия устройства для культивирования клеток по любому из пп. 1-19;
приведение в контакт устройства для культивирования клеток со средой для культивирования клеток и клеткой по меньшей мере одного типа; и
культивирование клетки.
21. Способ изготовления устройства для культивирования клеток для культивирования сфероидов, включающий:
(i) обеспечение наличия камеры для культивирования клеток, содержащей: (a) основание и боковые стенки, проходящие от основания и ограничивающие объем камеры для культивирования клеток; (b) впускное отверстие в основании или боковых стенках камеры для культивирования клеток, выполненное с возможностью передачи текучей среды в камеру; и (c) выпускное отверстие в основании или боковых стенках камеры для культивирования клеток, выполненное с возможностью передачи текучей среды из камеры; и
(ii) создание прерывистой поверхности на основании камеры для культивирования клеток, причем прерывистая поверхность выполнена с возможностью уменьшения или предотвращения агломерирования сфероидов.
22. Способ по п. 21, при котором прерывистая поверхность представляет собой прерывистую поверхность по любому из пп. 3-6.
23. Способ по п. 21 или 22, согласно которому прерывистую поверхность выполняют на основании с использованием механической обработки на станке с числовым программным управлением или литья под давлением.
24. Камера для культивирования клеток, содержащая основание, имеющее прерывистую поверхность, причем прерывистая поверхность содержит одиночные сфероиды, захваченные нею.
25. Камера для культивирования клеток по п. 24, в которой прерывистая поверхность представляет собой прерывистую поверхность по любому из пп. 3-6.
26. Устройство для культивирования клеток, содержащее камеру для культивирования клеток по п. 24 или 25.
27. Устройство для культивирования клеток по любому из пп. 1-19 и 26, в котором устройство представляет собой многолуночный планшет.
28. Камера для культивирования клеток по п. 24 или 25, в которой камера представляет собой лунку.
29. Применение устройства для культивирования клеток по любому из пп. 1-19, 26 и 27 или камеры для культивирования клеток по любому из пп. 24, 25 или 28 для культивирования сфероида или для поддержания сфероидов отдельно от других сфероидов.
30. Культура сфероидов, в которой сфероиды являются одиночными сфероидами после 5 часов или 5 дней культивирования.
Любая публикация, цитируемая или описанная в данном документе, предоставляет соответствующую информацию, раскрытую до даты подачи настоящей заявки. Заявления, сделанные в данном документе, не должны истолковываться как признание того, что авторы настоящего изобретения не имеют оснований для его противопоставления как более ранним таким раскрытиям. Все публикации, упомянутые в вышеприведенном описании, включены в данный документ посредством ссылки. Различные модификации и варианты настоящего изобретения будут очевидны специалистам в данной области техники без отступления от объема и сущности настоящего изобретения. Несмотря на то, что настоящее изобретение описано применительно к конкретным предпочтительным вариантам осуществления, следует понимать, что настоящее изобретение не должно чрезмерно ограничиваться такими конкретными вариантами осуществления. В действительности, предполагается, что разные модификации описанных способов осуществления настоящего изобретения, очевидные специалистам в областях генной инженерии, клеточной биологии и молекулярной биологии или в смежных областях, находятся в пределах объема нижеследующей формулы изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПЛАНШЕТ ДЛЯ КУЛЬТИВИРОВАНИЯ КЛЕТОК, УСТРОЙСТВА И СПОСОБЫ ВОЗДЕЙСТВИЯ IN VITRO | 2018 |
|
RU2776405C2 |
| 3D-FACS-АНАЛИЗ-ADCC NK-КЛЕТОК | 2011 |
|
RU2577702C2 |
| УСТРОЙСТВО И СПОСОБЫ ДЛЯ КУЛЬТИВИРОВАНИЯ КЛЕТОК | 2017 |
|
RU2741806C2 |
| СПОСОБЫ ПЕРФУЗИОННОГО КУЛЬТИВИРОВАНИЯ И ИХ ПРИМЕНЕНИЯ | 2015 |
|
RU2708919C2 |
| СПОСОБЫ ПЕРФУЗИОННОГО КУЛЬТИВИРОВАНИЯ И ИХ ПРИМЕНЕНИЯ | 2015 |
|
RU2733539C2 |
| Способ производства биокомпозитных сфероидов для восстановления костной ткани | 2020 |
|
RU2747087C1 |
| СПОСОБ ПЕРСОНИФИЦИРОВАННОГО СКРИНИНГА ДЕЙСТВИЯ ПРЕПАРАТОВ НА ЛЕЙКОЗНЫЕ КЛЕТКИ EX VIVO | 2015 |
|
RU2653442C2 |
| Способ трансплантации биокомпозитных сфероидов для обеспечения возможности восстановления целостности кости при дефектах, размеры которых превышают критические | 2020 |
|
RU2744756C1 |
| Биокомпозитный сфероид для восстановления костей и способ его получения | 2020 |
|
RU2744732C1 |
| ПЕРФОРИРОВАННАЯ КОНСТРУКЦИЯ | 2020 |
|
RU2810805C2 |
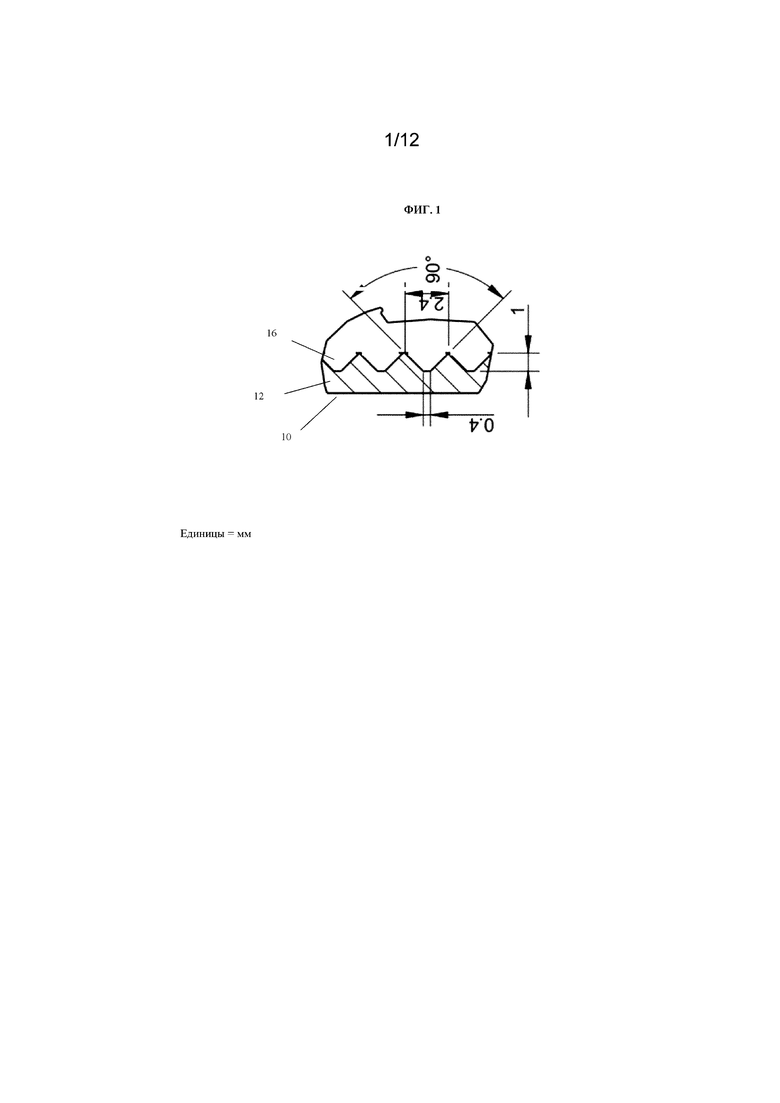

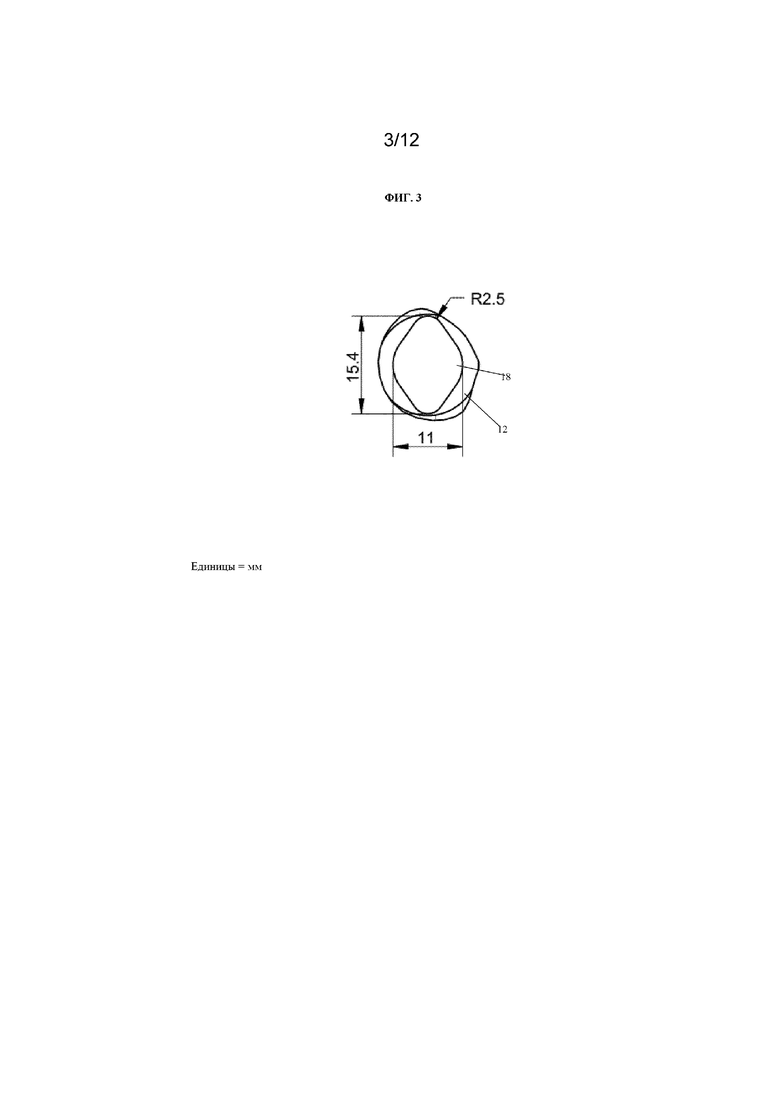
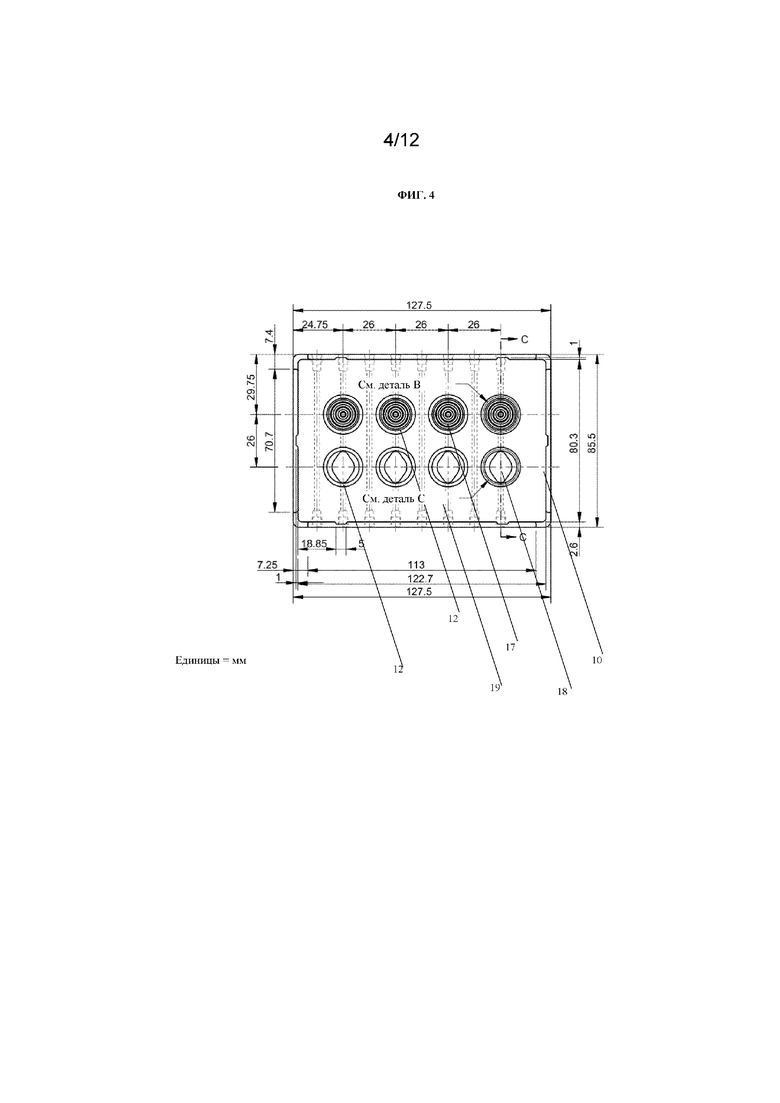
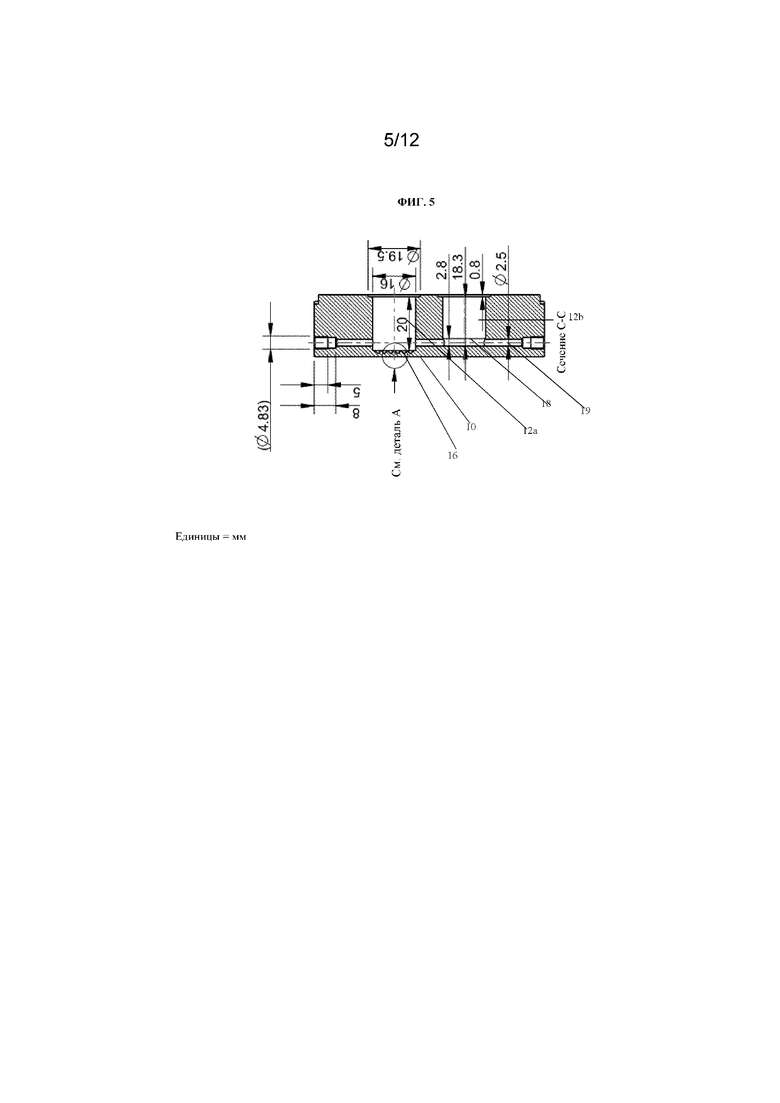

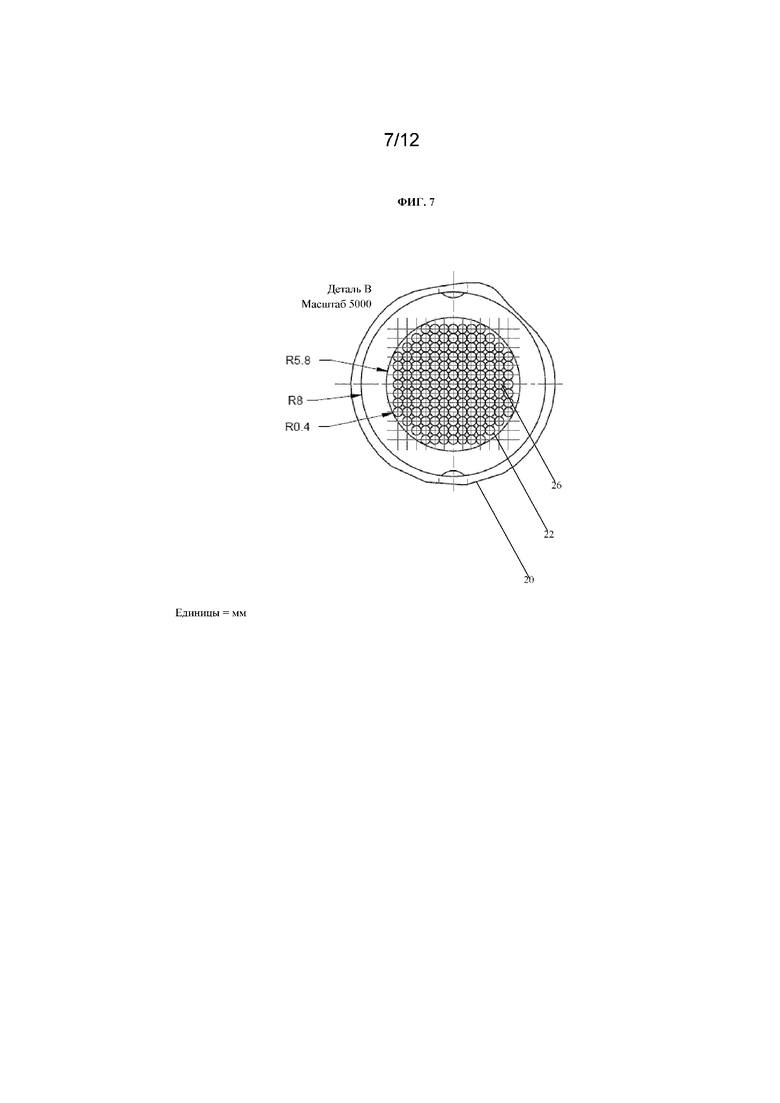
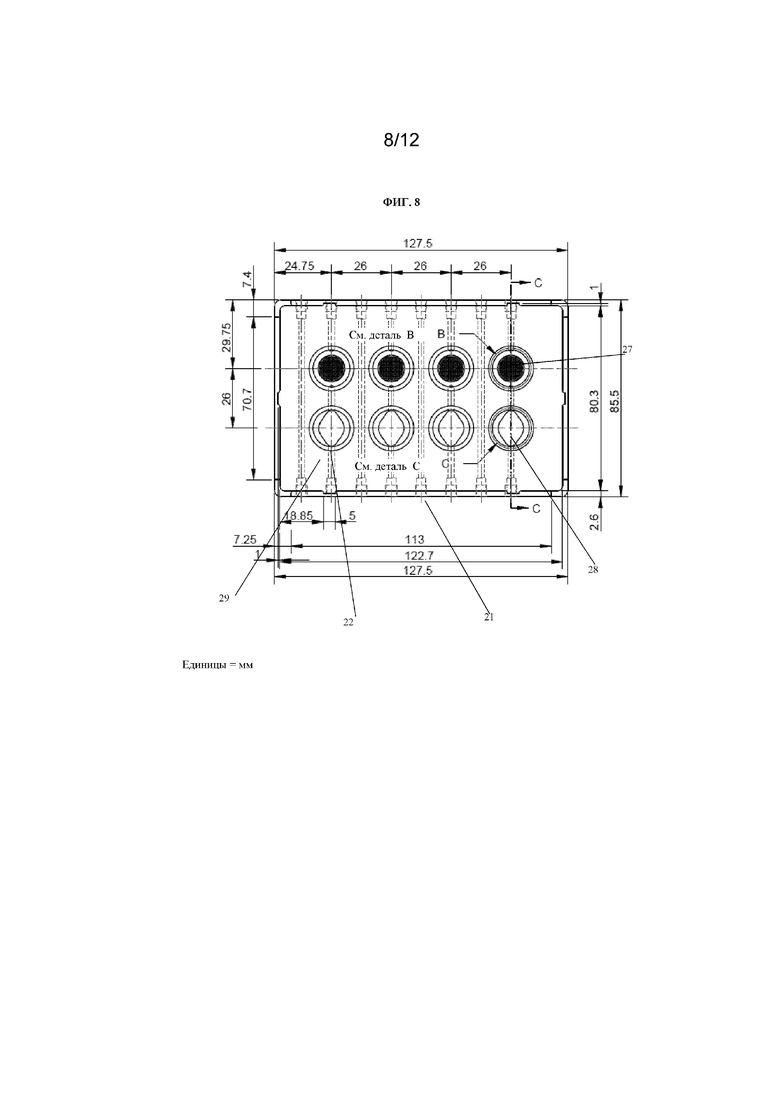




Группа изобретений относится к устройству для культивирования клеток и способу его применения. Клетки представляют собой трехмерные органотипические клетки или ткани - сфероиды. Для получения отдельного сфероида(ов) на прерывистой поверхности лунки осуществляют перенос отдельного сфероида(ов) в лунку устройства для культивирования клеток. Лунка устройства для культивирования клеток содержит основание и боковые стенки, проходящие от основания и ограничивающие объем лунки. В основании или боковых стенках лунки имеется впускное отверстие, выполненное с возможностью передачи текучей среды в лунку, и выпускное отверстие, выполненное с возможностью передачи текучей среды из лунки. Основание лунки имеет прерывистую поверхность, выполненную с возможностью захвата одного или более отдельных сфероидов в прерывистую поверхность для уменьшения или предотвращения их агломерирования. Затем отдельный сфероид(ы) приводят в контакт с прерывистой поверхностью и инкубируют в лунке. Осуществление изобретений обеспечивает уменьшение или предотвращение агломерирования сфероидов. 4 н. и 10 з.п. ф-лы, 12 ил.
1. Способ уменьшения или предотвращения агломерирования сфероидов, включающий:
(i) обеспечение одного или более отдельных сфероидов;
(ii) перенос отдельного сфероида(ов) в лунку устройства для культивирования клеток, причем лунка устройства для культивирования клеток содержит основание и боковые стенки, проходящие от основания и ограничивающие объем лунки; при этом в основании или боковых стенках лунки имеется впускное отверстие, выполненное с возможностью передачи текучей среды в лунку, в основании или боковых стенках лунки имеется выпускное отверстие, выполненное с возможностью передачи текучей среды из лунки, и основание лунки имеет прерывистую поверхность, выполненную с возможностью захвата одного или более отдельных сфероидов в прерывистую поверхность для уменьшения или предотвращения их агломерирования, причем прерывистая поверхность содержит множество канавок, при этом глубина и ширина указанных канавок составляют от приблизительно 200 до приблизительно 1000 мкм, причем канавки образуют множество концентрических колец на основании лунки;
(iii) приведение отдельного сфероида(ов) в контакт с прерывистой поверхностью и инкубирование отдельного сфероида(ов) в лунке; и
(iv) получение отдельного сфероида(ов) на прерывистой поверхности лунки.
2. Способ по п. 1, в котором известное количество отдельных сфероидов переносят на этапе (ii) и известное количество отдельных сфероидов получают на этапе (iv).
3. Способ по п. 1 или 2, в котором лунка содержит прерывистую поверхность, содержащую множество отверстий, имеющих закрытое дно и открытую верхнюю часть, причем размер отверстий, соответствующих по глубине и ширине, приблизительно, на 10% больше, чем максимальный диаметр сфероида.
4. Способ по любому из предшествующих пунктов, в котором лунка изготовлена из полиэфирэфиркетона.
5. Способ по любому из предшествующих пунктов, в котором лунка имеет покрытие, причем, предпочтительно, это покрытие представляет собой покрытие из поли(п-ксилилен) полимера.
6. Способ по любому из предшествующих пунктов, в котором в лунку устройства для культивирования клеток переносят от приблизительно 40 до приблизительно 100 сфероидов.
7. Способ по любому из предшествующих пунктов, в котором в лунку устройства для культивирования клеток подают поток среды, причем расход составляет от приблизительно 10 до приблизительно 1000 мкл/мин.
8. Применение устройства для культивирования клеток для уменьшения или предотвращения агломерирования сфероидов, причем устройство для культивирования клеток содержит:
лунку, содержащую основание и боковые стенки, проходящие от основания и ограничивающие объем лунки,
впускное отверстие в основании или боковых стенках лунки, выполненное с возможностью передачи текучей среды в лунку; и
выпускное отверстие в основании или боковых стенках лунки, выполненное с возможностью передачи текучей среды из лунки;
при этом основание лунки имеет прерывистую поверхность, выполненную с возможностью захвата одного или более сфероидов в прерывистую поверхность для уменьшения или предотвращения агломерирования сфероидов, причем прерывистая поверхность содержит множество канавок, при этом глубина и ширина указанных канавок составляют от приблизительно 200 до приблизительно 1000 мкм, причем канавки образуют множество концентрических колец на основании лунки.
9. Многолуночный планшет для культивирования клеток, в котором основание, по меньшей мере, одной из лунок многолуночного планшета для культивирования клеток и/или вставка, содержащаяся в указанной, по меньшей мере, одной из лунок многолуночного планшета для культивирования клеток, имеет прерывистую поверхность, выполненную с возможностью захвата одного или более отдельных сфероидов в прерывистую поверхность для уменьшения или предотвращения агломерирования сфероидов, причем прерывистая поверхность содержит множество канавок, при этом глубина и ширина указанных канавок составляют от приблизительно 200 до приблизительно 1000 мкм, причем канавки образуют множество концентрических колец на основании лунки.
10. Многолуночный планшет для культивирования клеток по п. 9, в котором планшет и/или вставка изготовлены из полиэфирэфиркетона; или, по меньшей мере, одно из лунок или вставки имеет покрытие, причем, предпочтительно, указанное покрытие представляет собой покрытие из поли(п-ксилилен) полимера.
11. Многолуночный планшет для культивирования клеток по п. 9 или 10, в котором, по меньшей мере, одна лунка или вставка содержит отдельный одиночный сфероид.
12. Вставка для применения в многолуночном планшете для культивирования клеток, имеющая прерывистую поверхность, выполненную с возможностью захвата одного или более отдельных сфероидов в прерывистую поверхность для уменьшения или предотвращения агломерирования сфероидов, причем прерывистая поверхность содержит множество канавок, при этом глубина и ширина указанных канавок составляют от приблизительно 200 до приблизительно 1000 мкм, причем канавки образуют множество концентрических колец на основании лунки.
13. Вставка по п. 12, в которой планшет и/или вставка изготовлены из полиэфирэфиркетона; или, по меньшей мере, одно из лунок или вставки имеет покрытие, причем, предпочтительно, указанное покрытие представляет собой покрытие из поли(п-ксилилен) полимера.
14. Вставка по п. 12 или 13, в которой, по меньшей мере, одна лунка или вставка содержит отдельный одиночный сфероид.
| US 20170342363 A1, 30.11.2017 | |||
| US 20160097028 A1, 07.04.2016 | |||
| WO 2008121417 A1, 09.10.2008 | |||
| Устройство для управления комбинированной дизельгазотурбинной судовой установкой | 1975 |
|
SU552412A1 |
| Способ изготовления фанеры-переклейки | 1921 |
|
SU1993A1 |
| УСТРОЙСТВА И СПОСОБЫ КУЛЬТИВИРОВАНИЯ КЛЕТОК | 2013 |
|
RU2615179C2 |
Авторы
Даты
2024-01-24—Публикация
2018-12-19—Подача