Предполагаемое изобретение относится к микробиологии, в частности - к биотехнологии, а именно к получению экстракта пигмента виолацеина посредством использования как продуцента виолацеина штамма Janthinobacterium lividium ВКМ B-3705D.
Виолацеин - это природный бис-индольный пигмент, обладающий антибиотическими (антибактериальными, противовирусными, противогрибковыми и противоопухолевыми) свойствами [Сон Ель Чой, Кен Хе Юн, 2 Джин Иль Ли, , Роберт Дж. Митчелл, Виолацеин: свойства и производство универсального бактериального пигмента, Биомед Res Int. 2015; 2015] Виолацеин вырабатывается несколькими видами бактерий, включая Chromobacterium violaceum, и придает этим организмам поразительные фиолетовые оттенки. Виолацеин находит все более интересное с коммерческой точки зрения применение, особенно для промышленного применения в косметике, лекарствах и тканях.
Виолацеин обладает умеренной микостатической активностью в отношении плесневого гриба Alternaria brassicicola F-1864 и может быть использован для разработки средств защиты растений (Lyakhovchenko et al., 2021).
Согласно литературным данным, виолацеин обладает множеством биотехнологически важных свойств, а именно, противоопухолевой, противовирусной, антибактериальной, антимикозной, антипротозойной и противопаразитарной активностью (Durán et al., 2007).
Имеются данные о цитотоксичности пигмента в отношении клеточных линий колоректального рака человека (виолацеин вызывал окислительный стресс, который является ключевым медиатором апоптоза), клеток рака толстой кишки (пигмент нарушал ход клеточного цикла). Согласно литературным данным, исследование с использованием внутрибрюшной инокуляции виолацеина в течение 12 дней подряд показало, что время жизни мышей с опухолями значительно увеличивалась. В том же источнике описаны антибактериальные и антимикозные свойства: виолацеин проявлял антимикробную активность в отношении 21 штамма бактерий, среди которых менее восприимчивыми оказались пять грамотрицательных штаммов и один штамм Bacillus subtillis; пигмент проявлял эффективность в отношении такого фитопатогенного гриба, как Rosellina necatrix, который является возбудителем белой корневой гнили шелковицы; антимикобактериальные свойства виолацеина в отношении Mycobacterium tuberculosis H37Ra (возбудителя туберкулеза) были сопоставимы с эффективностью химиотерапевтического противотуберкулезного средства. Кроме того, имеются сведения о противомалярийной активности. Показана противовирусная активность в отношении вируса простого герпеса и полиовируса с использованием клеток HeLa (Bromberg et al., 2005).
Среди биоактивных свойств виолацеина - эффективность контроля клеточного цикла и увеличение продукции рекомбинантного иммуноглобулина G (IgG) в клетках яичника китайского хомячка (СНО) которые используются в качестве клеток-хозяев для получения промышленных моноклональных антител (mAb). Контроль клеточного цикла - это эффективный подход к увеличению продукции mAb в культуре клеток. По сравнению с контролем 0,9 мкМ виолацеина в 14-дневной культуре с подпиткой увеличивало максимальную концентрацию IgG на 37,6% за счет увеличения удельной скорости продукции и продолжительности жизни клеток. Анализ клеточного цикла показал, что виолаацеин индуцировал остановку фазы G1 и G2 / M. Однако арест G1 наблюдался только в первый день, в то время как задержка G2 / M длилась более 3 дней, что позволяет предположить, что задержка G2 / M опосредует индуцированное виолаацеином усиленное производство IgG. Более того, в соответствии с повышенной экспрессией белка, уровни экспрессии мРНК IgG и скорость метаболизма питательных веществ также были увеличены. На профили N- связанного гликозилирования и вариантов заряда обработка виолацеином практически не влияла. Результаты исследования показывают, что виолацеин влияет на клеточный цикл клеток СНО и увеличивает выработку IgG без изменения качества продукта, показывая перспективу в качестве усилителя продукции mAb в клетках СНО. Исследование дает представление об использовании виолацеина в промышленном производстве мАт и может помочь в разработке передовых эффективных технологий производства мАт с использованием культур клеток СНО (Kido et al., 2020).
В работе Da-ae Gwon с соавторами, приводятся сведения о том, что при использовании поверхностно-активных соединений (твин 80 и тритон Х-100) выход виолацеина составил 47,64 мг/л и 48,12 мг/л, или 0,047 г/л и 0,048 г/л, соответственно [Gwon, Da., Seo, E. & Lee, J.W. Construction of Synthetic Microbial Consortium for Violacein Production. Biotechnol Bioproc E (2023). https://doi.org/10.1007/s12257-022-0284-5]. Авторами был смоделирован консорциум штаммов, где в одной композиции находился продуцент L-триптофана и виолациина. В результате удалось увеличить выход пигмента до 0,083 г/л. В свою очередь, согласно результатам культивирования, приведенным у Mendes A.S. с соавторами, было получено 0,43 г/л, тогда как сухой вес биомассы составил 21 г/л [Mendes, A.S., de Carvalho, J.E., Duarte, M.C. et al. Factorial design and response surface optimization of crude violacein for Chromobacterium violaceum production. Biotechnology Letters 23, 1963-1969 (2001). https://doi.org/10.1023/A:1013734315525]. При этом, авторы использовали различные ростовые субстраты и их комбинации:
Имеются сведения о том, что получен продуцент виолацеина, путем внедрения плазмиды pHSX-vioABCDE в Escherichia coli K12DH5α, который оказался способен к образованию пигмента концентрацией 0,017 г/л [Duran, M., Ponezi, A.N., Faljoni-Alario, A. et al. Potential applications of violacein: a microbial pigment. Med Chem Res 21, 1524-1532 (2012). https://doi.org/10.1007/s00044-011-9654-9]. В работе N. Duran с соавторами приводится результат культивирования штамма Pseudoalteromonas sp. (DSM 13623), согласно которым был получен неочищенный экстракт пигмента в концентрации 1,1 г/л из 30 литрового биореактора [Nelson Durán; Giselle Z. Justo; Carmen V. Ferreira; Patrícia S. Melo; Livia Cordi; Dorival Martins (2007). Violacein: properties and biological activities, 48(3), 127-0. doi:10.1042/ba20070115].
В патенте RU 2580105 (опубликован 10.12.2014) описан штамм- Chromobacterium violaceum, являющийся грамотрицательным сапрофитом, содержащимся в почве и воде. Обычно считается, что эта бактерия является непатогенной для человека, но так как она является условно-патогенным микроорганизмом, то может вызывать септицемию и фатальные инфекции у человека и животных. Chromobacterium violaceum - продуцент виолацеина, который по приведенным в патенте данным представляет собой высокоактивный инсектицид с оценочным значением LC50, составляющим 7×10-6 микрограммов на лунку в in vitro исследовании введения с кормом личинкам совки.
Способ получения виолацеина по изобретению включает очистку соединений, экстрагированных из культуры Chromobacterium substugae, для чего: культуральный бульон, полученный в результате ферментации С.substugae в 10 л бульона, экстрагировали на смоле Amberlite XAD-7 (Asolkar et al., 2006) путем встряхивания клеточной суспензии со смолой с частотой 225 раз/мин, в течение двух часов при комнатной температуре. Смолу и клеточную массу собирали путем фильтрования через марлю и промывали деионизованной водой для удаления солей. Смолу, клеточную массу и марлю затем вымачивали в течение 2 часов в смеси ацетон/метанол (50/50), после чего смесь ацетон/метанол фильтровали и сушили в вакууме на роторном испарителе с получением неочищенного экстракта. Неочищенный экстракт затем фракционировали путем эксклюзионной хроматографии на Sephadex LH20 (CH2Cl2/CH3OH; 50/50) с получением 7 фракций. Виолацеин и дезоксивиолацеин выделяли из фракции 5 путем хроматографии на Sephadex LH20. Активные фракции затем подвергали обращенно-фазовой ВЭЖХ (Spectra System P4000, Thermo Scientific) с получением чистых соединений, после чего проводили скрининг при помощи вышеуказанных биоисследований для определения/идентификации активных соединений. Для подтверждения структуры соединения получали дополнительные спектроскопические данные, такие как спектры ЖХ/МС и ЯМР.
Недостатком этого способа является условная патогенность штамма- Chromobacterium violaceum, а также низкая эффективность за счет продуцирования одновременно 7 различных фракций, из которых виолацеин можно выделить только из пятой фракции.
Задачей изобретения является создание способа получения экстракта виолацеина путем его синтеза с использованием штамма микроорганизма Janthinobacterium lividum ВКМ B-3705D.
Технический результат заключается в том, что предлагаемый способ расширяет ассортимент штаммов, пригодных к использованию в качестве продуцента виолацеина.
Указанный штамм Janthinobacterium lividum ВКМ B-3705D ранее не описан. Он был выделен из прибрежной зоны реки Везёлки в городе Белгороде путем высева на питательную агаризованную среду состава: 3% пептон, 2% агар микробиологический, остальное вода, с последующим селективным пересевом изолированных пигментированных колоний в отдельные чашки Петри с той же питательной средой для получения чистой культуры штамма Janthinobacterium lividum ВКМ B-3705D. Штамм хранится во Всероссийской коллекции микроорганизмов ИБФМ им. Г.К.Скрябина РАН, дата депонирования 07.04.2023 года.
Культуральные и морфологические свойства штамма Janthinobacterium lividum ВКМ B-3705D.
На вторые сутки культивирования на питательной агаризованной среде состава: 3% пептон, 2% агар микробиологический, остальное вода, появляется слабая пигментация. На третьи сутки культивирования заметна сине-фиолетовая пигментация. При этом, колонии зернистые с фестончатым краем. На третьи сутки культивирования пигментация колоний становится интенсивнее, структура зернистая с неровным краем. В просвете стереомикроскопа видны накопления кристаллов вторичных метаболитов. На седьмой день пигментация культуры штамма Janthinobacterium lividum ВКМ B-3705D ярко-выраженная сине-фиолетовая, колонии шероховатые, крупнозернистые, матовые, круглые с волнистым валиком по краю.
Штамм Janthinobacterium lividum ВКМ B-3705D растут в диапазоне температур 4-28°С с оптимумом при 20°С.
Janthinobacterium lividum ВКМ B-3705D способен расти в присутствии в среде NaCl в концентрации до 2%.
Штамм Janthinobacterium lividum ВКМ B-3705D представлен аэробными грамотрицательными подвижными палочками, располагающиеся одиночно, в парах или в коротких цепочках.
Физиолого-биохимические свойства штамма Janthinobacterium lividum ВКМ B-3705D
Каталазоположительные клетки, образуют цитохромоксидазу, гидролизуют казеин. На питательной среде с 3% пептоном не образуют индол, но выделяют аммиак. Сероводород не выделяется. Уреазу, липазу и лецитиназу не синтезирует, гидролизует казеин, но не крахмал. Штамм не способен разжижать желатин, но способен утилизировать цитраты. В ходе анализа не обнаружено активности β-галактозидазы, аргининдигидролазы, лизиндекарбоксилазы, орнитиндекарбоксилазы и триптофандеаминазы. Не образуют ацетоин.
Штамм способен утилизировать широкий ряд субстратов, а именно, глицерин, L-арабинозу, D-рибозу, D-ксилозу, D-галактозу, D-глюкозу, D-фруктозу, D-маннозу, инозит, D-маннит, D-сорбит, N-глюкозамин, эскулин, D-мальтозу, D-сахарозу, ксилит, D-ликсозу, D-арабит и калия 2-кетоглюконат.
В свою очередь, не утилизирует эритритол, D-арабинозу, L-ксилозу, D-адонитол, метил-βD-ксилопиранозид, D-сорбозу, L-рамнозу, дульцитол, метил- αD -маннопиранозид, метил- αD -глюкопиранозид, амигдалин, арбутин, салицин, D-целлобиозу, D-лактозу (бычью), D-мелибиозу, D-трегалозу, инулин, D-мелецитозу, D-раффинозу, амидон, гликоген, гентиобиозу, D-туранозу, D-тагатозу, D-фукозу, L-фукозу, L-арабит, калий глюконат и калий 5-кетоглюконат.
Молекулярно-генетическая идентификация штамма-продуцента.
Молекулярно-генетическая идентификация штамма Janthinobacterium lividum ВКМ B-3705D по 16S рРНК показала, что он с 95%-ной достоверностью относится к виду Janthinobacterium lividum. Последовательность 16S рРНК выделенного штамма была депонирована в GenBank Janthinobacterium sp. JF4 MW244020. [Lyakhovchenko, N.S.; Abashina, T.N.; Polivtseva, V.N.; Senchenkov, V.Y.; Pribylov, D.A.; Chepurina, A.A.; Nikishin, I.A.; Avakova, A.A.; Goyanov, M.A.; Gubina, E.D.; et al. A Blue-Purple Pigment-Producing Bacterium Isolated from the Vezelka River in the City of Belgorod. Microorganisms 2021, 9, 102. https://doi.org/10.3390/microorganisms9010102 ].
Способ характеризуют следующие графические материалы.
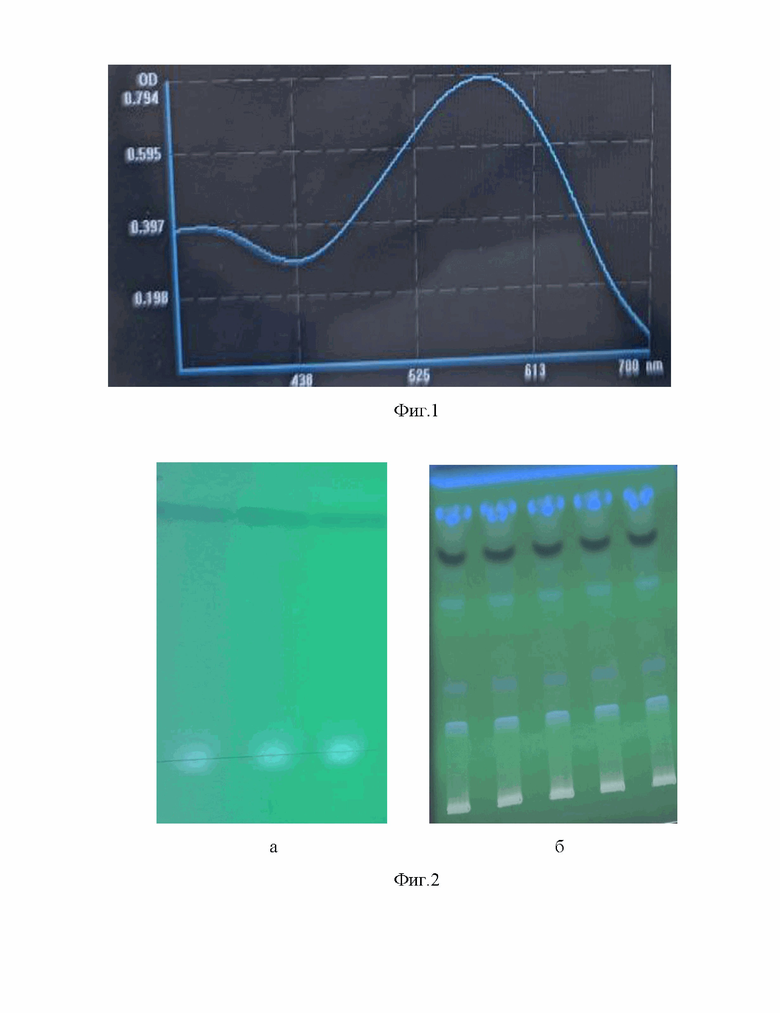
Фигура 1. Зависимость величины оптической плотности (OD) экстракта виолацеина в диметилсульфоксиде от длины волны света, полученной с использованием спектрофотометра Nabi NB1-D-210108, Micro Digital, Корея.
Фигура 2. Иллюстрация результатов оценки чистоты полученного экстракта методом тонкослойной хроматографии при излучении в ультрафиолетовой области спектра, полученного с использованием трансиллюминатора WUV-L50, DAIHAN Scientific Co., Ltd, Корея, где фиг.2а - очищенный экстракт, фиг. 2б -неочищенный экстракт.
Поставленную задачу решает предложенный способ получения экстракта виолацеина, включающий смешивание при комнатной температуре порошка Janthinobacterium lividum ВКМ B-3705D с изопропиловым спиртом с получением 1% коллоидного раствора и перемешиванием 150 об/мин в течение 3 часов, затем полученную смесь пропускают под вакуумом через фильтр с диаметром пор 0,1 мкм, процедуру фильтрации повторяют до получения обесцвеченного осадка на фильтре и все порции фильтрата объединяют в одной емкости; фильтрат, полученный на предыдущем этапе упаривают с помощью роторного испарителя с уменьшением объема в два раза, полученный экстракт очищают от примесей путем растворения в дистиллированной воде в соотношении 1:10 с последующим отстаиванием до образования взвеси, и фильтруют через фильтр с диаметром пор 0,1 мкм, после чего экстрагируют виолацеин из фильтра посредством 99%-ного диметилсульфоксида, при этом порошок Janthinobacterium lividum ВКМ B-3705D получают путем выращивания чистой культуры Janthinobacterium lividum ВКМ B-3705D на агаризованной питательной среде содержащей 3% пептон, 2% агар и 95% воды, в течении 24 часа при 25°С; полученную культуру суспендируют в стерильной воде; получают 1%-ный инокулят путем внесения полученной суспензии Janthinobacterium lividum ВКМ B-3705D в жидкую питательную среду, содержащую 1% пептона; осуществляют инкубацию инокулята в течение 2 суток при температуре 25°С и постоянном перемешивании со скоростью 150 об/мин, после чего его переносят в емкость со свежей питательной средой содержащей 1% пептон и культивируют 3 суток с аэрацией при перемешивании 400 об/мин при 25°С с обеспечением поддержания содержания растворенного кислорода 80%; затем полученную культуральную жидкость замораживают при минус 40°С после чего лиофильно высушивают.
Примеры осуществления заявленного способа
Пример 1. Получение биомассы Janthinobacterium lividum ВКМ B-3705D в виде порошка.
1. Чистую культуру штамма Janthinobacterium lividum ВКМ B-3705D выращивают на агаризованной питательной среде, содержащей 3% пептон, 2% агар и 95% воды в чашке Петри в течении 24 часа при 25°С;
2. Собирают полученную культуру микробиологической петлёй и получают суспензию Janthinobacterium lividum ВКМ B-3705D путем смешения культуры с 4 мл стерильной воды;
3. Подготавливают инокулят внесением 1 мл суспензии Janthinobacterium lividum ВКМ B-3705D в 100 мл жидкой питательной среды, содержащей 1% пептона;
4. Осуществляют инкубацию в течение 2 суток при температуре 25°С и постоянном перемешивании со скоростью 150 об/мин;
5. Полученный инокулят переносят в емкость с 900 мл свежей питательной среды, содержащей 1% пептона, и культивируют 3 суток с аэрацией при перемешивании 400 об/мин при 25°С с обеспечением поддержания содержания растворенного кислорода 80%;
6. Полученную культуральную жидкость замораживают при минус 40°С и затем лиофильно высушивают в течение 17 часов, получая Janthinobacterium lividum ВКМ B-3705D в виде порошка;
Пример 2. Получение экстракта виолацеина.
1. Порошок Janthinobacterium lividum ВКМ B-3705D полученный по примеру 1 в количестве 1 г смешивают со 100 мл изопропилового спирта, перемешивают в течение 3 часов со скоростью 150 об/мин и пропускают под вакуумом через фильтр с диаметром пор 0,1 мкм, полученный осадок вновь смешивают со 100 мл изопропилового спирта, перемешивают в течение 3 часов со скоростью 150 об/мин и пропускают под вакуумом через фильтр с диаметром пор 0,1 мкм. При этом, в случае необходимости процедуру повторяют до получения обесцвеченного осадка. Так как на фильтре был получен обесцвеченный осадок за две процедуры, далее ее не повторяют, а все порции фильтрата в количестве 200 мл объединяют в одной емкости;
2. Фильтрат, полученный на предыдущем этапе упаривают с помощью роторного испарителя до объема 100 мл и проводят процедуру очистки от примесей, для чего полученный экстракт растворяют в дистиллированной воде в соотношении 1:10 и отстаивают до образования взвеси;
3. Полученный водный раствор фильтруют через фильтр с диаметром пор 0,1 мкм и для исключения потерь готового продукта экстрагируют полученный виолацеин из фильтра посредством 99%-ного диметилсульфоксида в количестве 100 мл.
В результате получают экстракт пигмента-виолацеина в диметилсульфоксиде, при этом при пересчете концентрации с использованием закона Бугера-Ламберта-Бера получается концентрация пигмента-виолацеина в диметилсульфоксиде 28,4 г/л.
Экстракт спектрофотометрировали с использованием спектрофотометра Nabi NB1-D-210108, Micro Digital, (Корея) в диапазоне длин волн λ = 350-700 нм. Выявлен максимум поглощения раствора пигмента в диметилсульфоксиде при длине волны λ = 575 нм, что соответствует данным из источника [Durán, N., Justo, G.Z., Ferreira, C.V., Melo, P.S., Cordi, L. and Martins, D. (2007), Violacein: properties and biological activities. Biotechnology and Applied Biochemistry, 48: 127-133. doi:10.1042/BA20070115].
Чистоту полученного экстракта оценивали методом тонкослойной хроматографии (ТСХ) на пластинах (Sorbfil (100×100 мм), Краснодар (Россия) с использованием трансиллюминатора WUV-L50, DAIHAN Scientific Co., Ltd, (Корея). В качестве подвижной фазы использовали смесь ацетона с этилацетатом в соотношении 1:1. По результатам анализа установлено, что содержание примесей на линии старта могут быть остатком диметилсульфоксида (фиг.2а). Для сравнения на фиг. 2б представлено изображение неочищенного от примесей экстракта .
Таким образом, поставленная задача по созданию способа получения экстракта виолацеина путем его синтеза с использованием штамма микроорганизма Janthinobacterium lividum ВКМ B-3705D решена.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ получения фракции виолацеина при поверхностном твердофазном культивировании штамма Janthinobacterium lividum B-3705D | 2023 |
|
RU2819794C1 |
| ПРИМЕНЕНИЕ ПРОИЗВОДНЫХ 1,3-БЕНЗОДИОКСОЛА В КАЧЕСТВЕ РЕГУЛЯТОРОВ КОЛЛЕКТИВНОГО ПОВЕДЕНИЯ (ЧУВСТВА КВОРУМА) У БАКТЕРИЙ | 2012 |
|
RU2514001C2 |
| РЕГУЛЯТОР КОЛЛЕКТИВНОГО ПОВЕДЕНИЯ ("ЧУВСТВО КВОРУМА") У БАКТЕРИЙ | 2012 |
|
RU2534617C2 |
| Штамм Rhodococcus qingshengii VER34 биодеструктор органических загрязняющих соединений, содержащих в своей структуре лактонное кольцо | 2021 |
|
RU2828844C2 |
| БИОАКТИВНЫЕ КОМПОЗИЦИИ И МЕТАБОЛИТЫ CHROMOBACTERIUM | 2011 |
|
RU2580105C2 |
| Применение кумарина и его производных в качестве ингибиторов системы "кворум сенсинга" LuxI/LuxR типа у бактерий | 2015 |
|
RU2616237C1 |
| КОМПОЗИЦИЯ (ДВУХКОМПОНЕНТНАЯ) НА ОСНОВЕ ЭКСТРАКТОВ ЛЕКАРСТВЕННЫХ РАСТЕНИЙ, ПОДАВЛЯЮЩАЯ "ЧУВСТВО КВОРУМА" У БАКТЕРИЙ | 2020 |
|
RU2758451C1 |
| Штамм гриба Eremothecium gossypii - продуцент эфирного масла | 2016 |
|
RU2651502C2 |
| ШТАММ ГРИБА Eremothecium ashbyi - ПРОДУЦЕНТ ЭФИРНОГО МАСЛА С ЗАПАХОМ СВЕЖИХ ЦВЕТКОВ РОЗЫ | 2014 |
|
RU2567675C1 |
| СПОСОБ ПРИМЕНЕНИЯ КУМАРИНА ДЛЯ ИНГИБИРОВАНИЯ РАЗЛИЧНЫХ СИСТЕМ "КВОРУМ СЕНСИНГА" LUX/LUXR ТИПА У БАКТЕРИЙ | 2019 |
|
RU2744456C1 |
Изобретение относится к области биотехнологии. Изобретение представляет собой способ получения экстракта виолацеина с использованием Janthinobacterium lividium ВКМ B-3705D, относится к микробиологии, в частности – к биотехнологии. Способ включает смешивание при комнатной температуре порошка Janthinobacterium lividum ВКМ B-3705D с изопропиловым спиртом с получением 1% коллоидного раствора и перемешиванием 150 об/мин в течение 3 часов. Затем полученную смесь пропускают под вакуумом через фильтр с диаметром пор 0,1 мкм, процедуру фильтрации повторяют до получения обесцвеченного осадка на фильтре и все порции фильтрата объединяют в одной емкости. Фильтрат, полученный на предыдущем этапе, упаривают с помощью роторного испарителя с уменьшением объема в два раза, очищают полученный экстракт от примесей путем растворения в дистиллированной воде в соотношении 1:10 с последующим отстаиванием до образования взвеси. Полученную взвесь фильтруют через фильтр с диаметром пор 0,1 мкм, после чего экстрагируют виолацеин из фильтра посредством 99%-ного диметилсульфоксида. При этом порошок Janthinobacterium lividum ВКМ B-3705D получают путем выращивания чистой культуры Janthinobacterium lividum ВКМ B-3705D на агаризованной питательной среде содержащей 3% пептон, 2% агар и 95% воды, в течение 24 часа при 25°С. Полученную культуру суспендируют в стерильной воде. Получают 1%-ный инокулят путем внесения полученной суспензии Janthinobacterium lividum ВКМ B-3705D в жидкую питательную среду, содержащую 1% пептона и осуществляют инкубацию инокулята в течение 2 суток при температуре 25°С и постоянном перемешивании со скоростью 150 об/мин. После чего инокулят переносят в емкость со свежей питательной средой содержащей 1% пептон и культивируют 3 суток с аэрацией при перемешивании 400 об/мин при 25°С с обеспечением поддержания содержания растворенного кислорода 80%. Затем полученную культуральную жидкость замораживают при минус 40°С после чего лиофильно высушивают. Предложенный способ расширяет ассортимент штаммов, пригодных к использованию в качестве продуцента виолацеина. 2 ил.
Способ получения экстракта виолацеина, включающий смешивание при комнатной температуре порошка Janthinobacterium lividum ВКМ B-3705D с изопропиловым спиртом с получением 1% коллоидного раствора и перемешиванием 150 об/мин в течение 3 часов, затем полученную смесь пропускают под вакуумом через фильтр с диаметром пор 0,1 мкм, процедуру фильтрации повторяют до получения обесцвеченного осадка на фильтре и все порции фильтрата объединяют в одной емкости; фильтрат, полученный на предыдущем этапе упаривают с помощью роторного испарителя с уменьшением объема в два раза, полученный экстракт очищают от примесей путем растворения в дистиллированной воде в соотношении 1:10 с последующим отстаиванием до образования взвеси, и фильтруют через фильтр с диаметром пор 0,1 мкм, после чего экстрагируют виолацеин из фильтра посредством 99%-ного диметилсульфоксида, при этом порошок Janthinobacterium lividum ВКМ B-3705D получают путем выращивания чистой культуры Janthinobacterium lividum ВКМ B-3705D на агаризованной питательной среде содержащей 3% пептон, 2% агар и 95% воды, в течении 24 часа при 25°С; полученную культуру суспендируют в стерильной воде; получают 1%-ный инокулят путем внесения полученной суспензии Janthinobacterium lividum ВКМ B-3705D в жидкую питательную среду, содержащую 1% пептона; осуществляют инкубацию инокулята в течение 2 суток при температуре 25°С и постоянном перемешивании со скоростью 150 об/мин, после чего его переносят в емкость со свежей питательной средой содержащей 1% пептон и культивируют 3 суток с аэрацией при перемешивании 400 об/мин при 25°С с обеспечением поддержания содержания растворенного кислорода 80%; затем полученную культуральную жидкость замораживают при минус 40°С после чего лиофильно высушивают.
| БИОАКТИВНЫЕ КОМПОЗИЦИИ И МЕТАБОЛИТЫ CHROMOBACTERIUM | 2011 |
|
RU2580105C2 |
| СОН ЕЛЬ ЧОЙ, и др., Виолацеин: свойства и производство универсального бактериального пигмента, Биомед Res Int | |||
| Устройство для закрепления лыж на раме мотоциклов и велосипедов взамен переднего колеса | 1924 |
|
SU2015A1 |
| NELSON DURÁN; et al, Violacein: properties and biological activities, 2007, 48(3), 127-0 | |||
| Печь-кухня, могущая работать, как самостоятельно, так и в комбинации с разного рода нагревательными приборами | 1921 |
|
SU10A1 |
Авторы
Даты
2024-01-30—Публикация
2023-05-16—Подача