Предлагаемое изобретение относится к микробиологии, в частности к биотехнологии, медицинской и сельскохозяйственной биотехнологии. Изобретение касается поверхностного твердофазного культивирования аэробного штамма Janthinobacterium lividum В-3705D и может быть использовано для лабораторных исследований, получаемых в контролируемых условиях метаболитов, например, пигмента бактериального происхождения виолацеин, образуемого при формировании биопленки.
Это существенно при исследовании возбудителей болезней человека, сельскохозяйственных животных и растений. Вплоть до конца ХХ в. в микробиологии было принято считать, что в естественных условиях микроорганизмы существуют в свободно взвешенном состоянии, и все описанные свойства изучались на так называемых планктонных формах чистых культур. Сейчас известно, что в естественной среде обитания до 99% всех микроорганизмов существуют в виде биоплёнок - организованных сообществ бактерий, состоящих из активно функционирующих клеток и покоящихся форм, заключенных в экстрацеллюлярный матрикс. Биопленки формируются на границе раздела твердой и жидкой или твердой и газообразной фаз. Исследования таких объектов приобрели в настоящее время систематический характер. [Симонова Ирина Рафиковна и др., ст. Методы культивирования и изучения бактериальных биопленок, интернет-источник https://cyberleninka.ru/article/n/metody-kultivirovaniya-i-izucheniya-bakterialnyh-bioplenok?ysclid=lopfz0501l840134942]
Известно свойство микроорганизмов к биосинтезу ряда биологически активных веществ, например антибиотиков, после формирования биопленки. С этим свойством тесно связан механизм чувства кворума, или ЧК. В научной литературе описаны сведения о том, что этот механизм представляет собой систему межклеточной коммуникации, которая широко распространена в микробном сообществе и вступает в силу, когда плотность клеток в популяции достигает высоких значений [Meizhen Wang, Yulu Lian, Yujie Wang, Lin Zhu, The role and mechanism of quorum sensing on environmental antimicrobial resistance, Environmental Pollution, Volume 322, 2023, 121238 https://doi.org/10.1016/j.envpol.2023.121238]. Это связано с накоплением определенных сигнальных молекул, которые вызывают синтез таких соединений, как антибиотики. Известно, что с чувством кворума связаны такие явления, как приобретение устойчивости к противомикробным препаратам, что затрудняет лечение инфекционных болезней. Сообщается, что устойчивость стала одной из крупнейших угроз общественному здравоохранению, затрудняя профилактику и лечение хронических заболеваний. Высокий уровень серьезности проблемы подтверждает Всемирная организация здравоохранения (ВОЗ), и Европейская комиссия, которые признали необходимость изучения возникновения и необходимости мер по борьбе с резистентностью. Ожидается, что из-за резистентных заболеваний страны будут иметь самый высокий уровень смертности [Aditi Vashistha, Nikhil Sharma, Yerramsetti Nanaji, Deepak Kumar, Gurpal Singh, Ravi P. Barnwal, Ashok Kumar Yadav, Quorum sensing inhibitors as Therapeutics: Bacterial biofilm inhibition, Bioorganic Chemistry, Volume 136, 2023,106551, https://doi.org/10.1016/j.bioorg.2023.106551]. Так, инфекции, вызванные Pseudomonas aeruginosa, или синегнойной палочкой, трудно поддаются лечению из-за приобретенной и внутренней резистентности ко многим антибиотикам и в этом существенную роль играет механизм чувства кворума [Bové M, Kolpen M, Lichtenberg M, Bjarnsholt T, Coenye T. Adaptation of Pseudomonas aeruginosa biofilms to tobramycin and the quorum sensing inhibitor C-30 during experimental evolution requires multiple genotypic and phenotypic changes. Microbiology (Reading). 2023 Jan;169(1):001278. doi: 10.1099/mic.0.001278]. Отсюда следует, что есть необходимость в исследованиях механизма чувства кворума и организации биопленки в целом.
Наиболее простым способом получения веществ, образующихся в биопленке, является стандартный высев на агаризованную питательную среду в чашках Петри. При этом культуры засевают сплошным посевом из заранее подготовленной суспензии клеток [Нетрусов А.И., Практикум по микробиологии [Текст]: учеб. пособие для студ. высш. учеб. заведений / А.И. Нетрусов М. А. Егорова, Л.М. Захарчук и др.; - Москва: Издательский центр «Академия», 2005. - 608 с.]. Однако данный метод имеет ряд недостатков: трудоемкость и низкую концентрацию метаболитов. Это связано с тем, что диаметр чашки около 90 мм и требуется несколько чашек для получения большого объема метаболитов. Данный способ является удобным при исследовании антагонистической активности веществ, выделяемых микроорганизмами в среду, так как можно использовать метод агаровых дисков. Для этого, стерильным пробочным сверлом с необходимым диаметром, вырезают диски в чашках из агара с выросшей культурой и размещают на поверхности свежего посева тест-культуры в другой чашке Петри. Об антагонистической активности судят по зоне подавления роста тест-культуры вокруг диска [Нетрусов А.И., Практикум по микробиологии [Текст]: учеб. пособие для студ. высш. учеб. заведений / А.И. Нетрусов М. А. Егорова, Л.М. Захарчук и др.; - Москва: Издательский центр «Академия», 2005. - 608 с.].
В патенте RU 2532828 С1 (опубл. 10.11.2014), предложен способ и устройство для поверхностного выращивания микроорганизмов на жидкой питательной среде. Предлагаемое устройство и способ обеспечивают выращивание микроорганизмов с минимальным применением ручного труда. Способ включает выращивание чистой культуры микроорганизма на косом агаре, выращивание маточной культуры микроорганизма на жидкой питательной среде, выращивание биомассы микроорганизма путем соединения маточной культуры с жидкой питательной средой и поверхностного ее выращивания в тонком слое в кювете, отделение образовавшейся пленки биомассы микроорганизма от остатков питательной среды и ее доращивание в течение двух суток, сушку пленки биомассы до воздушно-сухого состояния, выгрузку сухой пленки биомассы, при этом способ осуществляют с помощью устройства, включающим кювету с поддоном для выращивания микроорганизма, снабженную свободно опущенной на ее дно транспортной сеткой, выполненной из нейтрального материала и закрепленной своими концами на приводных барабанах с приводом, обеспечивающих поднятие транспортной сетки со дна кюветы путем ее натяжения и ее продольное перемещение, приемное устройство с клапаном для присоединения к смесителю-дозатору и подачи смеси жидкой питательной среды с маточной культурой в кювету, поворотными заслонками, установленными по торцам кюветы для регулирования обмена воздуха в кювете, сливное устройство для слива культуральной жидкости из кюветы, патрубок для подачи сушильного агента под сетку, пробоотборник и сменные светофильтры в фонарях для регулирования освещенности, расположенные на боковых стенках кюветы, и крышку, герметично закрывающую кювету, выполненную с возможностью ее открывания и/или снятия, снабженную форсунками для распыления раствора ПАВ над поверхностью выращиваемой в кювете биомассы и моющими головками для осуществления санитарной обработки устройства. Недостатком данного способа является сложность устройства, больше подходящего для промышленного или полупромышленного процесса. Недостатком является то, что этот способ применим только для выращивания микроорганизмов на жидкой питательной среде в промышленных или полупромышленных масштабах, и его сложно реализовать в лабораторных условиях.
В патенте RU 2482174 C2 (опубл. 20.05.2013) предложены штаммы бактерий Bacillus subtilis ВКПМ В-10641, Bacillus amyloliquefaciens ВКПМ В-10642, Bacillus amyloliquefaciens ВКПМ В-10643, которые относятся к грамположительным факультативно аэробным палочковидным бактериям, и их комбинация. Для получения биомассы спор бактерий штаммы Bacillus subtilis ВКПМ В-10641, Bacillus amyloliquefaciens ВКПМ В-10642, Bacillus amyloliquefaciens ВКПМ В-10643 культивировали на жидкой питательной среде следующего состава:
- пептон мясной ферментативный - 10,0 г;
- дрожжевой экстракт - 5,0 г;
- хлорид натрия - 5,0 г;
- дистиллированная вода - до общего объема 1 дм3;
рН 7,2±0,2.
На 1 дм3 ферментационной питательной среды использовали 10 см3 посевного материала с титром 108 КОЕ/см3. Процесс выращивания биомассы осуществляли в ферментере в течение 48±2 часов. При указанном способе культивирования может быть получен титр спор (5-10)×1010 КОЕ/см3. Заявлена множественная ферментативная и антибиотическая активность такого варианта, что является хорошим преимуществом. Однако такая комбинация основана на культурах, полученных в результате селекции, и заявленная численность в композиции составляет не менее 1⋅104КОЕ/мл. В данном случае на выходе получается низкая концентрация клеток и увеличивается время биосинтеза сигнальных веществ, которые можно использовать в исследованиях. Недостатком является также то, что этот способ применим только для выращивания микроорганизмов на жидкой питательной среде.
В патенте RU 2535872 C2 от 20.12.2014, предложен способ твердофазного культивирования плесневого гриба Aspergillus ochraceus для получения протеиназы-активатора протеина С плазмы крови. Способ предусматривает культивирование в течение 3-7 суток продуцирующего активатора протеина С штамма микроскопического гриба Aspergillus ochraceus BKM F-4104D на ферментационной среде, содержащей глюкозу, крахмал, гидролизат рыбной муки, пептон, хлорид натрия, дигидрофосфат калия и сульфат магния, воду, причём ферментационная среда содержит твердый сыпучий субстрат или твердый сыпучий носитель, в качестве которых используют пшеничные отруби, силикагель, вермикулит или пенополиуретан. Авторам удалось повысить выход протеолитического фермента в сравнении с результатами ближайшего аналога. Однако предложенный способ характеризуется тем, что используется статическое культивирование и это может привести к снижению темпа формирования бактериальной биопленки. Причина этого заключается в том, что только поверхность сыпучей среды будет контактировать с достаточным объемом воздуха. Кроме того, требуется поддержание влажности воздуха, иначе субстрат высохнет, и развитие микроорганизмов будет неосуществимо.
Известен способ выделения анаэробных микроорганизмов в специальных емкостях, который носит название метода Р. Хангейта [Нетрусов А.И., Практикум по микробиологии [Текст]: учеб. пособие для студ. высш. учеб. заведений / А.И. Нетрусов М. А. Егорова, Л.М. Захарчук и др.; - Москва: Издательский центр «Академия», 2005. - 608 с.]. Сущность этого метода заключается в том, что расплавленную агаризованную питательную среду заливают в полые стерильные емкости, а именно пробирки, и дают ей застыть на стенках сосуда при постоянном вращении. Емкость продувают инертным газом, например, аргоном, для вытеснения кислорода. Производят засев среды в этой емкости в токе стерильного инертного газа с помощью бактериальной петли, проводя штрих во вращающейся пробирке в направлении от ее дна к горлышку. Иногда для получения чистой культуры бывает достаточно одного посева в плотную среду, однако чаще посев в плотную питательную среду повторяют 2-3 раза. Емкость заполняют газом и инкубируют при необходимой температуре. Проросшие колонии микроорганизмов изолируют и исследуют.
Недостатком данного способа является низкая продуктивность в результате малого объема пробирок, а также его неприменимость для культивирования аэробных микроорганизмов для лабораторных исследований.
Таким образом, разработка способа поверхностного культивирования микроорганизмов для лабораторных исследований, который смог бы обеспечить получение значительного количества метаболитов, является актуальной.
Задачей изобретения является разработка способа поверхностного твердофазного культивирования аэробного штамма Janthinobacterium lividum В-3705D для лабораторных исследований его метаболитов, например, пигмента бактериального происхождения виолацеин.
Технический результат - возможность получения для лабораторных исследований пигмента бактериального происхождения виолацеин, который штамм Janthinobacterium lividum В-3705D синтезирует в биопленке в контролируемых условиях.
Способ поверхностного твердофазного культивирования аэробного штамма Janthinobacterium lividum В-3705D, включающий внесение питательный среды в полую ёмкость, вращение ёмкости до застывания питательной среды на стенках ёмкости, посев микроорганизмов, инкубирование до окончания роста колонии микроорганизмов, содержит следующие новые признаки:
- емкость для культивирования, объемом не менее 2 литров, что важно для предотвращения высыхания среды, заполняют на 20% питательной средой, которая содержит 2,5% агар-агара, 1-3% пептона, преимущественно 1% пептона, что достаточно для получения заявленного технического результата;
- питательную среду в ёмкости автоклавируют при 115°С в течение 15 минут, затем устанавливают ёмкость так, чтобы ее ось была размещена горизонтально и вращают ёмкость вокруг оси до распределения её по стенкам ёмкости;
- после того, как питательная среда застынет на стенках ёмкости, вносят суспензию штамма Janthinobacterium lividum и продолжают вращают ёмкость вокруг оси в горизонтальной плоскости до распределения суспензии на питательной среде стенок ёмкости;
- устанавливают ёмкость так, чтобы ее ось была размещена вертикально и инкубируют при постоянной температуре 25°С, оптимальной для роста штамма Janthinobacterium lividum, и при аэрации воздухом, пропущенным через фильтр с размером пор не более 0,22 мкм;
- рост культуры микроорганизма контролируют с использованием данных об интенсивности дыхания по снижению значений рН 1%-ного раствора NaOH, через который пропускают выделяющийся в процессе культивирования углекислый газ;
- биопленку считают выросшей и завершают инкубацию, когда значение рН раствора NaOH не изменяется;
- осуществляют экстракцию образовавшихся при культивировании веществ путем перемешивания в течение 12 часов с органическим экстрагентом, внесённым в ёмкость, в количестве позволяющим при перемешивании покрыть всю образовавшуюся плёнку. Фильтруют полученную взвесь и фильтрат упаривают, затем упаренный экстракт перемешивают со стерильной дистиллированной водой в соотношении 1:10 и дают расслоиться в течение 12 часов. Полученную суспензию фильтруют и экстрагируют полученную фракцию метаболита из мембранного фильтра. Фракцию метаболита очищают, анализируют её состав и используют в дальнейших исследованиях.
Изобретение характеризуют следующие фигуры.
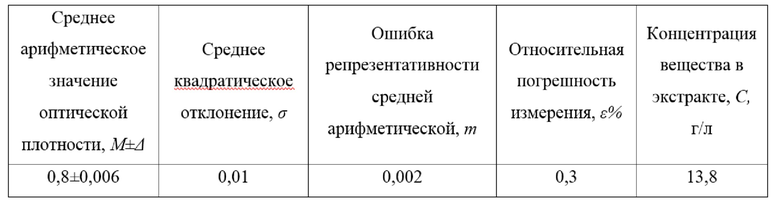
Фигура 1. Установка для поверхностного культивирования микробной культуры, где 1 - ёмкость для культивирования; 2 - культура микроорганизмов; 3 - компрессор для аэрации; 4 -трубка для аэрации; 5 - съемный фильтр с размером пор не более 0,22 мкм; 6 -трубка для удаления образующегося в процессе культивирования СО2; 7 - ёмкость для определения интенсивности дыхания; 8 - 1%-ный раствор гидроксида натрия; 9 - электрод рН-метра; 10 - рН-метр; 11 - трубка для удаления избытка воздуха из ёмкости 7.
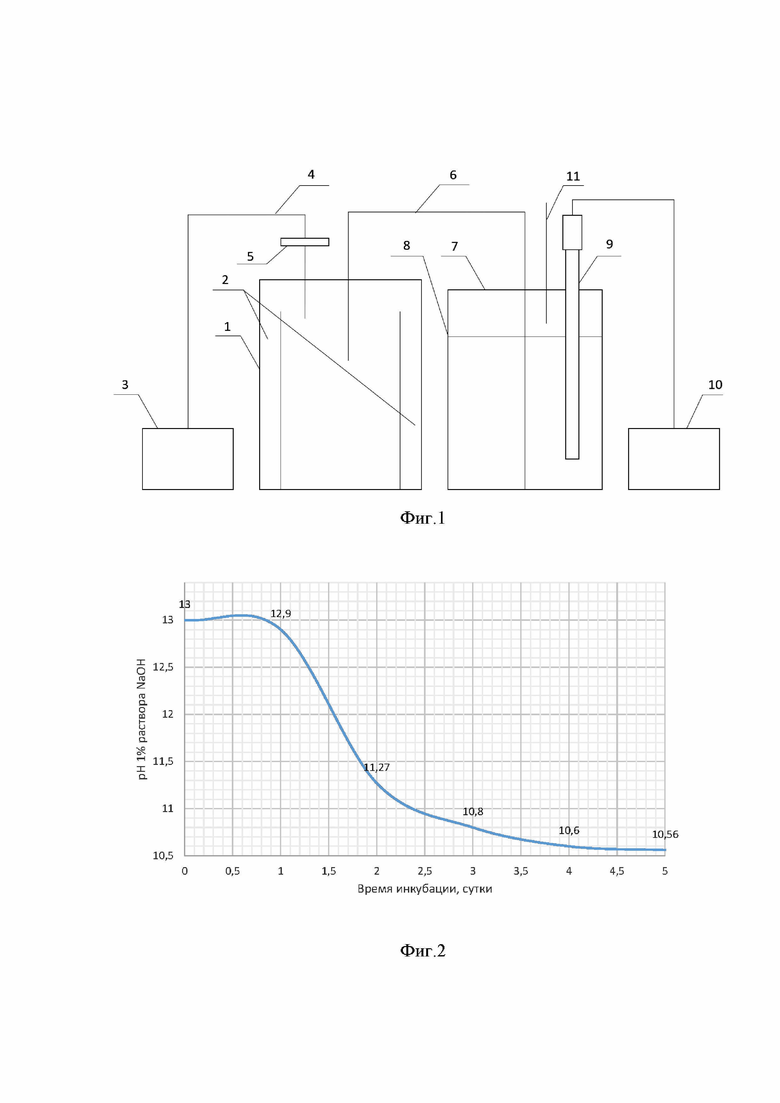
Фигура 2. График «Изменение рН 1% раствора NaOH в процессе культивирования штамма Janthinobacterium lividum ВКМ B-3705D» по примеру 1
Примеры осуществления заявленного изобретения - получение фракции пигмента бактериального происхождения виолацеин, синтезируемого штаммом Janthinobacterium lividum В-3705D.
Пример 1. Получение фракции виолацеина (violacein) при поверхностном твердофазном культивировании штамма Janthinobacterium lividium ВКМ В-3705D
1. Подготавливают суточную культуру Janthinobacterium lividium ВКМ В-3705D посевом методом штриха на агаризованной питательной среде, которая состоит из воды, 10,0 г/л пептона, 20,0 г/л агар-агара;
2. Подготовленную культуру по п.1 засевают в 100 мл жидкой среды, которая состоит из 1% пептона, а остальное - вода, инкубируют с перемешиванием при 150 об/мин и 25°С в течение 2-х суток для получения суспензии;
3. Емкость для культивирования, объемом 5 литров, заполняют на 20% питательной средой, которая содержит 2,5% агар-агара, 1% пептона, а остальное - вода. Смесь в емкости автоклавируют при 115°С в течение 15 минут. После чего, устанавливают ёмкость так, чтобы ее ось была размещена горизонтально, и вращают ёмкость вокруг оси до распределения питательной среды по стенкам ёмкости, при этом питательная среда застывает на боковых стенках ёмкости;
4. Полученную по п. 2 суспензию вносят в емкость 1 с застывшей питательной средой на боковых стенках емкости, продолжают вращать ёмкость вокруг оси в горизонтальной плоскости до распределения суспензии на питательной среде на стенках ёмкости, после чего устанавливают ёмкость так, чтобы ее ось была размещена вертикально (фиг.1) и затем инкубируют в вертикальном положении при 25°С, с аэрацией воздухом, пропущенным через фильтр с размером пор не более 0,22 мкм, посредством использования компрессора 3 - 400 мл/час, что позволяет сохранить влажность питательной среды;
5. Каждые 12 часов фиксируют изменение значения рН 1%-ного раствора NaOH, через который пропускают углекислый газ, выделяющийся в процессе культивирования штамма Janthinobacterium lividum В-3705D. На пятые сутки значение рН раствора NaOH практически не изменяется (фиг. 2), и культивирование завершают. Затем проводят экстракцию образовавшихся метаболитов, для чего в ёмкость 1 заливают 300 мл изопропилового спирта и перемешивают в течение 12 часов посредством орбитальной мешалки;
6. Полученную взвесь фильтруют. Полученный после фильтрации экстракт упаривают с использованием вакуумного роторного испарителя до объёма 50 мл. Упаренный экстракт смешивают со стерильной дистиллированной водой в соотношении 1:10 и дают расслоиться в течение 12 часов, после чего фильтруют и экстрагируют из мембранного фильтра изопропиловым спиртом фракции пигмента виолацеин.
Пример 2. Анализ индивидуальных свойств фракции метаболита - пигмента виолацеин, полученного заявленным способом.
Фракцию пигмента виолацеин спектрофотометрируют при длине волны λ = 575 нм и рассчитывают концентрацию с использованием формулы Бугера-Ламберта-Бера:
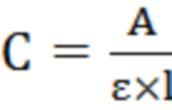 , (1)
, (1)
где С - концентрация раствора, г/л; ε - молярный коэффициент экстинции; l - толщина поглощающего слоя, см (1 см); А - оптическая плотность поглощающего вещества.
Доверительные интервалы (Δ) рассчитывают по формуле:
∆ = tst ⋅ m, (2)
где tst - стандартное значение критерия достоверности Стьюдента, m - ошибка репрезентативности средней квадратической и вычисляется по формуле:
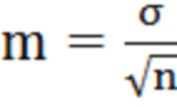 , (3)
, (3)
где σ - среднее квадратическое отклонение и рассчитывается по формуле:
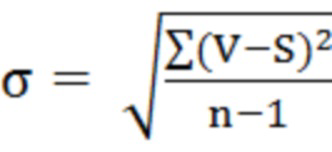 , (4)
, (4)
где V - дата, S - средняя квадратическая диаметра колонии, n - объем выборки.
Относительную погрешность измерения рассчитывали с использованием формулы:
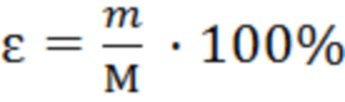 , (5)
, (5)
где М - среднее арифметическое значение, а m - ошибка репрезентативности среднего арифметического значения.
Результаты расчета представлены в таблице 1.
Таблица 1. Максимум поглощения фракции виолацеина в изопропаноле при длине волны λ = 575 нм как показатель концентрации вещества, г/л
Таким образом, при поверхностном твердофазном культивировании по примеру 1 была получена фракция метаболита, содержащая 13,8 г/л пигмента виолацеин, что достаточно для проведения лабораторных исследований указанного пигмента.
Следовательно, поставленная задача по разработке способа поверхностного твердофазного культивирования аэробного штамма Janthinobacterium lividum В-3705D, который может быть использован для лабораторных исследований его метаболитов, например, пигмента бактериального происхождения виолацеин, решена.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ ЭКСТРАКТА ВИОЛАЦЕИНА С ИСПОЛЬЗОВАНИЕМ JANTHINOBACTERIUM LIVIDIUM ВКМ B-3705D | 2023 |
|
RU2812461C1 |
| Устройство для оценки интенсивности дыхания микробной культуры | 2022 |
|
RU2783515C1 |
| СПОСОБ ПОЛУЧЕНИЯ КОРМОВОГО ПРОБИОТИЧЕСКОГО ПРЕПАРАТА ДЛЯ СЕЛЬСКОХОЗЯЙСТВЕННЫХ ЖИВОТНЫХ | 2013 |
|
RU2546880C2 |
| Бактериальный препарат для нитрификации и денитрификации воды | 2022 |
|
RU2826455C2 |
| СПОСОБ ПОЛУЧЕНИЯ КОМПОЗИЦИИ ДЛЯ ВЫРАЩИВАНИЯ РАСТЕНИЙ | 2014 |
|
RU2576197C1 |
| Способ получения кормовой композиции с функциональными свойствами для птицеводства | 2023 |
|
RU2819889C1 |
| Штамм Halobacterium salinarum, используемый для получения бактериальных препаратов | 2017 |
|
RU2662996C1 |
| Способ получения антибиотика с-15003 р-4 | 1978 |
|
SU882414A3 |
| Способ получения антибиотика @ -15003 @ -3 | 1978 |
|
SU1036251A3 |
| СПОСОБ ПРИГОТОВЛЕНИЯ ЛЕЧЕБНО-ПРОФИЛАКТИЧЕСКОГО ПРЕПАРАТА ИЗ ЖИВЫХ ШТАММОВ МИКРООРГАНИЗМОВ ЛАКТОБАЦИЛЛ И БИФИДОБАКТЕРИЙ "LB-КОМПЛЕКС ПЛЮС" | 2012 |
|
RU2517734C1 |
Способ поверхностного твердофазного культивирования аэробного штамма Janthinobacterium lividum В-3705D относится к микробиологии, в частности к биотехнологии, медицинской и сельскохозяйственной биотехнологии. Изобретение касается поверхностного твердофазного культивирования аэробного штамма Janthinobacterium lividum В-3705D и может быть использовано для лабораторных исследований, получаемых в контролируемых условиях метаболитов, например, пигмента бактериального происхождения виолацеин, образуемого при формировании биопленки. Способ включает внесение питательный среды в полую ёмкость, вращение ёмкости до застывания питательной среды на стенках ёмкости, посев микроорганизмов, инкубирование до окончания роста колонии микроорганизмов. При этом после того как питательная среда застынет на стенках ёмкости, вносят суспензию штамма Janthinobacterium lividum и продолжают вращать ёмкость вокруг оси в горизонтальной плоскости до распределения суспензии на питательной среде стенок ёмкости. Инкубируют микроорганизмы при постоянной температуре 25°С и при аэрации воздухом, пропущенным через фильтр с размером пор не более 0,22 мкм. Рост культуры микроорганизма контролируют с использованием данных об интенсивности дыхания по снижению значений рН 1%-ного раствора NaOH, через который пропускают выделяющийся в процессе культивирования углекислый газ. Биопленку считают выросшей и завершают инкубацию, когда значение рН раствора NaOH не изменяется. Затем осуществляют экстракцию образовавшихся при культивировании веществ путем перемешивания в течение 12 часов с органическим экстрагентом, фильтруют полученную взвесь и фильтрат упаривают. Упаренный экстракт перемешивают со стерильной дистиллированной водой в соотношении 1:10 и дают расслоиться в течение 12 часов. После фильтрации экстрагируют полученную фракцию метаболита из мембранного фильтра. Фракцию метаболита очищают, анализируют её состав и используют в дальнейших исследованиях. С использованием предлагаемого способа может реализовываться программа исследований, например, метаболита, синтезируемого штаммом Janthinobacterium lividum В-3705D, а именно пигмента бактериального происхождения виолацеин, который синтезируется при формировании биопленки. 2 ил., 1 табл.
Способ получения фракции виолацеина при поверхностном твердофазном культивировании штамма Janthinobacterium lividum ВКМ В-3705D, включающий внесение питательный среды в полую ёмкость, вращение ёмкости до застывания питательной среды на стенках ёмкости, посев микроорганизмов, инкубирование до окончания роста колонии микроорганизмов, отличающийся тем, что ёмкость для культивирования, объемом не менее 2 литров, заполняют на 20% питательной средой, которая содержит 2,5% агар-агара, 1% пептона, питательную среду в ёмкости автоклавируют при 115°С в течение 15 минут, затем устанавливают ёмкость так, чтобы ее ось была размещена горизонтально и вращают ёмкость вокруг оси до распределения её по стенкам ёмкости; после того, как питательная среда застынет на стенках ёмкости, вносят суспензию штамма Janthinobacterium lividum В-3705D и продолжают вращать ёмкость вокруг оси в горизонтальной плоскости до распределения суспензии на питательной среде стенок ёмкости; затем устанавливают ёмкость так, чтобы ее ось была размещена вертикально и инкубируют при постоянной температуре 25°С, и при аэрации воздухом, пропущенным через фильтр с размером пор не более 0,22 мкм; рост культуры микроорганизма контролируют с использованием данных об интенсивности дыхания по снижению значений рН 1%-ного раствора NaOH, через который пропускают выделяющийся в процессе культивирования углекислый газ; биопленку считают выросшей и завершают инкубацию, когда значение рН раствора NaOH не изменяется; осуществляют экстракцию образовавшихся при культивировании веществ путем перемешивания в течение 12 часов с органическим экстрагентом, внесённым в ёмкость в количестве, позволяющим при перемешивании покрыть всю образовавшуюся плёнку, затем фильтруют полученную взвесь и фильтрат упаривают, после чего упаренный экстракт перемешивают со стерильной дистиллированной водой в соотношении 1:10 и дают расслоиться в течение 12 часов, после фильтрации экстрагируют полученную фракцию метаболита из мембранного фильтра, фракцию метаболита очищают, анализируют её состав и используют в дальнейших исследованиях.
| СПОСОБ ТВЕРДОФАЗНОГО КУЛЬТИВИРОВАНИЯ Aspergillus ochraceus ДЛЯ ПОЛУЧЕНИЯ ПРОТЕИНАЗЫ - АКТИВАТОРА ПРОТЕИНА С ПЛАЗМЫ КРОВИ | 2013 |
|
RU2535872C2 |
| ШТАММЫ БАКТЕРИЙ Bacillus subtilis И Bacillus amyloliquefaciens, ОБЕСПЕЧИВАЮЩИЕ ВОССТАНОВЛЕНИЕ МИКРОБИОЦЕНОЗОВ ПОЧВЫ И ЖЕЛУДОЧНО-КИШЕЧНОГО ТРАКТА ЖИВОТНЫХ, ОБЛАДАЮЩИЕ БАКТЕРИЦИДНОЙ, ФУНГИЦИДНОЙ И ВИРУЛИЦИДНОЙ АКТИВНОСТЬЮ, И ПРЕПАРАТ НА ОСНОВЕ ЭТИХ ШТАММОВ | 2011 |
|
RU2482174C2 |
| MEIZHEN WANG, et al | |||
| The role and mechanism of quorum sensing on environmental antimicrobial resistance, Environmental Pollution, Volume 322, 2023, 121238 https://doi.org/10.1016/j.envpol.2023.121238. | |||
Авторы
Даты
2024-05-24—Публикация
2023-11-09—Подача