В настоящем изобретении предложены рекомбинантные бактерии, рекомбинантная плазмида, фармацевтическая композиция и набор, а также применение среды для разведения, содержащей хлорид-ионы, для разведения рекомбинантных бактерий.
Биофармацевтические препараты или биологические терапевтические препараты относятся к широкому спектру биологических продуктов в медицине, которые, например, получают с помощью биологических процессов, включающих технологию рекомбинантной ДНК.
Биофармацевтические препараты или биологические терапевтические средства включают, например, полипептиды, идентичные или почти идентичные полипептидам субъекта, подлежащего лечению, например, эритропоэтин - белок, стимулирующий образование крови, биосинтетический инсулин человека и его аналоги, или моноклональные антитела, которые можно получать специально для противодействия или блокирования любой заданной мишени, например, клеток конкретного типа, специфических полипептидов или эндогенных антигенов, а также молекулы РНК, предназначенные для модуляции экспрессии или трансляции генов путем нейтрализации молекул мРНК-мишеней.
Биофармацевтические препараты оказывают глубокое влияние на многие области медицины, дополняя основные варианты лечения многих заболеваний, в том числе заболеваний, для лечения которых отсутствовали эффективные способы лечения, и заболевания, при которых ранее существовавшие способы лечения были явно неадекватными.
В то же время появление биофармацевтических препаратов также породило сложные вопросы регулирования и значительные фармакоэкономические проблемы, поскольку стоимость биологических терапевтических средств значительно выше, чем для обычных лекарственных средств. Этот фактор имеет особое значение, поскольку многие биологические лекарственные средства используются для лечения хронических заболеваний или для лечения рака, не поддающегося лечению иным образом, в течение оставшейся части жизни.
Кроме того, у биофармацевтических препаратов часто есть недостаток - ограниченная устойчивость против разложения, например, протеазами или нуклеазами, особенно после применения у субъекта. Частичное или полное разложение молекул биофармацевтического препарата приводит к значительному сокращению периода полувыведения биофармацевтического препарата после введения субъекту.
Вместо непосредственного применения биофармацевтического средства у субъекта часто требуются альтернативные способы применения, обеспечивающие достаточное количество соответствующего биофармацевтического средства для субъекта.
Например, биофармацевтический препарат, например, полипептид, может быть получен за счет аутологичных или гетерологичных клеток, секретирующих соответствующий полипептид, или путем переноса гена, кодирующего необходимый полипептид, в ткань-мишень с помощью способов переноса генов, например, вирусных векторов.
Доступными для приобретения примерами являются заменители дермы, содержащие эмбриональные клетки человека, которые выделяют различные факторы роста после внесения в пораженную раневую область.
Заменитель дермы Dermagraft состоит из фибробластов, внеклеточного матрикса и биорассасываемого каркаса. Dermagraft производят из фибробластов человека, полученных из донорской крайней плоти новорожденного. В процессе производства фибробласты человека высевают на биорассасываемый полигалактиновый каркас.
Доступный для приобретения заменитель дермы Apligraf содержит клетки двух типов, полученные из крайней плоти новорожденного. Живые кератиноциты и фибробласты человека встраивают в раневой коллагеновый матрикс типа 1.
Недостатком вышеупомянутых заменителей дермы является сравнительно высокая цена, обусловленная производственным процессом. Кроме того, соответствующие клетки, используемые в кожных заменителях, необходимо тестировать на предмет инфицированности вирусами человека, например, вирусом иммунодефицита 1 и 2, вирусом гепатита B, вирусом гепатита C, возбудителем сифилиса, Т-лимфотропным вирусом человека 1 и 2 типа, а также вирусом Эпштейна-Барр.
Другой доступный для приобретения пример представляет собой voretigene neparvovec-rzyl (LUXTURNA). LUXTURNA - это средство для генной терапии в виде суспензии на основе аденоассоциированного вирусного вектора для субретинальных инъекций, предназначенное для доставки нормальной копии гена, кодирующего белок пигментного эпителия сетчатки человека массой 65 кДа (RPE65), в клетки сетчатки у лиц со сниженным уровнем или отсутствием биологически активного RPE65.
Недостатком вирусного продукта или любых других продуктов для генной терапии на основе вирусных векторов является высокая стоимость производства и ограничения масштабирования производства.
Например, в заявке WO 9714806 A2 описана доставка биологически активных полипептидов субъекту неинвазивными бактериями.
Заявка WO 9611277 A1 относится к применению микроорганизмов в качестве носителей для доставки терапевтических соединений субъекту.
В WO 2011160062 A2 предложен способ лечения воспалительного заболевания кишечника, включающий введение субъекту рекомбинантного микроорганизма, способного продуцировать терапевтически эффективное количество интерлейкина 27 (ИЛ-27) или его варианта или фрагмента в слизистой оболочке кишечника in situ.
В заявке US 2013209407 A описан комменсальный штамм E.coli, способный колонизировать слизистую оболочку мочеполовой системы и/или желудочно-кишечного тракта и блокировать инфекционную и/или болезнетворную активность патогенного организма путем секреции гетерологичного антимикробного полипептида.
У бактерий известны несколько систем экспрессии гетерологичных полипептидов, использующих индуцибельные либо конститутивные промоторы.
Конститутивный промотор предпочтительно активен в клетке при всех условиях, обеспечивающих получение желательного гетерологичного полипептида, предпочтительно с высоким уровнем экспрессии, что, однако, также может привести к значительному увеличению метаболической нагрузки и, таким образом, снижению жизнеспособности и/или скорости роста используемых бактерий. Это также может оказывать непосредственное влияние на выход бактерий во ходе ферментации во время производственного процесса. Чем выше метаболическая нагрузка, тем ниже может быть выход в процессе ферментации.
Напротив, регулируемый, предпочтительно индуцируемый, промотор становится активным или усиливает активность в ответ на специфичный индуктор. Под влиянием индуктора на рекомбинантные бактерии, экспрессирующие желательный гетерологичный полипептид под контролем соответствующего регулируемого, предпочтительно индуцируемого, промотора, указанный промотор становится активным, и происходит экспрессия нуклеиновой кислоты, представляющей интерес и кодирующей соответствующий гетерологичный полипептид. Это предпочтительно является преимуществом при производстве рекомбинантных бактерий. При этом можно достичь более высокого выхода рекомбинантных бактерий, поскольку метаболическая нагрузка сведена к минимуму.
Широко используемая контролируемая система экспрессии генов представляет собой, например, низин-контролируемую систему экспрессии генов (NICE) Lactococcus lactis.
Низин, хорошо известный специалистам в данной области техники, представляет собой полипептидный лантибиотик длиной 34 аминокислоты, характеризующийся широким спектром хозяев и продуцируемый несколькими штаммами L. lactis. Низин широко используется в качестве консерванта в пищевых продуктах. Первоначально низин синтезируется рибосомами в виде предшественника. После последующих ферментативных модификаций модифицированная молекула транслоцируется через цитоплазматическую мембрану и расщепляется с образованием зрелой формы.
Экспрессию нуклеотидной последовательности, представляющей интерес, можно индуцировать добавлением низина, если ген, представляющий интерес, расположен за индуцибельным промотором P nisA системы низина.
Система экспрессии генов, контролируемая низином, предпочтительно обеспечивает высокий выход белка, однако зависит от внешнего индуктора. Добавление низина при использовании для введения субъекту является дорогостоящим, поскольку требует получения низина фармацевтической чистоты, что влечет дополнительные нормативно-правовые проблемы.
Поскольку низин является полипептидом, он также подвержен разложению протеазами. Таким образом, если после введения субъекту рекомбинантных бактерий, экспрессирующих нуклеотидную последовательность, представляющую интерес, под контролем промотора низина, предполагается непрерывная экспрессия нуклеотидной последовательности, представляющей интерес, предпочтительно следует подавать низин несколько раз.
Требование добавления низина для непрерывной экспрессии нуклеиновой последовательности, представляющей интерес, дополнительно ограничивает подходящий путь введения соответствующих рекомбинантных бактерий.
Например, системное введение рекомбинантных бактерий, экспрессирующих нуклеиновую последовательность, представляющую интерес, под контролем промотора низина дополнительно требует введения потенциально значительного количества низина субъекту для достижения концентрации низина в организме субъекта, индуцирующей экспрессию соответствующей нуклеиновой последовательности, представляющей интерес.Кроме того, необходимо учитывать профиль токсичности низина, а также необходимость наличия низина фармацевтической чистоты.
Задача настоящего изобретения - предложить бактериальную систему экспрессии, обеспечивающую экспрессию по меньшей мере одной нуклеотидной последовательности, кодирующей по меньшей мере один гетерологичный фактор, независимо представляющий собой гетерологичный полипептид или его комплекс, причем указанный гетерологичный полипептид содержит по меньшей мере один эукариотический полипептид, по меньшей мере один его фрагмент или их комбинацию, не оказывая отрицательного влияния на жизнеспособность соответствующих импользуемых рекомбинантных бактерий перед введением субъекту.
Бактериальная система экспрессии должна обеспечивать индуцибельную экспрессию соответствующего гетерологичного фактора по меньшей мере при введении субъекту.
Бактериальная система экспрессии также должна обеспечивать простое введение по меньшей мере одного полезного фактора, независимо представляющего собой гетерологичный полипептид или его комплекс, причем указанный гетерологичный полипептид содержит по меньшей мере один эукариотический полипептид, по меньшей мере один его фрагмент или их комбинацию субъекту, предпочтительно в течение длительного периода времени, без необходимости подачи дополнительного индуктора.
Кроме того, бактериальная система экспрессии должна обеспечивать контролируемое количество соответствующего полезного фактора, который должен использоваться в медицине.
Задача настоящего изобретения решена путем предложения рекомбинантных бактерий по п.1, содержащих
а) по меньшей мере одну нуклеотидную последовательность, функционально связанную с прокариотическим хлорид-индуцируемым промотором и кодирующую по меньшей мере один гетерологичный фактор, причем указанный гетерологичный фактор независимо представляет собой гетерологичный полипептид или его комплекс, и
b) по меньшей мере один прокариотический регуляторный ген, контролирующий активность указанного хлорид-индуцируемого промотора, причем указанный гетерологичный полипептид содержит по меньшей мере один эукариотический полипептид, по меньшей мере один его фрагмент или их комбинацию.
Рекомбинантные бактерии согласно настоящему изобретению предпочтительно предназначены для применения в медицине.
Предпочтительные варианты реализации рекомбинантных бактерий описаны в любом из зависимых пп.3-13, 15 или 17-23 формулы изобретения.
Задача настоящего изобретения дополнительно решена путем предложения рекомбинантной нуклеиновой кислоты по п.2, содержащей
а) по меньшей мере одну нуклеотидную последовательность, функционально связанную с прокариотическим хлорид-индуцируемым промотором и кодирующую по меньшей мере один гетерологичный фактор, причем указанный гетерологичный фактор независимо представляет собой гетерологичный полипептид или его комплекс, и
b) по меньшей мере один прокариотический регуляторный ген, контролирующий активность указанного хлорид-индуцируемого промотора, причем указанный гетерологичный полипептид содержит эукариотический полипептид, по меньшей мере один его фрагмент или их комбинацию.
Рекомбинантную нуклеиновую кислоту, предпочтительно плазмиду, согласно настоящему изобретению предпочтительно применяют в способе производства рекомбинантных бактерий согласно настоящему изобретению.
Предпочтительные варианты реализации рекомбинантной нуклеиновой кислоты описаны в любом из зависимых пунктов 4-11 или 14-16 формулы изобретения.
Задача настоящего изобретения дополнительно решена путем предложения фармацевтической композиции по п.24, содержащей рекомбинантные бактерии по любому из пп.1, 3-13, 15 или 17-21 и по меньшей мере одно фармацевтически приемлемое вспомогательное вещество.
Фармацевтическую композицию согласно настоящему изобретению предпочтительно применяют в медицине, предпочтительно при лечении предпочтительно хронической, воспалившейся раны или дегенеративного состояния, или при лечении опухоли, предпочтительно злокачественной опухоли.
Предпочтительные варианты реализации фармацевтической композиции описаны в любом из зависимых пунктов 27 или 28 формулы изобретения.
Задача настоящего изобретения дополнительно решена за счет набора по п.25 для применения в медицине, содержащего
а) рекомбинантные бактерии по любому из пп.1, 3-13, 15 или 17-21, способные экспрессировать по меньшей мере один гетерологичный фактор под контролем прокариотического хлорид-индуцируемого промотора, и
b) по меньшей мере один индуктор, содержащий хлорид-ионы.
Предпочтительные варианты реализации набора описаны в любом из зависимых пунктов 28-30 формулы изобретения.
Задача настоящего изобретения дополнительно решена за счет медицинского устройства по п.26, содержащего
а) рекомбинантные бактерии по любому из пп.1, 3-13, 15 или 17-21, способные экспрессировать по меньшей мере один гетерологичный фактор под контролем прокариотического хлорид-индуцируемого промотора.
Предпочтительные варианты реализации набора описаны в зависимом пункте 28 формулы изобретения.
Задача настоящего изобретения дополнительно решена путем применения среды для разведения по п.31, содержащей хлорид-ионы для разведения рекомбинантных бактерий по любому из пп.1, 3-13, 15 или 17-23.
Авторы настоящего изобретения обнаружили, что рекомбинантные бактерии, содержащие вышеуказанные нуклеотидные последовательности, можно применять в медицине, предпочтительно при лечении предпочтительно хронической воспалившейся раны или дегенеративного состояния, или при лечении опухоли, предпочтительно злокачественной опухоли, с целью обеспечения подходящих профилактических и/или терапевтических факторов для субъекта, нуждающегося в этом, без дополнительного введения экзогенного индуктора.
Кроме того, авторы изобретения обнаружили, что внеклеточная тканевая среда или биологические жидкости субъекта обеспечивают достаточно высокую концентрацию хлорид-ионов для инициирования и/или поддержания экспрессии по меньшей мере одной нуклеотидной последовательности, функционально связанной с прокариотическим хлорид-индуцируемым промотором и кодирующей по меньшей мере один гетерологичный фактор.
Подходящие биологические жидкости представляют собой, например, внеклеточные жидкости, например, интерстициальную жидкость, внутрисосудистую жидкость, например, кровь, плазму и сыворотку, цереброспинальную жидкость, перитонеальную жидкость, мочу, слезы и лимфу.
Кроме того, внутриклеточные жидкости некоторых фагоцитарных клеток млекопитающих, например, нейтрофилов и моноцитов, предпочтительно содержат достаточно высокие внутриклеточные концентрации хлорид-ионов в состоянии покоя для инициирования и/или поддержания экспрессии по меньшей мере одной нуклеотидной последовательности, функционально связанной с прокариотическим хлорид-индуцируемым промотором и кодирующей по меньшей мере один гетерологичный фактор.
Однако во внутриклеточной жидкости других клеток млекопитающих концентрация внутриклеточных хлорид-ионов предпочтительно недостаточна для продукции белка, и, таким образом, при проникновении рекомбинантных бактерий согласно настоящему изобретению в цитоплазму этих клеток концентрация хлоридов внутри клетки, как фактор безопасности, предотвратит инициирование и/или поддержание экспрессии по меньшей мере одной нуклеотидной последовательности, функционально связанной с прокариотическим хлорид-индуцируемым промотором и кодирующей по меньшей мере один гетерологичный фактор.
Эти результаты позволяют получить рекомбинантные бактерии, которые предпочтительно можно сконструировать в виде единого фармацевтического объекта на основе бактерий, предпочтительно непатогенных молочнокислых бактерий, генетически сконструированных с целью продукции по меньшей мере одного гетерологичного фактора.
Согласно настоящему изобретению термин «гетерологичный фактор» означает фактор, предпочтительно полипептид или его комплекс, не встречающийся в природе или не экспрессирующийся указанными используемыми бактериями.
При упоминании «гетерологичного фактора (факторов)» в целом или при упоминании конкретного «гетерологичного фактора (факторов)», например, ФРФ-2, ИЛ-4, КСФ-1 и т.д., подразумевают, что указанный термин включает их функциональный аналог(аналоги).
Согласно настоящему изобретению термин «функциональный аналог» фактора обозначает агент, который связывается с таким же рецептором (рецепторами), как и соответствующий фактор, и предпочтительно активирует такие же вторичные мессенджеры в клетке-мишени.
Если соответствующий гетерологичный фактор представляет собой полипептид или его комплекс, идентичность аминокислотной последовательности «функционального аналога» указанного по меньшей мере одного гетерологичного фактора предпочтительно составляет по меньшей мере 50%, предпочтительно по меньшей мере 80%, еще более предпочтительно по меньшей мере 90%, еще более предпочтительно по меньшей мере 93%, еще более предпочтительно по меньшей мере 95%, еще более предпочтительно по меньшей мере 97%.
Если соответствующий гетерологичный фактор представляет собой рибонуклеиновую кислоту, идентичность последовательности «функционального аналога» указанного по меньшей мере одного гетерологичного фактора предпочтительно составляет по меньшей мере 80%, еще более предпочтительно по меньшей мере 90%, еще более предпочтительно по меньшей мере 93%, еще более предпочтительно по меньшей мере 95%, еще более предпочтительно по меньшей мере 97%.
«Функциональный аналог» также можно называть биоаналогом.
При индукции хлорид-ионами рекомбинантные бактерии согласно настоящему изобретению, содержащие вышеупомянутую по меньшей мере одну нуклеотидную последовательность, способны продуцировать по меньшей мере один гетерологичный фактор путем транскрипции и предпочтительно путем трансляции по меньшей мере одной нуклеотидной последовательности.
В присутствии хлорид-ионов рекомбинантные бактерии согласно настоящему изобретению предпочтительно способны доставлять по меньшей мере один гетерологичный фактор по п.1 в организм субъекта, например, в пораженную ткань, тем самым опосредуя благоприятный эффект и/или обеспечивая лечение субъекта. Рекомбинантные бактерии согласно настоящему изобретению предпочтительно высвобождают по меньшей мере один гетерологичный фактор после введения субъекту.
В присутствии хлорид-ионов рекомбинантные бактерии согласно настоящему изобретению предпочтительно дополнительно обеспечивают постоянное высвобождение по меньшей мере одного гетерологичного фактора, предпочтительно после введения субъекту, нуждающемуся в этом.
Следовательно, в настоящем изобретении предложен значительно улучшенный, более безопасный и экономически эффективный способ лечения субъектов, страдающих медицинским состоянием, например, предпочтительно хронической воспаленной раной, или дегенеративным состоянием, или опухолью, предпочтительно злокачественной опухолью.
Указанный по меньшей мере один гетерологичный фактор после высвобождения из бактерий предпочтительно проявляет по меньшей мере один вид биологической активности, поддерживающей лечение указанного субъекта и/или предотвращающей ухудшение медицинского состояния.
Кроме того, указанный по меньшей мере один гетерологичный фактор после высвобождения из бактерий может оказывать профилактическое и/или терапевтическое действие, например, за счет паракринной и/или эндокринной активности, влияющей на местный метаболизм или метаболизм всего организма, и/или за счет регуляторной активности по отношению к клеткам организма, и/или за счет воздействия на жизнеспособность, рост и дифференцировку различных клеток в организме, и/или за счет воздействия на иммунную регуляцию или индукцию острых воспалительных реакций на повреждение и/или инфекцию.
Рекомбинантные бактерии согласно настоящему изобретению содержат:
а) по меньшей мере одну нуклеотидную последовательность, функционально связанную с прокариотическим хлорид-индуцируемым промотором и кодирующую по меньшей мере один гетерологичный фактор, причем указанный гетерологичный фактор независимо представляет собой гетерологичный полипептид или его комплекс, и
b) по меньшей мере один прокариотический регуляторный ген, контролирующий активность указанного хлорид-индуцируемого промотора, причем указанный гетерологичный полипептид содержит по меньшей мере один эукариотический полипептид, по меньшей мере один его фрагмент или их комбинацию.
Термин «прокариотический промотор» известен специалисту в данной области техники и относится к нуклеотидной последовательности, контролирующей инициацию транскрипции конкретного гена, предпочтительно обеспечивая сайт связывания РНК-полимеразы и/или по меньшей мере одного фактора транскрипции, рекрутирующего РНК-полимеразу.
Прокариотический промотор предпочтительно расположен вблизи начала транскрипции гена, предпочтительно на той же самой цепи и перед указанным геном, т.е. в направлении 5'-конца той же цепи, подлежащей транскрипции.
Под термином «функционально связанный с» подразумевается, что транскрипция по меньшей мере одной нуклеотидной последовательности, кодирующей по меньшей мере один гетерологичный фактор, предпочтительно инициируется и контролируется соответствующим прокариотическим промотором.
Прокариотический промотор, используемый согласно настоящему изобретению предпочтительно для инициации и контроля транскрипции по меньшей мере одной нуклеотидной последовательности, кодирующей по меньшей мере один гетерологичный фактор, представляет собой прокариотический промотор, индуцируемый хлорид-ионами.
Кроме того, активность указанного прокариотического хлорид-индуцируемого промотора предпочтительно зависит от концентрации хлорид-ионов в окружении рекомбинантных бактерий, например, среде для разведения или биологической жидкости после применения у субъекта.
Термин «активность» указанного прокариотического хлорид-индуцируемого промотора предпочтительно относится к количеству по меньшей мере одного гетерологичного фактора, экспрессируемого с по меньшей мере одной нуклеотидной последовательности, функционально связанной с указанным промотором.
Термин «активность» указанного прокариотического хлорид-индуцируемого промотора предпочтительно относится к количеству белка(ов), полученному в результате транскрипции по меньшей мере одной нуклеотидной последовательности, кодирующей по меньшей мере один гетерологичный фактор.
Указанный по меньшей мере один гетерологичный фактор предпочтительно впоследствии генерируют из транскрибируемой мРНК, в частности, путем трансляции мРНК.
Активность промотора, используемого согласно настоящему изобретению предпочтительно для инициирования и контроля транскрипции по меньшей мере одной нуклеотидной последовательности, кодирующей по меньшей мере один гетерологичный фактор, дополнительно контролируется по меньшей мере одним прокариотическим регуляторным геном.
Термин «регуляторный ген» известен специалисту в данной области техники и относится к нуклеотидной последовательности, предпочтительно гену, участвующему в контроле экспрессии одного или более из других генов. Регуляторная последовательность, предпочтительно кодирующая регуляторный ген, предпочтительно расположена в 5'-направлении по отношению к начальному сайту транскрипции гена, подлежащего регулированию. Регуляторная последовательность также может быть расположена в 3'-направлении по отношению к начальному сайту транскрипции или на удаленном сайте на хромосоме.
Регуляторный ген предпочтительно может быть расположен внутри оперона, рядом с ним или далеко от него, предпочтительно в той же бактериальной клетке.
В предпочтительном варианте реализации настоящего изобретения регуляторный ген кодирует регуляторный белок, например, белок-репрессор или белок-активатор, причем экспрессия указанного регуляторного белка предпочтительно инициируется и контролируется отдельным прокариотическим промотором, выбранным по меньшей мере из одного конститутивного промотора или регулируемого, предпочтительно индуцибельного промотора.
Кроме того, экспрессия указанного регуляторного белка предпочтительно контролируется конститутивным прокариотическим промотором, и, таким образом, рекомбинантные бактерии согласно настоящему изобретению способны обеспечивать достаточное количество регуляторного белка для регулирования активности указанного хлорид-индуцируемого промотора.
Белок-репрессор предпочтительно связывается с оператором или промотором, предотвращая транскрипцию РНК РНК-полимеразой. По меньшей мере один индуктор предпочтительно может вызывать изменение формы белка-репрессора или иным образом приводить к неспособности репрессора связываться с ДНК, что позволяет РНК-полимеразе начинать и/или продолжать транскрипцию.
Белок-активатор, например, GadR, предпочтительно связывается с сайтом на молекуле ДНК, предпочтительно рядом с промотором, контролируемым регуляторным белком, и обеспечивает транскрипцию и/или повышает скорость транскрипции.
Согласно настоящему изобретению, по меньшей мере одна нуклеотидная последовательность, функционально связанная с указанным прокариотическим хлорид-индуцируемым промотором и кодирующая по меньшей мере один гетерологичный фактор и по меньшей мере один прокариотический регуляторный ген, контролирующий активность указанного хлорид-индуцируемого промотора, каждый из которых расположен в одной и той же бактериальной клетке, предпочтительно в каждой клетке рекомбинантных бактерий согласно настоящему изобретению.
Указанная по меньшей мере одна нуклеотидная последовательность, функционально связанная с указанным прокариотическим хлорид-индуцируемым промотором и кодирующая по меньшей мере один гетерологичный фактор, и указанный по меньшей мере один прокариотический регуляторный ген, контролирующий активность указанного хлорид-индуцируемого промотора, предпочтительно независимо расположены на хромосоме и/или по меньшей мере одной плазмиде в одной и той же клетке указанных рекомбинантных бактерий.
Например, указанная по меньшей мере одна нуклеотидная последовательность, функционально связанная с указанным прокариотическим хлорид-индуцируемым промотором и кодирующая по меньшей мере один гетерологичный фактор, расположена на по меньшей мере одной хромосоме и/или плазмиде по меньшей мере в одной клетке рекомбинантных бактерий согласно настоящему изобретению. Независимо от этого, по меньшей мере один прокариотический регуляторный ген предпочтительно расположен на по меньшей мере одной из хромосом и/или плазмид той же клетки указанных рекомбинантных бактерий.
Указанная по меньшей мере одна нуклеотидная последовательность, функционально связанная с прокариотическим хлорид-индуцируемым промотором и кодирующая по меньшей мере один гетерологичный фактор, и по меньшей мере один прокариотический регуляторный ген, контролирующий активность указанного хлорид-индуцируемого промотора, предпочтительно расположены на одной и той же рекомбинантной молекуле нуклеиновой кислоты, представляющей собой по меньшей мере одну из хромосом и/или плазмид.
Кроме того, как указанная по меньшей мере одна нуклеотидная последовательность, функционально связанная с указанным прокариотическим хлорид-индуцируемым промотором и кодирующая по меньшей мере один гетерологичный фактор, так и указанный по меньшей мере один прокариотический регуляторный ген, контролирующий активность указанного хлорид-индуцируемого промотора, предпочтительно по меньшей мере расположены на рекомбинантной нуклеиновой кислоте, предпочтительно на рекомбинантной плазмиде согласно настоящему изобретению.
Рекомбинантная нуклеиновая кислота, предпочтительно рекомбинантная плазмида согласно настоящему изобретению содержит
а) по меньшей мере одну нуклеотидную последовательность, функционально связанную с прокариотическим хлорид-индуцируемым промотором и кодирующую по меньшей мере один гетерологичный фактор, причем указанный гетерологичный фактор независимо представляет собой гетерологичный полипептид или его комплекс, и
b) по меньшей мере один прокариотический регуляторный ген, контролирующий активность указанного хлорид-индуцируемого промотора, причем указанный гетерологичный полипептид содержит эукариотический полипептид, по меньшей мере один его фрагмент или их комбинацию.
Термин «плазмида» известен специалисту в данной области техники и относится к предпочтительно циклической, предпочтительно двуцепочечной молекуле ДНК в бактериальной клетке, физически отделенной от хромосомной ДНК и способной к независимой репликации.
Это означает, что рекомбинантная нуклеиновая кислота согласно настоящему изобретению предпочтительно представляет собой циклическую, предпочтительно двуцепочечную молекулу ДНК, содержащую
а) по меньшей мере одну нуклеотидную последовательность, функционально связанную с прокариотическим хлорид-индуцируемым промотором и кодирующую по меньшей мере один гетерологичный фактор, причем указанный гетерологичный фактор независимо представляет собой гетерологичный полипептид или его комплекс, и
b) по меньшей мере один прокариотический регуляторный ген, контролирующий активность указанного хлорид-индуцируемого промотора, причем указанный гетерологичный полипептид содержит эукариотический полипептид, по меньшей мере один его фрагмент или их комбинацию.
Рекомбинантные бактерии согласно настоящему изобретению предпочтительно содержат по меньшей мере одну копию рекомбинантной нуклеиновой кислоты, предпочтительно рекомбинантной плазмиды согласно настоящему изобретению.
Указанная по меньшей мере одна нуклеотидная последовательность, функционально связанная с прокариотическим хлорид-индуцируемым промотором, кодирует по меньшей мере один гетерологичный фактор.
Указанная по меньшей мере одна нуклеотидная последовательность предпочтительно кодирует один или более факторов, каждый из которых не встречается в природе или не экспрессируется указанными используемыми бактериями.
Кроме того, по меньшей мере одна нуклеотидная последовательность предпочтительно кодирует 1, 2, 3, 4 или более факторов, каждый из которых не встречается в природе или не экспрессируется указанными используемыми бактериями и независимо представляет собой гетерологичный полипептид или его комплекс, предпочтительно гетерологичный полипептид или его комплекс.
Термин «комплекс» относится к белковому комплексу двух или более полипептидных цепей, которые можно называть «субъединицами» и которые предпочтительно ассоциированы или связаны посредством по меньшей мере одного нековалентного белок-белкового взаимодействия, например, водородной связи, ионного взаимодействия, силы Ван-дер-Ваальса и/или гидрофобной связи, и/или по меньшей мере одной ковалентной белок-белковой связи, которая не является пептидной связью, например, дисульфидной связи.
Субъединицы мультимерного белкового комплекса могут быть идентичными, как в гомомультимерном белковом комплексе, или различающимися, как в гетеромультимерном белковом комплексе.
Комплекс гетерологичного полипептида предпочтительно образуется до и/или после высвобождения по меньшей мере одного гетерологичного полипептида из рекомбинантных бактерий согласно настоящему изобретению.
Например, рекомбинантные бактерии согласно настоящему изобретению экспрессируют один гетерологичный полипептид, который после высвобождения из бактерий образует гомомультимерный белковый комплекс, содержащий две или более идентичных субъединиц.
В качестве альтернативы, рекомбинантные бактерии согласно настоящему изобретению экспрессируют два или более гетерологичных полипептида, отличающиеся друг от друга и после высвобождения из бактерий образующие гетеромультимерный белковый комплекс, содержащий две или более различных субъединиц.
По меньшей мере один гетерологичный фактор предпочтительно оказывает терапевтическое и/или профилактическое действие на субъекта, предпочтительно после применения рекомбинантных бактерий согласно настоящему изобретению у указанного субъекта.
В другом предпочтительном варианте реализации настоящего изобретения по меньшей мере один гетерологичный фактор представляет собой гетерологичный полипептид или его комплекс, каждый из которых содержит или состоит из по меньшей мере одного эукариотического полипептида, по меньшей мере одного его фрагмента или их комбинации.
Кроме того, термин «фрагмент эукариотического полипептида» предпочтительно относится к биологически активному фрагменту указанного эукариотического полипептида.
Рекомбинантные бактерии согласно настоящему изобретению после применения у субъекта предпочтительно экспрессируют по меньшей мере один гетерологичный полипептид или его комплекс.Кроме того, рекомбинантные бактерии согласно настоящему изобретению предпочтительно высвобождают, предпочтительно секретируют по меньшей мере один гетерологичный полипептид или его комплекс в окружающую среду, например, в область введения и/или в биологическую жидкость указанного субъекта.
По меньшей мере один гетерологичный полипептид или его комплекс сам по себе может оказывать биологическое действие на по меньшей мере одну клетку субъекта, например, стимулируя или ингибируя рост, пролиферацию и/или дифференциацию клеток, индуцируя или подавляя апоптоз, активируя или ингибируя иммунную систему, регулируя метаболизм, контролируя миграцию клеток и/или регулируя продукцию и/или высвобождение эндогенных факторов у субъекта, тем самым опосредуя терапевтический и/или профилактический эффект у субъекта, предпочтительно после применения рекомбинантных бактерий согласно настоящему изобретению у указанного субъекта и предпочтительно после высвобождения, предпочтительно после секреции из рекомбинантных бактерий согласно настоящему изобретению.
Терапевтический и/или профилактический эффект у субъекта также может быть опосредован связыванием по меньшей мере одного гетерологичного полипептида или его комплекса с по меньшей мере одной эндогенной или экзогенной молекулой-мишенью, присутствующей у субъекта, например, бактериальным антигеном, вирусным антигеном, опухолевым антигеном и/или эндогенным полипептидом.
Например, по меньшей мере один гетерологичный полипептид или его комплекс представляет собой антитело и/или по меньшей мере один его биологически активный фрагмент, который после применения рекомбинантных бактерий согласно настоящему изобретению у субъекта высвобождается из бактерий и впоследствии связывается по меньшей мере с одной молекулой-мишенью, предпочтительно с экзогенным антигеном, например, фрагментом бактериальной клетки или вируса, или с эндогенным антигеном или полипептидом, которые в противном случае опосредуют вредоносный эффект, например, гиперактивный иммунный ответ.
Посредством связывания с по меньшей мере одной молекулой-мишенью, присутствующей у субъекта, по меньшей мере один гетерологичный полипептид или его комплекс предпочтительно снижает количество указанной молекулы у указанного субъекта и/или снижает и/или предотвращает биологическую активность указанной молекулы у указанного субъекта, например, путем снижения или ингибирования ферментативной активности указанной молекулы и/или путем ослабления или ингибирования связывания указанной молекулы с эндогенным рецептором.
Указанный по меньшей мере один гетерологичный фактор предпочтительно представляет собой гетерологичный полипептид, по меньшей мере один его фрагмент, предпочтительно содержащий по меньшей мере 5, предпочтительно по меньшей мере 7 аминокислот, соединенных пептидными связями, и/или его комплекс.
Примеры подходящих полипептидов включают полипептиды, их предшественники, их фрагменты и их комбинации, полученные из видов эукариотических организмов, предпочтительно видов млекопитающих, предпочтительно человека, которые способны действовать локально и/или системно.
Кроме того, указанный по меньшей мере один гетерологичный полипептид предпочтительно выбран из группы, состоящей из факторов роста, цитокинов, хемокинов, ферментов, полипептидных гормонов, нейропептидов, антител, рецепторов клеточной поверхности, растворимых рецепторов, лигандов рецепторов, интрател, которые также можно называть внутриклеточными антителами, кофакторов, факторов транскрипции, молекул адгезии, опухолевых антигенов, их предшественников, предпочтительно биологически активных, их фрагментов и их комбинаций, полученных из видов эукариотических организмов, предпочтительно видов млекопитающих, предпочтительно человека.
Подходящие опухолевые антигены известны специалисту в данной области техники и предпочтительно описаны в Cheever, M.A. et al. (2009) (“The Prioritization of Cancer Antigens: A National Cancer Institute Pilot Project for the Acceleration of Translational Research”, Clin. Cancer Res. 15(17), pages 5323 ot 5337; DOI: 10.1158/1078-0432.CCR-09-0737)
Следует понимать, что функциональные аналоги упомянутых выше или ниже полипептидов или их биоаналогов также можно применять в рамках настоящего изобретения, как указано в формуле изобретения.
Факторы роста предпочтительно представляют собой полипептиды, способные стимулировать рост, пролиферацию клеток, заживление и/или дифференцировку клеток.
Фактор роста предпочтительно выбран из группы, состоящей из факторов роста фибробластов (ФРФ), факторов роста эндотелия сосудов (ФРЭС), эпидермальных факторов роста (ЭФР), инсулиноподобных факторов роста (ИФР), факторов роста тромбоцитов (ФРТ), трансформирующего фактора роста-бета (ТФР-бета), фактора роста нервов (ФРН), активинов, их функциональных аналогов, их биоаналогов и их смесей.
Факторы роста фибробластов - это семейство факторов роста, участвующих в ангиогенезе, заживлении ран и различных сигнальных эндокринных путях. У человека выявлено 22 члена семейства ФРФ, ФРФ-1 - ФРФ-14 и ФРФ-16 - ФРФ-23, которые можно применять в настоящем изобретении. ФРФ-1 - ФРФ-10 связываются с рецепторами факторов роста фибробластов (FGFR).
В предпочтительном варианте реализации настоящего изобретения фактор роста фибробластов выбран из группы, состоящей из ФРФ-1, ФРФ-2, ФРФ-3, ФРФ-4, ФРФ-5, ФРФ-6, ФРФ-7, ФРФ-8, ФРФ-9, ФРФ-10 и их смесей, более предпочтительно ФРФ-1, ФРФ-2, ФРФ-7, ФРФ-10 и их смесей, более предпочтительно ФРФ-2, ФРФ-7, их функциональных аналогов, их биоаналогов и их смесей, еще более предпочтительно ФРФ-2.
Например, ФРФ-1 и ФРФ-2 могут стимулировать ангиогенез и являются митогенными для клеток нескольких типов, присутствующих в очаге воспалительного нарушения функции кожи, включая фибробласты и кератиноциты. Кроме того, ФРФ-7 может стимулировать повторную эпителизацию раны паракринным способом.
Нуклеотидная последовательность мРНК фактора роста фибробластов человека 2 (чФРФ-2) доступна под номером доступа NCBI NM_002006.4. Соответствующая аминокислотная последовательность AUG-изомера доступна под номером доступа NCBI NP_001997.5, а также под номером доступа UniProt P09038, версия 182.
Предшественник содержит пробелок, в который входят аминокислоты 1-142 предшественника, и зрелый пептид фактора роста фибробластов человека 2, в который входят аминокислоты 143-288 предшественника.
В предпочтительном варианте реализации изобретения фактор роста фибробластов 2 содержит одну или по меньшей мере одну из аминокислотных последовательностей, представленных в SEQ ID NO: 5-7. Аминокислотные последовательности, представленные в SEQ ID NO: 5-7, представлены на фигурах 5a-5c, соответственно.
Инсулиноподобные факторы роста (ИФР) представляют собой белки, характеризующиеся высокой степенью сходства с инсулином. Инсулиноподобные факторы роста включают два белка ИФР-1 и ИФР-2, которые можно применять в настоящем изобретении.
Семейство эпидермальных факторов роста (ЭФР) представляет собой белки с очень сходными структурными и функциональными характеристиками и включает такие белки, как эпидермальный фактор роста (ЭФР), гепарин-связывающий ЭФР-подобный фактор роста (ГС-ЭФР), трансформирующий фактор роста-альфа (ТФР-α), амфирегулин (AR), эпирегулин (EPR), эпиген (EPGN), бетацеллюллин (BTC), нейрегулин-1 (NRG1), нейрегулин-2 (NRG2), нейрегулин-3 (NRG3) и нейрегулин-4 (NRG4), предпочтительно эпидермальный фактор роста (ЭФР), гепарин-связывающий ЭФР-подобный фактор роста (ГС-ЭФР), трансформирующий фактор роста-α (ТФР-α), амфирегулин (AR), эпирегулин (EPR), эпиген (EPGN) и бетацеллюлин (BTC), еще более предпочтительно эпидермальный фактор роста (ЭФР), гепарин-связывающий ЭФР-подобный фактор роста (ГС-ЭФР) и трансформирующий фактор роста-α (ТФР-α), которые можно применять в настоящем изобретении.
Трансформирующий фактор роста-α (ТФР-α), предпочтительно трансформирующий фактор роста-α человека (чТФР-α) может продуцироваться макрофагами, клетками головного мозга и кератиноцитами. чТФР-α индуцирует развитие эпителия. чТФР-α и чЭФР связываются с одним и тем же рецептором, рецептором эпидермального фактора роста (EGFR, ErbB-1, HER1 у человека). Связывание ТФР-α с EGFR может инициировать множество событий, связанных с пролиферацией клеток, включая заживление ран.
Трансформирующий фактор роста-α человека существует в виде по меньшей мере пяти изоформ, полученных путем альтернативного сплайсинга.
Аминокислотная последовательность предшественника изоформы 1 трансформирующего фактора роста-альфа человека доступна под номером доступа NCBI NP_003227.1. Соответствующая нуклеотидная последовательность мРНК доступна под номером доступа NCBI NM_003236.2.
Предшественник изоформы 1 трансформирующего фактора роста-альфа человека содержит сигнальный пептид, в который входят аминокислоты 1-23 предшественника, пробелок изоформы 1 трансформирующего фактора роста-альфа, в который входят аминокислоты 24-160 предшественника, и зрелый пептид трансформирующего фактора роста-альфа, в который входят аминокислоты 40-89 предшественника.
Аминокислотная последовательность предшественника изоформы 2 трансформирующего фактора роста-альфа человека доступна под номером доступа NCBI NP_001093161.1. Соответствующая нуклеотидная последовательность мРНК доступна под номером доступа NCBI NM_001099691.1.
Аминокислотная последовательность предшественника изоформы 3 трансформирующего фактора роста-альфа человека доступна под номером доступа NCBI NP_001295087.1. Соответствующая нуклеотидная последовательность мРНК доступна под номером доступа NCBI NM_001308158.1.
Аминокислотная последовательность предшественника изоформы 4 трансформирующего фактора роста-альфа человека доступна под номером доступа NCBI NP_001295088.1. Соответствующая нуклеотидная последовательность мРНК доступна под номером доступа NCBI NM_001308159.1.
Аминокислотная последовательность предшественника изоформы 5 трансформирующего фактора роста-альфа человека доступна под номером доступа NCBI AAF05090.1. Соответствующая нуклеотидная последовательность мРНК доступна под номером доступа NCBI AF149097.1.
Амфирегулин (AREG), предпочтительно амфирегулин человека (hAREG), является еще одним лигандом рецептора ЭФР. Амфирегулин человека является аутокринным фактором роста, а также митогеном для широкого круга клеток-мишеней, включая астроциты, шванновские клетки и фибробласты. Амфирегулин человека способствует пролиферации эпителиальных клеток.
Аминокислотная последовательность предшественника амфирегулина человека доступна под номером доступа NCBI NP_001648.1. Соответствующая нуклеотидная последовательность мРНК доступна под номером доступа NCBI NM_001657.3.
Эпирегулин (EPR), предпочтительно эпирегулин человека (hEPR), является лигандом рецептора ЭФР, способным стимулировать пролиферацию клеток и/или ангиогенез.
Аминокислотная последовательность предшественника эпирегулина человека доступна под номером доступа NCBI NP_001423.1. Соответствующая нуклеотидная последовательность мРНК доступна под номером доступа NCBI NM_001432.1.
Эпиген (EPGN), предпочтительно эпиген человека (hEPGN), способствует росту эпителиальных клеток. Эпиген человека существует в виде по меньшей мере семи изоформ, полученных путем альтернативного сплайсинга.
Аминокислотная последовательность предшественника изоформы 1 эпигена человека доступна под номером доступа NCBI NP_001257918.1. Соответствующая нуклеотидная последовательность мРНК доступна под номером доступа NCBI NM_001270989.1.
Аминокислотная последовательность предшественников изоформ 1-7 эпигена человека также доступна под номером доступа UniProt Q6UW88, версия 101.
Бетацеллюлин (BTC), предпочтительно бетацеллюлин человека (hBTC), является фактором роста, который также связывается с рецептором эпидермального фактора роста и синтезируется многими зрелыми тканями и культивируемыми клетками, включая клетки гладких мышц и эпителиальные клетки. Аминокислотная последовательность предшественника пробетацеллюлина человека доступна под номером доступа NCBI NP_001720.1. Соответствующая нуклеотидная последовательность мРНК доступна под номером доступа NCBI NM_001729.1.
Инсулиноподобный фактор роста 1 (ИФР-1) также известен под названием соматомедин C. Нуклеотидная последовательность мРНК ИФР-1 человека доступна под номером доступа NCBI NM_000618.2. Соответствующая аминокислотная последовательность доступна под номером доступа NCBI NP_000609.1, а также под номером доступа UniProt P05019, версия 178.
Нуклеотидная последовательность мРНК инсулиноподобного фактора роста человека 2 (чИФР-2) доступна под номером доступа NCBI NM_000612.4. Соответствующая аминокислотная последовательность предшественника инсулиноподобного фактора роста человека 2 доступна под номером доступа NCBI NP_000603.1, а также под номером доступа UniProt P01344, версия 192.
Семейство факторов роста эндотелия сосудов (ФРЭС) представляет собой группу факторов роста, которая включает ФРЭС-A, ФРЭС-B, ФРЭС-C, ФРЭС-D и плацентарный фактор роста (ПФР), которые можно применять в настоящем изобретении.
В предпочтительном варианте реализации настоящего изобретения фактор роста эндотелия сосудов представляет собой фактор роста эндотелия сосудов A (ФРЭС-A). ФРЭС-А может индуцировать ангиогенез, васкулогенез и размножение эндотелиальных клеток.
Нуклеотидная последовательность мРНК фактора роста эндотелия сосудов человека А (чФРЭС-A) доступна под номером доступа NCBI NM_001025366.1. Соответствующая аминокислотная последовательность фактора роста эндотелия сосудов человека А доступна под номером доступа NCBI NP_001020537.2, а также под номером доступа UniProt P15692, версия 197.
Фактор роста тромбоцитов (ФРТ) регулирует рост и деление клеток. Фактор роста тромбоцитов человека (чФРТ) содержит четыре субъединицы, ФРТ-A, ФРТ-B, ФРТ-C и ФРТ-D, образующие гомо- или гетеродимеры соответствующих субъединиц, которые можно применять в настоящем изобретении.
Фактор роста тромбоцитов предпочтительно представляет собой ФРТ-AA, ФРТ-BB, ФРТ-AB, ФРТ-CC, ФРТ-DD или их смесь.
Более предпочтительно, фактор роста тромбоцитов представляет собой димерный белок, состоящий из двух субъединиц PDGF-A, димерный белок, состоящий из двух субъединиц PDGF-B, димерный белок, состоящий из субъединицы PDGF-A и субъединицы PDGF-B, или их смесь.
Нуклеотидная последовательность мРНК субъединицы A фактора роста тромбоцитов человека (чФРТ-A) доступна под номером доступа NCBI NM_002607.4. Соответствующая аминокислотная последовательность доступна под номером доступа NCBI NP_002598.4, а также под номером доступа UniProt P04085, версия 159.
Нуклеотидная последовательность мРНК субъединицы B фактора роста тромбоцитов человека (чФРТ) доступна под номером доступа NCBI NM_002608.1. Соответствующая аминокислотная последовательность предшественника субъединицы фактора роста тромбоцитов человека доступна под номером доступа NCBI NP_002599.1, а также под номером доступа UniProt P01127, версия 181.
Фактор роста гепатоцитов (ФРГ) представляет собой фактор роста, секретируемый мезенхимными клетками и действующий главным образом на эпителиальные клетки и эндотелиальные клетки, а также на гемопоэтические клетки-предшественники, который можно применять в настоящем изобретении.
Нуклеотидная последовательность мРНК фактора роста гепатоцитов человека (чФРГ) доступна под номером доступа NCBI NM_000601.3. Соответствующая аминокислотная последовательность предшественника фактора роста гепатоцитов человека доступна под номером доступа NCBI NP_000592.3, а также под номером доступа UniProt P14210, версия 186.
Трансформирующий фактор роста бета (ТФР-бета), предпочтительно трансформирующий фактор роста бета человека (чТФР-бета), представляет собой цитокин, секретируемый многими типами клеток, в том числе макрофагами.
ТФР-β существует в виде по меньшей мере трех изоформ, ТФР-β1, ТФР-β2 и ТФР-β3, которые можно применять в настоящем изобретении.
Трансформирующий фактор роста человека β1 представляет собой секретируемый белок, расщепляющийся на пептид, ассоциированный с латентностью (LAP), и зрелый пептид ТФР-β1. Зрелый пептид может образовывать гомодимер или гетеродимер ТФР-β1 с другими членами семейства ТФР-β.
Нуклеотидная последовательность мРНК предшественника трансформирующего фактора роста β1 человека доступна под номером доступа NCBI NM_000660.4. Соответствующая аминокислотная последовательность доступна под номером доступа NCBI NP_000651.3 или номером доступа UniProt P01137, версия 199.
Трансформирующий фактор рост β2 (ТФР-β2), предпочтительно трансформирующий фактор роста человека β2 (чТФР-β2), представляет собой многофункциональный цитокин, который регулирует пролиферацию, дифференцировку, адгезию и миграцию многих типов клеток.
В качестве альтернативы, выявлены сплайс-варианты транскрипта гена трансформирующего фактора роста β2 человека, кодирующие две различные изоформы.
Нуклеотидная последовательность мРНК предшественника изоформы 1 трансформирующего фактора роста-бета 2 человека доступна под номером доступа NCBI NM_001135599.3. Соответствующая аминокислотная последовательность доступна под номером доступа NCBI NP_001129071.1.
Нуклеотидная последовательность мРНК предшественника изоформы 2 трансформирующего фактора роста β2 человека доступна под номером доступа NCBI NM_003238.3. Соответствующая аминокислотная последовательность доступна под номером доступа NCBI NP_003229.1. Аминокислотная последовательность трансформирующего фактора роста β2 также доступна под номером доступа UniProt P61812, версия 128.
Трансформирующий фактор роста β3 (ТФР-β3), предпочтительно трансформирующий фактор роста β3 человека (чТФР-β3), представляет собой секретируемый цитокин, который участвует в эмбриогенезе и дифференцировке клеток.
Нуклеотидная последовательность мРНК белка-предшественника трансформирующего фактора роста β3 человека доступна под номером доступа NCBI NM_003239.3. Соответствующая аминокислотная последовательность доступна под номером доступа NCBI NP_003230.1, а также под номером доступа UniProt P10600, версия 170.
Активины представляют собой связанные дисульфидными связями димерные белки, первоначально выделенные из гонадных жидкостей как белки, стимулирующие высвобождение гипофизарного фолликулостимулирующего гормона (ФСГ). Активины обладают широким спектром биологической активности, включая индукцию мезодермы, дифференцировку нейронов, ремоделирование костной ткани, гемопоэз и участие в физиологии половой системы.
Активины представляют собой гомодимеры или гетеродимеры различных изоформ бета-субъединицы, в то время как ингибины представляют собой гетеродимеры уникальной альфа-субъединицы и одной из четырех бета-субъединиц - бета A, бета B, бета C и бета E.
Цитокины предпочтительно представляют собой полипептиды, участвующие в аутокринной сигнализации, паракринной сигнализации и эндокринной сигнализации в качестве иммуномодулирующих агентов.
Цитокины предпочтительно выбраны из группы, состоящей из интерферонов, интерлейкинов, лимфокинов, факторов некроза опухолей, колониестимулирующих факторов, их функциональных аналогов, их биоаналогов и их смесей.
Предпочтительно интерфероны, дополнительно предпочтительно интерфероны человека выбраны из группы, состоящей из интерферона-альфа (ИФН-α), интерферона-бета (ИФН-β), интерферона-эпсилон (ИФН-ε), интерферона-каппа (ИФН-κ), интерферона-гамма (ИФН-γ), интерферона-омега (ИФН-ω), интерферона-лямбда (ИФН-λ), их функциональных аналогов, их биоаналогов и их смесей.
Интерферон-альфа, предпочтительно интерферон-альфа человека, предпочтительно выбран из группы, состоящей из интерферона-альфа-1 (ИФН-α1), интерферона-альфа-2 (ИФН-α2), интерферона-альфа-4 (ИФН-α4), интерферона-альфа-5 (ИФН-α5), интерферона-альфа-6 (ИФН-α6), интерферона-альфа-7 (ИФН-α7), интерферона-альфа-8 (ИФН-α8), интерферона-альфа-10 (ИФН-α10), интерферона-альфа-13 (ИФН-α13), интерферона-альфа-14 (ИФН-α14), интерферона-альфа-16 (ИФН-α16), интерферона-альфа-17 (ИФН-α17), интерферона-альфа-21 (ИФН-α21), их функциональных аналогов, их биоаналогов и их смесей, предпочтительно интерферона-альфа-2 (ИФН-α2), его функциональных аналогов, его биоаналогов и его смесей.
Нуклеотидная последовательность мРНК интерферона-альфа 1 человека (ИФН-α1) доступна под номером доступа NCBI NM_024013.2. Нуклеотидная последовательность мРНК интерферона-альфа 13 человека (ИФН-α13) доступна под номером доступа NCBI NM_006900.3.
Белковые последовательности интерферонов-альфа-1 и альфа-13 человека идентичны. Соответствующие аминокислотные последовательности предшественника интерферона-альфа-1/13 человека доступны под номером доступа NCBI NP_076918.1, под номером доступа NP_008831.3, а также под номером доступа UniProt P01562, версия 180.
Предшественник интерферона-альфа-1/13 человека содержит сигнальный пептид, в который входят аминокислоты 1-23 предшественника, и зрелый интерферон-альфа-2, в который входят аминокислоты 24-189 предшественника.
Нуклеотидная последовательность мРНК интерферона-альфа 2 человека (ИФН-α2) доступна под номером доступа NCBI NM_000605.3. Соответствующая аминокислотная последовательность предшественника интерферона-альфа-2 человека доступна под номером доступа NCBI NP_000596.2, а также под номером доступа UniProt P01563, версия 176.
Предшественник интерферона-альфа-2 человека содержит сигнальный пептид, в который входят аминокислоты 1-23 предшественника, и зрелый интерферон-альфа-2, в который входят аминокислоты 24-188 предшественника.
Кроме того, интерферон-альфа-2 предпочтительно содержит одну или по меньшей мере одну из аминокислотных последовательностей, представленных в SEQ ID NO:28-30, которые также изображены на фигурах 14а-14 с, соответственно.
Нуклеотидная последовательность мРНК интерферона-альфа 4 человека (ИФН-α4) доступна под номером доступа NCBI NM_021068.2. Соответствующая аминокислотная последовательность предшественника интерферона-альфа-4 человека доступна под номером доступа NCBI NP_066546.1, а также под номером доступа UniProt P05014, версия 168.
Предшественник интерферона-альфа-4 человека содержит сигнальный пептид, в который входят аминокислоты 1-23 предшественника, и зрелый интерферон-альфа-4, в который входят аминокислоты 24-189 предшественника.
Нуклеотидная последовательность мРНК интерферона-альфа 5 человека (ИФН-α5) доступна под номером доступа NCBI NM_002169.2. Соответствующая аминокислотная последовательность предшественника интерферона-альфа-5 человека доступна под номером доступа NCBI NP_002160.1, а также под номером доступа UniProt P01569, версия 158.
Предшественник интерферона-альфа-5 человека содержит сигнальный пептид, в который входят аминокислоты 1-21 предшественника, и зрелый интерферон-альфа-5, в который входят аминокислоты 22-189 предшественника.
Нуклеотидная последовательность мРНК интерферона-альфа 6 человека (ИФН-α6) доступна под номером доступа NCBI NM_021002.2. Соответствующая аминокислотная последовательность предшественника интерферона-альфа-6 человека доступна под номером доступа NCBI NP_066282.1, а также под номером доступа UniProt P05013, версия 158.
Предшественник интерферона-альфа-6 человека содержит сигнальный пептид, в который входят аминокислоты 1-20 предшественника, и зрелый интерферон-альфа-6, в который входят аминокислоты 21-189 предшественника.
Нуклеотидная последовательность мРНК интерферона-альфа 7 человека (ИФН-α7) доступна под номером доступа NCBI NM_021057.2. Соответствующая аминокислотная последовательность предшественника интерферона-альфа-7 человека доступна под номером доступа NCBI NP_066401.2, а также под номером доступа UniProt P01567, версия 160.
Предшественник интерферона-альфа-7 человека содержит сигнальный пептид, в который входят аминокислоты 1-23 предшественника, и зрелый интерферон-альфа-7, в который входят аминокислоты 24-189 предшественника.
Нуклеотидная последовательность мРНК интерферона-альфа 8 человека (ИФН-α8) доступна под номером доступа NCBI NM_002170.3. Соответствующая аминокислотная последовательность предшественника интерферона-альфа-8 человека доступна под номером доступа NCBI NP_002161.2, а также под номером доступа UniProt P32881, версия 157.
Предшественник интерферона-альфа-8 человека содержит сигнальный пептид, в который входят аминокислоты 1-23 предшественника, и зрелый интерферон-альфа-8, в который входят аминокислоты 24-189 предшественника.
Нуклеотидная последовательность мРНК интерферона-альфа 10 человека (ИФН-α10) доступна под номером доступа NCBI NM_002171.2. Соответствующая аминокислотная последовательность предшественника интерферона-альфа-10 человека доступна под номером доступа NCBI NP_002162.1, а также под номером доступа UniProt P01566, версия 160.
Предшественник интерферона-альфа-10 человека содержит сигнальный пептид, в который входят аминокислоты 1-23 предшественника, и зрелый интерферон-альфа-10, в который входят аминокислоты 24-189 предшественника.
Нуклеотидная последовательность мРНК интерферона-альфа 14 человека (ИФН-α14) доступна под номером доступа NCBI NM_002172.2. Соответствующая аминокислотная последовательность предшественника интерферона-альфа-14 человека доступна под номером доступа NCBI NP_002163.2, а также под номером доступа UniProt P01570, версия 172.
Предшественник интерферона-альфа-14 человека содержит сигнальный пептид, в который входят аминокислоты 1-23 предшественника, и зрелый интерферон-альфа-14, в который входят аминокислоты 24-189 предшественника
Нуклеотидная последовательность мРНК интерферона-альфа 16 человека (ИФН-α16) доступна под номером доступа NCBI NM_002173.3. Соответствующая аминокислотная последовательность предшественника интерферона-альфа-16 человека доступна под номером доступа NCBI NP_002164.1, а также под номером доступа UniProt P05015, версия 161.
Предшественник интерферона-альфа-16 человека содержит сигнальный пептид, в который входят аминокислоты 1-23 предшественника, и зрелый интерферон-альфа-16, в который входят аминокислоты 24-189 предшественника.
Нуклеотидная последовательность мРНК интерферона-альфа 17 человека (ИФН-α17) доступна под номером доступа NCBI NM_021268.2. Соответствующая аминокислотная последовательность предшественника интерферона-альфа-17 человека доступна под номером доступа NCBI NP_067091.1, а также под номером доступа UniProt P01571, версия 162.
Предшественник интерферона-альфа-17 человека содержит сигнальный пептид, в который входят аминокислоты 1-23 предшественника, и зрелый интерферон-альфа-17, в который входят аминокислоты 24-189 предшественника.
Нуклеотидная последовательность мРНК интерферона-альфа 21 человека (ИФН-α21) доступна под номером доступа NCBI NM_002175.2. Соответствующая аминокислотная последовательность предшественника интерферона-альфа-21 человека доступна под номером доступа NCBI NP_002166.2, а также под номером доступа UniProt P01568, версия 171.
Предшественник интерферона-альфа-21 человека содержит сигнальный пептид, в который входят аминокислоты 1-23 предшественника, и зрелый интерферон-альфа-21, в который входят аминокислоты 24-189 предшественника.
Нуклеотидная последовательность мРНК интерферона-бета 1 человека (ИФН-β1) доступна под номером доступа NCBI NM_002176.3. Соответствующая аминокислотная последовательность предшественника интерферона-бета человека доступна под номером доступа NCBI NP_002167.1, а также под номером доступа UniProt P01574, версия 196.
Предшественник интерферона-бета человека содержит сигнальный пептид, в который входят аминокислоты 1-21 предшественника, и зрелый интерферон-бета, в который входят аминокислоты 22-187 предшественника.
Нуклеотидная последовательность мРНК интерферона-гамма человека (ИФН-γ) доступна под номером доступа NCBI NM_000619.2. Соответствующая аминокислотная последовательность предшественника интерферона-гамма человека доступна под номером доступа NCBI NP_000610.2, а также под номером доступа UniProt P01579, версия 205.
Предшественник интерферона-гамма человека содержит сигнальный пептид, в который входят аминокислоты 1-23 предшественника, зрелый интерферон-гамма, в который входят аминокислоты 24-161 предшественника, и пропептид, в который входят аминокислоты 162-166 предшественника.
Нуклеотидная последовательность мРНК интерферона-каппа человека (ИФН-κ) доступна под номером доступа NCBI NM_020124.2. Соответствующая аминокислотная последовательность предшественника интерферона-каппа человека доступна под номером доступа NCBI NP_064509.2, а также под номером доступа UniProt Q9P0W0, версия 120.
Предшественник интерферона-каппа человека содержит сигнальный пептид, в который входят аминокислоты 1-27 предшественника, и зрелый интерферон-гамма, в который входят аминокислоты 28-207 предшественника.
Нуклеотидная последовательность мРНК интерферона-эпсилон человека (ИФН-ε) доступна под номером доступа NCBI NM_176891.4. Соответствующая аминокислотная последовательность предшественника интерферона-эпсилон человека доступна под номером доступа NCBI NP_795372.1, а также под номером доступа UniProt Q86WN2, версия 124.
Предшественник интерферона-эпсилон человека содержит сигнальный пептид, в который входят аминокислоты 1-21 предшественника, и зрелый интерферон-эпсилон, в который входят аминокислоты 22-208 предшественника.
Нуклеотидная последовательность мРНК интерферона-омега 1 человека (ИФН-ω1) доступна под номером доступа NCBI NM_002177.2. Соответствующая аминокислотная последовательность предшественника интерферона-омега человека доступна под номером доступа NCBI NP_002168.1, а также под номером доступа UniProt P05000, версия 165.
Предшественник интерферона-омега человека содержит сигнальный пептид, в который входят аминокислоты 1-21 предшественника, и зрелый интерферон-омега, в который входят аминокислоты 22-195 предшественника.
Интерферон-лямбда человека (ИФН-λ) предпочтительно выбран из группы, состоящей из интерферона-лямбда 1 (ИФН-λ1), интерферона-лямбда 2 (ИФН-λ2), интерферона-лямбда 3 (ИФН-λ3), интерферона-лямбда 4 (ИФН-λ4), их функциональных аналогов, их биоаналогов и их смесей.
Нуклеотидная последовательность мРНК интерферона-лямбда 1 человека (ИФН-λ1) доступна под номером доступа NCBI NM_172140.1. Соответствующая аминокислотная последовательность предшественника интерферона-лямбда 1 человека доступна под номером доступа NCBI NP_742152.1, а также под номером доступа UniProt Q8IU54, версия 125.
Предшественник интерферона-лямбда 1 человека содержит сигнальный пептид, в который входят аминокислоты 1-19 предшественника, и зрелый интерферон-лямбда 1, в который входят аминокислоты 20-200 предшественника.
Нуклеотидная последовательность мРНК интерферона-лямбда 2 человека (ИФН-λ2) доступна под номером доступа NCBI NM_172138.1. Соответствующая аминокислотная последовательность предшественника интерферона-лямбда 2 человека доступна под номером доступа NCBI NP_742150.1, а также под номером доступа UniProt Q8IZJ0, версия 105.
Предшественник предшественника интерферона-лямбда 2 человека содержит сигнальный пептид, в который входят аминокислоты 1-25 предшественника, и зрелый интерферон-лямбда 2, в который входят аминокислоты 26-200 предшественника.
Нуклеотидная последовательность мРНК интерферона-лямбда 3 человека (ИФН-λ3) содержит два варианта транскрипта. Последовательность мРНК варианта транскрипта 1 интерферона-лямбда 3 человека доступна под номером доступа NCBI NM_001346937.1. Последовательность мРНК варианта транскрипта 2 интерферона-лямбда 3 человека доступна под номером доступа NCBI NM_172139.3.
Соответствующая аминокислотная последовательность предшественника изоформы 1 интерферона-лямбда 3 человека доступна под номером доступа NCBI NP_001333866.1. Соответствующая аминокислотная последовательность предшественника изоформы 2 интерферона-лямбда 3 человека доступна под номером доступа NCBI NP_742151.2, а также под номером доступа UniProt Q8IZI9, версия 113.
Предшественник изоформы 2 интерферона-лямбда 3 человека содержит сигнальный пептид, в который входят аминокислоты 1-21 предшественника, и зрелый интерферон-лямбда 3, в который входят аминокислоты 22-196 предшественника.
Нуклеотидная последовательность мРНК интерферона-лямбда 4 человека (ИФН-λ4) доступна под номером доступа NCBI NM_001276254.2. Соответствующая аминокислотная последовательность предшественника интерферона-лямбда 4 человека доступна под номером доступа NCBI NP_001263183.2, а также под номером доступа UniProt K9M1U5, версия 24.
Предшественник интерферона-лямбда 4 человека содержит сигнальный пептид, в который входят аминокислоты 1-21 предшественника, и зрелый интерферон-лямбда 4, в который входят аминокислоты 22-179 предшественника.
Предпочтительно интерлейкины, более предпочтительно интерлейкины человека выбраны из группы, состоящей из интерлейкина-1 (ИЛ-1), интерлейкина-2 (ИЛ-2), интерлейкина-3 (ИЛ-3), интерлейкина-4 (ИЛ-4), интерлейкина-5 (ИЛ-5), интерлейкина-6 (ИЛ-6), интерлейкина-7 (ИЛ-7), интерлейкина-8 (ИЛ-8), интерлейкина-9 (ИЛ-9), интерлейкина-10 (ИЛ-10), интерлейкина-11 (ИЛ-11), интерлейкина-12 (ИЛ-12), интерлейкина-13 (ИЛ-13), интерлейкина-14 (ИЛ-14), интерлейкина-15 (ИЛ-15), интерлейкина-16 (ИЛ-16), интерлейкина-17 (ИЛ-17), интерлейкина-18 (ИЛ-18), интерлейкина-19 (ИЛ-19), интерлейкина-20 (ИЛ-20), интерлейкина-21 (ИЛ-21), интерлейкина-22 (ИЛ-22), интерлейкина-23 (ИЛ-23), интерлейкина-24 (ИЛ-24), интерлейкина-25 (ИЛ-25), интерлейкина-26 (ИЛ-26), интерлейкина-27 (ИЛ-27), интерлейкина-28 (ИЛ-28), интерлейкина-29 (ИЛ-29), интерлейкина-30 (ИЛ-30), интерлейкина-31 (ИЛ-31), интерлейкина-32 (ИЛ-32), интерлейкина-33 (ИЛ-33), интерлейкина-34 (ИЛ-34), интерлейкина-36-альфа (ИЛ-36α), интерлейкина-36-бета (ИЛ-36β), интерлейкина-36-гамма (ИЛ-36γ), интерлейкина-37 (ИЛ-37), кардиотрофин-подобного цитокинового фактора 1 (CLCF1), цилиарного нейротрофического фактора (CNTF), фактора, ингибирующего лейкоз (LIF), онкостатина-М (OSM), белков-антагонистов рецепторов интерлейкинов, белков, связывающих интерлейкины, их функциональных аналогов, из биоаналогов и их смесей, предпочтительно интерлейкина-2 (ИЛ-2), интерлейкина-12 (ИЛ-12), интерлейкина-18 (ИЛ-18), их функциональных аналогов, из биоаналогов и их смесей.
Предпочтительно интерлейкин-1 (ИЛ-1), еще более предпочтительно интерлейкин-1 человека, выбран из группы, состоящей из интерлейкина-1-альфа (ИЛ-1α), интерлейкина-1-бета (ИЛ-1β), их функциональных аналогов, их биоаналогов и их смесей.
Нуклеотидная последовательность мРНК предшественника интерлейкина-1-альфа (ИЛ-1α) человека доступна под номером доступа NCBI NM_000575.4. Соответствующая аминокислотная последовательность предшественника доступна под номером доступа NCBI NP_000566.3.
Аминокислотная последовательность предшественника интерлейкина-1-альфа человека также доступна под номером доступа UniProt P01583, версия 1908. Аминокислотная последовательность содержит пропептид, в который входят аминокислоты 1-112 предшественника интерлейкина-1-альфа, и зрелый интерлейкин-1-альфа, в который входят аминокислоты 113-271 предшественника.
Нуклеотидная последовательность мРНК предшественника интерлейкина-2 человека доступна под номером доступа NCBI NM_000586.3. Соответствующая аминокислотная последовательность доступна под номером доступа NCBI NP_000577.2.
Аминокислотная последовательность предшественника интерлейкина-2 человека также доступна под номером доступа UniProt P60568, версия 161. Эта аминокислотная последовательность содержит сигнальный пептид, в который входят аминокислоты 1-20 предшественника интерлейкина-2, и зрелый интерлейкин-2, в который входят аминокислоты 21-153 предшественника.
Нуклеотидная последовательность мРНК предшественника интерлейкина-3 человека доступна под номером доступа NCBI NM_000586.3. Соответствующая аминокислотная последовательность доступна под номером доступа NCBI NP_000577.2.
Аминокислотная последовательность предшественника интерлейкина-3 человека также доступна под номером доступа UniProt P08700, версия 177. Аминокислотные последовательности содержат сигнальный пептид, в который входят аминокислоты 1-19 предшественника интерлейкина-3, и зрелый интерлейкин 3, в который входят аминокислоты 20-152 предшественника.
Интерлейкин-4 (ИЛ-4), предпочтительно интерлейкин-4 человека (чИЛ-4), представляет собой плейотропный цитокин. Интерлейкин-4 является лигандом рецептора интерлейкина-4.
Нуклеотидная последовательность мРНК предшественника изоформы 1 интерлейкина-4 человека доступна под номером доступа NCBI NM_000589.3. Соответствующая аминокислотная последовательность предшественника изоформы 1 интерлейкина-4 доступна под номером доступа NCBI NP_000580.1.
Нуклеотидная последовательность мРНК предшественника изоформы 2 интерлейкина-4 человека доступна под номером доступа NCBI NM_172348.2. Соответствующая аминокислотная последовательность предшественника изоформы 2 интерлейкина-4 доступна под номером доступа NCBI NP_758858.1
Аминокислотная последовательность предшественников интерлейкина-4 человека также доступна под номером доступа UniProt P05112, версия 178. Аминокислотная последовательность содержит сигнальный пептид, в который входят аминокислоты 1-24 предшественников изоформы 1 и изоформы 2 интерлейкина 4.
Интерлейкин-4 предпочтительно содержит одну или по меньшей мере одну из аминокислотных последовательностей, представленных в SEQ ID NO: 8-10, которые также изображены на фигурах 6a-6c, соответственно.
Нуклеотидная последовательность мРНК предшественника интерлейкина-5 человека доступна под номером доступа NCBI NM_000879.2. Соответствующая аминокислотная последовательность доступна под номером доступа NCBI NP_000870.1.
Аминокислотная последовательность предшественника интерлейкина-5 человека также доступна под номером доступа UniProt P05113, версия 189. Аминокислотные последовательности содержат сигнальный пептид, в который входят аминокислоты 1-19 предшественника интерлейкина-5, и зрелый интерлейкин-5, в который входят аминокислоты 20-134 предшественника.
Нуклеотидная последовательность мРНК варианта транскрипта 1 предшественника интерлейкина-6 человека доступна под номером доступа NCBI NM_000600.4. Соответствующая аминокислотная последовательность предшественника изоформы 1 интерлейкина-6 доступна под номером доступа NCBI NP_000591.1.
Аминокислотная последовательность предшественника интерлейкина-6 человека также доступна под номером доступа UniProt P05231, версия 212. Аминокислотные последовательности содержат сигнальный пептид, в который входят аминокислоты 1-29 предшественника интерлейкина-6, и зрелый интерлейкин-6, в который входят аминокислоты 30-212 предшественника.
Нуклеотидная последовательность мРНК варианта транскрипта 1 предшественника интерлейкина-7 человека доступна под номером доступа NCBI NM_000880.3. Соответствующая аминокислотная последовательность предшественника изоформы 1 интерлейкина-7 доступна под номером доступа NCBI NP_000871.1.
Аминокислотная последовательность предшественника интерлейкина-7 человека также доступна под номером доступа UniProt P05231, версия 212. Аминокислотная последовательность предшественника изоформы 1 интерлейкина-7 человека содержит сигнальный пептид, в который входят аминокислоты 1-25 предшественника изоформы 1, и зрелый интерлейкин-7, в который входят аминокислоты 26-177 предшественника изоформы 1.
Нуклеотидная последовательность мРНК варианта транскрипта 1 предшественника интерлейкина-8 человека доступна под номером доступа NCBI NM_000584.3. Соответствующая аминокислотная последовательность предшественника изоформы 1 интерлейкина-8 доступна под номером доступа NCBI NP_000575.1.
Аминокислотная последовательность предшественника интерлейкина-8 человека также доступна под номером доступа UniProt P10145, версия 210. Аминокислотная последовательность предшественника изоформы 1 интерлейкина-8 человека содержит сигнальный пептид, в который входят аминокислоты 1-20 предшественника изоформы 1. Пептид-предшественник длиной 99 аминокислот подвергается расщеплению с образованием нескольких активных изоформ ИЛ-8.
Зрелый интерлейкин-8 человека предпочтительно содержит аминокислоты 31-99 предшественника изоформы 1 интерлейкина-8.
Интерлейкин-9 (ИЛ-9), предпочтительно интерлейкин-9 человека (чИЛ-9), продуцируют различные клетки. Нуклеотидная последовательность мРНК предшественника интерлейкина-9 человека доступна под номером доступа NCBI NM_000590.1. Соответствующая аминокислотная последовательность находится под номером доступа NCBI NP_000581.1, а также под номером доступа UniProt P15248, версия 153.
Аминокислотная последовательность предшественника интерлейкина-9 человека содержит сигнальный пептид, в который входят аминокислоты 1-18 белка-предшественника интерлейкина-9 человека и зрелый интерлейкин-9, в который входят аминокислоты 19-144 предшественника.
Интерлейкин-10 (ИЛ-10), предпочтительно интерлейкин-10 человека (чИЛ-10), представляет собой цитокин, продуцируемый главным образом моноцитами. Нуклеотидная последовательность мРНК предшественника интерлейкина-10 человека доступна под номером доступа NCBI NM_000572.2. Соответствующая аминокислотная последовательность находится под номером доступа NCBI NP_000563.1, а также под номером доступа UniProt P22301, версия 156.
Аминокислотная последовательность предшественника интерлейкина-10 человека включает сигнальный пептид, в который входят аминокислоты 1-18 белка-предшественника интерлейкина-10 человека.
Интерлейкин-12 представляет собой гетеродимерный цитокин, кодируемый двумя отдельными генами - геном альфа-субъединицы интерлейкина-12 (ИЛ-12A), также известной под обозначением p35, и геном бета-субъединицы интерлейкина-12 (ИЛ-12B), также известной под обозначением p40. Активный гетеродимер, который называют «p70», и гомодимер p40 образуются после синтеза белка.
Нуклеотидная последовательность мРНК предшественника альфа-субъединицы интерлейкина-12 человека содержит три варианта транскрипта, доступные под номерами доступа NCBI NM_000882.4 (вариант 1), NM_001354582.1 (вариант 2) и NM_001354583.1 (вариант 3).
Соответствующие аминокислотные последовательности изоформ 1, 2 и 3 предшественника альфа-субъединицы интерлейкина-12 человека доступны под номерами доступа NCBI NP_000873.2, NP_001341511.1 и NP_001341512.1, соответственно, а также под номером доступа UniProt P29459, версия 170.
Предшественник изоформы 1 альфа-субъединицы интерлейкина-12 человека содержит сигнальный пептид, в который входят аминокислоты 1-56 белка-предшественника, депонированного под номером эталонной последовательности NCBI: NP_000873.2.
В вариантах 2 и 3 ИЛ-12А человека отсутствует экзон альтернативной рамки считывания по сравнению с вариантом 1. N- и C-концы полученных изоформ 2 и 3 одинаковы, однако они короче изоформы 1.
Нуклеотидная последовательность мРНК альфа-субъединицы интерлейкина-12 мыши содержит два варианта транскрипта, доступные под номерами доступа NCBI NM_001159424.2 (вариант 1) и NM_008351.3 (вариант 2).
Соответствующие аминокислотные последовательности изоформ 1 и 2 предшественника альфа-субъединицы интерлейкина-12 мыши доступны под номерами доступа NCBI NP_001152896.1 и NP_032377.1, соответственно, а также под номером доступа UniProt P43431, версия 140.
Предшественник изоформы 2 альфа-субъединицы интерлейкина-12 мыши содержит сигнальный пептид, в который входят аминокислоты 1-22 белка-предшественника, депонированного под стандартной последовательностью NCBI: NP_032377.1.
Альфа-субъединица интерлейкина-12 предпочтительно содержит аминокислотные последовательности зрелой изоформы 2 альфа-субъединицы интерлейкина-12 мыши, представленной на фигуре 13b и в SEQ ID NO: 25.
Нуклеотидная последовательность мРНК предшественника бета-субъединицы интерлейкина-12 человека доступна под номером доступа NCBI NM_002187.2. Соответствующая аминокислотная последовательность доступна под номером доступа NCBI NP_002178.2, а также под номером доступа UniProt P29460, версия 210.
Предшественник бета-субъединицы интерлейкина-12 человека содержит сигнальный пептид, в который входят аминокислоты 1-22 аминокислотной последовательности, депонированной под номером эталонной последовательности NCBI NP_002178.2.
Нуклеотидная последовательность мРНК предшественника бета-субъединицы интерлейкина-12 мыши доступна под номером доступа NCBI NM_001303244.1. Соответствующая аминокислотная последовательность доступна под номером доступа NCBI NP_001290173.1, а также под номером доступа UniProt P43432, версия 163.
Предшественник бета-субъединицы интерлейкина-12 мыши содержит сигнальный пептид, в который входят аминокислоты 1-22 аминокислотной последовательности, депонированной под номером эталонной последовательности NCBI NP_001290173.1.
Бета-субъединица интерлейкина-12 предпочтительно содержит аминокислотные последовательности зрелой бета-субъединицы интерлейкина-12 мыши, представленной на фигуре 13а и в SEQ ID NO: 24.
Более предпочтительно, интерлейкин-12 экспрессируется в виде рекомбинантного гибридного белка, содержащего зрелую форму альфа-субъединицы интерлейкина-12 и зрелую форму бета-субъединицы интерлейкина-12, предпочтительно связанные линкерной последовательностью, предпочтительно содержащей по меньшей мере одну аминокислоту.
Более предпочтительно, интерлейкин-12 экспрессируется в виде рекомбинантного гибридного белка, содержащего одну или по меньшей мере одну из аминокислотных последовательностей, представленных в SEQ ID NO: 26-27, которые также изображены на фигурах 13c и 13d, соответственно.
Интерлейкин-13 (ИЛ-13), предпочтительно интерлейкин-13 человека (чИЛ-13), представляет собой иммунорегуляторный цитокин. Нуклеотидная последовательность мРНК предшественника интерлейкина-13 человека доступна под номером доступа NCBI NM_002188.2. Соответствующая аминокислотная последовательность доступна под номером доступа NCBI NP_002179.2, а также под номером доступа UniProt P35225, версия 157.
Предшественник интерлейкина-13 содержит сигнальный пептид, в который входят аминокислоты 1-24 белка-предшественника интерлейкина-13, депонированного под номером доступа UniProt P35225, версия 157.
Интерлейкин-18 (ИЛ-18) представляет собой цитокин, который принадлежит к суперсемейству ИЛ-1 и продуцируется, например, макрофагами.
Нуклеотидная последовательность мРНК предшественника интерлейкина-18 человека (чИЛ-18) содержит два варианта транскрипта, доступные под номерами доступа NCBI NM_001562.4 (вариант 1) и NM_001243211.1 (вариант 2).
Вариант транскрипта 1 представляет собой преобладающий и более длинный транскрипт и кодирует более длинную изоформу 1 чИЛ-18.
Вариант транскрипта 2, который также известен как Delta3pro-IL-18, не содержит кодирующего экзона в рамке считывания по сравнению с вариантом 1. Кодированная изоформа 2 чИЛ-18 короче и может быть устойчива к протеолитической активации по сравнению с изоформой 1 чИЛ-18.
Соответствующие аминокислотные последовательности изоформ 1 и 2 предшественника интерлейкина-18 человека доступны под номерами доступа NCBI NP_001553.1 и NP_001230140.1, соответственно, а также под номером доступа UniProt Q14116, версия 1174.
Предшественник изоформы 1 интерлейкина-18 человека содержит пропептид, в который входят аминокислоты 1-36 белка-предшественника, депонированного под стандартной последовательностью NCBI: NP_001553.1, процессинг которого in vivo осуществляет каспаза 1 (CASP1) или каспаза 4 (CASP4) с получением активной формы.
Интерлейкин-18 предпочтительно содержит одну или по меньшей мере одну из аминокислотных последовательностей, представленных в SEQ ID NO: 16-18, которые также изображены на фигуре 10a-10c, соответственно.
Интерлейкин-34 (ИЛ-34) представляет собой цитокин, который также стимулирует дифференцировку и жизнеспособность моноцитов и макрофагов. Вследствие альтернативного сплайсинга интерлейкин-34 человека существует в виде двух изоформ, которые можно применять в настоящем изобретении.
Нуклеотидная последовательность мРНК предшественника изоформы 1 интерлейкина-34 человека доступна под номером доступа NCBI NM_001172772.1. Соответствующая аминокислотная последовательность доступна под номером доступа NCBI NP_001166243.1.
Нуклеотидная последовательность мРНК предшественника изоформы 2 интерлейкина-34 человека доступна под номером доступа NCBI NM_001172771.1. Соответствующая аминокислотная последовательность доступна под номером доступа NCBI NP_001166242.1.
Соответствующая аминокислотная последовательность также доступна под номером доступа UniProt Q6ZMJ4, версия 80. Предшественник интерлейкина-34 человека содержит сигнальный пептид, в который входят аминокислоты 1-20 соответствующих аминокислотных последовательностей белков-предшественников.
Белки-антагонисты рецепторов интерлейкинов предпочтительно выбраны из белка-антагониста рецептора интерлейкина-1 (IL-1RA), белка-антагониста рецептора интерлейкина-36 (IL-36RA) и их смесей.
Подходящий белок, связывающий интерлейкин, предпочтительно представляет собой белок, связывающий интерлейкин-18 (IL-18BP).
Колониестимулирующие факторы предпочтительно представляют собой полипептиды, способные стимулировать пролиферацию клеток, заживление и/или дифференцировку клеток.
Колониестимулирующий фактор предпочтительно выбран из группы, состоящей из колониестимулирующего фактора 1 (КСФ-1), гранулоцитарно-макрофагального колониестимулирующего фактора (ГМКСФ), гранулоцитарного колониестимулирующего фактора (ГКСФ), эритропоэтина, тромбопоэтина, их функциональных аналогов, их биоаналогов и их смесей, предпочтительно колониестимулирующего фактора 1 (ГКС-1), гранулоцитарно-макрофагального колониестимулирующего фактора (ГМКСФ), гранулоцитарного колониестимулирующего фактора (ГКСФ), эритропоэтина, их функциональных аналогов, их биоаналогов и их смесей.
Колониестимулирующий фактор 1 (КСФ-1), который также известен как макрофагальный колониестимулирующий фактор (MКСФ), представляет собой цитокин, контролирующий продукцию, дифференцировку и функцию макрофагов.
Вследствие альтернативного сплайсинга КСФ-1 человека существует в виде различных изоформ, которые можно применять в настоящем изобретении.
Нуклеотидная последовательность мРНК изоформы 1 КСФ-1 человека, которая также называется предшественником изоформы A макрофагального колониестимулирующего фактора, доступна под номером доступа NCBI NM_000757.5. Соответствующая аминокислотная последовательность доступна под номером доступа NCBI NP_000748.3.
Нуклеотидная последовательность мРНК предшественника изоформы 2 КСФ-1 человека, которая также называется предшественником изоформы B макрофагального колониестимулирующего фактора 1 человека, доступна под номером доступа NCBI NM_172210.2. Соответствующая аминокислотная последовательность доступна под номером доступа NCBI NP_757349.1.
Нуклеотидная последовательность мРНК предшественника изоформы 3 КСФ-1 человека, которая также называется предшественником изоформы C макрофагального колониестимулирующего фактора 1, доступна под номером доступа NCBI NM_172211.3. Соответствующая аминокислотная последовательность доступна под номером доступа NCBI NP_757350.1.
Соответствующие аминокислотные последовательности также доступны под номером доступа UniProt P09603, версия 158. Изоформа 1 выбрана в качестве канонической последовательности UniProt.
Соответствующие белковые последовательности изоформ 1-3 предшественника КСФ-1 человека содержат N-концевой сигнальный пептид, в который входят аминокислоты 1-32 соответствующих аминокислотных последовательностей.
Активная форма КСФ-1 человека обнаруживается во внеклеточном пространстве в виде гомодимера, соединенного дисульфидными связями. Активная форма образуется путем протеолитического расщепления связанного с мембраной предшественника, что приводит к потере N-концевого сигнального пептида.
Колониестимулирующий фактор 1 предпочтительно содержит одну или по меньшей мере одну из аминокислотных последовательностей, представленных в SEQ ID NO: 11-13, которые также изображены на фигурах 7a-7c, соответственно.
Гранулоцитарно-макрофагальный колониестимулирующий фактор (ГМКСФ) также известен как колониестимулирующий фактор 2 (КСФ-2)
Нуклеотидная последовательность мРНК предшественника гранулоцитарно-макрофагального колониестимулирующего фактора человека доступна под номером доступа NCBI NM_000758.3. Соответствующая аминокислотная последовательность предшественника ГМКСФ доступна под номером доступа NCBI NP_000749.2.
Аминокислотная последовательность предшественника ГМКСФ человека также доступна под номером доступа UniProt P04141, версия 180. Аминокислотная последовательность предшественника ГМКСФ человека содержит сигнальный пептид, в который входят аминокислоты 1-17 предшественника, и зрелый ГМКСФ, в который входят аминокислоты 18-144 предшественника ГМКСФ.
Гранулоцитарно-макрофагальный колониестимулирующий фактор (ГМКСФ) предпочтительно содержит одну или по меньшей мере одну из аминокислотных последовательностей, представленных в SEQ ID NO: 19-21, которые также изображены на фигурах 11a-11c, соответственно.
Гранулоцитарный колониестимулирующий фактор (Г-КСФ или ГКСФ) также известен как колониестимулирующий фактор 3 (КСФ 3).
У людей путем дифференциального сплайсинга мРНК из одного и того же гена предпочтительно синтезируются 2 различных полипептида ГКСФ, называемых изоформой 1 и изоформой 2. Эти 2 полипептида отличаются наличием или отсутствием 3 аминокислот.Исследования экспрессии показывают, что оба они предпочтительно обладают активностью ГКСФ.
Нуклеотидная последовательность мРНК предшественника изоформы 1 ГКСФ человека, также называемого предшественником изоформы А ГКСФ, доступна под номером доступа NCBI NM_000759.3. Соответствующая аминокислотная последовательность доступна под номером доступа NCBI NP_000750.1.
Нуклеотидная последовательность мРНК предшественника изоформы 2 ГКСФ человека, также называемого предшественником изоформы B ГКСФ, доступна под номером доступа NCBI NM_172219.2. Соответствующая аминокислотная последовательность доступна под номером доступа NCBI NP_757373.1.
Соответствующие аминокислотные последовательности ГКСФ человека также доступны под номером доступа UniProt P09919, версия 193. Изоформа 1 выбрана в качестве канонической последовательности UniProt.
Соответствующие белковые последовательности изоформ 1-2 предшественника ГКСФ человека содержат N-концевой сигнальный пептид, в который входят аминокислоты 1-29 соответствующих аминокислотных последовательностей.
Эритропоэтин (ЭПО) стимулирует продукцию эритроцитов (эритропоэз) в костном мозге.
Нуклеотидная последовательность мРНК предшественника эритропоэтина человека доступна под номером доступа NCBI NM_000799.3. Соответствующая аминокислотная последовательность предшественника эритропоэтина доступна под номером доступа NCBI NP_000790.2.
Аминокислотная последовательность предшественника эритропоэтина человека также доступна под номером доступа UniProt P01588, версия 183. Аминокислотная последовательность предшественника эритропоэтина человека содержит сигнальный пептид, в который входят аминокислоты 1-27 предшественника, и зрелый эритропоэтин, в который входят аминокислоты 28-193 предшественника.
Хемокины представляют собой группу хемотаксических полипептидов, предпочтительно регулирующих рекрутинг различных лейкоцитов в область воспаления. На основе гомологии соответствующей полипептидной последовательности и количестве аминокислот между первыми двумя остатками цистеина, хемокины подразделяют на подгруппы C, CC, CXC и CX3C.
Хемокин предпочтительно выбран из группы, состоящей из CCL1-CCL28, CXCL1-CXCL17, XCL1, XCL2, CX3CL1, их функциональных аналогов, их биоаналогов и их смесей.
Примеры полипептидных гормонов известны специалисту в данной области техники и включают, например, рилизинг гормон кортикотропина, островковый амилоидный полипептид, желудочный ингибирующий полипептид, грелины, глюкагон-подобный пептид-1, рилизин-гормон гормона роста, аппетит-регулирующий гормон, инсулин, лептин, мотилин, рилизинг гормон тиреотропина, урокортин, панкреатический полипептид, соматостатин, натрийуретические пептиды, гормон роста, пролактин, кальцитонин, лютеинизирующий гормон, паратиреоидный гормон, тиреотропный гормон, вазоактивный кишечный полипептид, их функциональные аналоги, их биоаналоги и их смеси.
Примеры нейропептидов известны специалистам в данной области техники и включают, например, агути-связанный белок (AgRP), гастрин-высвобождающий пептид (GRP), пептид, родственный гену кальцитонина (CGRP), кокаин- и амфетамин-регулируемый транскриптный пептид (CART), динорфины, эндорфины, энтеростатин, пептид галанин (GAL), галанин-подобный пептид (GALP), гипокретин/орексин, меланин-концентрирующий гормон (MCH), нейромедины, нейропептид B, нейропептид K, нейропептид S, нейропептид W, нейропептид Y, нейротензин, окситоцин, пролактин-высвобождающий пептид, проопиомеланокортин и меланокортины, происходящие от него, аполипопротеин A-IV, оксинтомодулин, гастрин-высвобождающий пептид, глюкоза-независимый инсулинотрофный полипептид, орфанин FQ, энкефалины, их функциональные аналоги, их биоаналоги и их смеси.
Примеры ферментов известны специалисту в данной области техники и включают, например, эукариотические тромболитические ферменты, включая тканевый активатор плазминогена, урокиназу или другие ферменты, например, протеазу, активирующую фактор VII.
В настоящем документе антитело может представлять собой полноразмерное антитело или его функциональный фрагмент, например, Fab, гибридный белок или мультимерный белок.
В настоящем документе термин "функциональный" относится к фрагменту антитела, который по-прежнему может осуществлять свою функцию, т.е. связывание антигена. В данном контексте термин "антитело" включает обычные антитела, химерные антитела, dAb, биспецифичное антитело, триспецифичное антитело, полиспецифичное антитело, двухвалентное антитело, трехвалентное антитело, поливалентное антитело, VHH, нанотело, Fab, Fab', F(ab')2, scFv, Fv, dAb, Fd, диатело, триатело, одноцепочечное антитело, однодоменное антитело, единственный вариабельный домен антитела, но не ограничивается ими.
В настоящем контексте термин «антитело» используется для описания иммуноглобулина, природного или частично или полностью сконструированного. Поскольку антитела можно модифицировать различными способами, термин «антитело» охватывает фрагменты антител, производные, функциональные эквиваленты и гомологи антител, а также одноцепочечные антитела, бифункциональные антитела, двухвалентные антитела, VHH, нанотела, Fab, Fab', F(ab')2, scFv, Fv, dAb, Fd, диатела, триатела и антитела верблюдовых, включая любой полипептид, содержащий иммуноглобулиновый связывающий домен, природный или полностью или частично сконструированный. Таким образом, данный термин включает химерные молекулы, содержащие иммуноглобулиновый связывающий домен или его эквивалент, объединенный с другим полипептидом. Данный термин также охватывает любой полипептид или белок, содержащий связывающий домен, который представляет собой связывающий домен антитела или является гомологичным связывающему домену антитела, например, имитатор антитела.
Примерами антител являются изотипы и изотипические подклассы иммуноглобулинов, в том числе IgG (lgG1, lgG2a, lgG2b, lgG3, lgG4), IgA, IgD, IgM и IgE. Таким образом, специалист в данной области техники должен принимать во внимание, что настоящее изобретение также относится к фрагментам антител, содержащим антигенсвязывающий домен, например, VHH, нанотелам, Fab, scFv, Fv, dAb, Fd, диателам и триателам. В одном варианте реализации настоящее изобретение относится к грамположительной бактерии или рекомбинантной нуклеиновой кислоте, описанным в настоящем документе, причем один экзогенный ген кодирует легкую цепь (VL) антитела или его функционального фрагмента, а другой экзогенный ген кодирует тяжелую цепь (VH) антитела или его функционального фрагмента, причем в более предпочтительном случае функциональный фрагмент представляет собой Fab. В одном варианте реализации настоящего изобретения экзогенный ген, кодирующий VL или ее функциональный фрагмент, транскрипционно связан с 3'-концом экзогенного гена, кодирующего VH или ее функциональный фрагмент.
В предпочтительном варианте реализации рекомбинантные бактерии согласно настоящему изобретению экспрессируют 1, 2, 3, 4 или более гетерологичных факторов, каждый из которых не встречается в природе или не экспрессируется указанными используемыми бактериями, которые независимо представляют собой гетерологичный полипептид или его комплекс, предпочтительно гетерологичный полипептид или его комплекс.
Например, если рекомбинантные бактерии согласно настоящему изобретению экспрессируют 2, 3, 4 или более гетерологичных факторов, экспрессия каждого из соответствующих гетерологичных факторов может контролироваться отдельным прокариотическим хлорид-индуцируемым промотором или единственным прокариотическим хлорид-индуцируемым промотором, предпочтительно контролирующим экспрессию указанных гетерологичных факторов из одного оперона.
Например, каждая из соответствующих нуклеотидных последовательностей, кодирующих соответствующие гетерологичные факторы, может быть локализована в отдельных субпопуляциях рекомбинантных бактерий, которые объединяют для получения рекомбинантных бактерий согласно настоящему изобретению.
Соответствующая отдельная субпопуляция, содержащая соответствующие нуклеотидные последовательности, например, может состоять из одного и того же вида или из различных видов бактерий.
Например, различные виды рекомбинантных бактерий, экспрессирующие различные гетерологичные факторы, можно применять для адаптации экспрессии и, предпочтительно, высвобождения соответствующих гетерологичных факторов из рекомбинантных бактерий.
В предпочтительном варианте реализации настоящего изобретения соответствующие нуклеотидные последовательности, кодирующие по меньшей мере один гетерологичный фактор, присутствуют в рекомбинантных бактериях в различном количестве копий. Например, рекомбинантные бактерии содержат по меньшей мере одну копию соответствующих нуклеотидных последовательностей, кодирующих указанный по меньшей мере один гетерологичный фактор, на бактериальную клетку.
Количество копий соответствующей нуклеотидной последовательности, которая присутствует предпочтительно в каждой клетке рекомбинантных бактерий, можно независимо увеличить для усиления экспрессии соответствующего гетерологичного фактора.
Если, например, рекомбинантные бактерии должны экспрессировать два или более гетерологичных фактора, в клетке рекомбинантных бактерий могут присутствовать различные соотношения копий соответствующих нуклеотидных последовательностей, кодирующих указанные гетерологичные факторы.
В предпочтительном варианте реализации нуклеотидные последовательности, кодирующие по меньшей мере один, предпочтительно 1, 2, 3, 4 или более гетерологичный(х) фактор(ов), расположены в одной популяции рекомбинантных бактерий.
В другом предпочтительном варианте реализации соответствующая(ие) нуклеоидная(ые) последовательность(и), кодирующая(ие) по меньшей мере один гетерологичный фактор, расположена(ы) по меньшей мере на одной из хромосомы и плазмиды указанных рекомбинантных бактерий.
Локализация нуклеотидной последовательности на хромосоме рекомбинантных бактерий или на плазмиде указанных рекомбинантных бактерий определяет, в числе прочего, количество белка, транслируемого бактериями, поскольку уровни экспрессии на плазмиде выше по сравнению с уровнями экспрессии на хромосоме.
В другом предпочтительном варианте реализации настоящего изобретения по меньшей мере одна нуклеотидная последовательность, кодирующая соответствующий гетерологичный фактор, представлена на хромосоме бактерий и по меньшей мере одна нуклеотидная последовательность, кодирующая еще один гетерологичный фактор, представлена на плазмиде указанных рекомбинантных бактерий.
В альтернативном варианте реализации настоящего изобретения соответствующие нуклеотидные последовательности представлены на отдельных участках хромосомы рекомбинантных бактерий или на различных плазмидах указанных рекомбинантных бактерий.
В предпочтительном варианте реализации настоящего изобретения все нуклеотидные последовательности, кодирующие по меньшей мере один, предпочтительно 1, 2, 3, 4 или более гетерологичный(х) фактор(ов), представлены на одной рекомбинантной нуклеиновой кислоте, предпочтительно рекомбинантной плазмиде.
Кроме того, предпочтительно рекомбинантная нуклеиновая кислота, предпочтительно рекомбинантная плазмида согласно настоящему изобретению содержит 1, 2, 3, 4 или более нуклеотидных последовательностей, каждая из которых кодирует 1, 2, 3, 4 или более факторов, каждый из которых не встречается в природе или не экспрессируется указанными используемыми бактериями и которые независимо представляют собой гетерологичный полипептид или его комплекс.
В еще одном особенно предпочтительном варианте реализации настоящего изобретения по меньшей мере одна нуклеотидная последовательность, кодирующая по меньшей мере один, предпочтительно 1, 2, 3, 4 или более гетерологичный(х) фактор(ов), расположена в одном опероне, который функционально связан с и находится под контролем одного прокариотического хлорид-индуцируемого промотора, активность которого контролируется по меньшей мере одним прокариотическим регуляторным геном.
Кроме того, предпочтительно указанный хлорид-индуцируемый промотор и указанный по меньшей мере один регуляторный ген расположены в хлорид-индуцируемой кассете для экспрессии генов, причем указанный хлорид-индуцируемый промотор расположен после указанного по меньшей мере одного регуляторного гена, и указанная хлорид-индуцируемая кассета для экспрессии генов контролирует транскрипцию по меньшей мере одной нуклеотидной последовательности, кодирующей по меньшей мере один гетерологичный фактор, который предпочтительно расположен в одном опероне.
Оперон представляет собой функционирующую единицу ДНК, содержащую кластер генов под контролем одного промотора. Гены совместно транскрибируются в цепи мРНК и совместно транслируются в цитоплазме.
Соответствующие нуклеотидные последовательности, кодирующие соответствующие гетерологичные факторы, расположенные в указанном отдельном опероне, предпочтительно представлены совместно с нуклеотидной последовательностью, кодирующей сайт связывания рибосом для инициации трансляции.
Нуклеотидные последовательности, кодирующие сайт связывания рибосом, предпочтительно расположены до стартового кодона, т.е. в направлении 5'-конца цепи, подвергаемой трансляции. Последовательность предпочтительно является комплементарной 3'-концу 16S рибосомной РНК.
Соответствующие нуклеотидные последовательности, кодирующие соответствующие гетерологичные факторы, расположенные в указанном отдельном опероне, предпочтительно представлены совместно с нуклеотидной последовательностью, кодирующей секреторную сигнальную последовательность на 5'-конце открытой рамки считывания (ОРС) гетерологичного фактора, что приводит к получению гибридного белка, содержащего секреторную сигнальную последовательность и гетерологичный фактор.
В предпочтительном варианте реализации рекомбинантных бактерий согласно настоящему изобретению или рекомбинантной плазмиды согласно настоящему изобретению каждый указанный хлорид-индуцируемый промотор и/или указанный по меньшей мере один регуляторный ген не зависят от одного и того же вида бактерий.
В предпочтительном варианте реализации настоящего изобретения указанный хлорид-индуцируемый промотор представляет собой PgadC, полученный из бактерии таксономического порядка Lactobacillales, предпочтительно Lactococcus lactis
В предпочтительном варианте реализации настоящего изобретения указанный регуляторный ген кодирует GadR бактерии таксономического порядка Lactobacillales, предпочтительно Lactococcus lactis, предпочтительно кодируя полипептид, содержащий аминокислотную последовательность, доступную под номером доступа GenBank AAC46186.1.
Кроме того, экспрессия указанного регуляторного гена, который дополнительно предпочтительно кодирует GadR бактерии таксономического порядка Lactobacillales, предпочтительно Lactococcus lactis, предпочтительно регулируется конститутивным промотором.
Нуклеотидные последовательности, кодирующие положительный регулятор GadR (gadR), GadC (gadC) и глутаматдекарбоксилазу (gadB) Lactococcus lactis, предпочтительно доступны под номером доступа AAC46187.1.
В предпочтительном варианте реализации настоящего изобретения указанная хлорид-индуцируемая кассета для экспрессии генов содержит или состоит из нуклеотидной последовательности SEQ ID NO: 2, которая также изображена на фигуре 2b, и контролирует транскрипцию по меньшей мере одной нуклеотидной последовательности, кодирующей по меньшей мере один гетерологичный фактор, предпочтительно расположенный в одном опероне.
Рекомбинантные бактерии согласно настоящему изобретению предпочтительно получают путем трансформации бактерий, предпочтительно выбранных из таксономического типа фирмикут, таксономического типа актинобактерий или таксономического типа протеобактерий, причем по меньшей мере одна нуклеотидная последовательность функционально связана с прокариотическим хлорид-индуцируемым промотором и кодирует по меньшей мере один гетерологичный фактор, причем указанный гетерологичный фактор независимо представляет собой гетерологичный полипептид или его комплекс, причем указанный гетерологичный полипептид содержит по меньшей мере один эукариотический полипептид, по меньшей мере один его фрагмент или их комбинацию и по меньшей мере один прокариотический регуляторный ген, контролирующий активность указанного хлорид-индуцируемого промотора.
Протеобактерии - это крупный тип грамотрицательных бактерий, который включает широкий спектр известных родов бактерий, например, Escherichia, Salmonella, Vibrio, Helicobacter, Yersinia, Legionellales.
Подходящие бактерии для получения рекомбинантных бактерий согласно настоящему изобретению предпочтительно представляют собой непатогенные бактерии. Непатогенные бактерии предпочтительно представляют собой неинвазивные бактерии.
В еще более предпочтительном варианте реализации рекомбинантные бактерии представляют собой грамположительные бактерии, предпочтительно грамположительные неспорообразующие бактерии. Еще предпочтительнее, указанные бактерии представляют собой неколонизирующие бактерии, лишенные способности заселять желудочно-кишечный тракт.
В еще более предпочтительном варианте реализации рекомбинантные бактерии включают грамположительные пищевые бактериальные штаммы, предпочтительно факультативные анаэробные бактериальные штаммы.
В предпочтительном варианте реализации настоящего изобретения рекомбинантные бактерии могут быть получены из одного и того же бактериального штамма или смеси различных бактериальных штаммов.
В еще одном варианте реализации бактерии классифицируются Управлением по контролю качества пищевых продуктов и лекарственных средств США (FDA) как «безвредные» (GRAS).
В еще одном варианте реализации бактерии имеют статус «квалифицированная презумпция безопасности» (QPS-статус), согласно определению Европейского агентства по безопасности продуктов питания (EFSA). Внедрение подхода «квалифицированной презумпции безопасности» (QPS) для оценки выбранных микроорганизмов описано в EFSA Journal, Vol.587, 2007, pages 1-16.
В еще более предпочтительном варианте реализации настоящего изобретения бактерии представляют собой непатогенные бактерии, принадлежащие к таксономическому типу фирмикут или актинобактерий. Бактерии предпочтительно представляют собой непатогенные бактерии из по меньшей мере одного рода, выбранного из группы, состоящей из Bifidobacterium, Corynebacterium, Enterococcus, Lactobacillus, Lactococcus, Leuconostoc, Pediococcus, Propionibacterium и Streptococcus.
В еще одном предпочтительном варианте реализации рекомбинантные бактерии представляют собой молочнокислые бактерии (LAB). Молочнокислые бактерии представляют собой кладу грамположительных кислотоустойчивых обычно неспорообразующих анаэробных бактерий, которые обладают общими метаболическими и физиологическими характеристиками. Эти бактерии продуцируют молочную кислоту в качестве основного метаболического конечного продукта разложения углеводов.
Молочнокислые бактерии известны и используются, например, при ферментации продуктов питания. Кроме того, несколько штаммов молочнокислых бактерий продуцируют белковые бактериоцины.
В еще более предпочтительном варианте реализации бактерии, используемые для получения рекомбинантных бактерий согласно настоящему изобретению, исключают патогенные и/или условно-патогенные бактерии.
В еще одном варианте реализации указанные бактерии принадлежат к роду Bifidobacterium sp., включая Bifidobacterium actinocoloniiforme, Bifidobacterium adolescentis, Bifidobacterium aesculapii, Bifidobacterium angulatum, Bifidobacterium Bifidobacterium animalis, например, Bifidobacterium animalis subsp.animalis или Bifidobacterium animalis subsp.lactis, Bifidobacterium asteroides, Bifidobacterium biavatii, Bifidobacterium bifidum, Bifidobacterium bohemicum, Bifidobacterium bombi, Bifidobacterium boum, Bifidobacterium breve, Bifidobacterium callitrichos, Bifidobacterium catenulatum, Bifidobacterium choerinum, Bifidobacterium coryneforme, Bifidobacterium crudilactis, Bifidobacterium cuniculi, Bifidobacterium denticolens, Bifidobacterium dentium, Bifidobacterium faecale, Bifidobacterium gallicum, Bifidobacterium gallinarum, Bifidobacterium globosum, Bifidobacterium indicum, Bifidobacterium infantis, Bifidobacterium inopinatum, Bifidobacterium kashiwanohense, Bifidobacterium lactis, Bifidobacterium longum, например, Bifidobacterium longum subsp.infantis, Bifidobacterium longum subsp.longum или Bifidobacterium longum subsp.suis, Bifidobacterium magnum, Bifidobacterium merycicum, Bifidobacterium minimum, Bifidobacterium mongoliense, Bifidobacterium moukalabense, Bifidobacterium pseudocatenulatum, Bifidobacterium pseudolongum, например, Bifidobacterium pseudolongum subsp.globosum или Bifidobacterium pseudolongum subsp.pseudolongum, Bifidobacterium psychraerophilum, Bifidobacterium pullorum, Bifidobacterium reuteri, Bifidobacterium ruminantium, Bifidobacterium saeculare, Bifidobacterium saguini, Bifidobacterium scardovii, Bifidobacterium stellenboschense, Bifidobacterium subtile, Bifidobacterium stercoris, Bifidobacterium suis, Bifidobacterium thermacidophilum, например, Bifidobacterium thermacidophilum subsp.porcinum или Bifidobacterium thermacidophilum subsp.thermacidophilum, Bifidobacterium thermophilum или Bifidobacterium tsurumiense, но не ограничиваясь указанными.
Указанные бактерии предпочтительно не относятся к виду Bifidobacterium dentium.
Указанные бактерии предпочтительно представляют собой бактерии рода Bifidobacterium sp.со статусом «квалифицированной презумпции безопасности» (QPS-статус), включая Bifidobacterium adolescentis, Bifidobacterium animalis, Bifidobacterium longum, Bifidobacterium breve или Bifidobacterium bifidum, но не ограничиваясь указанными.
В одном варианте реализации бактерии принадлежат к роду Corynebacterium sp., включая Corynebacterium accolens, Corynebacterium afermentans, например, Corynebacterium afermentans subsp.afermentans или Corynebacterium afermentans subsp.lipophilum, Corynebacterium ammoniagenes, Corynebacterium amycolatum, Corynebacterium appendices, Corynebacterium aquatimens, Corynebacterium aquilae, Corynebacterium argentoratense, Corynebacterium atypicum, Corynebacterium aurimucosum, Corynebacterium auris, Corynebacterium auriscanis, Corynebacterium betae, Corynebacterium beticola, Corynebacterium bovis, Corynebacterium callunae, Corynebacterium camporealensis, Corynebacterium canis, Corynebacterium capitovis, Corynebacterium casei, Corynebacterium caspium, Corynebacterium ciconiae, Corynebacterium confusum, Corynebacterium coyleae, Corynebacterium cystitidis, Corynebacterium deserti, Corynebacterium diphtheriae, Corynebacterium doosanense, Corynebacterium durum, Corynebacterium efficiens, Corynebacterium epidermidicanis, Corynebacterium equi, Corynebacterium falsenii, Corynebacterium fascians, Corynebacterium felinum, Corynebacterium flaccumfaciens, например, Corynebacterium flaccumfaciens subsp.betae, Corynebacterium flaccumfaciens subsp.flaccumfaciens, Corynebacterium flaccumfaciens subsp.oortii или Corynebacterium flaccumfaciens subsp.poinsettiae, Corynebacterium flavescens, Corynebacterium frankenforstense, Corynebacterium freiburgense, Corynebacterium freneyi, Corynebacterium glaucum, Corynebacterium glucuronolyticum, Corynebacterium glutamicum, Corynebacterium halotolerans, Corynebacterium hansenii, Corynebacterium hoagie, Corynebacterium humireducens, Corynebacterium ilicis, Corynebacterium imitans, Corynebacterium insidiosum, Corynebacterium iranicum, Corynebacterium jeikeium, Corynebacterium kroppenstedtii, Corynebacterium kutscheri, Corynebacterium lactis, Corynebacterium lilium, Corynebacterium lipophiloflavum, Corynebacterium liquefaciens, Corynebacterium lubricantis, Corynebacterium macginleyi, Corynebacterium marinum, Corynebacterium maris, Corynebacterium massiliense, Corynebacterium mastitidis, Corynebacterium matruchotii, Corynebacterium michiganense, например, Corynebacterium michiganense subsp.insidiosum, Corynebacterium michiganense subsp.michiganense, Corynebacterium michiganense subsp.nebraskense, Corynebacterium michiganense subsp.sepedonicum или Corynebacterium michiganense subsp.tessellarius, Corynebacterium minutissimum, Corynebacterium mooreparkense, Corynebacterium mucifaciens, Corynebacterium mustelae, Corynebacterium mycetoides, Corynebacterium nebraskense, Corynebacterium nigricans, Corynebacterium nuruki, Corynebacterium oortii, Corynebacterium paurometabolum, Corynebacterium phocae, Corynebacterium pilbarense, Corynebacterium pilosum, Corynebacterium poinsettiae, Corynebacterium propinquum, Corynebacterium pseudodiphtheriticum, Corynebacterium pseudotuberculosis, Corynebacterium pyogenes, Corynebacterium pyruviciproducens, Corynebacterium rathayi, Corynebacterium renale, Corynebacterium resistens, Corynebacterium riegelii, Corynebacterium seminale, Corynebacterium sepedonicum, Corynebacterium simulans, Corynebacterium singulare, Corynebacterium sphenisci, Corynebacterium spheniscorum, Corynebacterium sputi, Corynebacterium stationis, Corynebacterium striatum, Corynebacterium suicordis, Corynebacterium sundsvallense, Corynebacterium terpenotabidum, Corynebacterium testudinoris, Corynebacterium thomssenii, Corynebacterium timonense, Corynebacterium tritici, Corynebacterium tuberculostearicum, Corynebacterium tuscaniense, Corynebacterium ulcerans, Corynebacterium ulceribovis, Corynebacterium urealyticum, Corynebacterium ureicelerivorans, Corynebacterium uterequi, Corynebacterium variabile, Corynebacterium vitaeruminis или Corynebacterium xerosis, но не ограничиваясь указанными.
Указанные бактерии предпочтительно не относятся к видам Corynebacterium diphtheriae, Corynebacterium amicolatum, Corynebacterium striatum, Corynebacterium jeikeium, Corynebacterium urealyticum, Corynebacterium xerosis, Corynebacterium pseudotuberculosis, Corynebacterium tenuis, Corynebacterium striatum или Corynebacterium minutissimum.
Указанные бактерии предпочтительно представляют собой бактерии рода Corynebacterium, классифицируемые как «безвредные» (GRAS), включая Corynebacterium ammoniagenes, Corynebacterium casei, Corynebacterium flavescens или Corynebacterium variabile, но не ограничиваясь указанными.
В еще одном варианте реализации бактерии принадлежат к роду Enterococcus sp., включая Enterococcus alcedinis, Enterococcus aquimarinus, Enterococcus asini, Enterococcus avium, Enterococcus caccae, Enterococcus camelliae, Enterococcus canintestini, Enterococcus canis, Enterococcus casseliflavus, Enterococcus cecorum, Enterococcus columbae, Enterococcus devriesei, Enterococcus diestrammenae, Enterococcus dispar, Enterococcus durans, Enterococcus eurekensis, Enterococcus faecalis, Enterococcus faecium, Enterococcus flavescens, Enterococcus gallinarum, Enterococcus gilvus, Enterococcus haemoperoxidus, Enterococcus hermanniensis, Enterococcus hirae, Enterococcus italicus, Enterococcus lactis, Enterococcus lemanii, Enterococcus malodoratus, Enterococcus moraviensis, Enterococcus mundtii, Enterococcus olivae, Enterococcus pallens, Enterococcus phoeniculicola, Enterococcus plantarum, Enterococcus porcinus, Enterococcus pseudoavium, Enterococcus quebecensis, Enterococcus raffinosus, Enterococcus ratti, Enterococcus rivorum, Enterococcus rotai, Enterococcus saccharolyticus, например, Enterococcus saccharolyticus subsp.saccharolyticus или Enterococcus saccharolyticus subsp.taiwanensis, Enterococcus saccharominimus, Enterococcus seriolicida, Enterococcus silesiacus, Enterococcus solitarius, Enterococcus sulfureus, Enterococcus termitis, Enterococcus thailandicus, Enterococcus ureilyticus, Enterococcus viikkiensis, Enterococcus villorum или Enterococcus xiangfangensis, но не ограничиваясь указанными.
Указанные бактерии предпочтительно представляют собой бактерии рода Enterococcus, классифицируемые как «безвредные» (GRAS), включая Enterococcus durans, Enterococcus faecalis или Enterococcus faecium, но не ограничиваясь указанными.
В еще одном варианте реализации бактрии принадлежат к роду Lactobacillus sp., включая Lactobacillus acetotolerans, Lactobacillus acidifarinae, Lactobacillus acidipiscis, Lactobacillus acidophilus, Lactobacillus agilis, Lactobacillus algidus, Lactobacillus alimentarius, Lactobacillus amylolyticus, Lactobacillus amylophilus, Lactobacillus amylotrophicus, Lactobacillus amylovorus, Lactobacillus animalis, Lactobacillus antri, Lactobacillus apinorum, Lactobacillus apis, Lactobacillus apodemi, Lactobacillus aquaticus, Lactobacillus arizonensis, Lactobacillus aviaries, например, Lactobacillus aviarius subsp.araffinosus или Lactobacillus aviarius subsp.aviarius, Lactobacillus backii, Lactobacillus bavaricus, Lactobacillus bifermentans, Lactobacillus bobalius, Lactobacillus bombi, Lactobacillus brantae, Lactobacillus brevis, Lactobacillus buchneri, Lactobacillus bulgaricus, Lactobacillus cacaonum, Lactobacillus camelliae, Lactobacillus capillatus, Lactobacillus carnis, Lactobacillus casei, например, Lactobacillus casei subsp.alactosus, Lactobacillus casei subsp.casei, Lactobacillus casei subsp.pseudoplantarum, Lactobacillus casei subsp.rhamnosus, или Lactobacillus casei subsp.tolerans, Lactobacillus catenaformis, Lactobacillus cellobiosus, Lactobacillus ceti, Lactobacillus coleohominis, Lactobacillus collinoides, Lactobacillus composti, Lactobacillus concavus, Lactobacillus confusus, Lactobacillus coryniformis, например, Lactobacillus coryniformis subsp.coryniformis или Lactobacillus coryniformis subsp.torquens, Lactobacillus crispatus, Lactobacillus crustorum, Lactobacillus curieae, Lactobacillus curvatus, например, Lactobacillus curvatus subsp.curvatus или Lactobacillus curvatus subsp.melibiosus, Lactobacillus cypricasei, Lactobacillus delbrueckii, например, Lactobacillus delbrueckii subsp.bulgaricus, Lactobacillus delbrueckii subsp.delbrueckii, Lactobacillus delbrueckii subsp.indicus, Lactobacillus delbrueckii subsp.jakobsenii, Lactobacillus delbrueckii subsp.lactis, или Lactobacillus delbrueckii subsp.sunkii, Lactobacillus dextrinicus, Lactobacillus diolivorans, Lactobacillus divergens, Lactobacillus durianis, Lactobacillus equi, Lactobacillus equicursoris, Lactobacillus equigenerosi, Lactobacillus fabifermentans, Lactobacillus faecis, Lactobacillus farciminis, Lactobacillus farraginis, Lactobacillus ferintoshensis, Lactobacillus fermentum, Lactobacillus floricola, Lactobacillus florum, Lactobacillus fornicalis, Lactobacillus fructivorans, Lactobacillus fructosus, Lactobacillus frumenti, Lactobacillus fuchuensis, Lactobacillus furfuricola, Lactobacillus futsaii, Lactobacillus gallinarum, Lactobacillus gasseri, Lactobacillus gastricus, Lactobacillus ghanensis, Lactobacillus gigeriorum, Lactobacillus graminis, Lactobacillus halotolerans, Lactobacillus hammesii, Lactobacillus hamsteri, Lactobacillus harbinensis, Lactobacillus hayakitensis, Lactobacillus heilongjiangensis, Lactobacillus helsingborgensis, Lactobacillus helveticus, Lactobacillus heterohiochii, Lactobacillus hilgardii, Lactobacillus hokkaidonensis, Lactobacillus hominis, Lactobacillus homohiochii, Lactobacillus hordei, Lactobacillus iners, Lactobacillus ingluviei, Lactobacillus intestinalis, Lactobacillus iwatensis, Lactobacillus jensenii, Lactobacillus johnsonii, Lactobacillus kalixensis, Lactobacillus kandleri, Lactobacillus kefiranofaciens, например, Lactobacillus kefiranofaciens subsp.kefiranofaciens или Lactobacillus kefiranofaciens subsp.kefirgranum, Lactobacillus kefiri, Lactobacillus kefirgranum, Lactobacillus kimbladii, Lactobacillus kimchicus, Lactobacillus kimchiensis, Lactobacillus kimchii, Lactobacillus kisonensis, Lactobacillus kitasatonis, Lactobacillus koreensis, Lactobacillus kullabergensis, Lactobacillus kunkeei, Lactobacillus lactis, Lactobacillus leichmannii, Lactobacillus lindneri, Lactobacillus malefermentans, Lactobacillus mali, Lactobacillus maltaromicus, Lactobacillus manihotivorans, Lactobacillus mellifer, Lactobacillus mellis, Lactobacillus melliventris, Lactobacillus mindensis, Lactobacillus minor, Lactobacillus minutus, Lactobacillus mucosae, Lactobacillus murinus, Lactobacillus nagelii, Lactobacillus namurensis, Lactobacillus nantensis, Lactobacillus nasuensis, Lactobacillus nenjiangensis, Lactobacillus nodensis, Lactobacillus odoratitofui, Lactobacillus oeni, Lactobacillus oligofermentans, Lactobacillus oris, Lactobacillus oryzae, Lactobacillus otakiensis, Lactobacillus ozensis, Lactobacillus panis, Lactobacillus pantheris, Lactobacillus parabrevis, Lactobacillus parabuchneri, Lactobacillus paracasei, например, Lactobacillus paracasei subsp.paracasei или Lactobacillus paracasei subsp.tolerans, Lactobacillus paracollinoides, Lactobacillus parafarraginis, Lactobacillus parakefiri, Lactobacillus paralimentarius, Lactobacillus paraplantarum, Lactobacillus pasteurii, Lactobacillus paucivorans, Lactobacillus pentosus, Lactobacillus perolens, Lactobacillus piscicola, Lactobacillus plantarum, например, Lactobacillus plantarum subsp.argentoratensis или Lactobacillus plantarum subsp.plantarum, Lactobacillus pobuzihii, Lactobacillus pontis, Lactobacillus porcinae, Lactobacillus psittaci, Lactobacillus rapi, Lactobacillus rennini, Lactobacillus reuteri, Lactobacillus rhamnosus, Lactobacillus rimae, Lactobacillus rodentium, Lactobacillus rogosae, Lactobacillus rossiae, Lactobacillus ruminis, Lactobacillus saerimneri, Lactobacillus sakei, например, Lactobacillus sakei subsp.carnosus или Lactobacillus sakei subsp.sakei, Lactobacillus salivarius, например, Lactobacillus salivarius subsp.salicinius или Lactobacillus salivarius subsp.salivarius, Lactobacillus sanfranciscensis, Lactobacillus saniviri, Lactobacillus satsumensis, Lactobacillus secaliphilus, Lactobacillus selangorensis, Lactobacillus senioris, Lactobacillus senmaizukei, Lactobacillus sharpeae, Lactobacillus shenzhenensis, Lactobacillus sicerae, Lactobacillus silagei, Lactobacillus siliginis, Lactobacillus similes, Lactobacillus sobrius, Lactobacillus songhuajiangensis, Lactobacillus spicheri, Lactobacillus sucicola, Lactobacillus suebicus, Lactobacillus sunkii, Lactobacillus suntoryeus, Lactobacillus taiwanensis, Lactobacillus thailandensis, Lactobacillus thermotolerans, Lactobacillus trichodes, Lactobacillus tucceti, Lactobacillus uli, Lactobacillus ultunensis, Lactobacillus uvarum, Lactobacillus vaccinostercus, Lactobacillus vaginalis, Lactobacillus versmoldensis, Lactobacillus vini, Lactobacillus viridescens, Lactobacillus vitulinus, Lactobacillus xiangfangensis, Lactobacillus xylosus, Lactobacillus yamanashiensis, например, Lactobacillus yamanashiensis subsp.mali или Lactobacillus yamanashiensis subsp.yamanashiensis, Lactobacillus yonginensis, Lactobacillus zeae или Lactobacillus zymae, но не ограничиваясь указанными.
Указанные бактерии предпочтительно представляют собой бактерии рода Lactobacillus sp, классифицируемые как «безвредные» (GRAS), включая штамм Lactobacillus acidophilus NP 28, штамм Lactobacillus acidophilus NP51, штамм Lactobacillus subsp.lactis NP7, штамм Lactobacillus reuteri NCIMB 30242, штамм Lactobacillus casei Shirota, штамм Lactobacillus reuteri DSM 17938, штамм Lactobacillus reuteri NCIMB 30242, штамм Lactobacillus acidophilus NCFM, штамм Lactobacillus rhamnosus HN001, штамм Lactobacillus rhamnosus HN001, штамм Lactobacillus reuteri DSM 17938, штамм Lactobacillus casei subsp.rhamnosus GG, Lactobacillus acidophilus, Lactobacillus lactis, Lactobacillus acetotolerans, Lactobacillus acidifarinae, Lactobacillus acidipiscis, Lactobacillus acidophilus, Lactobacillus alimentarius, Lactobacillus amylolyticus, Lactobacillus amylovorus, Lactobacillus brevis, Lactobacillus buchneri, Lactobacillus cacaonum, Lactobacillus casei subsp.casei, Lactobacillus collinoides, Lactobacillus composti, Lactobacillus coryniformis subsp.coryniformis, Lactobacillus crispatus, Lactobacillus crustorum, Lactobacillus curvatus subps. curvatus, Lactobacillus delbrueckii subsp.bulgaricus, Lactobacillus delbrueckii subsp.delbrueckii, Lactobacillus delbrueckii subsp.lactis, Lactobacillus dextrinicus, Lactobacillus diolivorans, Lactobacillus fabifermentans, Lactobacillus farciminis, Lactobacillus fermentum, Lactobacillus fructivorans, Lactobacillus frumenti, Lactobacillus gasseri, Lactobacillus ghanensis, Lactobacillus hammesii, Lactobacillus harbinensis, Lactobacillus helveticus, Lactobacillus hilgardii, Lactobacillus homohiochii, Lactobacillus hordei, Lactobacillus jensenii, Lactobacillus johnsonii, Lactobacillus kefiri, Lactobacillus kefiranofadens subsp.kefiranofaciens, Lactobacillus kefiranofadens subsp.kefirgranum, Lactobacillus kimchii, Lactobacillus kisonensis, Lactobacillus mail, Lactobacillus manihotivorans, Lactobacillus mindensis, Lactobacillus mucosae, Lactobacillus nagelii, Lactobacillus namurensis, Lactobacillus nantensis, Lactobacillus nodensis, Lactobacillus oeni, Lactobacillus otakiensis, Lactobacillus panis, Lactobacillus parabrevis, Lactobacillus parabuchneri, Lactobacillus paracasei subsp.paracasei, Lactobacillus parakefiri, Lactobacillus paralimentarius, Lactobacillus paraplantarum, Lactobacillus pentosus, Lactobacillus perolens, Lactobacillus plantarum subsp.plantarum, Lactobacillus pobuzihii, Lactobacillus pontis, Lactobacillus rapi, Lactobacillus reuteri, Lactobacillus rhamnosus, Lactobacillus rossiae, Lactobacillus sakei subsp carnosus, Lactobacillus sakei subsp.sakei, Lactobacillus sali varius subsp.salivarius, Lactobacillus sanfranciscensis, Lactobacillus satsumensis, Lactobacillus secaliphilus, Lactobacillus senmaizukei, Lactobacillus siliginis, Lactobacillus spicheri, Lactobacillus suebicus, Lactobacillus sunkii, Lactobacillus tucceti, Lactobacillus vaccinostercus, Lactobacillus versmoldensis или Lactobacillus yamanashiensis, но не ограничиваясь указанными.
Указанные бактерии предпочтительно представляют собой бактерии рода Lactobacillus sp.со статусом “квалифицированной презумпции безопасности” (QPS), включая Lactobacillus acidophilus, Lactobacillus amylolyticus, Lactobacillus amylovorus, Lactobacillus alimentarius, Lactobacillus aviaries, Lactobacillus brevis, Lactobacillus buchneri, Lactobacillus casei, Lactobacillus crispatus, Lactobacillus curvatus, Lactobacillus delbrueckii, Lactobacillus farciminis, Lactobacillus fermentum, Lactobacillus gallinarum, Lactobacillus gasseri, Lactobacillus helveticus, Lactobacillus hilgardii, Lactobacillus johnsonii, Lactobacillus kefiranofaciens, Lactobacillus kefiri, Lactobacillus mucosae, Lactobacillus panis, Lactobacillus paracasei, Lactobacillus paraplantarum, Lactobacillus pentosus, Lactobacillus plantarum, Lactobacillus pontis, Lactobacillus reuteri, Lactobacillus rhamnosus, Lactobacillus sakei, Lactobacillus salivarius, Lactobacillus sanfranciscensis или Lactobacillus zeae, но не ограничиваясь указанными.
В еще одном варианте реализации настоящего изобретения пробиотические бактерии принадлежат к роду Lactococcus sp., включая Lactococcus chungangensis, Lactococcus formosensis, Lactococcus fujiensis, Lactococcus garvieae, Lactococcus lactis, for example Lactococcus lactis subsp.cremoris, Lactococcus lactis subsp.hordniae, Lactococcus lactis subsp.lactis или Lactococcus lactis subsp.tructae, Lactococcus piscium, Lactococcus plantarum, Lactococcus raffinolactis или Lactococcus taiwanensis, но не ограничиваясь указанными.
Указанные бактерии предпочтительно представляют собой бактерии рода Lactococcus, классифицируемые как «безвредные» (GRAS), включая Lactococcus lactis subsp.cremoris, Lactococcus lactis subsp.lactis и Lactococcus raffinolactis, но не ограничиваясь указанными.
Указанные бактерии предпочтительно представляют собой Lactococcus lactis, предпочтительно Lactococcus lactis subsp.lactis, Lactococcus lactis subsp.lactis biovariant diacetylactis или Lactococcus lactis subsp.cremoris, еще предпочтительнее Lactococcus lactis subsp.cremoris.
В еще одном варианте реализации бактерии принадлежат к роду Leuconostoc sp., включая Leuconostoc amelibiosum, Leuconostoc argentinum, Leuconostoc carnosum, Leuconostoc citreum, Leuconostoc cremoris, Leuconostoc dextranicum, Leuconostoc durionis, Leuconostoc fallax, Leuconostoc ficulneum, Leuconostoc fructosum, Leuconostoc gasicomitatum, Leuconostoc gelidum, например, Leuconostoc gelidum subsp.aenigmaticum, Leuconostoc gelidum subsp.gasicomitatum или Leuconostoc gelidum subsp.gelidum, Leuconostoc holzapfelii, Leuconostoc inhae, Leuconostoc kimchii, Leuconostoc lactis, Leuconostoc mesenteroides, например, Leuconostoc mesenteroides subsp.cremoris, Leuconostoc mesenteroides subsp.dextranicums, Leuconostoc mesenteroides subsp.mesenteroides или Leuconostoc mesenteroides subsp.suionicum, Leuconostoc miyukkimchii, Leuconostoc oeni, Leuconostoc paramesenteroides, Leuconostoc pseudoficulneum или Leuconostoc pseudomesenteroides, но не ограничиваясь указанными.
Указанные бактерии предпочтительно представляют собой бактерии рода Leuconostoc sp., классифицируемые как «безвредные» (GRAS), включая Leuconostoc carnosum, Leuconostoc citreum, Leuconostoc fallax, Leuconostoc holzapfelii, Leuconostoc inhae, Leuconostoc kimchii, Leuconostoc lactis, Leuconostoc mesenteroides subsp.cremoris, Leuconostoc mesenteroides subsp.dextranicums, Leuconostoc mesenteroides subsp.mesenteroides, Leuconostoc palmae или Leuconostoc pseudomesenteroides, но не ограничиваясь указанными.
Указанные бактерии предпочтительно представляют собой бактерии рода Leuconostoc sp.со статусом «квалифицированной презумпции безопасности» (QPS), включая Leuconostoc citreum, Leuconostoc lactis, Leuconostoc mesenteroides subsp.cremoris, Leuconostoc mesenteroides subsp.dextranicum или Leuconostoc mesenteroides subsp.mesenteroides, но не ограничиваясь указанными.
В еще одном варианте реализации бактерии принадлежат к роду Pediococcus sp., включая Pediococcus acidilactici, Pediococcus argentinicus, Pediococcus cellicola, Pediococcus claussenii, Pediococcus damnosus, Pediococcus dextrinicus. Pediococcus ethanolidurans, Pediococcus halophilus, Pediococcus inopinatus, Pediococcus lolii, Pediococcus parvulus, Pediococcus pentosaceus, Pediococcus siamensis, Pediococcus stilesii, or Pediococcus urinaeequi, но не ограничиваясь указанными.
Указанные бактерии предпочтительно представляют собой бактерии рода Pediococcus sp.со статусом «квалифицированной презумпции безопасности» (QPS), включая Pediococcus acidilactici, Pediococcus dextrinicus или Pediococcus pentosaceus, но не ограничиваясь указанными.
В еще одном варианте реализации бактерии принадлежат к роду Propionibacterium sp., включая Propionibacterium acidifaciens, Propionibacterium acidipropionici, Propionibacterium acnes, Propionibacterium australiense, Propionibacterium avidum, Propionibacterium cyclohexanicum, Propionibacterium damnosum, Propionibacterium freudenreichii, например, Propionibacterium freudenreichii subsp.freudenreichii или Propionibacterium freudenreichii subsp.shermanii, Propionibacterium granulosum, Propionibacterium innocuum, Propionibacterium jensenii, Propionibacterium lymphophilum, Propionibacterium microaerophilum, Propionibacterium olivae, Propionibacterium propionicum или Propionibacterium thoenii, но не ограничиваясь указанными.
В соответствии с одним вариантом реализации бактерии не относятся к виду Propionibacterium acnes.
Еще предпочтительнее, бактерии представляют собой бактерии рода Propionibacterium sp., классифицируемые как «безвредные» (GRAS), включая Propionibacterium acidipropionici, Propionibacterium freudenreichii subsp.Freudenreichii, Propionibacterium freudenreichii subsp.shermanii, Propionibacterium jensenii или Propionibacterium thoenii, но не ограничиваясь указанными.
Еще предпочтительнее, бактерии представляют собой Propionibacterium freudenreichii, еще предпочтительнее - Propionibacterium freudenreichii subsp.freudenreichii или Propionibacterium freudenreichii subsp.shermanii.
В еще одном варианте реализации бактерии принадлежат к роду Streptococcus sp., включая Streptococcus acidominimus, Streptococcus adjacens, Streptococcus agalactiae, Streptococcus alactolyticus, Streptococcus anginosus, Streptococcus australis, Streptococcus bovis, Streptococcus caballi, Streptococcus canis, Streptococcus caprinus, Streptococcus castoreus, Streptococcus cecorum, Streptococcus constellatus, например, Streptococcus constellatus subsp.constellatus, Streptococcus constellatus subsp.pharynges или Streptococcus constellatus subsp.viborgensis, Streptococcus cremoris, Streptococcus criceti, Streptococcus cristatus, Streptococcus cuniculi, Streptococcus danieliae, Streptococcus defectivus, Streptococcus dentapri, Streptococcus dentirousetti, Streptococcus dentasini, Streptococcus dentisani, Streptococcus devriesei, Streptococcus didelphis, Streptococcus difficilis, Streptococcus downei, Streptococcus durans, Streptococcus dysgalactiae, например, Streptococcus dysgalactiae subsp.dysgalactiae или Streptococcus dysgalactiae subsp.equisimilis, Streptococcus entericus, Streptococcus equi, например, Streptococcus equi subsp.equi, Streptococcus equi subsp.ruminatorum или Streptococcus equi subsp.zooepidemicus, Streptococcus equinus, Streptococcus faecalis, Streptococcus faecium, Streptococcus ferus, Streptococcus gallinaceus, Streptococcus gallinarum, Streptococcus gallolyticus, например, Streptococcus gallolyticus subsp.gallolyticus, Streptococcus gallolyticus subsp.macedonicus, или Streptococcus gallolyticus subsp.pasteurianus, Streptococcus garvieae, Streptococcus gordonii, Streptococcus halichoeri, Streptococcus hansenii, Streptococcus henryi, Streptococcus hongkongensis, Streptococcus hyointestinalis, Streptococcus hyovaginalis, Streptococcus ictaluri, Streptococcus infantarius, например, Streptococcus infantarius subsp.coli или Streptococcus infantarius subsp.infantarius, Streptococcus infantis, Streptococcus iniae, Streptococcus intermedius, Streptococcus intestinalis, Streptococcus lactarius, Streptococcus lactis, например, Streptococcus lactis subsp.cremoris, Streptococcus lactis subsp.diacetilactis или Streptococcus lactis subsp.lactis, Streptococcus loxodontisalivarius, Streptococcus lutetiensis, Streptococcus macacae, Streptococcus macedonicus, Streptococcus marimammalium, Streptococcus massiliensis, Streptococcus merionis, Streptococcus minor, Streptococcus mitis, Streptococcus morbillorum, Streptococcus moroccensis, Streptococcus mutans, Streptococcus oligofermentans, Streptococcus oralis, Streptococcus orisasini, Streptococcus orisuis, Streptococcus ovis, Streptococcus parasanguinis, Streptococcus parauberis, Streptococcus parvulus, Streptococcus pasteurianus, Streptococcus peroris, Streptococcus phocae, например, Streptococcus phocae subsp.phocae или Streptococcus phocae subsp.salmonis, Streptococcus plantarum, Streptococcus pleomorphus, Streptococcus pluranimalium, Streptococcus plurextorum, Streptococcus pneumonia, Streptococcus porci, Streptococcus porcinus, Streptococcus porcorum, Streptococcus pseudopneumoniae, Streptococcus pseudoporcinus, Streptococcus pyogenes, Streptococcus raffinolactis, Streptococcus ratti, Streptococcus rifensis, Streptococcus rubneri, Streptococcus rupicaprae, Streptococcus saccharolyticus, Streptococcus salivarius, например, Streptococcus salivarius subsp.salivarius или Streptococcus salivarius subsp.thermophilus, Streptococcus saliviloxodontae, Streptococcus sanguinis, Streptococcus shiloi, Streptococcus sinensis, Streptococcus sobrinus, Streptococcus suis, Streptococcus thermophilus, Streptococcus thoraltensis, Streptococcus tigurinus, Streptococcus troglodytae, Streptococcus uberis, Streptococcus urinalis, Streptococcus ursoris, Streptococcus vestibularis или Streptococcus waius, но не ограничиваясь указанными.
Указанные бактерии предпочтительно представляют собой бактерии рода Streptococcus sp., классифицируемые как «безвредные» (GRAS), включая штамм Streptococcus thermophilus Th4, Streptococcus gallolyticus subsp.macedonicus, Streptococcus salivarius subsp.salivarius или Streptococrus salivarius subsp.thermophilus, но не ограничиваясь указанными.
Указанные бактерии предпочтительно представляют собой бактерии рода Streptococcus sp.со статусом «квалифицированной презумпции безопасности» (QPS), включая Streptococcus thermophilus, но не ограничиваясь указанным.
В предпочтительном варианте реализации указанные бактерии не продуцируют эндотоксины или другие потенциально токсичные вещества. Следовательно, указанные бактерии безопасны в применении и не являются вредными для субъекта после применения.
Кказанные бактерии предпочтительно не образуют споры. Бактериальные споры не являются частью полового цикла, а представляют собой устойчивые структуры, используемые для выживания в неблагоприятных условиях. Поскольку указанные рекомбинантные бактерии предпочтительно не образуют споры, то указанные рекомбинантные бактерии не могут выжить, например, без питательных веществ или в условиях отсутствия ауксотрофных факторов.
Указанные бактерии предпочтительно не образуют тельца включения. Тельца включения часто содержат гиперэкспрессированные белки, и агрегация указанных гиперэкспрессированных белков в тельцах включения может быть необратимой.
Поскольку бактерии, используемые для получения рекомбинантных бактерий согласно настоящему изобретению, предпочтительно не образуют тельца включения, количество указанного по меньшей мере одного гетерологичного фактора после транскрипции и предпочтительно трансляции соответствующих нуклеотидных последовательностей не уменьшается за счет внутриклеточного накопления в тельцах включения.
Еще предпочтительнее, указанные бактерии также не продуцируют внеклеточные протеиназы. Бактерии могут секретировать внеклеточные протеиназы для разрушения внеклеточных структур, например, белков, для получения питательных веществ, например, углерода, азота или серы. Внеклеточные протеиназы также могут действовать в качестве экзотоксина и могут являться примером фактора вирулентности при патогенезе бактериальных заболеваний.
Из-за отсутствия внеклеточных протеиназ безопасность указанных бактерий после применения у субъекта предпочтительно повышается. Кроме того, указанные бактерии предпочтительно не разрушают указанный по меньшей мере один гетерологичный фактор после его высвобождения из указанных рекомбинантных бактерий.
В еще более предпочтительном варианте реализации указанные рекомбинантные бактерии представляют собой молочнокислые бактерии, предпочтительно вида Lactobacillus или Lactococcus. В еще более предпочтительном варианте реализации указанный вид Lactococcus представляет собой Lactococcus lactis subsp.cremoris.
Молочнокислые бактерии дополнительно выделяют молочную кислоту в качестве основного метаболического конечного продукта ферментации углеводов. Известно, что молочная кислота стимулирует размножение и пролиферацию эндотелия. Кроме того, молочная кислота обладает антибактериальным действием, которое уменьшает вероятность бактериальной инфекции в очаге нарушения функции кожи.
Методики трансформации вышеуказанных бактерий известны специалисту в данной области техники и описаны, например, в Green and Sambrook (2012): “Molecular cloning: a laboratory manual”, fourth edition, Cold Spring Harbour Laboratory Press (Cold Spring Harbor, NY, US).
После трансформации рекомбинантные бактерии содержат по меньшей мере одну нуклеотидную последовательность, функционально связанную с прокариотическим хлорид-индуцируемым промотором и кодирующую по меньшей мере один гетерологичный фактор, причем указанный гетерологичный фактор независимо представляет собой гетерологичный полипептид или его комплекс, и по меньшей мере один прокариотический регуляторный ген, контролирующий активность указанного хлорид-индуцируемого промотора, причем указанный гетерологичный полипептид содержит по меньшей мере один эукариотический полипептид, по меньшей мере один его фрагмент или их комбинацию.
Кроме того, рекомбинантные бактерии предпочтительно содержат после трансформации по меньшей мере одну копию рекомбинантной плазмиды согласно настоящему изобретению.
Подходящие штаммы для получения рекомбинантных бактерий согласно настоящему изобретению доступны для приобретения, например, в MoBiTec GmbH (Геттинген, Германия) или в NIZO Food Research BV (Эде, Нидерланды). Подходящие штаммы представляют собой, например, штамм Lactococcus lactis NZ1330, предпочтительно содержащий систему селекции плазмиды, не основанную на устойчивости к антибиотикам.
В еще более предпочтительном варианте реализации нуклеотидные последовательности, кодирующие соответствующие гетерологичные факторы, модифицированы с целью повышения экспрессии, секреции и/или стабильности кодируемого по меньшей мере одного гетерологичного фактора.
Подходящие модификации известны специалистам в данной области техники и включают, например, адаптацию частоты использования кодонов по меньшей мере одной нуклеотидной последовательности для используемых бактерий.
Например, по меньшей мере одна нуклеотидная последовательность может быть сконструирована с учетом соответствия профилю частоты использования кодонов используемых бактерий. Кроме того, в дополнение к общей оптимизации кодонов можно использовать таблицы специфичных кодонов, например, таблицы кодонов для высокого уровня экспрессии генов белков рибосом соответствующих бактерий с целью дальнейшего увеличения трансляции кодируемого по меньшей мере одного гетерологичного фактора.
Подходящие модификации также включают, например, встраивание нуклеотидной последовательности, кодирующей секреторную сигнальную последовательность, на 5'-конце открытой рамки считывания (ОРС) гетерологичного фактора с целью получения гибридного белка, содержащего секреторную сигнальную последовательность и указанный гетерологичный фактор. Секреторная сигнальная последовательность предпочтительно расположена на N-конце соответствующего гетерологичного фактора.
Секреторная сигнальная последовательность предпочтительно направляет вновь синтезированный белок к плазматической мембране. На конце секреторной сигнальной последовательности, предпочтительно сигнального пептида, предпочтительно находится участок аминокислотной последовательности, распознаваемый и отщепляемый сигнальной пептидазой с образованием свободной секреторной сигнальной последовательности, предпочтительно сигнального пептида, и зрелого гетерологичного фактора, секретируемого во внеклеточное пространство.
Подходящие последовательности сигналов секреции включают, например, сигнальный пептид.
Последовательность сигнала секреции предпочтительно представляет собой нативный сигнальный пептид соответствующего гетерологичного фактора, кодируемого нуклеотидной последовательностью, который предпочтительно представляет собой предшественник соответствующего фактора.
В еще более предпочтительном варианте реализации указанная последовательность сигнала секреции представляет собой гомологичную секреторную последовательность указанных рекомбинантных бактерий, предпочтительно указанная последовательность сигнала секреции представляет собой сигнальную последовательность неизвестного секретируемого белка 45 (Usp 45) Lactococcus sp.Сигнал секреции Usp45 характеризуется очень высокой эффективностью секреции. Другие сигналы секреции известны специалисту в данной области техники и включают, например, PrtP, SlpA, SP310, SPEXP4 и AL9 Lactococcus sp.
Аминокислотная последовательность белка Usp45 Lactococcus lactis subsp.cremoris MG1363 доступна, например, под номером доступа GenBank CAL99070.1. В эту сигнальную последовательность входят аминокислоты 1-27 последовательности, депонированной под регистрационным номером GenBank CAL99070.1.
Например, нативный сигнальный пептид гетерологичного фактора можно заменить гомологичной последовательностью сигнала секреции рекомбинантной бактерии, используемой для экспрессии указанного по меньшей мере одного гетерологичного фактора.
Последовательность сигнала секреции предпочтительно улучшает эффективность секреции соответствующего гетерологичного фактора. Например, у Lactococcus lactis большинство белков секретируются посредством Sec-пути. Белки синтезируются в качестве предшественников, содержащих зрелые белки с N-концевым сигнальным пептидом. Сигнальный пептид направляет белок к цитоплазматической мембране и облегчает секрецию белка. После отщепления сигнального пептида зрелый белок высвобождается во внеклеточное пространство.
Еще предпочтительнее, секреторный сигнал содержит аминокислотную последовательность SEQ ID NO: 3, которая также показана на фигуре 3.
В еще более предпочтительном варианте реализации по меньшей мере один гетерологичный фактор, предпочтительно 1, 2, 3, 4 или более гетерологичный(х) фактор(ов) экспрессируется(ются) в виде пропептида, содержащего или не содержащего фактор, усиливающий секрецию. Указанный пропептид можно расщеплять протеазами с высвобождением зрелой формы по меньшей мере одного гетерологичного фактора, предпочтительно 1, 2, 3, 4 или более гетерологичного(ых) фактора(ов).
Предпочтительно по меньшей мере один гетерологичный фактор, предпочтительно 1, 2, 3, 4 или более гетерологичный(х) фактор(ов) способен(способны) высвобождаться из указанных рекомбинантных бактерий.
Например, у грамположительных бактерий, например, молочнокислые бактерий, белки, секретируемые бактерией, предпочтительно синтезируются в виде предшественника, содержащего N-концевой сигнальный пептид и зрелый белок. Эти предшественники распознаются секреторными механизмами бактерий и транслоцируются через цитоплазматическую мембрану. Затем сигнальный пептид отщепляется и разрушается, и зрелый белок высвобождается из бактерии, например, в супернатант культуры или в область воспалительного нарушения функции кожи.
Например, Lactococcus lactis способны секретировать белки как с низкой молекулярной массой, например, менее 10 кДа, так и с высокой молекулярной массой, например, молекулярной массой более 160 кДа, посредством Sec-зависимого пути.
В качестве альтернативы, по меньшей мере один гетерологичный фактор, предпочтительно 1, 2, 3, 4 или более, гетерологичный(х) фактор(ов) высвобождается(ются) из указанной рекомбинантной бактерии через нарушенную цитоплазматическую мембрану.
Например, цитоплазматическая мембрана указанных рекомбинантных бактерий становится более проницаемой вследствие нарушений синтеза компонентов клеточной стенки.
Указанные рекомбинантные бактерии предпочтительно содержат инактивированный ген аланинрацемазы (alr). В отсутствие D-аланина указанные рекомбинантные бактерии не могут поддерживать целостность цитоплазматической мембраны, и впоследствии по меньшей мере один гетерологичный фактор, предпочтительно 1, 2, 3, 4 или более гетерологичный(х) фактор(ов) высвобождается(ются) из указанных рекомбинантных бактерий.
В еще более предпочтительном варианте реализации настоящего изобретения рекомбинантные бактерии согласно настоящему изобретению содержат по меньшей мере один инактивированный ген, кодирующий незаменимый белок, необходимый для жизнеспособности указанных бактерий.
В предпочтительном варианте реализации настоящего изобретения незаменымый белок, необходимый для жизнеспособности указанных рекомбинантных бактерий, представляет собой белок, более предпочтительно фермент, необходимый для синтеза органического соединения, необходимого для жизнеспособности указанных рекомбинантных бактерий.
После инактивации указанного ключевого белка, предпочтительно фермента, соответствующее органическое соединение представляет собой ауксотрофный фактор, необходимый для жизнеспособности рекомбинантных бактерий, который требуется восполнять для поддержания жизнеспособности рекомбинантных бактерий.
Предпочтительно указанный ауксотрофный фактор представляет собой витамин, аминокислоту, нуклеиновую кислоту и/или жирную кислоту.
Например, аминокислоты и нуклеотиды представляют собой биологически важные органические соединения, которые являются предшественниками белков и нуклеиновых кислот, соответственно.
Предпочтительно, указанный ген, кодирующий незаменимый белок, необходимый для жизнеспособности указанных бактерий, представлен на рекомбинантной нуклеиновой кислоте и/или рекомбинантной плазмиде согласно настоящему изобретению.
В еше более предпочтительном варианте реализации по меньшей мере один ген, необходимый для жизнеспособности рекомбинантных бактерий, выбран из группы, состоящей из аланинрацемазы (alr), тимидилатсинтазы (thyA), аспарагинсинтазы (asnH), CTP-синтазы (pyrG), триптофансинтазы (trbBA) и их комбинаций.
Например, аланинрацемаза представляет собой фермент, который катализирует рацемизацию L-аланина в L- и D-аланин. D-аланин, продуцируемый аланинрацемазой, используется для синтеза пептидогликанов. Пептидогликан обнаруживается в клеточных стенках всех бактерий.
Специалисту в данной области техники известно, что инактивация гена аланинрацемазы (alr) у бактерий приводит к зависимости бактерий от внешнего источника D-аланина для поддержания целостности клеточной стенки.
Специалисту в данной области техники известно, что, например, Lactococcus lactis и Lactobacillus plantarum содержат единственный ген alr. Инактивация этого гена влияет на встраивание D-аланина в клеточную стенку.
Бактерия Lactococcus lactis, например, с инактивированным геном аланинрацемазы (alr) зависит от внешнего источника D-аланина, обеспечивающего возможность синтеза пептидогликана и включения D-аланина в липотейхоевую кислоту (LTA). Указанные бактерии быстро лизируют при удалении D-аланина, например, в середине фазы экспоненциального роста.
Штаммы молочнокислых бактерий, дефицитные по аланинрацемазе, можно получить, например, способами, известными в данной области техники.
Тимидилатсинтаза представляет собой фермент, катализирующий преобразование дезоксиуридинмонофосфата (дУМФ) в дезокситимидилатмонофосфат (дТМФ). дТМФ представляет собой один из трех нуклеотидов, образующих тимин (дТМФ, дТДФ и дТТФ). Тимидин входит в состав ДНК.
Специалисту в данной области техники известно, что тимидилатсинтаза играет важнейшую роль в биосинтезе ДНК. Кроме того, синтез ДНК необходим для пролиферации бактерий.
Инактивация гена тимидилатсинтазы (thyA) у бактерий приводит к зависимости бактерий от внешнего источника тимидина для поддержания целостности ДНК.
Аспарагинсинтетаза представляет собой фермент, синтезирующий аминокислоту аспарагин из аспартата. Инактивация гена аспарагинсинтетазы (asnH) приводит к неспособности синтезировать соответствующую аминокислоту, которая становится ауксотрофным фактором.
ЦТФ-синтаза представляет собой фермент, участвующий в синтезе пиримидинов. ЦТФ-синтаза осуществляет взаимное преобразование уридин-5’-трифосфата (УТФ) и цитидин-5’-трифосфата (ЦТФ). Инактивация гена ЦТФ-синтазы (pyrG) приводит к потере бактериями способности синтезировать цитозиновые нуклеотиды в ходе синтеза de novo, а также с помощью пути уридина в клеточной стенке.
ЦТФ становится ауксотрофным фактором, который требуется восполнять для синтеза РНК и ДНК.
Триптофансинтаза представляет собой фермент, катализирующий два последних этапа биосинтеза аминокислоты триптофана.
Инактивация гена триптофансинтазы (trpBA) приводит к неспособности бактерий синтезировать соответствующую аминокислоту, которая становится ауксотрофным фактором.
Способы инактивации указанного гена, необходимого для жизнеспособности бактерий, известны специалисту в данной области техники и включают удаление гена, мутирование гена, сайленсинг указанного гена, опосредованный РНК-интерференцией (RNAi), трансляционное ингибирование указанного гена или их комбинации.
В еще более предпочтительном варианте реализации предложен соответствующий ауксотрофный фактор вместе с указанными рекомбинантными бактериями.
В еще более предпочтительном варианте реализации настоящего изобретения указанный инактивированный ген, необходимый для жизнеспособности рекомбинантных бактерий, используется для их удерживания в определенной окружающей среде.
После применения рекомбинантных бактерий, содержащих по меньшей мере один инактивированный ген, необходимый для жизнеспособности указанных бактерий, соответствующий ауксотрофный фактор должен поступать извне, например, в среде для разведения, среде для нанесения или культуральной среде.
Если рекомбинантные бактерии высвобождаются в окружающую среду, ауксотрофный фактор отсутствует, и предпочтительно рекомбинантные бактерии погибают.
Кроме того, применение ауксотрофного фактора, поставляемого извне, позволяет контролировать биосинтез и высвобождение соответствующего(их) гетерологичного(ых) фактора(ов).
Более предпочтительно, указанный ген, кодирующий незаменимый белок, необходимый для жизнеспособности указанных бактерий, предпочтительно выбранный из группы, состоящей из аланинрацемазы (alr), тимидилатсинтазы (thyA), аспарагинсинтазы (asnH), ЦТФ-синтазы (pyrG), триптофансинтазы (trbBA) и их комбинаций, представлен на рекомбинантной нуклеиновой кислоте и/или рекомбинантной плазмиде согласно настоящему изобретению.
Таким образом, можно предложить высокостабильную систему для поддержания рекомбинантной нуклеиновой кислоты и/или рекомбинантной плазмиды согласно настоящему изобретению у рекомбинантных бактерий даже во время роста in vivo, поскольку можно достичь селекционного давления для поддержания рекомбинантной нуклеиновой кислоты и/или рекомбинантной плазмиды согласно настоящему изобретению, предпочтительно в отсутствие ауксотрофного фактора, поставляемого извне.
Экспрессия указанного гена, кодирующего незаменимый белок, необходимый для жизнеспособности указанных бактерий, который предпочтительно выбран из группы, состоящей из аланинрацемазы (alr), тимидилатсинтазы (thyA), аспарагинсинтазы (asnH), CTP-синтазы (pyrG), триптофансинтазы (trbBA) и их комбинаций, на рекомбинантной нуклеиновой кислоте и/или рекомбинантной плазмиде согласно настоящему изобретению не только позволяет использовать ауксотрофные добавки, но и может использоваться в качестве маркера селекции наличия рекомбинантной нуклеиновой кислоты и/или рекомбинантной плазмиды согласно настоящему изобретению в соответствующих бактериях.
В предпочтительном варианте реализации рекомбинантные бактерии предназначены для применения в медицине, еще предпочтительнее - для применения при лечении предпочтительно хронической воспаленной раны или дегенеративного состояния, или для применения при лечении опухоли, предпочтительно злокачественной опухоли.
Во время введения рекомбинантных бактерий согласно настоящему изобретению субъекту высвобожденный по меньшей мере один гетерологичный фактор, предпочтительно 1, 2, 3, 4 или более гетерологичный(х) фактор(ов) может(могут) подвергаться разложению, например, посредством расщепления протеиназами, что может привести к потере указанным(и) гетерологичным(и) фактором(ами) биологической активности.
Разложение или истощение указанного(ых) гетерологичного(ых) фактора(ов) можно компенсировать посредством замедленного высвобождения по меньшей мере одного гетерологичного фактора, предпочтительно 1, 2, 3, 4 или более гетерологичного(ых) фактора(ов) из указанных рекомбинантных бактерий согласно настоящему изобретению в присутствии хлорид-ионов.
Указанные рекомбинантные бактерии предпочтительно постоянно экспрессируют по меньшей мере один гетерологичный фактор, предпочтительно 1, 2, 3, 4 или более гетерологичный(х) фактор(ов). Указанные рекомбинантные бактерии предпочтительно постоянно высвобождают указанный(е) гетерологичный(е) фактор(ы).
Фармацевтическая композиция согласно настоящему изобретению содержит рекомбинантные бактерии согласно настоящему изобретению и по меньшей мере одно фармацевтически приемлемое вспомогательное вещество.
В предпочтительном варианте реализации рекомбинантные бактерии согласно настоящему изобретению представлены в виде фармацевтической композиции для применения в медицине, еще предпочтительнее для применения при лечении предпочтительно хронической воспаленной раны или дегенеративного состояния, или для применения при лечении опухоли, предпочтительно злокачественной опухоли.
Вспомогательное вещество представляет собой вещество, входящее в состав лекарственного средства вместе с действующим веществом, включенное с целью долгосрочной стабилизации, увеличения объема твердых составов, содержащих сильные действующие вещества в небольших количествах (такие вещества часто называют «объемообразующими агентами», «наполнителями» или «разбавителями»), или для усиления терапевтического эффекта действующего вещества в готовой лекарственной форме, например, для облегчения всасывания, снижения вязкости или повышения растворимости лекарственного средства.
Термин "вспомогательное вещество" предпочтительно также включает по меньшей мере один разбавитель.
Вспомогательные вещества также можно применять в производственном процессе в качестве вспомогательных средств при обращении с соответствующим действующим веществом, например, путем повышения текучести или снижения слипаемости порошка в дополнение к повышению стабильности in vitro, например, предотвращению денатурации или агрегации в течение ожидаемого срока годности, и/или для стимуляции жизнеспособности бактериальных клеток рекомбинантных бактерий во время замораживания и размораживания.
Указанная фармацевтическая композиция предпочтительно содержит по меньшей мере одно фармацевтически приемлемое вспомогательное вещество, которое также предпочтительно является подходящим для предполагаемого пути введения.
Указанное фармацевтически приемлемое вспомогательное вещество предпочтительно известно специалисту в данной области техники и содержит по меньшей мере один полимерный носитель, предпочтительно выбранный из группы, состоящей из полисахаридов, сложных полиэфиров, полиметакриламида и их смесей. Например, указанное фармацевтически приемлемое вспомогательное вещество представляет собой гидрогель, например, дополнительно обеспечивающий оптимальную влажность окружающей среды с целью стимуляции заживления раны. Кроме того, фармацевтически приемлемое вспомогательное вещество после нанесения способствует адгезии указанных рекомбинантных бактерий в очаге, предпочтительно хронической воспаленной раны или дегенеративного состояния, или опухоли, предпочтительно злокачественной опухоли.
Указанная фармацевтическая композиция предпочтительно дополнительно содержит по меньшей мере одно питательное вещество для указанных рекомбинантных бактерий, причем указанное питательное вещество предпочтительно выбрано из группы, состоящей из углеводов, витаминов, минералов, аминокислот, микроэлементов и их смесей.
Еще предпочтительнее, указанная фармацевтическая композиция дополнительно содержит по меньшей мере один компонент для стабилизации по меньшей мере одного, предпочтительно 1, 2, 3, 4 или более гетерологичного(ых) фактора(ов) и/или рекомбинантных бактерий согласно настоящему изобретению. Указанное стабилизирующее соединение предпочтительно выбрано из группы, состоящей из катионов металлов, предпочтительно двухвалентных катионов металлов, например, Mg2+, Ca2+и их смесей, противомикробных агентов, криопротекторов, ингибиторов протеаз, восстанавливающих агентов, хелатирующих агентов и их смесей.
В предпочтительном варианте реализации рекомбинантные бактерии согласно настоящему изобретению представлены в виде набора согласно настоящему изобретению для применения в медицине, еще предпочтительнее для применения при лечении предпочтительно хронической воспаленной раны или дегенеративного состояния, или для лечения опухоли, предпочтительно злокачественной опухоли, причем указанные рекомбинантные бактерии способны экспрессировать по меньшей мере один гетерологичный фактор под контролем прокариотического хлорид-индуцируемого промотора, причем указанный набор дополнительно содержит по меньшей мере один индуктор, содержащий хлорид-ионы.
Набор предпочтительно предложен в виде комбинированного препарата для раздельного, последовательного или одновременного применения в медицине, еще предпочтительнее для применения при лечении предпочтительно хронической воспаленной раны или дегенеративного состояния, или для лечения опухоли, предпочтительно злокачественной опухоли.
Индуктор, содержащий хлорид-ионы, предпочтительно представлен в форме жидкой, предпочтительно культуральной среды, содержащей хлорид-ионы, еще предпочтительнее вместе с по меньшей мере одним из вышеупомянутых фармацевтически приемлемых вспомогательных веществ.
В предпочтительном варианте реализации рекомбинантные бактерии согласно настоящему изобретению предложены в форме медицинского устройства согласно настоящему изобретению для применения в медицине, еще более предпочтительно для применения при лечении предпочтительно хронической воспаленной раны или дегенеративного состояния, или для лечения опухоли, предпочтительно злокачественной опухоли, причем указанные рекомбинантные бактерии способны экспрессировать по меньшей мере один гетерологичный фактор под контролем прокариотического хлорид-индуцируемого промотора.
Подходящее медицинское устройство предпочтительно дополнительно содержит по меньшей мере одну подложку и/или контейнер для указанных рекомбинантных бактерий, например, систему инкапсуляции клеток и/или микрогранулы.
Подходящее медицинское устройство предпочтительно представляет собой стент, имплантат, ингалятор, систему инкапсуляции или медицинскую повязку.
Фармацевтическая композиция и/или набор и/или медицинское устройство согласно настоящему изобретению предпочтительно содержит указанные рекомбинантные бактерии в растворе, замороженном или высушенном, предпочтительно лиофилизированном или высушенном распылением. Еще предпочтительнее, указанные рекомбинантные бактерии разводят в жидкой, предпочтительно культуральной среде, содержащей хлорид-ионы, перед введением рекомбинантных бактерий и/или фармацевтической композиции и/или набора субъекту.
Рекомбинантные бактерии согласно настоящему изобретению можно приводить в контакт с по меньшей мере одним указанным индуктором, предпочтительно для индукции экспрессии по меньшей мере одного, предпочтительно 1, 2, 3, 4 или более гетерологичного(ых) фактора(ов).
Кроме того, после индукции экспрессии предпочтительно по меньшей мере один, предпочтительно 1, 2, 3, 4 или более гетерологичный(х) фактор(ов) высвобождается(ются) из указанных бактерий.
Указанный по меньшей мере один, предпочтительно, 1, 2, 3, 4 или более гетерологичный(х) фактор(ов) предпочтительно экспрессируются с секреторной сигнальной последовательностью, предпочтительно N-концевым сигнальным пептидом. После экспрессии соответствующего фактора секреторную сигнальную последовательность, предпочтительно N-концевой сигнальный пептид, можно удалить. В качестве альтернативы, указанный первый, второй и/или третий гетерологичные факторы можно экспрессировать в зрелой форме, предпочтительно без секреторной сигнальной последовательности, предпочтительно N-концевого сигнального пептида.
Среда для разведения, содержащая хлорид-ионы и используемая для разведения рекомбинантных бактерий согласно настоящему изобретению, может находиться в форме раствора или дисперсии, например, эмульсии, суспензии, геля, предпочтительно гидрогеля, или коллоидного раствора.
Среда для разведения предпочтительно содержит хлорид-ионы в количестве, достаточном для инициации экспрессии по меньшей мере одного гетерологичного фактора под контролем прокариотического хлорид-индуцируемого промотора.
Подходящие полимеры для получения геля, предпочтительно гидрогеля, известны специалисту в данной области техники и включают природные и/или синтетические полимеры.
Рекомбинантные бактерии согласно настоящему изобретению предпочтительно представлены в количестве, эффективном для лечения и/или облегчения течения заболевания, например, предпочтительно хронической воспаленной раны, или дегенеративного состояния, или опухоли, предпочтительно злокачественной опухоли, у субъекта.
Фармацевтическая композиция и/или набор и/или медицинское устройство согласно настоящему изобретению предпочтительно содержат эффективное количество рекомбинантных бактерий согласно настоящему изобретению.
В предпочтительном варианте реализации настоящего изобретения рекомбинантные бактерии согласно настоящему изобретению и/или фармацевтическая композиция и/или набор и/или медицинское устройство согласно настоящему изобретению предназначены для применения при лечении воспаленной раны, предпочтительно хронической воспаленной раны.
В предпочтительном варианте реализации указанная воспаленная, предпочтительно хроническая воспаленная рана предпочтительно включает обморожения, дерматиты, язвы и их комбинации, еще предпочтительнее - язвы.
Указанная воспаленная рана также может включать воспаленную травму кожи, которая может прогрессировать в хроническое воспалительное состояние.
Обморожение представляет собой медицинское состояние, при котором локализованное поражение кожи и других тканей вызвано охлаждением, и может включать разрушение тканей. Указанное обморожение также может включать ознобыши (ознобление), которые представляют собой поверхностные изъязвления кожи, возникающие в результате воздействия холода и влажности. Повреждение капиллярного русла кожи вызывает покраснение, зуд, воспаление и иногда волдыри. Еще предпочтительнее указанные обморожения представляют собой обморожения 1 степени.
Хронические воспаленные раны известны специалисту в данной области техники и включают, например, хронические венозные язвы, хронические артериальные язвы, хронические диабетические язвы и хронические пролежневые язвы. Указанная хроническая рана предпочтительно представляет собой по меньшей мере одну из хронической венозной язвы, хронической артериальной язвы, хронической пролежневой язвы и хронических стадий их предизъязвления, предпочтительно одну из хронической венозной язвы, хронической артериальной язвы и хронической пролежневой язвы.
Хронические раны встречаются в различных формах и с различной частотой. Хроническая рана не заживает с упорядоченным набором стадий заживления и в прогнозируемые сроки по сравнению с острой раной. Раны, не заживающие в течение 1-3 месяцев или не реагирующие на первоначальное лечение, обычно классифицируются как хронические. В острых ранах существует точный баланс между продукцией и разложением веществ, а также уровнем активации иммунных клеток в микроокружении, что приводит к хорошо контролируемому поэтапному процессу заживления. В хронических ранах этот баланс теряется, что приводит к нарушению и аномальной активации местной иммунной системы. Как правило, хронические раны остаются в одной или более фазах процесса заживления раны, например, в стадии воспаления. Этот тип ран называют хроническими воспаленными ранами.
Хронические раны обычно возникают в результате различных основных заболеваний и медицинских состояний, например, опухоли, диабета (приводящего к диабетической стопе), нарушений кровообращения (приводящих к варикозным язвам), хирургического вмешательства и ожогов. Ишемия (т.е. недостаток кислорода в конечностях), бактериальная инфекция и колонизация, повышение уровня протеолитических ферментов и воспаление являются распространенными патофизиологическими причинами незаживающих ран.
Указанная язва может представлять собой пролежневую язву или трофическую язву. Указанная язва также может представлять собой венозную язву, артериальную язву, диабетическую язву или пролежневую язву. Указанная язва также может находиться на этапе предизъязвления вышеуказанных язв без каких-либо видимых признаков открытой раны кожи. При отсутствии медицинского вмешательства этап предизъязвления может прогрессировать до изъязвления.
Хронические венозные язвы обычно возникают на нижних конечностях и составляют приблизительно 70%-90% хронических ран, поражая главным образом пациентов пожилого возраста.
Еще одной важной причиной хронических воспалительных ран является диабет.Риск ампутации у пациентов, страдающих сахарным диабетом, повышен на 15% по сравнению с общей популяцией вследствие хронических язв. Диабет вызывает невропатию, которая ингибирует ноцицепцию и восприятие боли. Следовательно, пациенты могут не заметить небольшие раны на ногах и ступнях, и, следовательно, не предотвратить инфекцию или повторное повреждение.
Дополнительная проблема заключается в том, что диабет вызывает нарушения иммунной системы и повреждение мелких кровеносных сосудов, что приводит к ухудшению снабжения ткани кислородом. Подавление надлежащей оксигенации тканей значительно увеличивает распространенность хронических воспалительных ран.
Пролежневые язвы, которые также известны как язвы-пролежни или пролежни, могут возникать при диабетическом состоянии или в его отсутствие. Пролежневые язвы представляют собой локализованные повреждения кожи и/или подкожной клетчатки, которые могут возникнуть над выступами костей в результате давления или давления в комбинации со сдвигом или трением.
В настоящее время стандартное терапевтическое лечение хронических воспалительных ран, включая диабетические раны, например, язвы нижних конечностей, сосредоточено прежде всего на борьбе с инфекцией и на стимуляции повторной васкуляризации. Несмотря на применение перечисленных стратегий, частота ампутаций у пациентов, страдающих изъязвлением нижних конечностей, остается неприемлемо высокой.
Кроме того, даже в случаях улучшения или излечения основного заболевания или причины изъязвления, например, сахарного диабета или хронической венозной недостаточности, например, путем регулирования уровня глюкозы в крови или введения лекарственных средств для контроля артериального давления, соответственно, лечение существующих язв по-прежнему может занимать очень много времени.
Следовательно, для решения проблемы отсутствия оптимального неинвазивного способа лечения хронических воспалительных ран, в том числе диабетических ран, например, язв нижних конечностей, крайне необходимы новые стратегии, которые помогут активировать и стимулировать заживление ран у пациентов, страдающих хроническими ранами.
Предпочтительно, в случае воспаленной раны, предпочтительно хронической воспаленной раны, уникальная комбинация факторов, предпочтительно факторов, высвобождаемых указанными бактериями, позволяет осуществлять перепрограммирование указанной хронической воспаленной раны в острую рану, которую затем можно закрыть.
В предпочтительном варианте реализации в случае воспаленной раны, предпочтительно хронической воспаленной раны, рекомбинантные бактерии следует вводить системно, местно и/или путем подкожной инъекции, еще предпочтительнее - местно.
Рекомбинантные бактерии предпочтительно следует местно вводить в воспаленную, предпочтительно хроническую воспаленную рану, подлежащую лечению.
Рекомбинантные бактерии можно вводить местным путем в воспаленную, предпочтительно хроническую воспаленную рану и/или путем подкожной инъекции в непосредственной близости от раны, предпочтительно по краям или в полость воспаленной, предпочтительно хронической воспаленной раны.
Кроме того, прогрессирование предизъязвления до открытой воспаленной раны можно предотвратить путем местного нанесения или подкожной инъекции рекомбинантных бактерий согласно настоящему изобретению вблизи и/или внутрь области предизъязвления.
В предпочтительном варианте реализации в случае опухоли, предпочтительно злокачественной опухоли, рекомбинантные бактерии следует вводить системно, например, путем внутривенной инъекции, или местно, предпочтительно путем внутриопухолевой инъекции и/или путем внутрибрюшинной инъекции.
Рекомбинантные бактерии предпочтительно вводят в опухоль, предпочтительно злокачественную опухоль, путем внутриопухолевой инъекции в опухоль и/или путем инъекции вблизи опухоли и/или путем внутрибрюшинной инъекции рекомбинантных бактерий согласно настоящему изобретению.
В предпочтительном варианте реализации указанные рекомбинантные бактерии по п.1 содержат по меньшей мере одну нуклеотидную последовательность, кодирующую первый гетерологичный фактор, по меньшей мере одну нуклеотидную последовательность, кодирующую второй гетерологичный фактор, и по меньшей мере одну нуклеотидную последовательность, кодирующую третий гетерологичный фактор, при условии, что указанный первый фактор, указанный второй фактор и указанный третий фактор функционально различаются,
причем указанный первый фактор представляет собой фактор роста, указанный второй фактор выбран из группы, состоящей из M2-поляризующих факторов, а указанный третий фактор выбран из группы, состоящей из M2-поляризующих факторов и факторов роста.
В предпочтительном варианте реализации указанный второй гетерологичный фактор и указанный третий гетерологичный фактор выбраны из группы, состоящей из М2-поляризующих факторов, причем указанный второй фактор и указанный третий фактор представляют собой функционально различные М2-поляризующие факторы.
Иными словами, указанный второй гетерологичный фактор представляет собой первый М2-поляризующий фактор и указанный третий гетерологичный фактор представляет собой второй М2-поляризующий фактор, который функционально отличается от указанного первого М2-поляризующего фактора.
Предпочтительно указанный первый М2-поляризующий фактор представляет собой М2-поляризующий фактор, выбранный из группы, состоящей из колониестимулирующего фактора 1 (КСФ-1), интерлейкина 34 (ИЛ-34), интерлейкина 4 (ИЛ-4) и интерлейкина 13 (ИЛ-13), и указанный второй М2-поляризующий фактор представляет собой М2-поляризующий фактор, выбранный из группы, состоящей из колониестимулирующего фактора 1 (КСФ-1), интерлейкина 34 (ИЛ-34), интерлейкина 4 (ИЛ-4), интерлейкина 10 (ИЛ-10) и интерлейкина 13 (ИЛ-13), при условии, что указанный второй М2-поляризующий фактор функционально отличается от указанного первого М2-поляризующего фактора.
Еще предпочтительнее, указанный первый М2-поляризующий фактор представляет собой лиганд рецептора колониестимулирующего фактора 1 (CSF1R), а указанный второй М2-поляризующий фактор представляет собой М2-поляризующий фактор, выбранный из группы, состоящей из интерлейкина 4 (ИЛ-4), интерлейкина 10 (ИЛ-10), интерлейкина 13 (ИЛ-13), их функциональных аналогов, их биоаналогов и их смесей.
Другие предпочтительные комбинации M2-поляризующих факторов представляют собой:
• колониестимулирующий фактор 1 и интерлейкин-4,
• колониестимулирующий фактор 1 и интерлейкин-13,
• колониестимулирующий фактор 1 и интерлейкин-10,
• интерлейкин-34 и интерлейкин-4,
• интерлейкин-34 и интерлейкин-13,
• интерлейкин-34 и интерлейкин-10,
• интерлейкин-4 и интерлейкин-10 или
• интерлейкин-13 и интерлейкин-10.
Вышеупомянутые дополнительные предпочтительные комбинации М2-поляризующих факторов объединяют с по меньшей мере одним из указанных выше факторов роста, предпочтительно с фактором роста, выбранным из группы, состоящей из фактора роста фибробластов 1, фактора роста фибробластов 2, фактора роста фибробластов 7, фактора роста фибробластов 10, фактора роста гепатоцитов, трансформирующего фактора роста бета (ТФР-бета), эпидермального фактора роста (ЭФР), гепарин-связывающего ЭФР-подобного фактора роста (ГС-ЭФР), трансформирующего фактора роста альфа (ТФР-α) и фактора роста тромбоцитов ВВ.
Указанный первый, второй и третий гетерологичные факторы предпочтительно представляют собой комбинацию
• фактора роста фибробластов 2, колониестимулирующего фактора 1 и интерлейкина-4,
• фактора роста фибробластов 2, интерлейкина-34 и интерлейкина-4,
• фактора роста фибробластов 2, колониестимулирующего фактора 1 и интерлейкина-13,
• фактора роста фибробластов 2, интерлейкина-34 и интерлейкина-13,
• фактора роста фибробластов 2, колониестимулирующего фактора 1 и интерлейкина-10,
• фактора роста фибробластов 2, интерлейкина-34 и интерлейкина-10,
• фактора роста фибробластов 7, колониестимулирующего фактора 1 и интерлейкина-4,
• фактора роста фибробластов 7, интерлейкина-34 и интерлейкина-4,
• фактора роста фибробластов 7, колониестимулирующего фактора 1 и интерлейкина-13,
• фактора роста фибробластов 7, интерлейкина-34 и интерлейкина-13,
• фактора роста фибробластов 7, колониестимулирующего фактора 1 и интерлейкина-10,
• фактора роста фибробластов 7, интерлейкина-34 и интерлейкина-10,
• трансформирующего фактора роста бета, колониестимулирующего фактора 1 и интерлейкина-4,
• трансформирующего фактора роста бета, интерлейкина-34 и интерлейкина-4,
• трансформирующего фактора роста бета, колониестимулирующего фактора 1 и интерлейкина-13,
• трансформирующего фактора роста бета, интерлейкина-34 и интерлейкина-13
• трансформирующего фактора роста бета, колониестимулирующего фактора 1 и интерлейкина-10,
• трансформирующего фактора роста бета, интерлейкина-34 и интерлейкина-10,
• трансформирующего фактора роста альфа, колониестимулирующего фактора-1 и интерлейкина-4,
• трансформирующего фактора роста альфа, интерлейкина-34 и интерлейкина-4,
• трансформирующего фактора роста альфа, колониестимулирующего фактора-1 и интерлейкина-13,
• трансформирующего фактора роста альфа, интерлейкина-34 и интерлейкина-13
• трансформирующего фактора роста альфа, колониестимулирующего фактора-1 и интерлейкина-10,
• трансформирующего фактора роста альфа, интерлейкина-34 и интерлейкина-10
• фактора роста тромбоцитов ВВ, колониестимулирующего фактора 1 и интерлейкина-4,
• фактора роста тромбоцитов ВВ, интерлейкина-34 и интерлейкина-4,
• фактора роста тромбоцитов ВВ, колониестимулирующего фактора 1 и интерлейкина-13,
• фактора роста тромбоцитов ВВ, интерлейкина-34 и интерлейкина-13
• фактора роста тромбоцитов ВВ, колониестимулирующего фактора 1 и интерлейкина-10, или
• фактора роста тромбоцитов ВВ, интерлейкина-34 и интерлейкина-10.
Также указанный первый, второй и третий гетерологичные факторы предпочтительно представляют собой комбинацию фактора роста фибробластов 2, колониестимулирующего фактора 1 и интерлейкина 4, их функциональных аналогов и биологических аналогов.
Дополнительная стимуляция М2-поляризации неполяризованных макрофагов, М1-поляризованных макрофагов, а также недифференцированных моноцитов и других клеток-предшественников макрофагов предпочтительно достигается путем высвобождения двух или более М2-поляризующих факторов из бактерий согласно настоящему изобретению.
В альтернативном варианте реализации указанный первый фактор представляет собой первый фактор роста, выбранный из группы, состоящей из вышеупомянутых факторов роста, а указанный третий фактор представляет собой второй фактор роста, выбранный из группы, состоящей из вышеуказанных факторов роста, который функционально отличается от указанного первого фактора роста. Предпочтительно указанный второй фактор роста представляет собой трансформирующий фактор роста бета (ТФР-бета).
Другие предпочтительные комбинации факторов роста включают:
• фактор роста фибробластов 1 и трансформирующий фактор роста бета,
• фактор роста фибробластов 2 и трансформирующий фактор роста бета,
• фактор роста фибробластов 7 и трансформирующий фактор роста бета,
• фактор роста фибробластов 10 и трансформирующий фактор роста бета,
• фактор роста тромбоцитов ВВ и трансформирующий фактор роста бета,
• трансформирующий фактор роста альфа и трансформирующий фактор роста бета,
• эпидермальный фактор роста и трансформирующий фактор роста бета,
• связывающий гепарин ЭФР-подобный фактор роста и трансформирующий фактор роста бета,
• фактор роста гепатоцитов и трансформирующий фактор роста бета, или
• фактор роста эндотелия сосудов А и трансформирующий фактор роста бета.
Вышеупомянутые дополнительные предпочтительные комбинации факторов роста предпочтительно объединяют с М2-поляризующим фактором, выбранным из группы, состоящей из колониестимулирующего фактора 1 (КСФ-1), интерлейкина-34 (ИЛ-34), интерлейкина-4 (ИЛ-4), интерлейкина-10 (ИЛ-10), интерлейкина-13 (ИЛ-13), а также их смесей, предпочтительно колониестимулирующего фактора 1 (КСФ-1), интерлейкина-34 (ИЛ-34), интерлейкина-4 (ИЛ-4), интерлейкина-13 (ИЛ-13), а также их смесей.
В еще одном предпочтительном варианте реализации настоящего изобретения рекомбинантные бактерии согласно настоящему изобретению и/или фармацевтическая композиция и/или набор и/или медицинское устройство согласно настоящему изобретению предназначены для применения при лечении опухоли, предпочтительно злокачественной опухоли, предпочтительно перитонеального рака, еще предпочтительнее перитонеального карциноматоза, еще предпочтительнее метастатического рака яичников, карциномы ободочной и прямой кишки, рака поджелудочной железы, рака желудка, гепатоцеллюлярной карциномы, карциномы желчного пузыря, почечно-клеточной карциномы, переходно-клеточной карциномы, рака шейки матки, рака эндометрия и/или экстраабдоминальных состояний, например, рака молочной железы, рака легкого и злокачественной меланомы.
Опухоль представляет собой аномальный рост клеток/ткани, не обладающий физиологической функцией и возникающий в результате неконтролируемой, как правило, быстрой клеточной пролиферации. Опухоли могут быть доброкачественными или злокачественными. Названия различных видов опухолей происходят от видов клеток, которые их образуют. Примерами солидных опухолей являются саркомы, карциномы и лимфомы.
Перитонеальный рак можно разделить на две категории: первичный перитонеальный рак, причем первичная опухоль возникает в брюшине, и перитонеальный карциноматоз (ПК), определяемый как внутрибрюшинная диссеминация любой опухоли, возникающей в другом месте.
Перитонеальный карциноматоз является одним из наиболее распространенных диффузных заболеваний брюшины, наиболее распространенной причиной которого является рак яичников (46%), за которым следует карцинома ободочной и прямой кишки (31%), рак поджелудочной железы, рак желудка и другие злокачественные новообразования, включая гепатоцеллюлярную карциному, карциному желчного пузыря, почечно-клеточную карциному, переходно-клеточную карциному, рак эндометрия, рак шейки матки и рак неизвестной первичной локализации. Экстраабдоминальные состояния, например, рак молочной железы, рак легких и злокачественная меланома, могут вовлекать брюшную полость за счет гематогенной генерализации (Singh, S. et al. "Peritoneal Carcinomatosis: Pictorial Review of Computed Tomography Findings", International Journal of Advanced Research (2016), Volume 4, Issue 7, pages 735 to 748; doi:10.21474/IJAR01/936).
У 10%-35% пациентов с рецидивирующим раком оболочной и прямой кишки (CRC) и у до 50% пациентов с рецидивирующим раком желудка (РЖ) рецидив опухоли ограничивается брюшной полостью; (Coccolini, F. et al., World J Gastroenterol. 2013; 19(41): pages 6979 to 6994, doi: 10.3748/wjg.v19.i41.6979).
Метастазы в брюшную полость также могут возникать из-за отдаленного метастазирования внебрюшинных раковых опухолей, например, плевральной мезотелиомы, рака молочной железы и рака легких. Удержание опухолевых клеток в диафрагмальных или абдоминальных лимфатических протоках вызывает обструкцию лимфатического дренажа и уменьшает отток перитонеальной жидкости, что приводит к образованию карциноматоза и/или асцита.
Иммунная система предпочтительно играет важную роль в патофизиологии рака. Многие опухоли сильно инфильтрированы различными типами иммунных клеток. Однако состав этих клеток в опухоли может различаться. Ключевую роль в прогрессировании заболевания играют как клетки адаптивной иммунной системы, например, цитотоксические Т-клетки и Т-регуляторные клетки, так и клетки врожденной иммунной системы, например, макрофаги, дендритные клетки и естественные киллеры (NK). Эти иммунные клетки, по-видимому, связаны с ростом, инвазией и метастазированием опухоли.
В частности, рост опухоли сопровождался рекрутингом и накоплением макрофагов, причем эти клетки приобретают функции, поддерживающие рост опухоли и диссеминацию раковых клеток из первичной опухоли. Кроме того, имеются клинические данные, демонстрирующие строгую корреляцию между увеличением количества макрофагов с прогрессированием заболевания и плохим прогнозом. Поскольку макрофаги способны продуцировать широкий спектр различных цитокинов (Th1- и Th2-родственные цитокины), они играют ключевую роль в формировании иммунологического микроокружения.
Макрофаги можно разделить на фенотипы M1 (классически активированные) или M2 (альтернативно активированные). Макрофаги M1 демонстрируют провоспалительный фенотип и характеризуются экспрессией провоспалительных цитокинов, например, ИЛ-1, ИЛ-6, ФНО-α и ИФН-γ. Моноциты могут дифференцироваться в макрофаги типа М1 за счет компонентов бактерий, например, липополисахарида (LPS), и интерферона-γ (ИФН-γ).
Напротив, макрофаги M2 характеризуются иммуносупрессивным фенотипом и высвобождают факторы, способствующие Th2-ответу, например, ИЛ-10, ТФР-β и ФРЭС.
Макрофаги в опухолях, которые также называются опухоль-ассоциированными макрофагами (TAM), часто экспрессируют многие гены, типичные для фенотипа M2. Химические аттрактанты, секретируемые опухолевыми и стромальными клетками, рекрутируют моноциты в опухолевую ткань и стимулируют их дифференцировку в опухоль-ассоциированные М2-макрофаги, тем самым поддерживая рост и метастазирование опухоли.
После введения рекомбинантных бактерий согласно настоящему изобретению в опухоль рекомбинантные бактерии продуцируют и высвобождают терапевтический(е) белок(белки) в опухолевую среду.
Высвобождаемый(е) терапевтический(е) белок(белки) предпочтительно усиливает и стимулирует TH1-иммунный ответ у этих иммунных клеток, что затем приводит к снижению продукции фактора роста эндотелия сосудов (ФРЭС).
Исследования показывают, что экспрессия ФРЭС и его рецепторов на макрофагах играет роль в модуляции иммунной системы и ее микроокружения. В частности, опухоль-ассоциированные М2-макрофаги экспрессируют большое количество ФРЭС, поддерживая ангиогенез и иммуномодуляцию.
Кроме того, описано, что ФРЭС ингибирует дифференцировку дендритных клеток. И наоборот, показано, что ФРЭС ингибирует развитие Т-клеток, тем самым способствуя опухоль-индуцированной иммуносупрессии. F
Снижение продукции ФРЭС предпочтительно дополнительно поддерживает противоопухолевый эффект за счет предотвращения иммуносупрессии и ангиогенеза.
В предпочтительном варианте реализации указанные рекомбинантные бактерии по п.1 содержат по меньшей мере одну нуклеотидную последовательность, кодирующую по меньшей мере один гетерологичный фактор, предпочтительно выбранный из группы, состоящей из активаторов клеточных рецепторов, например, глюкокортикоид-индуцируемый TNFR-родственный белок (GITR), член 9 суперсемейства рецепторов фактора некроза опухолей (TNFRSF9), также известный как 4-1BB, кластер дифференцировки 40 (CD40), член 4 суперсемейства рецепторов фактора некроза опухолей (TNFRSF4), также известный как CD134 или рецептор OX40, и их комбинации, активаторы костимулирующих рецепторов, ингибиторы контрольных точек иммунного ответа, например, белок 4, ассоциированный с цитотоксическими Т-лимфоцитами (CTLA-4), белок программируемой гибели клеток 1 (PD-1), лиганд 1 белка программируемой гибели клеток (PD-1L), лиганд 2 белка программируемой гибели клеток (PD-1L2) и их комбинации, рецепторы химерных антигенов, например, CAR-T, и их комбинации, ферменты-активаторы пролекарств, например, HSV-tk, цитидиндезаминаза и их комбинации, цитокины, хемокины, факторы роста, лиганды рецепторов-ловушек, антитела, растворимые рецепторы, рецепторы-ловушки и их комбинации, предпочтительно гранулоцитарно-макрофагальный колониестимулирующий фактор (ГМКСФ), интерферон-альфа, предпочтительно интерферон-альфа 2 (ИФНА2), интерферон-бета, нтерферон-гамма, гранулоцитарный колониестимулрующий фактор (ГКСФ), интерлейкин-2 (ИЛ-2), интерлейкин-6 (ИЛ-6), интерлейкин-7 (ИЛ-7), интерлейкин-8 (ИЛ-8), интерлейкин-12 (ИЛ-12), интерлейкин-15 (ИЛ-15), интерлейкин-17 (ИЛ-17), интерлейкин-18 (ИЛ-18), интерлейкин-21 (ИЛ-21), интерлейкин-23 (ИЛ-23), интерлейкин-24 (ИЛ-24), интерлейкин-32 (ИЛ-32) и их комбинации.
Последовательности
SEQ ID NO: 1 соответствует нуклеотидной последовательности экспрессирующей плазмиды pAUC1010, которая также показана на фигуре 1. SEQ ID NO: 2 соответствует нуклеотидной последовательности промотора PgadC, используемой в разделе "Примеры", которая также показана на фигуре 2b. SEQ ID NO: 3 соответствует аминокислотной последовательности сигнальной последовательности Usp45 L. lactis, которая также показана на фигуре 3. SEQ ID NO: 4 соответствует 3’-концу 16S РНК L. lactis, который также показан на фигуре 4.
SEQ ID NO: 5 соответствует аминокислотной последовательности зрелой формы чФРФ-2-155, которая также показана на фигуре 5а. SEQ ID NO: 6 соответствует аминокислотной последовательности варианта чФРФ-2-153, используемого в разделе "Примеры, которая также показана на фигуре 5b. SEQ ID NO: 7 соответствует аминокислотной последовательности рекомбинантного белка-предшественника чФРФ-2-153, используемого в разделе "Примеры", которая также показана на фигуре 5c.
SEQ ID NO: 8 соответствует аминокислотной последовательности зрелой формы чИЛ-4, которая также показана на фигуре 6а. SEQ ID NO: 9 соответствует аминокислотной последовательности варианта чИЛ-4, используемого в разделе "Примеры", которая также показана на фигуре 6b. SEQ ID NO: 10 соответствует аминокислотной последовательности рекомбинантного белка-предшественника чИЛ-4, используемого в разделе "Примеры", которая также показана на фигуре 6c.
SEQ ID NO: 11 соответствует аминокислотной последовательности зрелой формы чКСФ-1, которая также показана на фигуре 7а. SEQ ID NO: 12 соответствует аминокислотной последовательности варианта чКСФ-1, используемого в разделе "Примеры", которая также показана на фигуре 7b. SEQ ID NO: 13 соответствует аминокислотной последовательности рекомбинантного белка-предшественника чКСФ-1, используемого в разделе "Примеры", которая также показана на фигуре 7c.
SEQ ID NO: 14 соответствует нуклеотидной последовательности синтетического конструкта CFI, используемого в разделе "Примеры", которая также показана на фигуре 8b. SEQ ID NO: 15 соответствует нуклеотидной последовательности экспрессирующей плазмиды pC-CFI, используемой в разделе "Примеры", которая также показана на фигуре 9b.
SEQ ID NO: 16 соответствует аминокислотной последовательности зрелой формы мИЛ-18, которая также показана на фигуре 10A. SEQ ID NO: 17 соответствует аминокислотной последовательности варианта мИЛ-18, используемого в разделе "Примеры", которая также показана на фигуре 10b. SEQ ID NO: 18 соответствует аминокислотной последовательности рекомбинантного белка-предшественника мИЛ-18, используемого в разделе "Примеры", которая также показана на фигуре 10C.
SEQ ID NO: 19 соответствует аминокислотной последовательности зрелой формы мГМКСФ, которая также показана на фигуре 10a. SEQ ID NO: 20 соответствует аминокислотной последовательности варианта мГМКСФ, используемого в разделе "Примеры", которая также показана на фигуре 10b. SEQ ID NO: 21 соответствует аминокислотной последовательности рекомбинантного белка-предшественника мГМКСФ, используемого в разделе "Примеры", которая также показана на фигуре 10c.
SEQ ID NO: 22 соответствует нуклеотидной последовательности синтетического конструкта mEG, используемого в разделе "Примеры", которая также показана на фигуре 12b. SEQ ID NO: 23 соответствует нуклеотидной последовательности экспрессирующей плазмиды pC-mEG, используемой в разделе "Примеры", которая также показана на фигуре 12 с.
SEQ ID NO: 24 соответствует аминокислотной последовательности зрелой формы мИЛ-12-бета, которая также показана на фигуре 13A. SEQ ID NO: 25 соответствует аминокислотной последовательности зрелой формы изоформы 2 мИЛ-12-альфа, которая также показана на фигуре 13b. SEQ ID NO: 26 соответствует аминокислотной последовательности зрелой формы рекомбинантного гибридного белка интерлейкина-12 мыши, используемой в разделе "Примеры", которая также показана на фигуре 13c. SEQ ID NO: 27 соответствует аминокислотной последовательности рекомбинантного белка-предшественника интерлейкина-12 мыши, используемого в разделе "Примеры", которая также показана на фигуре 13d.
SEQ ID NO: 28 соответствует аминокислотной последовательности зрелой формы интерферона-альфа 2 мыши, которая также показана на фигуре 14a. SEQ ID NO: 29 соответствует аминокислотной последовательности варианта интерферона-альфа-2 мыши, используемого в разделе "Примеры", которая также показана на фигуре 14b. SEQ ID NO: 30 соответствует аминокислотной последовательности рекомбинантного белка-предшественника интерферона-альфа-2 мыши, используемого в разделе "Примеры", которая также показана на фигуре 14c.
SEQ ID NO: 31 соответствует нуклеотидной последовательности синтетического конструкта mTEA, используемого в разделе "Примеры", которая также показана на фигуре 15а. SEQ ID NO: 32 соответствует нуклеотидной последовательности экспрессирующей плазмиды pC-mTEA, используемой в разделе "Примеры", которая также показана на фигуре 15c.
SEQ ID NO: 33 соответствует нуклеотидной последовательности синтетического конструкта mGTE, используемого в разделе "Примеры", которая также показана на фигуре 16а. SEQ ID NO: 34 соответствует нуклеотидной последовательности экспрессирующей плазмиды pC-mGTE, используемой в разделе "Примеры", которая также показана на фигуре 16c.
SEQ ID NO: 35 соответствует нуклеотидной последовательности синтетического конструкта mCherry, используемого в разделе "Примеры", которая также показана на фигуре 17b. SEQ ID NO: 36 соответствует нуклеотидной последовательности экспрессирующей плазмиды pC-mCherry, используемой в разделе "Примеры", которая также показана на фигуре 18b.
Следующие фигуры и примеры приведены исключительно для иллюстративных целей. Не следует считать, что настоящее изобретение ограничено следующими примерами:
Фигуры:
На фигурах используются следующие сокращения: «alr» обозначает ген аланинрацемазы, используемый для роста штамма-хозяина в отсутствие d-аланина; «T» обозначает последовательность терминатора; «-35» и «-10» обозначают элемент -35 и элемент -10 промотора, соответственно; «IR» обозначает инвертированный повтор; «repC» и «repA» обозначают прокариотические гены, необходимые для репликации плазмиды в бактериальной клетке, «gadR» обозначает ген gadR, «RBS» обозначает сайт связывания рибосом указанного гена, например, гена гамма-субъединицы АТФ-синтазы (atpG) и/или гена галактозид-O-ацетилтрансферазы (lacA); «ssUsp45» обозначает сигнал секреции Usp45;
На фигуре 1a показана карта экспрессирующей плазмиды pAUC1010. Соответствующая нуклеотидная последовательность показана на фигуре 1b.
На фигуре 2а показано схематическое изображение хлорид-индуцируемого промотора PgadC, включая регуляторные элементы. Соответствующая нуклеотидная последовательность показана на фигуре 2b, которая включает область промотора PgadC, включая регуляторные элементы, ген gadR, сайт связывания рибосом (RBS) и стартовый кодон гена gadC.
На фигуре 3 показана аминокислотная последовательность сигнала секреции белка Usp45 Lactococcus.
На фигуре 4 показана нуклеотидная последовательность 3'-конца 16S рРНК L. lactis.
На фигуре 5а показана аминокислотная последовательность зрелой формы ФРФ-2-155 человека. Аминокислотная последовательность варианта чФРФ2-153, используемого в разделе "Примеры", показана на фигуре 5b. Аминокислотная последовательность рекомбинантного белка-предшественника чФРФ-2-153, используемого в разделе "Примеры", показана на фигуре 5 с.
На фигуре 6а показана аминокислотная последовательность зрелой формы ИЛ-4 человека. Аминокислотная последовательность варианта чИЛ-4, используемого в разделе "Примеры", показана на фигуре 6b. Аминокислотная последовательность рекомбинантного белка-предшественника чИЛ-4, используемого в разделе "Примеры", показана на фигуре 6c.
На фигуре 7а показана аминокислотная последовательность зрелой формы КСФ-1 человека. Аминокислотная последовательность варианта чКСФ-1, используемого в разделе "Примеры", показана на фигуре 7b. Аминокислотная последовательность рекомбинантного белка-предшественника чКСФ-1, используемого в разделе "Примеры", показана на фигуре 7 с.
На фигуре 8а показано схематическое представление конструкта CFI, синтезированного de novo и используемого в разделе "Примеры". Соответствующая нуклеотидная последовательность конструкта CFI, синтезированного de novo, показана на фигуре 8b. Нуклеотидная последовательность экспрессирующей плазмиды под названием pC-CFI показана на фигуре 9b. Схематическое представление экспрессирующей плазмиды pC-CFI представлено на фигуре 9а.
На фигуре 10а показана аминокислотная последовательность зрелой формы ИЛ-18 мыши. Аминокислотная последовательность варианта мИЛ-18, используемого в разделе "Примеры", показана на фигуре 10b. Аминокислотная последовательность рекомбинантного белка-предшественника мИЛ-18, используемого в разделе "Примеры", показана на фигуре 10 с.
На фигуре 11а показана аминокислотная последовательность зрелой формы ГМКСФ мыши. Аминокислотная последовательность варианта мГМКСФ, используемого в разделе "Примеры", показана на фигуре 11b. Аминокислотная последовательность рекомбинантного белка-предшественника мГМКСФ, используемого в разделе "Примеры", показана на фигуре 11 с.
На фигуре 12а показана нуклеотидная последовательность синтетического конструкта mEG, используемого в разделе "Примеры". Нуклеотидная последовательность экспрессирующей плазмиды, обозначенной как pC-mEG, приведена на фигуре 12c, а схематическое изображение соответствующей экспрессирующей плазмиды pC-mEG, используемой в разделе "Примеры", приведено на фигуре 12b.
На фигуре 13а показана аминокислотная последовательность зрелой формы бета-субъединицы ИЛ-12 мыши. Аминокислотная последовательность изоформы 2 зрелой альфа-субъединицы интерлейкина-12 показана на фигуре 13b. Аминокислотная последовательность зрелой формы рекомбинантного гибридного белка интерлейкина-12, используемого в разделе "Примеры", показана на фигуре 13 с.Аминокислотная последовательность рекомбинантного белка-предшественника мИЛ-12, используемого в разделе "Примеры", показана на фигуре 13d.
На фигуре 14а показана аминокислотная последовательность зрелого ИФНa2 мыши. Аминокислотная последовательность варианта мИФНa2, используемого в разделе "Примеры", показана на фигуре 14b. Аминокислотная последовательность синтетического белка-предшественника мИФНa2, используемого в разделе "Примеры", показана на фигуре 14 с.
На фигуре 15а показана нуклеотидная последовательность синтетического конструкта mTEA, используемого в разделе "Примеры". Нуклеотидная последовательность экспрессирующей плазмиды, обозначенной как pC-mTEA, показана на фигуре 15 с.Схематическое изображение экспрессирующей плазмиды pC-mTEA представлено на фигуре 15b.
На фигуре 16а показана нуклеотидная последовательность синтетического конструкта mGTE, используемого в разделе "Примеры". Нуклеотидная последовательность экспрессирующей плазмиды, обозначенной как pC-mGTE, показана на фигуре 16c. Схематическое представление соответствующей экспрессирующей плазмиды pC-mEG, используемой в разделе "Примеры", представлено на фигуре 16b.
На фигуре 17а показано схематическое изображение синтетического конструкта mCherry, используемого в разделе "Примеры". Соответствующая нуклеотидная последовательность синтетического конструкта mCherry показана на фигуре 17b.
Нуклеотидная последовательность экспрессирующей плазмиды, обозначенной как pC-mCherry, используемой в разделе "Примеры", показана на фигуре 18b. Схематическое представление экспрессирующей плазмиды pC-mCherry представлено на фигуре 18а.
На фигуре 19а показано сравнение кривых роста L. lactis NZ1330 (pC-mCherry) после индукции экспрессии гена mCherry 100 мМ NaCl ("L. lactis NZ1330::pC-mCherry+NaCl") и без индукции ("L. lactis NZ1330::pC-mCherry+mq"), каждая из которых получена в примере 3 путем измерения оптической плотности при длине волны 600 нм (ОП600) в указанные моменты времени (T).
На фигуре 19b показано сравнение флуоресценции mCherry у L. lactis NZ1330 (pC-mCherry) после индукции экспрессии гена mCherry 100 мМ NaCl (“NZ1330::pC-mCherry+NaCl”) и без индукции (“NZ1330::pC-mCherry+MQ”) в искусственных единицах, измеренных в условиях, описанных в примере 3, в указанные моменты времени в минутах.
На фигуре 20а показан анализ методом вестерн-блоттинга рекомбинантных бактерий, обозначенных как AUP1602-C, экспрессирующих КСФ-1 человека, ФРФ-2 человека и ИЛ-4 человека с экспрессирующей плазмиды pC-CFI, полученной в примере 1.4. «антитело против КСФ-1», «антитело против ФРФ-2» и «антитело против ИЛ-4» обозначают первичное антитело, используемое в примере 3 для обнаружения экспрессии КСФ-1 человека, ФРФ-2 человека и ИЛ-4 человека, соответственно.
На фигуре 20b и фигуре 20c показан анализ методом вестерн-блоттинга рекомбинантных бактерий, обозначенных как AUP5563-C, экспрессирующих ИЛ-12 мыши, ИЛ-18 мыши и ГМКСФ мыши с экспрессирующей плазмиды pC-mGTE, полученной в примере 1.7. «антитело против ГМКСФ» и «антитело против ИЛ-18» обозначают первичное антитело, используемое в примере 3 для обнаружения экспрессии ГМКСФ мыши и ИЛ-18 мыши, соответственно.
На фигуре 20d показан анализ методом вестерн-блоттинга рекомбинантных бактерий, обозначенных как AUP555m-C, экспрессирующих ИЛ-12 мыши, ИЛ-18 мыши и ИФНa мыши с экспрессирующей плазмиды pC-mTEA, полученной в примере 1.6, и AUP5563-C, экспрессирующих ИЛ-12 мыши, ИЛ-18 мыши и ГМКСФ мыши с экспрессирующей плазмиды pC-mGTE, полученной в примере 1.7. «антитело против ИЛ-12» обозначает первичное антитело, используемое в примере 3 для обнаружения экспрессии ИЛ-12 мыши.
На фигуре 21 показана флуоресцентная визуализация мышей BALB/c с индуцированными опухолями через 48 часов после внутрибрюшинной инъекции рекомбинантного L. lactis, содержащего конструкт AUC1000 (pC-mCherry) ("PGAD-mCherry"), а также контрольных бактерий без экспрессирующей плазмиды ("L. lactis (контроль)") в условиях, описанных в примере 4. Синие круги указывают на положение опухоли
На фигуре 22 показана средняя процентная площадь раны для всех экспериментальных групп в экспериментах по закрытию раны, описанных в примере 5.
На фигуре 23 представлен средний процент закрытия раны для всех экспериментальных групп в экспериментах по закрытию раны, описанных в примере 5.
На фигуре 24 показан % ран, реагирующих на лечение, для каждой экспериментальной группы в день 1 экспериментов по закрытию раны, описанных в примере 5.
На фигурах 25a-27b показаны описанные в примере 6 результаты обнаружения ФРФ-2 человека, ИЛ-4 человека и КСФ-1 человека в раневых жидкостях мышей, получавших лечение в экспериментах по закрытию раны, описанных в примере 5.
На фигурах 28a-28c показаны описанные в примере 7 результаты измерений относительного объема опухоли контрольных мышей, получавших среду-носитель, мышей, получавших AUP5563-C4, и контрольных мышей, получавших антитело против m-CTLA-4, в указанные моменты времени.
На фигуре 29 показана кривая выживаемости мышей C57BL76, получавших в примере 8 комбинацию лекарственных продуктов AUP2059 (мИЛ-18/мГМКСФ) и AUP5551-C (мИЛ-12/мИЛ-18/мИФНa2b), каждая из которых была получена в примере 3, и контрольных мышей, получавших среду-носитель.
Примеры:
I) Общие экспериментальные процедуры:
Если не указано иное, эксперименты в разделе "Примеры" выполняли в соответствии с протоколами производителя аналитических систем. Если не указано иное, указанные химические вещества приобретали в Sigma-Aldrich Chemie Gmbh (Мюнхен, Германия), Merck KGaA (Дармштадт, Германия), Thermo Fisher Scientific Inc. (Валтман, штат Массачусетс, США) или Becton, Dickinson and Company (Франклин-Лейкс, штат Нью-Джерси, США).
I.1 Ростовые среды
Для разных целей клетки выращивали в различных средах.
Для общих процедур клонирования использовали среду М17 (Oxoid Deutschland GmbH, Везел, Германия), содержащую 1 мас.% глюкозы или лактозы, соответственно.
Штаммы E.coli выращивали в среде TY. Использовали следующую рецептуру среды TY:
1 масс.% триптона
0,5 масс.% дрожжевого экстракта
0,5 масс.% NaCl
Для различных способов ферментации и других функциональных экспериментов по исследованию роста использовали среду IM1, не содержащую ингредиентов животного происхождения. Лактозу, единственный оставшийся ингредиент животного происхождения, можно получить как реагент фармацевтического качества.
Использовали следующую рецептуру среды IM1:
1 масс.% лактозы
2 масс.% Na-β-глицерофосфата
1,5% масс. соевого пептона
1 масс.% дрожжевого экстракта
1 мМ MgSO4 × 7 H2O
0,1 мМ MnSO4× 4 H2O
рН=6,7
Стерилизация: 110°С, 15 мин.
Во время ферментации буфер (например, Na-β-глицерофосфат) не добавляли, поскольку рН автоматически регулировали с помощью 2,5 М NaOH. Указанный буфер нейтрализовал полученный лактат и позволял культуре достичь плотности клеток ОП600=10 - 15.
Для роста штаммов L. lactis NZ1330 и NZ9130 к среде добавляли D-аланин до конечной концентрации 200 мкг/мл.
I.2 Бактериальные штаммы
Использовали следующие доступные для приобретения бактериальные штаммы. Штаммы Lactococcus lactis NZ3900 и NZ1330 получили в MoBiTec GmbH (Геттинген, Германия).
Штаммы L. lactis NZ1330 содержали делецию гена, кодирующего аланинрацемазу (Δalr). Делеция гена alr приводила к ауксотрофии незаменимого компонента - D-аланина. Соответствующий штамм не способен расти на средах без D-аланина в отсутствие гена alr на плазмиде.
I.3 Методики молекулярного клонирования
Для молекулярного клонирования использовали стандартные методики, например, описанные в Green and Sambrook (2012): “Molecular cloning: a laboratory manual”, fourth edition, Cold Spring Harbour Laboratory Press (Cold Spring Harbor, NY, US).
Различные синтетические конструкты ДНК получали с помощью BaseClear (Лейден, Нидерланды). Конструкты получали в виде очищенных плазмид, а также клонов в E.coli.
Плазмидные ДНК выделяли с использованием стандартного выделения ДНК в соответствии с Birnboim, H.C. and Doly, J. (1979). Синтетические генные конструкты вырезали из плазмид с использованием выбранных ферментов рестрикции, очищали и лигировали в соответствующую целевую плазмиду. Лигирование выполняли с использованием мастер-микса с лигазой Anza T4 (ThermoFischer Scientific Inc.) в соответствии с прилагаемыми протоколами.
Различные смеси для лигирования трансформировали с помощью электропорации в выбранные штаммы L. lactis (L. lactis NZ1330 или L. lactis NZ 9130) и высевали на соответствующие среды.
I.4 Подготовка электрокомпетентных клеток штаммов и электропорация
Электрокомпетентные клетки получали в соответствии со следующим протоколом. L. lactis NZ1330 и NZ9130 выращивали в течение ночи при 30 °C в 10 мл среды SMGG, которую использовали для инокуляции 100 мл среды SMGG.
Клетки выращивали до достижения ОП600 ~ 0,5. Клетки трижды промывали ледяным буфером для промывки и ресуспендировали в 1 мл буфера для промывки. Аликвоты по 40 мкл хранили при -80 °C. Электрокомпетентные свойства клеток проверяли с использованием стандартной процедуры электропорации.
С этой целью 40 мкл клеток размораживали на льду и смешивали с 0,5 мкл плазмидной ДНК в ледяной кювете для электропорации и подавали 2500 вольт, 25 мкФ, 200 Ом с использованием электропоратора Eporator® (Eppendorf AG, Гамбург, Германия).
Клетки ресуспендировали в 4 мл среды SMG17MC и инкубировали при 30°С в течение 2 часов.
Различные количества культуры высевали на GSM17-агар и инкубировали при 30 °C.
Использовали буферы:
Среда SMGG: доступная для приобретения среда M17,
+0,5 М сахарозы
+0,5 масс.% глюкозы
+1 масс.% глицина
Среда SMG17MC: доступная для приобретения среда M17
+0,5 М сахарозы
+0,5 масс.% глюкозы
+20 мМ MgCl2
+2 мМ CaCl2
Агар GSM17: Агар М17, полученный в Oxoid Deutschland GmbH (Везел, Германия)
+0,5 М сахарозы
+0,5 масс.% глюкозы
Буфер для промывки: 0,5 М сахароза
+10 масс.% глицерина
I.5 Отбор трансформантов
Трансформаторы переносили с чашек на новые чашки и в пробирки с 3 мл среды M17 (с добавлением 1% глюкозы или лактозы), инкубировали при 30°С и выделяли ДНК, как описано выше в пункте I.3. Клоны подвергали скринингу на предмет наличия и ориентации вставленных последовательностей с использованием выбранных эндонуклеаз рестрикции и электрофореза в агарозном геле.
Положительные клоны отбирали, культивировали и хранили при -80 °C.
I.6 Культивирование и индукция экспрессии генов
Выбранные клоны высевали в среду IM1 с добавлением 0,5% глюкозы или лактозы и выращивали в течение ночи при 30 °C. В момент t=0 культуры инокулировали в соотношении 1:100 в 45 мл среды и инкубировали. При ОП600=0,5 культуры разделяли на три отдельные культуры по 15 мл, которые индуцировали добавлением NaCl (0 мМ, 100 мМ или 500 мМ).
Через 3 часа индукции генов клетки и супернатанты разделяли центрифугированием (10 мин при 6000 об/мин).
Клетки замораживали при -20 °C перед дальнейшей обработкой. Супернатанты смешивали с одной третью объема ТХУ (см. ниже) и хранили при -20 °C.
I.7 Получение бесклеточных экстрактов и осаждение трихлоруксусной кислотой (ТХУ)
Бесклеточные экстракты получали путем взбивания с гранулами в соответствии со стандартным протоколом работы. Эта процедура основана на использовании стеклянных гранул размером 50-100 мкм. Образцы хранили только на льду во избежание протеолитического разрушения белков. После заключительного этапа центрифугирования бесклеточные экстракты собирали и хранили при -20 °C.
Осаждение с помощью ТХУ выполняли путем добавления 1 объема ТХУ к 4 объемам супернатанта культуры. Смесь инкубировали при -20 °C до дальнейшего использования. Для получения осажденного с помощью ТХУ белка отбирали образцы объемом 1 мл и центрифугировали в течение 10 мин при 14000 об/мин. Супернатант декантировали и гранулы сушили в печи при 65-70°С. Затем добавляли буфер для образцов электрофореза в ДСН-ПААГ, содержащий 2% β-меркаптоэтанола, и денатурировали образцы путем инкубирования при 100°С в течение 10 мин.
I.8 Электрофорез в полиакриламидном геле в присутствии додецилсульфата натрия (ДСН-ПААГ) и вестерн-блоттинг
Электрофорез в ДСН-ПААГ (15 масс.% рабочего геля) выполняли по существу в соответствии с Laemmli, U.K. (1970). После электрофореза гели окрашивали с использованием Coomassie R-250 (Bio-Rad Laboratories, Inc., Херкулис, штат Калифорния, США), или белки переносили на мембраны из поливинилиденфторида (ПВДФ) или нитроцеллюлозы с помощью полусухой системы блоттинга (Owl®, Thermo Fisher Scientific, Inc.) в соответствии с инструкциями производителя.
Мембраны из ПВДФ или нитроцеллюлозы обрабатывали путем блокирования физиологическим раствором с трис-буфером, содержащим 0,05 масс.% твин-20 (TBST) и 2 масс.% бычьего сывороточного альбумина (БСА), с последующим инкубированием со специфичными первичными антителами против соответствующего белка, разбавленного TBST, содержащим 1 масс.% БСА, в течение 30 минут.
Затем блоты промывали TBST 3 раза по 10 минут.После промывки наносили вторичное конъюгированное с щелочной фосфатазой антитело козы против антител кролика, например, производства Santa Cruz Biotechnology, Inc. (Даллас, штат Техас, США, номер в каталоге sc-2004) (1:7500 в TBST+1 мас.% БСА). Несвязанное антитело промывали TBST (3 × 10 мин) с последующим ферментативным окрашиванием в соответствии со стандартными процедурами с использованием NBT и BCIP.
После достаточного развития окрашивания реакцию прекращали путем промывания водой, мембраны высушивали и фотографировали или сканировали.
В качестве альтернативы, в соответствии с протоколом производителя использовали антитело осла против антител козы IRDye® 680RD производства LI-COR, Inc. (Линкольн, штат Небраска, США), конъюгированное с флуоресцентным красителем, излучающим в ближней инфракрасной области (БИК). Обнаружение связанного вторичного антитела выполняли с использованием системы визуализации Odyssey® производства LI-COR, Inc. в соответствии с протоколом производителя.
Физиологический раствор с трис-буфером, содержащий 0,05 мас.% твин-20, получали с использованием таблеток Roti®fair TBST 7,6, полученных в Carl Roth GmbH Co. KG (Карлсруэ, Германия), в соответствии с инструкциями производителя.
Для обнаружения соответствующих рекомбинантных белков использовали следующие первичные антитела производства Abcam PLC (Кембридж, Великобритания), Bio-Rad Laboratories Inc. (Херкулис, штат Калифорния, США) и LifeSpan BioSciences, Inc. (Сиэтл, штат Вашингтон, США),
• антитело против ФРФ-2 - поликлональное антитело кролика против ФРФ-2 (Abcam PLC, ab126861),
• антитело против ИЛ-4 - поликлональное антитело кролика против ИЛ-4 (Abcam PLC, ab9622),
• антитело против МКСФ - поликлональное антитело кролика против МКСФ (Abcam PLC, ab9693),
• антитело против ГМКСФ мыши - поликлональное антитело кролика против ГМКСФ мыши (Bio-Rad Laboratories Inc., AAM16G),
• антитело против ИЛ-18 мыши - поликлональное антитело кролика против ИЛ-18 мыши (LifeSpan BioSciences, Inc., LS-C147100),
• антитело против ИЛ-12 мыши - антитело козы против ИЛ-12 мыши (Biorad Laboratories Inc., AAM33).
I.9 Ферментация
Ферментацию выполняли в 0,5 л ферментере Multifors с 6 реакционными сосудами (Infors Benelux, Велп, Нидерланды). Инокуляцию выполняли с использованием 1% предварительной культуры в среде IM-1; скорость перемешивания составляла 200 оборотов в минуту, а температура инкубации - 30°C. В ходе работы рН контролировали с помощью 2,5 М NaOH. Выполняли непрерывный мониторинг рН, температуры и добавления NaOH.
I.10 Измерения флуоресцентного белка
Штаммы, содержавшие конструкты с репортерным геном mCherry под контролем различных промоторов, выращивали и обрабатывали, как описано выше. Активность mCherry измеряли на флуориспектрофотометре Synergy HT (BioTek Instruments, Inc., Уинуски, штат Вермонт, США).
Возбуждение выполняли при 530 нм, излучение измеряли при 590 нм и применяли коэффициент усиления 120, как описано в работе Tauer et al. (2014).
Пример 1 Получение экспрессирующих плазмид
1.1 Получение плазмиды pAUC1010
Плазмиду pAUC1010 использовали в следующих экспериментах для экспрессии гетерологичных генов в L. lactis. Плазмида pAUC1010 основана на нативной плазмиде Lactococcus lactis pSH71, реплицирующейся по типу катящегося кольца, описанной в работах de Vos, W.M. (1987), а также de Vos, W.M. и Simons, G. (1994).
Плазмида pAUC1010 содержала ген аланинрацемазы (alr), включая его терминатор L. lactis в качестве селективного маркера, который можно использовать с мутантными штаммами L. lactis с нокаутом alr, например, NZ1330 (Bron, P.A. et al. (2002), Hols, P. et al. (1999)). Плазмида также содержала искусственный промотор Pcp14 (Ruhdal Jensen, P. and Hammer, K. (1998)).
Кроме того, плазмида pAUC1010 содержала последовательность терминатора гена аминопептидазы N (pepN) L. lactis (Tan, P.S.T. et al. (1992)) после промотора и сайт множественного клонирования (MCS). Терминаторная последовательность обеспечивала терминацию транскрипции.
Нуклеотидная последовательность гена alr аланинрацемазы (EC 5.1.1.1) Lactococcus lactis subsp.cremoris доступна, например, под номером доступа NCBI Y18148.2.
Соответствующую аминокислотную последовательность аланинрацемазы Lactococcus lactis subsp.cremoris можно, например, найти под номером доступа UniProt Q9RLU5, версия 99, или под номером эталонной последовательности NCBI WP_011835506.1.
Нуклеотидная последовательность pAUC1010 представлена в SEQ ID NO: 1 и на фигуре 1b.
На фигуре 1a показан схематический вид плазмиды pAUC1010. «alr» обозначает ген аланинрацемазы, используемый для роста штамма-хозяина в отсутствие D-аланина; «Т» обозначает последовательность терминатора; «repC» и «repA» обозначают прокариотические гены, необходимые для репликации плазмиды в бактериальной клетке.
1.2 Получение хлорид-индуцируемой экспрессирующей кассеты
В следующих экспериментах получили хлорид-индуцируемую экспрессирующую кассету, в которой промотор PgadC L. lactis subsp.cremoris использовали для контроля экспрессии различных гетерологичных генов в L. lactis.
Промотор PgadC использовали, как описано в работах Sanders et al. (1997) и Sanders et al. (1998) в комбинации с активаторным геном gadR и сайтом связывания рибосом и стартовым кодоном гена gadC, расположенными после промотора PgadC.
Промотор PgadC регулировался белком gadR, который являлся положительным регулятором Pgad. Белок gadR активировал промотор PgadC в присутствии хлорид-ионов.
Экспрессия самого гена gadR не активировалась хлорид-ионами, он находился под контролем конститутивного промотора, который также присутствовал в хлорид-индуцируемой кассете для экспрессии генов, используемой в настоящем изобретении, вместе с сайтом связывания рибосом (RBS), расположенным перед стартовым кодоном ATG нуклеотидной последовательности, кодирующей gadR.
Нуклеотидная последовательность промотора PgadC, включая ген gadR, сайт связывания рибосом и стартовый кодон гена gadC, выделяли из геномной последовательности штамма L. lactis subsp.cremoris MG1363. Соответствующая геномная последовательность доступна, например, под номером доступа NCBI NC_009004.1.
Нуклеотидная последовательность хлорид-индуцируемого промотора, включающая область промотора PgadC, ген gadR, сайт связывания рибосом и стартовый кодон гена gadC, представлена в SEQ ID NO: 2 и на фигуре 2b. Стартовый кодон (ATG) gadC обозначен на фигуре 2b подчеркиванием и полужирными прописными буквами.
Схематическое представление хлорид-индуцируемого промотора, включая регуляторные элементы, показано на фигуре 2а.
Соответствующий целевой ген или гены, кодирующие по меньшей мере один белок, подлежащий экспрессии рекомбинантными бактериями согласно настоящему изобретению, присоединяли к стартовому кодону (ATG) gadC. Кроме того, гены, кодирующие соответствующий белок, экспрессируемый рекомбинантными бактериями согласно настоящему изобретению, были представлены вместе с сигналом секреции для секреции белка, полученного от экспрессирующего штамма-хозяина.
Сигнал секреции предпочтительно получали из белка Usp45 Lactococcus, описанного, например, в работах van Asseldonk et al. (1993) и van Asseldonk et al. (1990). Аминокислотная последовательность сигнала секреции белка Usp45 Lactococcus показана на фигуре 3 и приведена в последовательности SEQ ID NO: 3.
В клетке существует механизм, обеспечивающий отщепление сигнальной последовательности от белка-мишени после секреции белка. Эта реакция катализируется сигнальной пептидазой, характеризующейся определенным предпочтением в отношении некоторых аминокислот в положениях вокруг сайта расщепления.
По меньшей мере один белок, экспрессируемый рекомбинантными бактериями согласно настоящему изобретению, экспрессировали в виде рекомбинантного белка-предшественника, содержащего соответствующий сигнал секреции, предпочтительно белка Usp45 Lactococcus, на N-конце соответствующего белка-предшественника.
Частоту использования кодонов для соответствующего гена и/или генов, кодирующих по меньшей мере один белок, экспрессируемый рекомбинантными бактериями согласно настоящему изобретению, адаптировали под обычную частоту использования кодонов L. lactis.
Кроме того, если рекомбинантные бактерии согласно настоящему изобретению должны экспрессировать более одного белка, то для соответствующих белков использовали одну и ту же сигнальную пептидную последовательность Usp45.
Во избежание получения крупных идентичных нуклеотидных областей на плазмиде в непосредственной близости друг от друга, что может привести к интраплазмидой рекомбинации/делециям, один и тот же сигнальный пептид кодировали с помощью различных кодонов на основе вырожденности кодонов и частоты применения кодонов L. lactis.
Кроме того, для оптимизации сайта расщепления, где сигнальный пептид отщепляется от синтетического белка-предшественника с получением зрелого белка, использовали веб-приложение SignalP 4.1 (http://www.cbs.dtu.dk/services/SignalP/).
Коме того, если рекомбинантные бактерии согласно настоящему изобретению должны экспрессировать более одного белка, предпочтительно по меньшей мере в одном опероне, каждый из соответствующих генов представили вместе с сайтом связывания рибосом (RBS) для улучшения экспрессии белка.
Предпочтительно для первого гена оперона, содержащего две или более нуклеотидных последовательностей, кодирующих белок, использовали сайт связывания рибосом гена gadC. Для других генов оперона использовали сайты связывания рибосом эндогенного гена L. lactis, например, гена гамма-субъединицы АТФ-синтазы (atpG) и/или гена галактозид-O-ацетилтрансферазы (lacA).
Подходящие сайты связывания рибосом можно, например, выбрать на основе хорошего соответствия 3’-концу 16S рРНК L. lactis, как описано в работе Bolotin et al. (2001), из известных нуклеотидных последовательностей L. lactis, например, из нуклеотидной последовательности генома L. lactis subsp.lactis IL1403, которая доступна в NCBI под номером доступа AE005176.1, или генома L. lactis subsp.cremoris MG1363, который доступен под номером доступа NCBI NC_009004.1.
3'-конец 16S рРНК L. lactis (5′ GGAUCACCUCCUUUCU 3′) показан в SEQ ID NO: 4 и на фигуре 4.
Синтетический нуклеотидный конструкт, содержащий хлорид-индуцируемый промотор, а также по меньшей мере одну нуклеотидную последовательность, кодирующую по меньшей мере один белок, экспрессируемый рекомбинантными бактериями согласно настоящему изобретению, синтезировали de novo и, как описано выше, затем лигировали в соответствующую экспрессирующую плазмиду, которую затем трансформировали в подходящий бактериальный штамм, предпочтительно L. lactis.
Получили следующие экспрессирующие плазмиды:
1.3 Получение экспрессирующей плазмиды для экспрессии mCherry
Получили различные конструкты, содержащие ген mCherry под контролем PgadC. mCherry представляет собой флуоресцентный белок, впервые описанный Beilharz K, et al. (2015).
Нуклеотидная последовательность, кодирующая белок mCherry, доступна под номером доступа NCBI KJ908190.1. Соответствующая аминокислотная последовательность доступна под номером доступа NCBI AIL28759.1.
Кодирующую последовательность mCherry присоединили к промотору PgadC. Схематическое представление соответствующих вставленных последовательностей показано на фигуре 17а.
Нуклеотидная последовательность синтетического конструкта mCherry показана на фигуре 17b и в SEQ ID NO: 33. Схематическое представление синтетического конструкта mCherry показано на фигуре 17а.
Готовые продукты синтеза генов получали из BaseClear в виде фрагмента, клонированного в векторе pUC57 E.coli.
Плазмиды pUC57 с соответствующими продуктами синтеза генов расщепляли ферментами рестрикции SphI и BglII. Фрагменты SphI и BglII, содержащие соответствующие продукты синтеза генов, выделяли путем экстракции фенолом и осаждения этанолом и лигировали в разрезанные SphI и BglII плазмиды pAUC1010, в результате чего получали экспрессирующие плазмиды, обозначенные как pC-mCherry
Нуклеотидная последовательность экспрессирующей плазмиды, обозначенной как pC-mCherry, показана на фигуре 18b и в SEQ ID NO: 34. Схематическое представление экспрессирующей плазмиды pC-mCherry представлено на фигуре 18а.
1.4 Получение экспрессирующей плазмиды для экспрессии чФРФ-2, чИЛ-4 и чКСФ-1 из одного оперона
Для экспрессии фактора роста фибробластов 2 человека (чФРФ-2), интерлейкина-4 человека (чИЛ-4) и колониестимулирующего фактора 1 человека (чКСФ-1) в L. lactis NZ1330 получили следующие нуклеотидные последовательности.
1.4.1 Фактор роста фибробластов 2 человека (чФРФ-2)
Аминокислотную последовательность, используемую для экспрессии чФРФ-2, получили из 288-аминокислотной последовательности предшественника ФРФ-2 человека, доступной под номером доступа NCBI NP_001997.5.
Зрелая форма чФРФ-2 содержит 155 аминокислот и обозначается далее как чФРФ-2-155. Его молекулярная масса составляет 17,3 кДа, а pI равен 9,85. Молекула содержит 4 остатка цистеина.
Вариант чФРФ-2, подлежавший экспрессии в L. lactis, был лишен первых двух аминокислот, метионина и аланина, и содержал 153 аминокислоты. Таким образом, в дальнейшем этот вариант обозначали как чФРФ-2-153. Молекулярная масса чФРФ-2-153 составляла 17,1 кДа, а pI - 9,85. Этот вариант содержал четыре остатка цистеина.
Соответствующая аминокислотная последовательность ФРФ-2-155 человека показана на фигуре 5a и в последовательности SEQ ID NO: 5. Подчеркнутые аминокислоты, показанные на фигуре 5а, обозначают первые две аминокислоты, метионин и аланин, которые отсутствовали в варианте чФРФ-2-153. Аминокислотная последовательность варианта чФРФ-2-153 показана на фигуре 5b и в последовательности SEQ ID NO: 6.
Последовательность ФРФ-2-155 представляла собой последовательность зрелого ФРФ-2 человека после секреции. В условиях in vivo указанная последовательность подвергается дальнейшему процессингу. Однако различные существующие рекомбинантные продукты основаны на последовательности из 155 аминокислот, с добавлением N-концевого остатка метионина или без него.
Для экспрессии и секреции чФРФ-2, например, в супернатант ростовой среды, к N-концу добавляли сигнальный пептид, как описано выше, с получением рекомбинантного белка-предшественника чФР-2-153.
Соответствующая аминокислотная последовательность рекомбинантного белка-предшественника чФРФ-2-153 показана на фигуре 5 с и в последовательности SEQ ID NO: 7. Подчеркнутые аминокислоты, показанные на фигуре 5c, обозначают сигнал секреции белка Usp45 Lactococcus.
1.4.2 Интерлейкин-4 человека (чИЛ-4)
Зрелый белок чИЛ-4 содержит 129 аминокислот, соответствующие аминокислотам 25-153 в аминокислотной последовательности, доступной под номером NCBI NP_000580.1. Молекулярная масса зрелого белка составляет 14,96 кДа, а pI равен 9,36. Молекула содержит 6 остатков цистеина.
Аминокислотная последовательность зрелого чИЛ-4 показана на фигуре 6а и в последовательности SEQ ID NO: 8.
Вариант чИЛ-4, подлежавший экспрессии в L. lactis, содержал дополнительный остаток аланина на N-конце зрелого белка и, следовательно, содержал 130 аминокислот.Молекулярная масса указанного варианта составляла 15,03 кДа, а pI - 9,36. Этот вариант также содержал 6 остатков цистеина.
Соответствующая аминокислотная последовательность варианта чИЛ-4 человека, подлежавшего экспрессии, показана на фигуре 6b и в последовательности SEQ ID NO: 9. Подчеркнутая аминокислота, показанная на фигуре 6b, обозначает дополнительный остаток аланина на N-конце аминокислотной последовательности.
Для экспрессии и секреции чИЛ-4, например, в супернатант ростовой среды, к N-концу добавляли сигнальный пептид, как описано выше, с получением рекомбинантного белка-предшественника чИЛ-4. Соответствующая аминокислотная последовательность рекомбинантного белка-предшественника чИЛ-4 показана на фигуре 6 с и в последовательности SEQ ID NO: 10. Подчеркнутые аминокислоты, показанные на фигуре 6c, обозначают сигнал секреции белка Usp45 Lactococcus.
1.4.3 Колониестимулирующий фактор 1 человека (чКСФ-1)
Аминокислотную последовательность чКСФ-1, использованную для экспрессии, получили из последовательности изоформы А предшественника КСФ-1 человека, содержащей 554 аминокислоты и доступной под номером доступа NCBI NP_000748.3.
В зрелую форму чКСФ-1 входят аминокислоты 33-450 предшественника. Аминокислотная последовательность показана на фигуре 7а и в последовательности SEQ ID NO: 11.
Аминокислотная последовательность, подлежавшая экспрессии, начиналась с аминокислоты 33 (E), которая является первой аминокислотой зрелого чКСФ-1, и заканчивалась аминокислотой 181 (Q).
Кроме того, к С-концу добавили дополнительные 9 аминокислот, которые занимали в нативном белке положения 480-488 (GHERQSEGS). Для повышения эффективности удаления сигнального пептида сигнальной пептидазой к N-концу добавили дополнительный остаток аланина. Полученная аминокислотная последовательность показана на фигуре 7b и в последовательности SEQ ID NO: 12.
Дополнительный остаток аланина на N-конце на фигуре 7b подчеркнут.Дополнительные 9 аминокислот, добавленные к С-концу, показаны на фигуре 7b полужирным шрифтом. Белок, кодируемый указанной последовательностью, содержал 159 аминокислот, его молекулярная масса составляла 18,5 кДа, а pI - 4,72. Белок содержал 7 остатков цистеина.
Для экспрессии и секреции чКСФ-1, например, в супернатант ростовой среды, к N-концу добавляли сигнальный пептид, как описано выше, с получением рекомбинантного белка-предшественника чКСФ-1. Соответствующая аминокислотная последовательность синтетического белка-предшественника чКСФ-1 показана на фигуре 7 с и в последовательности SEQ ID NO: 13. Подчеркнутые аминокислоты, показанные на фигуре 7c, обозначают сигнал секреции белка Usp45 Lactococcus
1.4.4 Получение экспрессирующих конструктов
Аминокислотные последовательности синтетического белка-предшественника чФРФ-2-153, показанного на фигуре 5 с и в SEQ ID NO: 7, синтетического белка-предшественника чИЛ-4, показанного на фигуре 6 с и в SEQ ID NO: 10, и синтетического белка-предшественника чКСФ-1, показанного на фигуре 7 с и в SEQ ID NO: 13, трансформировали в соответствующую нуклеотидную последовательность, тем самым адаптируя использование кодонов к обычному использованию кодонов L. lactis.
Получили 2 конструкта с использованием 2 из 6 перестановок трех генов (ФРФ-2, ИЛ-4, КСФ-1):
а) чКСФ-1, чФРФ-2, чИЛ-4 (CFI);
b) чИЛ-4, чКСФ-1, чФРФ-2 (ICF);
Для конструирования оперонов каждый ген представляли с его собственным сайтом связывания рибосом для инициации трансляции и собственным сигнальным пептидом для секреции белка с использованием одной и той же сигнальной последовательности (ssUsp45), которую кодировали с помощью различных кодонов на основе вырожденности кодонов и использования кодонов L. lactis.
Для каждого из первых генов 2 конструктов использовали сайт связывания рибосом гена gadC. Для двух других генов каждого из 2 конструктов использовали сайты связывания рибосом гена гамма-субъединицы АТФ-синтазы (atpG) и гена галактозид-O-ацетилтрансферазы (lacA).
Нуклеотидная последовательность конструкта CFI, синтезированного de novo, показана на фигуре 8b и в SEQ ID NO: 14. Схематическое представление конструкта CFI, синтезированного de novo, представлено на фигуре 8а.
Готовые продукты синтеза генов получали из BaseClear, каждый из них представлял собой фрагмент, клонированный в вектор pUC57 E.coli.
Плазмиды pUC57 с соответствующими продуктами синтеза генов расщепляли ферментами рестрикции SphI и BglII, каждый из которых получили из New England Biolabs (Ипсвич, штат Массачусетс, США). Фрагменты SphI и BglII, содержащие соответствующие продукты синтеза генов, выделяли путем экстракции фенолом и осаждения этанолом и лигировали в плазмиду pAUC1010, разрезанную SphI и BglII, получив экспрессирующую плазмиду, обозначенную как pC-CFI.
Нуклеотидная последовательность экспрессирующей плазмиды, обозначенной как pC-CFI, показана на фигуре 9b и в SEQ ID NO: 15. Схематическое представление экспрессирующей плазмиды pC-CFI представлено на фигуре 9а.
1.5 Получение экспрессирующей плазмиды для экспрессии мИЛ-18 и мГМКСФ из одного оперона
Для экспрессии интерлейкина-18 мыши (мИЛ-18) и гранулоцитарно-макрофагального колониестимулирующего фактора мыши (мГМКСФ) в L. lactis NZ1330 получили следующие нуклеотидные последовательности.
1.5.1 Интерлейкин-18 мыши (мИЛ-18)
Зрелый белок мИЛ-18 содержит 157 аминокислот, которые соответствуют аминокислотам 36-192 аминокислотной последовательности изоформы предшественника интерлейкина-18 мыши, доступного под номером доступа NCBI NP_032386.1.
Аминокислотная последовательность зрелого ИЛ-18 мыши показана на фигуре 10а и в последовательности SEQ ID NO: 16.
Вариант мИЛ-18, подлежавший экспрессии в L. lactis, содержал дополнительный остаток аланина на N-конце зрелого белка. Соответствующая аминокислотная последовательность варианта ИЛ-18 мыши, подлежавшего экспрессии, показана на фигуре 10b и в последовательности SEQ ID NO: 17. Подчеркнутая аминокислота, показанная на фигуре 10b, обозначает дополнительный остаток аланина на N-конце аминокислотной последовательности.
Для экспрессии и секреции мИЛ-18, например, в супернатант ростовой среды, к N-концу добавляли сигнальный пептид, как описано выше, с получением синтетического белка-предшественника мИЛ-18. Соответствующая аминокислотная последовательность синтетического белка-предшественника мИЛ-18 показана на фигуре 10 с и в последовательности SEQ ID NO: 18. Подчеркнутые аминокислоты, показанные на фигуре 10c, обозначают сигнал секреции белка Usp45 Lactococcus.
1.5.2 Гранулоцитарно-макрофагальный колониестимулирующий фактор мыши (мГМКСФ)
Зрелый мГМКСФ содержит 129 аминокислот, соответствующие аминокислотам 18-141 аминокислотной последовательности предшественника гранулоцитарно-макрофагального колониестимулирующего фактора мыши, доступного в эталонной последовательности NCBI: NP_034099.2.
Аминокислотная последовательность зрелого ГМКСФ мыши показана на фигуре 11а и в последовательности SEQ ID NO: 19.
Вариант мГМКСФ, подлежавший экспрессии в L. lactis, содержал дополнительный остаток аланина на N-конце зрелого белка, заменявший серин на N-конце для оптимизации отщепления сигнального пептида. Соответствующая аминокислотная последовательность варианта ГМКСФ мыши, подлежавшего экспрессии, показана на фигуре 11b и в последовательности SEQ ID NO: 20. Подчеркнутая аминокислота, показанная на фигуре 11b, обозначает дополнительный остаток аланина на N-конце аминокислотной последовательности.
Для экспрессии и секреции мГМКСФ, например, в супернатант ростовой среды, к N-концу добавляли сигнальный пептид, как описано выше, с получением рекомбинантного белка-предшественника мГМКСФ. Соответствующая аминокислотная последовательность синтетического белка-предшественника мГМКСФ показана на фигуре 11 с и в последовательности SEQ ID NO: 21. Подчеркнутые аминокислоты, показанные на фигуре 11c, обозначают сигнал секреции белка Usp45 Lactococcus.
1.5.3 Получение экспрессирующих конструктов
Аминокислотные последовательности рекомбинантного белка-предшественника мИЛ-18, показанного на фигуре 10c и в SEQ ID NO: 18, и рекомбинантного белка-предшественника мГМКСФ, показанного на фигуре 11c и в SEQ ID NO: 21, транслировали в соответствующую нуклеотидную последовательность, тем самым адаптируя использование кодонов к обычному использованию кодонов L. lactis.
Для конструирования оперонов каждый из двух генов, кодирующих соответствующие белки-предшественники, представляли с его собственным сайтом связывания рибосом для инициации трансляции и собственным сигнальным пептидом для секреции белка с использованием одной и той же сигнальной последовательности (ssUsp45), которую кодировали с помощью различных кодонов на основе вырожденности кодонов и использования кодонов L. lactis, как описано выше.
Для первого гена (мИЛ-18) оперона использовали сайт связывания рибосом гена gadC. Для второго гена (мГМКСФ) использовали сайт связывания рибосом гена гамма-субъединицы АТФ-синтазы (atpG).
Нуклеотидная последовательность синтетического конструкта mEG показана на фигуре 12а и в SEQ ID NO: 22.
Готовый продукт синтеза генов получали из BaseClear в виде фрагмента, клонированного в векторе pUC57 E.coli.
Плазмиду pUC57 с соответствующим продуктом синтеза генов расщепляли ферментами рестрикции SphI и BglII, каждый из которых получили из New England Biolabs (Ипсвич, штат Массачусетс, США). Фрагмент SphI и BglII, содержащий соответствующий продукт синтеза генов, выделяли путем экстракции фенолом и осаждения этанолом и лигировали в плазмиду pAUC1010, разрезанную SphI и BglII, получив экспрессирующую плазмиду, обозначенную как pC-mEG.
Нуклеотидная последовательность экспрессирующей плазмиды, обозначенной как pC-mEG, показана на фигуре 12 с и в SEQ ID NO: 23. Схематическое представление экспрессирующей плазмиды pC-mEG представлено на фигуре 12b.
1.6 Получение экспрессирующей плазмиды для экспрессии мИЛ-12, мИЛ-18 и мИФНa из одного оперона
Для экспрессии интерлейкина-12 мыши (мИЛ-12), интерлейкина-18 мыши (мИЛ-18) и интерферона-альфа-2 мыши (мИФНa) в L. lactis NZ1330 получили следующие нуклеотидные последовательности.
1.6.1 Интерлейкин-12 мыши (мИЛ-12)
Интерлейкин-12 (IL-12) представляет собой гетеродимерный цитокин, кодируемый двумя отдельными генами - ИЛ-12A (p35) и ИЛ-12B (p40).
Вариант мИЛ-12, подлежавший экспрессии в L. lactis, сконструировали в виде гибридного белка зрелой бета-субъединицы интерлейкина-12, образующей N-концевую часть гибридного белка, и зрелой альфа-субъединицы интерлейкина-12, образующей С-концевую часть гибридного белка, которые разделены пептидным линкером.
Зрелый белок бета-субъединицы интерлейкина-12 мыши содержит 313 аминокислот, соответствующих аминокислотам 23-335 аминокислотной последовательности предшественника бета-субъединицы интерлейкина-12 мыши, доступной под номером доступа NCBI NP_001290173.1.
Аминокислотная последовательность зрелой бета-субъединицы интерлейкина-12 показана на фигуре 13а и в последовательности SEQ ID NO: 24.
Альфа-субъединица интерлейкина-12 мыши существует в виде по меньшей мере двух изоформ 1 и 2. Кодированная изоформа 2 укорочена по N-концу по сравнению с изоформой 1.
Аминокислотная последовательность предшественника изоформы 1 альфа-субъединицы интерлейкина 12 мыши доступна под номером доступа NCBI NP_001152896.1.
Зрелый белок изоформы 2 альфа-субъединицы интерлейкина-12 мыши, аминокислотную последовательность которого использовали для экспрессии в следующих примерах, содержал 199 аминокислот, соответствующие аминокислотам 23-215 аминокислотной последовательности предшественника изоформы 2 альфа-субъединицы интерлейкина-12 мыши, доступной под номером доступа NCBI NP_032377.1.
Аминокислотная последовательность зрелой изоформы 2 альфа-субъединицы интерлейкина-12 показана на фигуре 13b и в последовательности SEQ ID NO: 25.
Аминокислотная последовательность зрелой формы гибридного белка рекомбинантного интерлейкина-12 показана на фигуре 13 с и в последовательности SEQ ID NO: 26. Кроме того, к N-концу рекомбинантного гибридного белка добавили две дополнительные аминокислоты (аланин и аспарагиновую кислоту), которые показаны на фигуре 13c подчеркнутым шрифтом. Линкерная последовательность, разделяющая две субъединицы ИЛ-12, выделена на фигуре 13c полужирным шрифтом.
Для экспрессии и секреции гибридного белка мИЛ-12, например, в супернатант ростовой среды, к N-концу добавляли сигнальный пептид, как описано выше, с получением рекомбинантного белка-предшественника мИЛ-12.
Соответствующая аминокислотная последовательность предшественника рекомбинантного гибридного белка мИЛ-12 показана на фигуре 13d и в последовательности SEQ ID NO: 27. Подчеркнутые аминокислоты, показанные на фигуре 13d, обозначают сигнал секреции белка Usp45 Lactococcus.
1.6.2 Интерлейкин-18 мыши (мИЛ-18)
Аминокислотная последовательность варианта мИЛ-18, подлежавшего экспрессии в L. lactis, показана на фигуре 10b и в последовательности SEQ ID NO: 17. Соответствующая аминокислотная последовательность рекомбинантного белка-предшественника мИЛ-18 показана на фигуре 10 с и в последовательности SEQ ID NO: 18. Подчеркнутые аминокислоты, показанные на фигуре 10c, обозначают сигнал секреции белка Usp45 Lactococcus.
1.6.3 Интерферон-альфа-2 мыши (мИФНa2)
Зрелая форма мИФНa2 содержит 167 аминокислот, соответствующие аминокислотам 24-190 аминокислотной последовательности предшественника интерферона-альфа-2 мыши, доступной в эталонной последовательности NCBI: NP_034633.2.
Аминокислотная последовательность зрелого ИФНa2 мыши показана на фигуре 14a и приведена в последовательности SEQ ID NO: 28.
Вариант мИФНa2, подлежавший экспрессии в L. lactis, содержал дополнительный остаток аланина на N-конце зрелого белка с целью оптимизации отщепления сигнального пептида. Соответствующая аминокислотная последовательность варианта рекомбинантного ИФНa2 мыши, подлежавшего экспрессии, показана на фигуре 14b и в последовательности SEQ ID NO: 29. Подчеркнутая аминокислота, показанная на фигуре 14b, обозначает дополнительный остаток аланина на N-конце аминокислотной последовательности.
Для экспрессии и секреции мИФНа2, например, в супернатант ростовой среды, к N-концу добавляли сигнальный пептид, как описано выше, с получением рекомбинантного белка-предшественника мИФНа2. Соответствующая аминокислотная последовательность синтетического белка-предшественника мИФНa2 показана на фигуре 14c и в последовательности SEQ ID NO: 30. Подчеркнутые аминокислоты, показанные на фигуре 14c, обозначают сигнал секреции белка Usp45 Lactococcus.
1.6.4 Получение экспрессирующих конструктов
Аминокислотные последовательности предшественника рекомбинантного белка мИЛ-12, показанного на фигуре 13d и в SEQ ID NO: 27, аминокислотные последовательности рекомбинантного белка-предшественника мИЛ-18, показанного на фигуре 10c и в SEQ ID NO: 18, и аминокислотные последовательности рекомбинантного белка-предшественника мИФНa2, показанного на фигуре 14c и в SEQ ID NO: 30, трансформировали в соответствующую нуклеотидную последовательность, тем самым адаптируя использование кодонов к обычному использованию кодонов L. lactis.
Для конструирования оперонов каждый из трех генов, кодирующих соответствующие белки-предшественники, представляли с его собственным сайтом связывания рибосом для инициации трансляции и собственным сигнальным пептидом для секреции белка с использованием одной и той же сигнальной последовательности (ssUsp45), которую кодировали с помощью различных кодонов на основе вырожденности кодонов и использования кодонов L. lactis, как описано выше.
Для первого гена (мИЛ-12) оперона использовали сайт связывания рибосом гена gadC. Для второго гена (мИЛ-18) использовали сайты связывания рибосом гена гамма-субъединицы АТФ-синтазы (atpG), а для третьего гена (мИФНa2) - сайты связывания рибосом гена галактозид-O-ацетилтрансферазы (lacA).
Нуклеотидная последовательность синтетического конструкта mTEA показана на фигуре 15 и в SEQ ID NO: 31.
Готовый продукт синтеза генов получали из BaseClear в виде фрагмента, клонированного в векторе pUC57 E.coli.
Плазмиду pUC57 с продуктом синтеза генов расщепляли с помощью ферментов рестрикции SphI и BglII. Фрагмент SphI и BglII, содержащий соответствующий продукт синтеза генов, выделяли путем экстракции фенолом и осаждения этанолом и лигировали в плазмиду pAUC1010, разрезанную SphI и BglII, получив экспрессирующую плазмиду, обозначенную как pC-mTEA.
Нуклеотидная последовательность экспрессирующей плазмиды, обозначенной как pC-mTEA, показана на фигуре 16b и в SEQ ID NO: 32. Схематическое представление экспрессирующей плазмиды pC-mTEA представлено на фигуре 16a.
1.7. Получение экспрессирующей плазмиды для экспрессии мГМКСФ, мИЛ-12 и мИЛ-18 из одного оперона
Для экспрессии гранулоцитарно-макрофагального колониестимулирующего фактора мыши (мГМКСФ), интерлейкина-12 мыши (мИЛ-12) и интерлейкина-18 мыши (мИЛ-18) в L. lactis NZ1330 получили следующие нуклеотидные последовательности.
1.7.1 Гранулоцитарно-макрофагальный колониестимулирующий фактор мыши (мГМКСФ)
Вариант мГМКСФ, подлежавший экспрессии в L. lactis, показан на фигуре 11b и в последовательности SEQ ID NO: 20. Подчеркнутая аминокислота, показанная на фигуре 11b, обозначает дополнительный остаток аланина на N-конце аминокислотной последовательности, как описано выше в пункте 1.5.2. Соответствующая аминокислотная последовательность синтетического белка-предшественника мГМКСФ показана на фигуре 11 с и в последовательности SEQ ID NO: 21. Подчеркнутые аминокислоты, показанные на фигуре 11c, обозначают сигнал секреции белка Usp45 Lactococcus.
1.7.2 Интерлейкин-12 мыши (мИЛ-12)
Вариант мИЛ-12, подлежавший экспрессии в L. lactis, сконструировали в виде гибридного белка зрелой бета-субъединицы интерлейкина-12, образующей N-концевую часть гибридного белка, и зрелой альфа-субъединицы интерлейкина-12, образующей С-концевую часть гибридного белка, которые разделены пептидным линкером, как описано выше в пункте 1.6.1. Соответствующая аминокислотная последовательность предшественника рекомбинантного гибридного белка мИЛ-12 показана на фигуре 13d и в последовательности SEQ ID NO: 27. Подчеркнутые аминокислоты, показанные на фигуре 13d, обозначают сигнал секреции белка Usp45 Lactococcus.
1.7.3 Интерлейкин-18 мыши (мИЛ-18)
Аминокислотная последовательность варианта мИЛ-18, подлежавшего экспрессии в L. lactis, показана на фигуре 10b и в последовательности SEQ ID NO: 17. Соответствующая аминокислотная последовательность рекомбинантного белка-предшественника мИЛ-18 показана на фигуре 10 с и в последовательности SEQ ID NO: 18. Подчеркнутые аминокислоты, показанные на фигуре 10c, обозначают сигнал секреции белка Usp45 Lactococcus.
1.7.4 Получение экспрессирующих конструктов
Аминокислотные последовательности рекомбинантного белка-предшественника мГМКСФ, показанные на фигуре 11c и в SEQ ID NO: 21, и аминокислотные последовательности предшественника рекомбинантного гибридного белка мИЛ-12, показанные на фигуре 13d и в SEQ ID NO: 27, преобразовали в соответствующую нуклеотидная последовательность, тем самым адаптируя использование кодонов к обычному использованию кодонов L. lactis.
Для конструирования оперонов каждый из двух генов, кодирующих соответствующие белки-предшественники, представляли с его собственным сайтом связывания рибосом для инициации трансляции и собственным сигнальным пептидом для секреции белка с использованием одной и той же сигнальной последовательности (ssUsp45), которую кодировали с помощью различных кодонов на основе вырожденности кодонов и использования кодонов L. lactis, как описано выше.
Для первого гена (мГМКСФ) оперона использовали сайт связывания рибосом гена gadC. Для второго гена (мИЛ-12) использовали сайт связывания рибосом гена гамма-субъединицы АТФ-синтазы (atpG), а для третьего гена (мИЛ-18) - сайты связывания рибосом гена галактозид-O-ацетилтрансферазы (lacA).
Нуклеотидная последовательность синтетического конструкта mGTE показана на фигуре 16а и в SEQ ID NO: 33.
Готовый продукт синтеза генов получали из BaseClear в виде фрагмента, клонированного в векторе pUC57 E.coli.
Плазмиду pUC57 с соответствующим продуктом синтеза генов расщепляли ферментами рестрикции SphI и BglII, каждый из которых получили из New England Biolabs (Ипсвич, штат Массачусетс, США). Фрагмент SphI и BglII, содержащий соответствующий продукт синтеза генов, выделяли путем экстракции фенолом и осаждения этанолом и лигировали в плазмиду pAUC1010, разрезанную SphI и BglII, получив экспрессирующую плазмиду, обозначенную как pC-mGTE.
Нуклеотидная последовательность экспрессирующей плазмиды, обозначенной как pC-mGTE, показана на фигуре 16 с и в SEQ ID NO: 34. Схематическое представление экспрессирующей плазмиды pC-mGTE представлено на фигуре 16b.
Пример 2 Получение рекомбинантных бактерий
Экспрессирующие плазмиды, полученные в примере 2, трансформировали в штаммы L. lactis с помощью электропорации, как описано выше. Сводная информация о соответствующих штаммам L. lactis, использованных в следующих примерах, приведена ниже в таблице 1.
Таблица 1: Сводная информация о рекомбинантных бактериях, использованных в следующих примерах
Для дальнейшего тестирования рабочие растворы соответствующих рекомбинантных бактерий с плотностью клеток приблизительно 1×1011 колониеобразующих единиц (КОЕ)/мл получали после роста в среде IM1 или CDM3 с добавлением лактозы и Na-бета-глицерофосфата путем добавления глицерина до конечной концентрации 20 мас.%. Рабочие растворы хранили при -80°С.
Состав среды CDM3 был основан на среде ZMB3, описанной в Zhang, G. and Block, DE (“Using highly efficient nonlinear experimental design methods for optimization of Lactococcus lactis fermentation in chemically defined media”, Biotechnol. Prog. 2009, 25(6): pages 1587 to 1597, doi: 10.1002/btpr.277).
Пример 3 Определение активности промотора Pgad in vitro
Для исследований индукции использовали среду IM1 для роста соответствующих штаммов L. lactis NZ1330, указанных в таблице 1. В среду IM1 в следующем эксперименте добавляли компоненты, описанные ниже:
2 масс.% β-глицерофосфата (Sigma, номер в каталоге 50020-500G)
1,5 масс.% соевого пептона (BD, номер в каталоге 211906)
1 масс.% дрожжевого экстракта (BD, номер в каталоге 212750)
1 мМ MgSO4.7H2O (Merck, номер в каталоге 1058860500)
0,1 мМ MgSO4.7H2O (Sigma, номер в каталоге M-7634)
3 масс.% глюкозы (Natural Spices B.V., номер в каталоге ES212)
Для ферментации с контролем рН использовали 3,5 М NH3OH, добавляемый в качестве основания.
Протокол индукции
Замороженные рабочие растворы из банков клеток использовали для инокуляции 50 мл среды IM1 с добавлением 3% глюкозы с последующим инкубированием в течение 16 часов при 30°C (предварительная культура). Эти ночные культуры использовали для инокуляции (1 об.% инокулята) 100 мл ферментеров, заранее собранных со средой IM1 с 3% глюкозы, pH 6,5, 30°C. Культуры перемешивали с непрерывной скоростью 200 об/мин, используя магнитную мешалку.
Экспрессию соответствующих генов индуцировали с помощью 100 мМ NaCl при ОП600=0,5. Контрольные клетки выращивали в среде без дополнительного NaCl и, таким образом, без индукции экспрессии соответствующих генов.
Влияние хлорид-индуцированной экспрессии гетерологичного гена на жизнеспособность L. lactis NZ1330 оценивали путем сравнения кривой роста L. lactis NZ1330, экспрессирующего mCherry под контролем Pgad, и неиндуцированного контроля.
Образцы культур отбирали через 0,5, 1, 2, 3, 4, 5 и 6 часов. Эти образцы использовали для измерения ОП600 и определения активности mCherry. Рост бактерий контролировали путем измерения оптической плотности при 600 нм (ОП600) индуцированных бактериальных клеток или неиндуцированных контрольных клеток. Сравнение соответствующих кривых роста представлено на фигуре 19а.
Флуоресцентную активность mCherry измеряли с использованием флуориспектрофотометра Synergy HT (Biotek, Уинуски, штат Вермонт, США). Возбуждение выполняли при 530 нм, излучение измеряли при 590 нм и применяли коэффициент усиления 120.
Результаты показаны на фигуре 19b. Как видно на фигуре 19b, индукция экспрессии гена mCherry путем добавления 100 мМ NaCl приводила к значительному увеличению флуоресценции, что соответствовало увеличению количества белка mCherry, продуцируемого посредством хлорид-индуцированной экспрессии гетерологичного гена в L. lactis NZ 1330. Повышенная экспрессия белка mCherry не оказывала существенного влияния на жизнеспособность соответствующих бактерий после индукции экспрессии гена mCherry, поскольку кривая роста индуцированных бактерий не демонстрировала значительного снижения скорости роста по сравнению с неиндуцированными бактериями, как можно видеть на фигуре 19а.
Хлорид-индуцированную экспрессию ФРФ-2, ИЛ-4 и КСФ-1 рекомбинантным штаммом, обозначенным как AUP-1602-C, определяли с помощью вестерн-блоттинга 1 мл супернатантов, осажденных ТХУ и полученных центрифугированием соответствующей культуры при 14000 g в течение 10 мин при +4°C с использованием вышеуказанного протокола.
В качестве стандартов положительного контроля использовали очищенный препарат доступного для приобретения рекомбинантного белка КСФ-1 человека (Abcam PLC, 5 нг), рекомбинантного белка ФРФ-2 человека (R&D Systems, 7,5 нг) и рекомбинантного белка ИЛ-4 человека (Sigma Aldrich, 5 нг). Соответствующие используемые первичные антитела указаны выше. В качестве вторичного антитела использовали антитело против IgG кролика, связанное с ПХ, производства New England BioLabs (номер в каталоге 7074).
Соответствующие вестерн-блоты представлены на фигуре 20а. Как можно видеть на фигуре 20а, штамм AUP-1602-C экспрессировал все три рекомбинантных белка и высвобождал их в супернатант.
Хлорид-индуцированную экспрессию ГМКСФ рекомбинантным штаммом, обозначенным как AUP5563-C, определяли с помощью вестерн-блоттинга 1 мл супернатантов, осажденных ТХУ и полученных центрифугированием соответствующих культур при 14000 g в течение 10 мин при +4°C с использованием вышеуказанного протокола. В качестве стандарта положительного контроля использовали очищенный препарат доступного для приобретения рекомбинантного белка ГМКСФ мыши (Sigma Aldrich).
Соответствующие вестерн-блоты показаны на фигуре 20b. Как можно видеть на фигуре 20b, AUP5563-C экспрессировал ГМКСФ и высвобождал его в супернатант.
Хлорид-индуцированную экспрессию ИЛ-18 рекомбинантным штаммом, обозначенным как AUP5563-C, определяли с помощью вестерн-блоттинга 1 мл супернатантов, осажденных ТХУ и полученных центрифугированием соответствующих культур при 14000 g в течение 10 мин при +4°C с использованием вышеуказанного протокола. В качестве стандарта положительного контроля использовали очищенный препарат доступного для приобретения рекомбинантного белка ИЛ-18 мыши (R&D Systems).
Соответствующий вестерн-блот показан на фигуре 20c. Как можно видеть на фигуре 20c, AUP5563-C экспрессировал ИЛ-18 и высвобождал его в супернатант.
Хлорид-индуцированную экспрессию ИЛ-12 рекомбинантными штаммами, обозначенными как AUP5551m-C и AUP5563-C, определяли с помощью вестерн-блоттинга 1 мл супернатантов, осажденных ТХУ и полученных центрифугированием соответствующих культур при 14000 g в течение 10 мин при +4°C с использованием вышеуказанного протокола. В качестве стандарта положительного контроля использовали очищенный препарат доступного для приобретения рекомбинантного белка ИЛ-12 мыши (R&D Systems).
Соответствующий вестерн-блот показан на фигуре 20d. Как можно видеть на фигуре 20d, штаммы AUP5551m-C и AUP5563-C экспрессировали ИЛ-12 и высвобождали его в супернатант.
Пример 4 Определение активности промотора Pgad in vivo
Активность системы промотора Pgad in vivo оценивали с использованием хлорид-индуцируемого конструкта mCherry и измерением флуоресцентного сигнала in situ после внутриопухолевой (в/о) инъекции.
Линия CT26 мыши представляет собой N-нитрозо-N-метилуретан-(NNMU)-индуцируемую недифференцированную линию клеток карциномы толстой кишки Mus musculus. Ее клонировали для получения линии клеток, обозначенной как CT26.WT (ATCC® CRL-2638™), которая доступна для приобретения в LGC Standards GmbH.
Клетки CT26.WT могли индуцировать летальные опухоли при инокуляции мышам BALB/c.
Согласно Wang, M. et al. (1995), у мышей BALB/c, которым подкожно инокулировали клетки CT26, развивались летальные опухоли с частотой 80% при введении 103 клеток и с частотой 100% при введении 104 клеток. Метастазы в легких развивались при внутривенном введении 104 клеток мышам. В настоящем исследовании использовали мышей BALB/cJ (генотип: A/A Tyrp1b/Tyrp1b Tyrc/Tyrc, код продукта 000651), приобретенных в The Jackson Laboratory (Бар-Харбор, штат Мэн, США).
Мышам BALB/c инокулировали клетки CT26.WT с помощью следующей процедуры:
1 × 10-5 опухолевых клеток в 0,1 мл PBS вводили путем подкожной инъекции в левый бок мышей. Лечение начинали, когда опухоли достигали среднего объема ~100-200 мм3, после чего мышей распределяли по экспериментальным группам с равномерным средним объемом опухоли между группами.
После однократной внутриопухолевой инъекции L. lactis NZ1330, содержащей конструкт pC-mCherry, мышей с опухолью визуализировали с использованием IVIS Spectrum CT (фильтры возбуждения: 535-570 нм/фильтры излучения: 580-680 нм). Животных визуализировали через 48 часов после в/о инъекции бактерий L. lactis NZ1330 (pC-mCherry) или контрольных бактерий, т.е. L. lactis NZ1330 без плазмиды mCherry. Продолжительность и объединение пикселей на матрице (чувствительность) получения изображения зависели от интенсивности присутствующих очагов, изображения получали и обрабатывали с помощью программного обеспечения Living Image 4.3.1 (PerkinElmer, Inc., Уолтем, штат Массачусетс, США).
Результаты показаны на фигуре 21, на которой продемонстрирована флуоресцентная визуализация через 48 часов после в/о инъекции бактерий L. lactis NZ1330 (pC-mCherry), а также контрольных бактерий. Черные круги указывают на положение опухоли. Повышенная активность mCherry обозначена черной областью.
Как можно видеть на фигуре 21, однократная 50-мкл внутриопухолевая инъекция 2×1010 КОЕ/мл рекомбинантных бактерий, полученных в примере 3 и экспрессирующих белок mCherry под контролем системы промотора PgadC, обеспечивала достаточную локализацию и выживаемость соответствующих бактерий в опухолевом окружении.
Результаты ясно показывают, что рекомбинантные бактерии согласно настоящему изобретению могут выживать в опухолевом окружении достаточно долго, чтобы экспрессировать и секретировать по меньшей мере один терапевтический белок, тем самым воздействуя на клетки врожденной и/или адаптивной иммунной системы опухолевого окружения с развитием противоопухолевого ответа.
Кроме того, концентрация хлорида в опухолевом окружении является достаточно высокой для обеспечения экспрессии соответствующего по меньшей мере одного терапевтического белка, который должны экспрессировать рекомбинантные бактерии согласно настоящему изобретению.
Пример 5: Эксперименты по исследованию закрытия ран
Пациенты с сахарным диабетом склонны к нарушениям процесса заживления ран, при этом особенно распространенными являются язвы на ногах. Эта задержка заживления ран также характерна для животных с диабетом, включая мышей со спонтанным диабетом (db/db), приобретенных в The Jackson Laboratory (Бар-Харбор, штат Мэн, США).
В первом исследовании использовали 60 самцов мышей с диабетом (название линии BKS.Cg-Dock7m+/+Leprdb/J, код продукта 00642) в возрасте приблизительно 10 недель.
Последствия применения бактерий, экспрессирующих комбинацию ФРФ-2, КСФ1 и ИЛ-4 человека под контролем промотора PgadC, при хирургических ранах на всю толщину кожи у диабетических мышей db/db исследовали в комбинированном фармакокинетическом (ФК)/фармакодинамическом (ФД) исследовании эффективности.
При этом рекомбинантные бактерии, обозначенные как AUP16-C, полученные в примере 3 и экспрессирующие ФРФ-2, ИЛ-4 и КСФ-1 в одной бактериальной клетке, оценивали и сравнивали с обработкой средой-носителем. Состав соответствующих сред-носителей, используемых для нанесения, кратко изложен ниже:
Среда-носитель 1: 5% декстрозы в 0,9% физиологическом растворе.
Среда-носитель 2: 5% декстроза+0,9% физиологический раствор+200 мМ ацетат натрия (pH 6,5)
Среда-носитель 3: 5% декстроза+2,5% раствор NaCl
Среда-носитель 4: 5% декстроза+2,5% раствор NaCl+200 мМ ацетат натрия (pH 6,5)
Среда-носитель 5: 10% декстроза+0,9% физиологический раствор
Среда-носитель 6: 10% декстроза+0,9% физиологический раствор+200 мМ ацетат натрия (pH 6,5)
Животных рандомизировали в группы для получения одной из 7 схем лечения в соответствии с таблицей 2.
№
(все с пленочной повязкой)
Таблица 2: Экспериментальные группы и схемы лечения
Рекомбинантные бактерии, экспрессирующие ФРФ-2, ИЛ-4 и КСФ-1 в одной бактериальной клетке, вносили в раны в день нанесения раны (день 0), их выживаемость оценивали через 6 часов после внесения.
Для определения продукции ФРФ-2, КСФ-1 и/или ИЛ-4 указанными бактериями, внесенными в раны, из ран брали образцы раневой жидкости через 6 часов и 1, 2 и 7 дней. Системную кровь и основные органы собирали через 6 и 24 часа и 7 дней для облегчения ФК/ФД-анализа. Раны, которые обрабатывали только средой-носителем 1, использовали в качестве контролей для определения показателей ФК/ФД в данном исследовании.
Для оценки влияния указанных рекомбинантных бактерий на процесс заживления ран, бактерии, экспрессирующие ФРФ-2, КСФ-1 и ИЛ-4 человека, вносили в раны в день нанесения раны (день 0), а затем ежедневно вплоть до 6 дня после нанесения раны. Заживление ран, обработанных указанными рекомбинантными бактериями, сравнивали с заживлением ран, которые обрабатывали только свежей средой-носителем 1.
Заживление ран исследовали на макроскопическом и гистологическом уровнях. Заживление ран исследовали на макроскопическом уровне для определения инициации реакций восстановления неодермы, сближения краев ран и закрытия ран.
Закрытие раны и компоненты этого процесса, сближение краев раны и повторную эпителизацию раны, определяли на основании цифровых фотографий, сделанных через 0, 4 и 7 дней после нанесения раны. Гистологические оценки формирования грануляционной ткани (глубина) и ширины раны (кранио-каудальное сближение краев) выполняли на обычных окрашенных (гематоксилином и эозином) срезах. Указанные гистологические оценки выполняли на тканях, собранных на 7 день после нанесения раны.
Развитие нежелательных явлений контролировали и полностью документировали.
Получение полнослойных экспериментальных ран и применение лечения
Всех мышей анестезировали с использованием изофлурана и воздуха, их кожу на спинной стороне бока зажимали и очищали. Одну стандартизированную рану на всю толщину кожи (10 мм × 10 мм) создавали на левом боку приблизительно в 10 мм от позвоночника. Затем каждую рану фотографировали с помощью идентификационной таблички и калибровочной линейки.
Все раны затем перевязывали прозрачной пленочной повязкой Tegaderm® Film (3M Deutschland GmbH, Нойс, Германия). Затем животным давали возможность восстановиться в прогретом помещении (34°C). Затем животных обездвиживали и вводили дозу одного из лекарственных средств, описанных в таблице 2, каждый из которых вводили путем инъекции через пленку Tegaderm® с использованием иглы 27 калибра.
Лекарственные средства также наносили на раны ежедневно до 6 дня после нанесения раны, таким образом, на каждую рану выполняли 7 нанесений. Все раны тщательно контролировали на предмет чрезмерного накопления наносимых агентов и чрезмерного увлажнения области раны; избыток продукта/жидкости удаляли путем аспирации на 4, 6 и 8 день после нанесения раны, а также перед повторным нанесением на 4 и 6 день и перед удалением повязки на 8 день.
На 4, 8, 12 и 16 день после нанесения ран всех животных повторно анестезировали, пленочные повязки и свободную некротическую ткань осторожно удаляли, а их раны очищали с помощью стерильной марли, пропитанной физиологическим раствором. Затем раны фотографировали, повторно наносили (как указано выше) пленочную повязку Bioclusive®, и животным позволяли восстановиться в прогретом помещении (34°C).
Сразу после нанесения ран, а затем на 4, 8 и 12 день, все раны фотографировали с помощью цифровой камеры вместе с калибровочной/идентификационной пластинкой после удаления пленочной повязки и очистки раны.
Всех животных умертвили на 20 день после фотографирования ран. Умерщвление выполняли с помощью способа, соответствующего «Регламенту 1» МВД Великобритании.
Визуализационный анализ закрытия раны
Цифровые фотографии каждой раны получали вместе с идентификационной/калибровочной пластиной сразу после травмы, а затем на 4, 8, 12, 16 и 20 дни, открытую раневую поверхность измеряли и выражали в виде % площади раны по сравнению с 0 днем.
Программное обеспечение для анализа изображений Image Pro Plus (версия 4.1.0.0, Media Cybernetics, Inc., Роквилл, штат Мэриленд, США) использовали для расчета закрытия раны на основании масштабированных изображений ран, полученных в каждый момент оценки.
Сводные результаты для каждой экспериментальной группы приведены в таблице 3 и на фигуре 22.
Закрытие конкретной раны в конкретный момент времени выражали в виде процента площади раны, оставшегося по сравнению с начальной площадью раны сразу после травмы (т.е. в день 0). В таблице 3 показан средний процент оставшейся площади раны для всех экспериментальных групп.
(среднее значение+/- стандартная ошибка)
Таблица 3. Процент данных «Оставшаяся площадь раны» для всех экспериментальных групп.
Как видно из данных, представленных в таблице 3, все группы, получавшие бактерии AUP1602-C, независимо от среды-носителя доставки, демонстрировали значительно более быстрое закрытие ран по сравнению с контрольной группой (5% декстрозы в 0,9% физиологическом растворе) во все моменты времени.
Сближение краев раны
Сближение краев представляет собой центростремительное движение краев раны за счет уплотнения грануляционной ткани в «теле» раны.
Считается, что "уплотняющие" силы, которые управляют этим процессом, находятся в клетках ростка фибробластов. В данном исследовании % сближения краев рассчитывали следующим образом:
Средние данные процентного сближения краев раны для всех экспериментальных групп описаны в таблице 4 и на фигуре 23.
(среднее значение+/- стандартная ошибка)
Таблица 4: Сводные данные по «процентному сближению краев раны».
Как видно из таблицы 4, все группы, получавшие бактерии AUP1602-C, независимо от среды-носителя доставки, демонстрировали значительно более быстрое сближение краев ран по сравнению с контрольной группой (5% декстрозы в 0,9% физиологическом растворе) во все моменты времени (p ≤ 0,007).
Раны у мышей без диабета закрывались преимущественно за счет сближения краев, в то время как раны у мышей с диабетом характеризовались значительно сниженной способностью к сближению краев, вероятно, из-за нарушений формирования грануляционной ткани. В результате раны на животных с диабетом, как правило, закрывались за счет повторной эпителизации в большей степени, чем у животных без диабета. Считается, что силы, управляющие процессом сближения краев, происходят от деятельности фибробластов, которые заселяют неодермальный компартмент ран кожи.
Наблюдение усиленного сближения краев после нанесения AUP1602-C явным образом указывает на улучшение функции грануляционной ткани, что, в свою очередь, можно объяснить увеличением количества образованной грануляционной ткани, увеличением скорости ее образования и/или увеличением сократительной способности ткани.
Инициация заживления ран (образование неодермальной ткани)
Раны визуально оценивали ежедневно до 8 дня, а затем через день для установления их статуса «заживления». Каждую рану оценивали на предмет проявлений «активности образования неодермальной ткани», т.е. инициировался ли в ране процесс заживления дермы или нет.Каждую рану оценивали два независимых наблюдателя, и процент ран, демонстрирующих «активность образования неодермальной ткани», сравнивали между экспериментальными группами в каждый момент оценки.
Количество ран, реагирующих на лечение в каждой экспериментальной группе каждый день, показано в таблице 5.
Процентная доля ран, реагировавших на лечение в каждой экспериментальной группе в 1 день, показана на фигуре 24. Реакция заживления была очевидна в большинстве ран, обработанных AUP1602-C, независимо от среды-носителя, используемой после первого дня лечения в 1 день после нанесения раны.
В 1 день после нанесения раны обнаружили, что 100% ран инициировали реакцию заживления в экспериментальных группах AUP1602-C (среда-носитель 2), AUP1602-C (среда-носитель 3) и AUP1602-C (среда-носитель 6), 88% при получении AUP1602-C (среда-носитель 4), 80% при получении AUP1602-C (среда-носитель 1) и 75% при получении AUP1602-C (среда-носитель 5).
Значимых различий между этими экспериментальными группами не обнаружено (точный критерий Фишера).
Обнаружено, что 100% ран, получавших AUP1602-C, демонстрировали реакцию заживления ко 2 дню после нанесения раны.
Ни одна из ран, обработанных только средой-носителем 1 (5% декстроза в 0,9% физиологическом растворе), не демонстрировала реакции заживления в течение 20-дневного периода исследования.
Во всех экспериментальных группах во все оцениваемые моменты времени обнаруживали реакцию значительно большей доли ран, обработанных AUP1602-C, по сравнению с контрольной группой, получавшей среду-носитель (p ≤ 0,001, точный критерий Фишера).
Таблица 5: Количество ран, демонстрирующих «инициацию образования неодермальной ткани» после указанного дня после нанесения раны.
Значительно большая доля ран, обработанных бактериями AUP1602-C, независимо от состава, инициировала «образование неодермальной ткани» по сравнению с контрольной группой, получавшей среду-носитель 1 (только 5% декстроза в 0,9% физиологическом растворе), т.е. 100% ран, обработанных бактериями AUP, реагировали на лечение; в то время как раны, обработанные только средой-носителем 1, по-видимому, не реагировали на лечение.
Для всех сред-носителей состава лечение AUP1602-C инициировало очень раннюю реакцию в раневом ложе после нанесения (в течение 1-2 дней).
Ангиогенная реакция
Изображения ран на 4 и 8 день оценивали визуально с целью количественной оценки уровня ангиогенеза. Средний балльный показатель ангиогенной реакции на 4 и 8 день для всех групп показан в таблице 6. Балльные показатели усреднены по 2 независимым наблюдателям.
Таблица 6: Балльный показатель ангиогенной реакции на 4 и 8 день после нанесения ран.
Все лекарственные средства, включающие AUP1602-C, характеризовались значительно более высоким балльным показателем ангиогенеза, чем среда-носитель 1 сама по себе при наблюдении в 4 и 8 дни (p ≤ 0,002).
Раны, обработанные бактериями AUP1602-C, независимо от среды-носителя, демонстрировали значительно усиленный ангиогенез по сравнению с контрольной группой, получавшей среду-носитель 1 (5% декстрозы в 0,9% физиологическом растворе), как на 4, так и на 8 день.
Обнаружено, что все схемы лечения с использованием бактерий, исследованные в данном эксперименте, независимо от среды-носителя стимулировали восстановление ран у мышей с диабетом db/db, которые являются общепринятой и одной из лучших проверенных животных моделей замедленного заживления ран у человека.
Хирургические раны у мышей db/db характеризуются достоверно замедленным закрытием ран, пониженным образованием грануляционной ткани, пониженной васкуляризацией раневого ложа и заметно сниженной пролиферацией, например, как описано в работе Michaels et al. (2007) (“db/db mice exhibit severe wound-healing impairments compared with other murine diabetic strains in a silicone-splinted excisional wound model”, Wound Rep.Reg. 15, pages 665 to 670).
Экспериментальные результаты ясно показывают, что применение рекомбинантных бактерий согласно настоящему изобретению обеспечивало значительное улучшение при лечении ран у человека, особенно хронических ран.
Применение рекомбинантных бактерий согласно настоящему изобретению индуцировало образование грануляционной ткани, усиление васкуляризации раневого ложа и пролиферации, что приводило к более эффективному и ускоренному закрытию ран даже в модели, демонстрирующей серьезное нарушение процесса заживления ран.
Таким образом, полученные результаты указывают на то, что применение рекомбинантных бактерий согласно настоящему изобретению оказывало положительное влияние на воспалительные, предпочтительно хронические воспалительные, нарушения функции кожи, например, обморожение, экзему, псориаз, дерматит, язву, рану, красную волчанку, нейродермит и их комбинации, предпочтительно дерматит, язву, рану и их комбинации, еще предпочтительнее язву.
Например, хронические раны, например, хронические венозные язвы, хронические артериальные язвы, хронические диабетические язвы и хронические пролежни можно лечить путем нанесения рекомбинантных бактерий согласно настоящему изобретению, поскольку нарушения процесса заживления ран, наблюдаемые при соответствующих хронических ранах, устраняются после применения рекомбинантных бактерий согласно настоящему изобретению, предпочтительно экспрессирующих ФРФ-2 человека, ИЛ-4 человека и КСФ-1 человека.
Пример 6: Обнаружение ФРФ-2 человека, ИЛ-4 человека и КСФ-1 человека в раневой жидкости.
Как и в примере 5, мышей-самцов с диабетом (название линии BKS.Cg-Dock7m+/+Leprdb/J, код продукта 00642) в возрасте приблизительно 10 недель использовали в следующем исследовании.
В этом исследовании проверяли обнаружение соответствующих рекомбинантных белков после применения бактерий, экспрессирующих комбинацию ФРФ-2, КСФ-1 и ИЛ-4 человека под контролем промотора PgadC, при хирургических ранах на всю толщину кожи у мышей с диабетом db/db. При этом рекомбинантные бактерии, обозначенные как AUP16-C, полученные в примере 3 и экспрессирующие ФРФ-2, ИЛ-4 и КСФ-1 в одной бактериальной клетке, оценивали по отношению к составу среды-носителя. Состав соответствующих сред-носителей, используемых для нанесения, кратко изложен ниже:
Среда-носитель 1: 5% декстроза в 0,9% физиологическом растворе
Среда-носитель 4: 5% декстроза в 2,5% растворе NaCl
+200 мМ ацетата натрия (pH 6,5)
Среда-носитель 7: 5% декстроза в 2,5% растворе NaCl
+200 мМ ацетата натрия
+50 мМ L-глутаминовой кислоты (pH 6,0)
Образцы раневой жидкости получали с помощью концентраторов с порогом молекулярной массы 5 кДа (концентратора образцов Vivaspin®), доступных для приобретения в Sigma-Aldrich, с 0,5% ДСН в соответствии с протоколом производителя.
Образцы разделяли на гелях ДСН-ПААГ и наносили для блоттинга на нитроцеллюлозу, как описано выше в пункте I.8.
Рекомбинантные белки обнаруживали с использованием следующих антител:
Для обнаружения ФРФ-2 человека использовали очищенное моноклональное антитело мыши против ФРФ-2 человека (BD Transduction laboratories, Гейдельберг, Германия) при разбавлении 1:250. Вторичное антитело представляло собой связанное с пероксидазой хрена (ПХ) антитело против IgG мыши при разбавлении 1:10000, полученное в Bioké BV (Лейден, Нидерланды).
Для обнаружения ИЛ-4 человека использовали моноклональное IgG1-антитело мыши против ИЛ-4 человека производства R&D systems (клон №3007) при разбавлении 1:500. Вторичное антитело представляло собой связанное с ПХ антитело против IgG мыши при разбавлении 1:10000, полученное в Bioké B.V. (Лейден, Нидерланды).
Для обнаружения КСФ-1 человека использовали поликлональное антитело кролика против MКСФ человека производства Abcam PLC (клон ab9693) при разбавлении 1:2000. Вторичное антитело представляло собой связанное с ПХ антитело против IgG кролика при разбавлении 1:2000, полученное в Bioké B.V. (Лейден, Нидерланды).
Количество соответствующих рекомбинантных белков в раневой жидкости определяли путем сравнения с соответствующим эталонным белком.
Эталонный белок ФРФ-2 человека получали в Sigma Aldrich и растворяли в 5 мМ трис, рН=7,5 до конечной концентрации 100 мкг/мкл. В качестве эталона на различные дорожки для вестерн-блоттинга наносили общее количество 10 мг, 3,3 нг, 1,1 нг, 0,37 нг и 0,12 нг.Результаты показаны на фигурах 25а и 25b.
Эталонный белок ИЛ-4 человека получали в R&D systems (Миннеаполис, штат Миннесота, США). ИЛ-4 человека растворяли в PBS (5,8 мМ Na2HPO4, 4,2 мМ NaH2PO4, 145 мМ NaCl) до конечной концентрации 100 мкг/мл. В качестве эталона на различные дорожки для вестерн-блоттинга наносили общее количество 10 мг, 3,3 нг, 1,1 нг, 0,37 нг и 0,12 нг.Результаты показаны на фигурах 26а и 26b.
Эталонный белок КСФ-1 человека получали в Abcam PLC (Кембридж, Великобритания). КСФ-1 человека растворяли в стерильной воде до конечной концентрации 100 мкг/мл. В качестве эталона на различные дорожки для вестерн-блоттинга наносили общее количество 10 мг, 3,3 нг, 1,1 нг, 0,37 нг и 0,12 нг.Результаты показаны на фигурах 27а и 27b.
Рекомбинантные бактерии, использующие систему PgadC in vivo, должным образом экспрессировали ФРФ-2 человека, ИЛ-4 человека и КСФ-1 человека, и все три белка-мишени обнаруживались в раневой жидкости.
AUP1602-C с системой промотора PgadC продуцировал достаточное количество соответствующих белков-мишеней в условиях in vivo после местного нанесения соответствующих рекомбинантных бактерий без необходимости дополнительного введения внешнего индуктора и/или вспомогательного вещества, например, β-галактозидазы или низина.
Пример 7 Ингибирование роста клеток карциномы in vivo
Необходимым условием успешной иммунотерапии является наличие полностью функционирующей иммунной системы. При этом иммуногенность опухоли считается доминирующим признаком, позволяющим прогнозировать ответ на иммунотерапию.
Среди различных моделей мышей, разработанных для оценки свойств противораковых агентов и/или способов лечения, мыши, несущие опухоли генетически одной и той же линии мышей, являются сингенными моделями. Эти модели позволяют использовать интактную иммунную систему и микроокружение для испытаний иммунотерапевтических и/или антиангиогенных агентов, а также схем лечения.
Показано, что исходная линия мыши, использованная для создания соответствующей модели мыши, влияет на иммуногенность опухоли, причем опухоли, адаптированные для мышей BALB/c, как правило, являются более иммуногенными, чем, например, опухоли, адаптированные для мышей C57BL/6.
Кроме того, исследование солидных опухолей на моделях мыши, выполненное Lechner, M.G. et al. (2013), продемонстрировало, что среди различных опухолевых клеточных линий CT26, RENCA и 4T1 демонстрировали наибольшую положительную реакцию на схемы иммунотерапии, включая значительное снижение роста опухоли и увеличение выживаемости.
Поэтому клетки CT26 выбрали в качестве линии клеток для использования с мышами BALB/C для первоначальной оценки эффективности введения AUP5563-C4 in vivo.
Выполнили исследование эффективности AUP5563-C4, экспрессирующего ИЛ-12, ИЛ-18 и ГМКСФ, с оценкой эффекта внутриопухолевого введения бактериального препарата AUP5563-C4 при лечении подкожной модели рака CT-26 у мышей.
Как описано выше в примере 4, клетки CT26.WT использовали для индукции летальных опухолей у мышей BALB/c путем подкожной инъекции 1 × 105 клеток CT26.WT в 0,1 мл PBS в левый бок мышей с помощью иглы 27 калибра.
Массу тела, дозировку и комментарии, связанные с клиническим состоянием, регистрировали в режиме реального времени с использованием программного обеспечения для управления исследованием StudyDirector (StudyLog Systems, Inc., Сан-Франциско, штат Калифорния, США).
Опухоль измеряли 3 раза в неделю во время лечения, кажущийся объем опухоли оценивали по формуле
V=0,5 × (длина × ширина2),
где V представляет собой объем опухоли, L - длину опухоли, а W - ширину опухоли при измерении опухоли в двух измерениях с использованием электронных штангенциркулей, как, например, описано в Tomayko, M. and Reynolds, C. (1989).
Мышей случайным образом распределяли по экспериментальным группам. Лечение начинали, когда опухоли достигали среднего объема 50-100 мм3. Мышей распределяли в экспериментальные группы 1-3, равномерно распределяя средний объем опухоли между группами. Продолжительность лечения составила до 2 недель. Сводная информация об экспериментальных группах приведена в таблице 7.
Таблица 7: Сводная информация по экспериментальным группам
Эффективность оценивали после внутриопухолевой (в/о) инъекции AUP5563-C4 (1×108 КОЕ) 3 раза в неделю в течение 2 недель.
Группа, получавшая среду-носитель, служила в качестве отрицательного контроля, а мыши, получавшие антитело против CTLA-4 - в качестве положительного контроля. Моноклональное антитело против CTLA-4 мыши, клон 9D9, получили из Bio X Cell (Вест-Лебанон, штат Нью-Гемпшир, США); это антитело против белка 4, ассоциированного с цитотоксическими Т-лимфоцитами мыши (CTLA-4) - белкового рецептора, подавляющего иммунную систему.
Сводные результаты представлены на фигурах 28A-28C, на которых показана оценка роста опухоли после внутриопухолевого (в/о) введения (a) физиологического раствора (отрицательный контроль), (b) AUP5563-C4 и (c) антитела против CTLA4 мыши (положительный контроль), соответственно.
Как можно видеть на фигуре 28A и 28B, в/б инъекция AUP5563-C4 (1×108 КОЕ) 3 раза в неделю в течение 2 недель значительно снижала рост опухоли по сравнению с контрольными мышами, получавшими среду-носитель.
Введение AUP5563-C4 (1×108 КОЕ) 3 раза в неделю в течение 2 недель приводило к сопоставимому снижению роста опухоли по сравнению с лечением антителом против m-CTLA-4, использованным в качестве положительного контроля.
Результаты демонстрируют, что эффективность в/б введения AUP5563-C4 была аналогична эффективности ингибитора контрольной точки иммунного ответа - антитела против CTLA4.
Опухоли, обработанные путем внутриопухолевой инъекции физиологического раствора (отрицательный контроль), характеризовались нормальным ростом.
Пример 8 Лечение внутрибрюшинной опухоли у мышей
Для оценки обоснованности, а также эффективности после внутрибрюшинного введения рекомбинантных бактерий согласно настоящему изобретению, экспрессирующих по меньшей мере один терапевтический белок под контролем промотора Pgad, клетки B16-F1 внутрибрюшинно инокулировали мышам C57BL/6 и измеряли выживаемость в качестве основного конечного показателя.
Клетки меланомы B16 выбрали для инокуляции опухоли, поскольку мыши C57BL/6 являются сингенными хозяевами для клеток B16-F1 с высокой частотой получения опухолей, как описано в работе Fu, Q. et al.(2016).
Кроме того, показано, что эта модель реагировала на схемы иммунотерапевтического лечения, как описано в работе Lesinski, G.B. et al (2003).
Инокуляция клеток мыши B16-F1 мышам C57BL/6 приводила к развитию злокачественных опухолей, которые без лечения могут привести к смерти мышей до 20 дня после имплантации.
Мышей B16-F1 (KCLB №80007) получили из Корейского банка линий клеток. Клетки высевали в 96-луночные микропланшеты и инкубировали в течение 24 часов при следующих условиях:
• Условия культивирования: 37°C.
• Культуральная среда: Среда Игла в модификации Дульбекко (DMEM) (Life Technologies Corporation, Карлсбад, штат Калифорния, США) с добавлением 50 ед/мл пенициллина, 50 мкг/мл стрептомицина и эмбриональной сыворотки крупного рогатого скота до конечной концентрации 10 объемных %.
Клетки B16-F1 являются хорошо известной моделью для исследования метастазирования и формирования солидных опухолей.
В общей сложности 66 мышей C57BL/6N, приобретенных в Orient Bio Inc. (Кенгидо, Республика Корея), использовали в данном исследовании.
1 × 105 клеток B16F1 инокулировали каждой отдельной мыши C57BL/6 путем внутрибрюшинной (в/б) инъекции (день 0). Среду-носитель (5% декстрозы в 0,9% физиологическом растворе) или AUP2059/AUP5551-C (1:1) вводили внутрибрюшинно (300 мкл на инъекцию) три раза в неделю в течение до пяти недель, начиная с дня 0 (до 15-кратного введения между 0 и 35 днем).
Животных рандомизировали в группы для получения одной из 6 схем лечения в соответствии с таблицей 8.
№
Таблица 8: Экспериментальные группы и схемы лечения
Лечение выполняли путем введения комбинации лекарственных средств AUP2059 (мИЛ-18/мГМКСФ) и AUP5551-C (мИЛ-12/мИЛ-18/мИФНa2b), полученных в примере 3.
Рекомбинантные бактерии смешивали в соотношении 1:1 на основе КОЕ/мл в количестве 2×05, 2×106, 2×107 или 2×108 КОЕ на 300 мкл дозы.
Обработку выполняли путем в/б инъекции комбинации 1:1 AUP2059 (mIL18/мГМКСФ) и AUP5551-C2 (мИЛ-12/мИЛ-18/мИФНa2b) в 5% декстрозе в 0,9% физиологическом растворе, приобретенной в Dai Han Pharm. CO. (Дай Хан, Республика Корея).
Введение начинали в день 0 после инокуляции клеток B16F1.
Сводная информация о средней выживаемости по сравнению со средой-носителем приведена на фигуре 29.
Как можно видеть на фигуре 29, лечение комбинацией AUP2059 (мИЛ-18/мГМКСФ) и AUP5551-C2 (мИЛ-12/мИЛ-18/мИФНa2b) приводило к значительному увеличению времени выживания по сравнению с мышами, получавшими среду-носитель.
Трансплантация сингенных раковых клеток индуцировала быструю смертность в контрольной группе, получавшей среду-носитель, причем все эти животные умерли к 19 дню.
По сравнению с этим, лечение комбинацией AUP5551-C2 и AUP2059 увеличивало выживаемость мышей в зависимости от дозы. Выживаемость улучшалась более чем на 70%, средняя и медианная выживаемость составила 28,3 и 28 дней, соответственно. Эти результаты ясно показывают, что введение рекомбинантных бактерий согласно настоящему изобретению, например, комбинации AUP5551-C2 и AUP2059, с высокой эффективностью замедляет рост опухоли у сингенных мышей с внутрибрюшинными (IP) опухолями.
Литература
Beilharz K, et al. (2015): “Red fluorescent proteins for gene expression and protein localization studies in Streptococcus pneumoniae and efficient transformation with DNA assembled via the gibson assembly method”, Appl. Environ. Microbiol. 81(20), pages 7244 to 7252.
Birnboim, H.C.and Doly, J. (1979): “A rapid alkaline extraction procedure for screening recombinant plasmid DNA”, Nucleic Acids Res. 7(6), pages 1513 to 1523.
Bron, P.A. et al. (2002): “Use of the alr gene as a food-grade selection marker in lactic acid bacteria”, Appl. Environ. Microbiol. 68(11), pages 5663 to 5670
Bolotin et al. (2001): “The complete genome sequence of the lactic acid bacterium lactococcus lactis ssp.lactis IL1403”, Genome Res. Volume 11, pages 731 to 753.
de Vos, W.M. (1987): “Gene cloning and expression in lactic streptococci”, FEMS Microbiol. Lett. 46 (3), page 281 to 295.
de Vos, W.M. and Simons, G. (1994): Gene cloning and expression systems in Lactococci. In Genetics and Biotechnology of Lactic Acid Bacteria. Edited by Gasson MJ, de Vos WM. Oxford: Chapman and Hall; pages 52 to 105 - ISBN: 978-0-7514-0098-4.
Hols, P. et al. (1999): "Conversion of Lactococcus lactis from homolactic to homoalanine fermentation through metabolic engineering”, Nat. Biotechnol. 17(6), pages 588 to 592.
Ruhdal Jensen, P. and Hammer, K. (1998): “The Sequence of Spacers between the Consensus Sequences”, Appl. Environ. Microbiol. 64(1), pages 82 to 87.
Tan, P.S.T. et al. (1992): “Characterization of the Lactococcus lactis pepN gene encoding an aminopeptidase homologous to mammalian aminopeptidase N”, FEBS Lett. 306(1), pages 9 to 16.
Sanders, J.W. et al. (1998): ”A chloride-inducible acid resistance mechanism in Lactococcus lactis and its regulation”, Mol Microbiol. 27(2) pages 299 to 310.
Sanders, J.W. et al. (1997): “A chloride-inducible gene expression cassette and its use in induced lysis of Lactococcus lactis”, Appl. Environ. Microbiol. 63(12), pages 4877 to 4882.
van Asseldonk et al. (1993): “Functional analysis of the Lactococcus lactis usp45 secretion signal in the secretion of a homologous proteinase and a heterologous alpha-amylase”, Mol. Gen. Genet. 240 (3), 1993, pages 428-434.
van Asseldonk et al. (1990): “Cloning of usp45, a gene encoding a secreted protein from Lactococcus lactis subsp.lactis MG1363”, Gene 95 (1), 1990, pages 155 to 160.
Laemmli, U.K. (1970): “Cleavage of structural proteins during the assembly of the head of bacteriophage T4”, Nature 227 (5259), pages 680 to 685.
Tauer, C. et al. (2014), “Tuning constitutive recombinant gene expression in Lactobacillus plantarum“, Microbial. Cell Factories 13,150, doi: 10.1186/s12934-014-0150-z:
Wang, M. et al. (1995): “Active immunotherapy of cancer with a nonreplicating recombinant fowlpox virus encoding a model tumor-associated antigen”, J. Immunol. 154(9), pages 4685 to 4692.
Tomayko, M. and Reynolds, C. (1989): “Determination of subcutaneous tumor size in athymic (nude) mice”, Cancer Chemother. Pharmacol. 24(3), pages 148 to 154.
Lechner, M.G. (2013); „Immunogenicity of murine solid tumor models as a defining feature of in vivo behavior and response to immunotherapy“, J. Immunother. 36(9), pages 477 to 489.
Fu, Q. et.al (2016): „Novel murine tumour models depend on strain and route of inoculation“, Int. J. Exp.Path. (2016), 97, pages 351 to 356.
Lesinski, G.B. et al (2003: “The antitumor effects of IFN-α are abrogated in a STAT1-deficient mouse”, J. Clin. Invest. 112(2), pages 170 to 180.
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110>Aurealis Pharma AG
<120>Хлорид-индуцируемая прокариотическая система экспрессии
<130>56002WO/AW/MC/
<160>36
<170>BiSSAP 1.3.6
<210>1
<211>3201
<211>ДНК
<213>Искусственная последовательность
<220>
<223>плазмида pAUC1010
<400>1
agatctcatg acggagttta ttcttgacac aggtatggac ttatgatata ataaaacagt 60
actctgcagg catgcggtac cactagttct agagagctca agctttcttt gaaccaaaat 120
tagaaaacca aggcttgaaa cgttcaattg aaatggcaat taaacaaatt acagcacgtg 180
ttgctttgat tgatagccaa aaagcagcag ttgataaagc aattactgat attgctgaaa 240
aattgtaatt tataaataaa aatcaccttt tagaggtggt ttttttattt ataaattatt 300
cgtttgattt cgctttcgat agaacaatca aatcgtttct gagacgtttt agcgtttatt 360
tcgtttagtt atcggcataa tcgttaaaac aggcgttatc gtagcgtaaa agcccttgag 420
cgtagcgtgg ctttgcagcg aagatgttgt ctgttagatt atgaaagccg atgactgaat 480
gaaataataa gcgcagcgtc cttctatttc ggttggagga ggctcaaggg agtttgaggg 540
aatgaaattc cctcatgggt ttgattttaa aaattgcttg caattttgcc gagcggtagc 600
gctggaaaat ttttgaaaaa aatttggaat ttggaaaaaa atggggggaa aggaagcgaa 660
ttttgcttcc gtactacgac cccccattaa gtgccgagtg ccaatttttg tgccaaaaac 720
gctctatccc aactggctca agggtttgag gggtttttca atcgccaacg aatcgccaac 780
gttttcgcca acgtttttta taaatctata tttaagtagc tttatttttg tttttatgat 840
tacaaagtga tacactaatt ttataaaatt atttgattgg agttttttaa atggtgattt 900
cagaatcgaa aaaaagagtt atgatttctc tgacaaaaga gcaagataaa aaattaacag 960
atatggcgaa acaaaaagat ttttcaaaat ctgcggttgc ggcgttagct atagaagaat 1020
atgcaagaaa ggaatcagaa caaaaaaaat aagcgaaagc tcgcgttttt agaaggatac 1080
gagttttcgc tacttgtttt tgataaggta attatatcat ggctattaaa aatactaaag 1140
ctagaaattt tggattttta ttatatcctg actcaattcc taatgattgg aaagaaaaat 1200
tagagagttt gggcgtatct atggctgtca gtcctttaca cgatatggac gaaaaaaaag 1260
ataaagatac atggaatagt agtgatgtta tacgaaatgg aaagcactat aaaaaaccac 1320
actatcacgt tatatatatt gcacgaaatc ctgtaacaat agaaagcgtt aggaacaaga 1380
ttaagcgaaa attggggaat agttcagttg ctcatgttga gatacttgat tatatcaaag 1440
gttcatatga atatttgact catgaatcaa aggacgctat tgctaagaat aaacatatat 1500
acgacaaaaa agatattttg aacattaatg attttgatat tgaccgctat ataacacttg 1560
atgaaagcca aaaaagagaa ttgaagaatt tacttttaga tatagtggat gactataatt 1620
tggtaaatac aaaagattta atggctttta ttcgccttag gggagcggag tttggaattt 1680
taaatacgaa tgatgtaaaa gatattgttt caacaaactc tagcgccttt agattatggt 1740
ttgagggcaa ttatcagtgt ggatatagag caagttatgc aaaggttctt gatgctgaaa 1800
cgggggaaat aaaatgacaa acaaagaaaa agagttattt gctgaaaatg aggaattaaa 1860
aaaagaaatt aaggacttaa aagagcgtat tgaaagatac agagaaatgg aagttgaatt 1920
aagtacaaca atagatttat tgagaggagg gattattgaa taaataaaag cccccctgac 1980
gaaagtcgac atggtcgatg tctagatgct taaactagag aaaggtttaa aagatgaaaa 2040
cttcaccaca tcgtaatact tcagctattg ttgatttaaa agcgattaga aataatattg 2100
aaaaatttaa aaagcatatt aaccctaatg cagagatttg gccagcagtg aaagcagatg 2160
cttatggtca tggctcgatt gaggtttcta aagcggtgag cgatttggta ggtggttttt 2220
gtgtatcaaa cctagatgag gcaattgaat tacgaaatca tctggtgact aaaccgattt 2280
tagttttatc cggaattgtt ccagaagatg ttgatattgc agctgccctt aatattagtc 2340
ttactgcccc gagtttagaa tggttgaaat tggttgttca agaagaagca gaactttcag 2400
atttaaaaat tcatattggt gtagattctg gtatgggtcg gattggtatt cgtgatgttg 2460
aagaagctaa tcagatgatt gaacttgctg ataaatatgc gattaatttt gaaggaattt 2520
tcactcattt tgcgactgcg gatatggctg atgaaacaaa atttaaaaat caacaggcaa 2580
gatttaacaa aattatggcc ggattatcac gtcaaccaaa atttatacac tcaactaata 2640
cggccgctgc tttatggcat aaggaacaag ttcaagctat tgaacgttta gggatttcaa 2700
tgtatggctt gaatccaagt ggtaaaactt tggaacttcc ttttgaaatt gaacccgctc 2760
tctctttagt ttctgaattg actcatataa aaaaaatagc tgcaggtgaa acggttggtt 2820
atggtgcaac ttatgagacg agtgaagaaa cttggattgg aactgttcca attggttacg 2880
ctgacgggtg gacccgtcaa atgcaaggtt tcaaagtgct tgttgatgga aagttttgtg 2940
agattgttgg tcgagtttgt atggatcaaa tgatgataaa acttgataag tcttaccctt 3000
tgggaacgaa ggtcactttg attggtcgag ataaggctaa tgaaatcacg acaacagacg 3060
ttgctgattg gcgtggaacg attaattatg aagtgctttg cttactttct gatagaatca 3120
aaagaatcta taaataaaat taaaaaaact gtatttttac agtttttttg ttttctgtta 3180
aaagcagatg ataacctcac t 3201
<210>2
<211>1248
<211>ДНК
<213>Lactococcus lactis
<220>
<223>промотор PgadC
<400>2
tgagcgttgt ataagctttt atgtctttct atatcaactt ttaatagaaa tataaagtaa 60
tataaatgtt tttataataa attatgtgag atatattttt ttgtccgtac tggtatagat 120
ttgacgatta agtcttaaat aagttataat ctcaattgcg taatttctta aatacagaaa 180
taacaactac attggtagac tgattaaaaa gtgtacttga tgaactgtta taaaccttaa 240
aaaaataaaa ataatagttt gggggatgtt aaagatgtat aaaaaatatg gagattgttt 300
taaaaagttg cgaaaccaaa agaatttagg gttatcatac tttagtaaac ttggaataga 360
ccgttcaaat atatctagat ttgaacatgg aaaatgtatg atgagttttg agcgtataga 420
tttgatgtta gaagaaatgc aagttccgtt atctgagtac gaattgattg taaataattt 480
tatgccgaat ttccaagaat tttttatatt agaattggaa aaagctgaat ttagccaaaa 540
tcgagataaa ataaaagagt tgtattctga ggtcaaagaa acggggaatc atttactgac 600
ggttaccgtg aaaacgaagc ttgggaatat aagtcagaca gaagttaaag aaattgaagc 660
ttatctttgc aatattgaag agtggggata ttttgaactt actttatttt attttgtatc 720
tgattatctc aatgtcaatc aattagaatt gctgcttttt aattttgata aaagatgtga 780
aaattactgt agagtcttaa aatatagaag gagactattg caaatagcct ataaaagtgt 840
tgcgatatac gcggctaaag gagaaagaaa aaaagccgaa aatattttag aaatgactaa 900
aaaatatcga actgtgggag tcgatttata ttcagaagta ttaagacatc ttgctagagc 960
tatcattatt tttaattttg aaaatgcaga gattggggaa gaaaaaataa attatgctct 1020
tgagattttg gaagaatttg gaggaaagaa gataaaagaa ttctatcaga ataaaatgga 1080
aaagtatttg aaaaggtcaa tttagtctct tttgagctgt tgctttaaag caacagctca 1140
aaagagattt tctttattct agagcatata ctagagggtg aagataggtt gtctgaagca 1200
ttataacttg tcttttaaaa aattcaatca taaatataag gaggtatg 1248
<210>3
<211>27
<212>БЕЛОК
<213>Lactococcus lactis
<220>
<223>сигнал секреции Usp45
<400>3
Met Lys Lys Lys Ile Ile Ser Ala Ile Leu Met Ser Thr Val Ile Leu
1 5 10 15
Ser Ala Ala Ala Pro Leu Ser Gly Val Tyr Ala
20 25
<210>4
<211>16
<212>РНК
<213>Lactococcus lactis
<220>
<223>3’-конец 16S РНК
<400>4
ggaucaccuc cuuucu 16
<210>5
<211>155
<212>БЕЛОК
<213>Homo sapiens
<220>
<223>зрелая форма фактора роста фибробластов-2 человека (чФРФ-2)
<400>5
Met Ala Ala Gly Ser Ile Thr Thr Leu Pro Ala Leu Pro Glu Asp Gly
1 5 10 15
Gly Ser Gly Ala Phe Pro Pro Gly His Phe Lys Asp Pro Lys Arg Leu
20 25 30
Tyr Cys Lys Asn Gly Gly Phe Phe Leu Arg Ile His Pro Asp Gly Arg
35 40 45
Val Asp Gly Val Arg Glu Lys Ser Asp Pro His Ile Lys Leu Gln Leu
50 55 60
Gln Ala Glu Glu Arg Gly Val Val Ser Ile Lys Gly Val Cys Ala Asn
65 70 75 80
Arg Tyr Leu Ala Met Lys Glu Asp Gly Arg Leu Leu Ala Ser Lys Cys
85 90 95
Val Thr Asp Glu Cys Phe Phe Phe Glu Arg Leu Glu Ser Asn Asn Tyr
100 105 110
Asn Thr Tyr Arg Ser Arg Lys Tyr Thr Ser Trp Tyr Val Ala Leu Lys
115 120 125
Arg Thr Gly Gln Tyr Lys Leu Gly Ser Lys Thr Gly Pro Gly Gln Lys
130 135 140
Ala Ile Leu Phe Leu Pro Met Ser Ala Lys Ser
145 150 155
<210>6
<211>153
<212>БЕЛОК
<213>Искусственная последовательность
<220>
<223>рекомбинантный вариант чФРФ-2
<400>6
Ala Gly Ser Ile Thr Thr Leu Pro Ala Leu Pro Glu Asp Gly Gly Ser
1 5 10 15
Gly Ala Phe Pro Pro Gly His Phe Lys Asp Pro Lys Arg Leu Tyr Cys
20 25 30
Lys Asn Gly Gly Phe Phe Leu Arg Ile His Pro Asp Gly Arg Val Asp
35 40 45
Gly Val Arg Glu Lys Ser Asp Pro His Ile Lys Leu Gln Leu Gln Ala
50 55 60
Glu Glu Arg Gly Val Val Ser Ile Lys Gly Val Cys Ala Asn Arg Tyr
65 70 75 80
Leu Ala Met Lys Glu Asp Gly Arg Leu Leu Ala Ser Lys Cys Val Thr
85 90 95
Asp Glu Cys Phe Phe Phe Glu Arg Leu Glu Ser Asn Asn Tyr Asn Thr
100 105 110
Tyr Arg Ser Arg Lys Tyr Thr Ser Trp Tyr Val Ala Leu Lys Arg Thr
115 120 125
Gly Gln Tyr Lys Leu Gly Ser Lys Thr Gly Pro Gly Gln Lys Ala Ile
130 135 140
Leu Phe Leu Pro Met Ser Ala Lys Ser
145 150
<210>7
<211>180
<212>БЕЛОК
<213>Искусственная последовательность
<220>
<223>ракомбинантный белок-предшественник чФРФ-2-153
<400>7
Met Lys Lys Lys Ile Ile Ser Ala Ile Leu Met Ser Thr Val Ile Leu
1 5 10 15
Ser Ala Ala Ala Pro Leu Ser Gly Val Tyr Ala Ala Gly Ser Ile Thr
20 25 30
Thr Leu Pro Ala Leu Pro Glu Asp Gly Gly Ser Gly Ala Phe Pro Pro
35 40 45
Gly His Phe Lys Asp Pro Lys Arg Leu Tyr Cys Lys Asn Gly Gly Phe
50 55 60
Phe Leu Arg Ile His Pro Asp Gly Arg Val Asp Gly Val Arg Glu Lys
65 70 75 80
Ser Asp Pro His Ile Lys Leu Gln Leu Gln Ala Glu Glu Arg Gly Val
85 90 95
Val Ser Ile Lys Gly Val Cys Ala Asn Arg Tyr Leu Ala Met Lys Glu
100 105 110
Asp Gly Arg Leu Leu Ala Ser Lys Cys Val Thr Asp Glu Cys Phe Phe
115 120 125
Phe Glu Arg Leu Glu Ser Asn Asn Tyr Asn Thr Tyr Arg Ser Arg Lys
130 135 140
Tyr Thr Ser Trp Tyr Val Ala Leu Lys Arg Thr Gly Gln Tyr Lys Leu
145 150 155 160
Gly Ser Lys Thr Gly Pro Gly Gln Lys Ala Ile Leu Phe Leu Pro Met
165 170 175
Ser Ala Lys Ser
180
<210>8
<211>129
<212>БЕЛОК
<213>Homo sapiens
<220>
<223>зрелая форма интерлейкина-4 человека (чИЛ-4)
<400>8
His Lys Cys Asp Ile Thr Leu Gln Glu Ile Ile Lys Thr Leu Asn Ser
1 5 10 15
Leu Thr Glu Gln Lys Thr Leu Cys Thr Glu Leu Thr Val Thr Asp Ile
20 25 30
Phe Ala Ala Ser Lys Asn Thr Thr Glu Lys Glu Thr Phe Cys Arg Ala
35 40 45
Ala Thr Val Leu Arg Gln Phe Tyr Ser His His Glu Lys Asp Thr Arg
50 55 60
Cys Leu Gly Ala Thr Ala Gln Gln Phe His Arg His Lys Gln Leu Ile
65 70 75 80
Arg Phe Leu Lys Arg Leu Asp Arg Asn Leu Trp Gly Leu Ala Gly Leu
85 90 95
Asn Ser Cys Pro Val Lys Glu Ala Asn Gln Ser Thr Leu Glu Asn Phe
100 105 110
Leu Glu Arg Leu Lys Thr Ile Met Arg Glu Lys Tyr Ser Lys Cys Ser
115 120 125
Ser
<210>9
<211>130
<212>БЕЛОК
<213>Искусственная последовательность
<220>
<223>рекомбинантный вариант чИЛ-4
<400>9
Ala His Lys Cys Asp Ile Thr Leu Gln Glu Ile Ile Lys Thr Leu Asn
1 5 10 15
Ser Leu Thr Glu Gln Lys Thr Leu Cys Thr Glu Leu Thr Val Thr Asp
20 25 30
Ile Phe Ala Ala Ser Lys Asn Thr Thr Glu Lys Glu Thr Phe Cys Arg
35 40 45
Ala Ala Thr Val Leu Arg Gln Phe Tyr Ser His His Glu Lys Asp Thr
50 55 60
Arg Cys Leu Gly Ala Thr Ala Gln Gln Phe His Arg His Lys Gln Leu
65 70 75 80
Ile Arg Phe Leu Lys Arg Leu Asp Arg Asn Leu Trp Gly Leu Ala Gly
85 90 95
Leu Asn Ser Cys Pro Val Lys Glu Ala Asn Gln Ser Thr Leu Glu Asn
100 105 110
Phe Leu Glu Arg Leu Lys Thr Ile Met Arg Glu Lys Tyr Ser Lys Cys
115 120 125
Ser Ser
130
<210>10
<211>157
<212>БЕЛОК
<213>Искусственная последовательность
<220>
<223>рекомбинантный белок-предшественник чИЛ-4
<400>10
Met Lys Lys Lys Ile Ile Ser Ala Ile Leu Met Ser Thr Val Ile Leu
1 5 10 15
Ser Ala Ala Ala Pro Leu Ser Gly Val Tyr Ala Ala His Lys Cys Asp
20 25 30
Ile Thr Leu Gln Glu Ile Ile Lys Thr Leu Asn Ser Leu Thr Glu Gln
35 40 45
Lys Thr Leu Cys Thr Glu Leu Thr Val Thr Asp Ile Phe Ala Ala Ser
50 55 60
Lys Asn Thr Thr Glu Lys Glu Thr Phe Cys Arg Ala Ala Thr Val Leu
65 70 75 80
Arg Gln Phe Tyr Ser His His Glu Lys Asp Thr Arg Cys Leu Gly Ala
85 90 95
Thr Ala Gln Gln Phe His Arg His Lys Gln Leu Ile Arg Phe Leu Lys
100 105 110
Arg Leu Asp Arg Asn Leu Trp Gly Leu Ala Gly Leu Asn Ser Cys Pro
115 120 125
Val Lys Glu Ala Asn Gln Ser Thr Leu Glu Asn Phe Leu Glu Arg Leu
130 135 140
Lys Thr Ile Met Arg Glu Lys Tyr Ser Lys Cys Ser Ser
145 150 155
<210>11
<211>418
<212>БЕЛОК
<213>Homo sapiens
<220>
<223>зрелая форма колониестимулирующего фактора-1 человека (КСФ-1)
<400>11
Glu Glu Val Ser Glu Tyr Cys Ser His Met Ile Gly Ser Gly His Leu
1 5 10 15
Gln Ser Leu Gln Arg Leu Ile Asp Ser Gln Met Glu Thr Ser Cys Gln
20 25 30
Ile Thr Phe Glu Phe Val Asp Gln Glu Gln Leu Lys Asp Pro Val Cys
35 40 45
Tyr Leu Lys Lys Ala Phe Leu Leu Val Gln Asp Ile Met Glu Asp Thr
50 55 60
Met Arg Phe Arg Asp Asn Thr Pro Asn Ala Ile Ala Ile Val Gln Leu
65 70 75 80
Gln Glu Leu Ser Leu Arg Leu Lys Ser Cys Phe Thr Lys Asp Tyr Glu
85 90 95
Glu His Asp Lys Ala Cys Val Arg Thr Phe Tyr Glu Thr Pro Leu Gln
100 105 110
Leu Leu Glu Lys Val Lys Asn Val Phe Asn Glu Thr Lys Asn Leu Leu
115 120 125
Asp Lys Asp Trp Asn Ile Phe Ser Lys Asn Cys Asn Asn Ser Phe Ala
130 135 140
Glu Cys Ser Ser Gln Asp Val Val Thr Lys Pro Asp Cys Asn Cys Leu
145 150 155 160
Tyr Pro Lys Ala Ile Pro Ser Ser Asp Pro Ala Ser Val Ser Pro His
165 170 175
Gln Pro Leu Ala Pro Ser Met Ala Pro Val Ala Gly Leu Thr Trp Glu
180 185 190
Asp Ser Glu Gly Thr Glu Gly Ser Ser Leu Leu Pro Gly Glu Gln Pro
195 200 205
Leu His Thr Val Asp Pro Gly Ser Ala Lys Gln Arg Pro Pro Arg Ser
210 215 220
Thr Cys Gln Ser Phe Glu Pro Pro Glu Thr Pro Val Val Lys Asp Ser
225 230 235 240
Thr Ile Gly Gly Ser Pro Gln Pro Arg Pro Ser Val Gly Ala Phe Asn
245 250 255
Pro Gly Met Glu Asp Ile Leu Asp Ser Ala Met Gly Thr Asn Trp Val
260 265 270
Pro Glu Glu Ala Ser Gly Glu Ala Ser Glu Ile Pro Val Pro Gln Gly
275 280 285
Thr Glu Leu Ser Pro Ser Arg Pro Gly Gly Gly Ser Met Gln Thr Glu
290 295 300
Pro Ala Arg Pro Ser Asn Phe Leu Ser Ala Ser Ser Pro Leu Pro Ala
305 310 315 320
Ser Ala Lys Gly Gln Gln Pro Ala Asp Val Thr Gly Thr Ala Leu Pro
325 330 335
Arg Val Gly Pro Val Arg Pro Thr Gly Gln Asp Trp Asn His Thr Pro
340 345 350
Gln Lys Thr Asp His Pro Ser Ala Leu Leu Arg Asp Pro Pro Glu Pro
355 360 365
Gly Ser Pro Arg Ile Ser Ser Leu Arg Pro Gln Gly Leu Ser Asn Pro
370 375 380
Ser Thr Leu Ser Ala Gln Pro Gln Leu Ser Arg Ser His Ser Ser Gly
385 390 395 400
Ser Val Leu Pro Leu Gly Glu Leu Glu Gly Arg Arg Ser Thr Arg Asp
405 410 415
Arg Arg
<210>12
<211>159
<212>БЕЛОК
<213>Искусственная последовательность
<220>
<223>рекомбинантный вариант чКСФ-1
<400>12
Ala Glu Glu Val Ser Glu Tyr Cys Ser His Met Ile Gly Ser Gly His
1 5 10 15
Leu Gln Ser Leu Gln Arg Leu Ile Asp Ser Gln Met Glu Thr Ser Cys
20 25 30
Gln Ile Thr Phe Glu Phe Val Asp Gln Glu Gln Leu Lys Asp Pro Val
35 40 45
Cys Tyr Leu Lys Lys Ala Phe Leu Leu Val Gln Asp Ile Met Glu Asp
50 55 60
Thr Met Arg Phe Arg Asp Asn Thr Pro Asn Ala Ile Ala Ile Val Gln
65 70 75 80
Leu Gln Glu Leu Ser Leu Arg Leu Lys Ser Cys Phe Thr Lys Asp Tyr
85 90 95
Glu Glu His Asp Lys Ala Cys Val Arg Thr Phe Tyr Glu Thr Pro Leu
100 105 110
Gln Leu Leu Glu Lys Val Lys Asn Val Phe Asn Glu Thr Lys Asn Leu
115 120 125
Leu Asp Lys Asp Trp Asn Ile Phe Ser Lys Asn Cys Asn Asn Ser Phe
130 135 140
Ala Glu Cys Ser Ser Gln Gly His Glu Arg Gln Ser Glu Gly Ser
145 150 155
<210>13
<211>186
<212>БЕЛОК
<213>Искусственная последовательность
<220>
<223>рекомбинантный белок-предшественник чКСФ-1
<400>13
Met Lys Lys Lys Ile Ile Ser Ala Ile Leu Met Ser Thr Val Ile Leu
1 5 10 15
Ser Ala Ala Ala Pro Leu Ser Gly Val Tyr Ala Ala Glu Glu Val Ser
20 25 30
Glu Tyr Cys Ser His Met Ile Gly Ser Gly His Leu Gln Ser Leu Gln
35 40 45
Arg Leu Ile Asp Ser Gln Met Glu Thr Ser Cys Gln Ile Thr Phe Glu
50 55 60
Phe Val Asp Gln Glu Gln Leu Lys Asp Pro Val Cys Tyr Leu Lys Lys
65 70 75 80
Ala Phe Leu Leu Val Gln Asp Ile Met Glu Asp Thr Met Arg Phe Arg
85 90 95
Asp Asn Thr Pro Asn Ala Ile Ala Ile Val Gln Leu Gln Glu Leu Ser
100 105 110
Leu Arg Leu Lys Ser Cys Phe Thr Lys Asp Tyr Glu Glu His Asp Lys
115 120 125
Ala Cys Val Arg Thr Phe Tyr Glu Thr Pro Leu Gln Leu Leu Glu Lys
130 135 140
Val Lys Asn Val Phe Asn Glu Thr Lys Asn Leu Leu Asp Lys Asp Trp
145 150 155 160
Asn Ile Phe Ser Lys Asn Cys Asn Asn Ser Phe Ala Glu Cys Ser Ser
165 170 175
Gln Gly His Glu Arg Gln Ser Glu Gly Ser
180 185
<210>14
<211>2899
<211>ДНК
<213>Искусственная последовательность
<220>
<223>синтетический конструкт CFI
<400>14
agatctgagc gttgtataag cttttatgtc tttctatatc aacttttaat agaaatataa 60
agtaatataa atgtttttat aataaattat gtgagatata tttttttgtc cgtactggta 120
tagatttgac gattaagtct taaataagtt ataatctcaa ttgcgtaatt tcttaaatac 180
agaaataaca actacattgg tagactgatt aaaaagtgta cttgatgaac tgttataaac 240
cttaaaaaaa taaaaataat agtttggggg atgttaaaga tgtataaaaa atatggagat 300
tgttttaaaa agttgcgaaa ccaaaagaat ttagggttat catactttag taaacttgga 360
atagaccgtt caaatatatc tagatttgaa catggaaaat gtatgatgag ttttgagcgt 420
atagatttga tgttagaaga aatgcaagtt ccgttatctg agtacgaatt gattgtaaat 480
aattttatgc cgaatttcca agaatttttt atattagaat tggaaaaagc tgaatttagc 540
caaaatcgag ataaaataaa agagttgtat tctgaggtca aagaaacggg gaatcattta 600
ctgacggtta ccgtgaaaac gaagcttggg aatataagtc agacagaagt taaagaaatt 660
gaagcttatc tttgcaatat tgaagagtgg ggatattttg aacttacttt attttatttt 720
gtatctgatt atctcaatgt caatcaatta gaattgctgc tttttaattt tgataaaaga 780
tgtgaaaatt actgtagagt cttaaaatat agaaggagac tattgcaaat agcctataaa 840
agtgttgcga tatacgcggc taaaggagaa agaaaaaaag ccgaaaatat tttagaaatg 900
actaaaaaat atcgaactgt gggagtcgat ttatattcag aagtattaag acatcttgct 960
agagctatca ttatttttaa ttttgaaaat gcagagattg gggaagaaaa aataaattat 1020
gctcttgaga ttttggaaga atttggagga aagaagataa aagaattcta tcagaataaa 1080
atggaaaagt atttgaaaag gtcaatttag tctcttttga gctgttgctt taaagcaaca 1140
gctcaaaaga gattttcttt attctagagc atatactaga gggtgaagat aggttgtctg 1200
aagcattata acttgtcttt taaaaaattc aatcataaat ataaggaggt atgatgaaaa 1260
agaaaatcat ttcagcgatt ttgatgtcaa cggttatttt aagcgcagca gctccattat 1320
ctggagttta tgcagcagaa gaagttagtg agtactgtag tcatatgatt ggttctggac 1380
acttacaatc acttcagcgt cttattgata gtcaaatgga aacctcttgt caaattacat 1440
ttgaatttgt agaccaagaa caacttaaag atccagtatg ttatcttaag aaagcttttc 1500
ttttagtcca agacataatg gaagatacaa tgagattcag agacaatact cctaacgcta 1560
tcgccattgt ccaattacaa gaactttctt taagattgaa aagttgcttc actaaagatt 1620
atgaggaaca tgataaagct tgtgttcgaa cattttatga aactcctttg caattattgg 1680
aaaaagtgaa aaatgttttc aatgagacga agaatttgtt ggataaagat tggaatatat 1740
tcagtaagaa ttgtaataac tcatttgccg aatgttcaag ccagggtcat gaacgtcaat 1800
cagaaggctc ttaataaacg cgtattaata aggaggctaa ctaatgaaaa aaaagattat 1860
ctcagctatt ttaatgtcta cagtgatact ttctgctgca gccccgttgt caggtgttta 1920
cgctgctggt tccattacga ccttgccggc tttaccagag gacggaggtt caggagcctt 1980
tccaccaggg cactttaaag atcccaaacg tctatattgt aaaaatggag gcttctttct 2040
gcgaattcat cctgatggac gtgtagatgg tgtgcgtgag aaaagtgatc ctcatatcaa 2100
actccaactt caggcagaag aaagaggcgt cgtaagtata aaaggagttt gcgcgaatcg 2160
ttacttagct atgaaagaag acggtcgatt attggcctct aagtgtgtta ctgatgaatg 2220
tttttttttt gaacggcttg aatctaataa ttataacact tatagaagca gaaaatatac 2280
atcatggtac gttgcactta aaaggacagg tcaatataaa ttagggtcta agacaggacc 2340
tggtcaaaaa gcaattttgt tcttaccaat gtcggctaaa agttaataaa cgcgtgaaat 2400
ttaggaggta gtccaaatga agaaaaagat tattagtgca attttaatgt caacggtcat 2460
cttaagcgct gctgccccat tgtcaggtgt ttatgcagca cataagtgtg atataacatt 2520
acaagaaatt atcaaaaccc ttaatagttt aactgaacag aagactttgt gtaccgaatt 2580
aactgtaact gatatttttg ctgcttctaa aaatacaact gaaaaagaga cattttgtcg 2640
agctgccaca gtgttaagac aattttacag tcatcatgaa aaagacacaa gatgtcttgg 2700
tgctacggca caacaatttc atagacacaa acaacttatc cgttttctta aacgtttgga 2760
tcgtaatctg tggggcttgg caggattgaa cagttgtcct gttaaagaag ccaatcaatc 2820
tactcttgaa aatttcttag agagattgaa aacaattatg cgagaaaaat attctaagtg 2880
ttcatcttaa taagcatgc 2899
<210>15
<211>6025
<211>ДНК
<213>Искусственная последовательность
<220>
<223>плазмида pC-CFI
<400>15
agatctgagc gttgtataag cttttatgtc tttctatatc aacttttaat agaaatataa 60
agtaatataa atgtttttat aataaattat gtgagatata tttttttgtc cgtactggta 120
tagatttgac gattaagtct taaataagtt ataatctcaa ttgcgtaatt tcttaaatac 180
agaaataaca actacattgg tagactgatt aaaaagtgta cttgatgaac tgttataaac 240
cttaaaaaaa taaaaataat agtttggggg atgttaaaga tgtataaaaa atatggagat 300
tgttttaaaa agttgcgaaa ccaaaagaat ttagggttat catactttag taaacttgga 360
atagaccgtt caaatatatc tagatttgaa catggaaaat gtatgatgag ttttgagcgt 420
atagatttga tgttagaaga aatgcaagtt ccgttatctg agtacgaatt gattgtaaat 480
aattttatgc cgaatttcca agaatttttt atattagaat tggaaaaagc tgaatttagc 540
caaaatcgag ataaaataaa agagttgtat tctgaggtca aagaaacggg gaatcattta 600
ctgacggtta ccgtgaaaac gaagcttggg aatataagtc agacagaagt taaagaaatt 660
gaagcttatc tttgcaatat tgaagagtgg ggatattttg aacttacttt attttatttt 720
gtatctgatt atctcaatgt caatcaatta gaattgctgc tttttaattt tgataaaaga 780
tgtgaaaatt actgtagagt cttaaaatat agaaggagac tattgcaaat agcctataaa 840
agtgttgcga tatacgcggc taaaggagaa agaaaaaaag ccgaaaatat tttagaaatg 900
actaaaaaat atcgaactgt gggagtcgat ttatattcag aagtattaag acatcttgct 960
agagctatca ttatttttaa ttttgaaaat gcagagattg gggaagaaaa aataaattat 1020
gctcttgaga ttttggaaga atttggagga aagaagataa aagaattcta tcagaataaa 1080
atggaaaagt atttgaaaag gtcaatttag tctcttttga gctgttgctt taaagcaaca 1140
gctcaaaaga gattttcttt attctagagc atatactaga gggtgaagat aggttgtctg 1200
aagcattata acttgtcttt taaaaaattc aatcataaat ataaggaggt atgatgaaaa 1260
agaaaatcat ttcagcgatt ttgatgtcaa cggttatttt aagcgcagca gctccattat 1320
ctggagttta tgcagcagaa gaagttagtg agtactgtag tcatatgatt ggttctggac 1380
acttacaatc acttcagcgt cttattgata gtcaaatgga aacctcttgt caaattacat 1440
ttgaatttgt agaccaagaa caacttaaag atccagtatg ttatcttaag aaagcttttc 1500
ttttagtcca agacataatg gaagatacaa tgagattcag agacaatact cctaacgcta 1560
tcgccattgt ccaattacaa gaactttctt taagattgaa aagttgcttc actaaagatt 1620
atgaggaaca tgataaagct tgtgttcgaa cattttatga aactcctttg caattattgg 1680
aaaaagtgaa aaatgttttc aatgagacga agaatttgtt ggataaagat tggaatatat 1740
tcagtaagaa ttgtaataac tcatttgccg aatgttcaag ccagggtcat gaacgtcaat 1800
cagaaggctc ttaataaacg cgtattaata aggaggctaa ctaatgaaaa aaaagattat 1860
ctcagctatt ttaatgtcta cagtgatact ttctgctgca gccccgttgt caggtgttta 1920
cgctgctggt tccattacga ccttgccggc tttaccagag gacggaggtt caggagcctt 1980
tccaccaggg cactttaaag atcccaaacg tctatattgt aaaaatggag gcttctttct 2040
gcgaattcat cctgatggac gtgtagatgg tgtgcgtgag aaaagtgatc ctcatatcaa 2100
actccaactt caggcagaag aaagaggcgt cgtaagtata aaaggagttt gcgcgaatcg 2160
ttacttagct atgaaagaag acggtcgatt attggcctct aagtgtgtta ctgatgaatg 2220
tttttttttt gaacggcttg aatctaataa ttataacact tatagaagca gaaaatatac 2280
atcatggtac gttgcactta aaaggacagg tcaatataaa ttagggtcta agacaggacc 2340
tggtcaaaaa gcaattttgt tcttaccaat gtcggctaaa agttaataaa cgcgtgaaat 2400
ttaggaggta gtccaaatga agaaaaagat tattagtgca attttaatgt caacggtcat 2460
cttaagcgct gctgccccat tgtcaggtgt ttatgcagca cataagtgtg atataacatt 2520
acaagaaatt atcaaaaccc ttaatagttt aactgaacag aagactttgt gtaccgaatt 2580
aactgtaact gatatttttg ctgcttctaa aaatacaact gaaaaagaga cattttgtcg 2640
agctgccaca gtgttaagac aattttacag tcatcatgaa aaagacacaa gatgtcttgg 2700
tgctacggca caacaatttc atagacacaa acaacttatc cgttttctta aacgtttgga 2760
tcgtaatctg tggggcttgg caggattgaa cagttgtcct gttaaagaag ccaatcaatc 2820
tactcttgaa aatttcttag agagattgaa aacaattatg cgagaaaaat attctaagtg 2880
ttcatcttaa taagcatgcg gtaccactag ttctagagag ctcaagcttt ctttgaacca 2940
aaattagaaa accaaggctt gaaacgttca attgaaatgg caattaaaca aattacagca 3000
cgtgttgctt tgattgatag ccaaaaagca gcagttgata aagcaattac tgatattgct 3060
gaaaaattgt aatttataaa taaaaatcac cttttagagg tggttttttt atttataaat 3120
tattcgtttg atttcgcttt cgatagaaca atcaaatcgt ttctgagacg ttttagcgtt 3180
tatttcgttt agttatcggc ataatcgtta aaacaggcgt tatcgtagcg taaaagccct 3240
tgagcgtagc gtggctttgc agcgaagatg ttgtctgtta gattatgaaa gccgatgact 3300
gaatgaaata ataagcgcag cgtccttcta tttcggttgg aggaggctca agggagtttg 3360
agggaatgaa attccctcat gggtttgatt ttaaaaattg cttgcaattt tgccgagcgg 3420
tagcgctgga aaatttttga aaaaaatttg gaatttggaa aaaaatgggg ggaaaggaag 3480
cgaattttgc ttccgtacta cgacccccca ttaagtgccg agtgccaatt tttgtgccaa 3540
aaacgctcta tcccaactgg ctcaagggtt tgaggggttt ttcaatcgcc aacgaatcgc 3600
caacgttttc gccaacgttt tttataaatc tatatttaag tagctttatt tttgttttta 3660
tgattacaaa gtgatacact aattttataa aattatttga ttggagtttt ttaaatggtg 3720
atttcagaat cgaaaaaaag agttatgatt tctctgacaa aagagcaaga taaaaaatta 3780
acagatatgg cgaaacaaaa agatttttca aaatctgcgg ttgcggcgtt agctatagaa 3840
gaatatgcaa gaaaggaatc agaacaaaaa aaataagcga aagctcgcgt ttttagaagg 3900
atacgagttt tcgctacttg tttttgataa ggtaattata tcatggctat taaaaatact 3960
aaagctagaa attttggatt tttattatat cctgactcaa ttcctaatga ttggaaagaa 4020
aaattagaga gtttgggcgt atctatggct gtcagtcctt tacacgatat ggacgaaaaa 4080
aaagataaag atacatggaa tagtagtgat gttatacgaa atggaaagca ctataaaaaa 4140
ccacactatc acgttatata tattgcacga aatcctgtaa caatagaaag cgttaggaac 4200
aagattaagc gaaaattggg gaatagttca gttgctcatg ttgagatact tgattatatc 4260
aaaggttcat atgaatattt gactcatgaa tcaaaggacg ctattgctaa gaataaacat 4320
atatacgaca aaaaagatat tttgaacatt aatgattttg atattgaccg ctatataaca 4380
cttgatgaaa gccaaaaaag agaattgaag aatttacttt tagatatagt ggatgactat 4440
aatttggtaa atacaaaaga tttaatggct tttattcgcc ttaggggagc ggagtttgga 4500
attttaaata cgaatgatgt aaaagatatt gtttcaacaa actctagcgc ctttagatta 4560
tggtttgagg gcaattatca gtgtggatat agagcaagtt atgcaaaggt tcttgatgct 4620
gaaacggggg aaataaaatg acaaacaaag aaaaagagtt atttgctgaa aatgaggaat 4680
taaaaaaaga aattaaggac ttaaaagagc gtattgaaag atacagagaa atggaagttg 4740
aattaagtac aacaatagat ttattgagag gagggattat tgaataaata aaagcccccc 4800
tgacgaaagt cgacatggtc gatgtctaga tgcttaaact agagaaaggt ttaaaagatg 4860
aaaacttcac cacatcgtaa tacttcagct attgttgatt taaaagcgat tagaaataat 4920
attgaaaaat ttaaaaagca tattaaccct aatgcagaga tttggccagc agtgaaagca 4980
gatgcttatg gtcatggctc gattgaggtt tctaaagcgg tgagcgattt ggtaggtggt 5040
ttttgtgtat caaacctaga tgaggcaatt gaattacgaa atcatctggt gactaaaccg 5100
attttagttt tatccggaat tgttccagaa gatgttgata ttgcagctgc ccttaatatt 5160
agtcttactg ccccgagttt agaatggttg aaattggttg ttcaagaaga agcagaactt 5220
tcagatttaa aaattcatat tggtgtagat tctggtatgg gtcggattgg tattcgtgat 5280
gttgaagaag ctaatcagat gattgaactt gctgataaat atgcgattaa ttttgaagga 5340
attttcactc attttgcgac tgcggatatg gctgatgaaa caaaatttaa aaatcaacag 5400
gcaagattta acaaaattat ggccggatta tcacgtcaac caaaatttat acactcaact 5460
aatacggccg ctgctttatg gcataaggaa caagttcaag ctattgaacg tttagggatt 5520
tcaatgtatg gcttgaatcc aagtggtaaa actttggaac ttccttttga aattgaaccc 5580
gctctctctt tagtttctga attgactcat ataaaaaaaa tagctgcagg tgaaacggtt 5640
ggttatggtg caacttatga gacgagtgaa gaaacttgga ttggaactgt tccaattggt 5700
tacgctgacg ggtggacccg tcaaatgcaa ggtttcaaag tgcttgttga tggaaagttt 5760
tgtgagattg ttggtcgagt ttgtatggat caaatgatga taaaacttga taagtcttac 5820
cctttgggaa cgaaggtcac tttgattggt cgagataagg ctaatgaaat cacgacaaca 5880
gacgttgctg attggcgtgg aacgattaat tatgaagtgc tttgcttact ttctgataga 5940
atcaaaagaa tctataaata aaattaaaaa aactgtattt ttacagtttt tttgttttct 6000
gttaaaagca gatgataacc tcact 6025
<210>16
<211>157
<212>БЕЛОК
<213>Mus musculus
<220>
<223>зрелая форма интерлейкина-18 мыши (мИЛ-18)
<400>16
Asn Phe Gly Arg Leu His Cys Thr Thr Ala Val Ile Arg Asn Ile Asn
1 5 10 15
Asp Gln Val Leu Phe Val Asp Lys Arg Gln Pro Val Phe Glu Asp Met
20 25 30
Thr Asp Ile Asp Gln Ser Ala Ser Glu Pro Gln Thr Arg Leu Ile Ile
35 40 45
Tyr Met Tyr Lys Asp Ser Glu Val Arg Gly Leu Ala Val Thr Leu Ser
50 55 60
Val Lys Asp Ser Lys Met Ser Thr Leu Ser Cys Lys Asn Lys Ile Ile
65 70 75 80
Ser Phe Glu Glu Met Asp Pro Pro Glu Asn Ile Asp Asp Ile Gln Ser
85 90 95
Asp Leu Ile Phe Phe Gln Lys Arg Val Pro Gly His Asn Lys Met Glu
100 105 110
Phe Glu Ser Ser Leu Tyr Glu Gly His Phe Leu Ala Cys Gln Lys Glu
115 120 125
Asp Asp Ala Phe Lys Leu Ile Leu Lys Lys Lys Asp Glu Asn Gly Asp
130 135 140
Lys Ser Val Met Phe Thr Leu Thr Asn Leu His Gln Ser
145 150 155
<210>17
<211>158
<212>БЕЛОК
<213>Искусственная последовательность
<220>
<223>рекомбинантный вариант мИЛ-18
<400>17
Ala Asn Phe Gly Arg Leu His Cys Thr Thr Ala Val Ile Arg Asn Ile
1 5 10 15
Asn Asp Gln Val Leu Phe Val Asp Lys Arg Gln Pro Val Phe Glu Asp
20 25 30
Met Thr Asp Ile Asp Gln Ser Ala Ser Glu Pro Gln Thr Arg Leu Ile
35 40 45
Ile Tyr Met Tyr Lys Asp Ser Glu Val Arg Gly Leu Ala Val Thr Leu
50 55 60
Ser Val Lys Asp Ser Lys Met Ser Thr Leu Ser Cys Lys Asn Lys Ile
65 70 75 80
Ile Ser Phe Glu Glu Met Asp Pro Pro Glu Asn Ile Asp Asp Ile Gln
85 90 95
Ser Asp Leu Ile Phe Phe Gln Lys Arg Val Pro Gly His Asn Lys Met
100 105 110
Glu Phe Glu Ser Ser Leu Tyr Glu Gly His Phe Leu Ala Cys Gln Lys
115 120 125
Glu Asp Asp Ala Phe Lys Leu Ile Leu Lys Lys Lys Asp Glu Asn Gly
130 135 140
Asp Lys Ser Val Met Phe Thr Leu Thr Asn Leu His Gln Ser
145 150 155
<210>18
<211>185
<212>БЕЛОК
<213>Искусственная последовательность
<220>
<223>рекомбинантный белок-предшественник мИЛ-18
<400>18
Met Lys Lys Lys Ile Ile Ser Ala Ile Leu Met Ser Thr Val Ile Leu
1 5 10 15
Ser Ala Ala Ala Pro Leu Ser Gly Val Tyr Ala Ala Asn Phe Gly Arg
20 25 30
Leu His Cys Thr Thr Ala Val Ile Arg Asn Ile Asn Asp Gln Val Leu
35 40 45
Phe Val Asp Lys Arg Gln Pro Val Phe Glu Asp Met Thr Asp Ile Asp
50 55 60
Gln Ser Ala Ser Glu Pro Gln Thr Arg Leu Ile Ile Tyr Met Tyr Lys
65 70 75 80
Asp Ser Glu Val Arg Gly Leu Ala Val Thr Leu Ser Val Lys Asp Ser
85 90 95
Lys Met Ser Thr Leu Ser Cys Lys Asn Lys Ile Ile Ser Phe Glu Glu
100 105 110
Met Asp Pro Pro Glu Asn Ile Asp Asp Ile Gln Ser Asp Leu Ile Phe
115 120 125
Phe Gln Lys Arg Val Pro Gly His Asn Lys Met Glu Phe Glu Ser Ser
130 135 140
Leu Tyr Glu Gly His Phe Leu Ala Cys Gln Lys Glu Asp Asp Ala Phe
145 150 155 160
Lys Leu Ile Leu Lys Lys Lys Asp Glu Asn Gly Asp Lys Ser Val Met
165 170 175
Phe Thr Leu Thr Asn Leu His Gln Ser
180 185
<210>19
<211>125
<212>БЕЛОК
<213>Mus musculus
<220>
<223>зрелая форма гранулоцитарно-макрофагального колониестимулирующего
фактора (ГМКСФ)
<400>19
Ser Ala Pro Thr Arg Ser Pro Ile Thr Val Thr Arg Pro Trp Lys His
1 5 10 15
Val Glu Ala Ile Lys Glu Ala Leu Asn Leu Leu Asp Asp Met Pro Val
20 25 30
Thr Leu Asn Glu Glu Val Glu Val Val Ser Asn Glu Phe Ser Phe Lys
35 40 45
Lys Leu Thr Cys Val Gln Thr Arg Leu Lys Ile Phe Glu Gln Gly Leu
50 55 60
Arg Gly Asn Phe Thr Lys Leu Lys Gly Ala Leu Asn Met Thr Ala Ser
65 70 75 80
Tyr Tyr Gln Thr Tyr Cys Pro Pro Thr Pro Glu Thr Asp Cys Glu Thr
85 90 95
Gln Val Thr Thr Tyr Ala Asp Phe Ile Asp Ser Leu Lys Thr Phe Leu
100 105 110
Thr Asp Ile Pro Phe Glu Cys Lys Lys Pro Gly Gln Lys
115 120 125
<210>20
<211>125
<212>БЕЛОК
<213>Искусственная последовательность
<220>
<223>рекомбинантный вариант мГМКСФ
<400>20
Ala Ala Pro Thr Arg Ser Pro Ile Thr Val Thr Arg Pro Trp Lys His
1 5 10 15
Val Glu Ala Ile Lys Glu Ala Leu Asn Leu Leu Asp Asp Met Pro Val
20 25 30
Thr Leu Asn Glu Glu Val Glu Val Val Ser Asn Glu Phe Ser Phe Lys
35 40 45
Lys Leu Thr Cys Val Gln Thr Arg Leu Lys Ile Phe Glu Gln Gly Leu
50 55 60
Arg Gly Asn Phe Thr Lys Leu Lys Gly Ala Leu Asn Met Thr Ala Ser
65 70 75 80
Tyr Tyr Gln Thr Tyr Cys Pro Pro Thr Pro Glu Thr Asp Cys Glu Thr
85 90 95
Gln Val Thr Thr Tyr Ala Asp Phe Ile Asp Ser Leu Lys Thr Phe Leu
100 105 110
Thr Asp Ile Pro Phe Glu Cys Lys Lys Pro Gly Gln Lys
115 120 125
<210>21
<211>152
<212>БЕЛОК
<213>Искусственная последовательность
<220>
<223>рекомбинантный белок-предшественник мГМКСФ
<400>21
Met Lys Lys Lys Ile Ile Ser Ala Ile Leu Met Ser Thr Val Ile Leu
1 5 10 15
Ser Ala Ala Ala Pro Leu Ser Gly Val Tyr Ala Ala Ala Pro Thr Arg
20 25 30
Ser Pro Ile Thr Val Thr Arg Pro Trp Lys His Val Glu Ala Ile Lys
35 40 45
Glu Ala Leu Asn Leu Leu Asp Asp Met Pro Val Thr Leu Asn Glu Glu
50 55 60
Val Glu Val Val Ser Asn Glu Phe Ser Phe Lys Lys Leu Thr Cys Val
65 70 75 80
Gln Thr Arg Leu Lys Ile Phe Glu Gln Gly Leu Arg Gly Asn Phe Thr
85 90 95
Lys Leu Lys Gly Ala Leu Asn Met Thr Ala Ser Tyr Tyr Gln Thr Tyr
100 105 110
Cys Pro Pro Thr Pro Glu Thr Asp Cys Glu Thr Gln Val Thr Thr Tyr
115 120 125
Ala Asp Phe Ile Asp Ser Leu Lys Thr Phe Leu Thr Asp Ile Pro Phe
130 135 140
Glu Cys Lys Lys Pro Gly Gln Lys
145 150
<210>22
<211>2309
<211>ДНК
<213>Искусственная последовательность
<220>
<223>синтетический конструкт mEG
<400>22
agatctgagc gttgtataag cttttatgtc tttctatatc aacttttaat agaaatataa 60
agtaatataa atgtttttat aataaattat gtgagatata tttttttgtc cgtactggta 120
tagatttgac gattaagtct taaataagtt ataatctcaa ttgcgtaatt tcttaaatac 180
agaaataaca actacattgg tagactgatt aaaaagtgta cttgatgaac tgttataaac 240
cttaaaaaaa taaaaataat agtttggggg atgttaaaga tgtataaaaa atatggagat 300
tgttttaaaa agttgcgaaa ccaaaagaat ttagggttat catactttag taaacttgga 360
atagaccgtt caaatatatc tagatttgaa catggaaaat gtatgatgag ttttgagcgt 420
atagatttga tgttagaaga aatgcaagtt ccgttatctg agtacgaatt gattgtaaat 480
aattttatgc cgaatttcca agaatttttt atattagaat tggaaaaagc tgaatttagc 540
caaaatcgag ataaaataaa agagttgtat tctgaggtca aagaaacggg gaatcattta 600
ctgacggtta ccgtgaaaac gaagcttggg aatataagtc agacagaagt taaagaaatt 660
gaagcttatc tttgcaatat tgaagagtgg ggatattttg aacttacttt attttatttt 720
gtatctgatt atctcaatgt caatcaatta gaattgctgc tttttaattt tgataaaaga 780
tgtgaaaatt actgtagagt cttaaaatat agaaggagac tattgcaaat agcctataaa 840
agtgttgcga tatacgcggc taaaggagaa agaaaaaaag ccgaaaatat tttagaaatg 900
actaaaaaat atcgaactgt gggagtcgat ttatattcag aagtattaag acatcttgct 960
agagctatca ttatttttaa ttttgaaaat gcagagattg gggaagaaaa aataaattat 1020
gctcttgaga ttttggaaga atttggagga aagaagataa aagaattcta tcagaataaa 1080
atggaaaagt atttgaaaag gtcaatttag tctcttttga gctgttgctt taaagcaaca 1140
gctcaaaaga gattttcttt attctagagc atatactaga gggtgaagat aggttgtctg 1200
aagcattata acttgtcttt taaaaaattc aatcataaat ataaggaggt atgatgaaga 1260
aaaagattat tagtgcaatt ttaatgtcaa cggtcatctt aagcgctgct gccccattgt 1320
caggtgttta tgcagcaaat tttggtagat tacattgtac aacagcagta atacgtaata 1380
ttaatgatca agttttattt gttgataaaa gacaacctgt ttttgaagat atgactgata 1440
ttgatcaatc tgcatctgaa ccacaaacta gattaataat ttatatgtat aaagatagtg 1500
aagttagagg attagctgta acattaagtg ttaaagatag taaaatgagt acattatcat 1560
gtaaaaacaa aataatttca tttgaagaaa tggacccacc tgaaaatatt gatgatattc 1620
aatcagattt aattttcttt caaaaacgtg ttccaggtca taacaaaatg gaatttgaat 1680
ctagtttata tgaaggtcac tttttagctt gtcaaaaaga agatgatgct tttaaattaa 1740
ttttaaagaa aaaagatgaa aatggagata aatcagttat gtttacatta actaatttac 1800
atcaatcata ataaacgcgt attaataagg aggctaacta atgaaaaaga aaatcatttc 1860
agcgattttg atgtcaacgg ttattttaag cgcagcagct ccattatctg gagtttatgc 1920
agccccaaca cgtagtccaa taacagtaac tagaccttgg aaacatgttg aagcaattaa 1980
agaagcatta aatttattag atgatatgcc agtaacatta aatgaagaag ttgaagtagt 2040
aagtaatgaa tttagtttta aaaaattaac atgtgttcaa actagattaa aaatttttga 2100
acaaggatta agaggtaatt ttactaaatt aaaaggtgct ttaaatatga cagctagtta 2160
ttatcaaaca tattgtccac caacacctga aactgattgt gaaacacaag taactacata 2220
tgctgatttt attgattcat taaaaacatt tttaactgat attccttttg aatgtaaaaa 2280
accaggacaa aaataataat aaggcatgc 2309
<210>23
<211>5432
<211>ДНК
<213>Искусственная последовательность
<220>
<223>плазмида pC-mEG
<400>23
gatctgagcg ttgtataagc ttttatgtct ttctatatca acttttaata gaaatataaa 60
gtaatataaa tgtttttata ataaattatg tgagatatat ttttttgtcc gtactggtat 120
agatttgacg attaagtctt aaataagtta taatctcaat tgcgtaattt cttaaataca 180
gaaataacaa ctacattggt agactgatta aaaagtgtac ttgatgaact gttataaacc 240
ttaaaaaaat aaaaataata gtttggggga tgttaaagat gtataaaaaa tatggagatt 300
gttttaaaaa gttgcgaaac caaaagaatt tagggttatc atactttagt aaacttggaa 360
tagaccgttc aaatatatct agatttgaac atggaaaatg tatgatgagt tttgagcgta 420
tagatttgat gttagaagaa atgcaagttc cgttatctga gtacgaattg attgtaaata 480
attttatgcc gaatttccaa gaatttttta tattagaatt ggaaaaagct gaatttagcc 540
aaaatcgaga taaaataaaa gagttgtatt ctgaggtcaa agaaacgggg aatcatttac 600
tgacggttac cgtgaaaacg aagcttggga atataagtca gacagaagtt aaagaaattg 660
aagcttatct ttgcaatatt gaagagtggg gatattttga acttacttta ttttattttg 720
tatctgatta tctcaatgtc aatcaattag aattgctgct ttttaatttt gataaaagat 780
gtgaaaatta ctgtagagtc ttaaaatata gaaggagact attgcaaata gcctataaaa 840
gtgttgcgat atacgcggct aaaggagaaa gaaaaaaagc cgaaaatatt ttagaaatga 900
ctaaaaaata tcgaactgtg ggagtcgatt tatattcaga agtattaaga catcttgcta 960
gagctatcat tatttttaat tttgaaaatg cagagattgg ggaagaaaaa ataaattatg 1020
ctcttgagat tttggaagaa tttggaggaa agaagataaa agaattctat cagaataaaa 1080
tggaaaagta tttgaaaagg tcaatttagt ctcttttgag ctgttgcttt aaagcaacag 1140
ctcaaaagag attttcttta ttctagagca tatactagag ggtgaagata ggttgtctga 1200
agcattataa cttgtctttt aaaaaattca atcataaata taaggaggta tgatgaagaa 1260
aaagattatt agtgcaattt taatgtcaac ggtcatctta agcgctgctg ccccattgtc 1320
aggtgtttat gcagcaaatt ttggtagatt acattgtaca acagcagtaa tacgtaatat 1380
taatgatcaa gttttatttg ttgataaaag acaacctgtt tttgaagata tgactgatat 1440
tgatcaatct gcatctgaac cacaaactag attaataatt tatatgtata aagatagtga 1500
agttagagga ttagctgtaa cattaagtgt taaagatagt aaaatgagta cattatcatg 1560
taaaaacaaa ataatttcat ttgaagaaat ggacccacct gaaaatattg atgatattca 1620
atcagattta attttctttc aaaaacgtgt tccaggtcat aacaaaatgg aatttgaatc 1680
tagtttatat gaaggtcact ttttagcttg tcaaaaagaa gatgatgctt ttaaattaat 1740
tttaaagaaa aaagatgaaa atggagataa atcagttatg tttacattaa ctaatttaca 1800
tcaatcataa taaacgcgta ttaataagga ggctaactaa tgaaaaagaa aatcatttca 1860
gcgattttga tgtcaacggt tattttaagc gcagcagctc cattatctgg agtttatgca 1920
gccccaacac gtagtccaat aacagtaact agaccttgga aacatgttga agcaattaaa 1980
gaagcattaa atttattaga tgatatgcca gtaacattaa atgaagaagt tgaagtagta 2040
agtaatgaat ttagttttaa aaaattaaca tgtgttcaaa ctagattaaa aatttttgaa 2100
caaggattaa gaggtaattt tactaaatta aaaggtgctt taaatatgac agctagttat 2160
tatcaaacat attgtccacc aacacctgaa actgattgtg aaacacaagt aactacatat 2220
gctgatttta ttgattcatt aaaaacattt ttaactgata ttccttttga atgtaaaaaa 2280
ccaggacaaa aataataagg catgcggtac cactagttct agagagctca agctttcttt 2340
gaaccaaaat tagaaaacca aggcttgaaa cgttcaattg aaatggcaat taaacaaatt 2400
acagcacgtg ttgctttgat tgatagccaa aaagcagcag ttgataaagc aattactgat 2460
attgctgaaa aattgtaatt tataaataaa aatcaccttt tagaggtggt ttttttattt 2520
ataaattatt cgtttgattt cgctttcgat agaacaatca aatcgtttct gagacgtttt 2580
agcgtttatt tcgtttagtt atcggcataa tcgttaaaac aggcgttatc gtagcgtaaa 2640
agcccttgag cgtagcgtgg ctttgcagcg aagatgttgt ctgttagatt atgaaagccg 2700
atgactgaat gaaataataa gcgcagcgtc cttctatttc ggttggagga ggctcaaggg 2760
agtttgaggg aatgaaattc cctcatgggt ttgattttaa aaattgcttg caattttgcc 2820
gagcggtagc gctggaaaat ttttgaaaaa aatttggaat ttggaaaaaa atggggggaa 2880
aggaagcgaa ttttgcttcc gtactacgac cccccattaa gtgccgagtg ccaatttttg 2940
tgccaaaaac gctctatccc aactggctca agggtttgag gggtttttca atcgccaacg 3000
aatcgccaac gttttcgcca acgtttttta taaatctata tttaagtagc tttatttttg 3060
tttttatgat tacaaagtga tacactaatt ttataaaatt atttgattgg agttttttaa 3120
atggtgattt cagaatcgaa aaaaagagtt atgatttctc tgacaaaaga gcaagataaa 3180
aaattaacag atatggcgaa acaaaaagat ttttcaaaat ctgcggttgc ggcgttagct 3240
atagaagaat atgcaagaaa ggaatcagaa caaaaaaaat aagcgaaagc tcgcgttttt 3300
agaaggatac gagttttcgc tacttgtttt tgataaggta attatatcat ggctattaaa 3360
aatactaaag ctagaaattt tggattttta ttatatcctg actcaattcc taatgattgg 3420
aaagaaaaat tagagagttt gggcgtatct atggctgtca gtcctttaca cgatatggac 3480
gaaaaaaaag ataaagatac atggaatagt agtgatgtta tacgaaatgg aaagcactat 3540
aaaaaaccac actatcacgt tatatatatt gcacgaaatc ctgtaacaat agaaagcgtt 3600
aggaacaaga ttaagcgaaa attggggaat agttcagttg ctcatgttga gatacttgat 3660
tatatcaaag gttcatatga atatttgact catgaatcaa aggacgctat tgctaagaat 3720
aaacatatat acgacaaaaa agatattttg aacattaatg attttgatat tgaccgctat 3780
ataacacttg atgaaagcca aaaaagagaa ttgaagaatt tacttttaga tatagtggat 3840
gactataatt tggtaaatac aaaagattta atggctttta ttcgccttag gggagcggag 3900
tttggaattt taaatacgaa tgatgtaaaa gatattgttt caacaaactc tagcgccttt 3960
agattatggt ttgagggcaa ttatcagtgt ggatatagag caagttatgc aaaggttctt 4020
gatgctgaaa cgggggaaat aaaatgacaa acaaagaaaa agagttattt gctgaaaatg 4080
aggaattaaa aaaagaaatt aaggacttaa aagagcgtat tgaaagatac agagaaatgg 4140
aagttgaatt aagtacaaca atagatttat tgagaggagg gattattgaa taaataaaag 4200
cccccctgac gaaagtcgac atggtcgatg tctagatgct taaactagag aaaggtttaa 4260
aagatgaaaa cttcaccaca tcgtaatact tcagctattg ttgatttaaa agcgattaga 4320
aataatattg aaaaatttaa aaagcatatt aaccctaatg cagagatttg gccagcagtg 4380
aaagcagatg cttatggtca tggctcgatt gaggtttcta aagcggtgag cgatttggta 4440
ggtggttttt gtgtatcaaa cctagatgag gcaattgaat tacgaaatca tctggtgact 4500
aaaccgattt tagttttatc cggaattgtt ccagaagatg ttgatattgc agctgccctt 4560
aatattagtc ttactgcccc gagtttagaa tggttgaaat tggttgttca agaagaagca 4620
gaactttcag atttaaaaat tcatattggt gtagattctg gtatgggtcg gattggtatt 4680
cgtgatgttg aagaagctaa tcagatgatt gaacttgctg ataaatatgc gattaatttt 4740
gaaggaattt tcactcattt tgcgactgcg gatatggctg atgaaacaaa atttaaaaat 4800
caacaggcaa gatttaacaa aattatggcc ggattatcac gtcaaccaaa atttatacac 4860
tcaactaata cggccgctgc tttatggcat aaggaacaag ttcaagctat tgaacgttta 4920
gggatttcaa tgtatggctt gaatccaagt ggtaaaactt tggaacttcc ttttgaaatt 4980
gaacccgctc tctctttagt ttctgaattg actcatataa aaaaaatagc tgcaggtgaa 5040
acggttggtt atggtgcaac ttatgagacg agtgaagaaa cttggattgg aactgttcca 5100
attggttacg ctgacgggtg gacccgtcaa atgcaaggtt tcaaagtgct tgttgatgga 5160
aagttttgtg agattgttgg tcgagtttgt atggatcaaa tgatgataaa acttgataag 5220
tcttaccctt tgggaacgaa ggtcactttg attggtcgag ataaggctaa tgaaatcacg 5280
acaacagacg ttgctgattg gcgtggaacg attaattatg aagtgctttg cttactttct 5340
gatagaatca aaagaatcta taaataaaat taaaaaaact gtatttttac agtttttttg 5400
ttttctgtta aaagcagatg ataacctcac ta 5432
<210>24
<211>312
<212>БЕЛОК
<213>Mus musculus
<220>
<223>зрелая форма бета-субъединицы интерлейкина-12 мыши (мИЛ-12)
<400>24
Met Trp Glu Leu Glu Lys Asp Val Tyr Val Val Glu Val Asp Trp Thr
1 5 10 15
Pro Asp Ala Pro Gly Glu Thr Val Asn Leu Thr Cys Asp Thr Pro Glu
20 25 30
Glu Asp Asp Ile Thr Trp Thr Ser Asp Gln Arg His Gly Val Ile Gly
35 40 45
Ser Gly Lys Thr Leu Thr Ile Thr Val Lys Glu Phe Leu Asp Ala Gly
50 55 60
Gln Tyr Thr Cys His Lys Gly Gly Glu Thr Leu Ser His Ser His Leu
65 70 75 80
Leu Leu His Lys Lys Glu Asn Gly Ile Trp Ser Thr Glu Ile Leu Lys
85 90 95
Asn Phe Lys Asn Lys Thr Phe Leu Lys Cys Glu Ala Pro Asn Tyr Ser
100 105 110
Gly Arg Phe Thr Cys Ser Trp Leu Val Gln Arg Asn Met Asp Leu Lys
115 120 125
Phe Asn Ile Lys Ser Ser Ser Ser Ser Pro Asp Ser Arg Ala Val Thr
130 135 140
Cys Gly Met Ala Ser Leu Ser Ala Glu Lys Val Thr Leu Asp Gln Arg
145 150 155 160
Asp Tyr Glu Lys Tyr Ser Val Ser Cys Gln Glu Asp Val Thr Cys Pro
165 170 175
Thr Ala Glu Glu Thr Leu Pro Ile Glu Leu Ala Leu Glu Ala Arg Gln
180 185 190
Gln Asn Lys Tyr Glu Asn Tyr Ser Thr Ser Phe Phe Ile Arg Asp Ile
195 200 205
Ile Lys Pro Asp Pro Pro Lys Asn Leu Gln Met Lys Pro Leu Lys Asn
210 215 220
Ser Gln Val Glu Val Ser Trp Glu Tyr Pro Asp Ser Trp Ser Thr Pro
225 230 235 240
His Ser Tyr Phe Ser Leu Lys Phe Phe Val Arg Ile Gln Arg Lys Lys
245 250 255
Glu Lys Met Lys Glu Thr Glu Glu Gly Cys Asn Gln Lys Gly Ala Phe
260 265 270
Leu Val Glu Lys Thr Ser Thr Glu Val Gln Cys Lys Gly Gly Asn Val
275 280 285
Cys Val Gln Ala Gln Asp Arg Tyr Tyr Asn Ser Ser Cys Ser Lys Trp
290 295 300
Ala Cys Val Pro Cys Arg Val Arg
305 310
<210>25
<211>193
<212>БЕЛОК
<213>Mus musculus
<220>
<223>зрелая форма изоформы 2 бета-субъединицы интерлейкина-12 мыши
(мИЛ-12)
<400>25
Arg Val Ile Pro Val Ser Gly Pro Ala Arg Cys Leu Ser Gln Ser Arg
1 5 10 15
Asn Leu Leu Lys Thr Thr Asp Asp Met Val Lys Thr Ala Arg Glu Lys
20 25 30
Leu Lys His Tyr Ser Cys Thr Ala Glu Asp Ile Asp His Glu Asp Ile
35 40 45
Thr Arg Asp Gln Thr Ser Thr Leu Lys Thr Cys Leu Pro Leu Glu Leu
50 55 60
His Lys Asn Glu Ser Cys Leu Ala Thr Arg Glu Thr Ser Ser Thr Thr
65 70 75 80
Arg Gly Ser Cys Leu Pro Pro Gln Lys Thr Ser Leu Met Met Thr Leu
85 90 95
Cys Leu Gly Ser Ile Tyr Glu Asp Leu Lys Met Tyr Gln Thr Glu Phe
100 105 110
Gln Ala Ile Asn Ala Ala Leu Gln Asn His Asn His Gln Gln Ile Ile
115 120 125
Leu Asp Lys Gly Met Leu Val Ala Ile Asp Glu Leu Met Gln Ser Leu
130 135 140
Asn His Asn Gly Glu Thr Leu Arg Gln Lys Pro Pro Val Gly Glu Ala
145 150 155 160
Asp Pro Tyr Arg Val Lys Met Lys Leu Cys Ile Leu Leu His Ala Phe
165 170 175
Ser Thr Arg Val Val Thr Ile Asn Arg Val Met Gly Tyr Leu Ser Ser
180 185 190
Ala
<210>26
<211>523
<212>БЕЛОК
<213>Искусственная последовательность
<220>
<223>рекомбинантный гибридный белок мИЛ-12
<400>26
Ala Asp Met Trp Glu Leu Glu Lys Asp Val Tyr Val Val Glu Val Asp
1 5 10 15
Trp Thr Pro Asp Ala Pro Gly Glu Thr Val Asn Leu Thr Cys Asp Thr
20 25 30
Pro Glu Glu Asp Asp Ile Thr Trp Thr Ser Asp Gln Arg His Gly Val
35 40 45
Ile Gly Ser Gly Lys Thr Leu Thr Ile Thr Val Lys Glu Phe Leu Asp
50 55 60
Ala Gly Gln Tyr Thr Cys His Lys Gly Gly Glu Thr Leu Ser His Ser
65 70 75 80
His Leu Leu Leu His Lys Lys Glu Asn Gly Ile Trp Ser Thr Glu Ile
85 90 95
Leu Lys Asn Phe Lys Asn Lys Thr Phe Leu Lys Cys Glu Ala Pro Asn
100 105 110
Tyr Ser Gly Arg Phe Thr Cys Ser Trp Leu Val Gln Arg Asn Met Asp
115 120 125
Leu Lys Phe Asn Ile Lys Ser Ser Ser Ser Ser Pro Asp Ser Arg Ala
130 135 140
Val Thr Cys Gly Met Ala Ser Leu Ser Ala Glu Lys Val Thr Leu Asp
145 150 155 160
Gln Arg Asp Tyr Glu Lys Tyr Ser Val Ser Cys Gln Glu Asp Val Thr
165 170 175
Cys Pro Thr Ala Glu Glu Thr Leu Pro Ile Glu Leu Ala Leu Glu Ala
180 185 190
Arg Gln Gln Asn Lys Tyr Glu Asn Tyr Ser Thr Ser Phe Phe Ile Arg
195 200 205
Asp Ile Ile Lys Pro Asp Pro Pro Lys Asn Leu Gln Met Lys Pro Leu
210 215 220
Lys Asn Ser Gln Val Glu Val Ser Trp Glu Tyr Pro Asp Ser Trp Ser
225 230 235 240
Thr Pro His Ser Tyr Phe Ser Leu Lys Phe Phe Val Arg Ile Gln Arg
245 250 255
Lys Lys Glu Lys Met Lys Glu Thr Glu Glu Gly Cys Asn Gln Lys Gly
260 265 270
Ala Phe Leu Val Glu Lys Thr Ser Thr Glu Val Gln Cys Lys Gly Gly
275 280 285
Asn Val Cys Val Gln Ala Gln Asp Arg Tyr Tyr Asn Ser Ser Cys Ser
290 295 300
Lys Trp Ala Cys Val Pro Cys Arg Val Arg Ser Gly Gly Gly Gly Ser
305 310 315 320
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Arg Val Ile Pro Val Ser
325 330 335
Gly Pro Ala Arg Cys Leu Ser Gln Ser Arg Asn Leu Leu Lys Thr Thr
340 345 350
Asp Asp Met Val Lys Thr Ala Arg Glu Lys Leu Lys His Tyr Ser Cys
355 360 365
Thr Ala Glu Asp Ile Asp His Glu Asp Ile Thr Arg Asp Gln Thr Ser
370 375 380
Thr Leu Lys Thr Cys Leu Pro Leu Glu Leu His Lys Asn Glu Ser Cys
385 390 395 400
Leu Ala Thr Arg Glu Thr Ser Ser Thr Thr Arg Gly Ser Cys Leu Pro
405 410 415
Pro Gln Lys Thr Ser Leu Met Met Thr Leu Cys Leu Gly Ser Ile Tyr
420 425 430
Glu Asp Leu Lys Met Tyr Gln Thr Glu Phe Gln Ala Ile Asn Ala Ala
435 440 445
Leu Gln Asn His Asn His Gln Gln Ile Ile Leu Asp Lys Gly Met Leu
450 455 460
Val Ala Ile Asp Glu Leu Met Gln Ser Leu Asn His Asn Gly Glu Thr
465 470 475 480
Leu Arg Gln Lys Pro Pro Val Gly Glu Ala Asp Pro Tyr Arg Val Lys
485 490 495
Met Lys Leu Cys Ile Leu Leu His Ala Phe Ser Thr Arg Val Val Thr
500 505 510
Ile Asn Arg Val Met Gly Tyr Leu Ser Ser Ala
515 520
<210>27
<211>550
<212>БЕЛОК
<213>Искусственная последовательность
<220>
<223>рекомбинантный белок-предшественник мИЛ-12
<400>27
Met Lys Lys Lys Ile Ile Ser Ala Ile Leu Met Ser Thr Val Ile Leu
1 5 10 15
Ser Ala Ala Ala Pro Leu Ser Gly Val Tyr Ala Ala Asp Met Trp Glu
20 25 30
Leu Glu Lys Asp Val Tyr Val Val Glu Val Asp Trp Thr Pro Asp Ala
35 40 45
Pro Gly Glu Thr Val Asn Leu Thr Cys Asp Thr Pro Glu Glu Asp Asp
50 55 60
Ile Thr Trp Thr Ser Asp Gln Arg His Gly Val Ile Gly Ser Gly Lys
65 70 75 80
Thr Leu Thr Ile Thr Val Lys Glu Phe Leu Asp Ala Gly Gln Tyr Thr
85 90 95
Cys His Lys Gly Gly Glu Thr Leu Ser His Ser His Leu Leu Leu His
100 105 110
Lys Lys Glu Asn Gly Ile Trp Ser Thr Glu Ile Leu Lys Asn Phe Lys
115 120 125
Asn Lys Thr Phe Leu Lys Cys Glu Ala Pro Asn Tyr Ser Gly Arg Phe
130 135 140
Thr Cys Ser Trp Leu Val Gln Arg Asn Met Asp Leu Lys Phe Asn Ile
145 150 155 160
Lys Ser Ser Ser Ser Ser Pro Asp Ser Arg Ala Val Thr Cys Gly Met
165 170 175
Ala Ser Leu Ser Ala Glu Lys Val Thr Leu Asp Gln Arg Asp Tyr Glu
180 185 190
Lys Tyr Ser Val Ser Cys Gln Glu Asp Val Thr Cys Pro Thr Ala Glu
195 200 205
Glu Thr Leu Pro Ile Glu Leu Ala Leu Glu Ala Arg Gln Gln Asn Lys
210 215 220
Tyr Glu Asn Tyr Ser Thr Ser Phe Phe Ile Arg Asp Ile Ile Lys Pro
225 230 235 240
Asp Pro Pro Lys Asn Leu Gln Met Lys Pro Leu Lys Asn Ser Gln Val
245 250 255
Glu Val Ser Trp Glu Tyr Pro Asp Ser Trp Ser Thr Pro His Ser Tyr
260 265 270
Phe Ser Leu Lys Phe Phe Val Arg Ile Gln Arg Lys Lys Glu Lys Met
275 280 285
Lys Glu Thr Glu Glu Gly Cys Asn Gln Lys Gly Ala Phe Leu Val Glu
290 295 300
Lys Thr Ser Thr Glu Val Gln Cys Lys Gly Gly Asn Val Cys Val Gln
305 310 315 320
Ala Gln Asp Arg Tyr Tyr Asn Ser Ser Cys Ser Lys Trp Ala Cys Val
325 330 335
Pro Cys Arg Val Arg Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
340 345 350
Gly Gly Gly Gly Ser Arg Val Ile Pro Val Ser Gly Pro Ala Arg Cys
355 360 365
Leu Ser Gln Ser Arg Asn Leu Leu Lys Thr Thr Asp Asp Met Val Lys
370 375 380
Thr Ala Arg Glu Lys Leu Lys His Tyr Ser Cys Thr Ala Glu Asp Ile
385 390 395 400
Asp His Glu Asp Ile Thr Arg Asp Gln Thr Ser Thr Leu Lys Thr Cys
405 410 415
Leu Pro Leu Glu Leu His Lys Asn Glu Ser Cys Leu Ala Thr Arg Glu
420 425 430
Thr Ser Ser Thr Thr Arg Gly Ser Cys Leu Pro Pro Gln Lys Thr Ser
435 440 445
Leu Met Met Thr Leu Cys Leu Gly Ser Ile Tyr Glu Asp Leu Lys Met
450 455 460
Tyr Gln Thr Glu Phe Gln Ala Ile Asn Ala Ala Leu Gln Asn His Asn
465 470 475 480
His Gln Gln Ile Ile Leu Asp Lys Gly Met Leu Val Ala Ile Asp Glu
485 490 495
Leu Met Gln Ser Leu Asn His Asn Gly Glu Thr Leu Arg Gln Lys Pro
500 505 510
Pro Val Gly Glu Ala Asp Pro Tyr Arg Val Lys Met Lys Leu Cys Ile
515 520 525
Leu Leu His Ala Phe Ser Thr Arg Val Val Thr Ile Asn Arg Val Met
530 535 540
Gly Tyr Leu Ser Ser Ala
545 550
<210>28
<211>168
<212>БЕЛОК
<213>Mus musculus
<220>
<223>зрелая форма интерферона-альфа-2 мыши (мИФНa2)
<400>28
Gly Cys Asp Leu Pro His Thr Tyr Asn Leu Arg Asn Lys Arg Ala Leu
1 5 10 15
Lys Val Leu Ala Gln Met Arg Arg Leu Pro Phe Leu Ser Cys Leu Lys
20 25 30
Asp Arg Gln Asp Phe Gly Phe Pro Leu Glu Lys Val Asp Asn Gln Gln
35 40 45
Ile Gln Lys Ala Gln Ala Ile Pro Val Leu Arg Asp Leu Thr Gln Gln
50 55 60
Thr Leu Asn Leu Phe Thr Ser Lys Ala Ser Ser Ala Ala Trp Asn Thr
65 70 75 80
Thr Leu Leu Asp Ser Phe Cys Asn Asp Leu His Gln Gln Leu Asn Asp
85 90 95
Leu Gln Thr Cys Leu Met Gln Gln Val Gly Val Gln Glu Pro Pro Leu
100 105 110
Thr Gln Glu Asp Ala Leu Leu Ala Val Arg Lys Tyr Phe His Arg Ile
115 120 125
Thr Val Tyr Leu Arg Glu Lys Lys His Ser Pro Cys Ala Trp Glu Val
130 135 140
Val Arg Ala Glu Val Trp Arg Ala Leu Ser Ser Ser Val Asn Leu Leu
145 150 155 160
Pro Arg Leu Ser Glu Glu Lys Glu
165
<210>29
<211>169
<212>БЕЛОК
<213>Искусственная последовательность
<220>
<223>рекомбинантный вариант мИФНa2
<400>29
Ala Gly Cys Asp Leu Pro His Thr Tyr Asn Leu Arg Asn Lys Arg Ala
1 5 10 15
Leu Lys Val Leu Ala Gln Met Arg Arg Leu Pro Phe Leu Ser Cys Leu
20 25 30
Lys Asp Arg Gln Asp Phe Gly Phe Pro Leu Glu Lys Val Asp Asn Gln
35 40 45
Gln Ile Gln Lys Ala Gln Ala Ile Pro Val Leu Arg Asp Leu Thr Gln
50 55 60
Gln Thr Leu Asn Leu Phe Thr Ser Lys Ala Ser Ser Ala Ala Trp Asn
65 70 75 80
Thr Thr Leu Leu Asp Ser Phe Cys Asn Asp Leu His Gln Gln Leu Asn
85 90 95
Asp Leu Gln Thr Cys Leu Met Gln Gln Val Gly Val Gln Glu Pro Pro
100 105 110
Leu Thr Gln Glu Asp Ala Leu Leu Ala Val Arg Lys Tyr Phe His Arg
115 120 125
Ile Thr Val Tyr Leu Arg Glu Lys Lys His Ser Pro Cys Ala Trp Glu
130 135 140
Val Val Arg Ala Glu Val Trp Arg Ala Leu Ser Ser Ser Val Asn Leu
145 150 155 160
Leu Pro Arg Leu Ser Glu Glu Lys Glu
165
<210>30
<211>196
<212>БЕЛОК
<213>Искусственная последовательность
<220>
<223>рекомбинантный белок-предшественник мИФНa2
<400>30
Met Lys Lys Lys Ile Ile Ser Ala Ile Leu Met Ser Thr Val Ile Leu
1 5 10 15
Ser Ala Ala Ala Pro Leu Ser Gly Val Tyr Ala Ala Gly Cys Asp Leu
20 25 30
Pro His Thr Tyr Asn Leu Arg Asn Lys Arg Ala Leu Lys Val Leu Ala
35 40 45
Gln Met Arg Arg Leu Pro Phe Leu Ser Cys Leu Lys Asp Arg Gln Asp
50 55 60
Phe Gly Phe Pro Leu Glu Lys Val Asp Asn Gln Gln Ile Gln Lys Ala
65 70 75 80
Gln Ala Ile Pro Val Leu Arg Asp Leu Thr Gln Gln Thr Leu Asn Leu
85 90 95
Phe Thr Ser Lys Ala Ser Ser Ala Ala Trp Asn Thr Thr Leu Leu Asp
100 105 110
Ser Phe Cys Asn Asp Leu His Gln Gln Leu Asn Asp Leu Gln Thr Cys
115 120 125
Leu Met Gln Gln Val Gly Val Gln Glu Pro Pro Leu Thr Gln Glu Asp
130 135 140
Ala Leu Leu Ala Val Arg Lys Tyr Phe His Arg Ile Thr Val Tyr Leu
145 150 155 160
Arg Glu Lys Lys His Ser Pro Cys Ala Trp Glu Val Val Arg Ala Glu
165 170 175
Val Trp Arg Ala Leu Ser Ser Ser Val Asn Leu Leu Pro Arg Leu Ser
180 185 190
Glu Glu Lys Glu
195
<210>31
<211>4135
<211>ДНК
<213>Искусственная последовательность
<220>
<223>синтетический конструкт mTEA
<400>31
agatctgagc gttgtataag cttttatgtc tttctatatc aacttttaat agaaatataa 60
agtaatataa atgtttttat aataaattat gtgagatata tttttttgtc cgtactggta 120
tagatttgac gattaagtct taaataagtt ataatctcaa ttgcgtaatt tcttaaatac 180
agaaataaca actacattgg tagactgatt aaaaagtgta cttgatgaac tgttataaac 240
cttaaaaaaa taaaaataat agtttggggg atgttaaaga tgtataaaaa atatggagat 300
tgttttaaaa agttgcgaaa ccaaaagaat ttagggttat catactttag taaacttgga 360
atagaccgtt caaatatatc tagatttgaa catggaaaat gtatgatgag ttttgagcgt 420
atagatttga tgttagaaga aatgcaagtt ccgttatctg agtacgaatt gattgtaaat 480
aattttatgc cgaatttcca agaatttttt atattagaat tggaaaaagc tgaatttagc 540
caaaatcgag ataaaataaa agagttgtat tctgaggtca aagaaacggg gaatcattta 600
ctgacggtta ccgtgaaaac gaagcttggg aatataagtc agacagaagt taaagaaatt 660
gaagcttatc tttgcaatat tgaagagtgg ggatattttg aacttacttt attttatttt 720
gtatctgatt atctcaatgt caatcaatta gaattgctgc tttttaattt tgataaaaga 780
tgtgaaaatt actgtagagt cttaaaatat agaaggagac tattgcaaat agcctataaa 840
agtgttgcga tatacgcggc taaaggagaa agaaaaaaag ccgaaaatat tttagaaatg 900
actaaaaaat atcgaactgt gggagtcgat ttatattcag aagtattaag acatcttgct 960
agagctatca ttatttttaa ttttgaaaat gcagagattg gggaagaaaa aataaattat 1020
gctcttgaga ttttggaaga atttggagga aagaagataa aagaattcta tcagaataaa 1080
atggaaaagt atttgaaaag gtcaatttag tctcttttga gctgttgctt taaagcaaca 1140
gctcaaaaga gattttcttt attctagagc atatactaga gggtgaagat aggttgtctg 1200
aagcattata acttgtcttt taaaaaattc aatcataaat ataaggaggt atgatgaaga 1260
aaaagattat tagtgcaatt ttaatgtcaa cggtcatctt aagcgctgct gccccattgt 1320
caggtgttta tgcagccgat atgtgggaat tagaaaaaga tgtttatgtt gtagaagttg 1380
attggacacc agatgctcct ggtgaaacag ttaatttaac atgtgatact ccagaagaag 1440
atgatattac atggacatct gatcaacgac atggagttat tggtagtgga aaaacattaa 1500
caattacagt taaagaattt ttagatgctg gacaatatac ttgtcataaa ggaggtgaaa 1560
cattatctca ttcacattta ttattacata aaaaagaaaa tggtatttgg tcaactgaaa 1620
tcttaaaaaa ttttaaaaat aagacatttt taaaatgtga agctcctaat tattctggta 1680
gatttacttg ttcatggtta gttcaaagaa atatggattt aaaatttaat attaaatcaa 1740
gttcaagtag tcctgatagt agagctgtaa catgtggaat ggcaagttta tctgctgaaa 1800
aagtaacact tgatcaacgt gattatgaaa aatattctgt tagttgtcaa gaagatgtta 1860
cttgtccaac agctgaagaa acattaccaa ttgaattagc attagaagct agacaacaaa 1920
acaaatatga aaattatagt acatctttct ttattcgtga cattattaaa cctgatccac 1980
ctaaaaattt acaaatgaaa cctttaaaaa atagtcaagt tgaagttagt tgggaatatc 2040
cagattcatg gtcaacacca cattcatatt tttcattaaa attctttgtt agaattcaac 2100
gtaaaaaaga aaaaatgaaa gaaactgaag aaggttgtaa ccaaaaaggt gcatttttag 2160
ttgaaaaaac tagtactgaa gttcaatgta aaggtggtaa tgtatgtgtt caagctcaag 2220
atcgatatta taattctagt tgttcaaaat gggcatgtgt tccatgtaga gttcgtagtg 2280
gaggaggtgg aagtggtgga ggtggttcag gtggtggagg ttcacgtgta attccagttt 2340
caggacctgc tcgatgttta agtcaatctc gaaatttatt aaaaactaca gatgatatgg 2400
ttaaaactgc tagagaaaaa ttaaaacatt atagttgtac agctgaagat attgatcatg 2460
aagatattac acgtgatcaa acttcaacac ttaaaacatg tttaccactt gaattacata 2520
aaaatgaatc ttgtttagct actagagaaa ctagtagtac aactagaggt tcttgtttgc 2580
ctccacaaaa aacatcatta atgatgacat tatgtttagg ttctatttat gaagatttga 2640
aaatgtatca aactgaattt caagcaatta atgctgcttt acaaaatcat aatcatcaac 2700
aaattatttt agataaaggt atgttagttg caattgatga attaatgcaa tctttaaatc 2760
ataatggtga aactcttaga caaaaaccac ctgttggaga agcagaccct tatcgagtga 2820
aaatgaaatt atgtatcttg ttgcacgctt tttcaacacg ggtagtcaca attaatcgtg 2880
taatgggata tttgagtagt gcataataaa cgcgtattaa taaggaggct aactaatgaa 2940
aaagaaaatc atttcagcga ttttgatgtc aacggttatt ttaagcgcag cagctccatt 3000
atctggagtt tatgcagcaa attttggtag attacattgt acaacagcag taatacgtaa 3060
tattaatgat caagttttat ttgttgataa aagacaacct gtttttgaag atatgactga 3120
tattgatcaa tctgcatctg aaccacaaac tagattaata atttatatgt ataaagatag 3180
tgaagttaga ggattagctg taacattaag tgttaaagat agtaaaatga gtacattatc 3240
atgtaaaaac aaaataattt catttgaaga aatggaccca cctgaaaata ttgatgatat 3300
tcaatcagat ttaattttct ttcaaaaacg tgttccaggt cataacaaaa tggaatttga 3360
atctagttta tatgaaggtc actttttagc ttgtcaaaaa gaagatgatg cttttaaatt 3420
aattttaaag aaaaaagatg aaaatggaga taaatcagtt atgtttacat taactaattt 3480
acatcaatca taataaacgc gtgaaattta ggaggtagtc caaatgaaaa aaaagattat 3540
ctcagctatt ttaatgtcta cagtgatact ttctgctgca gccccgttgt caggtgttta 3600
cgctgcctgt gatttaccac atacttataa tttaagaaat aagcgtgctt taaaagtttt 3660
agcacaaatg agacgtttac catttttaag ttgtttaaaa gatagacaag attttggttt 3720
tccattagaa aaagtagata atcaacaaat tcaaaaagct caagcaattc ctgttttaag 3780
agatttaaca caacaaacat taaatttatt tactagtaaa gctagtagtg cagcttggaa 3840
tgcaacatta ttagatagtt tttgtaatga tttacatcaa caattaaatg atttacaaac 3900
atgtttaatg caacaagtag gagttcaaga acctccatta actcaagaag atgcattatt 3960
agctgttaga aaatattttc atagaataac cgtttattta agagaaaaga aacatagtcc 4020
ttgtgcttgg gaagtagtta gagctgaagt ttggagagct ttaagttcat cagttaattt 4080
attacctaga ttaagtgaag aaaaagaata ataaccatgg gtactgcagg catgc 4135
<210>32
<211>7261
<211>ДНК
<213>Искусственная последовательность
<220>
<223>плазмида pC-mTEA
<400>32
gatctgagcg ttgtataagc ttttatgtct ttctatatca acttttaata gaaatataaa 60
gtaatataaa tgtttttata ataaattatg tgagatatat ttttttgtcc gtactggtat 120
agatttgacg attaagtctt aaataagtta taatctcaat tgcgtaattt cttaaataca 180
gaaataacaa ctacattggt agactgatta aaaagtgtac ttgatgaact gttataaacc 240
ttaaaaaaat aaaaataata gtttggggga tgttaaagat gtataaaaaa tatggagatt 300
gttttaaaaa gttgcgaaac caaaagaatt tagggttatc atactttagt aaacttggaa 360
tagaccgttc aaatatatct agatttgaac atggaaaatg tatgatgagt tttgagcgta 420
tagatttgat gttagaagaa atgcaagttc cgttatctga gtacgaattg attgtaaata 480
attttatgcc gaatttccaa gaatttttta tattagaatt ggaaaaagct gaatttagcc 540
aaaatcgaga taaaataaaa gagttgtatt ctgaggtcaa agaaacgggg aatcatttac 600
tgacggttac cgtgaaaacg aagcttggga atataagtca gacagaagtt aaagaaattg 660
aagcttatct ttgcaatatt gaagagtggg gatattttga acttacttta ttttattttg 720
tatctgatta tctcaatgtc aatcaattag aattgctgct ttttaatttt gataaaagat 780
gtgaaaatta ctgtagagtc ttaaaatata gaaggagact attgcaaata gcctataaaa 840
gtgttgcgat atacgcggct aaaggagaaa gaaaaaaagc cgaaaatatt ttagaaatga 900
ctaaaaaata tcgaactgtg ggagtcgatt tatattcaga agtattaaga catcttgcta 960
gagctatcat tatttttaat tttgaaaatg cagagattgg ggaagaaaaa ataaattatg 1020
ctcttgagat tttggaagaa tttggaggaa agaagataaa agaattctat cagaataaaa 1080
tggaaaagta tttgaaaagg tcaatttagt ctcttttgag ctgttgcttt aaagcaacag 1140
ctcaaaagag attttcttta ttctagagca tatactagag ggtgaagata ggttgtctga 1200
agcattataa cttgtctttt aaaaaattca atcataaata taaggaggta tgatgaagaa 1260
aaagattatt agtgcaattt taatgtcaac ggtcatctta agcgctgctg ccccattgtc 1320
aggtgtttat gcagccgata tgtgggaatt agaaaaagat gtttatgttg tagaagttga 1380
ttggacacca gatgctcctg gtgaaacagt taatttaaca tgtgatactc cagaagaaga 1440
tgatattaca tggacatctg atcaacgaca tggagttatt ggtagtggaa aaacattaac 1500
aattacagtt aaagaatttt tagatgctgg acaatatact tgtcataaag gaggtgaaac 1560
attatctcat tcacatttat tattacataa aaaagaaaat ggtatttggt caactgaaat 1620
cttaaaaaat tttaaaaata agacattttt aaaatgtgaa gctcctaatt attctggtag 1680
atttacttgt tcatggttag ttcaaagaaa tatggattta aaatttaata ttaaatcaag 1740
ttcaagtagt cctgatagta gagctgtaac atgtggaatg gcaagtttat ctgctgaaaa 1800
agtaacactt gatcaacgtg attatgaaaa atattctgtt agttgtcaag aagatgttac 1860
ttgtccaaca gctgaagaaa cattaccaat tgaattagca ttagaagcta gacaacaaaa 1920
caaatatgaa aattatagta catctttctt tattcgtgac attattaaac ctgatccacc 1980
taaaaattta caaatgaaac ctttaaaaaa tagtcaagtt gaagttagtt gggaatatcc 2040
agattcatgg tcaacaccac attcatattt ttcattaaaa ttctttgtta gaattcaacg 2100
taaaaaagaa aaaatgaaag aaactgaaga aggttgtaac caaaaaggtg catttttagt 2160
tgaaaaaact agtactgaag ttcaatgtaa aggtggtaat gtatgtgttc aagctcaaga 2220
tcgatattat aattctagtt gttcaaaatg ggcatgtgtt ccatgtagag ttcgtagtgg 2280
aggaggtgga agtggtggag gtggttcagg tggtggaggt tcacgtgtaa ttccagtttc 2340
aggacctgct cgatgtttaa gtcaatctcg aaatttatta aaaactacag atgatatggt 2400
taaaactgct agagaaaaat taaaacatta tagttgtaca gctgaagata ttgatcatga 2460
agatattaca cgtgatcaaa cttcaacact taaaacatgt ttaccacttg aattacataa 2520
aaatgaatct tgtttagcta ctagagaaac tagtagtaca actagaggtt cttgtttgcc 2580
tccacaaaaa acatcattaa tgatgacatt atgtttaggt tctatttatg aagatttgaa 2640
aatgtatcaa actgaatttc aagcaattaa tgctgcttta caaaatcata atcatcaaca 2700
aattatttta gataaaggta tgttagttgc aattgatgaa ttaatgcaat ctttaaatca 2760
taatggtgaa actcttagac aaaaaccacc tgttggagaa gcagaccctt atcgagtgaa 2820
aatgaaatta tgtatcttgt tgcacgcttt ttcaacacgg gtagtcacaa ttaatcgtgt 2880
aatgggatat ttgagtagtg cataataaac gcgtattaat aaggaggcta actaatgaaa 2940
aagaaaatca tttcagcgat tttgatgtca acggttattt taagcgcagc agctccatta 3000
tctggagttt atgcagcaaa ttttggtaga ttacattgta caacagcagt aatacgtaat 3060
attaatgatc aagttttatt tgttgataaa agacaacctg tttttgaaga tatgactgat 3120
attgatcaat ctgcatctga accacaaact agattaataa tttatatgta taaagatagt 3180
gaagttagag gattagctgt aacattaagt gttaaagata gtaaaatgag tacattatca 3240
tgtaaaaaca aaataatttc atttgaagaa atggacccac ctgaaaatat tgatgatatt 3300
caatcagatt taattttctt tcaaaaacgt gttccaggtc ataacaaaat ggaatttgaa 3360
tctagtttat atgaaggtca ctttttagct tgtcaaaaag aagatgatgc ttttaaatta 3420
attttaaaga aaaaagatga aaatggagat aaatcagtta tgtttacatt aactaattta 3480
catcaatcat aataaacgcg tgaaatttag gaggtagtcc aaatgaaaaa aaagattatc 3540
tcagctattt taatgtctac agtgatactt tctgctgcag ccccgttgtc aggtgtttac 3600
gctgcctgtg atttaccaca tacttataat ttaagaaata agcgtgcttt aaaagtttta 3660
gcacaaatga gacgtttacc atttttaagt tgtttaaaag atagacaaga ttttggtttt 3720
ccattagaaa aagtagataa tcaacaaatt caaaaagctc aagcaattcc tgttttaaga 3780
gatttaacac aacaaacatt aaatttattt actagtaaag ctagtagtgc agcttggaat 3840
gcaacattat tagatagttt ttgtaatgat ttacatcaac aattaaatga tttacaaaca 3900
tgtttaatgc aacaagtagg agttcaagaa cctccattaa ctcaagaaga tgcattatta 3960
gctgttagaa aatattttca tagaataacc gtttatttaa gagaaaagaa acatagtcct 4020
tgtgcttggg aagtagttag agctgaagtt tggagagctt taagttcatc agttaattta 4080
ttacctagat taagtgaaga aaaagaataa taaccatggg tactgcaggc atgcggtacc 4140
actagttcta gagagctcaa gctttctttg aaccaaaatt agaaaaccaa ggcttgaaac 4200
gttcaattga aatggcaatt aaacaaatta cagcacgtgt tgctttgatt gatagccaaa 4260
aagcagcagt tgataaagca attactgata ttgctgaaaa attgtaattt ataaataaaa 4320
atcacctttt agaggtggtt tttttattta taaattattc gtttgatttc gctttcgata 4380
gaacaatcaa atcgtttctg agacgtttta gcgtttattt cgtttagtta tcggcataat 4440
cgttaaaaca ggcgttatcg tagcgtaaaa gcccttgagc gtagcgtggc tttgcagcga 4500
agatgttgtc tgttagatta tgaaagccga tgactgaatg aaataataag cgcagcgtcc 4560
ttctatttcg gttggaggag gctcaaggga gtttgaggga atgaaattcc ctcatgggtt 4620
tgattttaaa aattgcttgc aattttgccg agcggtagcg ctggaaaatt tttgaaaaaa 4680
atttggaatt tggaaaaaaa tggggggaaa ggaagcgaat tttgcttccg tactacgacc 4740
ccccattaag tgccgagtgc caatttttgt gccaaaaacg ctctatccca actggctcaa 4800
gggtttgagg ggtttttcaa tcgccaacga atcgccaacg ttttcgccaa cgttttttat 4860
aaatctatat ttaagtagct ttatttttgt ttttatgatt acaaagtgat acactaattt 4920
tataaaatta tttgattgga gttttttaaa tggtgatttc agaatcgaaa aaaagagtta 4980
tgatttctct gacaaaagag caagataaaa aattaacaga tatggcgaaa caaaaagatt 5040
tttcaaaatc tgcggttgcg gcgttagcta tagaagaata tgcaagaaag gaatcagaac 5100
aaaaaaaata agcgaaagct cgcgttttta gaaggatacg agttttcgct acttgttttt 5160
gataaggtaa ttatatcatg gctattaaaa atactaaagc tagaaatttt ggatttttat 5220
tatatcctga ctcaattcct aatgattgga aagaaaaatt agagagtttg ggcgtatcta 5280
tggctgtcag tcctttacac gatatggacg aaaaaaaaga taaagataca tggaatagta 5340
gtgatgttat acgaaatgga aagcactata aaaaaccaca ctatcacgtt atatatattg 5400
cacgaaatcc tgtaacaata gaaagcgtta ggaacaagat taagcgaaaa ttggggaata 5460
gttcagttgc tcatgttgag atacttgatt atatcaaagg ttcatatgaa tatttgactc 5520
atgaatcaaa ggacgctatt gctaagaata aacatatata cgacaaaaaa gatattttga 5580
acattaatga ttttgatatt gaccgctata taacacttga tgaaagccaa aaaagagaat 5640
tgaagaattt acttttagat atagtggatg actataattt ggtaaataca aaagatttaa 5700
tggcttttat tcgccttagg ggagcggagt ttggaatttt aaatacgaat gatgtaaaag 5760
atattgtttc aacaaactct agcgccttta gattatggtt tgagggcaat tatcagtgtg 5820
gatatagagc aagttatgca aaggttcttg atgctgaaac gggggaaata aaatgacaaa 5880
caaagaaaaa gagttatttg ctgaaaatga ggaattaaaa aaagaaatta aggacttaaa 5940
agagcgtatt gaaagataca gagaaatgga agttgaatta agtacaacaa tagatttatt 6000
gagaggaggg attattgaat aaataaaagc ccccctgacg aaagtcgaca tggtcgatgt 6060
ctagatgctt aaactagaga aaggtttaaa agatgaaaac ttcaccacat cgtaatactt 6120
cagctattgt tgatttaaaa gcgattagaa ataatattga aaaatttaaa aagcatatta 6180
accctaatgc agagatttgg ccagcagtga aagcagatgc ttatggtcat ggctcgattg 6240
aggtttctaa agcggtgagc gatttggtag gtggtttttg tgtatcaaac ctagatgagg 6300
caattgaatt acgaaatcat ctggtgacta aaccgatttt agttttatcc ggaattgttc 6360
cagaagatgt tgatattgca gctgccctta atattagtct tactgccccg agtttagaat 6420
ggttgaaatt ggttgttcaa gaagaagcag aactttcaga tttaaaaatt catattggtg 6480
tagattctgg tatgggtcgg attggtattc gtgatgttga agaagctaat cagatgattg 6540
aacttgctga taaatatgcg attaattttg aaggaatttt cactcatttt gcgactgcgg 6600
atatggctga tgaaacaaaa tttaaaaatc aacaggcaag atttaacaaa attatggccg 6660
gattatcacg tcaaccaaaa tttatacact caactaatac ggccgctgct ttatggcata 6720
aggaacaagt tcaagctatt gaacgtttag ggatttcaat gtatggcttg aatccaagtg 6780
gtaaaacttt ggaacttcct tttgaaattg aacccgctct ctctttagtt tctgaattga 6840
ctcatataaa aaaaatagct gcaggtgaaa cggttggtta tggtgcaact tatgagacga 6900
gtgaagaaac ttggattgga actgttccaa ttggttacgc tgacgggtgg acccgtcaaa 6960
tgcaaggttt caaagtgctt gttgatggaa agttttgtga gattgttggt cgagtttgta 7020
tggatcaaat gatgataaaa cttgataagt cttacccttt gggaacgaag gtcactttga 7080
ttggtcgaga taaggctaat gaaatcacga caacagacgt tgctgattgg cgtggaacga 7140
ttaattatga agtgctttgc ttactttctg atagaatcaa aagaatctat aaataaaatt 7200
aaaaaaactg tatttttaca gtttttttgt tttctgttaa aagcagatga taacctcact 7260
a 7261
<210>33
<211>4003
<211>ДНК
<213>Искусственная последовательность
<220>
<223>синтетический конструкт mGTE
<400>33
agatctgagc gttgtataag cttttatgtc tttctatatc aacttttaat agaaatataa 60
agtaatataa atgtttttat aataaattat gtgagatata tttttttgtc cgtactggta 120
tagatttgac gattaagtct taaataagtt ataatctcaa ttgcgtaatt tcttaaatac 180
agaaataaca actacattgg tagactgatt aaaaagtgta cttgatgaac tgttataaac 240
cttaaaaaaa taaaaataat agtttggggg atgttaaaga tgtataaaaa atatggagat 300
tgttttaaaa agttgcgaaa ccaaaagaat ttagggttat catactttag taaacttgga 360
atagaccgtt caaatatatc tagatttgaa catggaaaat gtatgatgag ttttgagcgt 420
atagatttga tgttagaaga aatgcaagtt ccgttatctg agtacgaatt gattgtaaat 480
aattttatgc cgaatttcca agaatttttt atattagaat tggaaaaagc tgaatttagc 540
caaaatcgag ataaaataaa agagttgtat tctgaggtca aagaaacggg gaatcattta 600
ctgacggtta ccgtgaaaac gaagcttggg aatataagtc agacagaagt taaagaaatt 660
gaagcttatc tttgcaatat tgaagagtgg ggatattttg aacttacttt attttatttt 720
gtatctgatt atctcaatgt caatcaatta gaattgctgc tttttaattt tgataaaaga 780
tgtgaaaatt actgtagagt cttaaaatat agaaggagac tattgcaaat agcctataaa 840
agtgttgcga tatacgcggc taaaggagaa agaaaaaaag ccgaaaatat tttagaaatg 900
actaaaaaat atcgaactgt gggagtcgat ttatattcag aagtattaag acatcttgct 960
agagctatca ttatttttaa ttttgaaaat gcagagattg gggaagaaaa aataaattat 1020
gctcttgaga ttttggaaga atttggagga aagaagataa aagaattcta tcagaataaa 1080
atggaaaagt atttgaaaag gtcaatttag tctcttttga gctgttgctt taaagcaaca 1140
gctcaaaaga gattttcttt attctagagc atatactaga gggtgaagat aggttgtctg 1200
aagcattata acttgtcttt taaaaaattc aatcataaat ataaggaggt atgatgaaga 1260
aaaagattat tagtgcaatt ttaatgtcaa cggtcatctt aagcgctgct gccccattgt 1320
caggtgttta tgcagcccca acacgtagtc caataacagt aactagacct tggaaacatg 1380
ttgaagcaat taaagaagca ttaaatttat tagatgatat gccagtaaca ttaaatgaag 1440
aagttgaagt agtaagtaat gaatttagtt ttaaaaaatt aacatgtgtt caaactagat 1500
taaaaatttt tgaacaagga ttaagaggta attttactaa attaaaaggt gctttaaata 1560
tgacagctag ttattatcaa acatattgtc caccaacacc tgaaactgat tgtgaaacac 1620
aagtaactac atatgctgat tttattgatt cattaaaaac atttttaact gatattcctt 1680
ttgaatgtaa aaaaccagga caaaaataat aaacgcgtat taataaggag gctaactaat 1740
gaaaaagaaa atcatttcag cgattttgat gtcaacggtt attttaagcg cagcagctcc 1800
attatctgga gtttatgcag ccgatatgtg ggaattagaa aaagatgttt atgttgtaga 1860
agttgattgg acaccagatg ctcctggtga aacagttaat ttaacatgtg atactccaga 1920
agaagatgat attacatgga catctgatca acgacatgga gttattggta gtggaaaaac 1980
attaacaatt acagttaaag aatttttaga tgctggacaa tatacttgtc ataaaggagg 2040
tgaaacatta tctcattcac atttattatt acataaaaaa gaaaatggta tttggtcaac 2100
tgaaatctta aaaaatttta aaaataagac atttttaaaa tgtgaagctc ctaattattc 2160
tggtagattt acttgttcat ggttagttca aagaaatatg gatttaaaat ttaatattaa 2220
atcaagttca agtagtcctg atagtagagc tgtaacatgt ggaatggcaa gtttatctgc 2280
tgaaaaagta acacttgatc aacgtgatta tgaaaaatat tctgttagtt gtcaagaaga 2340
tgttacttgt ccaacagctg aagaaacatt accaattgaa ttagcattag aagctagaca 2400
acaaaacaaa tatgaaaatt atagtacatc tttctttatt cgtgacatta ttaaacctga 2460
tccacctaaa aatttacaaa tgaaaccttt aaaaaatagt caagttgaag ttagttggga 2520
atatccagat tcatggtcaa caccacattc atatttttca ttaaaattct ttgttagaat 2580
tcaacgtaaa aaagaaaaaa tgaaagaaac tgaagaaggt tgtaaccaaa aaggtgcatt 2640
tttagttgaa aaaactagta ctgaagttca atgtaaaggt ggtaatgtat gtgttcaagc 2700
tcaagatcga tattataatt ctagttgttc aaaatgggca tgtgttccat gtagagttcg 2760
tagtggagga ggtggaagtg gtggaggtgg ttcaggtggt ggaggttcac gtgtaattcc 2820
agtttcagga cctgctcgat gtttaagtca atctcgaaat ttattaaaaa ctacagatga 2880
tatggttaaa actgctagag aaaaattaaa acattatagt tgtacagctg aagatattga 2940
tcatgaagat attacacgtg atcaaacttc aacacttaaa acatgtttac cacttgaatt 3000
acataaaaat gaatcttgtt tagctactag agaaactagt agtacaacta gaggttcttg 3060
tttgcctcca caaaaaacat cattaatgat gacattatgt ttaggttcta tttatgaaga 3120
tttgaaaatg tatcaaactg aatttcaagc aattaatgct gctttacaaa atcataatca 3180
tcaacaaatt attttagata aaggtatgtt agttgcaatt gatgaattaa tgcaatcttt 3240
aaatcataat ggtgaaactc ttagacaaaa accacctgtt ggagaagcag acccttatcg 3300
agtgaaaatg aaattatgta tcttgttgca cgctttttca acacgggtag tcacaattaa 3360
tcgtgtaatg ggatatttga gtagtgcata ataaacgcgt gaaatttagg aggtagtcca 3420
aatgaaaaaa aagattatct cagctatttt aatgtctaca gtgatacttt ctgctgcagc 3480
cccgttgtca ggtgtttacg ctgcaaattt tggtagatta cattgtacaa cagcagtaat 3540
acgtaatatt aatgatcaag ttttatttgt tgataaaaga caacctgttt ttgaagatat 3600
gactgatatt gatcaatctg catctgaacc acaaactaga ttaataattt atatgtataa 3660
agatagtgaa gttagaggat tagctgtaac attaagtgtt aaagatagta aaatgagtac 3720
attatcatgt aaaaacaaaa taatttcatt tgaagaaatg gacccacctg aaaatattga 3780
tgatattcaa tcagatttaa ttttctttca aaaacgtgtt ccaggtcata acaaaatgga 3840
atttgaatct agtttatatg aaggtcactt tttagcttgt caaaaagaag atgatgcttt 3900
taaattaatt ttaaagaaaa aagatgaaaa tggagataaa tcagttatgt ttacattaac 3960
taatttacat caatcataat aaccatgggt actgcaggca tgc 4003
<210>34
<211>7129
<211>ДНК
<213>Искусственная последовательность
<220>
<223>плазмида pC-mGTE
<400>34
gatctgagcg ttgtataagc ttttatgtct ttctatatca acttttaata gaaatataaa 60
gtaatataaa tgtttttata ataaattatg tgagatatat ttttttgtcc gtactggtat 120
agatttgacg attaagtctt aaataagtta taatctcaat tgcgtaattt cttaaataca 180
gaaataacaa ctacattggt agactgatta aaaagtgtac ttgatgaact gttataaacc 240
ttaaaaaaat aaaaataata gtttggggga tgttaaagat gtataaaaaa tatggagatt 300
gttttaaaaa gttgcgaaac caaaagaatt tagggttatc atactttagt aaacttggaa 360
tagaccgttc aaatatatct agatttgaac atggaaaatg tatgatgagt tttgagcgta 420
tagatttgat gttagaagaa atgcaagttc cgttatctga gtacgaattg attgtaaata 480
attttatgcc gaatttccaa gaatttttta tattagaatt ggaaaaagct gaatttagcc 540
aaaatcgaga taaaataaaa gagttgtatt ctgaggtcaa agaaacgggg aatcatttac 600
tgacggttac cgtgaaaacg aagcttggga atataagtca gacagaagtt aaagaaattg 660
aagcttatct ttgcaatatt gaagagtggg gatattttga acttacttta ttttattttg 720
tatctgatta tctcaatgtc aatcaattag aattgctgct ttttaatttt gataaaagat 780
gtgaaaatta ctgtagagtc ttaaaatata gaaggagact attgcaaata gcctataaaa 840
gtgttgcgat atacgcggct aaaggagaaa gaaaaaaagc cgaaaatatt ttagaaatga 900
ctaaaaaata tcgaactgtg ggagtcgatt tatattcaga agtattaaga catcttgcta 960
gagctatcat tatttttaat tttgaaaatg cagagattgg ggaagaaaaa ataaattatg 1020
ctcttgagat tttggaagaa tttggaggaa agaagataaa agaattctat cagaataaaa 1080
tggaaaagta tttgaaaagg tcaatttagt ctcttttgag ctgttgcttt aaagcaacag 1140
ctcaaaagag attttcttta ttctagagca tatactagag ggtgaagata ggttgtctga 1200
agcattataa cttgtctttt aaaaaattca atcataaata taaggaggta tgatgaagaa 1260
aaagattatt agtgcaattt taatgtcaac ggtcatctta agcgctgctg ccccattgtc 1320
aggtgtttat gcagccccaa cacgtagtcc aataacagta actagacctt ggaaacatgt 1380
tgaagcaatt aaagaagcat taaatttatt agatgatatg ccagtaacat taaatgaaga 1440
agttgaagta gtaagtaatg aatttagttt taaaaaatta acatgtgttc aaactagatt 1500
aaaaattttt gaacaaggat taagaggtaa ttttactaaa ttaaaaggtg ctttaaatat 1560
gacagctagt tattatcaaa catattgtcc accaacacct gaaactgatt gtgaaacaca 1620
agtaactaca tatgctgatt ttattgattc attaaaaaca tttttaactg atattccttt 1680
tgaatgtaaa aaaccaggac aaaaataata aacgcgtatt aataaggagg ctaactaatg 1740
aaaaagaaaa tcatttcagc gattttgatg tcaacggtta ttttaagcgc agcagctcca 1800
ttatctggag tttatgcagc cgatatgtgg gaattagaaa aagatgttta tgttgtagaa 1860
gttgattgga caccagatgc tcctggtgaa acagttaatt taacatgtga tactccagaa 1920
gaagatgata ttacatggac atctgatcaa cgacatggag ttattggtag tggaaaaaca 1980
ttaacaatta cagttaaaga atttttagat gctggacaat atacttgtca taaaggaggt 2040
gaaacattat ctcattcaca tttattatta cataaaaaag aaaatggtat ttggtcaact 2100
gaaatcttaa aaaattttaa aaataagaca tttttaaaat gtgaagctcc taattattct 2160
ggtagattta cttgttcatg gttagttcaa agaaatatgg atttaaaatt taatattaaa 2220
tcaagttcaa gtagtcctga tagtagagct gtaacatgtg gaatggcaag tttatctgct 2280
gaaaaagtaa cacttgatca acgtgattat gaaaaatatt ctgttagttg tcaagaagat 2340
gttacttgtc caacagctga agaaacatta ccaattgaat tagcattaga agctagacaa 2400
caaaacaaat atgaaaatta tagtacatct ttctttattc gtgacattat taaacctgat 2460
ccacctaaaa atttacaaat gaaaccttta aaaaatagtc aagttgaagt tagttgggaa 2520
tatccagatt catggtcaac accacattca tatttttcat taaaattctt tgttagaatt 2580
caacgtaaaa aagaaaaaat gaaagaaact gaagaaggtt gtaaccaaaa aggtgcattt 2640
ttagttgaaa aaactagtac tgaagttcaa tgtaaaggtg gtaatgtatg tgttcaagct 2700
caagatcgat attataattc tagttgttca aaatgggcat gtgttccatg tagagttcgt 2760
agtggaggag gtggaagtgg tggaggtggt tcaggtggtg gaggttcacg tgtaattcca 2820
gtttcaggac ctgctcgatg tttaagtcaa tctcgaaatt tattaaaaac tacagatgat 2880
atggttaaaa ctgctagaga aaaattaaaa cattatagtt gtacagctga agatattgat 2940
catgaagata ttacacgtga tcaaacttca acacttaaaa catgtttacc acttgaatta 3000
cataaaaatg aatcttgttt agctactaga gaaactagta gtacaactag aggttcttgt 3060
ttgcctccac aaaaaacatc attaatgatg acattatgtt taggttctat ttatgaagat 3120
ttgaaaatgt atcaaactga atttcaagca attaatgctg ctttacaaaa tcataatcat 3180
caacaaatta ttttagataa aggtatgtta gttgcaattg atgaattaat gcaatcttta 3240
aatcataatg gtgaaactct tagacaaaaa ccacctgttg gagaagcaga cccttatcga 3300
gtgaaaatga aattatgtat cttgttgcac gctttttcaa cacgggtagt cacaattaat 3360
cgtgtaatgg gatatttgag tagtgcataa taaacgcgtg aaatttagga ggtagtccaa 3420
atgaaaaaaa agattatctc agctatttta atgtctacag tgatactttc tgctgcagcc 3480
ccgttgtcag gtgtttacgc tgcaaatttt ggtagattac attgtacaac agcagtaata 3540
cgtaatatta atgatcaagt tttatttgtt gataaaagac aacctgtttt tgaagatatg 3600
actgatattg atcaatctgc atctgaacca caaactagat taataattta tatgtataaa 3660
gatagtgaag ttagaggatt agctgtaaca ttaagtgtta aagatagtaa aatgagtaca 3720
ttatcatgta aaaacaaaat aatttcattt gaagaaatgg acccacctga aaatattgat 3780
gatattcaat cagatttaat tttctttcaa aaacgtgttc caggtcataa caaaatggaa 3840
tttgaatcta gtttatatga aggtcacttt ttagcttgtc aaaaagaaga tgatgctttt 3900
aaattaattt taaagaaaaa agatgaaaat ggagataaat cagttatgtt tacattaact 3960
aatttacatc aatcataata accatgggta ctgcaggcat gcggtaccac tagttctaga 4020
gagctcaagc tttctttgaa ccaaaattag aaaaccaagg cttgaaacgt tcaattgaaa 4080
tggcaattaa acaaattaca gcacgtgttg ctttgattga tagccaaaaa gcagcagttg 4140
ataaagcaat tactgatatt gctgaaaaat tgtaatttat aaataaaaat caccttttag 4200
aggtggtttt tttatttata aattattcgt ttgatttcgc tttcgataga acaatcaaat 4260
cgtttctgag acgttttagc gtttatttcg tttagttatc ggcataatcg ttaaaacagg 4320
cgttatcgta gcgtaaaagc ccttgagcgt agcgtggctt tgcagcgaag atgttgtctg 4380
ttagattatg aaagccgatg actgaatgaa ataataagcg cagcgtcctt ctatttcggt 4440
tggaggaggc tcaagggagt ttgagggaat gaaattccct catgggtttg attttaaaaa 4500
ttgcttgcaa ttttgccgag cggtagcgct ggaaaatttt tgaaaaaaat ttggaatttg 4560
gaaaaaaatg gggggaaagg aagcgaattt tgcttccgta ctacgacccc ccattaagtg 4620
ccgagtgcca atttttgtgc caaaaacgct ctatcccaac tggctcaagg gtttgagggg 4680
tttttcaatc gccaacgaat cgccaacgtt ttcgccaacg ttttttataa atctatattt 4740
aagtagcttt atttttgttt ttatgattac aaagtgatac actaatttta taaaattatt 4800
tgattggagt tttttaaatg gtgatttcag aatcgaaaaa aagagttatg atttctctga 4860
caaaagagca agataaaaaa ttaacagata tggcgaaaca aaaagatttt tcaaaatctg 4920
cggttgcggc gttagctata gaagaatatg caagaaagga atcagaacaa aaaaaataag 4980
cgaaagctcg cgtttttaga aggatacgag ttttcgctac ttgtttttga taaggtaatt 5040
atatcatggc tattaaaaat actaaagcta gaaattttgg atttttatta tatcctgact 5100
caattcctaa tgattggaaa gaaaaattag agagtttggg cgtatctatg gctgtcagtc 5160
ctttacacga tatggacgaa aaaaaagata aagatacatg gaatagtagt gatgttatac 5220
gaaatggaaa gcactataaa aaaccacact atcacgttat atatattgca cgaaatcctg 5280
taacaataga aagcgttagg aacaagatta agcgaaaatt ggggaatagt tcagttgctc 5340
atgttgagat acttgattat atcaaaggtt catatgaata tttgactcat gaatcaaagg 5400
acgctattgc taagaataaa catatatacg acaaaaaaga tattttgaac attaatgatt 5460
ttgatattga ccgctatata acacttgatg aaagccaaaa aagagaattg aagaatttac 5520
ttttagatat agtggatgac tataatttgg taaatacaaa agatttaatg gcttttattc 5580
gccttagggg agcggagttt ggaattttaa atacgaatga tgtaaaagat attgtttcaa 5640
caaactctag cgcctttaga ttatggtttg agggcaatta tcagtgtgga tatagagcaa 5700
gttatgcaaa ggttcttgat gctgaaacgg gggaaataaa atgacaaaca aagaaaaaga 5760
gttatttgct gaaaatgagg aattaaaaaa agaaattaag gacttaaaag agcgtattga 5820
aagatacaga gaaatggaag ttgaattaag tacaacaata gatttattga gaggagggat 5880
tattgaataa ataaaagccc ccctgacgaa agtcgacatg gtcgatgtct agatgcttaa 5940
actagagaaa ggtttaaaag atgaaaactt caccacatcg taatacttca gctattgttg 6000
atttaaaagc gattagaaat aatattgaaa aatttaaaaa gcatattaac cctaatgcag 6060
agatttggcc agcagtgaaa gcagatgctt atggtcatgg ctcgattgag gtttctaaag 6120
cggtgagcga tttggtaggt ggtttttgtg tatcaaacct agatgaggca attgaattac 6180
gaaatcatct ggtgactaaa ccgattttag ttttatccgg aattgttcca gaagatgttg 6240
atattgcagc tgcccttaat attagtctta ctgccccgag tttagaatgg ttgaaattgg 6300
ttgttcaaga agaagcagaa ctttcagatt taaaaattca tattggtgta gattctggta 6360
tgggtcggat tggtattcgt gatgttgaag aagctaatca gatgattgaa cttgctgata 6420
aatatgcgat taattttgaa ggaattttca ctcattttgc gactgcggat atggctgatg 6480
aaacaaaatt taaaaatcaa caggcaagat ttaacaaaat tatggccgga ttatcacgtc 6540
aaccaaaatt tatacactca actaatacgg ccgctgcttt atggcataag gaacaagttc 6600
aagctattga acgtttaggg atttcaatgt atggcttgaa tccaagtggt aaaactttgg 6660
aacttccttt tgaaattgaa cccgctctct ctttagtttc tgaattgact catataaaaa 6720
aaatagctgc aggtgaaacg gttggttatg gtgcaactta tgagacgagt gaagaaactt 6780
ggattggaac tgttccaatt ggttacgctg acgggtggac ccgtcaaatg caaggtttca 6840
aagtgcttgt tgatggaaag ttttgtgaga ttgttggtcg agtttgtatg gatcaaatga 6900
tgataaaact tgataagtct taccctttgg gaacgaaggt cactttgatt ggtcgagata 6960
aggctaatga aatcacgaca acagacgttg ctgattggcg tggaacgatt aattatgaag 7020
tgctttgctt actttctgat agaatcaaaa gaatctataa ataaaattaa aaaaactgta 7080
tttttacagt ttttttgttt tctgttaaaa gcagatgata acctcacta 7129
<210>35
<211>1970
<211>ДНК
<213>Искусственная последовательность
<220>
<223>синтетический конструкт mCherry
<400>35
agatctgagc gttgtataag cttttatgtc tttctatatc aacttttaat agaaatataa 60
agtaatataa atgtttttat aataaattat gtgagatata tttttttgtc cgtactggta 120
tagatttgac gattaagtct taaataagtt ataatctcaa ttgcgtaatt tcttaaatac 180
agaaataaca actacattgg tagactgatt aaaaagtgta cttgatgaac tgttataaac 240
cttaaaaaaa taaaaataat agtttggggg atgttaaaga tgtataaaaa atatggagat 300
tgttttaaaa agttgcgaaa ccaaaagaat ttagggttat catactttag taaacttgga 360
atagaccgtt caaatatatc tagatttgaa catggaaaat gtatgatgag ttttgagcgt 420
atagatttga tgttagaaga aatgcaagtt ccgttatctg agtacgaatt gattgtaaat 480
aattttatgc cgaatttcca agaatttttt atattagaat tggaaaaagc tgaatttagc 540
caaaatcgag ataaaataaa agagttgtat tctgaggtca aagaaacggg gaatcattta 600
ctgacggtta ccgtgaaaac gaagcttggg aatataagtc agacagaagt taaagaaatt 660
gaagcttatc tttgcaatat tgaagagtgg ggatattttg aacttacttt attttatttt 720
gtatctgatt atctcaatgt caatcaatta gaattgctgc tttttaattt tgataaaaga 780
tgtgaaaatt actgtagagt cttaaaatat agaaggagac tattgcaaat agcctataaa 840
agtgttgcga tatacgcggc taaaggagaa agaaaaaaag ccgaaaatat tttagaaatg 900
actaaaaaat atcgaactgt gggagtcgat ttatattcag aagtattaag acatcttgct 960
agagctatca ttatttttaa ttttgaaaat gcagagattg gggaagaaaa aataaattat 1020
gctcttgaga ttttggaaga atttggagga aagaagataa aagaattcta tcagaataaa 1080
atggaaaagt atttgaaaag gtcaatttag tctcttttga gctgttgctt taaagcaaca 1140
gctcaaaaga gattttcttt attctagagc atatactaga gggtgaagat aggttgtctg 1200
aagcattata acttgtcttt taaaaaattc aatcataaat ataaggaggt atgatgagca 1260
aaggagaaga agataacatg gcaatcatca aagaatttat gcgtttcaaa gttcacatgg 1320
aaggttctgt aaacggacac gaatttgaaa ttgaaggtga aggtgaaggc cgtccttatg 1380
aaggaacaca aacggcaaag ctgaaagtaa caaaaggcgg accgcttccg tttgcatggg 1440
atatcctttc tccgcaattc atgtacggtt caaaagcata cgtgaagcat ccggctgata 1500
ttcctgatta tttgaagctg tcattccctg aaggcttcaa atgggagcgt gtgatgaact 1560
ttgaagatgg cggtgttgtt actgttactc aagattcaag ccttcaagac ggtgaattta 1620
tttacaaagt gaagctgcgc ggaacaaact tcccatctga cggacctgtc atgcaaaaga 1680
aaacaatggg ctgggaagca agctctgaac gcatgtatcc agaggacggt gctttaaaag 1740
gagaaatcaa acagcgtttg aagctgaaag acggcggaca ctatgacgct gaagtgaaaa 1800
caacttacaa agcgaaaaag ccggttcagc ttccaggtgc ttacaacgta aacatcaaac 1860
ttgatattac aagccacaat gaagattata cgattgttga acaatatgaa cgcgctgaag 1920
gccgtcattc aactggcgga atggatgagc tttacaaata ataagcatgc 1970
<210>36
<211>5096
<211>ДНК
<213>Искусственная последовательность
<220>
<223>плазмида pC-mCherry
<400>36
gatctgagcg ttgtataagc ttttatgtct ttctatatca acttttaata gaaatataaa 60
gtaatataaa tgtttttata ataaattatg tgagatatat ttttttgtcc gtactggtat 120
agatttgacg attaagtctt aaataagtta taatctcaat tgcgtaattt cttaaataca 180
gaaataacaa ctacattggt agactgatta aaaagtgtac ttgatgaact gttataaacc 240
ttaaaaaaat aaaaataata gtttggggga tgttaaagat gtataaaaaa tatggagatt 300
gttttaaaaa gttgcgaaac caaaagaatt tagggttatc atactttagt aaacttggaa 360
tagaccgttc aaatatatct agatttgaac atggaaaatg tatgatgagt tttgagcgta 420
tagatttgat gttagaagaa atgcaagttc cgttatctga gtacgaattg attgtaaata 480
attttatgcc gaatttccaa gaatttttta tattagaatt ggaaaaagct gaatttagcc 540
aaaatcgaga taaaataaaa gagttgtatt ctgaggtcaa agaaacgggg aatcatttac 600
tgacggttac cgtgaaaacg aagcttggga atataagtca gacagaagtt aaagaaattg 660
aagcttatct ttgcaatatt gaagagtggg gatattttga acttacttta ttttattttg 720
tatctgatta tctcaatgtc aatcaattag aattgctgct ttttaatttt gataaaagat 780
gtgaaaatta ctgtagagtc ttaaaatata gaaggagact attgcaaata gcctataaaa 840
gtgttgcgat atacgcggct aaaggagaaa gaaaaaaagc cgaaaatatt ttagaaatga 900
ctaaaaaata tcgaactgtg ggagtcgatt tatattcaga agtattaaga catcttgcta 960
gagctatcat tatttttaat tttgaaaatg cagagattgg ggaagaaaaa ataaattatg 1020
ctcttgagat tttggaagaa tttggaggaa agaagataaa agaattctat cagaataaaa 1080
tggaaaagta tttgaaaagg tcaatttagt ctcttttgag ctgttgcttt aaagcaacag 1140
ctcaaaagag attttcttta ttctagagca tatactagag ggtgaagata ggttgtctga 1200
agcattataa cttgtctttt aaaaaattca atcataaata taaggaggta tgatgagcaa 1260
aggagaagaa gataacatgg caatcatcaa agaatttatg cgtttcaaag ttcacatgga 1320
aggttctgta aacggacacg aatttgaaat tgaaggtgaa ggtgaaggcc gtccttatga 1380
aggaacacaa acggcaaagc tgaaagtaac aaaaggcgga ccgcttccgt ttgcatggga 1440
tatcctttct ccgcaattca tgtacggttc aaaagcatac gtgaagcatc cggctgatat 1500
tcctgattat ttgaagctgt cattccctga aggcttcaaa tgggagcgtg tgatgaactt 1560
tgaagatggc ggtgttgtta ctgttactca agattcaagc cttcaagacg gtgaatttat 1620
ttacaaagtg aagctgcgcg gaacaaactt cccatctgac ggacctgtca tgcaaaagaa 1680
aacaatgggc tgggaagcaa gctctgaacg catgtatcca gaggacggtg ctttaaaagg 1740
agaaatcaaa cagcgtttga agctgaaaga cggcggacac tatgacgctg aagtgaaaac 1800
aacttacaaa gcgaaaaagc cggttcagct tccaggtgct tacaacgtaa acatcaaact 1860
tgatattaca agccacaatg aagattatac gattgttgaa caatatgaac gcgctgaagg 1920
ccgtcattca actggcggaa tggatgagct ttacaaataa taagcatgcg gtaccactag 1980
ttctagagag ctcaagcttt ctttgaacca aaattagaaa accaaggctt gaaacgttca 2040
attgaaatgg caattaaaca aattacagca cgtgttgctt tgattgatag ccaaaaagca 2100
gcagttgata aagcaattac tgatattgct gaaaaattgt aatttataaa taaaaatcac 2160
cttttagagg tggttttttt atttataaat tattcgtttg atttcgcttt cgatagaaca 2220
atcaaatcgt ttctgagacg ttttagcgtt tatttcgttt agttatcggc ataatcgtta 2280
aaacaggcgt tatcgtagcg taaaagccct tgagcgtagc gtggctttgc agcgaagatg 2340
ttgtctgtta gattatgaaa gccgatgact gaatgaaata ataagcgcag cgtccttcta 2400
tttcggttgg aggaggctca agggagtttg agggaatgaa attccctcat gggtttgatt 2460
ttaaaaattg cttgcaattt tgccgagcgg tagcgctgga aaatttttga aaaaaatttg 2520
gaatttggaa aaaaatgggg ggaaaggaag cgaattttgc ttccgtacta cgacccccca 2580
ttaagtgccg agtgccaatt tttgtgccaa aaacgctcta tcccaactgg ctcaagggtt 2640
tgaggggttt ttcaatcgcc aacgaatcgc caacgttttc gccaacgttt tttataaatc 2700
tatatttaag tagctttatt tttgttttta tgattacaaa gtgatacact aattttataa 2760
aattatttga ttggagtttt ttaaatggtg atttcagaat cgaaaaaaag agttatgatt 2820
tctctgacaa aagagcaaga taaaaaatta acagatatgg cgaaacaaaa agatttttca 2880
aaatctgcgg ttgcggcgtt agctatagaa gaatatgcaa gaaaggaatc agaacaaaaa 2940
aaataagcga aagctcgcgt ttttagaagg atacgagttt tcgctacttg tttttgataa 3000
ggtaattata tcatggctat taaaaatact aaagctagaa attttggatt tttattatat 3060
cctgactcaa ttcctaatga ttggaaagaa aaattagaga gtttgggcgt atctatggct 3120
gtcagtcctt tacacgatat ggacgaaaaa aaagataaag atacatggaa tagtagtgat 3180
gttatacgaa atggaaagca ctataaaaaa ccacactatc acgttatata tattgcacga 3240
aatcctgtaa caatagaaag cgttaggaac aagattaagc gaaaattggg gaatagttca 3300
gttgctcatg ttgagatact tgattatatc aaaggttcat atgaatattt gactcatgaa 3360
tcaaaggacg ctattgctaa gaataaacat atatacgaca aaaaagatat tttgaacatt 3420
aatgattttg atattgaccg ctatataaca cttgatgaaa gccaaaaaag agaattgaag 3480
aatttacttt tagatatagt ggatgactat aatttggtaa atacaaaaga tttaatggct 3540
tttattcgcc ttaggggagc ggagtttgga attttaaata cgaatgatgt aaaagatatt 3600
gtttcaacaa actctagcgc ctttagatta tggtttgagg gcaattatca gtgtggatat 3660
agagcaagtt atgcaaaggt tcttgatgct gaaacggggg aaataaaatg acaaacaaag 3720
aaaaagagtt atttgctgaa aatgaggaat taaaaaaaga aattaaggac ttaaaagagc 3780
gtattgaaag atacagagaa atggaagttg aattaagtac aacaatagat ttattgagag 3840
gagggattat tgaataaata aaagcccccc tgacgaaagt cgacatggtc gatgtctaga 3900
tgcttaaact agagaaaggt ttaaaagatg aaaacttcac cacatcgtaa tacttcagct 3960
attgttgatt taaaagcgat tagaaataat attgaaaaat ttaaaaagca tattaaccct 4020
aatgcagaga tttggccagc agtgaaagca gatgcttatg gtcatggctc gattgaggtt 4080
tctaaagcgg tgagcgattt ggtaggtggt ttttgtgtat caaacctaga tgaggcaatt 4140
gaattacgaa atcatctggt gactaaaccg attttagttt tatccggaat tgttccagaa 4200
gatgttgata ttgcagctgc ccttaatatt agtcttactg ccccgagttt agaatggttg 4260
aaattggttg ttcaagaaga agcagaactt tcagatttaa aaattcatat tggtgtagat 4320
tctggtatgg gtcggattgg tattcgtgat gttgaagaag ctaatcagat gattgaactt 4380
gctgataaat atgcgattaa ttttgaagga attttcactc attttgcgac tgcggatatg 4440
gctgatgaaa caaaatttaa aaatcaacag gcaagattta acaaaattat ggccggatta 4500
tcacgtcaac caaaatttat acactcaact aatacggccg ctgctttatg gcataaggaa 4560
caagttcaag ctattgaacg tttagggatt tcaatgtatg gcttgaatcc aagtggtaaa 4620
actttggaac ttccttttga aattgaaccc gctctctctt tagtttctga attgactcat 4680
ataaaaaaaa tagctgcagg tgaaacggtt ggttatggtg caacttatga gacgagtgaa 4740
gaaacttgga ttggaactgt tccaattggt tacgctgacg ggtggacccg tcaaatgcaa 4800
ggtttcaaag tgcttgttga tggaaagttt tgtgagattg ttggtcgagt ttgtatggat 4860
caaatgatga taaaacttga taagtcttac cctttgggaa cgaaggtcac tttgattggt 4920
cgagataagg ctaatgaaat cacgacaaca gacgttgctg attggcgtgg aacgattaat 4980
tatgaagtgc tttgcttact ttctgataga atcaaaagaa tctataaata aaattaaaaa 5040
aactgtattt ttacagtttt tttgttttct gttaaaagca gatgataacc tcacta 5096
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| МОДИФИЦИРОВАННЫЕ ГРАМПОЛОЖИТЕЛЬНЫЕ БАКТЕРИИ И ИХ ПРИМЕНЕНИЕ | 2012 |
|
RU2773435C2 |
| Выделенный модифицированный белок VP1 капсида аденоассоциированного вируса 5 серотипа (AAV5), капсид и вектор на его основе | 2019 |
|
RU2751592C2 |
| КОМПОЗИЦИИ И СПОСОБЫ ДЛЯ БИОЛОГИЧЕСКОГО ПОЛУЧЕНИЯ ЛАКТАТА ИЗ С1-СОЕДИНЕНИЙ С ПРИМЕНЕНИЕМ ТРАНСФОРМАНТОВ ЛАКТАТ ДЕГИДРОГЕНАЗЫ | 2014 |
|
RU2710714C2 |
| ГЕРПЕСВИРУС С ИЗМЕНЕННЫМ СПЕКТРОМ МИШЕНЕЙ, СОДЕРЖАЩИЙ ГИБРИДНЫЙ ГЛИКОПРОТЕИН Н | 2016 |
|
RU2732120C2 |
| ВАРИАНТ AAV, КОМПОЗИЦИИ И СПОСОБЫ, В КОТОРЫХ ОН ИСПОЛЬЗУЕТСЯ, А ТАКЖЕ СПОСОБЫ ЕГО ПРИМЕНЕНИЯ ДЛЯ ПЕРЕНОСА ГЕНОВ В КЛЕТКИ, ОРГАНЫ И ТКАНИ | 2014 |
|
RU2837753C2 |
| Выделенный модифицированный белок VPI капсида аденоассоциированного вируса 9 серотипа (AAV9), капсид и вектор на его основе | 2021 |
|
RU2825667C2 |
| НОВЫЕ НАЦЕЛИВАЮЩИЕ НА ПЕЧЕНЬ АДЕНОАССОЦИИРОВАННЫЕ ВИРУСНЫЕ ВЕКТОРЫ | 2019 |
|
RU2793735C2 |
| СУБЪЕДИНИЧНАЯ ВАКЦИНА ДЛЯ ЛЕЧЕНИЯ ИЛИ ПРЕДОТВРАЩЕНИЯ ИНФЕКЦИИ ДЫХАТЕЛЬНЫХ ПУТЕЙ | 2020 |
|
RU2811991C2 |
| ВЕКТОРЫ AAV, НАЦЕЛЕННЫЕ НА ЦЕНТРАЛЬНУЮ НЕРВНУЮ СИСТЕМУ | 2015 |
|
RU2727015C2 |
| Выделенная нуклеиновая кислота, которая кодирует слитый белок на основе FVIII-BDD и гетерологичного сигнального пептида, и ее применение | 2022 |
|
RU2818229C2 |
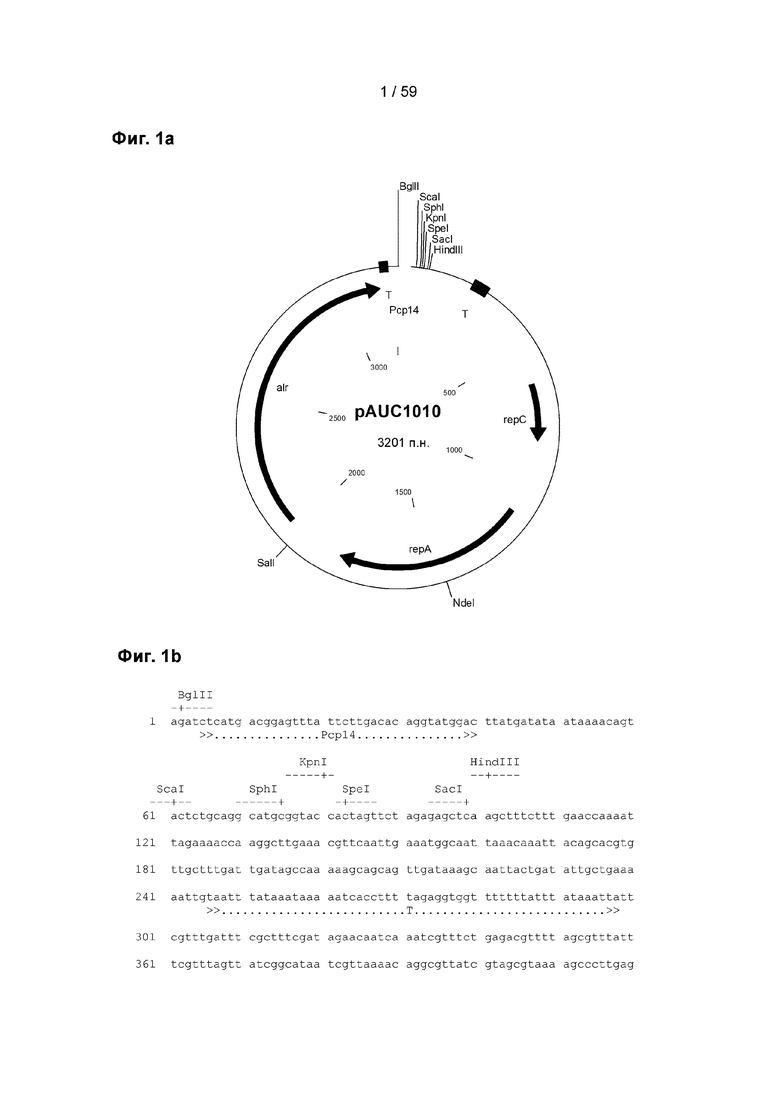








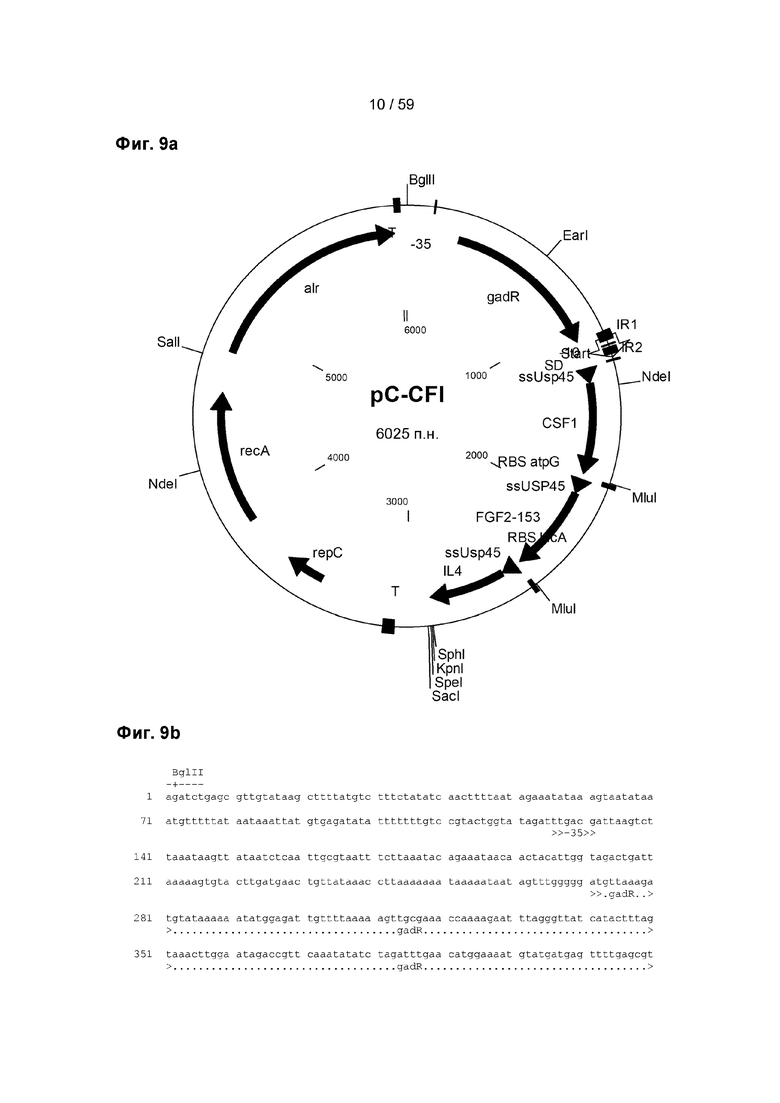
























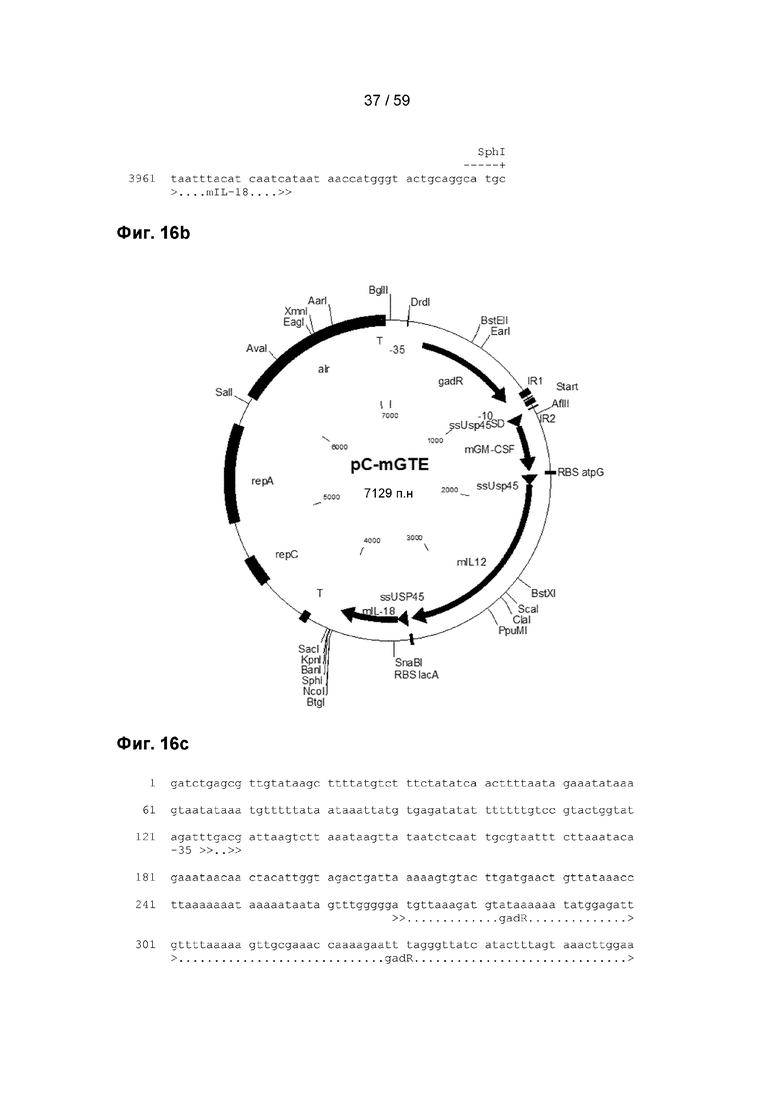







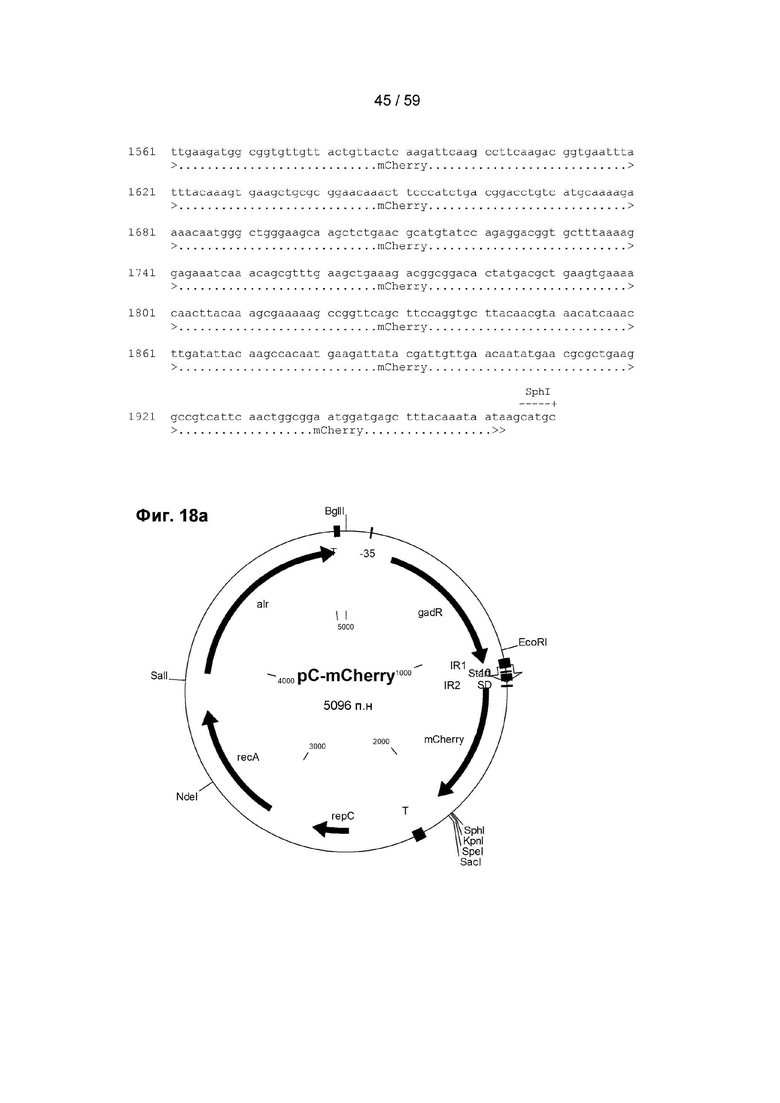




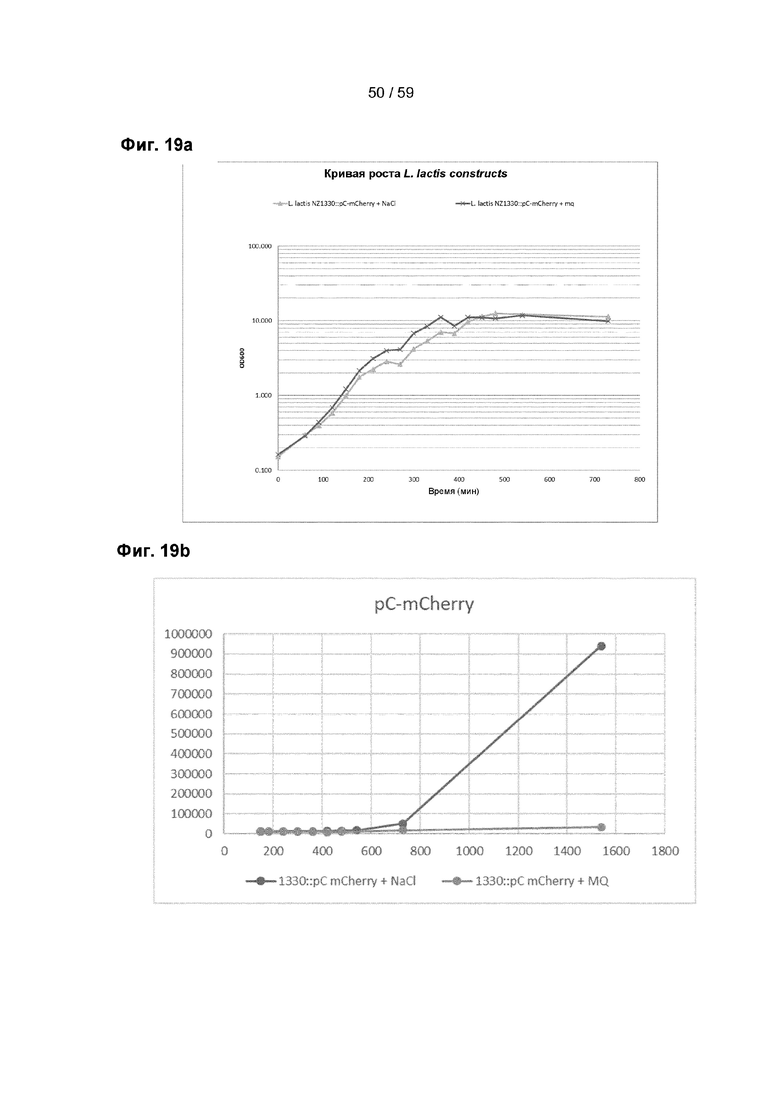
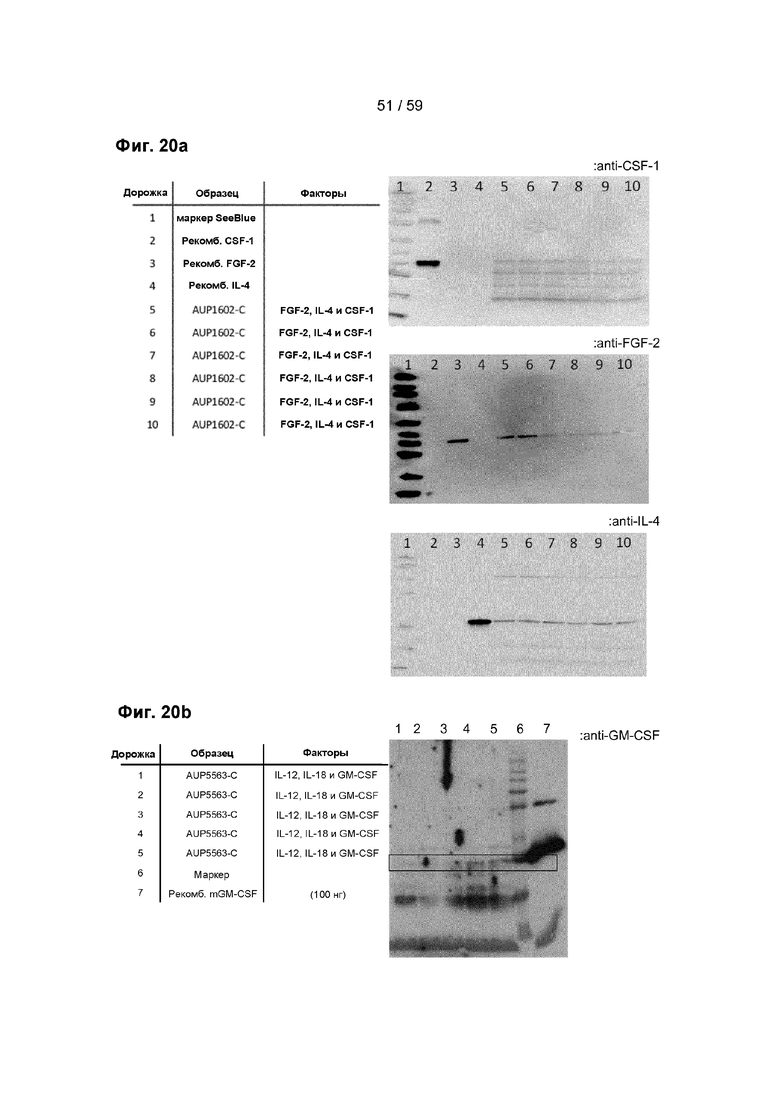
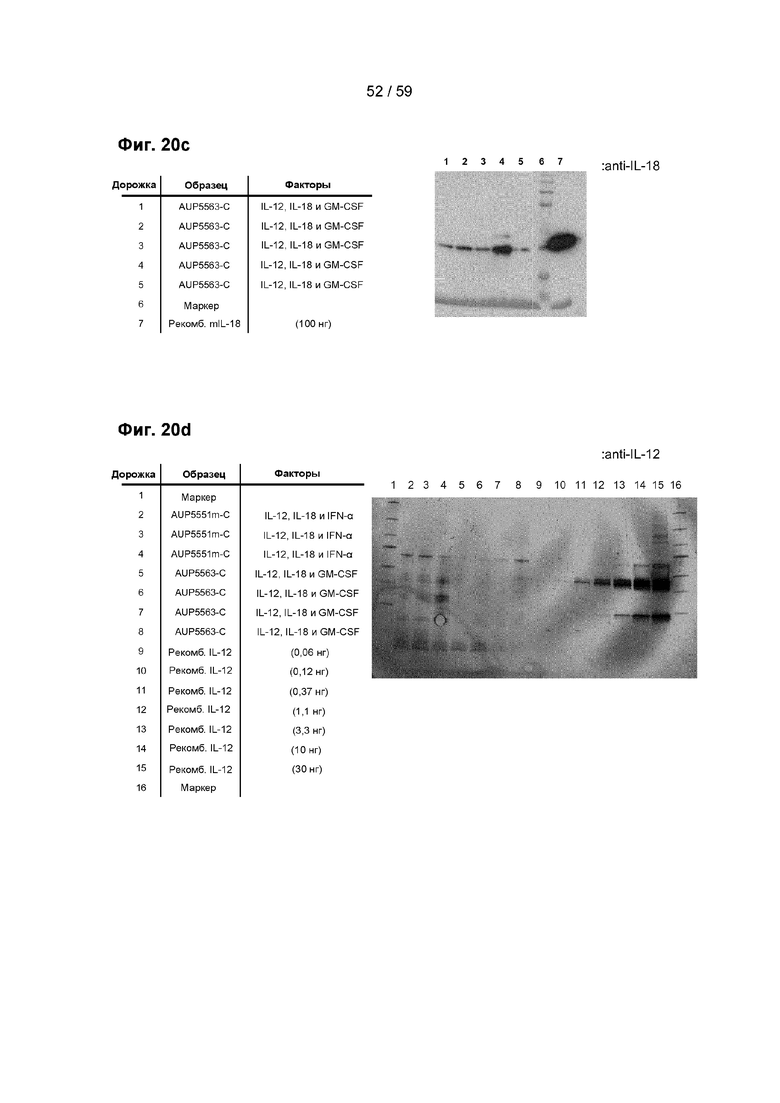
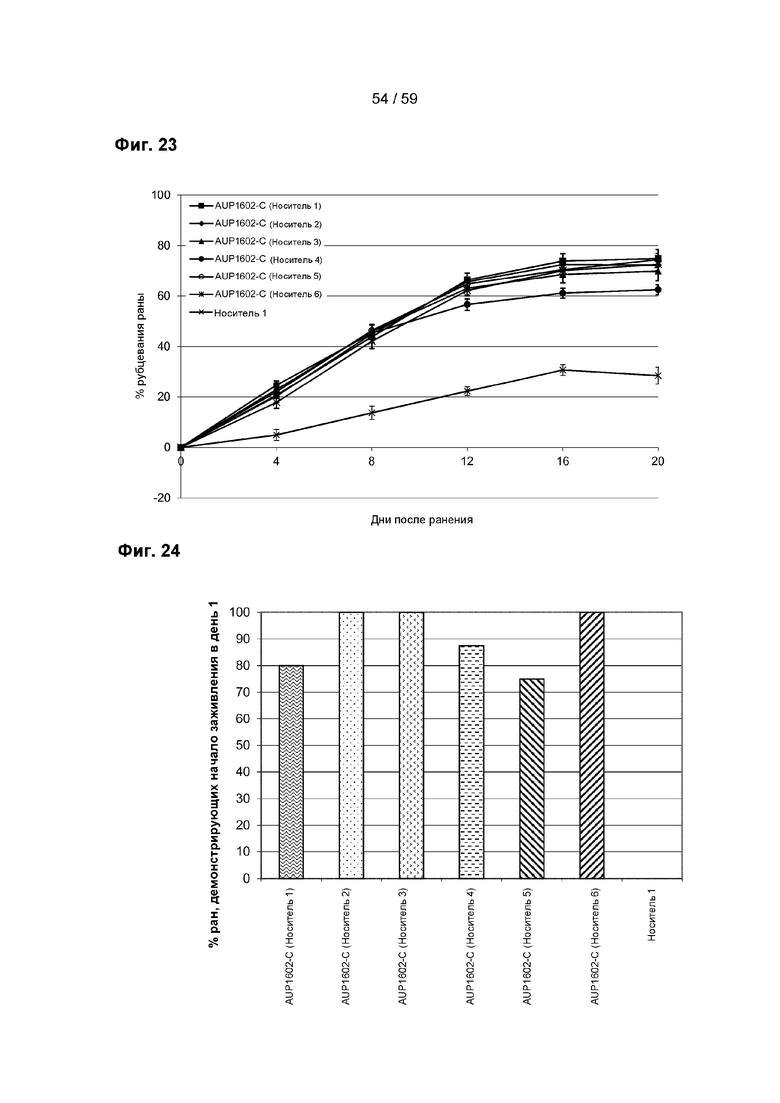
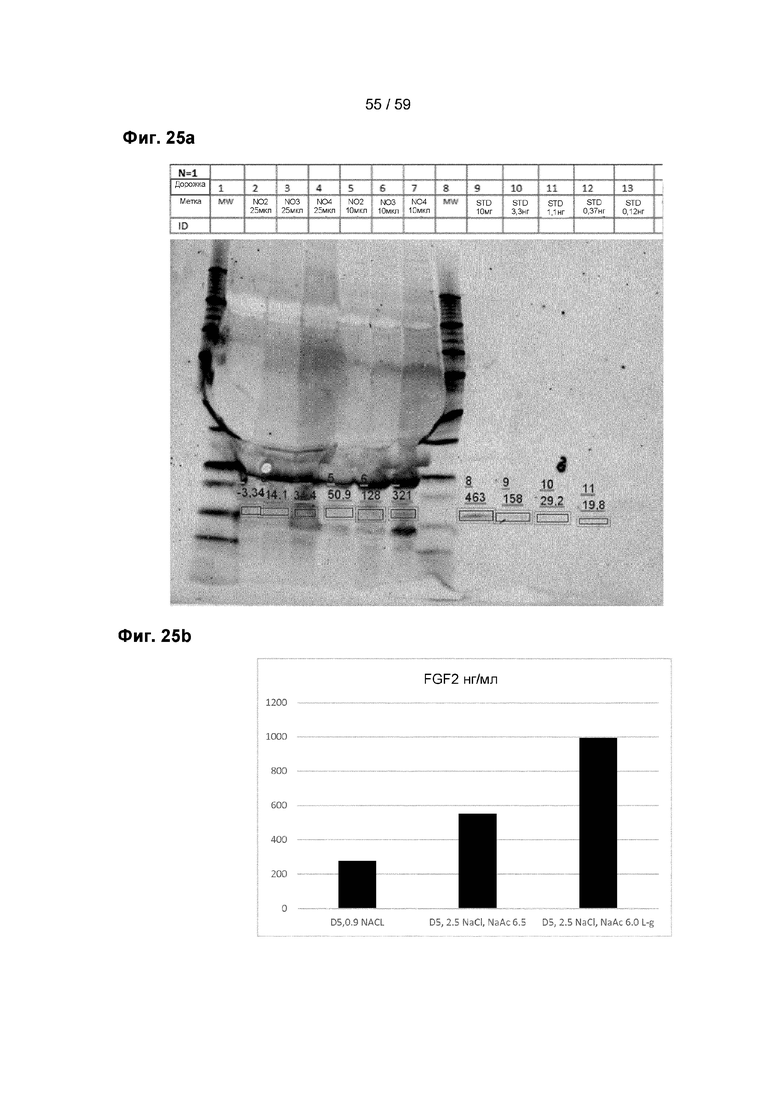
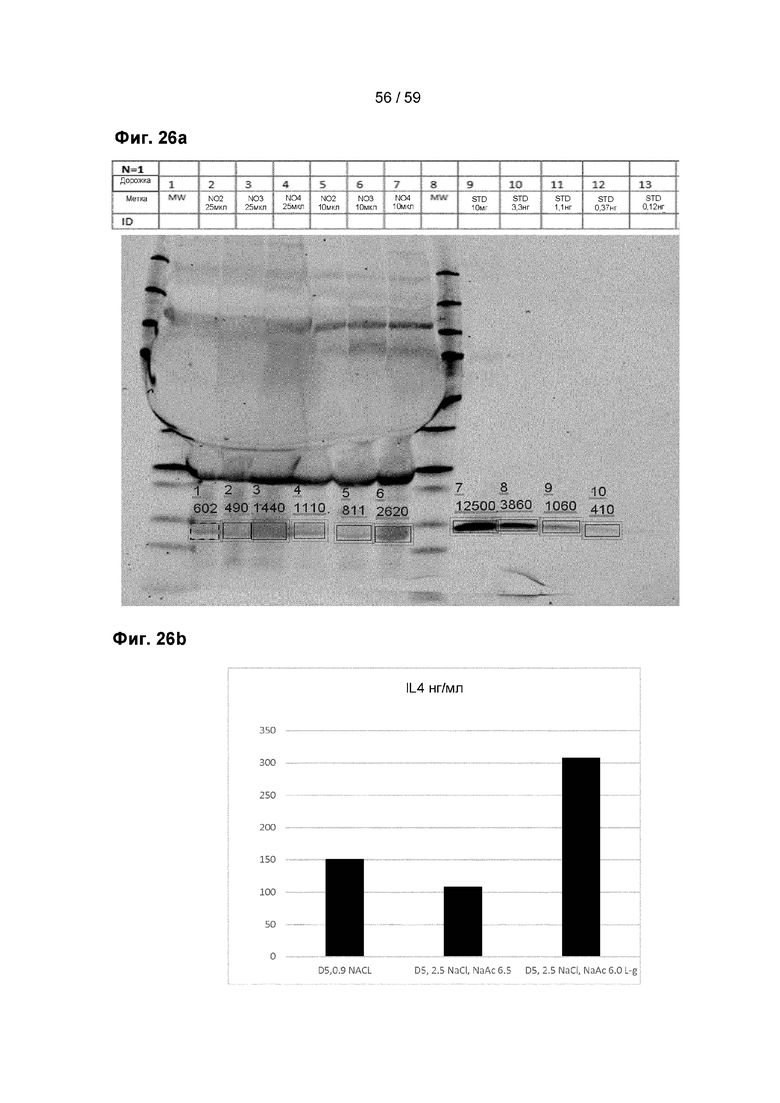
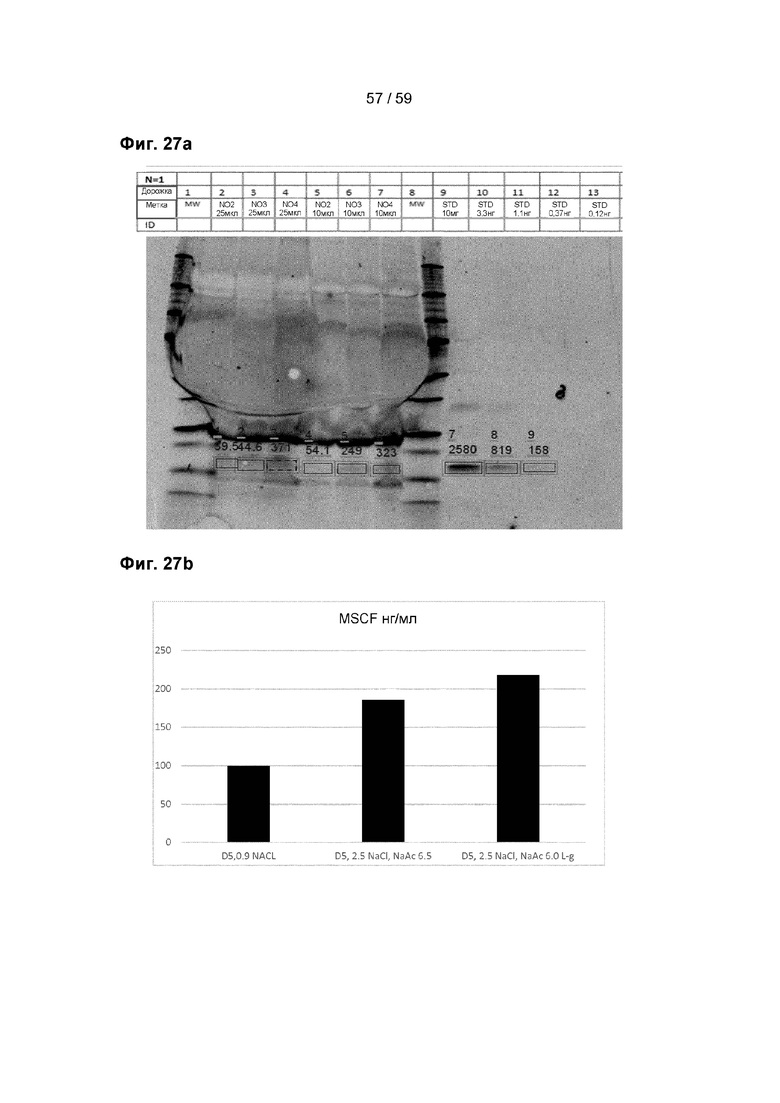
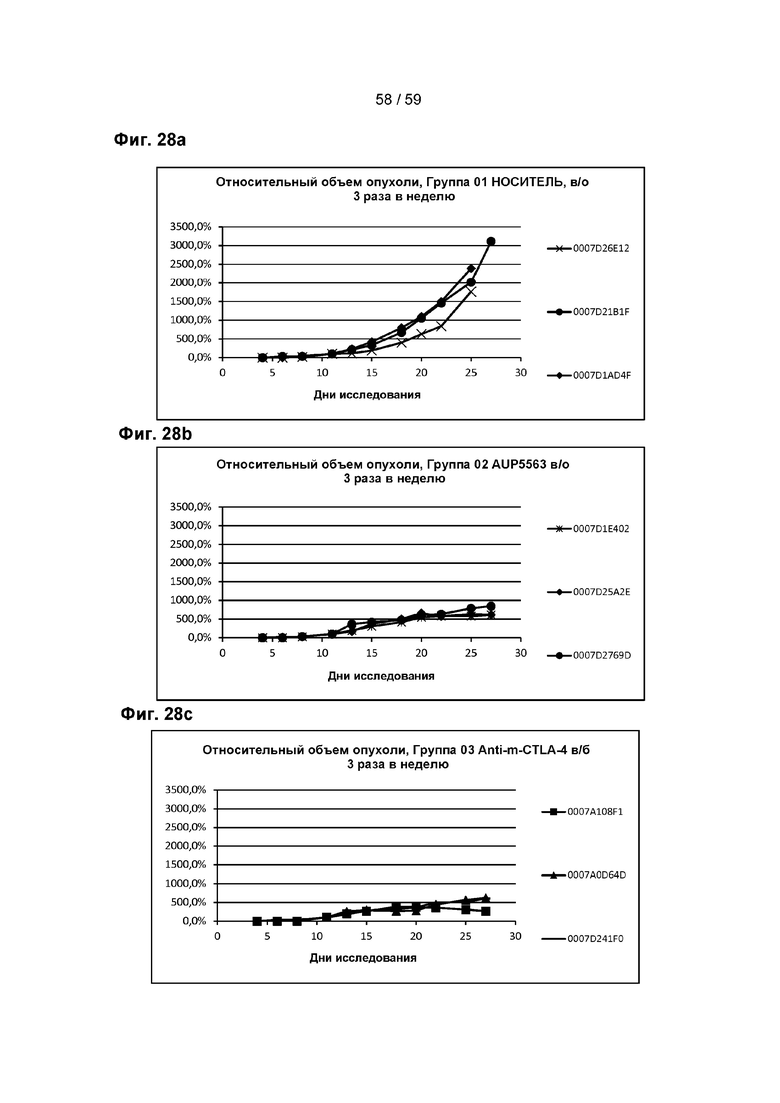
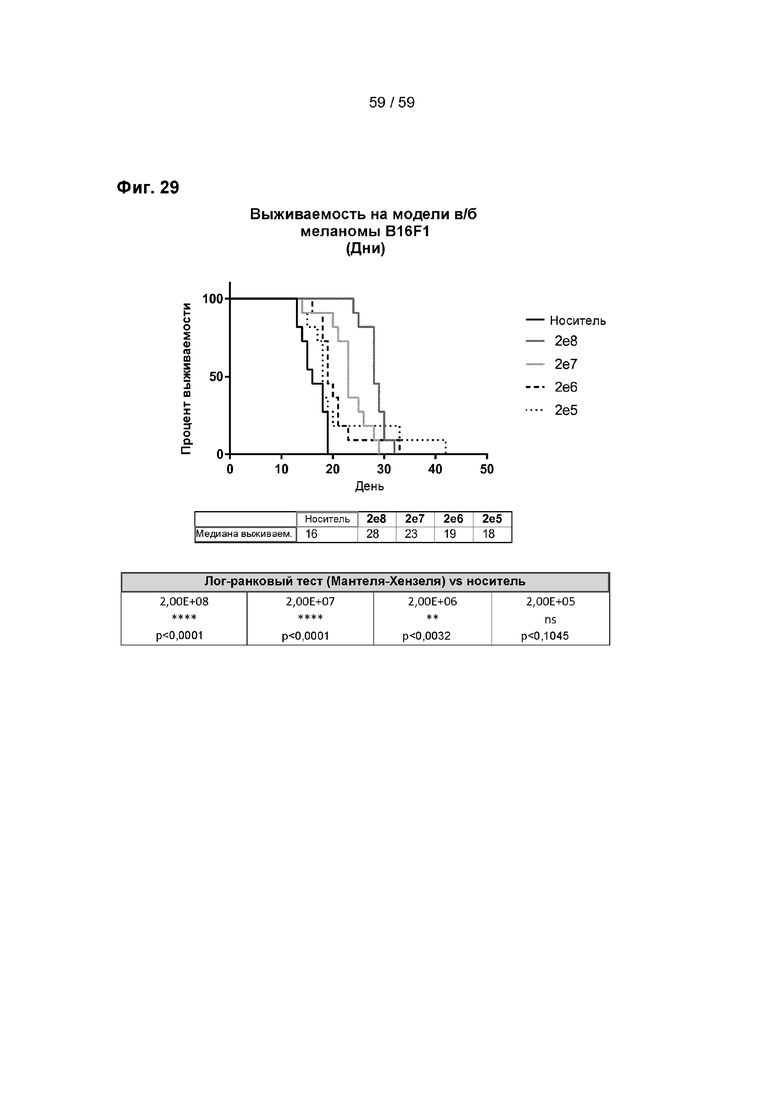
Изобретение относится к биотехнологии. Предложена популяция рекомбинантных бактерий для лечения и/или облегчения заболевания, выбранного из воспаленной раны и опухоли, рекомбинантная нуклеиновая кислота для получения указанной популяции рекомбинантных бактерий, фармацевтическая композиция для лечения и/или облегчения заживления раны, содержащая эффективное количество указанной популяции рекомбинантных бактерий, набор для лечения и/или облегчения заболевания, выбранного из воспаленной раны и опухоли, содержащий указанную популяцию рекомбинантных бактерий, медицинское устройство для лечения и/или облегчения заболевания, выбранного из воспаленной раны и опухоли, содержащее указанную популяцию рекомбинантных бактерий. Изобретение обеспечивает эффективное лечение и/или облегчение заболевания, выбранного из воспаленной раны и опухоли. 7 н. и 21 з.п. ф-лы, 29 ил., 8 табл., 8 пр.
1. Популяция рекомбинантных бактерий для лечения и/или облегчения заболевания, выбранного из воспаленной раны и опухоли, причем указанные рекомбинантные бактерии содержат:
а) по меньшей мере одну нуклеотидную последовательность, функционально связанную с прокариотическим хлорид-индуцируемым промотором и кодирующую по меньшей мере один гетерологичный фактор, оказывающий терапевтический эффект у субъекта, предпочтительно после применения указанных рекомбинантных бактерий у указанного субъекта, причем указанный гетерологичный фактор представляет собой гетерологичный полипептид или его комплекс, и
b) по меньшей мере один прокариотический регуляторный ген, контролирующий активность указанного хлорид-индуцируемого промотора,
причем указанный гетерологичный полипептид содержит по меньшей мере один эукариотический полипептид, по меньшей мере один его фрагмент или их комбинацию, и при этом указанный гетерологичный полипептид выбран из группы, состоящей из факторов роста, цитокинов, хемокинов, ферментов, нейропептидов, антител, рецепторов клеточной поверхности, растворимых рецепторов, лигандов рецепторов, интрател, кофакторов, факторов транскрипции, молекул адгезии, опухолевых антигенов, их предшественников, предпочтительно биологически активных, их фрагментов и их комбинаций, полученных из видов эукариотических организмов.
2. Рекомбинантная нуклеиновая кислота для получения популяции рекомбинантных бактерий по п. 1, содержащая:
а) по меньшей мере одну нуклеотидную последовательность, функционально связанную с прокариотическим хлорид-индуцируемым промотором и кодирующую по меньшей мере один гетерологичный фактор, оказывающий терапевтический и/или профилактический эффект у субъекта, причем указанный гетерологичный фактор представляет собой гетерологичный полипептид или его комплекс, и
b) по меньшей мере один прокариотический регуляторный ген, контролирующий активность указанного хлорид-индуцируемого промотора,
причем указанный гетерологичный полипептид содержит эукариотический полипептид, по меньшей мере один его фрагмент или их комбинацию, и при этом указанный гетерологичный полипептид выбран из группы, состоящей из факторов роста, цитокинов, хемокинов, ферментов, нейропептидов, антител, рецепторов клеточной поверхности, растворимых рецепторов, лигандов рецепторов, интрател, кофакторов, факторов транскрипции, молекул адгезии, опухолевых антигенов, их предшественников, предпочтительно биологически активных, их фрагментов и их комбинаций, полученных из видов эукариотических организмов.
3. Популяция рекомбинантных бактерий по п. 1, отличающаяся тем, что указанная по меньшей мере одна нуклеотидная последовательность, функционально связанная с прокариотическим хлорид-индуцируемым промотором и кодирующая по меньшей мере один гетерологичный фактор и/или указанный по меньшей мере один прокариотический регуляторный ген, контролирующий активность указанного хлорид-индуцируемого промотора, расположена на хромосоме и/или по меньшей мере одной плазмиде указанных рекомбинантных бактерий.
4. Популяция рекомбинантных бактерий по любому из пп. 1 или 3 или рекомбинантная нуклеиновая кислота по п. 2, отличающиеся тем, что каждый из указанного хлорид-индуцируемого промотора и/или указанного по меньшей мере одного регуляторного гена не зависит от вида предпочтительно грамположительной или грамотрицательной бактерии.
5. Популяция рекомбинантных бактерий по любому из пп. 1 или 3, 4 или рекомбинантная нуклеиновая кислота по любому из пп. 2 или 4, отличающиеся тем, что указанный хлорид-индуцируемый промотор представляет собой PgadC вида бактерии таксономического порядка Lactobacillales, предпочтительно Lactococcus lactis.
6. Популяция рекомбинантных бактерий по любому из пп. 1 или 3, 4 или рекомбинантная нуклеиновая кислота по любому из пп. 2 или 4, отличающиеся тем, что указанный регуляторный ген кодирует gadR вида бактерий таксономического порядка Lactobacillales, предпочтительно Lactococcus lactis.
7. Популяция рекомбинантных бактерий по любому из пп. 1 или 3-6 или рекомбинантная нуклеиновая кислота по любому из пп. 2 или 4-6, отличающиеся тем, что указанный хлорид-индуцируемый промотор и указанный по меньшей мере один регуляторный ген расположены в хлорид-индуцируемой кассете для экспрессии генов, причем указанный хлорид-индуцируемый промотор расположен после указанного по меньшей мере одного регуляторного гена, а указанная хлорид-индуцируемая кассета для экспрессии генов контролирует транскрипцию по меньшей мере одной нуклеотидной последовательности, кодирующей по меньшей мере один гетерологичный фактор.
8. Популяция рекомбинантных бактерий или рекомбинантная нуклеиновая кислота по п. 7, отличающиеся тем, что указанная хлорид-индуцируемая кассета для экспрессии генов содержит или состоит из нуклеотидной последовательности SEQ ID NO: 2 и контролирует транскрипцию по меньшей мере одной нуклеотидной последовательности, кодирующей по меньшей мере один гетерологичный фактор.
9. Популяция рекомбинантных бактерий по любому из пп. 1, 3 или 7, 8 или рекомбинантная нуклеиновая кислота по любому из пп. 2 или 7, 8, отличающиеся тем, что указанный по меньшей мере один гетерологичный фактор представляет собой гетерологичный полипептид или его комплекс, каждый из которых содержит по меньшей мере один эукариотический полипептид, по меньшей мере один его фрагмент или их комбинацию.
10. Популяция рекомбинантных бактерий по любому из пп. 1, 3 или 7-9 или рекомбинантная нуклеиновая кислота по любому из пп. 2 или 7-9, отличающиеся тем, что указанный по меньшей мере один гетерологичный фактор выбран из группы, состоящей из полипептидных гормонов, факторов роста, цитокинов, хемокинов, ферментов, нейропептидов, антител, их предшественников, их фрагментов и их комбинаций, полученных из вида эукариот, предпочтительно вида млекопитающих, более предпочтительно человека.
11. Популяция рекомбинантных бактерий по любому из пп. 1 или 3-10, дополнительно содержащая по меньшей мере один инактивированный ген, кодирующий незаменимый белок, необходимый для жизнеспособности указанных рекомбинантных бактерий.
12. Популяция рекомбинантных бактерий по п. 11, отличающаяся тем, что указанный ген, кодирующий незаменимый белок, инактивирован делецией указанного гена, мутацией указанного гена, сайленсингом указанного гена, опосредованным РНК-интерференцией (RNAi), трансляционным ингибированием указанного гена или их комбинацией.
13. Рекомбинантная нуклеиновая кислота по любому из пп. 2 или 4-10, дополнительно содержащая по меньшей мере один ген, кодирующий незаменимый белок, необходимый для жизнеспособности рекомбинантной бактерии.
14. Популяция рекомбинантных бактерий по любому из пп. 11, 12 или рекомбинантная нуклеиновая кислота по п. 13, отличающиеся тем, что указанный по меньшей мере один ген, необходимый для жизнеспособности, выбран из группы, состоящей из аланинрацемазы (alr), тимидилатсинтазы (thyA), аспарагинсинтазы (asnH), ЦТФ-синтазы (pyrG), триптофансинтазы (trpBA) и их комбинаций.
15. Рекомбинантная нуклеиновая кислота по любому из пп. 2, 4-10, 13 или 14, отличающаяся тем, что указанная рекомбинантная нуклеиновая кислота находится в форме плазмиды.
16. Популяция рекомбинантных бактерий по любому из пп. 1, 3-12 или 14, содержащая по меньшей мере одну рекомбинантную нуклеиновую кислоту по любому из пп. 2, 4-10, 14 или 15.
17. Популяция рекомбинантных бактерий по любому из пп. 1, 3-12, 14 или 16, отличающаяся тем, что указанные рекомбинантные бактерии представляют собой непатогенные бактерии.
18. Популяция рекомбинантных бактерий по любому из пп. 1, 3-12 или 14-17, отличающаяся тем, что указанные рекомбинантные бактерии представляют собой рекомбинантные бактерии, предпочтительно молочнокислые бактерии, более предпочтительно - виды Lactobacillus или Lactococcus.
19. Популяция рекомбинантных бактерий по п. 18, отличающаяся тем, что указанный вид Lactococcus представляет собой Lactococcus lactis, предпочтительно Lactococcus lactis подвид cremoris.
20. Применение популяции рекомбинантных бактерий по любому из пп. 1, 3-12, 14 или 16-19 при лечении хронической воспаленной раны.
21. Применение популяции рекомбинантных бактерий по любому из пп. 1, 3-12, 14 или 16-19 при лечении злокачественной опухоли.
22. Фармацевтическая композиция для лечения и/или облегчения заживления раны, содержащая эффективное количество популяции рекомбинантных бактерий по любому из пп. 1, 3-12, 14 или 16-19 и по меньшей мере одно фармацевтически приемлемое вспомогательное вещество.
23. Набор для лечения и/или облегчения заболевания, выбранного из воспаленной раны и опухоли, содержащий:
а) популяцию рекомбинантных бактерий по любому из пп. 1, 3-12, 14 или 16-19, способную экспрессировать по меньшей мере один гетерологичный фактор под контролем прокариотического хлорид-индуцируемого промотора, и
b) по меньшей мере один индуктор, содержащий хлорид-ионы.
24. Медицинское устройство для лечения и/или облегчения заболевания, выбранного из воспаленной раны и опухоли, содержащее:
а) популяцию рекомбинантных бактерий по любому из пп. 1, 3-12, 14 или 16-19, способную экспрессировать по меньшей мере один гетерологичный фактор под контролем прокариотического хлорид-индуцируемого промотора, и
б) по меньшей мере одну подложку и/или контейнер для указанных рекомбинантных бактерий.
25. Фармацевтическая композиция по п. 22, или набор по п. 23, или медицинское устройство по п. 24, отличающиеся тем, что указанные рекомбинантные бактерии находятся в растворе, заморожены или высушены, предпочтительно лиофилизированы или высушены распылением.
26. Фармацевтическая композиция по любому из пп. 22 или 25 или набор по любому из пп. 23 или 25 или медицинское устройство по любому из пп. 24 или 25, отличающиеся тем, что указанные рекомбинантные бактерии разводят в жидкой, предпочтительно культуральной среде, содержащей хлорид-ионы.
27. Набор по любому из пп. 23, 25 или 26, отличающийся тем, что указанный набор представлен в виде комбинированного препарата для раздельного, последовательного или одновременного применения при лечении предпочтительно хронической воспаленной раны.
28. Набор по любому из пп. 23, 25 или 27, отличающийся тем, что указанный набор представлен в виде комбинированного препарата для раздельного, последовательного или одновременного применения при лечении опухоли, предпочтительно злокачественной опухоли.
| US 2018135062 A1, 17.05.2018 | |||
| Токарный резец | 1924 |
|
SU2016A1 |
| Бесколесный шариковый ход для железнодорожных вагонов | 1917 |
|
SU97A1 |
| SANDERS JW, VENEMA G, KOK J | |||
| A chloride-inducible gene expression cassette and its use in induced lysis of Lactococcus lactis | |||
| Appl Environ Microbiol | |||
| Электрическое сопротивление для нагревательных приборов и нагревательный элемент для этих приборов | 1922 |
|
SU1997A1 |
| Печь-кухня, могущая работать, как самостоятельно, так и в комбинации с разного рода нагревательными приборами | 1921 |
|
SU10A1 |
| ПРОМОТОРЫ Lactococcus И ИХ ПРИМЕНЕНИЕ: | 2008 |
|
RU2495129C2 |
| СРЕДСТВА НА ОСНОВЕ КОНСТАНТНОЙ ОБЛАСТИ ИММУНОГЛОБУЛИНА СВЯЗЫВАЮЩИЕ Fc-РЕЦЕПТОР | 2008 |
|
RU2549676C2 |
Авторы
Даты
2024-02-02—Публикация
2019-03-04—Подача