Введение
В настоящем документе раскрыт способ лечения острого миелоидного лейкоза (ОМЛ) у субъекта, нуждающегося в этом, включающий введение субъекту эффективного количества низкомолекулярного соединения, которое является ингибитором полимеризации тубулина. Точнее, в настоящем документе описан способ лечения ОМЛ у субъекта, нуждающегося в этом, включающий введение субъекту эффективного количества низкомолекулярного соединения, которое является ингибитором полимеризации тубулина, отдельно или в комбинации с химиотерапевтическим средством.
Уровень техники
Рецидив заболевания является серьезной проблемой при лечении ОМЛ. У пожилых пациентов с ОМЛ, опосредованным мутантом p53, очень высок риск рецидива, особенно у пациентов со сложным кариотипом (60-80%) и ОМЛ, связанным с лечением (30%), у которых зачастую возникают мутации супрессора опухоли p53 (Nishida Y, et al.,; The novel BMI-1 inhibitor PTC596 downregulates MCL-1 and induces p53-independent mitochondrial apoptosis in acute myeloid leukemia progenitor cells; Blood Cancer J., 2017 Feb 17;7(2):e527; doi: 10.1038/bcj.2017.8). Пятилетняя выживаемость пациентов старше 60 лет составляет всего 3-8%.
У более молодых пациентов в определенных случаях ОМЛ вызывается событиями геномной транслокации, которые приводят к повышению образования онкогенных слитых белков (Greaves and Wiemels 2003). Транслокация t (10; 11) (p13-14; q14-21) представляет собой повторяющуюся сбалансированную транслокацию, наблюдаемую при ОМЛ и приводящую к возрастанию образования слитого белка CALM-AF10. Стандартные химиотерапевтические стратегии часто не очень эффективны при лечении пациентов со слиянием CALM-AF10. У пациентов со слиянием CALM-AF10 прогноз особенно неблагоприятный, поскольку для лечения заболевания такого подтипа в настоящее время нет доступных терапевтических средств направленного действия, одобренных для клинического применения. Слияния CALM-AF10 чаще встречаются у детей и молодых людей, средний возраст которых составляет 20 лет. 5-летняя выживаемость для более молодых пациентов составляет всего 30-40%.
Таким образом, необходимость в разработке терапевтических средств направленного действия клинического уровня для применения при лечении нерегулируемых CALM-AF10-положительных лейкозов является очень острой.
Сущность изобретения
Соединение 1 представляет собой низкомолекулярное соединение - 5-фтор-2-(6-фтор-2-метил-1H-бензо[d]имидазол-1-ил)-N4-[4-(трифторметил)фенил]пиримидин-4,6-диамин, структура которого представлена формулой (I):
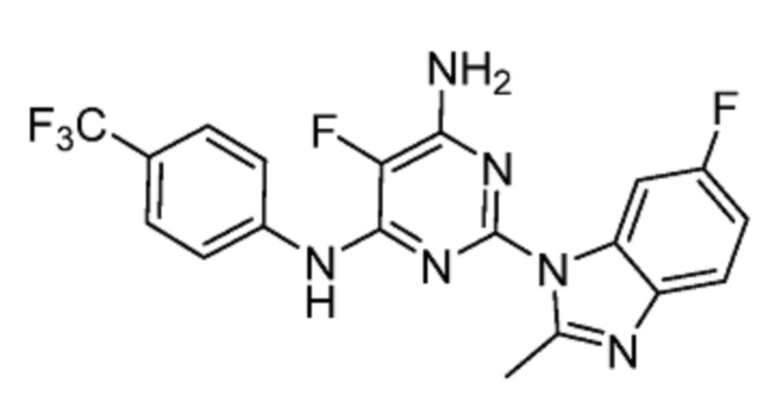
Формула (I)
или его фармацевтически приемлемую соль либо его фармацевтическую композицию для применения в лечении лейкоза.
Одним аспектом, описанным в настоящем документе, является способ лечения острого миелоидного лейкоза (ОМЛ) у субъекта, нуждающегося в этом, включающий введение субъекту эффективного количества соединения 1.
Другим аспектом, описанным в настоящем документе, является способ лечения ОМЛ у субъекта, нуждающегося в этом, включающий введение субъекту эффективного количества соединения 1 в комбинации с химиотерапевтическим средством.
Еще одним аспектом, описанным в настоящем документе, является применение соединения 1 для получения лекарственного средства для применения в лечении ОМЛ у субъекта, нуждающегося в этом, включающем введение субъекту эффективного количества лекарственного средства.
Еще одним аспектом, описанным в настоящем документе, является применение соединения 1 для получения лекарственного средства для применения в лечении ОМЛ у субъекта, нуждающегося в этом, включающем введение субъекту эффективного количества лекарственного средства в комбинации с химиотерапевтическим средством.
Одним аспектом, описанным в настоящем документе, является способ лечения CALM-AF10 опосредованного острого миелоидного лейкоза (ОМЛ) у субъекта, нуждающегося в этом, включающий введение субъекту эффективного количества соединения 1.
Другим аспектом, описанным в настоящем документе, является способ лечения ОМЛ, опосредованного CALM-AF10, у субъекта, нуждающегося в этом, включающий введение субъекту эффективного количества соединения 1 в комбинации с химиотерапевтическим средством.
Еще одним аспектом, описанным в настоящем документе, является применение соединения 1 для получения лекарственного средства для применения в лечении ОМЛ, опосредованного CALM-AF10, у субъекта, нуждающегося в этом, включающем введение субъекту эффективного количества лекарственного средства.
Еще одним аспектом, описанным в настоящем документе, является применение соединения 1 для получения лекарственного средства для применения в лечении ОМЛ, опосредованного CALM-AF10, у субъекта, нуждающегося в этом, включающем введение субъекту эффективного количества лекарственного средства в комбинации с химиотерапевтическим средством.
Одним аспектом, описанным в настоящем документе, является способ лечения острого миелоидного лейкоза (ОМЛ), опосредованного мутантом p53, у субъекта, нуждающегося в этом, включающий введение субъекту эффективного количества соединения 1.
Другим аспектом, описанным в настоящем документе, является способ лечения ОМЛ, опосредованного мутантом p53, у субъекта, нуждающегося в этом, включающий введение субъекту эффективного количества соединения 1 в комбинации с химиотерапевтическим средством.
Еще одним аспектом, описанным в настоящем документе, является применение соединения 1 для получения лекарственного средства для применения в лечении ОМЛ, опосредованного мутантом p53, у субъекта, нуждающегося в этом, включающем введение субъекту эффективного количества лекарственного средства.
Еще одним аспектом, описанным в настоящем документе, является применение соединения 1 для получения лекарственного средства для применения в лечении ОМЛ, опосредованного мутантом p53, у субъекта, нуждающегося в этом, включающем введение субъекту эффективного количества лекарственного средства в комбинации с химиотерапевтическим средством.
Одним аспектом, описанным в настоящем документе, является способ лечения острого миелоидного лейкоза у субъекта, нуждающегося в этом, включающий введение субъекту эффективного количества 5-фтор-2-(6-фтор-2-метил-1H-бензо[d]имидазол-1-ил)-N4-[4-(трифторметил)фенил]пиримидин-4,6-диамина, структура которого представлена формулой (I):

Формула (I)
или его фармацевтически приемлемой соли либо его фармацевтической композиции.
Другим аспектом, описанным в настоящем документе, является способ лечения острого миелоидного лейкоза, где острый миелоидный лейкоза представляет собой острый миелоидный лейкоз, опосредованный CALM-AF10.
Еще одним аспектом, описанным в настоящем документе, является способ лечения острого миелоидного лейкоза, где острый миелоидный лейкоз представляет собой острый миелоидный лейкоз, опосредованный мутантом p53.
Еще одним аспектом, описанным в настоящем документе, является способ введения субъекту эффективного количества 5-фтор-2-(6-фтор-2-метил-1H-бензо[d]имидазол-1-ил)-N4-[4-(трифторметил)фенил]пиримидин-4,6-диамина или его фармацевтически приемлемой соли либо его фармацевтической композиции в комбинации с эффективным количеством одного или нескольких химиотерапевтических средств.
В другом аспекте, описанном в настоящем документе, когда соединение 1 вводится в комбинации с эффективным количеством одного или нескольких химиотерапевтических средств, одно или несколько химиотерапевтических средств представляют собой 4-хлорфенил-(S)-6-хлор-1-(4-метоксифенил)-1,3,4,9-тетрагидро-2Н-пиридо[3,4-b]индол-2-карбоксилат («соединение 2»), структура которого представлена формулой (II):
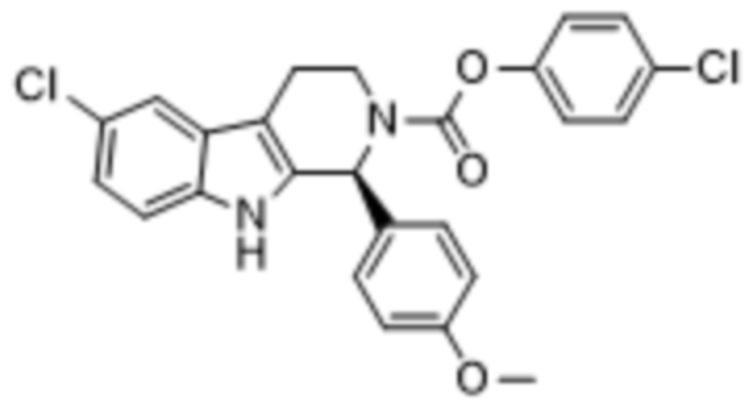 (II).
(II).
Краткое описание рисунков
Фигура 1. Представлена кривая выживаемости in vivo NSG/SRM3 мышиной модели ксенотрансплантата опухоли клеточной линии 31-Fujioka после лечения в течение 34 дней соединением 1 в сравнении с животными, получавшими разбавитель (n=5 мышей на группу, *P<0,002).
Фигура 2. Представлено изменение массы тела в процентах для NSG мышиной модели ОМЛ [NOD (диабет без ожирения) с SCID (тяжелый комбинированный иммунодефицит - Severe Combined Immunodeficiency) гамма] in vivo после лечения в течение 75 дней соединением 1 в сравнении с мышами, получавшими разбавитель (n=5 в группе, получающей разбавитель, n=2 в группе, получающей соединение 1).
Фигура 3. Представлена кривая выживаемости для NSG мышиной модели ОМЛ in vivo после 75 дней лечения соединением 1 в сравнении с мышами, получавшими разбавитель (n=5 в группе, получавшей разбавитель, n=2 в группе, получавшей соединение 1).
Фигура 4. Представлено изменение массы тела в процентах для NSG мышиной модели ОМЛ in vivo после лечения комбинацией соединения 1 и соединения 2 в течение 80 дней в сравнении с мышами, получавшими разбавитель, только соединение 1 и только соединения 2 (n=2 в группе, получавшей комбинацию и только соединение 1, n=5 в группе, получавшей разбавитель и только соединение 2).
Фигура 5. Представлена кривая выживаемости для NSG мышиной модели ОМЛ in vivo после лечения в течение до 80 дней комбинацией соединения 1 и соединения 2 в сравнении с мышами, получавшими разбавитель, только соединение 1 и только соединение 2.
Фигура 6. Представлена кривая выживаемости для NSG мышиной модели MOLT-4 (CD3 дефицитные мыши) ксенотрансплантата острого лимфобластного лейкоза (ОЛЛ) in vivo после 160 дней лечения соединением 2 в сравнении с введением разбавителя, соединения 1, доксорубицина (Dox) и цитарабина (Ara-C) в различных схемах дозирования.
Подробное описание изобретения
Одним аспектом, описанным в настоящем документе, является применение низкомолекулярного соединения 1-5-фтор-2-(6-фтор-2-метил-1H-бензо[d]имидазол-1-ил)-N4-[4-(трифторметил)фенил]пиримидин-4,6-диамина, структура которого представлена формулой (I):

Формула (I)
или его фармацевтически приемлемой соли либо его фармацевтической композиции в лечении лейкоза. Соединение 1 и способ его получения раскрыты в Международной публикации № WO2014/081906 (как соединение 109), которая введена в настоящий документ в качестве ссылки.
Одним аспектом, описанным в настоящем документе, является способ лечения острого миелоидного лейкоза (ОМЛ) у субъекта, нуждающегося в этом, включающий введение субъекту эффективного количества соединения 1.
Другим аспектом, описанным в настоящем документе, является способ лечения ОМЛ у субъекта, нуждающегося в этом, включающий введение субъекту эффективного количества соединения 1 в комбинации с химиотерапевтическим средством.
Еще одним аспектом, описанным в настоящем документе, является применение соединения 1 для получения лекарственного средства для применения в лечении ОМЛ у субъекта, нуждающегося в этом, включающем введение субъекту эффективного количества лекарственного средства.
Еще одним аспектом, описанным в настоящем документе, является применение соединения 1 для получения лекарственного средства для применения в лечении ОМЛ у субъекта, нуждающегося в этом, включающем введение субъекту эффективного количества лекарственного средства в комбинации с химиотерапевтическим средством.
Одним аспектом, описанным в настоящем документе, является способ лечения острого миелоидного лейкоза (ОМЛ), опосредованного CALM-AF10, у субъекта, нуждающегося в этом, включающий введение субъекту эффективного количества соединения 1.
Другим аспектом, описанным в настоящем документе, является способ лечения ОМЛ, опосредованного CALM-AF10, у субъекта, нуждающегося в этом, включающий введение субъекту эффективного количества соединения 1 в комбинации с химиотерапевтическим средством.
Еще одним аспектом, описанным в настоящем документе, является применение соединения 1 для получения лекарственного средства для применения в лечении ОМЛ, опосредованного CALM-AF10, у субъекта, нуждающегося в этом, включающем введение субъекту эффективного количества лекарственного средства.
Еще одним аспектом, описанным в настоящем документе, является применение соединения 1 для получения лекарственного средства для применения в лечении ОМЛ, опосредованного CALM-AF10, у субъекта, нуждающегося в этом, включающем введение субъекту эффективного количества лекарственного средства в комбинации с химиотерапевтическим средством.
Одним аспектом, описанным в настоящем документе, является способ лечения острого миелоидного лейкоза (ОМЛ), опосредованного мутантом p53, у субъекта, нуждающегося в этом, включающий введение субъекту эффективного количества соединения 1.
Другим аспектом, описанным в настоящем документе, является способ лечения ОМЛ, опосредованного мутантом p53, у субъекта, нуждающегося в этом, включающий введение субъекту эффективного количества соединения 1 в комбинации с химиотерапевтическим средством.
Еще одним аспектом, описанным в настоящем документе, является применение соединения 1 для получения лекарственного средства для применения в лечении ОМЛ, опосредованного мутантом p53, у субъекта, нуждающегося в этом, включающем введение субъекту эффективного количества лекарственного средства.
Еще одним аспектом, описанным в настоящем документе, является применение соединения 1 для получения лекарственного средства для применения в лечении ОМЛ, опосредованного мутантом p53, у субъекта, нуждающегося в этом, включающем введение субъекту эффективного количества лекарственного средства в комбинации с химиотерапевтическим средством.
Одним аспектом, описанным в настоящем документе, является способ лечения острого миелоидного лейкоза у субъекта, нуждающегося в этом, включающий введение субъекту эффективного количества 5-фтор-2-(6-фтор-2-метил-1H-бензо[d]имидазол-1-ил)-N4-[4-(трифторметил)фенил]пиримидин-4,6-диамина, структура которого представлено формулой (I):

Формула (I)
или его фармацевтически приемлемой соли либо его фармацевтической композиции.
Другим аспектом, описанным в настоящем документе, является способ лечения острого миелоидного лейкоза, где острый миелоидный лейкоз представляет собой острый миелоидный лейкоз, опосредованный CALM-AF10.
Еще одним аспектом, описанным в настоящем документе, является способ лечения острого миелоидного лейкоза, где острый миелоидный лейкоз представляет собой острый миелоидный лейкоз, опосредованный мутантом p53.
Еще одним аспектом, описанным в настоящем документе, является способ введения субъекту эффективного количества 5-фтор-2-(6-фтор-2-метил-1H-бензо[d]имидазол-1-ил)-N4-[4-(трифторметил)фенил]пиримидин-4,6-диамина или его фармацевтически приемлемой соли либо его фармацевтической композиции в комбинации с эффективным количеством одного или нескольких химиотерапевтических средств.
В другом аспекте, описанном в настоящем документе, когда соединение 1 вводится в комбинации с эффективным количеством одного или нескольких химиотерапевтических средств, одно или несколько химиотерапевтических средств представляет собой 4-хлорфенил-(S)-6-хлор-1-(4-метоксифенил)-1,3,4,9-тетрагидро-2Н-пиридо[3,4-b]индол-2-карбоксилат («соединение 2»), структура которого представлена формулой (II):

Способ получения соединения 2 раскрыт в Международной публикации заявки на патент № WO 2005/089764, которая введена в настоящий документ в виде ссылки. Соединение 2 также описано в Патенте США 7601840 (соответствующем Публикации Международной заявки № WO2005/089764), в Патенте США 7767689 (соответствующем Публикации Международной заявки № WO2006/113703), в Публикации Международной заявки № WO2010/138758; в Патенте США 8076352 (соответствующем Публикации Международной заявки № WO2008/127715); в Патенте США 8076353; в Патенте США 8367694; в Публикации заявки № 2010/0158858 (соответствующей Публикации Международной заявки № WO2008/127714), которые также введены в настоящий документ в качестве ссылок.
Определения
Термин «примерно», когда используется в настоящем документе, означает некоторый интервал значений, включающий заданное значение, где результирующее значение по существу совпадает с точно указанным значением. В одном аспекте термин «примерно» означает интервал в пределах 25% от указанного значения или диапазона значений. Например, фраза «примерно 70% по массе» включает по меньшей мере все значения от 52% до 88% по массе. В другом аспекте термин «примерно» означает интервал значений в пределах 10% от заданного значения или диапазона значений. Например, фраза «примерно 70% по массе» включает по меньшей мере все значения от 63% до 77% по массе. В еще одном аспекте термин «примерно» означает интервал значений в пределах 7% от заданного значения или диапазона значений. Например, фраза «примерно 70% по массе» включает по меньшей мере все значения от 65% до 75% по массе. Концентрации, количества, число клеток, проценты и другие числовые значения могут быть представлены в формате диапазона значений. Следует иметь в виду, что такой формат диапазона значений используется просто для удобства и краткости и должен интерпретироваться гибко, чтобы включать не только числовые значения, точно указанные в качестве предела диапазона, но и все отдельные числовые значения или поддиапазоны, охватываемые данным диапазоном, как если бы каждое числовое значение и поддиапазон были указаны точно.
Термины «методы терапии» и «терапия», когда используются в настоящем документе, могут относиться к любому(ым) протоколу(ам), способу(ам), композициям, препаратам и/или средству(ам), которые могут использоваться для предотвращения, лечения, контроля или облегчения состояния или расстройства или одного или нескольких его симптомов (например, острого миелоидного лейкоза или одного или нескольких его симптомов либо одного или нескольких состояний, связанных с ним; острого миелоидного лейкоза, опосредованного CALM-AF10, или одного или нескольких симптомов либо одного или нескольких состояний, связанных с ним; или острого миелоидного лейкоза, опосредованного мутантом p53, или одного или нескольких симптомов либо одного или нескольких состояний, связанных с ним).
В некоторых аспектах термины «методы терапии» или «терапия» относятся к лекарственной терапии, такой как химиотерапия, адъювантная терапия, лучевая терапия, хирургия, биологическая терапия, поддерживающая терапия, противовирусная терапия и/или другие виды терапии, применимые для лечения, контроля, предотвращения или облегчения состояния или расстройства либо одного или нескольких его симптомов (например, острого миелоидного лейкоза или одного или нескольких его симптомов либо одного или нескольких состояний, связанных с ним). В некоторых аспектах термин «терапия» относится к терапии, отличной от соединения 1 или его фармацевтически приемлемой соли либо его фармацевтической композиции. В конкретных аспектах термины «дополнительная терапия» и «дополнительные методы лечения» относятся к терапии, отличной от лечения с использованием соединения 1 или его фармацевтически приемлемой соли либо его фармацевтической композиции. В конкретном аспекте термин «терапия» включает применение соединения 1 в качестве адъювантной терапии. Например, применение соединения 1 в сочетании с лекарственной терапией, такой как химиотерапия, биологическая терапия, хирургия, поддерживающая терапия, противовирусная терапия и/или другие виды терапии, применимые для лечения, контроля, предотвращения или облегчения состояния или расстройства либо одного или нескольких его симптомов (например, острого миелоидного лейкоза или одного или нескольких его симптомов либо одного или нескольких состояний, связанных с ним).
Термин «младенец человека (human infant)», когда используется в настоящем документе, относится к новорожденному ребенку в возрасте до 1 года.
Термин «ребенок человека, начинающий ходить (human toddler)», когда используется в настоящем описании, относится к ребенку возраста от 1 года до 3 лет.
Термин «ребенок человека», когда используется в настоящем описании, относится к человеку возраста от 1 года до 18 лет.
Термин «взрослый человек», когда используется в настоящем описании, относится к человеку возраста 18 лет или старше.
Термин «человек среднего возраста», когда используется в настоящем описании, относится к человеку возраста от 30 до 64 лет.
Термин «пожилой человек», когда используется в настоящем описании, относится к человеку возраста 65 лет или старше.
Термин «субъект», когда используется в настоящем описании, относится индивидууму (субъекту), которому назначается терапия, описанная в настоящем документе. В конкретном аспекте индивидуум является человеком.
Термин «острый миелоидный лейкоз», когда используется в настоящем описании, относится к острому миелоидному лейкозу вообще, который описан в настоящем документе. В конкретном аспекте общий термин «лейкоз» также может использоваться в отношении острого миелоидного лейкоза без использования конкретного термина «острый миелоидный лейкоз». В другом конкретном аспекте термин «острый миелоидный лейкоз» также может использоваться в отношении ОМЛ, опосредованного CALM-AF10, или ОМЛ, опосредованного мутантом p53, без использования конкретных терминов «ОМЛ, опосредованный CALM-AF10» или «ОМЛ, опосредованный мутантом p53».
Термин «эффективное количество», когда используется в настоящем описании в контексте введения соединения 1 субъекту с острым миелоидным лейкозом, относится к дозе соединения 1, которая приводит к благоприятному или терапевтическому эффекту. В конкретных аспектах термин «эффективное количество соединения 1» относится к количеству соединения 1, которое является достаточным для достижения по меньшей мере одного, двух, трех, четырех или более из следующих благоприятных или терапевтических эффектов: (i) ингибирование острого миелоидного лейкоза; (ii) ремиссия острого миелоидного лейкоза; (iii) ликвидация, удаление или полная ремиссия острого миелоидного лейкоза; (iv) предотвращение развития или появления одного или нескольких симптомов, связанных с острым миелоидным лейкозом; (v) снижение или облегчение тяжести одного или нескольких симптомов, связанных с острым миелоидным лейкозом; (vi) снижение числа одного или нескольких симптомов, связанных с острым миелоидным лейкозом; (vii) облегчение тяжести одного или нескольких симптомов, связанных с острым миелоидным лейкозом; (viii) снижение длительности одного или нескольких симптомов, связанных с острым миелоидным лейкозом; (ix) предотвращение повторного проявления пролиферации или одного или нескольких симптомов, связанных с острым миелоидным лейкозом; (x) снижение смертности; (xi) повышение коэффициента выживаемости субъектов; (xii) повышение безрецидивной выживаемости; (xiii) повышение количества субъектов с острым миелоидным лейкозом в стадии ремиссии; (xiv) уменьшение госпитализации субъекта; (xv) снижение продолжительности госпитализации; (xvi) снижение частоты госпитализации; (xvii) увеличение выживаемости продолжительности жизни субъекта; (xviii) повышение бессимптомной выживаемости субъекта с острым миелоидным лейкозом; (xix) увеличение продолжительности периода ремиссии острого миелоидного лейкоза у субъекта; (xx) улучшение качества жизни (QOL), которое оценивается методами, хорошо известными в данной области техники, например QOL-анкетированием и т.п.; (xxi) снижение пролиферации в результате введения соединения 1 до лечения другим химиотерапевтическим средством; (xxii) снижение пролиферации в результате введения соединения 1 после лечения другим химиотерапевтическим средством; (xxiii) снижение пролиферации в результате комбинированной терапии введения соединения 1 с другим химиотерапевтическим средством; (xxiv) аддитивное антипролиферативное действие комбинированной терапии при введении соединения 1 с другим химиотерапевтическим средством; (xxv) синергическое антипролиферативное действие комбинированной терапии при введении соединения 1 с другим химиотерапевтическим средством; (xxvi) снижение пролиферации в результате введения соединения 1 перед лучевой терапией; (xxvii) снижение пролиферации в результате введения соединения 1 после лучевой терапии; (xxviii) снижение пролиферации в результате введения соединения 1 в комбинированном лечении с облучением; (xxix) снижение пролиферации в результате введения соединения 1 до лечения хирургическим вмешательством; (xxx) снижение пролиферации в результате введения соединения 1 в комбинированном лечении с хирургическим вмешательством; (xxxi) повышение или улучшение терапевтического действия в результате введения соединения 1 с паллиативной терапией; (xxxii) снижение концентрации BMI-1 в плазме субъекта с острым миелоидным лейкозом; (xxxiii) снижение количества циркулирующих пролиферативных клеток в плазме субъекта с острым миелоидным лейкозом; (xxxiv) изменение (например, снижение или повышение) концентрации биомаркера острого миелоидного лейкоза в плазме субъекта с острым миелоидным лейкозом (например, BMI-1, полимеризации тубулина, маркеров апоптоза или макеров ткани и т.п.); (xxxv) снижение концентрации BMI-1 в биологическом образце (например, в плазме, сыворотке крови, моче или любых других биологических жидкостях) субъекта с острым миелоидным лейкозом; (xxxvi) снижение количества пролиферативных клеток после введения терапии, описанной в настоящем документе, что измеряется обычными методами, доступными специалисту в данной области, такими как магнитно-резонансная томография (МРТ), МРТ с динамическим контрастным усилением (МРТ-ДКУ), рентгенография, компьютерная томография (КТ), позитронно-эмиссионная томография (ПЭТ), 7-AAD флуоресценция или DAPI флуоресценция; (xxxvii) количество пролиферативных клеток сохраняется неизменным после введения терапии, описанной в настоящем документе, что определяется обычными методами, доступными специалисту в данной области, такими как магнитно-резонансная томография (МРТ), МРТ с динамическим контрастным усилением (МРТ-ДКУ), рентгенография, компьютерная томография (КТ), позитронно-эмиссионная томография (ПЭТ), 7-AAD флуоресценция или DAPI флуоресценция; или (xxxviii) количество пролиферативных клеток не увеличивается или увеличивается меньше, чем ожидалось, после введения терапии, описанной в настоящем документе, что определяется обычными методами, доступными специалисту в данной области, такими как магнитно-резонансная томография (МРТ), МРТ с динамическим контрастным усилением (МРТ-ДКУ), рентгенография, компьютерная томография (КТ), позитронно-эмиссионная томография (ПЭТ), 7-AAD флуоресценция или DAPI флуоресценция.
Термин «период продолжительностью 24 часа», когда используется в настоящем описании, относится к периоду времени, в течение которого состояние остается неизменным; например, эффективным количеством соединения 1 является количество, при котором достигается средняя концентрация соединения 1 в плазме и сохраняется неизменной в течение множества 24-часовых периодов. Другими словами, средняя концентрация соединения 1 в плазме может быть достигнута за подходящее время, которое может составлять больше или меньше 24 часов.
Термин «терапия, которая описана в настоящем документе», относится к способу применения соединения 1 или его фармацевтически приемлемой соли либо фармацевтической композиции в качестве ингибитора полимеризации тубулина при лечении или облегчении острого миелоидного лейкоза у субъекта, нуждающегося в этом, который включает введение субъекту эффективного количества соединения 1.
В одном аспекте терапии, описанной в настоящем документе, применение или способ применения соединения 1 включает его фармацевтически приемлемую соль или фармацевтическую композицию. В другом аспекте терапии, описанной в настоящем документе, применение или способ применения соединения 1 включает применение или способ применения соединения 1 или его фармацевтически приемлемой соли либо фармацевтической композиции соединения 1 или комбинации соединения 1 или его фармацевтически приемлемой соли либо его фармацевтической композиции с другим химиотерапевтическим(и) средством(ами), где указанная комбинация обладает синергической антипролиферативной активностью. В другом аспекте другое химиотерапевтическое средство ингибирует полимеризацию тубулина. В еще одном аспекте другое химиотерапевтическое средство ингибирует функциональную активность BMI-1.
Термин «фармацевтически приемлемая(ые) соль(и)», когда используется в настоящем описании, относится к соли(ям), полученной(ым) из фармацевтически приемлемой нетоксичной кислоты или фармацевтически приемлемого нетоксичного основания, включая неорганическую кислоту и основание и органическую кислоту и основание; см., например, Remington’s Pharmaceutical Sciences, 18th eds., Mack Publishing, Easton PA (1990) or Remington: The Science and Practice of Pharmacy, 19 th eds., Mack Publishing, Easton PA (1995).
Термин «соединение 1», когда используется в настоящем описании, относится к 5-фтор-2-(6-фтор-2-метил-1H-бензо[d]имидазол-1-ил)-N4-[4-(трифторметил)фенил]пиримидин-4,6-диамину или его фармацевтически приемлемой соли либо к его фармацевтической композиции. В различных аспектах термин «соединение 1» относится к соединению 109, описанному в Международной Публикации № WO2014/081906, которая введена в настоящее описание во всей полноте в вилле ссылки.
Способ применения
В результате механистических исследований, но без ограничения теоретическими обоснованиями, было показано, что соединение 1 ингибирует полимеризацию микротрубочек без проявления вызывающих слабость токсичностей, присущих другим таким лекарственным средствам. Кроме того, соединение 1 аддитивно или синергически сочетается со стандартными клиническими схемами лечения, приводя к эффективной и длительной регрессии рака.
Как показано в настоящем документе, соединение 1 или его фармацевтически приемлемая соль либо его фармацевтическая композиция представляет собой низкомолекулярный ингибитор полимеризации тубулина для применения в лечении или облегчении острого миелоидного лейкоза у субъекта, нуждающегося в этом, которое включает введение субъекту эффективного количества соединения 1 или его фармацевтически приемлемой соли либо его фармацевтической композиции.
В одном аспекте применения или способа применения, описанных в настоящем документе, применение или способ применения соединения 1 включает его фармацевтически приемлемую соль или его фармацевтическую композицию. В другом аспекте применения или способа применения, описанных в настоящем документе, применение или способ применения соединения 1 включает применение или способ применения соединения 1, применение или способ применения фармацевтически приемлемой соли или фармацевтической композиции соединения 1 или применение или способ применения комбинации соединения 1 или его фармацевтически приемлемой соли либо его фармацевтической композиции с другим(и) химиотерапевтическим(и) средством(ами), где указанная комбинация обладает аддитивной или синергической антипролиферативной активностью. В другом аспекте другое химиотерапевтическое средство ингибируют полимеризацию тубулина. В еще одном аспекте другое химиотерапевтическое средство ингибируют функциональную активность BMI-1.
В одном аспекте в настоящем документе описаны способы ингибирования или снижения полимеризации тубулина, которые также могут опосредованно ингибировать функцию BMI-1 для индуцирования остановки клеточного цикла в пролиферирующей клетке или клеточной линии.
В другом аспекте способ ингибирования или снижения полимеризации тубулина и опосредованного ингибирования функции BMI-1 для индукции остановки клеточного цикла в пролиферирующей клетке или клеточной линии включает контактирование соединения 1 или его фармацевтически приемлемой соли либо его фармацевтической композиции с пролиферирующей клеткой или клеточной линией, где пролиферирующая клетка или клеточная линия может быть клеткой или клеточной линией, не подвергавшейся лечению, или, как было показано, подвергавшейся ингибированию или снижению полимеризации тубулина и функции BMI-1.
На моделях мышей и на людях показано, что при CALM-AF10-опосредованном ОМЛ соединение 1 неожиданно нарушает лейкемогенез в условиях in vitro и in vivo, как описано в настоящем документе. Эти данные и продемонстрированный профиль безопасности в качестве противоракового средства в клинических испытаниях демонстрируют наглядное обоснование разработки соединения 1 отдельно или в комбинации со стандартной химиотерапией для лечения ОМЛ, опосредованного CALM-AF10.
При ОМЛ, опосредованном мутантом p53 (см. Nishida, et al.), соединение 1 продемонстрировало снижение экспрессии MCL-1 и вызвало несколько молекулярных событий, согласующихся с индукцией митохондриального апоптоза: потерю потенциала митохондриальной мембраны, конформационное изменение BAX, расщепление каспазы-3 и экстернализацию фосфатидилсерина. Апоптоз индуцировался р53-независимым образом наряду со снижением MCL-1 и фосфорилированного AKT в CD34+CD38low/- стволовых клетках/клетках-предшественниках пациента. Исследования на мышиной модели ксенотрансплантата также показали противолейкозную активность in vivo, которая ингибировала рост лейкозных клеток in vivo, сохраняя нормальные гемопоэтические клетки. Эти данные также позволяют сделать предположение о том, что соединение 1 может применяться отдельно или в комбинации со стандартной химиотерапией для лечения ОМЛ, опосредованного мутантом p53.
В другом аспекте неограничивающие примеры таких клеток или клеточных линий выбраны из клеток HL-60, HeLa, HT1080, HCT116, HEK293, NCI H460, U-87MG, ASPC-1, PL-45, HPAF-2, PC-3, MDA-MB-231, MDA-MB-468, A431, SNU-1, AGS, Kato III, A549, Calu-6, A375, SY5Y, SKOV3, Capan-1, sNF96.2, TIVE-L1, TIVE-L2, LNCaP и т.п. В более конкретном аспекте клетка или клеточная линия может представлять собой клетку острого миелоидного лейкоза.
В одном аспекте способ ингибирования или снижения полимеризации тубулина и функции BMI-1 у субъекта с острым миелоидным лейкозом, нуждающемся в этом, включает введение эффективного количества соединения 1 или его фармацевтически приемлемой соли либо его фармацевтической композиции субъекту, как описано в настоящем документе.
В конкретном аспекте субъект, у которого диагностирован острый миелоидный лейкоз, может лечиться химиотерапевтическим средством для ингибирования или снижения полимеризации тубулина.
В конкретном аспекте субъект, у которого диагностирован острый миелоидный лейкоз, может лечиться химиотерапевтическим средством для ингибирования или снижения функции BMI-1.
В конкретном аспекте способ ингибирования или снижения полимеризации тубулина, описанный в настоящем документе, ингибирует или снижает полимеризацию тубулина примерно на 5%, 10%, 15%, 20%, 25%, 30%, 35%, 40%, 45%, 50%, 55%, 60%, 65%, 80%, 85%, 90%, 95% или 100% относительно полимеризации тубулина до введения соединения 1 субъекту, что определяется методами, хорошо известными в данной области.
В конкретном аспекте способ ингибирования или снижения функции BMI-1, описанный в настоящем документе, ингибирует функцию BMI-1 примерно на 5%, 10%, 15%, 20%, 25%, 30%, 35%, 40%, 45%, 50%, 55%, 60%, 65%, 80%, 85%, 90%, 95% или 100% относительно функции BMI-1 до введения соединения 1 субъекту, что определяется методами, известными в данной области.
В конкретном аспекте способ ингибирования или снижения полимеризации тубулина, описанный в настоящем документе, ингибирует или снижает полимеризацию тубулина на от примерно 5% до примерно 20%, от 10% до 30%, от 15% до 40%, от 15% до 50%, от 20% до 30%, от 20% до 40%, от 20% до 50%, от 30% до 60%, от 30% до 70%, от 30% до 80%, от 30% до 90%, от 30% до 95%, от 30% до 99% или от примерно 40% до примерно 100% или на любой промежуточный интервал значений относительно полимеризации тубулина до введения соединения 1 субъекту, что определяется методами, хорошо известными в данной области.
В конкретном аспекте способ ингибирования или снижения функции BMI-1, описанный в настоящем документе, ингибирует или снижает функцию BMI-1 на от примерно 5% до примерно 20%, от 10% до 30%, от 15% до 40%, от 15% до 50%, от 20% до 30%, от 20% до 40%, от 20% до 50%, от 30% до 60%, от 30% до 70%, от 30% до 80%, от 30% до 90%, от 30% до 95%, от 30% до 99% или на от примерно 40% до примерно 100% или на любой промежуточный интервал значений относительно функции BMI-1 до введения соединения 1 субъекту, что определяется методами, хорошо известными в данной области.
В конкретном аспекте способ ингибирования или снижения полимеризации тубулина, описанный в настоящем документе, ингибирует пролиферацию или уменьшает в условиях in vitro или in vivo популяцию пролифирующей клетки или клеточной линии примерно на 5%, 10%, 15%, 20%, 25%, 30%, 35%, 40%, 45%, 50%, 55%, 60%, 65%, 80%, 85%, 90%, 95% или 100% относительно популяции пролиферирующей клетки или клеточной линий in vitro или in vivo до введения соединения 1 субъекту, что определяется методами, хорошо известными в данной области.
В конкретном аспекте способ ингибирования или снижения функции BMI-1, описанный в настоящем документе, ингибирует пролиферацию или уменьшает в условиях in vitro или in vivo популяцию пролифирующей клетки или клеточной линии примерно на 5%, 10%, 15%, 20%, 25%, 30%, 35%, 40%, 45%, 50%, 55%, 60%, 65%, 80%, 85%, 90%, 95% или 100% относительно популяции пролиферирующей клетки или клеточной линии до введения соединения 1 субъекту, что определяется методами, хорошо известными в данной области.
В конкретном аспекте способ ингибирования или снижения полимеризации тубулина, описанный в настоящем документе, ингибирует пролиферацию или уменьшает в условиях in vitro или in vivo популяцию пролифирующей клетки или клеточной линии на примерно от 5% до примерно 20%, от 10% до 30%, от 15% до 40%, от 15% до 50%, от 20% до 30%, от 20% до 40%, от 20% до 50%, от 30% до 60%, от 30% до 70%, от 30% до 80%, от 30% до 90%, от 30% до 95%, от 30% до 99% или от примерно 40% до примерно 100% или на любой промежуточный интервал значений относительно популяции пролиферирующей клетки или клеточной линии in vitro или in vivo до введения соединения 1 субъекту, что определяется методами, хорошо известными в данной области.
В конкретном аспекте способ ингибирования или снижения функции BMI-1, описанный в настоящем документе, ингибирует пролиферацию или уменьшает в условиях in vitro или in vivo популяцию пролифирующей клетки или клеточной линии на примерно от 5% до примерно 20%, от 10% до 30%, от 15% до 40%, от 15% до 50%, от 20% до 30%, от 20% до 40%, от 20% до 50%, от 30% до 60%, от 30% до 70%, от 30% до 80%, от 30% до 90%, от 30% до 95%, от 30% до 99% или на примерно от 40% до примерно 100% или на любой промежуточный интервал значений относительно популяции пролиферирующей клетки или клеточной линии in vitro или in vivo до введения соединения 1 субъекту, что определяется методами, хорошо известными в данной области.
В различных аспектах способ ингибирования или снижения полимеризации тубулина, описанный в настоящем документе, снижает экспрессию субъединиц GTP-связанного αβ-тубулина, доступных для сбора микротрубочек, у субъекта, что определяется методами, хорошо известными в данной области, например методом твердофазного ИФА.
В различных аспектах способ ингибирования или снижения функции BMI-1, описанный в настоящем документе, снижает концентрацию BMI-1 в плазме субъекта, что определяется методами, хорошо известными в данной области, например твердофазным ИФА.
В одном аспекте в настоящем документе описан способ предотвращения, лечения или облегчения острого миелоидного лейкоза у субъекта, нуждающегося в этом, который включает введение количества соединения 1, эффективного для ингибирования или снижения полимеризации тубулина у субъекта.
В одном аспекте в настоящем документе описан способ предотвращения, лечения или облегчения острого миелоидного лейкоза у субъекта, нуждающегося в этом, который включает введение количества соединения 1, эффективного для ингибирования или снижения функции BMI-1 у субъекта.
В конкретном аспекте способ предотвращения, лечения или облегчения острого миелоидного лейкоза у субъекта, нуждающегося в этом, описанный в настоящем документе, ингибирует или снижает полимеризацию тубулина примерно на 5%, 10%, 15%, 20%, 25%, 30%, 35%, 40%, 45%, 50%, 55%, 60%, 65%, 80%, 85%, 90%, 95% или 100% относительно полимеризации тубулина до введения соединения 1 субъекту, что определяется методами, хорошо известными в данной области.
В конкретном аспекте способ предотвращения, лечения или облегчения острого миелоидного лейкоза у субъекта, нуждающегося в этом, описанный в настоящем документе, ингибирует или снижает функцию BMI-1 примерно на 5%, 10%, 15%, 20%, 25%, 30%, 35%, 40%, 45%, 50%, 55%, 60%, 65%, 80%, 85%, 90%, 95% или 100% относительно функции BMI-1 до введения соединения 1 субъекту, что определяется методами, хорошо известными в данной области.
В конкретном аспекте способ предотвращения, лечения или облегчения острого миелоидного лейкоза у субъекта, нуждающегося в этом, описанный в настоящем документе, ингибирует или снижает полимеризацию тубулина на примерно от 5% до примерно 20%, от 10% до 30%, от 15% до 40%, от 15% до 50%, от 20% до 30%, от 20% до 40%, от 20% до 50%, от 30% до 60%, от 30% до 70%, от 30% до 80%, от 30% до 90%, от 30% до 95%, от 30% до 99% или от примерно 40% до примерно 100% или на любой промежуточный интервал значений относительно полимеризации тубулина до введения соединения 1 субъекту, что определяется методами, хорошо известными в данной области.
В конкретном аспекте способ предотвращения, лечения или облегчения острого миелоидного лейкоза у субъекта, нуждающегося в этом, описанный в настоящем документе, ингибирует или снижает функцию BMI-1 на от примерно 5% до примерно 20%, от 10% до 30%, от 15% до 40%, от 15% до 50%, от 20% до 30%, от 20% до 40%, от 20% до 50%, от 30% до 60%, от 30% до 70%, от 30% до 80%, от 30% до 90%, от 30% до 95%, от 30% до 99% или от примерно 40% до примерно 100% или на любой промежуточный интервал значений относительно функции BMI-1 до введения соединения 1 субъекту, что определяется методами, хорошо известными в данной области.
В различных аспектах способ предотвращения, лечения или облегчения острого миелоидного лейкоза у субъекта, нуждающегося в этом, описанный в настоящем документе, снижает концентрацию BMI-1 у субъекта, что определяется методами, хорошо известными в данной области, например методом твердофазного ИФА.
В одном аспекте в настоящем документе описан способ предотвращения, лечения или облегчения острого миелоидного лейкоза у субъекта, нуждающегося в этом, который включает введение количества соединения 1, эффективного для ингибирования пролиферации или уменьшения в условиях in vitro или in vivo популяции пролиферирующей клетки или клеточной линии у субъекта.
В конкретном аспекте способ предотвращения, лечения или облегчения острого миелоидного лейкоза у субъекта, нуждающегося в этом, описанный в настоящем документе, ингибирует пролиферацию или уменьшает в условиях in vitro или in vivo популяцию пролиферирующей клетки или клеточной линии у субъекта примерно на 5%, 10%, 15%, 20%, 25%, 30%, 35%, 40%, 45%, 50%, 55%, 60%, 65%, 80%, 85%, 90%, 95% или 100% относительно пролиферации или популяции пролиферирующей клетки или клеточной линии у субъекта до введения соединения 1 субъекту, что определяется методами, хорошо известными в данной области.
В конкретном аспекте способ предотвращения, лечения или облегчения острого миелоидного лейкоза у субъекта, нуждающегося в этом, описанный в настоящем документе, ингибирует пролиферацию или уменьшает в условиях in vitro или in vivo популяцию пролифирующей клетки или клеточной линии у субъекта на от примерно 5% до примерно 20%, от 10% до 30%, от 15% до 40%, от 15% до 50%, от 20% до 30%, от 20% до 40%, от 20% до 50%, от 30% до 60%, от 30% до 70%, от 30% до 80%, от 30% до 90%, от 30% до 95%, от 30% до 99% или от примерно 40% до примерно 100% или на любой промежуточный интервал значений относительно пролиферации или популяции in vitro или in vivo пролиферирующей клетки или клеточной линии у субъекта до введения соединения 1 субъекту, что определяется методами, хорошо известными в данной области.
В различных аспектах способ предотвращения, лечения или облегчения острого миелоидного лейкоза у субъекта, нуждающегося в этом, описанный в настоящем документе, ингибирует пролиферацию или уменьшает в условиях in vitro или in vivo популяцию пролифирующей клетки или клеточной линии у субъекта, что определяется методами, хорошо известными в данной области, например методом твердофазного ИФА.
В одном аспекте в настоящее документе описан способ предотвращения, лечения или облегчения острого миелоидного лейкоза у субъекта, нуждающегося в этом, который включает введение количества соединения 1, эффективного для ингибирования пролиферации или уменьшения в условиях in vitro или vivo популяции пролиферирующей клетки или клеточной линии у субъекта, в комбинации с другой терапией (например, одним или несколькими дополнительными терапевтическими средствами, которые не включают соединение 1 или которые включают другое антипролиферативное средство) субъекту, нуждающемуся в этом.
Такие способы могут включать введение соединения 1 до, одновременно или после введения дополнительной терапии. В некоторых аспектах такие способы обладают аддитивным или синергическим эффектом.
В конкретном аспекте в настоящем документе представлен способ предотвращения, лечения или облегчения острого миелоидного лейкоза у субъекта, нуждающегося в этом, включающий введение субъекту, нуждающемуся в этом, эффективного количества соединения 1 и эффективного количества другой терапии.
Один аспект, описанный в настоящем документе, включает гематобластоз, который можно предотвращать, лечить или облегчать в соответствии со способами, представленными в настоящем документе, включая, но без ограничения только им, острый миелоидный лейкоз.
В конкретном аспекте примеры гематобластоза, которые можно предотвращать, лечить или облегчать в соответствии со способами, представленными в настоящем документе, включают, но без ограничения только им, острый миелоидный лейкоз.
В одном аспекте, представленном в настоящем документе, способ предотвращения, лечения или облегчения острого миелоидного лейкоза включает (a) введение субъекту, нуждающемуся в этом, одной или нескольких доз соединения 1 или его фармацевтически приемлемой соли либо его фармацевтической композиции; и (b) мониторинг концентрации некоторых биомаркеров до и/или после стадии (a).
В конкретном аспекте стадия мониторинга (b) проводится перед и/или после введения определенного количества доз (например, 1, 2, 4, 6, 8, 10, 12, 14, 15 или 29 или большего количества доз; от 2 до 4, от 2 до 8, от 2 до 20 или от 2 до 30 доз) или некоторого периода времени (например, 1, 2, 3, 4, 5, 6 или 7 дней; или 1, 2, 3, 4, 5, 10, 15, 20, 30, 40, 45, 48 или 50 недель) введения соединения 1 или его фармацевтически приемлемой соли либо его фармацевтической композиции.
В конкретном аспекте один или несколько из этих параметров мониторинга определяют до введения субъекту соединения 1 или его фармацевтически приемлемой соли либо его фармацевтической композиции.
В конкретном аспекте снижение пролиферации в условиях in vitro или in vivo популяции пролиферирующей клетки или клеточной линии после введения соединения 1 или его фармацевтически приемлемой соли либо его фармацевтической композиции показывает, что курс лечения эффективен для предотвращения, лечения или облегчения острого миелоидного лейкоза.
В конкретном аспекте изменение пролиферации in vitro или in vivo популяции пролиферирующей клетки или клеточной линии после введения соединения 1 или его фармацевтически приемлемой соли либо его фармацевтической композиции может показывать, что дозировка, частота и/или продолжительность введения соединения 1 или его фармацевтически приемлемой соли либо его фармацевтической композиции могут корректироваться (например, повышаться, снижаться или сохраняться на том же уровне).
В конкретном аспекте концентрация некоторых биомаркеров в биологических образцах субъекта контролируется до, во время или после курса лечения острого миелоидного лейкоза, включающего введение соединения 1 или его фармацевтически приемлемой соли или его фармацевтической композиции субъекту.
Дозировка, частота и/или продолжительность введения соединения 1 или его фармацевтически приемлемой соли либо его фармацевтической композиции субъекту может изменяться в результате изменения пролиферации in vitro или in vivo популяции пролиферирующей клетки или клеточной линии. В качестве альтернативы, изменения этих параметром мониторинга (например, концентрации определенных биомаркеров) может указывать на то, что курс лечения, включающий введение соединения 1 или его фармацевтически приемлемой соли или его фармацевтической композиции является эффективным в предотвращении, лечении или облегчении острого миелоидного лейкоза.
Концентрация определенных биомаркеров у субъекта может определяться методами, известными сециалистам в данной области техники. В определенных аспектах способ определения концентрации определенных биомаркеров у субъекта включает получение биологического образца (например, образца ткани или жидкости) от субъекта и определение концентрации биомаркеров в биологическом образце (например, в плазме, сыворотке, моче или любых других биологических жидкостях), который подвергался некоторой обработке (например, центрифугированию), и определение концентрации с помощью иммунологических методов, таких как метод твердофазного ИФА.
В конкретном аспекте метод твердофазного иммуноферментного анализа (ИФА), описанный в настоящем документе, может использоваться для определения концентрации биомаркеров в биологическом образце (например, в образце плазмы, сыворотки, мочи или любых других биологических жидкостей), который подвергался некоторой обработке (например, центрифугированию). Другие методы, известные в данной области техники, которые могут использоваться для определения концентрации биомаркеров в биологическом образце, включают мультиплексный или протеомный анализы.
В конкретных аспектах способы предотвращения, лечения или облегчения острого миелоидного лейкоза, представленные в настоящем документе, облегчают или сдерживают развитие одного, двух или более симптомов, связанных с острым миелоидным лейкозом. Облегчение или сдерживание развития одного, двух или более симптомов острого миелоидного лейкоза может использоваться в качестве клинического результата эффективности применения соединения 1 или его фармацевтически приемлемой соли либо его фармацевтической композиции для предотвращения, лечения или облегчения острого миелоидного лейкоза. В некоторых аспектах способы предотвращения, лечения или облегчения острого миелоидного лейкоза, представленные в настоящем документе, снижают продолжительность и/или тяжесть одного или нескольких симптомов, связанных с острым миелоидным лейкозом. В некоторых аспектах способы предотвращения, лечения или облегчения острого миелоидного лейкоза, представленные в настоящем документе, ингибируют начало, прогрессирование и/или рецидив одного или нескольких симптомов, связанных с острым миелоидным лейкозом. В некоторых аспектах способы лечения острого миелоидного лейкоза, представленные в настоящем документе, снижают число симптомов, связанных с острым миелоидным лейкозом.
В определенных аспектах способы предотвращения, лечения или облегчения острого миелоидного лейкоза, представленные в настоящем документе, продлевают или задерживают фазу G1/S или позднюю фазу G1/S клеточного цикла (т.е. период между последней контрольной точкой (фаза покоя или фаза, предшествующая синтезу ДНК) и ранней фазой синтеза ДНК). В других аспектах способы предотвращения, лечения или облегчения острого миелоидного лейкоза, представленные в настоящем документе, продлевают или задерживают фазу S или G2/M клеточного цикла (т.е. период между синтезом ДНК и ранней фазой деления).
В некоторых аспектах способы предотвращения, лечения или облегчения острого миелоидного лейкоза, представленные в настоящем документе, снижают, облегчают или смягчают тяжесть острого миелоидного лейкоза и/или одного или нескольких его симптомoв. В других аспектах способы предотвращения, лечения или облегчения острого миелоидного лейкоза, представленные в настоящем документе, снижают пребывание в стационаре (например, частоту и продолжительность пребывания в стационаре) субъекта с диагностированным острым миелоидным лейкозом.
В определенных аспектах способы, представленные в настоящем документе, повышают выживаемость субъекта с диагностированным острым миелоидным лейкозом. В конкретных аспектах способы, представленные в настоящем документе, повышают выживаемость субъекта с диагностированным острым миелоидным лейкозом примерно на 6 месяцев или более, примерно на 7 месяцев или более, примерно на 8 месяцев или более, примерно на 9 месяцев или более или примерно 12 месяцев или более.
В конкретных аспектах способы предотвращения, лечения или облегчения острого миелоидного лейкоза, представленные в настоящем документе, ингибируют или снижают прогрессирование острого миелоидного лейкоза или одного или нескольких симптомов, связанных с ним. В конкретных аспектах способы предотвращения, лечения или облегчения острого миелоидного лейкоза, представленные в настоящем документе, повышают или улучшают терапевтическое действие другой терапии (например, противоракового средства, облучения, лекарственной терапии, такой как химиотерапия, антиандрогенная терапия, или хирургического вмешательства). В определенных аспектах способы предотвращения, лечения или облегчения острого миелоидного лейкоза, представленные в настоящем документе, включают применение соединения 1 или его фармацевтически приемлемой соли либо его фармацевтической композиции в качестве адъювантной терапии.
В конкретных аспектах способы предотвращения, лечения или облегчения острого миелоидного лейкоза, представленные в настоящем документе, снижают смертность субъектов с диагностированным острым миелоидным лейкозом. В определенных аспектах способы предотвращения, лечения или облегчения острого миелоидного лейкоза, представленные в настоящем документе, увеличивают количество субъектов в стадии ремиссии или снижают пребывание в стационаре. В других аспектах способы предотвращения, лечения или облегчения острого миелоидного лейкоза, представленные в настоящем документе, предотвращают развитие, появление или прогрессирование одного или нескольких симптомов, связанных с острым миелоидным лейкозом.
В конкретных аспектах способы предотвращения, лечения или облегчения острого миелоидного лейкоза, представленные в настоящем документе, повышают бессимптомную выживаемость субъектов с острым миелоидным лейкозом. В некоторых аспектах способы предотвращения, лечения или облегчения острого миелоидного лейкоза, представленные в настоящем документе, не излечивают острый миелоидный лейкоз у субъектов, но предотвращают прогрессирование или обострение заболевания. В некоторых аспектах способы предотвращения, лечения или облегчения острого миелоидного лейкоза, представленные в настоящем документе, улучшают качество жизни субъекта.
В определенных аспектах способы предотвращения, лечения или облегчения острого миелоидного лейкоза, представленные в настоящем документе, повышают выживаемость без рака субъектов с диагностированным раком. В некоторых аспектах способы предотвращения, лечения или облегчения острого миелоидного лейкоза, представленные в настоящем документе, повышают безрецидивную выживаемость. В определенных аспектах способы предотвращения, лечения или облегчения острого миелоидного лейкоза, представленные в настоящем документе, повышают количество пациентов в стадии ремиссии. В других аспектах способы предотвращения, лечения или облегчения острого миелоидного лейкоза, представленные в настоящем документе, увеличивают продолжительность ремиссии у субъектов.
Пациенты, получающие лечение
В некоторых аспектах субъектом, получающим лечение от острого миелоидного лейкоза в соответствии со способами, представленными в настоящем документе, является человек, страдающий острым миелоидным лейкозом, или человек с диагностированным острым миелоидным лейкозом. В других аспектах субъектом, получающим лечение от острого миелоидного лейкоза в соответствии со способами, представленными в настоящем документе, является человек предрасположенный или восприимчивый к острому миелоидному лейкозу. В некоторых аспектах субъектом, получающим лечение от острого миелоидного лейкоза в соответствии со способами, представленными в настоящем документе, является человек с риском развития острого миелоидного лейкоза.
В одном аспекте, субъектом, получающим лечение от острого миелоидного лейкоза в соответствии со способами, представленными в настоящем документе, является младенец человека. В другом аспекте субъектом, получающим лечение от острого миелоидного лейкоза в соответствии со способами, представленными в настоящем документе, является ребенок человека, начинающий ходить. В другом аспекте субъектом, получающим лечение от острого миелоидного лейкоза в соответствии со способами, представленными в настоящем документе, является ребенок человека. В другом аспекте субъектом, получающим лечение от острого миелоидного лейкоза в соответствии со способами, представленными в настоящем документе, является взрослый человек. В еще одном аспекте субъектом, получающим лечение от острого миелоидного лейкоза в соответствии со способами, представленными в настоящем документе, является человек среднего возраста. В еще одном аспекте субъектом, получающим лечение от острого миелоидного лейкоза в соответствии со способами, представленными в настоящем документе, является пожилой человек.
В определенных аспектах у субъекта, получающего лечение от рака в соответствии со способами, представленными в настоящем документе, острый миелоидный лейкоз метастазирует в другие области тела, такие как кости, легкие и печень. В определенных аспектах субъект, получающий лечение от острого миелоидного лейкоза в соответствии со способами, представленными в настоящем документе, находится в стадии ремиссии острого миелоидного лейкоза. В некоторых аспектах у субъекта, получающего лечение от острого миелоидного лейкоза в соответствии со способами, представленными в настоящем документе, наблюдался рецидив острого миелоидного лейкоза. В определенных аспектах у субъекта, получающего лечение в соответствии со способами, представленными в настоящем документе, наблюдается рецидив одного или нескольких симптомов, связанных с острым миелоидным лейкозом.
В определенных аспектах субъектом, получающим лечение от острого миелоидного лейкоза в соответствии со способами, представленными в настоящем документе, является человек в возрасте от примерно 1 года до примерно 5 лет, от примерно 5 до примерно 10 лет, от примерно 10 до примерно 18 лет, от примерно 18 до примерно 30 лет, от примерно 25 до примерно 35 лет, от примерн 35 до примерно 45 лет, от примерно 40 до примерно 55 лет, от примерно 50 до примерно 65 лет, от примерно 60 до примерно 75 лет, от примерно 70 до примерно 85 лет, от примерно 80 до примерно 90 лет, от примерно 90 до примерно 95 лет или от примерно 95 до примерно 100 лет или возраста в любом промежуточном интервале значений.
В конкретном аспекте субъектом, получающим лечение от острого миелоидного лейкоза в соответствии со способами, представленными в настоящем документе, является человек в возрасте 18 лет или старше. В отдельном аспекте субъектом, получающим лечение от острого миелоидного лейкоза в соответствии со способами, представленными в настоящем документе, является ребенок человека в возрасте от 1 года до 18 лет. В определенном аспекте субъектом, получающим лечение от острого миелоидного лейкоза в соответствии со способами, представленными в настоящем документе, является человек в возрасте от 12 до 18 лет. В определенном аспекте субъектом является человек мужского пола. В другом аспекте субъектом является человек женского пола. В одном аспекте субъектом является женщина, которая не беременна или не кормит грудью. В еще одном аспекте субъектом является женщина, которая беременна или будет беременной/может забеременеть или кормит грудью.
В особых аспектах субъектом, получающим лечение от острого миелоидного лейкоза в соответствии со способами, представленными в настоящем документе, является человек, находящийся в состоянии ослабленного иммунитета или в состоянии подавленного иммунитета. В определенных аспектах субъектом, получающим лечение от острого миелоидного лейкоза в соответствии со способами, представленными в настоящем документе, является человек, получающий иммуносупрессивную терапию или восстанавливающийся после иммуносупрессивной терапии. В определенных аспектах субъектом, получающим лечение от острого миелоидного лейкоза в соответствии со способами, представленными в настоящем документе, является человек, страдающий острым миелоидным лейкозом или с риском заболеть острым миелоидным лейкозом. В определенных аспектах субъектом, получающим лечение от острого миелоидного лейкоза в соответствии со способами, представленными в настоящем документе, является человек, который проходит, будет или подвергся хирургическому вмешательству, медикаментозной терапии, такой как химиотерапия, гормональная терапия, и/или лучевой терапии.
В некоторых аспектах субъекту, получающему лечение от острого миелоидного лейкоза в соответствии со способами, представленными в настоящем документе, вводится соединение 1 или его фармацевтически приемлемая соль либо его фармацевтическая композиция или комбинированная терапия до развития любых побочных эффектов или непереносимости методов терапии, отличных от соединения 1. В некоторых аспектах субъект, получающий лечение от острого миелоидного лейкоза в соответствии со способами, представленными в настоящем документе, является субъектом, трудно поддающимся лечению. В определенных аспектах субъект, трудно поддающийся лечению, является субъектом, трудно поддающимся лечению стандартной терапией (например, хирургическим вмешательством, облучением и/или лекарственной терапией, такой как химиотерапия). В определенных аспектах субъект с острым миелоидным лейкозом трудно поддается терапевтическому лечению, когда острый миелоидный лейкоз по существу не был устранен и/или один или несколько его симптомов не были значительно смягчены. Определение того, является ли субъект трудно поддающимся лечению, может осуществляться in vivo или in vitro любым способом, известным в данной области для оценки эффективности лечения острого миелоидного лейкоза, используя принятые в данной области значения термина «трудно поддающийся лечению» в таком контексте.
В некоторых аспектах субъектом, получающим лечение от острого миелоидного лейкоза в соответствии со способами, представленными в настоящем документе, является человек с доказанной невосприимчивостью к терапии, отличной от лечения соединением 1 или его фармацевтически приемлемой солью либо его фармацевтической композицией, но больше не получает эти методы терапии. В определенных аспектах субъектом, получающим лечение от острого миелоидного лейкоза в соответствии со способами, представленными в настоящем документе, является человек, уже получавший лечение одним или несколькими стандартными методами терапии, такими как хирургическое вмешательство, лекарственная терапия, такая как химиотерапия, антиандрогенная терапия, или облучение. Среди эти субъектов есть субъекты, трудно поддающиеся лечению, субъекты, которые слишком молоды для стандартных методов терапии, и субъекты с рецидивирующим острым миелоидным лейкозом, несмотря на лечение существующими на сегодняшним день методами терапии.
В некоторых аспектах субъектом, получающим лечение от острого миелоидного лейкоза в соответствии со способами, представленными в настоящем документе, является человек, восприимчивый к неблагоприятным реакциям на традиционные методы терапии. В некоторых аспектах субъектом, получающим лечение от острого миелоидного лейкоза в соответствии со способами, представленными в настоящем документе, является человек, который не получал терапию, например лекарственную терапию, такую как химиотерапию, хирургическое вмешательство, антиандрогенная терапия, или лучевую терапию, до введения соединения 1 или его фармацевтически приемлемой соли либо его фармацевтической композиции. В других аспектах субъектом, получающим лечение от острого миелоидного лейкоза в соответствии со способами, представленными в настоящем документе, является человек, который получал терапию до введения соединения 1 или его фармацевтически приемлемой соли либо его фармацевтической композиции. В некоторых аспектах субъектом, получающим лечение от острого миелоидного лейкоза в соответствии со способами, представленными в настоящем документе, является человек, который испытал неблагоприятные побочные эффекты в предыдущем лечении или предыдущая терапия была прекращена вследствие неприемлемых уровней токсичности для человека.
Дозировка и способы введения
В соответствии со способами предотвращения, лечения или облегчения острого миелоидного лейкоза, представленными в настоящем документе, соединение 1 или его фармацевтически приемлемая соль или его фармацевтическая композиция может вводиться субъекту, нуждающемуся в этом, различными способами в количествах, которые приводят к благоприятной или лечебному эффекту. Соединение 1 или его фармацевтически приемлемая соль либо его фармацевтическая композиция может вводиться перорально субъекту, нуждающемуся в этом, в соответствии со способами предотвращения, лечения или облегчения острого миелоидного лейкоза, представленными в настоящем документе. Пероральное введение соединения 1 или его фармацевтически приемлемой соли либо его фармацевтической композиции может облегчить субъектам, нуждающимся в таком лечении, соблюдение схемы приема соединения 1 или его фармацевтически приемлемой соли либо его фармацевтической композиции. Таким образом, в конкретном аспекте соединение 1 или его фармацевтически приемлемая соль либо его фармацевтическая композиция вводится перорально субъекту, нуждающемуся в этом. В другом аспекте соединение 1 или его фармацевтически приемлемая соль либо его фармацевтическая композиция, представленные в настоящем документе, могут вводиться перорально с пищей или водой или без пищи и воды.
Другие способы введения включаю, но без ограничения только ими, внутривенное, внутрикожное, интратекальное, внутримышечное, подкожное, интраназальное, ингаляционное, трансдермальное, местное, трансмукозальное, внутричерепное, эпидуральное или внутрисиновиальное введение. В одном аспекте соединение 1 или его фармацевтически приемлемая соль либо его фармацевтическая композиция вводится системно (например, парентерально) субъекту, нуждающемуся в этом. В еще одном аспекте соединение 1 или его фармацевтически приемлемая соль либо его фармацевтическая композиция вводится способом, который позволяет соединению 1 или его фармацевтически приемлемой соли либо его фармацевтической композиции преодолевать гематоэнцефалический барьер (например, перорально).
В соответствии со способами предотвращения, лечения или облегчения острого миелоидного лейкоза, представленными в настоящем документе, которые включают введения соединения 1 или его фармацевтически приемлемой соли либо его фармацевтической композиции в комбинации с одним или несколькими дополнительными терапевтическими средствами, соединение 1 или его фармацевтически приемлемая соль либо его фармацевтическая композиция и одно или несколько дополнительных терапевтических средств могут вводиться одним и тем же или разными способами введения.
Дозировка и частота ведения соединения 1 или его фармацевтически приемлемой соли либо его фармацевтической композиции субъекту, нуждающемуся в этом, в соответствии со способами предотвращения, лечения или облегчения острого миелоидного лейкоза, представленными в настоящем документе, будут эффективными при одновременной минимизации любых побочных эффектов. Точная дозировка и частота введения соединения 1 или его фармацевтически приемлемой соли либо его фармацевтической композиции может определяться практикующим врачом в свете факторов, относящихся к субъекту, которому необходимо лечение.
Факторы, которые могут приниматься во внимание, включают тяжесть болезненного состояния, общее состояние здоровья субъекта, возраст, массу тела и пол субъекта, диету, время и частоту приема, комбинацию(и) с другими лекарственными средствами, восприимчивость к терапии и переносимость терапии/реакцию на терапию. Дозировка и частота введения соединения 1 или его фармацевтически приемлемой соли или фармацевтической композиции со временем могут корректироваться для обеспечения эффективного количества соединения 1 или его фармацевтически приемлемой соли либо его фармацевтической композиции или для поддержания желаемого эффекта.
Как описано в настоящем документе, способы предотвращения, лечения или облегчения острого миелоидного лейкоза у субъекта, нуждающегося в этом, представленные в настоящем документе, включают введение субъекту эффективного количества соединения 1 или его фармацевтически приемлемой соли либо его фармацевтической композиции, где эффективное количество представляет собой дозу, вводимую субъекту два раза в неделю в разные дни, причем вторая доза в неделю следует за первой через три дня, а первая доза на следующей неделе следует за второй дозой на предыдущей неделе через четыре дня.
В конкретном аспекте эффективное количество представляет собой дозу, вводимую субъекту, которая может быть увеличена или уменьшена в зависимости от реакции субъекта.
В конкретном аспекте способ предотвращения, лечения или облегчения острого миелоидного лейкоза у субъекта, нуждающегося в этом, включает введение субъекту эффективного количества соединения 1 или его фармацевтически приемлемой соли либо его фармацевтической композиции, где эффективное количество представляет собой дозу в интервале значений от примерно 50 мг до примерно 200 мг, от примерно 100 мг до примерно 200 мг, от примерно 150 мг до примерно 200 мг и т.п. или дозу в любом промежуточном интервале значений между указанными интервалами значений, вводимую перорально два раза в неделю.
В конкретном аспекте способ предотвращения лечения или облегчения острого миелоидного лейкоза у субъекта, нуждающегося в этом, включает введение эффективного количества соединения 1 или его фармацевтически приемлемой соли либо его фармацевтической композиции субъекту, где эффективное количество представляет собой дозу, выбранную из примерно 50 мг, примерно 100 мг, примерно 150 мг или примерно 200 мг и т.п. или любого промежуточного значения и вводимую перoрально два раза в неделю.
В конкретном аспекте способ предотвращения, лечения или облегчения острого миелоидного лейкоза у субъекта, нуждающегося в этом, включает введение эффективного количества соединения 1 или его фармацевтически приемлемой соли либо его фармацевтической композиции субъекту, где эффективное количество представляет собой дозу примерно 50 мг, вводимую перорально два раза в неделю.
В некоторых аспектах способ предотвращения, лечения или облегчения острого миелоидного лейкоза у субъекта, нуждающегося в этом, включает введение эффективного количества соединения 1 или его фармацевтической композицию субъекту, где эффективное количество представляет собой дозу, выраженную в мг на квадратный метр (мг/м2). Количество соединения 1, выраженное в мг/м2, может быть определено, например, умножением коэффициента пересчета для животных на дозу для животных в мг на килограмм (мг/мг) с получением эквивалентной дозы для человека в мг/м2. Для этой цели могут использоваться следующие коэффициенты пересчета: мышь=3, хомяк=4,1, крыса=6, морская свинка=7,7 (в соответствии с публикацией Freireich et al., Cancer Chemother. Rep. 50(4):219-244 (1966)). Площадь поверхности тела человека может рассчитываться в соответствии с формулой Бойда (Boyd) с использованием значений роста и массы тела. В конкретных аспектах способ предотвращения, лечения или облегчения острого миелоидного лейкоза у субъекта, нуждающегося в этом, включает введение эффективного количества соединения 1 или его фармацевтической композиции субъекту, где эффективное количество представляет собой количество в интервале от примерно 0,1 мг/м2 до примерно 1000 мг/м2 или в любом промежуточном интервале значений между указанными значениями.
В одном аспекте способ предотвращения, лечения или облегчения острого миелоидного лейкоза у субъекта, нуждающегося в этом, включает введение эффективного количества соединения 1 или его фармацевтической композиции субъекту, где эффективное количество представляет собой дозу, которая обеспечивает целевую среднюю концентрацию соединения 1 в плазме у субъекта с острым миелоидным лейкозом или животной модели с предварительно установленным острым миелоидным лейкозом.
В конкретном аспекте способ предотвращения, лечения или облегчения острого миелоидного лейкоза у субъекта, нуждающегося в этом, включает введение эффективного количества соединения 1 или его фармацевтической композиции субъекту, где эффективное количество представляет собой дозу, которая обеспечивает среднюю концентрацию соединения 1 в плазме субъекта с острым миелоидным лейкозом или животной модели с предварительно установленным острым миелоидным лейкозом в течение периода продолжительностью 24 в интервале от приблизительно 3 час·мкг/мл до приблизительно 70 час·мкг/мл, от приблизительно 3 час·мкг/мл до приблизительно 60 час·мкг/мл, от приблизительно 3 час·мкг/мл до приблизительно 50 час·мкг/мл, от приблизительно 3 час·мкг/мл до приблизительно 40 час·мкг/мл, от приблизительно 3 час·мкг/мл до приблизительно 30 час·мкг/мл, от приблизительно 3 час·мкг/мл до приблизительно 20 час·мкг/мл, от приблизительно 3 час·мкг/мл до приблизительно 10 час·мкг/мл и т.п. или в любом промежуточном интервале значений.
В конкретном аспекте способ предотвращения, лечения или облегчения острого миелоидного лейкоза у субъекта, нуждающегося в этом, включает введение субъекту эффективного количества соединения 1 или его фармацевтической композиции, где эффективное количество представляет собой дозу, при которой средняя концентрация соединения 1 в плазме у субъекта с острым миелоидным лейкозом или животной модели с предварительно установленным острым миелоидным лейкозом в течение периода продолжительностью 24 часа достигает приблизительно 3 час·мкг/мл, приблизительно 10 час·мкг/мл, приблизительно 20 час·мкг/мл, приблизительно 30 час·мкг/мл, приблизительно 40 час·мкг/мл, приблизительно 50 час·мкг/мл, приблизительно 60 час·мкг/мл, приблизительно 70 час·мкг/мл и т.п. или значения в любом промежуточном интервале значений.
Для достижения таких концентраций в плазме может вводиться доза описанного в настоящем документе соединения 1 или его фармацевтической композиции. В определенных аспектах последующие дозы соединения 1 или его фармацевтической композиции могут соответствующим образом корректироваться на основе средних концентраций соединения 1, достигнутых при введении субъекту дозы соединения 1 или его фармацевтической композиции.
В конкретных аспектах способ предотвращения, лечения или облегчения острого миелоидного лейкоза у субъекта, нуждающегося в этом, включает введение эффективного количества соединения 1 или его фармацевтической композиции субъекту, где эффективное количество представляет собой дозу, при которой достигается пониженная средняя целевая концентрация в плазме одного или нескольких биомаркеров у субъекта с острым миелоидным лейкозом или животной модели с предварительно установленным острым миелоидным лейкозом.
В конкретных аспектах способ предотвращения, лечения или облегчения острого миелоидного лейкоза у субъекта, нуждающегося в этом, включает введение эффективного количества соединения 1 или его фармацевтической композиции субъекту, где эффективное количество представляет собой дозу, при которой у субъекта с острым миелоидным лейкозом или животной модели с предварительно установленным острым миелоидным лейкозом достигаются желательные соотношения концентрации соединения 1 или его фармацевтической композиции в ткани и средней концентрации в плазме, что определяется, например, любыми методами визуализации, известными в данной области.
В некоторых аспектах способ предотвращения, лечения или облегчения острого миелоидного лейкоза у субъекта, нуждающегося в этом, включает введение эффективного количества соединения 1 или его фармацевтической композиции субъекту, где эффективное количество может быть одинаковым или неодинаковым для каждой дозы. В особых аспектах первая (т.е. исходная) доза соединения 1 или его фармацевтической композиции вводится субъекту, нуждающемуся в этом, в течение первого периода времени, затем вторая (т.е. загружающая) доза соединения 1 или его фармацевтической композиции вводится субъекту в течение второго периода времени, затем, третья (т.е. поддерживающая) доза соединения 1 или его фармацевтической композиции вводится субъекту в течение второго периода времени. Первая доза может быть больше второй дозы, или первая доза может быть меньше второй дозы. Аналогичным образом, третья доза соединения 1 или его фармацевтической композиции может быть больше или меньшей второй дозы и больше или меньшей первой дозы.
В некоторых аспектах описанные в настоящем документе дозированные количества относятся к общим введенным количествам; то есть если вводится более одного соединения, то в некоторых аспектах дозы соответствуют общему введенному количеству. В конкретном аспекте композиции для перорального введения содержат от примерно 5% до примерно 95% соединения 1 по массе.
Продолжительность периода, в течение которого субъекту, нуждающемуся в этом, вводится соединение 1 или его фармацевтическая композиция в соответствии со способом предотвращения, лечения или облегчения острого миелоидного лейкоза у субъекта, нуждающегося в этом, будет продолжительностью периода, которой определяется выживаемость без рака или без его симптомов. В определенных аспектах способ лечения острого миелоидного лейкоза, представленный в настоящем документе, включает введение соединения 1 или его фармацевтической композиции в течение периода времени до снижения тяжести и/или количества одного или нескольких симптомов, связанных с острым миелоидным лейкозом.
В некоторых аспектах способ предотвращения, лечения или облегчения острого миелоидного лейкоза у субъекта, нуждающегося в этом, включает введение соединения 1 или его фармацевтической композиции в течение не более 48 недель. В других аспектах способ предотвращения, лечения или облегчения острого миелоидного лейкоза у субъекта, нуждающегося в этом, включает введение соединения 1 или его фармацевтической композиции в течение не более 4 недель, 8 недель, 12 недель, 16 недель, 20 недель, 24 недель, 26 недель (0,5 года), 52 недель (1 год), 78 недель (1,5 лет), 104 недель (2 лет) или 130 недель (2,5 лет) или более.
В определенных аспектах способ предотвращения, лечения или облегчения острого миелоидного лейкоза у субъекта, нуждающегося в этом, включает введение соединения 1 или его фармацевтической композиции в течение неопределенного периода времени. В некоторых аспектах способ лечения острого миелоидного лейкоза, представленный в настоящем документе, включает введение соединения 1 или его фармацевтической композиции в течение периода времени, за которым следует период покоя (т.е. период, в течение которого соединение 1 или его фармацевтическая композиция не вводится), после чего введение соединения 1 или его фармацевтической композиции возобновляется.
В конкретных аспектах способ предотвращения, лечения или облегчения острого миелоидного лейкоза у субъекта, нуждающегося в этом, включает введение соединения 1 или его фармацевтической композиции циклами, например циклами продолжительностью в 1 неделю, 2 недели, 3 недели, 4 недели, 5 недель, 6 недель, 8 недель, 9 недель, 10 недель, 11 недель или 12 недель. В таких циклах соединение 1 или его фармацевтическая композиция может вводиться один или два раза в неделю. В конкретном аспекте недельного цикла соединение 1 или его фармацевтическая композиция может вводиться два раза в неделю. В конкретном аспекте такого недельного цикла соединение 1 или его фармацевтическая композиция может вводиться один раз в день.
В конкретных аспектах период времени введения соединения 1 или его фармацевтической композиции может определяться одним или несколькими параметрами мониторинга, например концентрацией определенных биомаркеров.
В особых аспектах период времени введения соединения 1 или его фармацевтической композиции может регулироваться на основании одного или нескольких параметров мониторинга, например концентраций биомаркеров.
В определенных аспектах в соответствии со способом предотвращения, лечения или облегчения острого миелоидного лейкоза у субъекта, нуждающегося в этом, соединение 1 или его фармацевтическая композиция вводится субъекту, нуждающемуся в этом, до приема пищи, одновременно с приемом пищи или после приема пищи (например, завтрака(ом), обеда(ом) или ужина(ом)). В конкретных аспектах в соответствии со способами лечения острого миелоидного лейкоза, представленными в настоящем документе, соединение 1 или его фармацевтическая композиция вводится субъекту, нуждающемуся в этом, утром (например, между 5 и 12 часами).
В определенных аспектах в соответствии со способом предотвращения, лечения или облегчения острого миелоидного лейкоза у субъекта, нуждающегося в этом, соединение 1 или его фармацевтическая композиция вводится субъекту, нуждающемуся в этом, в полдень (т.е. в 12 часов). В особых аспектах в соответствии со способами лечения острого миелоидного лейкоза, представленными в настоящем документе, соединение 1 или его фармацевтическая композиция вводится субъекту, нуждающемуся в этом, во второй половине дня (например, между 12 и 17 часами), вечером (например, между 17 часами и временем отхода ко сну) и/или перед сном.
В конкретном аспекте доза соединения 1 или его фармацевтической композиции вводится субъекту один раз в день или два раза в неделю.
Комбинированная терапия
В настоящем документе представлено лечение от острого миелоидного лейкоза комбинированной терапией, которая включают введение субъекту, нуждающемуся в этом, соединения 1 или его фармацевтической композиции в комбинации с одним или несколькими дополнительными терапевтическими средствами. В конкретном аспекте в настоящем документе представлено методы комбинированное лечения острого миелоидного лейкоза, которые включают введение субъекту, нуждающемуся в этом, эффективного количества соединения 1 или его фармацевтической композиции в комбинации с эффективным количеством другого терапевтического средства.
Термин «в комбинации», когда используется в настоящем документе в контексте введения соединения 1 или его фармацевтической композиции, относится к введению соединения 1 или его фармацевтической композиции до введения одного или нескольких дополнительных терапевтических средств или методов лечения, одновременно с ними или после введения одного или нескольких дополнительных терапевтических средств или дополнительных методов лечения (например, лекарственных средств, хирургического вмешательства или облучения) для применения в лечении острого миелоидного лейкоза. Применение термина «в комбинации» не ограничивает порядок, в котором субъекту вводится одно или несколько терапевтических средств и одно или несколько дополнительных методов лечения. В конкретных аспектах временной интервал между введением соединения 1 или его фармацевтической композиции и введением одного или нескольких дополнительных терапевтических средств или дополнительных методов лечения может составлять примерно 1-5 минут, 1-30 минут, от 30 минут до 60 минут, 1 час, 1-2 часа, 2-6 часов, 2-12 часов, 12-24 часов, 1-2 дня, 2 дня, 3 дня, 4 дня, 5 дней, 6 дней, 7 дней, 1 неделю, 2 недели, 3 недели, 4 недели, 5 недель, 6 недель, 7 недель, 8 недель, 9 недель, 10 недель, 15 недель, 20 недель, 26 недель, 52 недели, 11-15 недель, 15-20 недель, 20-30 недель, 30-40 недель, 40-50 недель, 1 месяц, 2 месяца, 3 месяца, 4 месяца, 5 месяцев, 6 месяцев, 7 месяцев, 8 месяцев, 9 месяцев, 10 месяцев, 11 месяцев, 12 месяцев, 1 год, 2 года или любой период времени между ними. В определенных аспектах соединение 1 или его фармацевтическая композиция и одно или несколько дополнительных терапевтических средств или дополнительных методов лечения вводятся отдельно менее чем через 1 день, 1 неделю, 2 недели, 3 недели, 4 недели, один месяц, 2 месяца, 3 месяца, 6 месяцев, 1 год, 2 года или 5 лет.
В некоторых аспектах комбинированная терапия, представленная в настоящем документе, включает введение соединения 1 или его фармацевтической композиции ежедневно и введение одного или нескольких дополнительных терапевтических средств или методов лечения раз в неделю, раз в каждые 2 недели, раз в каждые 3 недель, раз в каждые 4 недели, раз в каждый месяц, раз в каждые 2 месяца (например, приблизительно раз в 8 недель), раз в каждые 3 месяца (например, приблизительно раз в 12 недель) или раз в каждые 4 месяца (например, приблизительно раз в 16 недель). В определенных аспектах соединение 1 или его фармацевтическая композиция и одно или несколько дополнительных терапевтических средств или дополнительных методов лечения вводятся субъекту циклически. Цикличная терапия включает введение соединения 1 или его фармацевтической композиции в течение некоторого периода времени с последующим введением одного или нескольких дополнительных терапевтических средств или дополнительных методов лечения в течение некоторого периода времени и повторение этого последовательного введения. В определенных аспектах цикличная терапия также может включать период отдыха, когда соединение 1 или его фармацевтическая композиция или дополнительная терапия не вводится в течение определенного периода времени (например, 2 дня, 3 дня, 4 дня, 5 дней, 6 дней, 7 дней, 1 неделю, 2 недели, 3 недели, 4 недели, 5 недель, 10 недель, 20 недель, 1 месяц, 2 месяца, 3 месяца, 4 месяца, 5 месяцев, 6 месяцев, 7 месяцев, 8 месяцев, 9 месяцев, 10 месяцев, 11 месяцев, 12 месяцев, 2 года или 3 года). В данном аспекте количество циклов введения составляет от 1 до 12 циклов, от 2 до 10 циклов или от 2 до 8 циклов.
В некоторых аспектах способ предотвращения, лечения или облегчения острого миелоидного лейкоза у субъекта, нуждающегося в этом, включает введение соединения 1 или его фармацевтической композиции в качестве единственного средства в течение некоторого периода времени перед введением соединения 1 или его фармацевтической композиции в комбинации с дополнительной терапией. В определенных аспектах способы лечения острого миелоидного лейкоза, представленные в настоящем документе, включают введение дополнительной терапии самой по себе в течение некоторого периода времени перед введением соединения 1 или его фармацевтической композиции в комбинации с дополнительной терапией.
В некоторых аспектах введение соединения 1 или его фармацевтической композиции и одного или нескольких дополнительных терапевтических средств или дополнительных методов лечения в соответствии со способами, представленными в настоящем документе, обладает аддитивным эффектом относительно ведения соединения 1 или его фармацевтической композиции или указанных одного или нескольких дополнительных терапевтических средств или дополнительных методов лечения. В некоторых аспектах введение соединения 1 или его фармацевтической композиции и одной или нескольких дополнительных терапий в соответствии со способами, представленными в настоящем документе, обладает синергическим эффектом относительно введения одного соединения 1 или его фармацевтической композиции или указанной одной или нескольких дополнительно терапий.
Термин «синергический», когда используется в настоящем описании, относится к эффекту введения соединения 1 или его фармацевтической композиции в комбинации с одной или несколькими дополнительными терапиями (например, с дополнительными лекарственными средствами), где комбинация является более эффективной, чем аддитивные эффекты любых двух или нескольких отдельных терапий (например, лекарственных средств).
В конкретном аспекте синергический эффект комбинированной терапии позволяет применять более низкие дозы (т.е., неоптимальные дозы) соединения 1 или его фармацевтической композиции или дополнительной терапии и/или реже вводить субъекту соединение 1, его фармацевтическую композицию или дополнительную терапию.
В определенных аспектах возможность использовать более низкие дозы соединения 1, его фармацевтической композиции или дополнительной терапии и/или реже водить соединение 1, его фармацевтическую композицию или указанную дополнительную терапию снижает токсичность, связанную с введением соединения 1, его фармацевтической композиции или указанной дополнительной терапии, соответственно, без снижения эффективности в лечении острого миелоидного лейкоза соединения 1, его фармацевтической композиции или указанной дополнительной терапии, соответственно.
В некоторых аспектах синергический эффект приводит к повышенной эффективности соединения 1 или его фармацевтической композиции и каждой из указанных дополнительных терапевтических средств или каждого из дополнительных методов лечения в лечении острого миелоидного лейкоза. В некоторых аспектах синергический эффект комбинации соединения 1 или его фармацевтической композиции и одного или нескольких дополнительных терапевтических средств или одного или нескольких дополнительных методов лечения приводит к устранению или снижению неблагоприятных или нежелательных побочных эффектов, связанных с использованием любых отдельных терапевтических средств или методов лечения.
Технический результат изобретения достигается посредством 1) применения соединения 1 формулы (I) в сочетании с соединением формулы (II).
Технический результат изобретения также достигается посредством 1) применения соединения 1 формулы (I) и/или 2) применения соединения 1 формулы (I) в сочетании с химиотерапевтическим средством.
Комбинация соединения 1 или его фармацевтической композиции и одного или нескольких дополнительных терапевтических средств может вводиться субъекту в одной фармацевтической композиции. Альтернативно, соединение 1 или его фармацевтическая композиция и одно или несколько дополнительных терапевтических средств могут вводиться субъекту одновременно в отдельных фармацевтических композициях. Соединение 1 или его фармацевтическая композиция и одно или несколько дополнительных терапевтических средств могут вводиться субъекту последовательно в отдельных фармацевтических композициях. Соединение 1 или его фармацевтическая композиция и одно или несколько дополнительных терапевтических средств также могут вводиться субъекту одним и тем же или разными способами введения.
Комбинированная терапия, представленная в настоящем документе, включает введение субъекту, нуждающемуся в этом, соединения 1 или его фармацевтической композиции в комбинации со стандартными или известными терапевтическими средствами для лечения острого миелоидного лейкоза или с дополнительными методами лечения острого миелоидного лейкоза. Другие терапевтические средства для лечения острого миелоидного лейкоза или состояния, связанного с ним, направлены на контроль или облегчение одного или нескольких симптомов. Соответственно, в некоторых аспектах комбинированная терапия, представленная в настоящем документе, включает введение субъекту, нуждающемуся в этом, обезболивающего лекарственного средства или других терапевтических средств или применение других методов лечения, направленных на облегчение или контроль одного или нескольких симптомов, связанных с острым миелоидным лейкозом, или состояния, связанного с ним.
Конкретные примеры противораковых средств и методов лечения, которые могут использоваться в комбинации с соединением 1 или его фармацевтической композицией для лечения острого миелоидного лейкоза, включают гормональное средство (например, ингибитор ароматазы, селективный модулятор рецепторов эстрогена (selective estrogen receptor modulator - SERM) и антагонист рецепторов эстрогена), химиотерапевтическое средство (например, блокатор «демонтажа» микротрубочек, антиметаболит, ингибитор топизомеразы и ДНК-кросслинкер или ДНК-повреждающее средство), антиангиогенное средство (например, антагонист фактора роста сосудистого эндотелия (VEGF), антагонист рецептора, антагонист интегрина, средство направленного воздействия на сосуды (vascular targeting agent - VTA)/средство разрушения сосудов (disrupting agent - VDA)), лучевую терапию и стандартное хирургическое вмешательство.
Неограничивающие примеры гормональных средств, которые могут использоваться в комбинации с соединением 1 или его фармацевтической композицией для лечения острого миелоидного лейкоза, включают ингибиторы ароматазы, SERM и антагонисты рецепторов эстрогена. Гормональные средства, которые являются ингибиторами ароматазы, могут быть стероидными или нестероидными. Неограничивающие примеры нестероидных гормональных средств включают летрозол, анастрозол, аминоглутетимид, фадрозол и ворозол. Неограничивающие примеры стероидных гормональных средств включают аромазин (эксеместан), форместан и тестолактон. Неограничивающие примеры гормональных средств, которые являются SERM, включают тамоксифен (брендированный/доступный на рынке как Nolvadex®), афимоксифен, арзоксифен, базедоксифен, кломифен, фемарелл, лазофоксифен, ормелоксифен, ралоксифен и торемифен. Неограничивающие примеры гормональные средств, которые являются антагонистами рецепторов эстрогена, включают фулвестрант. Другие гормональные средства включают, но не ограничиваются только ими, абиратерон и лонаприсан.
Неограничивающие примеры химиотерапевтических средств, которые могут использоваться в комбинации с соединением 1 или его фармацевтической композицией для лечения рака, включают блокатор «демонтажа» микротрубочек, антиметаболит, ингибитор топоизомеразы и ДНК-кросслинкер или ДНК-повреждающее средство.
Химиотерапевтические средства, которые являются блокаторами «демонтажа» микротрубочек, включают, но без ограничения только ими, таксены (например, паклитаксел (брендированный/доступный на рынке как TAXOL®), доцетаксел, наб-паклитаксел (брендированный/доступный на рынке как ABRAXANE®), ларотаксел, ортатаксел и тезетаксел); эпотилоны (например, иксабепилон); и винкалкалоиды (например, винорелбин, винбластин, виндезин и винкристин (брендированный/доступный на рынке как ONCOVIN®)).
Химиотерапевтические средства, которые являются антиметаболитами, включают, но без ограничения только ими, фолатные антиметаболиты (например, метотрексат, аминоптерин, пеметрексед, ралтитрексед); пуриновые антиметаболиты (например, кладрибин, клофарабин, флударабин, меркаптопурин, пентостатин, тиогуанин); пиримидиновые антиметаболиты (например, 5-фторурацил, капцитабин, гемцитабин (GEMZAR®), цитарабин, децитабин, флоксуридин, тегафур); и дезоксирибонуклеотидные антиметаболиты (например, гидроксимочевину).
Химиотерапевтические средства, которые являются ингибиторами топоизомеразы, включают, но без ограничения только ими, ингибиторы топоизомеразы I класса (камптотека) (например, топотекан (брендированный/доступный на рынке как HYCAMTIN®), иринотекан, рубитекан и белотекан); ингибиторы топоизомеразы II класса (подофиллум) (например, этопозид или VP-16 и тенипозид); антрациклины (например, доксорубицин, эпирубицин, доксил, акларубицин, амрубицин, даунорубицин, идарубицин, пирарубицин, валрубицин и зорубицин); и антрацендионы (например, митоксантрон и пиксантрон).
Химиотерапевтические средства, которые являются ДНК-кросслинкерами (или ДНК-повреждающими средствами) включают, но без ограничения только ими, алкилирующие средства (например, циклофосфамид, мехлорэтамин, ифосфамид (брендированный/доступный на рынке как IFEX®), трофосфамид, хлорамбуцил, мелфалан, преднимустин, бендамустин, урамустин, эстрамустин, карбустин (брендированный/доступный на рынке как BiCNU®), ломустин, семустин, фотемустин, нимустин, ранимустин, стрептозоцин, бусулфан, манносульфан, треосулфан, карбоквон, N, N'N'-триэтилентиофосфорамид, триазиквон, триэтиленэмеламин); средства, подобные алкилирующим агентам (например, карбоплатин (брендированный/доступный на рынке как PARAPLATIN®), цисплатин, оксалиплатин, недаплатин, триплатина тетранитрат, сатраплатин, пикоплатин); неклассические ДНК-кросслинкеры (например, прокарбазин, дакарбазин, темозоломид (брендированный/доступный на рынке как TEMODAR®), алтретамин, митобронитол); и интеркалирующие средства (например, актиномицин, блеомицин, митомицин и пликамицин).
Неограничивающие примеры антиангиогенных средств, которые могут использоваться в комбинации с соединением 1 или его фармацевтической композицией для лечения острого миелоидного лейкоза, включают VEGF антагонисты, антагонисты рецепторов, антагонисты интегрина (например, витаксин, циленгитид и S247) и VTA/VDA (например, фосбретабулин). VEGF антагонисты включают, но без ограничения только ими, антитела против VEGF (например, бевацизумаб (брендированный/доступный на рынке как AVASTIN®) и ранибизумаб (брендированный/доступный на рынке как LUCENTIS®)), VEGF ловушки (например, афлиберцепт), антисмысловой VEGF или малые интерферирующие РНК или микроРНК и аптамеры (например, пегаптаниб (брендированный/доступный на рынке как MACUGEN®)). Антиангиогенные средства, которые являются антагонистами рецепторов, включают, но без ограничения только ими, антитела (например, рамуцирумаб) и ингибиторы киназ (например, сунитиниб, сорафениб, цедираниб, панзопаниб, вандетаниб, акситиниб и AG-013958), такие как ингибиторы тирозинкиназы. Другие неограничивающие примеры антиангиогенных средств включают ATN-224, анекортава ацетат (брендированный/доступный на рынке как RETAANE®), ингибитор деполимеризации микротрубочек, такой как пролекарство комбретастатина A4 и белок или фрагмент белка, такой как коллаген 18 (эндостатин).
Неограничивающие примеры других терапевтических средств, которые могут вводиться субъекту в комбинации с соединением 1 или его фармацевтической композицией для лечения острого миелоидного лейкоза, включают:
(1) статин, такой как ловостатин (например, брендированный/доступный на рынке как MEVACOR®);
(2) mTOR ингибитор, такой как сиролимус, известный также как рапамицин (например, брендированный/доступный на рынке как RAPAMUNE®), темсиролимус (например, брендированный/доступный на рынке как TORISEL®), эворолимус (например, брендированный/доступный на рынке как AFINITOR®) и дефоролимус;
(3) ингибитор фарнезилтрансферазы, такой как типифарниб (например, брендированный/доступный на рынке как ZARNESTRA®);
(4) антифибротическое средство, такое как пирфенидон;
(5) пегилированный интерферон, такой как ПЭГ-интерферон альфа-2b;
(6) стимулятор ЦНС, такой как метилфенидат (брендированный/доступный на рынке как RITALIN®);
(7) антагонист HER-2, такой как антитело против HER-2 (например, трастузумаб) и ингибитор киназ (например, лапатиниб);
(8) антагонист IGF-1, такой как антитело против IGF-1 (например, AVE1642 и IMC-A11) или ингибитор IGF-1 киназы;
(9) антагонист EGFR/HER-1, такой как антитело против EGFR (например, цетуксимаб, панитумамаб) или ингибитор EGFR киназы (например, эрлотиниб (например, брендированный/доступный на рынке как TARCEVA®), гефитиниб);
(10) SRC антагонист, такой как босутиниб;
(11) ингибитор циклинзависимой киназы (cyclin dependent kinase - CDK), такой как селициклиб;
(12) ингибитор Янус-киназы 2, такой как лестауртиниб;
(13) ингибитор протеасом, такой как бортезомиб;
(14) ингибитор фосфодиэстеразы, такой как анагрелид;
(15) ингибитор инозинмонофосфатдегидрогеназы, такой как тиазофурин;
(16) ингибитор липоксигеназы, такой как масопрокол;
(17) антагонист эндотелина;
(18) антагонист ретиноидного рецептора, такой как третиноин или алитретиноин;
(19) иммуномодулятор, такой как леналидомид, памалидомид или талидомид (например, брендированный/доступный на рынке как THALIDOMID®);
(20) ингибитор киназ (например, тирозинкиназы), такой как иматиниб (например, брендированный/доступный на рынке как GLEEVEC®), дасатиниб, эрлотиниб, нилотиниб, гефитиниб, сорафениб, сунитиниб (например, брендированный/доступный на рынке как SUTENT®), лапатиниб, AEE788 или TG100801;
(21) нестероидное противовоспалительное средство, такое как целекоксиб (брендированный/доступный на рынке как CELEBREX®);
(22) человеческий гранулоцитарный колониестимулирующий фактор (granulocyte colony-stimulating factor - G-CSF), такой как филграстим (брендированный/доступный на рынке как NEUPOGEN®);
(23) фолиновая кислота или лейковорин кальция;
(24) антагонист интегринов, такой как антагонист интегрина α5β1 (например, JSM6427);
(25) антагонист ядерного фактора каппа-бета (NF-κβ), такой как OT-551, который также является антиоксидантом;
(26) ингибитор hedgehog, такой как CUR61414, циклопамин, GDC-0449 или антитело против hedgehog;
(27) ингибитор гистондеацетилазы (histone deacetylase - HDAC), такой как SAHA (известный также как вориностат (брендированный/доступный на рынке как ZOLINZA®)), PCI-24781, SB939, CHR-3996, CRA-024781, ITF2357, JNJ-26481585 или PCI-24781;
(28) ретиноид, такой как изотретиноин (например, брендированный/доступный на рынке как ACCUTANE®);
(29) антагонист фактора роста гепатоцитов/рассеивающего фактора (hepatocyte growth factor/scatter factor - HGF/SF), такой как HGF/SF моноклональное антитело (например, AMG 102);
(30) синтетическое химическое вещество, такое как антинеопластон;
(31) противодиабетическое средство, такое как росиглитазона малеат (например, брендированный/доступный на рынке как AVANDIA®);
(32) противомалярийное и противоамебное средство, такое как хлороквин (например, брендированный/доступный на рынке как ARALEN®);
(33) синтетический брадикинин, такой как RMP-7;
(34) ингибитор рецептора тромбоцитарного фактора роста, такой как SU-101;
(35) ингибиторы рецепторной тирозинкиназы Flk-1/KDR/VEGFR2, FGFR1 и PDGFR бета, такие как SU5416 и SU6668;
(36) противовоспалительное средство, такое как сульфасалазин (например, брендированный/доступный на рынке как AZULFIDINE®); и
(37) TGF-бета антисмысловое терапевтическое средство.
Неограничивающие примеры других терапевтических средств, которые могут вводиться субъекту в комбинации с соединением 1 или его фармацевтической композицией для лечения острого миелоидного лейкоза, включают синтетический нонапептидный аналог природно существующего ганадотропин-высвобождающего гормона, такой как как лейпролида ацетат (брендированный/доступный на рынке как LUPRON®); нестероидный антиандроген, такой как флутамид (брендированный/доступный на рынке как EULEXIN®) или нилутамид (брендированный/доступный на рынке как NILANDRON®); ингибитор нестероидного андрогенного рецептора, такой как бикалутамид (брендированный/доступный на рынке как CASODEX®); стероидный гормон, такой как прогестерон; фунгицидное средство, такое как кетоконазол (брендированный/доступный на рынке как NIZORAL®); глюкокортикоид, такой как преднизон; эстрамустина натрия фосфат (брендированный/доступный на рынке как EMCYT®); и бисфосфонат, такой как памидронат, алендронат и ризедронат.
Дополнительные конкретные примеры терапевтических средств, которые могут использоваться в комбинации с соединением 1 или его фармацевтической композиции для лечения острого миелоидного лейкоза включают, но без ограничения только ими, лекарственные средства, связанные с иммунотерапией рака (например, цитокины, интерлейкины и противораковые вакцины).
Конкретные примеры средств, облегчающих побочные эффекты, связанные с острым миелоидным лейкозом, которые могут использоваться в качестве терапевтических средств в комбинации с соединением 1 или его фармацевтической композицией, включают, но не ограничиваются только ими, антиэметики, например ондансетрона гидрохлорид (брендированный/доступный на рынке как ZOFRAN®), гранисетрона гидрохлорид (брендированный/доступный на рынке как KYTRIL®), лоразепам (брендированный/доступный на рынке как ATIVAN®) и дексаметазон (брендированный/доступный на рынке как DECADRON®).
В определенных аспектах комбинированная терапия, представленная в настоящем документе для лечения острого миелоидного лейкоза, включает введение соединение 1 или его фармацевтической композиции в комбинации с одним или несколькими лекарственными средствами, используемыми для лечения и/или контроля побочного эффекта, такого как кровотечение (обычно преходящее носовое кровотечение легкой степени), артериальный и венозный тромбоз, гипертензия, замедленное заживление ран, бессимптомная протеинурия, перфорация перегородки носа, синдром обратимой задней лейкоэнцефалопатии в сочетании с артериальной гипертензией, головокружение, атаксия, головная боль, охриплость голоса, тошнота, рвота, диарея, сыпь, подногтевое кровоизлияние, миелодиспластические синдромы, миелосупрессия, усталость, гипотиреоз, удлинение интервала QT или сердечная недостаточность.
В определенных аспектах соединение 1 или его фармацевтическая композиция не используется в комбинации с лекарственным средством, которое метаболизируется главным образом CYP2D6 (таким как антидепрессант (например, атрициклический антидепрессант, селективный ингибитор обратного поглощения серотонина и т.п.), антипсихотическое средство, блокатор бета-адренергических рецепторов или антиаритмические средства определенных типов) для лечения острого миелоидного лейкоза.
Наборы
В настоящем документе представлена фармацевтическая упаковка или набор, которые включают один или несколько контейнеров, наполненных соединением 1 или его фармацевтической композицией. Кроме того, в фармацевтическую упаковку или набор также может включаться одно или несколько других терапевтических средств для лечения острого миелоидного лейкоза или другие подходящие лекарственные средства. В настоящем документе также представлена фармацевтическая упаковка или набор, которые включают один или несколько контейнеров, заполненных одним или несколькими ингредиентами фармацевтических композиций, описанных в настоящем документе. К таким наборам необязательно может прилагаться уведомление в форме, предусмотренной государственным агентством, регулирующим производство, применение и продажу фармацевтических или биологических продуктов, подтверждающее регистрацию и разрешение на производство, применения или продажу указанного набора для введения человеку.
Настоящее изобретение будет дополнительно разъяснено со ссылкой на представленные далее неограничивающие конкретные примеры.
ПРИМЕРЫ
ПРИМЕР 1
Иммунодефицитным мышам (NRG-SGM3) вводят инъекцией клеточную линию P31-Fujioka. Через десять дней после инъекции приживление клеток P31 подтверждают проточно-цитометрическим анализом на содержание маркера человека CD45 (данные не показаны). Одной группе мышей перорально вводят соединение 1, а другой группе, соответствующей по возрасту и степени приживления первой группе, вводят контрольный разбавитель. Результаты представлены на фигуре 1, где показаны кривые выживаемости мышей, получающих в качестве лечения соединение 1, относительно мышей, получающих в качестве лечения контрольный разбавитель (n=5 мышей в группе, *P<0,002). Полученные результаты показывают, что лечение соединением 1 значительно пролонгирует скрытый период заболевания у мышей по сравнению с контролем.
ПРИМЕР 2
Представленное далее исследование проводят на мышиной модели острого миелоидного лейкоза (ОМЛ), полученной внутривенной (IV) инъекции клеток MOLT-4-ОМЛ человека самцам мышей с диабетом без ожирения (non-obese diabetic - NOD) с тяжелым комбинированным иммунодфицитом (severe combined immunodeficiency - SID). Клетки MOLT-4 являются CD30-положительными. Мышей NOD-SCID получают из лаборатории Джексона (Jackson Laboratory, Bar Harbor Maine).
Самцам мышей NOD-SCID инокулируют опухолевые клетки ОМЛ человека MOLM13 из ATCC (5 × 106 клеток в 200 мкл PBS) внутривенной (IV) инъекцией 0,2 мл/мышь. Через три дня после инокуляции опухоли мышей рандомизируют на четыре группы по пять мышей в каждой группе и каждой группе один раз в день вводят следующие дозы: (группа 1) пероральное введение разбавителя (0,5% HPMC), (группа 2) пероральное введение 12,5 мг/кг соединения 1 в HPMC, (группа 3) пероральное введение 10 мг/кг соединения 2 в HPMC, (группа 4) пероральное введение комбинации 12,5 мг/кг соединения 1 и 10 мг/кг соединения 2 в HPMC в течение до 75 дней.
Результаты исследования представлены на фигурах 2-5. На фигуре 2 представлено изменение массы тела в процентах мышей групп 1 и 2 (разбавитель относительно соединения 1) после 75 дней лечения, а на фигуре 3 представлены кривые выживаемости для этих же двух групп мышей. Результаты показывают значительное увеличение продолжительности жизни животных, получающих соединение 1, по сравнению с животными, получающими разбавитель. На фигуре 4 представлено изменение массы тела в процентах животных всех четырех исследованных групп, а на фигуре 5 представлены кривые выживаемости для всех четырех групп мышей. Период выживания мышей, получающих соединение 1 отдельно или в комбинации с соединением 2, значительно превосходит период выживания мышей, получающих только соединение 2.
ПРИМЕР 3
Самцам NOD-SCID мышей инокулируют клетки MOLT опухоли острого лимфобластного лейкоза (acute lymphoblastic leukemia - ALL) человека из ATCC (1 × 107 клеток в 200 мкл PBS) внутривенной (IV) инъекцией 0,2 мл/мышь. Через семь дней после инокуляции опухоли мышей рандомизируют на семь групп по пять мышей в каждой группе и каждой группе вводят следующие дозы: (группа 1) пероральное введение раз в день разбавителя, содержащего 0,5% HPMC и 0,1% Tween 80, (группа 2) пероральное введение два раза в неделю 10 мг/кг соединения 1, (группа 3) пероральное введение раз в день 10 мг/кг соединения 2, (группа 4) введение 1 мг/кг доксорубицина интраперитонеальной (IP) инъекцией раз в неделю, (группа 5) введение 0,5 мг/кг доксорубицина IP инъекцией раз в неделю, (группа 6) введение 50 мг/кг цитарабина два раза в неделю IP инъекцией, и (группа 7) введение 70 мг/кг цитарабина IP инъекцией раз в неделю.
Полученные в данном исследовании кривые выживаемости семи групп мышей представлены на фигуре 6. Как показано на фигуре 6, максимальное количество дней выживания каждой группы мышей является следующим: группа 1 (разбавитель) 70 дней, группа 2 (соединение 1) 65 дней, группа 3 (соединение 2) 160 дней, группа 4 (доксорубицин, 1,0, раз в неделю) 40 дней, группа 5 (доксорубицин, 0,5, раз в неделю) 40 дней, группа 6 (цитарабин, 50, два раза в неделю) 65 дней, и группа 7 (цитарабин, 70, раз в неделю) 70 дней.
Независимо от того, был ли документ, упомянутый в настоящем документе, конкретно и индивидуально указан как включенный посредством ссылки, все документы, упомянутые в настоящем документе, включены в настоящее описание в виде ссылки для любых и всех целей в такой же степени, как если бы каждая отдельная ссылка была полностью введена в настоящий документ.
Специалистам в данной области техники, располагающим полным описанием предмета формулы изобретения, будет понятно, что изобретение можно осуществлять в широком диапазоне эквивалентных условий, не затрагивая объем заявленного предмета изобретения или аспектов, описанных в данном документе. Подразумевается, что прилагаемая формула изобретения должна интерпретироваться как включающая все такие эквиваленты.
| название | год | авторы | номер документа |
|---|---|---|---|
| КОНЪЮГАТЫ ЦИТАРАБИНА ДЛЯ ЛЕЧЕНИЯ РАКА | 2016 |
|
RU2708672C1 |
| КОМПОЗИЦИИ ФОРБОЛОВЫХ ЭФИРОВ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ ДЛЯ ЛЕЧЕНИЯ ИЛИ УМЕНЬШЕНИЯ ПРОДОЛЖИТЕЛЬНОСТИ ЦИТОПЕНИИ | 2015 |
|
RU2730998C2 |
| СОЛИ КОНЪЮГАТОВ ДЛЯ ЛЕЧЕНИЯ РАКА | 2016 |
|
RU2747528C2 |
| ФАРМАЦЕВТИЧЕСКОЕ СОЕДИНЕНИЕ | 2018 |
|
RU2786994C2 |
| СПОСОБЫ ЛЕЧЕНИЯ ЛЕЙКОПЕНИИ И ТРОМБОЦИТОПЕНИИ | 2015 |
|
RU2702122C2 |
| НОВЫЙ ПОДХОД К ЛЕЧЕНИЮ РАКА С ПРИМЕНЕНИЕМ ИММУНОМОДУЛЯЦИИ | 2016 |
|
RU2817047C2 |
| ТВЕРДЫЕ ФОРМЫ СОЕДИНЕНИЯ, МОДУЛИРУЮЩЕГО КИНАЗЫ | 2016 |
|
RU2730506C2 |
| ИСПОЛЬЗОВАНИЕ СОЕДИНЕНИЙ ПРИ ЛЕЧЕНИИ ГРИБКОВЫХ ИНФЕКЦИЙ | 2021 |
|
RU2805930C1 |
| СПОСОБЫ ЛЕЧЕНИЯ ЗАБОЛЕВАНИЙ И НАРУШЕНИЙ, СВЯЗАННЫХ С LSD1, ИНГИБИТОРАМИ LSD1 | 2020 |
|
RU2826217C1 |
| КОМБИНАЦИЯ ИНОТУЗУМАБА ОЗОГАМИЦИНА И ТОРИЗЕЛА ДЛЯ ЛЕЧЕНИЯ РАКА | 2012 |
|
RU2607594C2 |
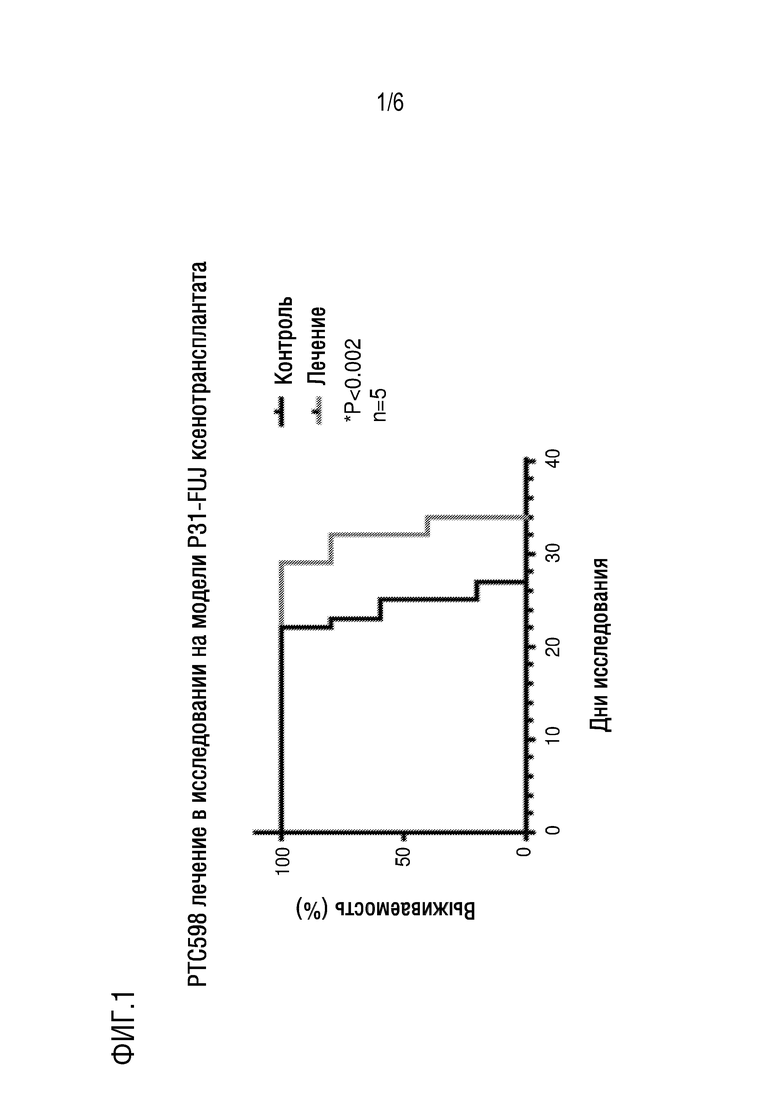
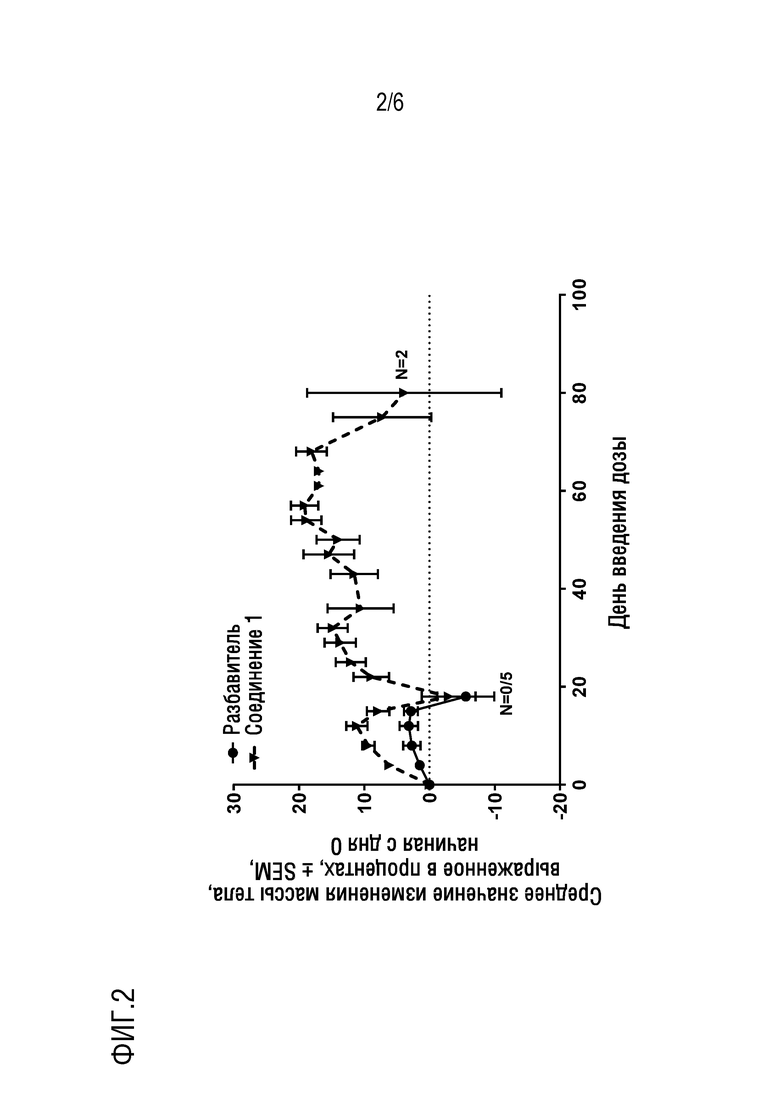
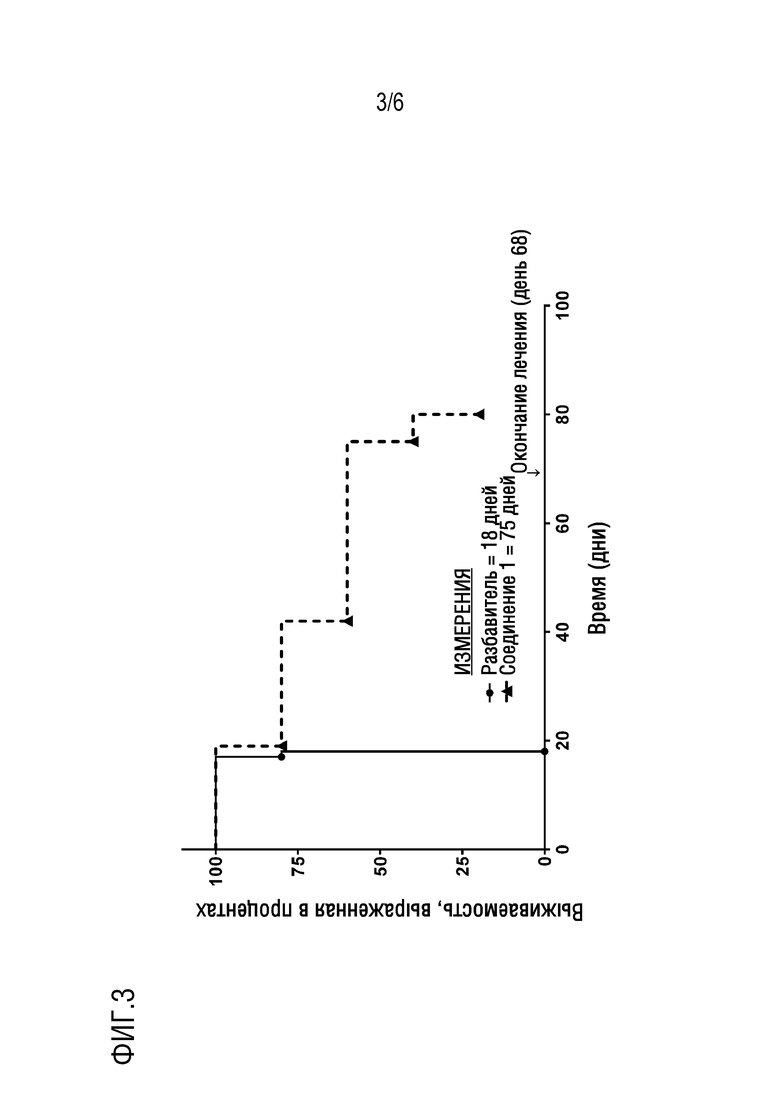
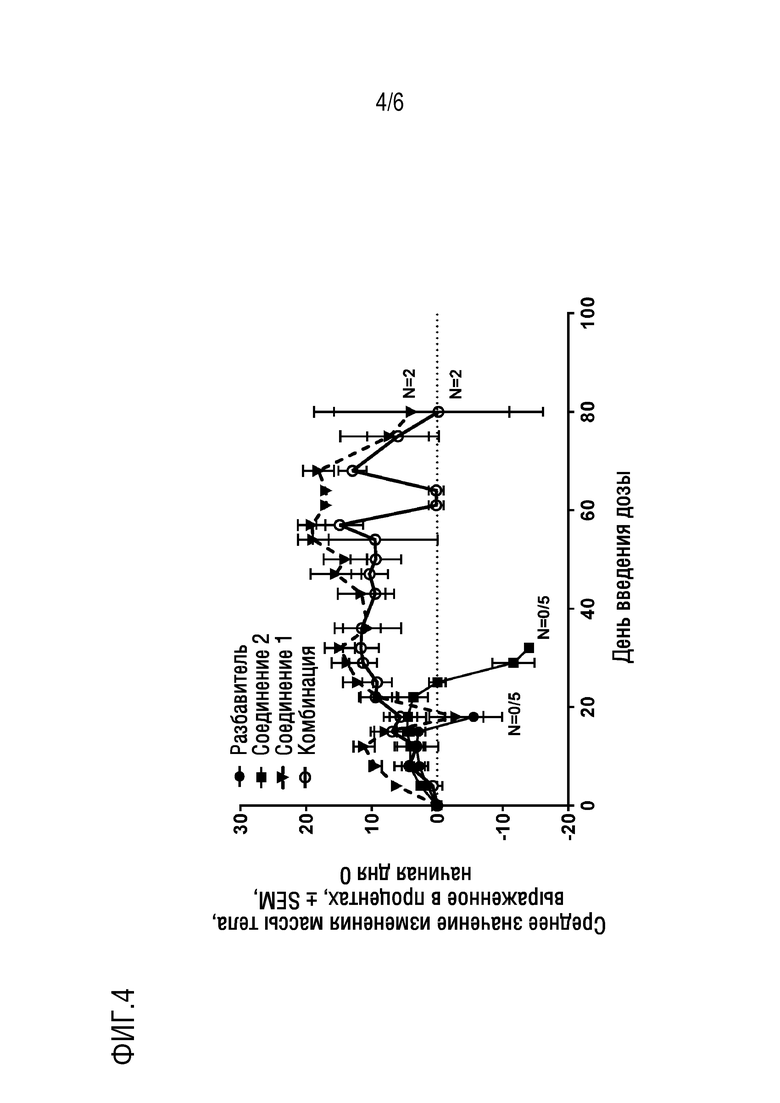
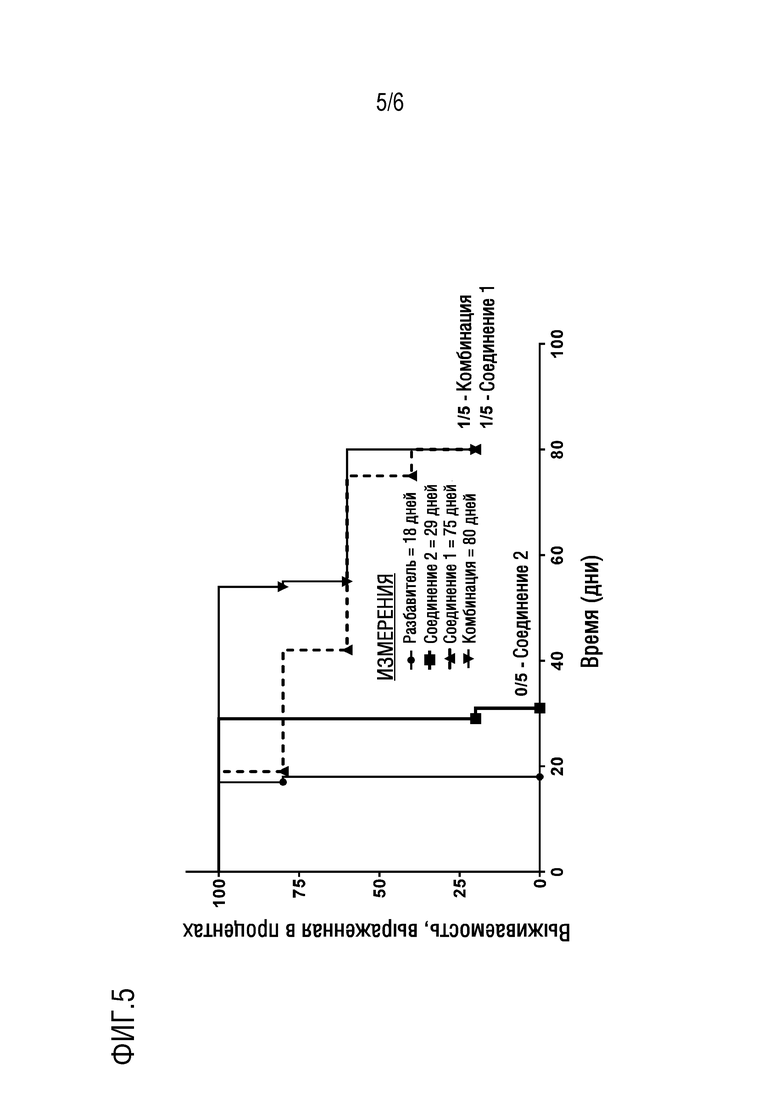
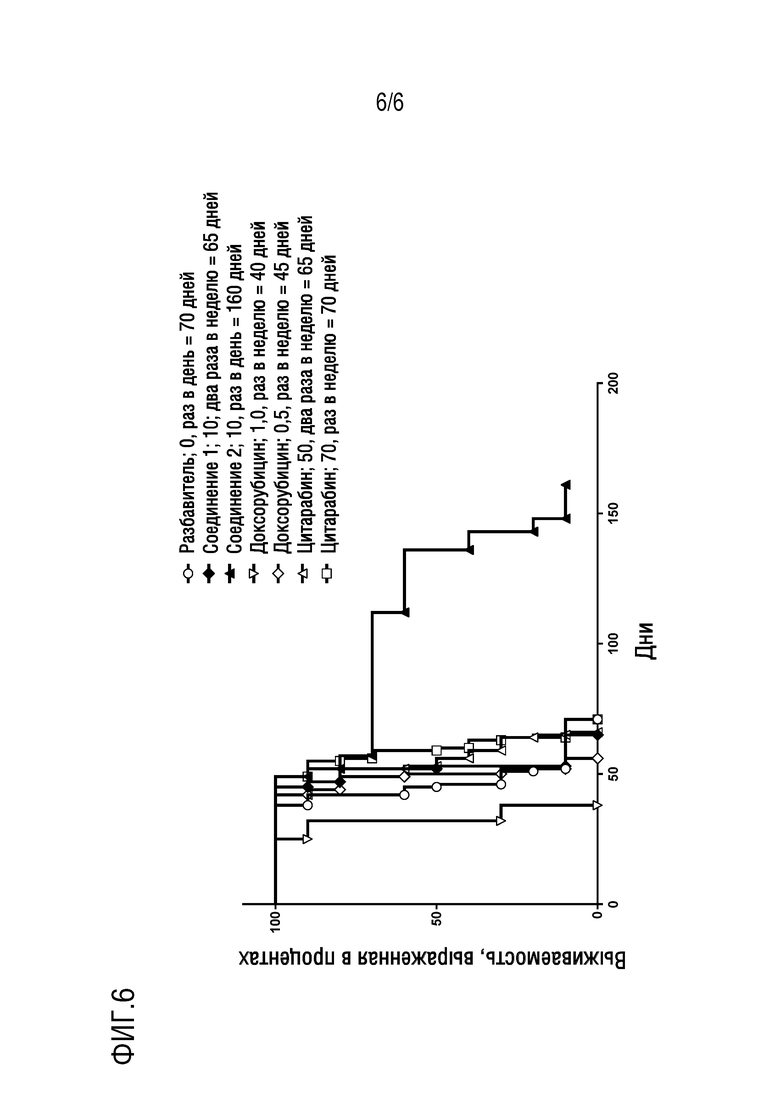
Изобретение относится к области медицины, а именно к способу лечения острого миелоидного лейкоза. Способ лечения острого миелоидного лейкоза у субъекта, нуждающегося в этом, включает введение субъекту эффективного количества 5-фтор-2-(6-фтор-2-метил-1H-бензо[d]имидазол-1-ил)-N4-[4-(трифторметил)фенил]пиримидин-4,6-диамина, структура которого представлена формулой (I):
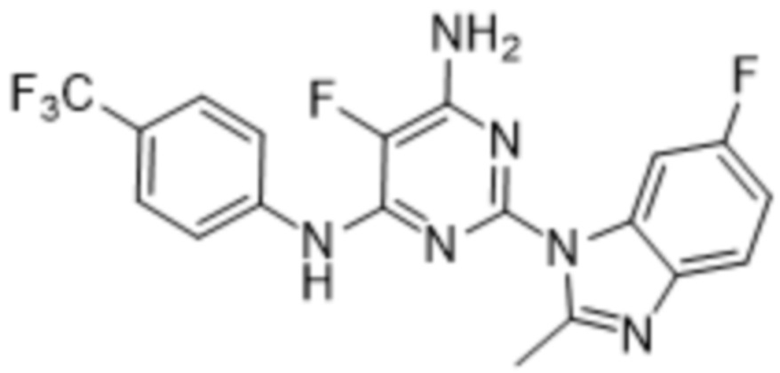
Формула (I)
или его фармацевтически приемлемой соли или его фармацевтической композиции, где эффективное количество достигает средней концентрации в плазме в течение 24 часов от 3 час*мкг/мл до 70 час*мкг/мл. Вышеописанное изобретение позволяет лечить острый миелоидный лейкоз у субъекта, нуждающегося в этом, путём введения субъекту эффективного количества соединения, представленного формулой (I). 9 з.п. ф-лы, 6 ил., 3 пр.
1. Способ лечения острого миелоидного лейкоза у субъекта, нуждающегося в этом, включающий введение субъекту эффективного количества 5-фтор-2-(6-фтор-2-метил-1H-бензо[d]имидазол-1-ил)-N4-[4-(трифторметил)фенил]пиримидин-4,6-диамина, структура которого представлена формулой (I):
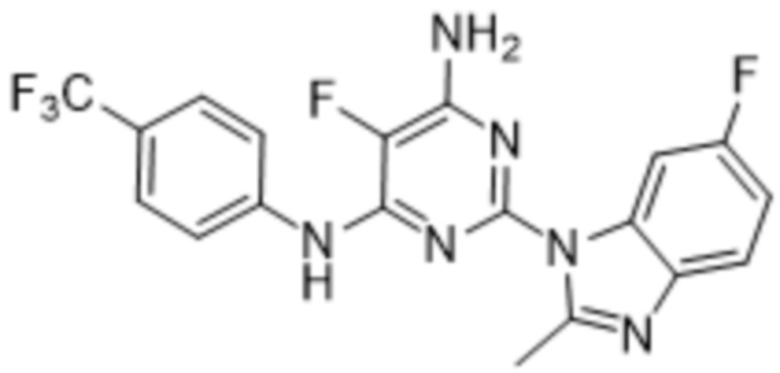
Формула (I)
или его фармацевтически приемлемой соли или его фармацевтической композиции, где эффективное количество достигает средней концентрации в плазме в течение 24 часов от 3 час*мкг/мл до 70 час*мкг/мл.
2. Способ по п.1, в котором острый миелоидный лейкоз представляет собой острый миелоидный лейкоз, опосредованный CALM-AF10.
3. Способ по п.1, дополнительно включающий введение субъекту эффективного количества одного или нескольких химиотерапевтических средств в комбинации с эффективным количеством 5-фтор-2-(6-фтор-2-метил-1H-бензо[d]имидазол-1-ил)-N4-[4-(трифторметил)фенил]пиримидин-4,6-диамина или его фармацевтически приемлемой соли.
4. Способ по п.3, в котором одно или несколько химиотерапевтических средств представляет собой 4-хлорфенил-(S)-6-хлор-1-(4-метоксифенил)-1,3,4,9-тетрагидро-2Н-пиридо[3,4-b]индол-2-карбоксилат, структура которого представлена формулой (II):
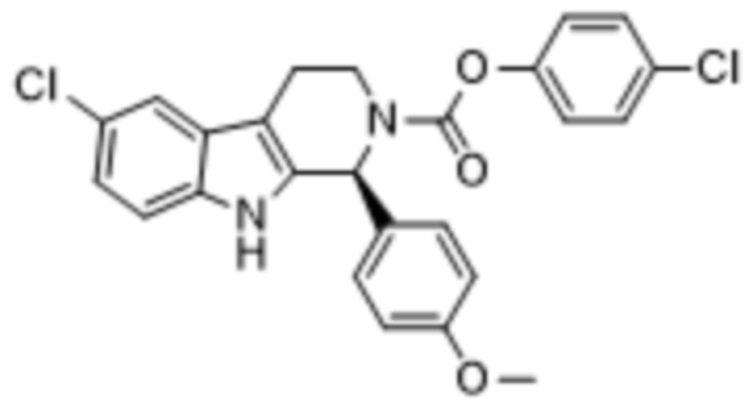 (II).
(II).
5. Способ по п.1, где эффективное количество достигает средней концентрации в плазме в течение 24 часов от 3 час*мкг/мл до 60 час*мкг/мл.
6. Способ по п.1, где эффективное количество достигает средней концентрации в плазме в течение 24 часов от 3 час*мкг/мл до 50 час*мкг/мл.
7. Способ по п.1, где эффективное количество достигает средней концентрации в плазме в течение 24 часов от 3 час*мкг/мл до 40 час*мкг/мл.
8. Способ по п.1, где эффективное количество достигает средней концентрации в плазме в течение 24 часов от 3 час*мкг/мл до 30 час*мкг/мл.
9. Способ по п.1, где эффективное количество достигает средней концентрации в плазме в течение 24 часов от 3 час*мкг/мл до 20 час*мкг/мл.
10. Способ по п.1, где эффективное количество достигает средней концентрации в плазме в течение 24 часов от 3 час*мкг/мл до 10 час*мкг/мл.
| WO 2014081906 A3, 17.07.2014 | |||
| CAUDELL D, APLAN P.D., The role of CALM-AF10 gene fusion in acute leukemia // Leukemia | |||
| Станок для изготовления деревянных ниточных катушек из цилиндрических, снабженных осевым отверстием, заготовок | 1923 |
|
SU2008A1 |
| LIANGXIAN CAO et al, PTC299 Is a Novel DHODH Inhibitor That Modulates VEGFA mRNA Translation and Inhibits Proliferation of a Broad Range of Leukemia Cells // Blood, Vol | |||
| Реверсивный дисковый культиватор для тросовой тяги | 1923 |
|
SU130A1 |
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
Авторы
Даты
2024-02-02—Публикация
2020-01-15—Подача