Изобретение относится к области тканевой инженерии и онкохирургии. Представлен способ оценки возможного рецидива рака поджелудочной железы в окружающие опухоль ткани после ее резекции, в том числе при использовании методов локальной деструкции (например, радиочастотная абляция (РЧА)), путем заселения децеллюляризированного матрикса опухолевого микроокружения пограничной зоны и/или зоны по линии резекции (в пределах здоровой ткани) и/или периопухолевой ткани опухолевыми клетками постоянной линии, полученной из карциномы экзокринной части поджелудочной железы человека (PANC-1, коллекция АТСС), или опухолевыми клетками поджелудочной железы, полученными из первичного материала при резекции (далее - клетками из первичного материала), заключающийся в том, что зону опухолевого микроокружения децеллюляризируют путем последовательной обработки раствором 100 мМ ЭДТА-Na2/10 мМ NaOH в дистиллированной воде в течение суток, 1% водного раствора Triton Х-100 в течение суток, 4.2 мМ раствора хлорида магния, содержащего 20 μg/ml ДНКазы в течение 2-3 часов, промывают эффективным количеством раствора фосфатно-солевого буфера, содержащим смесь антибиотиков - 300 МЕ/мл пенициллина, 300 МЕ/мл стрептомицина и 75 мкг/мл амфотерицина в течение 1 часа, стерилизуют путем погружения в 70% этиловый спирт и последующего воздействия ультрафиолета (УФ) в течение 15-20 мин и заселяют клетками линии PANC-1 или клетками из первичного материала, способными к прикреплению, инвазии и злокачественному новообразованию в измененном опухолью матриксе, что демонстрирует возможность рецидива опухоли. Изобретение позволяет оценить участие внеклеточного матрикса опухолевого микроокружения пограничной зоны и/или зоны по линии резекции и/или периопухолевой ткани в прогрессировании рака и в контроле свойств покоящихся опухолевых клеток, а также уточнить расстояние от края опухоли, нивелирующее риск локального рецидива (продолженного роста) опухоли в области операции.
Объект настоящего изобретения имеет отношение к дисциплинам тканевой инженерии, регенеративной медицины и онкохирургии, объединяющей методы биоинженерии с принципами наук о жизни для понимания структурных и функциональных связей в нормальных и патологических тканях млекопитающих. Децеллюляризация определяется как эффективное удаление всего клеточного и ядерного содержимого без отрицательного влияния на состав внеклеточного матрикса (Badylak et al. 2009). Сохранение этой наноструктурированной среды и сетчатой структуры из волокнистых и адгезивных белков обеспечивает закрепление клеток и регулирует будущую клеточную активность (Galler et al. 2011). Создание бесклеточного каркаса опухолевого микроокружения из тканей пограничной зоны и/или зоны по линии резекции и/или периопухолевой ткани, способного привлекать и поддерживать рост и пролиферацию опухолевых клеток, является возможным направлением для прогнозирования возможного локального рецидива (продолженного роста) злокачественного новообразования после его резекции, в том числе при использовании методов локальной деструкции (например, РЧА).
Учитывая позднюю выявляемость заболевания, преобладание нерезектабельных и генерализованных форм в структуре заболеваемости раком поджелудочной железы на первый план выходят минимально инвазивные методы локальной деструкции. Спектр методов и способов локальной деструкции первичных и метастатических опухолей в настоящее время достаточно широк и включает в себя как гипертермические (РЧА, микроволновая абляция (МВА), лазерная и ультразвуковая абляция), гипотермические (криодеструкция) и нетермические (необратимая электропорация, фотодинамическая абляция). У каждого из перечисленных методов есть свои преимущества и недостатки, но среди основных задач фигурирует создание достаточного по площади участка воздействия на ткань, для обеспечения высокой вероятности гибели клеток как внутри зоны абляции, так и по ее периферии. Одним из ограничений перечисленных методик является относительно малая зона, обеспечивающая полную девитализацию ткани. Для устранения этого недостатка, увеличения потенциальной площади воздействия и достижения морфологически чистого края с целью исключения рецидива / продолженного роста в зоне абляции применяют различные способы, к которым относят: увеличение числа электродов, повторное воздействие при смене локации активных электродов в зоне абляции, многократное перекрытие полей между парами электродов, увеличения интенсивности и кратности воздействия циклическим нагреванием и другие. Изучение области перехода от некротической (апоптотической, в зависимости от применяемой методики) зоны полной девитализации ткани к зоне парабиотических изменений, где потенциально возможно выживание опухолевых клеток, является актуальным для решения проблемы определения адекватного объема обрабатываемого массива опухоли и периопухолевой ткани, что позволит предотвратить продолженный рост опухоли в зоне воздействия, повысив радикальность лечебной процедуры.
Определение границ резекции и достаточности объема тканей, подвергаемых локальной деструкции, является актуальным вопросом хирургического лечения злокачественных опухолей. В настоящее время используется ряд методов интраоперационной визуализации краев резекции органа после удаления опухоли. Применяются современные волновые системы различного диапазона, позволяющие быстро сканировать большие поверхности с клеточной и молекулярной чувствительностью. К таким методам относят: (1) радиочастотную спектроскопию, позволяющую определить, является ли исследуемый образец злокачественным или доброкачественным, система «MarginProb» (Dune Medical Devices, Кесария, Израиль, одобрена FDA), точность датчика сопоставима со стандартным гистологическим исследованием, однако имеет серьезные недостатки в виде низкой чувствительности 70% и специфичности 70%, охватывает малую точечную площадь зоны исследования, под руководством пользователя (врача); (2) биоимпедансную спектроскопию резецированной ткани (устройство ClearEdge), чувствительность от 84.3% до 87.3%, специфичность от 75.6% до 81.9%. Кроме того, разрабатываются такие методики как визуализация в пространственно-частотной области (SFDI); флюоресцентная визуализация; спектроскопия диффузного отражения; микроскопия с УФ-возбуждением поверхности (MUSE). Перечисленные методы демонстрируют значительные положительные результаты в выборочных исследованиях, но многие требуют дальнейшей разработки и оптимизации применения в интраоперационных условиях и на этом основании не лишены недостатков. Точная идентификация состояния края при хирургической резекции имеет решающее значение, поскольку это имеет значительную прогностическую ценность и позволяет выбрать тех пациентов, которым адъювантная терапия принесет наибольшую пользу.
Поскольку одним из важных патофизиологических признаков аденокарцином поджелудочной железы является развитие интенсивной десмопластической реакции ( et al., 2014), в результате которой компоненты стромы могут способствовать прогрессированию роста опухоли, одним из наиболее перспективных подходов к решению заявленной проблемы - оценке возможного рецидива/продолженного роста опухоли в зоне резекции и повышения радикальности лечебной процедуры - представляется разработка способа морфологической оценки изменения края резекции.
et al., 2014), в результате которой компоненты стромы могут способствовать прогрессированию роста опухоли, одним из наиболее перспективных подходов к решению заявленной проблемы - оценке возможного рецидива/продолженного роста опухоли в зоне резекции и повышения радикальности лечебной процедуры - представляется разработка способа морфологической оценки изменения края резекции.
Для решения данной проблемы заявителями разработан способ прогнозирования возможного рецидива протоковой аденокарциномы поджелудочной железы после ее резекции, который заключается в том, что бесклеточный каркас опухолевого микроокружения из тканей пограничной зоны и/или зоны по линии резекции и/или периопухолевой ткани, полученных после резекции злокачественного новообразования поджелудочной железы, в том числе при использовании методов локальной деструкции (например, радиочастотная абляция (РЧА)), получают путем децеллюляризации тканей опухолевого микроокружения пограничной зоны и/или зоны по линии резекции и/или периопухолевой ткани последовательной их обработки раствором 100 мМ ЭДТА-Na2/10 мМ NaOH в дистиллированной воде в течение суток, 1% водного раствора Triton Х-100 в течение суток, 4.2 мМ раствора хлорида магния, содержащего 20 μg/ml ДНКазы в течение 2-3 часов, промывают эффективным количеством раствора фосфатно-солевого буфера, содержащим смесь антибиотиков - 300 МЕ/мл пенициллина, 300 МЕ/мл стрептомицина и 75 мкг/мл амфотерицина в течение 1 часа, затем стерилизуют путем погружения в 70% этиловый спирт и последующего воздействия УФ в течение 15-20 мин и заселяют культивированными клетками линии PANC-1 или опухолевыми клетками, полученными из зоны злокачественного новообразования поджелудочной железы после ее резекции (клетками из первичного материала) путем последовательной обработки, при которой биоптат опухолевой ткани промывают эффективным количеством раствора Хэнкса, измельчают ножницами и скальпелем до кусочков размером 1-3 мм3, которые помещают в раствор коллагеназы II типа 100 U/мл, приготовленного на культуральной среде DMEM/F12 (1:1), дополненной 5% эмбриональной телячьей сывороткой и антибиотиками, и инкубируют при 37°С в течение 16-18 часов, затем раствор с кусочками ткани интенсивно пипетируют и центрифугируют в течение 5-7 мин при 600-800 об/мин, затем клетки ресуспендируют в питательной среде, состоящей из культуральной среды DMEM/F12 (1:1), дополненной 10% эмбриональной телячьей сыворотки, 1%-ного раствора GlutaMax и антибиотиков, и после пипетирования распределяют в культуральных флаконах без покрытия и культивируют при температуре 37°С и 5% СО2, через 5-7 суток проводят первую смену среды и продолжают культивировать со сменой среды через 2-3 суток до достижения клетками конфлюэнтного монослоя и образования первичной культуры, затем проводят пассирование клеток первичной культуры, используя раствор трипсина- версена (1:5), далее клетки помещают в культуральные флаконы в плотности 1-2×104 кл./см2 и культивируют до 2-ого пассажа в виде адгезивных монослойных культур, далее клетки снимают с культуральной поверхности раствором трипсина-версена (1:5) и в виде суспензии направляют на заселение бесклеточного каркаса опухолевого микроокружения пограничной зоны и/или зоны по линии резекции и/или периопухолевой ткани, причем бесклеточный каркас опухолевого микроокружения пограничной зоны и/или зоны по линии резекции и/или периопухолевой ткани перед заселением промывают в культуральной среде DMEM/F12 (1:1) с антибиотиками, переносят в лунку 6 луночного культурального планшета и заливают культуральной средой DMEM/F12 (1:1), дополненной 10% эмбриональной телячьей сыворотки, 1%-ного раствора GlutaMax и антибиотиков, а заселение бесклеточного каркаса опухолевого микроокружения пограничной зоны и/или зоны по линии резекции и/или периопухолевой ткани осуществляют посредством диффузионного осаждения суспензии культивированных опухолевых клеток поджелудочной железы в плотности 4-5.5×104 кл./см2 в культуральной среде того же состава и культивируют при температуре 37°С и 5% СО2, со сменой среды через 2-3 суток в течение 14 суток, затем кокультивированные бесклеточные каркасы опухолевого микроокружения пограничной зоны и/или зоны по линии резекции и/или периопухолевой ткани с опухолевыми клетками поджелудочной железы направляют на гистологическое изучение наличия прикрепления и локализации культивируемых опухолевых клеток в бесклеточном каркасе опухолевого микроокружения пограничной зоны и/или зоны по линии резекции и/или периопухолевой ткани.
Техническим результатом данного изобретения является определение адгезии опухолевых клеток к поверхности децеллюляризированного матрикса и его инвазия, что способствует диагностике опухолевого роста и свидетельствует о локальном рецидиве опухоли.
Ниже приводится обоснование для осуществления настоящего изобретения.
В предпочтительном способе изобретения для локальной деструкции опухолевой ткани используют гипертермический метод (например, РЧА), что минимизирует инвазивность оперативного вмешательства.
В предпочтительном способе изобретения для формирования бесклеточного каркаса опухолевого микроокружения тканей пограничной зоны и/или зоны по линии резекции и/или периопухолевой ткани поверхность бесклеточного каркаса засевается клетками и культивируется для прикрепления опухолевых клеток к поверхности децеллюляризированного матрикса и его инвазии, что способствует диагностике опухолевого роста и свидетельствует о локальном рецидиве опухоли. В данном способе бесклеточный каркас опухолевого микроокружения тканей пограничной зоны и/или зоны по линии резекции и/или периопухолевой ткани заселен культивированными опухолевыми клетками из первичного материала или линии PANC-1 в условиях, достаточных для их прикрепления и роста.
Таким образом, способ оценки возможного рецидива рака поджелудочной железы в окружающей опухоль ткани существующего изобретения включает: (а) децеллюляризацию окружающей опухоль ткани, содержащей компоненты матрикса; (b) культивирование одного типа клеток (опухолевых клеток поджелудочной железы, полученных из первичного материала или линии PANC-1) для увеличения их количества; (с) кокультивирование клеток стадии (b) на децеллюляризированном матриксе окружающей опухоль ткани стадии (а) с целью прикрепления клеток к каркасу, его инвазии, росту и пролиферации, в котором стадии (а) и (b) могут осуществляться одновременно или последовательно.
Осуществление изобретения проиллюстрировано, но не ограничено, следующими примерами.
Пример 1. Забор и децеллюляризация тканей опухолевого микроокружения пограничной зоны и/или зоны по линии резекции и/или периопухолевой ткани рака поджелудочной железы человека.
Из пограничной зоны и/или зоны по линии резекции и/или периопухолевой ткани удаляемого по медицинским показаниям злокачественного новообразования поджелудочной железы скальпелем и пинцетом вырезают кусочек ткани (биоптат) размером до 5 мм3 для проведения децеллюляризации.
Децеллюляризация тканей опухолевого микроокружения пограничной зоны и/или зоны по линии резекции и/или периопухолевой ткани поджелудочной железы человека означает удаление клеток из ткани таким образом, что клетки и остатки клеток удаляются из ткани с целью получения внеклеточного матрикса без клеток, которые его произвели. В данном способе изобретения для децеллюляризации тканей опухолевого микроокружения пограничной зоны и/или зоны по линии резекции и/или периопухолевой ткани используется ряд химических воздействий для удаления клеток, остатков клеток и остаточных клеточных ДНК и РНК. Биоптат опухолевого микроокружения пограничной зоны и/или зоны по линии резекции и/или периопухолевой ткани сначала разрезают на полоски толщиной до 1 мм3, затем обрабатывают их контактированием с эффективным количеством хелатирующего агента, предпочтительно физиологически щелочного для контролируемо ограниченного набухания ткани. Хелатирующие агенты усиливают удаление клеток, клеточного детрита и структур базальной мембраны из ткани, уменьшая концентрацию двухвалентных катионов. Хелатирующий агент, этилендиаминтетрауксусная кислота (ЭДТА) и его натриевая соль ЭДТА-Na2 представляют собой предпочтительные хелатирующие агенты и могут быть сделаны более щелочными посредством добавления гидроксида натрия (NaOH). Концентрации ЭДТА или ЭДТА-Na2 предпочтительно находятся в диапазоне от приблизительно 50 до приблизительно 150 мМ. Предпочтительная концентрация NaOH находится в диапазоне от 0.001 до 0.10 М, наиболее предпочтительно приблизительно 0.01 М. Конечный рН основного хелатирующего раствора должен быть предпочтительно от приблизительно 11.1 до 11.8. В наиболее предпочтительном варианте ткань контактирует с раствором 100 мМ ЭДТА-Na2/10 мМ NaOH в дистиллированной воде. Ткань контактирует с щелочным хелатирующим агентом путем погружения в него, однако более эффективная обработка получается нежным взбалтыванием кусочков ткани и раствора вместе в течение эффективного для обработки времени (в течение суток). Для дополнительного разрушения мембран и солюбилизации мембранных белков и экстракции ДНК используется 1% водный раствор Triton Х-100 в течение суток. Конечный рН раствора, содержащего поверхностно-активное вещество, должен быть предпочтительно от приблизительно 7.1 до 8.0.
Кроме того, ткань контактирует с эффективным количеством кислого раствора, предпочтительно содержащего соли для удаления нуклеиновых кислот, таких как ДНК и РНК. Соли, которые могут использоваться, являются предпочтительно неорганическими хлористыми солями, такими как хлорид натрия (NaCl) или хлорид магния (MgCl2). Предпочтительно хлориды используются в концентрации от приблизительно 1 до приблизительно 5 мМ, наиболее предпочтительно от 3.75 до приблизительно 4.5 мМ. В способе изобретения использован 4.2 мМ хлорид магния (MgCl2), содержащий раствор ДНКазы (20 μg/ml). Ткань контактирует предпочтительно погружением в кислотный/солевой раствор, при этом эффективная обработка достигается при осторожном взбалтывании кусочков ткани вместе с раствором в течение времени, эффективного для обработки (2-3 часа).
Кроме того, кусочки ткани промывают эффективным количеством раствора фосфатно-солевого буфера, который предпочтительно буферизован до приблизительно физиологического рН. Буферный раствор соли нейтрализует материал, в то же время уменьшая его набухание. Кусочки ткани погружают в буферный раствор, при этом эффективная обработка достигается при осторожном взбалтывании конструкта вместе с раствором в течение времени, эффективного для обработки (в течение 1 часа).
После химической очистки кусочки ткани ополаскиваются фосфатно-солевым буфером, содержащим антибиотики (300 МЕ/мл пенициллина+300 МЕ/мл стрептомицина+75 мкг/мл амфотерицина В) в течение 1 часа и хранятся в свежей порции фосфатно-солевого буфера с антибиотиками при -70°С.
Результат децеллюляризации матрикса кусочков ткани опухолевого микроокружения пограничной зоны и/или зоны по линии резекции и/или периопухолевой ткани представляет собой эндогенно продуцированный внеклеточный матрикс, продуцированный клетками поджелудочной железы или опухоли, которые были децеллюляризированы от клеток, которые его произвели.
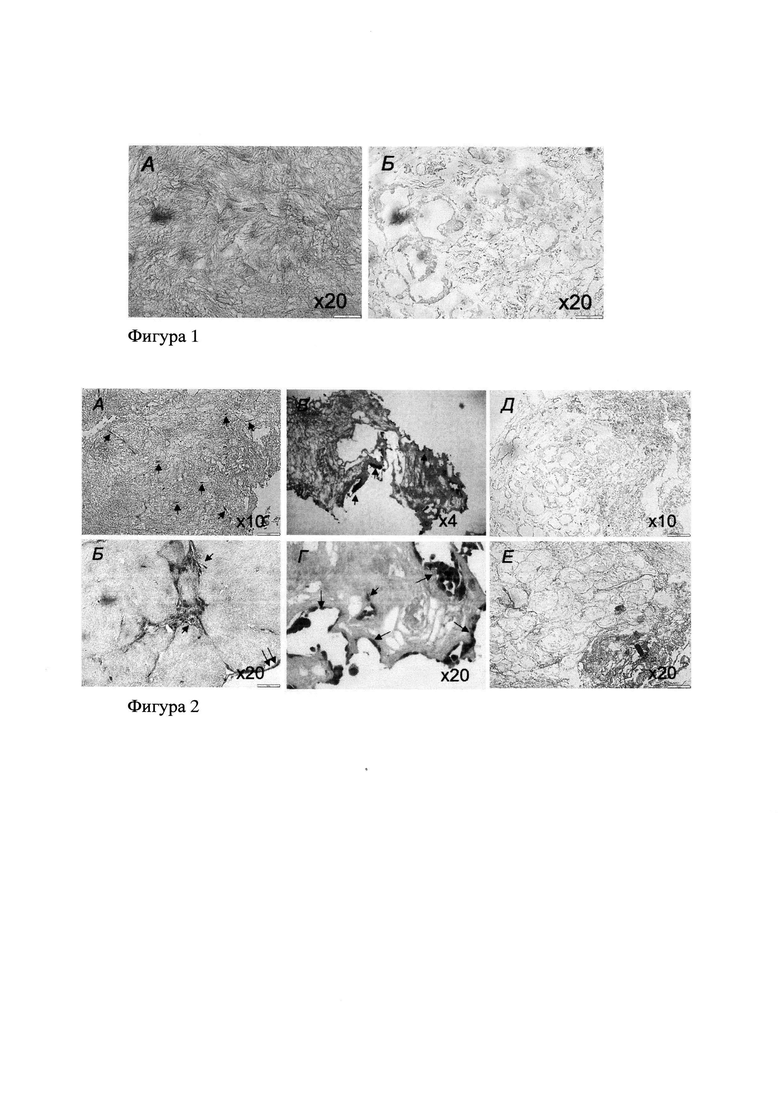
Для контроля децеллюляризации образцы фиксировали в 10% нейтральном формалине, заливали в гистомикс, приготавливали на микротоме серийные срезы и окрашивали их гематоксилин-эозином. Как показал анализ гистологических препаратов с помощью светового микроскопа, полученные каркасы состояли из матрикса с тенями клеток на месте удаленных клеток. Отсутствие клеток или их остатков в каркасах свидетельствовало об эффективности децеллюляризации (фиг. 1).
Децеллюляризацию матрикса опухолевого микроокружения пограничной зоны и/или зоны по линии резекции и/или периопухолевой ткани проводили по методике (Иванов и др., 2018).
Пример 2. Оценка эффективности иммобилизации клеток на пограничном к опухолевой ткани децеллюляризированном матриксе опухолевого микроокружения.
Опухолевые клетки для последующего заселения каркасов опухолевого микроокружения пограничного к опухолевой ткани были получены из коллекции АТСС (постоянная клеточная линия PANC-1) или выделены из операционного материала (опухоли) после резекции злокачественного новообразования поджелудочной железы человека.
Клетки линии PANC-1 после размораживания культивировали в питательной среде, состоящей из культуральной среды DMEM, дополненной 10% эмбриональной телячьей сыворотки, 1%-ного раствора GlutaMax и антибиотиков, и культивировали в виде адгезивных монослойных культур в культуральных флаконах без покрытия при температуре 37°С и 5% CO2 до 2-ого пассажа, далее клетки снимали с культуральной поверхности раствором трипсина-версена (1:10) и в виде суспензии направляли на заселение бесклеточного каркаса опухолевого микроокружения из пограничной с опухолевой тканью зоны, причем бесклеточный каркас опухолевого микроокружения из пограничной с опухолевой тканью зоны перед заселением промывали в культуральной среде DMEM/F12 (1:1) с антибиотиками, переносили в лунку 6 луночного культурального планшета и заливали культуральной средой DMEM/F12 (1:1), дополненной 10% эмбриональной телячьей сыворотки, 1%-ного раствора GlutaMax и антибиотиков, а заселение бесклеточного каркаса опухолевого микроокружения из пограничной с опухолевой тканью зоны осуществляли посредством диффузионного осаждения суспензии культивированных опухолевых клеток поджелудочной железы в плотности 2.5×104 кл./см2 в культуральной среде того же состава и культивировали при температуре 37°С и 5% CO2, со сменой среды через 2-3 суток в течение 14 суток, затем кокультивированные бесклеточные каркасы опухолевого микроокружения из пограничной с опухолевой тканью зоны с опухолевыми клетками поджелудочной железы (PANC-1) направляли на изучение наличия прикрепления и локализации культивируемых опухолевых клеток в бесклеточном каркасе опухолевого микроокружения из пограничной с опухолевой тканью зоны.
Биоптат опухолевой ткани промывали эффективным количеством раствора Хэнкса, измельчали ножницами и скальпелем до кусочков размером 1-3 мм3, которые помещали в раствор коллагеназы II типа 100 U/мл, приготовленного на культуральной среде DMEM/F12 (1:1), дополненной 5% эмбриональной телячьей сывороткой и антибиотиками, и инкубировали при 37°С в течение 17 часов, затем раствор с кусочками ткани интенсивно пипетировали и центрифугировали в течение 6 мин при 700 об/мин, затем клетки ресуспендировали в питательной среде, состоящей из культуральной среды DMEM/F12 (1:1), дополненной 10% эмбриональной телячьей сыворотки, 1%-ного раствора GlutaMax и антибиотиков, и после пипетирования распределяли в культуральных флаконах без покрытия и культивировали при температуре 37°С и 5% CO2, через 7 суток проводили первую смену среды и продолжали культивировать со сменой среды через 2-3 суток до достижения клетками конфлюэнтного монослоя и образования первичной культуры, затем проводили пассирование клеток первичной культуры, используя раствор трипсина-версена (1:5), далее клетки помещали в культуральные флаконы в плотности 2×104 кл./см2 и культивировали до 2-ого пассажа в виде адгезивных монослойных культур, далее клетки снимали с культуральной поверхности раствором трипсина-версена (1:5) и в виде суспензии направляли на заселение бесклеточного каркаса опухолевого микроокружения из пограничной с опухолевой тканью зоны, причем бесклеточный каркас опухолевого микроокружения из пограничной с опухолевой тканью зоны перед заселением промывали в культуральной среде DMEM/F12 (1:1) с антибиотиками, переносили в лунку 6 луночного культурального планшета и заливали культуральной средой DMEM/F12 (1:1), дополненной 10% эмбриональной телячьей сыворотки, 1%-ного раствора GlutaMax и антибиотиков, а заселение бесклеточного каркаса опухолевого микроокружения из пограничной с опухолевой тканью зоны осуществляли посредством диффузионного осаждения суспензии культивированных опухолевых клеток поджелудочной железы в плотности 5×104 кл./см2 в культуральной среде того же состава и культивировали при температуре 37°С и 5% CO2, со сменой среды через 2-3 суток в течение 14 суток, затем кокультивированные бесклеточные каркасы опухолевого микроокружения из пограничной с опухолевой тканью зоны с опухолевыми клетками поджелудочной железы направляли на изучение наличия прикрепления и локализации культивируемых опухолевых клеток в бесклеточном каркасе опухолевого микроокружения из пограничной с опухолевой тканью зоны.
Гистологический анализ каркасов опухолевого микроокружения из пограничной с опухолевой тканью зоны, культивируемых с клетками линии PANC-1 или опухолевыми клетками из первичного материала в течение 14 суток в стандартных ростовых средах без индукторов (DMEM или DMEM/F12 (1:1) соответственно с 10% эмбриональной телячьей сыворотки и 1%-ного раствора GlutaMax), показал заселение каркаса матрикса опухолевого микроокружения из пограничной с опухолевой тканью зоны опухолевыми клетками из первичного материала (фиг. 2А, Б) и клетками линии PANC-1 (фиг. 2 В, Г) по сравнению с каркасом опухолевой ткани, где заселения опухолевыми клетками нет (фиг. 2 Д, Е).
Таким образом, результаты микроскопического исследования свидетельствует, что опухолевые клетки линии PANC-1 и из первичного материала, культивируемые на каркасе опухолевого микроокружения, полученного из пограничной с опухолевой тканью зоны, в течение 14 суток, прикреплялись к поверхности и заселяли внеклеточный матрикс, расположенный вне опухолевой ткани, и не прикреплялись к поверхности и не заселяли внеклеточный матрикс самой опухолевой ткани, представленной децеллюляризироваными тканями. Следовательно, внеклеточный матрикс опухолевого микроокружения пограничной с опухолевой тканью зоны участвует в контроле покоящихся и пролиферативных свойств опухолевых клеток, а также в прогрессировании рака, что демонстрирует возможность локального рецидива опухоли в прилежащей к опухоли ткани.
Пример 3. Оценка эффективности иммобилизации клеток на децеллюляризированном матриксе зоны опухолевого микроокружения по линии резекции при использовании метода локальной деструкции РЧА.
Опухолевые клетки для последующего заселения каркасов зоны опухолевого микроокружения по линии резекции были получены из коллекции АТСС (постоянная клеточная линия PANC-1) или выделены из операционного материала после резекции злокачественного новообразования поджелудочной железы человека при использовании метода локальной деструкции РЧА.
Клетки линии PANC-1 после размораживания культивировали в питательной среде, состоящей из культуральной среды DMEM, дополненной 10% эмбриональной телячьей сыворотки, 1%-ного раствора GlutaMax и антибиотиков, и культивировали в виде адгезивных монослойных культур в культуральных флаконах без покрытия при температуре 37°С и 5% СО2 до 2-ого пассажа, далее клетки снимали с культуральной поверхности раствором трипсина-версена (1:10) и в виде суспензии направляли на заселение бесклеточного каркаса зоны опухолевого микроокружения по линии резекции, причем бесклеточный каркас зоны опухолевого микроокружения по линии резекции перед заселением промывали в культуральной среде DMEM/F12 (1:1) с антибиотиками, переносили в лунку 6 луночного культурального планшета и заливали культуральной средой DMEM/F12 (1:1), дополненной 10% эмбриональной телячьей сыворотки, 1%-ного раствора GlutaMax и антибиотиков, а заселение бесклеточного каркаса зоны опухолевого микроокружения по линии резекции осуществляли посредством диффузионного осаждения суспензии культивированных опухолевых клеток поджелудочной железы (PANC-1) в плотности 2.5×104 кл./см2 в культуральной среде того же состава и культивировали при температуре 37°С и 5% СО2, со сменой среды через 2-3 суток в течение 14 суток, затем кокультивированные бесклеточные каркасы зоны опухолевого микроокружения по линии резекции с опухолевыми клетками поджелудочной железы (PANC-1) направляли на изучение наличия прикрепления и локализации культивируемых опухолевых клеток в бесклеточном каркасе зоны опухолевого микроокружения по линии резекции.
Биоптат опухолевой ткани промывали эффективным количеством раствора Хэнкса, измельчали ножницами и скальпелем до кусочков размером 1-3 мм3, которые помещали в раствор коллагеназы II типа 100 U/мл, приготовленного на культуральной среде DMEM/F12 (1:1), дополненной 5% эмбриональной телячьей сывороткой и антибиотиками, и инкубировали при 37°С в течение 16 часов, затем раствор с кусочками ткани интенсивно пипетировали и центрифугировали в течение 6 мин при 700 об/мин, затем клетки ресуспендировали в питательной среде, состоящей из культуральной среды DMEM/F12 (1:1), дополненной 10% эмбриональной телячьей сыворотки, 1%-ного раствора GlutaMax и антибиотиков, и после пипетирования распределяли в культуральных флаконах без покрытия и культивировали при температуре 37°С и 5% СО2, через 5 суток проводили первую смену среды и продолжали культивировать со сменой среды через 2-3 суток до достижения клетками конфлюэнтного монослоя и образования первичной культуры, затем проводили пассирование клеток первичной культуры, используя раствор трипсина-версена (1:5), далее клетки помещали в культуральные флаконы в плотности 1×104 кл./см2 и культивировали до 2-ого пассажа в виде адгезивных монослойных культур, далее клетки снимали с культуральной поверхности раствором трипсина-версена (1:5) и в виде суспензии направляли на заселение бесклеточного каркаса зоны опухолевого микроокружения по линии резекции, причем бесклеточный каркас зоны опухолевого микроокружения по линии резекции перед заселением промывали в культуральной среде DMEM/F12 (1:1) с антибиотиками, переносили в лунку 6 луночного культурального планшета и заливали культуральной средой DMEM/F12 (1:1), дополненной 10% эмбриональной телячьей сыворотки, 1%-ного раствора GlutaMax и антибиотиков, а заселение бесклеточного каркаса зоны опухолевого микроокружения по линии резекции осуществляли посредством диффузионного осаждения суспензии культивированных опухолевых клеток поджелудочной железы в плотности 4×104 кл./см2 в культуральной среде того же состава и культивировали при температуре 37°С и 5% СО2, со сменой среды через 2-3 суток в течение 14 суток, затем кокультивированные бесклеточные каркасы зоны опухолевого микроокружения по линии резекции с опухолевыми клетками поджелудочной железы направляли на изучение наличия прикрепления и локализации культивируемых опухолевых клеток в бесклеточном каркасе зоны опухолевого микроокружения по линии резекции.
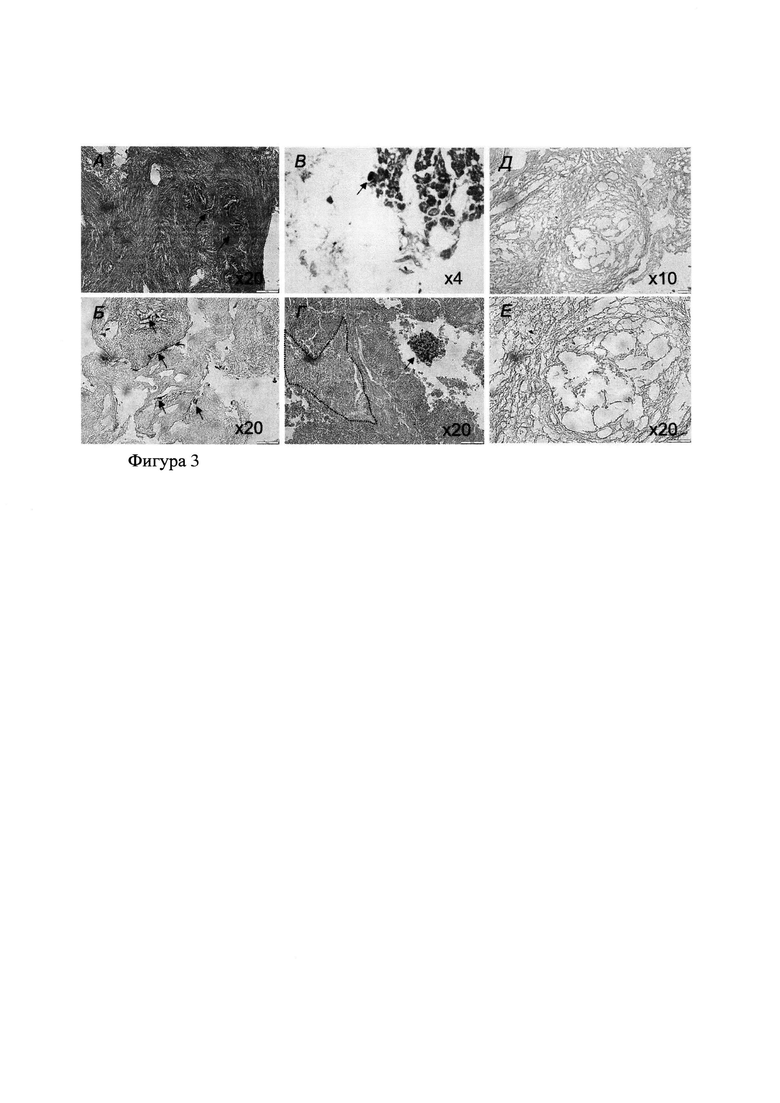
Гистологический анализ каркасов зоны опухолевого микроокружения по линии резекции, культивируемых с клетками линии PANC-1 или опухолевыми клетками из первичного материала в течение 14 суток в стандартных ростовых средах без индукторов (DMEM или DMEM/F12 (1:1) соответственно с 10% эмбриональной телячьей сыворотки и 1%-ного раствора GlutaMax), показал заселение каркаса матрикса опухолевыми клетками из первичного материала (фиг. 3А, Б) и клетками линии PANC-1 (фиг. 3В) по сравнению с каркасом опухолевой ткани, где заселения опухолевыми клетками нет (фиг. 3Д, Е). Кроме того, обнаружено скопление опухолевых клеток рядом с каркасом поджелудочной железы в области РЧА (фиг. 3Г).
Таким образом, результаты микроскопического исследования свидетельствует, что опухолевые клетки линии PANC-1 и из первичного материала, культивируемые на каркасе зоны опухолевого микроокружения по линии резекции в течение 14 суток, прикреплялись к поверхности и заселяли внеклеточный матрикс, расположенный вне опухолевой ткани, и не прикреплялись к поверхности и не заселяли внеклеточный матрикс самой опухолевой ткани, представленный децеллюляризироваными тканями. Следовательно, внеклеточный матрикс зоны опухолевого микроокружения по линии резекции участвует в контроле покоящихся и пролиферативных свойств опухолевых клеток, а также в прогрессировании рака, что демонстрирует возможность локального рецидива опухоли в зоне опухолевого микроокружения по линии резекции.
СПИСОК ЛИТЕРАТУРЫ
1. Badylak S.F., Freytes D.O., Gilbert T.W. Extracellular matrix as a biological scaffold material: Structure and function. Acta Biomater. 2009; 5(1): 1-13. doi: 10.1016/j.actbio. 2008.09.013
2. Galler K.M., D'Souza R.N., Federlin M., Cavender A.C., Hartgerink J.D., Hecker S., Schmalz G. Dentin conditioning codetermines cell fate in regenerative endodontics. J Endod. 2011;37(11):1536-41. doi: 10.1016/j.joen. 2011.08.027
3.  B.C., Pentcheva-Hoang Т., Carstens J.L., Zheng X., Wu C.C., Simpson T.R., Laklai H., Sugimoto H., Kahlert C, Novitskiy S. V., DeJesus-Acosta A., Sharma P., Heidari P., Mahmood U., Chin L., Moses H.L., Weaver V.M., Maitra A., Allison J.P., LeBleu V.S., Kalluri R. Depletion of carcinoma-associated fibroblasts and fibrosis induces immunosuppression and accelerates pancreas cancer with reduced survival. Cancer Cell. 2014; 25: 719. 10.1016/j.ccr. 2014.04.005.
B.C., Pentcheva-Hoang Т., Carstens J.L., Zheng X., Wu C.C., Simpson T.R., Laklai H., Sugimoto H., Kahlert C, Novitskiy S. V., DeJesus-Acosta A., Sharma P., Heidari P., Mahmood U., Chin L., Moses H.L., Weaver V.M., Maitra A., Allison J.P., LeBleu V.S., Kalluri R. Depletion of carcinoma-associated fibroblasts and fibrosis induces immunosuppression and accelerates pancreas cancer with reduced survival. Cancer Cell. 2014; 25: 719. 10.1016/j.ccr. 2014.04.005.
4. Пат. 2716594. Российская Федерация, МПК8 A61C 13/00, C12N 1/00. Способ восстановления резорбированной альвеолярной костной ткани биоинженерной конструкцией из децеллюляризированных тканей зуба человека/ Иванова А.А., Даниловой Т.И., Поповой О.П., Латышева А.В.; патентообладатель ФГБОУ ВО МГМСУ им. А.И. Евдокимова Минздрава России - №2019120140, заявлено 27.06.2019; Опубл. 13.03.2020. Бюл. №- 8 с: ил.
Краткое описание чертежей
Фиг. 1. Гистологические препараты каркасов матрикса опухолевого микроокружения (4) и опухоли {Б) после децеллюляризации. Об эффективности децеллюляризации свидетельствует отсутствие в каркасах эндогенных клеток или их остатков. Окраска гематоксилин-эозином.
Фиг. 2. Гистологические препараты каркасов опухолевого микроокружения пограничной с опухолевой тканью зоны (А-Г) и опухолевой ткани (Д, Е), полученных при резекции злокачественного новообразования поджелудочной железы и заселенные опухолевыми клетками из первичного материала {А, Б) и линии PANC-1 {В, Г). А-Г - видны опухолевые клетки внутри каркаса матрикса {короткие стрелки) и по поверхности каркаса матрикса {длинные стрелки); Д, Е - в каркасе опухолевой ткани опухолевых клеток нет. Окраска гематоксилином и эозином.
Фиг. 3. Гистологические препараты каркасов зоны опухолевого микроокружения по линии резекции {А, Б), поджелудочной железы {В, Г) и опухолевой ткани (Д, Е), полученных при резекции злокачественного новообразования поджелудочной железы и использованием методов локальной деструкции (РЧА) и заселенные опухолевыми клетками, полученными из первичного материала {А, Б, Г), или линии PANC-1 {В). Окраска гематоксилин-эозином. А - в каркасе матрикса видны очаговые скопления опухолевых клеток вокруг каркасов сосудов {стрелки); Б - опухолевые клетки в небольшом количестве определяются внутри каркаса матрикса, а также вокруг и внутри каркаса сосуда {стрелки); В - опухолевая клетка {стрелка) на каркасе поджелудочной железы; Г - скопление опухолевых клеток {стрелка) рядом с каркасом поджелудочной железы, область некроза выделена пунктирной линией; Д, Е - в каркасе опухолевой ткани опухолевых клеток нет.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ индукции спонтанной дифференцировки клеток периодонтальной связки и надкостницы в одонтогенном и остеогенном направлениях путем использования децеллюляризированного матрикса зуба и периодонтальной связки человека | 2022 |
|
RU2813729C1 |
| СПОСОБ МОДЕЛИРОВАНИЯ ТКАНЕВОЙ СТРУКТУРЫ СЕТЧАТКИ ГЛАЗА ЧЕЛОВЕКА | 2012 |
|
RU2486603C1 |
| Способ получения органоидов из опухолевой ткани органов головы и шеи | 2021 |
|
RU2787378C1 |
| Способ восстановления резорбированной альвеолярной костной ткани биоинженерной конструкцией из децеллюляризированных тканей зуба человека | 2019 |
|
RU2716594C1 |
| СРЕДА ДЛЯ КУЛЬТИВИРОВАНИЯ ЭПИТЕЛИАЛЬНЫХ КЛЕТОК РАКА ЛЁГКОГО, СПОСОБ ИХ КУЛЬТИВИРОВАНИЯ И ПРИМЕНЕНИЕ | 2021 |
|
RU2838489C2 |
| КУЛЬТУРАЛЬНАЯ СРЕДА ДЛЯ ПЕРВИЧНЫХ ЭПИТЕЛИАЛЬНЫХ КЛЕТОК МОЛОЧНОЙ ЖЕЛЕЗЫ, СПОСОБ ИХ КУЛЬТИВИРОВАНИЯ И ИХ ПРИМЕНЕНИЕ | 2019 |
|
RU2819362C1 |
| Клеточная культура и биотрансплантат для регенерации костной ткани на ее основе | 2017 |
|
RU2675930C1 |
| Способ получения тканеинженерной надкостницы из клеточных сфероидов для восстановления костных дефектов субъекта | 2022 |
|
RU2819284C2 |
| Способ получения тканеинженерной in vitro модели плоскоклеточного рака головы и шеи человека | 2023 |
|
RU2825474C1 |
| КУЛЬТУРАЛЬНАЯ СРЕДА ДЛЯ ЭПИТЕЛИАЛЬНЫХ СТВОЛОВЫХ КЛЕТОК И ОРГАНОИДОВ, СОДЕРЖАЩИХ УКАЗАННЫЕ СТВОЛОВЫЕ КЛЕТКИ | 2010 |
|
RU2555545C2 |
В настоящем изобретении представлен способ прогнозирования возможного локального рецидива протоковой аденокарциномы поджелудочной железы после ее резекции, в том числе при использовании методов локальной деструкции, путем заселения бесклеточного эндогенно продуцированного внеклеточного матрикса опухолевыми клетками. Техническим результатом данного изобретения является определение прикрепления опухолевых клеток к поверхности децеллюляризированного матрикса и его инвазия, что способствует диагностике опухолевого роста и свидетельствует о локальном рецидиве опухоли. 8 з.п. ф-лы, 3 ил., 3 пр.
1. Способ прогнозирования возможного локального рецидива протоковой аденокарциномы поджелудочной железы после ее резекции, путем заселения бесклеточного эндогенно продуцированного внеклеточного матрикса опухолевыми клетками, заключающийся в том, что пограничную зону опухолевого микроокружения и/или зону по линии резекции децеллюляризируют путем последовательной обработки раствором 100 мМ ЭДТА-Na2/10 мМ NaOH в дистиллированной воде в течение суток, 1% водного раствора Triton Х-100 в течение суток, 4.2 мМ раствора хлорида магния, содержащего 20 μg/ml ДНКазы в течение 2-3 часов, промывают эффективным количеством раствора фосфатно-солевого буфера, содержащим смесь антибиотиков - 300 МЕ/мл пенициллина, 300 МЕ/мл стрептомицина и 75 мкг/мл амфотерицина в течение 1 часа, и заселяют клетками линии PANC-1 или культивированными опухолевыми клетками, полученными из злокачественной опухоли поджелудочной железы после ее резекции, способными к прикреплению, инвазии и злокачественному новообразованию в измененном опухолью матриксе, что демонстрирует возможность локального рецидива опухоли.
2. Способ по п.1, отличающийся тем, что резекция протоковой аденокарциномы поджелудочной железы включает использование методов локальной деструкции.
3. Способ по п.2, отличающийся тем, что в качестве метода локальной деструкции используется радиочастотная абляция (РЧА).
4. Способ по п.1, отличающийся тем, что возможность локального рецидива определяется прикреплением опухолевых клеток к поверхности децеллюляризированного матрикса и его инвазия.
5. Способ по п.4, отличающийся тем, что в качестве опухолевых клеток используют опухолевую линию поджелудочной железы PANC-1.
6. Способ по п.4, отличающийся тем, что в качестве опухолевых клеток используют культивированные опухолевые клетки, полученные из злокачественной опухоли поджелудочной железы после ее резекции.
7. Способ по п.1, отличающийся тем, что заселение бесклеточного каркаса опухолевого микроокружения пограничной зоны и/или зоны по линии резекции осуществляют посредством диффузионного осаждения суспензии опухолевых клеток поджелудочной железы в плотности 4-5.5×104 кл./см2 в культуральной среде DMEM/F12 (1:1), дополненной 10% эмбриональной телячьей сыворотки, 1%-ного раствора GlutaMaх, антибиотиков и культивируют при температуре 37°С и 5% СО2, со сменой среды через 2-3 суток в течение 14 суток.
8. Способ по п.1, отличающийся тем, что культивированные бесклеточные каркасы опухолевого микроокружения пограничной зоны и/или зоны по линии резекции с опухолевыми клетками поджелудочной железы направляют на гистологическое изучение наличия прикрепления и локализации культивируемых опухолевых клеток в бесклеточном каркасе опухолевого микроокружения пограничной зоны и/или зоны по линии резекции.
9. Способ по п.8, отличающийся тем, что для гистологического изучения изготавливают гистологические срезы, которые монтируют на предметные стекла и окрашивают гематоксилином и эозином для оценки прикрепления, инвазии и злокачественного новообразования в измененном опухолью матриксе, что демонстрирует возможность локального рецидива опухоли.
| WENIGER M | |||
| et al., The extracellular matrix and pancreatic cancer: a complex relationship, Cancers, 2018, Vol.10, N9, pp.316 | |||
| LU P | |||
| et al., The extracellular matrix: a dynamic niche in cancer progression, Journal of cell biology, 2012, Vol.196, N4, pp.395-406 | |||
| HE C | |||
| et al., A quantitative clinicopathological signature for predicting recurrence |
Авторы
Даты
2023-03-01—Публикация
2022-02-15—Подача