В настоящем изобретении описаны Fc-области IgG, у которых модифицировали способность связываться с Fc-рецептором без нарушения их способности поддаваться очистке.
Предпосылки создания изобретения
Требование к экономичности процессов производства привело к необходимости оптимизации последующей очистки, включающей одну или несколько стадий аффинной хроматографии. Увеличенные объемы, подлежащие очистке, и более жесткие требования к протоколам «очистки на месте» (CIP) представляют собой некоторые из проблем, которые необходимо решать (Hober S., J. Chrom. В. 848, 2007, сс. 40-47).
Очистка моноклональных антител с помощью селективных в отношении Fc-области аффинных лигандов является наиболее перспективной методологией для крупномасштабного производства терапевтических моноклональных антител. Фактически эта процедура не требует создания какого-либо взаимодействия между антигенспецифическим участком антитела, т.е. Fab-доменом, который в результате остается интактным и может сохранять свои свойства (см. Salvalaglio М. и др., J. Chrom. А 1216, 2009, сс. 8678-8686).
Благодаря ее селективности, стадию аффинной очистки применяют на ранней стадии цепи очистки и тем самым можно снижать количество последовательных отдельных операций (см. Hober, выше; MacLennan J., Biotechnol. 13, 1995, с. 1180; Harakas N.K., Bioprocess Technol. 18, 1994, с. 259).
Лигандами, наиболее адоптированными для избирательного связывания IgG, являются белок А и белок G стафилококков, которые обладают способностью создавать высокоселективные взаимодействия с Fc-областью большинства IgG на участке, называемом «консенсусный сайт связывания» (CBS) (DeLano W.L. и др., Science 287, 2000, с. 1279), который локализован в шарнирной области между СН2- и СН3-доменами Fc-области.
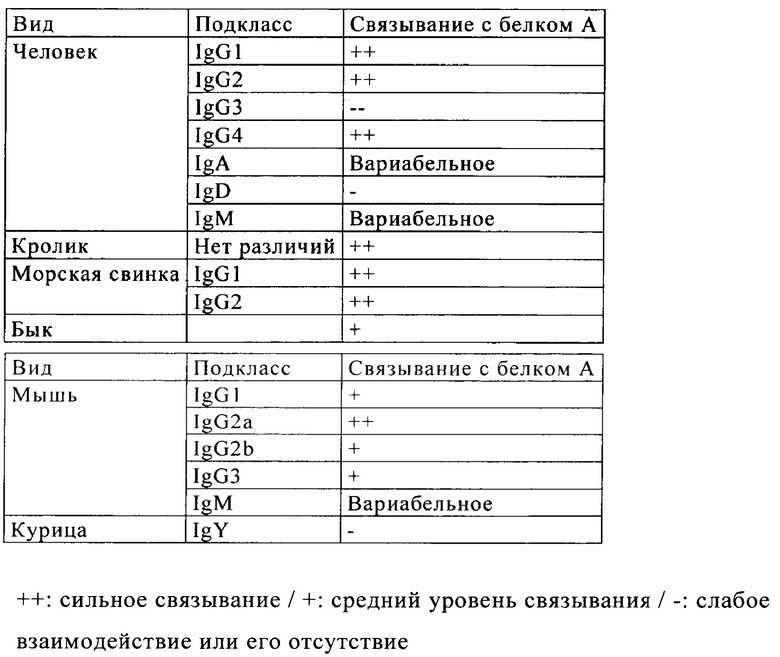
Белок А стафилококков (SPA) представляет собой ассоциированный с клеточной оболочкой белковый домен, экспонируемый на поверхности грамотрицательной бактерии Staphylococcus aureus. SPA обладает высокой аффинностью к IgG из различных видов, например, IgG человека, кроликов и морских свинок, но лишь слабым взаимодействием с бычьим и мышиным IgG (см. представленную ниже таблицу) (см. Hober, выше; Duhamel R.C. и др., J. Immunol. Methods 31, 1979, с. 211;  L. и Kronvall G., Immunol. J. 133, 1984, с. 969; Richman D.D. и др., J. Immunol. 128, 1982, с. 2300; Amersham Pharmacia Biotech, Handbook, Antibody Purification, 2000)).
L. и Kronvall G., Immunol. J. 133, 1984, с. 969; Richman D.D. и др., J. Immunol. 128, 1982, с. 2300; Amersham Pharmacia Biotech, Handbook, Antibody Purification, 2000)).
Шарнирная область тяжелой цепи между СН2- и СН3-доменами IgG обладает способностью связываться с несколькими белками помимо белка А, такими как неонатальный Fc-рецептор (FcRn) (см. DeLano и Salvalaglio, выше).
CBS SPA включает (охватывает) гидрофобный карман на поверхности антитела. Остатки, из которых состоит CBS IgG, представляют собой Ile 253, Ser 254, Met 252, Met 423, Tyr 326, His 435, Asn 434, His 433, Arg 255 и Glu 380 (нумерация остатков тяжелой цепи IgG в соответствии с системой нумерации по Кэботу на основе EU-индекса). Заряженные аминокислотные остаткив (Arg 255, Glu 380) расположены вокруг гидрофобного «выступа», образованного из Ilе 253 и Ser 254. Это (вероятно) приводит к созданию полярных и гидрофильных взаимодействий (см. Salvalaglio, выше).
В целом, взаимодействие белок A-IgG можно описать на основе двух основных сайтов связывания: первый располагается в СН2-домене тяжелой цепи и характеризуется гидрофобными взаимодействиями между Phe 132, Leu 136, Ile 150 (белка А) и гидрофобным «выступом» IgG, который состоит из Ile 253 и Ser 254, и одним электростатическим взаимодействием между Lys 154 (белок А) и Thr 256 (IgG). Второй сайт локализован в СН3-домене тяжелой цепи и характеризуется главным образом электростатическими взаимодействиями между Gln 129 и Tyr 133 (белок А) и His 433, Asn 434 и His 435 (IgG) (см. Salvalaglio, выше).
Lindhofer Н. с соавторами. (J. Immunol. 155, 1995, сс. 219-225) описали, прежде всего, ограниченное видом спаривание тяжелых/легких цепей спаривание в крысиных/мышиных квадромах.
Jedenberg L. с соавторами (J. Immunol. Meth. 201, 1997, сс. 25-34) описали, что анализы связывания с SPA двух вариантов Fc (Fc13 и Fc31, каждый из которых содержал изотипическую дипептидную замену из соответствующего другого изотипа) продемонстрировали, что Fc1 и Fc31 взаимодействовали с SPA, хотя у Fc3 и Fc13 отсутствовало поддающееся обнаружению связывание SPA. Было сделано заключение о том, что зависящее от SPA связывание Fc-области варианта Fc31 является результатом интродуцированной дипептидной замены R435H и F436Y.
В настоящее время касательно терапевтических моноклональных антител основное внимание сосредоточено на создании и применении биспецифических или даже мультиспецифических антител, которые специфически связываются с двумя или большим количеством мишеней (антигенов).
Основной проблемой, связанной с созданием мультиспецифических гетеродимерных антител IgG-типа, состоящих их четырех цепей антител (две различные тяжелые цепи и две различные легкие цепи) в одной клеточной линии, в которой происходит их экспрессия, является наличие так называемой ассоциации цепей (см. Klein С. и др., mAbs 4, 2012, сс. 653-663). Требование к применению различных цепей в качестве левого и правого плеча мультиспецифического антитела приводит к смесям антител при экспрессии в одной клетке: две тяжелые цепи обладают способностью к (теоретической) ассоциации в четырех различных комбинациях (две являются идентичными), и каждая из них может вступать в ассоциацию стохастическим образом с легкими цепями, что приводит к 24 (всего 16) теоретически возможным комбинациям цепей. Из 16 теоретически возможных комбинаций можно найти десять, из которых только одна соответствует требуемому функциональному биспецифическому антителу (De Lau W.B. и др., J. Immunol. 146, 1991, сс. 906-914). Трудности, связанные с изоляцией указанного требуемого биспецифического антитела из сложной смеси, и соответственно низкий выход на уровне 12,5%, что является теоретическим максимумом, делает производство биспецифического антитела в одной клеточной линии, применяемой для экспрессии, весьма проблематичным.
Для преодоления недостатка, связанного с ассоциацией цепей, и усиления правильной ассоциации двух различных тяжелых цепей в конце 1990-х годов Carter с соавторами, работающие на фирме Genentech, предложили подход, обозначенный как «knobs-into-holes» (KiH) (взаимодействие по типу выступы во впадины (см. Carter P., J. Immunol. Meth. 248, 2001, сс. 7-15; Merchant A.M. и др., Nat. Biotechnol. 16, 1998, cc. 677-681; Zhu Z. и др., Prot. Sci. 6, 1997, cc. 781-788; Ridgway J.B. и др., Prot. Eng. 9, 1996, cc. 617-621; Atwell S. и др., J. Mol. Biol. 270, 1997, cc. 26-35 и US 7183076). В целом, концепция основана на модификациях поверхности раздела между двумя СН3-доменами двух тяжелых цепей антитела, в которых происходит большая часть взаимодействий. Более крупный остаток интродуцируют в СН3-домен одной тяжелой цепи антитела, и он действует подобно ключу («выступ»). В другой тяжелой цепи формируют «впадину», в которую может помещаться указанный крупный остаток, имитирующую замок. Образовавшуюся гетеродимерную Fc-область можно дополнительно стабилизировать путем интродукции/формирования искусственных дисульфидных мостиков. Важно отметить, что все KiH-мутации «спрятаны» в СН3-доменах и не «видны» иммунной системе. Кроме того, свойства антител с KiH-мутациями, такие как (термо) стабильность, способность связываться с FcγR и эффекторные функции (например, ADCC, способность связываться с FcRn) и фармакокинетические (ФК) характеристики, не нарушаются.
Для достижения правильной ассоциации тяжелых цепей с получением уровней гетеродимеризации, составляющих более 97%, можно интродуцировать шесть мутаций: S354C, T366W в тяжелую цепь с «выступом» и Y349C, T366S, L368A, Y407V в тяжелую цепь с «впадиной» (см. Carter, нумерация остатков в соответствии с системой нумерации по Кэботу на основе EU-индекса). Хотя гомодимеры типа «впадина»-«впадина» могут образовываться, гомодимеры типа «выступ»-«выступ», как правило, отсутствуют. Содержание димеров типа «впадина»-«впадина» можно либо снижать с помощью избирательных процедур очистки, либо с помощью изложенных ниже процедур.
Хотя основное внимание направлено на случайную ассоциацию тяжелых цепей, должна гарантироваться также правильная ассоциация легких цепей. Аналогично KiH-подходу к СН3-домену, интенсивному изучению подвергались также асимметричные взаимодействия легкой цепи-тяжелой цепи, которые могут в конце концов приводить к образованию полностью биспецифических IgG.
На фирме Roche в настоящее время разработан CrossMab-подход в качестве пути усиления правильного спаривания легких цепей в биспецифических гетеродимерных антитела IgG-типа, при объединении его с KiH-технологией (см. Klein, выше; Schaefer W. и др., Proc. Natl. Acad. Sci. USA 108, 2011, cc. 11187-11192; Cain C., SciBX 4, 2011, cc. 1-4). Это позволяет создавать биспецифические или даже мультиспецифические антитела на основе общего подхода. В этом формате одно плечо требуемого биспецифического антитела остается неизмененным. Во втором плече всю Fab-область или VH-VL-домены или CH1-CL-домены обменивают путем кроссовера доменов между тяжелой и легкой цепью. В результате вновь образовавшаяся «скрещенная» легкая цепь больше не вступает в ассоциацию с (обычной, т.е. нескрещенной) Fab-областью тяжелой цепи другого плеча биспецифического антитела. Таким образом, правильную ассоциацию «легкой цепи» можно повышать путем указанного минимального изменения в организации доменов (см. Schaefer, выше).
Zhu с соавторами интродуцировали несколько стерически комплементарных мутаций, а также дисульфидные мостики в две поверхности раздела VL/VH вариантов димерных антител (диабоди). Когда мутации VL Y87A/F98M и VH V37F/L45W интродуцировали в поверхность раздела VL/VH антитела к p185HER2, выход гетеродимерного димерного антитела составлял >90%, при этом сохранялись общий выход и аффинность по сравнению с родительским димерным антителом (см. Zhu, выше).
Исследователи фирмы Chugai получили аналогичным образом сконструированные биспецифические димерные антитела путем интродукции мутаций в поверхности раздела VH-VL (прежде всего путем конверсии Q39 в VH и Q38 в VL на заряженные остатки) для усиления воздействия на правильную ассоциацию легких цепей (WO 2006/106905; Igawa Т. и др., Prot. Eng. Des. Sel. 23, 2010, cc. 667-677).
В WO 2011/097603 описаны общая легкая цепь мышей.
В WO 2010/151792 описан формат биспецифического антитела, легко поддающийся выделению, который содержит вариабельные домены тяжелой цепи иммуноглобулина, по-разному модифицированные, т.е. гетеродимерные, в СН3-домене, при этом различные модификация являются не иммуногенными или практически неиммуногенными касательно модификаций СН3, и по меньшей мере одна из модификаций приводит в другой аффинности биспецифического антитела в отношении аффинного реагента, такого как белок А, и биспецифическое антитело можно выделять из разрушенной клетки, из среды или из смеси антител на основе его аффинности к белку А.
Неонатальный Fc-рецептор (FcRn) играет важную роль в метаболической «судьбе» антител IgG-класса in vivo. Функции FcRn состоят в спасении IgG от лизосомального пути расщепления, что приводит к пониженному клиренсу и удлиненному времени полужизни. Он представляет собой гетеродимерный белок, состоящий из двух полипептидов: имеющего молекулярную массу 50 кДа белка типа белка класса I главного комплекса гистосовместимости (α-FcRn) и имеющего молекулярную массу 15 кДа β2-микроглобулина (β2m). FcRn связывается с высокой аффинностью с СН2-СН3-участком Fc-области антитела IgG-класса. Взаимодействие между антителом IgG-класса и FcRn зависит от рН и имеет место при стехиометрическом соотношении 1:2, т.е. одна молекула антитела IgG-класса может взаимодействовать с двумя молекулами FcRn через его два полипептида Fc-областей тяжелых цепей (см., например, Huber А.Н. и др., J. Mol. Biol. 230, 1993, сс. 1077-1083).
Таким образом, свойства/характеристики связывания IgG in vitro с FcRn являются показателем их фармакокинетических свойств в кровотоке in vivo.
Во взаимодействии между FcRn и Fc-областью антитела IgG-класса принимают участие различные аминокислотные остатки СН2- и СН3-домена тяжелой цепи.
Известны различные мутации, которые влияют на связывание с FcRn и следовательно на продолжительность полужизни в кровотоке. Остатки Fc-области, которые имеют решающее значение для взаимодействия мышиной Fc-область с мышиным FcRn, идентифицированы с помощью сайтнаправленного мутагенеза (см., например, Dall'Acqua W.F. и др., J. Immunol 169, 2002, сс. 5171-5180). Во взаимодействии участвуют остатки I253, Н310, Н433, N434 и Н435 (нумерация в соответствии с системой нумерации по Кэботу на основе EU-индекса) (Medesan С. и др., Eur. J. Immunol. 26, 1996, сс. 2533-2536; Firan М. И др., Int. Immunol. 13, 2001, сс. 993-1002; Kim J.К. и др., Eur. J. Immunol. 24, 1994, сс. 542-548). Установлено, что остатки I253, Н310 и Н435 имеют решающее значения для взаимодействия человеческой Fc-области с мышиным FcRn (Kim J.K. и др., Eur. J. Immunol. 29, 1999, сс. 2819-2885).
Методы повышения способности Fc-области (и соответственно IgG) связываться с FcRn осуществляли путем мутации различных аминокислотных остатков в Fc-области: Thr 250, Met 252, Ser 254, Thr 256, Thr 307, Glu 380, Met 428, His 433 и Asn 434 (см. Kuo T.T. и др., J. Clin. Immunol. 30, 2010, cc. 777-789; Ropeenian D.C. и др., Nat. Rev. Immunol. 7, 2007, cc. 715-725).
У Dall'Acqua с соавторами с помощью опытов по исследованию белок-белковых взаимодействий установлено, что комбинация мутаций M252Y, S254T, Т256Е повышает способность связываться с FcRn (Dall'Acqua W.F. и др., J. Biol. Chem. 281, 2006, cc. 23514-23524). Изучение комплекса человеческая Fc-область-человеческий продемонстрировало, что остатки I253, S254, Н435 и Y436 имеют решающее значение для взаимодействия (Firan М. и др., Int. Immunol. 13, 2001, сс. 993-1002; Shields R.L. и др., J. Biol. Chem. 276, 2001, cc. 6591-6604). У Yeung Y.A. с соавторами (J. Immunol. 182, 2009, cc. 7667-7671) описаны и изучены различные мутанты остатков 248-259 и 301-317 и 376-382 и 424-437.
В WO 2014/006217 описаны димерные белки с тремя мутациями. Кристаллическая структура комплекса FcRn/гетеродимерная Fc при разрешении 2,8 Åполипептид f в связи с изучением механизма рН-зависимого связывания описана у Martin W. с соавторами. (Mol. Cell. 7, 2001, сс. 867-877). В US 6277375 описаны иммуноглобулинподобные домены с удлиненным временем полужизни, указанные в WO 2013/004842. Shields R.L. с соавторами описали картирование с высоким разрешением сайта связывания человеческого IgG1 с Fc-гамма RI, Fc-гамма RII, Fc-гамма RIII и FcRn и создание вариантов IgG1 с повышенной способностью связываться с Fc-гамма R (Biochem. Mol. Biol. 276, 2001, сс. 6591-6604). Medesan С. с соавторами описали разграничение (делимитацию) аминокислотных остатков, участвующих в трансцитозе и катаболизме мышиного IgG1 (J. Immunol. 158,1997, сс. 2211-2217). В US 2010/0272720 описаны слитые белки антител с модифицированным сайтом связывания FcRn. Получение гетеродимерных белков описано в WO 2013/060867. Qiao S.-W. с соавторами описали зависимость от опосредуемой антителом презентации антигена на FcRn (Proc. Natl. Acad. Sci. USA 105, 2008, cc. 9337-9342).
Краткое изложения сущности изобретения
В настоящем изобретении описаны варианты Fc-областей, которые специфически связываются с белком A Staphylococcus и не связываются с человеческим FcRn. Указанные варианты Fc-областей содержат специфические аминокислотные мутации в СН2- и СН3-доменах. Было установлено, что указанные мутации при их применении либо в цепи с «впадиной», либо в цепи с «выступом» гетеродимерной Fc-области позволяют осуществлять очистку гетеродимерной Fc-области, т.е. отделение гетеродимерной Fc-области от гомодимерной Fc-области.
Одним из объектов настоящего изобретения является (димерный) полипептид, содержащий
первый полипептид, который содержит в направлении от N-конца к С-концу по меньшей мере часть шарнирной области иммуноглобулина, содержащей один или несколько остатков цистеина, СН2-домен иммуноглобулина и СН3-домен иммуноглобулина, и второй полипептид, который содержит в направлении от N-конца к С-концу по меньшей мере часть шарнирной области иммуноглобулина, содержащей один или несколько остатков цистеина, СН2-домен иммуноглобулина и СН3-домен иммуноглобулина, в котором (нумерация согласно системе нумерации на основе EU-индекса Кэбота)
I) первый полипептид содержит мутации I253A, Н310А и Н435А, а второй полипептид содержит мутации Н310А, Н433А и Y436A или
II) первый полипептид содержит мутации I253A, Н310А и Н435А, а второй полипептид содержит мутации L251D, L314D и L432D, или
III) первый полипептид содержит мутации s I253A, Н310А и Н435А, а второй полипептид содержит мутации L251S, L314S и L432S
и
в котором первый полипептид и второй полипептид соединены с помощью одного или нескольких дисульфидных мостиков по меньшей мере в части шарнирной области иммуноглобулина.
В одном из вариантов осуществления изобретения (димерный) полипептид не связывается специфически с человеческим FcRn и связывается специфически с белком А стафилококков.
В одном из вариантов осуществления изобретения (димерный) полипептид представляет собой гомодимерный полипептид.
В одном из вариантов осуществления изобретения (димерный) полипептид представляет собой гетеродимерный полипептид.
В одном из вариантов осуществления изобретения первый полипептид содержит дополнительно мутации Y349C, T366S, L368A и Y407V («впадина») и второй полипептид содержит мутации S354C и T366W («выступ»).
В одном из вариантов осуществления изобретения первый полипептид содержит дополнительно мутации S354C, T366S, L368A и Y407V («впадина») и второй полипептид содержит мутации Y349C и T366W («выступ»).
В одном из вариантов осуществления изобретения шарнирная область иммуноглобулина, СН2-домен иммуноглобулина и СН3-домен иммуноглобулина и первого и второго полипептида относятся к человеческому IgG1-подклассу. В одном из вариантов осуществления изобретения первый полипептид и второй полипептид каждый дополнительно содержит мутации L234A и L235A. В одном из вариантов осуществления изобретения первый полипептид и второй полипептид каждый дополнительно содержит мутацию P329G. В одном из вариантов осуществления изобретения первый полипептид и второй полипептид, и второй полипептид каждый дополнительно содержит мутации L234A, L235A и P329G.
В одном из вариантов осуществления изобретения шарнирная область иммуноглобулина, СН2-домен иммуноглобулина и СН3-домен иммуноглобулина первого и второго полипептида относятся к человеческому IgG2-подклассу. В одном из вариантов осуществления изобретения первый полипептид и второй полипептид каждый дополнительно содержит мутации H268Q, V309L, A330S и P331S.
В одном из вариантов осуществления изобретения шарнирная область иммуноглобулина, СН2-домен иммуноглобулина и СН3-домен иммуноглобулина первого и второго полипептида относятся к человеческому IgG2-подклассу. В одном из вариантов осуществления изобретения первый полипептид и второй полипептид каждый дополнительно содержит мутации V234A, G237A, P238S, Н268А, V309L, A330S и P331S.
В одном из вариантов осуществления изобретения шарнирная область иммуноглобулина, СН2-домен иммуноглобулина и СН3-домен иммуноглобулина первого и второго полипептида относятся к человеческому IgG4-подклассу. В одном из вариантов осуществления изобретения первый полипептид и второй полипептид каждый дополнительно содержит мутации S228P и L235E. В одном из вариантов осуществления изобретения первый полипептид и второй полипептид каждый дополнительно содержит мутацию P329G. В одном из вариантов осуществления изобретения первый полипептид и второй полипептид каждый дополнительно содержит мутации S228P, L235E и P329G.
В одном из вариантов осуществления изобретения шарнирная область иммуноглобулина, СН2-домен иммуноглобулина и СН3-домен иммуноглобулина первого и второго полипептида относятся к человеческому IgG4-подклассу. В одном из вариантов осуществления изобретения первый полипептид и второй полипептид каждый дополнительно содержит мутации S228P, L234A и L235A. В одном из вариантов осуществления изобретения первый полипептид и второй полипептид каждый дополнительно содержит мутацию P329G. В одном из вариантов осуществления изобретения первый полипептид и второй полипептид каждый дополнительно содержит мутации S228P, L234A, L235A и P329G.
В одном из вариантов осуществления изобретения первый полипептид и второй полипептид дополнительно содержат мутацию Y436A.
В одном из вариантов осуществления изобретения (димерный) полипептид представляет собой содержащий Fc-область слитый полипептид.
В одном из вариантов осуществления изобретения (димерный) полипептид представляет собой (полноразмерное) антитело.
В одном из вариантов осуществления изобретения (полноразмерное) антитело представляет собой моноспецифическое антитело. В одном из вариантов осуществления изобретения моноспецифическое антитело представляет собой одновалентное моноспецифическое антитело. В одном из вариантов осуществления изобретения моноспецифическое антитело представляет собой двухвалентное моноспецифическое антитело.
В одном из вариантов осуществления изобретения (полноразмерное) антитело представляет собой биспецифическое антитело. В одном из вариантов осуществления изобретения биспецифическое антитело представляет собой двухвалентное биспецифическое антитело. В одном из вариантов осуществления изобретения биспецифическое антитело представляет собой четырехвалентное биспецифическое антитело.
В одном из вариантов осуществления изобретения (полноразмерное) антитело представляет собой триспецифическое антитело. В одном из вариантов осуществления изобретения триспецифическое антитело представляет собой трехвалентное триспецифическое антитело. В одном из вариантов осуществления изобретения триспецифическое антитело представляет собой четырехвалентное триспецифическое антитело.
Одним из объектов настоящего изобретения является антитело, содержащее первый полипептид, который содержит в направлении от N-конца к С-концу вариабельный домен первой тяжелой цепи, СН1-домен иммуноглобулина IgG1-подкласса, шарнирную область иммуноглобулина IgG1-подкласса, СН2-домен иммуноглобулина IgG1-подкласса и СН3-домен иммуноглобулина IgG1-подкласса,
второй полипептид, который содержит в направлении от N-конца к С-концу вариабельный домен второй тяжелой цепи, СН1-домен иммуноглобулина IgG1-подкласса, шарнирную область иммуноглобулина IgG1-подкласса, СН2-домен иммуноглобулина IgG1-подкласса и СН3-домен иммуноглобулина IgG1-подкласса,
третий полипептид, который содержит в направлении от N-конца к С-концу вариабельный домен первой легкой цепи и константный домен легкой цепи,
четвертый полипептид, который содержит в направлении от N-конца к С-концу вариабельный домен второй легкой цепи и константный домен легкой цепи,
в котором вариабельный домен первой тяжелой цепи и вариабельный домен первой легкой цепи образуют первый сайт связывания, который специфически связывается с первым антигеном,
в котором вариабельный домен второй тяжелой цепи и вариабельный домен второй легкой цепи образуют второй сайт связывания, который специфически связывается со вторым антигеном,
в котором I) первый полипептид содержит мутации Y349C, T366S, L368A и Y407V, L234A, L235A и P329G, а второй полипептид содержит мутации S354C и T366W, L234A, L235A и P329G, или II) первый полипептид содержит мутации S354C, T366S, L368A, Y407V, L234A, L235A и P329G, и второй полипептид содержит мутации Y349C, T366W, L234A, L235A и P329G, и
в котором (нумерация согласно системе нумерации на основе EU-индекса Кэбота)
I) первый полипептид содержит мутации I253A, Н310А и Н435А, а второй полипептид содержит мутации Н310А, Н433А и Y436A или
в котором вариабельный домен второй тяжелой цепи и вариабельный домен второй легкой цепи образуют второй сайт связывания, который специфически связывается со вторым антигеном,
II) первый полипептид содержит мутации I253A, Н310А и Н435А, а второй полипептид содержит мутации L251D, L314D и L432D, или
III) первый полипептид содержит мутации I253A, Н310А и Н435А, а второй полипептид содержит мутации L251S, L314S и L432S,
и
в котором первый полипептид и второй полипептид соединены с помощью одного или нескольких дисульфидных мостиков в шарнирной области.
Одним из объектов настоящего изобретения является антитело, содержащее
первый полипептид, который содержит в направлении от N-конца к С-концу вариабельный домен первой тяжелой цепи, константный домен легкой цепи иммуноглобулина, шарнирную область иммуноглобулина IgG1-подкласса, СН2-домен иммуноглобулина IgG1-подкласса и СН3-домен иммуноглобулина IgG1-подкласса,
второй полипептид, который содержит в направлении от N-конца к С-концу вариабельный домен второй тяжелой цепи, СН1-домен иммуноглобулина IgG1-подкласса, шарнирную область иммуноглобулина IgG1-подкласса, СН2-домен иммуноглобулина IgG1-подкласса и СН3-домен иммуноглобулина IgG1 -подкласса,
третий полипептид, который содержит в направлении от N-конца к С-концу вариабельный домен первой легкой цепи и СН1-домен иммуноглобулина IgG1-подкласса,
четвертый полипептид, который содержит в направлении от N-конца к С-концу вариабельный домен второй легкой цепи и константный домен легкой цепи,
в котором вариабельный домен первой тяжелой цепи и вариабельный домен первой легкой цепи образуют первый сайт связывания, который специфически связывается с первым антигеном,
в котором I) первый полипептид содержит мутации Y349C, T366S, L368A и Y407V, L234A, L235A и P329G, и второй полипептид содержит мутации S354C и T366W, L234A, L235A и P329G, или II) первый полипептид содержит мутации S354C, T366S, L368A, Y407V, L234A, L235A и P329G, и второй полипептид содержит мутации Y349C, T366W, L234A, L235A и P329G, и
в котором (нумерация согласно системе нумерации на основе EU-индекса Кэбота)
I) первый полипептид содержит мутации I253A, Н310А и Н435А, и второй полипептид содержит мутации Н310А, Н433А и Y436A или
II) первый полипептид содержит мутации I253A, Н310А и Н435А, и второй полипептид содержит мутации L251D, L314D и L432D, или
III) первый полипептид содержит мутации I253A, Н310А и Н435А, второй полипептид содержит мутации L251S, L314S и L432S,
и
в котором первый полипептид и второй полипептид соединены с помощью одного или нескольких дисульфидных мостиков в шарнирной области.
3. Одним из объектов настоящего изобретения является антитело, содержащее
первый полипептид, который содержит в направлении от N-конца к С-концу вариабельный домен первой тяжелой цепи, СН1-домен иммуноглобулина IgG4-подкласса, шарнирную область иммуноглобулина IgG4-подкласса, СН2-домен иммуноглобулина IgG4-подкласса и СН3-домен иммуноглобулина IgG4-подкласса,
второй полипептид, который содержит в направлении от N-конца к С-концу вариабельный домен второй тяжелой цепи, СН1-домен иммуноглобулина IgG4-подкласса, шарнирную область иммуноглобулина IgG4-подкласса, СН2-домен иммуноглобулина IgG4-подкласса и СН3-домен иммуноглобулина IgG4-подкласса,
третий полипептид, который содержит в направлении от N-конца к С-концу вариабельный домен первой легкой цепи и константный домен легкой цепи,
четвертый полипептид, который содержит в направлении от N-конца к С-концу вариабельный домен второй легкой цепи и константный домен легкой цепи,
в котором вариабельный домен первой тяжелой цепи и вариабельный домен первой легкой цепи образуют первый сайт связывания, который специфически связывается с первым антигеном,
в котором вариабельный домен второй тяжелой цепи и вариабельный домен второй легкой цепи образуют второй сайт связывания, который специфически связывается со вторым антигеном,
в котором I) первый полипептид содержит мутации Y349C, T366S, L368A и Y407V, S228P, L235E и P329G, и второй полипептид содержит мутации S354C и T366W, S228P, L235E и P329G, или II) первый полипептид содержит мутации S354C, T366S, L368A, Y407V, S228P, L235E и P329G, и второй полипептид содержит мутации Y349C, T366W, S228P, L235E и P329G, и
в котором (нумерация согласно системе нумерации на основе EU-индекса Кэбота)
I) первый полипептид содержит мутации I253A, Н310А и Н435А, и второй полипептид содержит мутации Н310А, Н433А и Y436A или
II) первый полипептид содержит мутации I253A, Н310А и Н435А, и второй полипептид содержит мутации L251D, L314D и L432D, или
III) первый полипептид содержит мутации I253A, Н310А и Н435А, второй полипептид содержит мутации L251S, L314S и L432S,
и
в котором первый полипептид и второй полипептид соединены с помощью одного или нескольких дисульфидных мостиков в шарнирной области.
4. Одним из объектов настоящего изобретения является антитело, содержащее
первый полипептид, который содержит в направлении от N-конца к С-концу вариабельный домен первой тяжелой цепи, константный домен легкой цепи иммуноглобулина, шарнирную область иммуноглобулина IgG4-подкласса, СН2-домен иммуноглобулина IgG4-подкласса и СН3-домен иммуноглобулина IgG4-подкласса,
второй полипептид, который содержит в направлении от N-конца к С-концу вариабельный домен второй тяжелой цепи, СН1-домен иммуноглобулина IgG4-подкласса, шарнирную область иммуноглобулина IgG4-подкласса, СН2-домен иммуноглобулина IgG4-подкласса и СН3-домен иммуноглобулина IgG4-подкласса,
третий полипептид, который содержит в направлении от N-конца к С-концу вариабельный домен первой легкой цепи и СН1-домен иммуноглобулина IgG4-подкласса,
четвертый полипептид, который содержит в направлении от N-конца к С-концу вариабельный домен второй легкой цепи и константный домен легкой цепи,
в котором вариабельный домен первой тяжелой цепи и вариабельный домен первой легкой цепи образуют первый сайт связывания, который специфически связывается с первым антигеном,
в котором вариабельный домен второй тяжелой цепи и вариабельный домен второй легкой цепи образуют второй сайт связывания, который специфически связывается со вторым антигеном,
в котором I) первый полипептид содержит мутации Y349C, T366S, L368A и Y407V, S228P, L235E и P329G, и второй полипептид содержит мутации S354C и T366W, S228P, L235E и P329G S354C, или II) первый полипептид содержит мутации S354C, T366S, L368A, Y407V, S228P, L235E и P329G, и второй полипептид содержит мутации Y349C, T366W, S228P, L235E и P329G, и
в котором (нумерация согласно системе нумерации на основе EU-индекса Кэбота)
I) первый полипептид содержит мутации I253A, Н310А и Н435А, и второй полипептид содержит мутации Н310А, Н433А и Y436A или
II) первый полипептид содержит мутации I253A, Н310А и Н435А, и второй полипептид содержит мутации L251D, L314D и L432D, или
III) первый полипептид содержит мутации I253A, Н310А и Н435А, второй полипептид содержит мутации L251S, L314S и L432S, и
в котором первый полипептид и второй полипептид соединены с помощью одного или нескольких дисульфидных мостиков в шарнирной области.
5. Одним из объектов настоящего изобретения является антитело, содержащее
первый полипептид, который содержит в направлении от N-конца к С-концу вариабельный домен первой тяжелой цепи, СН1-домен иммуноглобулина IgG1-подкласса, шарнирную область иммуноглобулина IgG1-подкласса, СН2-домен иммуноглобулина IgG1-подкласса и СН3-домен иммуноглобулина IgG1-подкласса, пептидный линкер и первый scFv,
второй полипептид, который содержит в направлении от N-конца к С-концу вариабельный домен второй тяжелой цепи, СН1-домен иммуноглобулина IgG1-подкласса, шарнирную область иммуноглобулина IgG1-подкласса, СН2-домен иммуноглобулина IgG1-подкласса и СН3-домен иммуноглобулина IgG1-подкласса, пептидный линкер и второй scFv,
третий полипептид, который содержит в направлении от N-конца к С-концу вариабельный домен первой легкой цепи и константный домен легкой цепи,
четвертый полипептид, который содержит в направлении от N-конца к С-концу вариабельный домен второй легкой цепи и константный домен легкой цепи,
в котором вариабельный домен первой тяжелой цепи и вариабельный домен первой легкой цепи образуют первый сайт связывания, который специфически связывается с первым антигеном, и вариабельный домен второй тяжелой цепи и вариабельный домен второй легкой цепи образуют второй сайт связывания, который специфически связывается с первым антигеном, и первый и второй scFv специфически связываются со вторым антигеном,
в котором I) первый полипептид содержит мутации Y349C, T366S, L368A и Y407V, L234A, L235A и P329G, и второй полипептид содержит мутации S354C и T366W, L234A, L235A и P329G, или II) первый полипептид содержит мутации S354C, T366S, L368A, Y407V, L234A, L235A и P329G, и второй полипептид содержит мутации Y349C, T366W, L234A, L235A и P329G, и
в котором (нумерация согласно системе нумерации на основе EU-индекса Кэбота)
I) первый полипептид содержит мутации I253A, Н310А и Н435А, и второй полипептид содержит мутации Н310А, Н433А и Y436A или
II) первый полипептид содержит мутации I253A, Н310А и Н435А, и второй полипептид содержит мутации L251D, L314D и L432D, или
III) первый полипептид содержит мутации I253A, Н310А и Н435А, второй полипептид содержит мутации L251S, L314S и L432S, и
в котором первый полипептид и второй полипептид соединены с помощью одного или нескольких дисульфидных мостиков в шарнирной области.
6. Одним из объектов настоящего изобретения является антитело, содержащее
первый полипептид, который содержит в направлении от N-конца к С-концу вариабельный домен первой тяжелой цепи, константный домен легкой цепи иммуноглобулина, шарнирную область иммуноглобулина IgG1-подкласса, СН2-домен иммуноглобулина IgG1-подкласса и СН3-домен иммуноглобулина IgG1-подкласса, пептидный линкер и первый scFv,
второй полипептид, который содержит в направлении от N-конца к С-концу вариабельный домен второй тяжелой цепи, СН1-домен иммуноглобулина IgG1-подкласса, шарнирную область иммуноглобулина IgG1-подкласса, СН2-домен иммуноглобулина IgG1-подкласса и СН3-домен иммуноглобулина IgG1-подкласса, пептидный линкер и второй scFv,
третий полипептид, который содержит в направлении от N-конца к С-концу вариабельный домен первой легкой цепи и СН1-домен иммуноглобулина IgG1-подкласса,
четвертый полипептид, который содержит в направлении от N-конца к С-концу вариабельный домен второй легкой цепи константный домен легкой цепи,
в котором вариабельный домен первой тяжелой цепи и вариабельный домен первой легкой цепи образуют первый сайт связывания, который специфически связывается с первым антигеном, и вариабельный домен второй тяжелой цепи и вариабельный домен второй легкой цепи образуют второй сайт связывания, который специфически связывается с первым антигеном, и первый и второй scFv специфически связываются со вторым антигеном,
в котором I) первый полипептид содержит мутации Y349C, T366S, L368A и Y407V, L234A, L235A и P329G, и второй полипептид содержит мутации S354C и T366W, L234A, L235A и P329G, или II) первый полипептид содержит мутации S354C, T366S, L368A, Y407V, L234A, L235A и P329G, и второй полипептид содержит мутации Y349C, T366W, L234A, L235A и P329G, и
в котором (нумерация согласно системе нумерации на основе EU-индекса Кэбота)
I) первый полипептид содержит мутации I253A, Н310А и Н435А, и второй полипептид содержит мутации Н310А, Н433А и Y436A или
II) первый полипептид содержит мутации I253A, Н310А и Н435А, и второй полипептид содержит мутации L251D, L314D и L432D, или
III) первый полипептид содержит мутации I253A, Н310А и Н435А, второй полипептид содержит мутации L251S, L314S и L432S,
и
в котором первый полипептид и второй полипептид соединены с помощью одного или нескольких дисульфидных мостиков в шарнирной области.
Одним из объектов настоящего изобретения является способ получения (димерного) полипептида, указанного в настоящем описании, заключающийся в том, что осуществляют следующие стадии, на которых:
а) культивируют клетку млекопитающего, которая содержит одну или несколько нуклеиновых кислот, кодирующих (димерный) полипептид,
б) выделяют (димерный) полипептид из среды для культивирования, и
в) очищают (димерный) полипептид с помощью аффинной хроматографии на белке А и тем самым получают (димерный) полипептид.
Одним из объектов настоящего изобретения является применение комбинации мутаций Н310А, Н433А и Y436A для отделения гетеродимерных полипептидов от гомодимерных полипептидов.
Одним из объектов настоящего изобретения является применение комбинации мутаций L251D, L314D и L432D для отделения гетеродимерных полипептидов от гомодимерных полипептидов.
Одним из объектов настоящего изобретения является применение комбинации мутаций L251S, L314S и L432S для отделения гетеродимерных полипептидов от гомодимерных полипептидов.
Одним из объектов настоящего изобретения является применение комбинации мутаций I253A, Н310А и Н435А в первом полипептиде Fc-области в комбинации с мутациями Н310А, Н433А и Y436A во втором полипептиде Fc-области для отделения гетеродимерных Fc-областей, содержащих первый и второй полипептиды Fc-области, от гомодимерных Fc-областей.
Одним из объектов настоящего изобретения является применение комбинации мутаций I253A, Н310А и Н435А в первом полипептиде Fc-области в комбинации с мутациями L251D, L314D и L432D во втором полипептиде Fc-области для отделения гетеродимерных Fc-областей, содержащих первый и второй полипептиды Fc-области, от гомодимерных Fc-областей.
Одним из объектов настоящего изобретения является применение комбинации мутаций I253A, Н310А и Н435А в первом полипептиде Fc-области в комбинации с мутациями L251S, L314S и L432S во втором полипептиде Fc-области для отделения гетеродимерных Fc-областей, содержащих первый и второй полипептиды Fc-области, от гомодимерных Fc-областей.
В одном из варианте осуществления трех указанных выше объектов изобретения I) первый полипептид Fc-области дополнительно содержит мутации Y349C, T366S, L368A и Y407V, а второй полипептид Fc-области дополнительно содержит мутации S354C и T366W или II) первый полипептид содержит мутации S354C, T366S, L368A и Y407V, а второй полипептид содержит мутации Y349C и T366W.
В одном из вариантов осуществления изобретения оба полипептида Fc-области содержат в направлении от N-конца к С-концу вариабельный домен тяжелой цепи, СН1-домен иммуноглобулина, шарнирную область иммуноглобулина, СН2-домен иммуноглобулина и СН3-домен иммуноглобулина. В одном из вариантов осуществления изобретения шарнирная область и домены иммуноглобулина все относятся к IgG1-подклассу или все относятся к IgG4-подклассу.
Одним из объектов настоящего изобретения является способ лечения пациента, страдающего сосудистыми глазными заболеваниями, заключающийся в том, что вводят пациенту, который нуждается в таком лечении, (димерный) полипептид или антитело, указанный/указанное в настоящем описании.
Одним из объектов настоящего изобретения является (димерный) полипептид или антитело, указанный/указанное в настоящем описании, предназначенный/предназначенное для интравитреального применения.
Одним из объектов настоящего изобретения является (димерный) полипептид или антитело, указанный/указанное в настоящем описании, предназначенный/предназначенное для применения в качестве лекарственного средства.
Одним из объектов настоящего изобретения является (димерный) полипептид или антитело, указанный/указанное в настоящем описании, предназначенный/предназначенное для лечения сосудистых глазных заболеваний.
Одним из объектов настоящего изобретения является фармацевтическая композиция, содержащая (димерный) полипептид или антитело, указанный/указанное в настоящем описании, и необязательно фармацевтически приемлемый носитель.
При применении антитела, которое направлено/связывается с антигенами, не только присутствующими в глазу, но также и в остальном организме, целесообразным является короткое системное время полужизни после прохождения гемато-окулярного барьера из глаза в кровь для того, чтобы избегать побочных действий.
Кроме того, антитело, которое специфически связывается с лигандами рецептора, является эффективным для лечения глазных болезней только, если комплекс антитело-антиген удаляется из глаза, т.е. антитело функционирует в качестве носителя для удаления лигандов рецептора из глаза, ингибируя тем самым передачу сигналов рецептором.
При создании настоящего изобретения было установлено, что антитело, содержащее Fc-область, которая не связывается с человеческим неонатальным Fc-рецептором, т.е. (димерный) полипептид, указанный в настоящем описании, может проникать через гемато-окулярный барьер. Это является неожиданным, поскольку антитело не связывается с человеческим FcRn, хотя связывание с FcRn рассматривается как необходимое для транспортирования через гемато-окулярный барьер.
Одним из объектов настоящего изобретения является применение (димерного) полипептида или антитела, указанного в настоящем описании, для транспортирования растворимого лиганда рецептора из глаза через гемато-окулярный барьер в кровоток.
Одним из объектов настоящего изобретения является применение (димерного) полипептида или антитела, указанного в настоящем описании, для удаления одного или нескольких растворимых лигандов рецептора из глаза.
Одним из объектов настоящего изобретения является применение (димерного) полипептида или антитела, указанного в настоящем описании, для лечения глазных заболеваний, прежде всего глазных сосудистых заболеваний.
Одним из объектов настоящего изобретения является применение (димерного) полипептида или антитела, указанного в настоящем описании, для транспортирования одного или нескольких растворимых лигандов рецептора из интравитреального пространства в кровоток.
Одним из объектов настоящего изобретения является (димерный) полипептид или антитело, указанный/указанное в настоящем описании, предназначенный/предназначенное для применения для лечения глазного заболевания.
Одним из объектов настоящего изобретения является (димерный) полипептид или антитело, указанный/указанное в настоящем описании, предназначенный/предназначенное для применения для транспортирования растворимого лиганда рецептора из глаза через гемато-окулярный барьер в кровоток.
Одним из объектов настоящего изобретения является (димерный) полипептид или антитело, указанный/указанное в настоящем описании, предназначенный/предназначенное для применения для удаления одного или нескольких растворимых лигандов рецептора из глаза.
Одним из объектов настоящего изобретения является (димерный) полипептид или антитело, указанный/указанное в настоящем описании, предназначенный/предназначенное для применения для лечения глазных заболеваний, прежде всего глазных сосудистых заболеваний.
Одним из объектов настоящего изобретения является (димерный) полипептид или антитело, указанный/указанное в настоящем описании, предназначенный/предназначенное для применения для транспортирования одного или нескольких растворимых лигандов рецептора из интравитреального пространства в кровоток.
Одним из объектов настоящего изобретения является способ лечения индивидуума, который имеет глазное заболевание, заключающийся в том, вводят индивидууму в эффективном количестве (димерный) полипептид или антитело, указанный/указанное в настоящем описании.
Одним из объектов настоящего изобретения является способ транспортирования растворимого лиганда рецептора из глаза через гемато-окулярный барьер в кровоток, заключающийся в том, вводят индивидууму в эффективном количестве (димерный) полипептид или антитело, указанный/указанное в настоящем описании, для транспортирования растворимого лиганда рецептора из глаза через гемато-окулярный барьер в кровоток.
Одним из объектов настоящего изобретения является способ удаления одного или нескольких растворимых лигандов рецептора из глаза индивидуума, заключающийся в том, вводят индивидууму в эффективном количестве (димерный) полипептид или антитело, указанный/указанное в настоящем описании, для удаления одного или нескольких растворимых лигандов рецептора из глаза.
Одним из объектов настоящего изобретения является способ транспортирования одного или нескольких растворимых лигандов рецептора из интравитреального пространства в кровоток индивидуума, заключающийся в том, вводят индивидууму в эффективном количестве (димерный) полипептид или антитело, указанный/указанное в настоящем описании, для транспортирования одного или нескольких растворимых лигандов рецептора из интравитреального пространства в кровоток.
Одним из объектов настоящего изобретения является способ транспортирования растворимого лиганда рецептора из интравитреального пространства или глаза через гемато-окулярный барьер в кровоток индивидуума, заключающийся в том, вводят индивидууму в эффективном количестве (димерный) полипептид или антитело, указанный/указанное в настоящем описании, для транспортирования растворимого лиганда рецептора из глаза через гемато-окулярный барьер в кровоток.
В одном из вариантов осуществления изобретения (димерный) полипептид представляет собой биспецифическое антитело. В одном из вариантов осуществления изобретения биспецифическое антитело представляет собой двухвалентное биспецифическое антитело. В одном из вариантов осуществления изобретения биспецифическое антитело представляет собой четырехвалентное биспецифическое антитело.
В одном из вариантов осуществления изобретения (димерный) полипептид представляет собой триспецифическое антитело. В одном из вариантов осуществления изобретения триспецифическое антитело представляет собой трехвалентное биспецифическое антитело. В одном из вариантов осуществления изобретения триспецифическое антитело представляет собой четырехвалентное триспецифическое антитело.
В одном из вариантов осуществления изобретения (димерный) полипептид представляет собой CrossMab.
В одном из вариантов осуществления изобретения (димерный) полипептид представляет собой содержащий Fc-область слитый полипептид.
В одном из вариантов осуществления изобретения первый полипептид дополнительно содержит мутации Y349C, T366S, L368A и Y407V, а второй полипептид дополнительно содержит мутации S354C и T366W.
В одном из вариантов осуществления изобретения первый полипептид дополнительно содержит мутации S354C, T366S, L368A и Y407V, а второй полипептид дополнительно содержит мутации Y349C и T366W.
В одном из вариантов осуществления изобретения антитело или Fc-область слитого полипептида относится к IgG1-подклассу. В одном из вариантов осуществления изобретения антитело или Fc-область слитого полипептида дополнительно содержат мутации L234A и L235A. В одном из вариантов осуществления изобретения антитело или Fc-область слитого полипептида дополнительно содержат мутацию P329G.
В одном из вариантов осуществления изобретения антитело или Fc-область слитого полипептида относится к IgC2-подклассу. В одном из вариантов осуществления изобретения антитело или Fc-область слитого полипептида дополнительно содержат мутации V234A, G237A, P238S, Н268А, V309L, A330S и P331S.
В одном из вариантов осуществления изобретения антитело или Fc-область слитого полипептида относится к IgG4-подклассу. В одном из вариантов осуществления изобретения антитело или Fc-область слитого полипептида дополнительно содержат мутации S228P и L235E. В одном из вариантов осуществления изобретения антитело или Fc-область слитого полипептида дополнительно содержат мутацию P329G.
Краткое описание чертежей
На чертежах показано:
на фиг. 1 - схема, иллюстрирующая концепцию и преимущества антител к VEGF-ANG-2 (<VEGF-ANG-2>) IgG1 - или IgG4-подкласса с мутацией IHH-ААА (представляющей собой комбинацию мутаций I253A, Н310А и Н435А (нумерация согласно системе нумерации на основе EU-индекса Кэбота);
на фиг. 2 - результаты измерений вязкости в лабораторных условиях на основе DLS (динамическое рассеяние света). Представлены данные о полученной путем экстраполяции вязкости при 150 мг/мл в 200 мМ аргинин/сукцинатном буфере, рН 5,5 (сравнение антитела к VEGF/ANG2 VEGF/ ANG2-0016 (с IHH-AAA-мутациями) с референс-антителом VEGF/ANG2-0015 (без указанной IHH-ААА-мутации));
на фиг. 3 - полученные с помощью DLS данные об агрегации в зависимости от температуры (включающие полученные с помощью DLS данные о температуре начала агрегации) в 20 мМ гистидиновом буфере, 140 мМ NaCl, рН 6,05 (сравнение антитела к VEGF/ANG2, предлагаемого в изобретении, VEGF/ANG2-0016 (с IHH-ААА-мутацией) с референс-антителом VEGF/ANG2-0015 (без указанной IHH-ААА-мутации));
на фиг. 4 - данные о хранении в течение 7 дней при 40°С в концентрации 100 мг/мл (снижение основного пика и повышение пика, соответствующего высокомолекулярным (HMW) видам (сравнение антитела к VEGF/ANG2, предлагаемого в изобретении, VEGF/ANG2-0016 (с IHH-AAA-мутацией), для которого характерна более низкая агрегация, с референс-антителом VEGF/ANG2-0015 (без указанной IHH-ААА-мутации);
на фиг. 5А и Б - данные об аффинности к FcRn в стабильном состоянии А: VEGF/ANG2-0015 (без IHH-ААА-мутации) и Б: VEGF/ANG2-0016 (с IHH-ААА-мутацией);
на фиг. 6 - результаты количественной оцени взаимодействия FcгаммаRIIIa с VEGF/ANG2-0015 без IHH-AAA-мутации и VEGF/ANG2-0016 с IHH-AAA-мутацией (оба в виде антител IgG1-подкласса с мутациями P329G LALA; в качестве контроля применяли антитело к дигоксигенину (анти-Dig) IgG1-покласса и антитело, основой которого являлся IgG4);
на фиг. 7А - схема, иллюстрирующая принцип применяемого для изучения фармакокинетики (ФК) ELISA-анализа, предназначенного для определения концентраций антител к VEGF//ANG2 в сыворотке и лизатах всего глаза;
на фиг. 7Б - концентрация в сыворотке после внутривенного введения: сравнение VEGF/ANG2-0015 без IHH-AAA-мутации и VEGF/ANG2-0016 с IHH-ААА-мутацией;
на фиг. 7В - концентрация в сыворотке после интравитреального введения: сравнение VEGF/ANG2-0015 без IHH-AAA-мутации и VEGF/ANG2-0016 с IHH-ААА-мутацией;
на фиг. 7Г - концентрация в глазных лизатах VEGF/ANG2-0016 (с IHH-AAA мутацией) в правом и левом глазу (после интравитреального введения только в правый глаз в сравнении с внутривенным введением): после интравитреального введения значительные концентрации удалось обнаружить только в правом глазу. После внутривенного введения в лизатах глаз не удалось обнаружить никаких концентраций из-за небольшого времени полужизни в сыворотке VEGF/ANG2-0016 (с IHH-ААА-мутацией);
на фиг. 7Д - концентрация глазных в лизатах VEGF/ANG2-0015 (без IHH-ААА-мутации) правого и левого глаза (после интравитреального введения только в правый глаз в сравнении с внутривенным введением): в правом глазу (и в некоторой степени в левом глазу) после интравитреального введения удалось обнаружить концентрации VEGF/ANG2-0015; это свидетельствует о диффузии из правого глаза в сыворотку и из нее в левый глаз, что можно объяснить длительным временем полужизни VEGF/ANG2-0015 (без IHH-AAA-мутации); после внутривенного введения удалось также обнаружить значительные концентрации в лизатах обоих глаз в результате диффузии в глаза сохраняющего стабильность в сыворотке VEGF/ANG2-0015 (без IHH-AAA-мутации);
на фиг. 8 - результаты, демонстрирующие, что антитела, сконструированные с учетом их способности связываться с FcRn, характеризуются пролонгированным (YTE-мутация) или укороченным (IHH-ААА-мутация) временем полужизни in vivo, усиленным (YTE-мутация) или ослабленным связыванием (IHH-ААА-мутация) по сравнению с референс-антителом дикого типа (wt) при оценке с помощью SPR-анализа, а также увеличенным или уменьшенным временем удерживания при оценке с помощью хроматографии на колонках с FcRn; а) ФК-данные после однократной болюсной i.v.-инъекции в дозе 10 мг/кг трансгенным по huFcRn самцам мышей C57BL/6J +/- 276: данные о AUC для IgG дикого типа, а также IgG с модифицированными с помощью YTE и IHH-AAA Fc-областями; б) BIAcore-сенсограмма; в) результаты элюции из содержащей FcRn аффинной колонки; антитело к IGF-1R дикого типа (референс-антитело), YTE-мутант антитела к IGF-1R, IHH-ААА-мутант антитела к IGF-1R;
на фиг. 9 - данные об изменение времени удерживания, определенные с помощью FcRn-аффинной хроматографии, в зависимости от количества мутаций, интродуцированных в Fc-область;
на фиг. 10 - данные об изменении FcRn-связывания в зависимости от асимметричного распределения мутаций, интродуцированных в Fc-область;
на фиг. 11 - хроматограмма, полученная в результате элюции биспецифического антитела к VEGF/ANG2 (VEGF/ANG2-0121) с комбинацией мутаций Н310А, Н433А и Y436A в обеих тяжелых цепях, из двух последовательно расположенных колонок для аффинной хроматографии с белком А;
на фиг. 12 - хроматограмма, полученная в результате элюции антитела к IGF-1R (IGF-1R-0045) с мутациями Н310А, Н433А и Y436A в обеих тяжелых цепях, из колонки для аффинной хроматографии с белком А;
на фиг. 13 - данные о связывание антител к VEGF/ANG2 с модифицированной Fc-областью IgG с иммобилизованным белком А на СМ5-чипе;
на фиг. 14 - хроматограмма, полученная в результате элюции различных антител к VEGF/ANG2 из содержащей FcRn аффинной колонки;
на фиг. 15 - данные о связывании различных слитых полипептидов с белком А стафилококков (SPR);
на фиг. 16 - данные о связывании антитела к VEGF/ANG2 и мутантов антитела к IGF-1R с иммобилизованным белком A (SPR);
на фиг. 17 - сравнительные данные о концентрациях в сыворотке после внутривенного введения антител к IGF-1R 0033, 0035 и 0045;
на фиг. 18 - сравнительные данные о концентрации в лизате глаза после интравитреального и внутривенного введения антитела к IGF-1R 0033;
на фиг. 19 - сравнительные данные о концентрации в лизате глаза после интравитреального и внутривенного введения антитела к IGF-1R 0035;
на фиг. 20 - сравнительные данные о концентрации в лизате глаза после интравитреального и внутривенного введения антитела к IGF-1R 0045.
Подробное описание вариантов осуществления изобретения
I. Определения
Понятие «примерно» означает, что величина находится в пределах ±20% от указанного далее численного значения. В одном из вариантов осуществления изобретения понятие означает, что величина находится в пределах ±10% от указанного далее численного значения. В одном из вариантов осуществления изобретения понятие означает, что величина находится в пределах ±5% от указанного далее численного значения.
В контексте настоящего описания «акцепторный человеческий каркасный участок» означает каркасный участок, содержащий аминокислотную последовательность каркасного участка вариабельного домена легкой цепи (VL) или каркасного участка вариабельного домена тяжелой цепи (VH), выведенного из каркасного участка человеческого иммуноглобулина или консенсусного человеческого каркасного участка, указанного ниже. Акцепторный человеческий каркасный участок «выведенный из» каркасного участка человеческого иммуноглобулина или консенсусного человеческого каркасного участка, может содержать такую же аминокислотную последовательность или может содержать замены в аминокислотной последовательности. В некоторых вариантах осуществления изобретения количество аминокислотных замен составляет 10 или менее, 9 или менее, 8 или менее, 7 или менее, 6 или менее, 5 или менее, 4 или менее, 3 или менее или 2 или менее. В некоторых вариантах осуществления изобретения последовательность акцепторного человеческого каркасного участка VL идентична последовательности каркасного участка VL человеческого иммуноглобулина или последовательности консенсусного человеческого каркасного участка.
Антитело «с созревшей аффинностью» означает антитело с одним или несколькими изменениями в одном или нескольких гипервариабельных участках (HVR) по сравнению с родительским антителом, которое не содержит указанных изменений, указанные изменения приводят к повышению аффинности антитела к антигену.
Понятие «изменение» означает мутацию (замена), инсерцию (добавление) или делецию одного или нескольких аминокислотных остатков в родительском антителе или слитом полипептиде, например, слитом полипептиде, который содержит по меньшей мере FcRn-связывающий фрагмент Fc-области, с получением модифицированного антитела или слитого полипептида. Понятие «мутация» означает, что конкретный аминокислотный остаток заменен на другой аминокислотный остаток. Например, мутация L234A означает, что аминокислотный остаток лизина в положении 234 в Fc-области антитела (полипептиде) заменен на аминокислотный остаток аланина (замена лизина на аланин) (нумерация согласно системе нумерации на основе EU-индекса Кэбота).
«Встречающиеся в естественных условиях аминокислотные остатки» означают аминокислотный остаток, выбранный из группы, включающей аланин (трехбуквенный код: Ala, однобуквенный код: А), аргинин (Arg, R), аспарагин (Asn, N), аспарагиновую кислоту (Asp, D), цистеин (Cys, С), глутамин (Gln, Q), глутаминовую кислоту (Glu, Е), глицин (Gly, G), гистидин (His, Н), изолейцин (Ile, I), лейцин (Leu, L), лизин (Lys, К), метионин (Met, М), фенилаланин (Phe, F), пролин (Pro, Р), серии (Ser, S), треонин (Thr, Т), триптофан (Trp, W), тирозин (Tyr, Y) и валин (Val, V).
Понятие «аминокислотная мутация» означает замену по меньшей мере одного существующего аминокислотного остатка на другой отличный от него аминокислотный остаток (т.е. замещающий аминокислотный остаток). Замещающий аминокислотный остаток может представлять собой «встречающиеся в естественных условиях аминокислотные остатки» и их выбирают из группы, включающей аланин (трехбуквенный код: ala, однобуквенный код: А), аргинин (arg, R), аспарагин (asn, N), аспарагиновую кислоту (asp, D), цистеин (cys, С), глутамин (gln, Q), глутаминовую кислоту (glu, Е), глицин (gly, G), гистидин (his, Н), изолейцин (ile, I), лейцин (leu, L), лизин (lys, K), метионин (met, М), фенилаланин (phe, F), пролин (pro, Р), серии (ser, S), треонин (thr, Т), триптофан (trp, W), тирозин (tyr, Y) и валин (val, V). Замещающий аминокислотный остаток может представлять собой «не встречающийся в естественных условиях аминокислотный остаток» (см., например, US 6586207, WO 98/48032, WO 03/073238, US 2004/0214988, WO 2005/35727, WO 2005/74524, Chin J.W. и др., J. Am. Chem. Soc. 124, 2002, cc. 9026-9027; Chin J.W. и Schultz P.G., ChemBioChem 11, 2002, cc. 1135-1137; Chin J.W. и др., PICAS United States of America 99, 2002, cc. 11020-11024; и Wang L. и Schultz, P.G. Chem., 2002, cc. 1-10 (все публикации полностью включены в настоящее описание в качестве ссылки).
Понятие «аминокислотная делеция» означает удаление по меньшей мере одного аминокислотного остатка в предварительно определенном положении в аминокислотной последовательности.
В контексте настоящего описания понятие «ANG-2» относится к человеческому ангиопоэтину-2 (ANG-2) (который сокращенного обозначают как ANGPT2 или ANG2) (SEQ ID NO: 31), который описан, например, у Maisonpierre Р.С. и др., Science 277,1997, сс. 55-60 и Cheung А.Н. и др., Genomics 48, 1998, сс. 389-391. Ангиопоэтины-1 (SEQ ID NO: 32) и -2 описаны в качестве лигандов Tie, семейства тирозинкиназ, которые избирательно экспрессируются в сосудистом эндотелии (Yancopoulos G.D. и др., Nature 407, 2000, 242-248). В настоящее время известно четыре определенных представителя семейства ангиопоэтинов. Ангиопоэтин-3 и -4 (Ang-3 и Ang-4) могут представлять собой отличающиеся широким разнообразием копии одного и того же генного локуса у мышей и человека (Kim I. и др., FEBS Let, 443, 1999, сс. 353-356; Kim I. и др., J Biol Chem 274, 1999, сс. 26523-26528). ANG-1 и ANG-2 впервые идентифицированы в экспериментах, проведенных на культурах ткани, в качестве агониста и антагониста соответственно (см. касательно ANG-1: Davis S. и др., Cell 87, 1996, сс. 1161-1169; и касательно ANG-2: Maisonpierre Р.С. и др., Science 277, 1997, сс. 55-60). Все известные ангиопоэтины связываются прежде всего с Tie2 (SEQ ID NO: 33), а аффинность связывания обоих Ang-1 и -2 с Tie2 составляет 3нМ (Kd) (Maisonpierre Р.С. и др., Science 277, 1997, сс. 55-60).
В контексте настоящего описания понятие «антитело» используется в его наиболее широком смысле и относится к различным структурам антител, включая (но, не ограничиваясь только ими) моноклональные антитела, мультиспецифические антитела (например, биспецифические антитела, триспецифические антитела) и фрагменты антител, при условии, что они обладают требуемой антиген- и/или белок А, и/или FcRn-связывающей активностью.
Понятие «асимметричная Fc-область» обозначает пару полипептидов Fc-области, которые имеют различные аминокислотные остатки в соответствующих положениях согласно системе нумерации на основе EU-индекса Кэбота.
Понятие «асимметричная Fc-область в отношении FcRn-связывания» относится к Fc-области, которая состоит из двух полипептидных цепей, которые имеют различные аминокислотные остатки в соответствующих положениях, где положения определяют согласно системе нумерации на основе EU-индекса Кэбота, при этом различные положения влияют на связывание Fc-области с человеческим неонатальным Fc-рецептором (FcRn). Для целей настоящего описания различия между двумя полипептидными цепями Fc-области в «асимметричной Fc-области в отношении FcRn-связывания» не включают различия, интродуцированные для облегчения образования гетеродимерных Fc-областей, например, для получения биспецифических антител. Указанные различия также могут быть асимметричными, это означает, что две цепи имеют различия в несоответствующих аминокислотных остатках согласно системе нумерации на основе EU-индекса Кэбота. Такие различия облегчают гетеродимеризацию и снижают гомодимеризацию. Примерами таких различий являются так называемые замены типа «выступы во впадины», полученные с помощью технологии «knobs-into-holes» (обеспечение взаимодействия по типу «выступы во впадины») (см., например, US 7695936 и US 2003/0078385). Установлено, что следующие замены типа «выступы во впадины» в индивидуальных полипептидных цепях Fc-области антитела класса IgG подкласса IgG1 повышают образование гетеродимера: 1) Y407T в одной цепи и T366Y в другой цепи; 2) Y407A в одной цепи и T366W в другой цепи; 3) F405A в одной цепи и T394W в другой цепи; 4) F405W в одной цепи и T394S в другой цепи; 5) Y407T в одной цепи и T366Y в другой цепи; 6) T366Y и F405A в одной цепи и T394W и Y407T в другой цепи; 7) T366W и F405W в одной цепи и T394S и Y407A в другой цепи; 8) F405W и Y407A в одной цепи и T366W и T394S в другой цепи; и 9) T366W в одной цепи и T366S, L368A и Y407V в другой цепи, при этом последний вариант является наиболее приемлемым. Кроме того, изменения, приводящие к созданию новых дисульфидных мостиков между двумя полипептидными цепями Fc-области, облегчают образование гетеродимера (см., например, US 2003/0078385). Кроме того, установлено, что следующие замены, приводящие к соответствующему пространственному расположению отдельных остатков цистеина, что обеспечивает образование новых внутрицепочечных дисульфидных связей в индивидуальных полипептидных цепях Fc-области антитела класса IgG подкласса IgG1, повышают формирование гетеродимера: Y349C в одной цепи и S354C в другой; Y349C в одной цепи и Е356С в другой; Y349C в одной цепи и Е357С в другой; L351C в одной цепи и S354C в другой; Т394С в одной цепи и Е397С в другой; или D399C в одной цепи и К392С в другой. Другими примерами аминокислотных замен, облегчающих гетеродимеризацию, являются так называемые «замены заряженных пар» (см., например, WO 2009/089004). Установлено, что следующие замены заряженных пар индивидуальных полипептидных цепей Fc-области антитела класса IgG подкласса IgG1 повышают формирование гетеродимера: 1) K409D или К409Е в одной цепи и D399K или D399R в другой цепи; 2) K392D или K392Е в одной цепи и D399K или D399R в другой цепи; 3) K439D или K439Е в одной цепи и Е356К или E356R в другой цепи; 4) K370D или K370E в одной цепи и Е357К или E357R в другой цепи; 5) K409D и K360D в одной цепи плюс D399K и Е356К в другой цепи; 6) K409D и K370D в одной цепи плюс D399K и Е357К в другой цепи; 7) K409D и K392D в одной цепи плюс D399K, E356K и E357K в другой цепи; 8) K409D и K392D в одной цепи и D399K в другой цепи; 9) K409D и K392D в одной цепи и D399K и Е356К в другой цепи; 10) K409D и K392D в одной цепи и D39K и D357K в другой цепи; 11) K409D и K370D в одной цепи и D399K и D357K в другой цепи; 12) D399K в одной цепи и K409D и K360D в другой цепи; и 13) K409D и K439D в одной цепи и D399K и Е356К в другой.
Понятие «связывание (с антигеном)» относится к связыванию антитела с его антигеном, установленному с помощью анализа in vitro, в одном из вариантов осуществления изобретения с помощью анализа связывания, при котором антитело связывается с поверхностью и связывание антигена с антителом измеряют с использованием поверхностного плазмонного резонанса (SPR). Связывание характеризуется аффинностью связывания (KD), составляющей 10-8 М или менее, в некоторых вариантов осуществления от 10-13 до 10-9М.
Связывание можно исследовать с помощью BIAcore-анализа (фирма GE-Healthcare, Уппсала, Швеция). Аффинность связывания оценивают в понятиях ka (константа скорости ассоциации антитела в комплексе антитело/антиген), kd (константа диссоциации) и KD (kd/ka).
Понятие «химерное» антитело относится к антителу, в котором часть тяжелой и/или легкой цепи получена из конкретного источника или конкретных видов, а остальная часть тяжелой и/или легкой цепи получена из другого источника или других видов.
Понятие «СН2-домен» относится к части полипептида тяжелой цепи антитела, которая простирается примерно от EU-положения 231 до EU-положения 340 (согласно системе нумерации на основе EU-индекса Кэбота). В одном из вариантов осуществления изобретения СН2-домен имеет аминокислотную последовательность SEQ ID NO: 09: 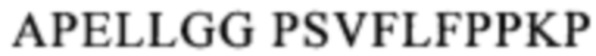
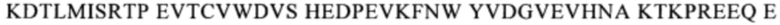
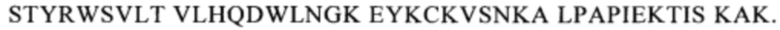
Понятие «СН3-домен» относится к части полипептида тяжелой цепи антитела, которая простирается примерно от EU-положения 341 до EU-положения 446 (согласно системе нумерации на основе EU-индекса Кэбота). В одном из вариантов осуществления изобретения СН3-домен имеет аминокислотную последовательность SEQ ID NO: 10: 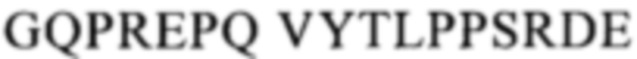
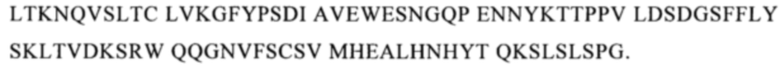
Понятие «класс» антитела относится к типу константного домена или константной области, который/которая входит в его тяжелую цепь. Известно пять основных классов антител: IgA, IgD, IgE, IgG и IgM и некоторые из них можно подразделять дополнительно на подклассы (изотипы), например, IgG1, IgG2, IgG3, IgG4, IgA1 и IgA2. Константные домены тяжелой цепи, которые соответствуют различным классам иммуноглобулина, обозначают как α, δ, ε, γ и μ соответственно.
Понятие «сопоставимая длина» означает, что два полипептида содержат идентичное количество аминокислотных остатков или могут отличаться по длине на один или несколько максимум вплоть до 10 аминокислотных остатков. В одном из вариантов осуществления изобретения полипептиды Fc-области содержат идентичное количество аминокислотных остатков или отличаются 1-10 аминокислотными остатками. В одном из вариантов осуществления изобретения полипептиды Fc-области содержат идентичное количество аминокислотных остатков или отличаются 1-5 аминокислотными остатками. В одном из вариантов осуществления изобретения полипептиды Fc-области содержат идентичное количество аминокислотных остатков или отличаются 1 -3 аминокислотными остатками.
Понятие «эффекторные функции» относится к тем видам биологической активности, которые связаны с Fc-областью антитела, которые варьируются в зависимости от класса антитела. Примеры эффекторных функций антитела включают: связывание C1q и комплементзависимую цитотоксичность (CDC); связывание Fc-рецептора; антитело-обусловленную клеточнозависимую цитотоксичность (ADCC); фагоцитоз; понижающую регуляция рецепторов клеточной поверхности (например, В-клеточного рецептора) и активацию В-клеток.
Понятие «эффективное количество» агента, например, фармацевтической композиции, означает количество, эффективное в дозах и в течение периода времени, необходимых для достижения требуемого терапевтического или профилактического результата.
Понятие «содержащий Fc слитый полипептид (слитый с Fc полипептид)» означает слияние связывающего домена (например, антигенсвязывающего домена, такого как одноцепочечное антитело, или полипептида, такого как лиганд или рецептор) с Fc-областью антитела, который обладает требуемой активностью связывания с мишенью и/или белком А, и/или FcRn.
Понятие «Fc-область человеческого происхождения» относится к С-концевой области тяжелой цепи человеческого иммуноглобулина, которая содержит по меньшей мере часть шарнирной области, СН2-домен и СН3-домен. В одном из вариантов осуществления изобретения Fc-область тяжелой цепи человеческого IgG простирается с Cys226 или с Pro230 до карбоксильного конца тяжелой цепи. В одном из вариантов осуществления изобретения Fc-область имеет аминокислотную последовательность SEQ ID NO: 60. Однако С-концевой лизин (Lys447) Fc-области может присутствовать или отсутствовать.
В контексте настоящего описания аминокислотные положения всех константных областей и доменов тяжелой и легкой цепи нумеруют согласно системе нумерации по Кэботу, описанной у Kabat Е.А. и др., Sequences of Proteins of Immunological Interest, 5-ое изд., изд-во Public Health Service, National Institutes of Health, Bethesda, MD, 1991, и обозначают в контексте настоящего описания как «нумерация по Кэботу». В частности систему нумерации по Кэботу (см. сс. 647-660), которая описана у Kabat и др., Sequences of Proteins of Immunological Interest, 5-ое изд., изд-во Public Health Service, National Institutes of Health, Bethesda, MD, 1991, применяют для константного домена легкой цепи CL каппа- и лямбда-изотипа и систему нумерации на основе EU-индекса Кэбота (см. сс. 661-723) применяют для константных доменов тяжелой цепи (СН1, шарнир, СН2 и СН3).
Понятие «FcRn» означает человеческий неонатальный Fc-рецептор. Функцией FcRn является «спасение» IgG от лизосомального пути расщепления, что приводит к пониженному клиренсу и удлиненному времени полужизни. FcRn представляет собой гетеродимерный белок, состоящий из двух полипептидов: имеющего молекулярную массу 50 кДа белка, напоминающего белок главного комплекса гистосовместимости класса I (α-FcRn), и имеющего молекулярную массу 15 кДа β2-микроглобулина (β2m). FcRn связывается с высокой аффинностью с СН2-СН3-участком Fc-области IgG. Взаимодействие между IgG и FcRn строго зависит от значения рН и имеет место при стехиометрическом соотношении 1:2, при этом один IgG связывается с двумя молекулами FcRn через две тяжелые цепи (Huber А.Н. и др., J. Mol. Biol. 230, 1993, сс. 1077-1083). FcRn-связывание происходит в эндосоме при кислом значении рН (рН<6,5) и IgG высвобождается на клеточной поверхности с нейтральным рН (рН примерно 7,4). Чувствительная к значению рН природа взаимодействия облегчает опосредуемую FcRn защиту проникающих в клетки посредством пиноцитоза IgG от внутриклеточного расщепления путем связывания с рецептором в кислой среде эндосом. Затем FcRn облегчает рециклинг IgG на клеточную поверхность и последующее высвобождение в кровоток после воздействия на комплекс FcRn-IgG среды с нейтральным рН вне клетки.
Понятие «FcRn-связывающий участок Fc-области» означает часть полипептида тяжелой цепи антитела, которая простирается примерно от EU-положения 243 до EU-положения 261 и примерно от EU-положения 275 до EU-положения 293 и примерно от EU-положения 302 до EU-положения 319, и примерно от EU-положения 336 до EU-положения 348, и примерно от EU-положения 367 до EU-положения 393, и в EU-положении 408, и примерно от EU-положения 424 до EU-положения 440. В одном из вариантов осуществления изобретения один или несколько следующих аминокислотных остатков согласно EU-нумерации Кэбота изменены: F243, Р244, Р245 Р, K246, Р247, К248, D249, Т250, L251, М252, I253, S254, R255, Т256, Р257, Е258, V259, Т260, С261, F275, N276, W277, Y278, V279, D280, V282, Е283, V284, Н285, N286, А287, K288, Т289, К290, Р291, R292, Е293, V302, V303, S304, V305, L306, Т307, V308, L309, Н310, Q311, D312, W313, L314, N315, G316, К317, Е318, Y319, I336, S337, К338, А339, К340, G341, Q342, Р343, R344, Е345, Р346, Q347, V348, С367, V369, F372, Y373, Р374, S375, D376, I377, А378, V379, Е380, W381, Е382, S383, N384, G385, Q386, Р387, Е388, N389, Y391, Т393, S408, S424, С425, S426, V427, М428, Н429, Е430, А431, L432, Н433, N434, Н435, Y436, Т437, Q438, К439 и S440 (EU-нумерация).
Понятие «каркасный участок» или «FR», означает аминокислотные остатки вариабельного домена, отличные от остатков гипервариабельного участка (HVR). FR вариабельного домена, как правило, состоит из четырех FR-доменов: FR1, FR2, FR3 и FR4. Таким образом, последовательности HVR и FR, как правило, имеют следующее расположение в VH (или VL): FR1-H1(L1)-FR2-H2(L2)-FR3-H3(L3)-FR4.
Понятия «полноразмерное антитело» в контексте настоящего описания обозначает антитело, имеющее структуру, практически сходную с нативной структурой антитела, или имеющее тяжелые цепи, которые содержат представленную в настоящем описании Fc-область. Полноразмерное антитело может содержать дополнительные домены, такие, например, как scFv или scFab, конъюгированные с одной или несколькими цепями полноразмерного антитела. Указанные конъюгаты подпадают также под понятие «полноразмерное антитело».
Понятие «димерный полипептид» означает комплекс, состоящий по меньшей мере из двух полипептидов, ковалентно ассоциированных. Комплекс может содержать дополнительные полипептиды, которые также ассоциированы ковалентно или нековалентно с другими полипептидами. В одном из вариантов осуществления изобретения димерный полипептид содержит два или четыре полипептида.
Понятия «гетеродимер» или «гетеродимерная» означает молекулу, которая содержит две полипептидные цепи (например, сопоставимой длины), в которой две полипептидные цепи имеют аминокислотную последовательность, которая содержит по меньшей мере один другой аминокислотный остаток в соответствующем положении, где соответствующее положение определяют согласно системе нумерации на основе EU-индекса Кэбота.
Понятия «гомодимер» или «гомодимерная» означает молекулу, которая содержит две полипептидные цепи (например, сопоставимой длины), в которой две полипептидные цепи имеют аминокислотную последовательность, которая является идентичной в соответствующих положениях, где соответствующие положения определяют согласно системе нумерации на основе EU-индекса Кэбота.
Димерный полипептид, представленный в настоящем описании, может быть гомодимерным или гетеродимерным, что определяют на основе представляющих интерес мутаций или свойств. Например, касательно связывания FcRn и/или белка А (т.е. представляющих интерес свойств) димерный полипептид является гомодимерным (т.е. оба полипептида димерного полипептида содержат указанные мутации) касательно мутаций Н310А, Н433А и Y436A (эти мутации представляют интерес касательно способности димерного полипептида связываться с FcRn и/или белком А), но в то же время является гетеродимерным касательно мутаций Y349C, T366S, L368A и Y407V (эти мутации не представляют интерес, поскольку эти мутации связаны с гетеродимеризацией тяжелых цепей, а не со способностью связывать FcRn/белок А), а также касательно мутаций S354C и T366W соответственно (первая содержится только в первом полипептиде, а вторая содержится только во втором полипептиде). Кроме того, например, димерный полипептид, представленный в настоящем описании, может быть гетеродимерным касательно мутаций I253A, Н310А, Н433А, Н435А и Y436A (т.е. все эти мутации влияют на способность димерного полипептида связываться с FcRn и/или белком А), т.е. один полипептид содержит мутации I253A, Н310А и Н435А, а другой полипептид содержит мутации Н310А, Н433А и Y436A.
Понятия «клетка-хозяин», «клеточная линия-хозяин» и «культура клетки-хозяина» используются взаимозаменяемо, и они относятся к клеткам, в которые интродуцирована экзогенная нуклеиновая кислота, включая потомство указанных клеток. К клеткам-хозяевам относятся «трансформанты» и «трансформированные клетки», которые включают первично трансформированную клетку и полученное из нее потомство безотносительно к количеству пересевов. Потомство может не быть полностью идентичным по составу нуклеиновых кислот родительской клетке, но может содержать мутации. Под объем изобретения подпадает мутантное потомство, которое обладает такой же функцией или биологической активностью, которая обнаружена в результате скрининга или отобрана у исходной трансформированной клетки.
«Человеческое антитело» представляет собой антитело, которое имеет аминокислотную последовательность, соответствующую последовательности антитела, продуцируемого человеком или человеческой клеткой, или выведенную из источника, отличного от человека, с использованием спектра человеческих антител или других кодирующих человеческое антитело последовательностей. Из указанного определения человеческого антитела специально исключено гуманизированное антитело, содержащее нечеловеческие антигенсвязывающие остатки.
«Человеческий консенсусный каркасный участок» представляет собой каркасный участок, в который входят наиболее часто встречающиеся аминокислотные остатки в выбранных последовательностях каркасных участков VL или VH человеческого иммуноглобулина. Как правило, выбор последовательностей VL или VH человеческого иммуноглобулина осуществляют из подгруппы последовательностей вариабельных доменов. Как правило, подгруппа последовательностей представляет собой подгруппу, описанную у Kabat и др., Sequences of Proteins of Immunological Interest, 5-ое изд., NIH Publication 91-3242, Bethesda MD, т.т. 1-3, 1991. В одном из вариантов осуществления изобретения касательно VL подгруппа представляет собой подгруппу каппа I согласно Kabat и др., выше. В одном из вариантов осуществления изобретения касательно VH подгруппа представляет собой подгруппу III согласно Kabat и др., выше.
Понятие «происходит (выведена, получена) из» означает, что аминокислотная последовательность получена из родительской аминокислотной последовательности путем интродукции изменений по меньшей мере в одно положение. Так, выведенная аминокислотная последовательность отличается от соответствующей родительской аминокислотной последовательности по меньшей мере одном соответствующим положением (нумерация согласно нумерации на основе EU-индекса Кэбота для Fc-областей антител). В одном из вариантов осуществления изобретения аминокислотная последовательность, полученная из родительской аминокислотной последовательности, отличается 1-15 аминокислотными остатками в соответствующих положениях. В одном из вариантов осуществления изобретения аминокислотная последовательность, полученная из родительской аминокислотной последовательности, отличается 1-10 аминокислотными остатками в соответствующих положениях. В одном из вариантов осуществления изобретения аминокислотная последовательность, полеченная из родительской аминокислотной последовательности, отличается 1-6 аминокислотными остатками в соответствующих положениях. Аналогично этому выведенная аминокислотная последовательность имеет высокую степень идентичности аминокислотной последовательности с ее родительской аминокислотной последовательностью. В одном из вариантов осуществления изобретения аминокислотная последовательность, полученная из родительской аминокислотной последовательности, имеет 80%-ную или более высокую идентичность аминокислотной последовательности. В одном из вариантов осуществления изобретения аминокислотная последовательность, полученная из родительской аминокислотной последовательности, имеет 90%-ную или более высокую идентичность аминокислотной последовательности. В одном из вариантов осуществления изобретения аминокислотная последовательность, полученная из родительской аминокислотной последовательности, имеет 95%-ную или более высокую идентичность аминокислотной последовательности.
Понятие «полипептид человеческой Fc-области» означает аминокислотную последовательность, идентичную «нативному» полипептиду или полипептиду «дикого типа» человеческой Fc-области. Понятие «полипептид варианта (человеческой) Fc-области» означает аминокислотную последовательность, которая получена из «нативного» полипептида или полипептида «дикого типа» человеческой Fc-области с помощью по меньшей мере одного «аминокислотного изменения». «Человеческая Fc-область» состоит из двух полипептидов человеческой Fc-области. «Вариант (человеческой) Fc-области» состоит из двух полипептидов Fc-области, при этом оба могут представлять собой полипептиды варианта (человеческой) Fc-области или один может представлять собой полипептид человеческой Fc-области, а другой представлять собой полипептид варианта (человеческой) Fc-области.
В одном из вариантов осуществления изобретения полипептид человеческой Fc-области имеет аминокислотную последовательность полипептида Fc-области человеческого IgG1 SEQ ID NO: 60 или полипептида Fc-области человеческого IgG2 SEQ ID NO: 61, или полипептида Fc-области человеческого IgG4 SEQ ID NO: 63 с мутациями, указанными в настоящем описании. В одном из вариантов осуществления изобретения полипептид Fc-области получают из полипептида Fc-области, имеющего SEQ ID NO: 60 или 61, или 63, и он имеет по меньшей мере одну аминокислотную мутацию по сравнению с полипептидом Fc-области, имеющим SEQ ID NO: 60 или 61, или 63. В одном из вариантов осуществления изобретения полипептид варианта (человеческой) Fc-области содержит/имеет от примерно 1 до примерно 10 аминокислотных мутаций, и в одном из вариантов осуществления изобретения от примерно 1 до примерно 5 аминокислотных мутаций. В одном из вариантов осуществления изобретения полипептид варианта (человеческой) Fc-области имеет примерно 80%-ную гомологию с полипептидом человеческой Fc-области, имеющим SEQ ID NO: 60 или 61, или 63. В одном из вариантов осуществления изобретения полипептид варианта (человеческой) Fc-области имеет примерно 90%-ную гомологию с полипептидом человеческой Fc-области, имеющим SEQ ID NO: 60 или 61, или 63. В одном из вариантов осуществления изобретения полипептид варианта (человеческой) Fc-области имеет примерно 95%-ную гомологию с полипептидом человеческой Fc-области, имеющим SEQ ID NO: 60 или 61, или 63.
Полипепид варианта (человеческой) Fc-области, полученный из полипептида человеческой Fc-области, имеющего SEQ ID NO: 60 или 61, или 63, определяют по имеющимся аминокислотным изменениям. Так, например, понятие P329G означает полипептид варианта (человеческой) Fc-области, полученный из полипептида человеческой Fc-области, который имеет мутацию, приводящую к замене пролина на глицин в аминокислотном положении 329, относительно полипептида человеческой Fc-области, имеющего SEQ ID NO: 60 или 61, или 63.
Полипептид Fc-области человеческого IgG1 имеет следующую аминокислотную последовательность:

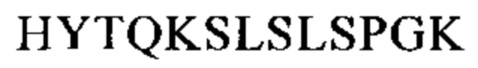 (SEQ ID NO: 60).
(SEQ ID NO: 60).
Полученный из Fc-области человеческого IgG1 полипептид Fc-области с мутациями L234A, L235A имеет следующую аминокислотную последовательность:

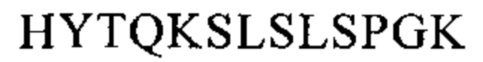 (SEQ ID NO: 64).
(SEQ ID NO: 64).
Полученный из Fc-области человеческого IgG1 полипептид Fc-области с мутациями Y349C, T366S, L368A и Y407V имеет следующую аминокислотную последовательность:

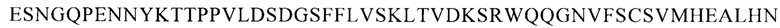
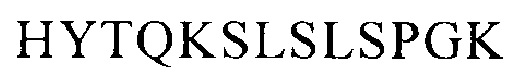 (SEQ ID NO: 65).
(SEQ ID NO: 65).
Полученный из Fc-области человеческого IgG1 полипептид Fc-области с мутациями S354C, T366W имеет следующую аминокислотную последовательность:

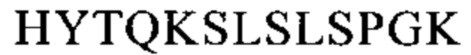 (SEQ ID NO: 66).
(SEQ ID NO: 66).
Полученный из Fc-области человеческого IgG1 полипептид Fc-области с мутациями L234A, L235A и мутациями Y349C, T366S, L368A, Y407V, имеет следующую аминокислотную последовательность:

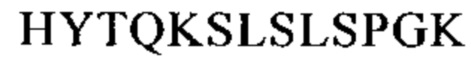 (SEQ ID NO: 67).
(SEQ ID NO: 67).
Полученный из Fc-области человеческого IgG1 полипептид Fc-области с мутациями L234A, L235A и S354C, T366W, имеет следующую аминокислотную последовательность:

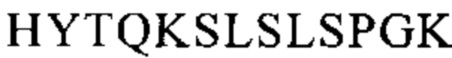 (SEQ ID NO: 68).
(SEQ ID NO: 68).
Полученный из Fc-области человеческого IgG1 полипептид Fc-области с мутацией P329G имеет следующую аминокислотную последовательность:

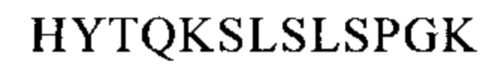 (SEQ ID NO: 69).
(SEQ ID NO: 69).
Полученный из Fc-области человеческого IgG1 полипептид Fc-области с мутациями L234A, L235A и мутацией P329G имеет следующую аминокислотную последовательность:

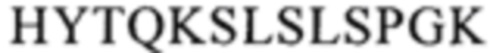 SEQ ID NO: 70).
SEQ ID NO: 70).
Полученный из Fc-области человеческого IgG1 полипептид Fc-области с мутацией P329G и мутациями Y349C, T366S, L368A, Y407V имеет следующую аминокислотную последовательность:

 (SEQ ID NO: 71).
(SEQ ID NO: 71).
Полученный из Fc-области человеческого IgG1 полипептид Fc-области с мутацией P329G и мутацией S354C, T366W имеет следующую аминокислотную последовательность:

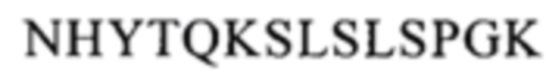 SEQ ID NO: 72.
SEQ ID NO: 72.
Полученный из Fc-области человеческого IgG1 полипептид Fc-области с мутациями L234A, L235A, P329G и Y349C, T366S, L368A, Y407V имеет следующую аминокислотную последовательность:

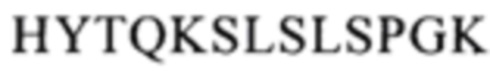 SEQ ID NO: 73.
SEQ ID NO: 73.
Полученный из Fc-области человеческого IgG1 полипептид Fc-области с мутациями L234A, L235A, P329G и мутациями S354C, T366W имеет следующую аминокислотную последовательность:

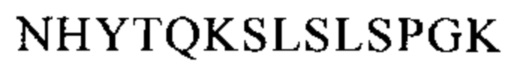 (SEQ ID NO: 74).
(SEQ ID NO: 74).
Полипептид Fc-области человеческого IgG4 имеет следующую аминокислотную последовательность:

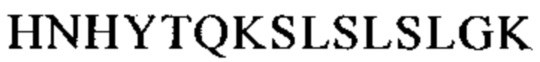 (SEQ ID NO: 63).
(SEQ ID NO: 63).
Полученный из Fc-области человеческого IgG4 полипептид Fc-области с мутациями S228P и L235E имеет следующую аминокислотную последовательность:

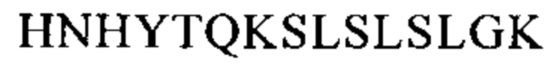 (SEQ ID NO: 75).
(SEQ ID NO: 75).
Полученный из Fc-области человеческого IgG4 полипептид Fc-области с мутациями S228P, L235E и мутацией P329G имеет следующую аминокислотную последовательность:

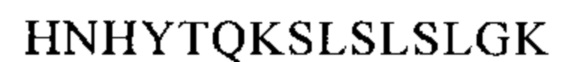 (SEQ ID NO: 76).
(SEQ ID NO: 76).
Полученный из Fc-области человеческого IgG4 полипептид Fc-области с мутациями S354C, T366W имеет следующую аминокислотную последовательность:

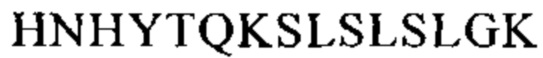 (SEQ ID NO: 77).
(SEQ ID NO: 77).
Полученный из Fc-области человеческого IgG4 полипептид Fc-области с мутациями Y349C, T366S, L368A, Y407V имеет следующую аминокислотную последовательность:

 (SEQ ID NO: 78).
(SEQ ID NO: 78).
Полученный из Fc-области человеческого IgG4 полипептид Fc-области с мутациями S228P, L235E и S354C, T366W имеет следующую аминокислотную последовательность:

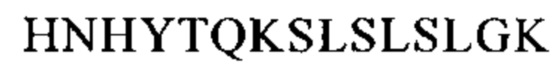 (SEQ ID NO: 79).
(SEQ ID NO: 79).
Полученный из Fc-области человеческого IgG4 полипептид Fc-области с мутациями S228P, L235E и Y349C, T366S, L368A, Y407V имеет следующую аминокислотную последовательность:

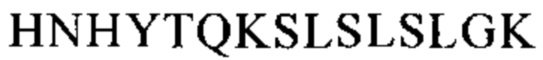 (SEQ ID NO: 80).
(SEQ ID NO: 80).
Полученный из Fc-области человеческого IgG4 полипептид Fc-области с мутацией P329G имеет следующую аминокислотную последовательность:

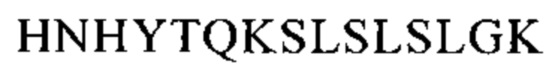 (SEQ ID NO: 81).
(SEQ ID NO: 81).
Полученный из Fc-области человеческого IgG4 полипептид Fc-области с мутациями P329G и Y349C, T366S, L368A, Y407V имеет следующую аминокислотную последовательность:

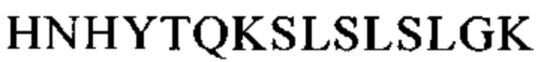 (SEQ ID NO: 82).
(SEQ ID NO: 82).
Полученный из Fc-области человеческого IgG4 полипептид Fc-области с мутациями P329G и S354C, T366W имеет следующую аминокислотную последовательность:

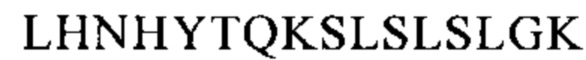 (SEQ ID NO: 83).
(SEQ ID NO: 83).
Полученный из Fc-области человеческого IgG4 полипептид Fc-области с мутациями S228P, L235E, P329G and Y349C, T366S, L368A, Y407V имеет следующую аминокислотную последовательность:

 (SEQ ID NO: 84).
(SEQ ID NO: 84).
Полученный из Fc-области человеческого IgG4 полипептид Fc-области с мутациями S228P, L235E, P329G и S354C, T366W имеет следующую аминокислотную последовательность:

 (SEQ ID NO: 85).
(SEQ ID NO: 85).
Результаты сравнительного анализа первичной структуры различных человеческих Fc-областей представлены ниже (согласно системе нумерации на основе EU-индекса Кэбота):


Понятие «гуманизированное» антитело относится к химерному антителу, которое содержит аминокислотные остатки из нечеловеческих HVR и аминокислотные остатки из человеческих FR. В некоторых вариантах осуществления изобретения гуманизированное антитело может содержать практически все из по меньшей мере одного и, как правило, двух вариабельных доменов, в которых все или практически все HVR (например, CDR) соответствуют участкам нечеловеческого антитела, а все или практически все FR соответствуют участкам человеческого антитела. Гуманизированное антитело необязательно может содержать по меньшей мере часть константной области антитела, выведенной из человеческого антитела. Понятие «гуманизированная форма» антитела, например, нечеловеческого антитела, относится к антителу, которое подвергали гуманизации.
Понятие «гипервариабельный участок» или «HVR» в контексте настоящего описания относится к каждому из участков вариабельного домена антитела, последовательности которых являются гипервариабельными («определяющие комплементарность участки» или «CDR») и/или формируют петли определенной структуры («гипервариабельные петли»), и/или содержат контактирующие с антигеном остатки («контакты с антигеном»). Как правило, антитела содержат шесть HVR; три в VH (H1, Н2, Н3) и три в VL (L1, L2, L3).
В контексте настоящего описания HVR включают
(а) гипервариабельные петли, включающие аминокислотные остатки 26-32 (L1), 50-52 (L2), 91-96 (L3), 26-32 (H1), 53-55 (Н2) и 96-101 (Н3) (Chothia С. и Lesk A.M., J. Mol. Biol. 196, 1987, cc. 901-917);
(б) CDR, включающие аминокислотные остатки 24-34 (L1), 50-56 (L2), 89-97 (L3), 31-35b (H1), 50-65 (H2) и 95-102 (Н3) (Kabat E.A. и др., Sequences of Proteins of Immunological Interest, 5-ое изд., изд-во Public Health Service, National Institutes of Health, Bethesda, MD, 1991, публикация NIH 91-3242);
(в) области контакта с антигеном, включающие аминокислотные остатки 27 с-36 (L1), 46-55 (L2), 89-96 (L3), 30-35b (H1), 47-58 (Н2) и 93-101 (Н3) (MacCallum и др., J. Mol. Biol. 262, 1996, cc. 732-745); и
(г) комбинации остатков, указанных в подпунктах (а), (б) и/или (в), включающие аминокислотные остатки HVR 46-56 (L2), 47-56 (L2), 48-56 (L2), 49-56 (L2), 26-35 (H1), 26-35b (H1), 49-65 (Н2), 93-102 (Н3) и 94-102 (Н3).
Если не указано иное, то HVR-остатки и другие остатки в вариабельном домене (например, FR-остатки) нумеруют в настоящем описании согласно системе нумерации на основе EU-индекса Кэбота (Kabat и др., выше).
В контексте настоящего описания понятие «IGF-1R» относится к любой нативной форме IGF-1R из любого позвоночного животного, включая, если не указано иное, млекопитающих, таких как приматы (например, люди) и грызуны (например, мыши и крысы). Понятие включает «полноразмерный» непроцессированный IGF-1R, а также любую форму IGF-1R, полученную в результате процессинга в клетке. Понятие относится также к встречающимся в естественных условиях вариантам IGF-1R, например, сплайсинговым вариантам или аллельным вариантам. Аминокислотная последовательность человеческого IGF-1R представлена в SEQ ID NO: 11.
«Индивидуум» или «субъект» представляет собой млекопитающее. К млекопитающим относятся (но, не ограничиваясь только ими) одомашненные животные (например, коровы, овцы, кошки, собаки и лошади), приматы (например, люди и приматы кроме человека, например, обезьяны), кролики и грызуны (например, мыши и крысы). В некоторых вариантах осуществления изобретения индивидуум или субъект представляет собой человека.
«Выделенное» антитело представляет собой антитело, которое отделено от компонента его естественного окружения. В некоторых вариантах осуществления изобретения антитело очищают до чистоты, превышающей 95% или 99% по данным, например, электрофоретических анализов (таких, например, как ДСН-ПААГ, изоэлектрическое фокусирование (ИЭФ), капиллярный электрофорез) или хроматографических анализов (таких, например, как ионообменная хроматография или ЖХВР с обращенной фазой). Обзор методов оценки чистоты антител см., например, у Flatman S. и др., J. Chrom. В 848, 2007, сс. 79-87.
«Выделенная» нуклеиновая кислота представляет собой молекулу нуклеиновой кислоты, которая отделена от компонента ее естественного окружения. Выделенная нуклеиновая кислота включает молекулу нуклеиновой кислоты, содержащуюся в клетке, которая в норме включает молекулу нуклеиновой кислоты, но в которой молекула нуклеиновой кислоты присутствует вне хромосомы или в которой ее локализация на хромосоме отличается от ее встречающейся в естественных условиях локализации на хромосоме.
Понятие «выделенная нуклеиновая кислота, кодирующая антитело к IGF-1R» относится к одной или нескольким молекулам нуклеиновых кислот, кодирующих тяжелые и легкие цепи антитела (или их фрагменты), включая указанную(ые) молекулу(ы) в одном векторе или в различных векторах, и указанную(ые) молекулу(ы) нуклеиновой(ых) кислоты(т), присутствующую(ие) в одной или нескольких положениях в клетке-хозяине.
Понятие «моноклональное антитело» в контексте настоящего описания относится к антителу, полученному из популяции практически гомогенных антител, т.е. индивидуальные антитела, входящие в популяцию, идентичны и/или связываются с одним и тем же эпитопом, за исключением возможных вариантов антител, например, содержащих мутации, встречающиеся в естественных условиях или возникающих в процессе производства препарата моноклонального антитела, указанные варианты, как правило, присутствуют в минорных количествах. В отличие от препаратов поликлональных антител, которые, как правило, включают различные антитела к различным детерминантам (эпитопам), каждое моноклональное антитело из препарата моноклонального антитела направлено против одной детерминанты антигена. Таким образом, прилагательное «моноклональный» определяет особенность антитела, характеризуя его как полученное из практически гомогенной популяции антител, а не сконструированное в соответствии с требованиями к получению антитела с помощью какого-либо конкретного метода. Например, моноклональные антитела, которые можно применять согласно настоящему изобретению, можно создавать с помощью различных технологий, включая (но, не ограничиваясь только ими) метод гибридом, методы рекомбинантной ДНК, методы фагового дисплея и методы с использованием трансгенных животных, которые содержат все или часть локусов иммуноглобулина, указанные методы и другие приведенные в качестве примера методы получения моноклональных антител представлены в настоящем описании.
Понятие «нативные антитела» относится к встречающимся в естественных условиях молекулам иммуноглобулинов с различными структурами. Например, нативные антитела в виде IgG представляют собой гетеротетрамерные гликопротеины с молекулярной массой примерно 150000 Да, состоящие из двух идентичных легких цепей и двух идентичных тяжелых цепей, связанных дисульфидными мостиками. Начиная с N- конца к С-концу, каждая тяжелая цепь имеет вариабельную область (VH), которую называют также вариабельным тяжелым доменом или вариабельным доменом тяжелой цепи, за которой следует три константных домена (CH1, СН2 и СН3). Аналогично этому, начиная с N-конца к С-концу, каждая легкая цепь имеет вариабельную область (VL), которую называют также вариабельным легким доменом или вариабельным доменом легкой цепи, за которой следует константный домен легкой цепи (CL). Легкая цепь антитела может принадлежать к одному из двух типов, называемых каппа (κ) и лямбда (λ), в зависимости от аминокислотной последовательности ее константного домена.
Понятие «листовка-вкладыш в упаковку» относится к инструкциям, которые обычно входят в поступающие в продажу упаковки терапевтических продуктов, содержащим информацию о показаниях, применении, дозе, пути введения, комбинированной терапии, противопоказаниях и/или мерах предосторожности, которые связаны с применением указанных терапевтических продуктов.
«Процент (%) идентичности аминокислотной последовательности» относительно полипептидной референс-последовательности определяют как процент аминокислотных остатков в последовательности-кандидате, которые идентичны аминокислотным остаткам в полипептидной референс-последовательности, после выравнивая последовательностей и при необходимости интродукции брешей для достижения максимального процента идентичности последовательностей, и не рассматривая какие-либо консервативные замены в качестве компонента при оценке идентичности последовательностей. Сравнительный анализ для целей определения процента идентичности аминокислотных последовательностей можно осуществлять различными путями, известными в данной области, используя, например, публично доступные компьютерные программы, такие как программа BLAST, BLAST-2, ALIGN или Megalign (DNASTAR). Специалисты в данной области могут определять соответствующие параметры для выравнивания последовательностей, включая любые алгоритмы, необходимые для достижения максимального выравнивания по всей длине сравниваемых последовательностей. Однако для целей настоящего изобретения величины % идентичности аминокислотных последовательностей получают, используя компьютерную программу для сравнения последовательностей ALIGN-2. Авторство компьютерной программы для сравнения последовательностей ALIGN-2 принадлежит фирме Genentech, Inc., и исходный код был представлен в комплекте с документацией для пользователей в U.S. Copyright Office, Washington D.C., 20559, где он зарегистрирован как U.S. Copyright Registration № TXU510087. Программа ALIGN-2 публично доступна от фирмы Genentech, Inc., Южный Сан-Франциско, шт. Калифорния, или ее можно компилировать на основе исходного кода. Программу ALIGN-2 можно компилировать для применения в операционной системе UNIX, включая цифровую систему UNIX V4.0D. Все параметры, требуемые для сравнения последовательностей, устанавливаются программой ALIGN-2 и не должны изменяться.
В ситуациях, в которых ALIGN-2 применяют для сравнения аминокислотных последовательностей, % идентичности аминокислотных последовательностей данной аминокислотной последовательности А по сравнению, с или относительно данной аминокислотной последовательности Б (что в альтернативном варианте можно обозначать как данная аминокислотная последовательность А, которая имеет или содержит определенный % идентичности аминокислотной последовательности по сравнению, с или относительно данной аминокислотной последовательности Б), рассчитывают следующим образом:
100 × дробь X/Y,
где X обозначает количество аминокислотных остатков, определенных как идентичные совпадения при оценке с помощью программы для сравнительного анализа последовательностей ALIGN-2, где с помощью программы осуществляли сравнение А и Б, и где Y обозначает общее количество аминокислотных остатков в Б. Должно быть очевидно, что, если длина аминокислотной последовательности А не равна длине аминокислотной последовательности Б, то % идентичности аминокислотных последовательностей А относительно Б не может быть равен % идентичности аминокислотной последовательности Б относительно А. Если специально не указано иное, то все величины % идентичности аминокислотных последовательностей, указанные в настоящем описании, получали с использованием описанной в предыдущем параграфе компьютерной программы ALIGN-2.
Понятие «фармацевтическая композиция» относится к препарату, который находится в такой форме, что он обеспечивает биологическую активность входящего в его состав действующего вещества, которое должно обладать эффективностью, и который не содержит дополнительных компонентов, обладающих неприемлемой токсичностью для индивидуума, которому следует вводить композицию.
«Фармацевтически приемлемый носитель» относится к ингредиенту в фармацевтической композиции, отличному от действующего вещества, который является нетоксичным для индивидуума. Фармацевтически приемлемые носители включают (но, не ограничиваясь только ими) буфер, эксципиент, стабилизатор или консервант.
В контексте изобретения под «пептидным линкером» понимают пептид, содержащий аминокислотные последовательности, который предпочтительно имеет синтетическое происхождение. В одном из вариантов осуществления изобретения пептидный линкер представляет собой пептид, аминокислотная последовательность которого состоит по меньшей мере из 30 аминокислот, предпочтительно из 32-50 аминокислот. В одном из вариантов осуществления изобретения пептидный линкер представляет собой пептид, аминокислотная последовательность которого состоит из 32-40 аминокислот. В одном из вариантов осуществления изобретения пептидный линкер представляет собой (GxS)n, где G = глицин, S = серин, (х=3, n=8, 9 или 10) или (х=4 и n=6, 7 или 8), в одном из вариантов осуществления изобретения х=4, n=6 или 7, в одном из вариантов осуществления изобретения х=4, n=7. В одном из вариантов осуществления изобретения пептидный линкер представляет собой (G4S)6G2.
В контексте настоящего описания понятие «рекомбинантное антитело» относится ко всем антителам (химерным, гуманизированным и человеческим), которые получают, экспрессируют, создают или выделяют методами рекомбинации. Оно включает антитела, выделенные из клетки-хозяина, такой как NS0- или СНО-клетка, или из животного (например, мыши), которое является трансгенным по человеческим генам иммуноглобулина, или антитела, экспрессируемые с использованием рекомбинантной экспрессионной плазмиды, которой трансфектируют клетку-хозяина. Такие рекомбинантные антитела имеют вариабельные и константные области в преобразованной форме. Рекомбинантные антитела, представленные в настоящем описании, можно подвергать соматической гипермутации in vivo. Таким образом, аминокислотные последовательности VH- и VL-областей рекомбинантных антител представляют собой последовательности, которые хотя выведены или являются родственными последовательностям VH и VL человеческой зародышевой линии, могут не существовать в естественных условиях в спектре антител человеческой зародышевой линии in vivo.
В контексте настоящего описания понятие «лечение» (и его грамматические вариации, такие как «лечить» или «процесс лечения») относится к клиническому вмешательству с целью изменения естественного течения болезни у индивидуума, подлежащего лечению, и его можно осуществлять либо для профилактики, либо в процессе развития клинической патологии. Требуемыми действиями лечения являются (но, не ограничиваясь только ими) предупреждение возникновения или рецидива болезни, облегчение симптомов, уменьшение любых прямых или косвенных патологических последствий болезни, предупреждение метастазов, снижение скорости развития болезни, облегчение или временное ослабление болезни и ремиссия или улучшение прогноза. В некоторых вариантах осуществления изобретения антитела или содержащие Fc-область слитые полипептиды, предлагаемые в изобретении, применяют для задержки развития болезни или замедления прогрессирования болезни.
В контексте настоящего описания понятие «валентный» означает присутствие конкретного количества связывающих сайтов в молекуле антитела. Так, понятия «двухвалентный», «четырехвалентный» и «шестивалентный» означает присутствие двух связывающих сайтов, четырех связывающих сайтов и шести связывающих сайтов соответственно в молекуле (антителе). Биспецифические антитела, предлагаемые в изобретении, предпочтительно являются «двухвалентными».
Понятие «вариабельная область» или «вариабельный домен» относится к домену тяжелой или легкой цепи антитела, который участвует в связывании антитела с антигеном. Вариабельные домены тяжелой цепи и легкой цепи (VH и VL соответственно) нативного антитела, как правило, имеют сходные структуры, при этом каждый домен содержит четыре консервативных каркасных участка (FR) и три гипервариабельных участка (HVR) (см., например, Kindt и др., Kuby Immunology, 6-ое изд., изд-во W.H. Freeman and Co., 2007, с. 91). Одного VH- или VL-домена может быть достаточно для обеспечения специфичности связывания антигена. Кроме того, антитела, которые связываются с конкретным антигеном, можно выделять, используя VH- или VL-домен из антитела, которое связывается с антигеном, для скрининга библиотеки комплементарных VL- или VH-доменов соответственно (см., например, Portolano и др., J. Immunol. 150, 1993, cc. 880-887; Clarkson и др., Nature 352, 1991, cc. 624-628).
Понятие «сосудистое глазное заболевание» включает (но, не ограничиваясь только ими) синдромы внутриглазной неоваскуляризации, такие как диабетическая ретинопатия, диабетический отек желтого пятна, ретролентальная фиброплазия, неоваскулярная глаукома, окклюзии вен сетчатки, окклюзии центральной вены сетчатки, дегенерация желтого пятна, возрастная дегенерация желтого пятна, пигментный ретинит, ретинальная ангиоматозная пролиферация, телеангиэктазия желтого пятна, ишемическая ретинопатия, неоваскуляризация радужной оболочки, внутриглазная неоваскуляризация, неоваскуляризация роговицы, неоваскуляризация сетчатки, хороидальная неоваскуляризация и дегенерация сетчатки (Garner A., Vascular diseases, в: Pathobiology of ocular disease, A dynamic approach, под ред. Garner А. и Klintworth G.K., 2-ое изд., изд-во Marcel Dekker, New York, 1994, cc. 1625-1710).
Понятие «вектор» в контексте настоящего описания относится к молекуле нуклеиновой кислоты, которая может обеспечивать воспроизводство другой нуклеиновой кислоты, с которой она связана. Под указанное понятие подпадает вектор в виде самореплицирующейся структуры нуклеиновой кислоты, а также вектор, встроенный в геном клетки-хозяина, в которую он интродуцирована. Некоторые векторы обладают способностью оказывать направленное воздействие на экспрессию нуклеиновых кислот, с которыми они функционально связаны. Указанные векторы в контексте настоящего описания обозначают как «экспрессионные векторы».
В контексте настоящего описания понятие «VEGF» относится к человеческому сосудистому эндотелиальному фактору роста (VEGF/VEGF-A), т.е. состоящему из 165 аминокислот фактору роста человеческих эндотелиальных клеток сосудов (аминокислоты 27-191 последовательности-предшественника человеческого VEGF165: SEQ ID NO: 30; аминокислоты 1-26 обозначают сигнальный пептид), и к родственным изоформам 121, 189 и 206 фактора роста эндотелиальных клеток сосудов, которые описаны у Leung D.W. и др., Science 246, 1989, сс. 1306-1309; Houck и др., Mol. Endocrin. 5, 1991, сс. 1806-1814; Keck P.J. и др., Science 246, 1989, сс. 1309-1312 и Connolly D.T. и др., J. Biol. Chem. 264, 1989, сс. 20017-20024; а также к встречающимся в естественных условиях аллельным и процессированным формам указанных факторов роста. VEGF участвует в регуляции нормального и аномального ангиогенеза и неоваскуляризации, ассоциированной с опухолями и внутриглазными болезнями (Ferrara N. и др., Endocr. Rev. 18, 1997, сс. 4-25; Berkman R.A. и др., J. Clin. Invest. 91, 1993, cc. 153-159; Brown L.F. и др., Human Pathol. 26, 1995, cc. 86-91; Brown L.F. и др., Cancer Res. 53, 1993, cc. 4727-4735; Mattern J. и др., Brit. J. Cancer. 73, 1996, cc. 931-934 и Dvorak H.F. и др., Am. J. Pathol. 146, 1995, cc. 1029-1039). VEGF представляет собой гомодимерный гликопротеин, который был выделен из нескольких источников и включает несколько изоформ. Для VEGF характерна высокая специфическая митогненная активность в отношении эндотелиальных клеток.
Понятие «с мутацией IHH-ААА» («IHH-AAA-мутация») в контексте настоящего описания относится к комбинации мутаций I253A (Ile253Ala), Н310А (His310Ala) и Н435А (His435Ala), и понятие «с мутацией HHY-ААА» («HHY-AAA-мутация») в контексте настоящего описания относится к комбинации мутаций Н310А (His310Ala), Н433А (His433Ala) и Y436A (Tyr436A1a), и понятие «с мутацией YTE» («YTE-мутация») в контексте настоящего описания относится к комбинации мутаций M252Y (Met252Tyr), S254T (Ser254Thr) и Т256Е (Thr256Glu) в константной области тяжелой цепи IgG1 - или IgG4-подкласса, где нумерация соответствует системе нумерации на основе EU-индекса Кэбота.
Понятие «с мутациями P329G LALA» («P329G LALA-мутации») в контексте настоящего описания относится к комбинации мутаций L234A (Leu234Ala), L235A (Leu235Ala) и P329G (Pro329Gly) в константной области тяжелой цепи IgG1-покласса, где нумерация соответствует системе нумерации на основе EU-индекса Кэбота. Понятие «с мутацией SPLE» («SPLE-мутация») в контексте настоящего описания относится к комбинации мутаций S228P (Ser228Pro) и L235E (Leu235Glu) в константной области тяжелой цепи IgG4-покласса, где нумерация соответствует системе нумерации на основе EU-индекса Кэбота. Понятие «с мутацией SPLE и P329G» («SPLE и P329G-мутация») в контексте настоящего описания относится к комбинации мутаций S228P (Ser228Pro), L235E (Leu235Glu) и P329G (Pro329Gly) в константной области тяжелой цепи IgG4-подкласса, где нумерация соответствует системе нумерации на основе EU-индекса Кэбота.
II. Композиции и способы
Согласно одному из объектов изобретения оно базируется, по меньшей мере частично, на открытие того, что специфические мутации или комбинации мутаций, которые влияют на связывание Fc-области иммуноглобулина с неонатальным Fc-рецептором (FcRn), т.е. которые уменьшают или даже элиминируют связывание Fc-области с FcRn, не элиминируют одновременно связывание Fc-области с белком А стафилококков. Это оказывает очень большое действие на процесс очистки, который можно применять, поскольку, ему не требуется ограничение в зависимости от специфичности и вида, характерное для материалов для аффинной хроматографии, таких, например, как KappaSelect™, которые связываются только с антителами, содержащими легкую каппа-цепь. Таким образом, с помощью комбинации мутаций, указанных в настоящем описании, можно одновременно уменьшать или даже элиминировать связывание с FcRn, сохраняя при этом способность связываться с белком А стафилококков.
Согласно одному из объектов изобретения оно базируется, по меньшей мере частично, на открытие того, что путем применения различных мутаций в Fc-областях каждой тяжелой цепи можно получать гетеродимерную молекулу, такую, например, как биспецифическое антитело, которое, с одной стороны, обладает пониженной или даже элиминированной способностью связываться с FcRn, но которое, с другой стороны, сохраняет способность связываться с белком А стафилококков. Указанную способность к связыванию с белком А стафилококков можно применять для отделения гетеродимерной молекулы от гомодимерных побочных продуктов. Например, путем объединения мутаций I253A, Н310А и Н435А в Fc-области одной тяжелой цепи с мутациями Н310А, Н433А и Y436A в Fc-области другой тяжелой цепи с использованием подхода «knobs-into-hole» можно получать гетеродимерную Fc-область, которая, с одной стороны, не связывается с FcRn (оба набора мутаций являются молчащими касательно человеческого FcRn), но сохраняет способность связываться с белком А стафилококков (Fc-область тяжелой цепи с мутациями I253A, Н310А и Н435А не связывается с FcRn и не связывается с белком А стафилококков, в то время как Fc-область тяжелой цепи с мутациями Н310А, Н433А и Y436A не связывается с FcRn, но все еще сохраняет способность связываться с белком А). В результате можно использовать стандартную аффинную хроматографию на белке А для удаления гомодимерных, несущих конструкцию типа «впадина-впадина» побочных продуктов, поскольку они уже не могут связываться с белком А. Таким образом, путем объединения подхода «knobs-into-holes» с мутациями I253A, Н310А и Н435А в несущей «впадину» цепи (цепь с «впадиной») и мутациями Н310А, Н433А и Y436A в несущей «выступы» цепи (цепь с «выступом») можно облегчать очистку/разделение гетеродимерного, несущего «выступы во впадинах» продукта, от гомодимерного, несущего конструкцию типа «впадина-впадина» побочного продукта.
Согласно одному из объектов изобретения оно базируется, по меньшей мере частично, на открытие того, что для интравитреального применения предпочтительными являются антитела, которые не могут связываться с FcRn, поскольку эти антитела могут пересекать гемато-ретинальный барьер, не обладают в значительной мере пролонгированным или укороченным временем полужизни в глазу и быстро удаляются в результате клиренса из кровотока, что приводит к отсутствию или к очень ограниченным системным побочным действиям вне глаза. Антитела, предлагаемые в изобретении, можно применять, например, для диагностирования или лечения сосудистых глазных заболеваний.
Изобретение базируется, по меньшей мере частично, на открытие того, что путем применения различных мутаций в каждом из полипептидов Fc-области можно получать Fc-область гетеродимерной молекулы, такой, например, как биспецифическое антитело, которая характеризуется специально «подогнанным» (оптимизированным) FcRn-связыванием, и тем самым можно получать антитела, которые имеют специально «подогнанное» системное время полужизни.
Комбинация мутаций I253A, Н310А, Н435А или L251D, L314D, L432D или L251S, L314S, L432S приводит к утрате способности связываться с белком А, а комбинация мутаций I253A, Н310А, Н435А или Н310А, Н433А, Y436A, или L251D, L314D, L432D приводит к утрате способности связываться с человеческим неонатальным Fc-рецептором.
В представленной ниже таблице приведен в качестве примера обзор аминокислотных остатков в Fc-области, которые вовлечены во взаимодействия или изменены для модификации взаимодействий.
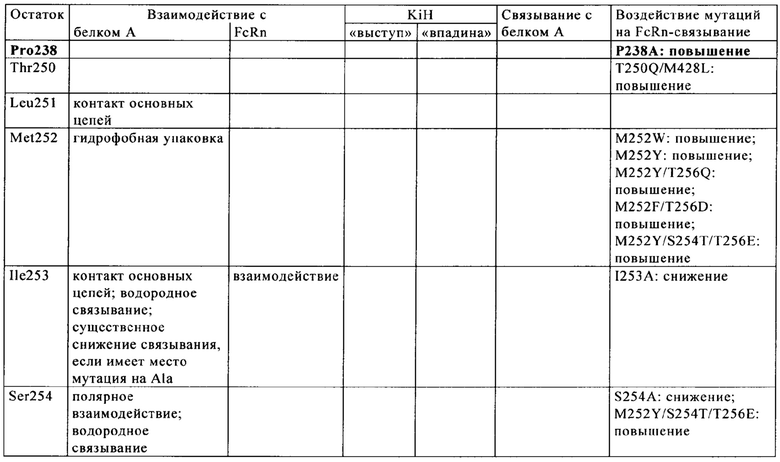
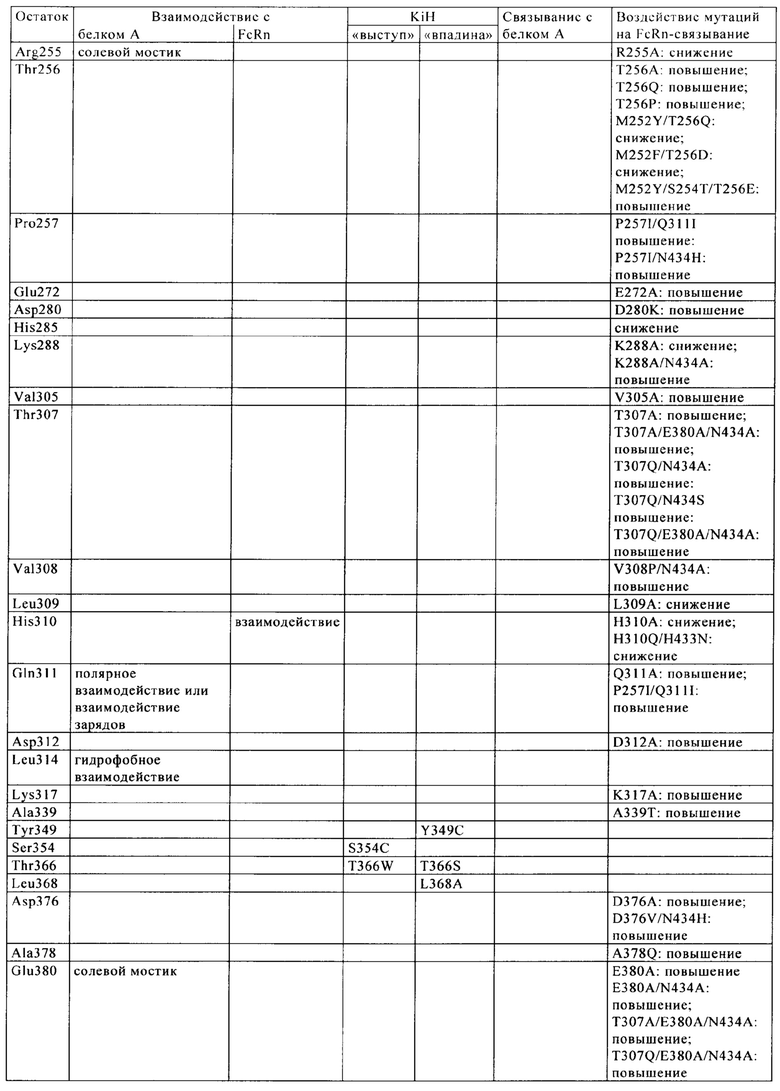
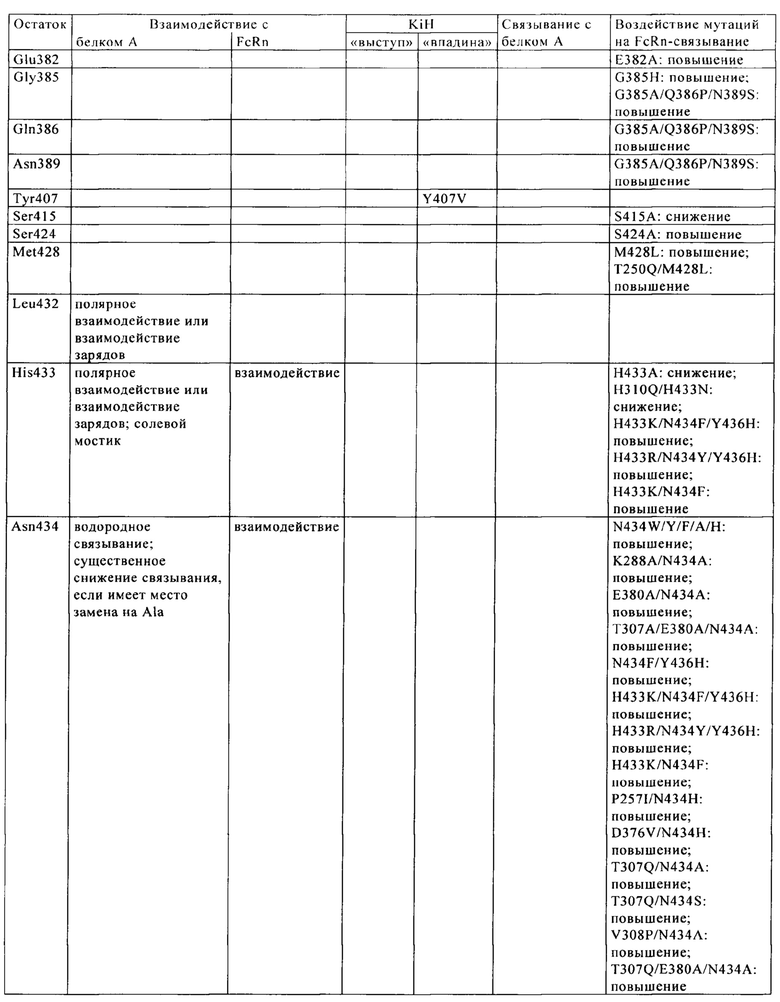
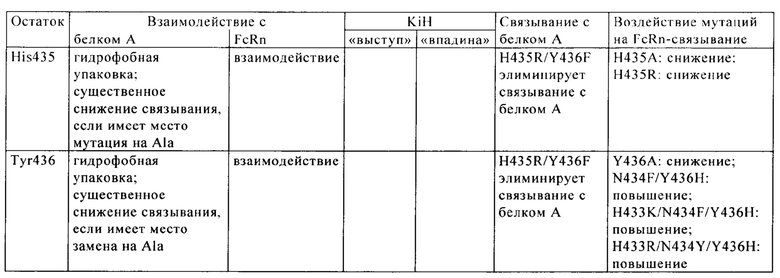
Модификации, указанные в настоящем описании, изменяют специфичность связывания в отношении одного или нескольких Fc-рецепторов, таких как человеческий FcRn. В то же время некоторые мутации, которые изменяют связывание с человеческим FcRn, не изменяют связывание с белком А стафилококков.
В одном вариантов осуществления изобретения комбинация мутаций, указанных в настоящем описании, может изменять или может существенно изменять время полужизни в сыворотке димерного полипептида по сравнению с соответствующим димерным полипептидом, у которого отсутствует указанная комбинация мутаций. В одном из вариантов осуществления изобретения комбинация мутаций кроме того не может изменять или не может существенно изменять связывание димерного полипептида с белком А по сравнению с соответствующим димерным полипептидом, у которого отсутствует указанная комбинация мутаций.
А. Неонатальный Fc-рецептор (FcRn)
Неонатальный Fc-рецептор (FcRn) играет важную роль в метаболической «судьбе» антител IgG-класса in vivo. Функции FcRn включают «спасение» IgG дикого типа от пути расщепления лизосомами, что приводит к пониженному клиренсу и удлиненному времени полужизни. Он представляет собой гетеродимерный белок, состоящий из двух полипептидов: имеющего молекулярную массу 50 кДа белка, напоминающего белок главного комплекса гистосовместимости класса I (α-FcRn), и имеющего молекулярную массу 15 кДа β2-микроглобулина (β2m). FcRn связывается с высокой аффинностью с СН2-СН3-участком Fc-области IgG. Взаимодействие между IgG и FcRn зависит от значения рН и имеет место при стехиометрическом соотношении 1:2, при этом одна молекула антитела IgG связывается с двумя молекулами FcRn через ее два полипептида Fc-области тяжелой цепи (Huber А.Н. и др., J. Mol. Biol. 230, 1993, cc. 1077-1083).
Таким образом, особенности FcRn-связывания/характеристики in vitro IgG являются показателем его фармакокинетических свойств in vivo в кровотоке.
Во взаимодействии между FcRn и Fc-областью антитела IgG-класса принимают участие различные аминокислотные остатки СН2- и СН3-домена тяжелой цепи. Аминокислотные остатки, взаимодействующие с FcRn, локализованы примерно между EU-положением 243 и EU-положением 261, примерно между EU-положением 275 и EU-положением 293, примерно между EU-положением 302 и EU-положением 319, примерно между EU-положением 336 и EU-положением 348, примерно между EU-положением 367 и EU-положением 393, в EU-положении 408 и примерно между EU-положением 424 и EU-положением 440. Более конкретно, следующие аминокислотные остатки согласно EU-нумерации Кэбота участвуют во взаимодействии между Fc-областью и FcRn: F243, Р244, Р245 Р, K246, Р247, K248, D249, Т250, L251, М252, I253, S254, R255, Т256, Р257, Е258, V259, Т260, С261, F275, N276, W277, Y278, V279, D280, V282, Е283, V284, Н285, N286, А287, К288, Т289, К290, Р291, R292, Е293, V302, V303, S304, V305, L306, Т307, V308, L309, Н310, Q311, D312, W313, L314, N315, G316, К317, Е318, Y319, I336, S337, К338, А339, К340, G341, Q342, Р343, R344, Е345, Р346, Q347, V348, С367, V369, F372, Y373, Р374, S375, D376, I377, А378, V379, Е380, W381, Е382, S383, N384, G385, Q386, Р387, Е388, N389, Y391, Т393, S408, S424, С425, S426, V427, М428, Н429, Е430, А431, L432, Н433, N434, Н435, Y436, Т437, Q438, К439 и S440.
Опыты с использованием сайтнаправленного мутагенеза доказали, что имеющими решающее значение сайтами связывания с FcRn в Fc-области IgG являются гистидин 310, гистидин 435 и изолейцин 253 и в меньшей степени гистидин 433 и тирозин 436 (см., например, Kim J.К. и др., Eur. J. Immunol. 29, 1999, cc. 2819-2825; Raghavan M. и др., Biochem. 34, 1995, cc. 14649-146579; Medesan С.и др., J Immunol. 158, 1997, cc. 2211-2217).
Методы, предназначенные для повышения IgG-связывания с FcRn, осуществляли, используя мутацию IgG на различных аминокислотных остатках: треонин 250, метионин 252, серии 254, треонин 256, треонин 307, глутаминовая кислота 380, метионин 428, гистидин 433 и аспарагин 434 (см. Kuo Т.Т. и др., J. Clin. Immunol. 30, 2010, сс. 777-789).
В некоторых случаях требуются антитела с укороченным временем полужизни в кровотоке. Например, лекарственные средства для интравитреального применения должны иметь продолжительное время полужизни в глазу и короткое время полужизни в кровотоке пациента. Указанные антитела обладают также преимуществом с позиции удлиненной экспозиции области заболевания, например, в глазу.
Известны различные мутации, которые влияют на FcRn-связывание и в результате на время полужизни в кровотоке. Остатки Fc-области, имеющие решающее значение для взаимодействия мышиная Fc-мышиный FcRn, идентифицированы путем сайтнаправленного мутагенеза (см., например, Dall'Acqua W.F. и др., J. Immunol 169, 2002, сс. 5171-5180). Остатки I253, Н310, Н433, N434 и Н435 (EU-нумерация согласно Кэботу) участвуют во взаимодействии (Medesan С. и др., Eur. J. Immunol. 26, 1996, сс. 2533-2536; Firan М. и др., Int. Immunol. 13, 2001, сс. 993-1002; Kim J.K. и др., Eur. J. Immunol. 24, 1994, cc. 542-548). Установлено, что остатки I253, Н310 и Н435 имеют решающее значение для взаимодействия человеческой Fc-области с мышиным FcRn (Kim J.K. и др., Eur. J. Immunol. 29, 1999, cc. 2819-2825). В опытах, проведенных Dall'Acqua с соавторами, установлено, что остатки M252Y, S254T, Т256Е улучшают FcRn-связывание путем белок-белкового взаимодействия (Dall'Acqua W.F. и др., J. Biol. Chem. 281, 2006, сс. 23514-23524). Исследования комплекса человеческая Fc-человеческий FcRn продемонстрировали, что остатки I253, S254, Н435 и Y436 имеют решающее значение для взаимодействия (Firan М. и др., Int. Immunol. 13, 2001, сс. 993-1002; Shields R.L. и др., J. Biol. Chem. 276, 2001, cc. 6591-6604). У Yeung Y.A. с соавторами (J. Immunol. 182, 2009, cc. 7667-7671) описаны и изучены различные мутанты остатков 248-259 и 301-317, и 376-382 и 424-437. Примеры мутаций и их воздействия на FcRn-связывание представлены ниже в таблице.
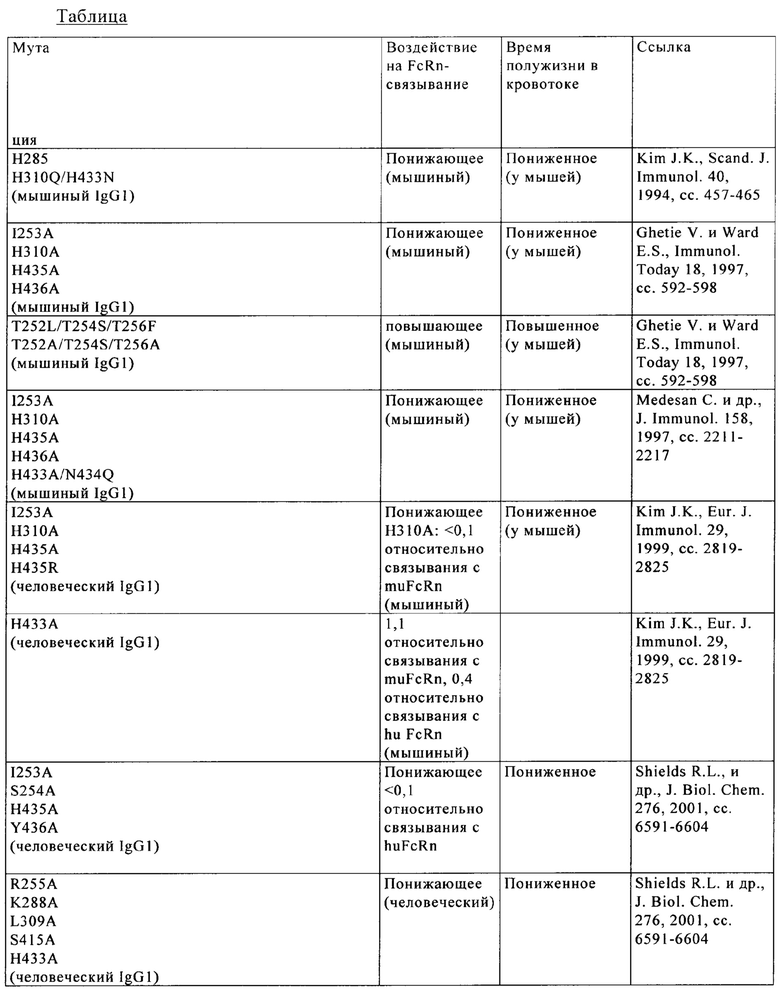
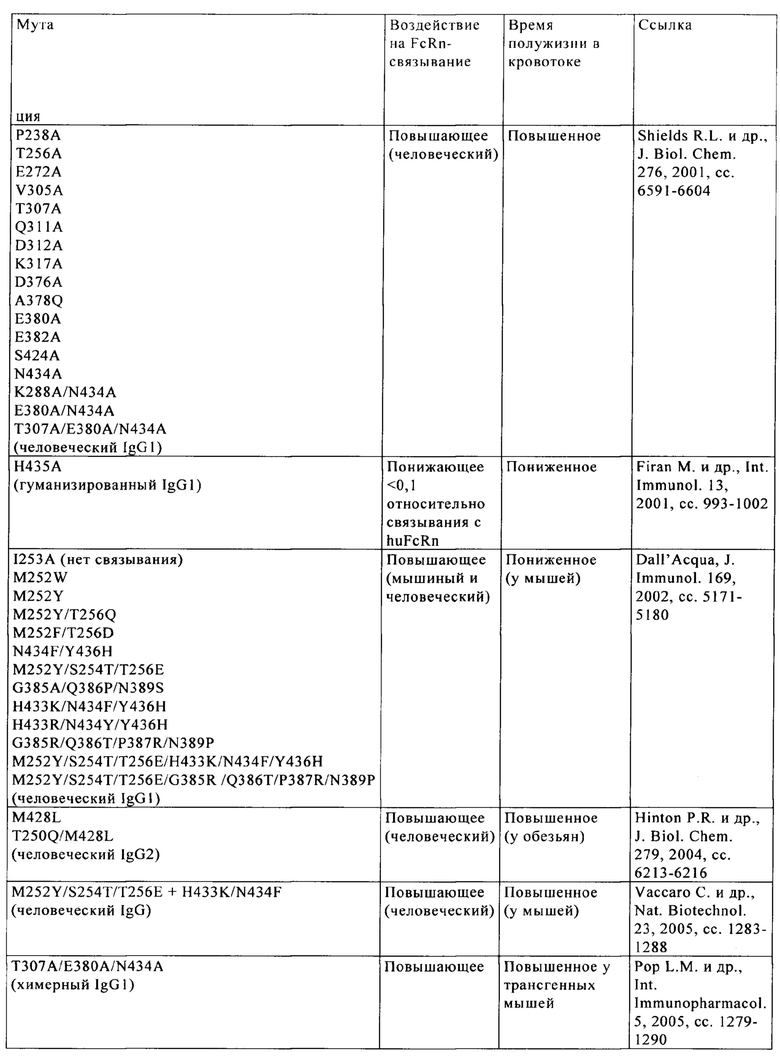
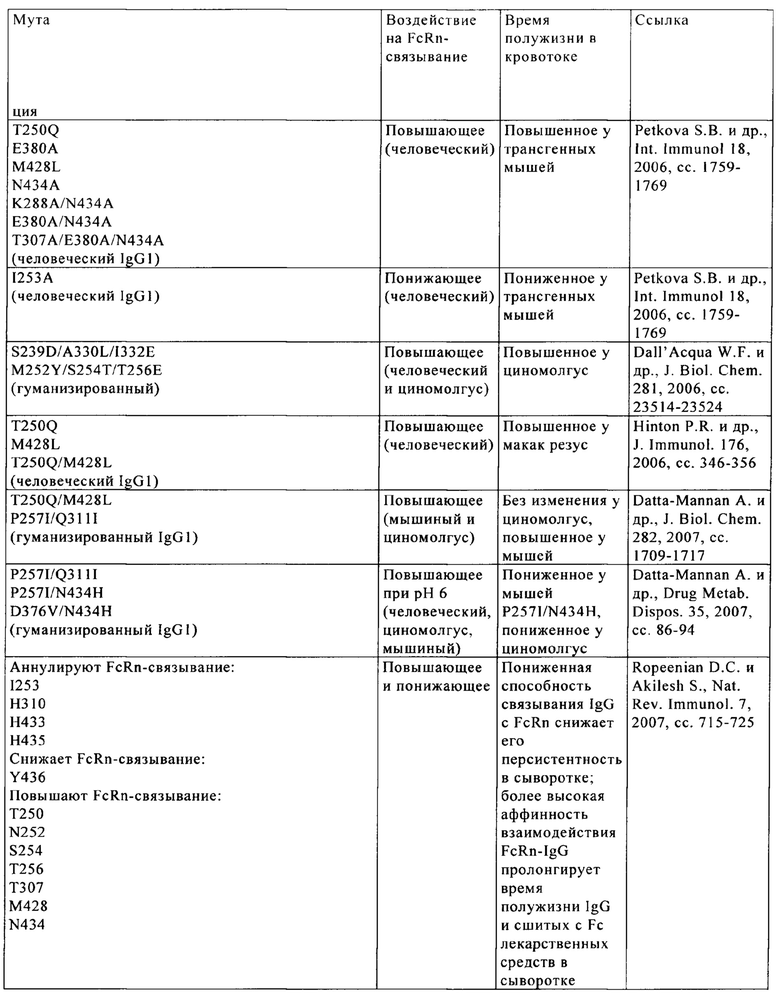
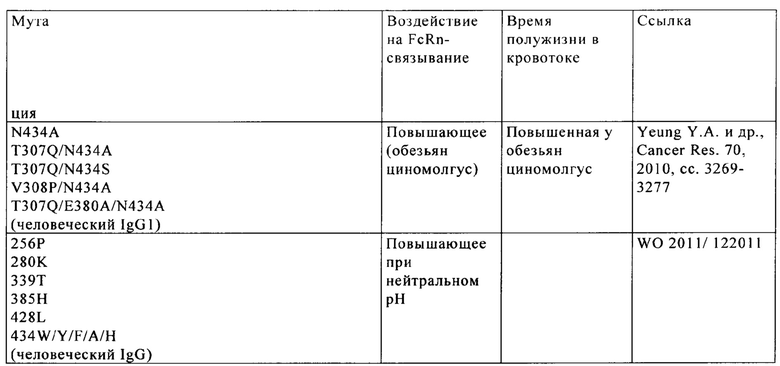
Было установлено, что одной односторонней мутации в одном полипептиде Fc-области достаточно для существенного ослабления связывания с FcRn. Чем больше мутаций интродуцировали в Fc-область, тем слабее становилось связывание с FcRn. Однако односторонних асимметричных мутаций недостаточно для полного ингибирования FcRn-связывания. Мутации на обеих сторонах необходимы для полного ингибирования FcRn-связывания.
Результаты создания симметричной Fc-области IgG1 для влияния на FcRn-связывание представлены ниже в таблице (сравнительный анализ мутаций и времени удерживания на содержащей FcRn колонке для аффинной хроматографии).
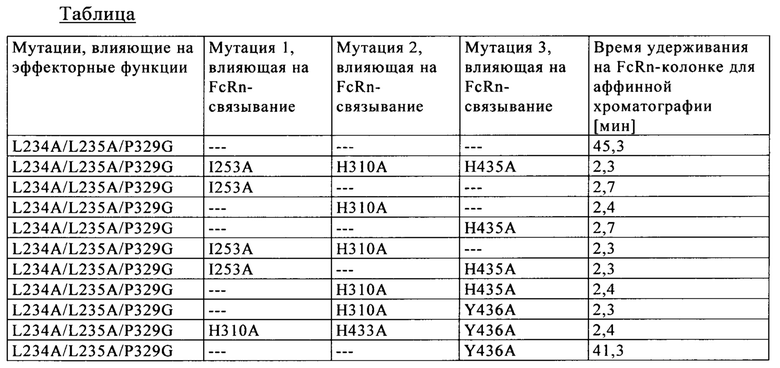
Время удерживания, составляющее менее 3 мин, соответствовало отсутствию связывания, поскольку субстанция находилась в прошедшем потоке («пустой» пик).
Индивидуальная мутация Н310А представляла собой наиболее важную «молчащую» симметричную мутацию, приводящую к элиминации какого-либо FcRn-связывания.
Симметричная индивидуальная мутация I253A и Н435А приводила к относительному сдвигу времени удерживания на 0,3-0,4 мин. Это можно, как правило, рассматривать как не поддающееся выявлению связывание.
Индивидуальная мутация Y436A приводила к поддающейся выявлению силе взаимодействия с содержащей FcRn аффинной колонкой. Не вдаваясь в теорию, эта мутация могла приводить к такому же опосредуемому FcRn времени полужизни, которое можно было отличить от времени полужизни, соответствующего нулевому взаимодействию, что и комбинация мутаций I253A, Н310А и Н435А (мутация IHH-ААА).
Результаты, полученные с использованием симметрично модифицированного антитела к HER2, представлены ниже в таблице (см. в качестве ссылки WO 2006/031370).
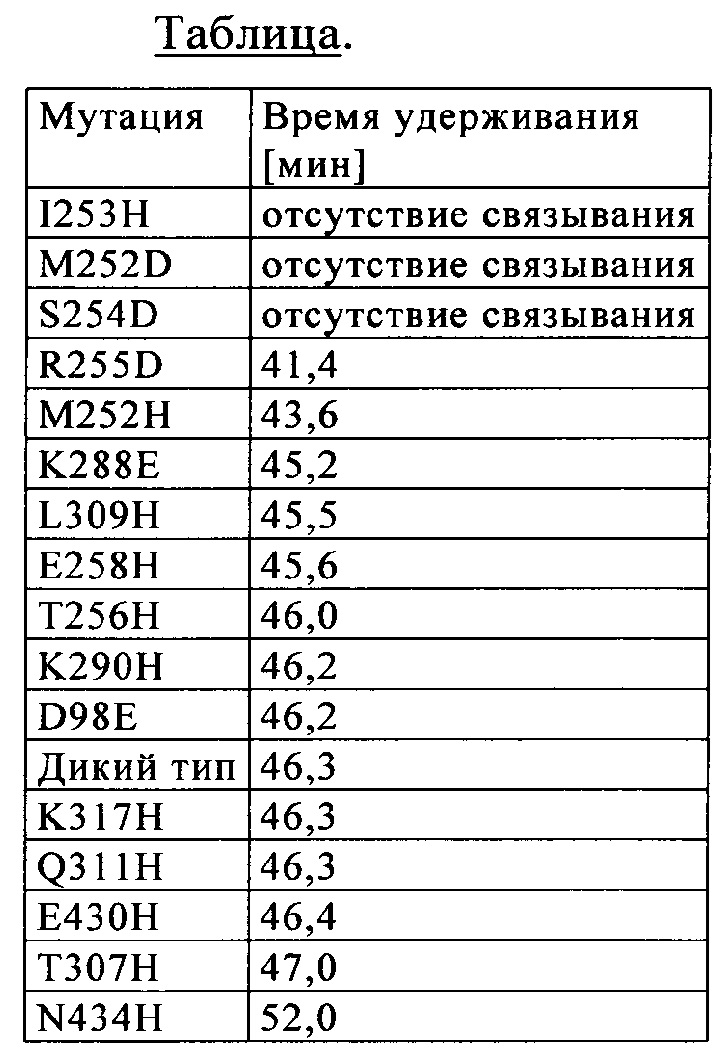
Воздействие интродукции асимметричных влияющих на FcRn-связывание мутаций в Fc-область описано на примере биспецифического антитела, собранного с помощью технологии «knobs-into-holes» (см., например, US 7695936, US 2003/0078385; мутации, приводящие к получению «несущей «впадину» цепи»: S354C/T366W, мутации, приводящие к получению «несущей «выступ» цепи»: Y349C/T366S/L368A/Y407V). Воздействие интродуцированных мутаций на FcRn-связывание можно легко оценивать с помощью метода FcRn-аффинной хроматографии (см. фиг. 9 и представленную ниже таблицу). Антитела, которые позднее элюируются из FcRn-аффинной колонки, т.е. имеют большее время удерживания на FcRn-аффинной колонке, имеют более продолжительное время полужизни in vivo, и наоборот.
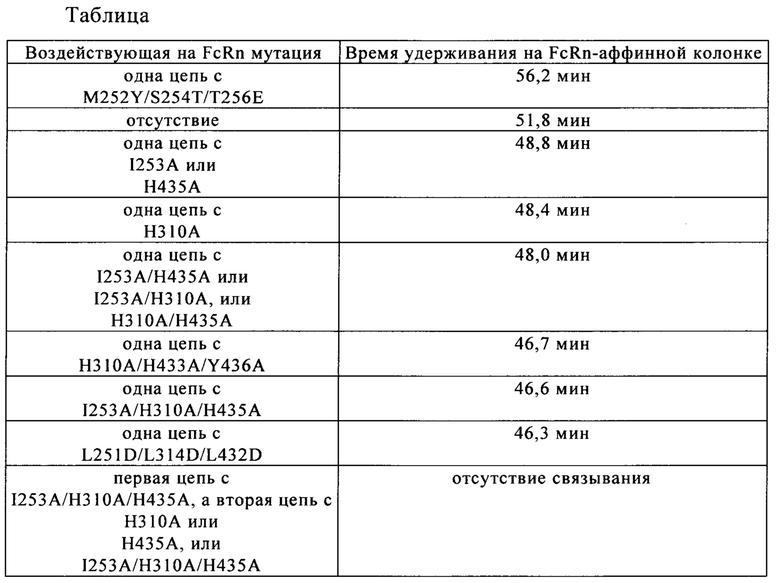
Воздействие интродукции асимметричных влияющих на FcRn-связывание мутаций в Fc-область описано также на примере моноспецифического антитела к IGF-1R, собранного с помощью технологии «knobs-into-holes», для того, чтобы обеспечить интродукцию асимметричных мутаций (см., например, US 7695936, US 2003/0078385; мутации, приводящие к получению «несущей «впадину» цепи» S354C/T366W, мутации, приводящие к получению «несущей «выступ» цепи»: Y349C/T366S/L368A/Y407V). Воздействие ассиметрично интродуцированных мутаций на FcRn-связывание можно легко оценивать с помощью метода аффинной хроматографии с использованием FcRn (см. представленную ниже таблицу). Антитела, которые позднее элюируются из FcRn-аффинной колонки, т.е. имеют большее время удерживания на FcRn-аффинной колонке, имеют более продолжительное время полужизни in vivo, и наоборот.
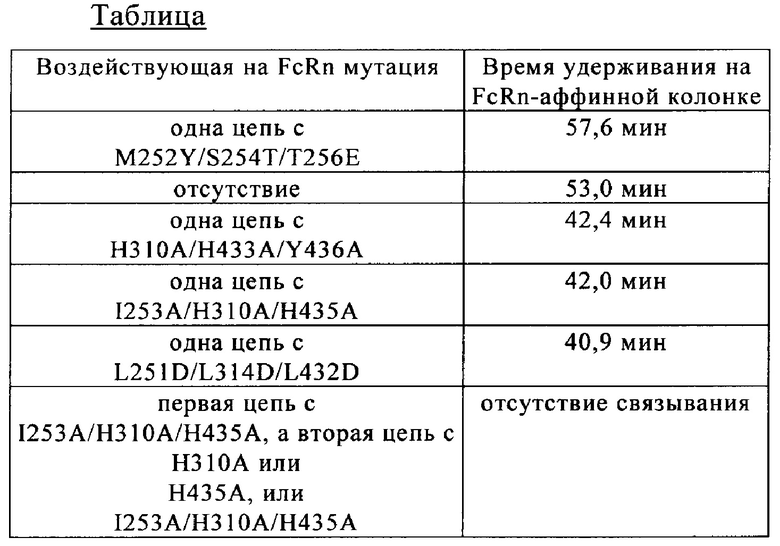
Асимметричные IHH-AAA- и LLL-DDD-мутации (LLL-DDD-мутация представляет собой комбинацию L251D, L314D и L432D) приводили к более слабому связыванию по сравнению с соответствующим родительским антителом или антителом дикого типа.
Симметричная HHY-AAA-мутация (т.е. комбинация мутаций Н310А, Н433А и Y436A) приводила к получению Fc-области, которая более не обладала способностью связываться с человеческим FcRn, при этом сохранялась способность связываться с белком А (см. фиг. 11, 12, 13 и 14).
Воздействие интродукции асимметричных влияющих на FcRn-связывание мутаций в Fc-область описано также на примере моноспецифического антитела к IGF-1R (IGF-1R), биспецифического антитела к VEGF/ANG2 (VEGF/ANG2) и полноразмерного антитела со слияниями с С-концом обеих тяжелых цепей (слияние), собранных с помощью технологии «knobs-into-holes», для того, чтобы обеспечить интродукцию асимметричных мутаций (см., например, US 7695936, US 2003/0078385; мутации, приводящие к получению «несущей «впадину» цепи»: S354C/T366W, мутации, приводящие к получению «несущей «выступ» цепи»: Y349C/T366S/L368A/Y407V). Воздействие интродуцированных мутаций на связывание с FcRn и связывание с белком А можно легко оценивать с помощью метода FcRn-аффинной хроматографии, метода аффинной хроматографии на белке А и методов на основе SPR (см. приведенную ниже таблицу).
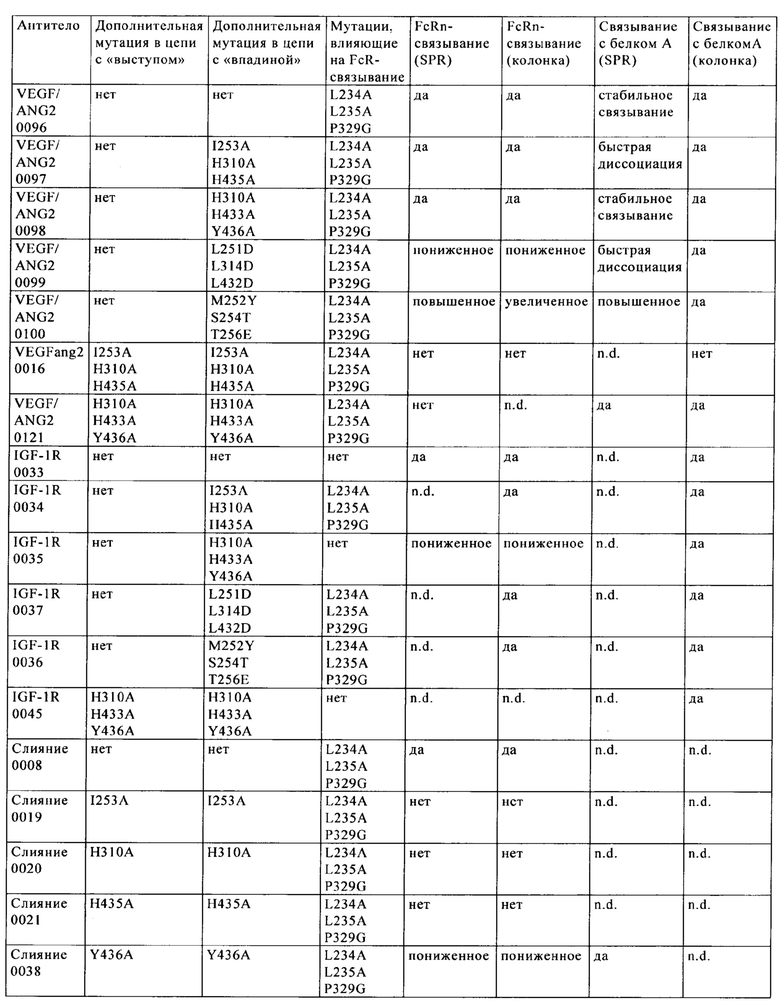
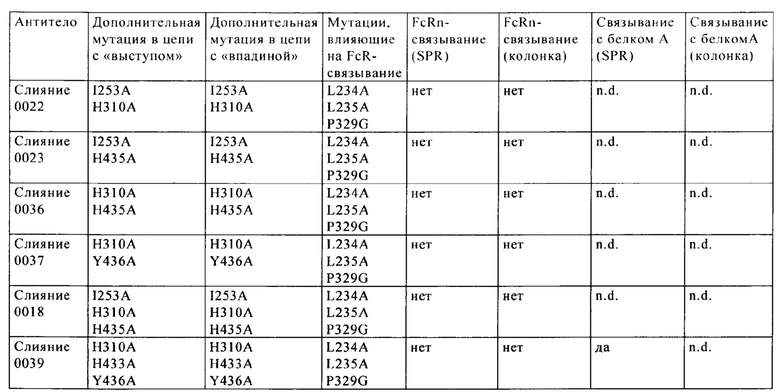
Одним из объектов изобретения является антитело или включающий Fc-область слитый полипептид, который содержит вариант Fc-область человеческого IgG-класса, указанные в настоящем описании.
Fc-область (димерный полипептид), указанная в настоящем описании, когда входит в содержащий Fc-область слитый полипептид или полноразмерное антитело, придает молекулы описанные выше характеристики. Партнер по слиянию может представлять собой любые молекулы, обладающие биологической активностью, время полужизни которых in vivo должно быть понижено или повышено, т.е. время полужизни in vivo которых должно быть строго определенным и специально «подогнанным» для его предполагаемого применения.
Включающие Fc-область слитые полипептиды могут содержать, например, вариант Fc-области (человеческого) IgG-класса, указанный в настоящем описании, и рецепторный белок, который связывается с мишенью, включая лиганд, такой, например, как слитый полипептид TNFR-Fc-область (TNFR представляет собой рецептор человеческого фактора некроза опухоли) или слитый полипептид IL-1R-Fc-область (IL-1R представляет собой рецептор человеческого интерлейкина-1), или слитые полипептиды VEGFR-Fc-область (VEGFR представляет собой рецептор человеческого сосудистого эндотелиального фактора роста), или слитые полипептиды ANG2R-Fc-область (ANG2R представляет собой рецептор человеческого ангиопоэтина 2).
Включающие Fc-область слитые полипептиды могут содержать, например, вариант Fc-области (человеческого) IgG-класса, указанный в настоящем описании, и фрагмент антитела, который связывается с мишенью, включая, например, Fab-фрагмент антитела, scFv (см., например, Nat. Biotechnol. 23, 2005, сс. 1126-1136), или доменные антитела (dAb) (см., например, WO 2004/058821 и WO 2003/002609).
Включающие Fc-область слитые полипептиды могут содержать, например, вариант Fc-области (человеческого) IgG-класса, указанный в настоящем описании, и лиганд рецептора (либо встречающийся в естественных условиях, либо искусственный).
Антитела, например, полноразмерные антитела или CrossMab, могут содержать вариант Fc-области (человеческого) IgG-класса, указанный в настоящем описании.
Б. Сосудистые глазные заболевания
Сосудистые глазные заболевания включает любые патологические состояния, отличающиеся измененной или нерегулируемой пролиферацией и инвазией новых кровеносных сосудов в структуры тканей глаза, таких как сетчатка или роговица.
В одном из вариантов осуществления изобретения сосудистое глазное заболевание выбирают из группы, включающей: влажную возрастную дегенерацию желтого пятна (влажная форма AMD), сухую возрастную дегенерацию желтого пятна (сухая форма AMD), диабетический отек желтого пятна (DME), цистоидный отек желтого пятна (СМЕ), непролиферативную диабетическую ретинопатию (NPDR), пролиферативную диабетическую ретинопатию (PDR), цистоидный отек желтого пятна, васкулит (например, окклюзия центральной вены сетчатки) папиллоэдему (отек диска зрительного нерва), ретинит, конъюнктивит, увеит, хороидит, мультифокальный хороидит, гитоплазмоз глаза, блефарит, «сухой глаз» (болезнь Шегрена) и другие офтальмические заболевания, при которых глазное заболевание или нарушение ассоциировано с неоваскуляризацией глаза, просачиванием из сосудов и/или отеком сетчатки.
Антитело, содержащее димерный полипептид, указанное в настоящем описании, можно применять для предупреждения и лечения влажной формы AMD, сухой формы AMD, СМЕ, DME, NPDR, PDR, блефарита, «сухого глаза» и увеита, предпочтительно также влажной формы AMD, сухой формы AMD, блефарита и «сухого глаза», предпочтительно также СМЕ, DME, NPDR и PDR, предпочтительно также блефарита и «сухого глаза», в частности влажной формы AMD и сухой формы AMD, а также наиболее предпочтительно важной формы AMD.
В некоторых вариантах осуществления изобретения сосудистое глазное заболевание выбирают из группы, состоящей из влажной возрастной дегенерации желтого пятна (влажная форма AMD), отека сетчатки, окклюзии вен сетчатки, ретролентальной фиброплазии и диабетической ретинопатии. Другие болезни, ассоциированные с неоваскуляризацией роговицы, включают (но, не ограничиваясь только ими) эпидемический кератоконъюнктивит, дефицит витамина А, переношение положенного времени контактных линз, атопический кератит, верхний лимбический кератит, птеригий, сухой кератит, болезнь Шегрена, розовые угри, филектенулоз, сифилис, инфекции, вызываемые микобактериями, липидные дегенерации, химические ожоги, бактериальные язвы, грибковые язвы, инфекции, вызываемые вирусом герпеса простого, инфекции, вызываемые вирусом опоясывающего лишая, протозойные инфекции, саркому Капоши, язву Мурена, краевую дегенерацию Терриена, краевой кератолизис, ревматоидный артрит, системную красную волчанку, полиартерит, травму, саркоидоз Вегенера, склерит, болезнь Стивена-Джонсона, перифигоидную радиальную кератотомию и отторжение трансплантата роговицы.
Заболевания, ассоциированные с ретинальной/хороидальной неоваскуляризацией, включают (но, не ограничиваясь только ими) диабетическую ретинопатию, дегенерацию желтого пятна, серповидноклеточная анемию, саркоид, сифилис, псевдоксантому эластическую, болезнь Педжета, окклюзию вен, окклюзию артерий, обструктивное заболевание сонной артерии, хронический увеит/витрит, инфекции, вызываемые микобактериями, болезнь Лайма, системную красную волчанку, ретролентальную фиброплазию, пигментный ретинит, отек сетчатки (включая отек желтого пятна), болезнь Изла, болезнь Бехчета, инфекции, вызывающие ретинит или хороидит, синдром предполагаемого глазного гистоплазмоза, болезнь Беста, миопию, ямки диска зрительного нерва, болезнь Штаргардта, туберкулез сосудистой оболочки глазного яблока (туберкулезный увеит), хроническое отслоение сетчатки, синдром гипервязкости, токсоплазмоз, осложнения, связанные с травмой и воздействием лазера.
Другие болезни включают (но, не ограничиваясь только ими) болезни, ассоциированные с покраснением (неоваскуляризация угла), и болезни, вызываемые аномальной пролиферацией фиброваскулярной или фиброзной ткани, включая все формы пролиферативной витриоретинопатии. Ретролентальная фиброплазия (ROP) представляет собой заболевание глаза, которое поражает преждевременно родившихся детей. Вероятно, оно вызывается дезорганизованным ростом кровеносных сосудов сетчатки, что может приводить к рубцеванию и отслоению сетчатки. ROP может быть слабой и может спонтанно устраняться, но может в серьезных случаях приводить к слепоте. В целом, все недоношенные дети имеют риск ROP, а очень низкий вес при рождении является дополнительным фактором риска. Как токсичность кислорода, так и относительно гипоксия могут принимать участие в развитии ROP.
Дегенерация желтого пятна представляет собой медицинское состояние, встречающееся главным образом у престарелых людей, при котором центр внутренней выстилки глаза, известный как желтое пятно (макула) сетчатки, истончается, атрофируется и в некоторых случаях кровоточит. Это может приводить к снижению центрального зрения, что влечет за собой отсутствие возможности видеть мелкие детали, читать или различать лица. Согласно Американской академии офтальмологии в Соединенных Штатах это является причиной потери центрального зрения (слепоты) у людей возрастом старше 50 лет. Хотя некоторые виды дистрофии желтого пятна, которые поражают более молодых индивидуумов, иногда обозначают как дегенерация желтого пятна, понятие, как правило, относится к возрастной дегенерации желтого пятна (AMD или ARMD).
Возрастная дегенерация желтого пятна начинается с характерных отложений желтого цвета, называемых друзами, в макуле (центральная область сетчатки, которая обеспечивает детализированное центральное зрение, называемая ямкой), между пигментным эпителием сетчатки и низлежащей собственно сосудистой оболочкой глаза. Большинство людей с указанными ранними изменениями (которые называют возрастной макулопатией) имеют хорошее зрение. У людей с друзами может развиваться запущенная форма AMD. Риск значительно возрастает, когда друзы становятся крупными и многочисленными и связанными с нарушением в слое пигментированных клеток под желтым пятном. Крупные и мягкие друзы связаны с повышенными отложениями холестерина и могут реагировать на лечение снижающими холестерин средствами или Рео-процедуру.
Запущенная форма AMD, ответственная за глубокую (полную) потерю зрения, имеет две формы: сухую и влажную. Затрагивающая центральную ямку географическая атрофия, сухая форма запущенной AMD, является результатом атрофии слоя пигментного эпителия сетчатки, расположенного под сетчаткой, что приводит к потере зрения в результате потери фоторецепторов (палочек и колбочек) в центральной области глаза. Хотя для этого состояния отсутствует лечение, Национальным институтом глаза и другими организациями продемонстрировано, что витаминные добавки с высокими дозами антиоксидантов, лютеином и зеаксантином замедляют развитие сухой формы дегенерации желтого пятна у некоторых пациентов, улучшая визуальную активность.
Ретинит пигментный (RP) представляет собой группу генетических состояний глаза. При прогрессировании симптомов RP, как правило, ночная слепота предшествует туннельному зрению в течение ряда лет или даже десятилетий. Многие люди с RP не становятся формально слепыми до 40 или 50 лет и сохраняют некоторое зрение в течение всей жизни. У других в результате RP развивается полная слепота, в некоторых случаях даже уже в детстве. Развитие RP в каждом случае является различным. RP является типом наследственной дистрофии сетчатки, т.е. относится к группе наследственных нарушений, при которых аномалии фоторецепторов (палочки и колбочки) или ретинального пигментного эпителия (RPE) сетчатки приводит к прогрессирующей потере зрения. Пораженные индивидуумы сначала страдают нарушенной адаптацией к темноте или никталопией (куриная (ночная) слепота), затем снижением периферического поля зрения (так называемым туннельным зрением) и иногда позднее в процессе развития болезни снижением центрального зрения.
Макулярный отек (отек желтого пятна) имеет место, когда жидкость и белковые отложения собираются на макуле или под макулой глаза, центральной областью желтого цвета сетчатки, вызывая утолщение и набухание. Набухание может искажать центральное зрение человека, поскольку желтое пятно находится вблизи центра сетчатки на задней стенке глазного яблока. Эта область содержит плотно упакованные колбочки, что обеспечивает острое, ясное центральное зрение, позволяющее человеку видеть форму, цвет и детали, которые находятся непосредственно на линии взгляда. Цистоидный (кистозный) макулярный отек является типом макулярного отека, который включает образование кист.
В. Очистка антител с использованием колонки для аффинной хроматографии с белком A Staphylococcus
Одним из объектов изобретения является димерный полипептид, содержащий
первый полипептид и второй полипептид, каждый из которых содержит в направлении от N-конца к С-концу по меньшей мере часть шарнирной области иммуноглобулина, которая содержит один или несколько остатков цистеина, СН2-домен иммуноглобулина и СН3-домен иммуноглобулина,
в котором
I) первый и второй полипептиды содержат мутации Н310А, Н433А и Y436A или
II) первый и второй полипептиды содержат мутации L251D, L314D и L432D, или
III) первый полипептид содержит мутации I253A, Н310А и Н435А, а второй полипептид содержит мутации Н310А, Н433А и Y436A, или
IV) первый полипептид содержит мутации I253A, Н310А и Н435А, а второй полипептид содержит мутации L251D, L314D и L432D.
Указанные димерные полипептиды благодаря этим мутациям приобретают способность не связываться с человеческим FcRn, в то время как способность связываться с белком А стафилококков сохраняется.
Таким образом, указанные антитела можно очищать, т.е. отделять от нежелательных побочных продуктов, с использованием общепринятых материалов для аффинной хроматографии, включающих белок А, таких как MabSelectSure. He требуется применять очень сложные, но имеющие видовое ограничение материалы для аффинной хроматографии, такие, например, как KappaSelect, которые можно применять только для антител, содержащих легкие цепи каппа-подкласса. Кроме того, не требуется адоптировать метод очистки, если сделаны модификация/изменение подкласса легкой цепи (см. фиг. 11 и 12 соответственно).
Одним из объектов настоящего изобретения является способ получения димерного полипептида, указанного в настоящем описании, заключающийся в том, что осуществляют следующие стадии, на которых:
а) культивируют клетку млекопитающего, содержащую одну или несколько нуклеиновых кислот, которая/которые кодирует(ют) димерный полипептид, указанный в настоящем описании,
б) выделяют димерный полипептид из среды для культивирования и
в) очищают димерный полипептид с помощью аффинной хроматографии на белке А и тем самым получают димерный полипептид.
Одним из объектов настоящего изобретения является применение мутаций Н310А, Н433А и Y436A для отделения гетеродимерных полипептидов от гомодимерных полипептидов.
Одним из объектов настоящего изобретения является применение мутаций L251D, L314D и L432D для отделения гетеродимерных полипептидов от гомодимерных полипептидов.
Одним из объектов настоящего изобретения является применение мутаций I253A, Н310А и Н435А в первом полипептиде в сочетании с мутациями Н310А, Н433А и Y436A во втором полипептиде для отделения гетеродимерных полипептидов, которые содержат первый и второй полипептиды, от гомодимерных полипептидов.
Одним из объектов настоящего изобретения является применение мутаций I253A, Н310А и Н435А в первом полипептиде в сочетании с мутациями L251D, L314D и L432D во втором полипептиде для отделения гетеродимерных полипептидов, которые содержат первый и второй полипептиды, от гомодимерных полипептидов.
В одном из вариантов осуществления изобретения трех предыдущих объектов изобретения первый полипептид содержит дополнительно мутации Y349C, T366S, L368A и Y407V, а второй полипептид содержит дополнительно мутации S354C и T366W.
В одном из вариантов осуществления изобретения трех предыдущих объектов изобретения первый полипептид содержит дополнительно мутации S354C, T366S, L368A и Y407V, а второй полипептид дополнительно содержит мутации Y349C и T366W.
Одним из объектов настоящего изобретения является применение мутации Y436A для повышения способности связываться димерного полипептида ??Fc-области димерного полипептида с белком А стафилококков.
Было установлено, что путем интродукции мутации Y436A можно усиливать связывание Fc-области с белком А стафилококков (SPA). Это является ценным, например, если интродуцированы дополнительные мутации, которые снижают связывание с SPA, такие, например, как I253A и Н310А или Н310А и Н435А (см. фиг. 15).
Одним из объектов настоящего изобретения является димерный полипептид, содержащий
первый полипептид и второй полипептид, каждый из которых содержит в направлении от N-конца к С-концу по меньшей мере часть шарнирной области иммуноглобулина, которая содержит один или несколько остатков цистеина, СН2-домен иммуноглобулина и СН3-домен иммуноглобулина
в котором первый, второй или первый и второй полипептиды содержат мутацию Y436A (нумерация согласно системе нумерации на основе EU-индекса Кэбота).
В одном из вариантов осуществления изобретения первый и второй полипептиды содержат мутацию Y436A.
Одним из объектов настоящего изобретения является биспецифическое антитело, которое легко выделять /очищать, содержащее Fc-области тяжелых цепей иммуноглобулина, которые модифицированы по-разному, где по меньшей мере одна из модификаций приводит к I) разной аффинности биспецифического антитела к белку А, и II) разной аффинности биспецифического антитела к человеческому FcRn, и это позволяет выделять биспецифическое антитело из разрушенных клеток, из среды или из смеси антител на основе его аффинности к белку А.
В одном из вариантов осуществления изобретения биспецифическое антитело элюируют при значении рН, превышающем рН 4,0.
В одном из вариантов осуществления изобретения биспецифическое антитело выделяют, используя аффинную хроматографию на белке А и градиент рН или ступенчатое изменение рН, где градиент рН или ступенчатое изменение рН включает добавление соли. В конкретном варианте осуществления изобретения соль присутствует в концентрации от примерно 0,5 моля до примерно 1 моль. В одном из вариантов осуществления изобретения соль выбирают из группы, состоящей из ацетатов лития, натрия и калия; бикарбонатов натрия и калия; карбонатов лития, натрия и калия; хлоридов лития, натрия, калия и магния; фторидов натрия и калия; нитратов натрия, калия и кальция; фосфатов натрия и калия и сульфатов кальция и магния. В одном из вариантов осуществления изобретения соль представляет собой галогенид щелочного металла или щелочноземельного металла. В одном из предпочтительных вариантов осуществления изобретения соль представляет собой хлорид натрия.
В одном из объектов изобретения димерный полипептид содержит первый полипептид, модифицированный согласно указанному в настоящем описании, и второй полипептид с немодифицированной способностью связываться с белком А и FcRn, в результате чего образуется гетеродимерный полипептид, где дифференциальная модификация приводит к тому, что элюция димерного полипептида из содержащего белок А аффинного материала происходит при значение рН, которое на 0,5, 0,6, 0,7, 0,8, 0,9, 1,0, 1,2, 1,3 или 1,4 единиц рН выше, чем значение рН соответствующего димерного полипептида, у которого отсутствует дифференциальная модификация. В одном из вариантов осуществления изобретения по-разному модифицированный димерный полипептид элюируется при рН 4 или выше, а немодифицированный димерный полипептид элюируется при рН 3,5 или ниже. В одном из вариантов осуществления изобретения по-разному модифицированный димерный полипептид элюируется при рН примерно 4, а немодифицированный димерный полипептид элюируется при рН примерно 2,8-3,5, 2,8-3,2 или 2,8-3. В этих вариантах осуществления изобретения «немодифицированный» относится к отсутствию модификации Н310А, Н433А и Y436A (нумерация согласно системе нумерации на основе EU-индекса Кэбота) в обоих полипептидах.
При осуществлении хроматографических циклов добавление от 0,5 до 1 моля соли (например, NaCl) может улучшать разделение гомодимерного полипептида и гетеродимерного полипептида, прежде всего, если он происходит из человеческого IgG1-подкласса. Добавление соли в раствор для элюции, что приводит к повышению значения рН, может расширять диапазон значений рН для элюции, так, что, например, ступенчатый градиент рН можно успешно применять для разделения двух видов.
Таким образом, одним из вариантов осуществления изобретения является способ отделения биспецифического антитела, содержащего Fc-область гетеродимерного IgG, в котором одна цепь содержит мутации, указанные в настоящем описании, включающий стадию применения градиента рН в присутствии соли. В одном из вариантов осуществления изобретения соль присутствует в концентрации, достаточной для повышения до максимума различия в рН между элюцией из содержащего белок А хроматографического материала гомодимера по Fc-области IgG и гетеродимера по Fc-области IgG. В одном из вариантов осуществления изобретения соль присутствует в концентрации от примерно 0,5 до примерно 1 моль. В одном из вариантов осуществления изобретения соль представляет собой соль щелочного металла или щелочноземельного металла и галогена. В одном из вариантов осуществления изобретения соль представляет собой хлорид щелочного металла или щелочноземельного металла, такую, например, как NaCl, KCl, LiCl, CaCl2 или MgCl2. В одном из вариантов осуществления изобретения градиент рН составляет от примерно рН 4 до примерно рН 5. В одном из вариантов осуществления изобретения градиент представляет собой линейный градиент. В одном из вариантов осуществления изобретения градиент рН представляет собой ступенчатый градиент. В одном из вариантов осуществления изобретения способ заключается в том, что применяют для уравновешивания аффинной колонки с белком раствор, значение рН которого составляет примерно 4. В одном из вариантов осуществления изобретения биспецифическое антитело содержащее Fc-область гетеродимерного IgG касательно модификаций, указанных в настоящем описании, элюируют из материала для аффинной хроматографии с белком А в виде одной или нескольких фракций, практически свободных от негетеродимерного биспецифического антитела.
Димерный полипептид, указанный в настоящем описании, получают с помощью методов рекомбинации. Так, одним из объектов настоящего изобретения является нуклеиновая кислота, которая кодирует димерный полипептид, указанный в настоящем описании, а другим объектом изобретения является клетка, которая содержит указанную нуклеиновую кислоту, которая кодирует димерный полипептид, указанный в настоящем описании. Методы рекомбинантного получения широко известны в данной области и заключаются в том, что экспрессируют белок в прокариотических и эукариотических клетках с последующим выделением димерного полипептида, и, как правило, очисткой до фармацевтически приемлемой чистоты. Для экспрессии димерных полипептидов в вышеуказанных клетках-хозяевах нуклеиновую кислоту, кодирующую соответственно первый и второй полипептиды, встраивают в экспрессионные векторы с помощью стандартных методов. Экспрессию осуществляют в пригодных прокариотических и эукариотических клетках-хозяевах типа СНО-клеток, NS0-клеток, SP2/0-клеток, HEK293-клеток, COS-клеток, PER.С6-клеток, дрожжей или клеток E.coli, и димерный полипептид выделяют из клеток (из супернатанта или клеток после лизиса).
Общие методы рекомбинантного получения антител хорошо известны в данной области и описаны, например, в обзорных статьях Makrides S.C., Protein Expr. Purif. 17, 1999, cc. 183-202; Geisse S. и др., Protein Expr. Purif. 8, 1996, cc. 271-282; Kaufman R.J., Mol. Biotechnol. 16, 2000, cc. 151-160; Werner R.G., Drug Res. 48, 1998, cc. 870-880.
Таким образом, одним из объектов изобретения является способ получения димерного полипептида, указанного в настоящем описании, заключающийся в том, что осуществляют стадии, на которых
а) трансформируют клетку-хозяина одним или несколькими векторами, содержащими молекулы нуклеиновых кислот, которые кодируют димерный полипептид, указанный в настоящем описании,
б) культивируют клетку-хозяина в условиях, обеспечивающих синтез димерного полипептида, и
в) выделяют димерный полипептид из культуры и тем самым получают димерный полипептид.
В одном из вариантов осуществления изобретения стадия выделения, указанная в подпункте в), включает применение специфического «захватывающего» реагента для Fc-области иммуноглобулина. В одном из вариантов осуществления изобретения указанный специфический для Fc-области «захватывающий» реагент применяют в режиме связывания-и-элюции. Примерами указанных специфических для Fc-области «захватывающих» реагентов являются, например, колонки для аффинной хроматографии на основе белка A Staphylococcus, которые основаны на обладающем высокой жесткостью агарозном матриксе, который обеспечивает высокие скорости потоков и низкое обратное давление при крупномасштабном процессе. Они выполняют функцию лиганда, который связывается с димерным полипептидом, т.е. его Fc-областью. Лиганды присоединяют к матриксу через плечо длинного гидрофильного спейсера, что делает их легко доступными для связывания с молекулой-мишенью.
Димерные полипептиды, указанные в настоящем описании, можно отделять от культуральной среды с помощью общепринятых процедур очистки иммуноглобулинов, таких, например, как хроматография на белке А-Сефарозе, гидроксилпаптите, гель-электрофорез, диализ или аффинная хроматография. В-клетки или клетки гибридом могут служить источником ДНК и РНК, кодирующих димерный полипептид. ДНК и РНК, кодирующие моноклональные антитела, легко выделять и секвенировать с использованием общепринятых процедур. После выделения ДНК можно встраивать в экспрессионные векторы, которыми затем трансфектируют клетки-хозяева, такие как HEK 293-клетки, СНО-клетки или клетки миеломы, которые в противном случае не могут продуцировать димерные полипептиды, с получением в результате синтеза рекомбинантных моноклональных димерных полипептидов в клетках-хозяевах.
Очистку антител осуществляют для того, чтобы элиминировать клеточные компоненты или другие загрязнители, например, другие клеточные нуклеиновые кислоты или белки, с использованием стандартных методик, включая обработку щелочью/ДСН, CsCl-бэндинг, хроматографию на колонках, электрофорез в агарозном геле и другие методы, хорошо известные в данной области (см. в Current Protocols in Molecular Biology, под ред. Ausubel F. и др., изд-во Greene Publishing and Wiley Interscience, New York, 1987). Для очистки белков детально разработаны и нашли широкое применение различные методы, такие как аффинная хроматография с использованием белков микроорганизмов (например, аффинная хроматография на белке А или белке G), ионообменная хроматография (например, катионообменная (карбоксиметильные смолы), анионообменная (аминоэтильные смолы) и хроматография на основе обмена смешанного типа), тиофильная адсорбция (например, с бета-меркаптоэтанолом и другими лигандами SH), хроматография гидрофобного взаимодействия или ароматической адсорбции (например, с фенил-сефарозой, аза-аренофильными смолами или м-аминофенилборной кислотой), металл-хелатная аффинная хроматография (например, с Ni(II)- и Cu(II)-аффинным материалом), гель-фильтрация и электрофоретические методы (такие как гель-электрофорез, капиллярный электрофорез) (Vijayalakshmi М.А., Appl. Biochem. Biotech. 75, 1998, cc. 93-102).
Одним из объектов изобретения является фармацевтическая композиция, которая содержит димерный полипептид или антитело, указанный/ указанное в настоящем описании. Другим объектом изобретения является применение димерного полипептида или антитела, указанного в настоящем описании, для приготовления фармацевтической композиции. Следующим объектом изобретения является способ приготовления фармацевтической композиции, которая содержит димерный полипептид или антитело, указанный/ указанное в настоящем описании. Еще одним объектом настоящего изобретения является композиция, например, фармацевтическая композиция, которая содержит димерный полипептид или антитело, указанный/ указанное в настоящем описании, приготовленная в сочетании с фармацевтическим носителем.
Композицию, указанную в настоящем описании, можно вводить с помощью различных методов, известных в данной области. Как должно быть очевидно специалисту в данной области, путь и/или форму введения можно варьировать в зависимости от требуемых результатов. Для введения соединения, предлагаемого в изобретении, с помощью определенных путей введения может оказаться необходимым наносить на соединение покрытие из материала, препятствующего его инактивации, или осуществлять введение соединения совместно с таким материалом. Например, соединение можно вводить индивидууму в соответствующем носителе, например, в липосомах или в разбавителе. К фармацевтически приемлемым разбавителям относятся физиологический раствор и водные забуферивающие растворы. К фармацевтически приемлемым носителям относятся стерильные водные растворы или дисперсии и стерильные порошки для приготовления стерильных инъекционных растворов или дисперсий непосредственно перед введением. Применение таких сред и агентов для обладающих фармацевтической активностью субстанций известно в данной области.
Можно применять целый ряд возможных путей введения, включая (но, не ограничиваясь только ими) внутриглазное применение или местное нанесение. В одном из вариантов осуществления изобретения применение является внутриглазным и включает (но, не ограничиваясь ими) подконъюнктивальную инъекцию, внутричерепную инъекцию, инъекцию в переднюю камеру через темпоральный лимб, интрастромальную инъекцию, инъекцию в роговицу, инъекцию в сетчатку, инъекцию в водянистую влагу глаза, инъекцию в субтеновое пространство глаза или введение с помощью устройства с замедленным высвобождением, интравитреальную инъекцию (например, инъекцию в переднюю, срединную или заднюю область стекловидного тела). В одном из вариантов осуществления изобретения применение является местным и включает (но, не ограничиваясь только ими) нанесение глазных капель на роговицу.
В одном из вариантов осуществления изобретения димерный полипептид, указанный в настоящем описании, или фармацевтическую композицию, указанную в настоящем описании, применяют путем интравитреального введения, например, путем инъекции в стекловидное тело. Это можно осуществлять с помощью стандартных процедур, известных в данной области (см., например, Ritter и др., J. Clin. Invest. 116, 2006, сс. 3266-76; Russelakis-Carneiro и др., Neuropathol. Appl. Neurobiol. 25, 1999, cc. 196-206 и Wray и др., Arch. Neurol. 33, 1976, cc. 183-185).
В некоторых вариантах осуществления изобретения терапевтические наборы, предлагаемые в изобретении, могут содержать одну или несколько доз димерного полипептида, указанного в настоящем описании, в фармацевтической композиции, указанной в настоящем описании, приемлемое устройство для инъекции фармацевтической композиции в стекловидное тело и инструкцию, детализирующую показания для применения индивидуумам и протоколы осуществления инъекции. В этих вариантах осуществления изобретения композиции, как правило, вводят индивидууму, которые нуждаются в лечении, путем инъекции в стекловидное тело. Это можно осуществлять с помощью стандартных процедур, известных в данной области (см., например, Ritter и др., J. Clin. Invest. 116, 2006, сс. 3266-3276; Russelakis-Carneiro и др., Neuropathol. Appl. Neurobiol. 25, 1999, сс. 196-206 и Wray и др., Arch. Neurol. 33, 1976, сс. 183-185).
Композиции могут содержать также адъюванты, такие как консерванты, смачивающие вещества, эмульгаторы и диспергирующие агенты. Отсутствие микроорганизмов можно обеспечивать как с помощью процедур стерилизации (см. выше), так и путем включения различных антибактериальных и противогрибковых средств, таких, например, как парабен, хлорбутанол, фенол, сорбиновая кислота и т.п. Может оказаться целесообразным включать в композиции агенты для придания изотоничности, такие как сахара, хлорид натрия и т.п. Кроме того, можно пролонгировать абсорбцию инъекционной фармацевтической формы путем включения веществ, которые замедляют абсорбцию, таких как моностеарат алюминия и желатин.
Вне зависимости от выбранного пути введения соединения, предлагаемые в настоящем изобретении, которые можно применять в пригодной гидратированной форме, и/или фармацевтические композиции, предлагаемые в настоящем изобретении, приготавливают в виде фармацевтически приемлемых форм лекарственного средства с помощью общепринятых методов, известных специалистам в данной области.
Фактические уровни доз действующих веществ в фармацевтических композициях, предлагаемых в настоящем изобретении, можно варьировать для получения количества действующего вещества, которое является эффективным для достижения требуемого терапевтического ответа у конкретного пациента при использовании конкретной композиции и пути введения, но которое не является токсичным для пациента. Выбранный уровень доз должен зависеть от различных фармакокинетических факторов, включая активность конкретных применяемых композиций, предлагаемых в настоящем изобретении, путь введения, продолжительность введения, скорость экскреции конкретного применяемого соединения, продолжительность лечения, другие лекарственные средства, соединения и/или материалы, которые используют в сочетании с конкретными применяемыми композициями, возраст, пол, вес, состояние, общее состояние здоровья и предшествующая история болезни пациента, подлежащего лечению, и другие подобные факторы, хорошо известные в области медицины.
Композиция должна быть стерильной и текучей в той степени, чтобы композицию можно было вводить с помощью шприца. Помимо воды в одном из предпочтительных вариантов осуществления изобретения носителем является изотонический забуференный физиологический раствор.
Соответствующую текучесть можно поддерживать, например, путем использования покрытия, такого как лецитин, путем поддержания требуемого размера частиц в случае дисперсии и путем применения поверхностно-активных веществ. Во многих случаях предпочтительно включать в композицию агенты для придания изотоничности, например, сахара, многоатомные спирты, такие как маннит или сорбит, и хлорид натрия.
Композиция может представлять собой офтальмическую композицию в форме депо, содержащую действующее вещество для субконъюнктивального введения. Офтальмическая композиция в форме депо содержит микрочастицы практически чистого действующего вещества, например, димерного полипептида, указанного в настоящем описании. Микрочастицы, содержащие димерный полипептид, указанный в настоящем описании, могут быть погружены в биосовместимый фармацевтически приемлемый полимер или липидный капсулирующий агент. Композиции в форме депо можно адаптировать для высвобождения всего или практически всего действующего вещества в течение удлиненного периода времени. Полимерный или липидный матрикс, если он присутствует, может быть адаптирован к расщеплению, достаточному для того, чтобы транспортироваться от места введения после высвобождения всего или практического всего действующего вещества. Композиция в форме депо может представлять собой жидкую композицию, содержащую фармацевтически приемлемый полимер и растворенное или диспергированное действующее вещество. После инъекции полимер образует депо в месте инъекции, например, путем образования геля или осаждения.
Другим объектом изобретения является димерный полипептид или антитело, указанный/указанное в настоящем описании, предназначенный/предназначенное для применения для лечения сосудистых глазных заболеваний.
Одним из вариантов осуществления изобретения является димерный полипептид или антитело, указанный/указанное в настоящем описании, предназначенный/предназначенное для применения для лечения сосудистых глазных заболеваний.
Другим объектом изобретения является фармацевтическая композиция, предназначенная для применения для лечения сосудистых глазных заболеваний.
Другим объектом изобретения является применение димерного полипептида или антитела, указанного в настоящем описании, для приготовления лекарственного средства, предназначенного для лечения сосудистых глазных заболеваний.
Другим объектом изобретения является способ лечения пациента, страдающего сосудистыми глазными заболеваниями, заключающийся в том, что вводят димерный полипептид или антитело, указанный/указанное в настоящем описании, пациенту, который нуждается в таком лечении.
Следует подчеркнуть, что понятие «содержащий» при применении в контексте настоящего описания включает понятие «состоящий из». Таким образом, во всех объектах и вариантах осуществления изобретения, которые включают понятие «содержащий», аналогично можно использовать понятие «состоящий из».
Г. Модификации
В другом объекте изобретения димерный полипептид согласно любому из указанных выше вариантов осуществления изобретения может обладать любыми особенностями, индивидуально или в комбинации, описанными ниже в разделах 1-6:
1. Аффинность антител
В одном из вариантов осуществления изобретения Kd измеряли методом поверхностного плазмонного резонанса с помощью устройства BIACORE®. Например, анализ осуществляли с помощью устройства BIACORE®-2000 или BIACORE®-3000 (фирма GE Healthcare Inc., Пискатавей, шт. Нью-Джерси) при 25°С с использованием антигена, иммобилизованного на СМ5-чипах с уровнем иммобилизации, соответствующим ~10 единицам ответа (RU). В одном из вариантов осуществления изобретения биосенсорные чипы из карбоксиметилированного декстрана (СМ5, фирма GE Healthcare Inc.) активировали с помощью гидрохлорида N-этил-N'-(3-диметиламинопропил)карбодиимида (EDC) и N-гидроксисукцинимида (NHS) согласно инструкциям поставщика. Антиген разводили 10 мМ ацетатом натрия, рН 4,8 до концентрации 5 мкг/мл (~0,2 мкМ) перед инъекцией со скоростью потока 5 мкл/мин для достижения уровня иммобилизации, соответствующего примерно 10 единицам ответа (RU) сшитого белка. После инъекции антигена инъецировали 1М этаноламин для блокады непрореагировавших групп. Для кинетических измерений инъецировали двукратные серийные разведения димерного полипептида, содержащего слиты полипептид или антитело (от 0,78 до 500нМ) в ЗФР, дополненном 0,05% полисорбата 20 (TWEEN-20™) в качестве сурфактанта (ЗФРТ), при 25°С со скоростью потока примерно 25 мкл/мин. Скорость реакции ассоциации (kon) и реакции диссоциации (koff) рассчитывали с использованием простой модели связывания Ленгмюра 1:1 (программа оценки BIACORE®, версия 3.2) путем одновременной аппроксимации сенсограмм ассоциации и диссоциации. Константу равновесия реакции диссоциации (Kd) рассчитывали как соотношение koff/kon (см., например, Chen и др., J Mol Biol 293, 1999, сс. 865-881). Если скорость реакции ассоциации превышала 106 М-1 с-1 при оценке с помощью описанного выше метода поверхностного плазмонного резонанса, то скорость реакции ассоциации можно определять с помощью метода гашения флуоресценции, который позволяет измерять повышение или снижение интенсивности излучения флуоресценции (длина волны возбуждения 295 нм; длина волны испускания 340 нм, полоса пропускания 16 нм) при 25°С применяемого в концентрации 20нМ антитела к антигену (Fab-формат) в ЗФР, рН 7,2, в присутствии возрастающих концентраций антигена, осуществляя измерения с помощью спектрометра, такого как спектрофотометр, снабженный блоком для остановки потока (фирма Aviv Instruments), или спектрофотометр SLM-AMINCO™ серии 8000 (фирма THERmoSpectronic), при перемешивании содержимого кюветы.
2. Химерные и гуманизированные антитела
В некоторых вариантах осуществления изобретения димерный полипептид, представленный в настоящем описании, представляет собой химерное антитело. Некоторые химерные антитела описаны, например, в US 4816567; и у Morrison S.L. и др., Proc. Natl. Acad. Sci. USA 81, 1984, cc. 6851-6855. В одном из примеров химерное антитело содержит нечеловеческую вариабельную область (например, вариабельную область из антитела мышей, крыс, хомяков, кроликов или приматов кроме человека, таких как обезьяны) и человеческую константную область. В другом примере химерное антитело представляет собой антитело «переключенного класса», класс или подкласс которого был изменен относительно родительского антитела. Химерные антитела включают их антигенсвязывающие фрагменты.
В некоторых вариантах осуществления изобретения химерное антитело представляет собой гуманизированное антитело. Как правило, нечеловеческое антитело гуманизируют для снижения иммуногенности для людей, сохраняя при этом специфичность и аффинность родительского нечеловеческого антитела. Как правило, гуманизированное антитело содержит один или несколько вариабельных доменов, в которых HVR, например, CDR (или их участки), выведены из нечеловеческого антитела, a FR (или их участки) выведены из последовательностей человеческого антитела. Гуманизированное антитело необязательно может содержать по меньшей мере часть человеческой константной области. В некоторых вариантах осуществления изобретения некоторые остатки FR в гуманизированном антителе заменены на соответствующие остатки из нечеловеческого антитела (например, антитела, из которого происходят остатки HVR), например, для сохранения или улучшения специфичности или аффинности антитела.
Гуманизированные антитела и методы их создания обобщены, например, у Almagro J.С. и Fransson J., Front. Biosci. 13, 2008, cc. 1619-1633, и описаны также у Riechmann I. и др., Nature 332, 1988, сс. 323-329; Queen С.и др., Proc. Natl. Acad. Sci. USA 86, 1989, cc. 10029-10033; US 5821337, US 7527791, US 6982321 и US 7087409; Kashmiri S.V. и др., Methods 36, 2005, cc. 25-34 (описание трансплантации определяющих специфичность участков (SDR)); Padlan Е.А. Mol. Immunol. 28, 1991, сс. 489-498 описание метода «изменения поверхности); Dall'Acqua W.F. и др., Methods 36, 2005, сс. 43-60 (описание «перестановки FR»); Osbourn J. и др., Methods 36, 2005, сс. 61-68 и Klimka А. и др., Br. J. Cancer 83, 2000, сс. 252-260 (описание подхода «направленной селекции» для перестановки FR).
Человеческие каркасные участки, которые можно применять для гуманизации, включают (но, не ограничиваясь только ими): каркасные участки, выбранные с использованием методов «наилучшего подбора» (см., например, Sims M.J. и др., J. Immunol. 151, 1993, сс. 2296-2308; каркасные участки, выведенные из консенсусной последовательности конкретной подгруппы вариабельных областей легких и тяжелых цепей человеческих антител (см., например, Carter Р. и др., Proc. Natl. Acad. Sci. USA 89, 1992, cc. 4285-4289 и Presta L.G. и др., J. Immunol. 151, 1993, cc. 2623-2632); человеческие зрелые (с соматическими мутациями) каркасные области или каркасные области человеческой зародышевой линии (см., например, Almagro J.С. и Fransson J., Front. Biosci. 13, 2008, с. 1619-1633); и каркасные участки, полученные в результате скрининга FR-библиотек (см., например, Baca М. и др., J. Biol. Chem. 272, 1997, сс. 10678-10684 и Rosok M.J. и др., J. Biol. Chem. 271, 1996, сс. 22611-22618).
3. Человеческие антитела
В некоторых вариантах осуществления изобретения димерный полипептид, указанный в настоящем описании, представляет собой человеческое антитело. Человеческие антитела можно получать, используя различные методики, известные в данной области. Человеческие антитела описаны в целом у van Dijk М.А. и van de Winkel J.G., Curr. Opin. Pharmacol. 5, 2001, cc. 368-374 и Lonberg N., Curr. Opin. Immunol. 20, 2008, cc. 450-459.
Человеческие антитела можно получать путем введения иммуногена трансгенному животному, модифицированному таким образом, чтобы оно продуцировало интактные человеческие антитела или интактные антитела с человеческими вариабельными областями в ответ на контрольное заражение антигеном. Указанные животные, как правило, содержат все или часть локусов человеческого иммуноглобулина вместо эндогенных иммуноглобулиновых локусов, которые либо присутствуют вне хромосом, либо интегрированы произвольно в хромосомы животного. У таких трансгенных мышей эндогенные иммуноглобулиновые локусы, как правило, инактивированы. Обзор методов получения человеческих антител в трансгенных животных см. у Lonberg N., Nat. Biotech. 23, 2005, cc. 1117-1125 (см., например, также в US №6075181 и US №6150584 описание технологии XENOMOUSE™; в US 5770429 описание технологии  ; в US №7041870 описание технологии К-М MOUSE® и в US №2007/0061900 описание технологии
; в US №7041870 описание технологии К-М MOUSE® и в US №2007/0061900 описание технологии  ). Человеческие вариабельные области из интактных антител, полученных с помощью указанных животных, можно дополнительно модифицировать, например, путем объединения с другой человеческой константной областью.
). Человеческие вариабельные области из интактных антител, полученных с помощью указанных животных, можно дополнительно модифицировать, например, путем объединения с другой человеческой константной областью.
Человеческие антитела можно создавать с помощью методов на основе гибридом. Описаны клеточные линии человеческой миеломы и мышиной-человеческой гетеромиеломы, предназначенные для получения человеческих моноклональных антител (см., например, Kozbor D., J. Immunol. 133, 1984, cc. 3001-3005; Brodeur B.R. и др., Monoclonal Antibody Production Techniques and Applications, изд-во Marcel Dekker, Inc., New York, 1987, cc. 51-63 и Boerner P. и др., J. Immunol. 147, 1991, cc. 86-95). Человеческие антитела, созданные с использованием технологии на основе человеческих В-клеточных гибридом, описаны также у Li J. и др., Proc. Natl. Acad. Sci. USA 103, 2006, cc. 3557-3562. Дополнительные методы включают методы, описанные, например, в US 7189826 (описание получения моноклональных человеческих антител типа IgM из клеточных линий гибридом), и у Ni J., Xiandai Mianyixue 26, 2006, cc. 265-268 (описание человеческих-человеческих гибридом). Технология человеческих гибридом (технология Trioma) описана также у Vollmers Н.Р. и Brandlein S., Histology and Histopathology 20, 2005, cc. 927-937 и Vollmers Н.Р. и Brandlein S., Methods and Findings in Experimental and Clinical Pharmacology 27, 2005, cc. 185-191.
Человеческие антитела можно создавать также путем выделения последовательностей вариабельных доменов Fv-клонов, отобранных из происходящих из человеческих антител фаговых дисплейных библиотек. Указанные последовательности затем можно объединять с требуемым человеческим константным доменом. Технологии селекции человеческих антител из библиотек антител описаны ниже.
4. Антитела, полученные из библиотек
В некоторых вариантах осуществления изобретения димерный полипептид, указанный в настоящем описании, представляет собой полученное с использованием библиотеки антитело. Полученные с использованием библиотек антитела можно выделять путем скрининга комбинаторных библиотек антител с требуемой активностью или видами активности. Например, в данной области известны разнообразные методы для создания фаговых дисплейных библиотек и скрининга указанных библиотек в отношении антител, обладающих требуемыми характеристиками связывания. Указанные методы обобщены, например, у Hoogenboom H.R. и др., Methods in Molecular Biology 178, 2001, cc. 1-37, и описаны также, например, у McCafferty J. и др., Nature 348, 1990, сс. 552-554; Clackson Т. и др., Nature 352, 1991, сс. 624-628; Marks J.D. и др., J. Mol. Biol. 222, 1992, сс. 581-597; Marks J.D. и Bradbury A., Methods in Molecular Biology 248, 2003, cc. 161-175; Sidhu S.S. и др., J. Mol. Biol. 338, 2004, cc. 299-310; Lee C.V. и др., J. Mol. Biol. 340, 2004, cc. 1073-1093; Fellouse F.A., Proc. Natl. Acad. Sci. USA 101, 2004, cc. 12467-12472 и Lee C.V. и др., J. Immunol. Methods 284, 2004, cc. 119-132.
При осуществлении некоторых методов фагового дисплея популяции VH- и VL-генов клонируют по отдельности с помощью полимеразной цепной реакции (ПЦР) и рекомбинируют произвольно в фаговых библиотеках, которые затем подвергают скринингу в отношении антигенсвязывающего фага согласно методу, описанному у Winter G. и др., Ann. Rev. Immunol. 12, 1994, сс. 433-455. Фаг, как правило, экспонирует фрагменты антител либо в виде одноцепочечных Fv-фрагментов (scFv), либо в виде Fab-фрагментов. Библиотеки, полученные из иммунизированных источников, включают антитела, обладающие высокой аффинностью к иммуногену, при этом отсутствует необходимость в создании гибридом. Альтернативно этому, можно клонировать необработанную («наивную») популяцию (например, из организма человека), получая один источник антител к широкому спектру чужих, а также своих антигенов без какой-либо иммунизации, что описано у Griffiths A.D. и др., EMBO J, 12, 1993, сс. 725-734. И, наконец, «наивные» библиотеки можно получать также методами синтеза путем клонирования неперегруппированных сегментов V-гена из стволовых клеток и с помощью ПЦР-праймеров, содержащих случайную последовательность, для кодирования гипервариабельных CDR3-участков и для осуществления перегруппировки in vitro согласно методу, описанному у Hoogenboom H.R. и Winter G., J. Mol. Biol. 227, 1992, cc. 381-388. Фаговые библиотеки человеческих антител описаны, например, в следующих патентных публикациях: US 5750373 и US 2005/0079574, US 2005/0119455, US 2005/0266000, US 2007/0117126, US 2007/0160598, US 2007/0237764, US 2007/0292936, и US 2009/0002360.
Антитела или фрагменты антител, выделенные из библиотек человеческих антител, рассматриваются как человеческие антитела или фрагменты человеческих антител.
5. Мультиспецифические антитела
В некоторых вариантах осуществления изобретения димерный полипептид, представленный в настоящем описании, представляет собой мультиспецифическое антитело, например, биспецифическое антитело. Мультиспецифические антитела представляют собой моноклональные антитела, которые имеют специфичности, связывающиеся по меньше мере с двумя различными сайтами. В некоторых вариантах осуществления изобретения одна из специфичностей связывается с первым антигеном, а другая со вторым отличным от первого антигеном. В некоторых вариантах осуществления изобретения биспецифические антитела могут связываться с двумя различными эпитопами одного и того же антигена. Биспецифические антитела можно применять также для локализации цитотоксических агентов в клетках, которые экспрессируют по меньшей мере один из антигенов. Биспецифические антитела можно получать в виде полноразмерных антител или фрагментов антител.
Методики создания мультиспецифических антител включают (но, не ограничиваясь только ими) рекомбинантную совместную экспрессию двух пар тяжелых цепей-легких цепей иммуноглобулинов, обладающих различными специфичностями (см. Milstein С. и Cuello А.С., Nature 305, 1983, сс. 537-540, WO 93/08829 и Traunecker А. и др., EMBO J. 10,1991, сс. 3655-3659), и технологию «knob-in-hole» (см., например, US 5731168). Мультиспецифические антитела можно получать также путем создания регулируемых электростатических воздействий для получения молекул антитела с гетеродимерными Fc (WO 2009/089004); перекрестного связывания двух или большего количества антител или фрагментов (см., например, US 4676980 и Brennan М. и др., Science 229, 1985, сс. 81-83); применения лейциновых молний для получения биспецифических антител (см., например, Kostelny S.A. и др., J. Immunol. 148, 1992, сс. 1547-1553; применения технологии «димерных антител (диабоди)» для создания фрагментов биспецифических антител (см., например, Holliger Р. и др., Proc. Natl. Acad. Sci. USA 90, 1993, cc. 6444-6448); и применения димеров одноцепочечных Fv (sFv) (см., например, Gruber М и др., J. Immunol. 152, 1994, сс. 5368-5374); и получения триспецифических антител согласно методу, описанному, например, у Tutt А. и др., J. Immunol. 147, 1991, сс. 60-69).
Под объем настоящего изобретения подпадают также сконструированные антитела с тремя или большим количеством функциональных антигенсвязывающих сайтов, включая «антитела-осьминоги» (см., например, US 2006/0025576А1).
Антитело или его фрагмент может включать также «Fab двойного действия» или «DAF» (см., например, US 2008/0069820).
Представленные в настоящем описании антитела или фрагменты включают также мультиспецифические антитела, описанные в WO 2009/080251, WO 2009/080252, WO 2009/080253, WO 2009/080254, WO 2010/112193, WO 2010/115589, WO 2010/136172, WO 2010/145792 и WO 2010/145793.
6. Варианты антител
В некоторых вариантах осуществления изобретения димерный полипептид, указанный в настоящем описании, представляет собой антитело. Другой вариант осуществления изобретения относятся к вариантам аминокислотных последовательностей антител, представленных в настоящем описании. Например, может требоваться повышать аффинность связывания и/или другие биологические свойства антитела. Варианты аминокислотной последовательности антитела можно получать путем интродукции соответствующих модификаций в нуклеотидную последовательность, кодирующую антитело, или путем синтеза пептидов Указанные модификации включают, например, делеции и/или инсерции, и/или замены остатков в аминокислотных последовательностях антитела. Для получения конечной конструкции можно использовать любую комбинацию делеций, инсерций и замен, при условии, что конечная конструкция обладает требуемыми характеристиками, например, способностью связываться с антигеном.
а) Полученные путем замены, инсерций и делении варианты
Некоторыми вариантами осуществления изобретения являются варианты антител, которые имеют одну или несколько аминокислотных замен. Сайты, представляющие интерес для замещающего мутагенеза, включают HVR и FR. Консервативные замены представлены ниже в таблице под заголовком «предпочтительные замены». Более общие замены представлены ниже в таблице под заголовком «приведенные в качестве примера замены», и они дополнительно описаны ниже со ссылкой на классы боковых цепей аминокислот.Аминокислотные замены можно интродуцировать в представляющее интерес антитело и продукты подвергать скринингу в отношении требуемой активности, например, сохранения/повышения способности к связыванию антигена, пониженной иммуногенности или повышенной ADCC или CDC.
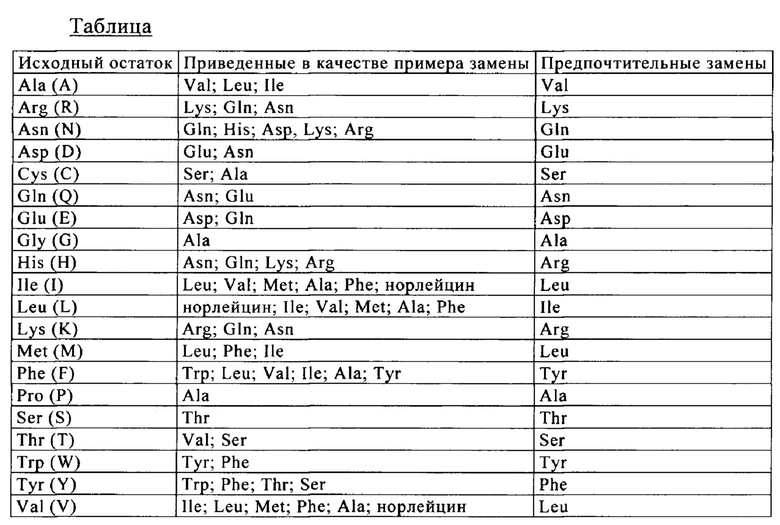
Аминокислоты можно группировать на основе общих свойств боковых цепей следующим образом:
(1) гидрофобные: норлейцин, Met, Ala, Val, Leu, Ile;
(2) нейтральные гидрофильные: Cys, Ser, Thr, Asn, Gln;
(3) кислотные: Asp, Glu;
(4) основные: His, Lys, Arg;
(5) остатки, которые влияют на ориентацию цепи: Gly, Pro;
(6) ароматические: Trp, Tyr, Phe.
Под неконсервативными заменами подразумевают замену представителя одного из указанных классов на представителя из другого класса.
Один тип полученного в результате замены варианта включает замену одного или нескольких остатков гипервариабельного участка родительского антитела (например, гуманизированного или человеческого антитела). Как правило, полученный(ые) в результате вариант(ы), отобранный(ые) для дополнительного исследования, должен(ы) иметь модификации (например, улучшения) некоторых биологических свойств (например, повышенную аффинность, пониженную иммуногенность) относительно родительского антитела, и/или должен(ы) иметь практически сохраненные определенные биологические свойства родительского антитела. Примером полученного в результате замены варианта является антитело с созревшей аффинностью, которое можно создавать, например, с использованием технологий созревания аффинности на основе фагового дисплея, например, указанных в настоящем описании. В целом, метод состоит в следующем: один или несколько остатков HVR подвергают мутации и варианты антител экспонируют на фаге и подвергают скринингу в отношении конкретной биологической активности (например, аффинности связывания).
Изменения (например, замены) можно осуществлять в HVR, например, для повышения аффинности антитела. Указанные изменения можно делать в «горячих (активных) точках» в HVR, т.е. остатках, кодируемых кодонами, которые с высокой частотой подвергаются мутации в процессе соматического созревания (см., например, Chowdhury P.S., Methods Mol. Biol. 207, 2008, cc. 179-196), и/или остатках, которые контактируют с антигеном, с последующим тестированием варианта VH или VL в отношении аффинности связывания. Созревание аффинности путем создания и повторной селекции из вторичных библиотек описано, например, у Hoogenboom H.R. и др., Methods in Molecular Biology 178, 2002, cc. 1-37. В некоторых вариантах осуществления процесса созревания аффинности интродуцируют разнообразие в гены вариабельной области, выбранные для создания мутации, с помощью любого из широкого разнообразия методов (например, ПЦР пониженной точности, перестановка цепи или сайтнаправленный мутагенез с использованием олигонуклеотидов). Затем создают вторичную библиотеку. Затем библиотеку подвергают скринингу для идентификации любых вариантов антител с требуемой аффинностью. Другой метод, применяемый для интродукции разнообразия, включает подходы, мишенью которых является HVR, при которых несколько остатков HVR (например, 4-6 остатков одновременно) рандомизируют. Остатки HVR, участвующие в связывании антигена, можно специфически идентифицировать, например, используя аланин-сканирующий мутагенез или моделирование. Часто мишенями являются прежде всего CDR-H3 и CDR-L3.
В некоторых вариантах осуществления изобретения замены, инсерции или делеции могут затрагивать один или несколько HVR, если указанные изменения не снижают существенно способность антитела связываться с антигеном. Например, в HVR могут быть сделаны консервативные изменения (например, консервативные замены, указанные в настоящем описании), которые не снижают существенно аффинность связывания. Указанные изменения, например, могут находиться вне принимающих участие в контактировании с антигеном остатков HVR. В некоторых вариантах осуществления изобретения в последовательностях вариантов VH и VL, указанных выше, каждый HVR либо является неизмененным, либо содержит не более одной, двух или трех аминокислотных замен.
Ценным методом идентификации остатков или областей антитела, которые можно подвергать мутагенезу, является так называемый «аланин-сканирующий мутагенез», описанный у Cunningham B.C. и Wells J.A., Science 244, 1989, сс. 1081-1085. При осуществлении этого метода остаток или группу остатков-мишеней (например, заряженные остатки, такие как arg, asp, his, lys и glu) идентифицируют и заменяют на нейтральную или отрицательно заряженную аминокислоту (например, аланин или полиаланин) для решения вопроса о том, будет ли это влиять на взаимодействие антитела с антигеном. Дополнительные замены можно интродуцировать в те положения аминокислот, для которых продемонстрирована функциональная чувствительность к начальным заменам. В альтернативном или дополнительном варианте изучают кристаллическую структуру комплекса антиген-антитело для идентификации точек контакта между антителом и антигеном. Указанные контактирующие остатки и соседние остатки можно рассматривать в качестве мишеней или исключать из рассмотрения в качестве кандидатов для замены. Варианты можно подвергать скринингу для решения вопроса о том, обладают ли они требуемыми свойствами.
Инсерции в аминокислотные последовательности включают амино- и/или карбоксиконцевые слияния, варьирующие по длине от одного остатка до полипептидов, содержащих сто или большее количество остатков, а также инсерции одного или нескольких аминокислотных остатков внутрь последовательности. Примером результата осуществления концевых инсерции является антитело с N-концевым метионильным остатком. Другие инсерционные варианты молекул антител включают слияние N- или С-концов антитела с ферментом (например, для ADEPT (антитело-направляемый фермент пролекарственной терапии) или полипептидом, который удлиняет время полужизни антитела в сыворотке.
б) Варианты гликозилирования
В некоторых вариантах осуществления изобретения антитело, предлагаемое в изобретении, изменяют с целью повышения или понижения степени гликозилирования антитела. Добавление или делецию сайтов гликозилирования в антителе можно легко осуществлять путем такого изменения аминокислотной последовательности, которое позволяет создавать или удалять один или несколько сайтов гликозилирования.
Если антитело содержит Fc-область, то можно изменять присоединенный к ней углевод. Нативные антитела, которые продуцируются клетками млекопитающих, как правило, содержат разветвленный биантенный олигосахарид, который, как правило, присоединен с помощью N-связи к Asn297 СН2-домена Fc-области (см., например, Wright А. и Morrison S.L., TIBTECH 15, 1997, сс. 26-32). Олигосахарид может включать различные углеводы, например, маннозу, N-ацетилглюкозамин (GlcNAc), галактозу и сиаловую кислоту, а также фукозу, присоединенную к GlcNAc в «стебле» биантенной олигосахаридной структуры. В некоторых вариантах осуществления изобретения модификации олигосахарида в антителе, предлагаемом в изобретении, можно осуществлять для создания вариантов антитела с определенными улучшенными свойствами.
Одним из вариантов осуществления изобретения являются варианты антитела, имеющие углеводную структуру, в которой снижено содержание фукозы, присоединенной (прямо или косвенно) к Fc-области. Например, содержание фукозы в указанной Fc-области может составлять от 1% до 80%, от 1% до 65%, от 5% до 65% или от 20% до 40%. Содержание фукозы определяют путем расчета среднего содержания фукозы в сахарной цепи на Asn297 относительно суммы всех гликоструктур, присоединенных к Asn 297 (например, комплексных, гибридных структур и структур с высоким содержанием маннозы), которое измеряют с помощью MALDI-TOF-масс-спектрометрии согласно методу, описанному, например, в WO 2008/077546. Asn297 обозначает остаток аспарагина, присутствующий примерно в положении 297 в Fc-области (EU-нумерация остатков Fc-области); однако вследствие минорных вариаций последовательности антитела Asn297 может располагаться также примерно на ±3 аминокислоты в прямом или обратном направлении относительно положения 297, т.е. между положениями 294 и 300. Указанные фукозилированные варианты могут обладать улучшенной ADCC-функцией (см., например, US 2003/0157108; US 2004/0093621). Примерами публикаций, касающихся «дефукозилированных» вариантов антител или вариантов антител «с дефицитом фукозы» являются: US 2003/0157108; WO 2000/61739; WO 2001/29246; US 2003/0115614; US 2002/0164328; US 2004/0093621; US 2004/0132140; US 2004/0110704; US 2004/0110282; US 2004/0109865; WO 2003/085119; WO 2003/084570; WO 2005/035586; WO 2005/035778; WO 2005/053742; WO 2002/031140; Okazaki и др., J. Mol. Biol. 336, 2004, cc. 1239-1249; Yamane-Ohnuki и др., Biotech. Bioeng. 87, 2004, c. 614-622). Примерами клеточных линий, которые обладают способностью продуцировать дефукозилированные антитела, являются Lec13 СНО-клетки с дефицитом белкового фукозилирования (Ripka и др., Arch. Biochem. Biophys. 249, 1986, cc. 533-545; US 2003/0157108 и WO 2004/056312, см., прежде всего, пример 11), и клеточные линии с «выключенным» геном, например, СНО-клетки с «выключенным» геном альфа-1,6-фукозилтрансферазы, FUT8 (см., например, Yamane-Ohnuki и др., Biotech. Bioeng. 87, 2004, с. 614-622); Kanda Y. и др., Biotechnol. Bioeng., 94(4), 2006, cc. 680-688; и WO 2003/085107).
Кроме того, описаны варианты антител с бисекционными олигосахаридами, например, в которых биантенный олигосахарид, присоединенный к Fc-области антитела, бисекционнируется с помощью GlcNAc. Указанные варианты антител могут отличаться пониженным фукозилированием и/или повышенной ADCC-функцией. Примеры указанных вариантов антител описаны, например, в WO 2003/011878; US 6602684 и US 2005/0123546. Предложены также варианты антител по меньшей мере с одним остатком галактозы в олигосахариде, присоединенном к Fc-области. Указанные варианты антител могут обладать повышенной CDC-функцией. Указанные варианты антител описаны, например, в WO 1997/30087; WO 1998/58964 и WO 1999/22764.
в) Варианты Fc-области
Согласно конкретным вариантам осуществления изобретения можно интродуцировать в Fc-область димерного полипептида, указанного в настоящем описании, одну или несколько аминокислотных модификаций, создавая тем самым вариант Fc-области. Вариант Fc-области может содержать последовательность человеческой Fc-области (например, Fc-области человеческого IgG1, IgG2, IgG3 или IgG4), включающую аминокислотную модификацию (например, замену) в одном или нескольких аминокислотных положениях).
Некоторые варианты осуществления изобретения относятся к димерному полипептиду, который обладает некоторыми, но не всеми эффекторными функциями, что делает его перспективным кандидатом для путей применения, для которых является важным время полужизни димерного полипептида in vivo, однако некоторые эффекторные функции (такие как CDC и ADCC) не являются необходимыми или являются вредными. Можно осуществлять анализы цитотоксичности in vitro и/или in vivo для подтверждения снижения/истощения CDC- и/или ADCC-активности. Например, можно осуществлять анализы связывания Fc-рецептора (FcR) для гарантии того, что у димерного полипептида отсутствует способность к связыванию с FcγR (и поэтому, вероятно, отсутствует ADCC-активность), но сохраняется способность связываться с FcRn. Первичные клетки, опосредующие ADCC, т.е. NK-клетки, экспрессируют только FcγRIII, в то время как моноциты экспрессируют FcγRI, FcγRII и FcγRIII. Данные об экспрессии FcR на гематопоэтических клетках обобщены в таблице 3 на с. 464 у Ravetch и Kinet, Annu. Rev. Immunol. 9, 1991, cc. 457-492. Примерами анализов in vitro ADCC-активности представляющей интерес молекулы являются (но, не ограничиваясь только ими) анализы, описанные в US 5500362 (см., например, Hellstrom I. и др., Proc. Natl. Acad. Sci. USA 83, 1986, cc. 7059-7063 и Hellstrom I. и др., Proc. Nat'l Acad. Sci. USA 82, 1985, cc.1499-1502); US 5821337 (см. Bruggemann M. и др., J. Exp. Med. 166, 1987, cc. 1351-1361). В альтернативном варианте можно применять нерадиоактивные методы анализа (см., например, нерадиоактивный анализ цитотоксичности ACTI™ на основе проточной цитометрии (фирма CellTechnology, Inc. Маунтин-Вью, шт. Калифорния); и нерадиоактивный анализ цитотоксичности CytoTox 96® (фирма Promega, Мэдисон, шт. Висконсин). Пригодными для таких анализов эффекторными клетками являются мононуклеарные клетки периферической крови (РВМС) и естественные клетки-киллеры (NK). В альтернативном или дополнительном варианте ADCC-активность представляющей интерес молекулы можно оценивать in vivo, например, на животной модели, например, как описано у Clynes и др., Proc. Natl. Acad. Sci. USA 95, 1998, cc. 652-656. Можно осуществлять также анализы связывания C1q для подтверждения того, что димерный полипептид не может связывать C1q и поэтому у него отсутствует CDC-активность (см., например, описание ELISA для оценки связывания C1q и С3с в WO 2006/029879 и WO 2005/100402). Для оценки активации комплемента можно осуществлять CDC-анализ (см., например, Gazzano-Santoro и др., J. Immunol. Methods 202, 1996, сс. 163-171; Cragg M.S. и др., Blood 101, 2003, сс. 1045-1052; и Cragg M.S. и M.J. Glennie, Blood 103, 2004, cc. 2738-2743). Определение FcRn-связывания и клиренса/времени полужизни in vivo можно осуществлять также с использованием методов, известных в данной области (см., например, Petkova S.B. и др., Int'l. Immunol. 18(12), 2006, сс. 1759-1769).
Димерные полипептиды с пониженной эффекторной функцией включают полипептиды с заменой одного или нескольких следующих остатков Fc-области, таких как 238, 265, 269, 270, 297, 327 и 329 (US 6737056). К указанным мутантам Fc относятся мутанты Fc с заменами в двух или большем количестве из следующих аминокислотных положений: 265, 269, 270, 297 и 327, включая так называемый мутант «DANA» Fc-области, несущий замену остатков 265 и 297 на аланин (US 7332581).
Описаны некоторые варианты антител с повышенной или пониженной способностью связываться с FcR (см., например, US 6737056; WO 2004/056312 и Shields R.L. и др., J. Biol. Chem. 276, 2001, cc. 6591-6604).
Согласно конкретным вариантам осуществления изобретения вариант димерного полипептида содержит Fc-область с одной или несколькими аминокислотными заменами, которые повышают ADCC, например, замены в положениях 298, 333, и/или 334 Fc-области (EU-нумерация остатков).
В некоторых вариантах осуществления изобретения в Fc-области осуществляют изменения, которые приводят к измененной (т.е. либо повышенной, либо пониженной) способности связывать C1q и/или комплементзависимой цитотоксичности (CDC), что описано, например, в US 6194551, WO 99/51642 и у Idusogie и др., J. Immunol. 164, 2000, сс. 4178-4184.
Антитела с удлиненным временем полужизни и повышенной способностью к связыванию с неонатальным Fc-рецептором (FcRn), который ответствен за перенос материнских IgG эмбриону (Guyer и др., J. Immunol. 117, 1976, сс. 587-593 и Kim и др., J. Immunol. 24, 1994, сс. 2429-2434), описаны в US 2005/0014934 А1. Эти антитела содержат Fc-область с одной или несколькими заменами, которые повышают связывание Fc-области с FcRn. Указанные варианты Fc-области включают варианты с заменами одного или нескольких следующих остатков Fc-области: 238, 256, 265, 272, 286, 303, 305, 307, 311, 312, 317, 340, 356, 360, 362, 376, 378, 380, 382, 413, 424 или 434, например, замену остатка 434 в Fc-области (US 7371826).
Дополнительные примеры, касающиеся других вариантов Fc-области, описаны также у Duncan и Winter, Nature 322, 1988, сс. 738-740; в US 5648260; US 5624821 и WO 94/29351.
г) Варианты антител, сконструированные с помощью цистеина
В некоторых вариантах осуществления изобретения может оказаться желательным создавать димерные полипептиды, сконструированные с помощью цистеина, например, аналогично «тиоМАт», в которых один или несколько остатков в антителе заменены на остатки цистеина. В конкретных вариантах осуществления изобретения замененные остатки находятся в доступных сайтах димерного полипептида. Путем замены этих остатков на цистеин реакционноспособные тиольные группы помещаются в доступные сайты димерного полипептида и могут использоваться для конъюгации димерного полипептида с другими фрагментами, такими как фрагменты, представляющие собой лекарственное средство, или фрагменты, представляющие собой линкер, связанный с лекарственным средством, с созданием иммуноконъюгата, указанного ниже в настоящем описании. В некоторых вариантах осуществления изобретения любой(ые) один или несколько следующих остатков может(гут) быть заменен(ы) на цистеин: V205 (нумерация по Кэботу) легкой цепи; А118 (EU-нумерация) тяжелой цепи и S400 (EU-нумерация) Fc-области тяжелой цепи. Антитела, сконструированные с помощью цистеина, можно создавать согласно методу, например, описанному в US 7521541.
д) Производные
В некоторых вариантах осуществления изобретения димерный полипептид, указанный в настоящем описании, можно дополнительно модифицировать таким образом, чтобы он содержал дополнительные небелковые фрагменты, известные в данной области и легко доступные. Фрагменты, пригодные для дериватизации димерного полипептида, включают (но, не ограничиваясь только ими) водорастворимые полимеры. Примерами водорастворимых полимеров являются (но, не ограничиваясь только ими) полиэтиленгликоль (ПЭГ), сополимеры этиленгликоля/пропиленгликоля, карбоксиметилцеллюлоза, декстран, поливиниловый спирт, поливинилпирролидон, поли-1,3-диоксолан, поли-1,3,6-триоксан, сополимер этилена/малеинового ангидрида, полиаминокислоты (либо гомополимеры, либо статистические сополимеры) и декстран- или поли(н-винилпиролидон)полиэтиленгликоль, гомополимеры пропиленгликоля, сополимеры пропиленоксида/этиленоксида, полиоксиэтилированные полиолы (например, глицерин), поливиниловый спирт и их смеси. Полиэтиленгликольпропиональдегид может иметь преимущество при производстве благодаря его стабильности в воде. Полимер может иметь любую молекулярную массу и может быть разветвленным или неразветвленным. Количество полимеров, присоединенных к димерному полипептиду, может варьироваться и, если присоединено более одного полимера, то они могут представлять собой одинаковые или различные молекулы. В целом, количество и/или тип полимеров, применяемых для дериватизации, можно определять с учетом таких особенностей (но, не ограничиваясь только ими), как конкретные свойства или функции димерного полипептида, подлежащие усовершенствованию, предполагается ли применение производного димерного полипептида в терапии в определенных условиях, и т.д.
Другим вариантом осуществления изобретения являются конъюгаты димерного полипептида и небелкового фрагмента, которые можно избирательно нагревать, воздействуя на него излучением. В одном из вариантов осуществления изобретения небелковый фрагмент представляет собой углеродную нанотрубку (Kam и др., Proc. Natl. Acad. Sci. USA 102, 2005, cc. 11600-11605). Излучение может иметь любую длину волны и включает (но, не ограничиваясь только ими) длины волн, которые не повреждают обычные клетки, но которые нагревают небелковый фрагмент до температуры, при которой уничтожаются клетки, ближайшие к конъюгату: димерный полипептид -небелковый фрагмент.
е) Гетеродимеризация
Известно несколько подходов к модификациям в СН3 для усиления гетеродимеризации, которые описаны, например, в WO 96/27011, WO 98/050431, ЕР 1870459, WO 2007/110205, WO 2007/147901, WO 2009/089004, WO 2010/129304, WO 2011/90754, WO 2011/143545, WO 2012058768, WO 2013157954, WO 2013096291. Как правило, при использовании любого из таких подходов первый СН3-домен и второй СН3-домен оба создают комплементарным путем так, чтобы каждый СН3-домен (или содержащая его тяжелая цепь) более не обладал способностью к гомодимеризации сам с собой, но обладал усиленной способностью к гетеродимеризации с комплементарно сконструированным другим СН3-доменом (так, чтобы имела место гетеродимеризация первого и второго СН3-доменов и не образовывались гомодимеры между двумя первыми или двумя вторыми СН3-доменами). Указанные различные подходы улучшения гетеродимеризации тяжелых цепей рассматриваются в качестве различных альтернатив в сочетании с модификациями тяжелой-легкой цепи (замена/обмен VH и VL в одном связывающим плече и интродукция замен заряженных аминокислот на противоположные заряды в поверхности раздела CH1/CL) в мультиспецифических антителах, предлагаемых в изобретении, которые снижают ошибочное спаривание легких цепей побочных продуктов типа белка Бенс-Джонса.
В одном из предпочтительных вариантов осуществления изобретения (в случае мультиспецифического антитела, содержащего СН3-домены в тяжелых цепях) СН3-домены указанного мультиспецифического антитела, предлагаемого в изобретении, можно изменять с использованием технологии «knob-into-holes», которая описана подробно в нескольких примерах, например, в WO 96/027011, у Ridgway J.B. и др., Protein Eng. 9, 1996, сс. 617-621 и у Merchant A.M. и др., Nat. Biotechnol. 16, 1998, сс. 677-681; WO 98/ 050431. При осуществлении этого метода поверхности взаимодействия двух СН3-доменов изменяют с целью повышения гетеродимеризации обеих тяжелых цепей, содержащих два указанных СН3-домена. Каждый из двух СН3-доменов (двух тяжелых цепей) может представлять собой «выступ», а другой представлять собой «впадину». Интродукция дисульфидного мостика дополнительно стабилизирует гетеродимеры (Merchant А.М и др., Nature Biotech 16, 1998, сс. 677-681; Atwell S. и др., J. Mol. Biol. 270, 1997, cc. 26-35) и повышает выход.
Таким образом, в одном из вариантов осуществления изобретения указанное мультиспецифическое антитело (которое содержит СН3-домен в каждой тяжелой цепи) дополнительно отличается тем, что
первый СН3-домен первой тяжелой цепи антитела, указанного в подпункте а), и второй СН3-домен второй тяжелой цепи антитела, указанного в подпункте б), каждый вступает в контакт на поверхности раздела, которая представляет собой исходную поверхность раздела между СН3-доменами антитела,
где указанную поверхность изменяют так, чтобы способствовать образованию мультиспецифического антитела, где изменение отличается тем, что:
I) СН3-домен одной тяжелой цепи изменяют так, что в исходной поверхности раздела СН3-домена одной тяжелой цепи, которая контактирует с исходной поверхностью раздела СН3-домена другой тяжелой цепи в мультиспецифическом антителе, аминокислотный остаток заменяют на аминокислотной остаток, имеющий больший объем боковой цепи, создавая тем самым выпуклость на поверхности раздела СН3-домена одной тяжелой цепи, которая может помещаться в полость в поверхности раздела СН3-домена другой тяжелой цепи,
и
II) СН3-домен другой тяжелой цепи изменяют так, что в исходной поверхности раздела второго СН3-домена, которая контактирует с исходной поверхностью раздела первого СН3-домена в мультиспецифическом антителе, аминокислотный остаток заменяют на аминокислотный остаток, имеющий меньший объем боковой цепи, создавая тем самым полость в поверхности раздела второго СН3-домена, в которую может помещаться выпуклость на поверхности раздела первого СН3-домена.
Предпочтительно аминокислотный остаток, имеющий больший объем боковой цепи, выбирают из группы, состоящей из аргинина (R), фенилаланина (F), тирозина (Y), триптофана (W).
Предпочтительно аминокислотный остаток, имеющий меньший объем боковой цепи, выбирают из группы, состоящей из аланина (А), серина (S), треонина (Т), валина (V).
В одном из объектов изобретения оба СН3-домена дополнительно изменяют путем интродукции аминокислоты цистеина (С) в соответствующие положения каждого СН3-домена, так, чтобы мог образовываться дисульфидный мостик.
В одном из предпочтительных вариантов осуществления изобретения указанное мультиспецифическое антитело содержит аминокислотную мутацию T366W в первом СН3-домене «цепи с выступами» и аминокислотные мутации T366S, L368A, Y407V во втором СН3-домене «цепи с впадиной». Можно применять также дополнительный межцепочечный дисульфидный мостик между СН3-доменами (Merchant А.М и др., Nature Biotech 16, 1998, сс. 677-681), например, путем интродукции аминокислотной мутации Y349C в СН3-домен «цепи с впадиной» и аминокислотной мутации Е356С или аминокислотной мутации S354C в СН3-домен «цепи с выступами».
В одном из предпочтительных вариантов осуществления изобретения указанное мультиспецифическое антитело (которое содержит СН3-домен в каждой тяжелой цепи) содержит аминокислотные мутации S354C, T366W в одном из двух СН3-доменов и аминокислотные мутации Y349C, T366S, L368A, Y407V во втором из двух СН3-доменов (дополнительная аминокислотная мутация Y349C в одном из СН3-доменов и дополнительная аминокислотная мутация Е356С или S354C в другом СН3-домене приводит к образованию межцепочечного дисульфидного мостика) (нумерация во всех случаях согласно Кэботу).
Другие методы СН3-модификаций, направленные на усиление гетеродимеризации, рассматриваются в качестве альтернативных вариантов осуществления изобретения, и они описаны, например, в WO 96/27011, WO 98/050431, ЕР 1870459, WO 2007/110205, WO 2007/147901, WO 2009/089004, WO 2010/129304, WO 2011/90754, WO 2011/143545, WO 2012/058768, WO 2013/157954, WO 2013/096291.
В одном из вариантов осуществления изобретения в качестве альтернативы можно использовать подход к гетеродимеризации, описанный в ЕР 1870459А1. Этот подход базируется на интродукции замен/мутаций заряженных аминокислот на аминокислоты с противоположным зарядом в конкретные аминокислотные положения в поверхности раздела СН3/СН3-доменов между двумя тяжелыми цепями. В одном из предпочтительных вариантов осуществления изобретения в указанном мультиспецифическом антителе присутствуют аминокислотные мутации R409D; K370E в первом СН3-домене (мультиспецифического антитела) и аминокислотные мутации D399K; E357K во втором СН3-домене мультиспецифического антитело (нумерации согласно Кэботу).
В другом варианте осуществления изобретения указанное мультиспецифическое антитело содержит аминокислотную мутацию T366W в СН3-домене «цепи с выступами» и аминокислотные мутации T366S, L368A, Y407V в СН3-домене «цепи с впадиной» и дополнительно аминокислотные мутации R409D; K370E в СН3-домене «цепи с выступами» и аминокислотные мутации D399K; E357K в СН3-домене «цепи с впадиной».
В другом варианте осуществления изобретения указанное мультиспецифическое антитело содержит аминокислотные мутации S354C, T366W в одном из двух СН3-доменов и аминокислотные мутации Y349C, T366S, L368A, Y407V во втором из двух СН3-доменов, или указанное мультиспецифическое антитело содержит аминокислотные мутации Y349C, T366W в одном из двух СН3-доменов и аминокислотные мутации S354C, T366S, L368A, Y407V во втором из двух СН3-доменов и дополнительно аминокислотные мутации R409D; K370E в СН3-домене «цепи с выступами» и аминокислотные мутации D399K; E357K в СН3-домене «цепи с впадиной».
В одном из вариантов осуществления изобретения в качестве альтернативы можно использовать подход к гетеродимеризации, описанный в WO 2013/157953. В одном из вариантов осуществления изобретения первый СН3-домен содержит аминокислотную мутацию T366K, а полипептид второго СН3-домена содержит аминокислотную мутацию L351D. В следующем варианте осуществления изобретения первый СН3-домен содержит дополнительную аминокислотную мутацию L351K. В другом варианте осуществления изобретения второй СН3-домен содержит дополнительную аминокислотную мутацию, выбранную из Y349E, Y349D и L368E (предпочтительно L368E).
В одном из вариантов осуществления изобретения в качестве альтернативы можно использовать подход к гетеродимеризации, описанный в WO 2012/058768. В одном из вариантов осуществления изобретения первый СН3-домен содержит аминокислотные мутации L351Y, Y407A, а второй СН3-домен содержит аминокислотные мутации Т366А, K409F. В следующем варианте осуществления изобретения второй СН3-домен содержит дополнительную аминокислотную мутацию в положении Т411, D399, S400, F405, N390 или К392, например, выбранные из а) T411N, Т411 R, T411Q, Т411К, Т41 ID, Т411Е или T411W, б) D399R, D399W, D399Y или D399K, в) S400E, S400D, S400R или S400K F405I, F405M, F405T, F405S, F405V или F405W N390R, N390K, или N390D K392V, K392M, K392R, K392L, K392F или К392Е. В следующем варианте осуществления изобретения первый СН3-домен содержит аминокислотные мутации L351Y, Y407A, а второй СН3-домен содержит аминокислотные мутации T366V, K409F. В другом варианте осуществления изобретения первый СН3-домен содержит аминокислотную мутацию Y407A, а второй СН3-домен содержит аминокислотные мутации Т366А, K409F. B следующем варианте осуществления изобретения второй СН3-домен содержит дополнительно аминокислотные мутации К392Е, T411E, D399R и S400R.
В одном из вариантов осуществления изобретения в качестве альтернативы можно использовать подход к гетеродимеризации, описанный в WO 2011/143545, например, с использованием аминокислотной модификации в положении, выбранном из группы, состоящей из 368 и 409.
В одном из вариантов осуществления изобретения в качестве альтернативы можно использовать подход к гетеродимеризации, описанный в WO 2011/090762, в котором применяют описанную выше технологию «knobs-into-holes». В одном из вариантов осуществления изобретения первый СН3-домен содержит аминокислотную мутацию T366W, а второй СН3-домен содержит аминокислотную мутацию Y407A. В одном из вариантов осуществления изобретения первый СН3-домен содержит аминокислотную мутацию T366Y, а второй СН3-домен содержит аминокислотную мутацию Y407T.
В одном из вариантов осуществления изобретения мультиспецифическое антитело имеет IgG2-изотоп и в качестве альтернативы можно использовать подход к гетеродимеризации, описанный в WO 2010/129304.
В одном из вариантов осуществления изобретения в качестве альтернативы можно использовать подход к гетеродимеризации, описанный в WO 2009/089004. В одном из вариантов осуществления изобретения первый СН3-домен содержит аминокислотную замену K392 или N392 на отрицательно заряженную аминокислоту (например, глутаминовую кислоту (Е) или аспарагиновую кислоту (D), предпочтительно K392D или N392D), а второй СН3-домен содержит аминокислотную замену D399, Е356, D356 или Е357 на положительно заряженную аминокислоту (например, лизин (К) или аргинин (R), предпочтительно D399K, E356K, D356K или E357K, и более предпочтительно D399K и E356K. В другом варианте осуществления изобретения первый СН3-домен содержит также аминокислотную замену K409 или R409 на отрицательно заряженную аминокислоту (например, глутаминовую кислоту (Е) или аспарагиновую кислоту (D), предпочтительно K409D или R409D). В следующем варианте осуществления изобретения первый СН3-домен в дополнительном или альтернативном варианте содержит аминокислотную замену K439 и/или K370 на отрицательно заряженную аминокислоту (например, глутаминовую кислоту (Е) или аспарагиновую кислоту (D)).
В одном из вариантов осуществления изобретения в качестве альтернативы можно использовать подход к гетеродимеризации, описанный в WO 2007/147901. В одном из вариантов осуществления изобретения первый СН3-домен содержит аминокислотные мутации K253E, D282K и K322D, а второй СН3-домен содержит аминокислотные мутации D239K, Е240К и K292D. В одном из вариантов осуществления изобретения в качестве альтернативы можно использовать подход к гетеродимеризации, описанный в WO 2007/110205.
Д. Методы рекомбинации и композиции
Антитела можно получать, используя методы рекомбинации и композиции, например, описанные в US 4816567. Одним из вариантов осуществления изобретения является выделенная(ые) нуклеиновая(ые) кислота(ы), кодирующая(ие) димерный полипептид, указанный в настоящем описании. Указанная нуклеиновая кислота может кодировать аминокислотную последовательность, содержащую первый полипептид, и/или аминокислотную последовательность, содержащую второй полипептид димерного полипептида. Следующим вариантом осуществления изобретения является(ются) один или несколько векторов (например, экспрессионных векторов), которые содержат указанную нуклеиновую кислоту. Еще одним вариантом осуществления изобретения является клетка-хозяин, которая содержит указанную нуклеиновую кислоту. В одном из указанных вариантов осуществления изобретения клетка-хозяин содержит (например, в результате трансформации указанными векторами): (1) вектор, содержащий нуклеиновую кислоту, которая кодирует аминокислотную последовательность, содержащую первый полипептид димерного полипептида, и аминокислотную последовательность, содержащую второй полипептид димерного полипептида, или (2) первый вектор, содержащий нуклеиновую кислоту, которая кодирует аминокислотную последовательность, содержащую первый полипептид димерного полипептида, и второй вектор, содержащий нуклеиновую кислоту, которая кодирует аминокислотную последовательность, содержащую второй полипептид димерного полипептида. В одном из вариантов осуществления изобретения клетка-хозяин представляет собой эукариотическую клетку, например, клетку яичника китайского хомячка (СНО) или лимфоидную клетку (например, Y0-, NS0-, Sp20-клетку). Одним из вариантов осуществления изобретения является способ получения димерного полипептида, указанного в настоящем описании, заключающийся в том, что культивируют клетку-хозяина, содержащую нуклеиновую кислоту, которая кодирует димерный полипептид, указанный выше, в условиях, пригодных для экспрессии димерного полипептида, и необязательно выделяют антитело из клетки-хозяина (или среды для культивирования клетки-хозяина).
Для рекомбинантного получения димерного полипептида, указанного в настоящем описании, нуклеиновую кислоту, кодирующую димерный полипептид, например, описанный выше, выделяют и встраивают в один или несколько векторов для дальнейшего клонирования и/или экспрессии в клетке-хозяине. Указанную нуклеиновую кислоту легко можно выделять и секвенировать с использованием общепринятых процедур (например, путем использования олигонуклеотидных зондов, которые обладают способностью специфически связываться с генами, кодирующими полипептид варианта Fc-области или тяжелые и легкие цепи антитела).
Приемлемые клетки-хозяева для клонирования или экспрессии кодирующих димерный полипептид векторов включают прокариотические или эукариотические клетки, представленные в настоящем описании. Например, димерные полипептиды можно получать в бактериях, в частности, когда не требуется гликозилирование и связанная с Fc эффекторная функция. Сведения об экспрессии фрагментов антитела и полипептидов в бактериях см. например, в US 5648237, US 5789199 и US 5840523 (см. также у Charlton K.А. в: Methods in Molecular Biology, под ред. Lo В.K.С., изд-во Humana Press, Totowa, NJ, т.248, 2003, cc. 245-254 описание экспрессии фрагментов антител в Е. coli.) После экспрессии димерный полипептид можно выделять из пасты бактериальных клеток в виде растворимой фракции и можно дополнительно очищать.
Помимо прокариотических организмов в качестве хозяев, пригодных для клонирования или экспрессии векторов, которые кодируют димерные полипептиды, можно использовать эукариотические микроорганизмы, такие как нитчатые грибы или дрожжи, включая штаммы грибов и дрожжей, пути гликозилирования которых были «гуманизированы», что позволяет получать димерный полипептид с частично или полностью человеческой схемой гликозилирования (см. Gerngross, Nat. Biotech. 22, 2004, cc. 1409-1414 и Li и др., Nat. Biotech. 24, 2006, cc. 210-215).
Клетки-хозяева, которые можно использовать для экспрессии гликозилированного димерного полипептида, получают также из многоклеточных организмов (беспозвоночных и позвоночных животных). Примерами клеток беспозвоночных являются клетки насекомых, а также можно применять клетки растений. Были выявлены многочисленные штаммы бакуловирусов и соответствующие пригодные для них в качестве хозяев клетки насекомых, прежде всего для трансфекции клеток Spodoptera frugiperda.
В качестве хозяев можно применять также культуры растительных клеток (см., например, US 5959177, 6040498, 6420548, 7125978 и 6417429 (описание технологии PLANTIBODIES™ для получения антител в трансгенных растениях).
В качестве хозяев можно применять также клетки позвоночных. Например, можно использовать клеточные линии млекопитающих, которые адаптированы к росту в суспензии. Другими примерами приемлемых линий клеток-хозяев млекопитающих являются линия клеток почки обезьяны CV1, трансформированная с помощью ОВ40 (COS-7); линия клеток почки эмбриона человека (HEK 293-клетки или клетки линии 293, описанные, например, у Graham и др., J. Gen. Virol., 36, 1977, сс. 59-74); клетки почки детеныша хомяка (ВНК); клетки Сертоли мыши (ТМ4-клетки, описанные, например, у Mather, Biol. Reprod., 23, 1980, сс. 243-251); клетки почки обезьяны (CV1); клетки почки африканской зеленой мартышки (VERO-76,); клетки карциномы шейки матки человека (HELA); клетки почки собаки (MDCK); клетки печени бычьей крысы (BRL 3А); клетки легкого человека (W138); клетки печени человека (Hep G2); клетки опухоли молочной железы мыши (ММТ 060562); клетки TRI, описанные, например, у Mather и др., Annals N.Y. Acad. Sci., 383, 1982, сс. 44-68); клетки MRC 5 и клетки FS4. Другими ценными линиями клеток-хозяев млекопитающих являются клетки яичника китайского хомячка (СНО), включая DHFR-CHO-клетки (Urlaub и др., Proc. Natl. Acad. Sci. USA, 77, 1980, cc. 4216-4220); и клеточные линии миеломы, такие как Y0, NS0 и Sp2/0. Обзор конкретных линий клеток-хозяев млекопитающих, которые можно применять для производства антител, см., например, у Yazaki и Wu, в: Methods in Molecular Biology под ред. В.К.С. Lo, изд-во Humana Press, Totowa, NJ, т.248, 2003, cc. 255-268.
E. Комбинированная терапия
Согласно некоторым вариантам осуществления изобретения димерный полипептид, указанный в настоящем описании, или фармацевтическую композицию, указанную в настоящем описании, применяют индивидуально (без дополнительного терапевтического средства) для лечения одного или нескольких сосудистых глазных заболеваний, указанных в настоящем описании.
В других вариантах осуществления изобретения димерный полипептид, антитело или фармацевтическую композицию, указанные в настоящем описании, применяют в сочетании с одним или несколькими дополнительными терапевтическими средствами или методами для лечения одного или нескольких сосудистых глазных заболеваний, указанных в настоящем описании.
В других вариантах осуществления изобретения димерный полипептид или фармацевтическую композицию, указанный/указанную в настоящем описании, приготавливают в сочетании с одним или несколькими дополнительными терапевтическими средствами и применяют для лечения одного или нескольких сосудистых глазных заболеваний, указанных в настоящем описании.
В некоторых вариантах осуществления изобретения комбинированные терапии, представленные в настоящем описании, предусматривают введение димерного полипептида или фармацевтической композиции, указанного/указанной в настоящем описании, последовательно с одним или несколькими дополнительными терапевтическими средствами для лечения одного или нескольких сосудистых глазных заболеваний, указанных в настоящем описании.
Дополнительные терапевтические средства включают (но, не ограничиваясь только ими) триптофанил-тРНК-синтетазу (TrpRS), EyeOO1 (пэгилированный анти-VEGF аптамер), скваламин, RETAANE™ (анекортава ацетат в виде депо-суспензии; фирма Alcon, Inc.), пролекарство комбретастатина А4 (СА4Р), MACUGEN™, MIFEPREX™ (мифепристон-ru486), субтенон, триамцинолона ацетонид, интравитреальный кристаллический триамцинолона ацетонид, приномастат (AG3340-синтетический ингибитор матричных металлопротеиназ, фирма Pfizer), флуцинолона ацетонид (включая внутриглазной имплантат флуцинолона, фирма Bausch & Lomb/Control Delivery Systems), ингибиторы VEGFR (фирма Sugen), VEGF-Trap (фирма Regeneron/Aventis), ингибиторы тирозинкиназного рецептора VEGF, такие как 4-(4-бром-2-фторанилино)-6-метокси-7-(1-метилпиперидин-4-илметокси)хиназолин (ZD6474), 4-(4-фтор-2-метилиндол-5-илокси)-6-метокси-7-(3-пирролидин-1-илпропокси)хиназолин (AZD2171), ваталаниб (РТК787) и SU 11248 (сунитиниб), линомид и ингибиторы функции интегрина бета-3, и ангиостатин.
Другие фармацевтические терапии, которые можно применять в сочетании с димерным полипептидом или фармацевтической композицией, указанным/указанной в настоящем описании, включают (но, не ограничиваясь только ими), VISUDYNE™, применяемый вместе с нетермическим лазером, РКС 412, эндовион (фирма NeuroSearch A/S), нейротрофические факторы, включая в качестве примера глиальный нейротрофический фактор и цилиарный нейротрофический фактор, диатазем, дорзоламид, фототроп (Phototrop), 9-цис-ретиналь, глазные лекарственные средства (включая эхо-терапию (Echo Therapy), включая фосфолина йодид или эхотиофат, или ингибиторы угольной ангидразы, АЕ-941 (фирма AEterna Laboratories, Inc.), Sirna-027 (фирма Sirna Therapeutics, Inc.), пегаптаниб (фирма NeXstar Pharmaceuticals/Gilead Sciences), нейротрофины (включая только в качестве примера, NT-4/5, фирма Genentech), Cand5 (фирма Acuity Pharmaceuticals), INS-37217 (фирма Inspire Pharmaceuticals), антагонисты интегрина (включая препараты фирм Jerini AG и Abbott Laboratories), EG-3306 (фирма Ark Therapeutics Ltd.), BDM-E (фирма BioDiem Ltd.), талидомид (применяемый, например, фирмой EntreMed, Inc.), кардиотрофин-1 (фирма Genentech), 2-метоксиэстрадиол (фирма Allergan/Oculex), DL-8234 (фирма Toray Industries), NTC-200 (фирма Neurotech), тетратиомолибдат (Мичиганский Университет (University of Michigan)), LYN-002 (фирма Lynkeus Biotech), соединение из микроводорослей (фирма Aquasearch/Albany, Mera Pharmaceuticals), D-9120 (фирма Celltech Group pic), ATX-S10 (Hamamatsu Photonics), TGF-бета 2 (фирма Genzyme/Celtrix), ингибиторы тирозинкиназ (фирмы Allergan, SUGEN, Pfizer), NX-278-L (фирма NeXstar Pharmaceuticals/Gilead Sciences), Opt-24 (фирма OPTIS France SA), нейропротекторы ганглиев клеток сетчатки (фирма Cogent Neurosciences), N-нитропиразольные производные (фирма Texas А&М University System), КР-102 (фирма Krenitsky Pharmaceuticals), циклоспорин А, «ограниченную транслокацию сетчатки», фотодинамическую терапию (PDT) (включая (только в качестве примера) рецепторнаправленную PDT, фирма Bristol-Myers Squibb, Co.; порфимер натрия для инъекции совместно с PDT; вертепорфин, фирма QLT Inc.; ростапорфин, применяемый совместно с PDT, фирма Miravent Medical Technologies; талапорфин натрия применяемый совместно с PDT, фирма Nippon Petroleum; мотексафин лютеция, фирма Pharmacyclics, Inc.), антисмысловые олигонуклеотиды (включая только в качестве примера, продукты, протестированные фирмой Novagali Pharma SA и ISIS-13650, фирма Isis Pharmaceuticals), лазерную фотокоагуляцию, обработку друз лазером, хирургию макулярных разрывов сетчатки, хирургическую транслокацию макулы, имплантируемые миниатюрные телескопы, ангиографию Phi-движения (известную также как микролазерная терапия или ангиография фидерных сосудов), бомбардировку протонным пучком, микростимулирующую терапию, хирургию по поводу отслоения сетчатки и операцию на стекловидном теле, операцию вдавливания сферы, операцию в субмакулярной области, транспупиллярную термотерапию, терапию фотосистемы I, применение РНК-интерференции (PHKi), экстракорпоральный реоферез (известный также как мембранная дифференциальная фильтрация и реотерапия), имплантацию микрочипов, терапию стволовыми клетками, генную заместительную терапию, генную терапию на основе рибозимов (включая генную терапию с использованием элемента ответа на гипоксию, фирмы Oxford Biomedica; Lentipak, Genetix; генная терапия PDEF, фирма GenVec), трансплантацию фоторецепторных/ретинальных клеток (включая трансплантируемые эпителиальные клетки сетчатки, фирма Diacrin, Inc.; трансплантат клеток сетчатки, фирма Cell Genesys, Inc.) и акупунктуру.
Любое антиангиогенное средство можно применять в сочетании с димерным полипептидом или фармацевтической композиций, указанным/указанной в настоящем описании, включая (но, не ограничиваясь только ими) указанные у Carmeliet и Jain, Nature 407, 2000, cc. 249-257. В некоторых вариантах осуществления изобретения антиангиогенное средства представляет собой другой антагонист VEGF или антагонист рецептора VEGF, такой как варианты VEGF, фрагменты растворимого рецептора VEGF, аптамеры, обладающие способностью блокировать VEGF или VEGFR, нейтрализующие антитела к VEGFR, низкомолекулярные ингибиторы тирозинкиназ VEGFR и любые их комбинации, и они включают анти-VEGF аптамеры (например, пегаптаниб), растворимые рекомбинантные рецепторы-ловушки (например, VEGF Trap). В некоторых вариантах осуществления изобретения антиангиогенное средство включает кортикостероиды, ангиостатические стероиды, анекортава ацетат, ангиостатин, эндостатин, малые интерферирующие РНК, снижающие экспрессию VEGFR или лиганда VEGF, средства пост-VEGFR-блокады на основе ингибиторов тирозинкиназ, ингибиторы ММР, IGFBP3, блокаторы SDF-1, PEDF, гамма-секретазу, дельта-подобный лиганд 4, антагонисты интегрина, блокатор HIF-1-альфа, блокатор протеинкиназы СК2 и ингибитор хоминга стволовой клетки (т.е. клетки-предшественника эндотелиальных клеток) к области неоваскуляризации с использованием эндотелиального кадхерина (CD-144) и антител к стромальному фактору (SDF)-I. Можно применять также низкомолекулярные ингибиторы RTK, мишенью которых являются VEGF-рецепторы, включая РТК787. Можно применять также агенты, обладающие активностью в отношении неоваскуляризации, которые не обязательно представляют собой анти-VEGF-соединения, и они включают противовоспалительные лекарственные средства, ингибиторы m-Tor, рапамицин, эверолимус, темсиролимус, циклоспон, анти-TNF-агенты, агенты, мишенью которых является комплемент, и нестероидные противовоспалительные средства. Можно применять также агенты, обладающие нейрозащитным действием, и которые могут потенциально снижать развитие сухой формы дегенерации желтого пятна, например, класс лекарственных средств, называемых «нейростероидами». Они включают такие лекарственные средства, как дегидроэпиандростерон (DHEA) (товарные знаки: Prastera® и Fidelin®), дегидроэпиандростерона сульфат и прегненолона сульфат.Любое предназначенное для лечения AMD (возрастная дегенерация желтого пятна) терапевтическое средство можно применять в сочетании с димерным полипептидом или фармацевтической композицией, указанной /указанным в настоящем описании, включая (но, не ограничиваясь только ими) вертепорфин в сочетании с PDT, пегаптаниб натрия, цинк или антиоксидант(ы), индивидуально или в любой комбинации.
Ж. Фармацевтические композиции
Фармацевтические композиции димерного полипептида, указанного в настоящем описании, получают путем смешения указанного димерного полипептида, имеющего необходимую степень чистоты, с одним или несколькими необязательными фармацевтически приемлемыми носителями (Remington's Pharmaceutical Sciences, под ред. A. Osol, 1980) в форме лиофилизированных композиций или водных растворов. Фармацевтически приемлемые носители, как правило, являются нетоксичными для реципиентов в используемых дозах и концентрациях, они включают (но, не ограничиваясь только ими) буферы, такие как фосфатный, цитратный, ацетатный буферы, а также буферы на основе других органических кислот; антиоксиданты, включая аскорбиновую кислоту и метионин; консерванты (такие как хлорид октадецилдиметилбензиламмония; хлорид гексаметония; хлорид бензалкония; хлорид бензетония; фенол; бутиловый или бензиловый спирт; алкилпарабены, такие как метил- или пропилпарабен; катехол; резорцинол; циклогексанол; 3-пентанол и мета-крезол); полипептиды с низкой молекулярной массой (содержащие менее приблизительно 10 остатков); белки, такие как сывороточный альбумин, желатин или иммуноглобулины; гидрофильные полимеры, такие как поливинилпирролидон; аминокислоты, такие как глицин, глутамин, аспарагин, гистидин, аргинин или лизин; моносахариды, дисахариды и другие углеводы, включая глюкозу, маннозу или декстрины; хелатирующие агенты, такие как ЭДТК; сахара, такие как сахароза, маннит, трегалоза или сорбит; солеобразующие противоионы, такие как натрий; содержащие металл комплексы (например, комплексы Zn-белок); и/или неионогенные поверхностно-активные вещества, такие как полиэтиленгликоль (ПЭГ). В контексте настоящего описания фармацевтически приемлемые носители включают также диспергирующие агенты интерстициальных лекарственных средств, такие как растворимые активные в нейтральной среде гликопротеины гиалуронидаз (sHASEGP), например, человеческие растворимые гликопротеины гиалуронидазы РН-20, такие как rHuPH20 (HYLENEX®, фирма Baxter International, Inc.). Некоторые примеры sHASEGP и методы их применения, в том числе rHuPH20, описаны в US 2005/0260186 и 2006/0104968. Согласно одному из объектов изобретения sHASEGP объединяют с одним или несколькими дополнительными гликозаминогликаназами, такими как хондроитиназы.
Примеры лиофилизированных композиций антител описаны в US 6267958. Водные композиции антител включают композиции, описанные в US 6171586 и WO 2006/044908, последние композиции включают гистидин-ацетатный буфер.
Композиция, представленная в настоящем описании, может содержать также более одного действующего вещества, если это необходимо для конкретного подлежащего лечению показания, предпочтительно соединения с дополнительными видами активности, которые не оказывают вредного воздействия друг на друга. Указанные действующие вещества должны присутствовать в комбинации в количествах, эффективных в отношении поставленной задачи.
Действующие вещества можно включать также в микрокапсулы, например, полученные с помощью методов коацервации или межфазной полимеризации, например в гидроксипропилметилцеллюлозные или желатиновые микрокапсулы и поли(метилметакрилатные) микрокапсулы соответственно, в коллоидные системы введения лекарственного средства (например в липосомы, альбуминовые микросферы, микроэмульсии, наночастицы и нанокапсулы) или в макроэмульсии. Такие методы описаны в Remington's Pharmaceutical Sciences, под ред. A. Osol, 1980.
Можно приготавливать препараты с замедленным высвобождением. Приемлемыми примерами препаратов с замедленным высвобождением являются полупроницаемые матрицы из твердых гидрофобных полимеров, включающие антитело, такие матрицы представляют собой изделия определенной формы, например, пленки или микрокапсулы.
Композиции, предназначенные для применения in vivo, как правило, должны быть стерильными. Это легко можно осуществлять путем фильтрации через стерильные фильтрующие мембраны.
З. Терапевтические способы и композиции
Любой из димерных полипептидов, указанных в настоящем описании, можно применять в терапевтических способах.
В одном из объектов изобретения димерный полипептид, указанный в настоящем описании, предназначен для применения в качестве лекарственного средства. В других объектах изобретения димерный полипептид, указанный в настоящем описании, предназначен для применения для лечения сосудистых глазных заболеваний. В некоторых вариантах осуществления изобретения димерный полипептид, указанный в настоящем описании, предназначен для применения в способе лечения. В некоторых вариантах осуществления изобретения димерный полипептид, указанный в настоящем описании, предназначен для применения в способе лечения индивидуума, имеющего сосудистое глазное заболевание, заключающемся в том, что вводят индивидууму в эффективном количестве димерный полипептид, указанный в настоящем описании. В одном из указанных вариантов осуществления изобретения способ дополнительно заключается в том, что вводят индивидууму в эффективном количестве по меньшей мере одно дополнительное терапевтическое средство, например, указанное выше в разделе Г. В дополнительных вариантах осуществления изобретения димерный полипептид, указанный в настоящем описании, предназначен для ингибирования ангиогенеза в глазу. В некоторых вариантах осуществления изобретения димерный полипептид, указанный в настоящем описании, предназначен для применения в способе ингибирования ангиогенеза у индивидуума, заключающемся в том, что вводят индивидууму в эффективном количестве димерный полипептид для ингибирования ангиогенеза. «Индивидуум» согласно любому из указанных выше вариантов осуществления изобретения предпочтительно представляет собой человека.
Следующим объектом изобретения является применение димерного полипептида, указанного в настоящем описании, для производства или приготовления лекарственного средства. В одном из вариантов осуществления изобретения лекарственное средство предназначено для лечения глазного сосудистого заболевания. В другом варианте осуществления изобретения лекарственное средство предназначено для применения в способе лечения глазного сосудистого заболевания, заключающемся в том, что вводят индивидууму, имеющему глазное сосудистое заболевание, в эффективном количестве лекарственное средство. В одном из указанных вариантов осуществления изобретения способ дополнительно заключается в том, что вводят индивидууму в эффективном количестве по меньшей мере одно дополнительное терапевтическое средство, например, описанное выше. В другом варианте осуществления изобретения лекарственное средство предназначено для ингибирования ангиогенеза. В другом варианте осуществления изобретения лекарственное средство предназначено для применения в способе ингибирования ангиогенеза у индивидуума, заключающемся в том, что вводят индивидууму лекарственное средство в количестве, эффективном для ингибирования ангиогенеза. «Индивидуум» согласно любому из указанных выше вариантов осуществления изобретения может представлять собой человека.
Следующим объектом изобретения является способ лечения сосудистого глазного заболевания. В одном из вариантов осуществления изобретения способ заключается в том, что вводят индивидууму, имеющему указанное сосудистое глазное заболевание, в эффективном количестве димерный полипептид, указанный в настоящем описании. В одном из указанных вариантов осуществления изобретения способ заключается также в том, что вводят индивидууму в эффективном количестве по меньшей мере одно дополнительное терапевтическое средство, указанное ниже. «Индивидуум» согласно любому из указанных выше вариантов осуществления изобретения может представлять собой человека.
Другим объектом изобретения является способ ингибирования ангиогенеза в глазу у индивидуума. В одном из вариантов осуществления изобретения способ заключается в том, что вводят индивидууму в эффективном количестве димерный полипептид, указанный в настоящем описании, для ингибирования ангиогенеза. В одном из вариантов осуществления изобретения «индивидуум» представляет собой человека.
Следующим объектом изобретения являются фармацевтические композиции, содержащие любой из димерных полипептидов, указанных в настоящем описании, например, предназначенные для применения в любом из указанных выше терапевтических способов. В одном из вариантов осуществления изобретения фармацевтическая композиция содержит любой из димерных полипептидов, указанных в настоящем описании, и фармацевтически приемлемый носитель. В другом варианте осуществления изобретения фармацевтическая композиция содержит любой из димерных полипептидов, указанных в настоящем описании, и по меньшей мере одно дополнительное терапевтическое средство.
Димерный полипептид, указанный в настоящем описании, можно применять для лечения либо индивидуально, либо в сочетании с другими средствами. Например, димерный полипептид, указанный в настоящем описании, можно вводить совместно по меньшей мере с одним дополнительным терапевтическим средством.
Димерный полипептид, указанный в настоящем описании (и любое дополнительное лекарственное средство), можно вводить любыми приемлемыми путями, включая парентеральный, внутрилегочный и интраназальный и при необходимости применять для местной обработки, осуществляя введение в повреждение. Парентеральные инфузии включают внутримышечное, внутривенное, внутриартериальное, внутрибрюшинное или подкожное введение. Дозирование можно осуществлять любым приемлемым путем, например, путем инъекций, таких как внутривенные или подкожные инъекции, в зависимости, в том числе, от того, является ли лечение кратковременным или хроническим. Можно применять различные схемы дозирования, включая (но, не ограничиваясь только ими) однократное введение или несколько введений в различные моменты времени, болюсное введение и пульсирующую инфузию.
Димерные полипептиды, указанные в настоящем описании, можно включать в состав композиций, дозировать и вводить в соответствии с надлежащей клинической практикой. Рассматриваемые в этом контексте факторы включают конкретное заболевание, подлежащее лечению, конкретное млекопитающее, подлежащее лечению, клиническое состояние индивидуального пациента, причину заболевания, область введения агента, метод введения, схему введения и другие факторы, известные практикующим медикам. Димерный полипептид можно, но это не является обязательным, включать в композицию в сочетании с одним или несколькими другими агентами, которые в настоящее время применяют для предупреждения рассматриваемого заболевания. Эффективное количество указанных других агентов зависит от количества димерного полипептида, присутствующего в композиции, типа нарушения или лечения и других указанных выше факторов. Их, как правило, применяют в таких же дозах и с использованием таких же путей введения, которые указаны в настоящем описании, или в количестве, составляющем от 1 до 99% от дозы, указанной в настоящем описании, или в любой дозе и с помощью любого пути, который по данным эмпирической/клинической оценки является пригодным.
Для предупреждения или лечения заболевания соответствующая доза димерного полипептида, указанного в настоящем описании (при его применении индивидуально или в сочетании с одним или несколькими другими дополнительными терапевтическими средствами), должна зависеть от типа заболевания, подлежащего лечению, типа димерного полипептида серьезности и течения болезни, применяют ли димерный полипептид, для профилактических или терапевтических целей, предшествующей терапии, истории болезни пациента и ответа на димерный полипептид, а также предписания лечащего врача. Димерный полипептид можно вводить пациенту однократно или в виде серий обработок. В зависимости от типа и серьезности заболевания примерно от 1 мкг/кг до 15 мг/кг (например, 0,5-10 мг/кг) димерного полипептида может представлять собой начальную возможную дозу для введения пациенту, например, с помощью одной или нескольких отдельных обработок или с помощью непрерывной инфузии. Одним из примеров типичных суточных доз может являться доза, составляющая от примерно 1 мкг/кг до 100 мг/кг или более в зависимости от указанных выше факторов. При использовании повторных введений в течение нескольких дней или более длительного периода времени, в зависимости от состояния, лечение, как правило, следует продолжать до достижения подавления симптомов заболевания. Одним из примеров доз димерного полипептида является доза, составляющая от примерно 0,05 до примерно 10 мг/кг. Так, пациенту можно вводить одну или несколько следующих доз: примерно 0,5, 2,0, 4,0 или 10 мг/кг (или любую их комбинацию). Указанные дозы можно вводить дробно, например, каждую неделю или каждые три недели (например, так, чтобы пациент получал от примерно двух до примерно двадцати, например, примерно шесть доз антитела). Можно применять начальную повышенную ударную дозу с последующим введением одной или нескольких более низких доз. С помощью общепринятых методов и анализов можно легко осуществлять мониторинг действия указанной терапии.
III. Изделия
Другим объектом изобретения является изделие, которое содержит продукты, применяемые для лечения, предупреждения и/или диагностирования указанных выше нарушений. Изделие представляет собой контейнер и этикетку или листовку-вкладыш в упаковку, которые размещены на контейнере или вложены в него. Приемлемыми контейнерами являются, например банки, пузырьки, шприцы, пакеты для внутривенного раствора и т.д. Контейнеры можно изготавливать из различных материалов, таких как стекло или пластмасса. Контейнер содержит композицию, которая сама или в сочетании с другой композицией является эффективной для лечения, предупреждения и/или диагностирования состояния, и может иметь стерильный порт доступа (например, контейнер может представлять собой пакет для IV-раствора или пузырек, снабженный пробкой, которую можно прокалывать с помощью иглы для подкожных инъекций). По меньшей мере одно действующее вещество в композиции представляет димерный полипептид, указанный в настоящем описании. На этикетке или листовке-вкладыше в упаковку указано, что композицию применяют для лечения выбранного состояния. Кроме того, изделие может включать (а) первый контейнер с находящейся в нем композицией, где композиция содержит димерный полипептид, указанный в настоящем описании; и (б) второй контейнер с находящейся в нем композицией, где композиция содержит дополнительное цитотоксическое или иное терапевтическое средство. Согласно этому варианту осуществления изобретения изделие может содержать листовку-вкладыш в упаковку, которая содержит информацию о том, что композиции можно использовать для лечения конкретного состояния. В альтернативном или дополнительном варианте изделие может дополнительно включать второй (или третий) контейнер с фармацевтически приемлемым буфером, таким как бактериостатическая вода для инъекций (БСВИ), забуференный фосфатом физиологический раствор, раствор Рингера и раствор декстрозы. Кроме того, оно может включать другие продукты, необходимые с коммерческой точки зрения и с точки зрения потребителя, в частности, другие буферы, разбавители, фильтры, иглы и шприцы.
Как должно быть очевидно, любое из указанных выше изделий может включать иммуноконъюгат, предлагаемый в изобретении, вместо или в дополнение к димерному полипептиду, указанному в настоящем описании.
IV. Конкретные варианты осуществления изобретения
1. Димерный полипептид, содержащий
первый полипептид и второй полипептид, каждый из которых содержит в направлении от N-конца к С-концу по меньшей мере часть шарнирной области иммуноглобулина, которая содержит один или несколько остатков цистеина, СН2-домен иммуноглобулина и СН3-домен иммуноглобулина, в котором
I) первый и второй полипептиды содержат мутации Н310А, Н433А и Y436A или
II) первый и второй полипептиды содержат мутации L251D, L314D и L432D, или
III) первый и второй полипептиды содержат мутации L251S, L314S и L432S, или
IV) первый полипептид содержит мутации I253A, Н310А и Н435А, а второй полипептид содержит мутации Н310А, Н433А и Y436A, или
V) первый полипептид содержит мутации I253A, Н310А и Н435А, а второй полипептид содержит мутации L251D, L314D и L432D, или
VI) первый полипептид содержит мутации I253A, Н310А и Н435А, а второй полипептид содержит мутации L251S, L314S и L432S.
2. Димерный полипептид по п. 1, отличающийся тем, что димерный полипептид не связывается специфически с человеческим FcRn и связывается специфически с белком А стафилококков.
3. Димерный полипептид по одному из п.п. 1-2, отличающийся тем, что димерный полипептид представляет собой гомодимерный полипептид.
4. Димерный полипептид по одному из п.п. 1-2, отличающийся тем, что димерный полипептид представляет собой гетеродимерный полипептид.
5. Димерный полипептид по одному из п.п. 1-4, отличающийся тем, что I) первый полипептид дополнительно содержит мутации Y349C, T366S, L368A и Y407V, а второй полипептид содержит мутации S354C и T366W или II) первый полипептид дополнительно содержит мутации S354C, T366S, L368A и Y407V, а второй полипептид содержит мутации Y349C и T366W.
6. Димерный полипептид по одному из п.п. 1-5, отличающийся тем, что шарнирная область иммуноглобулина, СН2-домен иммуноглобулина и СН3-домен иммуноглобулина относятся к человеческому IgG1-подклассу.
7. Димерный полипептид по одному из п.п. 1-6, отличающийся тем, что первый полипептид и второй полипептид дополнительно содержат мутации L234A и L235A.
8. Димерный полипептид по одному из п.п. 1-5, отличающийся тем, что шарнирная область иммуноглобулина, СН2-домен иммуноглобулина и СН3-домен иммуноглобулина относятся к человеческому IgG2-подклассу, необязательно с мутациями V234A, G237A, P238S, Н268А, V309L, A330S и P331S.
9. Димерный полипептид по одному из п.п. 1-5, отличающийся тем, что шарнирная область иммуноглобулина, СН2-домен иммуноглобулина и СН3-домен иммуноглобулина относятся к человеческому IgG4-подклассу.
10. Димерный полипептид по одному из п.п. 1-5 и 9, отличающийся тем, что первый полипептид и второй полипептид дополнительно содержат мутации S228P и L235E.
11. Димерный полипептид по одному из п.п. 1-10, отличающийся тем, что первый полипептид и второй полипептид дополнительно содержат мутацию P329G.
12. Димерный полипептид по одному из п.п. 1-11, отличающийся тем, что димерный полипептид представляет собой содержащий Fc-область слитый полипептид.
13. Димерный полипептид по одному из п.п. 1-11, отличающийся тем, что димерный полипептид представляет собой (полноразмерное) антитело.
14. Димерный полипептид по одному из п.п. 1-11 и 13, отличающийся тем, что (полноразмерное) антитело представляет собой моноспецифическое антитело.
15. Димерный полипептид по одному из п.п. 1-11 и 13-14, отличающийся тем, что моноспецифическое антитело представляет собой одновалентное моноспецифическое антитело.
16. Димерный полипептид по одному из п.п. 1-11 и 13-15, отличающийся тем, что моноспецифическое антитело представляет собой двухвалентное моноспецифическое антитело.
17. Димерный полипептид по одному 1-11 и 13, отличающийся тем, что (полноразмерное) антитело представляет собой биспецифическое антитело.
18. Димерный полипептид по одному из п.п. 1-11 и 13, и 17, отличающийся тем, что биспецифическое антитело представляет собой двухвалентное биспецифическо антитело.
19. Димерный полипептид по одному из п.п. 1-11 и 13, и 17-18, отличающийся тем, что биспецифическое антитело представляет собой четырехвалентное биспецифическое антитело.
20. Димерный полипептид по одному из п.п. 1-11 и 13, отличающийся тем, что (полноразмерное) антитело представляет собой триспецфическое антитело.
21. Димерный полипептид по одному из п.п. 1-11 и 13-20, отличающийся тем, что триспецифическое антитело представляет собой трехвалентное триспецифическое антитело.
22. Димерный полипептид по одному из п.п. 1-11 и 13, и 20-21, отличающийся тем, триспецифическое антитело представляет собой четырехвалентное триспецифическое антитело.
23. Димерный полипептид, содержащий
первый полипептид и второй полипептид, каждый из которых содержит в направлении от N-конца к С-концу по меньшей мере часть шарнирной области иммуноглобулина, которая содержит один или несколько остатков цистеина, СН2-домен иммуноглобулина и СН3-домен иммуноглобулина,
в котором первый, второй или первый и второй полипептиды содержат мутацию Y436A (нумерация согласно системе нумерации на основе EU-индекса Кэбота).
24. Димерный полипептид по п. 23, отличающийся тем, что первый и второй полипептиды содержат мутацию Y436A.
25. Димерный полипептид по одному из п.п. 23-24, отличающийся тем, что димерный полипептид не связывается специфически с человеческим FcRn и связывается специфически с белком А стафилококков.
26. Димерный полипептид по одному из п.п. 23-25, отличающийся тем, что димерный полипептид представляет собой гомодимерный полипептид.
27. Димерный полипептид по одному из п.п. 23-25, отличающийся тем, что димерный полипептид представляет собой гетеродимерный полипептид.
28. Димерный полипептид по одному из п.п. 23-27, отличающийся тем, что
а) первый полипептид дополнительно содержит мутации Y349C, T366S, L368A и Y407V, а второй полипептид содержит мутации S354C и T366W, или
первый полипептид дополнительно содержит мутации S354C, T366S, 368А и Y407V, а второй полипептид содержит мутации Y349C и T366W, и/или
б) I) первый и второй полипептиды содержат мутации Н310А, Н433А и Y436A или
II) первый и второй полипептиды содержат мутации L251D, L314D и L432D, или
III) первый и второй полипептиды содержат мутации L251S, L314S и L432S, или
IV) первый полипептид содержит мутации I253A, Н310А и Н435А, а второй полипептид содержит мутации Н310А, Н433А и Y436A, или
V) первый полипептид содержит мутации I253A, Н310А и Н435А, а второй полипептид содержит мутации L251D, L314D и L432D, или
VI) первый полипептид содержит мутации I253A, Н310А и Н435А, а второй полипептид содержит мутации L251S, L314S и L432S.
29. Димерный полипептид по одному из п.п. 23-28, отличающийся тем, что шарнирная область иммуноглобулина, СН2-домен иммуноглобулина и СН3-домен иммуноглобулина относятся к человеческому IgG1-подклассу.
30. Димерный полипептид по одному из п.п. 23-29, отличающийся тем, что первый полипептид и второй полипептид дополнительно содержат мутации L234A и L235A.
31. Димерный полипептид по одному из п.п. 23-28, отличающийся тем, что шарнирная область иммуноглобулина, СН2-домен иммуноглобулина и СН3-домен иммуноглобулина относятся к человеческому IgG2-подклассу, необязательно с мутациями V234A, G237A, P238S, Н268А, V309L, A330S и P331S.
32. Димерный полипептид по одному из п.п. 23-28, отличающийся тем, что шарнирная область иммуноглобулина, СН2-домен иммуноглобулина и СН3-домен иммуноглобулина относятся к человеческому IgG4-подклассу.
33. Димерный полипептид по одному из п.п. 23-28 и 32, отличающийся тем, что первый полипептид и второй полипептид дополнительно содержат мутации S228P и L235E.
34. Димерный полипептид по одному из п.п. 23-33, отличающийся тем, что первый полипептид и второй полипептид дополнительно содержат мутацию P329G.
35. Димерный полипептид по одному из п.п. 23-34, отличающийся тем, что димерный полипептид представляет собой содержащую Fc-область слитый полипептид.
36. Димерный полипептид по одному из п.п. 23-34, отличающийся тем, что димерный полипептид представляет собой (полноразмерное) антитело.
37. Димерный полипептид по одному из п.п. 23-34 и 36, отличающийся тем, что (полноразмерное) антитело представляет собой моноспецифическое антитело.
38. Димерный полипептид по одному из п.п. 23-34 и 36-37, отличающийся тем, что моноспецифическое антитело представляет собой одновалентное моноспецифическое антитело.
39. Димерный полипептид по одному из п.п. 23-34 и 36-38, отличающийся тем, что моноспецифическое антитело представляет собой двухвалентное моноспецифическое антитело.
40. Димерный полипептид по одному из п.п. 23-34 и 36, отличающийся тем, что (полноразмерное) антитело представляет собой биспецифическое антитело.
41. Димерный полипептид по одному из п.п. 23-34 и 36, и 40, отличающийся тем, что биспецифическое антитело представляет собой двухвалентное биспецифическое антитело.
42. Димерный полипептид по одному из п.п. 23-34 и 36, и 40-41, отличающийся тем, что биспецифическое антитело представляет собой четырехвалентное биспецифическое антитело.
43. Димерный полипептид по одному из п.п. 23-34 и 36, отличающийся тем, что (полноразмерное) антитело представляет собой триспецифическое антитело.
44. Димерный полипептид по одному из п.п. 23-34 и 36, и 43, отличающийся тем, что триспецифическое антитело представляет собой трехвалентное триспецифическое антитело.
45. Димерный полипептид по одному из п.п. 23-34 и 36, и 43-44, отличающийся тем, что триспецифическое антитело представляет собой четырехвалентное триспецифическое антитело.
46. Димерный полипептид, содержащий
первый полипептид, который содержит в направлении от N-концу к С-концу вариабельный домен первой тяжелой цепи, СН1-домен иммуноглобулина подкласса IgG1, шарнирную область иммуноглобулина подкласса IgG1, СН2-домен иммуноглобулина подкласса IgG1 и СН3-домен иммуноглобулина подкласса IgG1,
второй полипептид, который содержит в направлении от N-концу к С-концу вариабельный домен второй тяжелой цепи, СН1-домен иммуноглобулина подкласса IgG1, шарнирную область иммуноглобулина подкласса IgG1, СН2-домен иммуноглобулина подкласса IgG1 и СН3-домен иммуноглобулина подкласса IgG1,
третий полипептид, который содержит в направлении от N-конца к С-концу вариабельный домен первой легкой цепи и константный домен легкой цепи,
четвертый полипептид, который содержит в направлении от N-конца к С-концу вариабельный домен второй легкой цепи и константный домен легкой цепи,
в котором вариабельный домен первой тяжелой цепи и вариабельный домен первой легкой цепи образуют первый сайт связывания, который специфически связывается с первым антигеном,
в котором вариабельный домен второй тяжелой цепи и вариабельный домен второй легкой цепи образуют второй сайт связывания, который специфически связывается со вторым антигеном,
в котором I) первый полипептид содержит мутации Y349C, T366S, L368A и Y407V, а второй полипептид содержит мутации S354C и T366W или II) первый полипептид содержит мутации S354C, T366S, L368A и Y407V, а второй полипептид содержит мутации Y349C и T366W, и
в котором первый и второй полипептиды дополнительно содержат мутации L234A, L235A и P329G,
в котором
I) первый и второй полипептиды содержат мутации Н310А, Н433А и Y436A или
II) первый и второй полипептиды содержат мутации L251D, L314D и L432D, или
III) первый и второй полипептиды содержат мутации L251S, L314S и L432S, или
IV) первый полипептид содержит мутации I253A, Н310А и Н435А, а второй полипептид содержит мутации Н310А, Н433А и Y436A, или
V) первый полипептид содержит мутации I253A, Н310А и Н435А, а второй полипептид содержит мутации L251D, L314D и L432D, или
VI) первый полипептид содержит мутации I253A, Н310А и Н435А, а второй полипептид содержит мутации L251S, L314S и L432S.
47. Димерный полипептид, содержащий
первый полипептид, который содержит в направлении от N-конца к С-концу вариабельный домен первой тяжелой цепи, константный домен легкой цепи иммуноглобулина, шарнирную область иммуноглобулина подкласса IgG1, СН2-домен иммуноглобулина подкласса IgG1 и СН3-домен иммуноглобулина подкласса IgG1,
второй полипептид, который содержит в направлении от N-конца к С-концу вариабельный домен второй тяжелой цепи, СН1-домен иммуноглобулина подкласса IgG1, шарнирную область иммуноглобулина подкласса IgG1, СН2-домен иммуноглобулина подкласса IgG1 и СН3-домен иммуноглобулина подкласса IgG1,
третий полипептид, который содержит в направлении от N-конца к С-концу вариабельный домен первой легкой цепи и СН1-домен иммуноглобулина подкласса IgG1,
четвертый полипептид, который содержит в направлении от N-конца к С-концу вариабельный второй легкой цепи и константный домен легкой цепи,
в котором вариабельный домен первой тяжелой цепи и вариабельный домен первой легкой цепи образуют первый сайт связывания, который специфически связывается с первым антигеном,
в котором вариабельный домен второй тяжелой цепи и вариабельный домен второй легкой цепи образуют второй сайт связывания, который специфически связывается со вторым антигеном,
в котором I) первый полипептид содержит мутации Y349C, T366S, L368A и Y407V, а второй полипептид содержит мутации S354C и T366W или II) первый полипептид содержит мутации S354C, T366S, L368A и Y407V, а второй полипептид содержит мутации Y349C и T366W, и
в котором первый и второй полипептиды дополнительно содержат мутации L234A, L235A и P329G, и
в котором
I) первый и второй полипептиды содержат мутации Н310А, Н433А и Y436A или
II) первый и второй полипептиды содержат мутации L251D, L314D и L432D, или
III) первый и второй полипептиды содержат мутации L251S, L314S и L432S,или
IV) первый полипептид содержит мутации I253A, Н310А и Н435А, а второй полипептид содержит мутации Н310А, Н433А и Y436A, или
V) первый полипептид содержит мутации I253A, Н310А и Н435А, а второй полипептид содержит мутации L251D, L314D и L432D, или
VI) первый полипептид содержит мутации I253A, Н310А и Н435А, а второй полипептид содержит мутации L251S, L314S и L432S.
48. Димерный полипептид, содержащий
первый полипептид, который содержит в направлении от N-конца к С-концу вариабельный домен первой тяжелой цепи, СН1-домен иммуноглобулина подкласса IgG4, шарнирную область иммуноглобулина подкласса IgG4, CH2-домен иммуноглобулина подкласса IgG4 и СН3-домен иммуноглобулина подкласса IgG4,
второй полипептид, который содержит в направлении от N-конца к С-концу вариабельный домен второй тяжелой цепи, СН1-домен иммуноглобулина подкласса IgG4, шарнирную область иммуноглобулина подкласса IgG4, СН2-домен иммуноглобулина подкласса IgG4 и СН3-домен иммуноглобулина подкласса IgG4,
третий полипептид, который содержит в направлении от N-конца к С-концу вариабельный домен первой легкой цепи и константный домен легкой цепи,
четвертый полипептид, который содержит в направлении от N-конца к С-концу вариабельный домен второй легкой цепи и константный домен легкой цепи,
в котором вариабельный домен первой тяжелой цепи и вариабельный домен первой легкой цепи образуют первый сайт связывания, который специфически связывается с первым антигеном,
в котором вариабельный домен второй тяжелой цепи и вариабельный домен второй легкой цепи образуют второй сайт связывания, который специфически связывается со вторым антигеном,
в котором I) первый полипептид содержит мутации Y349C, T366S, L368A и Y407V, а второй полипептид содержит мутации S354C и T366W или II) первый полипептид содержит мутации S354C, T366S, L368A и Y407V, а второй полипептид содержит мутации Y349C и T366W, и
в котором первый и второй полипептиды дополнительно содержат мутации L234A, L235A и P329G, и
в котором
I) первый и второй полипептиды содержат мутации Н310А, Н433А и Y436A или
II) первый и второй полипептиды содержат мутации L251D, L314D и L432D, или
III) первый и второй полипептиды содержат мутации L251S, L314S и L432S, или
IV) первый полипептид содержит мутации I253A, Н310А и Н435А, а второй полипептид содержит мутации Н310А, Н433А и Y436A, или
V) первый полипептид содержит мутации I253A, Н310А и Н435А, а второй полипептид содержит мутации L251D, L314D и L432D, или
VI) первый полипептид содержит мутации I253A, Н310А и Н435А, а второй полипептид содержит мутации L251S, L314S и L432S.
49. Димерный полипептид, содержащий
первый полипептид, который содержит в направлении от N-конца к С-концу вариабельный домен первой тяжелой цепи, константный домен легкой цепи иммуноглобулина подкласса IgG4, шарнирную область иммуноглобулина подкласса IgG4, СН2-домен иммуноглобулина подкласса IgG4 и СН3-домен иммуноглобулина подкласса IgG4,
второй полипептид, который содержит в направлении от N-конца к С-концу вариабельный домен второй тяжелой цепи, СН1-домен иммуноглобулина подкласса IgG4, шарнирную область иммуноглобулина подкласса IgG4, СН2-домен иммуноглобулина подкласса IgG4 и СН3-домен иммуноглобулина подкласса IgG4,
третий полипептид, который содержит в направлении от N-конца к С-концу вариабельный домен первой легкой цепи и СН1 -домен иммуноглобулина подкласса IgG4,
четвертый полипептид, который содержит в направлении от N-конца к С-концу вариабельный домен второй легкой и константный домен легкой цепи,
в котором вариабельный домен первой тяжелой цепи и вариабельный домен первой легкой цепи образуют первый сайт связывания, который специфически связывается с первым антигеном,
в котором вариабельный домен второй тяжелой цепи и вариабельный домен второй легкой цепи образуют второй сайт связывания, который специфически связывается со вторым антигеном,
в котором I) первый полипептид содержит мутации Y349C, T366S, L368A и Y407V, а второй полипептид содержит мутации S354C и T366W или II) первый полипептид содержит мутации S354C, T366S, L368A и Y407V, а второй полипептид содержит мутации Y349C и T366W, и
в котором первый и второй полипептиды дополнительно содержат мутации L234A, L235A и P329G, и
в котором
I) первый и второй полипептиды содержат мутации Н310А, Н433А и Y436A или
II) первый и второй полипептиды содержат мутации L251D, L314D и L432D, или
III) первый и второй полипептиды содержат мутации L251S, L314S и L432S, или
IV) первый полипептид содержит мутации I253A, Н310А и Н435А, а второй полипептид содержит мутации Н310А, Н433А и Y436A, или
V) первый полипептид содержит мутации I253A, Н310А и Н435А, а второй полипептид содержит мутации L251D, L314D и L432D, или
VI) первый полипептид содержит мутации I253A, Н310А и Н435А, а второй полипептид содержит мутации L251S, L314S и L432S.
50. Димерный полипептид, содержащий
первый полипептид, который содержит в направлении от N-конца к С-концу вариабельный домен первой тяжелой цепи, СН1-домен иммуноглобулина подкласса IgG1, шарнирную область иммуноглобулина подкласса IgG1, СН2-домен иммуноглобулина подкласса IgG1, СН3-домен иммуноглобулина подкласса IgG1, пептидный линкер и первый scFv,
второй полипептид, который содержит в направлении от N-конца к С-концу вариабельный домен второй тяжелой цепи, СН1-домен иммуноглобулина подкласса IgG1, шарнирную область иммуноглобулина подкласса IgG1, СН2-домен иммуноглобулина подкласса IgG1, СН3-домен иммуноглобулина подкласса IgG1, пептидный линкер и второй scFv,
третий полипептид, который содержит в направлении от N-конца к С-концу вариабельный домен первой легкой цепи и константный домен легкой цепи,
четвертый полипептид, который содержит в направлении от N-конца к С-концу вариабельный домен второй легкой цепи и константный домен легкой цепи,
в котором вариабельный домен первой тяжелой цепи и вариабельный домен первой легкой цепи образуют первый сайт связывания, который специфически связывается с первым антигеном, вариабельный домен второй тяжелой цепи и вариабельный домен второй легкой цепи образуют второй сайт связывания, который специфически связывается с первым антигеном, первый и второй scFv специфически связываются со вторым антигеном,
в котором I) первый полипептид содержит мутации Y349C, T366S, L368A и Y407V, а второй полипептид содержит мутации S354C и T366W или И) первый полипептид содержит мутации S354C, T366S, L368A и Y407V, а второй полипептид содержит мутации Y349C и T366W, и
в котором первый и второй полипептиды дополнительно содержат мутации L234A, L235A и P329G, и
в котором
I) первый и второй полипептиды содержат мутации Н310А, Н433А и Y436A или
II) первый и второй полипептиды содержат мутации L251D, L314D и L432D, или
III) первый и второй полипептиды содержат мутации L251S, L314S и L432S, или
IV) первый полипептид содержит мутации I253A, Н310А и Н435А, а второй полипептид содержит мутации Н310А, Н433А и Y436A, или
V) первый полипептид содержит мутации I253A, Н310А и Н435А, а второй полипептид содержит мутации L251D, L314D и L432D, или
VI) первый полипептид содержит мутации I253A. Н310А и Н435А, а второй полипептид содержит мутации L251S, L314S и L432S.
51. Димерный полипептид, содержащий
первый полипептид, который содержит в направлении от N-конца к С-концу вариабельный домен первой тяжелой цепи, константный домен легкой цепи иммуноглобулина, шарнирную область иммуноглобулина подкласса IgG1, СН2-домен иммуноглобулина подкласса IgG1, СН3-домен иммуноглобулина подкласса IgG1, пептидный линкер и первый scFv,
второй полипептид, который содержит в направлении от N-конца к С-концу вариабельный домен второй тяжелой цепи, СН1-домен иммуноглобулина подкласса IgG1, шарнирную область иммуноглобулина подкласса IgG1, СН2-домен иммуноглобулина подкласса IgG1, СН3-домен иммуноглобулина подкласса IgG1, пептидный линкер и второй scFv,
третий полипептид, который содержит в направлении от N-конца к С-концу вариабельный домен первой легкой цепи и СН1-домен иммуноглобулина подкласса IgG1,
четвертый полипептид, который содержит в направлении от N-конца к С-концу вариабельный домен второй легкой цепи и константный домен легкой цепи,
в котором вариабельный домен первой тяжелой цепи и вариабельный домен первой легкой цепи образуют первый сайт связывания, который специфически связывается с первым антигеном, вариабельный домен второй тяжелой цепи и вариабельный домен второй легкой цепи образуют второй сайт связывания, который специфически связывается с первым антигеном, первый и второй scFv специфически связываются со вторым антигеном,
в котором I) первый полипептид содержит мутации Y349C, T366S, L368A и Y407V, а второй полипептид содержит мутации S354C и T366W или II) первый полипептид содержит мутации S354C, T366S, L368A и Y407V, а второй полипептид содержит мутации Y349C и T366W, и
в котором первый и второй полипептиды дополнительно содержат мутации L234A, L235A и P329G, и
в котором
I) первый и второй полипептиды содержат мутации Н310А, Н433А и Y436A или
II) первый и второй полипептиды содержат мутации L251D, L314D и L432D, или
III) первый и второй полипептиды содержат мутации L251S, L314S и L432S, или
IV) первый полипептид содержит мутации I253A, Н310А и Н435А, а второй полипептид содержит мутации Н310А, Н433А и Y436A, или
V) первый полипептид содержит мутации I253A, Н310А и Н435А, а второй полипептид содержит мутации L251D, L314D и L432D, или
VI) первый полипептид содержит мутации I253A, Н310А и Н435А, а второй полипептид содержит мутации L251S, L314S и L432S.
52. Способ получения димерного полипептида по одному из п.п. 1-51, заключающийся в том, что осуществляют следующие стадии, на которых:
а) культивируют клетку млекопитающего, которая содержит одну или несколько нуклеиновых кислот, кодирующих димерный полипептид по одному из п.п. 1-51,
в) выделяют димерный полипептид из среды для культивирования и
в) очищают димерный полипептид с помощью аффинной хроматографии на белке А.
53. Применение мутации Y436A для повышения способности связываться димерного полипептида с белком А.
54. Применение мутаций Н310А, Н433А и Y436A для отделения гетеродимерных полипептидов от гомодимерных полипептидов.
55. Применение мутаций L251D, L314D, L432D или мутаций L251S, L314S, L432S для отделения гетеродимерных полипептидов от гомодимерных полипептидов.
56. Применение мутаций I253A, Н310А и Н435А в первом полипептиде в комбинации с мутациями Н310А, Н433А и Y436A во втором полипептиде для отделения гетеродимерных полипептидов, содержащих первый и второй полипептиды, от гомодимерных полипептидов.
57. Применение мутаций I253A, Н310А и Н435А в первом полипептиде в комбинации с мутациями L251D, L314D, L432D или мутациями L251S, L314S, L432S во втором полипептид для отделения гетеродимерных полипептидов, содержащих первый и второй полипептиды, от гомодимерных полипептидов.
58. Применение по одному из п.п. 53-57, отличающееся тем, что I) первый полипептид дополнительно содержит мутации Y349C, T366S, L368A и Y407V, а второй полипептид дополнительно содержит мутации S354C и T366W, или II) первый полипептид содержит мутации S354C, T366S, L368A и Y407V, а второй полипептид содержит мутации Y349C и T366W.
59. Способ лечения пациента, страдающего сосудистыми глазными заболеваниями, заключающийся в том, что вводят пациенту, который нуждается в таком лечении, димерный полипептид по одному из п.п. 1-51.
60. Димерный полипептид по одному из п.п. 1-51, предназначенный для интравитреального применения.
61. Димерный полипептид по одному из п.п. 1-51, предназначенный для лечения сосудистых глазных заболеваний.
62. Фармацевтическая композиция, содержащая димерный полипептид по одному из п.п. 1-51 и необязательно фармацевтически приемлемый носитель.
63. Применение димерного полипептида по одному из п.п. 1-51 для транспортирования растворимого лиганда рецептора из глаза через гемато-окулярный барьер в кровоток.
64. Применение димерного полипептида по одному из п.п. 1-51 для удаления одного или нескольких растворимых лигандов рецептора из глаза.
65. Применение димерного полипептида по одному из п.п. 1-51 для лечения глазных заболеваний, прежде всего сосудистых глазных заболеваний.
66. Применение димерного полипептида по одному из п.п. 1-51 для транспортирования одного или нескольких растворимых лигандов рецептора из интравитреального пространства в кровоток.
67. Димерный полипептид по одному из п.п. 1-51, предназначенный для применения для лечения глазного заболевания.
68. Димерный полипептид по одному из п.п. 1-51, предназначенный для транспортирования растворимого лиганда рецептора из глаза через гемато-окулярный барьер в кровоток.
69. Димерный полипептид по одному из п.п. 1-51, предназначенный для применения для удаления одного или нескольких растворимых лигандов рецептора из глаза.
70. Димерный полипептид по одному из п.п. 1-51, предназначенный для применения для лечения глазных заболеваний, прежде всего сосудистых глазных заболеваний.
71. Димерный полипептид по одному из п.п. 1-51, предназначенный для применения для транспортирования одного или нескольких растворимых лигандов рецептора из интравитреального пространства в кровоток.
72. Способ лечения индивидуума, который имеет глазное заболевание, заключающийся в том, вводят индивидууму в эффективном количестве димерный полипептид по одному из п.п. 1-51.
73. Способ транспортирования растворимого лиганда рецептора из глаза через гемато-окулярный барьер в кровоток, заключающийся в том, вводят индивидууму в эффективном количестве димерный полипептид по одному из п.п. 1-51, для транспортирования растворимого лиганда рецептора из глаза через гемато-окулярный барьер в кровоток.
74. Способ удаления одного или нескольких растворимых лигандов рецептора из глаза индивидуума, заключающийся в том, вводят индивидууму в эффективном количестве димерный полипептид по одному из п.п. 1-51 для удаления одного или нескольких растворимых лигандов рецептора из глаза.
75. Способ транспортирования одного или нескольких растворимых лигандов рецептора из интравитреального пространства в кровоток индивидуума, заключающийся в том, вводят индивидууму в эффективном количестве димерный полипептид по одному из п.п. 1-51 для транспортирования одного или нескольких растворимых лигандов рецептора из интравитреального пространства в кровоток.
76. Способ транспортирования растворимого лиганда рецептора из интравитреального пространства или глаза через гемато-окулярный барьер в кровоток индивидуума, заключающийся в том, вводят индивидууму в эффективном количестве димерный полипептид по одному из п.п. 1-51 для транспортирования растворимого лиганда рецептора из глаза через гемато-окулярный барьер в кровоток.
V. Примеры
Ниже представлены примеры способов и композиций, предлагаемых в изобретении. Следует понимать, что с учетом представленного выше общего описания для практического воплощения можно использовать различные другие варианты осуществления изобретения.
Хотя выше описаны некоторые детали изобретения, приведенные с целью иллюстрации и примера для простоты понимания, описание и примеры не должны рассматриваться как ограничивающие объем изобретения. Описание всей патентной и научной литературы, представленной в настоящем описании, специально полностью включено в настоящее описание в качестве ссылки.
Методы
Масс-спектрометрия с ионизацией электроспреем (ESI-MC)
Аликвоты белка (50 мкг) дегликозилировали, добавляя 0,5 мкл N-гликаназы плюс (фирма Roche) и натрий-фосфатный буфер (0,1М, рН 7,1), с получением конечного объема образца 115 мкл. Смесь инкубировали при 37°С в течение 18 ч. Затем для восстановления и денатурации добавляли 60 мкл 0,5М ТСЕР (фирма Pierce) в 4М гуанидине × HCl (фирма Pierce) и 50 мкл 8М гуанидина × HCl. Смесь инкубировали при 37°С в течение 30 мин. Образцы обессоливали с помощью гель-фильтрации (Сефароза G-25, изократический режим, 40% ацетонитрила с 2% муравьиной кислоты). ESI-масс-спектры (+ve) определяли с помощью устройства Q-TOF (maXis, фирма Bruker), снабженным источником нано-ESI (TriVersa NanoMate, фирма Advion). Устанавливали следующие параметры для МС: перенос: ионная воронка RF, 400 Vpp; ISCID энергия, 0 эВ; мультипольный анализатор RF, 400 Vpp; квадрупольный анализатор: энергия ионов, 4,0 эВ; нижний предел массы, 600 m/z; источник: сухой газ, 8 л/мин; температура сухого газа, 160°С; ячейка столкновения: энергия столкновения, 10 эВ; столкновение RF: 2000 Vpp; ячейка охлаждения ионов: ячейка охлаждения ионов RF, 300 Vpp; время переноса: 120 мкс; выдерживание перед импульсом, 10 мкс; диапазон сканирования m/z от 600 до 2000. Оценку данных осуществляли с помощью созданной в лаборатории заявителей программы (MassAnalyzer).
Анализ (связывания с) FcRn методом поверхностного плазмонного резонанса (SPR)
Особенности связывания с FcRn антител дикого типа и мутантных оценивали с помощью технологии поверхностного плазмонного резонанса (SPR) с использованием устройства BIAcore Т100 (фирма BIAcore АВ, Уппсала, Швеция). Эта система создана для изучения молекулярных взаимодействий. Она позволяет осуществлять непрерывный мониторинг в реальном времени связывания лиганд/аналит и таким образом определять кинетические параметры в различных режимах анализа. SPR-технология основывается на измерении показателя преломления близи поверхности покрытого золотом биосенсорного чипа. Изменения коэффициента преломления свидетельствуют об изменениях массы на поверхности, вызываемых взаимодействием иммобилизованного лиганда с аналитом, инъецируемым в растворе. Масса возрастает, если молекулы связываются с иммобилизованными лигандами на поверхности, и наоборот масса снижается в случае диссоциации аналита. При осуществлении предлагаемого в изобретении анализа FcRn-рецептор иммобилизовали на биосенсорном СМ5-чипе BIAcore (фирма GE Healthcare Bioscience, Уппсала, Швеция) путем аминного сочетания до достижения уровня иммобилизации, соответствующего 400 единицам ответа (RU). Анализ осуществляли при комнатной температуре с использованием ЗФР, 0,05% Tween-20™ рН 6,0 (фирма GE Healthcare Bioscience) в качестве подвижного буфера и буфера для разведения. Образцы антитела (200нМ) инъецировали со скоростью потока 50 мкл/мин при комнатной температуре. Продолжительность ассоциации составляла 180 с, фаза диссоциации занимала 360 с. Для достижения регенерации поверхности чипа применяли кратковременную инъекцию HBS-P, рН 8,0. Оценку полученных с помощью SPR данных осуществляли путем сравнения высоты сигнала биологического ответа через 180 с после инъекции и через 300 с после инъекции. Соответствующие параметры представляли собой уровень RUmax (180 с после инъекции) и позднюю стабильность (300 с после окончания инъекции).
Анализ (связывания) белка А методом поверхностного плазмонного резонанса (SPR)
Анализ основан на спектроскопии поверхностного плазмонного резонанса. Белок А иммобилизовали на поверхности SPR-биосенсора. При инъекции образца в проточные ячейки SPR-спектрометра он образует комплекс с иммобилизованным белком А, что приводит к увеличению массы на поверхности сенсорного чипа и, как следствие, к более высокому уровню ответа (в виде 1 единицы RU, определение при 1 пг/мм2). Затем сенсорный чип регенерировали с помощью растворения комплекса образец-белок А. Полученные ответы затем анализировали в отношении высоты сигнала в виде единиц ответа (RU) и характеристик диссоциации.
Белок А (20 мкг/мл) сшивали с СМ5-чипом (фирма GE Healthcare) с уровнем связывания, соответствующим примерно 3500 единицам ответа (RU), при рН 4,0, используя набор для аминного сочетания фирмы GE Healthcare.
Буфер для образца и для системы представлял собой HBS-P+ (0,01М HEPES, 0,15М NaCl, 0,005% сурфактанта Р20, стерилизованный фильтрацией, рН 7,4). Температуру проточной ячейки устанавливали на 25°С и температуру ячейки для образца на 12°С. Систему примировали подвижным буфером. Затем инъецировали 5нМ растворы конструкций образцов в течение 120 с со скоростью потока 30 мкл/мин, с последующей 300-секундной фазой диссоциации. Затем поверхность сенсорного чипа регенерировали с помощью двух инъекций продолжительностью 30 с глицин × HCl, рН 1,5 со скоростью потока 30 мкл/мин. Каждый образец оценивали в трех повторностях. Биспецифические антитела и соответствующие им последовательности
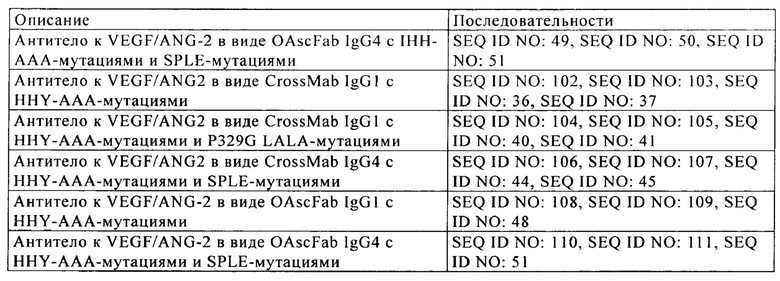
Понятие «с мутацией IHH-ААА» в контексте настоящего описания относится к комбинации мутаций I253A (Ile253Ala), Н310А (His310Ala) и Н435А (His435Ala) в константной области тяжелой цепи IgG1 - или IgG4-подкласса (нумерация согласно EU-индексу Кэбота), понятие «с мутацией HHY-ААА» в контексте настоящего описания относится к комбинации мутаций Н310А (His310Ala), Н433А (His433Ala) и Y436A (Tyr436Ala) в константной области тяжелой цепи IgG1 - или IgG4-подкласса (нумерация согласно системе нумерации на основе EU-индекса Кэбота, понятие «с мутацией P329G LALA» в контексте настоящего описания относится к комбинации мутаций L234A (Leu234Ala), L235A (Leu235Ala) и P329G (Pro329Gly) в константной области тяжелой цепи IgG1-подкласса (нумерация согласно системе нумерации на основе EU-индекса Кэбота), понятие «с мутацией SPLE» в контексте настоящего описания относится к комбинации мутаций S228P (Ser228Pro) и L235E (Leu235Glu) в константной области тяжелой цепи IgG4-подкласса (нумерация согласно системе нумерации на основе EU-индекса Кэбота).


Общие сведения
Общая информация, касающаяся нуклеотидных последовательностей легких и тяжелых цепей человеческого иммуноглобулина, представлена у Kabat Е.А. и др., Sequences of Proteins of Immunological Interest, 5-ое изд., изд-во Public Health Service, National Institutes of Health, Bethesda, MD, 1991. Аминокислотные остатки цепей антитела пронумерованы и обозначены согласно EU-нумерации (Edelman G.M. и др., Proc. Natl. Acad. Sci. USA 63, 1969, cc. 78-85; Kabat Е.А. и др., Sequences of Proteins of Immunological Interest, 5-ое изд., изд-во Public Health Service, National Institutes of Health, Bethesda, MD, 1991.
Методы рекомбинантной ДНК
Для манипуляций с ДНК применяли стандартные методы, описанные у Sambrook J. и др., Molecular Cloning: A laboratory manual; изд-во Cold Spring Harbor Laboratory Press, Cold Spring Harbor, New York, 1989. Все применяемые в молекулярной биологии реагенты применяли согласно инструкциям производителей.
Синтез генов
Требуемые сегменты генов заказывали в соответствии с представленными спецификациями на фирме Geneart (Регенсбург, Германия).
Определение последовательности ДНК
Последовательности ДНК определяли путем секвенирования двух цепей, которое осуществляли на фирме MediGenomix GmbH (Мартинсрид, Германия) или Sequiserve GmbH (Фатерштеттен, Германия).
Анализ последовательностей ДНК и белков и оценка данных о последовательностях
Для создания, картирования, анализа, аннотации и иллюстрации последовательностей применяли пакет программ фирмы GCG (Genetics Computer Group, Мэдисон, шт. Висконсин), версия 10.2 и усовершенствованный набор программ Infomax's Vector NT1, версия 8.0.
Экспрессионные векторы
Для экспрессии описанных антител применяли экспрессионные векторы для кратковременной экспрессии в клетках (например, в HEK293-F-клетках), основанные либо на кДНК-конструкции с интроном А промотора CMV или без него, либо на геномной конструкции с промотором CMV.
Помимо кассеты экспрессии антитела векторы включали:
- сайт инициации репликации, который обеспечивает репликацию этого вектора в Е. coli,
- ген β-лактамазы, который придает устойчивость Е. coli к ампициллину, и
- ген дигидрофолатредуктазы из Mus musculus в качестве селектируемого маркера в эукариотических клетках.
Транскрипционная единица гена антитела состояла из следующих элементов:
- уникальный(ые) сайт(ы) рестрикции на 5'-конце,
- немедленно-ранний энхансер и промотор из человеческого цитомегаловируса,
- расположенная за ней последовательность интрона А в случае конструкции на основе кДНК,
- 5'-нетранслируемая область гена человеческого иммуноглобулина,
- нуклеиновая кислота, кодирующая сигнальную последовательность тяжелой цепи иммуноглобулина,
- нуклеиновая кислота, кодирующая цепь человеческого антитела (дикого типа или с обменом доменов) в случае конструкции на основе кДНК, или в случае геномной конструкции с экзон-интронной конструкцией иммуноглобулина,
- 3'-нетранслируемая область с последовательностью сигнала полиаденилирования и
- уникальный(ые) сайт(ы) рестрикции на 3'-конце.
Нуклеиновые кислоты, кодирующие цепи антитела, создавали с помощью ПЦР и/или синтеза генов и собирали с помощью известных методов и технологий рекомбинации путем соединения соответствующих сегментов нуклеиновых кислот, например, с использованием уникальных сайтов рестрикции в соответствующих векторах. Субклонированные нуклеотидные последовательности подтверждали секвенированием ДНК. Для кратковременных трансфекций получали большие количества векторов путем получения векторов из трансформированных культур Е. coli (фирма Nucleobond АХ, фирма Macherey-Nagel).
Методики культивирования клеток
Применяли стандартные методики культивирования клеток, описанные в Current Protocols in Cell Biology, под ред. Bonifacino J.S., Dasso M., Harford J.В., Lippincott-Schwartz, J и Yamada K.M, изд-во John Wiley & Sons, Inc, 2000.
Биспецифические антитела экспрессировали путем кратковременной котрансфекции соответствующими экспрессионными векторами клеток HEK29-F, выращенных в суспензии, согласно описанному ниже методу.
Пример 1
Экспрессия и очистка
Кратковременные трансфекций в HEK293-F-системе
Моноспецифические и биспецифические антитела создавали путем кратковременной трансфекций с помощью соответствующих векторов (например, кодирующих тяжелую цепь и модифицированную тяжелую цепь, а также соответствующую легкую цепь и модифицированную легкую цепь), используя HEK293-Р-систему (фирма Invitrogen), согласно инструкции производителя. В целом, метод состоял в следующем: клетки HEK293-F (фирма Invitrogen), растущие в суспензии либо во встряхиваемой колбе, либо в ферментере с перемешивающим устройством в бессывороточной среде для экспрессии FreeStyle™ 293 (фирма Invitrogen), трансфектировали смесью соответствующих экспрессионных векторов и 293fectin™ или фектина (фирма Invitrogen). В 2-литровую встряхиваемую колбу (фирма Corning) высевали HEK293-F-клетки с плотностью 1,0×106 клеток/мл в 600 мл и инкубировали при 120 об/мин, 8% СО2. Через день клетки трансфектировали при клеточной плотности примерно 1,5×106 клеток/мл, используя примерно 42 мл смеси, содержащей А) 20 мл среды Opti-MEM (фирма Invitrogen) с 600 мкг общей векторной ДНК (1 мкг/мл), кодирующей тяжелую или модифицированную тяжелую цепь соответственно, и соответствующую легкую цепь в эквимолярном соотношении, и Б) 20 мл Opti-MEM + 1,2 мл 293 fectin™ или фектина (2 мкл/мл). В зависимости от поглощения глюкозы в процессе ферментации добавляли раствор глюкозы. Супернатант, содержащий секретированное антитело, собирали через 5-10 дней, и антитела либо очищали непосредственно из супернатанта или супернатант замораживали и помещали на хранение.
Очистка
Биспецифические антитела очищали из супернатантов клеточных культур с помощью аффинной хроматографии, используя MabSelectSure-Sepharose™ (для не-IHH-ААА-мутантов) (фирма GE Healthcare, Швеция) или kappaSelect-агарозу (для IHH-AAA -мутантов) (фирма GE Healthcare, Швеция), хроматографии гидрофобных взаимодействий с использованием бутил-сефарозы (фирма GE Healthcare, Швеция) и гель-фильтрации на смоле супердекс 200 (фирма GE Healthcare, Швеция).
В целом, метод состоял в следующем: полученные после стерилизации фильтрацией супернатанты клеточных культур «захватывали» с помощью смолы MabSelect SuRe (не-IHH-ААА-мутанты и антитела дикого типа), уравновешенной ЗФР-буфером (10мМ Na2HPO4, 1 мМ KH2PO4, 137 мМ NaCl и 2,7 мМ KCl, рН 7,4), промывали буфером для уравновешивания и элюировали 25 мМ цитратом натрия, рН 3,0. Антитела с IHH-AAA-мутацией «захватывали» с помощью смолы KappaSelect, уравновешенной 25 мМ Трис, 50 мМ NaCl, рН 7,2, отмывали буфером для уравновешивания и элюировали 25 мМ цитратом натрия, рН 2,9. Элюированные фракции антител объединяли и нейтрализовали 2М Трис, рН 9,0. Пулы антител подготавливали для хроматографии гидрофобных взаимодействий, добавляя 1,6М раствор сульфата аммония до конечной концентрации 0,8М сульфата аммония и значение рН доводили до 5,0 с помощью уксусной кислоты. После уравновешивания бутил-сефарозной смолы 35 мМ ацетатом натрия, 0,8М сульфатом аммония, рН 5,0 антитела наносили на смолу, промывали буфером для уравновешивания и элюировали линейным градиентом до 35 мМ ацетата натрия, рН 5,0. Фракции, содержащие (моноспецифическое или биспецифическое) антитело, объединяли и дополнительно очищали с помощью гель-фильтрации, используя колонку, заполненную смолой супердекс 200 26/60 GL (фирма GE Healthcare, Швеция), уравновешенную 20 мМ гистидином, 140 мМ NaCl, рН 6,0. Фракции, содержащие (моноспецифическое или биспецифическое антитело), объединяли, концентрировали до требуемой концентрации, используя устройства для ультрафильтрации Vivaspin (фирма Sartorius Stedim Biotech S.A., Франция), и хранили при -80°С.
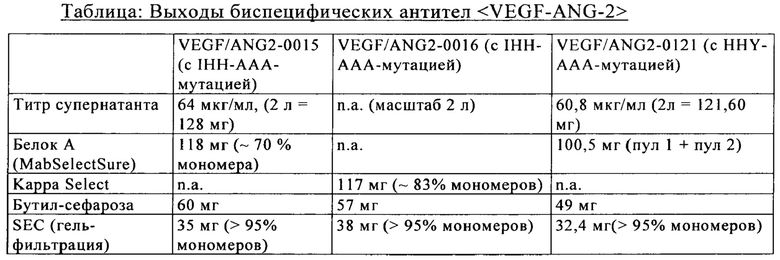
Чистоту и целостность антитела анализировали после каждой стадии очистки с помощью капиллярного электрофореза в присутствии ДСН (КЭ-ДСН), используя технологию микропотоков Labchip (фирма Caliper Life Science, США). 5 мкл белкового раствора подготавливали для КЭ-ДСН-анализа, используя набор реагентов НТ Protein Express согласно инструкциям производителя, и анализировали с помощью системы LabChip GXII, используя чип НТ Protein Express. Данные анализировали с помощью программы LabChip GX.
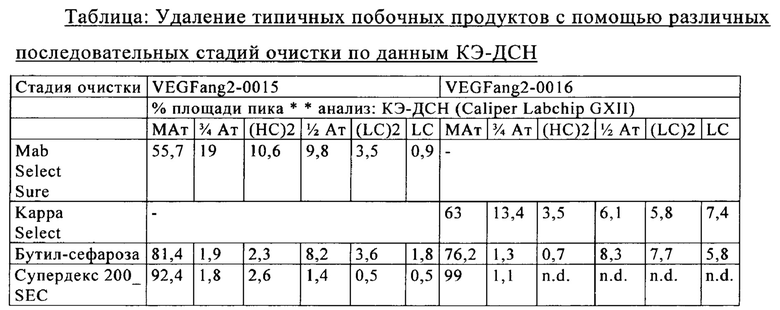
Содержание агрегатов в образцах антител анализировали с помощью высокоэффективной SEC на аналитической колонке для гель-фильтрации, заполненной супердексом 200 (фирма GE Healthcare, Швеция), применяя 2×ЗФР (20 мМ Na2HPO4, 2 мМ KH2PO4, 274 мМ NaCl и 5,4 мМ KCl, рН 7,4) в качестве подвижного буфера, при 25°С. 25 мкг белка инъецировали в колонку со скоростью потока 0,75 мл/мин и подвергали изократическому элюированию в течение 50 мин.
Аналогично этому получали и очищали антитела к VEGF/ANG2 VEGF/ ANG2-0012 и VEGF/ANG2-0201, достигая следующих выходов:
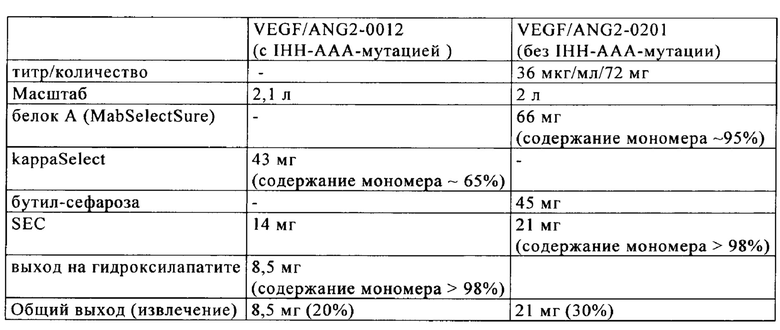
Кроме того, с использованием аналогичных методов можно получать и очищать такие биспецифические антитела к VEGF/ANG2, как анти-VEGF/ANG2 CrossMAb IgG4 с IHH-ААА-мутацией и SPLE-мутацией (SEQ ID NO: 42, SEQ ID NO: 43, SEQ ID NO: 44, SEQ ID NO: 45), анти-VEGF/ANG2 OAscFab IgG1 с IHH-ААА-мутацией (SEQ ID NO: 46, SEQ ID NO: 47, SEQ ID NO: 48), анти-VEGF/ANG2 OAscFab IgG4 с IHH-ААА-мутацией и SPLE-мутацией (SEQ ID NO: 49, SEQ ID NO: 50, SEQ ID NO: 51), анти-VEGF/ANG2 CrossMab IgG1 с HHY-ААА-мутацией и P329G LALA-мутацией (SEQ ID NO: 90, SEQ ID NO: 91, SEQ ID NO: 40, SEQ ID NO: 41), анти-VEGF/ANG2 CrossMab IgG4 с HHY-AAA-мутацией и SPLE-мутацией (SEQ ID NO: 92, SEQ ID NO: 93, SEQ ID NO: 44, SEQ ID NO: 45), анти-VEGF/ANG2 OAscFab IgG1 с HHY-AAA-мутацией (SEQ ID NO: 94, SEQ ID NO: 95, SEQ ID NO: 48) и анти-VEGF/ANG2 OAscFab IgG4 с HHY-AAA-мутацией и SPLE-мутацией (SEQ ID NO: 96, SEQ ID NO: 97, SEQ ID NO: 51), а также моноспецифические антитела к IGF-1R, такие как анти-IGF-1R дикого типа (SEQ ID NO: 88, SEQ ID NO: 89), анти-IGF-1R IgG1 с IHH-ААА-мутацией (SEQ ID NO: 88, SEQ ID NO: 90), анти-IGF-1R IgG1 с YTE-мутацией (SEQ ID NO: 88, SEQ ID NO: 91), анти-IGF-1R IgG1 дикого типа с KiH-мутацией (SEQ ID NO: 88, SEQ ID NO: 92, SEQ ID NO: 93), анти-IGF-1R IgG1 с KiH-мутацией и IHH-ААА-мутацией в цепи с «впадиной» (SEQ ID NO: 88, SEQ ID NO: 94, SEQ ID NO: 95), анти-IGF-1R IgG1 с KiH-мутацией и HHY-AAA-мутацией в цепи с «впадиной» (SEQ ID NO: 88, SEQ ID NO: 96, SEQ ID NO: 97), анти-IGF-1R IgG1 с KiH-мутацией и YTE-мутацией (SEQ ID NO: 88, SEQ ID NO: 98, SEQ ID NO: 99), анти-IGF-1R IgG1 с KiH-мутацией и DDD-мутацией (SEQ ID NO: 88, SEQ ID NO: 100, SEQ ID NO: 101) и анти-IGF-1R IgG1 с HHY-AAA-мутацией (SEQ ID NO: 88, SEQ ID NO: 112).
Пример 2
Аналитический анализ и возможность обнаружения
Основанное на DLS измерение вязкости в лабораторных условиях
Измерение вязкости осуществляли в целом согласно известному методу (Не F. и др., Analytical Biochemistry 399, 2009, сс. 141-143). В целом, метод состоял в следующем: образцы концентрировали до получения различных концентраций белка в 200 мМ сукцинате аргинина, рН 5,5 перед добавлением гранул из полистирольного латекса (диаметром 300 нм) и полисорбата 20 (0,02 об.%). Образцы переносили в оптический 384-луночный планшет посредством центрифугирования через 0,4-микрометровую фильтровальную пластину и покрывали парафиновым маслом. Кажущийся диаметр гранул латекса определяли путем динамического рассеяния света при 25°С. Вязкость раствора можно рассчитывать по формуле η=η0(rh/rh,0) (η: вязкость; η0: вязкость воды; rh: кажущийся гидродинамический радиус гранул латекса; rh,0: гидродинамический диаметр гранул латекса в воде.
Для того, чтобы можно было осуществлять сравнение различных образцов при одной и той же концентрации, данные о вязкости в зависимости от концентрации аппроксимировали с помощью уравнения Муни (уравнение 1) (Mooney, Colloid Sci, 1951; Monkos, Biochem. Biophys. Acta, 1997) и осуществляли интерполяцию данных с помощью следующего уравнения:
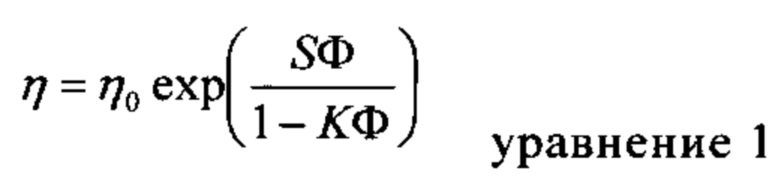
(S: параметр гидродинамического взаимодействия белка; K: коэффициент самосжатия; Ф: объем фракции растворенного белка).
Результаты представлены на фиг. 2: установлено, что VEGF/ANG2-0016 с IHH-AAA мутацией обладает более низкой вязкостью при всех температурах, при которых осуществляли измерения, по сравнению с VEGF/ANG2-0015 без IHH-AAA-мутации в Fc-области.
Температура начала агрегации по данным DLS
Образцы приготавливали в концентрации 1 мг/мл в 20 мМ гистидине/хлориде гистидина, 140 мМ NaCl, рН 6,0, переносили в оптический 384-луночный планшет посредством центрифугирования через 0,4-микрометровую фильтровальную пластину и покрывали парафиновым маслом. Гидродинамический радиус и в этом случае измеряли с помощью динамического рассеяния света, при этом образцы нагревали со скоростью 0,05°С/мин с 25°С до 80°С. Температуру начала агрегации определяли как температуру, при которой гидродинамический радиус начинал возрастать. Результаты представлены на фиг. 3. На фиг. 3 представлены данные об агрегации VEGF/ANG2-0015 без IHH-ААА-мутации в сравнении с VEGF/ANG2-0016 с IHH-ААА-мутацией в Fc-области. Установлено, что для VEGF/ANG2-0016 температура начала агрегации составляла 61°С, в то время как для VEGF/ANG2-0015 без IHH-AAA-мутации температура начала агрегации составляла 60°С.
Результаты DLS-анализа в зависимости от времени
Образцы приготавливали в концентрации 1 мг/мл в 20 мМ гистидине/хлориде гистидина, 140 мМ NaCl, рН 6,0, переносили в оптический 384-луночный планшет посредством центрифугирования через 0,4-микрометровую фильтровальную пластину и покрывали парафиновым маслом. Гидродинамический радиус и в этом случае измеряли с помощью динамического рассеяния света, при этом образцы выдерживали при постоянной температуре 50°С вплоть до 145 ч. В этом эксперименте тенденция к агрегации нативного неуложенного белка при повышенной температуре может приводить к увеличению среднего диаметра частиц с течением времени. Указанный метод на основе DLS является очень чувствительным в отношении агрегатов, поскольку их образование приводит к сверхпропорциональному изменению интенсивности рассеяния света. Даже после выдерживания в течение 145 ч при 50°С (температура, близкая к температуре начала агрегации, см. выше) средний диаметр частиц как VEGF/ANG2-0015, так и VEGF/ANG2-0016 увеличивался менее чем на 0,5 нм.
Хранение в течение 7 дней при 40°С в концентрации 100 мг/мл
Образцы концентрировали до конечной концентрации 100 мг/мл в 200 мМ сукцинате аргинина, рН 5,5, стерилизовали фильтрацией и хранили в покое при 40°С в течение 7 дней. До и после хранения определяли содержание высоко- и низкомолекулярных видов (HMW и LMW соответственно) с помощью гель-фильтрации. Различие в содержании HMW и LMW между образцами после хранения и образцами, в которых измерение осуществляли сразу после приготовления, обозначали как «повышение HMW» и «повышение LMW» соответственно. Результаты, представленные ниже в таблице и на фиг. 4, продемонстрировали, что для VEGF/ANG2-0015 (без IHH-AAA-мутации) характерно более выраженное снижение основного пика и более выраженное повышение HMW по сравнению с VEGF/ANG2-0016 (с IHH-ААА-мутацией). При создании изобретения неожиданно было установлено, что для VEGF/ANG2 (с IHH-ААА-мутацией) характерна меньшая тенденция к агрегации по сравнению с VEGF/ANG2-0015 (без IHH-ААА-мутации).

Функциональный антител биспецифических антител к VEGF/ANG2 осуществляли с помощью поверхностного плазмонного резонанса (SPR), используя устройство BIAcore® Т100 или Т200 (фирма GE Healthcare), при 25°С. Система BIAcore® хорошо подходит для изучения молекулярных взаимодействий. SPR-технология основана на измерении коэффициента преломления вблизи поверхности покрытого золотом биосенсорного чипа. Изменения коэффициента преломления свидетельствуют об изменениях массы на поверхности, вызываемых взаимодействием иммобилизованного лиганда с аналитом, инъецируемым в растворе. Масса возрастает, если молекулы связываются с иммобилизованными лигандами на поверхности, и наоборот масса снижается в случае диссоциации аналита от иммобилизованного лиганда (отражая диссоциацию комплекса). SPR позволяет осуществлять непрерывный мониторинг в реальном времени связывания лиганда/аналита и таким образом определять константу скорости ассоциации (ka), константу скорости диссоциации (kd) и константу равновесия (KD).
Пример 3
Связывание с VEGF, ANG2, FcгаммаR и FcRn
Оценка кинетики аффинности к изоформам VEGF, включая оценку видовой перекрестной реактивности
Систему для «захвата», уровень иммобилизации которой соответствовал примерно 12000 резонансных единиц (RU) (10 мкг/мл козьего античеловеческого F(ab)'2; код заказа: 28958325; фирма GE Healthcare Bio-Sciences АВ, Швеция), сшивали с СМ5-чипом (фирма GE Healthcare, BR-1005-30) при рН 5,0, применяя набор для аминного сочетания, поставляемый фирмой GE Healthcare. Буфер для системы и образца представлял собой ЗФР-Т (10мМ забуференный фосфатом физиологический раствор, включающий 0,05% Твин 20™), рН 7,4. Температуру проточной ячейки устанавливали на 25°С, а температуру блока для образца устанавливали на 12°С и примировали дважды, используя подвижный буфер. Биспецифическое антитело «захватывали» путем инъекции 50нМ раствора в течение 30 с при скорости потока 5 мкл/мин. Ассоциацию измеряли путем инъекции человеческого hVEGF121, мышиного mVEGF120 или крысиного rVEGF164 в различных концентрациях в растворе в течение 300 с при скорости потока 30 мкл/мин, начиная с концентрации 300 нМ, применяя разведения 1:3. Осуществляли мониторинг фазы диссоциации в течение периода времени вплоть до 1200 с и ее запускали путем замены раствора образца на подвижный буфер. Поверхность регенерировали путем 60-секундной промывки с помощью раствора глицина, рН 2, при скорости потока 30 мкл/мин. Все различия в коэффициентах преломления корректировали путем вычитания ответа, полученного от поверхности, покрытой козьим античеловеческим F(ab')2. Вычитали также данные, полученные при осуществлении контрольных «пустых» инъекций (двойной контроль). Для расчета кажущейся величины KD и других кинетических параметров применяли модель 1:1 Лэнгмюра. Результаты представлены ниже.
Аффинность к ANG2 в растворе, включая оценку видовой перекрестной реактивности
Оценка аффинности в растворе позволяет измерять аффинность взаимодействия путем определения концентрации свободных взаимодействующих партнеров в уравновешенной смеси. Анализ аффинности в растворе включал смешение биспецифического антитела к VEGF/ANG2 при сохранении его постоянной концентрации с лигандом (т.е. ANG2) в различных концентрациях. Антитело иммобилизовали на поверхности СМ5-чипа (фирма GE Healthcare, BR-1005-30) при рН 5,0 до уровня иммобилизации, соответствующего максимально возможному количеству резонансных единиц (например, 17000 резонансных единиц (RU)), используя набор для аминного сочетания, поставляемый фирмой GE Healthcare. Буфер для системы и образца представлял собой HBS-P, рН 7,4. Температуру проточной ячейки устанавливали на 25°С, а температуру блока для образца устанавливали на 12°С и примировали дважды, используя подвижный буфер. Для получения калибровочной кривой ANG2 в возрастающих концентрациях инъецировали в проточную ячейку устройства BIAcore, содержащую иммобилизованное антитело к VEGF/ANG2. Количество связанного ANG2 оценивали в резонансных единицах (RU) и строили график зависимости от концентрации. Растворы каждого лиганда (11 концентраций в диапазоне от 0 до 200 нм антитела к VEGF/ANG2) инкубировали с 10нМ ANG2 и давали достигать равновесия при комнатной температуре. Концентрации свободного ANG2 определяли с использованием калибровочной кривой, созданной до и после измерения ответа в растворах с известными количествами ANG2. 4-параметрическую подгонку осуществляли с помощью XLfit4 (программа фирмы IDBS) с моделью 201, откладывая концентрацию свободного ANG2 на у-оси и концентрацию ингибирующего антитела на х-оси. Аффинность рассчитывали, определяя точку изгиба этой кривой. Поверхность регенерировали путем однократной промывки в течение 30 с 0,85%-ным раствором Н3РО4 при скорости потока 30 мкл/мин. Все различия в коэффициентах преломления корректировали путем вычитания ответа, полученного от поверхности, покрытой «пустым» контролем. Результаты представлены ниже.
Аффинность к FcRn в стабильном состоянии
Для сравнения биспецифических антител друг с другом определяли аффинность к FcRn в стабильном состоянии. Человеческий FcRn разводили в буфере для сочетания (10 мкг/мл Na-ацетата, рН 5,0) и иммобилизовали на С1-чипе (фирма GE Healthcare, BR-1005-35), применяя процедуру направленной иммобилизации с использованием устройства BIAcore, до достижения уровня конечного ответа, соответствующего 200 RU. Температуру проточной ячейки устанавливали на 25°С, а температуру блока для образца устанавливали на 12°С и дважды примировали, используя подвижный буфер. Буфер для системы и образца представлял собой ЗФР-Т (10мМ забуференный фосфатом физиологический раствор, включающий 0,05% Твин 20™) рН 6,0. Для исследования каждого антитела применяли различные концентрации IgG, составляющие 62,5, 125, 250 и 500нМ. Скорость потока составляла 30 мкл/мин и различные образцы инъецировали последовательно на поверхность чипа, при этом в качестве периода ассоциации был выбран промежуток времени, составляющий 180 с. Поверхность регенерировали путем инъекции ЗФР-Т, рН 8 в течение 60 с при скорости потока 30 мкл/мин. Все различия в коэффициентах преломления корректировали путем вычитания ответа, полученного от «пустой» поверхности. Вычитали также результаты, полученные при инъекциях буфера (т.е. применяли двойной контроль). Для расчета аффинности в стабильном состоянии применяли метод, входящий в программу Bia-Evaluation. В целом, метод состоял в следующем: строили график зависимости величин RU от анализируемых концентраций, получая кривую дозовой зависимости. На основе 2-параметрической подгонки рассчитывали верхнюю асимптоту, что позволяло определять величину RU, составляющую половину от максимальной, и таким образом определять аффинность. Результаты представлены на фиг. 5 и ниже в таблице. Аналогичным образом определял аффинность к FcRn обезьян циномолгус (cyno), мышей и кроликов.
Оценка связывания FcгаммаRIIIa
Для измерения аффинности к FcгаммаRIIIa применяли прямой анализ связывания. Систему для «захвата» (1 мкг/мл пента-His; фирма Quiagen) (примерно 3000 резонансных единиц (RU)) сшивали с СМ5-чипом (фирма GE Healthcare, BR-1005-30) при рН 5,0, используя набор для аминного сочетания, поставляемый фирмой GE Healthcare. Буфер для системы и образца представлял собой HBS-P, рН 7,4. Температуру проточной ячейки устанавливали на 25°С, а температуру блока для образца устанавливали на 12°С и примировали дважды, используя подвижный буфер. FcгаммаRIIIa-His-рецептор «захватывали» путем инъекции 100нМ раствора в течение 60 с при скорости потока 5 мкл/мин. Связывание оценивали путем инъекции 100нМ биспецифического антитела или моноспецифических контрольных антител (антитела к дигоксегинину (анти-Dig) для антитела IgG1-подкласса и IgG4-подкласса) в течение 180 с при скорости потока 30 мкл/мин. Поверхность регенерировали путем промывки в течение 120 с раствором глицина, рН 2,5 при скорости потока 30 мкл/мин. Поскольку связывание FcгаммаRIIIa отличается от модели связывания 1:1 Лэнгмюра, в этом анализе определяли только наличие связывания/отсутствие связывания. Аналогичным образом можно определять связывание FcгаммаRIa и FcгаммаRIIa. Из результатов, представленных на фиг. 6, следует, что после интродукции мутаций P329G LALA не удалось обнаружить связывание с FcгаммаRIIIa.
Оценка независимого связывания VEGF и ANG2 с антителами к VEGF/ANG2
Систему для «захвата», уровень иммобилизации которой соответствовал примерно 3500 резонансным единицам (RU) (10 мкг/мл козьего античеловеческого IgG; фирма GE Healthcare Bio-Sciences АВ, Швеция), сшивали с СМ4-чипом (фирма GE Healthcare BR-1005-34) при рН 5,0, используя набор для аминного сочетания, поставляемый фирмой GE Healthcare. Буфер для системы и образца представлял собой ЗФР-Т (10мМ забуференный фосфатом физиологический раствор, включающий 0,05% Твин 20™) рН 7,4. Температуру проточной ячейки устанавливали на 25°С, а температуру блока для образца устанавливали на 12°С. Перед «захватом» проточную ячейку дважды примировали, используя подвижный буфер.
Биспецифическое антитело «захватывали» путем инъекции 10нМ раствора в течение 60 с со скоростью 5 мкл/мин. Независимое связывание каждого лиганда с биспецифическим антителом анализировали, определяя способность активного связывания для каждого лиганда, которые добавляли либо последовательно, либо одновременно (скорость 30 мкл/мин), согласно описанным ниже вариантам:
1. Инъекция человеческого VEGF в концентрации 200нМ в течение 180 с (для демонстрации индивидуального связывания антигена).
2. Инъекция человеческого ANG2 в концентрации 100нМ в течение 180 с (для демонстрации индивидуального связывания антигена).
3. Инъекция человеческого VEGF в концентрации 200нМ в течение 180 с с последующей дополнительной инъекцией человеческого ANG2 в концентрации 100нМ в течение 180 с (для демонстрации связывания ANG2 в присутствии VEGF).
4. Инъекция человеческого ANG2 в концентрации 100нМ в течение 180 с с последующей дополнительной инъекцией человеческого VEGF в концентрации 200нМ (для демонстрации связывания VEGF в присутствии ANG2).
5. Совместная инъекция человеческого VEGF в концентрации 200нМ и человеческого ANG2 в концентрации 100нМ в течение 180 с (для демонстрации одновременного связывания VEGF и ANG2).
Поверхность регенерировали в помощью промывки в течение 60 с 3мМ раствором MgCl2 при скорости потока 30 мкл/мин. Все различия в коэффициентах преломления корректировали путем вычитания ответа, полученного от поверхности, сенсибилизированной античеловеческим IgG.
Считается, что биспецифическое антитело обладает способностью связываться с обоими антигенами независимо друг от друга, если образующийся конечный сигнал, полученный при применении подходов 3, 4 и 5, равен или близок к сумме индивидуальных конечных сигналов, полученных при применении подходов 1 и 2. Результаты, представленные ниже в таблице, демонстрируют, что оба антитела VEGF/ANG2-0016, VEGF/ANG2-0012 обладали способностью независимо друг от друга связываться с VEGF и ANG2.
Оценка одновременного связывания VEGF и ANG2 с антителами к VEGF/ANG2
Во-первых, сшивали VEGF (примерно 1600 резонансных единиц (RU)) (20 мкг/мл) с СМ4-чипом (фирма GE Healthcare, BR-1005-34) при рН 5,0, используя набор для аминного сочетания, поставляемый фирмой GE Healthcare. Буфер для системы и образца представлял собой ЗФР-Т (10мМ забуференный фосфатом физиологический раствор, включающий 0,05% Твин 20™), рН 7,4. Температуру проточной ячейки устанавливали на 25°С, а температуру блока для образца устанавливали на 12°С и примировали дважды, используя подвижный буфер. Во-вторых, 50нМ раствор биспецифического антитела инъецировали в течение 180 с со скоростью 30 мкл/мин. В-третьих, hANG2 инъецировали в течение 180 с со скоростью 30 мкл/мин. Ответ в виде связывания hANG2 зависел от количества биспецифического антитела, связанного с VEGF, и он свидетельствовал об одновременном связывании. Поверхность регенерировали путем промывки в течение 60 с 0,85%-ным раствором Н3РО4 со скоростью потока 30 мкл/мин. О наличии одновременного связывания свидетельствует дополнительный специфический сигнал связывания hANG2 относительно предшествующего сигнала связывания VEGF с антителами к VEGF/ANG. Для обоих биспецифических антител VEGF/ANG2-0015 и VEGF/ANG2-0016 удалось обнаружить одновременное связывание VEGF и ANG2 с антителами к VEGF/ ANG2 (данные не представлены).
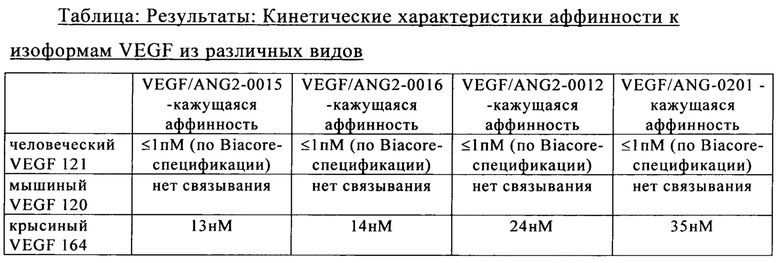
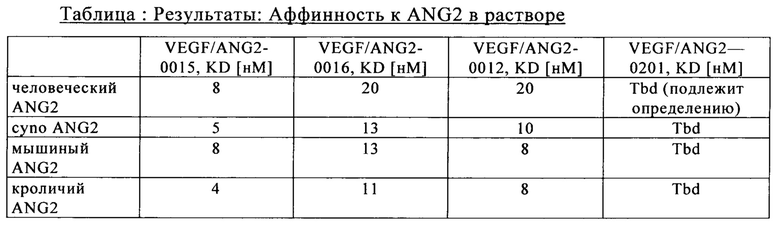
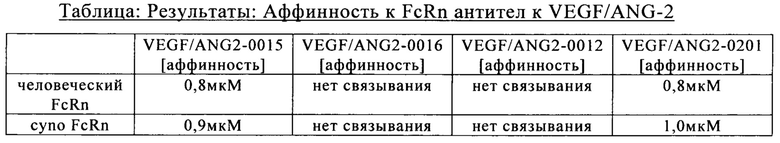
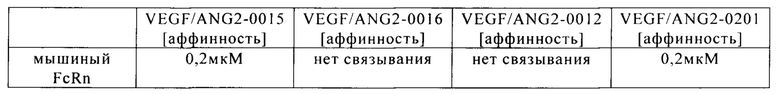

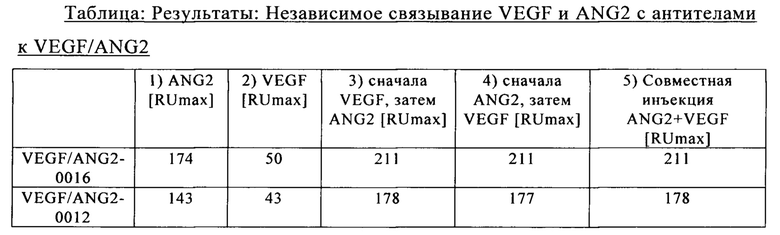
Пример 4
Масс-спектрометрия
В данном разделе описана характеризация антител к VEGF/ANG2 в отношении правильной сборки. Предполагаемые первичные структуры подтверждали с помощью масс-спектрометрии с ионизацией электроспреем (ESI-MC) дегликозилированных и интактных или расщепленных с помощью IdeS (расщепляющий IgG фермент из S. pyogenes) антител к VEGF/ANG2. Расщепление с помощью IdeS осуществляли с использованием 100 мкг очищенного антитела, которое инкубировали с 2 мкг IdeS-протеазы (фирма Fabricator) в буфере, содержащем 100 ммолей/л NaH2PO4/Na2HPO4, рН 7,1, при 37°С в течение 5 ч. Затем антитела дегликозилировали с помощью N-гликозидазы F, нейраминидазы и О-гликозидазы (фирма Roche) в буфере, содержащем 100 ммолей/л NaH2PO4/Na2HPO4, рН 7,1, при 37°С в течение вплоть до 16 ч, используя белок в концентрации 1 мг/мл, и затем осуществляли обессоливание с помощью ЖХВР на колонке с Сефадекс G25 (фирма GE Healthcare). Общую массу определяли с помощью ESI-MC, применяя МС-систему maXis 4G UHR-QTOF (фирма Bruker Daltonik), снабженную источником TriVersa NanoMate (фирма Advion).
Массы, установленные для расщепленных IdeS, дегликозилированных (таблица ниже) или интактных дегликозилированных (таблица ниже) молекул, соответствовали предсказанным массам, которые выводили на основе аминокислотных последовательностей антител к VEGF/ANG2, состоящих из двух различных легких цепей LCANG2 и LСлуцентис и двух различных тяжелых цепей HCANG2 и НСлуцентис.
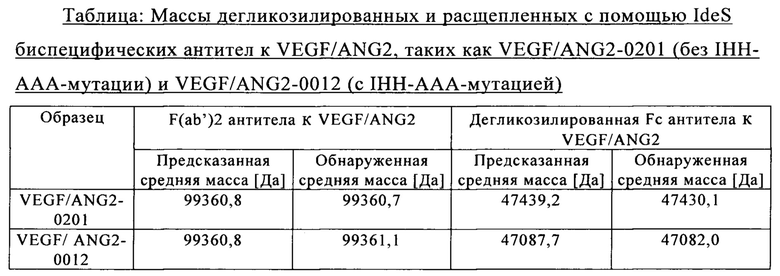

Пример 5
Хроматография с использованием FcRn
Сочетание со стрептавидин-сефарозой:
Добавляли 1 г стрептавидин-сефарозы (фирма GE Healthcare) к биотинилированному и подвергнутому диализу рецептору и инкубировали в течение 2 ч при встряхивании. Дериватизированной рецептором сефарозой заполняли 1-миллилитровую ХК-колонку (фирма GE Healthcare).
Хроматография с применением аффинной содержащей FcRn колонки:
Условия:
размеры колонки:50 мм × 5 мм,
высота слоя:5 см,
загрузка:50 мкг образца,
буфер для уравновешивания: 20 мМ MES с 150 мМ NaCl, регулирующий значение рН до 5,5,
буфер для элюции:20 мМ Трис/HCl с 150 мМ NaCl,
регулирующий значение рН до 8,8,
элюция:7,5 CV буфера для уравновешивания, в 30 CV
до 100% буфера для элюции, 10 CV буфера для элюции.
Колоночная хроматография для оценки аффинности к huFcRn
В приведенной ниже таблице представлены данные о временах удерживания антител к VEGF/ANG2 на колонках для аффинной хроматографии, содержащих человеческий FcRn. Данные получали с использованием указанных выше условий.
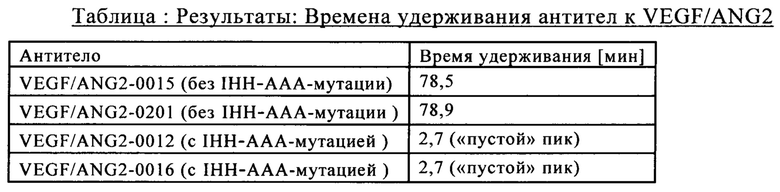
Пример 6
Фармакокинетические (ФК) свойства антител с IHH-ААА-мутацией
ФК данные в отношении FcRn, полученные на мышах, трансгенных по человеческому FcRn
Фаза прижизненных исследований:
Опыт проводили на самках мышей C57BL/6J (фон); мышей с дефицитом FcRn, но гемизиготных трансгенных по человеческому FcRn (huFcRn, линия 276 -/tg).
Часть 1
Всем мышам инъецировали однократно интравитреально в правый глаз 2 мкл/животное соответствующего раствора (т.е. 21 мкг соединения/животное (VEGF/ANG2-0015 (без IHH-AAA-мутации) или 23,6 мкг соединения/животное (VEGF/ANG2-0016 (с IHH-ААА-мутацией).
Мышей подразделяли на 2 группы по 6 животных в каждой. Получали образцы крови у животных группы 1 через 2, 24 и 96 ч, а у животных группы 2 через 7, 48 и 168 ч после дозирования.
Осуществляли инъекцию в стекловидное тело правого глаза мышей с помощью включающей микрошприц системы NanoFil для нанолитровых инъекций фирмы World Precision Instruments, Inc., Берлин, Германия. Мышей анестезировали с помощью 2,5% изофлурана, и для визуализации глаза мышей применяли микроскоп Leica MZFL 3 с 40-кратным увеличением и источником кольцевого света Leica KL 2500 LCD. Затем 2 мкл соединения инъецировали с помощью иглы 35-размера.
Кровь собирали из ретробульбарного венозного сплетения контралатерального глаза каждого животного для определения уровней соединения в сыворотке.
Образцы сыворотки объемом по меньшей мере 50 мкл получали из крови после выдерживания в течение 1 ч при КТ путем центрифугирования (9300×g) при 4°С в течение 3 мин. Образцы сыворотки замораживали непосредственно после центрифугирования и хранили в замороженном состоянии при -80°С до анализа. Обработанные глаза животных из группы 1 выделяли через 96 ч после обработки, у животных из группы 2 - через 168 ч после обработки. Образцы хранили в замороженном состоянии при -80°С до анализа.
Часть 2
Всем мышам инъецировали однократно внутривенно через хвостовую вену по 200 мкл/животное соответствующего раствора (т.е. 21 мкг соединения/животное (VEGF/ANG2-0015 (без IHH-AAA-мутации) или 23,6 мкг соединения/животное (VEGF/ANG2-0016 (с IHH-ААА-мутацией). Мышей подразделяли на 2 группы по 5 животных в каждой. Получали образцы крови у животных группы 1 через 1, 24 и 96 ч, а у животных группы 2 через 7, 48 и 168 ч после дозирования. Кровь собирали из ретробульбарного венозного сплетения каждого животного для определения уровней соединения в сыворотке.
Образцы сыворотки объемом по меньшей мере 50 мкл получали из крови после выдерживания в течение 1 ч при КТ путем центрифугирования (9300×g) при 4°С в течение 3 мин. Образцы сыворотки замораживали непосредственно после центрифугирования и хранили в замороженном состоянии при -80°С до анализа.
Получение лизатов всего глаза (мышей)
Лизаты глаз получали путем физико-химического расщепления всего глаза лабораторных животных. Для механического разрушения каждый глаз переносили в микропробирку с коническим дном объемом 1,5 мл. После замораживания и оттаивания глаза промывали однократно 1 мл промывочного буфера для клеток (фирма Bio-Rad, набор для лизиса клеток Bio-Plex, каталожный №171-304011). На следующей стадии добавляли 500 мкл свежеприготовленного буфера для лизиса клеток и глаза измельчали с помощью 1,5-миллилитрового пестика для измельчения тканей (фирма Kimble Chase, 1,5-миллилитровый пестик, артикул №749521-1500). Затем смесь 5 раз подвергали замораживанию и оттаиванию и вновь измельчали. Для отделения лизата от оставшейся ткани образцы центрифугировали в течение 4 мин при 4500×g. После центрифугирования супернатант собирали и хранили при -20°С для дополнительного анализа с помощью количественного ELISA.
Анализ
Концентрации антител к VEGF/ANG2 в сыворотке и лизатах глаз мышей определяли с помощью твердофазного иммуноферментного анализа (ELISA). Для количественной оценки антител к VEGF/ANG2 в образцах сыворотки и лизатах глаз мышей осуществляли стандартный твердофазный серийный сэндвич-иммуноанализ с применением биотинилированных и дигоксигенированных моноклональных антител в качестве иммобилизованного («захватывающего») и идентифицирующего антител. Подтверждением сохранения биспецифичности аналита должно являться то, что биотинилированное «захватывающее» антитело распознает VEGF-связывающий сайт, в то время как дигоксигенированное идентифицирующее антитело связывается с ANG2-связывающим сайтом аналита. Связанный иммунный комплекс, включающий «захватывающее» антитело, аналит и идентифицирующее антитело, на твердой фазе сенсибилизированного стрептавидином титрационного микропланшета (SA-MTP) затем выявляли с помощью сшитого с пероксидазой из хрена антитела к дигоксигенину. После отмывки несвязанного материала из SA-MTP и добавления ABTS-субстрата полученный сигнал пропорционален количеству аналита, связанного с твердой фазой SA-MTP. Затем осуществляли количественную оценку путем превращения измеренных сигналов образцов в концентрации, определенные относительно калибраторов, анализируемых параллельно.
На первой стадии SA-MTP сенсибилизировали, используя 100 мкл/лунку раствора биотинилированного «захватывающего» антитела (MAT<Id<VEGF>>M-2.45.51-IgG-Bi(DDS)) в концентрации 1 мкг/мл в течение 1 ч при 500 об/мин на шейкере для МТР. Тем временем подготавливали калибраторы, QC-образцы (образцы для контроля качества) и образцы. Калибраторы и QC-образцы разводили до 2% сывороточной основой; образцы разводили до тех пор, пока сигналы не попадали в линейную область калибраторов.
После сенсибилизации SA-MTP «захватывающим» антителом планшет промывали трижды промывочным буфером, используя 300 мкл/лунку. Затем с помощью пипетки вносили по 100 мкл/лунку калибраторов, QC-образцов и образцов в SA-MTP и вновь инкубировали в течение 1 ч при 500 об/мин. При этом анализируемое соединение связывалось с помощью его VEGF-связывающего сайта через «захватывающее» антитело с твердой фазой SA-MTP. После инкубации и удаления несвязанного аналита путем промывки планшета в SA-MTP добавляли по 100 мкл/лунку первого идентифицирующего антитела (MAT<Id-<Ang2>>M-2.6.81-IgG-Dig(XOSu)) в концентрации 250 нг/мл. И в этом случае планшет инкубировали в течение 1 ч при 500 об/мин на шейкере. После промывки в лунки SA-MTP добавляли по 100 мкл/лунку второго идентифицирующего антитела (ПАт<дигоксигенин>S-Fab-POD (поли)) в концентрации 50 мед./мл и планшет вновь инкубировали в течение 1 ч при 500 об/мин. После конечной стадии промывки для удаления избытка идентифицирующего антитела добавляли по 100 мкл/лунку субстрата (ABTS). Конъюгат антитело-фермент катализировал цветную реакцию ABTS®-субстрата. Затем сигнал измеряли с помощью ридера для ELISA при длине волны 405 нм (длина референс-волны: 490 нм ([405/490] нм)).
Оценка фармакокинетики
Фармакокинетические параметры рассчитывали с помощью некомпартментального анализа, используя программу для оценки фармакокинетических параметров WinNonlin™ (фирма Pharsight), версия 5.2.1.
Результаты:
А) Концентрации в сыворотке
Результаты определения концентраций в сыворотке представлены ниже в таблицах и на фиг. 7Б-7В.
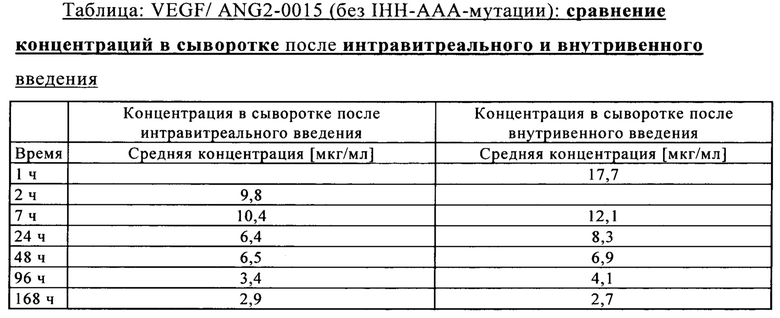
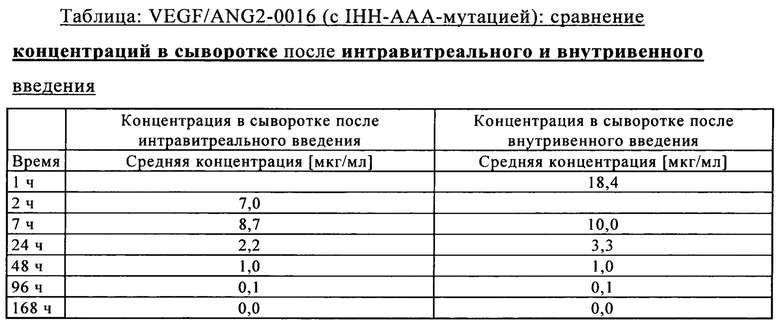
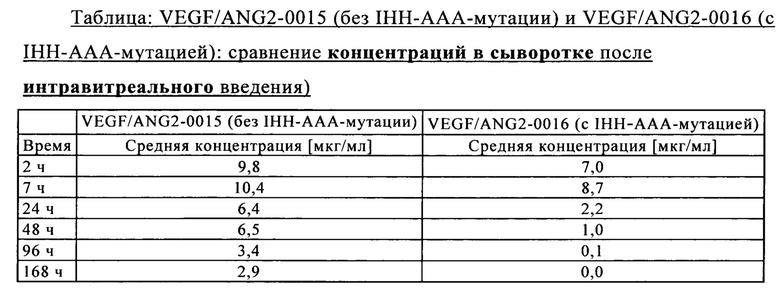
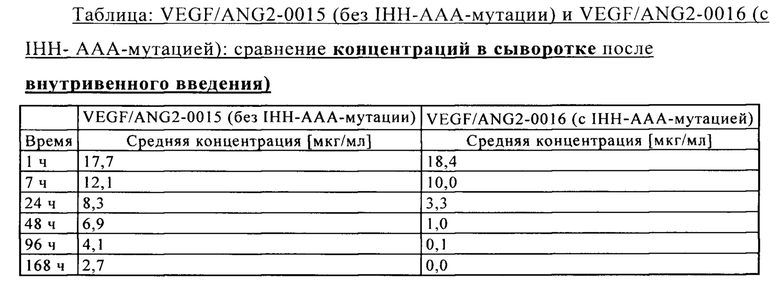
Результаты:
Б) Концентрации в глазных лизатах левых и правых глаз
Результаты определения концентраций в глазных лизатах представлены в ниже в таблицах и на фиг. 7Г-7Д.




Обобщение результатов:
После интравитреального введения биспецифического антитела к VEGF/ANG2, предлагаемого в изобретении, такого как VEGF/ANG2-0016 (с IHH-AAA-мутацией), в глазных лизатах обнаружены его концентрации (через 96 и 168 ч), близкие к концентрациями биспецифического антитела к VEGF/ANG2 без IHH-AAA-мутации, такого как VEGF/ANG2-0015.
Кроме того, после интравитреального введения биспецифического антитела к VEGF/ANG2, предлагаемого в изобретении, такого как VEGF/ANG2-0016 (с IHH-AAA-мутацией), обнаружены также более быстрый клиренс и более короткое время полужизни в сыворотке по сравнению с биспецифическим антителом к VEGF/ANG2 без IHH-AAA-мутации, таким как VEGF/ANG2-0015.
Пример 7
Анализ ангиогенеза в микрокармане роговицы мышей
Для оценки антиангиогенного действия биспецифического антитела к VEGF/ANG2 с соответствующими связывающими VEGF VH и VL, имеющими последовательность SEQ ID NO: 20 и 21, и связывающими ANG2 VH и VL SEQ ID NO: 28 и 29 в отношении индуцируемого VEGF ангиогенеза in vivo осуществляли анализ ангиогенеза в роговице мышей. При осуществлении этого анализа насыщенный VEGF Nylaflo-диск имплантировали в карман из бессосудистой роговицы на фиксированном расстоянии от сосудов лимба. В ответ на создание градиента VEGF в роговице сразу начинался рост сосудов. Опыт проводили на самках мышей линии Balb/c возрастом 8-10 недель, которых покупали у фирмы Charles River, Сульцфельд, Германия. Протокол модифицировали согласно методу, описанному у Rogers M.S. и др., Nat. Protoc. 2, 2007, cc. 2545-2550. В целом, метод состоял в следующем: у анестезированных мышей создавали под микроскопом микрокарманы глубиной примерно 500 мкм на расстоянии примерно 1 мм от лимба до верхней части роговицы, используя хирургическое лезвие и острые пинцеты. Имплантировали диск (Nylaflo®, фирма Pall Corporation, шт. Мичиган) диаметром 0,6 мм и поверхность области имплантации выравнивали. Диски инкубировали в соответствующем факторе роста или наполнителе в течение по меньшей мере 30 мин. Через 3, 5 и 7 дней (или в другом варианте только после 3, 5 или 7 дней) глаза фотографировали и оценивали сосудистый ответ. Результаты анализа выражали количественно, рассчитывая процент области новых сосудов относительно общей площади роговицы.
Диски пропитывали 300 нг VEGF или ЗФР в качестве контроля и имплантировали на 7 дней. Выросты сосудов из лимба в диск оценивали в день 3, 5 и/или 7. За 1 день до имплантации диска внутривенно вводили антитела в дозе 10 мг/кг (благодаря тому, что при внутривенном применении стабильное в сыворотке антитело VEGF/ ANG22-0015 (без IHH-AAA-мутации), которое отличалось от VEGF ANG2-0016 только наличием IHH-ААА-мутации и имело такие же связывающие VEGF и ANG2 VH- и VL-области, опосредующие эффективность, его применяли в качестве заместителя указанного антитела) для тестирования антиангиогенного действия в отношении индуцированного VEGF ангиогенеза in vivo. Животных в контрольной группе обрабатывали наполнителем. Применяемый объем составлял 10 мл/кг.
Пример 8
Фармакокинетические (ФК) свойства антител с HHY-AAA-мутацией
ФК данные в отношении FcRn, полученные на мышах, трансгенных по человеческому FcRn
Фаза прижизненных исследований:
Опыт проводили на самках мышей C57BL/6J (фон); мышей с дефицитом FcRn, но гемизиготных трансгенных по человеческому FcRn (huFcRn, линия 276 -/tg).
Часть 1
Всем мышам инъецировали однократно интравитреально в правый глаз соответствующий раствор IGF-1R 0033, IGF-1R 0035, IGF-1R 0045 (т.е. 22,2 мкг соединения/на животное для IGF-1R 0033, 24,4 мкг соединения/на животное для IGF-1R 0035, 32,0 мкг соединения/на животное для IGF-1R и 32,0 мкг соединения/на животное для IGF-1R 0045).
Тринадцать мышей разделяли на 2 группы, соответственно 6 и 7 животных в каждой. Получали образцы крови у животных группы 1 через 2, 24 и 96 ч, а у животных группы 2 через 7, 48 и 168 ч после дозирования.
Осуществляли инъекцию в стекловидное тело правого глаза мышей с помощью включающей микрошприц системы NanoFil для нанолитровых инъекций фирмы World Precision Instruments, Inc., Берлин, Германия. Мышей анестезировали с помощью 2,5% изофлурана, и для визуализации глаза мышей применяли микроскоп Leica MZFL 3 с 40-кратным увеличением и источником кольцевого света Leica KL 2500 LCD. Затем 2 мкл соединения инъецировали с помощью иглы 35-размера.
Кровь собирали из ретробульбарного венозного сплетения контралатерального глаза каждого животного для определения уровней соединения в сыворотке.
Образцы сыворотки объемом по меньшей мере 50 мкл получали из крови после выдерживания в течение 1 ч при КТ путем центрифугирования (9300×g) при 4°С в течение 3 мин. Образцы сыворотки замораживали непосредственно после центрифугирования и хранили в замороженном состоянии при -80°С до анализа. Обработанные глаза животных из группы 1 выделяли через 96 ч после обработки, у животных из группы 2 - через 168 ч после обработки. Образцы хранили в замороженном состоянии при -80°С до анализа.
Часть 2:
Всем мышам инъецировали однократно внутривенно через хвостовую вену соответствующий раствор IGF-1R 0033, IGF-1R 0035, IGF-1R 0045 (т.е. 22,2 мкг соединения/на животное для IGF-1R 0033, 24,4 мкг соединения/на животное для IGF-1R 0035, 32,0 мкг соединения/на животное для IGF-1R и 32,0 мкг соединения/животное для IGF-1R 0045).
Двенадцать мышей подразделяли на 2 группы по 6 животных в каждой. Получали образцы крови у животных группы 1 через 1, 24 и 96 ч, а у животных группы 2 через 7, 48 и 168 ч после дозирования. Кровь собирали из ретробульбарного венозного сплетения каждого животного для определения уровней соединения в сыворотке.
Образцы сыворотки объемом по меньшей мере 50 мкл получали из крови после выдерживания в течение 1 ч при КТ путем центрифугирования (9300×g) при 4°С в течение 3 мин. Образцы сыворотки замораживали непосредственно после центрифугирования и хранили в замороженном состоянии при -80°С до анализа.
Приготовление буфера для лизиса клеток
Осторожно смешивали 100 мкл фактора 1, 50 мкл фактора 2 и 24,73 мл буфера для клеточного лизиса (все фирмы Bio-Rad, набор для лизиса клеток Bio-Plex, каталожный №171-304011) и добавляли 125 мкл раствора PMSF (174,4 мг фенилметилсульфонилфторида, разведенного в 2,0 мл ДМСО).
Получение лизатов всего глаза (мышей)
Лизаты глаз получали путем физико-химического расщепления всего глаза лабораторных животных. Для механического разрушения каждый глаз переносили в микропробирку с коническим дном объемом 1,5 мл. После замораживания и оттаивания глаза промывали однократно 1 мл промывочного буфера для клеток (фирма Bio-Rad, набор для лизиса клеток Bio-Plex, каталожный №171-304011). На следующей стадии добавляли 500 мкл свежеприготовленного буфера для лизиса клеток и глаза измельчали с помощью 1,5-миллилитрового пестика для измельчения тканей (фирма VWR Int., артикул №431-0098). Затем смесь 5 раз подвергали замораживанию и оттаиванию и вновь измельчали. Для отделения лизата от оставшейся ткани образцы центрифугировали в течение 4 мин при 4500×g. После центрифугирования супернатант собирали и хранили при -20°С для дополнительного анализа с помощью количественного ELISA.
Анализ (сыворотка)
Для количественной оценки антител в образцах сыворотки мышей осуществляли стандартный твердофазный серийный сэндвич-иммуноанализ с применением биотинилированного и дигоксигенированного моноклональных антител в качестве иммобилизованного («захватывающего») и идентифицирующего антител. На долю сыворотки приходилось примерно 50% от объема всего образца крови.
Более конкретно, метод состоял в следующем: концентрации антител в образцах сыворотки мышей определяли с использованием специфического для человеческого-IgG (Fab) твердофазного иммуноферментного анализа. Сенсибилизированные стрептавидином титрационные микропланшеты инкубировали с биотинилированным моноклональным антителом к человеческому Fab(каппа) M-1.7.10-IgG, которое применяли в качестве «захватывающего» антитела, разведенного в буфере для анализа, в течение 1 ч при комнатной температуре при перемешивании. После трехкратной промывки забуференным фосфатом физиологическим раствором, дополненным полисорбатом 20 (Твин 20), добавляли различные разведения образцов сыворотки с последующей второй инкубацией в течение 1 ч при комнатной температуре. После трех повторяющихся промывок связанное антитело выявляли путем последующей инкубации с моноклональным антителом к человеческому Fab(CH1) М-1.19.31-IgG, конъюгированному с дигоксигенином, а затем с антителом к дигоксигенину, конъюгированному с пероксидазой из хрена (HRP). ABTS (2,2'-азинобис(3-этилбензотиазолин-6-сульфоновая кислота); фирма Roche Diagnostics GmbH, Мангейм, Германия) применяли в качестве субстрата для HRP для осуществления реакции, в результате которой образуется окрашенный продукт. Абсорбцию образовавшегося реакционного продукта определяли при 405 нм (ABTS; длина референс-волны: 490 нм).
Все образцы и образцы, представляющие собой положительные и отрицательные контроли, анализировали с использованием повторностей и калибровали относительно применяемого в качестве стандарта антитела.
Анализ (лизат глаза)
Концентрации аналитов в образцах лизатов глаз мышей определяли с помощью пригодного электрохемилюминисцентного иммуноанализа (ECLIA), основой которого служила инструментальная платформа ELECSYS® (фирма Roche Diagnostics GmbH, Мангейм, Германия) в условиях, не соответствующих GLP (свод международных требований к лабораторным исследованиям).
Неразведенный супернатант (лизаты глаз) инкубировали с «захватывающими» и идентифицирующими молекулами в течение 9 мин при 37°С. Биотинилированное моноклональное антитело к человеческому Fab(каппа) M-1.7.10-IgG применяли в качестве «захватывающей» молекулы, а меченное рутений(II)три(биспиридилом)32+ моноклональное антитело к человеческому Fab(CH1) М-1.19.31-IgG применяли для идентификации. Добавляли сенсибилизированные стрептавидином магнитные микрочастицы и инкубировали в течение еще 9 мин при 37°С, давая связаться предварительно образованным иммунным комплексам благодаря взаимодействиям биотин-стрептавидин. Микрочастицы «захватывались» посредством магнитного взаимодействия на электроде и генерировали хемилюминисцентный сигнал с использованием кореактанта трипропиламина (TPA). Собранные сигналы измеряли с помощью детектора-фотоумножителя.
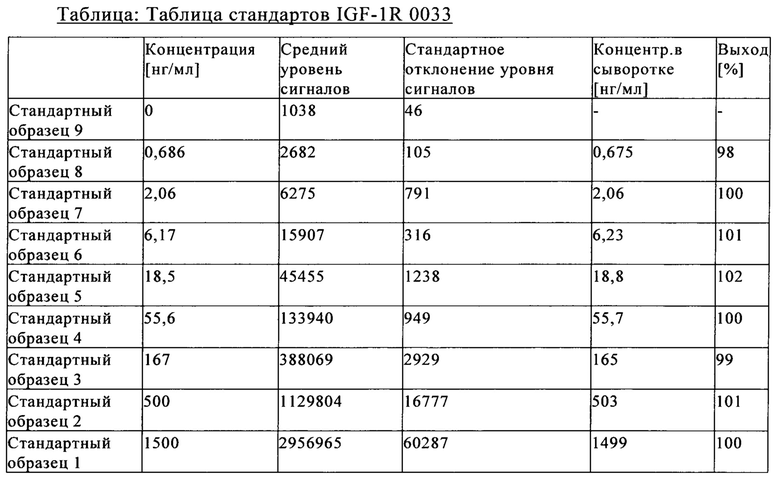

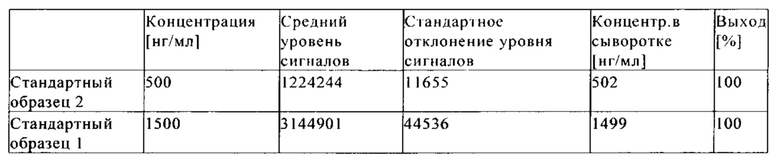
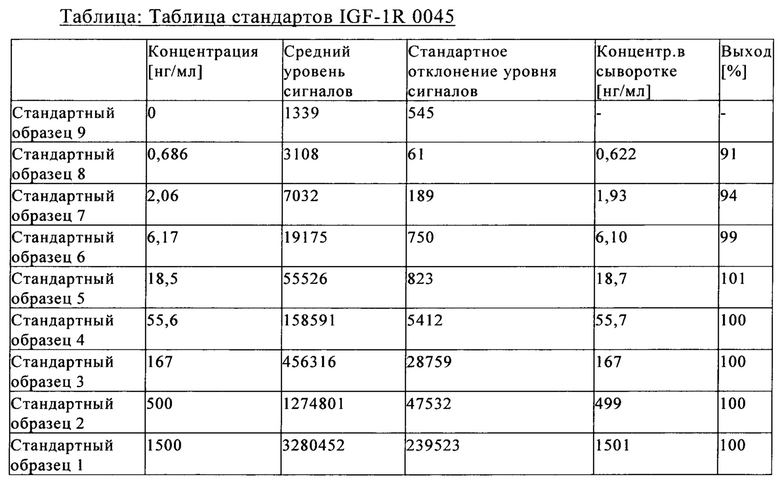
Результаты:
А) Концентрации в сыворотке
Данные о концентрациях в сыворотке представлены в приведенных ниже таблицах и на фиг. 17.
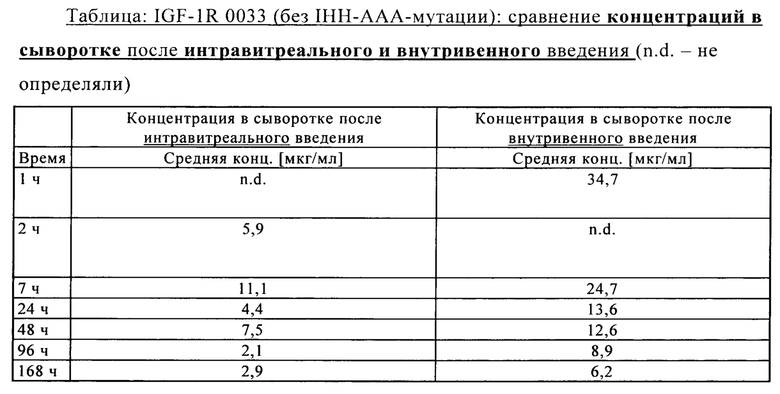
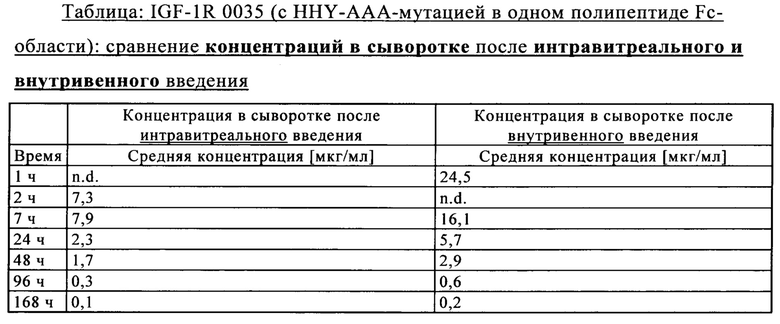
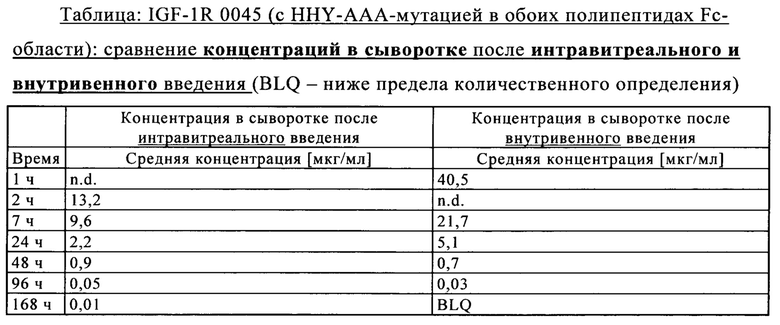
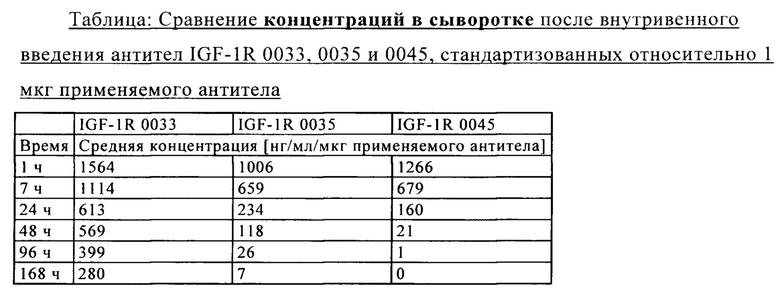
Результаты:
Б) Концентрации в глазных лизатах левых и правых глаз
Результаты определения концентраций в глазных лизатах представлены в ниже в таблицах и на фиг. 18-20.






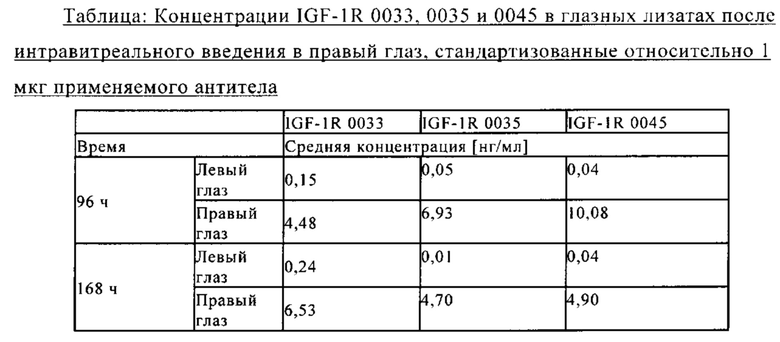
Обобщение результатов
После интравитреального введения антител к IGF-1R 0035 и 0045, указанных в настоящем описании (с односторонней или двухсторонней HHY-ААА-мутацией), обнаружены сходные концентрации (через 96 и 168 ч) в глазных лизатах по сравнению с антителом к IGF-1R без HHY-AAA-мутации (IGF-1R 0033).
Кроме того, после интравитреального введения антител к IGF-1R 0035 и 0045, указанных в настоящем описании (с односторонней или двухсторонней HHY-AAA-мутацией), обнаружен более быстрый клиренс и более короткое время полужизни в сыворотке по сравнению с антителом к IGF-1R без HHY-AAA-мутации (IGF-1R 0033).
Хотя выше описаны некоторые детали изобретения, приведенные с целью иллюстрации и примера для простоты понимания, описание и примеры не должны рассматриваться как ограничивающие объем изобретения. Описание всей процитированной патентной и научной литературы специально полностью включены в настоящее описание в качестве ссылки.
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> Ф. Хоффманн-Ля Рош АГ
<120> Варианты Fс-области с модифицированной способностью связываться
с FCRn и с сохраненной способностью связываться с белком А
<130> 31953
<150> EP14151320.0
<151> 2014-01-15
<150> EP14165923.5
<151> 2014-04-25
<160> 112
<170> PatentIn, версия 3.5
<210> 1
<211> 448
<212> PRT
<213> Homo sapiens
<400> 1
Gln Val Glu Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Arg
1 5 10 15
Ser Gln Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Gly Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Ile Ile Trp Phe Asp Gly Ser Ser Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Arg Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Phe Cys
85 90 95
Ala Arg Glu Leu Gly Arg Arg Tyr Phe Asp Leu Trp Gly Arg Gly Thr
100 105 110
Leu Val Ser Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro
115 120 125
Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly
130 135 140
Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn
145 150 155 160
Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln
165 170 175
Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser
180 185 190
Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser
195 200 205
Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys Thr
210 215 220
His Thr Cys Pro Pro Cys Pro Ala Pro Glu Ala Ala Gly Gly Pro Ser
225 230 235 240
Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg
245 250 255
Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro
260 265 270
Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala
275 280 285
Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val
290 295 300
Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr
305 310 315 320
Lys Cys Lys Val Ser Asn Lys Ala Leu Gly Ala Pro Ile Glu Lys Thr
325 330 335
Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu
340 345 350
Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Thr Cys
355 360 365
Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser
370 375 380
Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp
385 390 395 400
Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser
405 410 415
Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala
420 425 430
Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
435 440 445
<210> 2
<211> 448
<212> PRT
<213> Homo sapiens
<400> 2
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Gly Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Met
35 40 45
Ala Ile Ile Trp Phe Asp Gly Ser Ser Lys Tyr Tyr Gly Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Asp Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Glu Leu Gly Arg Arg Tyr Phe Asp Leu Trp Gly Arg Gly Thr
100 105 110
Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro
115 120 125
Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly
130 135 140
Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn
145 150 155 160
Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln
165 170 175
Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser
180 185 190
Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser
195 200 205
Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys Thr
210 215 220
His Thr Cys Pro Pro Cys Pro Ala Pro Glu Ala Ala Gly Gly Pro Ser
225 230 235 240
Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg
245 250 255
Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro
260 265 270
Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala
275 280 285
Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val
290 295 300
Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr
305 310 315 320
Lys Cys Lys Val Ser Asn Lys Ala Leu Gly Ala Pro Ile Glu Lys Thr
325 330 335
Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu
340 345 350
Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Thr Cys
355 360 365
Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser
370 375 380
Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp
385 390 395 400
Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser
405 410 415
Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala
420 425 430
Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
435 440 445
<210> 3
<211> 215
<212> PRT
<213> Homo sapiens
<400> 3
Glu Ile Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Ser Ser Tyr
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Asp Ala Ser Lys Arg Ala Thr Gly Ile Pro Ala Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Glu Pro
65 70 75 80
Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Arg Ser Lys Trp Pro Pro
85 90 95
Trp Thr Phe Gly Gln Gly Thr Lys Val Glu Ser Lys Arg Thr Val Ala
100 105 110
Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser
115 120 125
Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu
130 135 140
Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser
145 150 155 160
Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu
165 170 175
Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val
180 185 190
Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys
195 200 205
Ser Phe Asn Arg Gly Glu Cys
210 215
<210> 4
<211> 215
<212> PRT
<213> Homo sapiens
<400> 4
Glu Ile Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Ser Ser Tyr
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Asp Ala Ser Asn Arg Ala Thr Gly Ile Pro Ala Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Glu Pro
65 70 75 80
Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Arg Ser Lys Trp Pro Pro
85 90 95
Trp Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Arg Thr Val Ala
100 105 110
Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser
115 120 125
Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu
130 135 140
Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser
145 150 155 160
Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu
165 170 175
Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val
180 185 190
Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys
195 200 205
Ser Phe Asn Arg Gly Glu Cys
210 215
<210> 5
<211> 118
<212> PRT
<213> Homo sapiens
<400> 5
Gln Val Glu Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Arg
1 5 10 15
Ser Gln Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Gly Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Ile Ile Trp Phe Asp Gly Ser Ser Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Arg Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Phe Cys
85 90 95
Ala Arg Glu Leu Gly Arg Arg Tyr Phe Asp Leu Trp Gly Arg Gly Thr
100 105 110
Leu Val Ser Val Ser Ser
115
<210> 6
<211> 118
<212> PRT
<213> Homo sapiens
<400> 6
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Gly Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Met
35 40 45
Ala Ile Ile Trp Phe Asp Gly Ser Ser Lys Tyr Tyr Gly Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Asp Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Glu Leu Gly Arg Arg Tyr Phe Asp Leu Trp Gly Arg Gly Thr
100 105 110
Leu Val Thr Val Ser Ser
115
<210> 7
<211> 108
<212> PRT
<213> Homo sapiens
<400> 7
Glu Ile Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Ser Ser Tyr
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Asp Ala Ser Lys Arg Ala Thr Gly Ile Pro Ala Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Glu Pro
65 70 75 80
Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Arg Ser Lys Trp Pro Pro
85 90 95
Trp Thr Phe Gly Gln Gly Thr Lys Val Glu Ser Lys
100 105
<210> 8
<211> 108
<212> PRT
<213> Homo sapiens
<400> 8
Glu Ile Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Ser Ser Tyr
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Asp Ala Ser Asn Arg Ala Thr Gly Ile Pro Ala Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Glu Pro
65 70 75 80
Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Arg Ser Lys Trp Pro Pro
85 90 95
Trp Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 9
<211> 107
<212> PRT
<213> Homo sapiens
<400> 9
Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys
1 5 10 15
Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val
20 25 30
Trp Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val
35 40 45
Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln
50 55 60
Glu Ser Thr Tyr Arg Trp Ser Val Leu Thr Val Leu His Gln Asp Trp
65 70 75 80
Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro
85 90 95
Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys
100 105
<210> 10
<211> 106
<212> PRT
<213> Homo sapiens
<400> 10
Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Asp
1 5 10 15
Glu Leu Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe
20 25 30
Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu
35 40 45
Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe
50 55 60
Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly
65 70 75 80
Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr
85 90 95
Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly
100 105
<210> 11
<211> 1337
<212> PRT
<213> Homo sapiens
<400> 11
Glu Ile Cys Gly Pro Gly Ile Asp Ile Arg Asn Asp Tyr Gln Gln Leu
1 5 10 15
Lys Arg Leu Glu Asn Cys Thr Val Ile Glu Gly Tyr Leu His Ile Leu
20 25 30
Leu Ile Ser Lys Ala Glu Asp Tyr Arg Ser Tyr Arg Phe Pro Lys Leu
35 40 45
Thr Val Ile Thr Glu Tyr Leu Leu Leu Phe Arg Val Ala Gly Leu Glu
50 55 60
Ser Leu Gly Asp Leu Phe Pro Asn Leu Thr Val Ile Arg Gly Trp Lys
65 70 75 80
Leu Phe Tyr Asn Tyr Ala Leu Val Ile Phe Glu Met Thr Asn Leu Lys
85 90 95
Asp Ile Gly Leu Tyr Asn Leu Arg Asn Ile Thr Arg Gly Ala Ile Arg
100 105 110
Ile Glu Lys Asn Ala Asp Leu Cys Tyr Leu Ser Thr Val Asp Trp Ser
115 120 125
Leu Ile Leu Asp Ala Val Ser Asn Asn Tyr Ile Val Gly Asn Lys Pro
130 135 140
Pro Lys Glu Cys Gly Asp Leu Cys Pro Gly Thr Met Glu Glu Lys Pro
145 150 155 160
Met Cys Glu Lys Thr Thr Ile Asn Asn Glu Tyr Asn Tyr Arg Cys Trp
165 170 175
Thr Thr Asn Arg Cys Gln Lys Met Cys Pro Ser Thr Cys Gly Lys Arg
180 185 190
Ala Cys Thr Glu Asn Asn Glu Cys Cys His Pro Glu Cys Leu Gly Ser
195 200 205
Cys Ser Ala Pro Asp Asn Asp Thr Ala Cys Val Ala Cys Arg His Tyr
210 215 220
Tyr Tyr Ala Gly Val Cys Val Pro Ala Cys Pro Pro Asn Thr Tyr Arg
225 230 235 240
Phe Glu Gly Trp Arg Cys Val Asp Arg Asp Phe Cys Ala Asn Ile Leu
245 250 255
Ser Ala Glu Ser Ser Asp Ser Glu Gly Phe Val Ile His Asp Gly Glu
260 265 270
Cys Met Gln Glu Cys Pro Ser Gly Phe Ile Arg Asn Gly Ser Gln Ser
275 280 285
Met Tyr Cys Ile Pro Cys Glu Gly Pro Cys Pro Lys Val Cys Glu Glu
290 295 300
Glu Lys Lys Thr Lys Thr Ile Asp Ser Val Thr Ser Ala Gln Met Leu
305 310 315 320
Gln Gly Cys Thr Ile Phe Lys Gly Asn Leu Leu Ile Asn Ile Arg Arg
325 330 335
Gly Asn Asn Ile Ala Ser Glu Leu Glu Asn Phe Met Gly Leu Ile Glu
340 345 350
Val Val Thr Gly Tyr Val Lys Ile Arg His Ser His Ala Leu Val Ser
355 360 365
Leu Ser Phe Leu Lys Asn Leu Arg Leu Ile Leu Gly Glu Glu Gln Leu
370 375 380
Glu Gly Asn Tyr Ser Phe Tyr Val Leu Asp Asn Gln Asn Leu Gln Gln
385 390 395 400
Leu Trp Asp Trp Asp His Arg Asn Leu Thr Ile Lys Ala Gly Lys Met
405 410 415
Tyr Phe Ala Phe Asn Pro Lys Leu Cys Val Ser Glu Ile Tyr Arg Met
420 425 430
Glu Glu Val Thr Gly Thr Lys Gly Arg Gln Ser Lys Gly Asp Ile Asn
435 440 445
Thr Arg Asn Asn Gly Glu Arg Ala Ser Cys Glu Ser Asp Val Leu His
450 455 460
Phe Thr Ser Thr Thr Thr Ser Lys Asn Arg Ile Ile Ile Thr Trp His
465 470 475 480
Arg Tyr Arg Pro Pro Asp Tyr Arg Asp Leu Ile Ser Phe Thr Val Tyr
485 490 495
Tyr Lys Glu Ala Pro Phe Lys Asn Val Thr Glu Tyr Asp Gly Gln Asp
500 505 510
Ala Cys Gly Ser Asn Ser Trp Asn Met Val Asp Val Asp Leu Pro Pro
515 520 525
Asn Lys Asp Val Glu Pro Gly Ile Leu Leu His Gly Leu Lys Pro Trp
530 535 540
Thr Gln Tyr Ala Val Tyr Val Lys Ala Val Thr Leu Thr Met Val Glu
545 550 555 560
Asn Asp His Ile Arg Gly Ala Lys Ser Glu Ile Leu Tyr Ile Arg Thr
565 570 575
Asn Ala Ser Val Pro Ser Ile Pro Leu Asp Val Leu Ser Ala Ser Asn
580 585 590
Ser Ser Ser Gln Leu Ile Val Lys Trp Asn Pro Pro Ser Leu Pro Asn
595 600 605
Gly Asn Leu Ser Tyr Tyr Ile Val Arg Trp Gln Arg Gln Pro Gln Asp
610 615 620
Gly Tyr Leu Tyr Arg His Asn Tyr Cys Ser Lys Asp Lys Ile Pro Ile
625 630 635 640
Arg Lys Tyr Ala Asp Gly Thr Ile Asp Ile Glu Glu Val Thr Glu Asn
645 650 655
Pro Lys Thr Glu Val Cys Gly Gly Glu Lys Gly Pro Cys Cys Ala Cys
660 665 670
Pro Lys Thr Glu Ala Glu Lys Gln Ala Glu Lys Glu Glu Ala Glu Tyr
675 680 685
Arg Lys Val Phe Glu Asn Phe Leu His Asn Ser Ile Phe Val Pro Arg
690 695 700
Pro Glu Arg Lys Arg Arg Asp Val Met Gln Val Ala Asn Thr Thr Met
705 710 715 720
Ser Ser Arg Ser Arg Asn Thr Thr Ala Ala Asp Thr Tyr Asn Ile Thr
725 730 735
Asp Pro Glu Glu Leu Glu Thr Glu Tyr Pro Phe Phe Glu Ser Arg Val
740 745 750
Asp Asn Lys Glu Arg Thr Val Ile Ser Asn Leu Arg Pro Phe Thr Leu
755 760 765
Tyr Arg Ile Asp Ile His Ser Cys Asn His Glu Ala Glu Lys Leu Gly
770 775 780
Cys Ser Ala Ser Asn Phe Val Phe Ala Arg Thr Met Pro Ala Glu Gly
785 790 795 800
Ala Asp Asp Ile Pro Gly Pro Val Thr Trp Glu Pro Arg Pro Glu Asn
805 810 815
Ser Ile Phe Leu Lys Trp Pro Glu Pro Glu Asn Pro Asn Gly Leu Ile
820 825 830
Leu Met Tyr Glu Ile Lys Tyr Gly Ser Gln Val Glu Asp Gln Arg Glu
835 840 845
Cys Val Ser Arg Gln Glu Tyr Arg Lys Tyr Gly Gly Ala Lys Leu Asn
850 855 860
Arg Leu Asn Pro Gly Asn Tyr Thr Ala Arg Ile Gln Ala Thr Ser Leu
865 870 875 880
Ser Gly Asn Gly Ser Trp Thr Asp Pro Val Phe Phe Tyr Val Gln Ala
885 890 895
Lys Thr Gly Tyr Glu Asn Phe Ile His Leu Ile Ile Ala Leu Pro Val
900 905 910
Ala Val Leu Leu Ile Val Gly Gly Leu Val Ile Met Leu Tyr Val Phe
915 920 925
His Arg Lys Arg Asn Asn Ser Arg Leu Gly Asn Gly Val Leu Tyr Ala
930 935 940
Ser Val Asn Pro Glu Tyr Phe Ser Ala Ala Asp Val Tyr Val Pro Asp
945 950 955 960
Glu Trp Glu Val Ala Arg Glu Lys Ile Thr Met Ser Arg Glu Leu Gly
965 970 975
Gln Gly Ser Phe Gly Met Val Tyr Glu Gly Val Ala Lys Gly Val Val
980 985 990
Lys Asp Glu Pro Glu Thr Arg Val Ala Ile Lys Thr Val Asn Glu Ala
995 1000 1005
Ala Ser Met Arg Glu Arg Ile Glu Phe Leu Asn Glu Ala Ser Val
1010 1015 1020
Met Lys Glu Phe Asn Cys His His Val Val Arg Leu Leu Gly Val
1025 1030 1035
Val Ser Gln Gly Gln Pro Thr Leu Val Ile Met Glu Leu Met Thr
1040 1045 1050
Arg Gly Asp Leu Lys Ser Tyr Leu Arg Ser Leu Arg Pro Glu Met
1055 1060 1065
Glu Asn Asn Pro Val Leu Ala Pro Pro Ser Leu Ser Lys Met Ile
1070 1075 1080
Gln Met Ala Gly Glu Ile Ala Asp Gly Met Ala Tyr Leu Asn Ala
1085 1090 1095
Asn Lys Phe Val His Arg Asp Leu Ala Ala Arg Asn Cys Met Val
1100 1105 1110
Ala Glu Asp Phe Thr Val Lys Ile Gly Asp Phe Gly Met Thr Arg
1115 1120 1125
Asp Ile Tyr Glu Thr Asp Tyr Tyr Arg Lys Gly Gly Lys Gly Leu
1130 1135 1140
Leu Pro Val Arg Trp Met Ser Pro Glu Ser Leu Lys Asp Gly Val
1145 1150 1155
Phe Thr Thr Tyr Ser Asp Val Trp Ser Phe Gly Val Val Leu Trp
1160 1165 1170
Glu Ile Ala Thr Leu Ala Glu Gln Pro Tyr Gln Gly Leu Ser Asn
1175 1180 1185
Glu Gln Val Leu Arg Phe Val Met Glu Gly Gly Leu Leu Asp Lys
1190 1195 1200
Pro Asp Asn Cys Pro Asp Met Leu Phe Glu Leu Met Arg Met Cys
1205 1210 1215
Trp Gln Tyr Asn Pro Lys Met Arg Pro Ser Phe Leu Glu Ile Ile
1220 1225 1230
Ser Ser Ile Lys Glu Glu Met Glu Pro Gly Phe Arg Glu Val Ser
1235 1240 1245
Phe Tyr Tyr Ser Glu Glu Asn Lys Leu Pro Glu Pro Glu Glu Leu
1250 1255 1260
Asp Leu Glu Pro Glu Asn Met Glu Ser Val Pro Leu Asp Pro Ser
1265 1270 1275
Ala Ser Ser Ser Ser Leu Pro Leu Pro Asp Arg His Ser Gly His
1280 1285 1290
Lys Ala Glu Asn Gly Pro Gly Pro Gly Val Leu Val Leu Arg Ala
1295 1300 1305
Ser Phe Asp Glu Arg Gln Pro Tyr Ala His Met Asn Gly Gly Arg
1310 1315 1320
Lys Asn Glu Arg Ala Leu Pro Leu Pro Gln Ser Ser Thr Cys
1325 1330 1335
<210> 12
<211> 330
<212> PRT
<213> Homo sapiens
<400> 12
Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys
1 5 10 15
Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr
20 25 30
Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser
35 40 45
Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser
50 55 60
Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr
65 70 75 80
Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys
85 90 95
Lys Val Glu Pro Lys Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys
100 105 110
Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro
115 120 125
Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys
130 135 140
Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp
145 150 155 160
Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu
165 170 175
Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu
180 185 190
His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn
195 200 205
Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly
210 215 220
Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Asp Glu
225 230 235 240
Leu Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr
245 250 255
Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn
260 265 270
Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe
275 280 285
Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn
290 295 300
Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr
305 310 315 320
Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
325 330
<210> 13
<211> 327
<212> PRT
<213> Homo sapiens
<400> 13
Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Cys Ser Arg
1 5 10 15
Ser Thr Ser Glu Ser Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr
20 25 30
Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser
35 40 45
Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser
50 55 60
Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Lys Thr
65 70 75 80
Tyr Thr Cys Asn Val Asp His Lys Pro Ser Asn Thr Lys Val Asp Lys
85 90 95
Arg Val Glu Ser Lys Tyr Gly Pro Pro Cys Pro Ser Cys Pro Ala Pro
100 105 110
Glu Phe Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys
115 120 125
Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val
130 135 140
Asp Val Ser Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp
145 150 155 160
Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe
165 170 175
Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp
180 185 190
Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu
195 200 205
Pro Ser Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg
210 215 220
Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met Thr Lys
225 230 235 240
Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp
245 250 255
Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys
260 265 270
Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser
275 280 285
Arg Leu Thr Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val Phe Ser
290 295 300
Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser
305 310 315 320
Leu Ser Leu Ser Leu Gly Lys
325
<210> 14
<211> 14
<212> PRT
<213> Искусственная
<220>
<223> CDR3H тяжелой цепи, <VEGF>ранибизумаб
<400> 14
Tyr Pro Tyr Tyr Tyr Gly Thr Ser His Trp Tyr Phe Asp Val
1 5 10
<210> 15
<211> 17
<212> PRT
<213> Искусственная
<220>
<223> CDR2H тяжелой цепи, <VEGF>ранибизумаб
<400> 15
Trp Ile Asn Thr Tyr Thr Gly Glu Pro Thr Tyr Ala Ala Asp Phe Lys
1 5 10 15
Arg
<210> 16
<211> 5
<212> PRT
<213> Искусственная
<220>
<223> CDR1H тяжелой цепи, <VEGF>ранибизумаб
<400> 16
His Tyr Gly Met Asn
1 5
<210> 17
<211> 9
<212> PRT
<213> Искусственная
<220>
<223> CDR3L легкой цепи, <VEGF>ранибизумаб
<400> 17
Gln Gln Tyr Ser Thr Val Pro Trp Thr
1 5
<210> 18
<211> 7
<212> PRT
<213> Искусственная
<220>
<223> CDR2L легкой цепи, <VEGF>ранибизумаб
<400> 18
Phe Thr Ser Ser Leu His Ser
1 5
<210> 19
<211> 11
<212> PRT
<213> Искусственная
<220>
<223> CDR1L легкой цепи, <VEGF>ранибизумаб
<400> 19
Ser Ala Ser Gln Asp Ile Ser Asn Tyr Leu Asn
1 5 10
<210> 20
<211> 123
<212> PRT
<213> Искусственная
<220>
<223> вариабельный домен тяжелой цепи VH, <VEGF>ранибизумаб
<400> 20
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Tyr Asp Phe Thr His Tyr
20 25 30
Gly Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Gly Trp Ile Asn Thr Tyr Thr Gly Glu Pro Thr Tyr Ala Ala Asp Phe
50 55 60
Lys Arg Arg Phe Thr Phe Ser Leu Asp Thr Ser Lys Ser Thr Ala Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Lys Tyr Pro Tyr Tyr Tyr Gly Thr Ser His Trp Tyr Phe Asp Val
100 105 110
Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 21
<211> 107
<212> PRT
<213> Искусственная
<220>
<223> вариабельный домен легкой цепи VL, <VEGF>ранибизумаб
<400> 21
Asp Ile Gln Leu Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Ser Ala Ser Gln Asp Ile Ser Asn Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Val Leu Ile
35 40 45
Tyr Phe Thr Ser Ser Leu His Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Tyr Ser Thr Val Pro Trp
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 22
<211> 20
<212> PRT
<213> Искусственная
<220>
<223> CDR3H тяжелой цепи, <ANG-2>, вариант Ang2i_LC10
<400> 22
Ser Pro Asn Pro Tyr Tyr Tyr Asp Ser Ser Gly Tyr Tyr Tyr Pro Gly
1 5 10 15
Ala Phe Asp Ile
20
<210> 23
<211> 17
<212> PRT
<213> Искусственная
<220>
<223> CDR2H тяжелой цепи, <ANG-2>, вариант Ang2i_LC10
<400> 23
Trp Ile Asn Pro Asn Ser Gly Gly Thr Asn Tyr Ala Gln Lys Phe Gln
1 5 10 15
Gly
<210> 24
<211> 5
<212> PRT
<213> Искусственная
<220>
<223> CDR31 тяжелой цепи, <ANG-2>, вариант Ang2i_LC10
<400> 24
Gly Tyr Tyr Met His
1 5
<210> 25
<211> 11
<212> PRT
<213> Искусственная
<220>
<223> CDR3L легкой цепи, <ANG-2>, вариант Ang2i_LC10
<400> 25
Gln Val Trp Asp Ser Ser Ser Asp His Trp Val
1 5 10
<210> 26
<211> 7
<212> PRT
<213> Искусственная
<220>
<223> CDR2L легкой цепи, <ANG-2>, вариант Ang2i_LC10
<400> 26
Asp Asp Ser Asp Arg Pro Ser
1 5
<210> 27
<211> 11
<212> PRT
<213> Искусственная
<220>
<223> CDR1L легкой цепи, <ANG-2>, вариант Ang2i_LC10
<400> 27
Gly Gly Asn Asn Ile Gly Ser Lys Ser Val His
1 5 10
<210> 28
<211> 129
<212> PRT
<213> Искусственная
<220>
<223> вариабельный домен тяжелой цепи, <ANG-2>, вариант Ang2i_LC10
<400> 28
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Gly Tyr
20 25 30
Tyr Met His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Trp Ile Asn Pro Asn Ser Gly Gly Thr Asn Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Met Thr Arg Asp Thr Ser Ile Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Arg Leu Arg Ser Asp Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Ser Pro Asn Pro Tyr Tyr Tyr Asp Ser Ser Gly Tyr Tyr Tyr
100 105 110
Pro Gly Ala Phe Asp Ile Trp Gly Gln Gly Thr Met Val Thr Val Ser
115 120 125
Ser
<210> 29
<211> 110
<212> PRT
<213> Искусственная
<220>
<223> вариабельный домен легкой цепи VL, <ANG-2>, вариант Ang2i_LC10
<400> 29
Ser Tyr Val Leu Thr Gln Pro Pro Ser Val Ser Val Ala Pro Gly Gln
1 5 10 15
Thr Ala Arg Ile Thr Cys Gly Gly Asn Asn Ile Gly Ser Lys Ser Val
20 25 30
His Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Val Leu Val Val Tyr
35 40 45
Asp Asp Ser Asp Arg Pro Ser Gly Ile Pro Glu Arg Phe Ser Gly Ser
50 55 60
Asn Ser Gly Asn Thr Ala Thr Leu Thr Ile Ser Arg Val Glu Ala Gly
65 70 75 80
Asp Glu Ala Asp Tyr Tyr Cys Gln Val Trp Asp Ser Ser Ser Asp His
85 90 95
Trp Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu Gly Gln
100 105 110
<210> 30
<211> 191
<212> PRT
<213> Homo sapiens
<400> 30
Met Asn Phe Leu Leu Ser Trp Val His Trp Ser Leu Ala Leu Leu Leu
1 5 10 15
Tyr Leu His His Ala Lys Trp Ser Gln Ala Ala Pro Met Ala Glu Gly
20 25 30
Gly Gly Gln Asn His His Glu Val Val Lys Phe Met Asp Val Tyr Gln
35 40 45
Arg Ser Tyr Cys His Pro Ile Glu Thr Leu Val Asp Ile Phe Gln Glu
50 55 60
Tyr Pro Asp Glu Ile Glu Tyr Ile Phe Lys Pro Ser Cys Val Pro Leu
65 70 75 80
Met Arg Cys Gly Gly Cys Cys Asn Asp Glu Gly Leu Glu Cys Val Pro
85 90 95
Thr Glu Glu Ser Asn Ile Thr Met Gln Ile Met Arg Ile Lys Pro His
100 105 110
Gln Gly Gln His Ile Gly Glu Met Ser Phe Leu Gln His Asn Lys Cys
115 120 125
Glu Cys Arg Pro Lys Lys Asp Arg Ala Arg Gln Glu Asn Pro Cys Gly
130 135 140
Pro Cys Ser Glu Arg Arg Lys His Leu Phe Val Gln Asp Pro Gln Thr
145 150 155 160
Cys Lys Cys Ser Cys Lys Asn Thr Asp Ser Arg Cys Lys Ala Arg Gln
165 170 175
Leu Glu Leu Asn Glu Arg Thr Cys Arg Cys Asp Lys Pro Arg Arg
180 185 190
<210> 31
<211> 496
<212> PRT
<213> Homo sapiens
<400> 31
Met Trp Gln Ile Val Phe Phe Thr Leu Ser Cys Asp Leu Val Leu Ala
1 5 10 15
Ala Ala Tyr Asn Asn Phe Arg Lys Ser Met Asp Ser Ile Gly Lys Lys
20 25 30
Gln Tyr Gln Val Gln His Gly Ser Cys Ser Tyr Thr Phe Leu Leu Pro
35 40 45
Glu Met Asp Asn Cys Arg Ser Ser Ser Ser Pro Tyr Val Ser Asn Ala
50 55 60
Val Gln Arg Asp Ala Pro Leu Glu Tyr Asp Asp Ser Val Gln Arg Leu
65 70 75 80
Gln Val Leu Glu Asn Ile Met Glu Asn Asn Thr Gln Trp Leu Met Lys
85 90 95
Leu Glu Asn Tyr Ile Gln Asp Asn Met Lys Lys Glu Met Val Glu Ile
100 105 110
Gln Gln Asn Ala Val Gln Asn Gln Thr Ala Val Met Ile Glu Ile Gly
115 120 125
Thr Asn Leu Leu Asn Gln Thr Ala Glu Gln Thr Arg Lys Leu Thr Asp
130 135 140
Val Glu Ala Gln Val Leu Asn Gln Thr Thr Arg Leu Glu Leu Gln Leu
145 150 155 160
Leu Glu His Ser Leu Ser Thr Asn Lys Leu Glu Lys Gln Ile Leu Asp
165 170 175
Gln Thr Ser Glu Ile Asn Lys Leu Gln Asp Lys Asn Ser Phe Leu Glu
180 185 190
Lys Lys Val Leu Ala Met Glu Asp Lys His Ile Ile Gln Leu Gln Ser
195 200 205
Ile Lys Glu Glu Lys Asp Gln Leu Gln Val Leu Val Ser Lys Gln Asn
210 215 220
Ser Ile Ile Glu Glu Leu Glu Lys Lys Ile Val Thr Ala Thr Val Asn
225 230 235 240
Asn Ser Val Leu Gln Lys Gln Gln His Asp Leu Met Glu Thr Val Asn
245 250 255
Asn Leu Leu Thr Met Met Ser Thr Ser Asn Ser Ala Lys Asp Pro Thr
260 265 270
Val Ala Lys Glu Glu Gln Ile Ser Phe Arg Asp Cys Ala Glu Val Phe
275 280 285
Lys Ser Gly His Thr Thr Asn Gly Ile Tyr Thr Leu Thr Phe Pro Asn
290 295 300
Ser Thr Glu Glu Ile Lys Ala Tyr Cys Asp Met Glu Ala Gly Gly Gly
305 310 315 320
Gly Trp Thr Ile Ile Gln Arg Arg Glu Asp Gly Ser Val Asp Phe Gln
325 330 335
Arg Thr Trp Lys Glu Tyr Lys Val Gly Phe Gly Asn Pro Ser Gly Glu
340 345 350
Tyr Trp Leu Gly Asn Glu Phe Val Ser Gln Leu Thr Asn Gln Gln Arg
355 360 365
Tyr Val Leu Lys Ile His Leu Lys Asp Trp Glu Gly Asn Glu Ala Tyr
370 375 380
Ser Leu Tyr Glu His Phe Tyr Leu Ser Ser Glu Glu Leu Asn Tyr Arg
385 390 395 400
Ile His Leu Lys Gly Leu Thr Gly Thr Ala Gly Lys Ile Ser Ser Ile
405 410 415
Ser Gln Pro Gly Asn Asp Phe Ser Thr Lys Asp Gly Asp Asn Asp Lys
420 425 430
Cys Ile Cys Lys Cys Ser Gln Met Leu Thr Gly Gly Trp Trp Phe Asp
435 440 445
Ala Cys Gly Pro Ser Asn Leu Asn Gly Met Tyr Tyr Pro Gln Arg Gln
450 455 460
Asn Thr Asn Lys Phe Asn Gly Ile Lys Trp Tyr Tyr Trp Lys Gly Ser
465 470 475 480
Gly Tyr Ser Leu Lys Ala Thr Thr Met Met Ile Arg Pro Ala Asp Phe
485 490 495
<210> 32
<211> 498
<212> PRT
<213> Homo sapiens
<400> 32
Met Thr Val Phe Leu Ser Phe Ala Phe Leu Ala Ala Ile Leu Thr His
1 5 10 15
Ile Gly Cys Ser Asn Gln Arg Arg Ser Pro Glu Asn Ser Gly Arg Arg
20 25 30
Tyr Asn Arg Ile Gln His Gly Gln Cys Ala Tyr Thr Phe Ile Leu Pro
35 40 45
Glu His Asp Gly Asn Cys Arg Glu Ser Thr Thr Asp Gln Tyr Asn Thr
50 55 60
Asn Ala Leu Gln Arg Asp Ala Pro His Val Glu Pro Asp Phe Ser Ser
65 70 75 80
Gln Lys Leu Gln His Leu Glu His Val Met Glu Asn Tyr Thr Gln Trp
85 90 95
Leu Gln Lys Leu Glu Asn Tyr Ile Val Glu Asn Met Lys Ser Glu Met
100 105 110
Ala Gln Ile Gln Gln Asn Ala Val Gln Asn His Thr Ala Thr Met Leu
115 120 125
Glu Ile Gly Thr Ser Leu Leu Ser Gln Thr Ala Glu Gln Thr Arg Lys
130 135 140
Leu Thr Asp Val Glu Thr Gln Val Leu Asn Gln Thr Ser Arg Leu Glu
145 150 155 160
Ile Gln Leu Leu Glu Asn Ser Leu Ser Thr Tyr Lys Leu Glu Lys Gln
165 170 175
Leu Leu Gln Gln Thr Asn Glu Ile Leu Lys Ile His Glu Lys Asn Ser
180 185 190
Leu Leu Glu His Lys Ile Leu Glu Met Glu Gly Lys His Lys Glu Glu
195 200 205
Leu Asp Thr Leu Lys Glu Glu Lys Glu Asn Leu Gln Gly Leu Val Thr
210 215 220
Arg Gln Thr Tyr Ile Ile Gln Glu Leu Glu Lys Gln Leu Asn Arg Ala
225 230 235 240
Thr Thr Asn Asn Ser Val Leu Gln Lys Gln Gln Leu Glu Leu Met Asp
245 250 255
Thr Val His Asn Leu Val Asn Leu Cys Thr Lys Glu Gly Val Leu Leu
260 265 270
Lys Gly Gly Lys Arg Glu Glu Glu Lys Pro Phe Arg Asp Cys Ala Asp
275 280 285
Val Tyr Gln Ala Gly Phe Asn Lys Ser Gly Ile Tyr Thr Ile Tyr Ile
290 295 300
Asn Asn Met Pro Glu Pro Lys Lys Val Phe Cys Asn Met Asp Val Asn
305 310 315 320
Gly Gly Gly Trp Thr Val Ile Gln His Arg Glu Asp Gly Ser Leu Asp
325 330 335
Phe Gln Arg Gly Trp Lys Glu Tyr Lys Met Gly Phe Gly Asn Pro Ser
340 345 350
Gly Glu Tyr Trp Leu Gly Asn Glu Phe Ile Phe Ala Ile Thr Ser Gln
355 360 365
Arg Gln Tyr Met Leu Arg Ile Glu Leu Met Asp Trp Glu Gly Asn Arg
370 375 380
Ala Tyr Ser Gln Tyr Asp Arg Phe His Ile Gly Asn Glu Lys Gln Asn
385 390 395 400
Tyr Arg Leu Tyr Leu Lys Gly His Thr Gly Thr Ala Gly Lys Gln Ser
405 410 415
Ser Leu Ile Leu His Gly Ala Asp Phe Ser Thr Lys Asp Ala Asp Asn
420 425 430
Asp Asn Cys Met Cys Lys Cys Ala Leu Met Leu Thr Gly Gly Trp Trp
435 440 445
Phe Asp Ala Cys Gly Pro Ser Asn Leu Asn Gly Met Phe Tyr Thr Ala
450 455 460
Gly Gln Asn His Gly Lys Leu Asn Gly Ile Lys Trp His Tyr Phe Lys
465 470 475 480
Gly Pro Ser Tyr Ser Leu Arg Ser Thr Thr Met Met Ile Arg Pro Leu
485 490 495
Asp Phe
<210> 33
<211> 1124
<212> PRT
<213> Homo sapiens
<400> 33
Met Asp Ser Leu Ala Ser Leu Val Leu Cys Gly Val Ser Leu Leu Leu
1 5 10 15
Ser Gly Thr Val Glu Gly Ala Met Asp Leu Ile Leu Ile Asn Ser Leu
20 25 30
Pro Leu Val Ser Asp Ala Glu Thr Ser Leu Thr Cys Ile Ala Ser Gly
35 40 45
Trp Arg Pro His Glu Pro Ile Thr Ile Gly Arg Asp Phe Glu Ala Leu
50 55 60
Met Asn Gln His Gln Asp Pro Leu Glu Val Thr Gln Asp Val Thr Arg
65 70 75 80
Glu Trp Ala Lys Lys Val Val Trp Lys Arg Glu Lys Ala Ser Lys Ile
85 90 95
Asn Gly Ala Tyr Phe Cys Glu Gly Arg Val Arg Gly Glu Ala Ile Arg
100 105 110
Ile Arg Thr Met Lys Met Arg Gln Gln Ala Ser Phe Leu Pro Ala Thr
115 120 125
Leu Thr Met Thr Val Asp Lys Gly Asp Asn Val Asn Ile Ser Phe Lys
130 135 140
Lys Val Leu Ile Lys Glu Glu Asp Ala Val Ile Tyr Lys Asn Gly Ser
145 150 155 160
Phe Ile His Ser Val Pro Arg His Glu Val Pro Asp Ile Leu Glu Val
165 170 175
His Leu Pro His Ala Gln Pro Gln Asp Ala Gly Val Tyr Ser Ala Arg
180 185 190
Tyr Ile Gly Gly Asn Leu Phe Thr Ser Ala Phe Thr Arg Leu Ile Val
195 200 205
Arg Arg Cys Glu Ala Gln Lys Trp Gly Pro Glu Cys Asn His Leu Cys
210 215 220
Thr Ala Cys Met Asn Asn Gly Val Cys His Glu Asp Thr Gly Glu Cys
225 230 235 240
Ile Cys Pro Pro Gly Phe Met Gly Arg Thr Cys Glu Lys Ala Cys Glu
245 250 255
Leu His Thr Phe Gly Arg Thr Cys Lys Glu Arg Cys Ser Gly Gln Glu
260 265 270
Gly Cys Lys Ser Tyr Val Phe Cys Leu Pro Asp Pro Tyr Gly Cys Ser
275 280 285
Cys Ala Thr Gly Trp Lys Gly Leu Gln Cys Asn Glu Ala Cys His Pro
290 295 300
Gly Phe Tyr Gly Pro Asp Cys Lys Leu Arg Cys Ser Cys Asn Asn Gly
305 310 315 320
Glu Met Cys Asp Arg Phe Gln Gly Cys Leu Cys Ser Pro Gly Trp Gln
325 330 335
Gly Leu Gln Cys Glu Arg Glu Gly Ile Pro Arg Met Thr Pro Lys Ile
340 345 350
Val Asp Leu Pro Asp His Ile Glu Val Asn Ser Gly Lys Phe Asn Pro
355 360 365
Ile Cys Lys Ala Ser Gly Trp Pro Leu Pro Thr Asn Glu Glu Met Thr
370 375 380
Leu Val Lys Pro Asp Gly Thr Val Leu His Pro Lys Asp Phe Asn His
385 390 395 400
Thr Asp His Phe Ser Val Ala Ile Phe Thr Ile His Arg Ile Leu Pro
405 410 415
Pro Asp Ser Gly Val Trp Val Cys Ser Val Asn Thr Val Ala Gly Met
420 425 430
Val Glu Lys Pro Phe Asn Ile Ser Val Lys Val Leu Pro Lys Pro Leu
435 440 445
Asn Ala Pro Asn Val Ile Asp Thr Gly His Asn Phe Ala Val Ile Asn
450 455 460
Ile Ser Ser Glu Pro Tyr Phe Gly Asp Gly Pro Ile Lys Ser Lys Lys
465 470 475 480
Leu Leu Tyr Lys Pro Val Asn His Tyr Glu Ala Trp Gln His Ile Gln
485 490 495
Val Thr Asn Glu Ile Val Thr Leu Asn Tyr Leu Glu Pro Arg Thr Glu
500 505 510
Tyr Glu Leu Cys Val Gln Leu Val Arg Arg Gly Glu Gly Gly Glu Gly
515 520 525
His Pro Gly Pro Val Arg Arg Phe Thr Thr Ala Ser Ile Gly Leu Pro
530 535 540
Pro Pro Arg Gly Leu Asn Leu Leu Pro Lys Ser Gln Thr Thr Leu Asn
545 550 555 560
Leu Thr Trp Gln Pro Ile Phe Pro Ser Ser Glu Asp Asp Phe Tyr Val
565 570 575
Glu Val Glu Arg Arg Ser Val Gln Lys Ser Asp Gln Gln Asn Ile Lys
580 585 590
Val Pro Gly Asn Leu Thr Ser Val Leu Leu Asn Asn Leu His Pro Arg
595 600 605
Glu Gln Tyr Val Val Arg Ala Arg Val Asn Thr Lys Ala Gln Gly Glu
610 615 620
Trp Ser Glu Asp Leu Thr Ala Trp Thr Leu Ser Asp Ile Leu Pro Pro
625 630 635 640
Gln Pro Glu Asn Ile Lys Ile Ser Asn Ile Thr His Ser Ser Ala Val
645 650 655
Ile Ser Trp Thr Ile Leu Asp Gly Tyr Ser Ile Ser Ser Ile Thr Ile
660 665 670
Arg Tyr Lys Val Gln Gly Lys Asn Glu Asp Gln His Val Asp Val Lys
675 680 685
Ile Lys Asn Ala Thr Ile Thr Gln Tyr Gln Leu Lys Gly Leu Glu Pro
690 695 700
Glu Thr Ala Tyr Gln Val Asp Ile Phe Ala Glu Asn Asn Ile Gly Ser
705 710 715 720
Ser Asn Pro Ala Phe Ser His Glu Leu Val Thr Leu Pro Glu Ser Gln
725 730 735
Ala Pro Ala Asp Leu Gly Gly Gly Lys Met Leu Leu Ile Ala Ile Leu
740 745 750
Gly Ser Ala Gly Met Thr Cys Leu Thr Val Leu Leu Ala Phe Leu Ile
755 760 765
Ile Leu Gln Leu Lys Arg Ala Asn Val Gln Arg Arg Met Ala Gln Ala
770 775 780
Phe Gln Asn Val Arg Glu Glu Pro Ala Val Gln Phe Asn Ser Gly Thr
785 790 795 800
Leu Ala Leu Asn Arg Lys Val Lys Asn Asn Pro Asp Pro Thr Ile Tyr
805 810 815
Pro Val Leu Asp Trp Asn Asp Ile Lys Phe Gln Asp Val Ile Gly Glu
820 825 830
Gly Asn Phe Gly Gln Val Leu Lys Ala Arg Ile Lys Lys Asp Gly Leu
835 840 845
Arg Met Asp Ala Ala Ile Lys Arg Met Lys Glu Tyr Ala Ser Lys Asp
850 855 860
Asp His Arg Asp Phe Ala Gly Glu Leu Glu Val Leu Cys Lys Leu Gly
865 870 875 880
His His Pro Asn Ile Ile Asn Leu Leu Gly Ala Cys Glu His Arg Gly
885 890 895
Tyr Leu Tyr Leu Ala Ile Glu Tyr Ala Pro His Gly Asn Leu Leu Asp
900 905 910
Phe Leu Arg Lys Ser Arg Val Leu Glu Thr Asp Pro Ala Phe Ala Ile
915 920 925
Ala Asn Ser Thr Ala Ser Thr Leu Ser Ser Gln Gln Leu Leu His Phe
930 935 940
Ala Ala Asp Val Ala Arg Gly Met Asp Tyr Leu Ser Gln Lys Gln Phe
945 950 955 960
Ile His Arg Asp Leu Ala Ala Arg Asn Ile Leu Val Gly Glu Asn Tyr
965 970 975
Val Ala Lys Ile Ala Asp Phe Gly Leu Ser Arg Gly Gln Glu Val Tyr
980 985 990
Val Lys Lys Thr Met Gly Arg Leu Pro Val Arg Trp Met Ala Ile Glu
995 1000 1005
Ser Leu Asn Tyr Ser Val Tyr Thr Thr Asn Ser Asp Val Trp Ser
1010 1015 1020
Tyr Gly Val Leu Leu Trp Glu Ile Val Ser Leu Gly Gly Thr Pro
1025 1030 1035
Tyr Cys Gly Met Thr Cys Ala Glu Leu Tyr Glu Lys Leu Pro Gln
1040 1045 1050
Gly Tyr Arg Leu Glu Lys Pro Leu Asn Cys Asp Asp Glu Val Tyr
1055 1060 1065
Asp Leu Met Arg Gln Cys Trp Arg Glu Lys Pro Tyr Glu Arg Pro
1070 1075 1080
Ser Phe Ala Gln Ile Leu Val Ser Leu Asn Arg Met Leu Glu Glu
1085 1090 1095
Arg Lys Thr Tyr Val Asn Thr Thr Leu Tyr Glu Lys Phe Thr Tyr
1100 1105 1110
Ala Gly Ile Asp Cys Ser Ala Glu Glu Ala Ala
1115 1120
<210> 34
<211> 453
<212> PRT
<213> Искусственная
<220>
<223> Тяжелая цепь 1 <VEGF-ANG-2> CrossMAb IgG1 с AAA-мутациями
(VEGFang2-0012)
<400> 34
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Tyr Asp Phe Thr His Tyr
20 25 30
Gly Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Gly Trp Ile Asn Thr Tyr Thr Gly Glu Pro Thr Tyr Ala Ala Asp Phe
50 55 60
Lys Arg Arg Phe Thr Phe Ser Leu Asp Thr Ser Lys Ser Thr Ala Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Lys Tyr Pro Tyr Tyr Tyr Gly Thr Ser His Trp Tyr Phe Asp Val
100 105 110
Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly
115 120 125
Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly
130 135 140
Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val
145 150 155 160
Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe
165 170 175
Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val
180 185 190
Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val
195 200 205
Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys
210 215 220
Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu
225 230 235 240
Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr
245 250 255
Leu Met Ala Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val
260 265 270
Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val
275 280 285
Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser
290 295 300
Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu Ala Gln Asp Trp Leu
305 310 315 320
Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala
325 330 335
Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro
340 345 350
Gln Val Tyr Thr Leu Pro Pro Cys Arg Asp Glu Leu Thr Lys Asn Gln
355 360 365
Val Ser Leu Trp Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala
370 375 380
Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr
385 390 395 400
Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu
405 410 415
Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser
420 425 430
Val Met His Glu Ala Leu His Asn Ala Tyr Thr Gln Lys Ser Leu Ser
435 440 445
Leu Ser Pro Gly Lys
450
<210> 35
<211> 463
<212> PRT
<213> Искусственная
<220>
<223> Тяжелая цепь 2 <VEGF-ANG-2> CrossMAb IgG1 с AAA-мутациями
(VEGFang2-0012)
<400> 35
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Gly Tyr
20 25 30
Tyr Met His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Trp Ile Asn Pro Asn Ser Gly Gly Thr Asn Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Met Thr Arg Asp Thr Ser Ile Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Arg Leu Arg Ser Asp Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Ser Pro Asn Pro Tyr Tyr Tyr Asp Ser Ser Gly Tyr Tyr Tyr
100 105 110
Pro Gly Ala Phe Asp Ile Trp Gly Gln Gly Thr Met Val Thr Val Ser
115 120 125
Ser Ala Ser Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp
130 135 140
Glu Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn
145 150 155 160
Phe Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu
165 170 175
Gln Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp
180 185 190
Ser Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr
195 200 205
Glu Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser
210 215 220
Ser Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys Asp Lys Thr His
225 230 235 240
Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val
245 250 255
Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ala Ser Arg Thr
260 265 270
Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu
275 280 285
Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys
290 295 300
Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser
305 310 315 320
Val Leu Thr Val Leu Ala Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys
325 330 335
Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile
340 345 350
Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Cys Thr Leu Pro
355 360 365
Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Ser Cys Ala
370 375 380
Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn
385 390 395 400
Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser
405 410 415
Asp Gly Ser Phe Phe Leu Val Ser Lys Leu Thr Val Asp Lys Ser Arg
420 425 430
Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu
435 440 445
His Asn Ala Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
450 455 460
<210> 36
<211> 214
<212> PRT
<213> Искусственная
<220>
<223> Легкая цепь 1 <VEGF-ANG-2> CrossMAb IgG1 с AAA-мутациями
(VEGFang2-0012)
<400> 36
Asp Ile Gln Leu Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Ser Ala Ser Gln Asp Ile Ser Asn Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Val Leu Ile
35 40 45
Tyr Phe Thr Ser Ser Leu His Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Tyr Ser Thr Val Pro Trp
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Arg Thr Val Ala Ala
100 105 110
Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly
115 120 125
Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala
130 135 140
Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln
145 150 155 160
Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser
165 170 175
Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr
180 185 190
Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser
195 200 205
Phe Asn Arg Gly Glu Cys
210
<210> 37
<211> 213
<212> PRT
<213> Искусственная
<220>
<223> Легкая цепь 2 <VEGF-ANG-2> CrossMAb IgG1 с AAA-мутациями
(VEGFang2-0012)
<400> 37
Ser Tyr Val Leu Thr Gln Pro Pro Ser Val Ser Val Ala Pro Gly Gln
1 5 10 15
Thr Ala Arg Ile Thr Cys Gly Gly Asn Asn Ile Gly Ser Lys Ser Val
20 25 30
His Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Val Leu Val Val Tyr
35 40 45
Asp Asp Ser Asp Arg Pro Ser Gly Ile Pro Glu Arg Phe Ser Gly Ser
50 55 60
Asn Ser Gly Asn Thr Ala Thr Leu Thr Ile Ser Arg Val Glu Ala Gly
65 70 75 80
Asp Glu Ala Asp Tyr Tyr Cys Gln Val Trp Asp Ser Ser Ser Asp His
85 90 95
Trp Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu Ser Ser Ala Ser
100 105 110
Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr
115 120 125
Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro
130 135 140
Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val
145 150 155 160
His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser
165 170 175
Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile
180 185 190
Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys Lys Val
195 200 205
Glu Pro Lys Ser Cys
210
<210> 38
<211> 453
<212> PRT
<213> Искусственная
<220>
<223> Тяжелая цепь 1 <VEGF-ANG-2> CrossMAb IgG1 с AAA-мутациями
и P329G LALA-мутациями (VEGFang2-0016)
<400> 38
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Tyr Asp Phe Thr His Tyr
20 25 30
Gly Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Gly Trp Ile Asn Thr Tyr Thr Gly Glu Pro Thr Tyr Ala Ala Asp Phe
50 55 60
Lys Arg Arg Phe Thr Phe Ser Leu Asp Thr Ser Lys Ser Thr Ala Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Lys Tyr Pro Tyr Tyr Tyr Gly Thr Ser His Trp Tyr Phe Asp Val
100 105 110
Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly
115 120 125
Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly
130 135 140
Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val
145 150 155 160
Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe
165 170 175
Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val
180 185 190
Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val
195 200 205
Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys
210 215 220
Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Ala
225 230 235 240
Ala Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr
245 250 255
Leu Met Ala Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val
260 265 270
Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val
275 280 285
Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser
290 295 300
Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu Ala Gln Asp Trp Leu
305 310 315 320
Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Gly Ala
325 330 335
Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro
340 345 350
Gln Val Tyr Thr Leu Pro Pro Cys Arg Asp Glu Leu Thr Lys Asn Gln
355 360 365
Val Ser Leu Trp Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala
370 375 380
Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr
385 390 395 400
Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu
405 410 415
Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser
420 425 430
Val Met His Glu Ala Leu His Asn Ala Tyr Thr Gln Lys Ser Leu Ser
435 440 445
Leu Ser Pro Gly Lys
450
<210> 39
<211> 463
<212> PRT
<213> Искусственная
<220>
<223> Тяжелая цепь 2 <VEGF-ANG-2> CrossMAb IgG1 с AAA-мутациями
и P329G LALA-мутациями (VEGFang2-0016)
<400> 39
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Gly Tyr
20 25 30
Tyr Met His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Trp Ile Asn Pro Asn Ser Gly Gly Thr Asn Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Met Thr Arg Asp Thr Ser Ile Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Arg Leu Arg Ser Asp Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Ser Pro Asn Pro Tyr Tyr Tyr Asp Ser Ser Gly Tyr Tyr Tyr
100 105 110
Pro Gly Ala Phe Asp Ile Trp Gly Gln Gly Thr Met Val Thr Val Ser
115 120 125
Ser Ala Ser Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp
130 135 140
Glu Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn
145 150 155 160
Phe Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu
165 170 175
Gln Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp
180 185 190
Ser Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr
195 200 205
Glu Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser
210 215 220
Ser Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys Asp Lys Thr His
225 230 235 240
Thr Cys Pro Pro Cys Pro Ala Pro Glu Ala Ala Gly Gly Pro Ser Val
245 250 255
Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ala Ser Arg Thr
260 265 270
Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu
275 280 285
Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys
290 295 300
Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser
305 310 315 320
Val Leu Thr Val Leu Ala Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys
325 330 335
Cys Lys Val Ser Asn Lys Ala Leu Gly Ala Pro Ile Glu Lys Thr Ile
340 345 350
Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Cys Thr Leu Pro
355 360 365
Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Ser Cys Ala
370 375 380
Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn
385 390 395 400
Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser
405 410 415
Asp Gly Ser Phe Phe Leu Val Ser Lys Leu Thr Val Asp Lys Ser Arg
420 425 430
Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu
435 440 445
His Asn Ala Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
450 455 460
<210> 40
<211> 214
<212> PRT
<213> Искусственная
<220>
<223> Легкая цепь 1 <VEGF-ANG-2> CrossMAb IgG1 с AAA-мутациями
и P329G LALA-мутациями (VEGFang2-0016)
<400> 40
Asp Ile Gln Leu Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Ser Ala Ser Gln Asp Ile Ser Asn Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Val Leu Ile
35 40 45
Tyr Phe Thr Ser Ser Leu His Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Tyr Ser Thr Val Pro Trp
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Arg Thr Val Ala Ala
100 105 110
Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly
115 120 125
Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala
130 135 140
Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln
145 150 155 160
Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser
165 170 175
Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr
180 185 190
Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser
195 200 205
Phe Asn Arg Gly Glu Cys
210
<210> 41
<211> 213
<212> PRT
<213> Искусственная
<220>
<223> Легкая цепь 2 <VEGF-ANG-2> CrossMAb IgG1 с AAA-мутациями
и P329G LALA-мутациями (VEGFang2-0016)
<400> 41
Ser Tyr Val Leu Thr Gln Pro Pro Ser Val Ser Val Ala Pro Gly Gln
1 5 10 15
Thr Ala Arg Ile Thr Cys Gly Gly Asn Asn Ile Gly Ser Lys Ser Val
20 25 30
His Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Val Leu Val Val Tyr
35 40 45
Asp Asp Ser Asp Arg Pro Ser Gly Ile Pro Glu Arg Phe Ser Gly Ser
50 55 60
Asn Ser Gly Asn Thr Ala Thr Leu Thr Ile Ser Arg Val Glu Ala Gly
65 70 75 80
Asp Glu Ala Asp Tyr Tyr Cys Gln Val Trp Asp Ser Ser Ser Asp His
85 90 95
Trp Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu Ser Ser Ala Ser
100 105 110
Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr
115 120 125
Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro
130 135 140
Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val
145 150 155 160
His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser
165 170 175
Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile
180 185 190
Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys Lys Val
195 200 205
Glu Pro Lys Ser Cys
210
<210> 42
<211> 450
<212> PRT
<213> Искусственная
<220>
<223> Тяжелая цепь 1 <VEGF-ANG-2> CrossMAb IgG4 с AAA-мутациями
и с SPLE-мутациями
<400> 42
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Tyr Asp Phe Thr His Tyr
20 25 30
Gly Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Gly Trp Ile Asn Thr Tyr Thr Gly Glu Pro Thr Tyr Ala Ala Asp Phe
50 55 60
Lys Arg Arg Phe Thr Phe Ser Leu Asp Thr Ser Lys Ser Thr Ala Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Lys Tyr Pro Tyr Tyr Tyr Gly Thr Ser His Trp Tyr Phe Asp Val
100 105 110
Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly
115 120 125
Pro Ser Val Phe Pro Leu Ala Pro Cys Ser Arg Ser Thr Ser Glu Ser
130 135 140
Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val
145 150 155 160
Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe
165 170 175
Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val
180 185 190
Thr Val Pro Ser Ser Ser Leu Gly Thr Lys Thr Tyr Thr Cys Asn Val
195 200 205
Asp His Lys Pro Ser Asn Thr Lys Val Asp Lys Arg Val Glu Ser Lys
210 215 220
Tyr Gly Pro Pro Cys Pro Pro Cys Pro Ala Pro Glu Phe Glu Gly Gly
225 230 235 240
Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ala
245 250 255
Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser Gln Glu
260 265 270
Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp Gly Val Glu Val His
275 280 285
Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser Thr Tyr Arg
290 295 300
Val Val Ser Val Leu Thr Val Leu Ala Gln Asp Trp Leu Asn Gly Lys
305 310 315 320
Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu Pro Ser Ser Ile Glu
325 330 335
Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Cys
340 345 350
Thr Leu Pro Pro Ser Gln Glu Glu Met Thr Lys Asn Gln Val Ser Leu
355 360 365
Ser Cys Ala Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp
370 375 380
Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val
385 390 395 400
Leu Asp Ser Asp Gly Ser Phe Phe Leu Val Ser Arg Leu Thr Val Asp
405 410 415
Lys Ser Arg Trp Gln Glu Gly Asn Val Phe Ser Cys Ser Val Met His
420 425 430
Glu Ala Leu His Asn Ala Tyr Thr Gln Lys Ser Leu Ser Leu Ser Leu
435 440 445
Gly Lys
450
<210> 43
<211> 460
<212> PRT
<213> Искусственная
<220>
<223> Тяжелая цепь 2 <VEGF-ANG-2> CrossMAb IgG4 с AAA-мутациями
и с SPLE-мутациями
<400> 43
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Gly Tyr
20 25 30
Tyr Met His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Trp Ile Asn Pro Asn Ser Gly Gly Thr Asn Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Met Thr Arg Asp Thr Ser Ile Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Arg Leu Arg Ser Asp Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Ser Pro Asn Pro Tyr Tyr Tyr Asp Ser Ser Gly Tyr Tyr Tyr
100 105 110
Pro Gly Ala Phe Asp Ile Trp Gly Gln Gly Thr Met Val Thr Val Ser
115 120 125
Ser Ala Ser Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp
130 135 140
Glu Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn
145 150 155 160
Phe Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu
165 170 175
Gln Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp
180 185 190
Ser Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr
195 200 205
Glu Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser
210 215 220
Ser Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys Pro Pro Cys Pro
225 230 235 240
Pro Cys Pro Ala Pro Glu Phe Glu Gly Gly Pro Ser Val Phe Leu Phe
245 250 255
Pro Pro Lys Pro Lys Asp Thr Leu Met Ala Ser Arg Thr Pro Glu Val
260 265 270
Thr Cys Val Val Val Asp Val Ser Gln Glu Asp Pro Glu Val Gln Phe
275 280 285
Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro
290 295 300
Arg Glu Glu Gln Phe Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr
305 310 315 320
Val Leu Ala Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val
325 330 335
Ser Asn Lys Gly Leu Pro Ser Ser Ile Glu Lys Thr Ile Ser Lys Ala
340 345 350
Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Cys Gln
355 360 365
Glu Glu Met Thr Lys Asn Gln Val Ser Leu Trp Cys Leu Val Lys Gly
370 375 380
Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro
385 390 395 400
Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser
405 410 415
Phe Phe Leu Tyr Ser Arg Leu Thr Val Asp Lys Ser Arg Trp Gln Glu
420 425 430
Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn Ala
435 440 445
Tyr Thr Gln Lys Ser Leu Ser Leu Ser Leu Gly Lys
450 455 460
<210> 44
<211> 214
<212> PRT
<213> Искусственная
<220>
<223> Легкая цепь 1 <VEGF-ANG-2> CrossMAb IgG4 с AAA-мутациями
и с SPLE-мутациями
<400> 44
Asp Ile Gln Leu Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Ser Ala Ser Gln Asp Ile Ser Asn Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Val Leu Ile
35 40 45
Tyr Phe Thr Ser Ser Leu His Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Tyr Ser Thr Val Pro Trp
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Arg Thr Val Ala Ala
100 105 110
Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly
115 120 125
Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala
130 135 140
Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln
145 150 155 160
Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser
165 170 175
Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr
180 185 190
Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser
195 200 205
Phe Asn Arg Gly Glu Cys
210
<210> 45
<211> 213
<212> PRT
<213> Искусственная
<220>
<223> Легкая цепь 2 <VEGF-ANG-2> CrossMAb IgG4 с AAA-мутациями
и с SPLE-мутациями
<400> 45
Ser Tyr Val Leu Thr Gln Pro Pro Ser Val Ser Val Ala Pro Gly Gln
1 5 10 15
Thr Ala Arg Ile Thr Cys Gly Gly Asn Asn Ile Gly Ser Lys Ser Val
20 25 30
His Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Val Leu Val Val Tyr
35 40 45
Asp Asp Ser Asp Arg Pro Ser Gly Ile Pro Glu Arg Phe Ser Gly Ser
50 55 60
Asn Ser Gly Asn Thr Ala Thr Leu Thr Ile Ser Arg Val Glu Ala Gly
65 70 75 80
Asp Glu Ala Asp Tyr Tyr Cys Gln Val Trp Asp Ser Ser Ser Asp His
85 90 95
Trp Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu Ser Ser Ala Ser
100 105 110
Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Cys Ser Arg Ser Thr
115 120 125
Ser Glu Ser Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro
130 135 140
Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val
145 150 155 160
His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser
165 170 175
Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Lys Thr Tyr Thr
180 185 190
Cys Asn Val Asp His Lys Pro Ser Asn Thr Lys Val Asp Lys Arg Val
195 200 205
Glu Ser Lys Tyr Gly
210
<210> 46
<211> 453
<212> PRT
<213> Искусственная
<220>
<223> Тяжелая цепь 1 <VEGF-ANG-2> OAscFab IgG1 с AAA-мутациями
<400> 46
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Tyr Asp Phe Thr His Tyr
20 25 30
Gly Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Gly Trp Ile Asn Thr Tyr Thr Gly Glu Pro Thr Tyr Ala Ala Asp Phe
50 55 60
Lys Arg Arg Phe Thr Phe Ser Leu Asp Thr Ser Lys Ser Thr Ala Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Lys Tyr Pro Tyr Tyr Tyr Gly Thr Ser His Trp Tyr Phe Asp Val
100 105 110
Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly
115 120 125
Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly
130 135 140
Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val
145 150 155 160
Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe
165 170 175
Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val
180 185 190
Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val
195 200 205
Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys
210 215 220
Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu
225 230 235 240
Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr
245 250 255
Leu Met Ala Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val
260 265 270
Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val
275 280 285
Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser
290 295 300
Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu Ala Gln Asp Trp Leu
305 310 315 320
Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala
325 330 335
Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro
340 345 350
Gln Val Cys Thr Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln
355 360 365
Val Ser Leu Ser Cys Ala Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala
370 375 380
Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr
385 390 395 400
Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Val Ser Lys Leu
405 410 415
Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser
420 425 430
Val Met His Glu Ala Leu His Asn Ala Tyr Thr Gln Lys Ser Leu Ser
435 440 445
Leu Ser Pro Gly Lys
450
<210> 47
<211> 705
<212> PRT
<213> Искусственная
<220>
<223> Тяжелая цепь 2 <VEGF-ANG-2> OAscFab IgG1 с AAA-мутациями
<400> 47
Ser Tyr Val Leu Thr Gln Pro Pro Ser Val Ser Val Ala Pro Gly Gln
1 5 10 15
Thr Ala Arg Ile Thr Cys Gly Gly Asn Asn Ile Gly Ser Lys Ser Val
20 25 30
His Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Val Leu Val Val Tyr
35 40 45
Asp Asp Ser Asp Arg Pro Ser Gly Ile Pro Glu Arg Phe Ser Gly Ser
50 55 60
Asn Ser Gly Asn Thr Ala Thr Leu Thr Ile Ser Arg Val Glu Ala Gly
65 70 75 80
Asp Glu Ala Asp Tyr Tyr Cys Gln Val Trp Asp Ser Ser Ser Asp His
85 90 95
Trp Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu Gly Gln Pro Lys
100 105 110
Ala Ala Pro Ser Val Thr Leu Phe Pro Pro Ser Ser Glu Glu Leu Gln
115 120 125
Ala Asn Lys Ala Thr Leu Val Cys Leu Ile Ser Asp Phe Tyr Pro Gly
130 135 140
Ala Val Thr Val Ala Trp Lys Ala Asp Ser Ser Pro Val Lys Ala Gly
145 150 155 160
Val Glu Thr Thr Thr Pro Ser Lys Gln Ser Asn Asn Lys Tyr Ala Ala
165 170 175
Ser Ser Tyr Leu Ser Leu Thr Pro Glu Gln Trp Lys Ser His Arg Ser
180 185 190
Tyr Ser Cys Gln Val Thr His Glu Gly Ser Thr Val Glu Lys Thr Val
195 200 205
Ala Pro Thr Glu Cys Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
210 215 220
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly
225 230 235 240
Gly Gly Gly Ser Gly Gly Gln Val Gln Leu Val Glu Ser Gly Ala Glu
245 250 255
Val Lys Lys Pro Gly Ala Ser Val Lys Val Ser Cys Lys Ala Ser Gly
260 265 270
Tyr Thr Phe Thr Gly Tyr Tyr Met His Trp Val Arg Gln Ala Pro Gly
275 280 285
Gln Gly Leu Glu Trp Met Gly Trp Ile Asn Pro Asn Ser Gly Gly Thr
290 295 300
Asn Tyr Ala Gln Lys Phe Gln Gly Arg Val Thr Met Thr Arg Asp Thr
305 310 315 320
Ser Ile Ser Thr Ala Tyr Met Glu Leu Ser Arg Leu Arg Ser Asp Asp
325 330 335
Thr Ala Val Tyr Tyr Cys Ala Arg Ser Pro Asn Pro Tyr Tyr Tyr Asp
340 345 350
Ser Ser Gly Tyr Tyr Tyr Pro Gly Ala Phe Asp Ile Trp Gly Gln Gly
355 360 365
Thr Met Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe
370 375 380
Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu
385 390 395 400
Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp
405 410 415
Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu
420 425 430
Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser
435 440 445
Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro
450 455 460
Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys
465 470 475 480
Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro
485 490 495
Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ala Ser
500 505 510
Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp
515 520 525
Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn
530 535 540
Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val
545 550 555 560
Val Ser Val Leu Thr Val Leu Ala Gln Asp Trp Leu Asn Gly Lys Glu
565 570 575
Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys
580 585 590
Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr
595 600 605
Leu Pro Pro Cys Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Trp
610 615 620
Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu
625 630 635 640
Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu
645 650 655
Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys
660 665 670
Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu
675 680 685
Ala Leu His Asn Ala Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly
690 695 700
Lys
705
<210> 48
<211> 214
<212> PRT
<213> Искусственная
<220>
<223> Легкая цепь 1 <VEGF-ANG-2> OAscFab IgG1 с AAA-мутациями
<400> 48
Asp Ile Gln Leu Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Ser Ala Ser Gln Asp Ile Ser Asn Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Val Leu Ile
35 40 45
Tyr Phe Thr Ser Ser Leu His Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Tyr Ser Thr Val Pro Trp
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Arg Thr Val Ala Ala
100 105 110
Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly
115 120 125
Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala
130 135 140
Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln
145 150 155 160
Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser
165 170 175
Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr
180 185 190
Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser
195 200 205
Phe Asn Arg Gly Glu Cys
210
<210> 49
<211> 450
<212> PRT
<213> Искусственная
<220>
<223> Тяжелая цепь 1 <VEGF-ANG-2> OAscFab IgG4 с AAA-мутациями
и с SPLE-мутациями
<400> 49
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Tyr Asp Phe Thr His Tyr
20 25 30
Gly Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Gly Trp Ile Asn Thr Tyr Thr Gly Glu Pro Thr Tyr Ala Ala Asp Phe
50 55 60
Lys Arg Arg Phe Thr Phe Ser Leu Asp Thr Ser Lys Ser Thr Ala Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Lys Tyr Pro Tyr Tyr Tyr Gly Thr Ser His Trp Tyr Phe Asp Val
100 105 110
Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly
115 120 125
Pro Ser Val Phe Pro Leu Ala Pro Cys Ser Arg Ser Thr Ser Glu Ser
130 135 140
Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val
145 150 155 160
Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe
165 170 175
Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val
180 185 190
Thr Val Pro Ser Ser Ser Leu Gly Thr Lys Thr Tyr Thr Cys Asn Val
195 200 205
Asp His Lys Pro Ser Asn Thr Lys Val Asp Lys Arg Val Glu Ser Lys
210 215 220
Tyr Gly Pro Pro Cys Pro Pro Cys Pro Ala Pro Glu Phe Glu Gly Gly
225 230 235 240
Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ala
245 250 255
Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser Gln Glu
260 265 270
Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp Gly Val Glu Val His
275 280 285
Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser Thr Tyr Arg
290 295 300
Val Val Ser Val Leu Thr Val Leu Ala Gln Asp Trp Leu Asn Gly Lys
305 310 315 320
Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu Pro Ser Ser Ile Glu
325 330 335
Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Cys
340 345 350
Thr Leu Pro Pro Ser Gln Glu Glu Met Thr Lys Asn Gln Val Ser Leu
355 360 365
Ser Cys Ala Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp
370 375 380
Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val
385 390 395 400
Leu Asp Ser Asp Gly Ser Phe Phe Leu Val Ser Arg Leu Thr Val Asp
405 410 415
Lys Ser Arg Trp Gln Glu Gly Asn Val Phe Ser Cys Ser Val Met His
420 425 430
Glu Ala Leu His Asn Ala Tyr Thr Gln Lys Ser Leu Ser Leu Ser Leu
435 440 445
Gly Lys
450
<210> 50
<211> 702
<212> PRT
<213> Искусственная
<220>
<223> Тяжелая цепь 2 <VEGF-ANG-2> OAscFab IgG4 с AAA-мутациями и
с SPLE-мутациями
<400> 50
Ser Tyr Val Leu Thr Gln Pro Pro Ser Val Ser Val Ala Pro Gly Gln
1 5 10 15
Thr Ala Arg Ile Thr Cys Gly Gly Asn Asn Ile Gly Ser Lys Ser Val
20 25 30
His Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Val Leu Val Val Tyr
35 40 45
Asp Asp Ser Asp Arg Pro Ser Gly Ile Pro Glu Arg Phe Ser Gly Ser
50 55 60
Asn Ser Gly Asn Thr Ala Thr Leu Thr Ile Ser Arg Val Glu Ala Gly
65 70 75 80
Asp Glu Ala Asp Tyr Tyr Cys Gln Val Trp Asp Ser Ser Ser Asp His
85 90 95
Trp Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu Gly Gln Pro Lys
100 105 110
Ala Ala Pro Ser Val Thr Leu Phe Pro Pro Ser Ser Glu Glu Leu Gln
115 120 125
Ala Asn Lys Ala Thr Leu Val Cys Leu Ile Ser Asp Phe Tyr Pro Gly
130 135 140
Ala Val Thr Val Ala Trp Lys Ala Asp Ser Ser Pro Val Lys Ala Gly
145 150 155 160
Val Glu Thr Thr Thr Pro Ser Lys Gln Ser Asn Asn Lys Tyr Ala Ala
165 170 175
Ser Ser Tyr Leu Ser Leu Thr Pro Glu Gln Trp Lys Ser His Arg Ser
180 185 190
Tyr Ser Cys Gln Val Thr His Glu Gly Ser Thr Val Glu Lys Thr Val
195 200 205
Ala Pro Thr Glu Cys Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
210 215 220
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly
225 230 235 240
Gly Gly Gly Ser Gly Gly Gln Val Gln Leu Val Glu Ser Gly Ala Glu
245 250 255
Val Lys Lys Pro Gly Ala Ser Val Lys Val Ser Cys Lys Ala Ser Gly
260 265 270
Tyr Thr Phe Thr Gly Tyr Tyr Met His Trp Val Arg Gln Ala Pro Gly
275 280 285
Gln Gly Leu Glu Trp Met Gly Trp Ile Asn Pro Asn Ser Gly Gly Thr
290 295 300
Asn Tyr Ala Gln Lys Phe Gln Gly Arg Val Thr Met Thr Arg Asp Thr
305 310 315 320
Ser Ile Ser Thr Ala Tyr Met Glu Leu Ser Arg Leu Arg Ser Asp Asp
325 330 335
Thr Ala Val Tyr Tyr Cys Ala Arg Ser Pro Asn Pro Tyr Tyr Tyr Asp
340 345 350
Ser Ser Gly Tyr Tyr Tyr Pro Gly Ala Phe Asp Ile Trp Gly Gln Gly
355 360 365
Thr Met Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe
370 375 380
Pro Leu Ala Pro Cys Ser Arg Ser Thr Ser Glu Ser Thr Ala Ala Leu
385 390 395 400
Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp
405 410 415
Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu
420 425 430
Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser
435 440 445
Ser Ser Leu Gly Thr Lys Thr Tyr Thr Cys Asn Val Asp His Lys Pro
450 455 460
Ser Asn Thr Lys Val Asp Lys Arg Val Glu Ser Lys Tyr Gly Pro Pro
465 470 475 480
Cys Pro Pro Cys Pro Ala Pro Glu Phe Glu Gly Gly Pro Ser Val Phe
485 490 495
Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ala Ser Arg Thr Pro
500 505 510
Glu Val Thr Cys Val Val Val Asp Val Ser Gln Glu Asp Pro Glu Val
515 520 525
Gln Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr
530 535 540
Lys Pro Arg Glu Glu Gln Phe Asn Ser Thr Tyr Arg Val Val Ser Val
545 550 555 560
Leu Thr Val Leu Ala Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys
565 570 575
Lys Val Ser Asn Lys Gly Leu Pro Ser Ser Ile Glu Lys Thr Ile Ser
580 585 590
Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro
595 600 605
Cys Gln Glu Glu Met Thr Lys Asn Gln Val Ser Leu Trp Cys Leu Val
610 615 620
Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly
625 630 635 640
Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp
645 650 655
Gly Ser Phe Phe Leu Tyr Ser Arg Leu Thr Val Asp Lys Ser Arg Trp
660 665 670
Gln Glu Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His
675 680 685
Asn Ala Tyr Thr Gln Lys Ser Leu Ser Leu Ser Leu Gly Lys
690 695 700
<210> 51
<211> 214
<212> PRT
<213> Искусственная
<220>
<223> Легкая цепь 1 <VEGF-ANG-2> OAscFab IgG4 с AAA-мутациями
и с SPLE-мутациями
<400> 51
Asp Ile Gln Leu Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Ser Ala Ser Gln Asp Ile Ser Asn Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Val Leu Ile
35 40 45
Tyr Phe Thr Ser Ser Leu His Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Tyr Ser Thr Val Pro Trp
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Arg Thr Val Ala Ala
100 105 110
Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly
115 120 125
Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala
130 135 140
Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln
145 150 155 160
Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser
165 170 175
Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr
180 185 190
Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser
195 200 205
Phe Asn Arg Gly Glu Cys
210
<210> 52
<211> 453
<212> PRT
<213> Искусственная
<220>
<223> Тяжелая цепь 1 <VEGF-ANG-2> CrossMAb IgG1 дикого типа(без
AAA-мутаций) (VEGFang2-0201)
<400> 52
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Tyr Asp Phe Thr His Tyr
20 25 30
Gly Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Gly Trp Ile Asn Thr Tyr Thr Gly Glu Pro Thr Tyr Ala Ala Asp Phe
50 55 60
Lys Arg Arg Phe Thr Phe Ser Leu Asp Thr Ser Lys Ser Thr Ala Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Lys Tyr Pro Tyr Tyr Tyr Gly Thr Ser His Trp Tyr Phe Asp Val
100 105 110
Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly
115 120 125
Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly
130 135 140
Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val
145 150 155 160
Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe
165 170 175
Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val
180 185 190
Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val
195 200 205
Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys
210 215 220
Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu
225 230 235 240
Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr
245 250 255
Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val
260 265 270
Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val
275 280 285
Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser
290 295 300
Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu
305 310 315 320
Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala
325 330 335
Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro
340 345 350
Gln Val Tyr Thr Leu Pro Pro Cys Arg Asp Glu Leu Thr Lys Asn Gln
355 360 365
Val Ser Leu Trp Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala
370 375 380
Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr
385 390 395 400
Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu
405 410 415
Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser
420 425 430
Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser
435 440 445
Leu Ser Pro Gly Lys
450
<210> 53
<211> 463
<212> PRT
<213> Искусственная
<220>
<223> Тяжелая цепь 2 <VEGF-ANG-2> CrossMAb IgG1 дикого типа(без
AAA-мутаций) (VEGFang2-0201)
<400> 53
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Gly Tyr
20 25 30
Tyr Met His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Trp Ile Asn Pro Asn Ser Gly Gly Thr Asn Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Met Thr Arg Asp Thr Ser Ile Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Arg Leu Arg Ser Asp Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Ser Pro Asn Pro Tyr Tyr Tyr Asp Ser Ser Gly Tyr Tyr Tyr
100 105 110
Pro Gly Ala Phe Asp Ile Trp Gly Gln Gly Thr Met Val Thr Val Ser
115 120 125
Ser Ala Ser Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp
130 135 140
Glu Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn
145 150 155 160
Phe Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu
165 170 175
Gln Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp
180 185 190
Ser Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr
195 200 205
Glu Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser
210 215 220
Ser Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys Asp Lys Thr His
225 230 235 240
Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val
245 250 255
Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr
260 265 270
Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu
275 280 285
Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys
290 295 300
Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser
305 310 315 320
Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys
325 330 335
Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile
340 345 350
Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Cys Thr Leu Pro
355 360 365
Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Ser Cys Ala
370 375 380
Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn
385 390 395 400
Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser
405 410 415
Asp Gly Ser Phe Phe Leu Val Ser Lys Leu Thr Val Asp Lys Ser Arg
420 425 430
Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu
435 440 445
His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
450 455 460
<210> 54
<211> 214
<212> PRT
<213> Искусственная
<220>
<223> Легкая цепь 1 <VEGF-ANG-2> CrossMAb IgG1 дикого типа(без
AAA-мутаций) (VEGFang2-0201)
<400> 54
Asp Ile Gln Leu Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Ser Ala Ser Gln Asp Ile Ser Asn Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Val Leu Ile
35 40 45
Tyr Phe Thr Ser Ser Leu His Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Tyr Ser Thr Val Pro Trp
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Arg Thr Val Ala Ala
100 105 110
Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly
115 120 125
Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala
130 135 140
Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln
145 150 155 160
Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser
165 170 175
Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr
180 185 190
Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser
195 200 205
Phe Asn Arg Gly Glu Cys
210
<210> 55
<211> 213
<212> PRT
<213> Искусственная
<220>
<223> Легкая цепь 2 <VEGF-ANG-2> CrossMAb IgG1 дикого типа(без
AAA-мутаций) (VEGFang2-0201)
<400> 55
Ser Tyr Val Leu Thr Gln Pro Pro Ser Val Ser Val Ala Pro Gly Gln
1 5 10 15
Thr Ala Arg Ile Thr Cys Gly Gly Asn Asn Ile Gly Ser Lys Ser Val
20 25 30
His Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Val Leu Val Val Tyr
35 40 45
Asp Asp Ser Asp Arg Pro Ser Gly Ile Pro Glu Arg Phe Ser Gly Ser
50 55 60
Asn Ser Gly Asn Thr Ala Thr Leu Thr Ile Ser Arg Val Glu Ala Gly
65 70 75 80
Asp Glu Ala Asp Tyr Tyr Cys Gln Val Trp Asp Ser Ser Ser Asp His
85 90 95
Trp Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu Ser Ser Ala Ser
100 105 110
Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr
115 120 125
Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro
130 135 140
Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val
145 150 155 160
His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser
165 170 175
Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile
180 185 190
Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys Lys Val
195 200 205
Glu Pro Lys Ser Cys
210
<210> 56
<211> 453
<212> PRT
<213> Искусственная
<220>
<223> Тяжелая цепь 1 <VEGF-ANG-2> CrossMAb IgG1 с P329G LALA-
мутациями только (без AAA-мутаций) (VEGFang2-0015)
<400> 56
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Tyr Asp Phe Thr His Tyr
20 25 30
Gly Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Gly Trp Ile Asn Thr Tyr Thr Gly Glu Pro Thr Tyr Ala Ala Asp Phe
50 55 60
Lys Arg Arg Phe Thr Phe Ser Leu Asp Thr Ser Lys Ser Thr Ala Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Lys Tyr Pro Tyr Tyr Tyr Gly Thr Ser His Trp Tyr Phe Asp Val
100 105 110
Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly
115 120 125
Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly
130 135 140
Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val
145 150 155 160
Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe
165 170 175
Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val
180 185 190
Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val
195 200 205
Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys
210 215 220
Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Ala
225 230 235 240
Ala Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr
245 250 255
Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val
260 265 270
Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val
275 280 285
Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser
290 295 300
Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu
305 310 315 320
Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Gly Ala
325 330 335
Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro
340 345 350
Gln Val Tyr Thr Leu Pro Pro Cys Arg Asp Glu Leu Thr Lys Asn Gln
355 360 365
Val Ser Leu Trp Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala
370 375 380
Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr
385 390 395 400
Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu
405 410 415
Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser
420 425 430
Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser
435 440 445
Leu Ser Pro Gly Lys
450
<210> 57
<211> 463
<212> PRT
<213> Искусственная
<220>
<223> Тяжелая цепь 2 <VEGF-ANG-2> CrossMAb IgG1 с P329G LALA-
мутациями только (без AAA-мутаций) (VEGFang2-0015)
<400> 57
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Gly Tyr
20 25 30
Tyr Met His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Trp Ile Asn Pro Asn Ser Gly Gly Thr Asn Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Met Thr Arg Asp Thr Ser Ile Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Arg Leu Arg Ser Asp Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Ser Pro Asn Pro Tyr Tyr Tyr Asp Ser Ser Gly Tyr Tyr Tyr
100 105 110
Pro Gly Ala Phe Asp Ile Trp Gly Gln Gly Thr Met Val Thr Val Ser
115 120 125
Ser Ala Ser Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp
130 135 140
Glu Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn
145 150 155 160
Phe Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu
165 170 175
Gln Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp
180 185 190
Ser Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr
195 200 205
Glu Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser
210 215 220
Ser Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys Asp Lys Thr His
225 230 235 240
Thr Cys Pro Pro Cys Pro Ala Pro Glu Ala Ala Gly Gly Pro Ser Val
245 250 255
Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr
260 265 270
Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu
275 280 285
Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys
290 295 300
Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser
305 310 315 320
Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys
325 330 335
Cys Lys Val Ser Asn Lys Ala Leu Gly Ala Pro Ile Glu Lys Thr Ile
340 345 350
Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Cys Thr Leu Pro
355 360 365
Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Ser Cys Ala
370 375 380
Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn
385 390 395 400
Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser
405 410 415
Asp Gly Ser Phe Phe Leu Val Ser Lys Leu Thr Val Asp Lys Ser Arg
420 425 430
Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu
435 440 445
His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
450 455 460
<210> 58
<211> 214
<212> PRT
<213> Искусственная
<220>
<223> Легкая цепь 1 <VEGF-ANG-2> CrossMAb IgG1 с P329G LALA-
мутациями только (без AAA-мутаций) (VEGFang2-0015)
<400> 58
Asp Ile Gln Leu Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Ser Ala Ser Gln Asp Ile Ser Asn Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Val Leu Ile
35 40 45
Tyr Phe Thr Ser Ser Leu His Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Tyr Ser Thr Val Pro Trp
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Arg Thr Val Ala Ala
100 105 110
Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly
115 120 125
Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala
130 135 140
Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln
145 150 155 160
Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser
165 170 175
Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr
180 185 190
Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser
195 200 205
Phe Asn Arg Gly Glu Cys
210
<210> 59
<211> 213
<212> PRT
<213> Искусственная
<220>
<223> Легкая цепь 2 <VEGF-ANG-2> CrossMAb IgG1 с P329G LALA-
мутациями только (без AAA-мутаций) (VEGFang2-0015)
<400> 59
Ser Tyr Val Leu Thr Gln Pro Pro Ser Val Ser Val Ala Pro Gly Gln
1 5 10 15
Thr Ala Arg Ile Thr Cys Gly Gly Asn Asn Ile Gly Ser Lys Ser Val
20 25 30
His Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Val Leu Val Val Tyr
35 40 45
Asp Asp Ser Asp Arg Pro Ser Gly Ile Pro Glu Arg Phe Ser Gly Ser
50 55 60
Asn Ser Gly Asn Thr Ala Thr Leu Thr Ile Ser Arg Val Glu Ala Gly
65 70 75 80
Asp Glu Ala Asp Tyr Tyr Cys Gln Val Trp Asp Ser Ser Ser Asp His
85 90 95
Trp Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu Ser Ser Ala Ser
100 105 110
Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr
115 120 125
Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro
130 135 140
Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val
145 150 155 160
His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser
165 170 175
Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile
180 185 190
Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys Lys Val
195 200 205
Glu Pro Lys Ser Cys
210
<210> 60
<211> 227
<212> PRT
<213> Homo sapiens
<400> 60
Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly
1 5 10 15
Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met
20 25 30
Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His
35 40 45
Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val
50 55 60
His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr
65 70 75 80
Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly
85 90 95
Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile
100 105 110
Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val
115 120 125
Tyr Thr Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser
130 135 140
Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu
145 150 155 160
Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro
165 170 175
Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val
180 185 190
Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met
195 200 205
His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser
210 215 220
Pro Gly Lys
225
<210> 61
<211> 326
<212> PRT
<213> Homo sapiens
<400> 61
Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Cys Ser Arg
1 5 10 15
Ser Thr Ser Glu Ser Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr
20 25 30
Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser
35 40 45
Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser
50 55 60
Leu Ser Ser Val Val Thr Val Pro Ser Ser Asn Phe Gly Thr Gln Thr
65 70 75 80
Tyr Thr Cys Asn Val Asp His Lys Pro Ser Asn Thr Lys Val Asp Lys
85 90 95
Thr Val Glu Arg Lys Cys Cys Val Glu Cys Pro Pro Cys Pro Ala Pro
100 105 110
Pro Val Ala Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp
115 120 125
Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp
130 135 140
Val Ser His Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp Gly
145 150 155 160
Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe Asn
165 170 175
Ser Thr Phe Arg Val Val Ser Val Leu Thr Val Val His Gln Asp Trp
180 185 190
Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu Pro
195 200 205
Ala Pro Ile Glu Lys Thr Ile Ser Lys Thr Lys Gly Gln Pro Arg Glu
210 215 220
Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Glu Glu Met Thr Lys Asn
225 230 235 240
Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile
245 250 255
Ser Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr
260 265 270
Thr Pro Pro Met Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys
275 280 285
Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys
290 295 300
Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu
305 310 315 320
Ser Leu Ser Pro Gly Lys
325
<210> 62
<211> 377
<212> PRT
<213> Homo sapiens
<400> 62
Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Cys Ser Arg
1 5 10 15
Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr
20 25 30
Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser
35 40 45
Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser
50 55 60
Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr
65 70 75 80
Tyr Thr Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys
85 90 95
Arg Val Glu Leu Lys Thr Pro Leu Gly Asp Thr Thr His Thr Cys Pro
100 105 110
Arg Cys Pro Glu Pro Lys Ser Cys Asp Thr Pro Pro Pro Cys Pro Arg
115 120 125
Cys Pro Glu Pro Lys Ser Cys Asp Thr Pro Pro Pro Cys Pro Arg Cys
130 135 140
Pro Glu Pro Lys Ser Cys Asp Thr Pro Pro Pro Cys Pro Arg Cys Pro
145 150 155 160
Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys
165 170 175
Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val
180 185 190
Val Val Asp Val Ser His Glu Asp Pro Glu Val Gln Phe Lys Trp Tyr
195 200 205
Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu
210 215 220
Gln Tyr Asn Ser Thr Phe Arg Val Val Ser Val Leu Thr Val Leu His
225 230 235 240
Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys
245 250 255
Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Thr Lys Gly Gln
260 265 270
Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Glu Glu Met
275 280 285
Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro
290 295 300
Ser Asp Ile Ala Val Glu Trp Glu Ser Ser Gly Gln Pro Glu Asn Asn
305 310 315 320
Tyr Asn Thr Thr Pro Pro Met Leu Asp Ser Asp Gly Ser Phe Phe Leu
325 330 335
Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Ile
340 345 350
Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn Arg Phe Thr Gln
355 360 365
Lys Ser Leu Ser Leu Ser Pro Gly Lys
370 375
<210> 63
<211> 229
<212> PRT
<213> Homo sapiens
<400> 63
Glu Ser Lys Tyr Gly Pro Pro Cys Pro Ser Cys Pro Ala Pro Glu Phe
1 5 10 15
Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr
20 25 30
Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val
35 40 45
Ser Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp Gly Val
50 55 60
Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser
65 70 75 80
Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu
85 90 95
Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu Pro Ser
100 105 110
Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro
115 120 125
Gln Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met Thr Lys Asn Gln
130 135 140
Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala
145 150 155 160
Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr
165 170 175
Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu
180 185 190
Thr Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val Phe Ser Cys Ser
195 200 205
Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser
210 215 220
Leu Ser Leu Gly Lys
225
<210> 64
<211> 227
<212> PRT
<213> Искусственная последовательность
<220>
<223> Полипептид Fc-области, полученный из Fc-области человеческого IgG1, с мутациями L234A, L235A
<400> 64
Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Ala Ala Gly
1 5 10 15
Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met
20 25 30
Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His
35 40 45
Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val
50 55 60
His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr
65 70 75 80
Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly
85 90 95
Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile
100 105 110
Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val
115 120 125
Tyr Thr Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser
130 135 140
Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu
145 150 155 160
Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro
165 170 175
Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val
180 185 190
Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met
195 200 205
His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser
210 215 220
Pro Gly Lys
225
<210> 65
<211> 227
<212> PRT
<213> Искусственная последовательность
<220>
<223> Полипептид Fc-области, полученный из Fc-области человеческого IgG1, с мутациями Y349C, T366S, L368A и Y407V
<400> 65
Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly
1 5 10 15
Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met
20 25 30
Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His
35 40 45
Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val
50 55 60
His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr
65 70 75 80
Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly
85 90 95
Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile
100 105 110
Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val
115 120 125
Cys Thr Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser
130 135 140
Leu Ser Cys Ala Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu
145 150 155 160
Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro
165 170 175
Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Val Ser Lys Leu Thr Val
180 185 190
Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met
195 200 205
His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser
210 215 220
Pro Gly Lys
225
<210> 66
<211> 227
<212> PRT
<213> Искусственная последовательность
<220>
<223> Полипептид Fc-области, полученный из Fc-области человеческого IgG1, с мутациями S354C, T366W
<400> 66
Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly
1 5 10 15
Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met
20 25 30
Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His
35 40 45
Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val
50 55 60
His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr
65 70 75 80
Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly
85 90 95
Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile
100 105 110
Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val
115 120 125
Tyr Thr Leu Pro Pro Cys Arg Asp Glu Leu Thr Lys Asn Gln Val Ser
130 135 140
Leu Trp Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu
145 150 155 160
Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro
165 170 175
Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val
180 185 190
Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met
195 200 205
His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser
210 215 220
Pro Gly Lys
225
<210> 67
<211> 227
<212> PRT
<213> Искусственная последовательность
<220>
<223> Полипептид Fc-области, полученный из Fc-области человеческого IgG1, с мутациями L234A, L235A и с мутациями Y349C, T366S, L368A, Y407V
<400> 67
Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Ala Ala Gly
1 5 10 15
Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met
20 25 30
Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His
35 40 45
Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val
50 55 60
His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr
65 70 75 80
Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly
85 90 95
Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile
100 105 110
Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val
115 120 125
Cys Thr Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser
130 135 140
Leu Ser Cys Ala Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu
145 150 155 160
Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro
165 170 175
Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Val Ser Lys Leu Thr Val
180 185 190
Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met
195 200 205
His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser
210 215 220
Pro Gly Lys
225
<210> 68
<211> 227
<212> PRT
<213> Искусственная последовательность
<220>
<223> Полипептид Fc-области, полученный из Fc-области человеческого IgG1, с мутациями L234A, L235A и S354C, T366W
<400> 68
Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Ala Ala Gly
1 5 10 15
Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met
20 25 30
Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His
35 40 45
Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val
50 55 60
His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr
65 70 75 80
Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly
85 90 95
Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile
100 105 110
Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val
115 120 125
Tyr Thr Leu Pro Pro Cys Arg Asp Glu Leu Thr Lys Asn Gln Val Ser
130 135 140
Leu Trp Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu
145 150 155 160
Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro
165 170 175
Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val
180 185 190
Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met
195 200 205
His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser
210 215 220
Pro Gly Lys
225
<210> 69
<211> 227
<212> PRT
<213> Искусственная последовательность
<220>
<223> Полипептид Fc-области, полученный из Fc-области человеческого IgG1, с мутацией P329G
<400> 69
Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly
1 5 10 15
Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met
20 25 30
Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His
35 40 45
Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val
50 55 60
His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr
65 70 75 80
Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly
85 90 95
Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Gly Ala Pro Ile
100 105 110
Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val
115 120 125
Tyr Thr Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser
130 135 140
Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu
145 150 155 160
Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro
165 170 175
Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val
180 185 190
Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met
195 200 205
His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser
210 215 220
Pro Gly Lys
225
<210> 70
<211> 227
<212> PRT
<213> Искусственная последовательность
<220>
<223> Полипептид Fc-области, полученный из Fc-области человеческого IgG1, с мутациями L234A, L235A и с мутацией P329G
<400> 70
Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Ala Ala Gly
1 5 10 15
Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met
20 25 30
Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His
35 40 45
Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val
50 55 60
His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr
65 70 75 80
Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly
85 90 95
Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Gly Ala Pro Ile
100 105 110
Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val
115 120 125
Tyr Thr Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser
130 135 140
Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu
145 150 155 160
Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro
165 170 175
Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val
180 185 190
Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met
195 200 205
His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser
210 215 220
Pro Gly Lys
225
<210> 71
<211> 227
<212> PRT
<213> Искусственная последовательность
<220>
<223> Полипептид Fc-области, полученный из Fc-области человеческого IgG1, с мутацией P239G и мутациями Y349C, T366S, L368A, Y407V
<400> 71
Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly
1 5 10 15
Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met
20 25 30
Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His
35 40 45
Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val
50 55 60
His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr
65 70 75 80
Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly
85 90 95
Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Gly Ala Pro Ile
100 105 110
Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val
115 120 125
Cys Thr Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser
130 135 140
Leu Ser Cys Ala Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu
145 150 155 160
Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro
165 170 175
Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Val Ser Lys Leu Thr Val
180 185 190
Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met
195 200 205
His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser
210 215 220
Pro Gly Lys
225
<210> 72
<211> 227
<212> PRT
<213> Искусственная последовательность
<220>
<223> Полипептид Fc-области, полученный из Fc-области человеческого IgG1, с мутацией P329G и с мутацией S354C, T366W
<400> 72
Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly
1 5 10 15
Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met
20 25 30
Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His
35 40 45
Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val
50 55 60
His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr
65 70 75 80
Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly
85 90 95
Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Gly Ala Pro Ile
100 105 110
Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val
115 120 125
Tyr Thr Leu Pro Pro Cys Arg Asp Glu Leu Thr Lys Asn Gln Val Ser
130 135 140
Leu Trp Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu
145 150 155 160
Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro
165 170 175
Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val
180 185 190
Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met
195 200 205
His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser
210 215 220
Pro Gly Lys
225
<210> 73
<211> 227
<212> PRT
<213> Искусственная последовательность
<220>
<223> Полипептид Fc-области, полученный из Fc-области человеческого IgG1, с мутациями L234A, L235A, P329G и Y349C, T366S, L368A, Y407V
<400> 73
Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Ala Ala Gly
1 5 10 15
Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met
20 25 30
Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His
35 40 45
Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val
50 55 60
His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr
65 70 75 80
Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly
85 90 95
Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Gly Ala Pro Ile
100 105 110
Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val
115 120 125
Cys Thr Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser
130 135 140
Leu Ser Cys Ala Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu
145 150 155 160
Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro
165 170 175
Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Val Ser Lys Leu Thr Val
180 185 190
Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met
195 200 205
His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser
210 215 220
Pro Gly Lys
225
<210> 74
<211> 227
<212> PRT
<213> Искусственная последовательность
<220>
<223> Полипептид Fc-области, полученный из Fc-области человеческого IgG1, с мутациями L234A, L235A, P329G и с мутациями S354C, T366W
<400> 74
Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Ala Ala Gly
1 5 10 15
Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met
20 25 30
Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His
35 40 45
Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val
50 55 60
His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr
65 70 75 80
Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly
85 90 95
Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Gly Ala Pro Ile
100 105 110
Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val
115 120 125
Tyr Thr Leu Pro Pro Cys Arg Asp Glu Leu Thr Lys Asn Gln Val Ser
130 135 140
Leu Trp Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu
145 150 155 160
Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro
165 170 175
Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val
180 185 190
Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met
195 200 205
His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser
210 215 220
Pro Gly Lys
225
<210> 75
<211> 229
<212> PRT
<213> Искусственная последовательность
<220>
<223> Полипептид Fc-области, полученный из Fc-области человеческого IgG4, с мутациями S228P и L235E
<400> 75
Glu Ser Lys Tyr Gly Pro Pro Cys Pro Pro Cys Pro Ala Pro Glu Phe
1 5 10 15
Glu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr
20 25 30
Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val
35 40 45
Ser Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp Gly Val
50 55 60
Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser
65 70 75 80
Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu
85 90 95
Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu Pro Ser
100 105 110
Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro
115 120 125
Gln Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met Thr Lys Asn Gln
130 135 140
Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala
145 150 155 160
Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr
165 170 175
Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu
180 185 190
Thr Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val Phe Ser Cys Ser
195 200 205
Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser
210 215 220
Leu Ser Leu Gly Lys
225
<210> 76
<211> 229
<212> PRT
<213> Искусственная последовательность
<220>
<223> Полипептид Fc-области, полученный из Fc-области человеческого IgG4, с мутациями S228P, L235E мутациями и с мутацией P329G
<400> 76
Glu Ser Lys Tyr Gly Pro Pro Cys Pro Pro Cys Pro Ala Pro Glu Phe
1 5 10 15
Glu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr
20 25 30
Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val
35 40 45
Ser Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp Gly Val
50 55 60
Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser
65 70 75 80
Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu
85 90 95
Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu Gly Ser
100 105 110
Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro
115 120 125
Gln Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met Thr Lys Asn Gln
130 135 140
Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala
145 150 155 160
Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr
165 170 175
Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu
180 185 190
Thr Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val Phe Ser Cys Ser
195 200 205
Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser
210 215 220
Leu Ser Leu Gly Lys
225
<210> 77
<211> 229
<212> PRT
<213> Искусственная последовательность
<220>
<223> Полипептид Fc-области, полученный из Fc-области человеческого IgG4, с мутациями S354C,T366W
<400> 77
Glu Ser Lys Tyr Gly Pro Pro Cys Pro Ser Cys Pro Ala Pro Glu Phe
1 5 10 15
Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr
20 25 30
Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val
35 40 45
Ser Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp Gly Val
50 55 60
Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser
65 70 75 80
Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu
85 90 95
Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu Pro Ser
100 105 110
Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro
115 120 125
Gln Val Tyr Thr Leu Pro Pro Cys Gln Glu Glu Met Thr Lys Asn Gln
130 135 140
Val Ser Leu Trp Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala
145 150 155 160
Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr
165 170 175
Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu
180 185 190
Thr Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val Phe Ser Cys Ser
195 200 205
Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser
210 215 220
Leu Ser Leu Gly Lys
225
<210> 78
<211> 229
<212> PRT
<213> Искусственная последовательность
<220>
<223> Полипептид Fc-области, полученный из Fc-области человеческого IgG4, с мутациями Y349C, T366S, L368A, Y407V
<400> 78
Glu Ser Lys Tyr Gly Pro Pro Cys Pro Ser Cys Pro Ala Pro Glu Phe
1 5 10 15
Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr
20 25 30
Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val
35 40 45
Ser Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp Gly Val
50 55 60
Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser
65 70 75 80
Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu
85 90 95
Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu Pro Ser
100 105 110
Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro
115 120 125
Gln Val Cys Thr Leu Pro Pro Ser Gln Glu Glu Met Thr Lys Asn Gln
130 135 140
Val Ser Leu Ser Cys Ala Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala
145 150 155 160
Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr
165 170 175
Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Val Ser Arg Leu
180 185 190
Thr Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val Phe Ser Cys Ser
195 200 205
Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser
210 215 220
Leu Ser Leu Gly Lys
225
<210> 79
<211> 229
<212> PRT
<213> Искусственная последовательность
<220>
<223> Полипептид Fc-области, полученный из Fc-области человеческого IgG4, с мутациями S228P, L235E и S354C, T366W
<400> 79
Glu Ser Lys Tyr Gly Pro Pro Cys Pro Pro Cys Pro Ala Pro Glu Phe
1 5 10 15
Glu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr
20 25 30
Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val
35 40 45
Ser Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp Gly Val
50 55 60
Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser
65 70 75 80
Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu
85 90 95
Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu Pro Ser
100 105 110
Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro
115 120 125
Gln Val Tyr Thr Leu Pro Pro Cys Gln Glu Glu Met Thr Lys Asn Gln
130 135 140
Val Ser Leu Trp Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala
145 150 155 160
Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr
165 170 175
Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu
180 185 190
Thr Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val Phe Ser Cys Ser
195 200 205
Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser
210 215 220
Leu Ser Leu Gly Lys
225
<210> 80
<211> 229
<212> PRT
<213> Искусственная последовательность
<220>
<223> Полипептид Fc-области, полученный из Fc-области человеческого IgG4, с мутациями S228P, L235E и Y349C, T366S, L368A, Y407V
<400> 80
Glu Ser Lys Tyr Gly Pro Pro Cys Pro Pro Cys Pro Ala Pro Glu Phe
1 5 10 15
Glu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr
20 25 30
Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val
35 40 45
Ser Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp Gly Val
50 55 60
Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser
65 70 75 80
Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu
85 90 95
Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu Pro Ser
100 105 110
Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro
115 120 125
Gln Val Cys Thr Leu Pro Pro Ser Gln Glu Glu Met Thr Lys Asn Gln
130 135 140
Val Ser Leu Ser Cys Ala Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala
145 150 155 160
Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr
165 170 175
Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Val Ser Arg Leu
180 185 190
Thr Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val Phe Ser Cys Ser
195 200 205
Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser
210 215 220
Leu Ser Leu Gly Lys
225
<210> 81
<211> 229
<212> PRT
<213> Искусственная последовательность
<220>
<223> Полипептид Fc-области, полученный из Fc-области человеческого IgG4, с мутацией P329G
<400> 81
Glu Ser Lys Tyr Gly Pro Pro Cys Pro Ser Cys Pro Ala Pro Glu Phe
1 5 10 15
Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr
20 25 30
Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val
35 40 45
Ser Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp Gly Val
50 55 60
Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser
65 70 75 80
Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu
85 90 95
Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu Gly Ser
100 105 110
Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro
115 120 125
Gln Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met Thr Lys Asn Gln
130 135 140
Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala
145 150 155 160
Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr
165 170 175
Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu
180 185 190
Thr Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val Phe Ser Cys Ser
195 200 205
Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser
210 215 220
Leu Ser Leu Gly Lys
225
<210> 82
<211> 229
<212> PRT
<213> Искусственная последовательность
<220>
<223> Полипептид Fc-области, полученный из Fc-области человеческого IgG4, с мутациями P239G и Y349C, T366S, L368A, Y407V
<400> 82
Glu Ser Lys Tyr Gly Pro Pro Cys Pro Ser Cys Pro Ala Pro Glu Phe
1 5 10 15
Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr
20 25 30
Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val
35 40 45
Ser Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp Gly Val
50 55 60
Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser
65 70 75 80
Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu
85 90 95
Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu Gly Ser
100 105 110
Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro
115 120 125
Gln Val Cys Thr Leu Pro Pro Ser Gln Glu Glu Met Thr Lys Asn Gln
130 135 140
Val Ser Leu Ser Cys Ala Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala
145 150 155 160
Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr
165 170 175
Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Val Ser Arg Leu
180 185 190
Thr Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val Phe Ser Cys Ser
195 200 205
Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser
210 215 220
Leu Ser Leu Gly Lys
225
<210> 83
<211> 229
<212> PRT
<213> Искусственная последовательность
<220>
<223> Полипептид Fc-области, полученный из Fc-области человеческого IgG4, с мутациями P329G и S354C, T366W
<400> 83
Glu Ser Lys Tyr Gly Pro Pro Cys Pro Ser Cys Pro Ala Pro Glu Phe
1 5 10 15
Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr
20 25 30
Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val
35 40 45
Ser Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp Gly Val
50 55 60
Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser
65 70 75 80
Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu
85 90 95
Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu Gly Ser
100 105 110
Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro
115 120 125
Gln Val Tyr Thr Leu Pro Pro Cys Gln Glu Glu Met Thr Lys Asn Gln
130 135 140
Val Ser Leu Trp Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala
145 150 155 160
Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr
165 170 175
Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu
180 185 190
Thr Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val Phe Ser Cys Ser
195 200 205
Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser
210 215 220
Leu Ser Leu Gly Lys
225
<210> 84
<211> 229
<212> PRT
<213> Искусственная последовательность
<220>
<223> Полипептид Fc-области, полученный из Fc-области человеческого IgG4, с мутациями S228P, L235E, P329G и Y349C, T366S, L368A, Y407V
<400> 84
Glu Ser Lys Tyr Gly Pro Pro Cys Pro Pro Cys Pro Ala Pro Glu Phe
1 5 10 15
Glu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr
20 25 30
Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val
35 40 45
Ser Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp Gly Val
50 55 60
Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser
65 70 75 80
Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu
85 90 95
Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu Gly Ser
100 105 110
Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro
115 120 125
Gln Val Cys Thr Leu Pro Pro Ser Gln Glu Glu Met Thr Lys Asn Gln
130 135 140
Val Ser Leu Ser Cys Ala Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala
145 150 155 160
Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr
165 170 175
Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Val Ser Arg Leu
180 185 190
Thr Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val Phe Ser Cys Ser
195 200 205
Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser
210 215 220
Leu Ser Leu Gly Lys
225
<210> 85
<211> 229
<212> PRT
<213> Искусственная последовательность
<220>
<223> Полипептид Fc-области, полученный из Fc-области человеческого IgG4, с мутациями S228P, L235E, P329G и S354C, T366W
<400> 85
Glu Ser Lys Tyr Gly Pro Pro Cys Pro Pro Cys Pro Ala Pro Glu Phe
1 5 10 15
Glu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr
20 25 30
Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val
35 40 45
Ser Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp Gly Val
50 55 60
Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser
65 70 75 80
Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu
85 90 95
Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu Gly Ser
100 105 110
Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro
115 120 125
Gln Val Tyr Thr Leu Pro Pro Cys Gln Glu Glu Met Thr Lys Asn Gln
130 135 140
Val Ser Leu Trp Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala
145 150 155 160
Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr
165 170 175
Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu
180 185 190
Thr Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val Phe Ser Cys Ser
195 200 205
Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser
210 215 220
Leu Ser Leu Gly Lys
225
<210> 86
<211> 105
<212> PRT
<213> Нomo sapiens
<400> 86
Gln Pro Lys Ala Ala Pro Ser Val Thr Leu Phe Pro Pro Ser Ser Glu
1 5 10 15
Glu Leu Gln Ala Asn Lys Ala Thr Leu Val Cys Leu Ile Ser Asp Phe
20 25 30
Tyr Pro Gly Ala Val Thr Val Ala Trp Lys Ala Asp Ser Ser Pro Val
35 40 45
Lys Ala Gly Val Glu Thr Thr Thr Pro Ser Lys Gln Ser Asn Asn Lys
50 55 60
Tyr Ala Ala Ser Ser Tyr Leu Ser Leu Thr Pro Glu Gln Trp Lys Ser
65 70 75 80
His Arg Ser Tyr Ser Cys Gln Val Thr His Glu Gly Ser Thr Val Glu
85 90 95
Lys Thr Val Ala Pro Thr Glu Cys Ser
100 105
<210> 87
<211> 107
<212> PRT
<213> Homo sapiens
<400> 87
Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu
1 5 10 15
Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe
20 25 30
Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln
35 40 45
Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser
50 55 60
Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu
65 70 75 80
Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser
85 90 95
Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
100 105
<210> 88
<211> 215
<212> PRT
<213> Искусственная последовательность
<220>
<223> IGF-1R LC
<400> 88
Glu Ile Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Ser Ser Tyr
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Asp Ala Ser Lys Arg Ala Thr Gly Ile Pro Ala Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Glu Pro
65 70 75 80
Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Arg Ser Lys Trp Pro Pro
85 90 95
Trp Thr Phe Gly Gln Gly Thr Lys Val Glu Ser Lys Arg Thr Val Ala
100 105 110
Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser
115 120 125
Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu
130 135 140
Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser
145 150 155 160
Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu
165 170 175
Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val
180 185 190
Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys
195 200 205
Ser Phe Asn Arg Gly Glu Cys
210 215
<210> 89
<211> 447
<212> PRT
<213> Искусственная последовательность
<220>
<223> IGF-1R wt
<400> 89
Gln Val Glu Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Arg
1 5 10 15
Ser Gln Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Gly Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Ile Ile Trp Phe Asp Gly Ser Ser Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Arg Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Phe Cys
85 90 95
Ala Arg Glu Leu Gly Arg Arg Tyr Phe Asp Leu Trp Gly Arg Gly Thr
100 105 110
Leu Val Ser Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro
115 120 125
Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly
130 135 140
Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn
145 150 155 160
Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln
165 170 175
Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser
180 185 190
Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser
195 200 205
Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys Thr
210 215 220
His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser
225 230 235 240
Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg
245 250 255
Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro
260 265 270
Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala
275 280 285
Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val
290 295 300
Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr
305 310 315 320
Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr
325 330 335
Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu
340 345 350
Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Thr Cys
355 360 365
Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser
370 375 380
Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp
385 390 395 400
Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser
405 410 415
Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala
420 425 430
Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly
435 440 445
<210> 90
<211> 447
<212> PRT
<213> Искусственная последовательность
<220>
<223> IGF-1R AAA
<400> 90
Gln Val Glu Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Arg
1 5 10 15
Ser Gln Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Gly Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Ile Ile Trp Phe Asp Gly Ser Ser Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Arg Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Phe Cys
85 90 95
Ala Arg Glu Leu Gly Arg Arg Tyr Phe Asp Leu Trp Gly Arg Gly Thr
100 105 110
Leu Val Ser Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro
115 120 125
Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly
130 135 140
Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn
145 150 155 160
Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln
165 170 175
Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser
180 185 190
Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser
195 200 205
Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys Thr
210 215 220
His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser
225 230 235 240
Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ala Ser Arg
245 250 255
Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro
260 265 270
Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala
275 280 285
Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val
290 295 300
Ser Val Leu Thr Val Leu Ala Gln Asp Trp Leu Asn Gly Lys Glu Tyr
305 310 315 320
Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr
325 330 335
Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu
340 345 350
Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Thr Cys
355 360 365
Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser
370 375 380
Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp
385 390 395 400
Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser
405 410 415
Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala
420 425 430
Leu His Asn Ala Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly
435 440 445
<210> 91
<211> 447
<212> PRT
<213> Искусственная последовательность
<220>
<223> IGF-1R YTE
<400> 91
Gln Val Glu Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Arg
1 5 10 15
Ser Gln Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Gly Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Ile Ile Trp Phe Asp Gly Ser Ser Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Arg Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Phe Cys
85 90 95
Ala Arg Glu Leu Gly Arg Arg Tyr Phe Asp Leu Trp Gly Arg Gly Thr
100 105 110
Leu Val Ser Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro
115 120 125
Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly
130 135 140
Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn
145 150 155 160
Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln
165 170 175
Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser
180 185 190
Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser
195 200 205
Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys Thr
210 215 220
His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser
225 230 235 240
Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Tyr Ile Thr Arg
245 250 255
Glu Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro
260 265 270
Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala
275 280 285
Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val
290 295 300
Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr
305 310 315 320
Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr
325 330 335
Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu
340 345 350
Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Thr Cys
355 360 365
Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser
370 375 380
Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp
385 390 395 400
Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser
405 410 415
Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala
420 425 430
Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly
435 440 445
<210> 92
<211> 448
<212> PRT
<213> Искусственная последовательность
<220>
<223> IgG1 wtKiH
<400> 92
Gln Val Glu Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Arg
1 5 10 15
Ser Gln Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Gly Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Ile Ile Trp Phe Asp Gly Ser Ser Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Arg Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Phe Cys
85 90 95
Ala Arg Glu Leu Gly Arg Arg Tyr Phe Asp Leu Trp Gly Arg Gly Thr
100 105 110
Leu Val Ser Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro
115 120 125
Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly
130 135 140
Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn
145 150 155 160
Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln
165 170 175
Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser
180 185 190
Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser
195 200 205
Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys Thr
210 215 220
His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser
225 230 235 240
Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg
245 250 255
Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro
260 265 270
Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala
275 280 285
Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val
290 295 300
Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr
305 310 315 320
Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr
325 330 335
Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu
340 345 350
Pro Pro Cys Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Trp Cys
355 360 365
Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser
370 375 380
Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp
385 390 395 400
Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser
405 410 415
Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala
420 425 430
Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
435 440 445
<210> 93
<211> 448
<212> PRT
<213> Искусственная последовательность
<220>
<223> VH-IGG1-FCSSHOLE
<400> 93
Gln Val Glu Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Arg
1 5 10 15
Ser Gln Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Gly Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Ile Ile Trp Phe Asp Gly Ser Ser Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Arg Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Phe Cys
85 90 95
Ala Arg Glu Leu Gly Arg Arg Tyr Phe Asp Leu Trp Gly Arg Gly Thr
100 105 110
Leu Val Ser Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro
115 120 125
Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly
130 135 140
Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn
145 150 155 160
Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln
165 170 175
Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser
180 185 190
Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser
195 200 205
Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys Thr
210 215 220
His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser
225 230 235 240
Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg
245 250 255
Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro
260 265 270
Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala
275 280 285
Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val
290 295 300
Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr
305 310 315 320
Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr
325 330 335
Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Cys Thr Leu
340 345 350
Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Ser Cys
355 360 365
Ala Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser
370 375 380
Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp
385 390 395 400
Ser Asp Gly Ser Phe Phe Leu Val Ser Lys Leu Thr Val Asp Lys Ser
405 410 415
Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala
420 425 430
Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
435 440 445
<210> 94
<211> 448
<212> PRT
<213> Искусственная последовательность
<220>
<223> I253A, H310A, H435A
<400> 94
Gln Val Glu Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Arg
1 5 10 15
Ser Gln Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Gly Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Ile Ile Trp Phe Asp Gly Ser Ser Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Arg Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Phe Cys
85 90 95
Ala Arg Glu Leu Gly Arg Arg Tyr Phe Asp Leu Trp Gly Arg Gly Thr
100 105 110
Leu Val Ser Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro
115 120 125
Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly
130 135 140
Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn
145 150 155 160
Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln
165 170 175
Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser
180 185 190
Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser
195 200 205
Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys Thr
210 215 220
His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser
225 230 235 240
Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg
245 250 255
Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro
260 265 270
Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala
275 280 285
Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val
290 295 300
Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr
305 310 315 320
Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr
325 330 335
Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu
340 345 350
Pro Pro Cys Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Trp Cys
355 360 365
Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser
370 375 380
Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp
385 390 395 400
Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser
405 410 415
Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala
420 425 430
Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
435 440 445
<210> 95
<211> 448
<212> PRT
<213> Искусственная последовательность
<220>
<223> VH-AK18-IGG1-FCSSHOLE-AAA1
<400> 95
Gln Val Glu Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Arg
1 5 10 15
Ser Gln Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Gly Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Ile Ile Trp Phe Asp Gly Ser Ser Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Arg Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Phe Cys
85 90 95
Ala Arg Glu Leu Gly Arg Arg Tyr Phe Asp Leu Trp Gly Arg Gly Thr
100 105 110
Leu Val Ser Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro
115 120 125
Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly
130 135 140
Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn
145 150 155 160
Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln
165 170 175
Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser
180 185 190
Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser
195 200 205
Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys Thr
210 215 220
His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser
225 230 235 240
Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ala Ser Arg
245 250 255
Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro
260 265 270
Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala
275 280 285
Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val
290 295 300
Ser Val Leu Thr Val Leu Ala Gln Asp Trp Leu Asn Gly Lys Glu Tyr
305 310 315 320
Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr
325 330 335
Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Cys Thr Leu
340 345 350
Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Ser Cys
355 360 365
Ala Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser
370 375 380
Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp
385 390 395 400
Ser Asp Gly Ser Phe Phe Leu Val Ser Lys Leu Thr Val Asp Lys Ser
405 410 415
Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala
420 425 430
Leu His Asn Ala Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
435 440 445
<210> 96
<211> 448
<212> PRT
<213> Искусственная последовательность
<220>
<223> H310A, H433A, Y436A
<400> 96
Gln Val Glu Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Arg
1 5 10 15
Ser Gln Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Gly Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Ile Ile Trp Phe Asp Gly Ser Ser Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Arg Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Phe Cys
85 90 95
Ala Arg Glu Leu Gly Arg Arg Tyr Phe Asp Leu Trp Gly Arg Gly Thr
100 105 110
Leu Val Ser Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro
115 120 125
Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly
130 135 140
Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn
145 150 155 160
Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln
165 170 175
Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser
180 185 190
Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser
195 200 205
Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys Thr
210 215 220
His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser
225 230 235 240
Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg
245 250 255
Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro
260 265 270
Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala
275 280 285
Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val
290 295 300
Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr
305 310 315 320
Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr
325 330 335
Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu
340 345 350
Pro Pro Cys Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Trp Cys
355 360 365
Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser
370 375 380
Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp
385 390 395 400
Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser
405 410 415
Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala
420 425 430
Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
435 440 445
<210> 97
<211> 448
<212> PRT
<213> Искусственная последовательность
<220>
<223> VH-IGG1-FCSSHOLE-AAA2
<400> 97
Gln Val Glu Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Arg
1 5 10 15
Ser Gln Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Gly Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Ile Ile Trp Phe Asp Gly Ser Ser Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Arg Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Phe Cys
85 90 95
Ala Arg Glu Leu Gly Arg Arg Tyr Phe Asp Leu Trp Gly Arg Gly Thr
100 105 110
Leu Val Ser Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro
115 120 125
Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly
130 135 140
Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn
145 150 155 160
Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln
165 170 175
Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser
180 185 190
Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser
195 200 205
Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys Thr
210 215 220
His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser
225 230 235 240
Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg
245 250 255
Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro
260 265 270
Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala
275 280 285
Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val
290 295 300
Ser Val Leu Thr Val Leu Ala Gln Asp Trp Leu Asn Gly Lys Glu Tyr
305 310 315 320
Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr
325 330 335
Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Cys Thr Leu
340 345 350
Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Ser Cys
355 360 365
Ala Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser
370 375 380
Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp
385 390 395 400
Ser Asp Gly Ser Phe Phe Leu Val Ser Lys Leu Thr Val Asp Lys Ser
405 410 415
Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala
420 425 430
Leu Ala Asn His Ala Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
435 440 445
<210> 98
<211> 448
<212> PRT
<213> Искусственная последовательность
<220>
<223> M252Y, S254T, T256E
<400> 98
Gln Val Glu Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Arg
1 5 10 15
Ser Gln Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Gly Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Ile Ile Trp Phe Asp Gly Ser Ser Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Arg Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Phe Cys
85 90 95
Ala Arg Glu Leu Gly Arg Arg Tyr Phe Asp Leu Trp Gly Arg Gly Thr
100 105 110
Leu Val Ser Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro
115 120 125
Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly
130 135 140
Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn
145 150 155 160
Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln
165 170 175
Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser
180 185 190
Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser
195 200 205
Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys Thr
210 215 220
His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser
225 230 235 240
Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg
245 250 255
Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro
260 265 270
Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala
275 280 285
Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val
290 295 300
Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr
305 310 315 320
Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr
325 330 335
Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu
340 345 350
Pro Pro Cys Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Trp Cys
355 360 365
Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser
370 375 380
Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp
385 390 395 400
Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser
405 410 415
Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala
420 425 430
Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
435 440 445
<210> 99
<211> 448
<212> PRT
<213> Искусственная последовательность
<220>
<223> VH-IGG1-FCSSHOLE-YTE
<400> 99
Gln Val Glu Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Arg
1 5 10 15
Ser Gln Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Gly Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Ile Ile Trp Phe Asp Gly Ser Ser Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Arg Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Phe Cys
85 90 95
Ala Arg Glu Leu Gly Arg Arg Tyr Phe Asp Leu Trp Gly Arg Gly Thr
100 105 110
Leu Val Ser Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro
115 120 125
Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly
130 135 140
Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn
145 150 155 160
Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln
165 170 175
Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser
180 185 190
Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser
195 200 205
Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys Thr
210 215 220
His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser
225 230 235 240
Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Tyr Ile Thr Arg
245 250 255
Glu Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro
260 265 270
Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala
275 280 285
Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val
290 295 300
Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr
305 310 315 320
Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr
325 330 335
Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Cys Thr Leu
340 345 350
Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Ser Cys
355 360 365
Ala Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser
370 375 380
Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp
385 390 395 400
Ser Asp Gly Ser Phe Phe Leu Val Ser Lys Leu Thr Val Asp Lys Ser
405 410 415
Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala
420 425 430
Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
435 440 445
<210> 100
<211> 448
<212> PRT
<213> Искусственная последовательность
<220>
<223> DDD
<400> 100
Gln Val Glu Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Arg
1 5 10 15
Ser Gln Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Gly Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Ile Ile Trp Phe Asp Gly Ser Ser Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Arg Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Phe Cys
85 90 95
Ala Arg Glu Leu Gly Arg Arg Tyr Phe Asp Leu Trp Gly Arg Gly Thr
100 105 110
Leu Val Ser Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro
115 120 125
Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly
130 135 140
Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn
145 150 155 160
Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln
165 170 175
Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser
180 185 190
Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser
195 200 205
Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys Thr
210 215 220
His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser
225 230 235 240
Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg
245 250 255
Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro
260 265 270
Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala
275 280 285
Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val
290 295 300
Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr
305 310 315 320
Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr
325 330 335
Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu
340 345 350
Pro Pro Cys Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Trp Cys
355 360 365
Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser
370 375 380
Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp
385 390 395 400
Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser
405 410 415
Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala
420 425 430
Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
435 440 445
<210> 101
<211> 448
<212> PRT
<213> Искусственная последовательность
<220>
<223> VH-IGG1-FCSSHOLE-DDD
<400> 101
Gln Val Glu Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Arg
1 5 10 15
Ser Gln Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Gly Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Ile Ile Trp Phe Asp Gly Ser Ser Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Arg Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Phe Cys
85 90 95
Ala Arg Glu Leu Gly Arg Arg Tyr Phe Asp Leu Trp Gly Arg Gly Thr
100 105 110
Leu Val Ser Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro
115 120 125
Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly
130 135 140
Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn
145 150 155 160
Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln
165 170 175
Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser
180 185 190
Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser
195 200 205
Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys Thr
210 215 220
His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser
225 230 235 240
Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Asp Met Ile Ser Arg
245 250 255
Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro
260 265 270
Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala
275 280 285
Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val
290 295 300
Ser Val Leu Thr Val Leu His Gln Asp Trp Asp Asn Gly Lys Glu Tyr
305 310 315 320
Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr
325 330 335
Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Cys Thr Leu
340 345 350
Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Ser Cys
355 360 365
Ala Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser
370 375 380
Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp
385 390 395 400
Ser Asp Gly Ser Phe Phe Leu Val Ser Lys Leu Thr Val Asp Lys Ser
405 410 415
Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala
420 425 430
Asp His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
435 440 445
<210> 102
<211> 453
<212> PRT
<213> Искусственная
<220>
<223> Тяжелая цепь 1 <VEGF-ANG-2> CrossMAb IgG1 дикого типа (без
AAA-мутаций) (VEGFang2-0201)
<400> 102
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Tyr Asp Phe Thr His Tyr
20 25 30
Gly Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Gly Trp Ile Asn Thr Tyr Thr Gly Glu Pro Thr Tyr Ala Ala Asp Phe
50 55 60
Lys Arg Arg Phe Thr Phe Ser Leu Asp Thr Ser Lys Ser Thr Ala Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Lys Tyr Pro Tyr Tyr Tyr Gly Thr Ser His Trp Tyr Phe Asp Val
100 105 110
Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly
115 120 125
Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly
130 135 140
Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val
145 150 155 160
Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe
165 170 175
Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val
180 185 190
Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val
195 200 205
Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys
210 215 220
Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu
225 230 235 240
Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr
245 250 255
Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val
260 265 270
Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val
275 280 285
Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser
290 295 300
Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu Ala Gln Asp Trp Leu
305 310 315 320
Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala
325 330 335
Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro
340 345 350
Gln Val Tyr Thr Leu Pro Pro Cys Arg Asp Glu Leu Thr Lys Asn Gln
355 360 365
Val Ser Leu Trp Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala
370 375 380
Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr
385 390 395 400
Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu
405 410 415
Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser
420 425 430
Val Met His Glu Ala Leu Ala Asn His Ala Thr Gln Lys Ser Leu Ser
435 440 445
Leu Ser Pro Gly Lys
450
<210> 103
<211> 463
<212> PRT
<213> Искусственная
<220>
<223> Тяжелая цепь 2 <VEGF-ANG-2> CrossMAb IgG1 дикого типа (без
AAA-мутаций) (VEGFang2-0201)
<400> 103
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Gly Tyr
20 25 30
Tyr Met His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Trp Ile Asn Pro Asn Ser Gly Gly Thr Asn Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Met Thr Arg Asp Thr Ser Ile Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Arg Leu Arg Ser Asp Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Ser Pro Asn Pro Tyr Tyr Tyr Asp Ser Ser Gly Tyr Tyr Tyr
100 105 110
Pro Gly Ala Phe Asp Ile Trp Gly Gln Gly Thr Met Val Thr Val Ser
115 120 125
Ser Ala Ser Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp
130 135 140
Glu Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn
145 150 155 160
Phe Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu
165 170 175
Gln Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp
180 185 190
Ser Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr
195 200 205
Glu Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser
210 215 220
Ser Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys Asp Lys Thr His
225 230 235 240
Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val
245 250 255
Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr
260 265 270
Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu
275 280 285
Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys
290 295 300
Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser
305 310 315 320
Val Leu Thr Val Leu Ala Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys
325 330 335
Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile
340 345 350
Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Cys Thr Leu Pro
355 360 365
Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Ser Cys Ala
370 375 380
Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn
385 390 395 400
Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser
405 410 415
Asp Gly Ser Phe Phe Leu Val Ser Lys Leu Thr Val Asp Lys Ser Arg
420 425 430
Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu
435 440 445
Ala Asn His Ala Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
450 455 460
<210> 104
<211> 453
<212> PRT
<213> Искусственная
<220>
<223> Тяжелая цепь 1 <VEGF-ANG-2> CrossMAb IgG1 дикого типа (без
AAA-мутаций) (VEGFang2-0201)
<400> 104
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Tyr Asp Phe Thr His Tyr
20 25 30
Gly Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Gly Trp Ile Asn Thr Tyr Thr Gly Glu Pro Thr Tyr Ala Ala Asp Phe
50 55 60
Lys Arg Arg Phe Thr Phe Ser Leu Asp Thr Ser Lys Ser Thr Ala Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Lys Tyr Pro Tyr Tyr Tyr Gly Thr Ser His Trp Tyr Phe Asp Val
100 105 110
Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly
115 120 125
Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly
130 135 140
Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val
145 150 155 160
Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe
165 170 175
Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val
180 185 190
Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val
195 200 205
Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys
210 215 220
Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Ala
225 230 235 240
Ala Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr
245 250 255
Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val
260 265 270
Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val
275 280 285
Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser
290 295 300
Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu Ala Gln Asp Trp Leu
305 310 315 320
Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Gly Ala
325 330 335
Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro
340 345 350
Gln Val Tyr Thr Leu Pro Pro Cys Arg Asp Glu Leu Thr Lys Asn Gln
355 360 365
Val Ser Leu Trp Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala
370 375 380
Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr
385 390 395 400
Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu
405 410 415
Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser
420 425 430
Val Met His Glu Ala Leu Ala Asn His Ala Thr Gln Lys Ser Leu Ser
435 440 445
Leu Ser Pro Gly Lys
450
<210> 105
<211> 463
<212> PRT
<213> Искусственная
<220>
<223> Тяжелая цепь 2 <VEGF-ANG-2> CrossMAb IgG1 дикого типа (без
AAA-мутаций) (VEGFang2-0201)
<400> 105
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Gly Tyr
20 25 30
Tyr Met His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Trp Ile Asn Pro Asn Ser Gly Gly Thr Asn Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Met Thr Arg Asp Thr Ser Ile Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Arg Leu Arg Ser Asp Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Ser Pro Asn Pro Tyr Tyr Tyr Asp Ser Ser Gly Tyr Tyr Tyr
100 105 110
Pro Gly Ala Phe Asp Ile Trp Gly Gln Gly Thr Met Val Thr Val Ser
115 120 125
Ser Ala Ser Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp
130 135 140
Glu Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn
145 150 155 160
Phe Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu
165 170 175
Gln Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp
180 185 190
Ser Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr
195 200 205
Glu Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser
210 215 220
Ser Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys Asp Lys Thr His
225 230 235 240
Thr Cys Pro Pro Cys Pro Ala Pro Glu Ala Ala Gly Gly Pro Ser Val
245 250 255
Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr
260 265 270
Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu
275 280 285
Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys
290 295 300
Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser
305 310 315 320
Val Leu Thr Val Leu Ala Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys
325 330 335
Cys Lys Val Ser Asn Lys Ala Leu Gly Ala Pro Ile Glu Lys Thr Ile
340 345 350
Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Cys Thr Leu Pro
355 360 365
Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Ser Cys Ala
370 375 380
Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn
385 390 395 400
Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser
405 410 415
Asp Gly Ser Phe Phe Leu Val Ser Lys Leu Thr Val Asp Lys Ser Arg
420 425 430
Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu
435 440 445
Ala Asn His Ala Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
450 455 460
<210> 106
<211> 450
<212> PRT
<213> Искусственная
<220>
<223> Тяжелая цепь 1 <VEGF-ANG-2> CrossMAb IgG4 с AAA-мутациями
и с SPLE-мутациями
<400> 106
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Tyr Asp Phe Thr His Tyr
20 25 30
Gly Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Gly Trp Ile Asn Thr Tyr Thr Gly Glu Pro Thr Tyr Ala Ala Asp Phe
50 55 60
Lys Arg Arg Phe Thr Phe Ser Leu Asp Thr Ser Lys Ser Thr Ala Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Lys Tyr Pro Tyr Tyr Tyr Gly Thr Ser His Trp Tyr Phe Asp Val
100 105 110
Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly
115 120 125
Pro Ser Val Phe Pro Leu Ala Pro Cys Ser Arg Ser Thr Ser Glu Ser
130 135 140
Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val
145 150 155 160
Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe
165 170 175
Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val
180 185 190
Thr Val Pro Ser Ser Ser Leu Gly Thr Lys Thr Tyr Thr Cys Asn Val
195 200 205
Asp His Lys Pro Ser Asn Thr Lys Val Asp Lys Arg Val Glu Ser Lys
210 215 220
Tyr Gly Pro Pro Cys Pro Pro Cys Pro Ala Pro Glu Phe Glu Gly Gly
225 230 235 240
Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ala
245 250 255
Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser Gln Glu
260 265 270
Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp Gly Val Glu Val His
275 280 285
Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser Thr Tyr Arg
290 295 300
Val Val Ser Val Leu Thr Val Leu Ala Gln Asp Trp Leu Asn Gly Lys
305 310 315 320
Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu Pro Ser Ser Ile Glu
325 330 335
Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Cys
340 345 350
Thr Leu Pro Pro Ser Gln Glu Glu Met Thr Lys Asn Gln Val Ser Leu
355 360 365
Ser Cys Ala Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp
370 375 380
Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val
385 390 395 400
Leu Asp Ser Asp Gly Ser Phe Phe Leu Val Ser Arg Leu Thr Val Asp
405 410 415
Lys Ser Arg Trp Gln Glu Gly Asn Val Phe Ser Cys Ser Val Met His
420 425 430
Glu Ala Leu Ala Asn His Ala Thr Gln Lys Ser Leu Ser Leu Ser Leu
435 440 445
Gly Lys
450
<210> 107
<211> 460
<212> PRT
<213> Искусственная
<220>
<223> Тяжелая цепь 2 <VEGF-ANG-2> CrossMAb IgG4 с AAA-мутациями
и с SPLE-мутациями
<400> 107
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Gly Tyr
20 25 30
Tyr Met His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Trp Ile Asn Pro Asn Ser Gly Gly Thr Asn Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Met Thr Arg Asp Thr Ser Ile Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Arg Leu Arg Ser Asp Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Ser Pro Asn Pro Tyr Tyr Tyr Asp Ser Ser Gly Tyr Tyr Tyr
100 105 110
Pro Gly Ala Phe Asp Ile Trp Gly Gln Gly Thr Met Val Thr Val Ser
115 120 125
Ser Ala Ser Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp
130 135 140
Glu Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn
145 150 155 160
Phe Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu
165 170 175
Gln Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp
180 185 190
Ser Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr
195 200 205
Glu Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser
210 215 220
Ser Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys Pro Pro Cys Pro
225 230 235 240
Pro Cys Pro Ala Pro Glu Phe Glu Gly Gly Pro Ser Val Phe Leu Phe
245 250 255
Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val
260 265 270
Thr Cys Val Val Val Asp Val Ser Gln Glu Asp Pro Glu Val Gln Phe
275 280 285
Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro
290 295 300
Arg Glu Glu Gln Phe Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr
305 310 315 320
Val Leu Ala Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val
325 330 335
Ser Asn Lys Gly Leu Pro Ser Ser Ile Glu Lys Thr Ile Ser Lys Ala
340 345 350
Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Cys Gln
355 360 365
Glu Glu Met Thr Lys Asn Gln Val Ser Leu Trp Cys Leu Val Lys Gly
370 375 380
Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro
385 390 395 400
Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser
405 410 415
Phe Phe Leu Tyr Ser Arg Leu Thr Val Asp Lys Ser Arg Trp Gln Glu
420 425 430
Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu Ala Asn His
435 440 445
Ala Thr Gln Lys Ser Leu Ser Leu Ser Leu Gly Lys
450 455 460
<210> 108
<211> 453
<212> PRT
<213> Искусственная
<220>
<223> Тяжелая цепь 1 <VEGF-ANG-2> OAscFab IgG1 с AAA-мутациями
<400> 108
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Tyr Asp Phe Thr His Tyr
20 25 30
Gly Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Gly Trp Ile Asn Thr Tyr Thr Gly Glu Pro Thr Tyr Ala Ala Asp Phe
50 55 60
Lys Arg Arg Phe Thr Phe Ser Leu Asp Thr Ser Lys Ser Thr Ala Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Lys Tyr Pro Tyr Tyr Tyr Gly Thr Ser His Trp Tyr Phe Asp Val
100 105 110
Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly
115 120 125
Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly
130 135 140
Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val
145 150 155 160
Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe
165 170 175
Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val
180 185 190
Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val
195 200 205
Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys
210 215 220
Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu
225 230 235 240
Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr
245 250 255
Leu Ile Ala Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val
260 265 270
Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val
275 280 285
Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser
290 295 300
Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu Ala Gln Asp Trp Leu
305 310 315 320
Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala
325 330 335
Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro
340 345 350
Gln Val Cys Thr Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln
355 360 365
Val Ser Leu Ser Cys Ala Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala
370 375 380
Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr
385 390 395 400
Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Val Ser Lys Leu
405 410 415
Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser
420 425 430
Val Met His Glu Ala Leu Ala Asn His Ala Thr Gln Lys Ser Leu Ser
435 440 445
Leu Ser Pro Gly Lys
450
<210> 109
<211> 705
<212> PRT
<213> Искусственная
<220>
<223> Тяжелая цепь 2 <VEGF-ANG-2> OAscFab IgG1 с AAA-мутациями
<400> 109
Ser Tyr Val Leu Thr Gln Pro Pro Ser Val Ser Val Ala Pro Gly Gln
1 5 10 15
Thr Ala Arg Ile Thr Cys Gly Gly Asn Asn Ile Gly Ser Lys Ser Val
20 25 30
His Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Val Leu Val Val Tyr
35 40 45
Asp Asp Ser Asp Arg Pro Ser Gly Ile Pro Glu Arg Phe Ser Gly Ser
50 55 60
Asn Ser Gly Asn Thr Ala Thr Leu Thr Ile Ser Arg Val Glu Ala Gly
65 70 75 80
Asp Glu Ala Asp Tyr Tyr Cys Gln Val Trp Asp Ser Ser Ser Asp His
85 90 95
Trp Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu Gly Gln Pro Lys
100 105 110
Ala Ala Pro Ser Val Thr Leu Phe Pro Pro Ser Ser Glu Glu Leu Gln
115 120 125
Ala Asn Lys Ala Thr Leu Val Cys Leu Ile Ser Asp Phe Tyr Pro Gly
130 135 140
Ala Val Thr Val Ala Trp Lys Ala Asp Ser Ser Pro Val Lys Ala Gly
145 150 155 160
Val Glu Thr Thr Thr Pro Ser Lys Gln Ser Asn Asn Lys Tyr Ala Ala
165 170 175
Ser Ser Tyr Leu Ser Leu Thr Pro Glu Gln Trp Lys Ser His Arg Ser
180 185 190
Tyr Ser Cys Gln Val Thr His Glu Gly Ser Thr Val Glu Lys Thr Val
195 200 205
Ala Pro Thr Glu Cys Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
210 215 220
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly
225 230 235 240
Gly Gly Gly Ser Gly Gly Gln Val Gln Leu Val Glu Ser Gly Ala Glu
245 250 255
Val Lys Lys Pro Gly Ala Ser Val Lys Val Ser Cys Lys Ala Ser Gly
260 265 270
Tyr Thr Phe Thr Gly Tyr Tyr Met His Trp Val Arg Gln Ala Pro Gly
275 280 285
Gln Gly Leu Glu Trp Met Gly Trp Ile Asn Pro Asn Ser Gly Gly Thr
290 295 300
Asn Tyr Ala Gln Lys Phe Gln Gly Arg Val Thr Met Thr Arg Asp Thr
305 310 315 320
Ser Ile Ser Thr Ala Tyr Met Glu Leu Ser Arg Leu Arg Ser Asp Asp
325 330 335
Thr Ala Val Tyr Tyr Cys Ala Arg Ser Pro Asn Pro Tyr Tyr Tyr Asp
340 345 350
Ser Ser Gly Tyr Tyr Tyr Pro Gly Ala Phe Asp Ile Trp Gly Gln Gly
355 360 365
Thr Met Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe
370 375 380
Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu
385 390 395 400
Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp
405 410 415
Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu
420 425 430
Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser
435 440 445
Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro
450 455 460
Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys
465 470 475 480
Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro
485 490 495
Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser
500 505 510
Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp
515 520 525
Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn
530 535 540
Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val
545 550 555 560
Val Ser Val Leu Thr Val Leu Ala Gln Asp Trp Leu Asn Gly Lys Glu
565 570 575
Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys
580 585 590
Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr
595 600 605
Leu Pro Pro Cys Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Trp
610 615 620
Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu
625 630 635 640
Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu
645 650 655
Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys
660 665 670
Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu
675 680 685
Ala Leu Ala Asn His Ala Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly
690 695 700
Lys
705
<210> 110
<211> 450
<212> PRT
<213> Искусственная
<220>
<223> Тяжелая цепь 1 <VEGF-ANG-2> OAscFab IgG4 с AAA-мутациями
и с SPLE-мутациями
<400> 110
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Tyr Asp Phe Thr His Tyr
20 25 30
Gly Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Gly Trp Ile Asn Thr Tyr Thr Gly Glu Pro Thr Tyr Ala Ala Asp Phe
50 55 60
Lys Arg Arg Phe Thr Phe Ser Leu Asp Thr Ser Lys Ser Thr Ala Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Lys Tyr Pro Tyr Tyr Tyr Gly Thr Ser His Trp Tyr Phe Asp Val
100 105 110
Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly
115 120 125
Pro Ser Val Phe Pro Leu Ala Pro Cys Ser Arg Ser Thr Ser Glu Ser
130 135 140
Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val
145 150 155 160
Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe
165 170 175
Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val
180 185 190
Thr Val Pro Ser Ser Ser Leu Gly Thr Lys Thr Tyr Thr Cys Asn Val
195 200 205
Asp His Lys Pro Ser Asn Thr Lys Val Asp Lys Arg Val Glu Ser Lys
210 215 220
Tyr Gly Pro Pro Cys Pro Pro Cys Pro Ala Pro Glu Phe Glu Gly Gly
225 230 235 240
Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile
245 250 255
Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser Gln Glu
260 265 270
Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp Gly Val Glu Val His
275 280 285
Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser Thr Tyr Arg
290 295 300
Val Val Ser Val Leu Thr Val Leu Ala Gln Asp Trp Leu Asn Gly Lys
305 310 315 320
Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu Pro Ser Ser Ile Glu
325 330 335
Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Cys
340 345 350
Thr Leu Pro Pro Ser Gln Glu Glu Met Thr Lys Asn Gln Val Ser Leu
355 360 365
Ser Cys Ala Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp
370 375 380
Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val
385 390 395 400
Leu Asp Ser Asp Gly Ser Phe Phe Leu Val Ser Arg Leu Thr Val Asp
405 410 415
Lys Ser Arg Trp Gln Glu Gly Asn Val Phe Ser Cys Ser Val Met His
420 425 430
Glu Ala Leu Ala Asn His Ala Thr Gln Lys Ser Leu Ser Leu Ser Leu
435 440 445
Gly Lys
450
<210> 111
<211> 702
<212> PRT
<213> Искусственная
<220>
<223> Тяжелая цепь 2 <VEGF-ANG-2> OAscFab IgG4 с AAA-мутациями и
с SPLE-мутациями
<400> 111
Ser Tyr Val Leu Thr Gln Pro Pro Ser Val Ser Val Ala Pro Gly Gln
1 5 10 15
Thr Ala Arg Ile Thr Cys Gly Gly Asn Asn Ile Gly Ser Lys Ser Val
20 25 30
His Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Val Leu Val Val Tyr
35 40 45
Asp Asp Ser Asp Arg Pro Ser Gly Ile Pro Glu Arg Phe Ser Gly Ser
50 55 60
Asn Ser Gly Asn Thr Ala Thr Leu Thr Ile Ser Arg Val Glu Ala Gly
65 70 75 80
Asp Glu Ala Asp Tyr Tyr Cys Gln Val Trp Asp Ser Ser Ser Asp His
85 90 95
Trp Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu Gly Gln Pro Lys
100 105 110
Ala Ala Pro Ser Val Thr Leu Phe Pro Pro Ser Ser Glu Glu Leu Gln
115 120 125
Ala Asn Lys Ala Thr Leu Val Cys Leu Ile Ser Asp Phe Tyr Pro Gly
130 135 140
Ala Val Thr Val Ala Trp Lys Ala Asp Ser Ser Pro Val Lys Ala Gly
145 150 155 160
Val Glu Thr Thr Thr Pro Ser Lys Gln Ser Asn Asn Lys Tyr Ala Ala
165 170 175
Ser Ser Tyr Leu Ser Leu Thr Pro Glu Gln Trp Lys Ser His Arg Ser
180 185 190
Tyr Ser Cys Gln Val Thr His Glu Gly Ser Thr Val Glu Lys Thr Val
195 200 205
Ala Pro Thr Glu Cys Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
210 215 220
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly
225 230 235 240
Gly Gly Gly Ser Gly Gly Gln Val Gln Leu Val Glu Ser Gly Ala Glu
245 250 255
Val Lys Lys Pro Gly Ala Ser Val Lys Val Ser Cys Lys Ala Ser Gly
260 265 270
Tyr Thr Phe Thr Gly Tyr Tyr Met His Trp Val Arg Gln Ala Pro Gly
275 280 285
Gln Gly Leu Glu Trp Met Gly Trp Ile Asn Pro Asn Ser Gly Gly Thr
290 295 300
Asn Tyr Ala Gln Lys Phe Gln Gly Arg Val Thr Met Thr Arg Asp Thr
305 310 315 320
Ser Ile Ser Thr Ala Tyr Met Glu Leu Ser Arg Leu Arg Ser Asp Asp
325 330 335
Thr Ala Val Tyr Tyr Cys Ala Arg Ser Pro Asn Pro Tyr Tyr Tyr Asp
340 345 350
Ser Ser Gly Tyr Tyr Tyr Pro Gly Ala Phe Asp Ile Trp Gly Gln Gly
355 360 365
Thr Met Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe
370 375 380
Pro Leu Ala Pro Cys Ser Arg Ser Thr Ser Glu Ser Thr Ala Ala Leu
385 390 395 400
Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp
405 410 415
Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu
420 425 430
Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser
435 440 445
Ser Ser Leu Gly Thr Lys Thr Tyr Thr Cys Asn Val Asp His Lys Pro
450 455 460
Ser Asn Thr Lys Val Asp Lys Arg Val Glu Ser Lys Tyr Gly Pro Pro
465 470 475 480
Cys Pro Pro Cys Pro Ala Pro Glu Phe Glu Gly Gly Pro Ser Val Phe
485 490 495
Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro
500 505 510
Glu Val Thr Cys Val Val Val Asp Val Ser Gln Glu Asp Pro Glu Val
515 520 525
Gln Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr
530 535 540
Lys Pro Arg Glu Glu Gln Phe Asn Ser Thr Tyr Arg Val Val Ser Val
545 550 555 560
Leu Thr Val Leu Ala Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys
565 570 575
Lys Val Ser Asn Lys Gly Leu Pro Ser Ser Ile Glu Lys Thr Ile Ser
580 585 590
Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro
595 600 605
Cys Gln Glu Glu Met Thr Lys Asn Gln Val Ser Leu Trp Cys Leu Val
610 615 620
Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly
625 630 635 640
Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp
645 650 655
Gly Ser Phe Phe Leu Tyr Ser Arg Leu Thr Val Asp Lys Ser Arg Trp
660 665 670
Gln Glu Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu Ala
675 680 685
Asn His Ala Thr Gln Lys Ser Leu Ser Leu Ser Leu Gly Lys
690 695 700
<210> 112
<211> 447
<212> PRT
<213> Искусственная последовательность
<220>
<223> IGF-1R wt
<400> 112
Gln Val Glu Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Arg
1 5 10 15
Ser Gln Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Gly Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Ile Ile Trp Phe Asp Gly Ser Ser Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Arg Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Phe Cys
85 90 95
Ala Arg Glu Leu Gly Arg Arg Tyr Phe Asp Leu Trp Gly Arg Gly Thr
100 105 110
Leu Val Ser Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro
115 120 125
Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly
130 135 140
Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn
145 150 155 160
Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln
165 170 175
Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser
180 185 190
Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser
195 200 205
Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys Thr
210 215 220
His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser
225 230 235 240
Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg
245 250 255
Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro
260 265 270
Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala
275 280 285
Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val
290 295 300
Ser Val Leu Thr Val Leu Ala Gln Asp Trp Leu Asn Gly Lys Glu Tyr
305 310 315 320
Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr
325 330 335
Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu
340 345 350
Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Thr Cys
355 360 365
Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser
370 375 380
Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp
385 390 395 400
Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser
405 410 415
Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala
420 425 430
Leu Ala Asn His Ala Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly
435 440 445
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| ВАРИАНТЫ FC-ОБЛАСТИ С МОДИФИЦИРОВАННЫМИ СПОСОБНОСТЯМИ СВЯЗЫВАТЬСЯ С FCRN | 2015 |
|
RU2730592C2 |
| АНТИТЕЛА, СВЯЗЫВАЮЩИЕСЯ С CD3 | 2019 |
|
RU2810924C2 |
| МУЛЬТИСПЕЦИФИЧЕСКИЕ СВЯЗЫВАЮЩИЕ БЕЛКИ НА ОСНОВЕ ПСЕВДО-FAB | 2019 |
|
RU2820254C2 |
| АНТИТЕЛА, СВЯЗЫВАЮЩИЕСЯ С CD3 | 2019 |
|
RU2832669C2 |
| CD3-СВЯЗЫВАЮЩИЙ ДОМЕН | 2015 |
|
RU2742691C2 |
| АНТИТЕЛА, СВЯЗЫВАЮЩИЕСЯ С GPRC5D | 2020 |
|
RU2841523C2 |
| МУЛЬТИСПЕЦИФИЧЕСКИЕ СВЯЗЫВАЮЩИЕ БЕЛКИ С МУТАНТНЫМИ ДОМЕНАМИ FAB | 2019 |
|
RU2827657C2 |
| АНТИТЕЛО, СПОСОБНОЕ СВЯЗЫВАТЬСЯ С ТИМИЧЕСКИМ СТРОМАЛЬНЫМ ЛИМФОПОЭТИНОМ, И ЕГО ПРИМЕНЕНИЕ | 2020 |
|
RU2825304C2 |
| ПОЛИВАЛЕТНЫЕ И ПОЛИСПЕЦИФИЧНЫЕ GITR-СВЯЗЫВАЮЩИЕ СЛИТЫЕ БЕЛКИ | 2016 |
|
RU2753439C2 |
| Белки, связывающие NKG2D, CD16 и опухолеассоциированный антиген | 2018 |
|
RU2816716C2 |

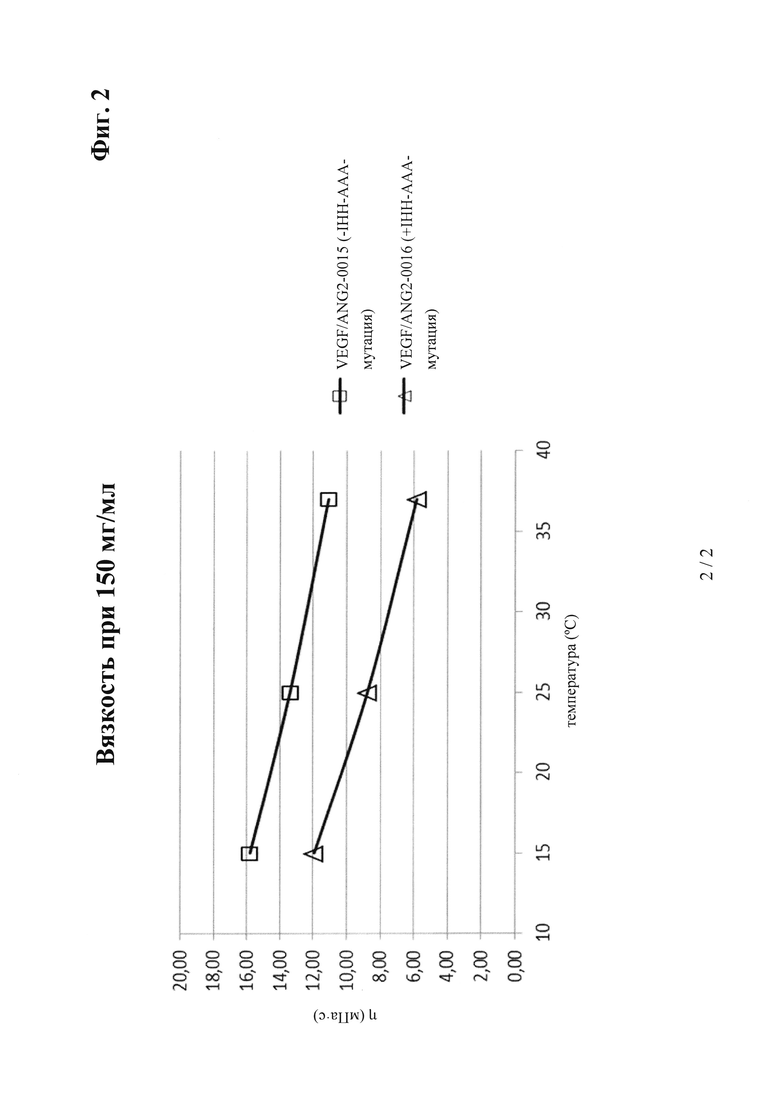
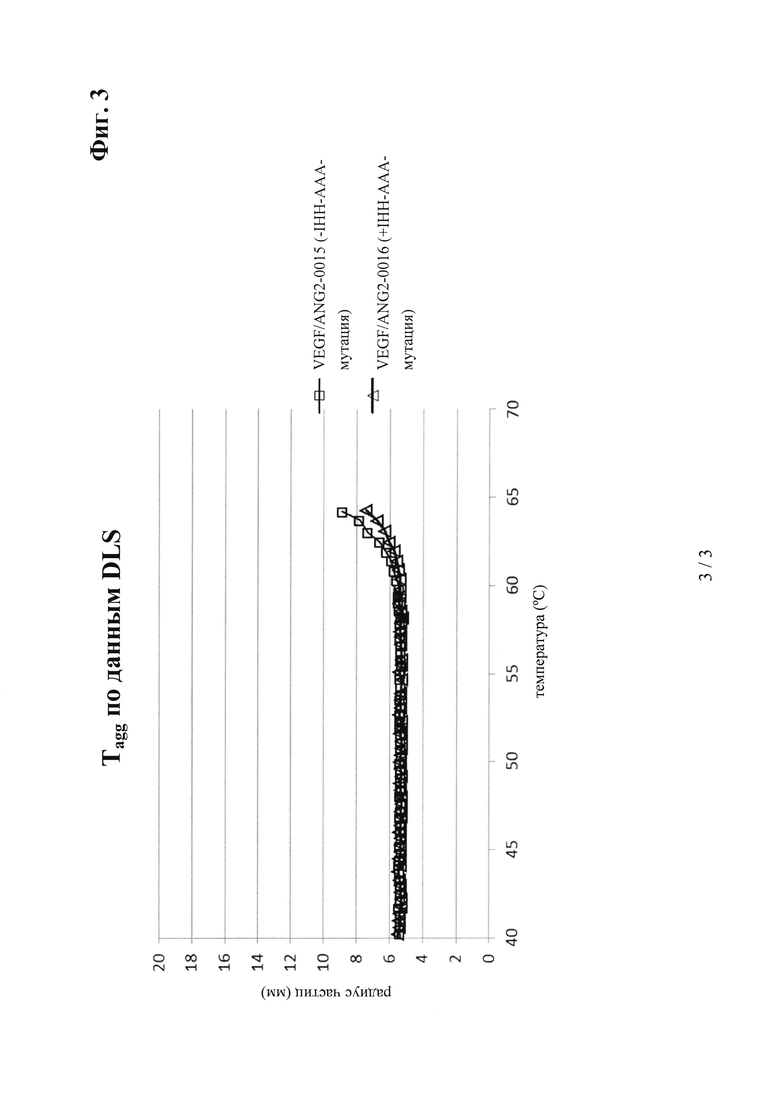
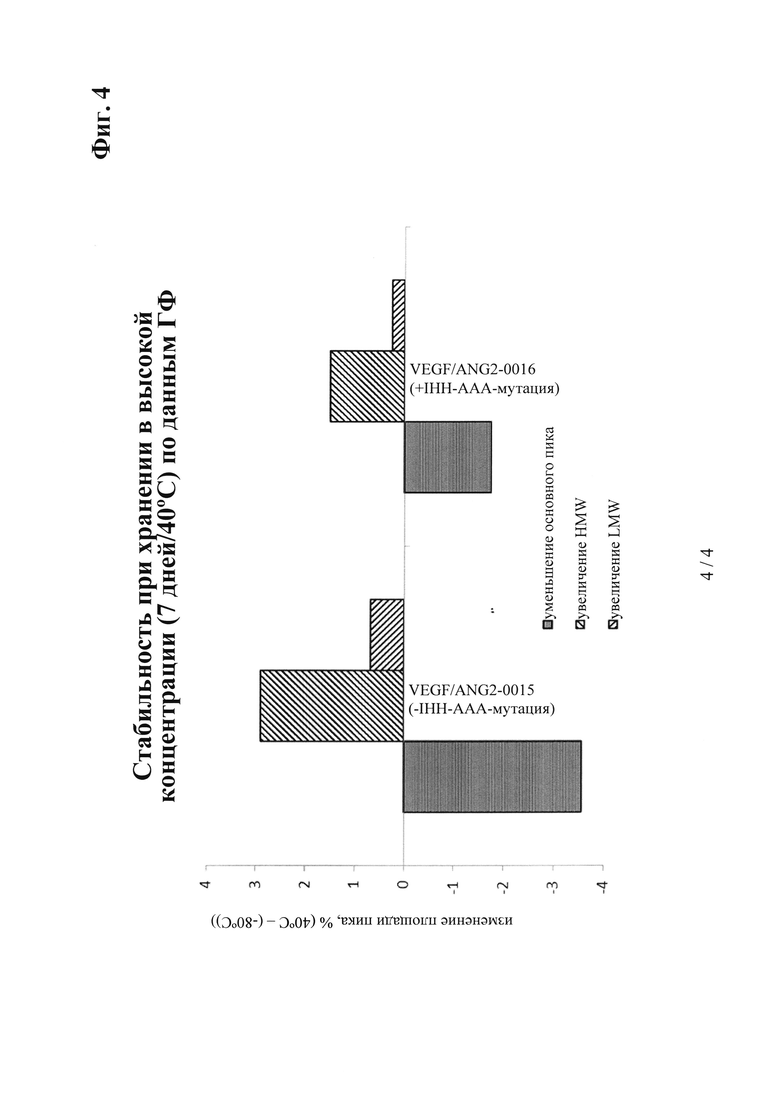
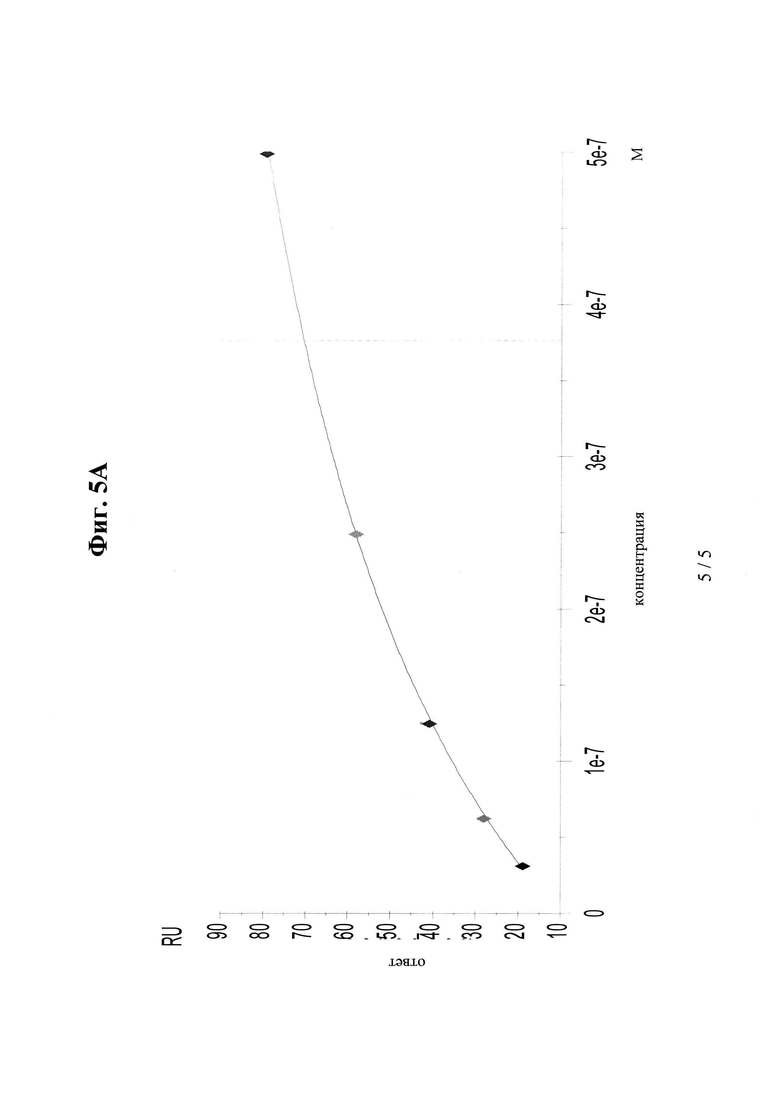
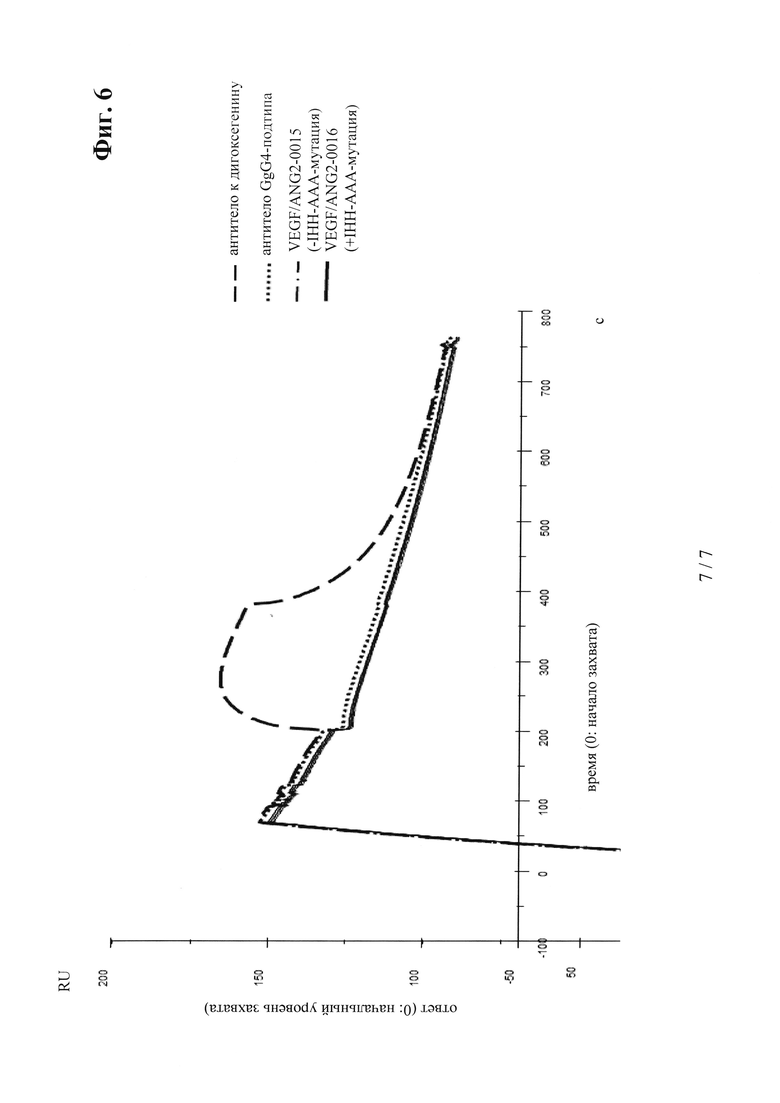
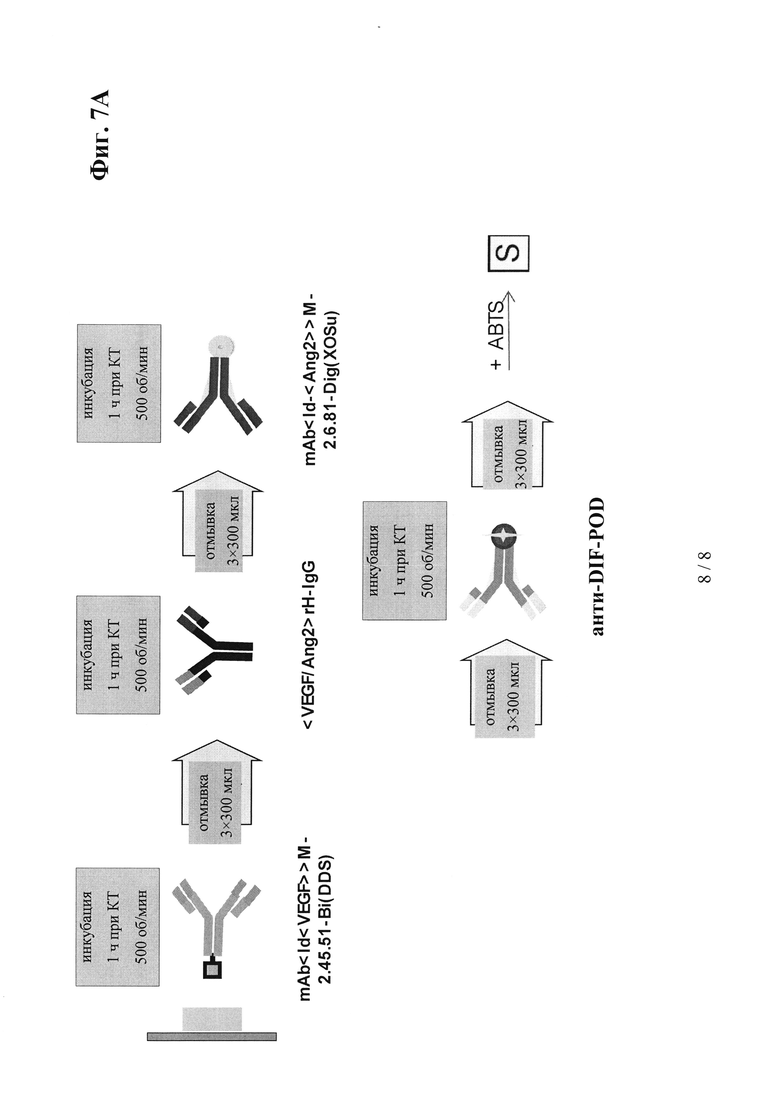
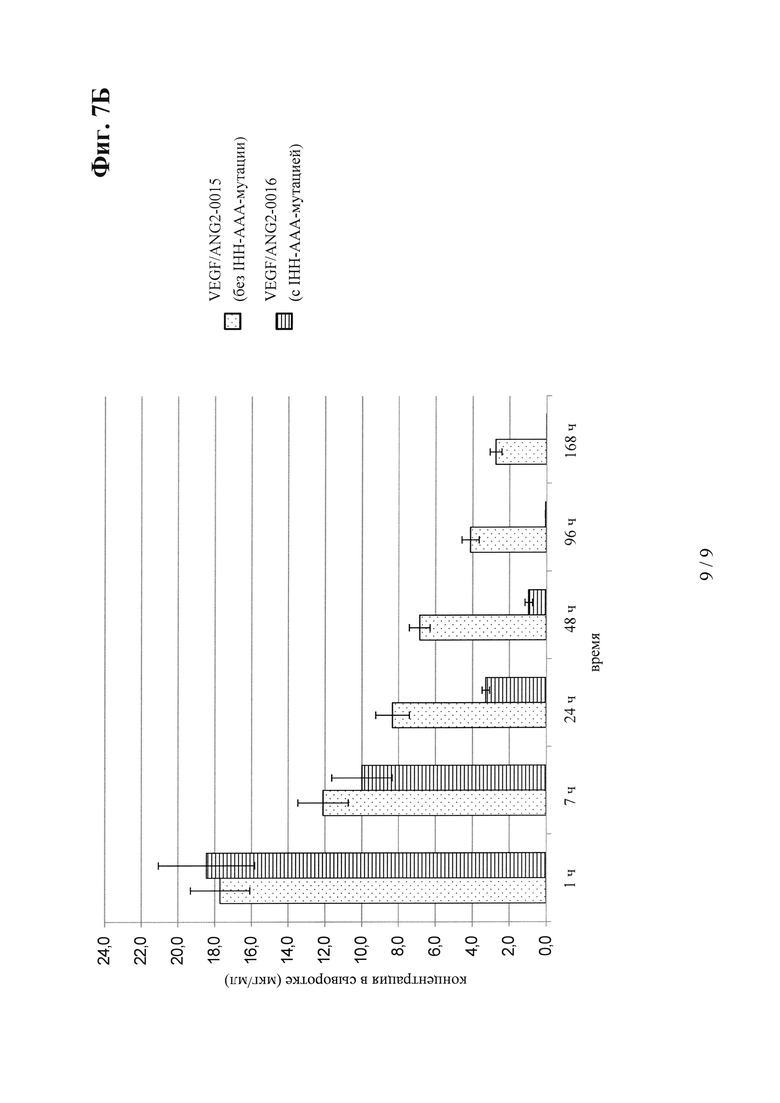
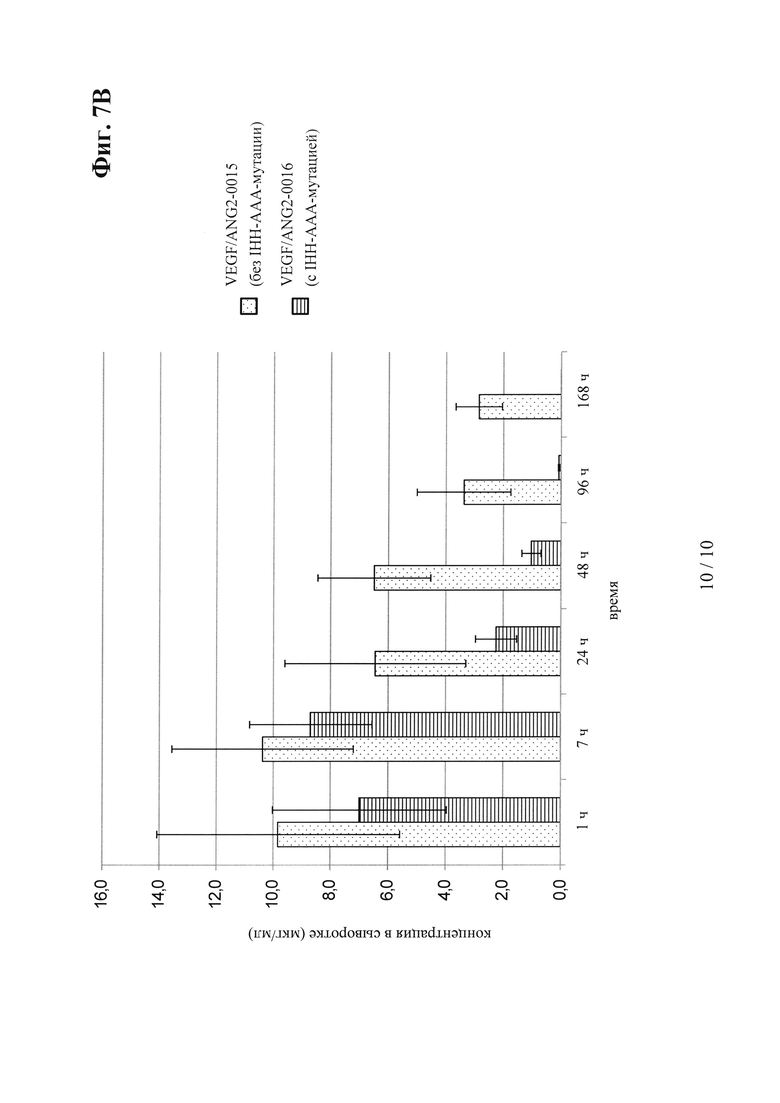
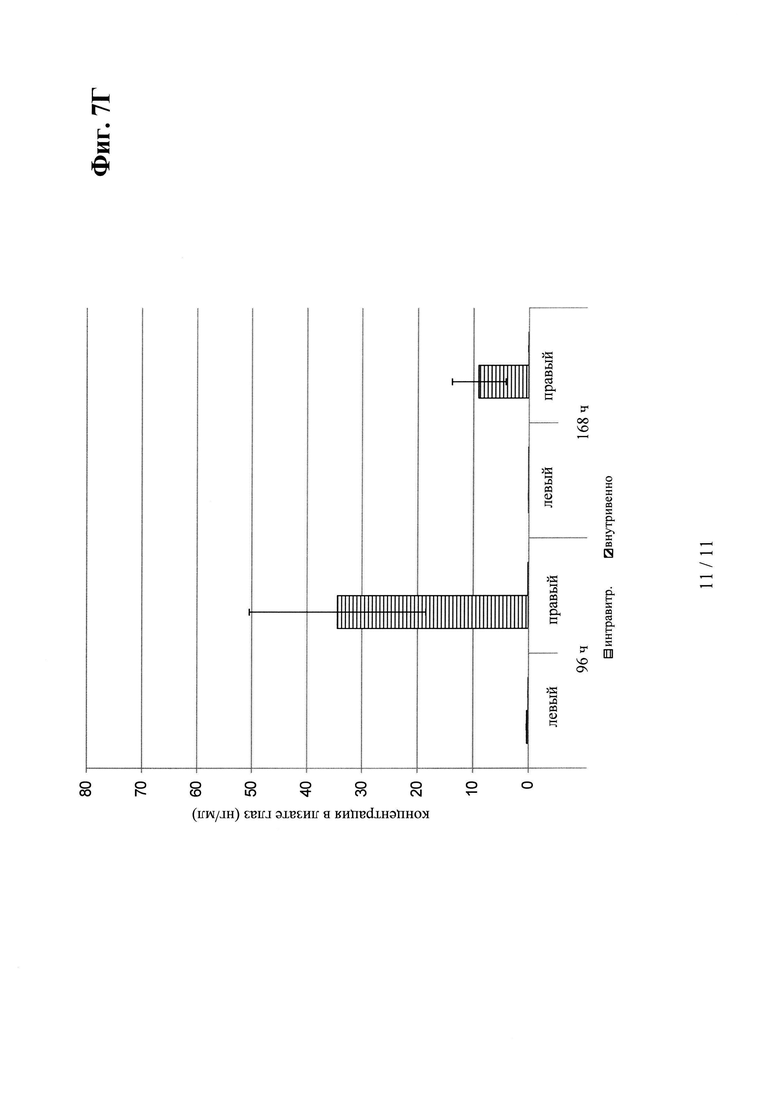
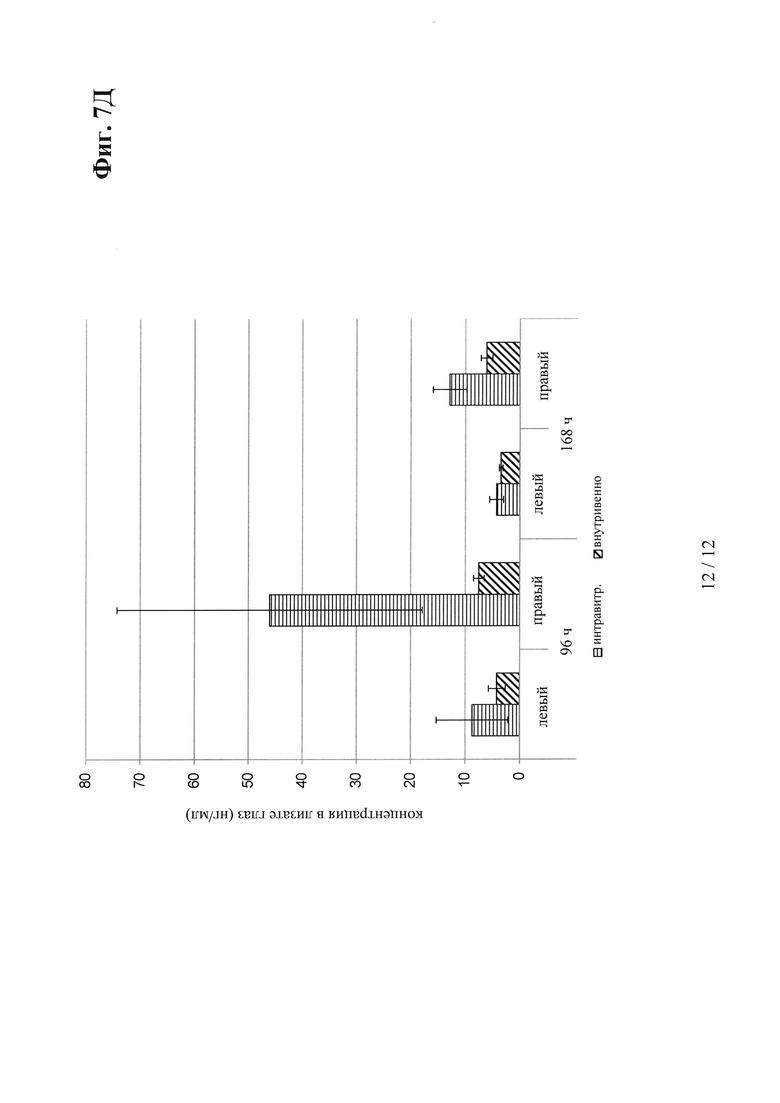
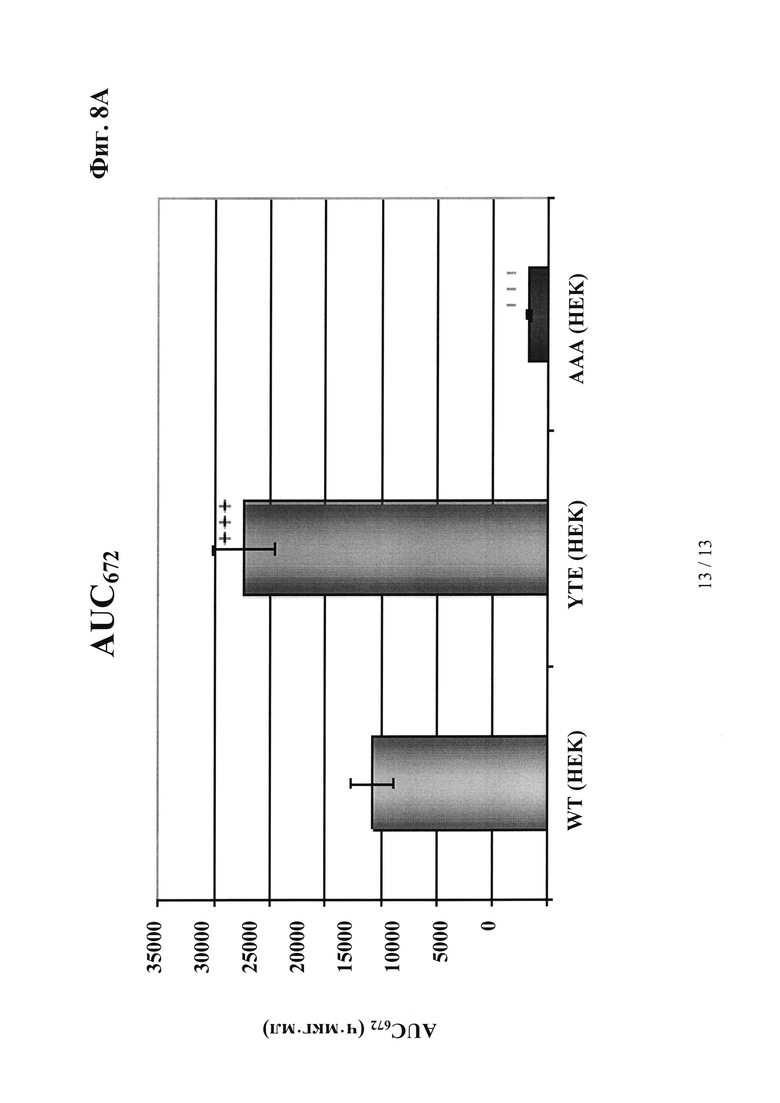
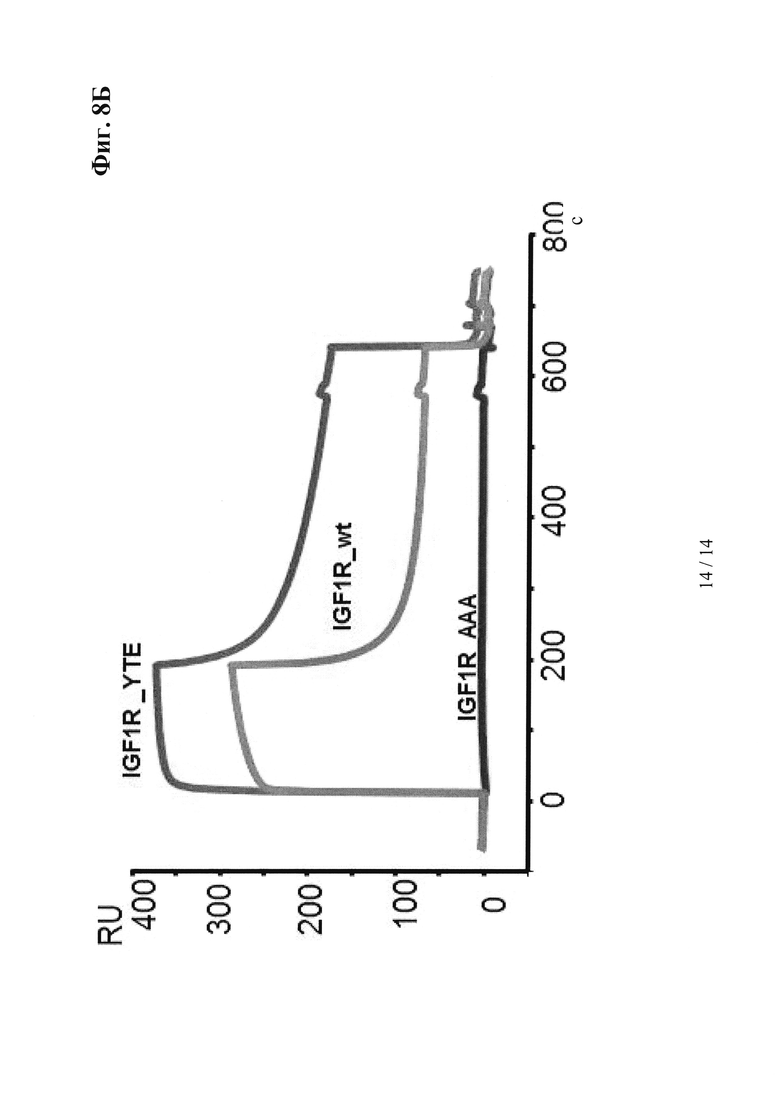
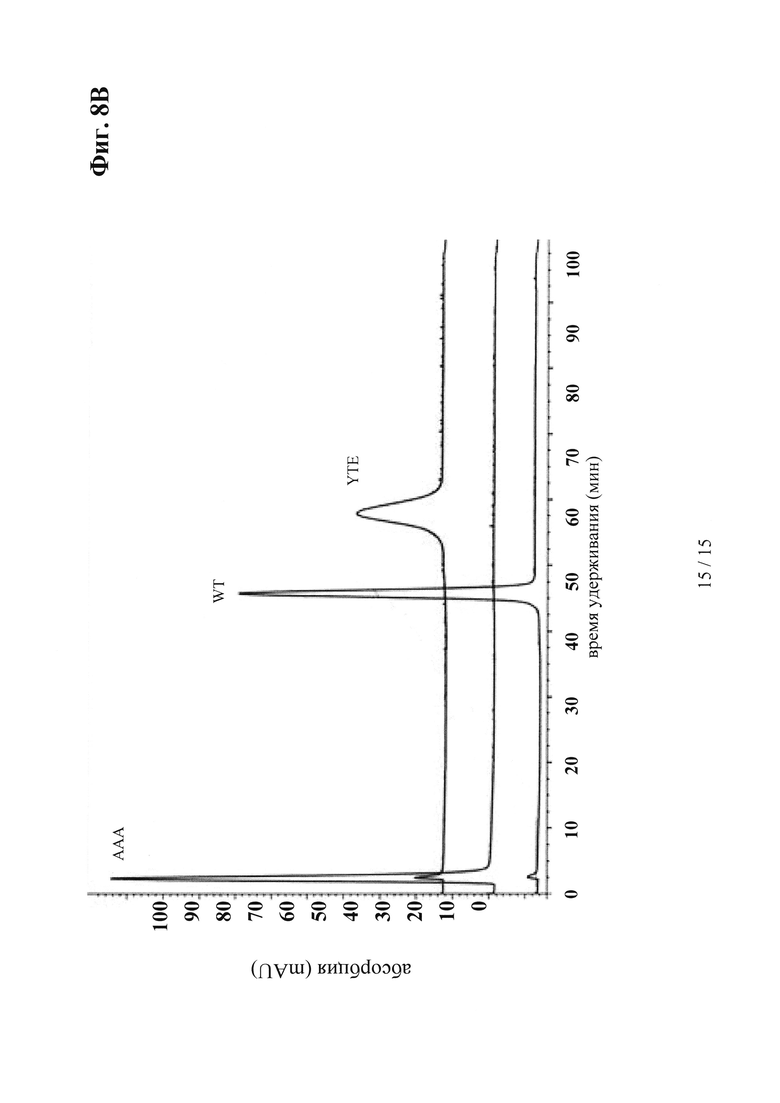
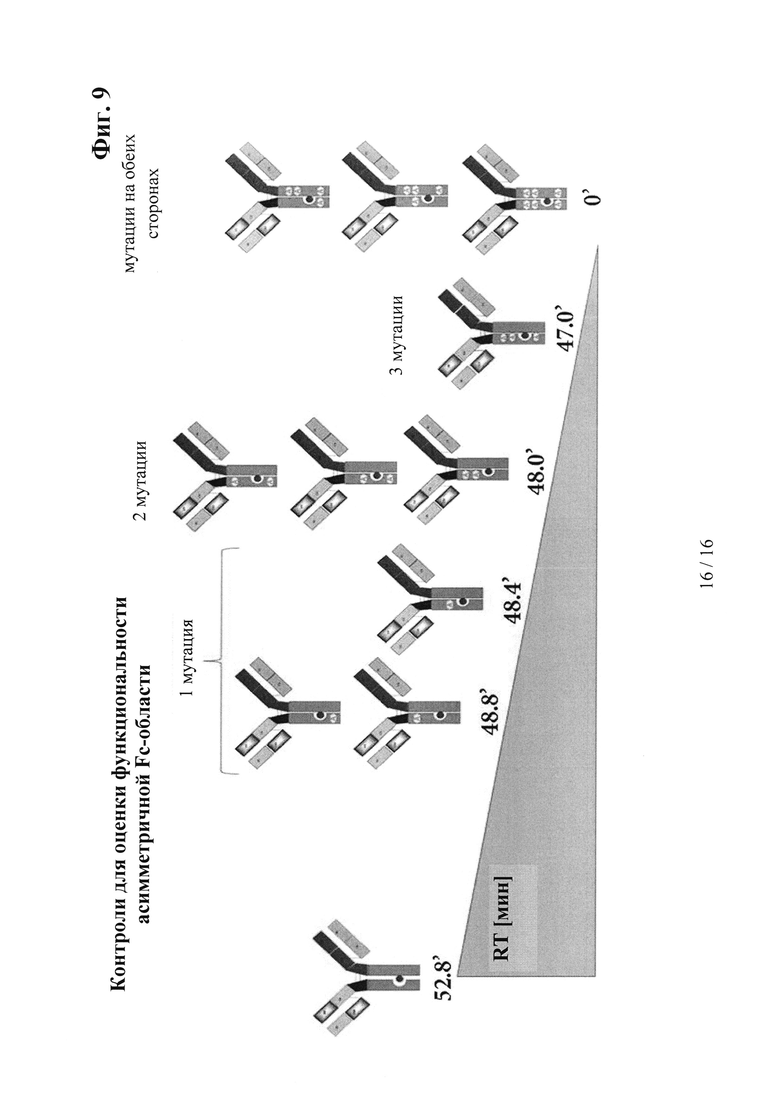
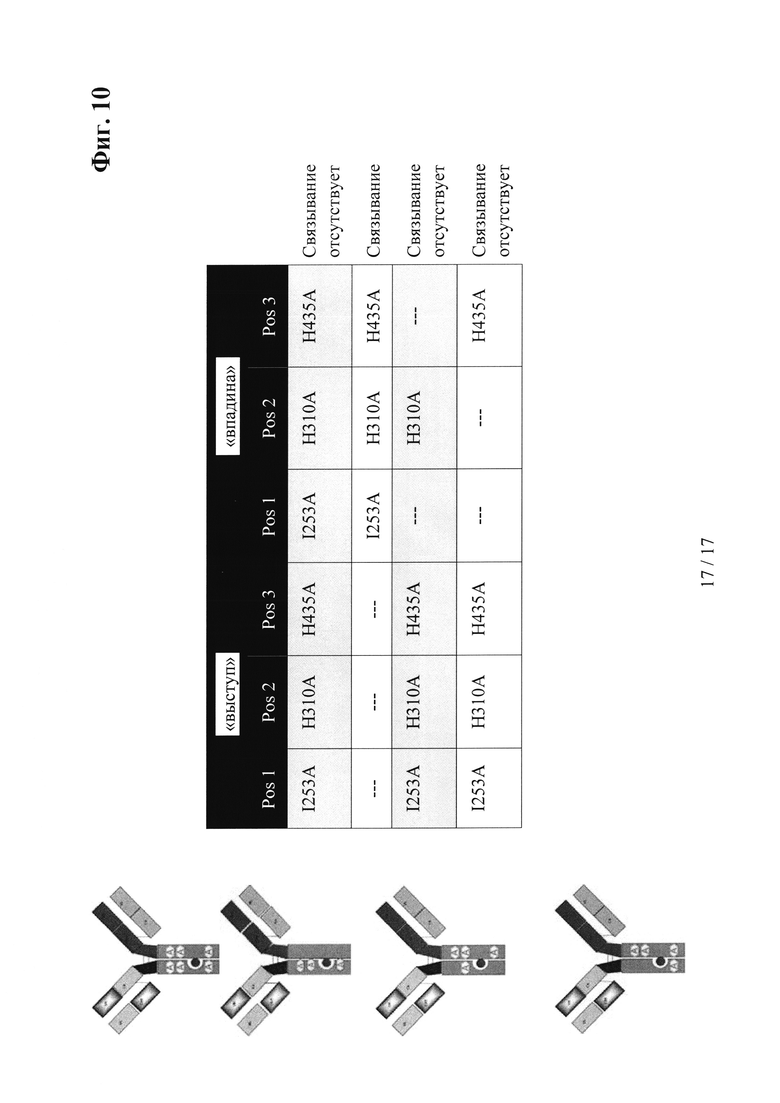
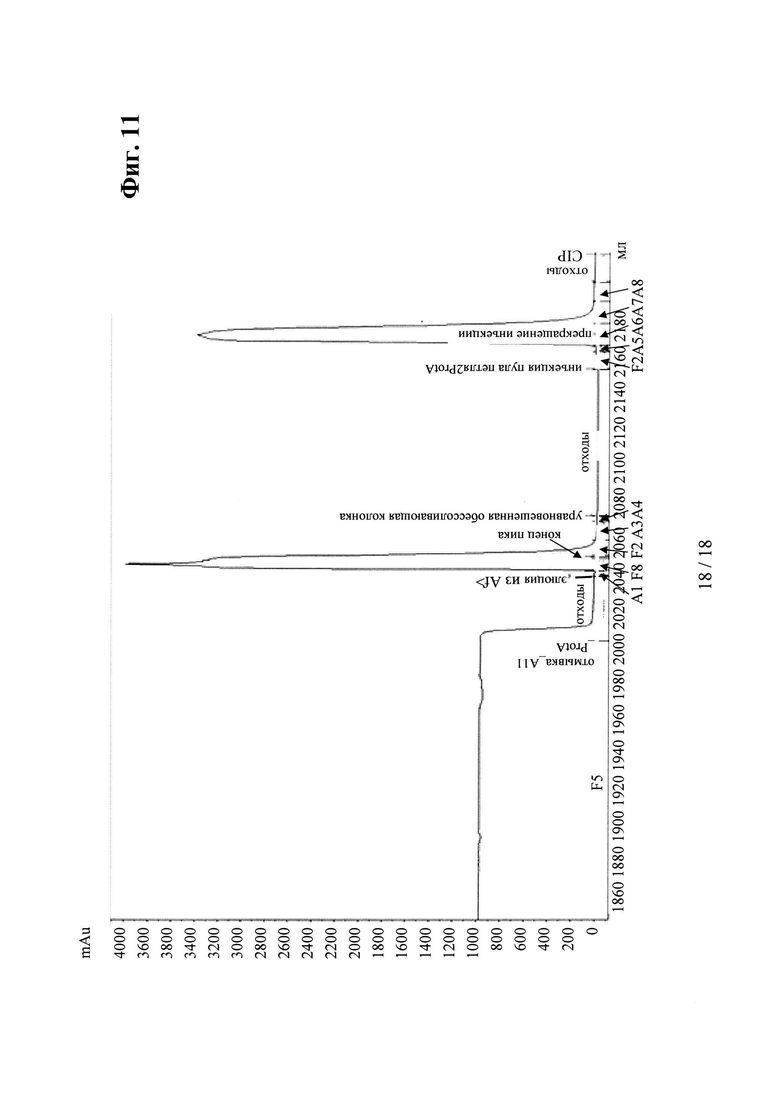
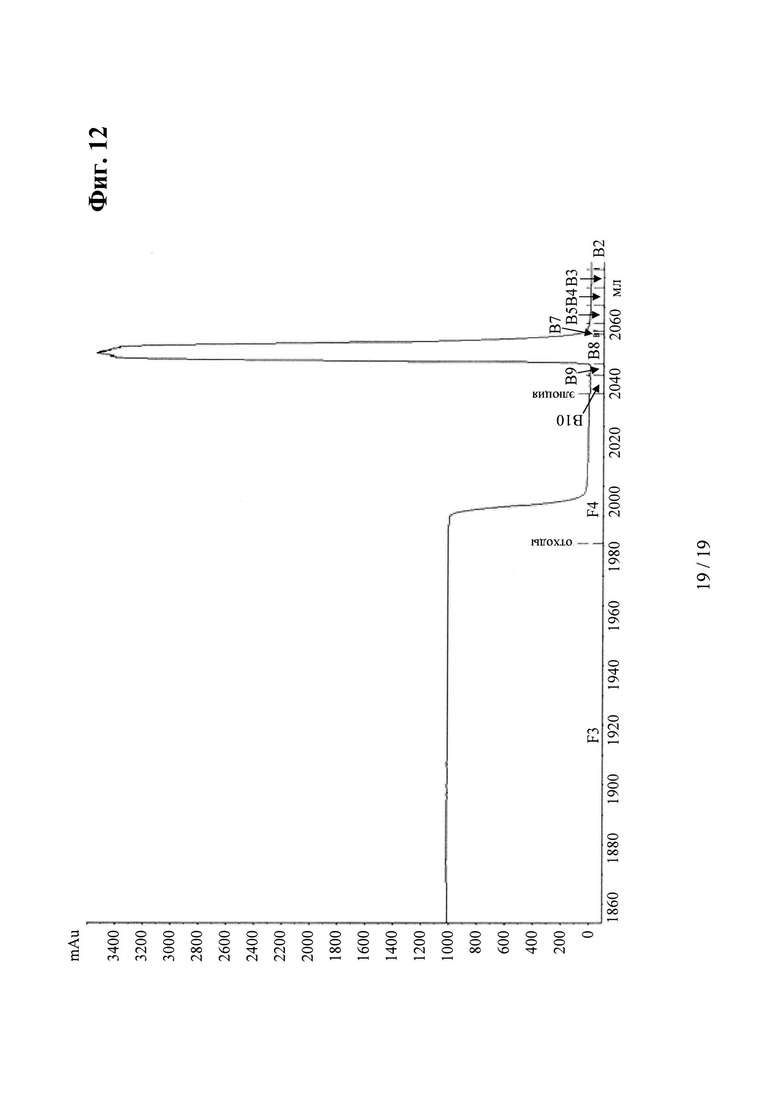
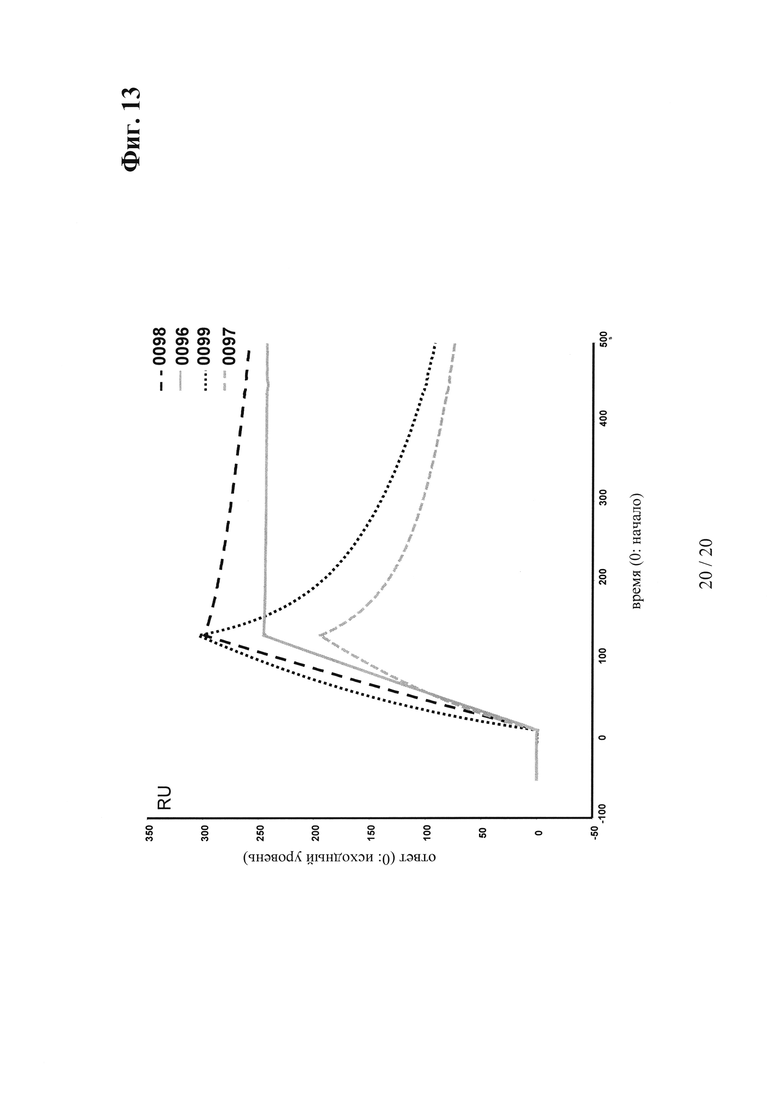
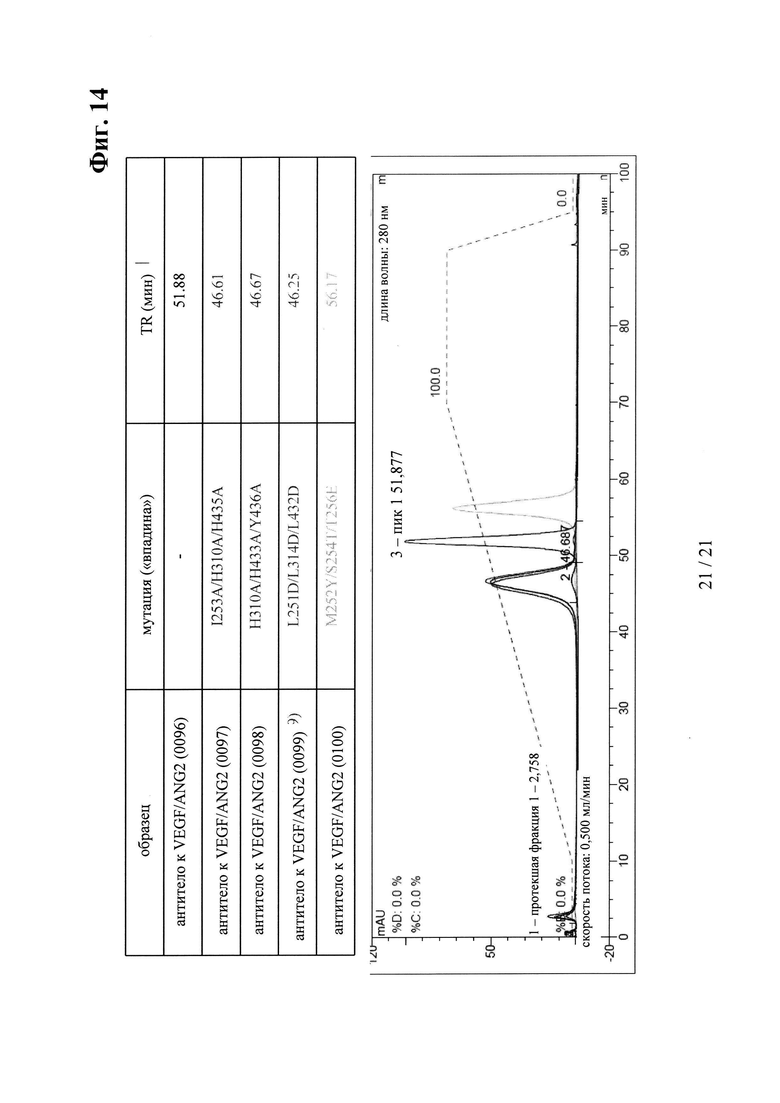

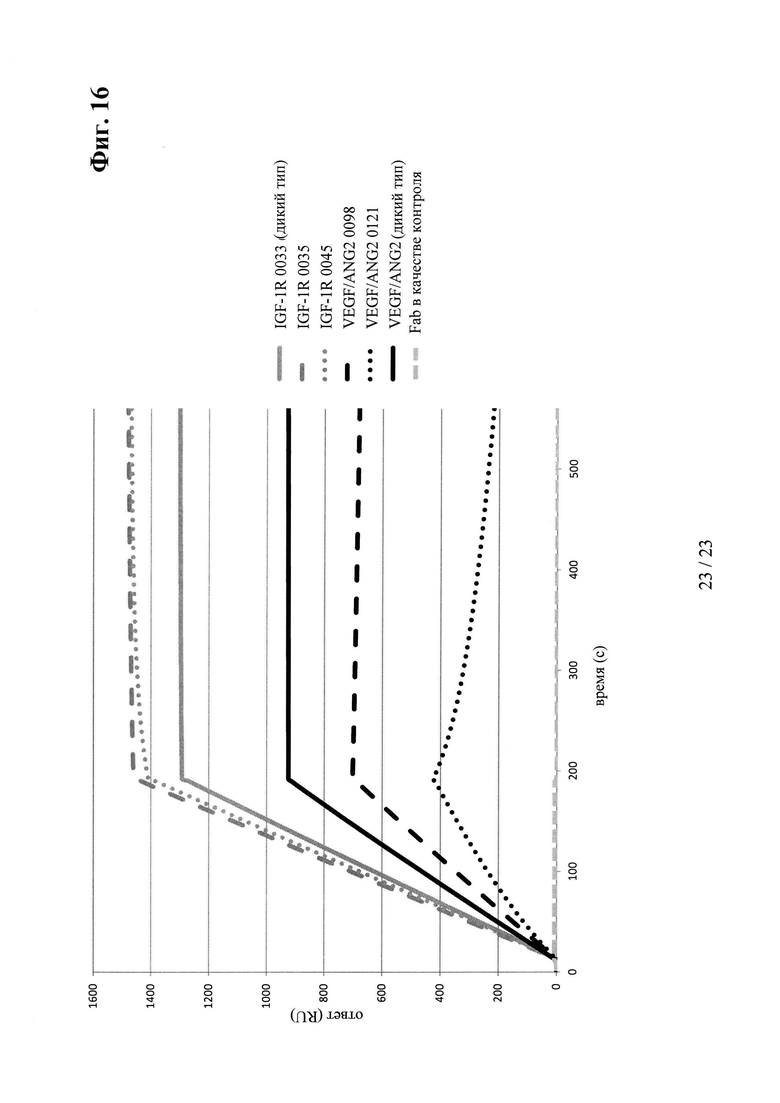
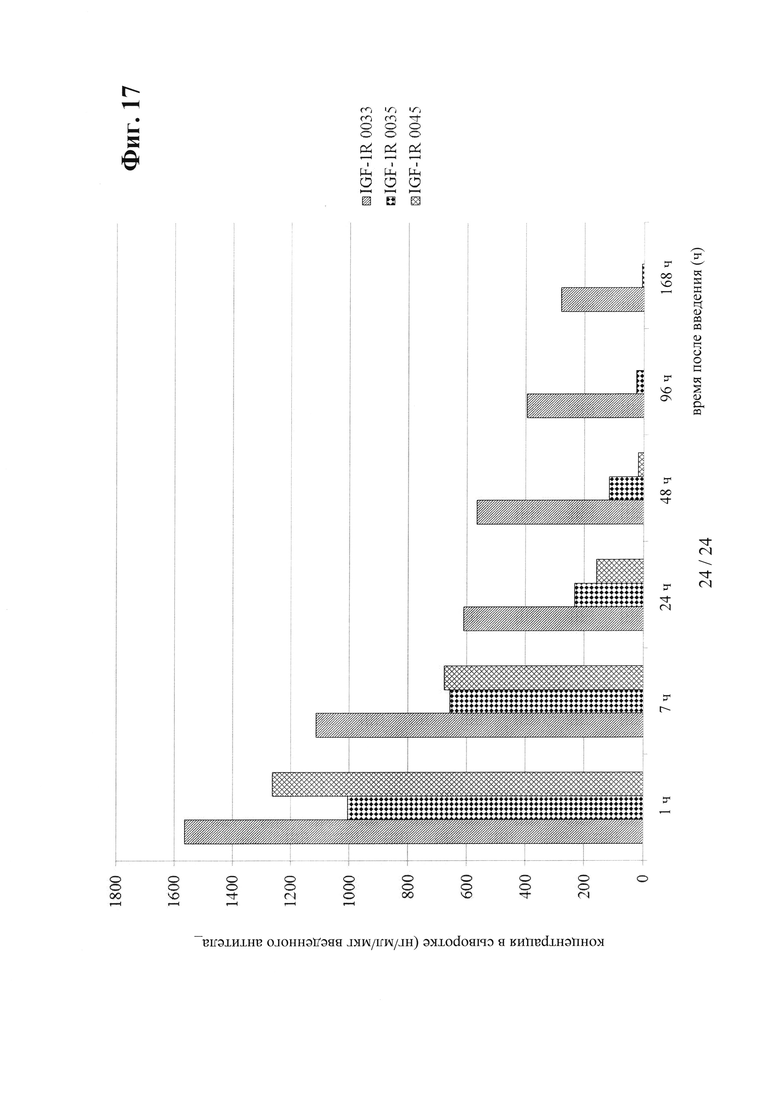
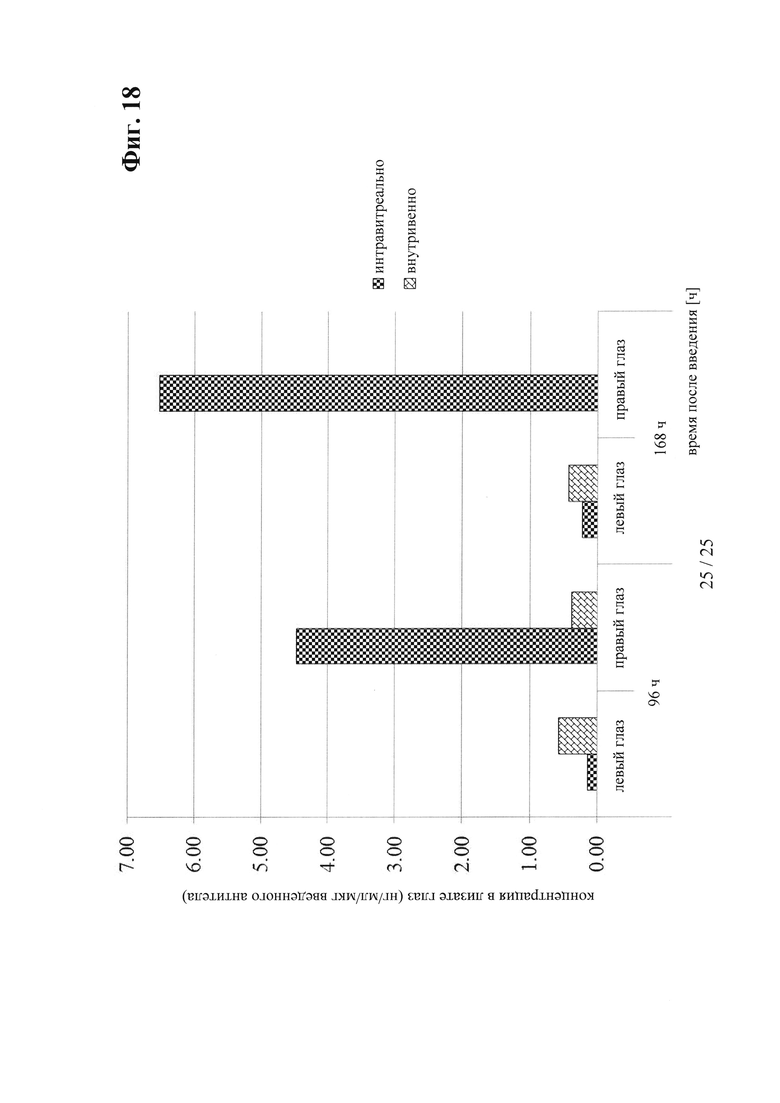
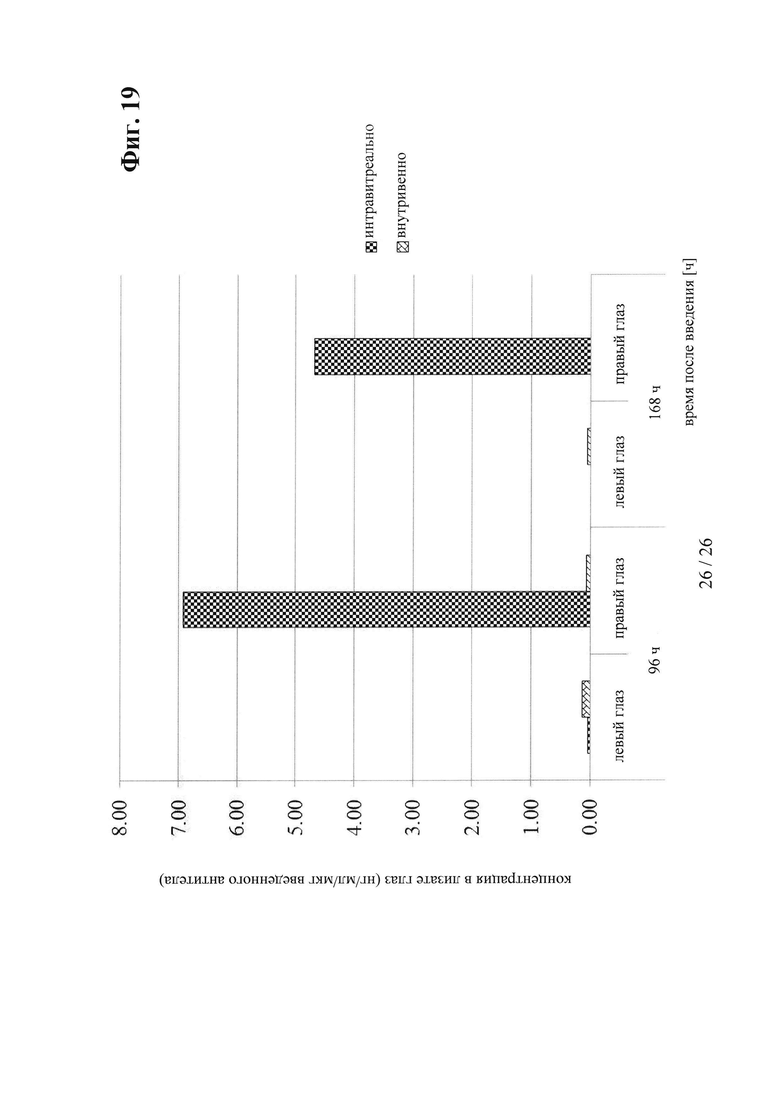
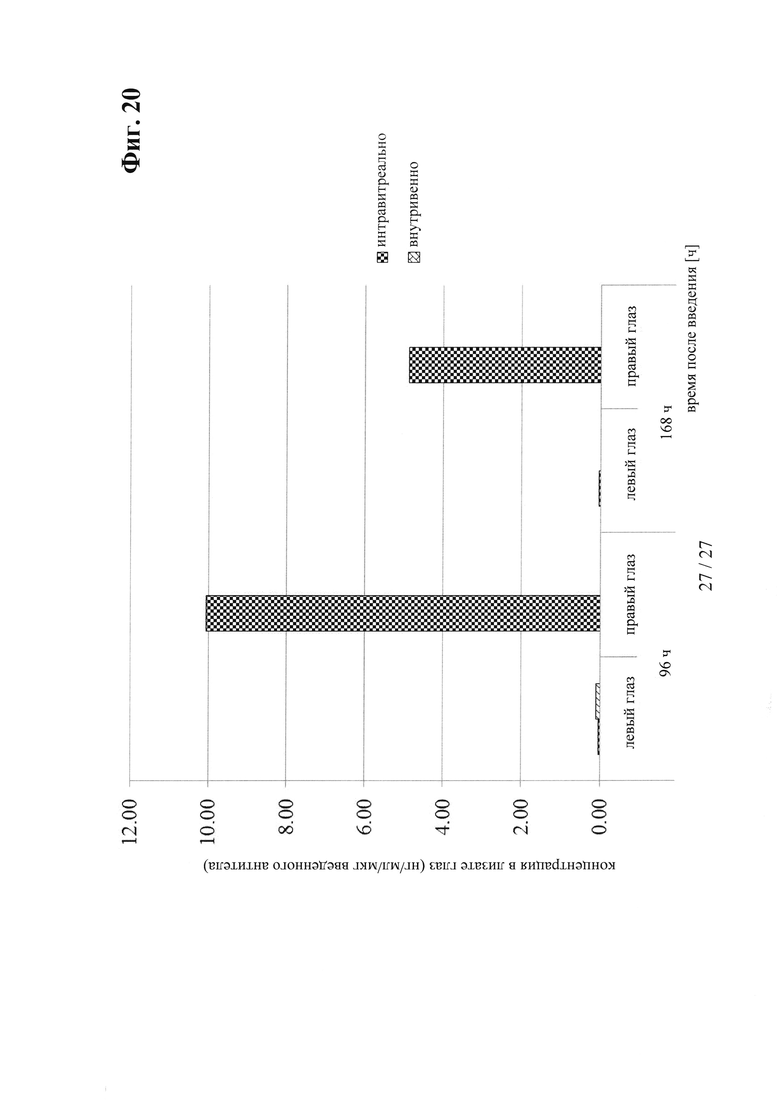
Настоящее изобретение относится к области иммунологии. Предложены способы получения полипептида, который специфически связывается с белком А стафилококков и не связывается с человеческим FcRn, содержащего четыре полипептида. Предложенное изобретение может найти дальнейшее применение в получении полипептидов со сниженным клиренсом и увеличенным временем полувыведения. 3 н. и 8 з.п. ф-лы, 45 табл., 20 ил., 8 пр.
1. Способ получения антитела, не связывающегося с FcRn человека и связывающегося с белком А стафилококков, содержащего первый полипептид и второй полипептид, каждый из которых содержит в направлении от N-конца к С-концу по меньшей мере часть шарнирной области иммуноглобулина IgG1-подкласса, которая содержит один или несколько остатков цистеина, СН2-домен иммуноглобулина IgG1-подкласса и СН3-домен иммуноглобулина IgG1-подкласса, в котором первый полипептид содержит мутации I253A, Н310А и Н435А (нумерация согласно Кэботу), а второй полипептид содержит мутации Н310А, Н433А и Y436A (нумерация согласно Кэботу),
причем указанный способ включает стадии:
- культивирования клетки-хозяина, содержащей нуклеиновую кислоту, кодирующую этот полипептид, в условиях, пригодных для его экспрессии, и
- выделения полипептида из клетки или культуральной среды.
2. Способ по п. 1, отличающийся тем, что I) первый полипептид дополнительно содержит мутации Y349C, T366S, L368A и Y407V (нумерация согласно Кэботу), а второй полипептид содержит мутации S354C и T366W (нумерация согласно Кэботу) или II) первый полипептид дополнительно содержит мутации S354C, T366S, L368A и Y407V (нумерация согласно Кэботу), а второй полипептид содержит мутации Y349C и T366W (нумерация согласно Кэботу).
3. Способ по любому из пп. 1, 2, отличающийся тем, что шарнирная область иммуноглобулина, СН2-домен иммуноглобулина и СН3-домен иммуноглобулина относятся к человеческому IgG1-подклассу.
4. Способ по любому из пп. 1-3, отличающийся тем, что первый полипептид и второй полипептид дополнительно содержат мутации L234A и L235A (нумерация согласно Кэботу).
5. Способ по любому из пп. 1, 2, отличающийся тем, что шарнирная область иммуноглобулина, СН2-домен иммуноглобулина и СН3-домен иммуноглобулина относятся к человеческому IgG2-подклассу.
6. Способ по любому из пп. 1, 2, отличающийся тем, что шарнирная область иммуноглобулина, СН2-домен иммуноглобулина и СН3-домен иммуноглобулина относятся к человеческому IgG4-подклассу.
7. Способ по любому из пп. 1, 2 и 6, отличающийся тем, что первый полипептид и второй полипептид дополнительно содержат мутации S228P и L235E (нумерация согласно Кэботу).
8. Способ по любому из пп. 1-7, отличающийся тем, что первый полипептид и второй полипептид дополнительно содержат мутацию P329G (нумерация согласно Кэботу).
9. Способ по любому из пп. 1-8, отличающийся тем, что полипептид представляет собой биспецифическое антитело.
10. Способ получения антитела, не связывающегося с FcRn человека и связывающегося с белком А стафилококков, содержащего первый полипептид, который содержит в направлении от N-конца к С-концу вариабельный домен первой тяжелой цепи, СН1 -домен иммуноглобулина IgG1-подкласса, шарнирную область иммуноглобулина IgG1-подкласса, СН2-домен иммуноглобулина IgG1-подкласса IgG1-подклассаи СН3-домен иммуноглобулина IgG1-подкласса,
второй полипептид, который содержит в направлении от N-конца к С-концу вариабельный домен второй тяжелой цепи, СН1-домен иммуноглобулина IgG1-подкласса подкласса IgG1, шарнирную область иммуноглобулина подкласса IgG1, СН2-домен иммуноглобулина IgG1-подклассаи СН3-домен иммуноглобулина подкласса IgG1,
третий полипептид, который содержит в направлении от N-конца к С-концу вариабельный домен первой легкой цепи и константный домен легкой цепи,
четвертый полипептид, который содержит в направлении от N-конца к С-концу вариабельный домен второй легкой цепи и константный домен легкой цепи,
в котором вариабельный домен первой тяжелой цепи и вариабельный домен первой легкой цепи образуют первый сайт связывания, который связывается с первым антигеном,
в котором вариабельный домен второй тяжелой цепи и вариабельный домен второй легкой цепи образуют второй сайт связывания, который связывается со вторым антигеном,
в котором первый полипептид содержит мутации Y349C, T366S, L368A и Y407V (нумерация согласно Кэботу), а второй полипептид содержит мутации S354C и T366W (нумерация согласно Кэботу), в котором первый и второй полипептиды дополнительно содержат мутации L234A, L235A и P329G (нумерация согласно Кэботу), и в котором первый полипептид содержит мутации I253A, Н310А и Н435А (нумерация согласно Кэботу), а второй полипептид содержит мутации Н310А, Н433А и Y436A(нумерация согласно Кэботу),
причем указанный способ включает стадии:
- культивирования клетки-хозяина, содержащей нуклеиновую кислоту, кодирующую этот полипептид, в условиях, пригодных для его экспрессии, и
- выделения полипептида из клетки или культуральной среды.
11. Способ получения антитела, не связывающегося с FcRn человека и связывающегося с белком А стафилококков, содержащего
первый полипептид, который содержит в направлении от N-конца к С-концу вариабельный домен первой тяжелой цепи, константный домен легкой цепи иммуноглобулина, шарнирную область иммуноглобулина подкласса IgG1, СН2-домен иммуноглобулина IgG1-подклассаи СН3-домен иммуноглобулина подкласса IgG1,
второй полипептид, который содержит в направлении от N-конца к С-концу вариабельный домен второй тяжелой цепи, СН1-домен иммуноглобулина подкласса IgG1, шарнирную область иммуноглобулина подкласса IgG1, СН2-домен иммуноглобулина IgG1-подклассаи СН3-домен иммуноглобулина подкласса IgG1,
третий полипептид, который содержит в направлении от N-конца к С-концу вариабельный домен первой легкой цепи и СН1-домен иммуноглобулина подкласса IgG1,
четвертый полипептид, который содержит в направлении от N-конца к С-концу вариабельный домен второй легкой цепи и константный домен легкой цепи,
в котором вариабельный домен первой тяжелой цепи и вариабельный домен первой легкой цепи образуют первый сайт связывания, который связывается с первым антигеном,
в котором вариабельный домен второй тяжелой цепи и вариабельный домен второй легкой цепи образуют второй сайт связывания, который связывается со вторым антигеном,
в котором первый полипептид содержит мутации Y349C, T366S, L368A и Y407V (нумерация согласно Кэботу), а второй полипептид содержит мутации S354C и T366W (нумерация согласно Кэботу),
в котором первый и второй полипептиды дополнительно содержат мутации L234A, L235A и P329G (нумерация согласно Кэботу), и в котором первый полипептид содержит мутации I253A, Н310А и Н435А (нумерация согласно Кэботу), а второй полипептид содержит мутации Н310А, Н433А и Y436A (нумерация согласно Кэботу),
причем указанный способ включает стадии:
- культивирования клетки-хозяина, содержащей нуклеиновую кислоту, кодирующую этот полипептид, в условиях, пригодных для его экспрессии, и
- выделения полипептида из клетки или культуральной среды.
| Способ защиты переносных электрических установок от опасностей, связанных с заземлением одной из фаз | 1924 |
|
SU2014A1 |
| Многоступенчатая активно-реактивная турбина | 1924 |
|
SU2013A1 |
| QIAO SW et | |||
| al | |||
| "Dependence of antibody-mediated presentation of antigen on FcRn", Proc Natl Acad Sci USA, Vol | |||
| Транспортер для перевозки товарных вагонов по трамвайным путям | 1919 |
|
SU105A1 |
| Прибор для отбирания средних проб жидкостей | 1926 |
|
SU9337A1 |
| MEDESAN C et | |||
| al | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Способ окисления боковых цепей ароматических углеводородов и их производных в кислоты и альдегиды | 1921 |
|
SU58A1 |
Авторы
Даты
2020-07-22—Публикация
2015-01-12—Подача