Изобретение относится к области медицины, а именно к способу прогнозирования анальгетической эффективности антиконвульсантов инфузией трифосаденина у онкологических пациентов с интенсивной болью.
Одним из ведущих симптомов в онкологической практике является боль, при этом частота интенсивной боли в популяции онкологических пациентов варьирует, по данным разных авторов, от 33% до 91% [1, 2]. Как известно, интенсивная боль нарушает эмоциональную сферу пациента, его физическую и социальную активность и, в целом, значительно снижает качество его жизни [3]. Однако, несмотря на существование клинических рекомендаций во многих странах мира, неэффективность терапии боли в странах с развитой медициной отмечена у 39-59% онкологических пациентов [4].
Нейропатическая боль, как компонент болевого синдрома онкологических пациентов, встречается часто [5] и может плохо поддаваться стандартной анальгетической терапии, включающей ингибиторы циклооксигеназы и сильные опиоиды [6]. Для усиления обезболивания к стандартной схеме рекомендуется добавлять анальгетические адъюванты, такие как антиконвульсанты, трициклические антидепрессанты, ингибиторы обратного захвата серотонина и норадреналина, но наиболее часто назначают габапентиноиды: габапентин и прегабалин [7].
Назначение габапентина онкологическим пациентам с болью нередко значительно улучшает их состояние, однако полноценный эффект препарата следует оценивать через несколько дней приема, а при его плохой переносимости подбор дозы задерживается на несколько недель [8], что может обусловить негативную оценку работы врача-специалиста по лечению боли со стороны пациента и его родственников.
В конце прошлого столетия в научной литературе появились работы, продемонстрировавшие анальгетические свойства неселективных агонистов пуриновых рецепторов [9]. Впоследствии было показано, что активация тормозных А1 пуриновых рецепторов афферентных нейронов ведет к ингибированию проведения ноцицептивных импульсов и смягчению болевых ощущений [10]. Было также установлено, что анальгетический эффект достигается при скорости инфузии равной 35-50 мкг/кг/мин в течение 45-60 мин [11].
При изучении обезболивающих свойств неселективных агонистов пуриновых рецепторов исследователи была продемонстрирована их эффективность в качестве анальгетика в периоперационном периоде [12], у пациентов с хронической нейропатической болью [13], в онкологии [14]. Кроме того, было выявлено, что этот класс фармакологических средств обладает свойствами антиконвульсанта [15].
Лечение боли у пациентов с онкологическим заболеванием может быть сложной клинической задачей [17]. Множественность механизмов развития боли, индивидуальность сочетания механизмов развития боли, особенности ментального статуса, недоступность подходящих фармакологических препаратов или методов анальгезии, недостаточная подготовка врача по проблемам обезболивания - вот неполный список причин случаев неудовлетворительного качества терапии боли [18].
Всемирно признанный подход к выбору схемы обезболивающей терапии заключается в применении шкалы, названной анальгетической лестницей Всемирной организации здравоохранения (ВОЗ), когда в зависимости от интенсивности боли должен быть назначен препарат той или иной группы. При этом, из-за того, что интенсивность боли лежит в основе принятия решения, механизмы развития боли у конкретного пациента остаются без внимания. Поэтому анальгетическая лестница ВОЗ была модифицирована, что заключалось в допустимости усиления обезболивающей схемы включением в ее состав анальгетических адъювантов, однако подход к назначению этих препаратов не определен с достаточной мерой стандартизации [19].
Одним из классов анальгетических адъювантов являются антиконвульсанты. Их эффективность при болевом синдроме у онкологических пациентов продемонстрирована многими исследовательскими группами [20]. Тем не менее, остается ряд неотвеченных вопросов, в частности, в какой популяции онкопациентов с болью следует назначать антиконвульсанты и в какой момент времени?
Одним из существенных недостатков, применяемых для лечения боли антиконвульсантов, является значительная продолжительность периода времени от начала приема до возможности полноценного заключения об анальгетической эффективности препарата у конкретного пациента.
Принимая во внимание вышесказанное, сделано предположение о том, что внутривенная инфузия неселективного агониста пуриновых рецепторов трифосаденина может сыграть роль прогностического критерия эффективности перорально принимаемого антиконвульсанта габапентина у онкологических пациентов с интенсивной болью.
Наиболее близким к заявляемому изобретения является способ прогнозирования анальгетической эффективности антиконвульсантов инфузией трифосаденина у онкологических пациентов с интенсивной болью (Карелов А.Е., Рязанкина А.А., Хохлова Е.А., Васильева Г.Н., Семкичев В.А. Применение инфузии трифосаденина у онкологических пациентов с болью: пилотное исследование. Вестник интенсивной терапии им. А.И. Салтанова. 2021;4:115-121. DOI: 10.21320/1818-474X-2021-4-115-121), в ходе которого пациенту осуществляют внутривенную инфузию раствора трифосаденина, а для прогностической оценки эффективности инфузии трифосаденина использовалась оригинальная шкала локализованности боли со следующим распределением таксономических критериев:
1 - боль четко локализована, пациент указывает границы на кожных покровах;
2 - пациент указывает приблизительные границы области болевых ощущений (область сустава, крупной кости, мышечной группы);
3 - пациент указывает на крупную анатомическую область без границ (конечность, таз, проекцию вовлеченного в онкопроцесс органа и т. п.).
При использовании шкалы локализованности боли была выявлена статистически достоверная корреляционная связь между эффективностью инфузии трифосаденина и болью с четкой локализованностью.
Недостатком ближайшего аналога является относительно низкая точность прогнозирования анальгетической эффективности трифосаденина у онкологических пациентов с приблизительными и, особенно, не имеющих границ локализованности боли.
Технической проблемой является необходимость разработки способа прогнозирования анальгетической эффективности обезболивающего средства, когда в течение малого промежутка времени, с помощью клинически релевантного инструмента (шкала или лекарственное средство) выявляются показания и определяется эффективность анальгетического действия для применения препарата (антиконвульсанта) у онкологических пациентов с интенсивной болью, лишенного вышеприведенных недостатков.
Технический результат состоит в повышении точности прогнозирования обезболивающей эффективности перорального назначения габапентина у конкретного онкологического пациента с жалобами на боль высокой или средней степени интенсивности на фоне применения неселективного ингибитора циклооксигеназы и слабого опиоида с помощью использования внутривенной инфузии трифосаденина.
Заявляемый способ осуществляют следующим образом. У каждого пациента была проанализирована вероятность наличия нейропатического компонента болевого синдрома. С этой целью применяли шкалу DN4 [16], валидизированную для применения в РФ. В тех случаях, когда насчитывали 4 и более баллов, принимали за правильную гипотезу о том, что у пациента имеет место нейропатический компонент болевого синдрома, а значит схему обезболивание следовало дополнить назначением препарата из группы антиконвульсантов. Пациенту при интенсивной онкологической боли (4 и выше баллов по вербально-цифровой шкале) на фоне применения неселективного ингибитора циклооксигеназы (кеторолак по 30 мг 2 р/сут внутримышечно или кетопрофен по 100 мг 2 р/сут внутримышечно) и слабого опиоидного агониста трамадола (по 100 мг 3 р/сут внутримышечно) осуществляют инфузию трифосаденина в количестве 35-45 мкг/кг/мин шприцевым дозатором в течение 110-160 мин. Оценку интенсивности боли производили за 30 мин до начала процедуры и через 30 мин после ее окончания. Интенсивность боли оценивают с помощи вербально-цифровой шкалы в диапазоне от 0 (нет боли) до 10 баллов (боль максимальной интенсивности). Положительный результат фармакологической интервенций считали снижение интенсивности боли на 20% и более (на 2 балла и более по 10-бальной вербально-цифровой шкале) и показанием для назначения антиконвульсантов габапентина. Во время процедуры побочные эффекты инфузии трифосфаденина, контролировали определением частоты сердечных сокращений и сатурации гемоглобина кислородом в пульсирующем потоке с помощью портативного пульсоксиметра.
После восстановления интенсивности боли до исходной величины пациентам с положительным результатом (снижение интенсивности боли на 20% и более (на 2 балла и более по 10-бальной вербально-цифровой шкале)) назначали перорально антиконвульсант габапентин в суточной дозе 900 мг, разделенной на три приема, при этом первую капсулу пациент принимал на ночь. При возникновении избыточной сонливости снижали разовую дозу в 2-3 раза с последующим ее наращиванием до 300 мг с интервалами, равными 2-3 суток. Эффективность габапентина оценивали после четырех суток его регулярного приема в дозе 900 мг/сут.
В некоторых вариантах реализации изобретения в дополнение к шкале могут быть использованы биомаркеры, являющиеся предикторами боли. Для этого за 30 мин до начала процедуры у пациента забирают анализ крови и оценивают экспрессию генов GNG7, CNTN1, LY9, CCDC144B, GBP1 и MFAP3 [22, 23]. Через 30 минут у пациента берут дополнительный анализ крови и при наличии изменения экспрессии по меньшей мере одного из данных генов в 2 раза и более по сравнению с результатами первого анализа, фиксируют изменение интенсивности боли у пациента. При этом снижение или повышение интенсивности при таком изменении определяют путем опроса пациента.
Заявляемый способ был разработан следующим образом.
Для быстрой оценки эффективности антиконвульсанта габапентина при интенсивной онкологической боли на фоне применения неселективного ингибитора циклооксигеназы и трамадола, использовалась внутривенная инфузия препарата трифосаденина с антиконвульсивным и обезболивающим эффектами. В результате инфузии трифосаденина в течение приблизительно 60 минут был достигнут хороший уровень обезболивания, который проявил высокую корреляционную связь с эффектом ежедневного перорального приема 900 мг габапентина, что доказывает клиническую значимость предложенного метода.
Взрослые 34-е онкологических пациента, имевшие жалобы на боль высокой или средней степени интенсивности, т.е. 4 и выше баллов по вербально-цифровой шкале, на фоне схемы обезболивания, включавшей неселективный ингибитор циклооксигеназы и слабый опиоид трамадол. Эти пациенты страдали запущенными формами солидных опухолей, мелкоклеточным раком легкого, лимфопролиферативными заболеваниями и др.; части из них проводили неоадъювантную лучевую и/или полихимиотерапию в качестве подготовки к хирургическому лечению или специфическое противоопухолевое лечение, если оперативное вмешательство не планировалось. Болевые ощущения определялись в регионах роста опухоли и/или ее метастазов, которые локализовались в грудной и брюшной полостях, забрюшинном пространстве, области таза, тканях конечностей.
В таблице 1 показано распределение пациентов по полу и возрасту.
Распределение пациентов по полу и возрасту
Все пациенты обезболивались с помощью одного из препаратов группы неселективных ингибиторов циклооксигеназы (кеторолак по 30 мг 2 р/сут внутримышечно или кетопрофен по 100 мг 2 р/сут внутримышечно) и слабый опиоидный агонист трамадол (по 100 мг 3 р/сут внутримышечно). Применение какого-либо варианта нейроаксиальной блокады во всех случаях было признано либо противопоказанным из-за инфекционного процесса, либо нецелесообразным из-за большой распространенности болевых ощущений.
У каждого пациента была проанализирована вероятность наличия нейропатического компонента болевого синдрома. С этой целью применяли шкалу DN4 [16], валидизированную для применения в РФ. В тех случаях, когда насчитывали 4 и более баллов, принимали за правильную гипотезу о том, что у пациента имеет место нейропатический компонент болевого синдрома, а значить, схему обезболивание следовало дополнить назначением препарата из группы антиконвульсантов.
Внутривенную инфузию трифосаденина проводили в палате профильного отделения или в процедурном кабинете на кушетке. После катетеризации периферической вены налаживали капельную систему и начинали вливание 0,9% раствора натрия хлорида с минимальной скоростью. Затем подсоединяли линию с 1% раствором трифосаденина; последний вводили со скоростью 35-45 мкг/кг/мин шприцевым дозатором в течение 110-160 мин.
Интенсивность боли оценивали с помощи вербально-цифровой шкалы в диапазоне от 0 (нет боли) до 10 баллов (боль максимальной интенсивности). Оценку интенсивности боли производили за 30 мин до начала процедуры и через 30 мин после ее окончания. Учитывая спектр побочных эффектов инфузии трифосфаденина, во время процедуры контролировали частоту сердечных сокращений и сатурацию гемоглобина кислородом в пульсирующем потоке с помощью портативного пульсоксиметра, но ни у кого из пациентов никаких побочных эффектов после применения инфузии трифосаденина выявлено не было.
После восстановления интенсивности боли до исходной величины назначали перорально антиконвульсант габапентин в суточной дозе 900 мг, разделенной на три приема, при этом первую капсулу пациент принимал на ночь. При возникновении избыточной сонливости снижали разовую дозу в 2-3 раза с последующим ее наращиванием до 300 мг с интервалами, равными 2-3 суток. Однако одна пациентка выбыла из исследования из-за плохой переносимости габапентина в виде избыточной сонливости и обстипации, поэтому ее данные не учитывались при обработке полученного материала. Эффективность габапентина оценивали после четырех суток его регулярного приема в дозе 900 мг/сут.
Эффективность препаратов оценивали путем анализа их обезболивающей активности в исследуемой группе пациентов. Положительным результатом любой из фармакологических интервенций считали снижение интенсивности боли на 20% и более (на 2 балла и более по 10-бальной вербально-цифровой шкале).
После получения результатов и формирования электронной матрицы статистическая обработка данных производилась в среде программ Statistica 10.0 (StatSoft Inc., США). Для статистического анализа были использован непараметрический критерий - T-критерий Wilcoxon (Wilcoxon signed rank test) для связанных выборок. При выполнении корреляционного анализа применяли ρ-критерий Spearman (Spearman rank correlation coefficient), τ-критерий Kendall (Kendall tau rank correlation coefficient) и гамма-критерий (gamma-test). Для характеристики силы связи использовали шкалу Chaddock-Snedecor (Chaddock-Snedecor scale).
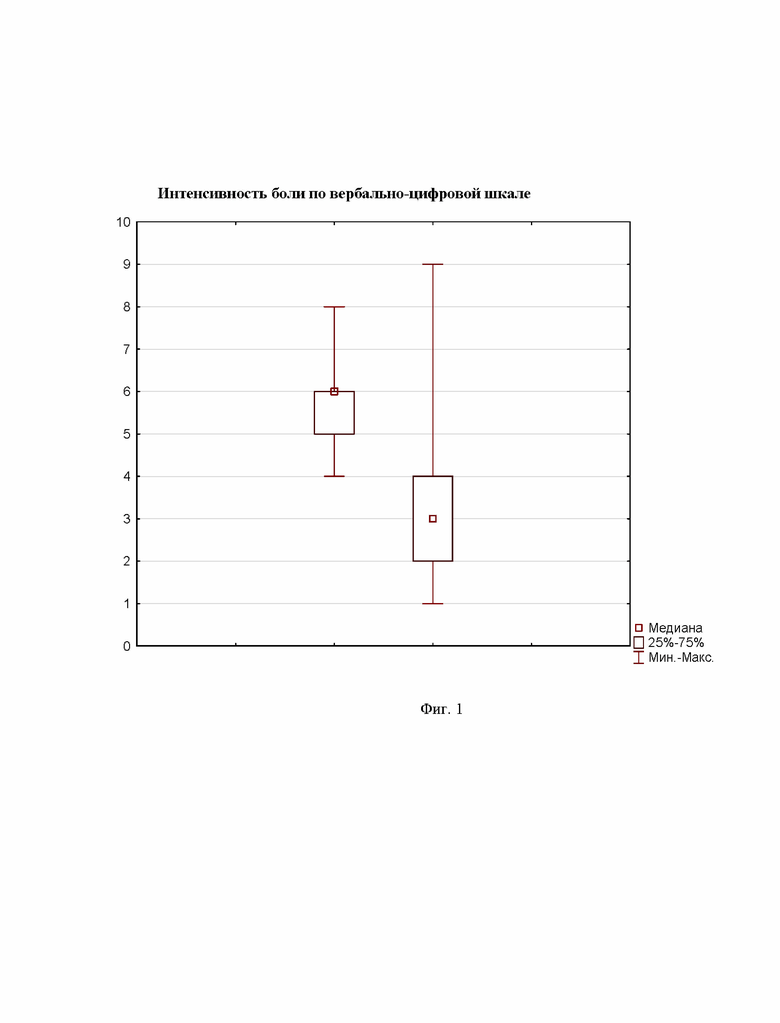
Внутривенная инфузия раствора трифосаденина обеспечила снижение интенсивности боли более чем на 20% у 24 из 34 пациентов, что составляет 70,6%. При статистическом анализе полученных результатов была выявлена достоверная разница между средними величинами интенсивности боли до инфузии трифосаденина и после нее (Z=4,0; р=0,00006 - T-критерий Wilcoxon). На рисунке 1 показаны графики положения медианы интенсивности боли, квартильный доверительный интервал (25-75%) и границы крайних - минимального и максимального - значений, которые оценивали до и после инфузии трифосаденина. На фиг. 1 представлено сравнение интенсивности боли до и после внутривенной инфузии трифосаденина (n=34).
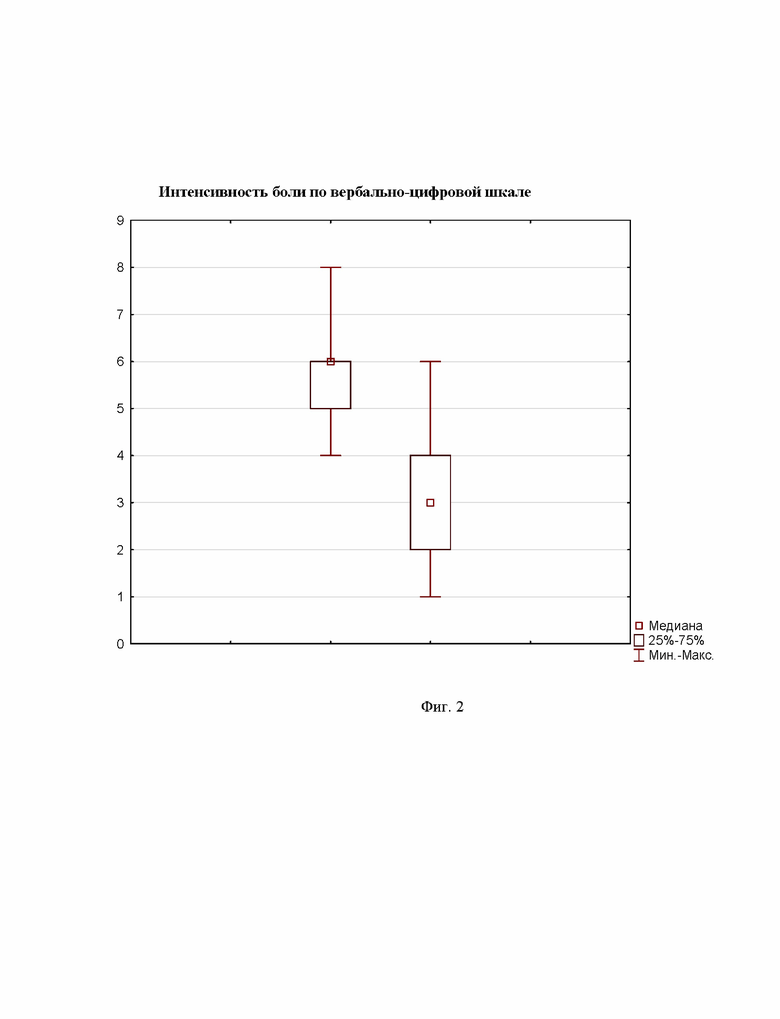
Прием габапентина позволил добиться положительного результата у 82,4% (28 из 34) пациентов. Анализ полученных данных позволил выявить статистически достоверную разницу интенсивности боли до и после четырехдневного приема 900 мг габапентина ежесуточно (Z=4,9; р=0,000001 - T-критерий Wilcoxon). На фиг. 2 показаны графики положения медианы интенсивности боли, квартильный доверительный интервал (25-75%) и границы крайних - минимального и максимального - значений, которые оценивали до и после четырех дней приема 900 мг габапентина.
На фиг. 2 представлено сравнение интенсивности боли до и после четырехдневного приема габапентина в дозе 900 мг/сут (n=34).
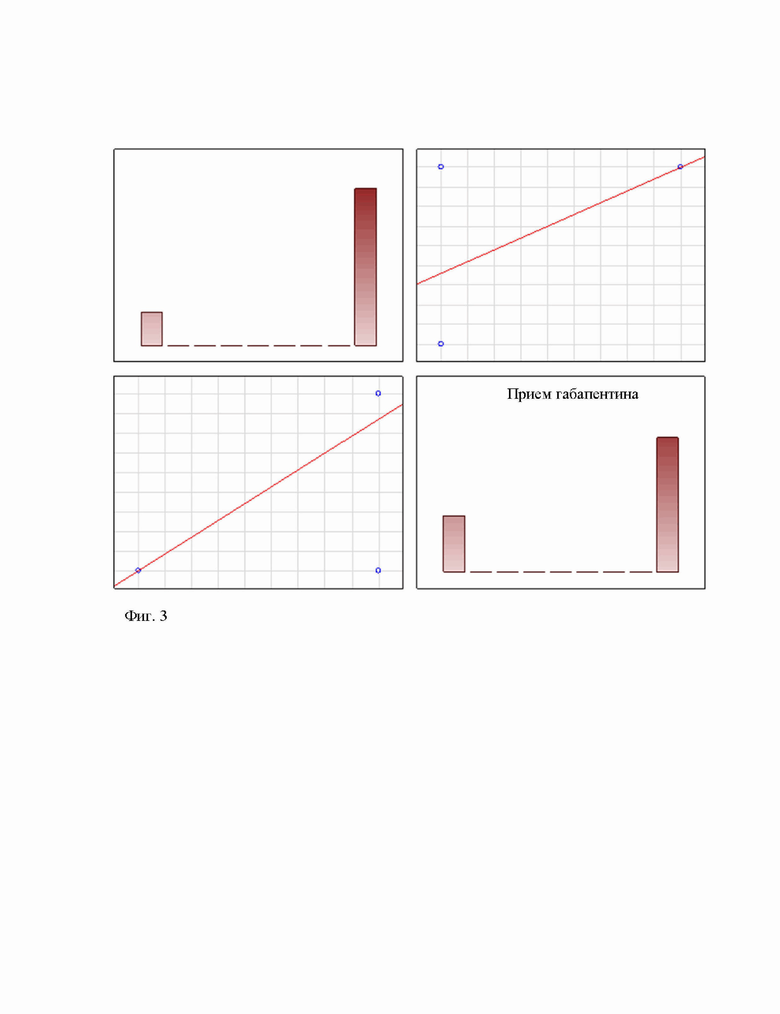
При проведении корреляционного анализа была выявлена статистически достоверная корреляционная связь между обезболивающей эффективностью инфузии трифосаденина и снижением интенсивности боли при пероральном приеме 900 мг/сут габапентина (t(N-2)=5,82; теснота связи = 0,72 (сильная связь); p=0,000002 - pо-критерий Spearman; Z - 5,96; теснота связи = 0,72 (сильная связь); p=0,0000001 - тау-критерий Кенделл; Z - 5,96; теснота связи = 1 (очень сильная связь); p=0,0000001 - гамма-критерий). На рисунке 2 представлены графики корреляционного анализа между эффективностью инфузии трифосаденина и обезболивающим действием перорального приема габапентина.
На фиг. 3 представлен результат корреляционного анализа между эффективностью инфузии трифосаденина и обезболивающим действием ежедневного перорального приема 900 мг габапентина (n=34)
Динамика интенсивности боли до и после инфузии трифосаденина
максимальное значение
Динамика интенсивности боли до и после четырехдневного перорального приема габапентина в суточной дозе 900 мг
максимальное значение
Инфузия трифосаденина является эффективным способом обезболивания у онкологических пациентов. Однако отсутствие неинъекционных лекарственных форм и краткосрочность эффекта этого препарата не позволяет говорить сегодня о значимых перспективах длительного его применения при хронических болевых синдромах. Главное клиническое значение этого препарата как показано это, с одной стороны, в лечении вариантов острой боли, а, с другой стороны, в использовании его в качестве тестирующего препарата - практического воплощения концепции анальготестирования [21].
Кроме того, следует отметить, что в выбранной популяции онкологических пациентов неэффективность инфузии трифосаденина была отмечена в 10 (29,4%) случаях, а ежедневного перорального приема 900 мг габапентина - у 6 (17,6%) человек; при этом все эти пациенты по шкале DN4 набрали от 4 до 7 баллов. Интересно, что пуриновый агонист оказался эффективнее антиконвульсанта у 4 пациентов, а габапентин действеннее трифосаденина в 7 наблюдениях.
Внутривенная инфузия неселективного агониста пуриновых рецепторов трифосаденина имеет значение для прогноза эффективности перорального приема антиконвульсанта у онкопациентов на фоне приема неселективного ингибитора циклооксигеназы и слабого опиоида.
Список литературы
1. International Association for the Study of Pain. IASP. Cancer Pain. Accessed December 09, 2020
https://www.iasp-pain.org/GlobalYear/CancerPain
2. Laws & Regulations Database of The Republic of China (2014). Regulations for Cancer Care Quality Assurance Measures. Laws & Regulations Database of The Republic of China. Accessed 30 March 2020
https://law.moj.gov.tw/ENG/LawClass/LawAll.aspx?pcode=L0070016
3. Lin C.C., Lai Y.L., Ward S.E. Effect of cancer pain on performance status, mood states, and level of hope among Taiwanese cancer patients. J Pain Symptom Manag 2003;25(1):29-37
https://doi.org/10.1016/s0885-3924(02)00542-0
4. Deandrea S., Montanari M., Moja L., Apolone G. (2008) Prevalence of undertreatment in cancer pain. A review of published literature. Ann Oncol 2008;19(12):1985-1991
https://doi.org/10.1093/annonc/mdn419
5. Garcia de Paredes M.L., del Moral  del Prado P. et al. First evidence of oncologic neuropathic pain prevalence after screening 8615 cancer patients. Results of the On-study Ann Oncol 2011;22(4):924-930
del Prado P. et al. First evidence of oncologic neuropathic pain prevalence after screening 8615 cancer patients. Results of the On-study Ann Oncol 2011;22(4):924-930
https://doi.org/10.1093/annonc/mdq449
6. Rayment C., Hjermstad MJ, Aass N. et al. Neuropathic cancer pain: prevalence, severity, analgesics and impact from the European Palliative Care Research Collaborative-Computerised Symptom Assessment study. Palliat Med. 2013 Sep;27(8):714-21.
https://doi.org/10.1177/0269216312464408
7. Finnerup N.B., Sindrup S.H., Jensen T.S. The evidence for pharmacological treatment of neuropathic pain. Pain 2010;150(3):573-581
https://doi.org/10.1016/j.pain.2010.06.019
8. Chen D.L., Li Y.H., Wang Z.J., Zhu Y.K. The research on long-term clinical effects and patients' satisfaction of gabapentin combined with oxycontin in treatment of severe cancer pain. Medicine (Baltimore) 2016;95(42):e5144 https://doi.org/10.1097/MD.0000000000005144
9. Sollevi A. Adenosine infusion during isoflurane-nitrous oxide anaesthesia: indications of perioperative analgesic effect Acta Anesthesiol Scand 1992;36(6):595-599
10. Reeve A.J., Dickenson A.H. The roles of spinal adenosine receptors in the control of acute and more persistent nociceptive responses of dorsal horn neurones in the anaesthetized rat Br J Pharmacol 1995;116:2221-2228
11. Belfrage M., Sollevi A., Segerdahl M.,  Hansson P. Systemic adenosine infusion alleviates spontaneous and stimulus evoked pain in patients with peripheral neuropathic pain. Anesth Analg 1995;81(4):713-717
Hansson P. Systemic adenosine infusion alleviates spontaneous and stimulus evoked pain in patients with peripheral neuropathic pain. Anesth Analg 1995;81(4):713-717
https://doi.org/10.1097/00000539-199510000-00010
12. Lynch M.E., Clark A.J., Sawynok J. Intravenous adenosine alleviates neuropathic pain: a double blind placebo controlled crossover trial using an enriched enrolment design. Pain 2003;103(1-2):111-117
https://doi.org/10.1016/s0304-3959(02)00419-0
13. Карелов А.Е. Сравнение потребности в миорелаксантах во время абдоминальных операций на фоне пуриновой или опиоидной анальгезии Эфферентная терапия 2010;16(4):47-50. [Karelov A.E. Comparison of the need for muscle relaxants during abdominal surgery on the background of purine or opioid analgesia. Efferentnaya terapiya 2010;16(4):47-50. (in Russ.)].
14. Карелов А.Е. Рязанкина А.А., Хохлова Е.А., Васильева Г.Н., Семкичев В.А. Применение инфузии трифосаденина у онкологических пациентов с болью: пилотное исследование. Вестник интенсивной терапии 2021;4:115-121. [Karelov A.E., Ryazankina A.A., Khokhlova E.A., Vasilieva G.N., Semkichev V.A. Adenosine triphosphate infusion in patients with cancer pain: a pilot study. Annals of Critical Care 2021;4:115-121. (in Russ.)].
https://doi.org/10.21320/1818-474X-2021-4-115-121
15. Boison D. Adenosine and epilepsy: from therapeutic rationale to new therapeutic strategies. Neuroscientist 2005;11:25-36
https://doi.org/10.1177/1073858404269112
16. Bouhassira D., Attal N., Alchaar H. et al. Comparison of pain syndromes associated with nervous or somatic lesions and development of a new neuropathic pain diagnostic questionnaire (DN4). Pain 2005;114(1-2):29-36
https://doi.org/10.1016/j.pain.2004.12.010
17. Осипова Н.А. Современные тенденции в науке и практике лечения боли. Анестезиология и реаниматология 2014;2:26-32. [Osipova N.A. Modern global tendencies in the research and practice of pain treatment trends in world science and practice of pain treatment. Anaesthesiology and reanimatology 2014;2:26-32. (in Russ.)].
18. Карелов А.Е. Современные представления о механизмах боли. Анестезиология и реаниматология. 2020;(6):88-95. [Karelov AE. Modern concepts of pain mechanisms. Russian Journal of Anaesthesiology and Reanimatology 2020;(6):88-95. (In Russ.)].
https://doi.org/10.17116/anaesthesiology202006187
19. https://doi.org/10.17116/anaesthesiology202006187 Yang J., Bauer B.A., Wahner-Roedler D.L., Chon T.Y., Xiao L. The Modified WHO Analgesic Ladder: Is It Appropriate for Chronic Non-Cancer Pain? J Pain Res. 2020;13:411-417
https://doi.org/10.2147/JPR.S244173
20. Caraceni A., Zecca E., Bonezzi C. Gabapentin for neuropathic cancer pain: a randomized controlled trial from the Gabapentin Cancer Pain Study Group. J Clin Oncol. 2004;22(14):2909-2917
https://doi.org/10.1200/JCO.2004.08.141
21. Карелов А.Е. Принципы анальготестирования в клинической альгологии Вестник интенсивной терапии 2014;3:34-37. [Karelov AE The analgotesting principles in clinical algology. Herold of intensive care 2014;3:34-37 (in Russ.)].
22. International Association for the Study of Pain. IASP. Cancer Pain. Accessed December 09, 2020
https://www.iasp-pain.org/GlobalYear/CancerPain
23. Laws & Regulations Database of The Republic of China (2014). Regulations for Cancer Care Quality Assurance Measures. Laws & Regulations Database of The Republic of China. Accessed 30 March 2020
https://law.moj.gov.tw/ENG/LawClass/LawAll.aspx?pcode=L0070016
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПРЕДОТВРАЩЕНИЯ ФАНТОМНОГО БОЛЕВОГО СИНДРОМА ПОСЛЕ АМПУТАЦИИ КОНЕЧНОСТЕЙ | 2011 |
|
RU2446795C1 |
| Способ определения показаний к лечению габапентином болевого синдрома при синдроме жжения глаз | 2022 |
|
RU2786958C1 |
| Способ лечения онкологической боли | 2019 |
|
RU2707954C1 |
| Способ послеоперационного обезболивания онкологических больных с хроническим болевым синдромом при выполнении декомпрессивно-стабилизирующих операций на позвоночнике | 2023 |
|
RU2811259C2 |
| СПОСОБ ПРОФИЛАКТИКИ ПОСТТОРАКОТОМИЧЕСКОГО БОЛЕВОГО СИНДРОМА В ОНКОХИРУРГИИ | 2016 |
|
RU2619212C2 |
| Способ лечения болей после ампутации конечности | 2023 |
|
RU2823155C1 |
| ПРИМЕНЕНИЕ РЕТИГАБИНА ДЛЯ НЕВРОПАТИЧЕСКИХ БОЛЕЙ | 2000 |
|
RU2264813C2 |
| СПОСОБ ПОСЛЕОПЕРАЦИОННОГО ОБЕЗБОЛИВАНИЯ ПРИ ВЫПОЛНЕНИИ ДЕКОМПРЕССИВНО-СТАБИЛИЗИРУЮЩИХ ОПЕРАЦИЙ НА ПОЗВОНОЧНИКЕ У ОНКОЛОГИЧЕСКИХ БОЛЬНЫХ С ХРОНИЧЕСКИМ БОЛЕВЫМ СИНДРОМОМ | 2023 |
|
RU2811265C2 |
| СПОСОБ ЛЕЧЕНИЯ ДИАБЕТИЧЕСКОЙ ДИСТАЛЬНОЙ СИММЕТРИЧНОЙ СЕНСОМОТОРНОЙ ПОЛИНЕВРОПАТИИ НИЖНИХ КОНЕЧНОСТЕЙ | 2008 |
|
RU2358720C1 |
| Способ лечения скелетно-мышечной неспецифической боли в нижней части спины | 2023 |
|
RU2826167C1 |
Изобретение относится к области медицины, а именно к онкологии, и может быть использовано для прогнозирования анальгетической эффективности антиконвульсантов инфузией трифосаденина у онкологических пациентов с интенсивной болью. У пациента с интенсивностью боли от 4 баллов и выше по вербально-цифровой шкале осуществляют инфузию трифосаденина в количестве 35-45 мкг/кг/мин в течение 110-160 мин. Через 30 минут после окончания введения препарата проводят повторную оценку интенсивности боли по вербально-цифровой шкале. При снижении интенсивности боли на 2 балла и более прогнозируют высокую эффективность габапентина, а при отсутствии снижения интенсивности боли прогнозируют низкую эффективность габапентина. Способ повышает точность прогнозирования обезболивающей эффективности перорального назначения габапентина у конкретного онкологического пациента с жалобами на боль высокой или средней степени интенсивности на фоне применения неселективного ингибитора циклооксигеназы и слабого опиоида за счет проведения внутривенной инфузии трифосаденина. 3 ил., 3 табл.
Способ прогнозирования анальгетической эффективности антиконвульсантов инфузией трифосаденина у онкологических пациентов с интенсивной нейропатической болью на фоне приема неселективного ингибитора циклооксигеназы и трамадола, в ходе которого пациенту осуществляют инфузию трифосаденина, отличающийся тем, что у пациента с интенсивностью боли от 4 баллов и выше по вербально-цифровой шкале осуществляют инфузию трифосаденина в количестве 35-45 мкг/кг/мин в течение 110-160 мин, затем через 30 минут после окончания введения препарата проводят повторную оценку интенсивности боли по вербально-цифровой шкале, и при снижении интенсивности боли на 2 балла и более прогнозируют высокую эффективность габапентина, а при отсутствии снижения интенсивности боли прогнозируют низкую эффективность габапентина.
| КАРЕЛОВ А.Е | |||
| Эффективность инфузии аденозинтрифосфата натрия у пациентов, страдающих нейропатическими болевыми синдромами | |||
| Вестник Российской военно-медицинской академии | |||
| Устройство для закрепления лыж на раме мотоциклов и велосипедов взамен переднего колеса | 1924 |
|
SU2015A1 |
| Огнетушитель | 0 |
|
SU91A1 |
| КАРЕЛОВ А.Е | |||
| и др | |||
| Применение инфузии трифосаденина у онкологических пациентов с болью: пилотное исследование | |||
| Вестник интенсивной терапии им | |||
| А.И | |||
Авторы
Даты
2024-02-29—Публикация
2022-12-07—Подача