Область техники
[1] Настоящее изобретение относится к противовирусному соединению, в частности, к соединению, имеющему высокую селективность и биоактивность против вируса иммунодефицита человека (ВИЧ), и к его применению.
Уровень техники
[2] Синдром приобретенного иммунодефицита (СПИД) возникает в результате инфицирования вирусом иммунодефицита человека (ВИЧ). Существует две формы ВИЧ, ВИЧ-1 и ВИЧ-2, причем ВИЧ-1 является наиболее распространенным во всем мире. Для лечения СПИДа разработаны ингибиторы ферментов в соответствии с механизмом действия ВИЧ. В зависимости от места действия, ингибиторы ферментов подразделяют на нуклеозидные ингибиторы обратной транскриптазы (NRTI), ингибиторы протеазы (PI), ингибиторы слияния и ингибиторы интегразы.
[3] По механизму действия различают ингибиторы интегразы с ингибирующей активностью в каталитическом центре и с ингибирующей активностью не в каталитическом центре. До настоящего времени проведены активные исследования ингибиторов каталитического центра интегразы, и были разработаны и представлены на рынке три типа таких препаратов-ингибиторов. Среди них иллюстративным препаратом является ралтегравир, разработанный в 2008 году. С другой стороны, представлен ингибирующий механизм действия не в каталитическом центре интегразы, описанный авторами Zeger Debyser et al., (Frauke Christ, Zeger Debyser at al., Nature Chemical Biology, 2010, том 6, 442-448), и разработка ингибиторов с таким механизмом действия активно продолжается.
[4] Кроме того, проводятся различные исследования по разработке препаратов для эффективного лечения резистентных вирусов, причем такие терапевтические агенты демонстрируют значительное влияние на увеличение продолжительности жизни при проведении высокоактивной антиретровирусной терапии (HAART), в которой вводят комбинацию от 2 до 4 типов препаратов, ингибирующих различные механизмы. Однако, несмотря на предпринятые усилия, СПИД не был излечен, и даже продолжают возникать проблемы токсичности лекарственных средств и развития резистентности к современным терапевтическим агентам. Соответственно, существует постоянная потребность в разработке новых терапевтических агентов.
[5] В рамках работ по решению указанных проблем, авторы настоящего изобретения неоднократно проводили исследования по разработке новых терапевтических средств против СПИДа и в результате обнаружили, что производное пирролопиридина с новым скелетом обладает эффектом ингибирования пролиферации ВИЧ, и завершили настоящее изобретение.
Сущность изобретения
Техническая проблема
[6] Задача настоящего изобретения заключается в обеспечении пирролопиридинового производного, обладающего эффектом ингибирования пролиферации ВИЧ-1 посредством подавления активности фермента интегразы ВИЧ-1, его рацемата, его стереоизомера или его фармацевтически приемлемой соли.
[7] Другая задача настоящего изобретения заключается в обеспечении способа получения нового пирролопиридинового производного, его рацемата, его стереоизомера или его фармацевтически приемлемой соли.
[8] Еще одна задача настоящего изобретения заключается в обеспечении медицинского применения предложенного соединения.
Техническое решение
[9] Для достижения поставленных задач авторами настоящего изобретения проведены исследования и приложены усилия, в результате чего было подтверждено, что пирролопиридиновое производное, представленное следующей формулой I, ингибирует пролиферацию ВИЧ, и было завершено настоящее изобретение.
[10] Пирролопиридиновое производное
[11] В настоящем изобретении предложено соединение, представленное следующей формулой I, его рацемат, его стереоизомер или его фармацевтически приемлемая соль:
[12] [Формула I]
[13] 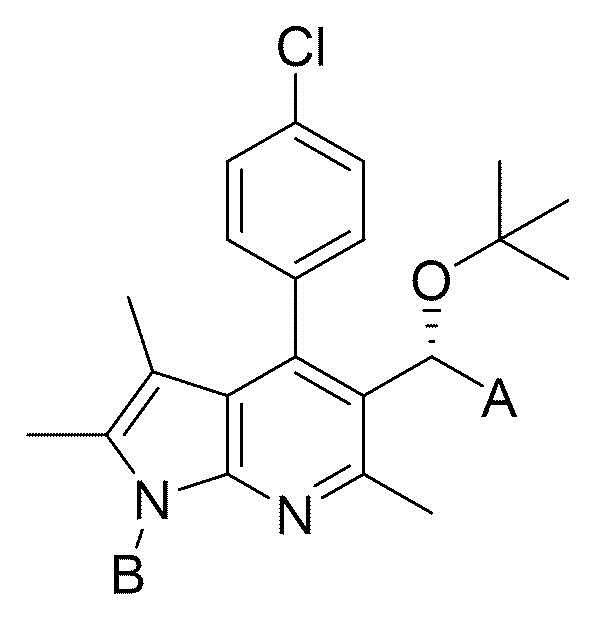
[14] на представленной выше формуле
[15] A представляет собой -гидрокси, -амино, -азидо, -циано, -трифторметил, -COR1, -C=NOHR2, -B(OH)2, -SO3H, -P=O(OH)2 или –гетероарил;
[16] R1 и R2, каждый независимо, представляют собой -NR3R4, -NR3OR4 или -OR5;
[17] R3 и R4, каждый независимо, представляют собой -водород, -C1-6 алкил или -гетероарил;
[18] R5 представляет собой -C5-20 алкил, -(CH2)n-O-(CH2)-O-CH3, -(CH2)n-OCOO-CH3, -(CH)CH3-OCOO-C3-6 циклоалкил или -(CH2)n-гетероарил;
[19] B представляет собой -(CH2)n-R6;
[20] R6 представляет собой -гидрокси, -амино, -азидо, -циано, -трифторметил, -C2-6 алкенил, -C2-6 алкинил, -C1-6 алкокси, -CONH(C1-3 алкил), -CON(C1-3 алкил)2, -COOH, -S-(C1-6 алкил), -SO2-(C1-6 алкил), -карбамоил, -C3-6 циклоалкил, 4-6-членный гетероциклоалкил, -арил или -гетероарил {где по меньшей мере один H в -C3-6 циклоалкиле, 4-6-членном гетероциклоалкиле, -ариле или -гетероариле может быть замещен -C1-6 алкилом, -C1-6 галогеналкилом, -C1-6 аминоалкилом, -C1-6 гидроксиалкилом, -C1-6 алкокси, -циано, -карбокси, -амино, -нитро, -азидо, -гидрокси, -карбамоилом, -тиолом или -галогеном}; и
[21] n равен 1, 2, 3 или 4.
[22] В соответствии с одним вариантом реализации настоящего изобретения, соединение, представленное формулой I, его рацемат, его стереоизомер или его фармацевтически приемлемая соль могут быть такими, как описано далее.
[23] A представляет собой -циано, -COR1, -C=NOHR2, -B(OH)2, -SO3H, -P=O(OH)2 или –гетероарил;
[24] R1 и R2, каждый независимо, представляют собой -NR3R4, -NR3OR4 или -OR5;
[25] R3 и R4, каждый независимо, представляют собой -водород, -C1-6 алкил или -гетероарил;
[26] R5 представляет собой -C5-20 алкил, -(CH2)n-O-(CH2)-O-CH3, -(CH2)n-OCOO-CH3, -(CH)CH3-OCOO-C3-6 циклоалкил или -(CH2)n-гетероарил;
[27] B представляет собой -(CH2)n-R6;
[28] R6 представляет собой -C1-6 алкокси, 4-6-членный гетероциклоалкил, -C3-6 циклоалкил, -арил или -гетероарил {где по меньшей мере один H в -C3-6 циклоалкиле, 4-6-членном гетероциклоалкиле, -ариле или -гетероариле может быть замещен -C1-6 алкилом, -C1-6 галогеналкилом, -C1-6 аминоалкилом, -C1-6 гидроксиалкилом, -C1-6 алкокси, -циано, -карбокси, -амино, -нитро, -азидо, -гидрокси, -карбамоилом, -тиолом или -галогеном}; и
[29] n равен 1, 2 или 3.
[30] Дополнительно, в соответствии с одним вариантом реализации настоящего изобретения, соединение, представленное формулой I, его рацемат, его стереоизомер или его фармацевтически приемлемая соль могут быть такими, как описано далее.
[31] A представляет собой -циано, -COR1, -C=NOHR2 или -гетероарил;
[32] R1 и R2, каждый независимо, представляют собой -NR3R4, -NR3OR4 или -OR5;
[33] R3 и R4, каждый независимо, представляют собой -водород, -C1-6 алкил или -гетероарил;
[34] R5 представляет собой -C5-20 алкил, -(CH2)n-O-(CH2)-O-CH3, -(CH2)n-OCOO-CH3, -(CH)CH3-OCOO-C3-6 циклоалкил или -(CH2)n-гетероарил;
[35] B представляет собой -(CH2)n-R6;
[36] R6 представляет собой -C1-6 алкокси, 4-6-членный гетероциклоалкил, -арил или -гетероарил {где по меньшей мере один H в 4-6-членном гетероциклоалкиле, -ариле или -гетероариле может быть замещен -C1-6 алкилом, -C1-6 галогеналкилом, -C1-6 аминоалкилом, -C1-6 гидроксиалкилом, -C1-6 алкокси, -циано, -карбокси, -амино, -нитро, -азидо, -гидрокси, -карбамоилом, -тиолом или -галогеном}; и
[37] n равен 1, 2 или 3.
[38] Дополнительно, в соответствии с одним вариантом реализации настоящего изобретения, соединение, представленное формулой I, его рацемат, его стереоизомер или его фармацевтически приемлемая соль могут быть такими, как описано далее.
[39] A представляет собой -циано, -COR1, -C=NOHR2 или -гетероарил;
[40] R1 представляет собой -NR3R4, -NR3OR4 или -OR5;
[41] R2 представляет собой -NR3R4;
[42] R3 и R4, каждый независимо, представляют собой -водород, -C1-6 алкил или -гетероарил;
[43] R5 представляет собой -C5-20 алкил, -(CH2)n-O-(CH2)-O-CH3, -(CH2)n-OCOO-CH3, -(CH)CH3-OCOO-C3-6 циклоалкил или -(CH2)n-гетероарил;
[44] B представляет собой -(CH2)n-R6;
[45] R6 представляет собой -C1-6 алкокси, 4-6-членный гетероциклоалкил, -арил или -гетероарил {где по меньшей мере один H в 4-6-членном гетероциклоалкиле, -ариле или -гетероариле может быть замещен -C1-6 алкилом или -галогеном}; и
[46] n равен 1 или 2.
[47] Дополнительно, соединение, представленное формулой I согласно настоящему изобретению, может быть выбрано из группы, состоящей из следующих соединений:
[48] 1) тридецил-(S)-2-(трет-бутокси)-2-(4-(4-хлорфенил)-2,3,6-триметил-1-((1-метил-1H-пиразол-4-ил)метил)-1H-пирроло[2,3-b]пиридин-5-ил)ацетат;
[49] 2) (5-метил-2-оксо-1,3-диоксол-4-ил)метил-(2S)-2-(трет-бутокси)-2-(4-(4-хлорфенил)-2,3,6-триметил-1-(оксетан-2-илметил)-1H-пирроло[2,3-b]пиридин-5-ил)ацетат;
[50] 3) (5-метил-2-оксо-1,3-диоксол-4-ил)метил-(S)-2-(трет-бутокси)-2-(4-(4-хлорфенил)-1-(2-метоксиэтил)-2,3,6-триметил-1H-пирроло[2,3-b]пиридин-5-ил)ацетат;
[51] 4) (5-метил-2-оксо-1,3-диоксол-4-ил)метил-(S)-2-(трет-бутокси)-2-(4-(4-хлорфенил)-2,3,6-триметил-1-((1-метил-1H-пиразол-4-ил)метил)-1H-пирроло[2,3-b]пиридин-5-ил)ацетат;
[52] 5) (S)-2-(трет-бутокси)-2-(4-(4-хлорфенил)-2,3,6-триметил-1-((1-метил-1H-пиразол-4-ил)метил)-1H-пирроло[2,3-b]пиридин-5-ил)ацетамид;
[53] 6) (S)-2-(трет-бутокси)-2-(4-(4-хлорфенил)-2,3,6-триметил-1-((1-метил-1H-пиразол-4-ил)метил)-1H-пирроло[2,3-b]пиридин-5-ил)ацетонитрил;
[54] 7) (S)-5-(трет-бутокси(1H-тетразол-5-ил)метил)-4-(4-хлорфенил)-2,3,6-триметил-1-((1-метил-1H-пиразол-4-ил)метил)-1H-пирроло[2,3-b]пиридин;
[55] 8) (S)-2-(трет-бутокси)-2-(4-(4-хлорфенил)-2,3,6-триметил-1-((1-метил-1H-пиразол-4-ил)метил)-1H-пирроло[2,3-b]пиридин-5-ил)-N-метилацетамид;
[56] 9) (S)-2-(трет-бутокси)-2-(4-(4-хлорфенил)-2,3,6-триметил-1-((1-метил-1H-пиразол-4-ил)метил)-1H-пирроло[2,3-b]пиридин-5-ил)-N-метоксиацетамид;
[57] 10) (S)-2-(трет-бутокси)-2-(4-(4-хлорфенил)-2,3,6-триметил-1-((1-метил-1H-пиразол-4-ил)метил)-1H-пирроло[2,3-b]пиридин-5-ил)-N-метокси-N-метилацетамид;
[58] 11) (S)-2-(трет-бутокси)-2-(4-(4-хлорфенил)-2,3,6-триметил-1-((1-метил-1H-пиразол-4-ил)метил)-1H-пирроло[2,3-b]пиридин-5-ил)-N-гидроксиацетамид;
[59] 12) (S,Z)-2-(трет-бутокси)-2-(4-(4-хлорфенил)-2,3,6-триметил-1-((1-метил-1H-пиразол-4-ил)метил)-1H-пирроло[2,3-b]пиридин-5-ил)-N'-гидроксиацетимидамид;
[62] 13) (S)-3-(трет-бутокси(4-(4-хлорфенил)-2,3,6-триметил-1-((1-метил-1H-пиразол-4-ил)метил)-1H-пирроло[2,3-b]пиридин-5-ил)метил)-5-метил-1,2,4-оксадиазол;
[61] 14) (S)-2-(трет-бутокси)-2-(4-(4-хлорфенил)-2,3,6-триметил-1-((1-метил-1H-пиразол-4-ил)метил)-1H-пирроло[2,3-b]пиридин-5-ил)-N-(2H-тетразол-5-ил)ацетамид;
[62] 15) ((метоксикарбонил)окси)метил-(S)-2-(трет-бутокси)-2-(4-(4-хлорфенил)-2,3,6-триметил-1-((1-метил-1H-пиразол-4-ил)метил)-1H-пирроло[2,3-b]пиридин-5-ил)ацетат;
[63] 16) 2-(2-метоксиэтокси)этил-(S)-2-(трет-бутокси)-2-(4-(4-хлорфенил)-2,3,6-триметил-1-((1-метил-1H-пиразол-4-ил)метил)-1H-пирроло[2,3-b]пиридин-5-ил)ацетат;
[64] 17) 1-(((циклогексилокси)карбонил)окси)этил-(2S)-2-(трет-бутокси)-2-(4-(4-хлорфенил)-2,3,6-триметил-1-((1-метил-1H-пиразол-4-ил)метил)-1H-пирроло[2,3-b]пиридин-5-ил)ацетат; и
[65] 18) (5-метил-2-оксо-1,3-диоксол-4-ил)метил-(S)-2-(трет-бутокси)-2-(4-(4-хлорфенил)-1-(3,4-дифторбензил)-2,3,6-триметил-1H-пирроло[2,3-b]пиридин-5-ил)ацетат.
[66] Соединения, представленные формулой I согласно настоящему изобретению, показанные выше, могут образовывать соль, в частности, фармацевтически приемлемую соль. Подходящие фармацевтически приемлемые соли представляют соли, обычно используемые в данной области техники, такие как соли присоединения кислот, и они не имеют специального ограничения.
[67] Примеры предпочтительных фармацевтически приемлемых солей присоединения кислот могут включать соли с неорганическими кислотами, такими как хлористоводородная кислота, бромистоводородная кислота, фосфорная кислота, ортофосфорная кислота или серная кислота; или соли с органическими кислотами, такими как метансульфоновая кислота, бензолсульфоновая кислота, толуолсульфоновая кислота, уксусная кислота, пропионовая кислота, молочная кислота, лимонная кислота, фумаровая кислота, яблочная кислота, янтарная кислота, салициловая кислота, малеиновая кислота, глицерофосфорная кислота или ацетилсалициловая кислота.
[68] Кроме того, обычным способом могут быть получены фармацевтически приемлемые соли металлов с использованием основания. Например, фармацевтически приемлемая соль металла может быть получена посредством растворения соединения, представленного формулой I, в растворе избытка гидроксида щелочного металла или гидроксида щелочноземельного металла, отфильтровывания нерастворенной соли соединения с последующим выпариванием и сушкой фильтрата. Фармацевтически неприемлемая соль или сольват соединения, представленного формулой I, может быть использован в качестве промежуточного соединения для получения соединения, представленного формулой I, или его фармацевтически приемлемой соли или сольвата.
[69] Соединение, представленной формулой I согласно настоящему изобретению, включает не только его фармацевтически приемлемую соль, но и все возможные сольваты и гидраты, которые могут быть получены из его фармацевтически приемлемой соли. Стереоизомеры соединения, представленного формулой I, и промежуточные соединения могут быть получены обычными способами.
[70] Кроме того, соединение, представленное формулой I согласно настоящему изобретению, может быть получено в кристаллической или аморфной форме, и если соединение, представленное формулой I, полученное в кристаллической форме, то указанное соединение может быть необязательно гидратированным или сольватированным.
[71] Применение пирролопиридинового производного
[72] В настоящем изобретении предложено медицинское применение соединения, представленного формулой I, его рацемата, его стереоизомера или его фармацевтически приемлемой соли.
[73] В соответствии с вариантами реализации настоящего изобретения, в настоящем изобретении предложена противовирусная фармацевтическая композиция, содержащая соединение, представленное формулой I, его рацемат, его стереоизомер или его фармацевтически приемлемую соль в качестве активного ингредиента. В частности, противовирусная композиция может представлять собой композицию против вируса иммунодефицита человека (ВИЧ).
[74] В экспериментальном примере настоящего изобретения соединение, представленное формулой I, обладает превосходным ингибирующим эффектом против ВИЧ с низкой цитотоксичностью и имеет различные преимущества при разработке лекарственного средства, такие как улучшение физико-химических свойств в форме биоизостера или пролекарства, улучшение абсорбции лекарственного средства и регулирование стабильности и токсичности, и т.п.
[75] Композиция согласно настоящему изобретению может быть составлена в пероральной или инъекционной лекарственной форме. Лекарственная форма для перорального введения может включать, например, таблетки и капсулы, и т.п., и такие лекарственные формы содержат, помимо активных ингредиентов, разбавители (например, лактозу, декстрозу, сахарозу, маннит, сорбит, целлюлозу и/или глицин) или смазывающие вещества (например, диоксид кремния, тальк, стеариновую кислоту и ее магниевые и кальциевые соли, или пропиленгликоль). Таблетка может также содержать связующие вещества, такие как алюмосиликат магния, крахмальный клейстер, желатин, трагакант, метилцеллюлоза, карбоксиметилцеллюлоза натрия или поливинилпирролидин, и необязательно может содержать разрыхлители, такие как крахмал, агар, альгиновая кислота или ее натриевая соль, или подобные смеси, и/или абсорбенты, окрашивающие вещества, ароматизаторы и подсластители. В качестве лекарственной формы для инъекций предпочтительным является изотонический водный раствор или суспензия.
[76] Композиция может быть стерильной и/или может содержать адъюванты, такие как консерванты, стабилизаторы, гидратирующие агенты или ускорители эмульгирования, соли и/или буферы для регулирования осмотического давления и другие терапевтически пригодные вещества.
[77] Лекарственная форма может быть получена обычными способами смешивания, гранулирования или нанесения покрытий и может содержать активный ингредиент в количестве от примерно 0,1 до 75% мас., предпочтительно от примерно 1 до 50% мас. Единичная лекарственная форма для млекопитающего массой примерно 50-70 кг содержит от примерно 10 до 200 мг активного ингредиента.
[78] Предпочтительная доза соединения согласно настоящему изобретению варьируется в зависимости от состояния и массы тела пациента, тяжести заболевания, типа лекарственного средства, способа и продолжительности введения, но может быть надлежащим образом выбрана специалистом в данной области техники. Соединение согласно настоящему изобретению может быть введено пероральным или парентеральным способом один раз в сутки или в дробных дозах.
[79] Композицию согласно настоящему изобретению можно вводить млекопитающим, включая крыс, мышей, домашних животных и людей, различными способами введения. Могут быть спрогнозированы все способы введения, например, композиция согласно настоящему изобретению может быть введена перорально, ректально или посредством внутримышечной, подкожной, внутриматочной, дуральной или интрацеребровентрикулярной инъекции.
[80] Кроме того, в соответствии с вариантами реализации настоящего изобретения, в настоящем изобретении предложен способ предотвращения или лечения вирусной инфекции, в частности, инфекции ВИЧ, включающий введение терапевтически эффективного количества соединения, представленного формулой I, описанной выше, его рацемата, его стереоизомера или его фармацевтически приемлемой соли.
[81] Кроме того, в соответствии с вариантами реализации настоящего изобретения, в настоящем изобретении предложено применение соединения, представленного формулой I, описанной выше, его рацемата, его стереоизомера или его фармацевтически приемлемой соли для производства лекарственного средства для лечения вирусной инфекции, в частности, инфекции ВИЧ.
[82] Сведения, описанные в применении, композиции и способе лечения согласно настоящему изобретению, применимы в равной степени, если они не противоречат друг другу.
Полезные эффекты
[83] Соединение согласно настоящему изобретению, его рацемат, его стереоизомер или его фармацевтически приемлемая соль может иметь высокую селективность и биоактивность против вирусов, в частности, вируса иммунодефицита человека (ВИЧ), и низкую токсичность, и, следовательно, является особенно подходящим для лечения инфекции, вызванной вирусом иммунодефицита человека (ВИЧ).
Наилучший способ реализации
[84] Далее настоящее изобретение будет описано более подробно с помощью следующих примеров и экспериментальных примеров. Однако следующие примеры и экспериментальные примеры предназначены лишь для иллюстрации настоящего изобретения, и объем настоящего изобретения не ограничен только приведенными примерами.
[85] Пример 1: Тридецил-(S)-2-(трет-бутокси)-2-(4-(4-хлорфенил)-2,3,6-триметил-1-((1-метил-1H-пиразол-4-ил)метил)-1H-пирроло[2,3-b]пиридин-5-ил)ацетат
[86] Карбонат цезия (112 мг, 0,81 ммоль), 1-бромтридекан (128 мг, 0,49 ммоль) и диметилацетамид (1,3 мл) добавляли к (S)-2-(трет-бутокси)-2-(4-(4-хлорфенил)-2,3,6-триметил-1-((1-метил-1H-пиразол-4-ил)метил)-1H-пирроло[2,3-b]пиридин-5-ил)уксусной кислоте (200 мг, 0,40 ммоль) и перемешивали при 55-60 °С в течение 12 часов. После завершения реакции разбавляли реакционный раствор этилацетатом и промывали очищенной водой. Сушили органический слой над безводным сульфатом натрия, концентрировали при пониженном давлении и очищали колоночной хроматографией с получением требуемого продукта (255 мг) в виде желтого маслянистого вещества.
[87] ЖХ-МС (ИЭР, m/z) = 677,2 (M+H+).
[88] Пример 2: (5-Метил-2-оксо-1,3-диоксол-4-ил)метил-(2S)-2-(трет-бутокси)-2-(4-(4-хлорфенил)-2,3,6-триметил-1-(оксетан-2-илметил)-1H-пирроло[2,3-b]пиридин-5-ил)ацетат
[89] (2S)-2-(Трет-бутокси)-2-(4-(4-хлорфенил)-2,3,6-триметил-1-(оксетан-2-илметил)-1H-пирроло[2,3-b]пиридин-5-ил)уксусную кислоту (47 мг, 0,10 ммоль) и 4-(хлорметил)-5-метил-1,3-диоксол-2-он (22 мг, 0,15 ммоль) приводили во взаимодействие таким же образом, как в примере 1, с получением требуемого продукта (20 мг) в виде почти белого твердого вещества.
[90] ЖХ-МС (ИЭР, m/z) = 583,2 (M+H+).
[91] Пример 3: (5-Метил-2-оксо-1,3-диоксол-4-ил)метил-(S)-2-(трет-бутокси)-2-(4-(4-хлорфенил)-1-(2-метоксиэтил)-2,3,6-триметил-1H-пирроло[2,3-b]пиридин-5-ил)ацетат
[92] (S)-2-(Трет-бутокси)-2-(4-(4-хлорфенил)-1-(2-метоксиэтил)-2,3,6-триметил-1H-пирроло[2,3-b]пиридин-5-ил)уксусную кислоту (342 мг, 0,75 ммоль) и 4-(хлорметил)-5-метил-1,3-диоксол-2-он (184 мг, 1,12 ммоль) приводили во взаимодействие таким же образом, как в примере 1, с получением требуемого продукта (272 мг) в виде почти белого твердого вещества.
[93] ЖХ-МС (ИЭР, m/z) = 571,1 (M+H+).
[94] Пример 4: (5-Метил-2-оксо-1,3-диоксол-4-ил)метил-(S)-2-(трет-бутокси)-2-(4-(4-хлорфенил)-2,3,6-триметил-1-((1-метил-1H-пиразол-4-ил)метил)-1H-пирроло[2,3-b]пиридин-5-ил)ацетат
[95] (S)-2-(Трет-бутокси)-2-(4-(4-хлорфенил)-2,3,6-триметил-1-((1-метил-1H-пиразол-4-ил)метил)-1H-пирроло[2,3-b]пиридин-5-ил)уксусную кислоту (70 мг, 0,14 ммоль) и 4-(хлорметил)-5-метил-1,3-диоксол-2-он (34 мг, 0,21 ммоль) приводили во взаимодействие таким же образом, как в примере 1, с получением требуемого продукта (55 мг) в виде почти белого твердого вещества.
[96] ЖХ-МС (ИЭР, m/z) = 607,2 (M+H+).
[97] Пример 5: (S)-2-(трет-бутокси)-2-(4-(4-хлорфенил)-2,3,6-триметил-1-((1-метил-1H-пиразол-4-ил)метил)-1H-пирроло[2,3-b]пиридин-5-ил)ацетамид
[98] Хлорид аммония (32 мг, 0,61 ммоль), диизопропилэтиламин (157 мг, 1,21 ммоль), PyBOP (315 мг, 0,61 ммоль) и диметилформамид (1,3 мл) добавляли к (S)-2-(трет-бутокси)-2-(4-(4-хлорфенил)-2,3,6-триметил-1-((1-метил-1H-пиразол-4-ил)метил)-1H-пирроло[2,3-b]пиридин-5-ил)уксусной кислоте (200 мг, 0,40 ммоль) и перемешивали при комнатной температуре в течение 16 часов. После завершения реакции разбавляли реакционный раствор этилацетатом и промывали очищенной водой. Сушили органический слой над безводным сульфатом натрия, концентрировали при пониженном давлении и очищали колоночной хроматографией с получением требуемого продукта (100 мг) в виде почти белого вещества.
[99] ЖХ-МС (ИЭР, m/z) = 494,2 (M+H+).
[100] Пример 6: (S)-2-(трет-бутокси)-2-(4-(4-хлорфенил)-2,3,6-триметил-1-((1-метил-1H-пиразол-4-ил)метил)-1H-пирроло[2,3-b]пиридин-5-ил)ацетонитрил
[101] Соединение, полученное в примере 5 (100 мг, 0,20 ммоль), растворяли в ДХМ (0,7 мл), охлаждали до 0-5 °С и добавляли триэтиламин (31 мкл, 0,61 ммоль) и ангидрид ТФК (31 мкл, 0,22 ммоль), затем перемешивали при 0-5 °С в течение 2 часов. После завершения реакции разбавляли реакционный раствор этилацетатом и водным раствором бикарбоната натрия, и экстрагировали органический слой, и промывали очищенной водой. Сушили органический слой над безводным сульфатом натрия, концентрировали при пониженном давлении и очищали колоночной хроматографией с получением требуемого продукта (53 мг) в виде почти белого вещества.
[102] ЖХ-МС (ИЭР, m/z) = 476,2 (M+H+).
[103] Пример 7: (S)-5-(трет-бутокси(1H-тетразол-5-ил)метил)-4-(4-хлорфенил)-2,3,6-триметил-1-((1-метил-1H-пиразол-4-ил)метил)-1H-пирроло[2,3-b]пиридин
[104] Азид натрия (10 мг, 0,16 ммоль), гидрохлорид аммония (8 мг, 0,16 ммоль) и диметилформамид (0,4 мл) добавляли к соединению, полученному в примере 6 (50 мг, 0,11 ммоль), и перемешивали при 95-100 °С в течение 20 часов. После завершения реакции разбавляли реакционный раствор этилацетатом и промывали очищенной водой. Сушили органический слой над безводным сульфатом натрия, концентрировали при пониженном давлении и очищали колоночной хроматографией с получением требуемого продукта (21 мг) в виде почти белого вещества.
[105] ЖХ-МС (ИЭР, m/z) = 519,2 (M+H+).
[106] Пример 8: (S)-2-(трет-бутокси)-2-(4-(4-хлорфенил)-2,3,6-триметил-1-((1-метил-1H-пиразол-4-ил)метил)-1H-пирроло[2,3-b]пиридин-5-ил)-N-метилацетамид
[107] (S)-2-(Трет-бутокси)-2-(4-(4-хлорфенил)-2,3,6-триметил-1-((1-метил-1H-пиразол-4-ил)метил)-1H-пирроло[2,3-b]пиридин-5-ил)уксусную кислоту (200 мг, 0,404 ммоль) и гидрохлорид метиламина (40,9 мг, 0,606 ммоль) приводили во взаимодействие таким же образом, как в примере 5, с получением требуемого продукта (158 мг) в виде почти белого твердого вещества.
[108] ЖХ-МС (ИЭР, m/z) = 508,1 (M+H+).
[109] Пример 9: (S)-2-(трет-бутокси)-2-(4-(4-хлорфенил)-2,3,6-триметил-1-((1-метил-1H-пиразол-4-ил)метил)-1H-пирроло[2,3-b]пиридин-5-ил)-N-метоксиацетамид
[110] (S)-2-(Трет-бутокси)-2-(4-(4-хлорфенил)-2,3,6-триметил-1-((1-метил-1H-пиразол-4-ил)метил)-1H-пирроло[2,3-b]пиридин-5-ил)уксусную кислоту (200 мг, 0,404 ммоль) и гидрохлорид O-метилгидроксиамина (50,6 мг, 0,606 ммоль) приводили во взаимодействие таким же образом, как в примере 5, с получением требуемого продукта (141,6 мг) в виде почти белого твердого вещества.
[111] ЖХ-МС (ИЭР, m/z) = 524,2 (M+H+).
[112] Пример 10: (S)-2-(трет-бутокси)-2-(4-(4-хлорфенил)-2,3,6-триметил-1-((1-метил-1H-пиразол-4-ил)метил)-1H-пирроло[2,3-b]пиридин-5-ил)-N-метокси-N-метилацетамид
[113] (S)-2-(Трет-бутокси)-2-(4-(4-хлорфенил)-2,3,6-триметил-1-((1-метил-1H-пиразол-4-ил)метил)-1H-пирроло[2,3-b]пиридин-5-ил)уксусную кислоту (200 мг, 0,404 ммоль) и гидрохлорид N,O-диметилгидроксиамина (59,1 мг, 0,606 ммоль) приводили во взаимодействие таким же образом, как в примере 5, с получением требуемого продукта (71,2 мг) в виде почти белого твердого вещества.
[114] ЖХ-МС (ИЭР, m/z) = 538,2 (M+H+).
[115] Пример 11: (S)-2-(трет-бутокси)-2-(4-(4-хлорфенил)-2,3,6-триметил-1-((1-метил-1H-пиразол-4-ил)метил)-1H-пирроло[2,3-b]пиридин-5-ил)-N-гидроксиацетамид
[116] (S)-2-(Трет-бутокси)-2-(4-(4-хлорфенил)-2,3,6-триметил-1-((1-метил-1H-пиразол-4-ил)метил)-1H-пирроло[2,3-b]пиридин-5-ил)уксусную кислоту (300 мг, 0,606 ммоль) и гидрохлорид гидроксиамина (473 мг, 0,909 ммоль) приводили во взаимодействие таким же образом, как в примере 5, с получением требуемого продукта (100 мг) в виде почти белого твердого вещества.
[117] ЖХ-МС (ИЭР, m/z) = 510,1 (M+H+).
[118] Пример 12: (S,Z)-2-(трет-бутокси)-2-(4-(4-хлорфенил)-2,3,6-триметил-1-((1-метил-1H-пиразол-4-ил)метил)-1H-пирроло[2,3-b]пиридин-5-ил)-N'-гидроксиацетимидамид
[119] К соединению, полученному в примере 6 (413 мг, 0,87 ммоль), добавляли гидрохлорид гидроксиламина (121 мг, 1,74 ммоль), гидрокарбонат натрия (146 мг, 1,74 ммоль) и этанол (4,3 мл) и перемешивали в течение 4 часов при 80 °С. После завершения реакции разбавляли реакционный раствор этилацетатом и промывали очищенной водой. Сушили органический слой над безводным сульфатом натрия, концентрировали при пониженном давлении и очищали колоночной хроматографией с получением требуемого продукта (390 мг) в виде почти белого вещества.
[120] ЖХ-МС (ИЭР, m/z) = 509,3 (M+H+).
[121] Пример 13: (S)-3-(трет-бутокси(4-(4-хлорфенил)-2,3,6-триметил-1-((1-метил-1H-пиразол-4-ил)метил)-1H-пирроло[2,3-b]пиридин-5-ил)метил)-5-метил-1,2,4-оксадиазол
[122] К соединению, полученному в примере 12 (325 мг, 0,64 ммоль), добавляли гидрат п-толуолсульфоновой кислоты (36 мг, 0,19 ммоль), хлорид цинка (26 мг, 0,19 ммоль) и ацетонитрил (2,1 мл) и перемешивали в течение 3 часов при 80 °С. После завершения реакции разбавляли реакционный раствор этилацетатом и промывали очищенной водой. Сушили органический слой над безводным сульфатом натрия, концентрировали при пониженном давлении и очищали колоночной хроматографией с получением требуемого продукта (9 мг) в виде почти белого вещества.
[123] ЖХ-МС (ИЭР, m/z) = 533,3 (M+H+).
[124] Пример 14: (S)-2-(трет-бутокси)-2-(4-(4-хлорфенил)-2,3,6-триметил-1-((1-метил-1H-пиразол-4-ил)метил)-1H-пирроло[2,3-b]пиридин-5-ил)-N-(2H-тетразол-5-ил)ацетамид
[125] (S)-2-(Трет-бутокси)-2-(4-(4-хлорфенил)-2,3,6-триметил-1-((1-метил-1H-пиразол-4-ил)метил)-1H-пирроло[2,3-b]пиридин-5-ил)уксусную кислоту (200 мг, 0,404 ммоль) и 5-амино-1H-тетразол (51,6 мг, 0,606 ммоль) приводили во взаимодействие таким же образом, как в примере 5, с получением требуемого продукта (83,5 мг) в виде почти белого твердого вещества.
[126] ЖХ-МС (ИЭР, m/z) = 562,1 (M+H+).
[127] Пример 15: ((Метоксикарбонил)окси)метил-(S)-2-(трет-бутокси)-2-(4-(4-хлорфенил)-2,3,6-триметил-1-((1-метил-1H-пиразол-4-ил)метил)-1H-пирроло[2,3-b]пиридин-5-ил)ацетат
[128] (S)-2-(Трет-бутокси)-2-(4-(4-хлорфенил)-2,3,6-триметил-1-((1-метил-1H-пиразол-4-ил)метил)-1H-пирроло[2,3-b]пиридин-5-ил)уксусную кислоту (300 мг, 0,606 ммоль) разбавляли в ДМФА (1,21 мл), затем добавляли хлорметилметилкарбонат (113 мг, 0,909 ммоль) и карбонат цезия (592 мг, 1,818 ммоль) и перемешивали смесь при комнатной температуре в течение 22 часов. После завершения реакции разбавляли реакционный раствор этилацетатом и промывали очищенной водой. Сушили органический слой над безводным сульфатом натрия, концентрировали при пониженном давлении и очищали колоночной хроматографией с получением требуемого продукта (316 мг) в виде почти белого вещества.
[129] ЖХ-МС (ИЭР, m/z) = 583,1 (M+H+).
[130] Пример 16: 2-(2-Метоксиэтокси)этил-(S)-2-(трет-бутокси)-2-(4-(4-хлорфенил)-2,3,6-триметил-1-((1-метил-1H-пиразол-4-ил)метил)-1H-пирроло[2,3-b]пиридин-5-ил)ацетат
[131] (S)-2-(Трет-бутокси)-2-(4-(4-хлорфенил)-2,3,6-триметил-1-((1-метил-1H-пиразол-4-ил)метил)-1H-пирроло[2,3-b]пиридин-5-ил)уксусную кислоту (200 мг, 0,404 ммоль) и 1-бром-2-(2-метоксиэтокси)этан (123 мг, 0,606 ммоль) приводили во взаимодействие таким же образом, как в примере 15, с получением требуемого продукта (118,6 мг) в виде почти белого твердого вещества.
[132] ЖХ-МС (ИЭР, m/z) = 597,2 (M+H+).
[133] Пример 17: 1-(((Циклогексилокси)карбонил)окси)этил-(2S)-2-(трет-бутокси)-2-(4-(4-хлорфенил)-2,3,6-триметил-1-((1-метил-1H-пиразол-4-ил)метил)-1H-пирроло[2,3-b]пиридин-5-ил)ацетат
[134] (S)-2-(Трет-бутокси)-2-(4-(4-хлорфенил)-2,3,6-триметил-1-((1-метил-1H-пиразол-4-ил)метил)-1H-пирроло[2,3-b]пиридин-5-ил)уксусную кислоту (700 мг, 2,121 ммоль) и 1-хлорэтилциклогексилкарбонат (438 мг, 2,121 ммоль) приводили во взаимодействие таким же образом, как в примере 15, с получением требуемого продукта (912 мг) в виде бледно-желтого твердого вещества.
[135] ЖХ-МС (ИЭР, m/z) = 665,2 (M+H+).
[136] Пример 18: (5-Метил-2-оксо-1,3-диоксол-4-ил)метил-(S)-2-(трет-бутокси)-2-(4-(4-хлорфенил)-1-(3,4-дифторбензил)-2,3,6-триметил-1H-пирроло[2,3-b]пиридин-5-ил)ацетат
[137] [Стадия 1]. Получение метил-(S)-2-(трет-бутокси)-2-(4-(4-хлорфенил)-1-(3,4-дифторбензил)-2,3,6-триметил-1H-пирроло[2,3-b]пиридин-5-ил)ацетата
[138] Метил-(S)-2-(трет-бутокси)-2-(4-(4-хлорфенил)-2,3,6-триметил-1H-пирроло[2,3-b]пиридин-5-ил)ацетат (150 мг, 0,362 ммоль), 4-(бромметил)-1,2-дифторбензол (374 мг, 1,808 ммоль), гидроксид калия (50,7 мг, 0,904 ммоль) и TBAB (11,65 мг, 0,036 ммоль) разбавляли в ДХМ (3,23 мл) и перемешивали в течение 5 часов при комнатной температуре. После завершения реакции разбавляли реакционный раствор этилацетатом и промывали очищенной водой. Сушили органический слой над безводным сульфатом натрия, концентрировали при пониженном давлении и очищали колоночной хроматографией с получением требуемого продукта (122 мг) в виде бледно-желтого твердого вещества.
[139] ЖХ-МС (ИЭР, m/z) = 541,1 (M+H+).
[140] [Стадия 2]. Получение (S)-2-(трет-бутокси)-2-(4-(4-хлорфенил)-1-(3,4-дифторбензил)-2,3,6-триметил-1H-пирроло[2,3-b]пиридин-5-ил)уксусной кислоты
[141] Соединение, полученное на стадии 1 (122 мг, 0,225 ммоль), растворяли в смеси ТГФ:MeOH (1:1), затем добавляли NaOH (27,1 мг, 0,676 моль) и перемешивали смесь при 40 °С в течение 13 часов. После завершения реакции разбавляли реакционный раствор этилацетатом и промывали очищенной водой. Сушили органический слой над безводным сульфатом натрия, концентрировали при пониженном давлении и очищали колоночной хроматографией с получением требуемого продукта (89,5 мг) в виде почти белого вещества.
[142] ЖХ-МС (ИЭР, m/z) = 527,2 (M+H+).
[143] [Стадия 3]. Получение (5-метил-2-оксо-1,3-диоксол-4-ил)метил-(S)-2-(трет-бутокси)-2-(4-(4-хлорфенил)-1-(3,4-дифторбензил)-2,3,6-триметил-1H-пирроло[2,3-b]пиридин-5-ил)ацетата
[144] Соединение, полученное на стадии 2 (20 мг, 0,038 ммоль), и 4-(хлорметил)-5-метил-1,3-диоксол-2-он (9 мг, 0,057 ммоль) приводили во взаимодействие таким же образом, как в примере 15, с получением требуемого продукта (3,1 мг) в виде бледно-желтого твердого вещества.
[145] ЖХ-МС (ИЭР, m/z) = 639,1 (M+H+).
[146] Экспериментальный пример 1: Исследование ингибирующего эффекта против ВИЧ-1 (дикого типа) и испытание цитотоксичности соединений согласно настоящему изобретению
[147] Для определения ингибирующего эффекта соединений согласно настоящему изобретению против ВИЧ-1 (дикого типа) проводили следующее испытание. Клетки-хозяева представляли собой клетки MT-4, а штамм вируса представлял собой штамм NL4-3 ВИЧ-1. Вирус и клетки смешивали в присутствии соединений согласно настоящему изобретению с последующей инкубацией в течение 6 дней. Противовирусный эффект измеряли как процентное уменьшение цитопатического действия вируса (CPE), а цитотоксичность соединений оценивали с помощью анализа восстановления красителя MTS (реагент CellTiter® 96, Promega, Мэдисон, штат Висконсин). Результаты исследований представлены в таблице 1.
[148]
[149] Подробно описаны конкретные части настоящего изобретения. Специалистам в данной области техники понятно, что изложенные конкретные описания представляют собой лишь предпочтительные варианты реализации, и объем настоящего изобретения не ограничен ими. Таким образом, существенный объем настоящего изобретения следует определять прилагаемой формулой изобретения и ее эквивалентами.
| название | год | авторы | номер документа |
|---|---|---|---|
| НОВОЕ ПИРРОЛОПИРИДИНОВОЕ СОЕДИНЕНИЕ, СПОСОБ ЕГО ПОЛУЧЕНИЯ И ЕГО ПРИМЕНЕНИЕ | 2017 |
|
RU2733723C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПИРРОЛОПИРИДИНОВОГО ПРОИЗВОДНОГО | 2021 |
|
RU2830589C1 |
| ГЕТЕРОЦИКЛИЧЕСКИЕ ПРОИЗВОДНЫЕ И ИХ ПРИМЕНЕНИЕ | 2015 |
|
RU2734390C2 |
| БЕНЗАМИДНЫЕ СОЕДИНЕНИЯ | 2019 |
|
RU2801647C2 |
| АЗАИНДОЛИЛПИРИДОНЫ И ДИАЗАИНДОЛИЛПИРИДОНЫ | 2018 |
|
RU2788659C2 |
| БИЦИКЛИЧЕСКИЕ ЛАКТАМЫ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2016 |
|
RU2716136C2 |
| БИЦИКЛИЧЕСКИЕ ЛАКТАМЫ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2016 |
|
RU2827714C1 |
| СОЕДИНЕНИЯ, ГЕТЕРОБИЦИКЛО-ЗАМЕЩЕННЫЕ-[1,2,4]ТРИАЗОЛО[1,5c]ХИНАЗОЛИН-5-АМИНА, ОБЛАДАЮЩИЕ СВОЙСТВАМИ А2А АНТАГОНИСТОВ | 2013 |
|
RU2671628C2 |
| ИНГИБИТОРЫ HPK1 И ИХ ПРИМЕНЕНИЕ | 2020 |
|
RU2839132C2 |
| КЛАСС БИФУНКЦИОНАЛЬНЫХ ХИМЕРНЫХ ГЕТЕРОЦИКЛИЧЕСКИХ СОЕДИНЕНИЙ ДЛЯ НАПРАВЛЕННОГО РАЗРУШЕНИЯ АНДРОГЕННЫХ РЕЦЕПТОРОВ И ИХ ПРИМЕНЕНИЕ | 2020 |
|
RU2825000C2 |
Изобретение относится к пирролопиридиновому производному формулы I или его фармацевтически приемлемой соли, содержащей его фармацевтической композиции и его применению. Соединение согласно настоящему изобретению имеет высокую селективность и биоактивность против вируса иммунодефицита человека (ВИЧ), а также низкую токсичность и, следовательно, применимо в качестве терапевтического агента против вирусной инфекции, вызванной вирусом иммунодефицита человека (ВИЧ). 3 н. и 1 з.п. ф-лы, 1 табл., 18 пр.
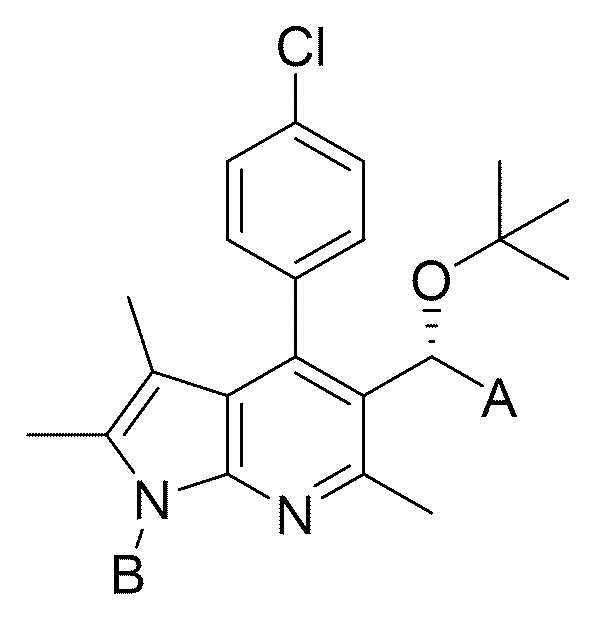 формула I
формула I
1. Соединение, представленное следующей формулой I, или его фармацевтически приемлемая соль:
[Формула I]
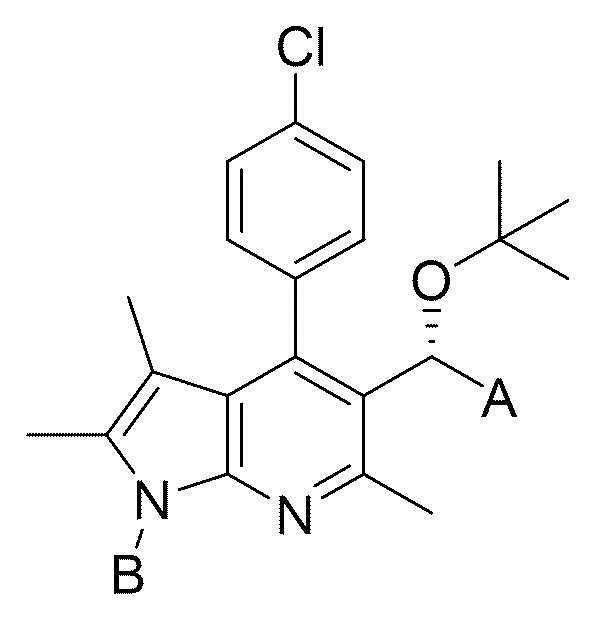
на представленной выше формуле
A представляет собой -циано, -COR1, -C=NOHR2, 5-метил-1,2,4-оксадиазолил или -тетразолил;
R1 представляет собой -NR3OR4 или -OR5;
R2 представляет собой -NR3R4;
R3 и R4, каждый независимо, представляют собой -водород, -C1-6 алкил или -тетразолил;
R5 представляет собой -C10-20 алкил, -(CH2)n-O-(CH2)-O-CH3, -(CH2)n-OCOO-CH3,-(CH)CH3-OCOO-C3-6циклоалкил или 5-метил-2-оксо-1,3-диоксол-4-ил-CH2;
B представляет собой -(CH2)n-R6;
R6 представляет собой -C1-6 алкокси, -оксетанил, -фенил или -пиразолил, где по меньшей мере один H в -оксетаниле, -фениле или –пиразолиле может быть замещен -C1-6 алкилом или -галогеном; и
n равен 1 или 2.
2. Соединение, представленное формулой I, или его фармацевтически приемлемая соль по п. 1, где указанное соединение выбрано из группы, состоящей из следующих формул:
1) тридецил-(S)-2-(трет-бутокси)-2-(4-(4-хлорфенил)-2,3,6-триметил-1-((1-метил-1H-пиразол-4-ил)метил)-1H-пирроло[2,3-b]пиридин-5-ил)ацетат;
2) (5-метил-2-оксо-1,3-диоксол-4-ил)метил-(2S)-2-(трет-бутокси)-2-(4-(4-хлорфенил)-2,3,6-триметил-1-(оксетан-2-илметил)-1H-пирроло[2,3-b]пиридин-5-ил)ацетат;
3) (5-метил-2-оксо-1,3-диоксол-4-ил)метил-(S)-2-(трет-бутокси)-2-(4-(4-хлорфенил)-1-(2-метоксиэтил)-2,3,6-триметил-1H-пирроло[2,3-b]пиридин-5-ил)ацетат;
4) (5-метил-2-оксо-1,3-диоксол-4-ил)метил-(S)-2-(трет-бутокси)-2-(4-(4-хлорфенил)-2,3,6-триметил-1-((1-метил-1H-пиразол-4-ил)метил)-1H-пирроло[2,3-b]пиридин-5-ил)ацетат;
5) (S)-2-(трет-бутокси)-2-(4-(4-хлорфенил)-2,3,6-триметил-1-((1-метил-1H-пиразол-4-ил)метил)-1H-пирроло[2,3-b]пиридин-5-ил)ацетонитрил;
6) (S)-5-(трет-бутокси(1H-тетразол-5-ил)метил)-4-(4-хлорфенил)-2,3,6-триметил-1-((1-метил-1H-пиразол-4-ил)метил)-1H-пирроло[2,3-b]пиридин;
7) (S)-2-(трет-бутокси)-2-(4-(4-хлорфенил)-2,3,6-триметил-1-((1-метил-1H-пиразол-4-ил)метил)-1H-пирроло[2,3-b]пиридин-5-ил)-N-метоксиацетамид;
8) (S)-2-(трет-бутокси)-2-(4-(4-хлорфенил)-2,3,6-триметил-1-((1-метил-1H-пиразол-4-ил)метил)-1H-пирроло[2,3-b]пиридин-5-ил)-N-метокси-N-метилацетамид;
9) (S)-2-(трет-бутокси)-2-(4-(4-хлорфенил)-2,3,6-триметил-1-((1-метил-1H-пиразол-4-ил)метил)-1H-пирроло[2,3-b]пиридин-5-ил)-N-гидроксиацетамид;
10) (S,Z)-2-(трет-бутокси)-2-(4-(4-хлорфенил)-2,3,6-триметил-1-((1-метил-1H-пиразол-4-ил)метил)-1H-пирроло[2,3-b]пиридин-5-ил)-N'-гидроксиацетимидамид;
11) (S)-3-(трет-бутокси(4-(4-хлорфенил)-2,3,6-триметил-1-((1-метил-1H-пиразол-4-ил)метил)-1H-пирроло[2,3-b]пиридин-5-ил)метил)-5-метил-1,2,4-оксадиазол;
12) (S)-2-(трет-бутокси)-2-(4-(4-хлорфенил)-2,3,6-триметил-1-((1-метил-1H-пиразол-4-ил)метил)-1H-пирроло[2,3-b]пиридин-5-ил)-N-(2H-тетразол-5-ил)ацетамид;
13) ((метоксикарбонил)окси)метил-(S)-2-(трет-бутокси)-2-(4-(4-хлорфенил)-2,3,6-триметил-1-((1-метил-1H-пиразол-4-ил)метил)-1H-пирроло[2,3-b]пиридин-5-ил)ацетат;
14) 2-(2-метоксиэтокси)этил-(S)-2-(трет-бутокси)-2-(4-(4-хлорфенил)-2,3,6-триметил-1-((1-метил-1H-пиразол-4-ил)метил)-1H-пирроло[2,3-b]пиридин-5-ил)ацетат;
15) 1-(((циклогексилокси)карбонил)окси)этил-(2S)-2-(трет-бутокси)-2-(4-(4-хлорфенил)-2,3,6-триметил-1-((1-метил-1H-пиразол-4-ил)метил)-1H-пирроло[2,3-b]пиридин-5-ил)ацетат; и
16) (5-метил-2-оксо-1,3-диоксол-4-ил)метил-(S)-2-(трет-бутокси)-2-(4-(4-хлорфенил)-1-(3,4-дифторбензил)-2,3,6-триметил-1H-пирроло[2,3-b]пиридин-5-ил)ацетат.
3. Фармацевтическая композиция против ВИЧ (вируса иммунодефицита человека), содержащая соединение, представленное формулой I по п. 1 или 2, или его фармацевтически приемлемую соль в качестве активного ингредиента.
4. Применение соединения, представленного формулой I по п. 1 или 2, или его фармацевтически приемлемой соли для получения лекарственного средства для лечения инфекции ВИЧ (вируса иммунодефицита человека).
| WO 2013012649 A1, 24.01.2013 | |||
| Пневматическая радиальная легковая шина | 2022 |
|
RU2781519C1 |
| WO 2018174320 A1, 27.09.2018 | |||
| KR 1020150141275 A, 18.12.2015 | |||
| WO 2005103003 A2, 03.11.2005 | |||
| US 2010179139 A1, 15.07.2010. | |||
Авторы
Даты
2024-03-19—Публикация
2021-08-20—Подача