Изобретение относится к области медицины, в частности к пористым биомедицинским материалам на основе никелида титана, которые могут быть использованы для изготовления костных имплантатов или инкубаторов клеточных культур.
Биосовместимость - характеристика медицинских материалов инвазивного применения, определяемая отсутствием воспалительной реакции, токсического и аллергического действия, провоцирования развития инфекции, при сохранении функциональных свойств в течение предусмотренного периода эксплуатации.
К указанному классу материалов относятся керамика, полимеры, металлы и их сплавы, химически стойкие в агрессивных средах организма. Выбор подходящего материала при разработке новых технических средств, кроме биосовместимости, определен другими требованиями, определяемыми функцией последнего.
Среди известных современных материалов наиболее полно медико-техническому комплексу требований отвечают пористые и монолитные сплавы никелида титана в различных вариациях легирующих и основных компонентов [Медицинские материалы и имплантаты с памятью формы: В 14 томах / Под ред. В.Э. Гюнтера. Медицинские материалы с памятью формы. Т. 1 // В.Э. Гюнтер, В.Н. Ходоренко, Т.Л. Чекалкин, и др. - Томск: Изд-во МИЦ, 2011. 534 с.].
Прецизионным подбором состава и содержания легирующих примесей можно широко варьировать такие свойства как сверхэластичность, эффект памяти формы, циклостойкость, прочность, пластичность и др.
Сплавы на основе никелида титана широко применяются в медицине и постоянно совершенствуются.
В медицине существует проблема инфицирования ран при операциях. Это обстоятельство сильно мешает, а порой сводит на нет интеграцию искусственного чужеродного имплантата в живой организм. Особенно это актуально в случае применения пористых имплантатов со сквозной пористостью, когда бактерии способны размножаться и проникать вглубь имплантата, лечение воспалительных процессов антибиотиками малоэффективно либо, при таких осложнениях, существенно увеличиваются сроки приживаемости имплантата.
Для борьбы с инфицированием широкое распространение получило использование препаратов с серебром. Антибактериальные свойства серебра известны давно. Ионы серебра сильно ингибируют рост бактерий и других микроорганизмов. Ионы серебра разрушают важные компоненты клеток микроорганизмов, угнетая их жизненные функции. Серебро проявляет антибактериальную активность широкого спектра и эффективно даже против штаммов, резистентных к антибиотикам. Кроме того, серебро воздействует на многочисленные области внутри бактериальных клеток, уменьшая вероятность проявления бактериями резистентности любого рода.
В связи с повышением резистентности наиболее патогенных микроорганизмов против обычно используемых антибиотиков в последние годы серебро открыли заново, как активное антибактериальное вещество.
Обоснованность этого подхода подтверждена многочисленными исследованиями, например, [Zheng Y.F., Zhang В.В., Wang B.L., Wang Y.B., Li L., Yang Q.B., Cui L.S. // Introduction of antibacterial function into biomedical TiNi shape memory alloy by the addition of element Ag / Acta Biomater. 2011, 7, 2758].
Известен ряд способов реализации антибактериальной функции серебра путем нанесения покрытий на готовые изделия.
Известен, например, способ остеосинтеза с наносеребром [патент РФ №2557938], который характеризуется тем, что на поверхность медицинского изделия наносят антибактериальное покрытие, содержащее наночастицы серебра. Указанное покрытие получают химическим превращением поверхности имплантата посредством плазменного электролитического оксидирования. Основным недостатком данного способа является невозможность оксидирования внутренних поверхностей пористых медицинских материалов и низкая адгезионная прочность покрытия.
Известен способ формирования серебросодержащего биосовместимого покрытия титанового имплантата [патент РФ №2669402], при котором покрытие получают путем последовательной обработки монолитной основы сначала пучком ионов гелия с формированием пористой структуры, а затем пучком ионов серебра в присутствии вакуумной среды СО2 с образованием углеродной серебросодержащей алмазоподобной беспористой пленки с антимикробными свойствами. Такой способ подтверждает способность ионов серебра, покрывающих шероховатую пористую поверхность, осуществлять антибактериальную защиту.
Недостатком данного способа является то, что получаемое покрытие можно нанести только на внешнюю поверхность медицинского имплантата, что снижает сам антибактериальный эффект и является недостаточным в случае применения проницаемого жидкостями организма пористого имплантата на основе никелида титана. Проницаемость является обязательным условием для полной интеграции имплантата в костную структуру, обеспечивающей ее прочность.
Сложность получения покрытий на внутренних поверхностях пористого имплантата приводит к идее введения антисептика в состав самого материала имплантата в процессе его получения. Так, биосовместимый материал на основе монолитного сплава никелида титана по патенту [РФ №2668128 от 26.09.2018 г.], отличается тем, что в состав сплава введено дополнительно серебро в количестве 0,1-0,2 ат. %. В результате отмечается повышение жизнеспособности клеток костного мозга более чем на 30%. Материал получают методом индукционной плавки. Достоинством этого материала является распределение серебра по всему объему, благодаря чему исключается истощение поверхностного слоя.
Следует отметить, что придание сплаву бактерицидных свойств в определенной степени противоречит требованию биосовместимости, что указывает на необходимость определения предельно допустимых концентраций серебра с тем, чтобы не препятствовать функционированию клеточных тканей реципиента. В цитированном выше исследовании [Zheng Y.F. et al.] предполагается, что серебро нарушает процессы в бактериальных клетках, связанные с их автономным существованием (дыхание, репликация), которые не столь критичны для более высокоразвитых специализированных тканевых клеток организма.
Установлено, что в диапазоне от 0% до 0,1% жизнеспособость клеток увеличивается на указанные 30%, после чего в диапазоне от 0,1% до 1,5% остается на практически неизменном уровне. Это обстоятельство позволяет без ущерба для биосовместимости варьировать содержание серебра от 0,1% до 1,5%, регулируя другие характеристики материала, такие как прочность, пластичность, температуры фазовых переходов и т.п.
Недостатком этого материала является отсутствие пористости и связанная с этим сложность фиксации имплантата и как следствие затруднение его интеграции с костной тканью.
Преимущества пористых имплантатов для остеопластики стимулируют поиски путей создания пористых аналогов, обладающих такими же антисептическими свойствами, как известные монолитные сплавы.
Известен способ получения биосовместимого пористого материала с антибактериальным эффектом путем фиксации антибактериальной субстанции в пористом имплантате [патент РФ №2330685] путем заполнения его жидким гелем, используемым в качестве носителя антисептика. Антисептик удерживается в застывшем геле и постепенно высвобождается после установки имплантата в область костного дефекта.
Недостаток данного способа состоит в том, что жидкости организма не проникают в глубину имплантата из-за густого геля и не происходит остеогенеза (зарождения костной ткани) во внутренней части имплантата, а это означает, что имплантат будет фиксироваться менее надежно. Антибактериальный эффект пропадет, как только гель с антибиотиком будет израсходован.
Таким образом, к реализация антибактериального эффекта в пористом никелиде титана следует приближаться по пути его легирования серебром, аналогично решению по патенту РФ №2668128, касающегося монолитного материала. Поскольку в заявляемом решении реализуется антибактериальный эффект в пористом материале, в качестве прототипа выбирается решение по вышеприведенному патенту РФ №2330685. Данное решение включает получение биосовместимого пористого материала с антибактериальным эффектом путем фиксации антисептика в объеме материала. Известное решение является компромиссным, поскольку позволяет или продлять антисептический эффект за счет ухудшения проницаемости избыточным увеличением густоты геля, или же увеличивать проницаемость и ускорять прорастание за счет разжижения антисептического геля и снижения срока его рассасывания.
Технический результат предлагаемого изобретения - улучшение проницаемости материала для жидкостей и тканей в процессе остеогенеза при сохранении длительного действия антисептического эффекта.
Технический результат достигается тем, что биосовместимый пористый материал с антибактериальным эффектом, обусловленным фиксацией антисептика в объеме материала, получают реакцией самораспространяющегося высокотемпературного синтеза, проводимой в смеси порошков титана и никеля, разбавленной порошком никелида титана, в которую в качестве легирующей добавки добавляют порошок серебра при ингредиентном содержании в атомных процентах: никель - 48,9-48,5 ат. %; серебро - 0,1-0,5 ат. %; титан - остальное.
Технический результат связан с установленным фактом антибактериального эффекта от введения серебра в монолитный никелид титана. Вместе с тем, очевидных решений для перехода от монолитного сплава к пористому СВС сплаву не известно. При получении пористых сплавов на основе никелида титана используют методы порошковой металлургии, которым сопутствует образование большого количества металлических и интерметаллических соединений (TiNi(O,C,N)), имеющих индивидуальные особенности поведения. Точно так же неизвестны особенности распределения включений серебра в ходе реакции СВС и возможности их контакта с биологической средой. Таким образом, неочевидным является состав шихты и режим получения заявляемого биосовместимого пористого материала с антибактериальным эффектом.
Достижение антибактериального эффекта в сочетании с высокой биосовместимостью подтверждено материаловедческими и биологическими экспериментами. Результаты экспериментов иллюстрируются фигурами 1-7.
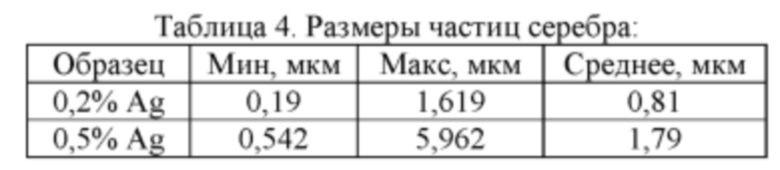
На фиг. 1 приведено растровое изображение микроструктуры контрольного пористого СВС-сплава TiNi.
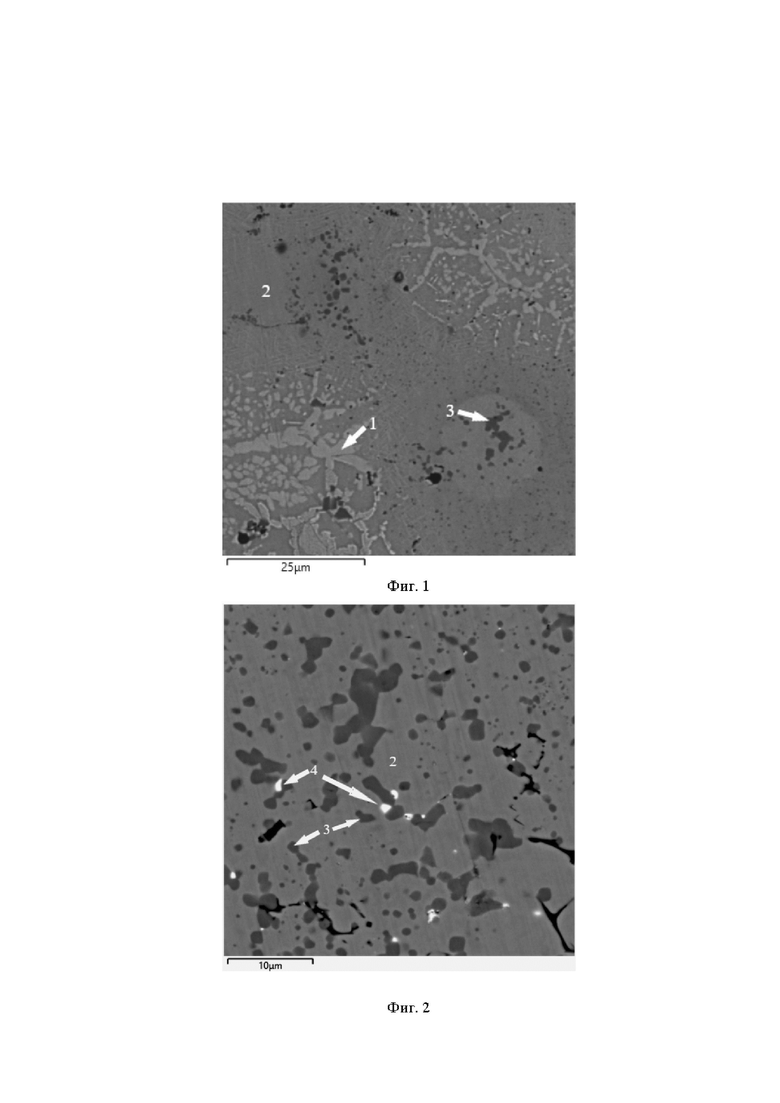
На фиг. 2, 3 приведены растровые изображения микроструктуры пористых СВС-сплавов TiNi + 0,2% Ag и TiNi + 0,5% Ag.
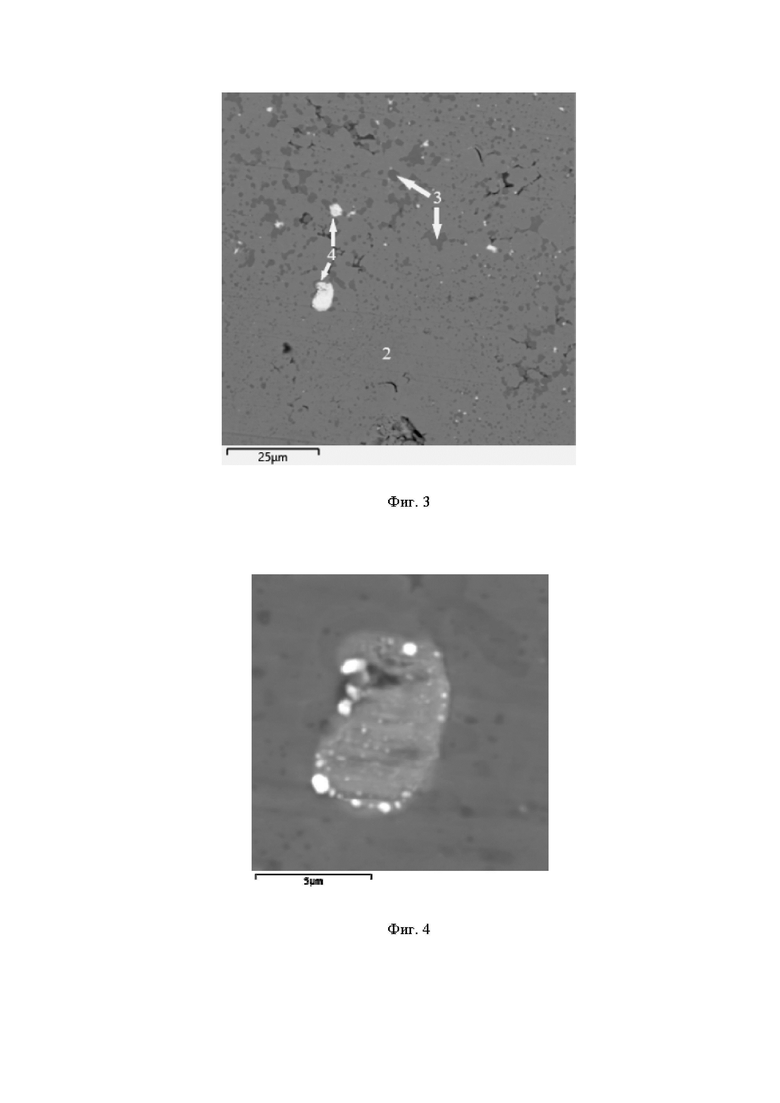
На фиг. 4 приведено растровое изображение микроструктуры частицы агломерированного серебра в пористом СВС-сплаве TiNi + 0,5% Ag.
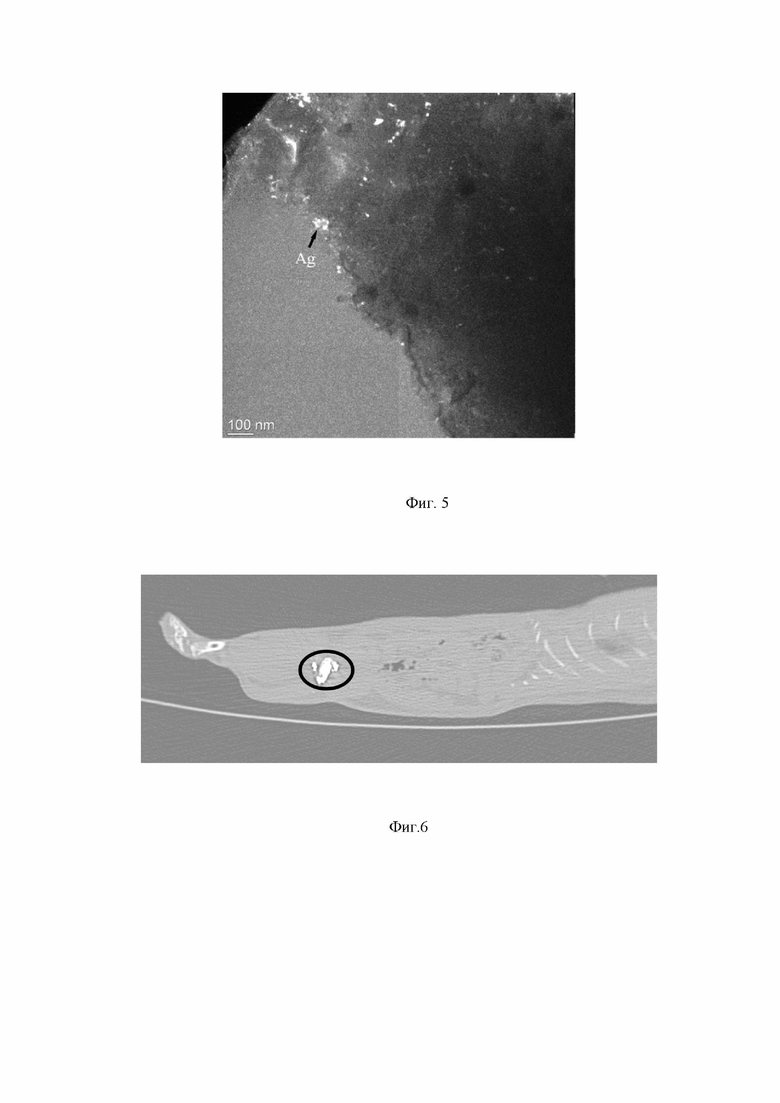
На фиг. 5 приведено темнопольное изображение микроструктуры образца TiNi + 0,5% Ag.
На фиг. 6 приведен сагиттальный срез КТ лабораторной крысы с фрагментом пористого материала в костномозговом канале бедренной кости.
На фиг. 7 приведено 3D изображение КТ лабораторной крысы с фрагментами пористого материала, имплантированного в кость и окружающие мягкие ткани.
Экспериментальные образцы получали с содержанием серебра 0 ат. % (контроль), 0,2 ат. % и 0,5 ат. %. Исходная навеска для контрольных образцов пористого сплава без серебра содержала: Ti - 46,27 вес. %; Ni - 53,73 вес. %; указанная навеска разбавлялась основой из порошка никелида титана марки ПН55Т45ОМ в пропорции 15 вес. % к 85 вес. %. Добавку серебра для экспериментальных образцов вносили в расчетном количестве в навеску из смеси порошков никеля и титана, замещая соответствующее количество никеля. Для более равномерного смешивания порошков вначале смешивали серебро с никелем в близких по весу количествах, затем добавляли и перемешивали равное количество порошка титана. Далее постепенным добавлением порций никеля и титана увеличивали массу навески до требуемой величины. Например, в навесках массой 100 г для результирующих концентраций 0,2 ат. % и 0,5 ат. % количество никеля в экспериментальных навесках уменьшали соответственно на 1,56 г и на 3,9 г, замещая его серебром. Полученные навески смешивали с расчетным количеством основы из порошка никелида титана. В итоге состав шихты в атомных процентах составлял: контрольная - Ti51Ni49, исследуемые: Ti51Ni48.8Ag0,2 и Ti51Ni48,5Ag0,5. Образцы пористого сплава на основе никелида титана получали методом самораспространяющегося высокотемпературного синтеза (СВС) в печи, наполненной аргоном для предотвращения окисления порошков во время нагрева. Температуру в печи стабилизировали на уровне 520°С. Синтез инициировали электрической спиралью. После протекания синтеза образцы охлаждали погружением в воду.
Далее было проведено исследование микроструктуры пористых сплавов на основе никелида титана: контрольного, без содержания серебра, и легированных 0,2 ат. % и 0,5 ат. % Ag.
Изображения растровой электронной микроскопии контрольного пористого СВС сплава (фиг. 1) показывают, что сплав состоит преимущественно из трех фаз: 1 - фаза, образовавшаяся в результате сплавления частиц порошка никелида титана марки ПН55Т45ОМ (встречается участками); 2 - фаза TiNi, результат сплавления частиц титана и частиц никеля; 3 - фаза Ti2Ni, образованная по перитектической реакции в процессе застывания расплава. Результаты элементного анализа, приведенные в таблице 1, показывают наличие в составе фазы Ti2Ni кислорода, что позволяет более точно определить ее как Ti4Ni2O.
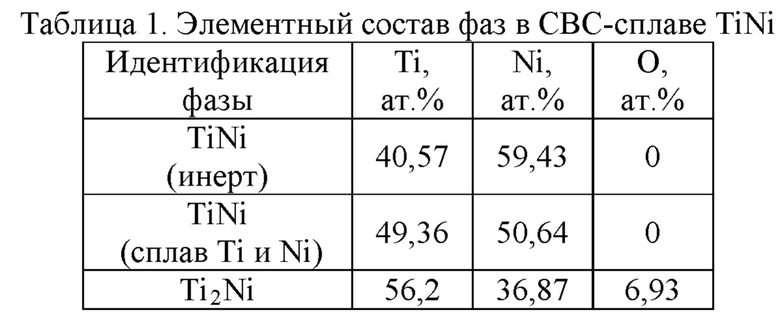
Светлопольные растровые электронные изображения образцов пористых сплавов с 0,2 и 0,5 ат. % Ag (фиг. 2, 3) показывает присутствие серебра в виде светлых частиц размером до 500 нм. Частицы серебра локализуются преимущественно на частицах Ti4Ni2O. По-видимому, наночастицы серебра из-за низкой растворимости и высокой скорости распространения волны горения в ходе прохождения синтеза СВС агломерируются в более крупные образования и вытесняются при кристаллизации к более легкоплавкой фазе Ti4Ni2O.
Результаты элементного анализа (табл. 2 и 3) показывают, что в некоторых частицах серебра присутствует кальций, что связано с гидридно-кальциевым способом получения титансодержащих порошков.
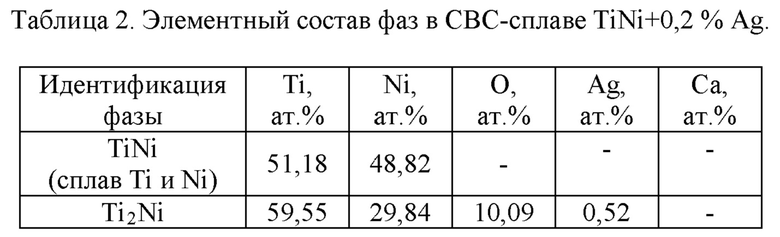
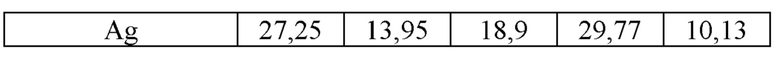
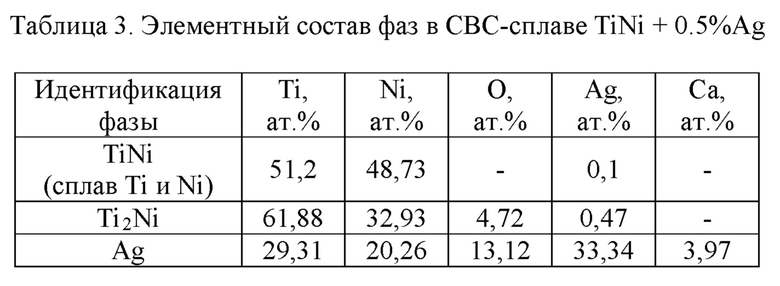
Характерно, что кальций обнаруживается только в частицах серебра, куда он диффундирует в ходе синтеза. На фиг. 4 приведен характерный вид сравнительно крупной частицы CaAg размером до 7 мкм с отдельными включениями чистого серебра. Растворимость серебра в фазе TiNi пористого сплава относительно мала и не превышает 0,1 ат. %.
По результатам анализа растровых изображений образцов сплава TiNiAg можно сделать вывод, что частицы серебра в основном располагаются в зонах перитектической кристаллизации фазы Ti4Ni2O. С увеличением концентрации серебра в сплаве растет и размер агломератов из частиц Ag (табл. 4).
Результаты просвечивающей электронной микроскопии на основе никелида титана.
По результатам просвечивающей электронной микроскопии образцов пористых проницаемых СВС сплавов TiNiAg в геометрии поперечного сечения видно, что в поверхностном слое Ti4Ni2O серебро кристаллизуется в виде наночастиц размером до 10 нм (фиг. 4), причем не агломератами, а отдельными наночастицами равномерно по всему поверхностному слою. В этом состоит отличие поверхностного слоя от матрицы, где серебро кристаллизуется в виде крупных частиц, размеры которых, в соответствии с таблицей 4, исчисляются микронами.
Таким образом, в результате проведенных структурных исследований показано, что частицы серебра находятся в пористом сплаве в форме чистого серебра и (или) в форме соединения CaAg. Крупнокристаллические частицы серебра средним размером до 2 мкм расположены в матрице в зонах перитектической кристаллизации фазы Ti2Ni. В поверхностном слое Ti4Ni2O серебро представлено равномерно распределенными нанокристаллическими частицами с размерами порядка 10 нм. Эти частицы покрывают как наружную поверхность образца, такта и внутреннюю поверхность его пор, обеспечивая антибактериальный эффект.
Исследование антибактериальных свойств.
Антибактериальные свойства биосовместимого пористого материала обусловлены включением в его состав наночастиц серебра. Для определения антибактериальной активности был использован стандартный метод инкубации бактерий в жидком бульоне в присутствии изучаемых образов с последующим высевом на твердые среды и подсчетом колоний.
Суточная культура Staphylococcus epidermidis была приготовлена путем переноса 10 мкл чистой культуры микроорганизмов со скошенного агара в питательный бульон (400 мл) с последующей инкубацией 24 часа при температуре 25°С. Спустя сутки был произведен посев 50 мкл суточной культуры на твердую питательную среду для определения численности микроорганизмов в 1 мл культуры. Опытные образцы сплавов CBC-NiTi инкубировали в питательном бульоне, содержащем микробную взвесь Staphylococcus epidermidis в течение 72 часов при 25°С.
По 100 мкл цельной взвеси микроорганизмов, в разведении 10-6 высевали на чашки с плотной питательной средой с последующей инкубацией 72 часа при 25°С и подсчетом колонии образующих единиц (КОЕ). В контроле к бульону добавляли 100 мкл физ. раствора.
В результате подсчета получены значения КОЕ для образцов с 0% Ag и контрольной чашки - 150, для 0,2% Ag - 120 и для 0,5% Ag - 100. Таким образом, можно говорить о том, что содержание наночастиц Ag придает данным сплавам антибактериальные свойства.
С целью проверки биосовместимости проведено экспериментальное исследование имплантации пористого сплава на основе никелида титана с добавкой серебра (0,2-0,5 ат. %) invivo в бедренную кость белой крысы. На базе вивария Уральского государственного медицинского университета, в соответствии с «Правилами проведения работ с использованием экспериментальных животных» и принципами, изложенными в конвенции по защите позвоночных животных, используемых для эксперимента и других целей (Страсбург, Франция, 1986). Экспериментальные исследования, направленные на изучение инновационного сплава никелида титана одобрены локальным этическим комитетом УГМУ, выписка из протокола №6 от 17.06.2022. Все животные содержались в соответствии с санитарными требованиями №1045-73 от 06.04.1973. Эксперимент проводился на 9 половозрелых самках белых лабораторных крыс, весом 400-600 грамм. Крысы были разделены на 3 группы по 3 особи, всем животным был имплантирован никелид титана в виде мелкодисперсного порошка, который получали из пористого сплава на основе никелида титана, легированного наночастицами серебра (0; 0,2; 0,5 ат. %) с помощью резца на металлообрабатывающем станке. В первой группе в сплав было добавлено 0,5% серебра, во второй группе 0,2% серебра, а в третьей группе для сравнения был чистый никелид титана без добавления серебра.
Хирургическое лечение проводилось в стерильных условиях под общей анестезией. Проведение наркоза осуществляли путем внутримышечной инъекции препарата «Золетил 100» из расчета 10 мг/кг массы. После подготовки операционного поля, удаления шерсти и обработки растворами антисептика, производился операционный доступ путем разреза кожи до 2 см по наружной поверхности правого бедра. Тупым и острым путем была выделена бедренная кость, и при помощи гравера со стерильным булавовидным наконечником выполнено трефинационное отверстие в проксимальной метадиафизарной области бедренной кости размерами 0,3x0,3 см. На данном этапе получена модель полостного образования трубчатой кости. Далее при помощи ложки Фолькмана проводилась имплантация мелкодисперсного порошка никелида титана в образованную костную полость в зависимости от группы. Материал плотно утрамбовывали в кости. Часть материала попадала в мягкие ткани около кости, что является допустимым. Завершали операцию послойными швами раны и обработкой бриллиантовой зеленью области основного доступа. Послеоперационный период протекал без особенностей, обезболивание проводили препаратом Флексопрофен 2,5% из расчета 2,5 мг/кг массы. На 75 сутки все животные были выведены из эксперимента путем передозировки наркозного препарата с последующим забором бедренных костей для дальнейшего гистологического исследования границы кость-имплант и электронной микроскопии.
При проведении клинической оценки результатов отмечалось полное отсутствие гнойно-воспалительных осложнений у всех животных на всех сроках эксперимента. Перед выведением животных при клиническом осмотре отсутствуют признаки воспаления в зоне имплантации материала, пальпация безболезненная, местная температура не повышена, передвижение животных в клетке не затруднено.
На 75 сутки животным проведена компьютерная томография. На фиг. 5 показан сагиттальный срез КТ лабораторной крысы. Выделен материал, установленный в костномозговой канал бедренной кости. На фиг. 6 показано 3D изображение КТ лабораторной крысы. Выделено место имплантации в кость и окружающие мягкие ткани. Отмечена хорошая заполняемость костного дефекта, отсутствие дистрофического эффекта в области контакта кости и мягких тканей с материалом.
Таким образом, in vivo подтверждена биосовместимость пористого сплава на основе легированного серебром никелида титана, сочетающаяся с выраженным антибактериальным эффектом. Установлено, что антибактериальный эффект не оказывает существенного ингибитного эффекта на клетки белой крысы. При проведении клинической оценки результатов отмечалось полное отсутствие гнойно-воспалительных осложнений у всех животных на всех сроках эксперимента.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ аддитивного производства пористых имплантатов из никелида титана с управляемыми механическими характеристиками и биосовместимостью | 2024 |
|
RU2835297C1 |
| УСТРОЙСТВО ДЛЯ ЗАМЕЩЕНИЯ ПОСТРЕЗЕКЦИОННЫХ ГРУДИННО-РЕБЕРНЫХ ДЕФЕКТОВ У ПАЦИЕНТОВ ПРИ РЕКОНСТРУКЦИИ КАРКАСА ГРУДНОЙ КЛЕТКИ | 2024 |
|
RU2837561C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПОРИСТЫХ БИОСОВМЕСТИМЫХ МАТЕРИАЛОВ НА ОСНОВЕ НИКЕЛИДА ТИТАНА | 2010 |
|
RU2459686C2 |
| СПОСОБ ПОЛУЧЕНИЯ БИОСОВМЕСТИМОГО ПОРИСТОГО СПЛАВА НА ОСНОВЕ НИКЕЛИДА ТИТАНА | 2022 |
|
RU2796898C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПОРИСТОГО СПЛАВА НА ОСНОВЕ НИКЕЛИДА ТИТАНА | 2022 |
|
RU2798496C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПОРИСТОГО МАТЕРИАЛА НА ОСНОВЕ НИКЕЛИДА ТИТАНА | 2020 |
|
RU2732716C1 |
| БИОСОВМЕСТИМЫЙ МАТЕРИАЛ | 2017 |
|
RU2668128C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПОРИСТОГО СПЛАВА НА ОСНОВЕ НИКЕЛИДА ТИТАНА | 2017 |
|
RU2651846C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПОРИСТОГО МАТЕРИАЛА НА ОСНОВЕ НИКЕЛИДА ТИТАНА МЕТОДОМ САМОРАСПРОСТРАНЯЮЩЕГОСЯ ВЫСОКОТЕМПЕРАТУРНОГО СИНТЕЗА | 2021 |
|
RU2771150C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПОРИСТЫХ МАТЕРИАЛОВ НА ОСНОВЕ НИКЕЛИДА ТИТАНА | 2006 |
|
RU2310548C1 |

Изобретение относится к области медицины, в частности к пористым биомедицинским материалам на основе никелида титана, которые могут быть использованы для изготовления костных имплантатов или инкубаторов клеточных культур. Способ получения биосовместимого пористого материала с антибактериальным эффектом, обусловленным фиксацией антисептика в объеме материала, включает проведение реакции самораспространяющегося высокотемпературного синтеза в смеси порошков титана и никеля, разбавленной порошком никелида титана, в которую в качестве легирующей добавки добавляют порошок серебра. Ингредиентное содержание в атомных процентах в смеси выбирают в пределах: никель – 48,8-48,5 ат.%; серебро – 0,2-0,5 ат.%; титан – остальное, причем концентрацию никелида титана в смеси выбирают равной 15%, а температуру в печи стабилизируют на уровне 520°С. Изобретение обеспечивает улучшение проницаемости материала для жидкостей и тканей в процессе остеогенеза при сохранении длительного действия антисептического эффекта. 7 ил., 4 табл.
Способ получения биосовместимого пористого материала с антибактериальным эффектом, обусловленным фиксацией антисептика в объеме материала, включающий проведение реакции самораспространяющегося высокотемпературного синтеза в смеси порошков титана и никеля, разбавленной порошком никелида титана, в которую в качестве легирующей добавки добавляют порошок серебра, отличающийся тем, что ингредиентное содержание в атомных процентах выбирают в пределах: никель – 48,8-48,5 ат.%; серебро – 0,2-0,5 ат.%; титан – остальное, концентрацию никелида титана в смеси выбирают равной 15%, а температуру в печи стабилизируют на уровне 520°С.
| CN 102648876 A, 29.08.2012 | |||
| МАРЧЕНКО Е.С | |||
| и др | |||
| Особенности СВС пористого никелида титана: учеб.-метод | |||
| пособие | |||
| Томск: Издательство Томского государственного университета, 2021, с.7-8, 24, 27 | |||
| БИОСОВМЕСТИМЫЙ МАТЕРИАЛ | 2017 |
|
RU2668128C1 |
| Способ получения биоактивного покрытия c бактерицидными свойствами на имплантате из титана | 2019 |
|
RU2719475C1 |
| МАТЕРИАЛ ДЛЯ ИМПЛАНТАЦИИ И ПЛАСТИКИ ПАРОДОНТА И СПОСОБ ЕГО ПРИГОТОВЛЕНИЯ | 2008 |
|
RU2399387C2 |
| BAIGONAKOVA G | |||
| et al | |||
| Influence of Silver Addition on Structure, | |||
Авторы
Даты
2024-03-19—Публикация
2022-12-12—Подача