Область техники
Изобретение относится к области полимеров, полимерных материалов, находящихся в твердом агрегатном состоянии и изделий на их основе и предназначено для оценки их гемолитического действия ин витро. Может быть использовано в научно-исследовательских лабораториях, лабораториях предприятий, при оценке гемолитического действия новых полимеров и полимерных материалов, изделий из них, полимеров и полимерных материалов, получаемых по различным технологиям, полимерных материалов и изделий на их основе, при изменении сферы применения известного полимера, полимерного материала, изделия.
Уровень техники
Гемолиз - это процесс разрушения эритроцитов с выбросом гемоглобина в плазму крови. Гемолиз в организме человека может являться следствием взаимодействия эритроцитов с чужеродным материалом или веществом, в результате которого происходит разрыв мембран эритроцитов. Повышенные уровни свободного гемоглобина могут спровоцировать токсические эффекты. Концентрация свободного гемоглобина является информативным параметром, характеризующим степень повреждения эритроцитов, а также косвенным индикатором повреждения мембраны других элементов крови. Величина гемолиза зависит, в том числе, от времени контакта вещества, материала с кровью и от свойств самого вещества, материала, таких как энергия, морфология и химический состав поверхности [ГОСТ ISO 10993-4-2020 Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 4 Исследования изделий, взаимодействующих с кровью (ISO 10993-4:2017, Biological evaluation of medical devices - Part 4: Selection of tests for interactions with blood, IDT)]. Это свойство эритроцитов положено в основу относительно простых методов ин витро первичной оценки гемолитического действия полимера, полимерного материала, изделия из него, предполагающих использование в условиях контакта с кровью. Отсутствие гемолитических свойств у исследуемого образца является предпосылкой к дальнейшему испытанию потенциального материала ин витро, с учетом конкретной области его применения. Метод оценки гемолитической активности материала ин витро в статических условиях наиболее простой и, следовательно, более доступный, в сравнении с методом исследования в потоке крови. Кроме этого, данный метод более информативен в случае оценки влияния химической природы (состава) полимера, полимерного материала и изделия из них поскольку гемолитическая активность многих изделий, вызванная гемодинамическими силами и взаимодействием с поверхностями в условиях потока, превышает значения гемолиза, вызванного химическими свойствами материалов [ГОСТ ISO 10993-4-2020 Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 4 Исследования изделий, взаимодействующих с кровью (ISO 10993-4:2017, Biological evaluation of medical devices - Part 4: Selection of tests for interactions with blood, IDT)]. Подобные исследования позволяют значительно ускорить разработку нового гемосовместимого полимера, полимерного материала, изделия из него путем отбраковки образцов по результатам исследования их гемолитической активности ин витро. Методы исследования гемолитической активности полимера, полимерного материала, изделия из него ин витро в статических условиях можно разделить на две группы: 1) непрямые методы, предполагающие определение гемолиза посредством веществ, экстрагируемых из исследуемых объектов; 2) прямые методы определяют гемолиз путем физических и химических взаимодействий исследуемого материала с эритроцитами. К непрямым методам оценки гемолитического действия полимерных материалов является известная методика, утвержденная Минздравом в конце прошлого столетия [Методика определения гемолитического действия полимерных материалов и изделий "ин витро" (утв. Минздравом СССР 27.11.1985)]. Преимуществом прямых методов оценки гемолитического действия полимера, полимерного материала, является как раз то, что они предполагают контакт с эритроцитами полностью всей пробы материала, а не только экстракта из нее. Это увеличивает количество возможных негативных воздействий полимера в рамках исследования полимерного материала или изделия из них на эритроциты, приводя к гемолизу и, следовательно, повышает достоверность получаемых результатов анализа. При контакте суспензий эритроцитов с исследуемыми материалами, значения гемолиза, как правило, вычисляют как процентное содержание гемоглобина, который был высвобожден в супернатант относительно общего количества гемоглобина в данной суспензии клеток, т.е. значение концентрации свободного гемоглобина деленное на концентрацию общего гемоглобина, умноженное на 100%. Под суспензией эритроцитов необходимо понимать гетерогенную систему, в которой дисперсной фазой являются эритроциты, а дисперсионной средой - вода или водные растворы. В некоторых методиках суспензию эритроцитов называют взвесью. Под понятием «супернатант» следует понимать отцентрифугированную надосадочную жидкость исследуемой пробы, которая не может быть осаждена при данных условиях центрифугирования. Если все эритроциты суспензии разрушены, то наблюдается 100%-й гемолиз. Именно эта количественная характеристика гемолиза принимается в настоящем изобретении. Рамках настоящего изобретения под понятием «полимер» подразумевается любое высокомолекуляное вещество, полимерный материал и изделия из полимерного материала или включающие полимер или полимерный материал.
В качестве источников эритроцитов исследователи выбирают кровь людей или животных. Известно использование эритроцитов барана для исследования гемолитической активности полимера [XiaoyaLi, XiaoWang, Sathiyaraj Subramaniyan, YangLiu, JingyiRao, and Baozhong Zhang. Hyper-branched Polyesters Based on Indole - and Lignin-Derived Monomeric Aromatic Aldehydes as Effective Nonionic Antimicrobial Coatings with Excellent Biocom-patibility. Biomacromolecules 2022, 23, 150-162]. Описан способ оценки гемолитического действия наночастиц, покрытых полимерными материалами с использованием крови лошади и барана [Justin M.Zook, Melissa D. Halter, Danielle Cleveland, Stephen E. Long. Disentangling the effects of polymer coatings on silver nanoparticle agglomeration, dissolution, and toxicity to determine mechanisms of nanotoxicity. J Nanopart Res (2012) 14:1165]. Описывается использование крови свиньи для определения гемолитического действия гибридного материала с полимерным покрытием, предлагаемого к использованию в качестве заменителя сердечно-сосудистой ткани [Jahnavi Mudigonda, Dongyang Xu, Brooks Lane, Daniella Corporan, Vivian Wang, Muralidhar Padala. A Biohybrid Material With Extracellular Matrix Core and Polymeric Coating as a Cell Honing Cardiovascular Tissue Substitute. J. Frontiers in cardiovascular medicine. 2022/3/24. P. 192]. Известен пример использования крови крыс для изучения гемолитичекого действия полимеров [Dagmar Fischera, YouxinLib, Barbara Ahlemeyerc, Josef Krieglsteinc, Thomas Kissela. In vitro cytotoxicity testing of polycations: influence of polymer structure on cell viability and hemolysis. Biomaterials 24 (2003) 1121-1131]. Известны рекомендации по определению гемолитических свойств материала, рекомендующие использование крови кроликов для исследований [ASTM F756-13. Standard Practice for Assessment of Hemolytic Properties of Materials], а также пример применения крови кроликов на практике [Qiu, W.; Wang, J.; Li, L. Preparation and Biological Performance of Poly(Vinyl Alcohol)/Hydroxyapatite Porous Composites Used for Cartilage Repair. RSC Adv 2016, 6, 99940-99947, DOI: 10.1039/c6ra22929h]. Известно [ГОСТ ISO 10993-4-2020], что из-за индивидуального характера реактивности крови у животных различных видов, при возможности, используют кровь человека (за исключением установленных методов исследования с кровью животных, таких как некоторые тесты на гемолиз). Вместе с этим указывается, что все результаты испытаний на крови животных следует интерпретировать с осторожностью. Выбранные виды и используемое количество животных должны быть обоснованы [ГОСТ ISO 10993-4-2020 Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 4 Исследования изделий, взаимодействующих с кровью (ISO 10993-4:2017, Biological evaluation of medical devices - Part 4:Selection of tests for interactions with blood, IDT)]. В связи с этим, недостаток методик оценки гемолитического действия полимеров, материалов, использующих кровь или эритроциты животных, состоит в получении менее достоверных результатов анализа по сравнению с методиками, предполагающими использование крови или эритроцитов человека.
Известен способ определения гемолитической активности полимерных материалов, основанный на определении гемолиза вытяжки из полимерного материала [Методика определения гемолитического действия полимерных материалов и изделий "ин витро" (утв. Минздравом СССР 27.11.1985)]. Способ реализуется по следующей методике. Вытяжки из полимера готовят в соответствии с методической и нормативной документацией для конкретных групп материалов и изделий. Для приготовления взвеси эритроцитов может быть использована эритроцитная масса или цитратная кровь, заготовленная на 3,9% растворе цитрата натрия в соотношении 1:9. Срок хранения цитратной крови (эритроцитарной массы) - 72 ч при +4°С. Кровь (эритроцитарную массу) 5 мл центрифугировать 10 мин. при 900 об./мин. Надосадочную жидкость отделить. К осадку добавить 8 мл стерильного 0,9% раствора хлористого натрия. Содержимое взболтать и центрифугировать 10 мин. при 900 g. Надосадочную жидкость (супернатант) отделить. Эта операция (отмывание клеток) повторяется два раза. После отмывания надосадочная жидкость должна быть прозрачна, бесцветна, не иметь следов гемолиза. Если надосадочная жидкость не отвечает указанным требованиям, эритроциты не могут быть использованы для приготовления взвеси эритроцитов. Для получения 10% взвеси эритроцитов 1 мл осадка клеток смешивают с 9 мл 0,9% раствора хлористого натрия. Полученную взвесь эритроцитов можно хранить не более 24 часов в холодильнике при температуре от -4 до -6°С. Для приготовления контрольной пробы смешивают 0,5 мл 10% взвеси эритроцитов и 5 мл 0,9% раствора хлористого натрия. Для приготовления пробы со 100% гемолизом смешивают 0,5 мл 10% взвеси эритроцитов и 5 мл дистиллированной воды. Контрольную пробу и пробу со 100% гемолизом готовят для каждого образца эритроцитной взвеси. До определения гемолитического действия к вытяжке (приготовленной на дистиллированной воде) необходимо добавить хлористый натрий из расчета 9 мг на 1 мл вытяжки для превращения дистиллированной воды в изотонический раствор для крови. В 3 пробирки разлить по 0,5 мл 10% взвеси эритроцитов. К 0,5 мл 10% взвеси эритроцитов в каждую пробирку добавить по 5 мл вытяжки, в которую предварительно добавлен хлористый натрий до 0,9% раствора. Смесь термостатируют 1 час при температуре 37°С, затем центрифугируют в течение 20 мин. при 2000 об./мин. Все манипуляции по отношению к контролю и пробе со 100% гемолизом проводятся параллельно с опытными пробами, как описано выше. Надосадочную жидкость отделяют для проведения измерений оптической плотности. Опытные, контрольную пробу и пробу со 100% гемолизом измеряют на фотоэлектроколориметре (ФЭК-60, КФК) при длине волны 540 нм против холостой пробы (вода). Толщина кюветы 1 см. Результаты регистрируются по оптической плотности.
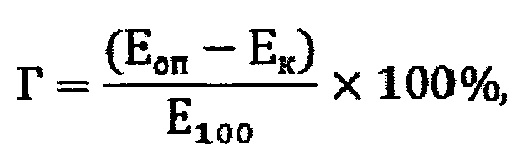
где Г - процент гемолиза, Еоп - оптическая плотность опытной пробы, Ек - оптическая плотность контрольной пробы, Е100 - оптическая плотность воды со взвесью эритроцитов 100% гемолиз.
Испытуемое изделие свободно от гемолитически действующих веществ, если % гемолиза во всех трех пробах менее 2.
Примечания: 1. Если оптическая плотность контрольной пробы (10% эритроцитная взвесь с 0,9% раствором хлористого натрия) составляет 0,03 и более, результаты всего опыта недостоверны и не учитываются. 2. Оптическая плотность раствора со 100% гемолизом должна быть не менее 0,8 и не более 1. В случае отклонения от указанных пределов опыт следует повторить с вновь приготовленной эритроцитной взвесью. 3. Если шкала фотоэлектроколориметра от 0 до 1,0, а оптическая плотность более 1, то необходимо раствор развести в 2 раза, затем определить оптическую плотность и увеличить ее еще в 2 раза. 4. При проведении научных исследований для обеспечения статистической достоверности результатов необходимо опыты ставить не менее чем на 5 образцах крови.
Недостатками способа являются: использование вытяжки из полимера, а не целиком полимер, т.е отсутствие прямого контакта материала, не приведены требования к происхождению крови, отсутствие буферных растворов для поддержания физиологического значения рН проб, поскольку рН вытяжек может отличаться от физиологических значений рН крови и, следовательно, негативно отразиться на полученных результатах анализа. Еще одним недостатком является то, что нет доказательства, что при более продолжительном времени инкубирования образцов определенный процент гемолиза не будет иметь более высокие значения и, следовательно, вывод о гемолитической активности материала может быть ошибочным. В приведенном способе не предусмотрен учет влияния оптической плотности супернатанта от наличия других компонентов, например веществ, экстрагированных из материала или растворившаяся или диспергированная часть самого исследуемого материала на результат, что является недостатком способа.
Известен способ оценки гемолитических свойства материалов, используемых при изготовлении медицинских устройств, контактирующих с кровью [ASMT. F756. Standard Practice for Assessment of Hemolytic Properties of Materials]. Способ предполагает проведение тестов для образца материала как при непосредственном его контакте с к кровью, так и исследование его экстракта. Для реализации исследования по этому способу необходимо приготовить минимум по шесть образцов тестируемого материала, отрицательного контроля и положительного контроля для теста, предполагающего прямой контакт с кровью и по три образца для теста с экстрактом. Поверхность исследуемых образцов должны соответствовать конечному применению. Образцы должны быть стерилизованы методом, используемым для стерилизации конечного продукта. В качестве отрицательного контроля берут материал, такой как полиэтилен, который вызывает небольшой гемолиз или не вызывает его вовсе (<2% после вычитания холостой пробы) в процедуре испытания. Желательно, чтобы контрольные образцы имели ту же конфигурацию, что и испытуемые. В качестве положительного контроля используют материалы, способные постоянно давать гемолитический индекс (выше отрицательного контроля) не менее 5%. Например, авторы утверждают, что мытый каучук Buna N (Aero Rubber Company; ARC-45010, лист толщиной 0,031 дюйма) и виниловый пластизоль (Plasti-Coat; лист толщиной от 0,025 до 0,075 дюйма, цвет: DB1541 -средний синий 300) давал уровни гемолиза выше 90% при использовании экстрактов, полученных при 121°С в течение 1 часа, во время ограниченных межлабораторных испытаний. 4 В тестах прямого контакта каучук Buna N (ARC-45010) с кровью показал уровни гемолиза 14,5±5,3%.
Кроме этого, для реализации исследования по описываемому методу необходимо создать калибровочную кривую концентрации гемоглобина с использованием метода цианметгемоглобина. Используют эталонные стандарты и реагенты от компаний, занимающихся клинической диагностикой, которые соответствуют спецификациям Международного комитета по стандартизации в гематологии (ICSH). Используют спектрофотометр, обеспечивающий показания поглощения с точностью не менее трех знаков после запятой. Стандартную калибровочную зависимость готовят из подходящего стандарта в шести разведениях в диапазоне концентраций от 0,03 до 0,7 мг/мл. Разбавитель реагента цианметгемоглобина принимают за образец сравнения при спектрофотометрическим измерении. Измеряют поглощение при 540 нм. При построении калибровочной кривой откладывают концентрацию гемоглобина (мг/мл) по оси ординат и А540 по оси абсцисс. Калибровочный коэффициент (F) представляет собой наклон этого графика. Пересечение с осью Y должно быть приблизительно в нуле. Разработчики метода уточняют, что если отсутствует возможность использования стандартных цианметгемоглобиновых реагентов, то другой метод измерения концентрации общего гемоглобина в крови, концентрации свободного гемоглобина в плазме и концентрации гемоглобина в супернатанте может быть применен при условии, что он утвержден и доказано, что он по существу эквивалентен методу цианметгемоглобина. Методы количественного определения только оксигемоглобина могут оказаться неприемлемыми, поскольку некоторые материалы могут преобразовывать оксигемоглобин в другие формы или изменять спектр поглощения. Исследователи должны знать, что их результаты определения концентрации гемоглобина в супернатанте могут быть ошибочны из-за абсорбции гемоглобина тестируемым материалом, осаждением гемоглобина из раствора, или изменением спектра спектрофотометрического поглощения материалом.
Для исследований используют кровь кролика с антикоагулянтом не менее чем от трех доноров. Предпочтительным антикоагулянтом является цитрат (0,13 М). От каждого кролика следует взять примерно 5 мл крови. Хранят кровь при температуре 4±2°С и предпочтительно используют в течение 48 часов. Кровь можно использовать в течение 96 ч после забора, если уровень свободного гемоглобина в плазме не является избыточным. Объединяют равные количества крови от каждого кролика. В крови определяют концентрацию свободного гемоглобина. Для этого 3,0 мл крови центрифугируют при 700-800 G в стандартной клинической центрифуге в течение 15 мин. После этого 0,5 мл полученной плазмы добавляют к 0,5 мл цианметгемоглобинового реагента. Через 15 минут измеряют оптическую плотность спектрофотометрически при длине волны 540 нм. Концентрацию гемоглобина в плазме (PFH, мг/мл) рассчитывают следующим образом:
PFH=APFH⋅F⋅2,
где, согласно принятых авторами сокращении: APFH - значение поглощения образцом, измеренное при 540 нм, F - наклон стандартной калибровочной зависимости поглощения от концентрации гемоглобина.
Кровь пригодна для исследования, если PFH составляет менее 2 мг/мл.
Выбранную для исследований кровь анализируют на концентрацию общего гемоглобина. Для этого 20 мкл образца цельной крови добавляют к 5,0 мл раствора цианметгемоглобина или валидированного разбавителя. Дают полученному раствору отстояться 5 мин или 15 мин, в случае применения реактива Драбкина, а затем измеряют поглощение раствора с помощью спектрофотометра при длине волны 540 нм. Выполняют два параллельных опыта. Общая концентрация гемоглобина в крови рассчитывается следующим образом:
С=AC⋅F⋅251,
где, согласно принятых авторами сокращений: С - общая концентрация гемоглобина в крови, AC - значение поглощения образцом, измеренное при 540 нм, F - наклон стандартной калибровочной зависимости поглощения от концентрации гемоглобина.
После этого доводят общее содержание гемоглобина в образце крови до 10±1 мг/мл путем разбавления соответствующим количеством натрий-фосфатного буфера (PBS), не содержащего кальция и магния. Проверяют концентрацию общего гемоглобина, как описано выше, в трех экземплярах, но смешивают 300 мкл разбавленной крови и 4,5 мл реагента. Общая концентрация гемоглобина в крови рассчитывается следующим образом:
T=AT⋅F⋅16,
Где, согласно принятых авторами сокращений: Т - общая концентрация гемоглобина в разбавленной крови, AT - значение поглощения образцом разбавленной крови, измеренное при 540 нм, F - наклон стандартной калибровочной зависимости поглощения от концентрации гемоглобина.
Способ предполагает испытания образцов, предусматривающие прямой контакт образца с кровью ин витро, так и испытания, не предполагающие прямого контакта материала с кровью.
Для проведения испытания, не предполагающего контакт исследуемого образца с кровью, получают экстракт. Экстрагирование проводят согласно [F619.Standard Practice for Extraction of Medical Plastics].Для этого берут образцы материала с площадь поверхности 120 см2 если его толщина составляет 0,50 мм или меньше или с площадью поверхности 60 см2 при толщине образца превышающей 0,50 мм. Количество экстрагента берут 20 мл. Для образцов сложной геометрии или образцов с толщиной более 1,0 мм берут образец, масса которого составляет 0,2 г/мл. Посуду для экстрагирования моют и стерилизуют. Для экстрагирования готовят три образца материала. В качестве экстрагента используют PBS. Помещают по одному образцу материала в каждый из трех емкостей для экстракции. Для экстрагирования используют одно из следующих условий: при 37±1°С 120 часов, возможно 72±2 часа или 24±2 часа; при 50±2°С 72 часа; 70±2°С 24 часа; 121±2°С 1 час. Рекомендуется проводить экстракцию при самой высокой температуре, которую выдержит материал. Если материал растворяется при 37°С, то его анализируют в виде раствора. Вместе с эти разработчики метода предлагают использовать время и температуру, которые имитируют предполагаемое использование материала. После экстрагирования сосуды охлаждают до 22°С. После охлаждения энергично встряхивают в течение 30 секунд и переливают жидкость в другую подходящую емкость. Экстракты хранят 48 часов при температуре от 22 до 30°С. По 7,0 мл полученного экстракта каждого образца переливают в отдельные пробирки с завинчивающимися крышками из боросиликатного стекла или полистирола (или эквивалента) примерно 16×125 или 16×150 мм. В них же добавляют по 0.1 мл крови разбавленной PBS, как описано выше. Пробирки инкубируют не менее 3 ч при 37±2°С на водяной бане. Аккуратно перемешивают содержимое каждой пробирки примерно каждые 30 мин. По истечении указанного времени инкубации центрифугируют при 700-800 G в течение 15 мин в стандартной клинической центрифуге. Надосадочную жидкость анализируют спектрофофтометрически на содержание гемоглобина.
Для определение гемоглобина в надосадочной жидкости добавляют ее 1,0 мл к 1,0 мл цианметгемоглобинового реагента или проверенного разбавителя. Выдерживают образец 15 минут в случае применения реактива Драбкина или 3-5 минут для цианметгемоглобина. Измеряют поглощение раствора с помощью спектрофотометра при длине волны 540 нм. Определяют концентрацию гемоглобина надосадочной жидкости каждого образца, используя калибровочную кривую, описанную ранее. Концентрацию гемоглобина в надосадочной жидкости из исследуемого образца или контрольных пробирок рассчитывают следующим образом, с поправкой на коэффициент разбавления 2:
S=AS⋅F⋅2,
Где, согласно принятых авторами сокращений: S - общая концентрация гемоглобина в образце тестируемого материала или отрицательного или положительного контрольного образца, AS -значение поглощения соответствующим образцом, измеренное при 540 нм, F - наклон стандартной калибровочной зависимости поглощения от концентрации гемоглобина.
Гемолиз вычисляют следующим образом:

В приведенном выше уравнении общую концентрацию гемоглобина в пробирке рассчитывают путем деления общей концентрации гемоглобина в крови, приготовленной при разведении цельной крови PBS, как описано выше, на 8 для учета разведения крови PBS в пробирках. Использование этого уравнения предполагает, что фоновое воздействие эндогенной плазмы и свободного гемоглобина, а также экстрактов незначительно. Для проверки этого предположения при инкубировании исследуемых образцов с кровью параллельно инкубируют еще две пробирки, одна из которых содержит содержит 7 мл PBS и 1 мл разбавленной крови (10 мг/мл), а другая наполнена экстрактом образца. После инкубировани эти пробирки центрифугируют в таких же условиях, что и исследуемые образцы. После чего спектрофотометрически измеряют поглощение надосадочных жидкостей.
Как указано в описании способа, гемолиз с поправкой на фон от холостого образца рассчитывают следующим образом:
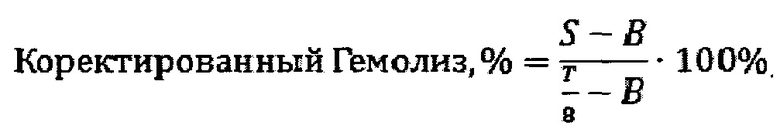
Где, согласно принятых авторами сокращений: S - общая концентрация гемоглобина в образце тестируемого материала или отрицательного или положительного контрольного образца, В - пустой образец (пробирка), в которой при инкубировании отсутствовал исследуемый образец и содержался только изотонический раствор. Если в процессе выполнения исследования были строго соблюдены все разбавления, то приведенное выше уравнение можно упростить следующим образом:
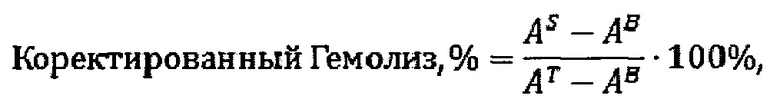
Где, согласно принятых авторами сокращений: AS - значение поглощения соответствующим образцом, измеренное при 540 нм, AS - общая концентрация гемоглобина в образце тестируемого материала или отрицательного или положительного контрольного образца, AB - значение поглощения образцом из пробирки, в которой при инкубировании отсутствовал исследуемый образец и содержался только изотонический раствор, измеренное при 540 нм, AT - значение поглощения надосадочной жидкости из пробирки, в которой при инкубировании только разбавленная PBS кровь, измеренное при 540 нм.
В качестве количественной характеристики гемолитической активности материала способ предполагает присвоение гемолитического класса исследуемому материалу. Для его вычисления следует средний процент гемолиза образца без исследуемого материала вычесть из среднего процента гемолиза контрольного и испытуемого образцов. Результаты тестового образца следует сравнить с результатами отрицательного контроля. Кроме того, если среднее значение из повторных тестовых образцов меньше 5, но один или несколько образцов дали гемолитический индекс больше 5, то испытание следует повторить с удвоенным количеством испытуемых образцов. Если гемолитический индекс исследуемого материала выше гемолитического индекса отрицательного контроля в диапазоне от 0 до 2%, то материал не является гемолитически активным. Если гемолитический индекс исследуемого материала выше гемолитического индекса отрицательного контроля в диапазоне от 2 до 5%, то материал считают, что материал проявляет слабую гемолитическую активность. При гемолитическом индексе исследуемого материала выше 5% материал признается гемолитически активным.
Для проведения испытания, предполагающего контакт исследуемого образца с кровью, подготавливают по три аналогичных образца исследуемого материала, материала положительного контроля и материала - отрицательного контроля, руководствуясь нижеприведенной таблицей. Подготовка образцов материала, аналогична описанному выше способу для проведения испытания, не предполагающего прямой контакт исследуемого материала с кровью.

Образцы разрезают на соответствующие кусочки. Переносят каждый из трех неэкстрагированных образцов, включая испытуемые и контрольные образцы в отдельные пробирки. Рекомендуемый размер пробирки составляет 16×125 мм. Однако, размер пробирки может быть другим, но обязательным условием является покрытие образца 7,0 мл раствора PBS. Приливают по 7,0 мл PBS в каждую пробирку, содержащую неэкстрагированные образцы. Параллельно готовят три пробирки только с 7,0 мл раствора PBS которые служат в качестве холостых проб. В каждую пробирку добавляют по 1,0 мл разведенной раствором PBS крови кролика, с содержанием гемоглобина 10±1 мг/мл. Процесс разведения крови аналогичен, описанному выше при подготовке крови к исследованию не предусматривающему прямой контакт материала с кровью. После этого все пробирки инкубируют на водяной бане не менее 3 часов при температуре 37°С. Осторожно переворачивайте каждую пробирку дважды примерно каждые 30 мин. В некоторых случаях для образцов со сложной конфигурацией, допускается большее количество. По окончании указанного времени инкубации переносят жидкость в подходящую пробирку и центрифугируют при 700-800 G в течение 15 минут в стандартной клинической центрифуге. Надосадочную жидкость анализируют на содержание гемоглобина, как указано выше при описании процесса анализа образца, не предполагающего его прямой контакт с кровью. Обработка результатов аналогична описанной выше для процесса анализа образца, не предполагающего его прямой контакт с кровью.
К недостаткам способа можно отнести следующее: Способ сложен для реализации, поскольку предполагает определения концентрации гемоглобина в крови, построения калибровочной зависимости, использование химических реагентов для определения концентрации гемоглобина, необходимость применения образцов полимера, с известными гемолитическими свойствами в качестве положительного и отрицательного контроля; неопределенность точного времени инкубирования анализируемых образцов в крови (не менее 3 часов), что может привести к получению различных результатов анализа одного и того же образца при различном времени его инкубирования с кровью, кроме этого недостатком является и то, что нет доказательства, того что при более продолжительном времени инкубирования образцов чем выбранное, определенный процент гемолиза не будет иметь более высокие значения и, следовательно, вывод о гемолитической активности материала может быть ошибочным; использование крови кролика, а не человека. Недостатком теста, не предполагающего прямой контакт образца с кровью, является то, что не только экстрагируемые вещества, но и сам образец может вызывать гемолиз.
Известен способ оценки гемолитической активности полимерного материала [Tavakalyan, N.B. Influence of unsaturated carbonic acids on hemocom-patibility and cytotoxicity of poly-vinylacetate based co-polymers / N.B. Tavakalyan, A.G. Karapetyan // Journal of materials science: materials in medicine. -2010. - Vol. 21, №5. - P. 1693-1702. DOI 10.1007/s10856-010-4020-х]. Согласно этому способу гемолиз под действием материала измеряют при прямом контакте его с кровью. Кровь получают от здорового добровольца (50 лет). Изучаемые образцы тщательно промывают и инкубируют в 10 мл физиологического раствора (37°С, 30 мин). Для исследования готовят по 200 мл смеси крови и цитратного буфера в соотношении кровь:цитратный буфер 9:1. Цитратный буфер состоит из 3,8% масс. цитрата натрия, смешанного с 0,85% масс. натрия хлористый. Изучаемые образцы инкубируют в этой смеси при 37°С в течение 4 часов. После инкубации отбирают аликвоты и центрифугируют для осаждения эритроцитов (3000 об/мин, 15 мин). Затем измеряют оптическую плотность супернатанта с помощью фотоколориметра (КФК-2-УХЛ4.2, Россия) при 540 нм. Процент гемолиза рассчитывают по формуле:
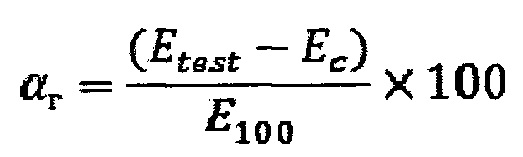
где αг - процент гемолиза, Etest - оптическая плотность исследуемого образца, Ес - оптическая плотность контроля, Е100 - оптическая плотность образца, демонстрирующего 100% гемолиз. Образцы считают гемосовместимыми, если степень гемолиза не превышает 2%.
Недостатками способа являются: отсутствие указания на площадь поверхности исследуемого образца. При изменении площади поверхности исследуемого образца, при прочих равных условиях, возможно получение различных результатов анализа. Не указано что является контрольным образцом и образцом со 100%-м гемолизом, нет доказательства, что при более продолжительном времени инкубирования образцов в смеси крови с цитратным буфером определенный процент гемолиза не будет иметь более высокие значения. Предварительное инкубирование образцов в физиологическом растворе перед их инкубированием в смеси крови с цитратным буфером может приводить к экстракции компонентов материала, проявляющих, в том числе и гемолитическую активность, что может привести к заниженным значениям определенного процента гемолиза. Использование крови, а не суспензии промытых эритроцитов является недостатком, поскольку количество жизнеспособных эритроцитов отличается в зависимости от используемой крови, условий ее транспортировки, хранения. Оптическая плотность супернатанта может зависеть не только от концентрации гемоглобина, но и от наличия других компонентов, например веществ, экстрагированных из материала или растворившаяся или диспергированная часть самого исследуемого материала. В приведенном способе не предусмотрен учет влияния этого на результат.
Известен способ оценки гемолитической активности коронарных стен-тов с полимерным покрытием [Jin-ZhouZhu, Xiao-WeiXiong, RunDu, Ya-JunJing, YuanYing, Xiao-MingFan, Tian-QiZhu, Rui-Yan Zhang Hemocompatibility of drug-eluting coronary stents coated with sulfonated poly (styrene-block-isobutylene-block-styrene). Biomaterials. 33. 2012. 8204-8212. doi. 10.1016/j.biomaterials.2012.07.066]. Согласно этому способу исследуемый стент с полимерным покрытием помещают во флакон с плоским дном. Затем во флаконы наливали 10 мл физиологического раствора и выдерживают при 37°С на водяной бане-качалке в течение 60 мин. После этой инкубации во флаконы добавляют смесь, состоящую из цельной крови, физиологического раствора и кислотно-цитратного декстрозного антикоагулянта (ACD). После этого исследуемые объекты инкубируют еще 60 мин. Далее растворы центрифугируют без исследуемого продукта при 1000 g в течение 5 мин. Поглощение супернатанта измеряют спектрофотометрически при длине волны 542 нм. Коэффициент гемолиза (HR) рассчитывают по уравнению:

где AS - поглощение супернатанта образца, АР и AN - поглощение положительного контроля (10 мл стерильной дистиллированной воды +0,2 мл разбавленный ACD - цельная кровь) и отрицательный контроль (10 мл физиологического раствора +0,2 мл разведенного ACD - цельная кровь) соответственно. Недостатком этого способа является то, что не указана концентрация разведенной крови, взятой для анализа. Отсутствие указания на площадь поверхности материала, от которой, как сказано ранее, может зависеть результат исследования. Это ограничивает круг применимости способа, поскольку, в случае исследования другого полимера на основании приведенной методики трудно рассчитать количество полимера, необходимое для анализа. Другой недостаток заключается в том, что нет доказательства того, что при более продолжительном времени инкубирования образцов определенный процент гемолиза не будет иметь более высокие значения и, следовательно, вывод о гемолитической активности материала может быть ошибочным. Еще одним недостатком является отсутствие описания природы крови, что может оказать влияние на конечный результат анализа. В приведенном способе не предусмотрен учет влияния оптической плотности супернатанта от наличия других компонентов, например веществ, экстрагированных из материала или растворившаяся или диспергированная часть самого исследуемого материала на результат. В случае применения способа для исследования других полимерных материалов использование физиологического раствора, а не буферного раствора может оказаться недостатком, поскольку полимер или другие вещества в составе материала могут изменять рН среды и тем самым провоцировать гемолиз. В связи с этим, достоверность результатов, полученных по этому способу нельзя принять высокой. Кроме этого, не указано, что способ применим для анализа других полимеров и материалов.
Известен способ оценки гемолитической активности сополимера лактида с гликолидом, поли-1,8-октандиолцитрата и политетрафторэтилена [DelaraMotlagh, JosephineAllen, RyanHoshi, JianYang, KarenLui, GuillermoAmeer. Hemocompatibility evaluation of poly(diol citrate) in vitro for vascular tissue engineering. Journal of Biomedical Materials Research Part A. 2007. p.907-917. DOI: 10.1002/jbm.a.31211]. Для исследования гемолитического действия полимерами готовят диски диаметром 10 мм и толщиной 0,8 мм из предварительно сформированных пленок соответствующих полимеров. Приготовленные диски помещают в чистые конические пробирки на 1,5 мл. Антикоагулированную кровь (кислотно-цитратного декстрозного антикоагулянта (ACD)) добровольцев, объемом 200 мкл разбавляют в 10 мл 0,9% физиологического раствора) и добавляли в пробирку (200 мкл на пробирку). В качестве положительного контроля гемолиза 200 мкл крови разводят в стерильной дистиллированной воде; в то время как разведенная физиологическим раствором кровь, добавленная в пустую пробирку, служит отрицательным контролем. Разведенную кровь инкубируют с образцами при слабом перемешивании в течение 2 ч при 37°С. Затем образцы удаляют и каждую пробирку центрифугируют при 1000 g в течение 10 мин. Супернатант из каждой пробирки переносят в лунку на 96-луночном планшете, где измеряют поглощение при 545 нм. Процент гемолиза рассчитывают следующим образом:
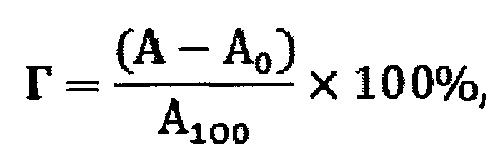
Где А - абсорбция исследуемого образца, А0 - абсорбция отрицательного контроля, А100 - абсорбция положительного контроля
Недостатком является то, что нет доказательства, что при более продолжительном времени инкубирования образцов (более 2 часов) определенный процент гемолиза не будет иметь более высокие значения и, следовательно, вывод о гемолитической активности материала может быть ошибочным. Еще одним недостатком является отсутствие описания природы крови, что может оказать влияние на конечный результат анализа. Использование крови, а не суспензии промытых эритроцитов является недостатком, поскольку количество жизнеспособных эритроцитов отличается в зависимости от используемой крови, условий ее транспортировки, хранения. В приведенном способе не предусмотрен учет влияния оптической плотности супернатанта от наличия других компонентов, например веществ, экстрагированных из материала или растворившаяся или диспергированная часть самого исследуемого материала на результат. В случае применения способа для исследования других полимерных материалов использование физиологического раствора, а не буферного раствора может оказаться недостатком, поскольку полимер или другие вещества в составе материала могут изменять рН среды и тем самым провоцировать гемолиз. В связи с этим, достоверность результатов, полученных по этому способу нельзя принять высокой. Кроме этого, не указано, что способ применим для анализа других полимеров и материалов, например, из которых нельзя сформировать диски указанных размеров описанным способом.
Известен способ оценки гемолитической активности целлюлозной пленки [GourisankarRoymahapatra, DebasisDe, SantanabGiri, San-tiM.Mandal.Microstructure and Thermal Behavior of a Biocompatible Naturally Occurring Novel Cellulose Film.Int.J.HIT.TRANSC:ECCN. Vol. 4: Issue 1A. 2018. р. 8-15]. Согласно способу, для исследования берут образцы пленок массой 0,051 г, толщиной 0,008 мм. Перед исследованием гемолитической активности образцы помещают в 6 мл дистиллированной воды и оставляют набухать в течение 24 часов. Затем образцы вынимают и сушат при температуре (30±2)°С и относительной влажности (60±4) % в течение 48 ч. Кровь для исследования получают от 6-недельных мышей-самцов BALB/c. Из забранной крови получают эритроциты путем центрифугирования (1500 g, 5 мин и 4°С). Собранные эритроциты разводят в 20 мм забуференного физиологического раствора HEPES (рН 7,4) до концентрации 5%. Полученную суспензию эритроцитов добавляют к забуференному HEPES физиологическому раствору (отрицательный контроль, характеризующийся 0% лизисом эритроцитов), к 1,0% раствору Triton Х-100 (положительный контроль, характеризующийся 100% лизисом эритроцитов) и к анализируемому образцу пленки. Инкубируют в течение 30 мин и 60 мин при 37°С. После этого центрифугируют при 12000 об/мин и 4°С. Супернатанты переносят на 96-луночный планшет.Гемолитическую активность определяют путем измерения поглощения при 570 нм с использованием прибора Biorad 5804R. В эксперименте использовали контрольные образцы с 0%-ным лизисом (в буфере HEPES) и 100%-ным лизисом (в 1% Triton Х-100) (2). Все анализы выполняют в трех повторениях. Гемолитический эффект выражают в процентах лизиса эритроцитов, определяемых как: [(образцы Abs570)/ (Abs570 положительного контроля] × 100, где Abs - коэффициент поглощения.
Недостатками предложенного способа являются: использование эритроцитов крови мышей, не указано после какого времени инкубирования гемолитический эффект выражают в процентах лизиса эритроцитов, следует принимать за гемолитическую активность материала, отсутствует процедура отмывки эритроцитов, что влияет на результаты анализа. Предварительное набухание материала в воде и последующее его высушивание перед проведением анализа на гемолитическую активность является недостатком, если материал не предполагает такой обработки перед применением. Кроме этого недостатком является и то, что нет доказательства, того что при более продолжительном времени инкубирования образцов чем выбранное, определенный процент гемолиза не будет иметь более высокие значения и, следовательно, вывод о гемолитической активности материала может быть ошибочным. В приведенном способе не предусмотрен учет влияния оптической плотности супернатанта от наличия других компонентов, например веществ, экстрагированных из материала или растворившаяся или диспергированная часть самого исследуемого материала на результат. Еще недостатком является отсутствие информации о соотношении суспензии эритроцитов к забуференному HEPES физиологическому раствору и к 1,0% раствору Triton Х-100 при приготовлении проб. К недостаткам способа можно отнести и использование сложного и малораспространенного в аналитических лабораториях оборудования, что ограничивает его применение.
Известен способ оценки гемолитического действия полимерных пленок на основе поливинилового спирта [Dilshad Qureshi, Ayasharani Sahoo, Biswaranjan Mohanty, Arfat Anis, Viktoryia Kulikouskaya, Kseniya Hileuskaya, Vladimir Agabekov, Preetam Sarkar, Sirsendu Sekhar Ray, Samarendra Maji, Kunal Pal. Fabrication and Characterization of Poly (vinyl alcohol) and Chitosan Oligosaccharide-Based Blend Films. Gels. 2021. 7. 55. P. 1-23. DOI: 10.3390/gels7020055]. Для этой цели свежую козью кровь собирают в присутствии цитрата натрия в качестве антикоагулянта. Образцы пленки 2×2 см и толщиной в диапазоне от 0,13 до 0,18 мм уравновешивают в 10 мл физиологического раствора (0,9%) в течение 1 ч при 37°С. После этого 0,5 мл уравновешенной среды инкубировали с 0,5 мл разбавленной крови (4 мл цитратной крови и 5 мл физиологического раствора), и конечный объем доводят до 10 мл физиологического раствора. Положительный контроль получают путем смешивания 0,5 мл 0,1 NHCl (используемого вместо тестируемого образца) с 0,5 мл разбавленной крови, которую затем разбавляли до 10 мл с использованием обычного физиологического раствора. Отрицательный контроль готовят путем смешения 0,5 мл разбавленной крови и 9,5 мл обычного физиологического раствора. Испытуемые образцы вместе с положительным и отрицательным контролем инкубируют при 37°С в течение 1 ч. После этого образцы центрифугируют при 3000 об/мин в течение 10 мин. Оптическую плотность супернатанта определяют при 545 нм с использованием спектрофотометра (Shimadzu-1700, Токио, Япония). Испытание проводят в трех экземплярах для каждого образца. Процент гемолиза рассчитывали с использованием уравнения:

где AS - поглощение супернатанта образца, АР и AN - поглощение положительного контроля и отрицательный контроль соответственно.
Недостатком является то, что нет доказательства, что при более продолжительном времени инкубирования образцов (более 1 часа) определенный процент гемолиза не будет иметь более высокие значения и, следовательно, вывод о гемолитической активности материала может быть ошибочным. Еще одним недостатком является использование козьей крови. Использование крови, а не суспензии промытых эритроцитов является недостатком, поскольку количество жизнеспособных эритроцитов отличается в зависимости от используемой крови, условий ее транспортировки, хранения. Без этого способ не применим для не образующих пленок полимеров. В случае применения способа для исследования других полимерных материалов использование физиологического раствора, а не буферного раствора может оказаться недостатком, поскольку полимер или другие вещества в составе материала могут изменять рН среды и тем самым провоцировать гемолиз. В приведенном способе не предусмотрен учет влияния оптической плотности супернатанта от наличия других компонентов, например веществ, экстрагированных из материала или растворившаяся или диспергированная часть самого исследуемого материала на результат. В связи с этим, достоверность результатов, полученных по этому способу нельзя принять высокой.
Известен способ оценки гемолитического действия материала на основе шелка, модифицированного гепарином [Tanrada Fungmongkonsatean, Jirapas Jongjitwimol, Pussadee Paensuwan, Teonchit Nuamchit, Duangduan Siriwit-tayawan, Sorada Kanokpanont, Siriporn Damrongsakkul, Piyanuch Thitiwuthikiat. Hemocompatibility Evaluation of Thai Bombyxmori Silk Fibroin and Its Improvement with Low Molecular Weight Heparin Immobilization. Polymers. 2022. 14. 2943. DOI:10.3390/polyml4142943]. Для реализации способа готовят исследуемые образцы в виде пленок размером 1×1 см2. Эритроциты предварительно инкубируют при 37°С в течение 30 мин и разбавляют обычным физиологическим раствором в соотношении 1:1. Исследуемые образцы предварительно инкубируют с натрий-фосфатным буфером (PBS) при 37°С в течение 5 мин. После этого PBS заменяют разбавленными эритроцитами и инкубируют при 37°С в течение 1 ч. В качестве отрицательного и положительного контроля используют обычный физиологический раствор и дистиллированную воду соответственно. После инкубирования образцы центрифугируют при 2500 об/мин, 4°С в течение 5 мин. После этого, супернатанты, содержащие лизаты эритроцитов анализируют спектрофотометрически при 545. Процент гемолиза рассчитывают в соответствии со следующим уравнением:

где AS - поглощение супернатанта образца, АР и AN - поглощение положительного контроля и отрицательный контроль соответственно.
Недостатком предложенного способа является неизвестная история получения и хранения эритроцитов крови, что может оказать существенное влияние на результаты анализа. Предварительное инкубирование материала в PBS перед проведением анализа на гемолитическую активность является недостатком, если материал не предполагает такой обработки перед применением. Недостатком является и то, что нет доказательства, того что при более продолжительном времени инкубирования образцов чем 1 час, определенный процент гемолиза не будет иметь более высокие значения и, следовательно, вывод о гемолитической активности материала может быть ошибочным. В приведенном способе не предусмотрен учет влияния оптической плотности супернатанта от наличия других компонентов, например веществ, экстрагированных из материала или растворившаяся или диспергированная часть самого исследуемого материала на результат.
Наиболее близким к предлагаемому изобретению является способ оценки гемолитической активности полимерных микротрубок [Бабичева Т.С.Физико-химические основы получения микротрубок хитозана. дисс. канд. хим. наук. Саратов, 2022. 174 с.]. Биоматериалом для получения эритроцитов служит венозная кровь здоровых доноров. В качестве антикоагулянта применяют 0.147 моль/л раствор цитрата натрия (рН=7.8). Для приготовления суспензии эритроцитов к цельной донорской крови с антикоагулянтом добавляют трехкратный объем стерильного физиологического раствора (0.154 моль/л), центрифугируют со скоростью вращения ротора 1000 об/мин на центрифуге-встряхивателе СМ-70М-07 SIA «ELMI» (Латвия) в течение 10 мин. Процедуру повторяют трижды. Затем удаляют супернатант и по 500 мкл суспензии эритроцитов ресуспендируют в 50 мл физиологического раствора или дистиллированной воды. В стерильные чашки Петри вносят микротрубки с площадью поверхности 1 см2 и 4 мл суспензии эритроцитов. Отрицательным контролем служит суспензия эритроцитов в дистиллированной воде (100% гемолиз), положительным контролем - в физиологическом растворе (0% гемолиз). Чашки Петри с опытными и контрольными образцами инкубируют при 37°С на термошейкере BioSan PST 60HL (Латвия) в режиме встряхивания при 350 об/мин в течение 1 часа. Площадь поверхности опытных образцов должна составлять 1 см2. После инкубирования пробы центрифугируют и измеряют оптическую плотность супернатанта на планшетном фотометре StatFax 4200 AwarenessTechnology (США) при λ=545 нм. Для количественной оценки гемолитической активности тестируемого образца рассчитывают степень гемолиза (Г, %) по соотношению:
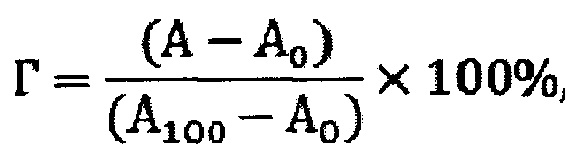
где А, А0 и А100 - оптическая плотность супернатанта тестируемой системы,
суспензии в физиологическом растворе и дистиллированной воде.
Тестируемый образец считают гемосовместимым при условии Г<5%.
Недостатком является то, что нет доказательства, что при более продолжительном времени инкубирования образцов (более 1 часа) определенный процент гемолиза не будет иметь более высокие значения и, следовательно, вывод о гемолитической активности материала может быть ошибочным. На примере нескольких полимеров нами экспериментально установлено, что определяемые значения гемолиза могут в большей или меньшей степени зависеть от времени инкубирования. В связи с этим, достоверность результатов, полученных по этому способу нельзя принять высокой. Недостатком является то, что метод предполагает исследование опытных образцов с площадью поверхности, равной 1 см2. В некоторых случаях приготовление опытных образцов с площадью поверхности, равной 1 см2, затруднительно или невозможно, следовательно это усложняет процесс исследования и ограничивает область применения способа. Недостатком является использования термошейкера и планшетного фотометра, что повышает требования к материальной базе исследовательской лаборатории и, следовательно, ограничивает круг потенциальных пользователей способа. В приведенном способе не предусмотрен учет влияния оптической плотности супернатанта от наличия других компонентов, например веществ, экстрагированных из материала или растворившаяся или диспергированная часть самого исследуемого материала на результат. В случае применения способа для исследования других полимерных материалов использование физиологического раствора, а не буферного раствора может оказаться недостатком, поскольку полимер или другие вещества в составе материала могут изменять рН среды и тем самым провоцировать гемолиз. Реализацию режима встряхивания в процессе инкубирования можно признать недостатком, усложняющим процесс, поскольку из уровня техники известны примеры проведения исследования в статических условиях. Еще недостатком, усложняющим процесс, является добавление физиологического раствора перед получением эритроцитов из цельной крови. Нами установлено, что при центрифугировании цельной крови при 3000 оборотах в минуту в течение 5 минут эритроцитарная масса прекрасно отделяется в осадок без предварительного добавления в кровь физиологического раствора. Недостатком является и способ расчета гемолиза. Поскольку гемолиз - это процесс разрушения эритроцитов с выбросом гемоглобина, в данном случае под действием исследуемого образца, то логично было бы его рассчитывать как отношение оптической плотности супернатанта, обусловленной только выделившимся из эритроцитов гемоглобином под действием исследуемого образца к оптической плотности супернатанта в случае 100% гемолиза и умноженное на 100. Анализируя условия способа можно заключить, что отношение площади поверхности опытных образцов к объему суспензии эритроцитов составляет  или 0,25. Гематокрит используемой суспензии эритроцитов равен 1%.
или 0,25. Гематокрит используемой суспензии эритроцитов равен 1%.
Все известные из уровня техники способы определения гемолитической активности полимерных материалов имеют недостатки, не позволяющие, либо воспроизвести исследование, либо проводить исследования в плохо оснащенных лабораториях, либо не являются универсальными для определения гемолитической активности любых полимеров в конденсированном состоянии. К недостаткам практически всех способов, за исключением, например [Методика определения гемолитического действия полимерных материалов и изделий "ин витро" (утв. Минздравом СССР 27.11.1985)] можно отнести отсутствие требований к оптической плотности супернатанта суспензии эритроцитов, полученного в случае 100%-го гемолиза эритроцитов. Это является важным условием, поскольку диапазон измерения оптической плотности у приборов различен. Способ будет более прост для реализации, иметь больший круг потенциальных пользователей, который предполагает использование суспензии эритроцитов с концентрациями, при которых оптическая плотность супернатанта, полученного в случае 100%-ного гемолиза эритроцитов, не будет превышать 1, поскольку это условие позволит проводить исследования с использованием приборов, не позволяющих с достаточной точностью измерять оптическую плотность при ее значениях много больше 1. Кроме этого, во всех известных способах принято фиксированное время инкубирования исследуемых образцов с суспензией эритроцитов или приводится достаточно узкий временной диапазон, не позволяющий установить максимальное (равновесное) значение гемолиза под действием материала. Под понятием «равновесное значение гемолиза» следует понимать максимальное значение гемолиза под действием исследуемого полимера, полимерного материала или изделия из него, не изменяющееся с увеличением времени инкубирования.
Техническим результатом настоящего изобретения является разработка способа оценки гемолитического действия полимеров, полимерных материалов и изделий из них ин витро в статических условиях, заключающегося в универсальности, простоте способа, повышении достоверности результатов определения гемолитической активности полимеров, полимерных материалов и изделий из них ин витро за счет определения максимальных и не изменяющихся при увеличении времени инкубирования значений, расширении круга потенциальных пользователей способа.
Технический результат достигается тем, что предлагается способ оценки гемолитической активности полимеров, полимерных материалов и изделий из них, находящихся в твердом агрегатном состоянии ин витро, включающий использование крови человека, взятой у здорового донора не моложе 18 лет и не старше 60 лет, воздерживающегося от курения, приема алкоголя, наркотических и лекарственных средств, с добавлением раствора антикоагулянта цитрата, с концентрацией 3,8 мас. % в объемном соотношении кровь:раствор антикоагулянта, равном 9:1, приготовление эритроцитарной массы путем цетрифугирования крови при скорости вращения 3000 оборотов в минуту в течение 5 минут, с последующим отделением эритроцитов, их трехкратной отмывкой фосфатно-солевым буферным раствором со значением рН, равным 7,4, инкубирование в статических условиях, при 37°С не менее чем по три параллельных образца: образцов исследуемого материала при отношении их площади поверхности к объему суспензии эритроцитов, равной 0,25, при гематокрите суспензии эритроцитов в диапазоне от 0,8 до 1%, приготовленной с использованием фосфатно-солевого буферного раствора со значением рН, равным 7,4, образцов положительного контроля, представляющих собой суспензию эритроцитов человека с гематокритом в диапазоне от 0,8 до 1%, приготовленную на дистиллированной воде, образцов отрицательного контроля, представляющих собой суспензию эритроцитов человека с гематокритом в диапазоне от 0,8 до 1%, приготовленной с использованием фосфатно-солевого буферного раствора со значением рН, равным 7,4, с последующим цетрифугированием образцов при скорости вращения 3000 оборотов в минуту в течение 5 минут, измерением фотометрически оптической плотности супернатантов при длине волны 540 нм и расчет гемолиза в процентах.
Отличительными особенностями предлагаемого способа является то, что параллельно инкубируют не менее трех образов исследуемого материала при 37°С в фосфатно-солевом буферном растворе со значением рН, равным 7,4, при соотношении их площади поверхности к объему фосфатно-солевого буферного раствора, равной 0,25, с последующим цетрифугированием образцов при скорости вращения 3000 оборотов в минуту в течение 5 минут, измерением фотометрически оптической плотности супернатантов при длине волны 540 нм и учете ее при расчете гемолиза, время инкубирования исследуемых образцов, образцов положительного и отрицательного контролей составляет от 2 до 24 часов, за значение гемолиза принимают средний максимальный процент гемолиза эритроцитов человека в присутствии образца материала, полученный из параллельных опытов и не изменяющийся при увеличении времени инкубирования образцов на 1 час или рассчитанный по зависимости гемолиза от времени инкубирования, если полученное значение гемолиза после 24 часов инкубирования образцов больше значения гемолиза, полученного после 23 часов инкубирования образцов.
Примеры
Пример 1. Для исследования гемолитического действия полимера осуществляют забор крови у здоровых доноров не моложе 18 лет и не старше 60 лет, воздерживающихся от курения, приема алкоголя, наркотических и лекарственных средств. Забор крови осуществляют в стандартные вакуумные пробирки с антикоагулянтом. В качестве антикоагулянта используют раствор цитрата натрия концентрацией 3,8% и так, чтоб объемное соотношение кровь:раствор цитрата натрия составило 9:1. После забора крови, до использования ее в исследованиях, при необходимости осуществляют ее хранение при контролируемой температуре в диапазоне от +2°С до +6°С и транспортировку продолжительностью не более 24 часов в контейнере при температуре не превышающей +10°С.
Для получения эритроцитов кровь помещают в центрифужные пробирки и центрифугируют на лабораторной центрифуге со скоростью вращения ротора 3000 оборотов в минуту в течение 5 мин. После этого удаляют супернатант. Полученную эритроцитарную массу трижды отмывают. Для отмывки полученной эритроцитарной массы к ней добавляют фосфатно-солевой буферный раствор с рН=7,4 (PBS) в объемном соотношении эритроцитарная масса: физиологический раствор, равном 1:9 и центрифугируют на лабораторной центрифуге со скоростью вращения ротора 3000 об/мин в течение 5 мин с последующим удалением супернатанта. Процедуру проводят трижды. К отмытым эритроцитам приливают фосфатно-солевой буферный раствор с рН=7,4 до гематокрита 5%. Полученную суспензию используют для исследования. В пробирках готовят четыре вида образцов:
первый вид - образцы, содержащие исследуемый полимер, и суспензию эритроцитов с гематокритом 0,8% в фосфатно-солевом буферном растворе с рН=7,4;
второй вид - образцы исследуемого полимера в фосфатно-солевом буферном растворе с рН=7,4;
третий вид - образцы отрицательного контроля, состоящие из суспензии эритроцитов с гематокритом 0,8% в фосфатно-солевом буферном растворе с рН=7,4;
четвертый вид - образцы положительного контроля со 100% гемолиза.
Шесть образцов первого вида готовят следующим образом. Образец исследуемого полимера с известной площадью поверхности или несколько образцов полимера с известной суммарной площадью поверхности помещают в пробирки типа Эппендорф, объемом 5 мл. Готовят суспензию эритроцитов с гематокритом 0,8% путем разведения суспензии эритроцитов с гематокритом 5% фосфатно-солевым буферным раствором с рН=7,4 и приливают ее в пробирки с образцами. Суспензию эритроцитов с гематокритом 0,8% приливают в пробирки с образцом полимера. При выборе размера образца или образцов полимера, количества приливаемой суспензии эритроцитов руководствуются следующим: заполнение пробирки должно быть не более чем на 80%, So/Vc=0,25, где So - площадь поверхности образца или суммарная площадь поверхности образцов, Vc -объем суспензии эритроцитов с гематокритом 0,8%.
Готовят шесть образцов второго вида. Для этого образец исследуемого полимера с известной площадью поверхности или несколько образцов полимера с известной суммарной площадью поверхности помещают в пробирки типа Эппендорф, объемом 5 мл и добавляют фосфатно-солевой буферный раствор с рН=7,4. При выборе размера образца или образцов полимера, количества приливаемого фосфатно-солевого буферного раствора руководствуются следующим: заполнение пробирки должно быть не более чем на 80%, So/Vб=0,25, где So - площадь поверхности образца или суммарная площадь поверхности образцов, Vб -объем фосфатно-солевого буферного раствора с рН=7,4.
Готовят шесть образцов третьего типа (отрицательного контроля). Для этого в пробирках типа Эппендорф, объемом 5 мл готовят суспензию эритроцитов с гематокритом 0,8% в фосфатно-солевом буферном растворе с рН=7,4. Для этого смешивают исходную суспензию эритроцитов с гематокритом 5% с фосфатно-солевым буферным раствором с рН=7,4. Объем полученной суспензии эритроцитов не должен превышать 80% от объема пробирки.
Готовят шесть образцов четвертого типа (положительного контроля). Для этого в пробирках типа Эппендорф, объемом 5 мл готовят суспензию эритроцитов с гематокритом 0,8% в дистиллированной воде. Для этого смешивают исходную суспензию эритроцитов с гематокритом 5% с дистиллированной водой. Объем полученной суспензии эритроцитов не должен превышать 80% от объема пробирки.
Все приготовленные образцы инкубируют 2 часа при температуре, равной 37°С. После двух часов инкубирования по три образца первого, третьего и четвертого видов центрифугируют на лабораторной центрифуге со скоростью вращения ротора 3000 оборотов в минуту в течение 5 минут. У супернатантов и у жидкости образцов второго вида измеряют оптическую плотность с использованием спектрофотометра при длине волны 540 нм. В качестве раствора сравнения используют фосфатно-солевой буферный раствор с рН=7,4. Процент гемолиза рассчитывают, используя следующее уравнение:
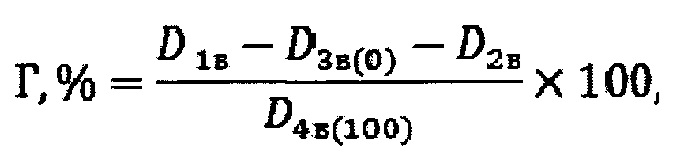
где: Г, % - гемолиз, D1в - оптическая плотность супернатанта образца первого вида, D2в - оптическая плотность супернатанта образца второго вида, D3в(o) - оптическая плотность супернатанта образца третьего вида (отрицательный контроль), (D4в(100) - оптическая плотность супернатанта образца
четвертого вида (положительный контроль). Вычисляют среднее значение гемолиза и стандартную ошибку среднего известным способом. Если полученный процент гемолиза ≥5 исследование останавливают. Образец признают гемолитически активным. Если процент гемолиза <5, то образцы (по три каждого вида) не подвергавшиеся центрифугированию продолжают инкубировать еще один час так, чтоб суммарное время инкубирования при 37°С составило три часа. После трех часов инкубирования по три образца первого, третьего и четвертого видов центрифугируют на лабораторной центрифуге со скоростью вращения ротора 3000 оборотов в минуту в течение 5 минут. У супернатантов образцов первого, третьего и четвертого видов и у жидкости образцов второго вида измеряют оптическую плотность с использованием спектрофотометра при длине волны 540 нм. Гемолиз рассчитывают по вышеприведенной формуле. Вычисляют среднее значение гемолиза и стандартную ошибку среднего известным способом. Если полученный Г≥5 исследование останавливают. Образец признают гемолитически активным. Если Г<5, то его сравнивают с Г, полученным после двух часов инкубирования образцов. Сравнение осуществляют с помощью t-критерия Стьюдента. Уровень значимости принимают 0,05. Если Г рассчитанный после трех часов инкубирования исследуемого полимера не увеличился по сравнению с Г, полученным после двух часов инкубирования и его значение <5, то исследование останавливают и признают полимер негемолитическим. Если Г рассчитанный после трех часов инкубирования исследуемого полимера ≥5, то исследование останавливают и признают полимер гемолитически активным. Если Г, рассчитанный после трех часов инкубирования исследуемого полимера увеличился по сравнению с Г, полученным после двух часов инкубирования, при этом его значение <5, то исследование продолжают. Для этого готовят дополнительную серию образцов по три образца первого, второго, третьего и четвертого видов и инкубируют их при 37°С на один час дольше предыдущего, т.е. четыре часа. После четырех часов инкубирования образцы центрифугируют, анализируют и рассчитывают Г аналогично образцам после двух и трех часов инкубирования. Полученный Г сравнивают с Г, полученным после трех часов инкубирования. Сравнение, интерпретацию результатов и принятие решения об окончании или продолжении исследования осуществляют аналогично сравнению значений гемолиза, полученных после двух и трех часов инкубирования полимера. В случае принятия решения о продолжении исследования время инкубирования каждой новой серии образцов увеличивают на один час, а значения Г сравнивают со значениями Г серии образцов, инкубированной на один час меньше. При этом максимальное время инкубирования образцов не может превышать более 24 часов. В случае, если Г возрастает с увеличением времени инкубирования и по достижению 24 часов инкубирования полученное значение Г больше значения Г, полученного после 23 часов инкубирования и при этом Г<5 то значение Г после 25 часов инкубирования прогнозируют. Для прогнозирования значения Г после 25 часов инкубирования на основе полученных экспериментальных значений строят зависимость Г от времени инкубирования образцов. По зависимости Г от времени инкубирования, используя общеизвестные способы, рассчитывают Г после 25 часов инкубирования. Если рассчитанное значение Г после 25 часов инкубирования <5, то исследуемый полимер признают негемолитическим. Если рассчитанное значение Г после 25 часов инкубирования ≥5, то исследуемый полимер признают гемолитически активным.
Пример 2
Отличается от примера 1 тем, что в образцах первого, третьего и четвертого вида используют суспензию эритроцитов с гематокритом 1%.
Пример 3
Отличается от примера 1 тем, что в образцах первого, третьего и четвертого вида используют суспензию эритроцитов с гематокритом более 0,8% и менее 1%.
Пример 4
Отличается от примеров 1,2,3 тем, что исследования проводят в центрифужных пробирках, объемом 10 мл. Пример 5.
Отличается от примеров 1,2,3,4 тем, что исследования проводят в центрифужных пробирках объемом 15 мл.
Технический результат заключается в универсальности, простоте способа, повышении достоверности результатов определения гемолитической активности полимеров, полимерных материалов и изделий из них ин витро за счет определения максимальных и не изменяющихся при увеличении времени инкубирования значений.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ОПРЕДЕЛЕНИЯ ОСМОТИЧЕСКОЙ РЕЗИСТЕНТНОСТИ ЭРИТРОЦИТОВ | 2007 |
|
RU2328741C1 |
| СПОСОБ ЛАБОРАТОРНОЙ ДИАГНОСТИКИ ПАРОКСИЗМАЛЬНОЙ НОЧНОЙ ГЕМОГЛОБИНУРИИ | 2015 |
|
RU2574968C1 |
| Способ определения резистентности эритроцитов | 1987 |
|
SU1469464A1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ ЦИТОТОКСИЧНОСТИ МАЛОРАСТВОРИМЫХ ПРОИЗВОДСТВЕННЫХ ПЫЛЕЙ | 2011 |
|
RU2480751C1 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, СОДЕРЖАЩАЯ ЭРИТРОЦИТЫ, В КОТОРЫХ ЗАКЛЮЧЕН ФЕРМЕНТ, ЗАВИСИМЫЙ ОТ ПИРИДОКСАЛЬФОСФАТА, И ЕГО КОФАКТОР | 2015 |
|
RU2697086C2 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, СОДЕРЖАЩАЯ ЭРИТРОЦИТЫ, В КОТОРЫХ ЗАКЛЮЧЕН ФЕРМЕНТ, ЗАВИСИМЫЙ ОТ ПИРИДОКСАЛЬФОСФАТА, И ЕГО КОФАКТОР | 2015 |
|
RU2744659C2 |
| Способ выявления нестабильного гемоглобина в крови | 1987 |
|
SU1508168A1 |
| Способ определения резистентности эритроцитов | 1983 |
|
SU1178410A1 |
| СПОСОБ ОЦЕНКИ ОСМОТИЧЕСКОЙ РЕЗИСТЕНТНОСТИ ЭРИТРОЦИТОВ | 2009 |
|
RU2419792C1 |
| Скрининг-тест для определения функциональной активности системы комплемента крысы | 2022 |
|
RU2786208C1 |
Изобретение предназначено для оценки гемолитического действия полимеров, полимерных материалов и изделий из них, находящихся в твердом агрегатном состоянии, ин витро и может быть использовано в научно-исследовательских лабораториях и лабораториях предприятий при оценке гемолитического действия новых полимеров и полимерных материалов или при изменении сферы применения известного полимера или полимерного материала. Способ оценки включает инкубирование в статических условиях не менее чем по три параллельных образца 4 видов: образцов исследуемого материала первого вида, представляющих собой исследуемый полимер в суспензии эритроцитов при отношении их площади поверхности к объему суспензии эритроцитов, равном 0,25, при гематокрите суспензии эритроцитов в диапазоне от 0,8 до 1%, приготовленной с использованием фосфатно-солевого буферного раствора со значением рН, равным 7,4; образцов положительного контроля, представляющих собой суспензию эритроцитов человека с гематокритом в диапазоне от 0,8 до 1%, приготовленную на дистиллированной воде; образцов отрицательного контроля, представляющих собой суспензию эритроцитов человека с гематокритом в диапазоне от 0,8 до 1%, приготовленную с использованием фосфатно-солевого буферного раствора со значением рН, равным 7,4; и образцов исследуемого материала второго вида, представляющих собой образцы исследуемого полимера в фосфатно-солевом буферном растворе со значением рН, равным 7,4, при отношении их площади поверхности к объему фосфатно-солевого буферного раствора, равном 0,25. После инкубирования все образцы подвергают центрифугированию и измеряют фотометрически оптическую плотность супернатантов при длине волны 540 нм. Расчет гемолиза в процентах осуществляют по формуле. За значение гемолиза принимают средний максимальный процент гемолиза эритроцитов человека в присутствии образца материала, полученный из параллельных опытов и не изменяющийся при увеличении времени инкубирования образцов на 1 час или рассчитанный по зависимости гемолиза от времени инкубирования, если полученное значение гемолиза после 24 часов инкубирования образцов больше значения гемолиза, полученного после 23 часов инкубирования образцов. Способ является простым и обеспечивает повышение достоверности результатов определения гемолитической активности полимеров. 1 табл., 5 пр.
Способ оценки гемолитической активности полимеров, полимерных материалов и изделий из них, находящихся в твердом агрегатном состоянии, ин витро, включающий использование крови человека, взятой у здорового донора не моложе 18 лет и не старше 60 лет, воздерживающегося от курения, приема алкоголя, наркотических и лекарственных средств, с добавлением раствора антикоагулянта цитрата, с концентрацией 3,8 мас. % в объемном соотношении кровь : раствор антикоагулянта, равном 9:1, приготовление эритроцитарной массы путем центрифугирования крови при скорости вращения 3000 оборотов в минуту в течение 5 минут, с последующим отделением эритроцитов, их трехкратной отмывкой фосфатно-солевым буферным раствором со значением рН, равным 7,4, инкубирование в статических условиях при 37°С не менее чем по три параллельных образца: образцов исследуемого материала первого вида, представляющих собой исследуемый полимер в суспензии эритроцитов при отношении их площади поверхности к объему суспензии эритроцитов, равном 0,25, при гематокрите суспензии эритроцитов в диапазоне от 0,8 до 1%, приготовленной с использованием фосфатно-солевого буферного раствора со значением рН, равным 7,4, образцов положительного контроля, представляющих собой суспензию эритроцитов человека с гематокритом в диапазоне от 0,8 до 1%, приготовленную на дистиллированной воде, образцов отрицательного контроля, представляющих собой суспензию эритроцитов человека с гематокритом в диапазоне от 0,8 до 1%, приготовленную с использованием фосфатно-солевого буферного раствора со значением рН, равным 7,4, с последующим цетрифугированием образцов при скорости вращения 3000 оборотов в минуту в течение 5 минут, измерением фотометрически оптической плотности супернатантов при длине волны 540 нм и расчет гемолиза в процентах, отличающийся тем, что параллельно инкубируют при 37°С не менее трех образцов исследуемого материала второго вида, представляющих собой образцы исследуемого полимера в фосфатно-солевом буферном растворе со значением рН, равным 7,4, при отношении их площади поверхности к объему фосфатно-солевого буферного раствора, равном 0,25, с последующим цетрифугированием образцов при скорости вращения 3000 оборотов в минуту в течение 5 минут, измерением фотометрически оптической плотности супернатантов при длине волны 540 нм и учете ее при расчете гемолиза, используя следующее уравнение:
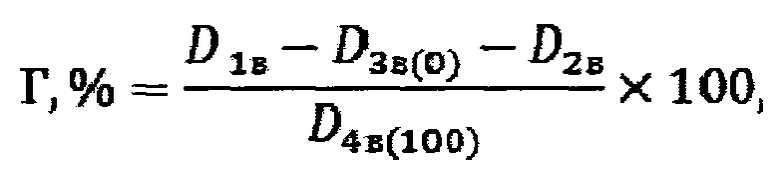
где: Г,% - гемолиз, D1B - оптическая плотность супернатанта образца первого вида, D2B - оптическая плотность супернатанта образца второго вида, D3B(0) -оптическая плотность супернатанта образца третьего вида (отрицательный контроль), D4B(100) - оптическая плотность супернатанта образца четвертого вида (положительный контроль), причем время инкубирования исследуемых образцов, образцов положительного и отрицательного контролей составляет от 2 до 24 часов, за значение гемолиза принимают средний максимальный процент гемолиза эритроцитов человека в присутствии образца материала, полученный из параллельных опытов и не изменяющийся при увеличении времени инкубирования образцов на 1 час или рассчитанный по зависимости гемолиза от времени инкубирования, если полученное значение гемолиза после 24 часов инкубирования образцов больше значения гемолиза, полученного после 23 часов инкубирования образцов.
| СПОСОБ ВЫПОЛНЕНИЯ ГЕМОЛИТИЧЕСКОГО ТЕСТИРОВАНИЯ КОНСТРУКЦИОННОГО СТОМАТОЛОГИЧЕСКОГО МАТЕРИАЛА | 2008 |
|
RU2392619C2 |
| CN 105092863 A, 25.11.2015 | |||
| Регулятор электрической дуги для прожектора | 1926 |
|
SU10993A1 |
| Оценка биологического действия медицинских изделий | |||
| Очаг для массовой варки пищи, выпечки хлеба и кипячения воды | 1921 |
|
SU4A1 |
| Исследования изделий, взаимодействующих с кровью | |||
| Москва, Стандартинформ, 2020 | |||
| Сборник руководящих методических материалов по токсиколого-гигиеническим исследованиям полимерных материалов | |||
Авторы
Даты
2024-04-23—Публикация
2023-03-09—Подача