Изобретение относится к медицинской иммунологии и может быть использовано для определения функциональной активности системы комплемента сыворотки крови крысы.
Система комплемента является частью иммунной системы и состоит из более чем 30 компонентов, которые действуют каскадным механизмом. Эта система играет ключевую роль, как в клиренсе иммунных комплексов, так и в иммунном ответе на инфекционные агенты, чужеродные антигены, опухолевые и вирус-инфицированные клетки. Система комплемента может активироваться тремя путями: классическим, альтернативным и лектиновым.
Классический путь является Са2+/Mg2+-завйсимым каскадом, который в норме активируется при формировании иммунного комплекса (ИК). Компонент С1, первый ферментный комплекс в каскаде, является пентамолекулярным комплексом. Включает одну молекулу C1q и по две молекулы С1 г и C1s. С1 комплекс связывается с Fc-фрагментом иммуноглобулинов в составе ИК через C1q и инициирует ферментативный каскад системы комплемента. Как только активируется С1 комплекс, C1s расщепляет компонент С4, приводя к образованию C4b, который затем связывает компонент С2. Иммобилизованный компонент С2 расщепляется при помощи фермента C1s с образованием С3-конвертазы (C4bC2a) классического пути.
Альтернативный путь является Mg2+- зависимым и активируется рядом разнообразных веществ, включающих полисахариды клеточных стенок дрожжей и бактерий, определенные биополимерные материалы. При иммобилизации C3b на поверхности на него садится фактор В, который под действием фермента, фактора D, расщепляется и образуется С3-конвертаза (C3bBb) альтернативного пути.
Пектиновый путь активирует комплемент при помощи маннан-связывающего дентина (МСЛ) и двух ассоциированных с ним сериновых протеаз (МАСП-1 и МАСП-2) (подобно с C1r и C1s в классическом пути активации комплемента). Как и в классическом пути активации комплемента, для лектинового пути также требуются компоненты С2 и С4. Активация лектинового пути приводит к формированию С3-конвертазы, аналогичной с С3-конвертазой классического пути (C4bC2a) [Ройт А., Бростофф Дж., Мейл Д. Иммунология: Пер. с англ. М.: Мир, 2000. - 592 с].
Субстратом С3-конвертазы трех путей активации является ключевой компонент комплемента, компонент С3, при гидролизе которого образуется С3а (анафилатоксйн) и C3b (опсонин). Присоединяя дополнительно молекулу C3b, С3-конвертаза обретает способность гидролизовать компонент С5, который запускает реакцию формирования мембрано-атакующего комплекса (МАК).
При активации комплемента генерируются биологически активные фрагменты белков С3 и С5 (С3а и С5а - анафилатоксины) и C5b-9 (МАК), которые опосредуют воспалительные активности, включающие лейкоцитарный хемотаксис, активацию макрофагов, нейтрофилов и тромбоцитов, тучных и эндотелиальных клеток, повышение сосудистой проницаемости, цитолиз и тканевое повреждение [SahuA., LambrisJ.D. Complement inhibitors are surget conceptin anti-inflamatory therapeutics // Immunopharmacology - 2000. - V.49. - P. 133-148.].
Избыточная (неконтролируемая) активация системы комплемента является частью патогенеза большого числа воспалительных заболеваний. Патологические эффекты могут быть обусловлены повышенной, продолжительной активацией, например, вызванной присутствием иммунных комплексов (системная красная волчанка и связанные с ней заболевания), а также сниженной экспрессией и функцией различных ингибиторов комплемента, или комбинацией этих двух факторов [Carroll M.V., R. В. Sim R.B. Complement in health and disease //Advanced Drug Delivery Reviews. - 2011. - V.63, №12. - P. 965-975].
Ишемия и последующая реперфузия органов и тканей наблюдается при таких состояниях как инфаркт миокарда или инсульт. Неконтролируемая активация системы комплемента играет важную роль при реперфузионном повреждении. Результатом этого является мультифункциональньгй воспалительный процесс, вовлекающий генерацию анафилатоксинов, повышенную экспрессию адгезивных белков и тканевых факторов на эндотелиальных клетках и выход из сосудов полиморфно-ядерных лейкоцитов [Banz Y., Rieben R. Role of complement and perspectives for intervention in ischemia-reperfusion damage // Annals of Medicine.-2012.-V. 44, №3.-P. 205-217].
Для исследования системы комплемента определяют его гемолитическую активность. Суть метода заключается в следующем: 1) разные разведения исследуемой сыворотки добавляют к эритроцитам барана, сенсибилизированным антителами кролика (ЕА); 2) степень гемолиза оценивают фотометрически по выходу гемоглобина в раствор после центрифугирования. Активность комплемента выражают в гемолитических единицах. За одну гемолитическую единицу комплемента (СН50) принимают такое его количество, которое вызывает гемолиз 50% 0,5 мл стандартной суспензии ЕА при 37°С за 45 мин. В 1 мл сыворотки крови человека содержится 20-40 СН50 [Лабораторные методы исследования в клинике: Справочник/Меньшиков В.В., Делеторская Л.Н., Золотницкая Р.П. и др.: Под ред. В.В.Меньшикова. М.: Медицина, 1987. - 368 с].
Существенным недостатком этого метода является использование гетерологичных эритроцитов барана с коротким сроком их хранения, длительность выполнения теста, недостаточная точность (колебания нормальных значений в два раза), для оценки степени лизиса требуется центрифугирование и определение гемоглобина в супбрнатанте (дополнительный контакт оператора с биоматериалом).
Из уровня техники Известен способ определения чувствительности эритроцитов человека к лизису по тромбиновому пути активации комплемента [патент РФ №2 696981, опубл. 08.08.2019 Бюл. №22]. Суть метода заключается в том, что для Определения чувствительности эритроцитов человека к лизису при активации системы комплемента по тромбиновому пути используют цитратную плазму с высокой активностью тромбина, связанного с фибрином. Для ингибированйя активации комплемента по одному из известных трех путей (классическому, альтернативному или лектиновому) используют цитрат натрия в качестве хелатора для связывания Са2+ и Mg+2. В присутствии активного тромбина, связанного с фибрином, активируется компонент С5 и формируется мембрано-атакующий комплекс, который определяют по лизису эритроцитов человека (ЭЧ). Параллельно определяют стандартным методом группу крови ЭЧ по системе АВ0. Наиболее чувствительными к лизису по тромбиновому пути активации комплемента оказались эритроциты человека с группой крови А, на втором месте - АВ, на третьем месте - В. Наиболее устойчивыми к лизису оказались эритроциты человека 0 группой крови.
Таким образом, авторами убедительно показан лизис эритроцитов человека мембрано-атакующим комплексом, который формируется на эритроцитах человека кроме 0 группы, под действием тромбина, связанного с фибрином и вызывает лизис.
Также из уровня техники известен тест определения функциональной активности системы комплемента по классическому пути, основанный на иммуноферментном анализе (ИФА). Суть теста заключается в определении активности классического пути системы комплемента по сорбции мембрано-атакующего комплекса (МАК) на подложке 96-ти луночной планшеты, сорбированной агрегированными иммуноглобулинами. Связывание МАК проявляют моноклональными антителами, конъюгированными с ферментом, щелочной фосфатазой, с использованием его субстрата. В качестве стандарта используют лиофильно высушенный препарат сыворотки крови человека. Рассчитывают в процентах функциональную активность классического пути активации комплемента относительно стандарта [WIESLAB Complement system Classical pathway. "EuroDiagnostica", Швеция].
Существенным недостатком ИФА-теста скрининга комплемента по классическому пути является длительность проведения анализа (не менее 3 часов), использование моноклональных антител, которые делают данный анализ недоступным для рутинных исследований. Также использование лиофильно высушенной сыворотки в качестве стандарта требуют специальных условий для хранения и транспортировки (-20°С), а также подобный стандарт может завышать активность комплемента при анализе из-за потери функциональной активности самого стандарта при лиофилизации, хранении и транспортировке.
Также из уровня техники известен скрининг-тест определения активности классического пути системы комплемента человека методом турбидиметрии [патент на изобретение РФ №2704121, опубл. 24.10.2019 Бюл. №30]. Суть метода заключается в определении функциональной активности классического пути системы комплемента с использованием реакции лизиса эритроцитов барана, сенсибилизированных антителами кролика (ЕА), в условиях вероналового солевого буфера (VBS2+) при температуре (37,0±0,5)°С в течение 10 мин. Реакцию комплемент-зависимого лизиса ЕА определяют турбидиметрически по снижению оптической плотности суспензии ЕА при длине волны 620 нм, затем определяют степень лизиса эритроцитов в опытных пробах по калибровочному графику, где контроль ЕА представляет 0% лизиса, а контроль полного лизиса ЕА - 100% лизис.
Недостатком данного гемолитического теста является использование также эритроцитов барана, сенсибилизированных антителами кролика, которые не всегда доступны для рутинных исследований и ограничены в сроках использования.
Наиболее близким аналогом (прототипом) является скрининг-тест определения функциональной активности классического пути системы комплемента человека для прогноза тяжести течения системной воспалительной реакции [патент РФ №27567764. Опубл. 05.10.2021. Бюл. №28]. Способ включает проведение реакции лизиса эритроцитов человека группы А по системе АВ0 [Е(А)], сенсибилизированных анти-А моноклональными IgM антителами [Е(А)мАт] и сыворотки крови человека в условиях вероналового солевого буфера (VBS2+), инкубирование полученной пробы, далее оценивают реакцию комплемент-зависимого лизиса Е(А)мАт турбидиметрически, по снижению оптической плотности суспензии Е(А)мАт при длине волны 620 нм определяют степень лизиса эритроцитов в опытных пробах по калибровочному графику, где контроль Е(А)мАт представляет 0% лизиса, а контроль полного лизиса Е(А)мАт - 100% лизис, при определенных условиях, при этом повышенную функциональную активность классического пути системы комплемента человека отмечают при степени лизиса более 60%, при степени лизиса от 31% до 59% как нормальную и при степени лизиса менее 30% как пониженную функциональную активность системы комплемента человека.
Таким образом, на настоящий момент не существует доступного теста для скрининга функциональной активности системы комплемента крысы.
Техническим результатом предлагаемого способа является повышение точности метода исследования функциональной активности классического пути системы комплемента, а также упрощения регистрации результатов анализа функциональной активности классического пути системы комплемента в рутинных исследованиях.
Указанный результат достигается тем, что определение функциональной активности классического пути системы комплемента крысы проводят с использованием 1% суспензии эритроцитов человека с группой А по системе АВ0 Е(А), сенсибилизированных анти-А моноклональными IgM антителами [Е(А)мАт], 12,5% сыворотки в условиях вероналового солевого буфера (VBS2+) при температуре (37,0±0,5)°С в течение 15 мин. Реакцию комплемент-зависимого лизиса Е(А)мАт оценивают турбидиметрически по снижению оптической плотности суспензии Е(А)мАт при длине волны 620 нм, затем определяют степень лизиса эритроцитов в опытных пробах по графику, где контроль Е(А)мАт представляет 0% лизйса, а контроль полного лизиса Е(А)мАт - 100% лизис, при этом повышенную функциональную активность классического пути системы комплемента считают при степени лизиса более 80%, при степени лизиса от 50% до 79% как нормальную, а при степени лизиса менее 50% как пониженную активность.
Заявленное изобретение поясняется фигурами:
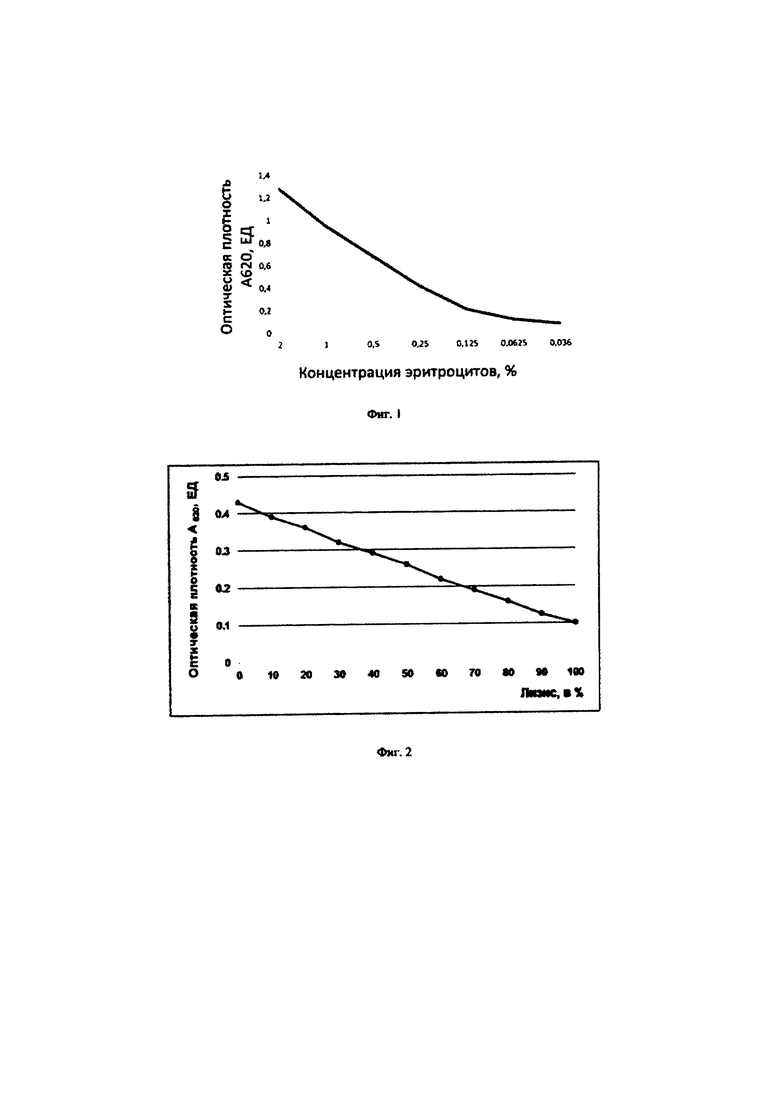
на фиг.1 представлен график зависимости оптической плотности суспензии эритроцитов человека при длине волны 620 нм от концентрации эритроцитов;
на фиг.2 представлен график для определения степени лизиса эритроцитов человека в % методом турбидиметрии;
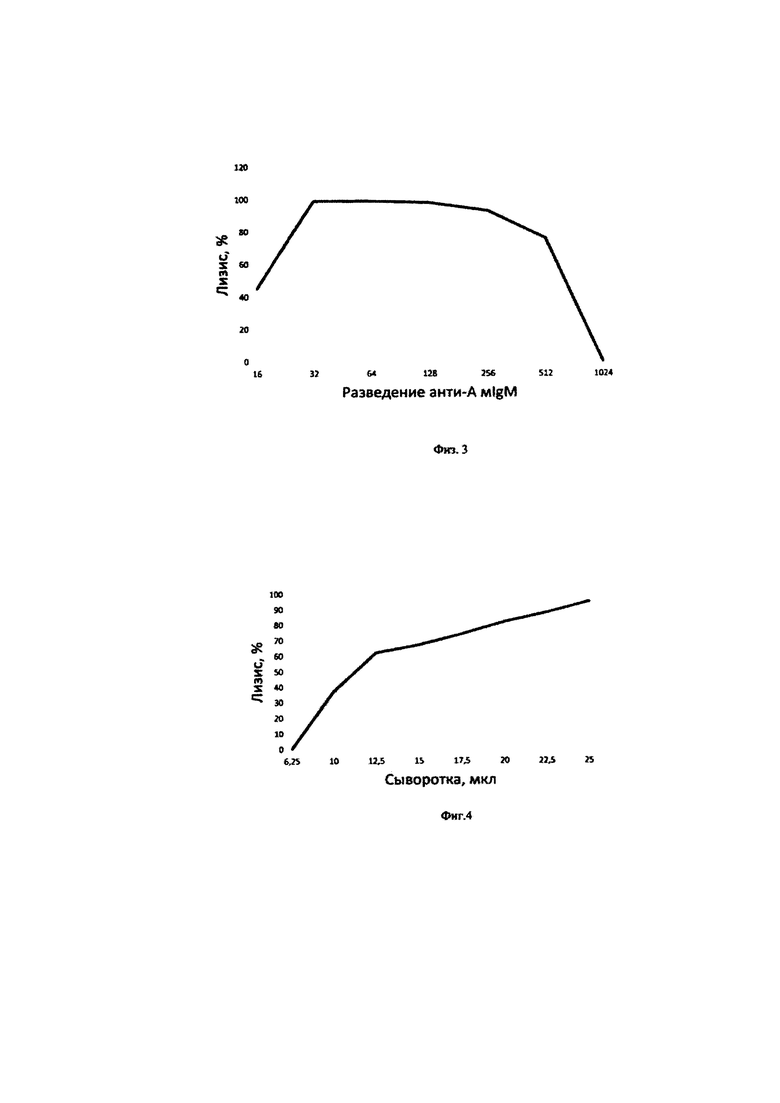
на фиг.З представлен график определения оптимальной концентрации моноклональных анти-А IgM антител для активации комплемента сыворотки крови крысы по классическому пути;
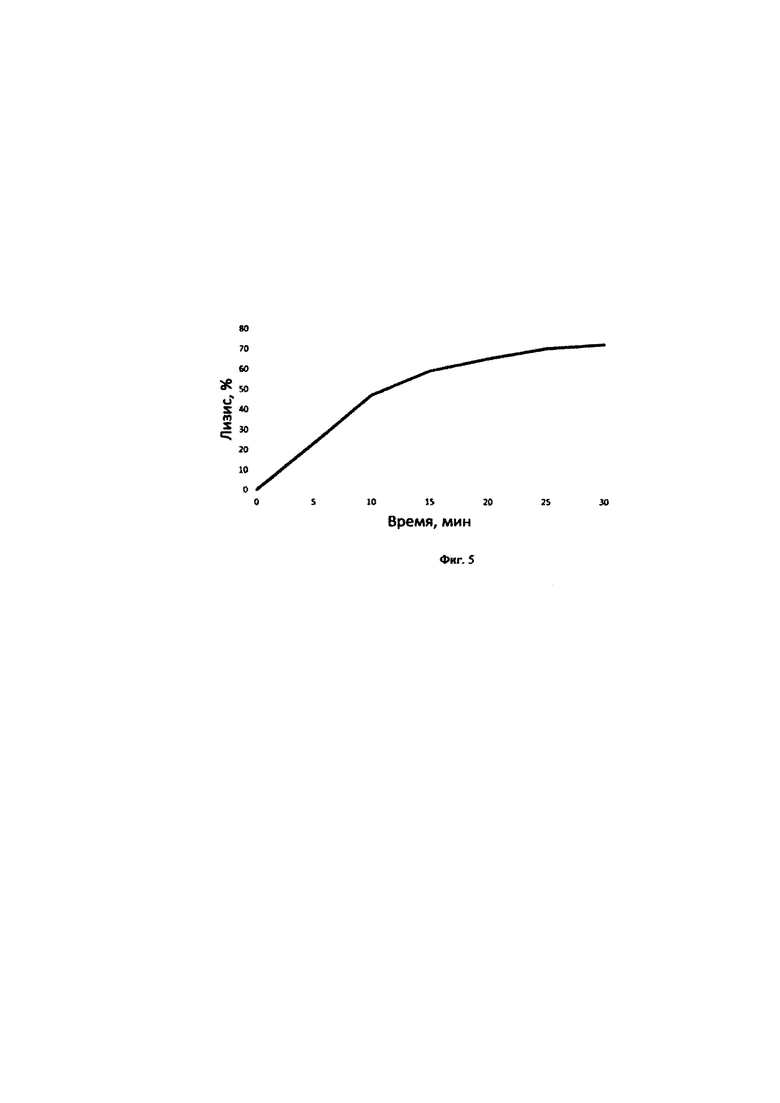
на фиг 4 представлена раститровка пулированной сыворотки с эритроцитами А группы человека, сенсибилизированных анти-А моноклональными IgM антителами;
на фиг.5 представлено влияние времени инкубации на гемолиз эритроцитов человека.
Способ осуществляют следующим образом. Проводят забор крови, готовят сыворотку, проводят литический тест и осуществляют расчет степени лизиса в опытных пробах. Гемолитический тест проводят с использованием 1% суспензии эритроцитов человека группы А [Е(А)], сенсибилизированных анти-А-моноклональными IgM антителами [Е(А)мАт] в вероналовом солевом буфере, содержащем Са2+ и Mg2+ (VBS2+). Время проведения скрининг-теста - 15 мин. Суть метода заключается в изменении светорассеивания эритроцитов при их лизисе в 96-ти луночных иммунологических плоскодонных планшетах. Изменение светорассеивания при лизисе эритроцитов определяют турбидиметрически при длине волны 620 нм с использованием фотометра для иммуноферментного анализа. Для определения степени лизиса эритроцитов в опытных образцах строят калибровочный график зависимости оптической плотности А620 от лизиса эритроцитов человека, по которому определяют степень лизиса (фиг.2), где за 0% лизиса принимают оптическую плотность контроля эритроцитов человека Е(А)мАт на спонтанный лизис, соответственно за 100% лизиса принимают оптическую плотность контроля на полный лизис. Повышенную функциональную активность классического пути системы комплемента считают при степени лизиса более 80%, при степени лизиса от 50% до 79% как нормальную, а при степени лизиса менее 50% как пониженную активность.
Определение оптимальной концентрации эритроцитов человека для определения функциональной активности системы комплемента. Эритроциты человека группы А [Е(А)] по системе АВ0 3 раза отмывают в вероналовом солевом буфере (VBS2+) центрифугированием в течение 10 мин при 2800 об/мин. Строят график зависимости оптической плотности суспензий Е(А) при длине волны 620 нм от концентрации эритроцитов в процентах. Для этого 4% суспензии Е(А) прогрессивно разводят в плоскодонной 96-ти луночной иммунологической планшете в объеме 50 мкл VBS2+. Объем доводят до 100 мкл тем же буфером. Тщательно перемешивают и измеряют на фотометре для иммуноферментного анализа при А620 (фиг.1).
Как видно из данных, представленных на фиг.1, наблюдается линейная зависимость оптической плотности суспензии эритроцитов человека от концентрации их в растворе до А620 равной 0,68 единиц оптической плотности (ЕОП). Выше 0,68 ЕОП при А620 наблюдается незначительный загиб. Поэтому для теста определения функциональной активности классического пути активации системы комплемента нами выбрана концентрация эритроцитов Е(А), которая в объеме 100 мкл в лунке 96-луночного планшета дает оптическую плотность, равную 0,68, что соответствует 0,5% концентрации эритроцитов (0,5×107 кл/мл). Для определения степени лизиса эритроцитов нами предложен калибровочный график (фиг.2), где степень лизиса эритроцитов оценивают по снижению оптической плотности при длине волны 620 нм. За 0% лизиса принимают оптическую плотность контроля эритроцитов человека на спонтанный лизис (25 мкл 2% Е(А) + 75 мкл VBS2+), соответственно за 100% лизис принимают оптическую плотность контроля на полный лизис (25 мкл 2% Е(А) + 75 мкл Н2О).
Как видно из фиг.2, построение калибровочного графика по 2 точкам и 7 точкам, полученным прогрессивным разбавлением суспензии эритроцитов человека, практически совпадают. Разброс максимальный в области 50% лизиса, но меньше 5%, что вполне допустимо для расчета степени лизиса эритроцитов при активации комплемента.
Таким образом, калибровочный график позволяет определять методом турбидиметрии степень лизиса эритроцитов человека в процентах по оптической плотности пробы без стадии центрифугирования и измерения гемоглобина в супернатанте и последующего расчета степени лизиса эритроцитов, что существенно упрощает регистрацию результатов анализа функциональной активности классического пути системы комплемента в рутинных исследованиях. Определение степени лизиса Эритроцитов методом турбидиметрии также позволяет проводить кинетические исследования функциональной активности комплемента, т.е. исследования комплемент-опосредованного лизиса эритроцитов во времени без остановки реакции для измерения степени лизиса.
Определение оптимальной концентрации моноклоналъных анти-А IgM антител для активации комплемента по классическому пути. Предварительно моноклональные IgM анти-А антитела по 25 мкл прогрессивно разводят в иммунологических планшетах с плоским дном, затем добавляют по 25 мкл буфера VBS2+, пулированной сыворотки крови крысы и 2% суспензии Е(А) человека. После тщательного перемешивания измеряют мутность проб при А620 (0 мин) и инкубируют в течение 30 мин при 37°С. В качестве контроля используют: 1 - контроль эритроцитов на спонтанный лизис (25 мкл Е(А) + 75 мкл VBS2+); 2 - Контроль на полный лизис (25 Е(А) + 75 мкл Н2О). Степень лизиса Е(А) в % определяли по графику (фиг.2), где контроль Е(А) на спонтанный лизис представляет 0% лизис, а контроль на полный лизис - 100% лизис. Полученные результаты представлены на фиг.3. Как видно на фиг.3, максимальный лизис эритроцитов человека группы А наблюдается при разведении анти-А моноклональных IgM антител при разведении от 1:31 до 1:255. При дальнейшем разведении анти-А моноклональных IgM антител наблюдается снижение лизиса. При разведении 1024 раз наблюдается полное отсутствие лизиса.
Таким образом, нами в дальнейших исследованиях использовано разведение в 128 раз исходного препарата анти-А моноклональных IgM антител в тестируемых пробах.
Титрование пулированной сыворотки крови крысы на функциональную активность классического пути системы комплемента методом турбидиметрии. Предварительно от 10 до 25 мкл пулированной сыворотки крови от 10 крыс вносят в лунки иммунологических планшет с плоским дном, затем объем в каждой пробе доводят до 50 мкл буфером VBS2+. В разведенные сыворотки вносят по 50 мкл 1% эритроцитов человека А группы, сенсибилизированных анти-А моноклональными IgM антителами (Е(А)мА/Т (конечный объем гемолитической системы 100 мкл), тщательно перемешивают и измеряют мутность проб при 620 нм (0 мин) на фотометре для ИФА. Затем инкубируют в течение 30 мин при 37°С. В качестве контроля используют: 1 - контроль эритроцитов на спонтанный лизис (50 мкл Е(А)мА/Т + 50 мкл VBS2+); 2 - контроль на полный лизис (50 Е(А)мА/Т + 50 мкл Н2О). После инкубации тщательно перемешивают, измеряют мутность проб и определяют степень лизиса эритроцитов в % по калибровочному графику (фиг.2), где контроль эритроцитов на спонтанный лизис принимают за 0% лизиса, контроль на полный лизис представляет 100% лизис.Полученные результаты представлены на фиг.4. Как видно из фиг.4, степень лизиса от 62 до 95% зависит линейно от концентрации сыворотки в гемолитической системе при инкубации в течение 30 мин.
Таким образом, для дальнейших исследований использовали 12,5 мкл сыворотки крыс в тест-системе, содержащей 0,5% суспензию группы А эритроцитов человека, сенсибилизированных анти-А моноклональными IgM антителами.
Определение оптимального времени инкубации для определения функциональной активности системы комплемента. К 12,5 мкл сыворотки крови добавляют 37,5 мкл буфера VBS2+ и 50 мкл 1% суспензии Е(А)мАт) в лунки 96-ти луночных плоскодонных планшет для иммуноферментного анализа. Тщательно перемешивают и инкубируют в течение 30 минут при 37°С при постоянном перемешивании. В процессе инкубации измеряют оптическую плотность проб на фотометре Multiscan FC с блоком термостатирования и шейкером при длине волны 620 нм через 5, 10, 15, 20, 25 и 30 мин. В качестве контроля используют: 1 - контроль эритроцитов на спонтанный лизис (50 мкл Е(А)мАт + 50 мкл VBS2+); 2 - Контроль на полный лизис (50 мкл Е(А)мАт + 50 мкл Н2О). Степень лизиса Е(А)мАт в % определяют как описано выше. Полученные результаты представлены на фиг.5. Как видно на фиг.5, максимальный лизис наблюдается первые 15 мин и при дальнейшей инкубации увеличение степени гемолиза зависит от длительности инкубации. То есть, при высоком лизисе на 10 минуте инкубации продолжение инкубации незначительно увеличивает гемолиз. При слабом гемолизе на 10 минуте инкубации, дальнейшая инкубация приводит к более высокому гемолизу.
Таким образом, оптимальным временем инкубации данной гемолитической системы является 15-ти минутная инкубация при 37°С.
Примеры осуществления.
Пример 1. Определение функциональной активности классического пути системы комплемента в сыворотках крови крыс.
К 12,5 мкл сыворотки крови добавляют 37,5 мкл буфера VBS2+ и 50 мкл 1% Е(А)мАт (эритроциты человека с группой А, сенсибилизированные моноклональными анти-А IgM антителами), в лунки 96-ти луночных плоскодонных планшет для иммуноферментного анализа. Тщательно перемешивают и инкубируют в течение 15 минут при 37°С при постоянном перемешивании. Степень лизиса Е(А)мАт в % определяют, как описано выше. Полученные результаты представлены в таблице 1.
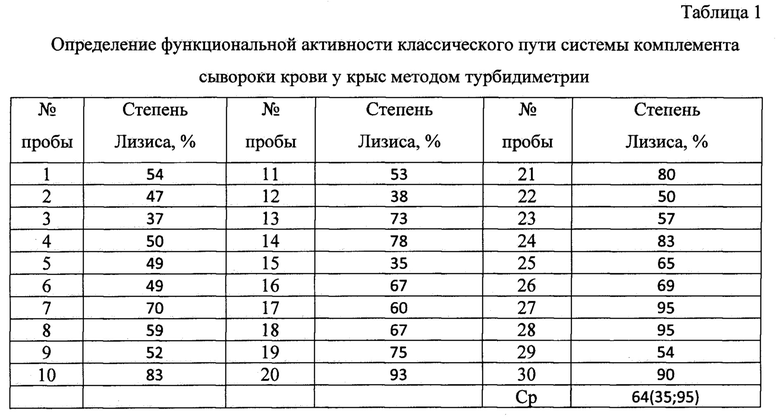
Как видно из данных, представленных в таблице 1, в 3 пробах из 30 (10%) определяется пониженная функциональная активность системы комплемента (степень лизиса менее 40% лизиса). В 11 пробах (37%) - повышенная активность системы комплемента (степень лизиса более 70%). В остальных 16 пробах (53%) наблюдается нормальная функциональная активность системы комплемента (степень лизиса более от 41% до 69%).
Пример 2. Сравнительные исследования функциональной активности классического пути системы комплемента предлагаемым методом и прототипом.
Проведены сравнительные исследования функциональной активности классического пути системы комплемента предлагаемым методом и прототипом. Определения функциональной активности классического пути комплемента предлагаемым методом проводили как описано выше.
Определение функциональной активности классического пути активации системы комплемента по прототипу проводили следующим образом. К 8 мкл сыворотки крови, разведенной 1:7 буфером VBS2+, добавляли 42 мкл буфера VBS2+ и 50 мкл стандартизированных (1,5×108 кл/мл) эритроцитов барана, сенсибилизированных антителами кролика (ЕА) в лунки иммунологических 96-ти луночных плоскодонных планшет для ИФА. Тщательно перемешивают и инкубируют в течение 10 минут при 37°С при постоянном перемешивании. Степень лизиса ЕА в % определяли по калибровочному графику зависимости оптической плотности А620 от лизиса эритроцитов барана. Полученные результаты представлены в таблице 2.
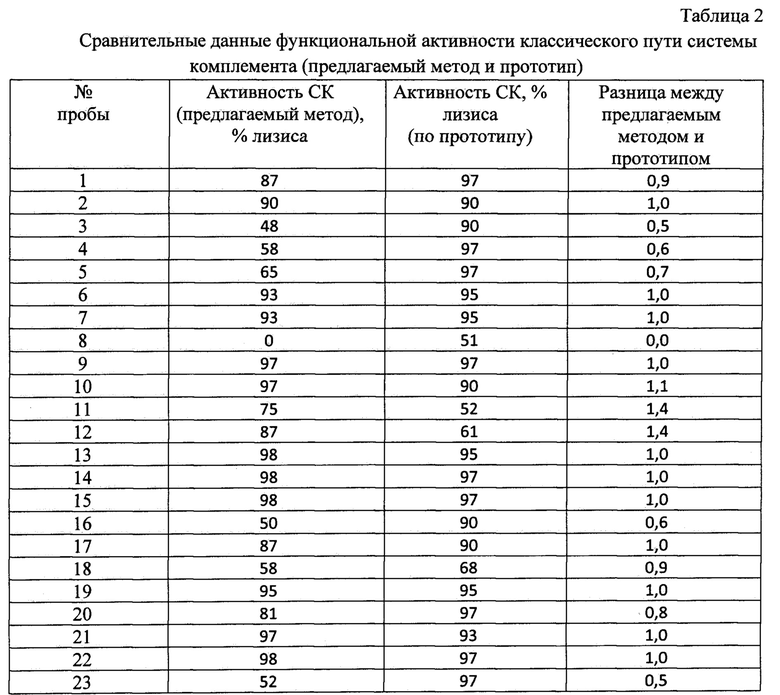
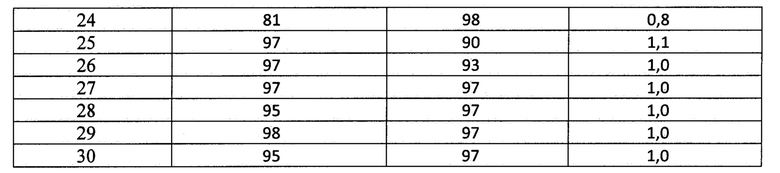
Как видно из данных, представленных в таблице 2, анализ функциональной активности системы комплемента по классическому пути с использованием прототипа выявляет в 6 пробах (20%) из тестированных 30 проб сыворотки нормальную (от <50%) активность и в 3 пробах (10%) повышенную функциональную активность классического пути системы комплемента (>80%). Причем повышенная гемолитическая активность в 100% совпала по двум методам. Наибольшее расхождение (почти 2 с лишним раза) наблюдается в группе с низкой активностью комплемента. Данный факт можно объяснить влиянием ингибиторов комплемента при использовании 12,5% сыворотки в тестах, т.е. в прототипе концентрация сыворотки составляет всего 1%, что приводит к снижению их роли при проведении гемолитического теста с одной стороны. И отсутствие ингибитора мембрано-атакующего комплекса (CD59) на поверхности эритроцитов барана делает их более чувствительными к комплемент-опосредованному лизису.
Таким образом, предлагаемый способ определения и прогнозирования функциональной активности классического пути активации системы комплемента является более информативным при выявлении сниженной активности данного пути активации комплемента. Дальнейшие исследования функциональной активности классического пути системы комплемента у больных с аутоиммунными заболеваниями, связанными солюбилизацией и элиминацией иммунных комплексов (болезни иммунных комплексов, включающие ревматоидный артрит, системную красную волчанку, гломерулонефрит) позволят как контролировать эффективность проводимой терапии, так и на ранних доклинических стадиях выявлять скрытое течение заболеваний.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПРОГНОЗИРОВАНИЯ ТЯЖЕСТИ СИСТЕМНОЙ ВОСПАЛИТЕЛЬНОЙ РЕАКЦИИ В ОРГАНИЗМЕ ЧЕЛОВЕКА ПРИ ЗАБОЛЕВАНИЯХ | 2022 |
|
RU2808416C1 |
| Способ определения активности классического и альтернативного путей системы комплемента мыши | 2022 |
|
RU2800363C1 |
| Способ определения комплемент-активирующей функции антител к SARS-CoV-2 для прогнозирования тяжести течения COVID-19 | 2023 |
|
RU2818351C1 |
| Способ определения ингибиторного потенциала крови для прогнозирования неконтролируемой активации системы комплемента при Ковид-19 | 2023 |
|
RU2814496C1 |
| Способ определения функциональной активности системы комплемента человека для прогноза тяжести течения системной воспалительной реакции | 2021 |
|
RU2756764C1 |
| Скрининг-тест для определения функциональной активности классического пути системы комплемента | 2018 |
|
RU2704121C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ СТАБИЛИЗАЦИИ С3-КОНВЕРТАЗЫ КЛАССИЧЕСКОГО ПУТИ АКТИВАЦИИ КОМПЛЕМЕНТА ЧЕЛОВЕКА | 2013 |
|
RU2549468C2 |
| СПОСОБ ОПРЕДЕЛЕНИЯ ФУНКЦИОНАЛЬНОЙ АКТИВНОСТИ ИОНИЗИРОВАННОГО КАЛЬЦИЯ В СЫВОРОТКЕ КРОВИ ЧЕЛОВЕКА | 2013 |
|
RU2526824C1 |
| СПОСОБ ЭКСПРЕСС-ОПРЕДЕЛЕНИЯ ХОЛЕСТЕРИНА В ИММУННЫХ КОМПЛЕКСАХ | 2013 |
|
RU2538685C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ НАРУШЕНИЯ ИММУННОГО СТАТУСА | 2002 |
|
RU2247381C2 |
Изобретение относится к биотехнологии, а именно к способу определения функциональной активности системы комплемента крысы. Способ определения функциональной активности системы комплемента крысы включает проведение реакции лизиса эритроцитов человека группы А системы АВ0 [Е(А)], сенсибилизированных анти-А моноклональными IgM антителами [Е(А)мАт], и сыворотки в условиях вероналового солевого буфера (VBS2+), инкубирование полученной пробы, далее оценивают реакцию комплемент-зависимого лизиса Е(А)мАт. Вышеописанный способ позволяет повысить точность метода исследования функциональной активности классического пути системы комплемента, а также упростить регистрацию результатов анализа функциональной активности классического пути системы комплемента в рутинных исследованиях и адаптации способа для скрининг-исследований в условиях клинико-диагностических лабораторий. 5 ил., 2 табл., 2 пр.
Скрининг-тест определения функциональной активности системы комплемента крысы путем проведения реакции лизиса эритроцитов, отличающийся тем, что используют 12,5% сыворотку крови крысы, 0,5% суспензию эритроцитов человека группы А по системе АВ0 [Е(А)], сенсибилизированных анти-А моноклональными IgM антителами [Е(А)мАт] в условиях вероналового солевого буфера VBS2+ при температуре 37,0±0,5°С, инкубируют в течение 15 мин, реакцию комплемент-зависимого лизиса Е(А)мАт оценивают турбидиметрически по снижению оптической плотности суспензии Е(А)мАт при длине волны 620 нм, строят калибровочный график зависимости оптической плотности А620 от лизиса эритроцитов человека, по которому определяют степень лизиса эритроцитов в опытных пробах, где за 0% лизиса принимают оптическую плотность контроля Е(А)мАт на спонтанный лизис при использовании 50 мкл 1% Е(А)мАт и 50 мкл VBS2+, соответственно за 100% лизиса принимают оптическую плотность контроля на полный лизис при использовании 50 мкл 1% Е(А)мАт и 50 мкл Н2О, при этом повышенную функциональную активность системы комплемента отмечают при степени лизиса более 80%, при степени лизиса от 50% до 79% как нормальную и при степени лизиса менее 50% как пониженную функциональную активность системы комплемента крысы.
| Li Y | |||
| et al | |||
| Complement opsonization of nanoparticles: Differences between humans and preclinical species //Journal of Controlled Release | |||
| Способ регенерирования сульфо-кислот, употребленных при гидролизе жиров | 1924 |
|
SU2021A1 |
| - Т | |||
| Чемодан с сигнальным замком | 1922 |
|
SU338A1 |
| - С | |||
| ПРИБОР ДЛЯ СЪЕМКИ ПЛАНА МЕСТНОСТИ | 1922 |
|
SU548A1 |
| Addinsall A | |||
| B | |||
| et al | |||
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
Авторы
Даты
2022-12-19—Публикация
2022-04-05—Подача