Область техники
Изобретение относится к области выращивания белковых кристаллов и исследования пространственных структуры белковых молекул, в частности к способу получения кристаллов интегральных мембранных белков.
Уровень техники
Для разработки новых эффективных лекарств необходимо фундаментальное понимание молекулярных механизмов функционирования белков, которое может быть достигнуто путем изучения их пространственных структур на атомном разрешении. В настоящее время наиболее подробную информацию о строении макромолекул можно получить с помощью метода рентгеноструктурного анализа белковых кристаллов. Выращивание качественных белковых кристаллов для многих объектов оказывается непростой задачей, что ведет к необходимости разрабатывать различные подходы к ее решению.
Иногда информации о статичных структурах белков оказывается недостаточно для детального понимания механизма их функционирования. В таких случаях необходимо изучать не только структуру фермента до или после выполнения им своей работы, но и во время работы, когда формируются так называемые промежуточные (интермедиатные) состояния. Для структурных исследований сверхбыстрых процессов, происходящих в белковых макромолекулах во время их работы, подходят два кристаллографических метода - поточная кристаллография с временным разрешением на синхротроне и с использованием лазера на свободных электронах. Оба подхода требуют большого количества (от нескольких десятков до тысяч) кристаллов для проведения эксперимента, что дополнительно усложняет процесс белковой кристаллизации. Особые трудности вызывают мембранные белки, для работы с которыми требуются дополнительные ухищрения из-за их нестабильности вне клеточной мембраны.
Общий принцип методов кристаллизации белков заключается в получении перенасыщенного белкового раствора путем медленного изменения параметров системы кристаллизации. Такое состояние раствора способствует зарождению кристаллов и их дальнейшему росту.
Наиболее популярными являются несколько способов кристаллизации. Первый - это метод диффузии паров в «висячей капле» или «сидячей капле». За счет того, что кристаллизационная смесь постепенно теряет воду в процессе диффузии паров из кристаллизационной капли в резервуарный раствор, в котором концентрация преципитанта выше, постепенно происходит увеличение концентрации белка и преципитанта в капле. Известно большое число изобретений, реализующих этот способ, и устройств для кристаллизации. Устройства, реализующие данный способ, чаще всего представляют собой планшеты с большим числом ячеек, накрытых пленкой или стеклом [1].
Другой способ основан на встречной диффузии в капилляре. Раствор белка заливается в капилляр диаметром 0,3-0,5 мм, на его конец одевается трубка, заполненная гелем. Этим концом капилляр помещается в раствор преципитанта, который медленно диффундирует через гель в капилляр, где и происходит кристаллизация [2].
Известен способ формирования кристаллов с использованием диализа в устройстве, в котором расположены камеры для белкового и буферного растворов, разделенные полупроницаемой мембраной и камеру осадителя, взаимодействующую с ними [3].
Методики, разработанные для водорастворимых белков, часто показывают малую эффективность в случае кристаллизации мембранных белков. Это привело к пониманию важности использования липидов для стабилизации и кристаллизации мембранных белков. Ландау и Розенбуш предложили в 1996 г. способ кристаллизации белков в липидной кубической фазе (ЛКФ) [4,5]. При этом подходе раствор мембранного белка смешивается с липидной кубической фазой, липиды которой выступают в качестве матрицы для роста кристаллов. ЛКФ представляет собой один из нескольких типов липидных мезофаз, мембраноподобных структур, которые стабилизируют инкорпорированные мембранные белки аналогично нативным клеточным мембранам. Другой мезофазой, подходящей для кристаллизации мембранных белков является липидная губчатая фаза (ЛГФ), впервые предложенная к использованию Пиа Вадстин в 2006 году [6].
Известны технические решения, которые описывают способы кристаллизации белковых молекул в липидной фазе. В международной заявке WO 2006036772 описаны гелевые композиции трехмерно связанного липидного бислоя (CLB) и способы их получения и использования для кристаллизации мембранных белков. Гели CLB образуются с использованием смеси для кристаллизации, содержащей водный раствор и липидную фазу, где липидная фаза включает липид хозяина и фузоген. Указанная смесь для кристаллизации объединена с подлежащим кристаллизации белком [7].
Наиболее близким к объекту данного изобретения является способ получения белковых кристаллов с помощью стеклянных шприцов, в основном используются шприцы фирмы Hamilton. В работе М. Кафрея с соавторами описана установка для проведения кристаллизации и способ для проведения кристаллизации, который включает в себя: (а) помещение раствора мембранного белка и липида в отдельные газонепроницаемые микрошприцы (обычно 50 или 100 мкл), соединенные узконаправленным соединителем (коннектором), (б) передачу раствора белка и липида из одного шприца в другой через коннектор для осуществления смешивания, гомогенизации и самопроизвольной самосборки кубической фазы в бислой, (в) перенос оптически прозрачной мезофазы в один из шприцов, (г) замена пустого шприца дозирующим микрошприцом (обычно 10 мкл), установленным в дозатор (степпер), и перенос белок-содержащей мезофазы из большого шприца в малый с помощью соединителя, (д) дозирование мезофазы с последующим добавлением раствора преципитанта в лунки стеклянной плашки типа сэндвич и (е) герметизация лунок покровным стеклом. Оставшиеся лунки на пластине заполняются и герметизируются, после чего пластина инкубируется при желаемой температуре до окончания кристаллизации [8].
Недостаток метода мезофазной кристаллизации с использованием луночного планшета состоит в том, что подготовленная смесь мезофазы и преципитанта размещается во всех лунках в одинаковом объеме и с одинаковым соотношением объемов мезофазы и осадителя. Взаимодействие мезофазы и раствора преципитанта происходит на границе раздела фаз и, если условия соотношения объемов мезофазы и осадителя в реакционных смесях выбраны неправильно, количество и качество кристаллов неудовлетворительно во всех лунках. Поэтому, рассмотренный способ кристаллизации требует от исследователя много времени и высокого расхода белка для скрининга условий кристаллизации и часто не гарантирует успеха.
При приготовлении кристаллов для использования в серийно-поточной кристаллографии, основным недостатком описанной методики является ограниченный максимальный объем кристаллизационной смеси, которого не хватает для получения нужного для эксперимента количества кристаллов. При увеличении объема мезофазы и противораствора в обычном планшете граница раздела фаз становится сравнительно небольшой по отношению к объему компонентов кристаллизационной смеси и не обеспечивает достаточно эффективной диффузии преципитанта. Этот недостаток характерен практически всем методикам мезофазной кристаллизации.
Таким образом, в данной области техники существует потребность в других способах роста кристаллов для выполнения недорогого и эффективного скрининга условий кристаллизации мембранных белков, которые позволят вырастить достаточное количество кристаллов для экспериментов серийно-поточной кристаллографии.
Задачей предлагаемого изобретения является создание способа кристаллизации мембранных белков с возможностью проведения скрининга условий кристаллизации и с возможностью получения достаточного количества кристаллов для экспериментов серийно-поточной кристаллографии.
Технический результат состоит в том, что данный способ кристаллизации позволит проводить кристаллизацию образца мембранного белка в сравнительно большом объеме липидной губчатой фазы (от 10 до 100 мкл) при этом сохраняя площадь раздела фаз между смесью ЛГФ/белок и раствором преципитанта на уровне, обеспечивающим достаточную диффузию преципитанта в толщу смеси ЛГФ/белок. Способ кристаллизации основан на формировании внутри рабочего объема градиента соотношений между фазой ЛГФ/белок и раствором преципитанта вдоль центральной оси контейнера в процессе кристаллизации, что обеспечивает возможность дополнительного эффективного скрининга условий кристаллизации.
Сущность изобретения
Для достижения вышеуказанных целей объектом изобретения является способ кристаллизации белка, содержащий следующие этапы: (а) подготовка липидной губчатой фазы; (б) установка кристаллизационного контейнера в горизонтальное положение; (в) введение в рабочую секцию камеры контейнера раствора преципитанта; (г) введение в рабочую камеру контейнера липидной губчатой фазы; (д) герметизация входного отверстия контейнера; (е) установка кристаллизационного контейнера на платформу держателей контейнеров; (ж) установка, по меньшей мере одной платформы в термостатируемый объем в горизонтальном положении и проведение инкубации для выращивания кристаллов белков; (з) открытие входного отверстия контейнера и отбор фракции липидной губчатой фазы с кристаллами белка; (и) детектирование кристаллов белка. При этом объем липидной губчатой фазы выбирают в пределах от 20 до 80 мкл, а соотношение объема липидной фазы к объему преципитанта выбирают в пределах от 1 к 2 до 2 к 1.
Другой аспект изобретения связан с выбором параметров контейнера, где форма рабочей секции камеры контейнера выполнена в виде конуса, с возможностью создания градиента соотношений объемов преципитанта и смеси ЛГФ/белок вдоль центральной оси рабочей зоны (2) контейнера (1).
Перечень фигур
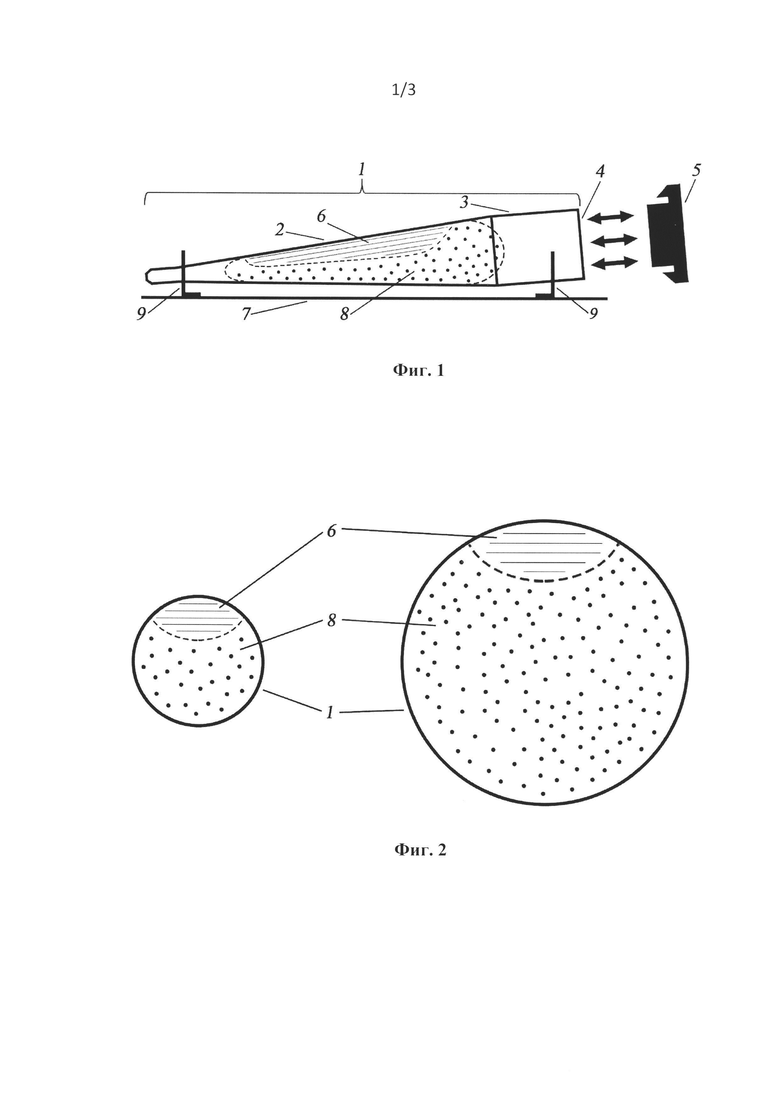
Фиг. 1. Структурная схема устройства для выращивания кристаллов биологических макромолекул.
Фиг. 2. Виды сечений рабочей зоны (2) контейнера (1) в его вершине - А и в основании - Б рабочей зоны, показывающие изменение соотношения площади границы раздела фаз между раствором преципитанта (8) и смеси ЛГФ/белок (6) к объему кристаллизационной смеси.
Фиг. 3. Конструкция платформы для крепления контейнеров.
Фиг. 4. Сборка нескольких платформ с закрепленными контейнерами.
Фиг. 5. Внешний вид смеси ЛГФ/белок после кристаллизации белка, в которой кристаллы белка выделены цветом, что позволяет детектировать их с помощью микроскопа.
Описание изобретения
Для создания обширной границы раздела фаз между мезофазной (смесь ЛГФ/белк) и водной (раствор преципитанта) фракциями для контейнера была выбрана форма удлиненной полой конусообразной трубки. Обе фракции формируют удлиненную границу раздела фаз по всей длине заполненного рабочего объема устройства. При проведении экспериментов по выбору оптимальной технологии кристаллизации белковых молекул было обнаружено, что создание условий, при которых инкубация липидной губчатой фазу с включенными в нее молекулами белка проводимая в конусообразном рабочем объеме контейнера позволяет создать разные условия кристаллизации, за счет постепенного расширения объема рабочей зоны. Расширение рабочего объема от вершины конуса к его основанию формирует градиент отношений величин объемов между липидной губчатой фазой и преципитантом. При этом за счет введения липидной губчатой фазы в объем реакционной зоны с помощью шприца, формируется гелеобразная сплюснутая цилиндрическая зона распределения липидной губчатой фазы вдоль оси контейнера. Этот объем губчатой фазы распределен равномерно вдоль верхней части рабочей зоны от вершины конуса до его основания. На фиг. 1А приведена структурная схема кристаллизационного контейнера (1). Общий внутренний объем контейнера (1) имеет рабочую (2) и вспомогательную (3) зоны. Внутренний объем рабочей зоны (2) выполнен в виде конуса, внутренний объем вспомогательной (3) зоны выполнен в форме цилиндра. При этом внутренняя часть зоны (3) сопряжена с основанием конуса рабочей зоны (2), где внешняя часть зоны (3) формирует вход (4) для ввода и вывода из контейнера (1) жидких компонентов для выращивания кристаллов. Вход (4) контейнера выполнен с возможностью герметизации общего объема контейнера с помощью пробки, крышки, пленки, на фиг. 1Б и фиг. 1В приведены сечения А-А и Б-Б конуса рабочей зоны. Как видно из фигур 1Б и 1В соотношение площадей между зоной размещения преципитанта в рабочей зоне (2) и зоной размещения ЛГФ/белок (6) и имеет разную величину и увеличивается при приближении к основанию конуса рабочей зоны (2).
Контейнер (1) имеет объем от 20 мкл до 200 мкл с длиной рабочей зоны от 20 до 40 мм и выполнен из прозрачного материала входящего в группу инертных полимеров, стекла. Толщину стенки контейнера (1) выбирают в пределах от 0,1 до 0,5 мм. При выборе материала контейнера необходимо учитывать необходимость в последующем использовании поляризатора при анализе кристаллов под микроскопом.
Таким образом, конусообразная форма реакционной зоны контейнера формирует градиент в соотношении объемов между преципитантом и липидной губчатой фазой ееи вдоль оси конуса от 1/1 до 1/10. Это дает возможность проводить анализ эффективности кристаллизации после проведения экспериментов, определяя зоны, в которых кристаллизация происходит более эффективно. Определяя положение зоны и место в реакционной зоне, где произошла эффективная кристаллизация возможно определить величину оптимального соотношения объемов преципитанта и липидной губчатой фазы. Это увеличивает возможность сокращения экспериментов при поиске оптимальных условий кристаллизации.
Контейнер (1) закреплен горизонтально на платформе (7) с помощью фиксаторов (9) которые обеспечивают возможность крепления контейнера (1) с наклоном оси контейнера под углом от 0 до 5 градусов относительно поверхности платформы (7).
В общем случае реализация способа с применением конусообразного реакционного объема контейнера, устанавливаемого во время инкубации (роста кристаллов) горизонтально осуществляется в следующей последовательности.
1. Проводят подготовку липидной губчатой фазы;
2. Устанавливают кристаллизационный контейнер в горизонтальное положение;
3. Вводят в рабочую секцию камеры контейнера раствор преципитанта;
4. Вводят в верхнюю часть рабочей камеры контейнера липидную губчатую фазу;
5. Герметизируют входное отверстие контейнера;
6. Устанавливают кристаллизационный контейнер на платформу держателей контейнеров;
7. Формируют сборку нескольких платформ;
8. Устанавливают сборку платформ в термостатируемый объем обеспечивая горизонтальное положение контейнеров;
9. Выбирают температуру и проводят инкубацию контейнеров для выращивания кристаллов белков. Инкубацию проводят в диапазоне от 15 до 20°С, в случае использования для формирования губчатой фазы моонолеина, предпочтительно проводить инкубацию при температуре 16°С;
10. Осуществляют разборку устройства крепления платформ. При изготовлении платформ в форме диска с центральным отверстием поочередно снимают диски с общего стержня. При изготовлении платформ в виде прямоугольников их крепят с помощью стоек друг над другом. При разборке поочередно снимают платформы и отсоединяют контейнеры от платформ.
11. Оценивают количество выращенных кристаллов с помощью оптической микроскопии;
12. Подготавливают контейнеры к отбору фракций с выращенными кристаллами. В одном из вариантов открывают входное отверстия каждого контейнера при этом снимают пленку или пробку или крышку освобождая вход контейнера и осуществляют отбор фракции липидной губчатой фазы с кристаллами белка с помощью шприца. В другом, более предпочтительном варианте, формируют отверстие на вершине конуса затем проводят разгерметизацию входа в контейнер (4) и осуществляют вытеснение фракции липидной губчатой фазы (6) с кристаллами белка из рабочего объема путем вытеснения фракции липидной губчатой фазы через сформированное отверстие. Вытеснение осуществляют за счет создания воздушного давления через вход контейнера (4) с помощью автоматической пипетки;
13. Проводят детектирование результатов процесса кристаллизации белка и выбор оптимальных условий роста кристаллов.
Рассматриваемый способ подтверждается следующими примерами.
Пример №1
Приготовление липидной губчатой фазы (ЛГФ) происходило по методике, описанной в [6]. Готовую ЛГФ переносили в шприц для кристаллизации (Hamilton 1700 Series Syringe, США) на 100 мкл. В другой идентичный шприц вносили раствор белка с концентрацией 20-25 мг/мл. Соотношение объемов вносимых в шприцы липидной губчатой фазы и белкового раствора составляло 1 к 1, объемы не превышали 50 мкл. Жидкости вносились с помощью автоматической пипетки с объемом дозирования от 10 до 100 мкл через заднюю часть шприца, после чего туда вставлялся поршень и продавливалась жидкость до кончика шприца таким образом, чтобы не оставалось пузырьков воздуха. Шприцы соединялись коннектором, после чего происходило плавное перемешивание до формирования однородной субстанции. Смесь ЛГФ/белок переносилась в один из шприцов, а коннектор заменялся на иглу, с помощью которой в дальнейшем производилось введение липидной фазы с белком в рабочую зону контейнера.
Пример №2
Размещают контейнер в горизонтальном положении. На первом этапе в рабочую зону контейнера вводят раствор преципитанта (8). Объем вводимого раствора составляет 20-40 мкм. Объем отмеряют с помощью градуировки на шприце. Раствор вносят в вершину конуса рабочей зоны, оставляя до начала вершины около 5 мм. Благодаря тому, что конус рабочей зоны достаточно узкий, жидкость заполняет все пространство и остается внутри рабочей зоны под действием сил поверхностного натяжения. Далее в раствор преципитанта (8) вводят смесь липидной губчатой фазы (6). с белком. Введение осуществлялось из шприца с помощью иглы плавно и осторожно. Иглу вводят прямо в раствор преципитанта и добавляют смесь липидной фазы с белком до соотношения к раствору преципитанта от 1 к 2 до 2 к 1. Чем больше доля раствора преципитанта, тем сильнее идет диффузия преципитанта в объем ЛГФ/белок, что позволяет осуществлять дополнительный поиск условий кристаллизации, изменяя пропорции объемов преципитанта и смеси ЛГФ/белок.
Пример №3
После внесения раствора преципитанта и смеси ЛГФ/белок, вход контейнера зарывают пленкой Parafilm "М" (Bemis Company, Inc) или крышкой (5) и в горизонтальном положении помещают на платформу, а затем и в термостат. Инкубацию проводят при постоянной температуре в диапазоне от 15 до 20°С, в зависимости от липида, используемого для приготовления губчатой фазы. Кристаллы белка были цветными, что позволило детектировать их появление с помощью микроскопа без применения поляризатора. Инкубацию проводят 3-7 дней. На фиг. 5 приведена фотография липидной губчатой фазы, со сформированными кристаллами белка, выделенной из реакционной зоны контейнера.
Для извлечения липидной губчатой фазы, содержащей кристаллы, применяют два способа. По первому способу с помощью скальпеля или ножниц отрезают и формируют отверстие в верхней части конуса рабочей зоны контейнера, выполненного из пластмассы, после чего проводят разгерметизацию внутреннего объема снимая с входного отверстия пленку и далее наконечником автоматической пипетки извлекают ЛГФ/белок. По второму способу - сначала удаляют пленку Parafilm или крышку (5), затем надевают наконечник на автоматическую пипетку, после чего формируют отверстие, срезая кончик и далее выдавливают содержимое контейнера через сформированное отверстие.
Промышленная применимость
Разработанный способ предназначен для получения белковых кристаллов, с целью дальнейшего определения структуры белковых молекул, имеющих фундаментальное, промышленное или медицинское значение. Данная техника кристаллизации рассчитана на получение множества кристаллов белка в объемах 20-80 мкл ЛГФ/белок для дальнейшего использования в серийно-поточной кристаллографии.
Источники информации
1. KENYON D.J. et al. CRYSTAL FORMING DEVICE AND AUTOMATED CRYSTALLIZATION SYSTEM. Международная заявка № WO 9307311 (1993-04-15).
2. Крамаренко B.A. и др. УСТРОЙСТВО ДЛЯ ВЫРАЩИВАНИЯ КРИСТАЛЛОВ БИОЛОГИЧЕСКИХ МАКРОМОЛЕКУЛ. Патент РФ №RU2424383 (2011.07.20).
3 Митичкин О.В. и др. УСТРОЙСТВО ДЛЯ ВЫРАЩИВАНИЯ МОНОКРИСТАЛЛОВ БЕЛКА. Патент РФ № RU 2040595 (25.07.1995)
4. Landau Е.М., Rosenbusch J.P. Lipidic cubic phases: A novel concept for the crystallization of membrane proteins (1996) PNAS 93 (25) 14532-14535.
5. Gordeliy V. et al. Method of crystallization of membrane proteins and to compositions, devices and kits to conduct such method. Европейский патент № EP 2832741 (2015-02-04).
6. Wadsten, P. et al. Lipidic sponge phase crystallization of membrane proteins (2006). J. Mol. Biol. 17;364, 44-53.
7. Glaeser R. M. et al. CRYSTALLIZATION OF MEMBRANE PROTEINS IN THREE-DIMENTIONALLY CONNECTED LIPID BILAYER GELS. Межд. Заявка № WO 2006036772 (2006-12-14).
8. Caffreya M. A comprehensive review of the lipid cubic phase or in meso method for crystallizing membrane and soluble proteins and complexes. Acta Crystallogr F Struct Biol Commun. (2015 Jan 1) v. 71(Pt 1): 3-18.
| название | год | авторы | номер документа |
|---|---|---|---|
| КАССЕТА ДЛЯ СИСТЕМЫ КРИСТАЛЛИЗАЦИИ МЕМБРАННЫХ БЕЛКОВ ДЛЯ ЦЕЛЕЙ ПОТОЧНОГО РЕНТГЕНОСТРУКТУРНОГО АНАЛИЗА | 2022 |
|
RU2809851C1 |
| Амфифильные полимеры FABPEG для модификации липидных мембранных систем, используемых в биологии и медицине, способ получения амфифильных полимеров FABPEG для модификации липидных мембранных систем, способ модификации параметров липидных систем с использованием амфифильных полимеров FABPEG и способ смешивания многокомпонентных липидных мембранных систем | 2023 |
|
RU2829345C1 |
| КРИСТАЛЛИЧЕСКИЕ АНТИТЕЛА ПРОТИВ IL-12 ЧЕЛОВЕКА | 2008 |
|
RU2476442C2 |
| Устройство для выращивания кристаллов белка | 1989 |
|
SU1761823A1 |
| МИКРОФЛЮИДНОЕ УСТРОЙСТВО ДЛЯ КРИСТАЛЛИЗАЦИИ БЕЛКОВ В УСЛОВИЯХ НЕВЕСОМОСТИ | 2012 |
|
RU2522613C2 |
| БИОКРИСТАЛЛИЗАТОР | 1992 |
|
RU2042747C1 |
| СПОСОБ ПОЛУЧЕНИЯ РЕНАТУРИРОВАННЫХ МЕМБРАННЫХ БЕЛКОВ | 2005 |
|
RU2306319C1 |
| КОНЦЕНТРИРОВАНИЕ СОКА КОРНЕПЛОДОВ ИЛИ КЛУБНЕЙ ВЫМОРАЖИВАНИЕМ | 2017 |
|
RU2720319C2 |
| БЕЛОК ПЛАЗМАТИЧЕСКИЙ МЕМБРАНЫ АДИПОЦИТА, СПОСОБ ЕГО ПОЛУЧЕНИЯ И КОМПЛЕКС ДЛЯ ЗАПУСКА tyr-ФОСФОРИЛИРОВАНИЯ ИНСУЛИНРЕЦЕПТОРНЫХ СУБСТРАТНЫХ БЕЛКОВ IRS-1 И IRS-2 | 2003 |
|
RU2325399C2 |
| СПОСОБ ОПРЕДЕЛЕНИЯ ЛИПИДПЕРЕНОСЯЩЕЙ СПОСОБНОСТИ БЕЛКОВ | 2005 |
|
RU2302426C2 |


Изобретение относится к биотехнологии. Предложено способ для кристаллизации и поиска условий кристаллизации белковых молекул, в частности интегральных мембранных белков, с использованием липидной губчатой фазы (ЛГФ) применяемой для создания мембраноподобного окружения белков. Способ выращивания кристаллов биологических макромолекул содержит этапы подготовки липидной губчатой фазы, установку кристаллизационного контейнера в горизонтальное положение и введение в рабочую секцию камеры контейнера раствора преципитанта, введение в рабочую камеру контейнера липидной губчатой фазы, герметизацию входного отверстия контейнера и установку кристаллизационного контейнера на платформу держателей контейнеров с возможностью крепления контейнера (1) с наклоном оси контейнера под углом от 0 до 5 градусов относительно поверхности платформы (7), установку, по меньшей мере одной платформы в термостатируемый объем и проведение инкубации для выращивания кристаллов белков, открытие входного отверстия контейнера с отбором фракции липидной губчатой фазы с кристаллами белка и детектирование кристаллов белка. При этом соотношение объема липидной фазы к объему преципитанта выбирают в пределах от 1 к 2 до 2 к 1, а объем липидной губчатой фазы выбирают в пределах от 20 до 80 мкл. 2 з.п. ф-лы, 5 ил.
1. Способ кристаллизации белка для поточной кристаллографии, содержащий следующие этапы: (а) подготовка липидной губчатой фазы; (б) установка кристаллизационного контейнера в горизонтальное положение; (в) введение в рабочую секцию камеры контейнера раствора преципитанта; (г) введение в рабочую камеру контейнера липидной губчатой фазы; (д) герметизация входного отверстия контейнера; (е) установка кристаллизационного контейнера на платформу держателей контейнеров с возможностью крепления контейнера (1) с наклоном оси контейнера под углом от 0 до 5 градусов относительно поверхности платформы (7); (ж) установка по меньшей мере одной платформы в термостатируемый объем в горизонтальном положении и проведение инкубации для выращивания кристаллов белков; (з) открытие входного отверстия контейнера и отбор фракции липидной губчатой фазы с кристаллами белка; (и) детектирование кристаллов белка;
где соотношение объема липидной фазы к объему преципитанта выбирают в пределах от 1 к 2 до 2 к 1;
где объем липидной губчатой фазы выбирают в пределах от 20 до 80 мкл;
где форма рабочей секции камеры контейнера выполнена в виде конуса, с возможностью создания градиента соотношений объемов преципитанта и липидной губчатой фазы вдоль центральной оси рабочей зоны (2) контейнера;
где инкубацию проводят 3-7 дней.
2. Способ кристаллизации белка по п. 1, отличающийся тем, что на этапе (д) герметичное (герметизацию) закрытие входного отверстия контейнера осуществляют пробкой, крышкой, пленкой в зависимости от конструкции контейнера.
3. Способ кристаллизации белка по п. 1, отличающийся тем, что на этапе (з) отбора фракции липидной губчатой фазы из рабочей секции камеры контейнера в дополнение к открытию входного отверстия контейнера вводят дополнительный этап и формируют отверстие в верхней части конуса, через которое выдавливают фракцию липидной губчатой фазы.
| Caffreya M., A comprehensive review of the lipid cubic phase or in meso method for crystallizing membrane and soluble proteins and complexes, Acta Crystallogr F Struct Biol Commun, 2015 Jan 1, v | |||
| Контрольный стрелочный замок | 1920 |
|
SU71A1 |
| WO 2006036772 A2,06.04.2006 | |||
| Wadsten, P | |||
| et al | |||
| Lipidic sponge phase crystallization of membrane proteins, 2006, J | |||
| Mol | |||
| Biol | |||
| Печь для сжигания твердых и жидких нечистот | 1920 |
|
SU17A1 |
Авторы
Даты
2024-05-15—Публикация
2020-12-17—Подача