ОБЛАСТЬ ТЕХНИКИ
Перекрестная ссылка на родственную(ые) заявку(и)
Настоящая заявка претендует на преимущество корейской заявки на патент №10-2020-0060578, поданной 20 мая 2020 года, и полное содержание, раскрытое в документах соответствующих корейских заявок на патент, включено как часть настоящего описания изобретения.
Настоящее изобретение относится к новому мутированному полипептиду, обладающему активностью изопропилмалатсинтазы; полинуклеотиду, кодирующему его; вектору, содержащему полинуклеотид; микроорганизму, включающему мутированный полипептид, полинуклеотид, вектор или их комбинацию; и способу получения L-лейцина посредством культивирования микроорганизма.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
L-Аминокислоты промышленно производят посредством способов ферментации с использованием продуцирующих аминокислоты бактерий, принадлежащих к коринеформным бактериям или семейству Enterobacteriaceae, которые имеют способность продуцировать L-аминокислоту. В качестве таких продуцирующих аминокислоты бактерий для повышения продуктивности используют штаммы, выделенные в природе, а также искусственные мутанты таких штаммов и рекомбинантные штаммы, в которых фермент биосинтеза L-аминокислот усилен посредством генетической рекомбинации.
Среди L-аминокислот L-лейцин является типом незаменимой аминокислоты, которая является дорогостоящей и широко используется в лекарствах, пищевых продуктах, кормовых добавках, промышленных химикатах и тому подобном. Кроме того, L-лейцин главным образом получают с использованием микроорганизмов. Ферментационное получение L-лейцина в основном осуществляют с помощью микроорганизма рода Escherichia или микроорганизма рода Corynebacterium, которые, как известно, биосинтезируют в несколько стадий 2-кетоизокапроат в качестве предшественника из пировиноградной кислоты. Однако ферменты, вовлеченные в биосинтез L-лейцина, вызывают ингибирование по типу обратной связи конечным продуктом, то есть L-лейцином или его производным, затрудняя таким образом крупномасштабное промышленное производство L-лейцина.
Таким образом, авторы настоящего изобретения обнаружили, что мутантный штамм, полученный путем изменения конкретного положения изопропилмалатсинтазы, может оптимизировать активность фермента и, таким образом, может быть использован для получения L-лейцина с высоким выходом, тем самым создав настоящее изобретение.
Литература известного уровня техники
Патентная литература
Патентная литература 1: US 2018-0251772 А1
РАСКРЫТИЕ ИЗОБРЕТЕНИЯ
Техническая задача
Задача настоящего изобретения заключается в предложении мутированного полипептида, обладающего активностью изопропилмалатсинтазы, в котором аминокислотный остаток пролина в положении 247 в аминокислотной последовательности SEQ ID NO: 1 заменен на аминокислотный остаток, отличный от пролина.
Другая задача настоящего изобретения заключается в предложении полинуклеотида, кодирующего мутированный полипептид.
Еще одна задача настоящего изобретения заключается в предложении вектора, содержащего полинуклеотид.
Еще одна задача настоящего изобретения заключается в предложении микроорганизма, содержащего по меньшей мере один из выбранных из группы, состоящей из мутированного полипептида, полинуклеотида и вектора, содержащего полинуклеотид.
Еще одна задача настоящего изобретения заключается в предложении способа получения L-лейцина, включающего стадию культивирования микроорганизма в среде.
Еще одна задача настоящего изобретения заключается в предложении композиции для получения L-лейцина, содержащей по меньшей мере один из выбранных из группы, состоящей из мутированного полипептида, полинуклеотида, кодирующего мутированный полипептид, вектора, содержащего полинуклеотид, и микроорганизма (например, мутированного полипептида по настоящему изобретению, полинуклеотида по настоящему изобретению и/или микроорганизма (рекомбинантной клетки), содержащего вектор по настоящему изобретению).
Еще одна задача настоящего изобретения заключается в том, чтобы предложить применение по меньшей мере одного из выбранных из группы, состоящей из мутированного полипептида, полинуклеотида, кодирующего мутированный полипептид, вектора, содержащего полинуклеотид, и микроорганизма (например, мутированного полипептида по настоящему изобретению, полинуклеотида по настоящему изобретению и/или микроорганизма (рекомбинантной клетки), содержащего вектор по настоящему изобретению) для получения L-лейцина.
Техническое решение
В одном аспекте настоящего изобретения предложен мутированный полипептид, обладающий активностью изопропилмалатсинтазы, в котором аминокислотный остаток в положении 247 от N-конца в аминокислотной последовательности белка изопропилмалатсинтазы SEQ ID NO: 1 или в соответствующем ему положении заменен на другой аминокислотный остаток.
В данном документе термин «изопропилмалатсинтаза (2-изопропилмалатсинтаза, а-изопропилмалатсинтаза)» относится к ферменту, который катализирует конденсацию ацетильной группы ацетил-КоА и 2-кетоизовалерата (3-метил-2-оксобутаноат, 2-экзоизовалерат) с превращением его в изопропилмалат (3-карбокси-3-гидрокси-4-метилпентаноат), который является предшественником L-лейцина. Изопропилмалатсинтаза может включать фермент, имеющий активность превращения, независимо от происхождения микроорганизма. Например, изопропилмалатсинтаза может представлять собой фермент, имеющий происхождение из микроорганизма рода Corynebacterium.
Изопропилмалатсинтаза может содержать аминокислотную последовательность SEQ ID NO: 1 или может состоять из аминокислотной последовательности SEQ ID NO: 1. Кроме того, если фермент имеет активность такую же или соответствующую изопропилмалатсинтазе, как полипептид, имеющий гомологию по меньшей мере 60% или более, 70% или более, 80% или более, 85% или более, 90% или более, 92% или более, 94% или более, 96% или более, 98% или более, или 99% или более, 99,5% или более, или 99,8% или более с аминокислотной последовательностью SEQ ID NO: 1, независимо от происхождения микроорганизма, то полипептид, имеющий аминокислотную последовательность, в которой некоторые последовательности удалены, модифицированы, заменены или добавлены в аминокислотную последовательность SEQ ID NO: 1, также может быть включен в объем настоящего изобретения в качестве изопропилмалатсинтазы.
То есть, даже если его описывают в данном документе как «полипептид (или белок), содержащий аминокислотную последовательность, представленную конкретным номером последовательности», или «полипептид (или белок), состоящий из аминокислотной последовательности, представленной конкретным номером последовательности», то полипептид (или белок), имеющий аминокислотную последовательность, в которой некоторые последовательности удалены, модифицированы, заменены или добавлены, также можно использовать в качестве белка или полипептида, подлежащего мутации в настоящем изобретении, когда он имеет такую же или соответствующую активность, что и полипептид (или белок), состоящий из аминокислотной последовательности с соответствующим номером последовательности. Например, полипептид, имеющий такую же или соответствующую активность, что и «полипептид, состоящий из аминокислотной последовательности SEQ ID NO: 1», может относиться к «полипептиду, состоящему из аминокислотной последовательности SEQ ID NO: 1».
Аминокислотная последовательность изопропилмалатсинтазы и нуклеотидная последовательность гена, кодирующего изопропилмалатсинтазу, могут быть легко получены из баз данных, известных в данной области техники, таких как Национальный центр биотехнологической информации (NCBI) и Банк данных ДНК Японии (DDBJ).
В этом описании изобретения полинуклеотид или полипептид, «содержащий конкретную последовательность нуклеиновой кислоты (нуклеотидную последовательность) или аминокислотную последовательность» может означать, что полинуклеотид или полипептид состоит или по существу содержит конкретную последовательность нуклеиновой кислоты (нуклеотидную последовательность) или аминокислотную последовательность и может интерпретироваться как содержащий последовательности, в которых конкретная последовательность нуклеиновых кислот или аминокислотная последовательность мутирована (удалена, заменена, модифицирована и/или добавлена) (или как не исключающая мутацию) в диапазоне сохранения исходной функции и/или желаемой функции полинуклеотида или полипептида. В одном воплощении полинуклеотид или полипептид, «содержащий конкретную последовательность нуклеиновых кислот (нуклеотидную последовательность) или аминокислотную последовательность» может означать, что полинуклеотид или полипептид (1) состоит из или по существу содержит конкретную последовательность нуклеиновых кислот (нуклеотидную последовательность) или аминокислотную последовательность или (2) состоит из или по существу содержит последовательность нуклеиновой кислоты или аминокислотную последовательность, имеющую гомологию 60% или более, 70% или более, 80% или более, 85% или более, 90% или более, 91% или более, 92% или более, 93% или более, 94% или более, 95% или более, 96% или более, 97% или более, 98% или более, 98% или более, 99,5% или более или 99,9% или более с конкретной последовательностью нуклеиновых кислот (нуклеотидной последовательностью) или аминокислотной последовательностью и сохраняет исходную функцию и/или желаемую функцию.
В этом описании изобретения аминокислотная последовательность изопропилмалатсинтазы, имеющей происхождение из Corynebacterium glutamicum дикого типа (например, АТСС13032), представлена под SEQ ID NO: 1, а нуклеотидная последовательность гена leuA, кодирующего изопропилмалатсинтазу, имеющую происхождение из данного штамма дикого типа, представлена под SEQ ID NO: 2. Было показано, что изопропилмалатсинтаза состоит из 616 аминокислот в SEQ ID NO: 1, но из некоторых литературных источников известно, что она состоит из 581 аминокислоты, так как кодон инициации трансляции указан после 35 аминокислот, и аминокислотная последовательность изопропилмалатсинтазы, состоящая из 581 аминокислоты, представлена под SEQ ID NO: 16. Изопропилмалатсинтаза, состоящая из 581 аминокислоты, может быть включена в объем настоящего изобретения в качестве изопропилмалатсинтазы, и в этом случае положение 247 интерпретируется как положение 212, которое, таким образом, может быть включено в объем настоящего изобретения.
Мутированный полипептид согласно одному воплощению может представлять собой полипептид, в котором:
аминокислотный остаток аргинина в положении 558 (или соответствующем ему положении) в аминокислотной последовательности SEQ ID NO: 1 заменен на аминокислотный остаток, отличный от аргинина, аминокислотный остаток глицина в положении 561 (или соответствующем ему положении) в аминокислотной последовательности SEQ ID NO: 1 заменен на аминокислотный остаток, отличный от глицина, или
полипептид дополнительно модифицирован этими двумя заменами.
В одном воплощении, в случае изопропилмалатсинтазы, состоящей из 581 аминокислоты с SEQ ID NO: 16, положение 558 интерпретируется как положение 523, а положение 561 как положение 526, которое, таким образом, входит в объем настоящего изобретения.
В этом описании изобретения термин «гомология» относится к проценту сходства между двумя полинуклеотидами или полипептидными фрагментами. Гомология между последовательностями от фрагмента до другого фрагмента может быть определена посредством методики, известной в данной области техники. Например, гомология может быть определена посредством упорядочивания информации о последовательности и непосредственного упорядочивания информации о последовательности, то есть таких параметров, как оценка, идентичность и сходство и т.д., двух полинуклеотидных молекул или двух полипептидных молекул с использованием легкодоступной компьютерной программы. Компьютерная программа может представлять собой BLAST (NCBI), CLC Main Workbench (CLC bio), Megalign (DNASTAR Inc) или тому подобные. Кроме того, гомология между полинуклеотидами может быть определена посредством гибридизации полинуклеотидов в условиях образования стабильной двойной нити между гомологичными участками, расщепления с помощью одноцепочечной специфической нуклеазы с последующим подтверждением размера расщепленных фрагментов.
Согласно одному аспекту может быть предложен мутированный полипептид, обладающий активностью изопропилмалатсинтазы, в котором аминокислотный остаток пролина в положении 247 (или соответствующем ему положении) в аминокислотной последовательности SEQ ID NO: 1 заменен на аминокислотный остаток, отличный от пролина.
Согласно другому аспекту может быть предложен мутированный полипептид, обладающий активностью изопропилмалатсинтазы, в котором аминокислотный остаток пролина в положении 212 в аминокислотной последовательности SEQ ID NO: 16 заменен на аминокислотный остаток, отличный от пролина.
В этом описании изобретения «положение ~ в аминокислотной последовательности SEQ ID NO: ~» можно использовать взаимозаменяемо с «положением ~ от N-конца полипептида, состоящего из (или содержащего) аминокислотной последовательности SEQ ID NO: ~».
Аминокислоты, отличные от пролина, могут включать аргинин, аланин, лейцин, изолейцин, валин, фенилаланин, триптофан, метионин, глицин, серии, треонин, цистеин, тирозин, аспарагин, глутамин, лизин, гистидин, аспарагиновую кислоту и глутаминовую кислоту.
Согласно одному воплощению мутированный полипептид может представлять собой полипептид, в котором пролин в положении 247 (или соответствующем ему положении) в аминокислотной последовательности SEQ ID NO: 1 заменен на цистеин.
Согласно одному воплощению мутированный полипептид может содержать аминокислотную последовательность SEQ ID NO: 3 или может состоять из аминокислотной последовательности SEQ ID NO: 3.
Мутированный полипептид согласно одному воплощению может представлять собой полипептид, в котором аминокислотный остаток в положении, соответствующем положению 247 (в случае SEQ ID NO: 16, положение 212) в аминокислотной последовательности полипептида, имеющего гомологию 60% или более, 70% или более, 80% или более, 85% или более, 90% или более, 92% или более, 94% или более, 96% или более, 98% или более, или 99% или более, 99,5% или более, или 99,8% или более с аминокислотной последовательностью SEQ ID NO: 1 (или SEQ ID NO: 16), заменен на другой аминокислотный остаток.
Мутированный полипептид согласно одному воплощению может иметь повышенную активность продуцирования L-лейцина, чем у полипептида, содержащего аминокислотную последовательность SEQ ID NO: 1 (или SEQ ID NO: 16), посредством замены пролина в положении 247 в аминокислотной последовательности SEQ ID NO: 1 (или пролина в положении 212 в аминокислотной последовательности SEQ ID NO: 16) или аминокислоты в положении, соответствующем ему, на другую аминокислоту.
Согласно одному воплощению мутированный полипептид, в котором аминокислотный остаток пролина в положении 247 или аминокислотный остаток в соответствующем ему положении в аминокислотной последовательности полипептида, имеющей гомологию 70% или более, 80% или более, 85% или более, 90% или более, 92% или более, 94% или более, 96% или более, 98% или более, или 99% или более с аминокислотной последовательностью SEQ ID NO: 1 или в аминокислотной последовательности SEQ ID NO: 1 заменен на другой аминокислотный остаток, может обладать активностью изопропилмалатсинтазы. Указанный «другой аминокислотный остаток» может означать другой тип аминокислотного остатка, отличного от аминокислоты (например пролина), который присутствовал в указанном положении (положение 247 в аминокислотной последовательности SEQ ID NO: 1 или положение, соответствующее ему) перед заменой.
Мутированный полипептид согласно одному воплощению может иметь повышенную активность продуцирования L-лейцина, чем у изопропилмалатсинтазы, имеющей происхождение из штамма дикого типа (например изопропилмалатсинтазы, содержащей (или состоящей из) аминокислотную последовательность SEQ ID NO: 1 или SEQ ID NO: 16) посредством замены пролина в положении 247 (или в положении 212) в аминокислотной последовательности SEQ ID NO: 1 (или SEQ ID NO: 16) или аминокислотного остатка в соответствующем ему положении на другой остаток.
Мутированный полипептид согласно одному воплощению может иметь повышенную ферментативную активность изопропилмалатсинтазы, чем у изопропилмалатсинтазы, имеющей происхождение из штамма дикого типа (например изопропилмалатсинтазы, состоящей из аминокислотной последовательности SEQ ID NO: 1 (или SEQ ID NO: 16)) посредством замены пролина в положении 247 (или в положении 212) в аминокислотной последовательности SEQ ID NO: 1 (или SEQ ID NO: 16) или аминокислотного остатка в соответствующем ему положении, на другой остаток.
В этом описании изобретения термин «повышение активности изопропилмалатсинтазы» относится к увеличению активности превращения в изопропилмалат. Таким образом, мутированный полипептид согласно одному воплощению может иметь более высокий уровень активности превращения в изопропилмалат по сравнению с полипептидом, имеющим активность изопропилмалатсинтазы, содержащей аминокислотную последовательность SEQ ID NO: 1 (или SEQ ID NO: 16).
В этом описании изобретения термин «повышение активности» можно использовать взаимозаменяемо с «усиленной активностью». Кроме того, изопропилмалат представляет собой один из предшественников L-лейцина, и, таким образом, использование мутированного полипептида согласно одному воплощению приводит к получению более высокого уровня L-лейцина по сравнению с полипептидом, обладающим активностью изопропилмалатсинтазы, содержащей аминокислотную последовательность SEQ ID NO: 1 (или SEQ ID NO: 16).
Активность превращения в изопропилмалат может быть непосредственно подтверждена путем измерения уровня образованного изопропилмалата или может быть подтверждена опосредованно путем измерения уровня образованного КоА. Ферментативная активность изопропилмалатсинтазы может быть измерена известным способом, например, может быть измерена согласно способу, описанному в Kohlhaw et al. (Methods in Enzymology 166:423-9 (1988)), и может быть измерено изменение поглощения при 412 нм, обусловленное тионитробензоатом (TNB), образованным из DTNB (5,5'-дитиобис-(2-нитробензойная кислота), реагент Эллмана) путем восстановления с использованием полученного КоА, посредством этого определяя активность фермента изопропилмалатсинтазы.
Мутированный полипептид согласно одному воплощению может снижать ингибирование L-лейцином и/или его производным по типу обратной связи по сравнению с изопропилмалатсинтазой, имеющей происхождение из штамма дикого типа (например, изопропилмалатсинтазой, состоящей из аминокислотной последовательности SEQ ID NO: 1), посредством замены пролина в положении 247 (или положении 212) в аминокислотной последовательности SEQ ID NO: 1 (или SEQ ID NO: 16) или аминокислотной последовательности в положении, соответствующем ему, на другую аминокислоту.
В этом описании изобретения термин «ингибирование по типу обратной связи» означает, что конечный продукт ферментативной системы ингибирует реакцию на начальной стадии ферментативной системы. Например, ингибирование по типу обратной связи может означать, что L-лейцин или его производное ингибирует активность изопропилмалатсинтазы, которая опосредует первую стадию его биосинтетического пути. Следовательно, когда ингибирование изопропилмалатсинтазы по типу обратной связи снижается (или ослабляется), продуктивность по L-лейцину может быть увеличена по сравнению со случаем, когда его нет.
В этом описании изобретения термин «производное» может относиться к соединениям, которые, как известно, способны ингибировать способность продуцировать L-лейцин из микроорганизмов посредством индукции ингибирования по типу обратной связи в отношении биосинтеза L-лейцина, который является конечным продуктом настоящего изобретения. Их примеры могут включать изолейцин, терлейцин, норлейцин и/или циклолейцин и т.д.
Согласно одному воплощению мутированный полипептид может представлять собой полипептид, в котором положение, отличное от положения 247 (или положения 212) в аминокислотной последовательности SEQ ID NO: 1 (или SEQ ID NO: 16), дополнительно мутировано, тем самым синергически усиливая один или более эффектов, выбранных из группы, состоящей из (1) увеличения активности продуцирования L-лейцина; (2) увеличения ферментативной активности изопропилмалатсинтазы; и (3) уменьшения ингибирования L-лейцином и/или его производным по типу обратной связи.
Согласно одному воплощению, мутированный полипептид может дополнительно содержать мутации, которые могут проявлять один или более эффектов, выбранных из группы, состоящей из (1) увеличения активности продуцирования L-лейцина; (2) увеличения ферментативной активности изопропилмалатсинтазы; и (3) уменьшения ингибирования L- лейцином и/или его производным по типу обратной связи.
Мутированный полипептид может представлять собой полипептид, в котором:
аминокислотный остаток аргинина в положении 558 (или соответствующем ему положении) в аминокислотной последовательности SEQ ID NO: 1 заменен на аминокислотный остаток, отличный от аргинина,
аминокислотный остаток глицина в положении 561 (или соответствующем ему положении) в аминокислотной последовательности SEQ ID NO: 1 заменен на аминокислотный остаток, отличный от глицина, или полипептид дополнительно модифицирован этими двумя заменами.
Мутированный полипептид может представлять собой полипептид, в котором:
аминокислотный остаток аргинина в положении 523 (или соответствующем ему положении) в аминокислотной последовательности SEQ ID NO: 16 заменен на аминокислотный остаток, отличный от аргинина,
аминокислотный остаток глицина в положении 526 (или соответствующем ему положении) в аминокислотной последовательности SEQ ID NO: 16 заменен на аминокислотный остаток, отличный от глицина, или полипептид дополнительно модифицирован этими двумя заменами.
Аминокислота, отличная от аргинина, может включать аланин, лейцин, изолейцин, валин, пролин, фенилаланин, триптофан, метионин, глицин, серии, треонин, цистеин, тирозин, аспарагин, глутамин, лизин, гистидин, аспарагиновую кислоту и глутаминовую кислоту; и аминокислота, отличная от глицина, может включать аланин, лейцин, изолейцин, валин, пролин, фенилаланин, триптофан, метионин, аргинин, серии, треонин, цистеин, тирозин, аспарагин, глутамин, лизин, гистидин, аспарагиновую кислоту и глутаминовую кислоту; но не ограничиваясь ими.
Согласно одному воплощению, аминокислота, отличная от аргинина, может представлять собой гистидин.
Согласно одному воплощению аминокислота, отличная от глицина, может представлять собой аспарагиновую кислоту.
Согласно одному воплощению мутированный полипептид может представлять собой полипептид, в котором:
аминокислотный остаток аргинина в положении 558 в аминокислотной последовательности SEQ ID NO: 1 заменен на аминокислотный остаток гистидина,
аминокислотный остаток глицина в положении 561 в аминокислотной последовательности SEQ ID NO: 1 заменен на аминокислотный остаток аспарагиновой кислоты, или
полипептид дополнительно модифицирован этими двумя заменами.
Согласно одному воплощению мутированный полипептид может содержать аминокислотную последовательность SEQ ID NO: 5 или может состоять из аминокислотной последовательности SEQ ID NO: 5.
Мутированный полипептид, в котором аминокислотный остаток в положении 247 (или положении 212) в аминокислотной последовательности SEQ ID NO: 1 (или SEQ ID NO: 16) заменен на аминокислотный остаток, отличный от пролина,
мутированный полипептид, в котором аминокислотный остаток аргинина в положении 558 (или положении 523) в аминокислотной последовательности SEQ ID NO: 1 (или SEQ ID NO: 16) заменен на аминокислотный остаток, отличный от аргинина, аминокислотный остаток глицина в положении 561 (или положении 526) заменен на аминокислотный остаток, отличный от глицина, или полипептид дополнительно модифицирован этими двумя заменами, может представлять собой полипептид, в котором:
по сравнению с мутированным полипептидом, в котором (1) изопропилмалатсинтаза, имеющая происхождение из штамма дикого типа (например, изопропилмалатсинтаза, содержащая аминокислотную последовательность SEQ ID NO: 1 или SEQ ID NO: 16), или (2) аминокислотный остаток пролина в положении 247 (или положении 212) в аминокислотной последовательности SEQ ID NO: 1 (или SEQ ID NO: 16) заменен на аминокислотный остаток, отличный от пролина,
один или более эффектов, выбранных из группы, состоящей из следующих (1)-(3), могут быть увеличены:
1) увеличение активности продуцирования L-лейцина;
2) увеличение ферментативной активности изопропилмалатсинтазы; и
3) уменьшение ингибирования L-лейцином и/или его производным по типу обратной связи.
Согласно одному воплощению, в зависимости от комбинации мутаций, в которых аминокислота в положениях 247, 558 и/или 561 (или положениях 212, 523 и/или 526) в аминокислотной последовательности SEQ ID NO: 1 (или SEQ ID NO: 16) заменена на другой тип аминокислоты, мутированный полипептид согласно одному воплощению может иметь синергически усиленный один или более эффектов, выбранных из группы, состоящей из следующих (1)-(3):
1) увеличение активности продуцирования L-лейцина;
2) увеличение ферментативной активности изопропилмалатсинтазы; и
3) уменьшение ингибирования L-лейцином и/или его производным по типу обратной связи.
Эффекты (1)-(3) выше являются такими, как описано выше.
Согласно другому аспекту может быть предложен полинуклеотид, кодирующий мутированный полипептид. В этом описании изобретения термин «полинуклеотид» представляет собой полимер нуклеотидов, в котором нуклеотидные мономеры ковалентно связаны в форме длинной цепи, и представляет собой цепь ДНК или РНК, имеющую определенную длину или длиннее. Более конкретно, это может означать полинуклеотидный фрагмент, кодирующий мутированный полипептид.
Мутированный полипептид является таким, как описано выше.
Полинуклеотид может содержать, без ограничения, полинуклеотидную последовательность, кодирующую мутированный полипептид по настоящему изобретению.
Согласно одному воплощению он может представлять собой полинуклеотид, кодирующий полипептид, в котором аминокислотный остаток пролина в положении 247 (или положении 212) в аминокислотной последовательности SEQ ID NO: 1 (или SEQ ID NO: 16) заменен на аминокислотный остаток, отличный от пролина, или полинуклеотид, кодирующий полипептид, который имеет гомологию 60% или более, 70% или более, 80% или более, 85% или более, 90% или более, 92% или более, 94% или более, 96% или более, 98% или более, или 99% или более, 99,5% или более, или 99,8% или более с аминокислотной последовательностью SEQ ID NO: 1 (или SEQ ID NO: 16), в котором аминокислотный остаток в положении, соответствующем положению 247 (или положению 212) в аминокислотной последовательности SEQ ID NO: 1 (или SEQ ID NO: 16), заменен на другой аминокислотный остаток, или кодирующий полипептид, в котором некоторые из последовательностей удалены, модифицированы, заменены или добавлены к ней.
Согласно одному воплощению полинуклеотид может содержать, без ограничений, если он представляет собой зонд, который может быть получен из известной последовательности гена, например, зонд, способный к гибридизации с комплементарной последовательностью для всей или части полинуклеотидной последовательности в жестких условиях и содержащий последовательность, соответствующую последовательности, кодирующей вариант белка, в котором аминокислота в положении 247 (или положении 212) или соответствующем ему в аминокислотной последовательности SEQ ID NO: 1 (или SEQ ID NO: 16) заменена на другую аминокислоту. Термин «жесткие условия» относится к условиям, при которых образуется так называемый специфический гибрид, в то время как неспецифические гибриды не образуются. Примеры таких условий включают условия, при которых гены, имеющие высокие степени гомологии, такие как гены, имеющие гомологию 60% или более, 70% или более, 80% или более, 85% или более, 90% или более, 92% или более, 94% или более, 96% или более, 98% или более, или 99% или более, 99,5% или более, или 99,8% или более, гибридизуются друг с другом, в то время как гены, имеющие низкие степени гомологии, не гибридизуются друг с другом, или условия, при которых гены промывают 1 раз, а конкретно 2 и 3 раза, при температуре и концентрации соли, эквивалентными 60°С, 1× SSC и 0,1% SDS, в частности 60°С, 0,1× SSC, и 0,1% SDS и более конкретно 68°С, 0,1× SSC и 0,1% SDS, которые представляют собой условия для промывки традиционной Саузерн-гибридизации (Sambrook et al., Molecular Cloning: A Laboratory Manual, 3rd Ed., Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y. (2001)).
Зонд, используемый в гибридизации, может представлять собой часть комплементарной последовательности нуклеотидной последовательности. Такой зонд может быть сконструирован с помощью ПЦР с использованием олигонуклеотида, полученного на основе известной последовательности в качестве праймера и с использованием фрагмента гена, содержащего такую нуклеотидную последовательность в качестве матрицы. Например, фрагмент гена, имеющий длину около 300 п. н., можно использовать в качестве зонда. Более конкретно, в случае использования зонда, имеющего длину примерно 300 п. н., для условий промывки в гибридизации можно рекомендовать 50°С, 2× SSC и 0,1% SDS.
Согласно одному воплощению полинуклеотид может содержать нуклеотидную последовательность SEQ ID NO: 4 или SEQ ID NO: 6, или может состоять из нуклеотидной последовательности SEQ ID NO: 4 или SEQ ID NO: 6, и полинуклеотид, который может быть транслирован в мутированный полипептид согласно одному воплощению вследствие вырожденности кодона, также может быть включен в объем настоящего изобретения.
Согласно другому аспекту может быть предложен вектор, содержащий полинуклеотид.
В этом описании изобретения термин «вектор» относится к любому носителю для клонирования и/или переноса нуклеотидов в клетку-хозяина. Вектор может представлять собой репликон, обеспечивающий репликацию фрагментов, комбинированных с другими фрагментами ДНК. «Репликон» относится к любой генетической единице (например плазмиде, фагу, космиде, хромосоме и вирусу), действующей как самовоспроизводящаяся репликация ДНК in vivo, то есть реплицируемой путем саморегуляции.
В одном воплощении вектор может представлять собой конструкцию ДНК, содержащую полинуклеотидную последовательность, кодирующую целевой белок, который функционально связан с подходящей регуляторной последовательностью, так что целевой белок может экспрессироваться в соответствующем хозяине. Регуляторная последовательность может содержать промотор, способный инициировать транскрипцию, любую операторную последовательность для контроля транскрипции, последовательность, кодирующую соответствующий мРНК-домен связывания рибосомы, и последовательность, контролирующую терминацию транскрипции и трансляции. После трансформации в подходящую клетку-хозяина вектор может реплицироваться или функционировать независимо от генома хозяина, и он может быть интегрирован в сам геном хозяина.
В этом описании изобретения термин «функционально связанный» означает, что последовательность гена функционально связана с промоторной последовательностью, которая инициирует и опосредует транскрипцию полинуклеотида, кодирующего полипептид.
Вектор конкретно не ограничен, пока он способен реплицироваться в клетке-хозяине, и может быть использован любой вектор, известный в данной области техники. Например, вектор может представлять собой природные или рекомбинантные плазмиды, космиды, вирусы и бактериофаги. В качестве фагового вектора или космидного вектора можно использовать MBL3, MBL4, LXII, ASHII, APII, t10, t11, pWE15, М13, λEMBL3, λEMBL4, λFIXII, λDASHII, λZAPII λgt10, λgt11, Charon4A и/или Charon21A и т.д., a также в качестве плазмидного вектора можно использовать векторы pDZ, векторы на основе pBR, векторы на основе pUC, векторы на основе pBluescript II, векторы на основе pGEM, векторы на основе pTZ, векторы на основе pCL и/или векторы на основе рЕТ и т.п. Например, можно использовать векторы pCR2.1, pDC, pDZ, pACYC177, pACYC184, pCL, pECCG117, pUC19, pBR322, pMW118 и/или pCC1BAC и т.п.
Согласно другому аспекту может быть предложен микроорганизм (или рекомбинантная клетка), содержащий по меньшей мере один из выбранных из группы, состоящей из мутированного полипептида, полинуклеотида, кодирующего мутированный полипептид, и вектора, содержащего полинуклеотид.
Подробности, касающиеся мутированного полипептида, полинуклеотида и вектора являются такими, как описано выше.
Микроорганизм (или рекомбинантная клетка) может дополнительно содержать мутацию, которая увеличивает продуцирование L-лейцина, и положение мутации и/или тип гена, подлежащего мутированию, могут быть указаны без ограничений, пока они увеличивают продуцирование L-лейцина.
Микроорганизм (или рекомбинантная клетка) может дополнительно содержать мутацию, которая усиливает активность фермента, вовлеченного в биосинтез L-лейцина. Усиление активности фермента является таким, как описано выше.
Микроорганизм (рекомбинантную клетку) можно использовать без ограничений, пока он представляет собой клетку, способную к трансформации.
Микроорганизм (или рекомбинантная клетка) может иметь способность продуцировать L-лейцин. Микроорганизм (или рекомбинантная клетка) может иметь более улучшенную способность продуцировать L-лейцин или может иметь способностью продуцировать L-лейцин, которой не обладают клетка, родительский штамм и/или штамм дикого типа до рекомбинации.
Микроорганизм (или рекомбинантная клетка) может представлять собой полипептид, в котором аминокислотная последовательность, соответствующая изопропилмалатсинтазе, мутирована таким образом, чтобы повысить ее активность по сравнению со штаммом дикого типа, родительским штаммом и/или клеткой до рекомбинации, или освободить от ингибирования L-лейцина и его производного по типу обратной связи, или может быть достигнуто как увеличение активности фермента, так и освобождение от ингибирования по типу обратной связи.
Микроорганизм (или рекомбинантная клетка) может представлять собой такой, в котором полинуклеотид согласно одному воплощению интегрирован в хромосому, и, например, полинуклеотид согласно одному воплощению может быть заменен на нативный ген leuA (ген, кодирующий изопропилмалатсинтазу) в сайте гена в хромосоме или интегрирован в дополнительный сайт гена.
В этом описании изобретения «обладающий способностью продуцировать L-лейцин» относится к микроорганизмам, у которых способность продуцировать лейцин придана клеткам и/или микроорганизмам, которые не имеют способность продуцировать лейцин, или клеткам и/или микроорганизмам, которые имеют естественную способность продуцировать лейцин. Например, микроорганизмы рода Corynebacterium, имеющие способность продуцировать L-лейцин, относятся к микроорганизму рода Corynebacterium, который имеют улучшенную способность продуцировать L-лейцин в результате вставки внешнего гена, связанного с механизмом продуцирования лейцина, или усиления или инактивации активности нативного гена или самого по себе природного микроорганизма. Микроорганизм может представлять собой микроорганизм рода Corynebacterium.
Микроорганизм рода Corynebacterium может представлять собой Corynebacterium glutamicum, Corynebacterium ammoniagenes, Corynebacterium acetoacidophilum, Corynebacterium acetoglutamicum, Corynebacterium alkanolyticum, Corynebacterium callunae, Corynebacterium lilium, Corynebacterium melassecola, Corynebacterium Thermoaminogenes, Corynebacterium efficiens и/или Corynebacterium Herculis и т.д.
Микроорганизм (или рекомбинантная клетка) может быть искусственно полученным посредством трансформации и/или возникшим естественным путем. Например, микроорганизм (или рекомбинантная клетка) может быть трансформирован полинуклеотидом, кодирующим мутированный полипептид согласно одному воплощению, или вектором, содержащим его.
В этом описании изобретения термин «трансформация» относится к введению гена или полинуклеотида в клетку-хозяина так, чтобы он мог экспрессироваться в клетке-хозяине, и трансформированный ген или полинуклеотид может содержать как форму, вставленную в хромосому клетки-хозяина, так и форму, расположенную вне хромосомы, без ограничений, пока он может экспрессироваться в клетке-хозяине.
В этом описании изобретения способ трансформации включает, без ограничения, пока он представляет собой способ введения гена в клетку и может быть выполнен путем выбора подходящей стандартной методики, известной в данной области техники, в зависимости от клетки-хозяина. Например, можно использовать электропорацию, осаждение фосфатом кальция (CaPO4), осаждение хлоридом кальция (CaCl2), микроинъекцию, ретровирусную инфекцию, способ с полиэтиленгликолем (ПЭГ), способ с DEAE-декстраном, способ катионных липосом и/или способ с ацетатом лития-диметилсульфоксидом (ДМСО), но без ограничения этими.
Микроорганизм (или рекомбинантная клетка) может представлять собой тот, в котором полинуклеотидная последовательность согласно одному воплощению интегрирована в хромосому. Гомологичная рекомбинация позволяет осуществлять обмен фрагментов ДНК на хромосоме с полинуклеотидом согласно одному воплощению, который переносится вектором в клетку, наряду с использованием вектора согласно одному воплощению. Для эффективной рекомбинации между циклической молекулой ДНК вектора и ДНК-мишенью на хромосоме область обмениваемой ДНК, содержащую полинуклеотид согласно одному воплощению, обеспечивают нуклеотидной последовательностью, гомологичной сайту-мишени на конце; и это определяет сайт интеграции вектора и сайт обмена ДНК. Например, полинуклеотид согласно одному воплощению может быть заменен на нативный ген leuA в сайте нативного гена в хромосоме или может быть включен в дополнительный сайт гена.
Согласно другому аспекту может быть предложен способ получения L-лейцина, который включает стадию культивирования микроорганизма (или рекомбинантной клетки) в среде.
В одном воплощении способ может дополнительно включать стадию сбора L-лейцина из культивируемой среды или микроорганизма (или рекомбинантной клетки).
Культивирование можно выполнять в соответствии с подходящей средой и условиями культивирования, известными в данной области техники, должно соответствующим образом удовлетворять потребностям конкретного штамма и может быть подходящим образом модифицировано специалистом в данной области техники.
Способ культивирования может включать, например, периодическое культивирование, непрерывное культивирование, периодическое культивирование с подпиткой или комбинированное культивирование, но без ограничения этим.
Среда для культивирования микроорганизма (или рекомбинантной клетки) может быть известной из литературы (Manual of Methods for General Bacteriology. American Society for Bacteriology. Washington D.C., USA, 1981), но без ограничения этим.
Согласно одному воплощению, среда может содержать различные источники углерода, источники азота и компоненты микроэлементов, и рекомбинантные клетки можно культивировать при регулировании температуры и/или рН в обычной среде, содержащей соответствующий источник углерода, источник азота, аминокислоту, витамин и тому подобное. Источник углерода содержит сахара и углеводы, такие как глюкоза, сахароза, лактоза, фруктоза, мальтоза, крахмал и/или целлюлоза, масла и жиры, такие как соевое масло, подсолнечное масло, касторовое масло и/или кокосовое масло, жирные кислоты, такие как пальмитиновая кислота, стеариновая кислота и/или линолевая кислота, спирты, такие как глицерин и/или этиловый спирт, органические кислоты, такие как уксусная кислота. Эти вещества можно использовать по отдельности или в комбинации двух или более, но без ограничения этим. Источник азота, который можно использовать, может содержать пептон, дрожжевой экстракт, мясной сок, солодовый экстракт, кукурузный отвар, соевую муку и мочевину или неорганические соединения, например, сульфат аммония, хлорид аммония, фосфат аммония, карбонат аммония и нитрат аммония. Источник азота можно также использовать по отдельности или в комбинации из двух или более, но не ограничивается этим. Источник фосфора, который можно использовать, может включать дигидрофосфат калия или гидрофосфат дикалия или соответствующие натрийсодержащие соли, но без ограничения этим. Кроме того, среда может содержать соль металла, такую как сульфат магния или сульфат железа, необходимую для роста, но без ограничения этим. Кроме того, могут содержаться необходимые для роста вещества, такие как аминокислоты и витамины. Кроме того, можно использовать предшественники, подходящие для среды. Среду или отдельные компоненты можно добавлять в загрузочную партию периодическим или непрерывным образом во время процесса культивирования, но не ограничиваясь этим.
Согласно одному воплощению такие соединения, как гидроксид аммония, гидроксид калия, аммиак, фосфорная кислота и серная кислота, могут быть добавлены в культуральную среду микроорганизма соответствующим образом во время культивирования для регулирования рН культуральной среды. Кроме того, образование пузырьков может быть подавлено путем использования во время культивирования пеногасителя, такого как сложный полигликолевый эфир жирных кислот. Кроме того, с целью поддержания аэробного состояния культуральной среды в культуральную среду может быть введен кислород или кислородсодержащий газ (например, воздух). Температура питательной среды может составлять от 20°С до 45°С, от 25°С до 40°С или от 30°С до 37°С. Период культивирования может продолжаться до получения полезного вещества (например, L-лейцина) в требуемом количестве продуцирования, и может составлять, например, от 10 до 160 часов.
Стадию выделения или сбора L-лейцина из культивируемого микроорганизма (или рекомбинантной клетки) и/или культивируемой среды можно выполнять с использованием подходящего способа, известного в данной области техники, в зависимости от способа культивирования. Например, можно использовать центрифугирование, фильтрацию, экстракцию, распыление, сушку, дистилляцию, осаждение, кристаллизацию, электрофорез, фракционное растворение (например, осаждение сульфатом аммония) и/или хроматографию (например, ионообменную, аффинную, гидрофобную и эксклюзионную), но без ограничения этим. Культуральная среда относится к среде, в которой культивировали микроорганизм (или рекомбинантную клетку).
Согласно одному воплощению стадию выделения или сбора L-лейцина можно выполнять путем центрифугирования культуры при низкой скорости для удаления биомассы и выделения полученного супернатанта с помощью ионообменной хроматографии.
Способ получения L-лейцина может дополнительно включать стадию очистки L-лейцина.
Согласно другому аспекту может быть предложена композиция для получения L-лейцина, содержащая по меньшей мере один из выбранных из группы, состоящей из мутированного полипептида по настоящему изобретению, полинуклеотида, кодирующего мутированный полипептид, вектора, содержащего полинуклеотид, и микроорганизма (например, мутированного полипептида по настоящему изобретению, полинуклеотида по настоящему изобретению и/или микроорганизма (рекомбинантной клетки), содержащего вектор по настоящему изобретению).
Композиция по настоящему изобретению может дополнительно содержать любой подходящий эксципиент, обычно используемый в композициях для получения аминокислот, и эксципиент, например, может представлять собой консервант, смачивающий агент, диспергирующий агент, суспендирующий агент, буферизующий агент, стабилизирующий агент или изотонический агент, но без ограничения этим.
В композиции по настоящему изобретению мутированные полипептиды, полинуклеотиды, векторы, микроорганизмы и среды являются такими же, как те, которые описаны в других аспектах выше.
Согласно другому аспекту может быть предложено применение по меньшей мере одного из выбранных из группы, состоящей из мутированного полипептида, полинуклеотида, кодирующего мутированный полипептид, вектора, содержащего полинуклеотид, и микроорганизма (например, мутированного полипептида по настоящему изобретению, полинуклеотида по настоящему изобретению и/или микроорганизма (рекомбинантной клетки), содержащего вектор по настоящему изобретению) для продуцирования L-лейцина.
При использовании настоящего изобретения мутированные полипептиды, полинуклеотиды, векторы, микроорганизмы и среды являются такими же, как те, которые описаны в других аспектах выше.
БЛАГОПРИЯТНЫЕ ЭФФЕКТЫ
Посредством применения мутированного полипептида согласно воплощению можно получать L-лейцин с высоким выходом.
ПОДРОБНОЕ ОПИСАНИЕ ВОПЛОЩЕНИЙ
Далее настоящее изобретение будет описано более подробно со ссылкой на следующие примеры, но объем настоящего изобретения не предназначен для ограничения этими примерами.
Пример 1. Конструирование библиотеки ДНК, кодирующей мутированную изопропилмалатсинтазу
Пример 1-1. Конструирование вектора, содержащего leuA
Для того чтобы сконструировать библиотеку мутантов leuA, кодирующую вариант, обладающий активностью изопропилмалатсинтазы, сначала сконструировали рекомбинантный вектор, содержащий leuA.
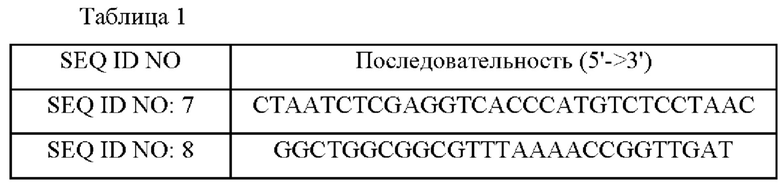
Для амплификации гена leuA (SEQ ID NO: 2), кодирующего белок LeuA (2-изопропилмалатсинтаза) (SEQ ID NO: 1, код доступа Uniprot: P42455), имеющий происхождение из Corynebacterium glutamicum дикого типа, выполняли способ ПЦР, используя хромосому Corynebacterium glutamicum АТСС13032 дикого штамма в качестве матрицы и используя праймеры SEQ ID NO: 7 и 8 в следующих условиях повторяющихся 25 циклов: денатурация при 94°С в течение 1 мин, отжиг при 58°С в течение 30 сек и полимеризация при 72°С в течение 1 мин с использованием ДНК-полимеразы Pfu. Конкретные последовательности используемых праймеров приведены в Таблице 1 ниже.
Амплифицированный ПЦР-продукт клонировали в вектор Е. coli pCR2.1 с использованием набора для клонирования ТОРО (Invitrogen) в соответствии с руководством производителя с получением "pCR-leuA".
Пример 1-2. Конструирование библиотеки мутантов leuA
На основе вектора, сконструированного в Примере 1-1, была сконструирована библиотека мутантов leuA с использованием набора для ПЦР с внесением ошибок (clontech Diversify ® PCR Random Mutagenesis Kit). В условиях, когда имели место от О до 3 мутаций на 1000 п. н., реакцию ПЦР выполняли с использованием вектора pCR-leuA в качестве матрицы и с использованием праймеров SEQ ID NO: 7 и SEQ ID NO: 8. Конкретно, в качестве условия, когда имели место от 0 до 3 мутаций на 1000 п. н., реакцию ПЦР выполняли при следующих условиях: предварительный нагрев при 94°С в течение 30 секунд, и затем 25 циклов при 94°С в течение 30 секунд и 68°С в течение 1 мин и 30 сек. Полученный ПЦР-продукт использовали в качестве мегапраймера (50-125 нг), и реакцию ПЦР выполняли посредством повторяющихся 25 циклов при 95°С в течение 50 с, при 60°С в течение 50 с и при 68°С в течение 12 м с последующей обработкой DpnI. Обработанный Dpnl ПЦР-продукт трансформировали в Е. coli DH5α методом теплового шока и наносили на твердую среду LB, содержащую канамицин (25 мг/л). После отбора 20 трансформированных колоний получали плазмиды и анализировали нуклеотидную последовательность. В результате было подтверждено, что мутации были введены во взаимно отличающихся положениях с частотой 2 мутации/кб. Было взято примерно 20000 трансформированных колоний Е. coli и экстрагированы плазмиды, которые получили название "библиотека pTOPO-leuA".
Пример 2. Оценка сконструированной библиотеки и отбор вариантов
Пример 2-1. Отбор мутантных штаммов с количественно повышенном продукцией L-лейцина
Библиотеку pTOPO-leuA, сконструированную в Примере 1-2, трансформировали в Corynebacterium glutamicum дикого типа АТСС13032 с помощью обработки электропорацией, трансформированный штамм распределяли на питательной среде (Таблица 2), содержащей 25 мг/л канамицина, и отбирали колонии из 10000 штаммов, в которые был вставлен мутантный ген. Каждая отобранная колония была названа от АТСС13032/рТОРО_leuA(mt) 1 до АТСС13032/рТОРО_leuA(mt) 10000. Для идентификации колоний с количественно повышенной продукцией L-лейцина, среди 10000 полученных колоний для каждой колонии оценивали титр ферментации следующим образом.

Каждую колонию инокулировали в 250 мл колбу с угловой перегородкой, содержащую 25 мкг/мл канамицина в 25 мл стерилизованной в автоклаве среды для продуцирования (Таблица 2), используя платиновую петлю, и затем подвергали культивированию со встряхиванием при 30°С со скоростью встряхивания 200 об/мин в течение 60 часов. После завершения культивирования количество продуцируемого L-лейцина измеряли способом с использованием высокоэффективной жидкостной хроматографии (ВЭЖХ, SHIMAZDU LC20A).
Из 10000 полученных колоний был отобран один штамм (АТСС13032/ рТОРО_leuA(mt)5306), имеющий наиболее улучшенную способность продуцировать L-лейцин по сравнению со штаммом Corynebacterium glutamicum дикого типа (АТСС13032). Концентрация L-лейцина, продуцированного в отобранном штамме (АТСС13032/pTOPO_leuA(mt)5306), показана в Таблице 3 ниже.

Как показано в Таблице 3, штамм Corynebacterium glutamicum ATCC13032/pTOPO_leuA(mt) 5306, имеющий мутацию в гене leuA, увеличил способность продуцировать L-лейцин примерно в 1,5 раза по сравнению с родительским штаммом Corynebacterium glutamicum АТСС13032.
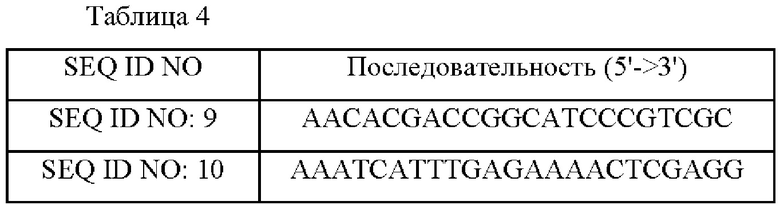
Пример 2-2. Подтверждение мутаций в мутантных штаммах с повышенным продуцированием L-лейцина Для подтверждения мутации гена leuA штамма Corynebacterium glutamicum ATCC13032/pTOPO_leuA(mt) 5306 выполняли ПЦР с использованием ДНК штамма АТСС13032/рТОРО_leuA(mt)5306 в качестве матрицы и с использованием праймеров SEQ ID NO: 9 и SEQ ID NO: 10, перечисленных в Таблице 4, в следующих условиях: денатурация при 94°С в течение 5 мин, затем 30 циклов при 94°С в течение 30 сек, при 55°С в течение 30 сек и при 72°С в течение 1 мин и 30 сек, затем при 72°С в течение 5 мин, и проводили секвенирование ДНК.
В результате секвенирования было подтверждено, что в штамме ATCC13032/pTOPO_leuA(mt)5306, СС, которые представляют собой 739-ый и 740-ой нуклеотиды гена leuA, заменены на TG. Это означает способность кодировать вариант (далее Р247С), в котором пролин, который представляет собой аминокислоту в положении 247 (положение 212, если белок LeuA состоит из 581 аминокислоты (SEQ ID NO: 16), так как кодон инициации трансляции указывают после 35 аминокислот, на основании известной литературы; далее представлено только как положение 247) белка LeuA, заменен на цистеин. Аминокислотная последовательность варианта LeuA (Р247С) и нуклеотидная последовательность варианта leuA, кодирующего его, являются такими же, как в SEQ ID NO: 3 и SEQ ID NO: 4, соответственно.
В следующих примерах была предпринята попытка подтвердить, влияет ли мутация (Р247С) на количество продуцирования L-лейцина микроорганизмом рода Corynebacterium.
Пример 3. Подтверждение способности отобранных мутантных штаммов продуцировать L-лейцин
Пример 3-1. Конструирование инсерционных векторов, содержащих мутацию leuA
В этом примере, чтобы ввести выбранную мутацию (Р247С) в штаммы с использованием метода сайт-направленного мутагенеза, была предпринята попытка сконструировать вектор для вставки. ПЦР выполняли с использованием хромосомы Corynebacterium glutamicum дикого типа (АТСС13032) в качестве матрицы и с использованием праймеров SEQ ID NO: 11 и 12 и пар праймеров SEQ ID NO: 13 и 14. Конкретно, ПЦР выполняли при следующих условиях: денатурация при 94°С в течение 5 мин, затем 30 циклов при 94°С в течение 30 сек, при 55°С в течение 30 сек и при 72°С в течение 1 мин и 30 сек, затем при 72°С в течение 5 мин. Конкретные последовательности используемых праймеров приведены в Таблице 5.

Полученный ПЦР-продукт расщепляли с помощью фермента рестрикции Smal с получением линейного вектора pDZ, и гомологичную последовательность концевого 15-го основания между фрагментами ДНК подвергали слиянию и клонировали с использованием фермента In-Fusion, посредством этого получая вектор "pDZ-leuA (Р247С)", в котором пролин (Pro), который представляет собой 247-ую аминокислоту leuA, заменен на цистеин (Cys).
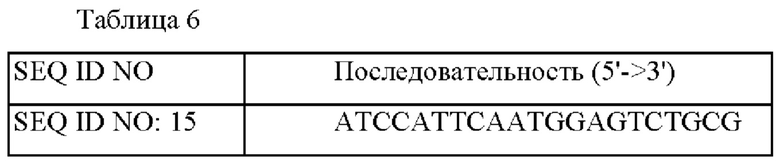
Пример 3-2. Введение мутации гена leuA в штамм АТСС13032 Вектор pDZ-leuA (Р247С), сконструированный в Примере 3-1, трансформировали в АТСС13032 посредством обработки электропорацией, и штаммы, имеющие вектор, вставленный в хромосому путем рекомбинации гомологичной последовательности, отбирали в среде, содержащей 25 мг/л канамицина. Отобранный первичный штамм снова подвергали вторичному кроссинговеру, и отбирали штамм, в котором в гене leuA была введена мутация. Подтверждение того, введена или нет мутация гена leuA в конечный трансформированный штамм, осуществляли с помощью анализа нуклеотидных последовательностей после выполнения ПЦР с использованием праймеров SEQ ID NO: 9 и SEQ ID NO: 15 в следующих условиях: при 94°С в течение 5 мин, затем 30 циклов при 94°С в течение 30 сек / при 55°С в течение 30 сек / при 72°С в течение 90 сек, затем при 72°С в течение 5 мин. В результате анализа нуклеотидной последовательности было подтверждено, что СС, где 739-ый и 740-ой нуклеотиды гена leuA в хромосоме штамма был заменен на TG, и мутация leuA, кодирующего LeuA, в которой 247-ая аминокислота пролин (Pro) была заменена на цистеин (Cys), были введены в данный штамм. Полученный штамм был назван "АТСС 13032_1еиА_Р247С". Конкретные последовательности используемых праймеров приведены в Таблицах 4 и 6.
Пример 3-3. Оценка способности мутантных штаммов продуцировать L-лейцин
Чтобы оценить способность штамма АТСС13032_leuA_Р247С продуцировать L-лейцин, полученный в Примере 3-2, оценивали титр ферментации в колбе аналогично способу Примера 2. Родительские штаммы, Corynebacterium glutamicum АТСС13032 и ATCC13032_leuA_P247C, соответственно, инокулировали в 250 мл колбу с угловыми перегородками, содержащую 25 мл среды для продуцирования, используя платиновую петлю, и затем подвергали культивированию со встряхиванием при 30°С со скоростью встряхивания 200 об/мин в течение 60 часов для получения L-лейцина. После завершения культивирования измеряли количество продуцируемого L-лейцина посредством ВЭЖХ, и концентрация L-лейцина в культуральной среде для каждого штамма показана в Таблице 7 ниже.

Как показано в Таблице 7, АТСС 13032_leuA_Р 247 С повышал выход L-лейцина примерно в 1,55 раза по сравнению с исходным штаммом Corynebacterium glutamicum АТСС13032.
Пример 4. Оценка способности продуцировать лейцин у мутантных продуцирующих лейцин штаммов Так как штамм дикого типа рода Corynebacterium продуцирует следовое количество L-лейцина, был получен продуцирующий лейцин штамм, имеющий происхождение из АТСС13032, и мутацию (Р247С), отобранную в Примере 2, вводили для подтверждения способности продуцировать L-лейцин. Конкретный эксперимент проводили следующим образом.
Пример 4-1. Получение продуцирующего L-лейцин штамма (штамм CJL-8100)
В качестве штамма для получения L-лейцина с высокой концентрацией был получен штамм, имеющий происхождение из АТСС13032, содержащий следующие мутации: (1) мутацию (R558H), в которой аргинин, который представляет собой 558-ую аминокислоту белка LeuA, заменен на гистидин посредством замены G, который представляет собой 1673-ий нуклеотид гена leuA, на А, и (2) мутацию (G561D), в которой глицин, который представляет собой 561-ую аминокислоту, заменен на аспарагиновую кислоту посредством замены GC, которые представляют собой 1682-ой и 1683-ий нуклеотиды гена leuA, на AT.
Конкретно, вектор pDZ-leuA (R558H, G561D), содержащий мутацию гена leuA (KR10-2018-0077008 А), трансформировали в Corynebacterium glutamicum АТСС13032 посредством обработки электропорацией, и штамм, имеющий вектор, вставленный в хромосому путем рекомбинации гомологичной последовательности, отбирали в среде, содержащей 25 мг/л канамицина. Отобранный первичный штамм снова подвергали вторичному кроссинговеру, и отбирали штамм, в который была введена мутация гена leuA. Наконец, подтверждали, введены или не введены мутации трансформированного штамма, выполняя ПЦР с использованием праймеров SEQ ID NO: 7 и SEQ ID NO: 13 в следующих условиях: при 94°С в течение 5 мин, затем 30 циклов при 94°С в течение 30 сек/ 55°С в течение 30 секунд/ 72°С в течение 90 секунд, затем при 72°С в течение 5 минут, и анализировали нуклеотидную последовательность, тем самым подтвердив, что были введены мутации R558H и G561D. Конкретные последовательности используемых праймеров представлены в Таблицах 1 и 5. Штамм АТСС13032 leuA (R558H, G561D), трансформированный вектором pDZ-leuA (R558H, G561D), был назван "CJL-8100".
Пример 4-2. Конструирование инсерционного вектора, содержащего мутацию leuA
В этом примере, для того чтобы ввести мутацию (Р247С), отобранную в Примере 2, в CJL-8100, который представляет собой штамм, продуцирующий L-лейцин, в котором две мутации (R558H, G561D) введены в LeuA, предприняли попытку сконструировать вектор для вставки.
Выполняли ПЦР с использованием хромосомы штамма CJL-8100 в качестве матрицы и с использованием праймеров SEQ ID NO: 9 и 10 и пар праймеров SEQ ID NO: 11 и 12. ПЦР выполняли в следующих условиях: денатурация при 94°С в течение 5 мин, затем 30 циклов при 94°С в течение 30 сек, при 55°С в течение 30 сек и при 72°С в течение 1 мин и 30 сек с последующей полимеризацией при 72°С в течение 5 мин. Полученный ПЦР-продукт расщепляли ферментом рестрикции SmaI с получением линейного вектора pDZ и гомологичную последовательность концевого 15 основания между фрагментами ДНК подвергали слиянию и клонировали с использованием фермента In-Fusion, посредством этого был сконструирован вектор pDZ-leuA(P247C, R558H, G561D), который содержит мутацию leuA, кодирующую вариант LeuA, в котором аргинин, который представляет собой 558-ую аминокислоту, заменен на гистидин, и глицин, который представляет собой 561-ую аминокислоту, заменен на аспарагиновую кислоту в аминокислотной последовательности LeuA штамма дикого типа, и пролин (Pro), 247-ая аминокислота LeuA, заменена на цистеин (Cys).
Пример 4-3. Введение и оценка мутанта LeuA (Р247С) в штамме CLJ-8100 CJL-8100, который представляет собой продуцирующий L-лейцин штамм, трансформировали с помощью вектора pDZ-leuA (Р247С, R558H, G561D), полученного в Примере 4-2, и штаммы, в которых вектор был вставлен в хромосому путем рекомбинации гомологичных последовательностей, отбирали в среде, содержащей 25 мг/л из канамицина. Отобранный первичный штамм снова подвергали вторичному кроссинговеру и затем отбирали штамм, в который была введена мутация целевого гена. Подтверждение того, введена или нет мутация гена leuA у конечного трансформированного штамма, осуществляли посредством анализа нуклеотидных последовательностей после проведения ПЦР с использованием праймеров SEQ ID NO: 9 и SEQ ID NO: 15 в следующих условиях: при 94°С в течение 5 мин, затем 30 циклов при 94°С 30 сек/55°С в течение 30 секунд/72°С в течение 90 секунд, затем при 72°С в течение 5 минут. В результате анализа нуклеотидной последовательности подтверждено, что мутация leuA, кодирующей вариант LeuA (Р247С, R558H, G561D), в котором аргинин, который представляет собой 558-ую аминокислоту белка LeuA, заменен на гистидин, глицин, который представляет собой 561-ую аминокислоту, заменен на аспарагиновую кислоту, и пролин (Pro), который представляет собой 247-ую аминокислоту, заменен на цистеин (Cys) посредством замены G, который представляет собой 1673-ий нуклеотид гена leuA, на A, GC, которые представляют собой 1682-ой и 1683-ий нуклеотиды, на AT, и СС, которые представляют собой 739-ый и 740-ой нуклеотиды, на TG в хромосоме штамма, были введены в данный штамм. Полученный CJL8100 leuA Р247С назвали "СА13-8105" и депонировали в Корейский центр культур микроорганизмов (КССМ), который является международным депозитарием в соответствии с Будапештским договором, 29 апреля 2020 года под указанным номером депонирования. Аминокислотная последовательность варианта LeuA (Р247С, R558H, G561D), содержащая эти три мутации, и нуклеотидная последовательность варианта leuA, кодирующего ее, являются такими, как показано в SEQ ID NO: 5 и SEQ ID NO: 6, соответственно.
Штаммы АТСС 13032, полученные CJL-8100 и СА 13-8105, оценивали на способность продуцировать L-лейцин. Конкретно, культивирование в колбе выполняли таким же образом, как в Примере 2-2, и после завершения культивирования количество продуцирования L-лейцина родительским штаммом и мутантным штаммом измеряли посредством ВЭЖХ, и результаты представили в Таблице 8 ниже.

Как показано в Таблице 8, продуцирующий L-лейцин штамм Corynebacterium glutamicum CJL8100 улучшил способность продуцировать L-лейцин примерно на 130% по сравнению с исходным штаммом АТСС13032. Штамм СА13-8105, который дополнительно включает мутацию leuA_Р247С в штамме CJL8100, улучшил способность продуцировать L-лейцин примерно на 150% по сравнению с родительским штаммом CJL8100. На основании приведенных выше результатов можно подтвердить, что аминокислота в положении 247 в аминокислотной последовательности белка LeuA является важным положением для активности продуцирования L-лейцина.
Пример 4-4. Измерение активности изопропилмалатсинтазы в штамме с введенным вариантом LeuA
С целью измерения активности изопропилмалатсинтазы в CJL-8100 и СА13-8105, которые представляют собой продуцирующие L-лейцин штаммы, полученные в Примере 4-3, эксперимент выполняли следующим способом.
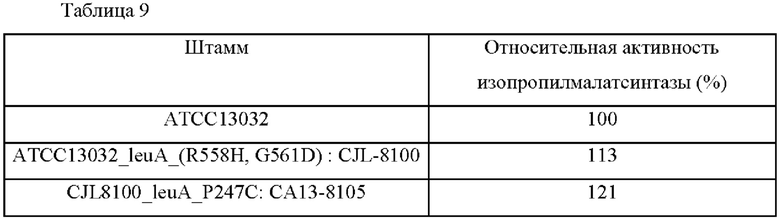
Штаммы (CJL-8100, СА13-8105) и АТСС13032 дикого типа инокулировали соответственно в колбу 250 мл с угловыми перегородками, содержащую по 25 мл каждой посевной среды (среда для продуцирования в Таблице 2), используя платиновую петлю, и затем подвергали культивированию при встряхивании при 30°С со скоростью встряхивания 200 оборотов в минуту в течение 16 часов. После завершения культивирования культуральный раствор центрифугировали, надосадочную жидкость отбрасывали и осадок суспендировали и промывали буферным раствором для лизиса, клетки разрушали с помощью шарикового гомогенизатора. Количественное определение белка в лизате основано на методе анализа Брэдфорда, и использовали лизат, содержащий 100 мкг/мл белка. Активность фермента изопропилмалатсинтазы измеряли путем измерения изменения поглощения при 412 нм, обусловленного тионитробензоатом (TNB), образованным из DTNB (5,5'-дитиобис-(2-нитробензойная кислота), реагент Эллмана) путем восстановления с использованием продуцированного на данный момент КоА.
Результаты измерения активности изопропилмалатсинтазы в каждом штамме приведены в Таблице 9 ниже.
Далее, чтобы подтвердить степень освобождения от ингибирования по типу обратной связи вышеуказанного фермента лейцином, измеряли КоА, полученный при использовании раствора, содержащего 100 мкг/л белка, в условиях, при которых добавляли 2 г/л лейцина, тем самым измеряя активность изопропилмалатсинтазы.
Результаты измерения активности изопропилмалатсинтазы в каждом штамме приведены в Таблице 10 ниже.
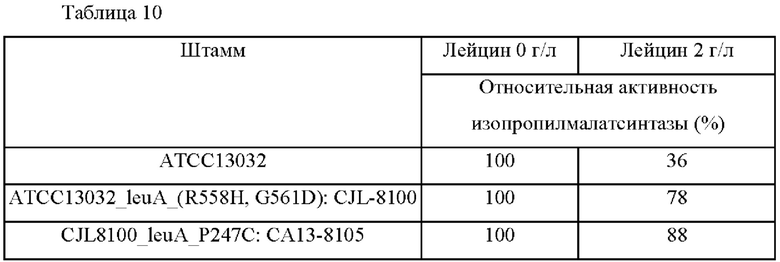
Как показано в Таблицах 9 и 10, было подтверждено, что продуцирующие L-лейцин штаммы CJL-8100 и СА13-8105, трансформированные вектором экспрессии мутанта LeuA, увеличили активность изопропилмалатсинтазы в 1,13 раза и 1,21 раза, соответственно, по сравнению с контрольным Corynebacterium glutamicum АТСС 13032. Кроме того, было подтверждено, что продуцирующие L-лейцин штаммы, поддерживали активность фермента изопропилмалатсинтазы на уровне 78% и 88%, соответственно, даже в условиях добавления 2 г/л лейцина, указывая на то, что ингибирование по типу обратной связи лейцином освобождалось.
На основании вышеизложенного специалист в области техники, к которой относится настоящее изобретение, сможет понять, что настоящее изобретение может быть воплощено в других конкретных формах без изменения технических концепций или существенных характеристик настоящего изобретения. В этом отношении примерные воплощения, раскрытые здесь, предназначены только для иллюстративных целей и не должны истолковываться как ограничивающие объем настоящего изобретения. Напротив, настоящее изобретение предназначено для охвата не только примерных воплощений, но также различных альтернатив, модификаций, эквивалентов и других воплощений, которые могут входить в сущность и объем настоящего изобретения, как определено в прилагаемой формуле изобретения.
Номер доступа
Название депозитария: Корейский культурный центр микроорганизмов
Номер доступа: KCCM12709P
Дата депонирования: 20200429
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> CJ CheilJedang Corporation
<120> Новый полипептид и способ получения L-лейцина с его
использованием
<130> OPP20210722KR
<150> KR 10-2020-0060578
<151> 2020-05-20
<160> 16
<170> KoPatentIn 3.0
<210> 1
<211> 616
<212> PRT
<213> Artificial Sequence
<220>
<223> LeuA AA (616 аминокислот)
<400> 1
Met Ser Pro Asn Asp Ala Phe Ile Ser Ala Pro Ala Lys Ile Glu Thr
1 5 10 15
Pro Val Gly Pro Arg Asn Glu Gly Gln Pro Ala Trp Asn Lys Gln Arg
20 25 30
Gly Ser Ser Met Pro Val Asn Arg Tyr Met Pro Phe Glu Val Glu Val
35 40 45
Glu Asp Ile Ser Leu Pro Asp Arg Thr Trp Pro Asp Lys Lys Ile Thr
50 55 60
Val Ala Pro Gln Trp Cys Ala Val Asp Leu Arg Asp Gly Asn Gln Ala
65 70 75 80
Leu Ile Asp Pro Met Ser Pro Glu Arg Lys Arg Arg Met Phe Glu Leu
85 90 95
Leu Val Gln Met Gly Phe Lys Glu Ile Glu Val Gly Phe Pro Ser Ala
100 105 110
Ser Gln Thr Asp Phe Asp Phe Val Arg Glu Ile Ile Glu Lys Gly Met
115 120 125
Ile Pro Asp Asp Val Thr Ile Gln Val Leu Val Gln Ala Arg Glu His
130 135 140
Leu Ile Arg Arg Thr Phe Glu Ala Cys Glu Gly Ala Lys Asn Val Ile
145 150 155 160
Val His Phe Tyr Asn Ser Thr Ser Ile Leu Gln Arg Asn Val Val Phe
165 170 175
Arg Met Asp Lys Val Gln Val Lys Lys Leu Ala Thr Asp Ala Ala Glu
180 185 190
Leu Ile Lys Thr Ile Ala Gln Asp Tyr Pro Asp Thr Asn Trp Arg Trp
195 200 205
Gln Tyr Ser Pro Glu Ser Phe Thr Gly Thr Glu Val Glu Tyr Ala Lys
210 215 220
Glu Val Val Asp Ala Val Val Glu Val Met Asp Pro Thr Pro Glu Asn
225 230 235 240
Pro Met Ile Ile Asn Leu Pro Ser Thr Val Glu Met Ile Thr Pro Asn
245 250 255
Val Tyr Ala Asp Ser Ile Glu Trp Met His Arg Asn Leu Asn Arg Arg
260 265 270
Asp Ser Ile Ile Leu Ser Leu His Pro His Asn Asp Arg Gly Thr Gly
275 280 285
Val Gly Ala Ala Glu Leu Gly Tyr Met Ala Gly Ala Asp Arg Ile Glu
290 295 300
Gly Cys Leu Phe Gly Asn Gly Glu Arg Thr Gly Asn Val Cys Leu Val
305 310 315 320
Thr Leu Ala Leu Asn Met Leu Thr Gln Gly Val Asp Pro Gln Leu Asp
325 330 335
Phe Thr Asp Ile Arg Gln Ile Arg Ser Thr Val Glu Tyr Cys Asn Gln
340 345 350
Leu Arg Val Pro Glu Arg His Pro Tyr Gly Gly Asp Leu Val Phe Thr
355 360 365
Ala Phe Ser Gly Ser His Gln Asp Ala Val Asn Lys Gly Leu Asp Ala
370 375 380
Met Ala Ala Lys Val Gln Pro Gly Ala Ser Ser Thr Glu Val Ser Trp
385 390 395 400
Glu Gln Leu Arg Asp Thr Glu Trp Glu Val Pro Tyr Leu Pro Ile Asp
405 410 415
Pro Lys Asp Val Gly Arg Asp Tyr Glu Ala Val Ile Arg Val Asn Ser
420 425 430
Gln Ser Gly Lys Gly Gly Val Ala Tyr Ile Met Lys Thr Asp His Gly
435 440 445
Leu Gln Ile Pro Arg Ser Met Gln Val Glu Phe Ser Thr Val Val Gln
450 455 460
Asn Val Thr Asp Ala Glu Gly Gly Glu Val Asn Ser Lys Ala Met Trp
465 470 475 480
Asp Ile Phe Ala Thr Glu Tyr Leu Glu Arg Thr Ala Pro Val Glu Gln
485 490 495
Ile Ala Leu Arg Val Glu Asn Ala Gln Thr Glu Asn Glu Asp Ala Ser
500 505 510
Ile Thr Ala Glu Leu Ile His Asn Gly Lys Asp Val Thr Val Asp Gly
515 520 525
Arg Gly Asn Gly Pro Leu Ala Ala Tyr Ala Asn Ala Leu Glu Lys Leu
530 535 540
Gly Ile Asp Val Glu Ile Gln Glu Tyr Asn Gln His Ala Arg Thr Ser
545 550 555 560
Gly Asp Asp Ala Glu Ala Ala Ala Tyr Val Leu Ala Glu Val Asn Gly
565 570 575
Arg Lys Val Trp Gly Val Gly Ile Ala Gly Ser Ile Thr Tyr Ala Ser
580 585 590
Leu Lys Ala Val Thr Ser Ala Val Asn Arg Ala Leu Asp Val Asn His
595 600 605
Glu Ala Val Leu Ala Gly Gly Val
610 615
<210> 2
<211> 1851
<212> DNA
<213> Artificial Sequence
<220>
<223> leuA NT
<400> 2
atgtctccta acgatgcatt catctccgca cctgccaaga tcgaaacccc agttgggcct
60
cgcaacgaag gccagccagc atggaataag cagcgtggct cctcaatgcc agttaaccgc
120
tacatgcctt tcgaggttga ggtagaagat atttctctgc cggaccgcac ttggccagat
180
aaaaaaatca ccgttgcacc tcagtggtgt gctgttgacc tgcgtgacgg caaccaggct
240
ctgattgatc cgatgtctcc tgagcgtaag cgccgcatgt ttgagctgct ggttcagatg
300
ggcttcaaag aaatcgaggt cggtttccct tcagcttccc agactgattt tgatttcgtt
360
cgtgagatca tcgaaaaggg catgatccct gacgatgtca ccattcaggt tctggttcag
420
gctcgtgagc acctgattcg ccgtactttt gaagcttgcg aaggcgcaaa aaacgttatc
480
gtgcacttct acaactccac ctccatcctg cagcgcaacg tggtgttccg catggacaag
540
gtgcaggtga agaagctggc taccgatgcc gctgaactaa tcaagaccat cgctcaggat
600
tacccagaca ccaactggcg ctggcagtac tcccctgagt ccttcaccgg cactgaggtt
660
gagtacgcca aggaagttgt ggacgcagtt gttgaggtca tggatccaac tcctgagaac
720
ccaatgatca tcaacctgcc ttccaccgtt gagatgatca cccctaacgt ttacgcagac
780
tccattgaat ggatgcaccg caatctaaac cgtcgtgatt ccattatcct gtccctgcac
840
ccgcacaatg accgtggcac cggcgttggc gcagctgagc tgggctacat ggctggcgct
900
gaccgcatcg aaggctgcct gttcggcaac ggcgagcgca ccggcaacgt ctgcctggtc
960
accctggcac tgaacatgct gacccagggc gttgaccctc agctggactt caccgatata
1020
cgccagatcc gcagcaccgt tgaatactgc aaccagctgc gcgttcctga gcgccaccca
1080
tacggcggtg acctggtctt caccgctttc tccggttccc accaggacgc tgtgaacaag
1140
ggtctggacg ccatggctgc caaggttcag ccaggtgcta gctccactga agtttcttgg
1200
gagcagctgc gcgacaccga atgggaggtt ccttacctgc ctatcgatcc aaaggatgtc
1260
ggtcgcgact acgaggctgt tatccgcgtg aactcccagt ccggcaaggg cggcgttgct
1320
tacatcatga agaccgatca cggtctgcag atccctcgct ccatgcaggt tgagttctcc
1380
accgttgtcc agaacgtcac cgacgctgag ggcggcgagg tcaactccaa ggcaatgtgg
1440
gatatcttcg ccaccgagta cctggagcgc accgcaccag ttgagcagat cgcgctgcgc
1500
gtcgagaacg ctcagaccga aaacgaggat gcatccatca ccgccgagct catccacaac
1560
ggcaaggacg tcaccgtcga tggccgcggc aacggcccac tggccgctta cgccaacgcg
1620
ctggagaagc tgggcatcga cgttgagatc caggaataca accagcacgc ccgcacctcg
1680
ggcgacgatg cagaagcagc cgcctacgtg ctggctgagg tcaacggccg caaggtctgg
1740
ggcgtcggca tcgctggctc catcacctac gcttcgctga aggcagtgac ctccgccgta
1800
aaccgcgcgc tggacgtcaa ccacgaggca gtcctggctg gcggcgttta a
1851
<210> 3
<211> 616
<212> PRT
<213> Artificial Sequence
<220>
<223> LeuA P247C AA (616 аминокислот)
<400> 3
Met Ser Pro Asn Asp Ala Phe Ile Ser Ala Pro Ala Lys Ile Glu Thr
1 5 10 15
Pro Val Gly Pro Arg Asn Glu Gly Gln Pro Ala Trp Asn Lys Gln Arg
20 25 30
Gly Ser Ser Met Pro Val Asn Arg Tyr Met Pro Phe Glu Val Glu Val
35 40 45
Glu Asp Ile Ser Leu Pro Asp Arg Thr Trp Pro Asp Lys Lys Ile Thr
50 55 60
Val Ala Pro Gln Trp Cys Ala Val Asp Leu Arg Asp Gly Asn Gln Ala
65 70 75 80
Leu Ile Asp Pro Met Ser Pro Glu Arg Lys Arg Arg Met Phe Glu Leu
85 90 95
Leu Val Gln Met Gly Phe Lys Glu Ile Glu Val Gly Phe Pro Ser Ala
100 105 110
Ser Gln Thr Asp Phe Asp Phe Val Arg Glu Ile Ile Glu Lys Gly Met
115 120 125
Ile Pro Asp Asp Val Thr Ile Gln Val Leu Val Gln Ala Arg Glu His
130 135 140
Leu Ile Arg Arg Thr Phe Glu Ala Cys Glu Gly Ala Lys Asn Val Ile
145 150 155 160
Val His Phe Tyr Asn Ser Thr Ser Ile Leu Gln Arg Asn Val Val Phe
165 170 175
Arg Met Asp Lys Val Gln Val Lys Lys Leu Ala Thr Asp Ala Ala Glu
180 185 190
Leu Ile Lys Thr Ile Ala Gln Asp Tyr Pro Asp Thr Asn Trp Arg Trp
195 200 205
Gln Tyr Ser Pro Glu Ser Phe Thr Gly Thr Glu Val Glu Tyr Ala Lys
210 215 220
Glu Val Val Asp Ala Val Val Glu Val Met Asp Pro Thr Pro Glu Asn
225 230 235 240
Pro Met Ile Ile Asn Leu Cys Ser Thr Val Glu Met Ile Thr Pro Asn
245 250 255
Val Tyr Ala Asp Ser Ile Glu Trp Met His Arg Asn Leu Asn Arg Arg
260 265 270
Asp Ser Ile Ile Leu Ser Leu His Pro His Asn Asp Arg Gly Thr Gly
275 280 285
Val Gly Ala Ala Glu Leu Gly Tyr Met Ala Gly Ala Asp Arg Ile Glu
290 295 300
Gly Cys Leu Phe Gly Asn Gly Glu Arg Thr Gly Asn Val Cys Leu Val
305 310 315 320
Thr Leu Ala Leu Asn Met Leu Thr Gln Gly Val Asp Pro Gln Leu Asp
325 330 335
Phe Thr Asp Ile Arg Gln Ile Arg Ser Thr Val Glu Tyr Cys Asn Gln
340 345 350
Leu Arg Val Pro Glu Arg His Pro Tyr Gly Gly Asp Leu Val Phe Thr
355 360 365
Ala Phe Ser Gly Ser His Gln Asp Ala Val Asn Lys Gly Leu Asp Ala
370 375 380
Met Ala Ala Lys Val Gln Pro Gly Ala Ser Ser Thr Glu Val Ser Trp
385 390 395 400
Glu Gln Leu Arg Asp Thr Glu Trp Glu Val Pro Tyr Leu Pro Ile Asp
405 410 415
Pro Lys Asp Val Gly Arg Asp Tyr Glu Ala Val Ile Arg Val Asn Ser
420 425 430
Gln Ser Gly Lys Gly Gly Val Ala Tyr Ile Met Lys Thr Asp His Gly
435 440 445
Leu Gln Ile Pro Arg Ser Met Gln Val Glu Phe Ser Thr Val Val Gln
450 455 460
Asn Val Thr Asp Ala Glu Gly Gly Glu Val Asn Ser Lys Ala Met Trp
465 470 475 480
Asp Ile Phe Ala Thr Glu Tyr Leu Glu Arg Thr Ala Pro Val Glu Gln
485 490 495
Ile Ala Leu Arg Val Glu Asn Ala Gln Thr Glu Asn Glu Asp Ala Ser
500 505 510
Ile Thr Ala Glu Leu Ile His Asn Gly Lys Asp Val Thr Val Asp Gly
515 520 525
Arg Gly Asn Gly Pro Leu Ala Ala Tyr Ala Asn Ala Leu Glu Lys Leu
530 535 540
Gly Ile Asp Val Glu Ile Gln Glu Tyr Asn Gln His Ala Arg Thr Ser
545 550 555 560
Gly Asp Asp Ala Glu Ala Ala Ala Tyr Val Leu Ala Glu Val Asn Gly
565 570 575
Arg Lys Val Trp Gly Val Gly Ile Ala Gly Ser Ile Thr Tyr Ala Ser
580 585 590
Leu Lys Ala Val Thr Ser Ala Val Asn Arg Ala Leu Asp Val Asn His
595 600 605
Glu Ala Val Leu Ala Gly Gly Val
610 615
<210> 4
<211> 1851
<212> DNA
<213> Artificial Sequence
<220>
<223> LeuA P247C NT
<400> 4
atgtctccta acgatgcatt catctccgca cctgccaaga tcgaaacccc agttgggcct
60
cgcaacgaag gccagccagc atggaataag cagcgtggct cctcaatgcc agttaaccgc
120
tacatgcctt tcgaggttga ggtagaagat atttctctgc cggaccgcac ttggccagat
180
aaaaaaatca ccgttgcacc tcagtggtgt gctgttgacc tgcgtgacgg caaccaggct
240
ctgattgatc cgatgtctcc tgagcgtaag cgccgcatgt ttgagctgct ggttcagatg
300
ggcttcaaag aaatcgaggt cggtttccct tcagcttccc agactgattt tgatttcgtt
360
cgtgagatca tcgaaaaggg catgatccct gacgatgtca ccattcaggt tctggttcag
420
gctcgtgagc acctgattcg ccgtactttt gaagcttgcg aaggcgcaaa aaacgttatc
480
gtgcacttct acaactccac ctccatcctg cagcgcaacg tggtgttccg catggacaag
540
gtgcaggtga agaagctggc taccgatgcc gctgaactaa tcaagaccat cgctcaggat
600
tacccagaca ccaactggcg ctggcagtac tcccctgagt ccttcaccgg cactgaggtt
660
gagtacgcca aggaagttgt ggacgcagtt gttgaggtca tggatccaac tcctgagaac
720
ccaatgatca tcaacctgtg ttccaccgtt gagatgatca cccctaacgt ttacgcagac
780
tccattgaat ggatgcaccg caatctaaac cgtcgtgatt ccattatcct gtccctgcac
840
ccgcacaatg accgtggcac cggcgttggc gcagctgagc tgggctacat ggctggcgct
900
gaccgcatcg aaggctgcct gttcggcaac ggcgagcgca ccggcaacgt ctgcctggtc
960
accctggcac tgaacatgct gacccagggc gttgaccctc agctggactt caccgatata
1020
cgccagatcc gcagcaccgt tgaatactgc aaccagctgc gcgttcctga gcgccaccca
1080
tacggcggtg acctggtctt caccgctttc tccggttccc accaggacgc tgtgaacaag
1140
ggtctggacg ccatggctgc caaggttcag ccaggtgcta gctccactga agtttcttgg
1200
gagcagctgc gcgacaccga atgggaggtt ccttacctgc ctatcgatcc aaaggatgtc
1260
ggtcgcgact acgaggctgt tatccgcgtg aactcccagt ccggcaaggg cggcgttgct
1320
tacatcatga agaccgatca cggtctgcag atccctcgct ccatgcaggt tgagttctcc
1380
accgttgtcc agaacgtcac cgacgctgag ggcggcgagg tcaactccaa ggcaatgtgg
1440
gatatcttcg ccaccgagta cctggagcgc accgcaccag ttgagcagat cgcgctgcgc
1500
gtcgagaacg ctcagaccga aaacgaggat gcatccatca ccgccgagct catccacaac
1560
ggcaaggacg tcaccgtcga tggccgcggc aacggcccac tggccgctta cgccaacgcg
1620
ctggagaagc tgggcatcga cgttgagatc caggaataca accagcacgc ccgcacctcg
1680
ggcgacgatg cagaagcagc cgcctacgtg ctggctgagg tcaacggccg caaggtctgg
1740
ggcgtcggca tcgctggctc catcacctac gcttcgctga aggcagtgac ctccgccgta
1800
aaccgcgcgc tggacgtcaa ccacgaggca gtcctggctg gcggcgttta a
1851
<210> 5
<211> 616
<212> PRT
<213> Artificial Sequence
<220>
<223> LeuA P247C R558H G561D AA (616 аминокислот)
<400> 5
Met Ser Pro Asn Asp Ala Phe Ile Ser Ala Pro Ala Lys Ile Glu Thr
1 5 10 15
Pro Val Gly Pro Arg Asn Glu Gly Gln Pro Ala Trp Asn Lys Gln Arg
20 25 30
Gly Ser Ser Met Pro Val Asn Arg Tyr Met Pro Phe Glu Val Glu Val
35 40 45
Glu Asp Ile Ser Leu Pro Asp Arg Thr Trp Pro Asp Lys Lys Ile Thr
50 55 60
Val Ala Pro Gln Trp Cys Ala Val Asp Leu Arg Asp Gly Asn Gln Ala
65 70 75 80
Leu Ile Asp Pro Met Ser Pro Glu Arg Lys Arg Arg Met Phe Glu Leu
85 90 95
Leu Val Gln Met Gly Phe Lys Glu Ile Glu Val Gly Phe Pro Ser Ala
100 105 110
Ser Gln Thr Asp Phe Asp Phe Val Arg Glu Ile Ile Glu Lys Gly Met
115 120 125
Ile Pro Asp Asp Val Thr Ile Gln Val Leu Val Gln Ala Arg Glu His
130 135 140
Leu Ile Arg Arg Thr Phe Glu Ala Cys Glu Gly Ala Lys Asn Val Ile
145 150 155 160
Val His Phe Tyr Asn Ser Thr Ser Ile Leu Gln Arg Asn Val Val Phe
165 170 175
Arg Met Asp Lys Val Gln Val Lys Lys Leu Ala Thr Asp Ala Ala Glu
180 185 190
Leu Ile Lys Thr Ile Ala Gln Asp Tyr Pro Asp Thr Asn Trp Arg Trp
195 200 205
Gln Tyr Ser Pro Glu Ser Phe Thr Gly Thr Glu Val Glu Tyr Ala Lys
210 215 220
Glu Val Val Asp Ala Val Val Glu Val Met Asp Pro Thr Pro Glu Asn
225 230 235 240
Pro Met Ile Ile Asn Leu Cys Ser Thr Val Glu Met Ile Thr Pro Asn
245 250 255
Val Tyr Ala Asp Ser Ile Glu Trp Met His Arg Asn Leu Asn Arg Arg
260 265 270
Asp Ser Ile Ile Leu Ser Leu His Pro His Asn Asp Arg Gly Thr Gly
275 280 285
Val Gly Ala Ala Glu Leu Gly Tyr Met Ala Gly Ala Asp Arg Ile Glu
290 295 300
Gly Cys Leu Phe Gly Asn Gly Glu Arg Thr Gly Asn Val Cys Leu Val
305 310 315 320
Thr Leu Ala Leu Asn Met Leu Thr Gln Gly Val Asp Pro Gln Leu Asp
325 330 335
Phe Thr Asp Ile Arg Gln Ile Arg Ser Thr Val Glu Tyr Cys Asn Gln
340 345 350
Leu Arg Val Pro Glu Arg His Pro Tyr Gly Gly Asp Leu Val Phe Thr
355 360 365
Ala Phe Ser Gly Ser His Gln Asp Ala Val Asn Lys Gly Leu Asp Ala
370 375 380
Met Ala Ala Lys Val Gln Pro Gly Ala Ser Ser Thr Glu Val Ser Trp
385 390 395 400
Glu Gln Leu Arg Asp Thr Glu Trp Glu Val Pro Tyr Leu Pro Ile Asp
405 410 415
Pro Lys Asp Val Gly Arg Asp Tyr Glu Ala Val Ile Arg Val Asn Ser
420 425 430
Gln Ser Gly Lys Gly Gly Val Ala Tyr Ile Met Lys Thr Asp His Gly
435 440 445
Leu Gln Ile Pro Arg Ser Met Gln Val Glu Phe Ser Thr Val Val Gln
450 455 460
Asn Val Thr Asp Ala Glu Gly Gly Glu Val Asn Ser Lys Ala Met Trp
465 470 475 480
Asp Ile Phe Ala Thr Glu Tyr Leu Glu Arg Thr Ala Pro Val Glu Gln
485 490 495
Ile Ala Leu Arg Val Glu Asn Ala Gln Thr Glu Asn Glu Asp Ala Ser
500 505 510
Ile Thr Ala Glu Leu Ile His Asn Gly Lys Asp Val Thr Val Asp Gly
515 520 525
Arg Gly Asn Gly Pro Leu Ala Ala Tyr Ala Asn Ala Leu Glu Lys Leu
530 535 540
Gly Ile Asp Val Glu Ile Gln Glu Tyr Asn Gln His Ala His Thr Ser
545 550 555 560
Asp Asp Asp Ala Glu Ala Ala Ala Tyr Val Leu Ala Glu Val Asn Gly
565 570 575
Arg Lys Val Trp Gly Val Gly Ile Ala Gly Ser Ile Thr Tyr Ala Ser
580 585 590
Leu Lys Ala Val Thr Ser Ala Val Asn Arg Ala Leu Asp Val Asn His
595 600 605
Glu Ala Val Leu Ala Gly Gly Val
610 615
<210> 6
<211> 1851
<212> DNA
<213> Artificial Sequence
<220>
<223> LeuA P247C R558H G561D NT
<400> 6
atgtctccta acgatgcatt catctccgca cctgccaaga tcgaaacccc agttgggcct
60
cgcaacgaag gccagccagc atggaataag cagcgtggct cctcaatgcc agttaaccgc
120
tacatgcctt tcgaggttga ggtagaagat atttctctgc cggaccgcac ttggccagat
180
aaaaaaatca ccgttgcacc tcagtggtgt gctgttgacc tgcgtgacgg caaccaggct
240
ctgattgatc cgatgtctcc tgagcgtaag cgccgcatgt ttgagctgct ggttcagatg
300
ggcttcaaag aaatcgaggt cggtttccct tcagcttccc agactgattt tgatttcgtt
360
cgtgagatca tcgaaaaggg catgatccct gacgatgtca ccattcaggt tctggttcag
420
gctcgtgagc acctgattcg ccgtactttt gaagcttgcg aaggcgcaaa aaacgttatc
480
gtgcacttct acaactccac ctccatcctg cagcgcaacg tggtgttccg catggacaag
540
gtgcaggtga agaagctggc taccgatgcc gctgaactaa tcaagaccat cgctcaggat
600
tacccagaca ccaactggcg ctggcagtac tcccctgagt ccttcaccgg cactgaggtt
660
gagtacgcca aggaagttgt ggacgcagtt gttgaggtca tggatccaac tcctgagaac
720
ccaatgatca tcaacctgtg ttccaccgtt gagatgatca cccctaacgt ttacgcagac
780
tccattgaat ggatgcaccg caatctaaac cgtcgtgatt ccattatcct gtccctgcac
840
ccgcacaatg accgtggcac cggcgttggc gcagctgagc tgggctacat ggctggcgct
900
gaccgcatcg aaggctgcct gttcggcaac ggcgagcgca ccggcaacgt ctgcctggtc
960
accctggcac tgaacatgct gacccagggc gttgaccctc agctggactt caccgatata
1020
cgccagatcc gcagcaccgt tgaatactgc aaccagctgc gcgttcctga gcgccaccca
1080
tacggcggtg acctggtctt caccgctttc tccggttccc accaggacgc tgtgaacaag
1140
ggtctggacg ccatggctgc caaggttcag ccaggtgcta gctccactga agtttcttgg
1200
gagcagctgc gcgacaccga atgggaggtt ccttacctgc ctatcgatcc aaaggatgtc
1260
ggtcgcgact acgaggctgt tatccgcgtg aactcccagt ccggcaaggg cggcgttgct
1320
tacatcatga agaccgatca cggtctgcag atccctcgct ccatgcaggt tgagttctcc
1380
accgttgtcc agaacgtcac cgacgctgag ggcggcgagg tcaactccaa ggcaatgtgg
1440
gatatcttcg ccaccgagta cctggagcgc accgcaccag ttgagcagat cgcgctgcgc
1500
gtcgagaacg ctcagaccga aaacgaggat gcatccatca ccgccgagct catccacaac
1560
ggcaaggacg tcaccgtcga tggccgcggc aacggcccac tggccgctta cgccaacgcg
1620
ctggagaagc tgggcatcga cgttgagatc caggaataca accagcacgc ccacacctcg
1680
gatgacgatg cagaagcagc cgcctacgtg ctggctgagg tcaacggccg caaggtctgg
1740
ggcgtcggca tcgctggctc catcacctac gcttcgctga aggcagtgac ctccgccgta
1800
aaccgcgcgc tggacgtcaa ccacgaggca gtcctggctg gcggcgttta a
1851
<210> 7
<211> 30
<212> DNA
<213> Artificial Sequence
<220>
<223> pCR-leuA_F
<400> 7
ctaatctcga ggtcacccat gtctcctaac
30
<210> 8
<211> 27
<212> DNA
<213> Artificial Sequence
<220>
<223> pCR-leuA_R
<400> 8
ggctggcggc gtttaaaacc ggttgat
27
<210> 9
<211> 22
<212> DNA
<213> Artificial Sequence
<220>
<223> leuA_секвенирование_F
<400> 9
aacacgaccg gcatcccgtc gc
22
<210> 10
<211> 23
<212> DNA
<213> Artificial Sequence
<220>
<223> leuA_секвенирование_R
<400> 10
aaatcatttg agaaaactcg agg
23
<210> 11
<211> 45
<212> DNA
<213> Artificial Sequence
<220>
<223> leuA_P247C_Up_F
<400> 11
gtgaattcga gctcggtacc caaatcattt gagaaaactc gaggc
45
<210> 12
<211> 45
<212> DNA
<213> Artificial Sequence
<220>
<223> leuA_P247C_Up_R
<400> 12
ggtgatcatc tcaacggtgg aacacaggtt gatgatcatt gggtt
45
<210> 13
<211> 45
<212> DNA
<213> Artificial Sequence
<220>
<223> leuA_P247C_Down_F
<400> 13
aacccaatga tcatcaacct gtgttccacc gttgagatga tcacc
45
<210> 14
<211> 42
<212> DNA
<213> Artificial Sequence
<220>
<223> leuA_P247C_Down_R
<400> 14
ggtcgactct agaggatccc caagaaggca acatcggaca gc
42
<210> 15
<211> 21
<212> DNA
<213> Artificial Sequence
<220>
<223> leuA_секвенирование_R
<400> 15
atccattcaa tggagtctgc g
21
<210> 16
<211> 581
<212> PRT
<213> Artificial Sequence
<220>
<223> LeuA AA (581 аминокислот)
<400> 16
Met Pro Val Asn Arg Tyr Met Pro Phe Glu Val Glu Val Glu Asp Ile
1 5 10 15
Ser Leu Pro Asp Arg Thr Trp Pro Asp Lys Lys Ile Thr Val Ala Pro
20 25 30
Gln Trp Cys Ala Val Asp Leu Arg Asp Gly Asn Gln Ala Leu Ile Asp
35 40 45
Pro Met Ser Pro Glu Arg Lys Arg Arg Met Phe Glu Leu Leu Val Gln
50 55 60
Met Gly Phe Lys Glu Ile Glu Val Gly Phe Pro Ser Ala Ser Gln Thr
65 70 75 80
Asp Phe Asp Phe Val Arg Glu Ile Ile Glu Lys Gly Met Ile Pro Asp
85 90 95
Asp Val Thr Ile Gln Val Leu Val Gln Ala Arg Glu His Leu Ile Arg
100 105 110
Arg Thr Phe Glu Ala Cys Glu Gly Ala Lys Asn Val Ile Val His Phe
115 120 125
Tyr Asn Ser Thr Ser Ile Leu Gln Arg Asn Val Val Phe Arg Met Asp
130 135 140
Lys Val Gln Val Lys Lys Leu Ala Thr Asp Ala Ala Glu Leu Ile Lys
145 150 155 160
Thr Ile Ala Gln Asp Tyr Pro Asp Thr Asn Trp Arg Trp Gln Tyr Ser
165 170 175
Pro Glu Ser Phe Thr Gly Thr Glu Val Glu Tyr Ala Lys Glu Val Val
180 185 190
Asp Ala Val Val Glu Val Met Asp Pro Thr Pro Glu Asn Pro Met Ile
195 200 205
Ile Asn Leu Pro Ser Thr Val Glu Met Ile Thr Pro Asn Val Tyr Ala
210 215 220
Asp Ser Ile Glu Trp Met His Arg Asn Leu Asn Arg Arg Asp Ser Ile
225 230 235 240
Ile Leu Ser Leu His Pro His Asn Asp Arg Gly Thr Gly Val Gly Ala
245 250 255
Ala Glu Leu Gly Tyr Met Ala Gly Ala Asp Arg Ile Glu Gly Cys Leu
260 265 270
Phe Gly Asn Gly Glu Arg Thr Gly Asn Val Cys Leu Val Thr Leu Ala
275 280 285
Leu Asn Met Leu Thr Gln Gly Val Asp Pro Gln Leu Asp Phe Thr Asp
290 295 300
Ile Arg Gln Ile Arg Ser Thr Val Glu Tyr Cys Asn Gln Leu Arg Val
305 310 315 320
Pro Glu Arg His Pro Tyr Gly Gly Asp Leu Val Phe Thr Ala Phe Ser
325 330 335
Gly Ser His Gln Asp Ala Val Asn Lys Gly Leu Asp Ala Met Ala Ala
340 345 350
Lys Val Gln Pro Gly Ala Ser Ser Thr Glu Val Ser Trp Glu Gln Leu
355 360 365
Arg Asp Thr Glu Trp Glu Val Pro Tyr Leu Pro Ile Asp Pro Lys Asp
370 375 380
Val Gly Arg Asp Tyr Glu Ala Val Ile Arg Val Asn Ser Gln Ser Gly
385 390 395 400
Lys Gly Gly Val Ala Tyr Ile Met Lys Thr Asp His Gly Leu Gln Ile
405 410 415
Pro Arg Ser Met Gln Val Glu Phe Ser Thr Val Val Gln Asn Val Thr
420 425 430
Asp Ala Glu Gly Gly Glu Val Asn Ser Lys Ala Met Trp Asp Ile Phe
435 440 445
Ala Thr Glu Tyr Leu Glu Arg Thr Ala Pro Val Glu Gln Ile Ala Leu
450 455 460
Arg Val Glu Asn Ala Gln Thr Glu Asn Glu Asp Ala Ser Ile Thr Ala
465 470 475 480
Glu Leu Ile His Asn Gly Lys Asp Val Thr Val Asp Gly Arg Gly Asn
485 490 495
Gly Pro Leu Ala Ala Tyr Ala Asn Ala Leu Glu Lys Leu Gly Ile Asp
500 505 510
Val Glu Ile Gln Glu Tyr Asn Gln His Ala Arg Thr Ser Gly Asp Asp
515 520 525
Ala Glu Ala Ala Ala Tyr Val Leu Ala Glu Val Asn Gly Arg Lys Val
530 535 540
Trp Gly Val Gly Ile Ala Gly Ser Ile Thr Tyr Ala Ser Leu Lys Ala
545 550 555 560
Val Thr Ser Ala Val Asn Arg Ala Leu Asp Val Asn His Glu Ala Val
565 570 575
Leu Ala Gly Gly Val
580
<---
Изобретение относится к биотехнологии. Предложен мутированный полипептид, обладающий активностью изопропилмалатсинтазы, содержащий аминокислотную последовательность SEQ ID NO:1 или SEQ ID NO: 16, где пролин в положении 247 или 212 соответственно заменен на цистеин. Также предложен мутированный полипептид, обладающий активностью изопропилмалатсинтазы, содержащий аминокислотную последовательность SEQ ID NO:1, где (1) пролин в положении 247 заменен на цистеин и (2) где аргинин в положении 558 заменен на гистидин и/или где глицин в положении 561 заменен на аспарагиновую кислоту. Также предложены полинуклеотид, кодирующий указанный мутированный полипептид, вектор экспрессии, содержащий указанный полинуклеотид, микроорганизм, обладающий способностью продуцировать L-лейцин, композиция для получения L-лейцина и способ получения L-лейцина. Изобретение позволяет получить L-лейцин с высоким выходом. 8 н. и 5 з.п. ф-лы, 10 табл., 4 пр.
1. Мутированный полипептид, обладающий активностью изопропилмалатсинтазы, содержащий аминокислотную последовательность SEQ ID NO: 1 или SEQ ID NO: 16, где пролин в положении 247 или 212 соответственно заменен на цистеин.
2. Мутированный полипептид по п. 1, содержащий аминокислотную последовательность SEQ ID NO: 3.
3. Мутированный полипептид, обладающий активностью изопропилмалатсинтазы, содержащий аминокислотную последовательность SEQ ID NO: 1,
(1) где пролин в положении 247 заменен на цистеин; и
(2) где аргинин в положении 558 заменен на гистидин, и/или
где глицин в положении 561 заменен на аспарагиновую кислоту.
4. Мутированный полипептид по п. 3, содержащий аминокислотную последовательность SEQ ID NO: 5.
5. Полинуклеотид, кодирующий мутированный полипептид по любому из пп. 1-4.
6. Вектор экспрессии, содержащий полинуклеотид по п. 5.
7. Микроорганизм, обладающий способностью продуцировать L-лейцин, содержащий по меньшей мере один из выбранных из группы, состоящей из мутированного полипептида по любому из пп. 1-4, полинуклеотида, кодирующего данный мутированный полипептид, и вектора, содержащего данный полинуклеотид.
8. Микроорганизм по п. 7, представляющий собой микроорганизм рода Corynebacterium.
9. Микроорганизм по п. 8, где микроорганизм рода Corynebacterium представляет собой Corynebacterium glutamicum.
10. Способ получения L-лейцина, включающий стадию культивирования микроорганизма по п. 7 в среде.
11. Способ получения L-лейцина по п. 10, дополнительно включающий стадию сбора L-лейцина из культивируемой среды или микроорганизма.
12. Композиция для получения L-лейцина, содержащая по меньшей мере один из выбранных из группы, состоящей из мутированного полипептида по любому из пп. 1-4, полинуклеотида, кодирующего данный мутированный полипептид, вектора, содержащего данный полинуклеотид, и микроорганизма, содержащего данный полипептид, данный полинуклеотид или данный вектор; и эксципиент.
13. Применение по меньшей мере одного, выбранного из группы, состоящей из мутированного полипептида по любому из пп. 1-4, полинуклеотида, кодирующего данный мутированный полипептид, вектора, содержащего данный полинуклеотид, и микроорганизма, содержащего данный полипептид, данный полинуклеотид или данный вектор, для получения L-лейцина.
| NCBI Reference Sequence: WP_015439406.1, 19.05.2013 | |||
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| WO 2018124440 A2, 05.07.2018 | |||
| Микроорганизм, продуцирующий L-лейцин, и способ получения L-лейцина с использованием этого микроорганизма | 2016 |
|
RU2693663C1 |
| МУТАНТНАЯ АЛЬФА-ИЗОПРОПИЛМАЛАТ СИНТАЗА (IPMS), ДНК, КОДИРУЮЩАЯ МУТАНТНУЮ IPMS, СПОСОБ ПОЛУЧЕНИЯ ШТАММА ESCHERICHIA COLI, СПОСОБ ПОЛУЧЕНИЯ L-ЛЕЙЦИНА | 1999 |
|
RU2201454C2 |
Авторы
Даты
2024-01-11—Публикация
2021-05-13—Подача