1. Область изобретения
Настоящее раскрытие относится к новому варианту глутамат-цистеинлигазы и способу получения глутатиона с его использованием.
2. Описание родственной области
Глутатион (GSH) представляет собой органическое соединение серы, которое чаще всего присутствует в клетках, и он находится в виде трипептида, в котором объединены три аминокислоты: глицин, глутамати цистеин.
В организме глутатион существует в двух формах: восстановленный глутатион (GSH) и окисленный глутатион (GSSG). Восстановленный глутатион (GSH), который при обычных условиях существует в относительно высоком процентном содержании, главным образом, распределяется в клетках печени и кожи человеческого организма и имеет важную роль, такую как антиоксидантная функция разложения и удаления радикалов кислорода, детоксификационная функция удаления экзогенных соединений, таких как токсические вещества, функция отбеливания - ингибирование продукции пигмента меланина и т.д.
Поскольку продукция глутатиона постепенно снижается с возрастом, уменьшение продукции глутатиона, который имеет важную роль в антиоксидантной функции и детоксификационной функции, стимулирует накопление кислородных радикалов, что является одной из главных причин старения, и, следовательно, необходима внешняя поставка глутатиона (Sipes IG et al., The role of glutathione in the toxicity of xenobiotic compounds: metabolic activation of 1,2-dibromoethane by glutathione, Adv Exp Med Biol. 1986;197:457-67.).
С таким разнообразием функций глутатион привлек много внимания в качестве вещества в разных областях, таких как фармацевтика, здоровое функциональное питание, косметика и т.д., и он также используется в получении корригентов, продуктов питания и кормовых добавок. Известно, что глутатион имеет значительное влияние на усиление вкуса сырья и поддержание насыщенного вкуса, и глутатион можно использовать в качестве усилителя вкуса кокуми посредством применения его одного или в комбинации с другими веществами. Обычно вещества кокуми имеют более насыщенный вкус, чем существующие вещества умами, такие как нуклеиновые кислоты, MSG (глутамат натрия) и т.д., и известно то, что их получают посредством разложения и старения белков.
Однако, несмотря на возрастающий спрос на глутатион, который может использоваться в разных областях, как описано выше, способ ферментативного синтеза еще не был введен в коммерческий оборот из-за высоких производственных затрат, и рынок значительно не активизирован из-за того, что для промышленного производства глутатиона требуются значительные затраты.
Авторы настоящего изобретения обнаружили то, что микроорганизм с введенным вновь разработанным вариантом глутамат- цисте инлигазы способен продуцировать глутатион с высоким выходом, посредством этого осуществляя настоящее раскрытие.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Задачей настоящего изобретения является предложение варианта глутамат-цистеинлигазы, в котором аминокислота, соответствующая положению 653 от N-конца аминокислотной последовательности SEQ ID NO: 1, заменена метионином в белке, имеющем активность глутамат-цисте инлигазы.
Другой задачей настоящего изобретения является предложение полинуклеотида, кодирующего данный вариант, и вектора, включающего данный полинуклеотид.
Еще одной задачей настоящего изобретения является предложение микроорганизма, продуцирующего глутатион, посредством включения любого одного или более чем одного варианта; полинуклеотида, кодирующего данный вариант; и вектора, включающего данный полинуклеотид.
Еще одной другой задачей настоящего изобретения является предложение способа получения глутатиона, включающего стадию культивирования данного микроорганизма.
ПОДРОБНОЕ ОПИСАНИЕ ПРЕДПОЧТИТЕЛЬНЫХ ВОПЛОЩЕНИЙ
Настоящее раскрытие будет подробно описано следующим образом. Тем временем, каждое описание и воплощение, раскрытое в данном описании, также может применяться к другим описаниям и воплощениям. То есть, все комбинации разных элементов, раскрытых в данном описании, попадают в объем настоящего описания.
Кроме того, объем настоящего раскрытия не ограничивается конкретным описанием, описанным ниже.
Кроме того, специалистам в данной области будут известны, или они смогут установить с использованием не более чем традиционного экспериментирования многие эквиваленты конкретных воплощений описанного здесь раскрытия. Кроме того, данные эквиваленты следует интерпретировать как попадающие в пределы настоящего раскрытия.
В одном аспекте настоящего раскрытия может быть предложен вариант глутамат-цистеинлигазы, включающий аминокислотную замену в белке, имеющем глутамат-цистеинлигазную активность, где данная замена включает замену метионином аминокислоты, соответствующей положению 653 от N-конца SEQ ID NO: 1.
Данный вариант может представлять собой вариант белка, в котором глицин, который представляет собой аминокислоту, соответствующую положению 653 от N-конца аминокислотной последовательности глутамат-цистеинлигазы SEQ ID NO: 1, заменен метионином.
«Глутамат-цистеинлигаза (GCL)» по настоящему раскрытию представляет собой фермент, также именуемый «глутамат-цистеинлигаза» или «гамма-глутамилцистеинсинтетаза (GCS)». Известно, что данная глутамат-цистеинлигаза катализирует следующую реакцию:
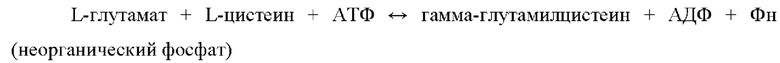
Кроме того, реакция, катализируемая глутамат-цистеинлигазой, известна как первая стадия синтеза глутатиона.
В настоящем раскрытии аминокислотная последовательность глутамат-цистеинлигазы представляет собой аминокислотную последоватеьность, кодируемую геном gsh1, и также может называться «белок GSH1» или «глутамат-цистеинлигаза». Аминокислотную последовательность, составляющую глутамат-цисте инлигазу по настоящему раскрытию, можно получать из GenBank NCBI (Национальный центр биотехнологической информации), который является известной базой данных. Данная глутамат-цистеинлигаза может представлять собой белок, включающий аминокислотную последовательность SEQ ID NO: 1, или по существу состоящий из нее, или состоящий из нее, но не ограничиваясь ими. В качестве другого примера, глутамат-цистеинлигаза может происходить от Saccharomyces cerevisiae, и, в качестве еще одного другого примера, аминокислота, соответствующая положению 653 в аминокислотной последовательности SEQ ID NO: 1 Saccharomyces, может представлять собой глицин. Однако данная глутамат-цистеинлигаза не ограничивается ими и может включать любую последовательность без ограничения, при условии, что она представляет собой последовательность, имеющую такую же глутамат-цистеинлигазную активность, что и данная аминокислотная последовательность.
В качестве конкретного примера, глутамат-цистеинлигаза по настоящему раскрытию может представлять собой белок, включающий аминокислотную последовательность SEQ ID NO: 1 или аминокислотную последовательность, имеющую 80%-ную, 85%-ную, 90%-ную, 95%-ную, 96%-ную, 97%-ную, 98%-ную, или 99%-ную, или большую гомологию или идентичность с ней. Кроме того, очевидно то, что белки, имеющие аминокислотные последовательности, в которых некоторые последовательности делетированы, модифицированы, заменены или добавлены, также включены в пределы объема белка, который является мишенью изменений по настоящему раскрытию, при условии, что аминокислотные последовательности имеют такую гомологию или идентичность и демонстрируют эффективность, соответствующую эффективности приведенного выше белка.
Кроме того, в качестве примера глутамат-цистеинлигазы по настоящему раскрытию она была определена как белок, включающий аминокислотную последовательность SEQ ID NO: 1, но не исключает бессмысленную последовательность выше или ниже аминокислотной последовательности SEQ ID NO: 1, встречающуюся в природе мутацию или ее молчащую мутацию, и специалистам в данной области очевидно, что белки также включены в объем глутамат-цистеинлигазы по настоящему раскрытию, при условии, что они имеют активность, идентичную или соответствующую активности белка, состоящего из аминокислотной последовательности SEQ ID NO: 1.
То есть, в настоящем раскрытии, хотя и используется экспрессия «белка или полипептида, имеющего аминокислотную последовательность, описанную специфической SEQ ID NO», «белка или полипептида, включающего аминокислотную последовательность, описанную специфической SEQ ID NO», очевидно то, что в настоящем раскрытии может использоваться любой белок, включающий аминокислотную последовательность, в которой некоторые последовательности делегированы, модифицированы, заменены или добавлены, при условии, что данный белок или полипептид имеет активность, идентичную или соответствующую активности полипептида, состоящего из аминокислотной последовательности, соответствующей SEQ ID NO.
Термин «вариант» или «модифицированный полипептид» в том виде, как он здесь используется, относится к белку, в котором одна или более чем одна аминокислота отличается от аминокислот перечисленной последовательости при консервативной замене и/или модификации, но функции или свойства данного белка поддерживаются. Относительно задач настоящего раскрытия данный вариант может представлять собой вариант глутамат-цистеинлигазы, в котором аминокислота, соответствующая положению 653 от N-конца SEQ ID NO: 1, заменяется метионином в глутамат-цистеинлигазе, описанной выше, или модифицированном полипептиде, имеющем глутамат-цистеинлигазную активность. Относительно варианта по настоящему раскрытию «вариант глутамат-цистеинлигазы» также может быть описан как «(модифицированный) полипептид, имеющий глутамат-цистеинлигазную активность» или «вариант GSH1».
Данный вариант отличается от последовательностей, которые идентифицируются заменой, делецией или присоединением нескольких аминокислот. Такой вариант обычно может быть идентифицирован модифицированием одной или более чем одной аминокислоты аминокислотной последовательности данного белка и оценкой свойств данного модифицированного белка. Другими словами, способность данного варианта может увеличиваться, оставаться неизменной или снижаться по сравнению со способностью природного белка. Кроме того, некоторый вариант может включать модифицированный полипептид, в котором удаляется одна или более чем одна часть, такая как N-концевая лидерная последовательность или трансмембранный домен. Другие варианты могут включать варианты, в которых удаляется часть от N-и/или С-конца зрелого белка. Термин «вариант» или «модифицированный полипептид» можно использовать взаимозаменяемо с такими терминами, как модификация, модифицированный белок, мутант, мутеин, дивергент, вариант и т.д., и данный термин не ограничивается, при условии, что он используется как означающий модификацию.
Относительно задач настоящего раскрытия, данный вариант может иметь повышенную активность модифицированного белка по сравнению с природным белком дикого типа или немодифицированным белком, или может увеличивать продуцируемое количество глутатиона по сравнению с белком перед модификацией или природным полипептидом дикого типа или ^модифицированным полипептидом, но не ограничивается им.
Термин «консервативная замена» в том виде, как он здесь используется, относится к замене аминокислоты другой аминокислотой, имеющей аналогичные структурные и/или химические свойства. Данный вариант может иметь, например, одну или более чем одну консервативную замену при сохранении одной или более чем одной биологической активности. Данная аминокислотная замена обычно может происходить на основе сходства в полярности, электрическом заряде, растворимости, гидрофобности, гидрофильности и/или амфипатической природе остатков.
Например, среди электрически заряженных аминокислот положительно заряженные (основные) аминокислоты включают аргинин, лизин и гистидин, и отрицательно заряженные (кислотные) аминокислоты включают глутаминовую кислоту и аспарагиновую кислоту; и аминокислоты, имеющие незаряженные боковые цепи, включают глицин, аланин, валин, лейцин, изолейцин, метионин, фенилаланин, триптофан и пролин, серии, треонин, цистеин, тирозин, аспарагин и глутамин.
Кроме того, данный вариант может включать делеции или присоединения аминокислот, которые имеют минимальное влияние на свойства и вторичную структуру данного полипептида. Например, полипептид может быть конъюгирован с сигнальной (или лидерной) последовательностью N-конца белка, который участвует в котрансляционном или посттрансляционном переносе белков. Кроме того, данный полипептид также может быть конъюгирован с другой последовательностью или линкером для идентификации, очистки или синтеза полипептида.
В одном воплощении данный вариант может представлять собой вариант глутамат-цистеинлигазы, в котором аминокислота, соответствующая положению 653 от N-конца аминокислотной последовательности SEQ ID NO: 1 заменена метионином. В одном воплощении данный вариант может представлять собой вариант, в котором глицин, соответствующий положению 653 в аминокислотной последовательности SEQ ID NO: 1 заменен метионином, но не ограничивается им.
Термин «замена другой аминокислотой» в том виде, как он здесь используется, не ограничивается, при условии, что замененная аминокислота, отличается от данной аминокислоты перед заменой. Тем временем, в настоящем раскрытии при выражении «специфическая аминокислота заменена» очевидно то, что данная аминокислота заменена аминокислотой, отличной от аминокислоты перед заменой, хотя даже отдельно не указано, что данная аминокислота заменяется другой аминокислотой. Термин «соответствующее положение» в том виде, как он здесь используется, относится к аминокислотному остатку в положении, перечисленном в белке или полипептиде, или к аминокислотному остатку, аналогичному, идентичному или гомологичному остатку, перечисленному в белке или полипептиде. Термин «соответствующая область» в том виде, как он здесь используется, обычно относится к аналогичному или соответствующему положению в родственном белке или эталонном белке.
В настоящем раскрытии специфическая нумерация может использоваться для положений аминокислотных остатков в белках, используемых в настоящем раскрытии. Например, посредством выравнивания белка-мишени, подлежащего сравнению с полипептидной последовательностью белка по настоящему раскрытию, возможна перенумерация положения, соответствующего положению аминокислотного остатка белка по настоящему раскрытию.
Вариантом глутамат-цистеинлигазы по настоящему раскрытию, в котором аминокислота, соответствующая положению 653 от N-конца аминокислотной последовательности SEQ ID NO: 1, заменена метионином, может быть белок, в котором аминокислота, соответствующая положению 653 SEQ ID NO: 1, заменена метионином в аминокислотной последовательности SEQ ID NO: 1, или аминокислотная последовательность, имеющая 80%-ную, 85%-ную, 90%-ную, 95%-ную, 96%-ную, 97%-ную, 98%-ную или 99%-ную, или большую гомологию или идентичность с ней. Такой вариант может представлять собой вариант, имеющий аминокислотную последовательность, имеющую 80%-ную, 85%-ную, 90%-ную, 95%-ную, 96%-ную, 97%-ную, 98%-ную или 99%-ную, или большую гомологию или идентичность с SEQ ID NO: 1, и имеющий меньше, чем 100%-ную гомологию или идентичность с SEQ ID NO: 1, но не ограничивается ими.
Вариант глутамат-цистеинлигазы по настоящему раскрытию, в котором аминокислота, соответствующая положению 653 от N-конца аминокислотной последовательности SEQ ID NO: 1, заменена метионином, может включать аминокислотную последовательность SEQ ID NO: 3. В частности, он может по существу состоять из аминокислотной последовательности SEQ ID NO: 3 и, более конкретно, может состоять из любой аминокислотной последовательности SEQ ID NO: 3, но не ограничиваясь ей.
Кроме того, данный вариант может включать аминокислотную последовательность SEQ ID NO: 3 или может включать аминокислотную последовательность, имеющую 80%-ную или большую гомологию или идентичность с SEQ ID NO: 3, при условии, что аминокислота в положении 653 в данной аминокислотной последовательности фиксирована (т.е. в аминокислотной последовательности данного варианта аминокислота, соответствующая положению 653 SEQ ID NO: 3, является такой же, как и аминокислота в положении 653 SEQ ID NO: 3), но не ограничивается ими.
В частности, вариант по настоящему раскрытию может включать полипептид, имеющий SEQ ID NO: 3 или имеющий по меньшей мере 80%-ную, 90%-ную, 95%-ную, 96%-ную, 97%-ную, 98%-ную или 99%-ную гомологию или идентичность с аминокислотной последовательностью SEQ ID NO: 3. Кроме того, очевидно то, что варианты, имеющие аминокислотные последовательности, в которых некоторые последовательности делетированы, модифицированы, заменены или добавлены, помимо положения 653, также включаются в объем настоящего раскрытия, при условии, что данные аминокислотные последовательности имеют такую гомологию или идентичность и демонстрируют эффективность, соответствующую эффективности данного варианта.
Термин «гомология» или «идентичность» в том виде, как он здесь используется, означает соответствие между двумя данными аминокислотными последовательностями или последовательностями оснований, и оно может быть выражено в виде процентной доли. Термины «гомология» и «идентичность» часто могут использоваться взаимозаменяемо.
Гомология или идентичность последовательности консервативного полинуклеотида или полипептида определяется стандартными алгоритмами выравнивания, и можно совместно использовать штраф за пробел по умолчанию, устанавливаемый используемой программой. По существу гомологичные или идентичные последовательности обычно способны к гибридизации со всей или с по меньшей мере 50%, 60%, 70%, 80% или 90% всей длины при умеренно или сильно жестких условиях. Очевидно то, что гибридизация также включает гибридизацию полинуклеотида с полинуклеотидом, включающим общий кодон или кодон, учитывая вырожденность кодона.
Имеют ли любые две последовательности полинуклеотида или полипептида гомологию, сходство или идентичность, можно определять с использованием известных компьютерных алгоритмов, таких как программа "FASTA", например, с использованием параметров по умолчанию, как в Pearson et al. (1988) [Proc. Natl. Acad. Sci. USA 85]: 2444. В качестве альтернативы, она может быть определена с использованием алгоритма Needleman-Wunsch (Needleman and Wunsch, 1970, J. Mol. Biol. 48: 443^153), как осуществляется в программе Needleman пакета EMBOSS (EMBOSS: The European Molecular Biology Open Software Suite, Rice et al., 2000, Trends Genet. 16: 276-277) (версия 5.0.0 или более поздняя) (включая программный пакет GCG ((Devereux, J., et al., Nucleic Acids Research 12: 387 (1984)), BLASTP, BLASTN, FASTA (Atschul, [S.] [F.,] [ET AL, J MOLEC BIOL 215]: 403 (1990); Guide to Huge Computers, Martin J. Bishop, [ED.,] Academic Press, San Diego,1994 и [CARILLO et al.](1988) SIAM J Applied Math 48: 1073). Например, для определения гомологии, сходства или идентичности можно использовать BLAST Национального центра биотехнологической информации или ClustalW.
Гомологию, сходство или идентичность полинуклеотидов или полипептидов можно определять сравнением информации о последовательности с использованием, например, компьютерной программы GAP, такой как Needleman et al. (1970), J Mol Biol. 48:443, как анонсировано, например, в Smith and Waterman, Adv. Appl. Math (1981) 2:482. В заключение, программа GAP может быть определена как значение, полученное делением числа аналогично выровненных символов (а именно: нуклеотидов или аминокислот) на общее число символов в более короткой из двух последовательностей. Параметры по умолчанию для программы GAP могут включать (1) матрицу бинарных сравнений (включающую значения 1 для идентичности и 0 для неидентичности) и матрицу взвешенных сравнений Gribskov et al. (1986) Nucl. Acids Res. 14: 6745 (или матрицу замен EDNAFULL (EMBOSS версии NCBI NUC4.4)), как раскрыто в Schwartz and Dayhoff, eds., Atlas Of Protein Sequence And Structure, National Biomedical Research Foundation, pp.353-358 (1979); (2) штраф 3,0 для каждого пробела и дополнительный штраф 0,10 для каждого символа в каждом пробеле (или штраф за открытие пробела 10, штраф за расширение пробела 0,5); и (3) отсутствие штрафа за концевые пробелы.
Дополнительно, имеют ли любые две последовательности полинуклеотида или полипептида гомологию, сходство или идентичность, может быть определено сравнением данных последовательностей посредством экспериментов по саузерн-гибридизации при определенных жестких условиях, и подходящие условия гибридизации, подлежащие определению, могут находиться в пределах данного объема технологии и могут быть определены способом, хорошо известным обычному специалисту в данной области (например, J. Sambrook et al., Molecular Cloning, A Laboratory Manual, 2nd Edition, Cold Spring Harbor Laboratory press, Cold Spring Harbor, New York, 1989; F.M. Ausubel et al., Current Protocols in Molecular Biology, John Wiley & Sons, Inc., New York).
Вариант глутамат-цистеинлигазы по настоящему раскрытию, в котором аминокислота, соответствующая положению 653 от N-конца аминокислотной последовательности SEQ ID NO: 1, заменена метионином, может дополнительно включать изменение, при котором аминокислота, соответствующая положению 86 от N-конца аминокислотной последовательности SEQ ID NO: 1, заменяется другой аминокислотой.
В частности, данный вариант может включать изменение, при котором цистеин, соответствующий положению 86, заменяется другой аминокислотой, например, аргинином.
Например, данный вариант может включать аминокислотную последовательность SEQ ID NO: 13, может по существу состоять из нее или может состоять из нее, но не ограничивается ей.
Согласно другому аспекту настоящего раскрытия может быть предложен полинуклеотид, кодирующий данный вариант.
Термин «полинуклеотид» в том виде, как он здесь используется, относится к нити ДНК или РНК, имеющей определенную длину, или, более того, к полимеру нуклеотидов, в котором нуклеотидные мономеры соединяются в длинную цепь посредством ковалентных связей.
Ген, кодирующий глутамат-цистеинлигазу по настоящему раскрытию, может представлять собой ген gsh1.
Данный ген может происходить от дрожжей. В частности, он может происходить от рода Saccharomyces и, более конкретно, он может происходить от Saccharomyces cerevisiae. В частности, данный ген может включать любой ген без ограничения, при условии, что он кодирует полипептид, имеющий активность глутамат-цистеинлигазы, происходящей от Saccharomyces cerevisiae, и в одном воплощении данный ген может представлять собой ген, кодирующий аминокислотную последовательность SEQ ID NO: 1, и в одном воплощении данный ген может включать нуклеотидную последовательность SEQ ID NO: 2, но не ограничиваясь ей.
Полинуклеотид, кодирующий вариант белка по настоящему раскрытию, может включать любой полинуклеотид без ограничения, при условии, что он представляет собой полинуклеотид, кодирующий вариант глутамат-цистеинлигазы по настоящему раскрытию, и полипептид, имеющий соответствующую ему активность.
В полинуклеотиде, кодирующем глутамат-цисте инлигазу по настоящему раскрытию и кодирующем ее вариант, могут быть сделаны разные модификации в кодирующей области, при условии, что аминокислотная последовательность данного полипептида не изменяется, учитывая вырожденность кодонов или предпочтительные кодоны в организмах, которые предназначены для экспрессии данного полипептида.
В частности, полинуклеотид, кодирующий вариант белка по настоящему раскрытию, может включать любую полинуклеотидную последовательность без ограничения, при условии, что он представляет собой полинуклеотидную последовательность, кодирующую вариант белка, в котором аминокислота, соответствующая положению 653 в аминокислотной последовательности SEQ ID NO: 1, заменена метионином. Например, полинуклеотид, кодирующий вариант белка по настоящему раскрытию, может представлять собой полинуклеотидную последовательность, кодирующую вариант белка по настоящему раскрытию, в частности, белок, включающий аминокислотную последовательность SEQ ID NO: 3, или полипептид, имеющий гомологию или идентичность с ней, но не ограничиваясь ими. Данная гомология или идентичность является такой же, как описано выше.
Кроме того, полинуклеотид, кодирующий вариант белка по настоящему раскрытию, может включать зонд, который может быть получен из последовательности известного гена, например, последователности без ограничения, при условии, что она представляет собой последовательность, которая гибридизуется с комплементарной последовательностью со всей или частью данной полинуклеотид ной последовательности при жестких условиях с кодированием варианта белка, в котором аминокислота, соответствующая положению 653 в аминокислотной последовательности SEQ ID NO: 1, заменена метионином.
Термин «жесткие условия» означает условия, которые обеспечивают специфичную гибридизацию между полинуклеотидами. Данные условия конкретно описываются в документах (например, J. Sambrook et al., 1989, выше). Например, жесткие условия могут включать условия, при которых полинуклеотиды, имеющие высокую гомологию или идентичность, например, 40%-ную или большую, в частности, 90%-ную или большую, более конкретно 95%-ную или большую, 95%-ную или большую, 96%-ную или большую, 97%-ную или большую, 98%-ную или большую, более конкретно 99%-ную или большую гомологию или идентичность, гибридизуются друг с другом, а полинуклеотиды, имеющие меньшую гомологию или идентичность, чем приведенная выше гомология или идентичность, не гибридизуются друг с другом, или обычные условия промывки саузерн-гибридизации, при которых промывка осуществляется один раз, в частности, от двух до трех раз при концентрации соли и температуре, эквивалентных 60°С, 1× SSC (раствор цитрата и хлорида натрия), 0,1% SDS (додецилсульфат натрия), в частности, при 60°С, 1× SSC, 0,1% SDS, более конкретно, 68°С, 0,1× SSC, 0,1% SDS.
Гибридизация требует того, чтобы две нуклеиновые кислоты имели комплементарные последовательности, хотя и допускаются несоответствия между основаниями, в зависимости от жесткости гибридизации. Термин «комплементарность» используется для описания связи между нуклеотидными основаниями, способными к гибридизации друг с другом. Например, в отношении ДНК, аденин является комплементарным тимину, и цитозин является комплементарным гуанину. Следовательно, полинуклеотид по настоящему раскрытию также может включать по существу аналогичные последовательности нуклеиновой кислоты, а также выделенные фрагменты нуклеиновой кислоты, которые являются комплементарными всей последовательности.
В частности, полинуклеотид, имеющий гомологию или идентичность, может быть выявлен с использованием условий гибридизации, включающих стадию гибридизации при значении Tm 55°С и вышеописанных условиях. Кроме того, данное значение Tm может составлять 60°С, 63°С или 65°С, но не ограничиваясь ими, и может подходящим образом корректироваться специалистами в данной области согласно цели.
Подходящая жесткость гибридизации данного полинуклеотида зависит от длины и уровня комплементарности данного полинуклеотида, и данные переменные хорошо известны в данной области (см. Sambrook et al., 1989, выше, 9.50-9.51, 11.7-11.8).
Согласно еще одному другому аспекту настоящего раскрытия может быть предложен вектор, включающий полинуклеотид, кодирующий данный вариант белка.
Термин «вектор» в том виде, как он здесь используется, относится к конструкции ДНК, включающей последовательность полинуклеотида, кодирующего интересующий полипептид, связанную функциональным образом с подходящей областью контроля экспрессии (или последовательностью контроля экспрессии) таким образом, что данный интересующий полипептид может экспрессироваться в подходящем хозяине. Данная область контроля экспрессии может включать промотор, способный к инициации транскрипции, любую последовательность оператора для обеспечения контроля транскрипции, последовательность, кодирующую подходящий сайт связывания рибосомы мРНК, и последовательность, контролирующую терминацию транскрипции и трансляции. Данный вектор может трансформироваться в подходящую клетку-хозяина и затем реплицироваться или функционировать независимо от генома хозяина, или может интегрировать в сам геном.
Например, полинуклеотид, кодирующий интересующий белок в хромосоме, может заменяться мутировавшим полинуклеотидом посредством вектора для внутриклеточной вставки в хромосому. Вставка данного полинуклеотида в хромосому может осуществляться любым способом, известным в данной области, например, гомологичной рекомбинацией, но не ограничиваясь ей. Данный вектор может дополнительно включать селективный маркер для осуществления идентификации вставки в хромосому. Селективный маркер служит для отбора клеток, трансформированных векторами, т.е. для осуществления идентификации вставки интересующей молекулы нуклеиновой кислоты, и можно использовать маркеры, которые придают селектируемые фенотипы, такие как устойчивость к лекарственному средству, ауксотрофия, устойчивость к цитотоксическим средствам или экспрессия поверхностных полипептидов. В среде, обработанной селективным агентом, только клетки, экспрессирующие селективный маркер, выживают или демонстрируют другие фенотипические признаки, и, таким образом, могут быть отобраны трансформированные клетки.
Вектор, используемый в настоящем раскрытии, конкретно не ограничивается, и можно использовать любой вектор, извесный в данной области. Векторы дрожжевой экспрессии включают и векторы на основе интегрирующей дрожжевой плазмиды (Yip), и на основе внехромосомной плазмиды. Вектор на основе внехромосомной плазмиды может включать эписомную дрожжевую плазмиду (YEp), репликативную дрожжевую плазмиду (YRp) и дрожжевую центромерную плазмиду (YCp). Кроме того, в качестве векторов по настоящему раскрытию также можно использовать искусственные дрожжевые хромосомы (YAC). В качестве конкретного примера, применимые векторы могут включать pESCHIS, pESC-LEU, pESC-TRP, pESC-URA, Gateway pYES-DEST52, pAO815, pGAPZ A, pGAPZ B, pGAPZ C, pGAPα A, pGAPα B, pGAPα C, pPIC3.5K, pPIC6 A, pPIC6 B, pPIC6 C, pPIC6a A, pPIC6a B, pPIC6α C, pPIC9K, pYC2/CT, вектор дрожжевого дисплея pYD1, pYES2, pYES2/CT, pYES2/NT A, pYES2/NT B, pYES2/NT C, pYES2/CT, pYES2.1, pYES-DEST52, pTEF1/Zeo, pFLD1, PichiaPinkTM, p427-TEF, p417-CYC, pGAL-MF, p427-TEF, p417-CYC, PTEF-MF, pBY011, pSGP47, pSGP46, pSGP36, pSGP40, ZM552, pAG303GAL-ccdB, pAG414GAL-ccdB, pAS404, pBridge, pGAD-GH, pGAD T7, pGBK T7, pHIS-2, pOBD2, pRS408, pRS410, pRS418, pRS420, pRS428, форму дрожжевого micron A, pRS403, pRS404, pRS405, pRS406, pYJ403, pYJ404, pYJ405 и pYJ406, но не ограничиваются ими.
Термин «трансформация» в том виде, как он здесь используется, означает то, что вектор, включающий полинуклеотид, кодирующий целевой белок, вводят в клетку-хозяина или микроорганизм таким образом, что белок, кодируемый данным полинуклеотидом, может экспрессироваться в данной клетке-хозяине. Трансформированный полинуклеотид может локализоваться посредством вставки в хромосому клетки-хозяина или локализоваться вне данной хромосомы, при условии, что он может экспрессироваться в клетке-хозяине. Кроме того, данный полинуклеотид включает ДНК и РНК, кодирующую интересующий белок. Данный полинуклеотид может вводиться в любой форме, при условии, что он может вводиться в клетку-хозяина и затем экспрессироваться. Например, данный полинуклеотид может вводиться в клетку-хозяина в виде экспрессионной кассеты, которая представляет собой генетическую конструкцию, содержащую все элементы, требующиеся для автономной экспрессии. Данная экспрессионная кассета обычно может включать промотор, связанный функциональным образом с данным полинуклеотидом, сигнал терминации транскрипции, сайт связывания рибосомы и сигнал терминации трансляции. Данная экспрессионная кассета может находиться в виде экспрессионного вектора, способного к автономной репликации. Кроме того, данный полинуклеотид может вводиться в клетку-хозяина в его собственном виде и может быть связан функциональным образом с последовательностью, требующейся для экспрессии в клетке-хозяине, но не ограничивается ими.
Кроме того, термин «связанный функциональным образом» в том виде, как он здесь используется, означает то, что последовательность гена функционально связана с последовательностью промотора, который инициирует и опосредует транскрипцию полинуклеотида, кодирующего интересующий полипептид по настоящему раскрытию.
Способ трансформирования вектора по настоящему раскрытию включает любой способ введения нуклеиновой кислоты в клетку, и он может осуществляться посредством выбора подходящей стандартной методики, как известно в данной области, согласно клетке-хозяину. Например, данный способ может включать электропорацию, осаждение фосфатом кальция (CaPO4), осаждение хлоридом кальция (CaCl2), микроинъекцию, способ с полиэтиле нгликол ем (PEG), способ с DEAE(диэтиламиноэтил)-декстраном, способ с катионными липосомами, способ с ацетатом лития-DMSO (диметилсульфоксид) и т.д., но не ограничивается ими.
Согласно настоящему раскрытию может быть предложен микроорганизм, продуцирующий глутатион, посредством включения любого одного или более чем одного варианта, полинуклеотид, кодирующий данный вариант; и вектор, включающий данный полинуклеотид.
Термин «микроорганизм» в том виде, как он здесь используется, включает все микроорганизмы дикого типа или естественным образом или искусственно генетически модифицированные микроорганизмы, и идеей является именно включение всех микроорганизмов, в которых специфический механизм ослаблен или усилен из-за вставки чужеродного гена или усиления активности, или инактивации эндогенного гена. В настоящем раскрытии данный микроорганизм может включать любой микроорганизм без ограничения, при условии, что он представляет собой микроорганизм, в который вводится или включается вариант глутамат-цистеинлигазы по настоящему раскрытию.
Данный микроорганизм, например, представляет собой клетку или микроорганизм, который трансформируется геном, кодирующим целевой белок, или включающим его вектором и экспрессирует данный целевой белок. По отношению к целям настоящего раскрытия данная клетка-хозяин или микроорганизм представляет собой любой микроорганизм, при условии, что он способен к продукции глутатиона посредством включения варианта глутамат-цистеинлигазы.
Термин «глутатион» по настоящему раскрытию используется взаимозаменямо с «GSH» и относится к трипептиду, состоящему из трех аминокислот: глутамата, цистеина и глицина. Глутатион может использоваться в качестве сырья в фармацевтике, здоровом функциональном питании, корригентах, продуктах питания, кормовых добавках, косметике и т.д., но не ограничиваясь ими.
В настоящем раскрытии термин «микроорганизм, продуцирующий глутатион» включает все микроорганизмы, в которых генетическое изменение происходит естественным образом или искусственно, и представляет собой микроорганизм, в котором ослабляется или усиливается специфический механизм из-за вставки чужеродного гена или усиления активности, или инактивации эндогенного гена, и он может представлять собой микроорганизм, в котором произошли генетические изменения, или была усилена активность для продукции желательного глутатиона. Относительно целей настоящего раскрытия термин «микроорганизм, продуцирующий глутатион», может относиться к микроорганизму, который включает глутамат-цистеинлигазу для продукции избыточного количества желательного глутатиона по сравнению с микроорганизмом дикого типа или немодифицированным микроорганизмом. Термин «микроорганизм, продуцирующий глутатион» может использоваться взаимозаменяемо с такими терминами, как «глутатионпродуцирующий микроорганизм», «микроорганизм, имеющий способность к продукции глутатиона», «глутатионпродуцирующий штамм», «штамм, имеющий способность к продукции глутатиона» и т.д.
Тип микроорганизма, продуцирующего глутатион, конкретно не ограничивается, при условии, что данный микроорганизм способен продуцировать глутатион, но он может представлять собой микроорганизм рода Saccharomyces, в частности, Saccharomyces cerevisiae, но не ограничиваясь им.
Родительский штамм глутатионпродуцирующего микроорганизма, включающего данный вариант, конкретно не ограничвается, при условии, что он способен продуцировать глутатион. Данный микроорганизм может дополнительно включать такие изменения, как усиление биосинтетического пути для увеличения способности к продукции глутатиона, ослабление ингибирования по механизму обратной связи, инактивацию генов, что ослабляет путь разложения или биосинтетический путь, не исключая изменения, встречающиеся в природе. В одном воплощении данный микроорганизм может включать изменение, которое увеличивает способность к продукции глутатиона, в области контроля экспрессии глутамат-цистеинлигазы. Данное изменение может представлять собой любое одно или более чем одно изменение, выбранное из -250(С→Т), -252(G→A), -398(А→Т), -399(А→С), -407(Т→С) и -409(Т→С) выше ORF (открытая рамка считывания) GSH1, но не ограничиваясь им.
Микроорганизм, включающий любой один или более чем один вариант по настоящему раскрытию; полинуклеотид, кодирующий данный вариант; и вектор, включающий данный полинуклеотид, может представлять собой микроорганизм, экспрессирующий вариант глутамат-цистеинлигазы, в котором аминокислота, соответствующая положению 653 в аминокислотной последовательности SEQ ID NO: 1, заменяется метионином, но не ограничивается им.
Данная глутамат-цистеинлигаза и ее вариант являются такими, как описано выше.
Термин белок «подлежащий экспрессии/экспрессируемый» в том виде, как он здесь используется, означает состояние, при котором целевой белок вводится в микроорганизм или модифицируется для экспрессии в микроорганизме. Когда целевой белок представляет собой белок, присутствующий в микроорганизмах, это означает состояние, при котором его активность усиливается по сравнению с эндогенной активностью или активностью перед модификацией.
Микроорганизм, экспрессирующий вариант белка по настоящему раскрытию, может представлять собой микроорганизм, модифицированный для экспрессии варианта белка по настоящему раскрытию, и, следовательно, согласно еще одному другому аспекту настоящего раскрытия предложен способ получения микроорганизма, экспрессирующего вариант белка по настоящему раскрытию.
В настоящем раскрытии термин «введение белка» относится к демонстрированию активности конкретного белка, которой исходно не обладает микроорганизм, или демонстрирование усиленной активности, по сравнению с эндогенной активностью соответствующего белка или активностью перед модификацией. Например, введение белка может относиться к введению конкретного белка, введению полинуклеотида, кодирующего конкретный белок, в хромосому микроорганизма или введению вектора, включающего полинуклеотид, кодирующий конкретный белок, в микроорганизм, экспрессируя, посредством этого его активность.
Термин «усиление» активности полипептида или белка в том виде, как он здесь используется, означает то, что активность полипептида или белка увеличивается по сравнению с эндогенной активностью. Термин «усиление» можно использовать взаимозаменяемо с такими терминами, как повышающая регуляция, сверхэкспрессия, увеличение и т.д. Здесь увеличение может включать и демонстрирование активности, которой исходно не обладали, и демонстрирование улучшенной активности по сравнению с эндогенной активностью или активностью перед модификацией. Данная «эндогенная активность» означает активность специфического полипептида или белка, которой исходно обладал родительский штамм перед изменением признака или немодифицированный микроорганизм, когда признак изменяется генетическим изменением из-за природных или искусственных факторов. Это можно использовать взаимозаменяемо с фразой «активность перед модификацией». Тот факт, что активность полипептида или белка «усиливается» или «повышается» по сравнению с эндогенной активностью означает то, что данная активность полипептида или белка улучшается по сравнению с активностью специфического полипептида или белка, которой исходно обладал родительский штамм перед изменением признака или немодифицированный микроорганизм.
Данное «усиление активности» может достигаться посредством введения чужеродного полипептида или белка, или усиления эндогенной активности полипептида или белка, в частности, посредством усиления эндогенной активности данного полипептида или белка. Усиление активности данного полипептида или белка может быть подтверждено увеличением уровня активности и уровня экспрессии соответствующего полипептида или белка, или количества продукта, продуцированного из соответствующего белка.
Для усиления активности полипептида или белка можно применять разные способы, хорошо известные в данной области, и данный способ не ограничивается, при условии, что активность интересующего полипептида или белка может быть усилена по сравнению с активностью микроорганизма перед модификацией. В частности, можно использовать генную инженерию и/или белковую инженерию, хорошо известные специалистам в данной области, которые являются традиционными способами молекулярной биологии, но данный способ не ограничивается ими (Sitnicka et al. Functional Analysis of Genes. Advances in Cell Biology. 2010, Vol.2. 116, Sambrook et al. Molecular Cloning 2012 и т.д.).
В частности, способ усиления активности полипептида или белка с использованием генной инженерии можно осуществлять, например, следующим образом:
1) увеличение числа внутриклеточных копий гена или полинуклеотида, кодирующего полипептид или белок;
2) замена регуляторной области экспрессии гена на хромосоме, кодирующей полипептид или белок, последовательностью, демонстрирующей сильную активность;
3) модификация инициирующего кодона полипептида или белка, или последовательности оснований, кодирующей 5'-UTR (нетранслируемая) область;
4) модификация полинуклеотидной последовательности на хромосоме для усиления активности полипептида или белка;
5) введение чужеродного полинуклеотида, демонстрирующего активность полипептида или белка, или варианта данного полинуклеотида с оптимизированными кодонами; или
6) комбинация приведенных выше способов, но не ограничиваясь ими.
Данный способ усиления активности полипептида или белка с использованием способа белковой инженерии можно проводить, например, модифицируя или химически модифицируя экспонированную область, отобранную посредством анализа трехмерной структуры полипептида или белка, не ограничиваясь ими.
(1) Увеличение числа внутриклеточных копий гена или полинуклеотида, кодирующего данный полипептид или белок, можно проводить любым способом, хорошо известным в данной области, например, посредством введения вектора, который реплицируется и функционирует независимо от клетки-хозяина и связан функциональным образом с геном или полинуклеотидом, кодирующим соответствующий полипептид или белок, в клетку-хозяина. В качестве альтернативы, его можно проводить посредством введения вектора, который связан функциональным образом с данным геном и способен к вставке данного гена или полинуклеотида в хромосому клетки-хозяина, в клетку-хозяина, но не ограничиваясь им.
(2) Замена регуляторной области экспрессии гена (или регуляторной последовательности экспрессии) на хромосоме, кодирующей данный полипептид или белок, последовательностью, демонстрирующей сильную активность, может осуществляться любым способом, известным в данной области, например, посредством введения мутации в данную последовательность посредством делеции, вставки, неконсервативной или консервативной замены нуклеотидной последовательности, или любой их комбинации, или посредством замены последовательности нуклеотидной последовательностью с более сильной активностью для дальнейшего усиления активности данной регуляторной области экспрессии. Данная регуляторная область экспрессии может включать, но конкретно не ограничивается, промотором, последовательностью оператора, последовательностью, кодирующей сайт связывания рибосомы, и последовательностью для регуляции терминации транскрипции и трансляции. Данный способ может конкретно осуществляться посредством связывания с более сильным гетерологичным промотором вместо эндогенного промотора, но не ограничиваясь им.
Примеры известных промоторов для эукариот включают прототоры для фактора элонгации трансляции 1 (TEF1), глицерол-3-фосфатдегидрогеназы 1 (GPD1), 3-фосфоглицераткиназы или других гликолитических ферментов, таких как енолаза, глицеральдегид-3-фосфатдегидрогеназа, гексокиназа, пируватдекарбоксилаза, фосфофруктокиназа, глюкозо-6-фосфатизомераза, 3-фосфоглицератмутаза, пируваткиназа, триозофосфатизомераза, фосфоглюкозоизомераза и глюкокиназа, и примеры другого дрожжевого промотора, который представляет собой индуцибельный промотор с дополнительным преимуществом транскрипции, контролируемой условиями роста, включают промоторы для алкогольдегидрогеназы 2, изоцитохрома С, кислой фосфатазы, деградирующих ферментов, ассоциированных с метаболизмом азота, металлотионеина, глицеральдегид-3-фосфатдегидрогеназы и ферментов, ответственных за утилизацию мальтозы и галактозы, и когда клетка-хозяин представляет собой дрожжи, доступные промоторы могут включать промотор TEF1, промотор TEF2, промотор GAL10, промотор GAL1, промотор ADH1, промотор ADH2, промотор РН05, промотор GAL1-10, промотор TDH3 (промотор GPD), промотор TDH2, промотор TDH1, промотор PGK1, промотор PYK2, промотор ENO1, промотор ENO2 и промотор ТРИ, и векторы и промоторы, подходящие для применения в дрожжевой экспрессии, дополнительно описываются в ЕР 073657, но не ограничиваются ими. С дрожжевыми промоторами также можно преимущественно использовать дрожжевые энхансеры, но не ограничиваясь ими.
(3) Модификация инициирующего кодона полипептида или белка, или последовательности оснований, кодирующей 5'-UTR область, может осуществляться любым способом, известным в данной области, например, посредством замены эндогенного инициирующего кодона полипептида или белка другим инициирующим кодоном с более высоким уровнем экспрессии полипептида или белка по сравнению с эндогенной инициацией, но не ограничиваясь им.
(4) Модификация последовательности полинуклеотида на хромосоме для усиления активности полипептида или белка может осуществляться любым способом, известным в данной области, например, индукцией модификации на регуляторной последовательности экспрессии посредством делеции, вставки, неконсервативной или консервативной замены, или любой их комбинации для дальнейшего усиления активности данной последовательности полинуклеотида, или посредством замены данной последовательности последовательностью полинуклеотида, модифицированной для того, чтобы иметь более сильную активность. Данная замена может представлять собой специфичную вставку гена в хромосому посредством гомологичной рекомбинации, но не ограничивается ей.
Используемый здесь вектор может дополнительно включать селективный маркер для выявления хромосомной вставки. Данный селективный маркер является таким, как описано выше.
(5) Введение чужеродного полинуклеотида, демонстрирующего активность данного полипептида или белка, может осуществляться любым способом, известным в данной области, например, посредством введения чужеродного полинуклеотида, кодирующего полипептид или белок, имеющий идентичную/аналогичную активность активности данного полипептида или белка, или посредством введения в клетку-хозяина его варианта полинуклеотида с оптимизированными кодонами. Происхождение или последовательность данного чужеродного полинуклеотида конкретно не ограничивается, при условии, что данный чужеродный полинуклеотид демонстрирует идентичную/аналогичную активность активности данного полипептида или белка. Кроме того, в клетку-хозяина может быть введен полинуклеотид с оптимизированными кодонами для оптимизированной транскрипции и трансляции введенного чужеродного полинуклеотида в клетке-хозяине. Данное введение может осуществляться любым известным способом трансформации, подходящим образом отобранным обычными специалистами в данной области. Поскольку введенный полинуклеотид экспрессируется в клетке-хозяине, продуцируется данный полипептид или белок, увеличивая, посредством этого, их активность.
Наконец, (6) комбинацию описанных выше способов можно осуществлять посредством применения одного или более чем одного способа (1)-(5) в комбинации.
Усиление активности полипептида или белка, как описано выше, может представлять собой увеличение активности или концентрации соответствующего полипептида или белка по сравнению с активностью или концентрацией данного полипептида или белка, экспрессируемого в микроорганизме дикого типа или микроорганизме перед модификацией, или увеличение количества продукта, полученного из соответствующего полипептида или белка, но не ограничиваясь ими.
Термин «штамм перед модификацией» или «микроорганизм перед модификацией» в том виде, как он здесь используется, не исключает штаммы, включающие мутации, встречающиеся в природе в микроорганизмах, и он может относиться к самому штамму дикого типа или штамму природного типа, или штамму перед трансформацией генетической модификацией из-за природного или искусственного фактора. Термин «штамм перед модификацией» или «микроорганизм перед модификацией» может использоваться взаимозаменяемо с термином «немутировавший штамм», «немодифицированный штамм», «немутировавший микроорганизм», «немодифицированный микроорганизм» или «эталонный микроорганизм».
Микроорганизм, включающий вариант глутамат-цистеинлигазы или включающий полинуклеотид, кодирующий данный вариант, или вектор, включающий данный полинуклеотид, в том виде, как он здесь используется, может представлять собой рекомбинантный микроорганизм, или рекомбинация может достигаться генетической модификацией, такой как трансформация.
Например, данный микроорганизм может представлять собой рекомбинантный микроорганизм, полученный трансформацией с использованием вектора, включающего данный полинуклеотид, но не ограничивается им. Данный рекомбинантный микроорганизм может представлять собой дрожжей, и его примером может быть микроорганизм рода Saccharomyces, в частности, Saccharomyces cerevisiae, но не ограничиваясь им.
Согласно еще одному другому аспекту настоящего раскрытия предложен способ продуцирования глутатиона, включающий стадию культивирования данного микроорганизма. Данный микроорганизм и глутатион являются такими, как описано выше.
В качестве среды и других культуральных условий, используемых для культивирования штамма по настоящему раскрытию, можно использовать любую среду без конкретного ограничения, при условии, что она представляет собой среду, обычно используемую для культивирования микроорганизмов рода Saccharomyces. В частности, штамм по настоящему раскрытию может культивироваться в обычной среде, содержащей правильные источники углерода, источники азота, источники фосфора, неорганические соединения, аминокислоты и/или витамины и т.д. при осуществлении контроля температуры, рН и т.д. при аэробных или анаэробных условиях.
В настоящем раскрытии данные источники углерода включают углеводы, такие как глюкоза, фруктоза, сахароза, мальтоза и т.д.; сахароспирты, такие как маннит, сорбит и т.д.; органические кислоты, такие как пировиноградная кислота, молочная кислота, лимонная кислота и т.д.; аминокислоты, такие как глутаминовая кислота, метионин, лизин и т.д.; и тому подобное, но не ограничиваются ими. Кроме того, можно использовать природные органические питательные вещества, такие как гидролизат крахмала, меласса, сырая меласса, рисовые отруби, маниок, остаток сахарного тростника и жидкий кукурузный экстракт. В частности, можно использовать углеводы, такие как глюкоза и стерилизованная предобработанная меласса (а именно меласса, превращенная в восстанавливающий сахар), и можно использовать подходящие количества других источников углерода разными способами без ограничения. Данные источники углерода можно использовать одни или в комбинации двух или более чем двух из них.
В качестве источников азота можно использовать источники неорганического азота, такие как аммиак, сульфат аммония, хлорид аммония, ацетат аммония, фосфат аммония, карбонат аммония, нитрат аммония и т.д.; и источники органического азота, такие как аминокислоты, пептон, NZ-амин, мясной экстракт, дрожжевой экстракт, солодовый экстракт, жидкий кукурузный экстракт, гидролизат казеина, рыба или ее продукты разложения и обезжиренный соевый жмых или его продукты разложения, и т.д. Данные источники азота можно использовать одни или в комбинации двух или более чем двух из них, но не ограничиваясь ими.
Источники фосфора могут включать монокалия фосфат, дикалия фосфат или соответствующие им натрийс о держащие соли. В качестве неорганических соединений можно использовать хлорид натрия, хлорид кальция, хлорид железа, сульфат магния, сульфат железа, сульфат марганца, карбонат кальция и т.д.
Кроме данных соединений, могут содержаться аминокислоты, витамины и/или подходящие предшественники. В частности, в культуральную среду для штамма могут быть добавлены L-аминокислоты и т.д. В частности, могут быть добавлены глицин, глутамат и/или цистеин и т.д., и, если необходимо, могут быть дополнительно добавлены L-аминокислоты, такие как лизин и т.д., но не обязательно ограничиваясь ими.
Данные среды или предшественники можно добавлять в культуру порционно или непрерывно, но не ограничиваясь ими.
В настоящем раскрытии во время культивирования данного штамма рН культуры может корректироваться добавлением в культуру правильным способом таких соединений, как гидроксид аммония, гидроксид калия, аммиак, фосфорная кислота и серная кислота. Во время культивирования пенообразование может подавляться посредством применения пеногасителя, такого как сложный эфир жирной кислоты и полигликоля. Кроме того, в культуру может инъецироваться кислород или кислородсодержащий газ для того, чтобы поддерживать аэробное состояние среды, или газ может не инъецироваться, или может инъецироваться газообразный азот, водород или диоксид углерода для того, чтобы поддерживать анаэробное и микроаэробное состояния.
Может поддерживаться температура культуры от 25°С до 40°С, более конкретно, от 28°С до 37°С, но не ограничиваясь ими. Культивирование может продолжаться, пока не получают желательное количество продукта, в частности, в течение 1 часа 100 часов, но не ограничиваясь ими.
Способ продуцирования глутатиона может, кроме того, включать дополнительный процесс после стадии культивирования. Данный дополнительный процесс может быть подходящим образом отобран согласно применению глутатиона.
В частности, способ продуцирования глутатиона может включать стадию сбора глутатиона, который накапливается в клетках посредством стадии культивирования, например, стадию сбора глутатиона из одного или более чем одного материала, выбранного из штамма, сухого продукта, экстракта, культуры и ее лизата, после стадии культивирования.
Данный способ может дополнительно включать стадию лизирования штамма перед или одновременно со стадией сбора. Лизис данного штамма может осуществляться способом, обычно используемым в области, к которой относится настоящее раскрытие, например, с использованием лизирующего буферного раствора, соникатора, тепловой обработки и кофеварки, и т.д. Кроме того, данная стадия лизиса может включать ферментативные реакции, такие как с использованием ферментов деградации клеточных стенок, ферментов деградации нуклеиновых кислот, трансфераз нуклеиновых кислот и ферментов деградации белка, но не ограничиваясь ими.
Относительно задач настоящего раскрытия сухие дрожжи, дрожжевой экстракт, смешанный порошок дрожжевого экстракта или чистый глутатион, имеющий высокое содержание глутатиона, можно получать посредством способа получения глутатиона, но не ограничиваясь им, и можно подходящим образом получать согласно желательному продукту.
Термин «сухие дрожжи» в том виде, как он здесь используется, можно использовать взаимозаменяемо с термином «сухой штамм» и т.д. Сухие дрожжи можно получать посредством сушки штамма дрожжей, в котором накапливается глутатион, и, в частности, можно включать в кормовую композицию, пищевую композицию и т.д., но не ограничиваясь ими.
Термин «дрожжевой экстракт» в том виде, как он здесь используется, может использоваться взаимозаменяемо с термином «экстракт штамма» и т.д. Экстракт штамма может относиться к веществу, которое остается после того, как клеточная стенка отделяеся от тела клеток данного штамма. В частности, экстракт штамма может относиться к остальным компонентам, исключающим клеточную стенку, полученным лизисом тела клетки. Данный экстракт штамма может включать глутатион и может включать, в качестве компонентов, отличных от глутатиона, один или более чем один компонент белков, углеводов, нуклеиновых кислот и волокон, но не ограничиваясь ими.
Стадию сбора можно осуществлять с использованием подходящего способа, известного в данной области, собирая, посредством этого, глутатион, который представляет собой желательное вещество.
Стадия сбора может включать процесс очистки. Данный процесс очистки может представлять собой процесс отделения от штамма только чистого глутатиона. Посредством способа очистки можно получать чистый глутатион.
По мере необходимости, способ получения глутатиона может дополнительно включать стадию смешивания эксципиента с веществом, выбранным из штамма, полученного после стадии культивирования, сухого продукта, экстракта, культуры и ее лизата, и собранного из них глутатиона. Посредством данной стадии смешивания может быть получен смешанный порошок дрожжевого экстракта.
Данный эксципиент может быть подходящим образом выбран для применения согласно его намеченным применению или форме и, например, может быть выбран из крахмала, глюкозы, целлюлозы, лактозы, гликогена, D-маннита, сорбита, лактита, мальтодекстрина, карбоната кальция, синтетического силиката алюминия, моногидрофосфата кальция, сульфата кальция, хлорида натрия, гидрокарбоната натрия, очищенного ланолина, декстрина, альгината натрия, метилцеллюлозы, коллоидного силикагеля, гидроксипропилкрахмала, гидроксипропилметилцеллюлозы, пропиленгликоля, казеина, лактата кальция, примогеля, аравийской камеди и, в частности, одного или более чем одного компонента, выбранного из крахмала, глюкозы, целлюлозы, лактозы, декстрина, гликогена, D-маннита и мальтодекстрина, но не ограничиваясь ими.
Данный эксципиент может включать, например, консервант, увлажнитель, диспергирующий агент, суспендирующий агент, буферизующий агент, стабилизатор или изотоничный агент и т.д., но не ограничивается ими.
Согласно еще одному другому аспекту настоящего раскрытия предложено применение варианта по настоящему раскрытию в продукции глутатиона.
Согласно еще одному другому аспекту настоящего раскрытия предложено применение микроорганизма, включающего вариант глутамат-цистеинлигазы по настоящему раскрытию, в продукции глутатиона.
Данный вариант, полинуклеотид и микроорганизм являются такими, как описано выше.
Ниже настоящее изобретение будет более подробно описано со ссылкой на Примеры и Экспериментальный пример. Однако данные Примеры и Экспериментальный пример служат лишь для иллюстрации настоящего раскрытия, и объем настоящего раскрытия не предназначен для того, чтобы ограничиваться данными Примерами и Экспериментальным примером.
Пример 1: отбор и улучшение штамма, продуцирующего глутатион
Пример 1-1: отбор штамма, продуцирующего глутатион
Штаммы получали из закваски нурук, содержащей разные штаммы, и отбирали штаммы, имеющие способность к продукции глутатиона, улучшая данные штаммы.
В подробностях, образцы зерна, такого как рис, ячмень, маш, овес и т.д., отбирали всего из 20 регионов, включающих Йонъин, Ичеон, Пхентхек, Хвасон, провинция Кенгидо Республики Корея, и затем размалывали, замешивали, заворачивали в ткань, крепко сжимали, заворачивали в солому, с последующей ферментацией в течение 10 суток. Затем данные образцы медленно сушили с получением нурука.
Для того, чтобы выделять разные штаммы из полученного нурука проводили эксперименты следующим образом. 45 мл физиологического раствора добавляли к 5 г нурука и измельчали с использованием миксера. Для чистого отделения штаммов дрожжей осуществляли серийное разведение, с последующим распределением на YPD (пептон декстроза дрожжей) агаре (10 г/л дрожжевого экстракта, 20 г/л бактопептона, 20 г/л глюкозы, на основе 1 литра дистиллированной воды) и инкубацией при 30°С в течение 48 часов. Затем колонии дрожжей наносили штрихами на YPD агар посредством морфологии колонии и микроскопической проверки. 25 мл бульона YPD дозировали в 250 мл колбу Эрленмейера, высевали чистый отделенный штамм и культивировали со встряхиванием (30°С, 200 об./мин) в течение 48 часов для подтверждения продукции глутатиона, и осуществляли скрининг штамма.
Для улучшения первично выделенных штаммов в данных выделенных штаммах индуцировали случайные мутации. В подробностях, среди дрожжей, выделенных из нурука, выделяли штамм, у которого была подтверждена продукция глутатиона, и называли его штамм CJ-37. Данный штамм CJ-37 культивировали на твердой среде, высевали в бульон с получением культуральной среды, и данные клетки облучали УФ (ультрафиолет) с использованием УФ лампы. Затем культуральную среду, облученную УФ, переносили на среду для чашек с получением только мутантных штаммов, образующих колонии, и проверяли их продукцию глутатиона.
В результате, из мутантных штаммов отбирали штамм, демонстрирующий наивысшую продукцию глутатиона, в качестве штамма, продуцирующего глутатион, называли его штамм CJ-5 и депонировали в Корейский центр культивирования микроорганизмов (КССМ) международный депозитарный орган, работающий согласно Будапештскому соглашению, 31 июля 2019 г., и присваивали ему № доступа KCCM12568P.
Пример 1-2: эксперимент для дополнительного улучшения для повышен ни способности к продукции глутатиона
Для того, чтобы дополнительно улучшить способность к продукции глутатиона штамма CJ-5, индуцировали мутации следующим образом.
Штамм CJ-5 культивировали на твердой среде, высевали в бульон для с получением культуральной среды, и данные клетки облучали УФ с использованием УФ лампы. Затем культуральную среду, облученную УФ, переносили на среду для чашек с получением только мутантных штаммов, образующих колонии, выделяли штамм, демонстрирующий самую улучшенную способность к продукции глутатиона, называли его штамм СС02-2490 и депонировали в Корейский центр культивирования микроорганизмов (KCCM) - международный депозитарный орган, работающий согласно Будапештскому соглашению, 17 января 2020 г., и присваивали ему № доступа KCCM12659P.
В результате осуществления анализа нуклеотидной последовательности гена биосинтеза глутатиона gsh1 в связи с увеличением способности к продукции глутатиона штамма СС02-2490 подтвердили то, что цистеин, который является 86-ой аминокислотой белка GSH1 (SEQ ID NO: 1), кодируемого геном gsh1, заменяется аргинином.
Пример 1-3: эксперимент для дополнительного улучшения для увеличения способности к продукции глутатиона
Для того, чтобы дополнительно улучшить способность к продукции глутатиона штамма СС02-2490, индуцировали мутации следующим образом.
Штамм СС02-2490 культивировали на твердой среде, высевали в бульон с получением культуральной среды, и данные клетки облучали УФ с использованием УФ лампы. Затем культуральную среду, облученную УФ, переносили на среду для чашек с получением только мутантных штаммов, образующих колонии, выделяли штамм, демонстрирующий самую улучшенную способность к продукции глутатиона, называли его штамм СС02-2544 и депонировали в Корейский центр культивирования микроорганизмов (КССМ) - международный депозитарный орган, работающий согласно Будапештскому соглашению, 20 февраля 2020 г., и присваивали ему № доступа КССМ 12674Р.
В результате осуществления анализа нуклеотидной последовательности гена биосинтеза глутатиона gsh1 в связи с увеличением способности к продукции глутатиона штамма СС02-2544 подтвердили то, что происходили изменения -250(С→Т), -252(G→A), -398(А→Т), -399(А→С), -407(Т→С), -409(Т→С) выше ORF GSH1 (SEQIDNO: 12).
Пример 2: эксперимент для дополнительного улучшения штамма СС02-2544 для увеличения способности к продукции глутатиона
Для того, чтобы дополнительно улучшить способность к продукции глутатиона штамма СС02-2544, индуцировали мутации следующим образом.
Штамм СС02-2544 культивировали на твердой среде, высевали в бульон с получением культуральной среды, и данные клетки облучали УФ с использованием УФ лампы. Затем культуральную среду, облученную УФ, переносили на среду для чашек с получением только мутантных штаммов, образующих колонии, с последующим анализом нуклеотидной последовательности.
В результате данного эксперимента подтвердили то, что метионином была заменена 653-я аминокислота (глицин) GSH1, который представляет собой белок, кодируемый геном биосинтеза глутатиона gsh1 штамма, демонстрирующего 27%-ное увеличение содержания глутатиона. Данный штамм называли СС02-2816 и депонировали в Корейский центр культивирования микроорганизмов (КССМ) международный депозитарный орган, работающий согласно Будапештскому соглашению, 8 декабря 2020 г., и присваивали ему № доступа КССМ12891Р.
Пример 3: эксперимент по изменению остатка G653 GSH1
Из приведенных выше результатов Примера 2 определили то, что положение 653 белка GSH1 было бы важным для продукции глутатиона, и получали варианты штамма Saccharomyces cerevisiae (S. cerevisiae) CEN.PK2-1D и CC02-2544 для экспрессии вариантов белка, в которых аминокислота в положении 653 белка GSH1 была заменена другой аминокислотой, и намеревались проверить, увеличивалась ли или нет продукция глутатиона. С другой стороны, как упомянуто выше, штамм СС02-2544 представляет собой штамм, имеющий изменения -250(С→Т), -252(G→А), -398(А→Т), -399(А→С), -407(Т→С), -409(Т→С) выше ORF GSH1 в варианте штамма GSH1 C86R. В соответствующем штамме дополнительно ввели изменение аминокислоты в положении 653 белка GSH1.
Для получения штамма, в котором аминокислота в положении 653 белка GSH1 дрожжей Saccharomyces cerevisiae была заменена метионином, использовали плазмиды pWAL100 и pWBR100 со ссылкой на содержание, раскрытое в литературе: Lee ТН, et al. (J. Microbiol. Biotechnol. (2006), 16(6), 979 982). В подробностях, ПЦР (полимеразная цепная реакция) проводили следующим образом с использованием геномной ДНК штамма CJ-5 в качестве матрицы. ПЦР проводили с использованием праймеров SEQ ID NO: 4 и SEQ ID NO: 5 с получением части N-концевой последовательности GSH1, включающей N-концевую фланкирующую последовательность BamHI, инициирующий кодон ORE GSH1 и посредовательность, кодирующую изменение G653M, и с использованием праймеров SEQ ID NO: 6 и SEQ ID NO: 7 с получением части С-концевой последовательности GSH1, включающей С-концевую фланкирующую последовательность XhoI, терминирующий кодон ORF GSH1 и посредовательность, кодирующую изменение G653M. Затем проводили ПЦР с перекрывающимися праймерами с использованием данных двух последовательностей в качестве матриц и SEQ ID NO: 4 и SEQ ID NO: 7, и, в результате, получали фрагмент ORF GSH1, включающий последовательность, кодирующую вариант белка GSH1, в которой аминокислота в положении 653 была заменена метионином, N-концевую последовательность рестрикционного фермента BamHI и С-концевую последовательность рестрикционного фермента XhoI. Данный фрагмент ORF обрабатывали BamHI и XhoI, и затем клонировали в вектор pWAL100, который обрабатывали такими же ферментами, с получением вектора pWAL100-GSH1(G653M).
Кроме того, ПЦР проводили с использованием геномной ДНК штамма CJ-5 в качестве матрицы и SEQ ID NO: 8 и SEQ ID NO: 9 с получением фрагмента из 500 п.н. после терминирующего кодона ORF GSH1, содержащего N-концевую последовательность рестрикционного фермента SpeI и С-концевую последовательность рестрикционного фермента NcoI. Затем данный фрагмент клонировали в pWBR100, которую обрабатывали такими же рестрикционными ферментами, с получением вектора pWBR100-GSH1.
Наконец, для получения фрагмента ДНК, подлежащего введению в дрожжи, получали ПЦР-продукт, содержащий последовательность, кодирующую вариант с метионином, и часть KIURA3, с использованием полученного ранее вектора pWAL100- GSH1 (G653M) в качестве матрицы и праймеров SEQ ID NO: 4 и SEQ ID NO: 10, и ПЦР-продукт, содержащий часть KIURA3 и 500 п. н. после терминирующего кодона GSH1 получали с использованием вектора pWBR100-GSH1 в качестве матрицы и праймеров SEQ ID NO: 11 и SEQ ID NO: 9, и затем каждый ПЦР-продукт трансформировали в S. cerevisiae CEN.PK2-1D и S. cerevisiae СС02-2544 в том же самом мольном соотношении. ПЦР проводили при условиях тепловой денатурации при 95°С в течение 5 минут, отжига при 53°С в течение 1 минуты и полимеризации при 72°С в течение 1 минуты на 1 т.п.н. Трансформацию дрожжей проводили с использованием способа с ацетатом лития, модифицированного из диссертации Geitz (Nucleic Acid Research, 20(6), 1425). В подробностях, дрожжевые клетки при ОП (оптическая плотность) 0,7 ~ 1,2 дважды промывали буфером ацетат лития/ТЕ, и затем смешивали друг с другом ПЦР-продукты и одноцепочечную ДНК (Sigma D-7656) и инкубировали в буфере ацетат лития/ТЕ/40% PEG (полиэтиленгликоль) в течение 30 минут при 30°С и 42°С в течение 15 минут, и затем данные клетки культивировали на чашке с агаром SC (2% глюкоза) без урацила, пока колонии не становились видимыми, и получали штамм, в который были введены кодирующая последовательность изменения G653M GSH1 и ген KIURA3. Затем, для того, чтобы удалить KIURA3, каждый штамм инкубировали в течение ночи в 2 мл YPD, разводили 1/100 и распределяли на чашке с агаром SC (2% глюкоза), содержащим 0,1% 5-FOA, с получением варианта штамма S. cerevisiae CEN.PK2-1D GSH1 G653M и варианта штамма S. cerevisiae СС02-2544 GSH1 G653M, из которых удаляли урациловый маркер. Также получали штамм, способный к экспрессии варианта белка GSH1, в котором осуществлялись замены на другие типы аминокислот, чем метионин, таким же способом, за исключением применения пары праймеров, в которых последовательность, кодирующая метионин в положении 653 на последовательностях праймеров SEQ ID NO: 5 и SEQ ID NO: 6, была заменена последовательностью, кодирующей другую аминокислоту.


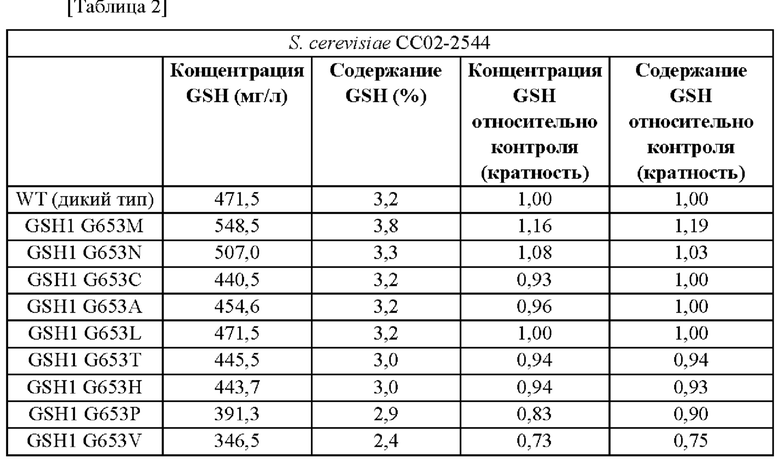
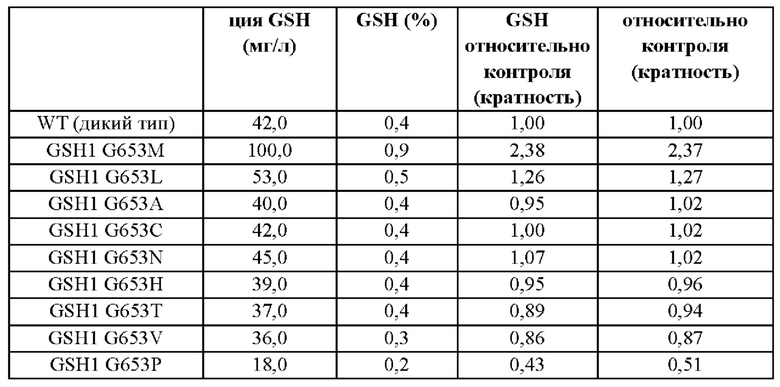
Результаты измерения концентрации и содержания глутатиона (GSH), продуцируемого культивированием каждого из полученных штаммов в течение 26 часов, показаны в Таблице 2 и Таблице 3. В штамм СС02-2544 дополнительно вводили изменение G653M GSH1 (SEQ ID NO: 13). В результате, концентрация GSH увеличивалась на 77 мг/л - от 471,5 мг/л до 548,5 мг/л, и в результате введения изменения G653M GSH1 (SEQ ID NO: 3) в штамм CEN.PK-1D концентрация GSH увеличивалась на 58 мг/л от 42 мг/л до 100 мг/л.
Пример 3-1: введение изменения G653 GSH1 в штамм СС02-2544
Пример 3-2: введение изменения G653 GSH1 в штамм CEN.PK-1D

Из этого можно видеть то, что вариант GSH1, в котором глицин в положении 653 белка GSH1 заменен метионином, значительно увеличивает способность к продукции глутатиона.
Это подтвердило то, что новый вариант GSH1, разработанный в данном раскрытии, демонстрирует увеличение продукции глутатиона. Кроме того, дрожжи, демонстрирующие высокую продукцию глутатиона посредством включения варианта GSH1 по настоящему раскрытию, их сухой продукт, их экстракт, их культура, их лизат и продуцированный глутатион имеют антиоксидантные эффекты, детоксифицирующие эффекты и эффекты усиления иммунитета и, таким образом, они также могут с пользой использоваться в косметических композициях, пищевых композициях, кормовых композициях, фармацевтических композициях и их получении.
Эталонный пример: эксперимент по замене остатка С86 белка GSH1
Получали варианты штамма Saccharomyces cerevisiae (S. cerevisiae) CEN.PK2-1D и Saccharomyces cerevisiae (S. cerevisiae) CJ-5 для экспрессии варианта белка, в котором аминокислота цистеин в положении 86 белка GSH1 заменяется другой аминокислотой. Намеревались проверить, увеличивается ли продукция глутатиона.
Для получения штамма, в котором цистеин в положении 86 белка GSH1 Saccharomyces cerevisiae был заменен аргинином, использовали плазмиды pWAL100 и pWBR100 со ссылкой на содержание, раскрытое в литературе, Lee ТН, et al. (J. Microbiol. Biotechnol. (2006), 16(6), 979 982). В подробностях, ПЦР проводили следующим образом с использованием геномной ДНК штамма CJ-5 в качестве матрицы. ПЦР проводили с использованием праймеров SEQ ID NO: 4 и SEQ ID NO: 14 с получением части N-концевой последовательности GSH1, включающей N-концевую фланкирующую последовательность BamHI, инициирующий кодон ORE GSH1 и последовательность, кодирующую изменение C86R, и с использованием праймеров SEQ ID NO: 15 и SEQ ID NO: 7 с получением части С-концевой последовательности GSH1, включающей С-концевую фланкирующую последовательность XhoI, терминирующий кодон ORF GSH1 и последовательность, кодирующую изменение C86R. Затем проводили ПЦР с перекрывающимися праймерами с использованием данных двух последвательностей в качестве матриц и SEQ ID NO: 4 и SEQ ID NO: 7, и, в результате, получали фрагмент ORF GSH1, включающий последовательность, кодирующую вариант белка GSH1, в которой цистеин в положении 86 был заменен аргинином, N-концевую последовательность рестрикционного фермента BamHI и С-концевую последовательностью рестрикционного фермента XhoI. Данный фрагмент ORF обрабатывали BamHI и XhoI, и затем клонировали в вектор pWAL100, который обрабатывали такими же ферментами, с получением вектора pWAL100-GSHl(C86R).
Кроме того, проводили ПЦР с использованием геномной ДНК штамма CJ-5 в качестве матрицы и SEQ ID NO: 8 и SEQ ID NO: 9 с получением фрагмента из 500 п. н. после терминирующего кодона ORF GSH1, содержащего N-концевую последовательность рестрикционного фермента SpeI и С-концевую последовательность рестрикционного фермента NcoI, который затем обрабатывали рестрикционными ферментами SpeI и NcoI. Затем данный фрагмент клонировали в pWBR100, которую обрабатывали такими же рестрикционными ферментами, с получением вектора pWBR100-GSHl.
Наконец, для получения фрагмента ДНК, подлежащего введению в дрожжи, получали ПЦР-продукт, содержащий последовательность, кодирующую изменение по аргинину, и часть KIURA3, и использованием полученного ранее вектора pWBR100-GSH1(C86R) в качестве матрицы и праймеров SEQ ID NO: 4 и SEQ ID NO: 10, и получали ПЦР-продукт, содержащий часть KIURA3 и 500 п. н. после терминирующего кодона GSH1, с использованием вектора pWBR100-GSHl в качестве матрицы и праймеров SEQ ID NO: 11 и SEQ ID NO: 9, и затем каждый ПЦР-продукт трансформировали в S. cerevisiae CEN.PK2-1D и S. cerevisiae CJ-5 при одинаковом мольном соотношении. ПЦР проводили при условиях тепловой денатурации при 95°С в течение 5 минут, отжига при 53°С в течение 1 минуты и полимеризации при 72°С в течение 1 минуты на 1 т.п.н. Трансформацию дрожжей проводили с использованием способа с ацетатом лития, модифицированного из диссертации Geitz (Nucleic Acid Research, 20(6), 1425). В подробностях, дрожжевые клетки при ОП 0,7-1,2 дважды промывали буфером ацетат лития/ТЕ, и затем смешивали друг с другом ПЦР-продукты и одноцепочечную ДНК (Sigma D-7656) и инкубировали в буфере ацетат лития/ТЕ/40% PEG в течение 30 минут при 30°С и 42°С в течение 15 минут, и затем данные клетки подвергали стационарному культивированию на чашке с агаром SC (2% глюкоза) без урацила, пока колонии не становились видимыми, и получали штамм, в который были введены последовательность, кодирующая изменение C86R GSH1, и ген KIURA3. Затем, для того, чтобы удалить KIURA3, каждый штамм инкубировали в течение ночи в 2 мл YPD, разводили 1/100 и распределяли на чашке с агаром SC (2% глюкоза), содержащим 0,1% 5-FOA, с получением варианта штамма S. cerevisiae CEN.PK2-1D GSH1 C86R и варианта штамма S. cerevisiae CJ-5 GSH1 C86R, из которых удаляли урациловый маркер. Также получали штамм, способный к экспрессии варианта белка GSH1, в котором осуществлялись замены на другие типы аминокислот, чем аргинин, таким же способом, за исключением применения пары праймеров, в которых последовательность, кодирующая аргинин в положении 86, на последовательностях праймеров SEQ ID NO: 14 и SEQ ID NO: 15 была заменена последовательностью, кодирующей другую аминокислоту.

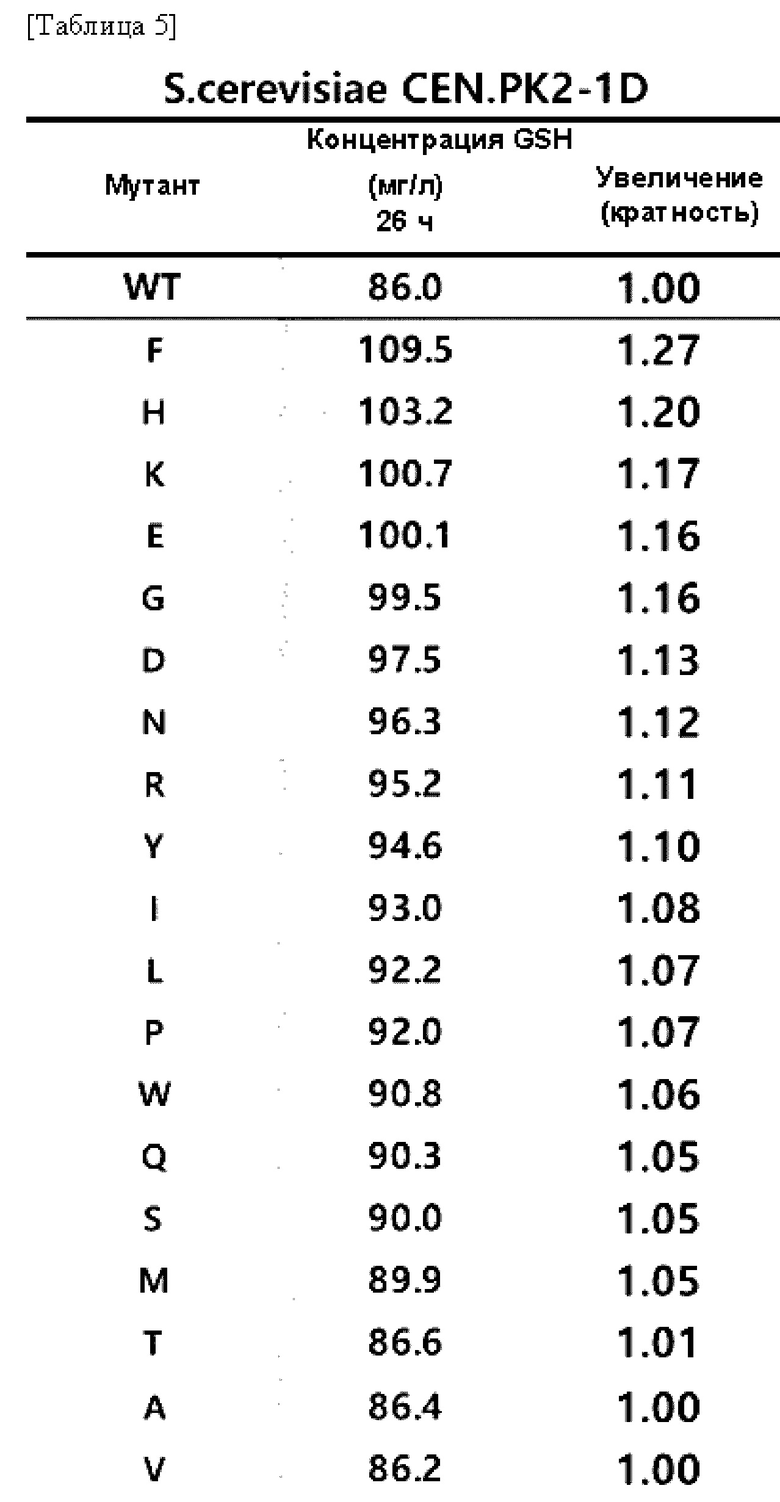
Результаты измерения концентрации глутатиона (GSH), продуцируемого культивированием каждого из полученных штаммов в течение 26 часов, показаны в Таблице 5 и Таблице 6.
 ■
■
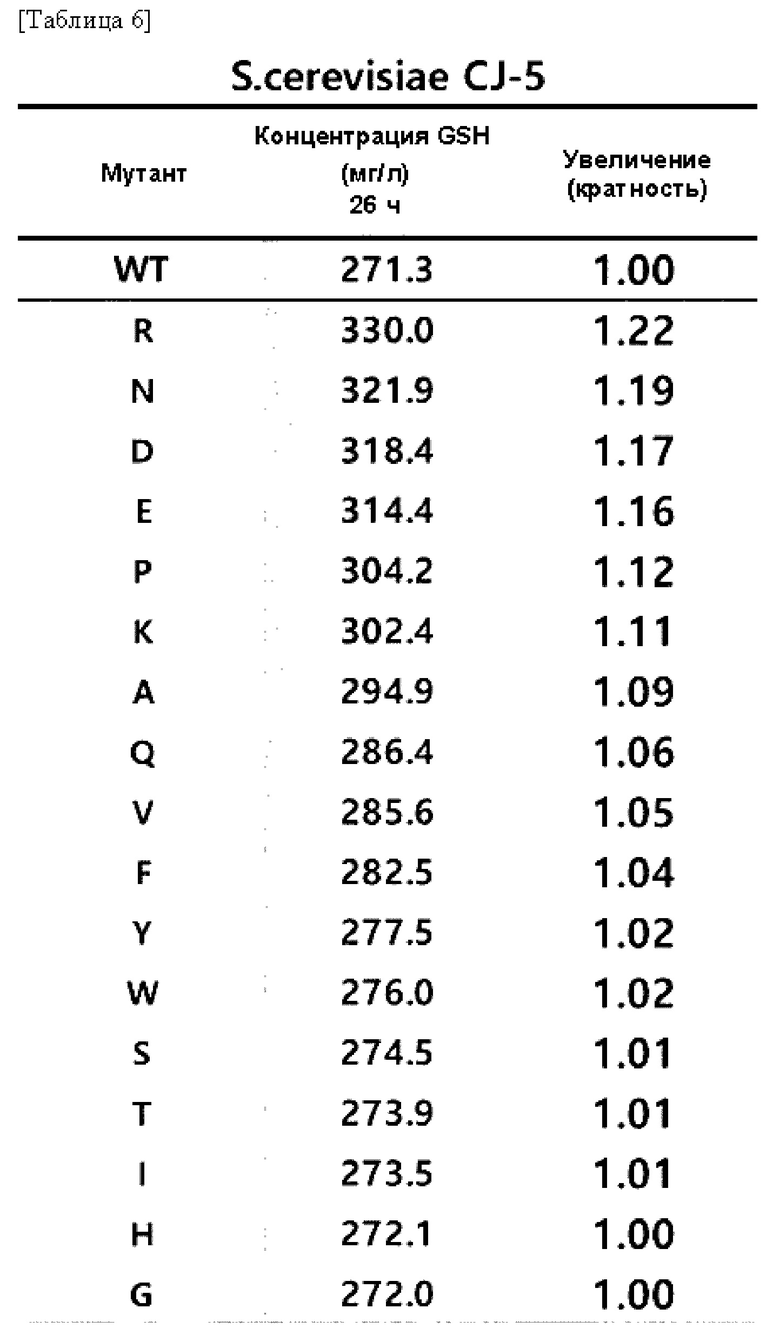
В результате данного эксперимента подтвердили то, что при замене цистеина в положении 86 белка GSH1 другой аминокислотой увеличивается способность к продукции глутатиона по сравнению со способностью белка GSH1 дикого типа.
Это указывает на то, что у варианта GSH1, в котором цистеин в положении 86 белка GSH1 заменяется другой аминокислотой, значительно увеличивается способность к продукции глутатиона.
На основе приведенного выше описания специалистам в данной области будет понятно то, что настоящее раскрытие может применяться в разных конкретных формах без изменения его технической сущности или существенных характеристик. В данном отношении следует понимать то, что приведенное выше воплощение не является ограничивающим, но иллюстративным во всех аспектах. Объем данного раскрытия определяется приложенной формулой изобретения, а не предшествующим ей описанием, и, следовательно, подразумевается то, что все изменения и модификации, которые попадают в пределы границ формулы изобретения, или эквиваленты таких границ, следовательно, охватываются данной формулой изобретения.
Эффект изобретения
Новый вариант глутамат-цистеинлигазы по настоящему раскрытию значительно увеличивает продукцию глутатиона и, таким образом, его можно с пользой применять для высокой продукции глутатиона. Как описано, дрожжи, показывающие высокую продукцию глутатиона, их сухой продукт, их экстракт, их культура, их лизат и продуцированный глутатион имеют антиоксидантные эффекты, эффекты детоксификации и эффекты усиления иммунитета, и, таким образом, они могут также с пользой использоваться в косметических композициях, пищевых композициях, кормовых композициях, фармацевтических композициях и их получении.
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> CJ CheilJedang Corporation
<120> ВАРИАНТ ГЛУТАМАТ-ЦИСТЕИНЛИГАЗЫ И СПОСОБ ПОЛУЧЕНИЯ ГЛУТАТИОНА
С ЕГО ИСПОЛЬЗОВАНИЕМ
<130> OPA21295
<150> KR10-2021-0000361
<151> 2021-01-04
<160> 15
<170> KoPatentIn 3.0
<210> 1
<211> 678
<212> PRT
<213> Saccharomyces cerevisiae
<400> 1
Met Gly Leu Leu Ala Leu Gly Thr Pro Leu Gln Trp Phe Glu Ser Arg
1 5 10 15
Thr Tyr Asn Glu His Ile Arg Asp Glu Gly Ile Glu Gln Leu Leu Tyr
20 25 30
Ile Phe Gln Ala Ala Gly Lys Arg Asp Asn Asp Pro Leu Phe Trp Gly
35 40 45
Asp Glu Leu Glu Tyr Met Val Val Asp Phe Asp Asp Lys Glu Arg Asn
50 55 60
Ser Met Leu Asp Val Cys His Asp Lys Ile Leu Thr Glu Leu Asn Met
65 70 75 80
Glu Asp Ser Ser Leu Cys Glu Ala Asn Asp Val Ser Phe His Pro Glu
85 90 95
Tyr Gly Arg Tyr Met Leu Glu Ala Thr Pro Ala Ser Pro Tyr Leu Asn
100 105 110
Tyr Val Gly Ser Tyr Val Glu Val Asn Met Gln Lys Arg Arg Ala Ile
115 120 125
Ala Glu Tyr Lys Leu Ser Glu Tyr Ala Arg Gln Asp Ser Lys Asn Asn
130 135 140
Leu His Val Gly Ser Arg Ser Val Pro Leu Thr Leu Thr Val Phe Pro
145 150 155 160
Arg Met Gly Cys Pro Asp Phe Ile Asn Ile Lys Asp Pro Trp Asn His
165 170 175
Lys Asn Ala Ala Ser Arg Ser Leu Phe Leu Pro Asp Glu Val Ile Asn
180 185 190
Arg His Val Arg Phe Pro Asn Leu Thr Ala Ser Ile Arg Thr Arg Arg
195 200 205
Gly Glu Lys Val Cys Met Asn Val Pro Met Tyr Lys Asp Ile Ala Thr
210 215 220
Pro Glu Thr Asp Asp Ser Ile Tyr Asp Arg Asp Trp Phe Leu Pro Glu
225 230 235 240
Asp Lys Glu Ala Lys Leu Ala Ser Lys Pro Gly Phe Ile Tyr Met Asp
245 250 255
Ser Met Gly Phe Gly Met Gly Cys Ser Cys Leu Gln Val Thr Phe Gln
260 265 270
Ala Pro Asn Ile Asn Lys Ala Arg Tyr Leu Tyr Asp Ala Leu Val Asn
275 280 285
Phe Ala Pro Ile Met Leu Ala Phe Ser Ala Ala Ala Pro Ala Phe Lys
290 295 300
Gly Trp Leu Ala Asp Gln Asp Val Arg Trp Asn Val Ile Ser Gly Ala
305 310 315 320
Val Asp Asp Arg Thr Pro Lys Glu Arg Gly Val Ala Pro Leu Leu Pro
325 330 335
Lys Tyr Asn Lys Asn Gly Phe Gly Gly Ile Ala Lys Asp Val Gln Asp
340 345 350
Lys Val Leu Glu Ile Pro Lys Ser Arg Tyr Ser Ser Val Asp Leu Phe
355 360 365
Leu Gly Gly Ser Lys Phe Phe Asn Arg Thr Tyr Asn Asp Thr Asn Val
370 375 380
Pro Ile Asn Glu Lys Val Leu Gly Arg Leu Leu Glu Asn Asp Lys Ala
385 390 395 400
Pro Leu Asp Tyr Asp Leu Ala Lys His Phe Ala His Leu Tyr Ile Arg
405 410 415
Asp Pro Val Ser Thr Phe Glu Glu Leu Leu Asn Gln Asp Asn Lys Thr
420 425 430
Ser Ser Asn His Phe Glu Asn Ile Gln Ser Thr Asn Trp Gln Thr Leu
435 440 445
Arg Phe Lys Pro Pro Thr Gln Gln Ala Thr Pro Asp Lys Lys Asp Ser
450 455 460
Pro Gly Trp Arg Val Glu Phe Arg Pro Phe Glu Val Gln Leu Leu Asp
465 470 475 480
Phe Glu Asn Ala Ala Tyr Ser Val Leu Ile Tyr Leu Ile Val Asp Ser
485 490 495
Ile Leu Thr Phe Ser Asp Asn Ile Asn Ala Tyr Ile His Met Ser Lys
500 505 510
Val Trp Glu Asn Met Lys Ile Ala His His Arg Asp Ala Ile Leu Phe
515 520 525
Glu Lys Phe His Trp Lys Lys Ser Phe Arg Asn Asp Thr Asp Val Glu
530 535 540
Thr Glu Asp Tyr Ser Ile Ser Glu Ile Phe His Asn Pro Glu Asn Gly
545 550 555 560
Ile Phe Pro Gln Phe Val Thr Pro Ile Leu Cys Gln Lys Gly Phe Val
565 570 575
Thr Lys Asp Trp Lys Glu Leu Lys His Ser Ser Lys His Glu Arg Leu
580 585 590
Tyr Tyr Tyr Leu Lys Leu Ile Ser Asp Arg Ala Ser Gly Glu Leu Pro
595 600 605
Thr Thr Ala Lys Phe Phe Arg Asn Phe Val Leu Gln His Pro Asp Tyr
610 615 620
Lys His Asp Ser Lys Ile Ser Lys Ser Ile Asn Tyr Asp Leu Leu Ser
625 630 635 640
Thr Cys Asp Arg Leu Thr His Leu Asp Asp Ser Lys Gly Glu Leu Thr
645 650 655
Ser Phe Leu Gly Ala Glu Ile Ala Glu Tyr Val Lys Lys Asn Lys Pro
660 665 670
Ser Ile Glu Ser Lys Cys
675
<210> 2
<211> 2037
<212> DNA
<213> Saccharomyces cerevisiae
<400> 2
atgggactct tagctttggg cacgcctttg cagtggtttg agtctaggac gtacaatgaa
60
cacataaggg atgaaggtat cgagcagttg ttgtatattt tccaagctgc tggtaaaaga
120
gacaatgacc ctcttttttg gggagacgag cttgagtaca tggttgtaga ttttgatgat
180
aaggagagaa attctatgct cgacgtttgc catgacaaga tactcactga gcttaatatg
240
gaggattcgt ccctttgtga ggctaacgat gtgagttttc accctgagta tggccggtat
300
atgttagagg caacaccagc ttctccatat ttgaattacg tgggtagtta cgttgaggtt
360
aacatgcaaa aaagacgtgc cattgcagaa tataagctat ctgaatatgc gagacaagat
420
agtaaaaata acttgcatgt gggctccagg tctgtccctt tgacgctgac tgtcttcccg
480
aggatgggat gccccgactt tattaacatt aaggatccgt ggaatcataa aaatgccgct
540
tccaggtctc tgtttttacc cgatgaagtc attaacagac atgtcaggtt tcctaacttg
600
acagcatcca tcaggaccag gcgtggtgaa aaagtttgca tgaatgttcc catgtataaa
660
gatatagcta ctccagaaac ggatgactcc atctacgatc gagattggtt tttaccagaa
720
gacaaagagg cgaaactggc ttccaaaccg ggtttcattt atatggattc catgggtttt
780
ggcatgggct gttcgtgctt acaagtgacc tttcaggcac ccaatatcaa caaggcacgt
840
tacctgtacg atgcattagt gaattttgca cctataatgc tagccttctc tgccgctgcg
900
cctgctttta aaggttggct agccgaccaa gatgttcgtt ggaatgtgat atctggtgcg
960
gtggacgacc gtactccgaa ggaaagaggt gttgcgccat tactacccaa atacaacaag
1020
aacggatttg gaggcattgc caaagacgta caagataaag tccttgaaat accaaagtca
1080
agatatagtt cggttgatct tttcttgggt gggtcgaaat ttttcaatag gacttataac
1140
gacacaaatg tacctattaa tgaaaaagta ttaggacgac tactagagaa tgataaggcg
1200
ccactggact atgatcttgc taaacatttt gcgcatctct acataagaga tccagtatct
1260
acattcgaag aactgttgaa tcaggacaac aaaacgtctt caaatcactt tgaaaacatc
1320
caaagtacaa attggcagac attacgtttt aaacccccca cacaacaagc aaccccggac
1380
aaaaaggatt ctcctggttg gagagtggaa ttcagaccat ttgaagtgca actattagat
1440
tttgagaacg ctgcgtattc cgtgctcata tacttgattg tcgatagcat tttgaccttt
1500
tccgataata ttaacgcata tattcatatg tccaaagtat gggaaaatat gaagatagcc
1560
catcacagag atgctatcct atttgaaaaa tttcattgga aaaaatcatt tcgcaacgac
1620
accgatgtgg aaactgaaga ttattctata agcgagattt tccataatcc agagaatggt
1680
atatttcctc aatttgttac gccaatccta tgccaaaaag ggtttgtaac caaagattgg
1740
aaagaattaa agcattcttc caaacacgag agactatact attatttaaa gctaatttct
1800
gatagagcaa gcggtgaatt gccaacaaca gcaaaattct ttagaaattt tgtactacaa
1860
catccagatt acaaacatga ttcaaaaatt tcaaagtcga tcaattatga tttgctttct
1920
acgtgtgata gacttaccca tttagacgat tcaaaaggtg aattgacatc ctttttagga
1980
gctgaaattg cagaatatgt aaaaaaaaat aagccttcaa tagaaagcaa atgttaa
2037
<210> 3
<211> 678
<212> PRT
<213> Artificial Sequence
<220>
<223> GSH1_G653M
<400> 3
Met Gly Leu Leu Ala Leu Gly Thr Pro Leu Gln Trp Phe Glu Ser Arg
1 5 10 15
Thr Tyr Asn Glu His Ile Arg Asp Glu Gly Ile Glu Gln Leu Leu Tyr
20 25 30
Ile Phe Gln Ala Ala Gly Lys Arg Asp Asn Asp Pro Leu Phe Trp Gly
35 40 45
Asp Glu Leu Glu Tyr Met Val Val Asp Phe Asp Asp Lys Glu Arg Asn
50 55 60
Ser Met Leu Asp Val Cys His Asp Lys Ile Leu Thr Glu Leu Asn Met
65 70 75 80
Glu Asp Ser Ser Leu Cys Glu Ala Asn Asp Val Ser Phe His Pro Glu
85 90 95
Tyr Gly Arg Tyr Met Leu Glu Ala Thr Pro Ala Ser Pro Tyr Leu Asn
100 105 110
Tyr Val Gly Ser Tyr Val Glu Val Asn Met Gln Lys Arg Arg Ala Ile
115 120 125
Ala Glu Tyr Lys Leu Ser Glu Tyr Ala Arg Gln Asp Ser Lys Asn Asn
130 135 140
Leu His Val Gly Ser Arg Ser Val Pro Leu Thr Leu Thr Val Phe Pro
145 150 155 160
Arg Met Gly Cys Pro Asp Phe Ile Asn Ile Lys Asp Pro Trp Asn His
165 170 175
Lys Asn Ala Ala Ser Arg Ser Leu Phe Leu Pro Asp Glu Val Ile Asn
180 185 190
Arg His Val Arg Phe Pro Asn Leu Thr Ala Ser Ile Arg Thr Arg Arg
195 200 205
Gly Glu Lys Val Cys Met Asn Val Pro Met Tyr Lys Asp Ile Ala Thr
210 215 220
Pro Glu Thr Asp Asp Ser Ile Tyr Asp Arg Asp Trp Phe Leu Pro Glu
225 230 235 240
Asp Lys Glu Ala Lys Leu Ala Ser Lys Pro Gly Phe Ile Tyr Met Asp
245 250 255
Ser Met Gly Phe Gly Met Gly Cys Ser Cys Leu Gln Val Thr Phe Gln
260 265 270
Ala Pro Asn Ile Asn Lys Ala Arg Tyr Leu Tyr Asp Ala Leu Val Asn
275 280 285
Phe Ala Pro Ile Met Leu Ala Phe Ser Ala Ala Ala Pro Ala Phe Lys
290 295 300
Gly Trp Leu Ala Asp Gln Asp Val Arg Trp Asn Val Ile Ser Gly Ala
305 310 315 320
Val Asp Asp Arg Thr Pro Lys Glu Arg Gly Val Ala Pro Leu Leu Pro
325 330 335
Lys Tyr Asn Lys Asn Gly Phe Gly Gly Ile Ala Lys Asp Val Gln Asp
340 345 350
Lys Val Leu Glu Ile Pro Lys Ser Arg Tyr Ser Ser Val Asp Leu Phe
355 360 365
Leu Gly Gly Ser Lys Phe Phe Asn Arg Thr Tyr Asn Asp Thr Asn Val
370 375 380
Pro Ile Asn Glu Lys Val Leu Gly Arg Leu Leu Glu Asn Asp Lys Ala
385 390 395 400
Pro Leu Asp Tyr Asp Leu Ala Lys His Phe Ala His Leu Tyr Ile Arg
405 410 415
Asp Pro Val Ser Thr Phe Glu Glu Leu Leu Asn Gln Asp Asn Lys Thr
420 425 430
Ser Ser Asn His Phe Glu Asn Ile Gln Ser Thr Asn Trp Gln Thr Leu
435 440 445
Arg Phe Lys Pro Pro Thr Gln Gln Ala Thr Pro Asp Lys Lys Asp Ser
450 455 460
Pro Gly Trp Arg Val Glu Phe Arg Pro Phe Glu Val Gln Leu Leu Asp
465 470 475 480
Phe Glu Asn Ala Ala Tyr Ser Val Leu Ile Tyr Leu Ile Val Asp Ser
485 490 495
Ile Leu Thr Phe Ser Asp Asn Ile Asn Ala Tyr Ile His Met Ser Lys
500 505 510
Val Trp Glu Asn Met Lys Ile Ala His His Arg Asp Ala Ile Leu Phe
515 520 525
Glu Lys Phe His Trp Lys Lys Ser Phe Arg Asn Asp Thr Asp Val Glu
530 535 540
Thr Glu Asp Tyr Ser Ile Ser Glu Ile Phe His Asn Pro Glu Asn Gly
545 550 555 560
Ile Phe Pro Gln Phe Val Thr Pro Ile Leu Cys Gln Lys Gly Phe Val
565 570 575
Thr Lys Asp Trp Lys Glu Leu Lys His Ser Ser Lys His Glu Arg Leu
580 585 590
Tyr Tyr Tyr Leu Lys Leu Ile Ser Asp Arg Ala Ser Gly Glu Leu Pro
595 600 605
Thr Thr Ala Lys Phe Phe Arg Asn Phe Val Leu Gln His Pro Asp Tyr
610 615 620
Lys His Asp Ser Lys Ile Ser Lys Ser Ile Asn Tyr Asp Leu Leu Ser
625 630 635 640
Thr Cys Asp Arg Leu Thr His Leu Asp Asp Ser Lys Met Glu Leu Thr
645 650 655
Ser Phe Leu Gly Ala Glu Ile Ala Glu Tyr Val Lys Lys Asn Lys Pro
660 665 670
Ser Ile Glu Ser Lys Cys
675
<210> 4
<211> 33
<212> DNA
<213> Artificial Sequence
<220>
<223> F_BamHI_GSH1
<400> 4
ggtaggatcc atgggactct tagctttggg cac
33
<210> 5
<211> 25
<212> DNA
<213> Artificial Sequence
<220>
<223> R_GSH1_G653M
<400> 5
gtcaattcca tttttgaatc gtcca
25
<210> 6
<211> 25
<212> DNA
<213> Artificial Sequence
<220>
<223> F_GSH1_G653M
<400> 6
attcaaaaat ggaattgaca tcctt
25
<210> 7
<211> 35
<212> DNA
<213> Artificial Sequence
<220>
<223> R_XhoI_GSH1
<400> 7
atgactcgag ttaacatttg ctttctattg aaggc
35
<210> 8
<211> 33
<212> DNA
<213> Artificial Sequence
<220>
<223> F_SpeI_GSH1_DW
<400> 8
tagaactagt actcctttta tttcggttgt gaa
33
<210> 9
<211> 35
<212> DNA
<213> Artificial Sequence
<220>
<223> R_NcoI_GSH1_DW
<400> 9
gctgccatgg gaatagtgtg aaccgataac tgtgt
35
<210> 10
<211> 27
<212> DNA
<213> Artificial Sequence
<220>
<223> R_AL killer
<400> 10
gagcaatgaa cccaataacg aaatctt
27
<210> 11
<211> 24
<212> DNA
<213> Artificial Sequence
<220>
<223> F_BR killer
<400> 11
cttgacgttc gttcgactga tgag
24
<210> 12
<211> 500
<212> DNA
<213> Artificial Sequence
<220>
<223>промотор CJ-5 S. cerevisiae
<400> 12
ctcttgaatg gcgacagcct attgcctcag tgttccctca acaaccttgg tagttggagc
60
gcaattagcg tatcctgtac catactaatt cccctctgcc cctcgacggc tgccattagt
120
cagcatggcg cgcacgtgac tacaactgtg gctggaaacc ttttcgtcct ccccggtttt
180
tcagtgagcc gactctacta caatgctttt tcatttttca ctcagaaaaa cctgcaattt
240
tccaaattag tcatgctctg tgcctccctt gacaaaggac atcttccctg tttataaacg
300
gcggcttacc aaaagttgaa gcttgttctt gcttcttatg agtggagcaa tcgattatat
360
tgaatcgttg tgctggagta gttggatctt tccacgtggt ctcgagtcac ttgtagaagc
420
tgaaaaattg agcaggttta gtatagggct acattgtagg gtggtttaga gtatcgaaaa
480
tatacatata gaagaataaa
500
<210> 13
<211> 678
<212> PRT
<213> Artificial Sequence
<220>
<223> GSH1_G653M+C86R
<400> 13
Met Gly Leu Leu Ala Leu Gly Thr Pro Leu Gln Trp Phe Glu Ser Arg
1 5 10 15
Thr Tyr Asn Glu His Ile Arg Asp Glu Gly Ile Glu Gln Leu Leu Tyr
20 25 30
Ile Phe Gln Ala Ala Gly Lys Arg Asp Asn Asp Pro Leu Phe Trp Gly
35 40 45
Asp Glu Leu Glu Tyr Met Val Val Asp Phe Asp Asp Lys Glu Arg Asn
50 55 60
Ser Met Leu Asp Val Cys His Asp Lys Ile Leu Thr Glu Leu Asn Met
65 70 75 80
Glu Asp Ser Ser Leu Arg Glu Ala Asn Asp Val Ser Phe His Pro Glu
85 90 95
Tyr Gly Arg Tyr Met Leu Glu Ala Thr Pro Ala Ser Pro Tyr Leu Asn
100 105 110
Tyr Val Gly Ser Tyr Val Glu Val Asn Met Gln Lys Arg Arg Ala Ile
115 120 125
Ala Glu Tyr Lys Leu Ser Glu Tyr Ala Arg Gln Asp Ser Lys Asn Asn
130 135 140
Leu His Val Gly Ser Arg Ser Val Pro Leu Thr Leu Thr Val Phe Pro
145 150 155 160
Arg Met Gly Cys Pro Asp Phe Ile Asn Ile Lys Asp Pro Trp Asn His
165 170 175
Lys Asn Ala Ala Ser Arg Ser Leu Phe Leu Pro Asp Glu Val Ile Asn
180 185 190
Arg His Val Arg Phe Pro Asn Leu Thr Ala Ser Ile Arg Thr Arg Arg
195 200 205
Gly Glu Lys Val Cys Met Asn Val Pro Met Tyr Lys Asp Ile Ala Thr
210 215 220
Pro Glu Thr Asp Asp Ser Ile Tyr Asp Arg Asp Trp Phe Leu Pro Glu
225 230 235 240
Asp Lys Glu Ala Lys Leu Ala Ser Lys Pro Gly Phe Ile Tyr Met Asp
245 250 255
Ser Met Gly Phe Gly Met Gly Cys Ser Cys Leu Gln Val Thr Phe Gln
260 265 270
Ala Pro Asn Ile Asn Lys Ala Arg Tyr Leu Tyr Asp Ala Leu Val Asn
275 280 285
Phe Ala Pro Ile Met Leu Ala Phe Ser Ala Ala Ala Pro Ala Phe Lys
290 295 300
Gly Trp Leu Ala Asp Gln Asp Val Arg Trp Asn Val Ile Ser Gly Ala
305 310 315 320
Val Asp Asp Arg Thr Pro Lys Glu Arg Gly Val Ala Pro Leu Leu Pro
325 330 335
Lys Tyr Asn Lys Asn Gly Phe Gly Gly Ile Ala Lys Asp Val Gln Asp
340 345 350
Lys Val Leu Glu Ile Pro Lys Ser Arg Tyr Ser Ser Val Asp Leu Phe
355 360 365
Leu Gly Gly Ser Lys Phe Phe Asn Arg Thr Tyr Asn Asp Thr Asn Val
370 375 380
Pro Ile Asn Glu Lys Val Leu Gly Arg Leu Leu Glu Asn Asp Lys Ala
385 390 395 400
Pro Leu Asp Tyr Asp Leu Ala Lys His Phe Ala His Leu Tyr Ile Arg
405 410 415
Asp Pro Val Ser Thr Phe Glu Glu Leu Leu Asn Gln Asp Asn Lys Thr
420 425 430
Ser Ser Asn His Phe Glu Asn Ile Gln Ser Thr Asn Trp Gln Thr Leu
435 440 445
Arg Phe Lys Pro Pro Thr Gln Gln Ala Thr Pro Asp Lys Lys Asp Ser
450 455 460
Pro Gly Trp Arg Val Glu Phe Arg Pro Phe Glu Val Gln Leu Leu Asp
465 470 475 480
Phe Glu Asn Ala Ala Tyr Ser Val Leu Ile Tyr Leu Ile Val Asp Ser
485 490 495
Ile Leu Thr Phe Ser Asp Asn Ile Asn Ala Tyr Ile His Met Ser Lys
500 505 510
Val Trp Glu Asn Met Lys Ile Ala His His Arg Asp Ala Ile Leu Phe
515 520 525
Glu Lys Phe His Trp Lys Lys Ser Phe Arg Asn Asp Thr Asp Val Glu
530 535 540
Thr Glu Asp Tyr Ser Ile Ser Glu Ile Phe His Asn Pro Glu Asn Gly
545 550 555 560
Ile Phe Pro Gln Phe Val Thr Pro Ile Leu Cys Gln Lys Gly Phe Val
565 570 575
Thr Lys Asp Trp Lys Glu Leu Lys His Ser Ser Lys His Glu Arg Leu
580 585 590
Tyr Tyr Tyr Leu Lys Leu Ile Ser Asp Arg Ala Ser Gly Glu Leu Pro
595 600 605
Thr Thr Ala Lys Phe Phe Arg Asn Phe Val Leu Gln His Pro Asp Tyr
610 615 620
Lys His Asp Ser Lys Ile Ser Lys Ser Ile Asn Tyr Asp Leu Leu Ser
625 630 635 640
Thr Cys Asp Arg Leu Thr His Leu Asp Asp Ser Lys Met Glu Leu Thr
645 650 655
Ser Phe Leu Gly Ala Glu Ile Ala Glu Tyr Val Lys Lys Asn Lys Pro
660 665 670
Ser Ile Glu Ser Lys Cys
675
<210> 14
<211> 25
<212> DNA
<213> Artificial Sequence
<220>
<223> R_GSH1_C86R
<400> 14
ttagcctccc taagggacga atcct
25
<210> 15
<211> 25
<212> DNA
<213> Artificial Sequence
<220>
<223> F_GSH1_C86R
<400> 15
cgtcccttag ggaggctaac gatgt
25
<---
Изобретение относится к биотехнологии. Предложен полипептид, вовлеченный в продуцирование глутатиона, в котором аминокислота, соответствующая положению 653 от N-конца аминокислотной последовательности SEQ ID NO: 1, заменена метионином. Также предложены полинуклеотид, кодирующий указанный полипептид, экспрессионный вектор, содержащий указанный полинуклеотид, микроорганизм для продуцирования глутатиона, содержащий любой один или более чем один указанный полипептид, полинуклеотид, кодирующий данный полипептид, или экспрессионный вектор, включающий данный полинуклеотид. Также предложен способ продуцирования глутатиона. Изобретение позволяет продуцировать глутатион с высоким выходом. 5 н. и 7 з.п. ф-лы, 6 табл., 3 пр.
1. Полипептид, вовлеченный в продуцирование глутатиона, в котором аминокислота, соответствующая положению 653 от N-конца аминокислотной последовательности SEQ ID NO: 1, заменена метионином.
2. Полипептид по п. 1, в котором аминокислота, соответствующая положению 653, представляет собой глицин.
3. Полипептид по п. 1, где данный полипептид состоит из аминокислотной последовательности SEQ ID NO: 3.
4. Полипептид по п. 1, где данный полипептид имеет дополнительную замену аминокислоты, соответствующей положению 86, другой аминокислотой.
5. Полипептид по п. 4, где данный полипептид состоит из аминокислотной последовательности SEQ ID NO: 13.
6. Полинуклеотид, кодирующий полипептид по любому из пп. 1-5.
7. Экспрессионный вектор, содержащий полинуклеотид по п. 6.
8. Микроорганизм для продуцирования глутатиона, содержащий любой один или более чем один полипептид по любому из пп. 1-5; полинуклеотид, кодирующий данный полипептид; и экспрессионный вектор, включающий данный полинуклеотид.
9. Микроорганизм для продуцирования глутатиона по п. 8, где данный микроорганизм представляет собой микроорганизм рода Saccharomyces.
10. Микроорганизм для продуцирования глутатиона по п. 8, где данный микроорганизм представляет собой Saccharomyces cerevisiae.
11. Способ продуцирования глутатиона, включающий стадию культивирования в среде микроорганизма, включающего любой один или более чем один полипептид по любому из пп. 1-5; полинуклеотид, кодирующий данный вариант; и экспрессионный вектор, включающий данный полинуклеотид.
12. Способ по п. 11, дополнительно включающий стадию сбора глутатиона из одного или более чем одного материала, выбранного из культивируемого микроорганизма, сухого продукта микроорганизма, экстракта микроорганизма, культуры микроорганизма и лизата микроорганизма.
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| XU W., JIA H., ZHANG L | |||
| ET AL | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Коридорная многокамерная вагонеточная углевыжигательная печь | 1921 |
|
SU36A1 |
Авторы
Даты
2024-06-19—Публикация
2021-09-08—Подача