Изобретение относится к медицине, а именно к онкологии и может быть использовано для прогнозирования риска прогрессирования после проводимой противоопухолевой лекарственной терапии, включающей анти-EGFR моноклональные антитела у больных метастатическим колоректальным раком.
Колоректальный рак как в России, так и в мире занимает лидирующие позиции по заболеваемости и смертности (см. Sung H, Ferlay J, Siegel RL, et al. Global cancer statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin. 2021;71(3):209–249). В России за последний год частота встречаемости на 100 тысяч населения для рака ободочной кишки составила 161 случай, для рака прямой кишки 121,1 (см. Каприн Д.А Злокачественные новообразования в России в 2013 году (заболеваемость и смертность) / Д.А Каприн, В.В. Старинский, Г.В. Петрова. - М: ФГБУ МНИОИ им. П.А. Герцена Минздрава России. - − 2022. − илл. − 239 с.). За последние годы достигнуты большие успехи в лечении колоректального рака на ранних стадиях заболевания. Остается высоким показатель регистрации метастатического рака толстой кишки. Так на IV стадию рака ободочной кишки проходится 26,8% от всех зарегистрированных случаев заболеваний в 2021 году, на опухоли прямой кишки – 22,2% (см. Каприн Д.А Злокачественные новообразования в России в 2013 году (заболеваемость и смертность) / Д.А Каприн, В.В. Старинский, Г.В. Петрова. - М: ФГБУ МНИОИ им. П.А. Герцена Минздрава России. - − 2022. − илл. − 239 с.).
Ведущим методом лечения, распространённого колоректального рака является лекарственный - комбинация химиотерапии с препаратами моноклональными антителами, нацеленными на сигнальные пути EGFR и VEGF(см. Cremolini C, et al. First-line chemotherapy for mCRC—a review and evidence-based algorithm. Nat. Rev. Clin. Oncol. 2015;12:607–619. doi: 10.1038/nrclinonc.2015.129). Определение статуса генов RAS и BRAF позволили индивидуализировать терапию с увеличением эффективности и снижением токсичности проводимой терапии.
К анти-EGFR препаратам относят – цетуксимаб и панитумумаб, представляющие собой химерное моноклональное антитело способное связывать внеклеточный домен EGFR, предотвращая его активацию и запуск внутриклеточных каскадных механизмов. Для эффективной работы данных препаратов обязательным условием является отсутствие активирующих мутаций в генах KRAS и NRAS (см. Amado RG, et al. Wild-type KRAS is required for panitumumab efficacy in patients with metastatic colorectal cancer. J Clin Oncol. 2008;26:1626–34; Douillard JY, et al. Panitumumab-FOLFOX4 treatment and RAS mutations in colorectal cancer. N Engl J Med. 2013;369:1023–34).
Несмотря на таргетный подход к терапии процент летальности на первом году жизни от момента установления диагноза для рака ободочной кишки составляет 23,1%, для рака прямой кишки – 19,25%. Однако 5-летняя выживаемость пациентов с метастатическим колоректальным раком составляет только 15%, что требует поиска новых терапевтических подходов в терапии, в том числе изучение влияния иммунитета в системном и локальном виде.
Взаимосвязь канцерогенеза и воспаления, делает воспалительные цитокины важными исследовательскими мишенями, в том числе на фоне проводимой лекарственной терапии. Так, например, опосредованные цетуксимабом реакции антитело-зависимой клеточно-опосредованной цитотоксичности могут усиливаться под воздействием цитокинов, например, интерлейкина 12 (IL-12), интерлейкина 2 (IL-2) и другими, которые активируют NK-клетки, обладающие литической активностью против клеток, связанных с цетуксимабом, приводя тем самым к усилению противоопухолевого эффекта (см. Luedke E, Jaime-Ramirez AC, Bhave N, et al. Cetuximab therapy in head and neck cancer: immune modulation with interleukin-12 and other natural killer cell-activating cytokines. Surgery. 2012;152:431–440; см. Roda JM, Joshi T, Butchar JP, et al. The activation of natural killer cell effector functions by cetuximab-coated, epidermal growth factor receptor positive tumor cells is enhanced by cytokines. Clin Cancer Res. 2007;13:6419–6428). Остается отрытым вопрос о поиске предиктивных маркеров эффективности планируемой терапии для увеличения продолжительности общей выживаемости больных с метастатическим колоректальным ракам.
Из патентных источников известен «Способ диагностики лечебного ответа у пациентов с метастазами в печень колоректального рака». Суть данного метода заключается в определении в крови концентрации онкомаркеров раковоэмбрионального антигена (РЭА) и комплиментарного маркера СА 19-9 до начала лечения, результаты которых суммируют и затем определяют сумму данных показателей после проводимой химиотерапии. После чего производят сравнительную оценку полученной суммы показателей уровней концентрации онкомаркеров после лечения с суммой показателей уровней концентрации онкомаркеров, полученных до проводимого лечения. Изобретение обеспечивает расширение арсенала технических средств для оценки эффективности проводимой химиотерапии у больных колоректальным раком с метастазами в печени с высокой достоверностью на раннем этапе. Также, позволяет улучшить общую выживаемость больных благодаря ранней диагностике прогрессирования опухолевого процесса (см. патент на изобретение RU 2800325 C1,опубл. 20.07.2023, Бюл. № 20). Авторами разработана формула: уменьшение суммы концентрации онкомаркеров до лечения по сравнению с уровнем этих же показателей после лечения более чем на 30% расценивается как частичный ответ на проведенное лечение, при увеличении показателей ≥ 20% - прогрессирование, при уменьшении менее чем на 30% и увеличении не более чем на 20% - стабилизация. Однако, данный способ оценивает эффективность таргетной терапии только у пациентов с метастазами в печень колоректального рака и не оценивает эффективность терапии при метастатическом поражении других органов.
Также известен «Способ прогнозирования метастазирования местно-распространенного рака толстой кишки» (см. патент на изобретение RU 2619340 C1, опубл. 15.05.2017, Бюл. № 14). Суть данного метода заключается в способе прогнозирования метастазирования местно-распространенного рака толстой кишки, основанный на исследовании опухолевой ткани и ткани перитуморальной зоны из удаленного в ходе оперативного вмешательства препарата, отличающийся тем, что проводят иммунофенотипирование лимфоцитов крови, взятой из локтевой вены до оперативного вмешательства, а также лимфоцитов ткани опухоли и перитуморальной области, с целью выявления субпопуляций лимфоцитов, таких как αβкр- Т-лимфоциты с рецептором αβ в крови (X1), CD4+Пери- Т-хелперно-индукторные лимфоциты в перитуморальной зоне (Х2), CD8+Пери- цитотоксические Т-лимфоциты в перитуморальной зоне (Х3), CD19+Пери- В-лимфоциты в перитуморальной зоне (Х4), CD19+Оп- В-лимфоциты в опухолевой зоне (Х5), затем на основании полученных данных определяют показатель риска метастазирования местно-распространенного рака толстой кишки:
Рм = -0,3+0,001⋅αβкр+0,017⋅CD4Пери-0,004⋅CD8Пери +0,002⋅CD19Пери + 0,008⋅CD19Оп, где -0,3 - свободный член суммы, 0,001; 0,017; -0,004; 0,002; 0,008 – коэффициенты.
Авторами разработана формула - вероятность развития метастазирования местно-распространенного рака толстой кишки в ближайшие 2 года: при значении Рм, равном 0,5 и более, прогнозируют появление метастазов местно-распространенного рака толстой кишки, при значении Рм менее 0,5 прогнозируют отсутствие риска метастазирования. Однако, данный способ применим только для неметастатического колоректального рака.
Задачей изобретения является разработка прогностической дискриминантной модели, которая по совокупности иммунологических показателей сыворотки крови позволяет прогнозировать эффективность таргетной анти-EGFR терапии метастатического колоректального рака.
Технический результат настоящего изобретения заключается в индивидуальном, достоверном прогнозе риска прогрессирования после таргетной анти-EGFR терапии метастатического колоректального рака на амбулаторном этапе за счет исследования цитокинового профиля сыворотки крови.
Технический результат достигается тем, что на догоспитальном этапе при первичном обращении, до начала лекарственной терапии, проводят забор периферической крови с немедленным выделением сыворотки и последующим аликвотированием и определением иммуноферментным методом концентрации цитокинов IFNg, IL4, MIP1a, рассчитывают риск прогрессирования метастатического колоректального рака после таргетной анти-EGFR терапии по формуле К = expz/(1+expz), где К – вероятность прогрессирования заболевания от 0 до 1; z – коэффициент регрессии; z = 6,67-1,46*Х1-0,98*Х2-0,054*Х3; Х1 – концентрация цитокина IFNg в сыворотке крови, Х2 - концентрация цитокина IL4 в сыворотке крови, Х3 - концентрация цитокина MIP1a в сыворотке крови, 6,67, -1,46, -0,98, -0,054 – коэффициенты и при значении К меньше 0,16 – риск прогрессирования оценивают как низкий, при значениях К равно и больше 0,16 – риск прогрессирования высокий.
Коэффициенты перед параметрами модели и постоянная математического выражения определены в результате регрессионного анализа по первичным статистическим данным выборки пациентов.
Статистическая значимость разработанной модели была высокой, о чем свидетельствовали высокие значения критерия Хи квадрат Пирсона χ2=21,13 и соответствующая доверительная вероятность p=0,0001.
Для каждого пациента выборки по разработанной модели были рассчитаны величины К. Далее методом ROC анализа найдена дифференциальная точка разделения для К, при достижении и превышении которой вероятность прогрессирования заболевания повышалась. Точка cut-off составила 0,16. При превышении разделительной точки 0,16 с диагностической чувствительностью 94,12% и специфичностью 87,5% риск прогрессирования злокачественного заболевания после анти-EGFR терапии повышался. Диагностическая точность разработанного метода составила 92%.
Площадь под ROC кривой составила 0,971±0,0327 (доверительная вероятность от 0,813 до 1,0), что свидетельствовало об отличном качестве диагностической модели. Доверительная вероятность отклонения ROC кривой от диагональной линии была высокой и составила р<0,0001 (z=14,3).
Индивидуальные значения пациента подставляются в математическую модель и рассчитывается вероятность прогрессирования после анти-EGFR терапии.
Для лучшего понимания способа приводим фигуры.
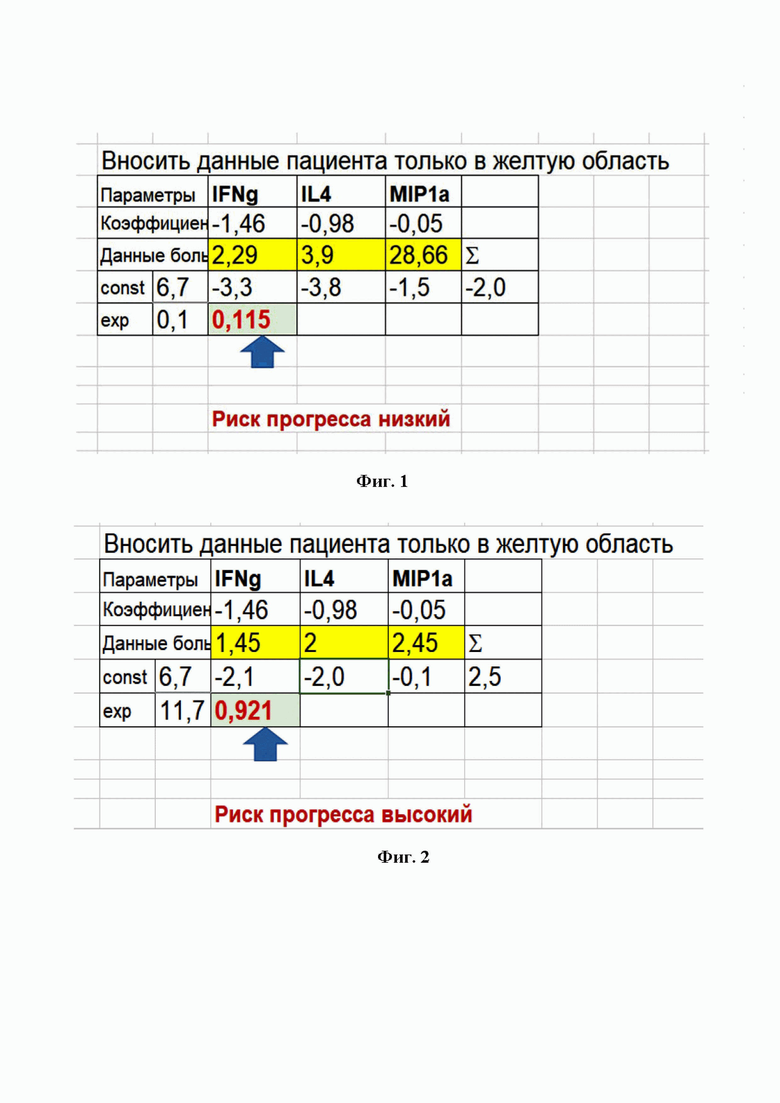
Фигура 1. Окно программы MS Office Excel 2016 для автоматического расчета прогностического коэффициента для пациента С.
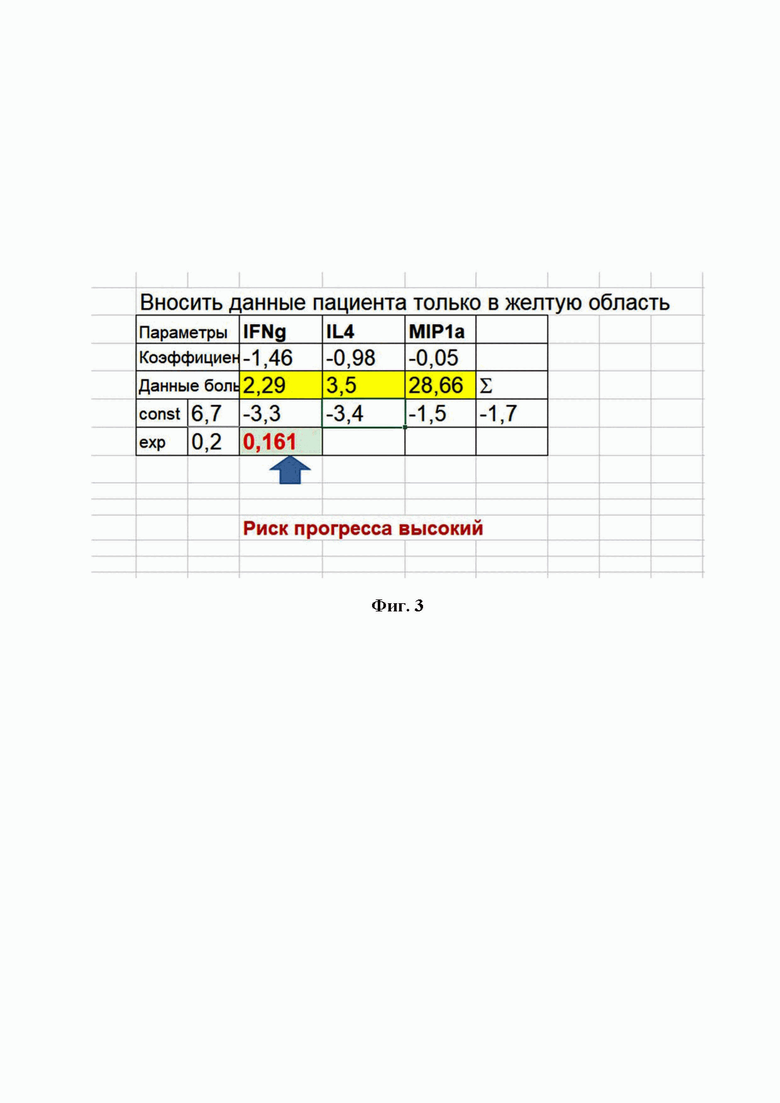
Фигура 2. Окно программы MS Office Excel 2016 для автоматического расчета прогностического коэффициента для пациента М.
Фигура 3. Окно программы MS Office Excel 2016 для автоматического расчета прогностического коэффициента для пациента З.
Способ осуществляется следующим образом.
Исследование проводятся на догоспитальном этапе при первичном обращении, путем забора периферической крови с немедленным выделением и аликвотированием сыворотки и определением методом мультиплексного анализа, используя набор Bio-Plex Pro Human Immunotherapy 20-Plex Panel (Био Рад, США) следующих цитокинов: IFNg, IL4, MIP1a.
Оценку результатов анализа осуществляли на Luminex 200 Analyser (BIO-RAD, USA) с программным обеспечением Bio-Plex Manager Software. Результаты исследования выражали в пг/мл.
Затем рассчитывают риск прогрессирования метастатического колоректального рака после таргетной анти-EGFR терапии по формуле К = expz/(1+expz), где К – вероятность прогрессирования заболевания от 0 до 1; z – коэффициент регрессии; z = 6,67-1,46*Х1-0,98*Х2-0,054*Х3; Х1 – концентрация цитокина IFNg в сыворотке крови, Х2 - концентрация цитокина IL4 в сыворотке крови, Х3 - концентрация цитокина MIP1a в сыворотке крови, 6,67, -1,46, -0,98, -0,054 – коэффициенты. При значении К меньше 0,16 – риск прогрессирования прогнозируют как низкий, при значениях К равно и больше 0,16 – риск прогрессирования высокий.
В табличном процессоре Excel произведена автоматизация расчетов. Данные пациентов необходимо вносить в маркированную желтым цветом область и после нажатия кнопки Enter автоматически рассчитывается как значение прогностического коэффициента, так и производится его качественная оценка. Для удобства расчетов в табличном процессоре Ms Excel создан файл для расчета вероятности эффективности терапии, окна которого представлены на фигурах 1, 2, 3.
Индивидуальные значения пациента подставляются в математическую модель и рассчитывается вероятность прогрессирования после анти-EGFR-терапии.
В доступных источниках информации нами не обнаружено аналогичного предлагаемому способу прогнозирования риска прогрессирования после антиEGFR терапии метастатического колоректального рака.
Приводим клинические примеры применения способа.
Клинический пример 1.
Пациентка С., 1952 года рождения наблюдается и лечится в нашем учреждении с января 2022. Считает себя больной с октября 2021 года, когда по месту жительства был поставлен диагноз: рак ректосигмоидного соединения толстой кишки сT3N1M1(hep), ст.IV, состояние после 5 курсов ПХТ (XELOX) по месту жительства. Г/а - аденокарцинома.
При обследовании 13.01.2022 на КТ органов грудной клетки патологических изменений со стороны органов грудной клетки не выявлено.
14.01.2022 МРТ органов малого таза: МР-картина патоморфоза циркулярной солидной опухоли ректосигмоидного соединения над телом матки (на 16 см от анодермального перехода визуализирован нижний край остаточной циркулярной стенозирующей опухоли, протяженностью до 18х19х19 мм без экстрамуральной инвазии). На МРТ органов брюшной полости и забрюшинного пространства с контрастным усилением от 18.01.2022: множественное мтс-поражение обеих долей печени не менее 7 очагов печени (мтс с вовлечением передней поверхности S4 печени 24х18х19 мм ADC 0,001 мм2/c, мтс в S6 по задней поверхности 25х24х24 мм, всего не менее 7 мтс-очагов). Стеатогепатоз, гепатомегалия. Простые кисты правой и левой почек по Босняк тип 1. Аденома левого надпочечника.
Выполнена трепан-биопсия образования печени 20.01.2022. Г/а - в трепан биоптате печени участки аденокарциномы кишечного типа с обширными очагами некроза.
03.02.2022 протокол молекулярно-генетического исследования: MSI не обнаружена; соматической мутации V600 в 15 экзоне гена BRAF не обнаружено; соматических мутаций в генах KRAS и NRAS не обнаружено.
Проведен забор периферической крови с немедленным выделением сыворотки и последующим аликвотированием и определением иммуноферментным методом концентрации цитокинов: IFNg, IL4, MIP1a.
Результаты иммунологического обследования были следующими:
IFNg – 2,29, IL4 – 3,9, MIP1a – 28,66 пг/мл.
Данные показатели внесены в программу расчета, получено значение К = 0,115, что соответствует низкому риску прогрессирования заболевания при проведении анти-EGFR терапии в первой линии, поскольку величина К менее 0,16 (см. Фиг. 1).
После проведенных 4 курсов терапии проведены контрольные исследования, включающие СРКТ органов грудной клетки, МРТ органов брюшной полости и малого таза, оценена эффективность проведенной терапии согласно критериям RECIST версия 1.1, процент регресса опухоли составил 71%, что соответствует частичной ремиссии.
Продолжена терапия с включением анти-EGFR препаратов до 8 циклов с последующей оценкой эффективности. После 8 циклов сохраняется эффект от лечения, лекарственная терапия с включением препаратов анти-EGFR продолжается.
Клинический пример 2.
Пациентка М., 1954 года рождения наблюдается и лечится в нашем учреждении с ноября 2021. Считает себя больной с июля 2019 года, когда по месту жительства была выполнена обструктивная резекция сигмовидной кишки, г/а - высокодифференированная аденокарцинома с инвазией всех слоев, данных о л/узлах нет. 6 курсов АПХТ (капецитабин).
При контрольном обследовании при МРТ органов малого таза от 11.11.2021 - МР-картина объемных образований яичников (дифференцировать первичное опухолевое поражение и мтс), параовариальных жидкостных скоплений; многоузловой формы фибромиомы тела матки; кист почек, стеатоза паренхимы поджелудочной железы.
На КТ органов грудной клетки от 12.11.21 - патологических изменений со стороны органов грудной клетки не выявлено.
При ФКС от 17.11.21 Данных за рецидив в зоне анастомоза не выявлено.
Выполнена трепан-биопсия образования яичника от 18.11.2021, г/а - в трепан-биоптатах мелкие фрагменты ткани яичника с очагами аденокарциномы кишечного типа. С учетом клинических данных более вероятен метастаз аденокарциномы сигмовидной кишки. Выполнен анализ на микросателлитную нестабильность - при исследовании полученного образца ДНК микросателлитная нестабильность не обнаружена.
Анализ от 02.12.21 -в образце опухоли не обнаружено мутаций в сайте V600 гена BRAF.
Анализ от 03.12.21 - при исследовании полученного образца соматических мутаций в генах KRAS, NRAS не обнаружено.
Проведен забор периферической крови с немедленным выделением сыворотки и последующим аликвотированием и отпределением иммуноферментным методом концентрации следующих цитокинов: IFNg, IL4, MIP1a.
Результаты иммунологического обследования были следующими:
IFNg – 1,45, IL4 – 2, MIP1a – 2,45 пг/мл.
Данные показатели внесены в программу расчета, получено значение К = 0,921, что соответствует высокому риску прогрессирования заболевания при проведении антиEGFR терапии в первой линии, поскольку величина К более 0,16 (см. Фи. 2).
После проведенных 4 курсов терапии проведены контрольные исследования, включающие СРКТ органов грудной клетки, МРТ органов брюшной полости и малого таза, оценена эффективность проведенной терапии согласно критериям RECIST версия 1.1, в связи с увеличением суммы очагов на 38%, зарегистрировано прогрессирование заболевания. Пациентка переведена на 2 линию терапии.
Клинический пример 3.
Пациент З., 1954 года рождения наблюдается и лечится в нашем учреждении с февраля 2022 года. Считает себя больным с мая 2021 года, когда по месту жительства был установлен диагноз - Рак прямой кишки и выполнена брюшно-промежностная экстирпация прямой кишки, цистпростатвезикулэктомии с пластикой тонкой кишкой по Брикеру от 17.05.2021. Г/а - аденокарцинома. В дальнейшем получил 9 курсов АПХТ по схеме mFOLFOX 6. В результате очередного обследования выявлено прогрессирование заболевания. КТ органов грудной клетки, брюшной полости и малого таза от 03.02.2022 г. В легочной ткани без очагов. Состояние после БПЭ прямой кишки. Данных за рецидив нет. Очаговые образования правой доли печени пониженной плотности по данным КТ - метастазы. Целесообразно выполнить МРТ органов брюшной полости.
МРТ органов брюшной полости от 24.02.2022 г. - МР-картина метастатического поражения обеих долей печени, не менее 3х очагов. Выполнена трепан-биопсия образования печени 25.02.2022 г. Гистологический анализ от 25-02-2022 - в трепан биоптате печени участки аденокарциномы кишечного типа с обширными очагами некроза. С учетом клинических данных вероятнее метастаз аденокарциномы толстой кишки. Выполнен анализ на микросателлитную нестабильность от 11.02.22 - при исследовании полученного образца ДНК микросателлитная нестабильность не обнаружена. Анализ от 11.02.2022 - при исследовании полученного образца ДНК мутации V600 в 15 экзоне гена BRAF не обнаружено. Анализ от 11.02.2022 - при исследовании полученного образца соматических мутаций в генах KRAS, NRAS не обнаружено.
Проведен забор периферической крови с немедленным выделением сыворотки и последующим аликвотированием и определением иммуноферментным методом концентрации следующих цитокинов: IFNg, IL4, MIP1a.
Результаты иммунологического обследования были следующими:
IFNg – 2,29, IL4 – 3,5, MIP1a – 28,66 пг/мл.
Данные показатели внесены в программу расчета, получено значение К = 0,161, что соответствует высокому риску прогрессирования заболевания при проведении антиEGFR терапии в первой линии, поскольку величина К равна 0,16 (см. Фиг. 3).
После проведенных 4 курсов терапии проведены контрольные исследования, включающие СРКТ органов грудной клетки, органов брюшной полости и малого таза, оценена эффективность проведенной терапии согласно критериям RECIST версия 1.1, в связи с увеличением суммы очагов на 51%, зарегистрировано прогрессирование заболевания. Пациенту рекомендовано проведение терапии 2 линии.
Данным способом был рассчитан прогноз для 22 больных с метастатическим колоректальным раком. Диагностическая чувствительность метода составила 94,12%, диагностическая специфичностью 87,5%
Технико-экономическая эффективность способа заключается в том, что его применение позволяет на амбулаторном этапе за счет исследования цитокинового профиля сыворотки крови пациента осуществить индивидуальный достоверный прогноз риска прогрессирования заболевания после анти-EGFR терапии.
Заявленное изобретение является промышленно применимым, так как может быть многократно повторено и использовано при прогнозировании риска прогрессирования после анти-EGFR терапии и воспроизведено в различных лечебно-профилактических, научных, медицинских учреждениях в онкологии.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ оценки риска прогрессирования метастатического колоректального рака после анти-VEGF терапии | 2024 |
|
RU2823505C1 |
| Способ диагностики лечебного ответа у пациентов с метастазами в печень колоректального рака | 2022 |
|
RU2800325C1 |
| Способ прогнозирования резистентности опухоли к таргетной терапии цетуксимабом у больных плоскоклеточным раком языка и слизистой дна полости рта | 2016 |
|
RU2626682C1 |
| СПОСОБ КОРРЕКЦИИ ДЕРМАТОЛОГИЧЕСКИХ РЕАКЦИЙ У ОНКОЛОГИЧЕСКИХ БОЛЬНЫХ ПРИ ПРИМЕНЕНИИ ТЕРАПИИ ИНГИБИТОРАМИ EGFR | 2018 |
|
RU2689993C1 |
| Способ прогнозирования метастазирования местно-распространенного рака толстой кишки | 2016 |
|
RU2619340C1 |
| Способ прогнозирования исхода распространённой меланомы кожи при проведении терапии ингибиторами контрольных точек | 2023 |
|
RU2810433C1 |
| Способ создания таргетной панели для исследования геномных регионов для выявления терапевтических биомаркеров ингибиторов иммунных контрольных точек (ИКТ) | 2023 |
|
RU2818360C1 |
| Способ комбинированного лечения метастатического колоректального рака у больных с резектабельными метастазами в печени и при отсутствии мутаций в генах KRAS и BRAF | 2021 |
|
RU2764955C1 |
| Способ прогнозирования течения заболевания у больных локальным почечно-клеточным раком почки | 2018 |
|
RU2674677C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ СТЕПЕНИ РИСКА РАЗВИТИЯ ОТДАЛЕННЫХ МЕТАСТАЗОВ У БОЛЬНЫХ РАКОМ ОБОДОЧНОЙ КИШКИ | 2016 |
|
RU2623119C1 |
Изобретение относится к медицине, а именно к онкологии. На догоспитальном этапе при первичном обращении, до начала лекарственной терапии, проводят забор периферической крови. Выделяют сыворотку крови с последующим аликвотированием и определением иммуноферментным методом концентрации цитокинов IFNg, IL4, MIP1. Рассчитывают риск прогрессирования метастатического колоректального рака после таргетной анти-EGFR терапии по формуле К = expz/(1+expz), где К – вероятность прогрессирования заболевания от 0 до 1; z – коэффициент регрессии; z = 6,67-1,46*Х1-0,98*Х2-0,054*Х3; Х1 – концентрация цитокина IFNg в сыворотке крови, Х2 – концентрация цитокина IL4 в сыворотке крови, Х3 – концентрация цитокина MIP1a в сыворотке крови, 6,67, -1,46, -0,98, -0,054 – коэффициенты. При значении К меньше 0,16 – риск прогрессирования прогнозируют как низкий. При значениях К равно и больше 0,16 – риск прогрессирования высокий. Способ позволяет прогнозировать эффективность противоопухолевой анти-EGFR терапии метастатического колоректального рака. 3 ил., 3 пр.
Способ прогнозирования риска прогрессирования метастатического колоректального рака после анти-EGFR терапии, заключающийся в том, что на догоспитальном этапе при первичном обращении, до начала лекарственной терапии, проводят забор периферической крови с немедленным выделением сыворотки и последующим аликвотированием и определением иммуноферментным методом концентрации цитокинов IFNg, IL4, MIP1a, рассчитывают риск прогрессирования метастатического колоректального рака после таргетной анти-EGFR терапии по формуле К = expz/(1+expz), где К – вероятность прогрессирования заболевания от 0 до 1; z – коэффициент регрессии; z = 6,67-1,46*Х1-0,98*Х2-0,054*Х3; Х1 – концентрация цитокина IFNg в сыворотке крови, Х2 – концентрация цитокина IL4 в сыворотке крови, Х3 – концентрация цитокина MIP1a в сыворотке крови, 6,67, -1,46, -0,98, -0,054 – коэффициенты, и при значении К меньше 0,16 – риск прогрессирования оценивают как низкий, при значениях К равно и больше 0,16 – риск прогрессирования высокий.
| Способ прогнозирования метастазирования местно-распространенного рака толстой кишки | 2016 |
|
RU2619340C1 |
| Способ поперечного управления аэропланом посредством самовращающихся роторов | 1929 |
|
SU19463A1 |
| Владимирова Л.Ю | |||
| и др | |||
| // Таргетная терапия анти-EGFR моноклональными антителами в лечении колоректального рака // Злокачественные опухоли | |||
| Токарный резец | 1924 |
|
SU2016A1 |
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Lee KH et al | |||
| // The efficacy of anti-EGFR therapy in treating metastatic colorectal cancer differs between the middle/low rectum and | |||
Авторы
Даты
2024-06-03—Публикация
2024-02-08—Подача