В настоящей заявке на изобретение заявлен приоритет заявки на патент Китая No. 202011477966.6, поданной 15 декабря 2020 года, который для всех задач включен сюда путем ссылки.
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Настоящая заявка на изобретение в общем относится к области медицины, и в частности к применению липосомы митоксантрона гидрохлорида в лечении рака яичника, рака желудка или плоскоклеточной карциномы головы и шеи.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Рак яичника представляет собой одно из распространенных злокачественных новообразований у женщин. Из-за отсутствия типичных симптомов и признаков, рак яичника после постановки диагноза в основном находится на средней или поздней стадии, и пациенты имеют очень короткие периоды выживания. Рак яичника имеет много патологических типов, и наиболее распространенным типом является эпителиальный рака яичника, составляющий 70% случаев, за которым следуют злокачественные терминальные опухоли и опухоли стромы полового тяжа яичника.
Общий прогноз эпителиального рака яичника является плохим из-за сложности ранней диагностики и отсутствия эффективного лечения лекарственно-устойчивого рецидивирующего эпителиального рака яичника. Хирургия вместе с химиотерапией является основным терапевтическим режимом при злокачественных новообразованиях яичника. Химиотерапия играет важную роль в адъювантном лечении и лечении рецидивов. Комбинированная химиотерапия на основе платины является основным рекомендуемым режимом послеоперационной химиотерапии для прогрессирующего рака яичника. От 70% до 80% больных дают рецидив, даже если полная ремиссия достигается при помощи вышеуказанного лечения. В настоящее время исходным стандартным режимом химиотерапии для прогрессирующего эпителиального рака яичника является комбинированная химиотерапия на основе платины. Выбор конкретных схем должен учитывать персонализированные особенности пациентов. Другие рекомендованные схемы лечения включают карбоплатин вместе с липосомой антрациклина доксорубицина. Кроме того, липосома доксорубицина рекомендуется для использования самой по себе или в комбинации с бевацизумабом для лечения рецидивирующего лекарственно-устойчивого рака яичника. Тем не менее, среди всех текущих монотерапий лечения для рецидивирующего устойчивого к лечению препаратами платины рака яичника, ни одна из них не является лучше, чем другие с точки зрения безопасности и эффективности.
Рак желудка является пятым по распространенности раком в мире. Для пациентов, которые не могут получить радикальное лечение путем хирургии или страдают от метастатического рака желудка, в настоящее время признано, что должны быть приняты всесторонние методы лечения на основе системного лекарственного лечения. Обычно используемые системные химиотерапевтические лекарственные средства включают 5-фторурацил (5-FU), капецитабин, тигио, цисплатин, оксалиплатин, паклитаксел, доцетаксел, альбумин паклитаксел, иринотекан и эпирубицин. Таргетные терапевтические препараты включают трастузумаб и апатиниб. Лечение прогрессирующего рецидивирующего/метастатического рака желудка является трудным, особенно с плохой эффективностью и ограниченным выбором терапии второй линии и третьей линии.
Показатели заболеваемости опухолями головы и шеи занимают шестое место в мире, включая опухоли, происходящие из носовой полости, пазухи, носоглотки, ротоглотки, гортанной части глотки, шейного отдела пищевода, щитовидной железы, слюнной железы, ротовой полости, гортани и уха. 90% опухолей головы и шеи представляют собой плоскоклеточные карциномы головы и шеи (SCCHN), при этом проявляются более чем 550000 новых случаев и более чем 300000 смертельных случаев в год во всем мире. Большинство пациентов не могут быть вылечены из-за локального рецидива и метастазирования. Пятилетняя выживаемость составляет менее 50%. Хирургия и химиотерапия не достигают удовлетворительных результатов лечения.
Среди пациентов с рецидивирующими опухолями головы и шеи только небольшая доля может лечиться с помощью радикальных местных способов лечения, таких как хирургия или лучевая терапия, и большинство из них, такие как пациенты, имеющие метастаз, получают любую паллиативную системную терапию (PS 0-1) или оптимальную поддерживающую терапию (PS≥2). Цисплатин в комбинации с 5-FU (схема PF) или в комбинации с паклитакселем является распространенным вариантом в химиотерапевтических схемах первой линии. Цисплатин можно заменить карбоплатаном, если пациенту не подходит цисплатин. Все вышеперечисленные схемы могут дополнительно включать цетуксимаб.
Для рецидивирующей и метастатической плоскоклеточной карциномы головы и шеи, у которых основанная на платине терапия первой линии оказалась неэффективной, в настоящее время нет стандартного режима лечения. Обычно используемыми лекарственными средствами являются метотрексат, паклитаксел, доцетаксел, цетуксимаб или ингибиторы контрольных точек иммунного ответа. Для пациентов, у которых основанная на платине терапия первой линии оказалась неэффективной и которым нужна терапия второй линии/консервативные способы лечения, иммунотерапевтические лекарственные средства или другие схемы могут быть выбраны на основе результатов тестов PD-L1.
Таким образом, для устойчивого к терапии рака, такого как рак яичника, рак желудка или плоскоклеточная карцинома головы и шеи, существует острая потребность в более хороших терапевтических продуктах и схемах лечения.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
В первом аспекте в настоящей заявке предложено применение липосомы митоксантрона гидрохлорида в изготовлении лекарственного средства для лечения рака яичника, рака желудка или плоскоклеточной карциномы головы и шеи.
В некоторых воплощениях липосома митоксантрона гидрохлорида представляет собой единственный активный ингредиент в лекарственном средстве.
В некоторых воплощениях лекарственное средство или липосома митоксантрона гидрохлорида обладает одним или более чем одним из следующих свойств:
(1) липосома митоксантрона гидрохлорида имеет размер частиц от приблизительно 30 до 80 нм, например от приблизительно 35 до 75 нм, от приблизительно 40 до 70 нм, от приблизительно 40 до 60 нм или приблизительно 60 нм;
(2) митоксантрона гидрохлорид взаимодействует с мультивалентным противоионом (например, сульфатом, цитратом или фосфатом) в липосоме с образованием плохо растворимого осадка;
(3) фосфолипидный бислой в липосоме митоксантрона гидрохлорида содержит фосфолипид, имеющий температуру фазового перехода (Tm) выше, чем температура тела, таким образом, липосома имеет температуру фазового перехода выше, чем температура тела, например, фосфолипид выбран из группы, состоящей из гидрированного соевого фосфатидилхолина, фосфатидилхолина, гидрированного лецитина яичного желтка, лецитин дипальмитата, лецитин дистеарата или любой их комбинации;
(4) фосфолипидный бислой в липосоме в расчете на митоксантрон гидрохлорида содержит гидрированный соевый фосфатидилхолин, холестерин и дистеароилфосфатидилэтаноламин, модифицированный полиэтиленгликолем 2000 (DSPE-PEG2000).
В некоторых воплощениях фосфолипидный бислой в липосоме митоксантрона гидрохлорида содержит гидрированный соевый фосфатидилхолин, холестерин и дистеароилфосфатидилэтаноламин, модифицированный PEG2000, в массовом отношении приблизительно 3:1:1, митоксантрона гидрохлорид взаимодействует с мультивалентным ионом кислоты в липосоме с образованием плохо растворимого осадка, и липосома митоксантрона гидрохлорида имеет размер частиц приблизительно 60 нм в лекарственном средстве.
В некоторых воплощениях рак яичника представляет собой трудно поддающийся лечению препаратами платины или устойчивый к лечению препаратами платины рецидивирующий рак яичника.
В некоторых воплощениях рак желудка представляет собой рак желудка на поздней стадии.
В некоторых воплощениях плоскоклеточная карцинома головы и шеи представляет собой плоскоклеточную карциному, возникающую в носовой полости, пазухе, носоглотке, ротоглотке, гортанной части глотки, шейном отделе пищевода, щитовидной железе, слюнной железе, ротовой полости, гортани и/или ухе.
В некоторых воплощениях плоскоклеточная карцинома головы и шеи представляет собой рецидивирующую или метастатическую плоскоклеточную карциному головы и шеи, для которой терапия первой линии оказалась неэффективной, например, терапия первой линии представляет собой комбинированную терапию цисплатином или карбоплатином и 5-FU или паклитакселем, возможно дополнительно в комбинации с цетуксимабом.
В некоторых воплощениях лекарственное средство представлено в форме для инъекции, такой как жидкая инъекция, порошок для инъекции, или таблетка для инъекции.
В некоторых воплощениях лекарственное средство представляет собой жидкую инъекцию.
В некоторых воплощениях содержание активного ингредиента в лекарственном средстве составляет от 0,5 до 5 мг/мл, например, от 1 до 2 мг/мл или 1 мг/мл/, в расчете на митоксантрон.
Во втором аспекте заявки предложен способ лечения рака яичника, рака желудка или плоскоклеточной карциномы головы и шеи у субъекта, включающий введение субъекту фармацевтической композиции, содержащей терапевтически эффективное количество липосомы митоксантрона гидрохлорида.
В некоторых воплощениях липосома митоксантрона гидрохлорида представляет собой единственный активный ингредиент в фармацевтической композиции.
В некоторых воплощениях фармацевтическая композиция или липосома митоксантрона гидрохлорида обладает одним или более чем одним из следующих свойств:
(1) липосома митоксантрона гидрохлорида имеет размер частиц от приблизительно 30 до 80 нм, например от приблизительно 35 до 75 нм, от приблизительно 40 до 70 нм, от приблизительно 40 до 60 нм или приблизительно 60 нм;
(2) митоксантрона гидрохлорид взаимодействует с мультивалентным противоионом (например, сульфатом, цитратом или фосфатом) в липосоме с образованием плохо растворимого осадка;
(3) фосфолипидный бислой в липосоме митоксантрона гидрохлорида содержит фосфолипид, имеющий температуру фазового перехода (Tm) выше, чем температура тела, таким образом, что липосома имеет температуру фазового перехода выше, чем температура тела, например, фосфолипид выбран из группы, состоящей из гидрированного соевого фосфатидилхолина, фосфатидилхолина, гидрированного лецитина яичного желтка, лецитин дипальмитата, лецитин дистеарата или любой их комбинации;
(4) фосфолипидный бислой в липосоме митоксантрона гидрохлорида содержит гидрированный соевый фосфатидилхолин, холестерин и дистеароилфосфатидилэтаноламин, модифицированный PEG2000 (DSPE-PEG2000).
В некоторых воплощениях фосфолипидный бислой в липосоме митоксантрона гидрохлорида содержит гидрированный соевый фосфатидилхолин, холестерин и дистеароилфосфатидилэтаноламин, модифицированный PEG2000, в массовом отношении приблизительно 3:1:1, митоксантрона гидрохлорид взаимодействует с мультивалентным ионом кислоты в липосоме с образованием плохо растворимого осадка, и липосома митоксантрона гидрохлорида имеет размер частиц приблизительно 60 нм в лекарственном средстве.
В некоторых воплощениях рак яичника представляет собой трудно поддающийся лечению препаратами платины или устойчивый к лечению препаратами платины рецидивирующий рак яичника.
В некоторых воплощениях рак желудка представляет собой рак желудка на поздней стадии.
В некоторых воплощениях плоскоклеточная карцинома головы и шеи представляет собой плоскоклеточную карциному, возникающую в носовой полости, пазухе, носоглотке, ротоглотке, гортанной части глотки, шейном отделе пищевода, щитовидной железе, слюнной железе, ротовой полости, гортани и/или ухе.
В некоторых воплощениях плоскоклеточная карцинома головы и шеи представляет собой рецидивирующую или метастатическую плоскоклеточную карциному головы и шеи, для которой терапия первой линии оказалась неэффективной, например, терапия первой линии представляет собой комбинированную терапию цисплатином или карбоплатином и 5-FU или паклитакселем, возможно дополнительно в комбинации с цетуксимабом.
В некоторых воплощениях фармацевтическая композиция представлена в форме для инъекции, такой как жидкая инъекция, порошок для инъекции или таблетка для инъекции.
В некоторых воплощениях фармацевтическая композиция представляет собой жидкую инъекцию.
В некоторых воплощениях содержание активного ингредиента в фармацевтической композиции составляет от 0,5 до 5 мг/мл, например, от 1 до 2 мг/мл или 1 мг/мл, в расчете на митоксантрон.
В некоторых воплощениях фармацевтическую композицию вводят путем внутривенного введения, например, в каждом внутривенном введении время инфузионного введения фармацевтической композиции составляет от 30 мин до 120 мин, такое как от 60 мин до 120 мин или 60±15 мин.
В некоторых воплощениях фармацевтическую композицию вводят один раз в течение четырех недель или трех недель, например один раз в течение трех недель.
В некоторых воплощениях терапевтически эффективное количество составляет от 8 до 30 мг/м2, например от 12 до 20 мг/м2 или 20 мг/м2, в расчете на митоксантрон.
В третьем аспекте настоящей заявки предложена фармацевтическая композиция, содержащая липосому митоксантрона гидрохлорида, для применения в лечении рака яичника, рака желудка или плоскоклеточной карциномы головы и шеи.
В некоторых воплощениях липосома митоксантрона гидрохлорида представляет собой единственный активный ингредиент в фармацевтической композиции.
В некоторых воплощениях фармацевтическая композиция или липосома митоксантрона гидрохлорида обладает одним или более чем одним из следующих свойств:
(1) липосома митоксантрона гидрохлорида имеет размер частиц от приблизительно 30 до 80 нм, например от приблизительно 35 до 75 нм, от приблизительно 40 до 70 нм, от приблизительно 40 до 60 нм или приблизительно 60 нм;
(2) митоксантрона гидрохлорид взаимодействует с мультивалентным противоионом (например, сульфатом, цитратом или фосфатом) в липосоме с образованием плохо растворимого осадка;
(3) фосфолипидный бислой в липосоме митоксантрона гидрохлорида содержит фосфолипид, имеющий температуру фазового перехода (Tm) выше, чем температура тела, таким образом, что липосома имеет температуру фазового перехода выше, чем температура тела, например, фосфолипид выбран из группы, состоящей из гидрированного соевого фосфатидилхолина, фосфатидилхолина, гидрированного лецитина яичного желтка, лецитина дипальмитата, лецитина дистеарата или любой их комбинации;
(4) фосфолипидный бислой в липосоме митоксантрона гидрохлорида содержит гидрированный соевый фосфатидилхолин, холестерин и дистеароилфосфатидилэтаноламин, модифицированный PEG2000 (DSPE-PEG2000).
В некоторых воплощениях фосфолипидный бислой в липосоме митоксантрона гидрохлорида содержит гидрированный соевый фосфатидилхолин, холестерин и дистеароилфосфатидилэтаноламин, модифицированный PEG2000, в массовом отношении приблизительно 3:1:1, митоксантрона гидрохлорид взаимодействует с мультивалентным ионом кислоты в липосоме с образованием плохо растворимого осадка, и липосома митоксантрона гидрохлорида имеет размер частиц приблизительно 60 нм в лекарственном средстве.
В некоторых воплощениях рак яичника представляет собой трудно поддающийся лечению препаратами платины или устойчивый к лечению препаратами платины рецидивирующий рак яичника.
В некоторых воплощениях рак желудка представляет собой рак желудка на поздней стадии.
В некоторых воплощениях плоскоклеточная карцинома головы и шеи представляет собой плоскоклеточную карциному, возникающую в носовой полости, пазухе, носоглотке, ротоглотке, гортанной части глотки, шейном отделе пищевода, щитовидной железе, слюнной железе, ротовой полости, гортани и/или ухе.
В некоторых воплощениях плоскоклеточная карцинома головы и шеи представляет собой рецидивирующую или метастатическую плоскоклеточную карциному головы и шеи, для которой терапия первой линии оказалась неэффективной, например, терапия первой линии представляет собой комбинированную терапию цисплатином или карбоплатином и 5-FU или паклитакселем, возможно дополнительно в комбинации с цетуксимабом.
В некоторых воплощениях фармацевтическая композиция представлена в форме для инъекции, такой как жидкая инъекция, порошок для инъекции или таблетка для инъекции.
В некоторых воплощениях фармацевтическая композиция представляет собой жидкую инъекцию.
В некоторых воплощениях содержание активного ингредиента в фармацевтической композиции составляет от 0,5 до 5 мг/мл, такое как от 1 до 2 мг/мл или 1 мг/мл, на основе митоксантрона.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Митоксантрона гидрохлорид представляет собой антрахиноновое противоопухолевое лекарственное средство. Показаниями для применения, одобренными FDA (Управление по надзору в сфере пищевых продуктов и лекарственных средств), являются рассеянный склероз, рак предстательной железы и острый миелоидный лейкоз. Клинические исследования продемонстрировали некоторую эффективность против злокачественной лимфомы, рака молочной железы, острой миелоидной лейкемии, рака легких, меланомы, саркомы мягких тканей, множественной миеломы, рака печени, колоректального рака, рака почки, рака предстательной железы, рака эндометрия, опухолей яичка, рака яичника и рака головы и шеи. Клиническое введение дозы митоксантрона гидрохлорида ограничено вследствие относительно серьезных побочных действий, таких как подавление костного мозга, лейкопения и тромбоцитопения (ограничивающая дозу токсичность), учащенное сердцебиение, экстрасистолы или аномальные электрокардиограммы Обычно митоксантрона гидрохлорид должен быть использован в комбинации с другими лекарственными средствами. Тем не менее, предыдущие исследования продемонстрировали, что эффективность этих комбинированных схем лечения не была идеальной. Дополнительное улучшение противоопухолевой эффективности без серьезных токсических побочных эффектов является проблемой в клиническом применении митоксантрона гидрохлорида.
Липосома представляет собой новую форму носителей лекарственных средств. В фармацевтических определениях липосомальные лекарственные средства обычно относятся к микровезикулам, образованным путем инкапсулирования лекарственного средства в липидном бислое. Исследования показали, что липосомальные лекарственные средства могут изменять распределение инкапсулированного лекарственного средства in vivo, обеспечивая возможность накопления лекарственного средства прежде всего в тканях и органах, таких как печень, селезенка, легкое и костный мозг, таким образом, увеличивая терапевтический индекс, уменьшая терапевтическую дозу и уменьшая токсичность. Эти характеристики обеспечивают применение нагруженного липосомами лекарственного средства гораздо большей важностью в исследованиях противоопухолевых лекарственных средств. Авторы настоящей заявки провели исследования липосомальных композиций митоксантрона. Например, заявка на патент Китая №200610102339.8, поданная 29 декабря 2006 года и публикация РСТ WO 2008/080367А1, поданная 29 декабря 2007 года, раскрывает липосому митоксантрона. Описания двух вышеупомянутых ссылок включены сюда для всех задач полностью.
Липосомальный препарат митоксантрона является специальным препаратом, и отличается от обычных инъекций митоксантрона. Его абсорбция, распределение и метаболизм после попадания в организм существенно отличаются. Таким образом, трудно обеспечить подходящую схему лечения в соответствии с показаниями для соединения среди различных показаний или среди различных типов опухолей. Таким образом, эффективность и показания для липосомальных композиций митоксантрона должны изучаться независимо. С этой целью авторы настоящего изобретения тщательно исследовали эффективность липосомных композиций митоксантрона при трудно поддающемся лечению раке яичника, раке желудка или плоскоклеточной карциноме головы и шеи, и создали различные изобретения в настоящей заявке.
В следующем подробном описании, если не определено иное, все используемые здесь научные и технические термины имеют одно и то же значение, которое понятно специалисту в данной области техники.
Хотя числовые диапазоны и округления параметров представлены в своих широких диапазонах в настоящей заявке на изобретение, числовые значения, представленные в конкретных воплощениях, описаны максимально точно. Тем не менее, любые численные значения по своей природе содержат некоторые ошибки из-за стандартного отклонения, присутствующего в их соответствующих измерениях. Кроме того, все описанные здесь диапазоны должны пониматься как охватывающие любые и содержащиеся в них все поддиапазоны. Например, описанный диапазон от "1 до 10" должен рассматриваться как охватывающий любые и все поддиапазоны между минимальным значением 1 и максимальным значением 10, включительно, т.е. все поддиапазоны, начиная с минимальной величины 1 или большей величины, такой как от 1 до 6,1, и поддиапазоны, заканчивающиеся максимальным значением 10 или меньшей величины, такой как от 5,5 до 10. Когда "приблизительно" используется здесь для числовой величины или диапазона числовых величин, она представляет собой степень варьирования числовой величины, приемлемой в данной области техники, и обычно означает ±10% на основе численной величины или диапазона числовых величин, таких как ±9% или ±8%, или ±7%, или ±6%, или ±5%, или ±4%, или ±3%, или ±2%, или ±1%.
Используемый здесь термин "фармацевтическая композиция" означает комбинацию по меньшей мере одного лекарственного средства и, возможно, фармацевтически приемлемого носителя или адъюванта для совместного функционирования для достижения определенной фармацевтической задачи. В техническом контексте липосомных композиций в соответствии с настоящей заявкой, фармацевтически приемлемыми носителями обычно являются водные носители, например, вода, водные буферы, изотонические физиологические растворы (например, физиологический раствор или физиологический раствор, забуференный фосфатом (PBS)), или растворы сахара. Хотя в контексте настоящей заявки инъекция является подходящей формой композиции (и, таким образом, существуют соответствующие типы фармацевтически приемлемых носителей), специалистам в данной области техники будет понятно, что другие типы фармацевтически приемлемых носителей могут быть выбраны тогда, когда возможны другие формы композиции (например, композиции для перорального введения).
Используемый здесь термин "терапевтически эффективное количество" или "эффективное количество" относится к дозе, достаточной для того, чтобы продемонстрировать пользу для субъекта, которого лечат. Фактическое количество, подлежащее введению, а также скорость и длительность введения будут зависеть от состояния и тяжести заболевания субъекта, подлежащего лечению. Назначение лечения (например, решение о дозировке) в конечном итоге определяется лечащими врачами, которые, как правило, учитывают заболевание, подлежащее лечению, состояние конкретного пациента, место доставки, способ введения и другие факторы, известные лечащему врачу Описанные здесь "индивиды", "субъекты" или "пациенты" включают всех членов сообщества животных, включая без ограничения млекопитающих (например, мышей, крыс, кошек, обезьян, собак, лошадей или свиней) и людей. Предпочтительно субъект представляет собой человека. Термины "индивиды", "субъекты" и "пациенты" могут использоваться взаимозаменяемо, если не указано иное.
1. Липосома митоксантрона гидрохлорида и композиции Митоксантрона гидрохлорид (митоксантрон HCl) представляет собой антрахиноновое противоопухолевое лекарственное средство, имеющее следующую структуру:
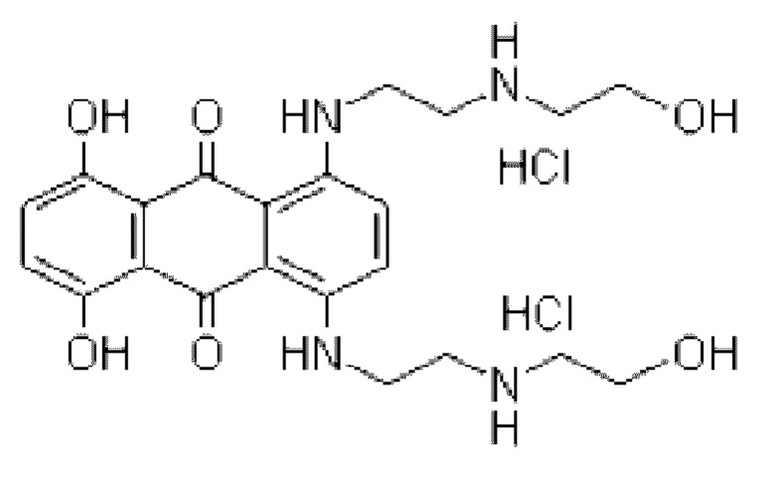
В широком смысле липосома является искусственной мембраной. В воде гидрофильная головка молекулы фосфолипида погружена в воду, гидрофобный хвост липосомы простирается в воздух, и после встряхивания образуется сферическая липосома из молекул бислоя липидов. В области биомедицины липосома обычно используется в трансгенных способах или при изготовлении лекарственных средств. Липосома может быть слита с клеточными мембранами для доставки лекарственных средств внутрь клеток. В фармацевтических определениях липосомальные лекарственные средства обычно относятся к микровезикулам, образованным путем инкапсулирования лекарственного средства в липидный бислой. Химический состав липосом обычно включает фосфолипиды (включая природные и синтетические фосфолипиды) и холестерин.
В области техники известны способы приготовления липосомальных фармацевтических композиций. Специалист в данной области техники может найти техническое руководство для приготовления липосомальных композиций митоксантрона гидрохлорида.
В некоторых воплощениях липосома митоксантрона гидрохлорида представляет собой единственный активный ингредиент в лекарственном средстве.
В технической области настоящей заявки авторы настоящего изобретения обнаружили, что препараты липосом митоксантрона гидрохлорида, приготовленные способом, раскрытым в заявке на патент Китая №200610102339.8 или публикации РСТ WO 2008/080367А1, обладают хорошей эффективностью.
Не желая быть связанными конкретной теорией, авторы настоящего изобретения обнаружили, что одно или более чем одно, или все из следующих свойств являются благоприятными для композиции липосомы митоксантрона гидрохлорида.
Во-первых, в липосомальных композициях/лекарственных средствах размер частиц липосом митоксантрона гидрохлорида составляет от приблизительно 30 до 80 нм, например, приблизительно 30, 25, 40, 45, 50, 55, 60, 65, 70, 75 или 80 нм. Более подходящие диапазоны включают от приблизительно 35 до 75 нм, от приблизительно 40 до 70 нм и от приблизительно 40 до 60 нм. В одном из примеров (смотри примеры далее) размер частицы липосом митоксантрона гидрохлорида составляет приблизительно 60 нм. Размер частиц может быть измерен множеством путей, включающих без ограничения NanoZS.
Во-вторых, митоксантрона гидрохлорид взаимодействует с мультивалентными противоионами (например, сульфат, цитрат или фосфат) в липосоме с образованием плохо растворимого осадка.
В-третьих, фосфолипидный бислой в липосоме митоксантрона гидрохлорида содержит фосфолипиды, имеющие температуру фазового перехода (Tm) выше, чем температура тела (например, от 36 до 38°С), таким образом, что температура фазового перехода липосомы выше, чем температура тела. Фосфолипидные молекулы, представляющие собой важные компоненты липосомы, образованные различными видами фосфолипидных молекул, обладают свойствами фазового перехода твердое вещество-гель-жидкость при различных температурах, и композиция фосфолипидов в значительной степени определяет температуру фазового перехода липосомы. Фосфолипидные частицы, подходящие здесь для достижения желаемых температур фазовых переходов, включают без ограничения гидрированный соевый фосфатидилхолин, фосфатидилхолин, гидрированный лецитин яичного желтка, биспальмитат лецитин, бисстеарат или любые их комбинации. Кроме того, специалист в данной области техники может выбрать другие походящие фосфолипидные частицы и пропорции комбинаций на основе тестов температур фазового перехода. В некоторых воплощениях дополнительно к холестерину липосомы из фосфолипидного бислоя митоксантрона гидрохлорида в соответствии с настоящей заявкой содержит фосфолипидные молекулы, включающие гидрированный соевый лецитин и дистеароилфосфатидилэтаноламин, модифицированный PEG2000 (DSPE-PEG2000).
В некоторых воплощениях фосфолипидный бислой в липосоме митоксантрона гидрохлорида содержит гидрированный соевый фосфатидилхолин, холестерин и дистеароилфосфатидилэтаноламин, модифицированный PEG2000, в массовом отношении приблизительно 3:1:1, митоксантрона гидрохлорид взаимодействует с мультивалентным ионом кислоты в липосоме с образованием плохо растворимого осадка, и размер частиц липосомы митоксантрона гидрохлорида в лекарственном средстве составляет приблизительно 60 нм.
В липосомальных фармацевтических композициях "отношение липида к лекарственному средству" относится к массовому отношению компонентов (включающих фосфолипиды и холестерин) фосфолипидного бислоя в липосоме к лекарственному средству (митоксантрон в настоящей заявке). Например, в примере липосомальной фармацевтической композиции в соответствии с настоящей заявкой отношение липида к лекарственному средству относится к массовому отношению компонентов фосфолипидного бислоя (включая HSPC, DSPE-PEG2000 и Chol) в липосоме к митоксантрону.
В качестве не ограничивающего объем изобретения примера липосомальные композиции митоксантрона гидрохлорида в соответствии с настоящей заявкой могут быть приготовлены в соответствии со следующими протоколами.
Гидрированный соевый фосфатидилхолин (HSPC), холестерин (Chol) и дистеароилфосфатидилэтаноламин, модифицированный PEG2000 (DSPE-PEG2000), взвешивали в массовом отношении 3:1:1 и растворяли в 95% этаноле с получением прозрачного раствора (т.е. этанольного раствора фосфолипидов). Этанольный раствор фосфолипидов смешивали с 300 мМ раствором сульфата аммония. После встряхивания в течение 1 ч при 60-65°С для гидратации получали гетерогенную мультикомпартментную липосому. Затем размер частиц липосомы уменьшали с использованием микрофлюидального устройства. Полученный образец в 200 раз разбавляли 0,9% раствором NaCl и обнаруживали при помощи NanoZS. Средний размер частиц составлял приблизительно 60 нм. Основной пик сосредоточен между 40 и 60 нм. Затем сульфат аммония наружной фазы контрольной липосомы удаляли с помощью устройства для ультрафильтрации, и внешнюю фазу заменяли на 290 мМ сахарозу и 10 мМ глицин с образованием трансмембранного градиента сульфата аммония. К исходной липосоме добавляли раствор митоксантрона гидрохлорида (10 мг/мл относительно митоксантрона) в соотношении липид/лекарственное средство 16:1 при температуре загрузки лекарственного средства 60-65°С. После инкубации в течение приблизительно 1 ч эффективность инкапсуляции может быть продемонстрирована как приблизительно 100% с использованием вытеснительной гель-хроматографии по размеру частиц. Полученный таким образом продукт назван PLM60, и его использовали в примерах, описанных ниже. Массовое соотношение HSPC:Chol:DSPE-PEG2000:митоксантрон в PLM60 составляло 9,58:3,19:3,19:1. Осмоляльность раствора сахарозы глицина близка к физиологической величине.
Понятно, что различные технические детали и параметры в приведенных выше примерах способов получения могут корректироваться и определяться специалистами в данной области техники в разумных пределах. Например, аминокислоты, которые могут использоваться для замены глицина во внешней фазе, используемые для образования трансмембранного градиента сульфата аммония, включают без ограничения гистидин, аспарагин, глутаминовую кислоту, лейцин, пролин и аланин. В еще одном примере массовое соотношение HSPC, Chol и DSPE-PEG2000 можно корректировать соответствующим образом. В качестве еще одного примера для соотношений липида к лекарственному средству при изготовлении конкретных липосомных фармацевтических композиций специалист в данной области техники может разработать, протестировать и в конечном итоге определить подходящие отношения липида к лекарственному средству для того, чтобы максимизировать загрузку лекарственного средства, уменьшая при этом утечку лекарственного средства. Для липосомальных композиций митоксантрона гидрохлорида в соответствии с настоящей заявкой отношения липида к лекарственному средству, которые можно использовать, находятся в широких диапазонах, например, от минимум 2:1 до максимум 30:1, 40:1 или 50:1, и более подходящие отношения липида к лекарственному средству могут составлять приблизительно (от 15 до 20):1, например, приблизительно 15:1, 16:1, 17:1, 18:1, 19:1 или 20:1. Таким образом, более важны некоторые благоприятные свойства липосомальных композиций митоксантрона гидрохлорида, описанных выше, и существуют различные методологии для достижения этих свойств.
2. Показания
В настоящей заявке показания для липосомальных композиций митоксантрона гидрохлорида включают рак яичника, рак желудка и плоскоклеточную карциному головы и шеи. Лекарственные средства первой линии, второй линии или второй или более высоких линий для лечения рака яичника, рака желудка и плоскоклеточной карциномы головы и шеи, упомянутые в настоящей заявке, относятся к лекарственным средствам первой линии, второй линии или второй или более высокой линии для лечения рака яичника, рака желудка или плоскоклеточной карциномы головы и шеи, одобренным управляющим департаментом в Китае и другими юрисдикциями (такими как США, Европейский союз, Япония или Корея), включая без ограничения одобренный FDA бевацизумаб, ингибиторы PD-1, трастузумаб и апатиниб.
2.1 Рак яичника
В некоторых воплощениях показание для липосомальных композиций митоксантрона гидрохлорида представляет собой рак яичника. В некоторых воплощениях липосома митоксантрона гидрохлорида служит в качестве единственного активного ингредиента в лекарственных средствах/фармацевтических композициях в соответствии с настоящей заявкой для лечения рака яичника.
В некоторых воплощениях рак яичника представляет собой трудно поддающийся лечению препаратами платины или устойчивый к лечению препаратами платины рецидивирующий рак яичника. Трудно поддающийся лечению препаратами платины или устойчивый к лечению препаратами платины рецидивирующий рак яичника относится к трудно поддающемуся лечению препаратами платины или устойчивому к лечению препаратами платины рецидивирующему раку яичника, лечение которого по меньшей степени потерпело неудачу при стандартной схеме лечения, основанной на препаратах платины.
Подходящие фармацевтические лекарственные формы представляют собой инъецируемые лекарственные формы, включая жидкие инъекции, порошки для инъекции и таблетки для инъекции. Если лекарственное средство представляет собой жидкую инъекцию, то содержание активного ингредиента в лекарственном средстве составляет от 0,5 до 5 мг/мл в расчете на митоксантрон, и более подходящие диапазоны включают от 1 до 2 мг/мл или 1 мг/мл.
Во время лечения, на основании митоксантрона, терапевтически эффективное количество как правило составляет от 8 до 30 мг/м2 в расчете на основе площади поверхности субъекта, и более подходящие диапазоны включают от 12 до 20 мг/м2, например, 12 мг/м2, 14 мг/м2, 16 мг/м2, 18 мг/м2 или 20 мг/м2.
Подходящий способ введения для липосомальных композиций митоксантрона гидрохлорида в соответствии с настоящей заявкой представляет собой внутривенное введение. В некоторых воплощениях частота введения составляет один раз в течение четырех недель или трех недель. В некоторых воплощениях для каждого момента внутривенного введения липосомальную фармацевтическую композицию вводят в течение от 30 мин до 120 мин, и более подходящие диапазоны включают от 60 мин до 120 мин и 90±15 мин.
2.2 Рак желудка
В некоторых воплощениях показание для липосомальных композиций митоксантрона гидрохлорида представляет собой рак желудка. В некоторых воплощениях липосома митоксантрона гидрохлорида служит в качестве единственного активного ингредиента в лекарственных средствах/фармацевтических композициях в соответствии с настоящей заявкой на изобретение для лечения рака желудка.
В некоторых воплощениях рак желудка представляет собой рак желудка на поздней стадии. Рак желудка на поздней стадии относится к раку желудка на поздней стадии, который был диагностирован гистопатологически и сопровождается метастазами, включая карциному желудочно-кишечного перехода.
Подходящие фармацевтические лекарственные формы представляют собой инъецируемые лекарственные формы, включая жидкие инъекции, порошки для инъекции и таблетки для инъекции. Если лекарственное средство представляет собой жидкую инъекцию, то содержание активного ингредиента в лекарственном средстве составляет от 0,5 до 5 мг/мл в расчете на митоксантрон, и более подходящие диапазоны включают от 1 до 2 мг/мл или 1 мг/мл.
Во время лечения в расчете на митоксантрон терапевтически эффективное количество как правило составляет от 8 до 30 мг/м2 в расчете на основе площади поверхности субъекта, и более подходящие диапазоны включают от 12 до 20 мг/м2, например, 12 мг/м2, 14 мг/м2, 16 мг/м2, 18 мг/м2 или 20 мг/м2.
Подходящий способ введения для липосомальных композиций митоксантрона гидрохлорида в соответствии с настоящей заявкой на изобретение представляет собой внутривенное введение. В некоторых воплощениях частота введения составляет один раз в течение четырех недель или трех недель. В некоторых воплощениях для каждого момента внутривенного введения липосомальную фармацевтическую композицию вводят в течение от 30 мин до 120 мин, и более подходящие диапазоны включают от 60 мин до 120 мин и 90±15 мин.
2.3. Плоскоклеточная карцинома головы и шеи
В некоторых воплощениях показание для липосомальных композиций митоксантрона гидрохлорида представляет собой плоскоклеточную карциному головы и шеи. В некоторых воплощениях липосома митоксантрона гидрохлорида служит в качестве единственного активного ингредиента в лекарственных средствах/фармацевтических композициях в соответствии с настоящей заявкой на изобретение для лечения плоскоклеточной карциномы головы и шеи.
Плоскоклеточная карцинома головы и шеи включает плоскоклеточную карциному, возникающую в носовой полости, пазухе, носоглотке, ротоглотке, гортанной части глотки, шейном отделе пищевода, щитовидной железе, слюнной железе, ротовой полости, гортани и/или ухе, среди которых назофарингеальная карцинома представляет собой тип рака, вызывающая особенный интерес в настоящей заявке на изобретение.
В некоторых воплощениях плоскоклеточная карцинома головы и шеи представляет собой рецидивирующую/метастатическую плоскоклеточную карциному головы и шеи. В некоторых воплощениях плоскоклеточная карцинома головы и шеи представляет собой рецидивирующую/метастатическую плоскоклеточную карциному головы и шеи, для которой терапия первой линии оказалась неэффективной. В некоторых воплощениях комбинация цисплатина с 5-фторурацилом (5-FU) (схема PF) или комбинация цисплатина с паклитакселем представляет собой обычную опцию для схем химиотерапии первой линии. Если пациенту не подходит лечения цисплатином, то вместо него можно использовать карбоплатин. Вышеупомянутые схемы первой линии терапии могут быть комбинированы с цетуксимабом.
Подходящие фармацевтические лекарственные формы представляют собой инъецируемые лекарственные формы, включая жидкие инъекции, порошки для инъекции и таблетки для инъекции. Если лекарственное средство представляет собой жидкую инъекцию, содержание активного ингредиента в лекарственном средстве составляет от 0,5 до 5 мг/мл в расчете на митоксантрон, и более подходящие диапазоны включают от 1 до 2 мг/мл или 1 мг/мл.
Во время лечения в расчете на митоксантрон терапевтически эффективное количество как правило составляет от 8 до 30 мг/м2 в расчете на основе площади поверхности субъекта, и более подходящие диапазоны включают от 12 до 20 мг/м2, например, 12 мг/м2, 14 мг/м2, 16 мг/м2, 18 мг/м2 или 20 мг/м2.
Подходящий способ введения для липосомальных композиций митоксантрона гидрохлорида в соответствии с настоящей заявкой на изобретение представляет собой внутривенное введение. В некоторых воплощениях частота введения составляет один раз в течение четырех недель или трех недель. В некоторых воплощениях для каждого момента внутривенного введения липосомальную фармацевтическую композицию вводят в течение от 30 мин до 120 мин, и более подходящие диапазоны включают от 60 мин до 120 мин и 90±15 мин.
3. Схемы введения доз
Как описано выше, липосомальные лекарственные препараты относятся к конкретному типу лекарственных средств. Поглощение, распределение и метаболизм липосомального лекарственного средства после его поступления в организм могут отличаться по сравнению со свободным лекарственным средством. Таким образом, схемы введения доз, основанные на разработке и тестировании свободного лекарственного средства, не обязательно подходят для липосомальных композиций, содержащих то же самое лекарственное средство. Аналогично, схема введения доз, определенная для липосомальной фармацевтической композиции при разработке и тестировании для конкретного типа рака, не обязательно подходит для введения липосомальной фармацевтической композиции при других типах рака.
Предшествующие исследования продемонстрировали, что безопасная и эффективная доза одного лекарственного средства может значительно варьировать при лечении различных показаний, как приведено ниже.
Доксил (липосомальная композиция доксорубицина гидрохлорида) имеет три показания, одобренные FDA, то есть (1) рак яичника с рекомендуемой дозой 50 мг/м2 путем внутривенного введения один раз в четыре недели; (2) саркома Капоши с рекомендуемой дозой 20 мг/м2 путем внутривенного введения один раз в три недели; и (3) множественная миелома с рекомендуемой дозой 30 мг/м2 путем внутривенного введения на четвертые сутки после введения бортезомиба.
У абраксана (паклитаксел для инъекции [альбумин-связанный]) имеется три показания, одобренные FDA с различными схемами введения доз, т.е. (1) метастатический рак молочной железы с рекомендуемой дозой 260 мг/м2 путем внутривенного капельного введения в течение 30 минут, один раз в течение трех недель; (2) немелкоклеточный рак легкого с рекомендуемой дозой 100 мг/м2 путем внутривенного капельного введения в течение 30 минут и терапевтическим курсом 21 сутки с введением на 1, 8 и 15 сутки, соответственно (на 1 сутки немедленно после введения паклитаксела для инъекции (альбумин-связанный), вводят карбоплатин и затем вводят один раз в 21 сутки); и (3) рак поджелудочной железы с рекомендуемой дозой 125 мг/м2 путем внутривенного капельного введения в течение 30-40 минут и терапевтическим курсом 28 суток с введением на 1, 8 и 15 сутки, соответственно (для каждого времени терапии, сразу после введения паклитаксела для инъекции (альбумин-связанный), вводят гемцитабин).
Амбизом (липосомальная композиция амфотерицина В для инъекции) имеет различные показания с различными исходными дозами. Для эмпирического лечения рекомендуемая доза составляет 3 мг/кг/сутки. Для лечения системной грибковой инфекции (Aspergillus, Candida или Cryptococcus) рекомендуемая доза составляет от 3 до 5 мг/кг/сутки. Для лечения криптококкового менингита у зараженных HIV (вирус иммунодефицита человека) пациентов рекомендуемые дозы составляют 6 мг/кг/сутки (1-5 сутки), и 3 мг/кг/сутки (4 и 21 сутки). Для лечения пациентов с ослабленным иммунитетом, страдающих от висцерального лейшманиоза, рекомендуемые дозы составляют 4 мг/кг/сутки (15 сутки), и 4 мг/кг/сутки (10, 17, 24, 31 и 38 сутки). Можно видеть, что существуют различия в безопасных и эффективных дозах одного лекарственного средства при различных показаниях. Дозы и схемы введения доз персонифицированы в зависимости от конкретного вида заболевания и фактического состояния пациента для достижения максимальной эффективности и минимальных токсических или побочных эффектов и, наконец, для достижения безопасного и эффективного лечения заболевания.
Таким образом, для липосомальных композиций митоксантрона гидрохлорида в соответствии настоящей заявкой также могут быть различные оптимальные схемы введения доз для различных типов рака.
Примеры
Настоящая заявка дополнительно проиллюстрирована со ссылкой на приведенные ниже примеры. Примеры являются исключительно иллюстративными в соответствии с настоящей заявкой и не предполагается, что они ограничивают объем настоящей заявки. Экспериментальные способы, подробно не описанные в следующих примерах, обычно соответствуют обычным условиям, или в соответствии с протоколами, предложенными производителями.
Пример 1
Авторы настоящего изобретения протестировали эффективность липосомальной композиции митоксантрона гидрохлорида PLM60 в основанных на животных моделях экспериментах для рака яичника, рака желудка и плоскоклеточной карциномы головы и шеи. Результаты продемонстрировали, что (не показано в настоящей заявке) PLM60 была эффективной в лечении рака яичника, рака желудка и плоскоклеточной карциномы головы и шеи.
Пример 2 Клиническое исследование инъекции липосом митоксантрона гидрохлорида при лечении трудно поддающегося лечению препаратами платины или устойчивого к лечению препаратами платины рецидивирующего рак яичника
Исследование в этом примере представляет собой несравнительное, без контроля плацебо, многоцентровое исследование фазы Ib, в котором участвующих субъектов лечили путем инъекции липосом митоксантрона гидрохлорида (PLM60) для того, чтобы оценить безопасность и эффективность инъекции липосом митоксантрона гидрохлорида субъектам, страдающим от трудно поддающегося лечению препаратами платины или устойчивого к лечению препаратами платины рецидивирующего рака яичника.
В этом и последующих примерах используются сокращения: полный ответ (CR), частичный ответ (PR), стабильное заболевание (SD), объективный уровень ответа (ORR) и уровень контроля заболевания (DCR).
I. Дизайн исследования
1. Протоколы исследований
Всех участвующих субъектов лечили при помощи инъекций липосом митоксантрона гидрохлорида в дозе 20 мг/м2 однократно в течение трех недель (q3w). План исследования включал участие не менее 30 субъектов. За 28 суток до введения были завершены скрининговые тесты и выполнены базовые оценки. После определения критериев включения/исключения участвующие субъекты получали терапии. Все участвующие субъекты получили 8 курсов лечения. Лечение может быть прекращено тогда, когда обнаружено прогрессирование заболевания (PD), непереносимая токсичность или смерть, или продолжительная польза не может быть достигнута по мнению исследователей. Для субъектов, которые прошли 8 курсов лечения, если они все еще могли достигать терапевтическую пользу, и лечение было для них терпимым, исследователи могли проконсультироваться с организатором испытания для того, чтобы определить, может ли лечение быть продолжено, чтобы обнаружить и оценить предварительную эффективность и безопасность.
Исследование каждого субъекта включает период отбора, период лечения и период наблюдения.
После того, как субъекты подписали форму информированного согласия и завершили все базовые тесты в период отбора, субъектов, которых квалифицировали для участия, лечили путем инъекции митоксантрона гидрохлоридом в порядке участия. В соответствии с протоколами все субъекты получали тесты, указанные в протоколах, в течение всего периода испытываемого лечения для оценки безопасности.
2. Длительность исследования
Исследование включало период скрининга из четырех недель (28 суток) и период лечения из 8 курсов (24 недели). Наблюдение за безопасностью осуществляли через четыре недели (28 дней) после последней дозы. Затем осуществляли наблюдения PFS (выживаемость без прогрессирования) каждые шесть недель, и наблюдения за выживаемостью каждые шесть недель после прогрессирования заболевания. Ожидаемая продолжительность исследования для каждого пациента составляла приблизительно 12 месяцев.
План исследования включал участие не менее 30 субъектов, и ожидается, что вся продолжительность исследования составит от 24 до 36 месяцев. II. Исследуемая группа:
Субъекты, которые соответствовали всем следующим критериям участия и ни одному из критериев исключения, были вовлечены в это клиническое исследование. (1) Критерии включения
Субъекты должны удовлетворять всем из следующих критериев.
1) добровольное участие в исследовании и подписание формы информированного согласия;
2) субъект-женщина в возрасте 18 лет и старше;
3) гистопатологический диагноз эпителиального рака яичника, рак маточной трубы или первичный перитонеальный рак (за исключением слабо выраженного серозного и муцинозного рака);
4) представляет собой трудно поддающегося лечению препаратами платины или устойчивого к лечению препаратами платины субъекта в стадии рецидива, у которого по меньшей мере не удалось лечение при помощи стандартной схемы лечения, основанной на препарате платине;
5) имеет по меньшей мере одно измеряемое поражение, которое удовлетворяет определению RECIST 1.1 в базовом состоянии;
6) имеет оценку ECOG (восточная объединенная онкологическая группа) 0-2;
7) имеет ожидаемое время выживаемости три месяца и более;
8) Восстанавливается до уровня ≤1 (за исключением облысения, пигментации или иной токсичности, которую рассматривают как не представляющую риск для безопасности исследуемого субъекта) в результате токсичности вследствие предыдущих противоопухолевых способов лечения;
9) имеет следующие показатели лабораторных тестов:
• абсолютный подсчет нейтрофилов (ANC) ≥1,5×109/л (отсутствие увеличивающей G-CSF (гранулоцитарный колониестимулирующий фактор) терапии в течение одной недели перед лабораторными тестами);
• гемоглобин (Hb) ≥9,0 г/дл (отсутствие эритроцитарной трансфузионной терапии в течение одной недели перед лабораторными тестами);
• тромбоциты ≥75×109/л (отсутствие трансфузии тромбоцитов, тромбопоэтина, интерлейкина-11 или других лекарственных средств, которые увеличивали уровень тромбоцитов в течение одной недели перед лабораторными тестами);
• креатинин ≤1,5 × ВГН (верхняя граница нормы);
• общий билирубин ≤1,5 × ВГН (≤3 × ВГН для пациентов с метастазом в печени);
• аланинаминотрансфераза (ALT)/аспартатаминотрансфераза (AST) ≤2,5 × ВГН (≤5 × ВГН для пациентов с метастазом в печени);
• альбумин ≥3,0 г/дл;
• свертывание крови с протромбиновым временем (РТ) и международное нормализованное отношение (INR) ≤1,5 × ВГН;
10) являются отрицательными в отношении HCG (хорионический гонадотропин человека) в моче или крови (за исключением лиц, находящихся в состоянии менопаузы или лиц, перенесших гистерэктомию) для субъектов-женщин, и для лиц в детородном возрасте способность устанавливать меры эффективной контрацепции (например, комбинация гормонов (включающие эстроген и прогестин) в комбинации с ингибированием овуляции, прогестиновая контрацепция в комбинации с ингибированием овуляции, внутриматочная спираль, внутриматочная система высвобождения гормонов, двусторонняя перевязка маточных труб, вазэктомия или избегание сексуального поведения) со своими супругами во время исследования и в течение шести месяцев после окончательной дозы; и
11) способны хорошо общаться с исследователями и понимать и добровольно соблюдать требования исследования.
(2) Критерии исключения:
Субъекты, удовлетворяющие одному из следующих критериев, были исключены из этого исследования.
1) имеющие сильную аллергию на митоксантрон или липосомы;
2) имеющие местастазы в головном мозге или мозговых оболочках;
3) имеющие перикардиальный экссудат с клиническими симптомами;
4) перенесшие аллогенную трансплантацию органов или аллогенную трансплантацию костного мозга;
5) имеющие активный гепатит В (положительные в отношении HbsAg или HBcAb и HBV ДНК≥2000 МЕ/мл) или активный гепатит С (положительные в отношении антитела HCV и уровень РНК HCV выше нижнего предела, обнаруживаемого в исследовательском центре), или положительные в отношении антитела против HIV;
6) имеющие активную бактериальную инфекцию, грибковую инфекцию, вирусную инфекцию или интерстициальную пневмонию, требующую системного лечения в течение одной недели перед первой дозой;
7) получающие любое противоопухолевое лечение в течение четырех недель перед первой дозой;
8) получающие лечение при помощи лекарственного средства в другом клиническом исследовании в течение четырех недель перед первой дозой;
9) подвергнутые полостной хирургии в течение трех месяцев перед первой дозой (хирургическая сложность 3-4, за исключением имплантации внутривенного порта), или имеющие планы подвергнуться полостной хирургии во время исследования;
10) имеющие тромбозные или эмболические симптомы, такие как нарушения мозгового кровообращения (включающие преходящие ишемические нарушения мозгового кровообращения), или эмболию легких в течение последних шести месяцев;
11) имеющие другие активные злокачественные опухоли в течение последних трех лет, за исключением пролеченного локального поддающегося излечению рака, такого как базальный или плоскоклеточный рак кожи, поверхностный рак мочевого пузыря или рак предстательной железы, шейки матки или молочной железы in situ;
12) имеющие сердечную дисфункцию, характеризующуюся:
• синдромом удлиненного интервала QTc или интервалом QTc≥480 мс;
• полной блокадой левой ножки пучка Гиса, или предсердно-желудочковой блокадой II или III степени;
• тяжелыми и неконтролируемыми аритмиями, требующими медицинского лечения;
• NYHA (Функциональная классификация хронической сердечной недостаточности Нью-йоркской кардиологической ассоциации)≥3 уровень;
• фракцией сердечного выброса ниже 50% или ниже нижнего предела, обнаруживаемого в исследовательском центре;
• СТСАЕ (Общие терминологические критерии оценки нежелательных явлений)≥2 порок сердечного клапана;
• неконтролируемой гипертензией (определенной как систолическое давление крови ≥150 мм рт. ст.или диастолическое давление крови ≥90 мм рт. ст.при множественных измерениях при лекарственной терапии); или
• инфарктом миокарда, нестабильной стенокардией, анамнезом тяжелого заболевания перикарда, электрокардиографическим доказательством острых ишемических нарушений или нарушений системы активного проведения, возникших в течение шести месяцев перед отбором.
13) получающие лечение доксорубицином или другими антрациклинами с накопленными дозами доксорубицина больше 350 мг/м2 (расчет эквивалентной дозы для антрациклинов: 1 мг доксорубицина=2 мг эпирубицина=2 мг даунорубицина=0,5 мг нордоксорубицина=0,45 мг митоксантрона);
14) являющиеся беременными или кормящими;
15) имеющие какое-либо тяжелое и/или неконтролируемое заболевание, которое по мнению исследователей может влиять на участие пациентов в исследовании (включающее без ограничения неконтролируемый сахарный диабет, заболевание почек, требующее диализа, тяжелые заболевания печени, угрожающие жизни аутоиммунные системные заболевания и геморрагические заболевания, злоупотребление наркотиками и заболевания нервной системы); и
16) имеющие другие факторы, не соответствующие для участия в исследовании, по мнению исследователей.
(3) Критерии досрочного выхода/прекращения
У субъектов, которые столкнулись с любым из следующих событий во время курса исследования, лечение тестируемым лекарственным средством было прекращено.
1) Субъект испытывал неприемлемую токсичность, и исследователи предположили, что риск продолжения лечения исследуемым лекарственным средством перевешивает пользу.
2) Прогресс заболевания обнаружен путем визуализационной оценки.
3) Обнаружено клинически оцененное прогрессирование заболевания, произошло серьезное нарушение протокола или субъект плохо соблюдал схему лечения, что, по мнению исследователей, не привело бы к пользе от продолжающейся терапии тестируемым лекарственным средством.
4) Субъект забеременел.
5) Субъект умер.
6) Субъект удовлетворяет любому из критериев досрочного выхода.
Все субъекты, которые вышли из лечения, по-прежнему будут наблюдаться в соответствии с протоколами исследования, за исключением того, что смерть субъекта является причиной прекращения лечения, или субъект удовлетворяет любому из следующих критериев для отказа от исследования.
Субъекты имели право выйти из исследования в любое время по любой причине. Субъекты будут исключены из исследования, если произойдет какое-либо из следующих событий.
1) С субъектом прекратилась связь после наблюдения.
2) Субъект отозвал согласие или сам субъект или член его/ее семьи попросил субъекта выйти из исследования.
3) Исследование прекращено.
4) Другие
III. Результаты исследования
Субъектов оценивали в отношении эффективности в соответствии с критериями RECIST 1.1, и оценивали в отношении побочных явлений в соответствии с критериями СТСАЕ 5.0.
Авторы изобретения тестировали липосому митоксантрона. Лекарственное средство после попадания в организм человека путем внутривенной инфузии демонстрировало эффекты медленного высвобождения, направленного действия, облегчения и увеличенной эффективности. Вводимая доза была выше, чем доза обычной инъекции. В качестве лечения одним агентом введение липосомы митоксантрона может улучшить эффективность и снизить частоту возникновения побочных эффектов.
В общей сложности 47 субъектов были вовлечены на момент 31 октября 2021 года (исследование продолжается до сих пор), включая 13 трудно поддающихся лечению препаратами платины случаев и 34 устойчивых к лечению препаратами платины случаев. 39 субъектов получили по меньшей мере одну оценку эффективности с общим ORR (частота объективного ответа) 17,9% (7/39) и DCR (частота контроля заболевания) 59,0% (23/39). Среди пациентов, которые были устойчивыми к лечению препаратами платины и подверглись лечению третьей или более высокой линии, в общей сложности 24 субъекта получили по меньшей мере одну оценку эффективности с ORR, составляющей 29,2% (7/24) и DCR 62,5% (15/24). У всех пациентов не обнаруживались непереносимые побочные эффекты.
В соответствии с экспериментальными результатами до настоящего момента, липосомальная композиция митоксантрона гидрохлорида в соответствии с настоящей заявкой могла улучшить схему лечения рака яичника и закладывает основу для последующей комбинированной терапии для обхода лечения первой линии и второй линии.
Пример 3 Клиническое исследование инъекции липосомы митоксантрона гидрохлорида при лечении рака желудка на поздней стадии.
Исследование в этом примере представляет собой несравнительное, без контроля плацебо, многоцентровое исследование фазы Ib, в котором участвующих субъектов лечили путем инъекции липосом митоксантрона гидрохлорида (PLM60) для того, чтобы оценить безопасность и эффективность инъекции липосом митоксантрона гидрохлорида субъектам, страдающим от рака желудка на поздней стадии.
I. Дизайн исследования
1. Протоколы исследований
Всех участвующих субъектов лечили при помощи инъекций липосом митоксантрона гидрохлорида в дозе 20 мг/м2 однократно в течение трех недель (q3w). План исследования включал участие от 30 до 60 субъектов (мужчин или женщин), страдающих от рака желудка на поздней стадии. За 28 суток до введения были завершены скрининговые тесты и выполнены базовые оценки. После определения критериев включения/исключения участвующие субъекты получали терапии. Все участвующие субъекты получили 8 курсов лечения. Лечение может быть прекращено тогда, когда обнаружено прогрессирование заболевания (PD), непереносимая токсичность или смерть, или продолжительная польза не может быть достигнута по мнению исследователей. Введение может быть отложено после второго курса, но задержка не должна превышать трех недель. Корректировка дозы может быть выполнена после второго курса до минимальной дозы 12 мг/м2. Оценку безопасности и эффективности осуществляли после введения в соответствии с протоколами. Наблюдение осуществляли через 28 суток после последней дозы. Субъекты, которые рано вышли из исследования, должны наблюдаться по возможности после последней дозы. После последней дозы начался период наблюдения. Оценки опухоли продолжались каждые шесть недель для субъектов, вышедших из исследования по причинам, за исключением радиографически анализируемого прогрессирования заболевания или получения новой противоопухолевой терапии до обнаружения прогрессирования заболевания. Наблюдение за выживаемостью проводилось каждые шесть недель, когда у субъекта развивалось радиологически анализируемое прогрессирование заболевания или он начинал получать новую противоопухолевую терапию.
Исследование каждого субъекта включает период отбора, период лечения и период наблюдения.
После того, как субъекты подписали форму информированного согласия и завершили все базовые тесты в период отбора, субъектов, которых квалифицировали для участия, лечили путем инъекции митоксантрона гидрохлоридом в порядке участия. В соответствии с протоколами все субъекты получали тесты, указанные в протоколах, в течение всего периода испытываемого лечения для оценки безопасности.
2. Длительность исследования
Исследование включало период скрининга из четырех недель (28 суток) и период лечения из 8 курсов (24 недели). Наблюдение за безопасностью осуществляли через четыре недели (28 суток) после последней дозы. Затем осуществляли наблюдения PFS каждые шесть недель, и наблюдения за выживаемостью каждые шесть недель после прогрессирования заболевания. Ожидаемая продолжительность исследования для каждого пациента составляла приблизительно 12 месяцев.
План исследования включал участие от 30 до 60 субъектов, и ожидается, что вся продолжительность исследования составит от 24 до 36 месяцев.
II. Исследуемая группа:
Субъекты, которые соответствовали всем следующим критериям участия и ни одному из критериев исключения, были вовлечены в это клиническое исследование. (1) Критерии включения
Субъекты должны удовлетворять всем из следующих критериев
1) добровольное участие в исследовании и подписание формы информированного согласия;
2) возраст ≥18 лет для мужчин и женщин;
3) гистопатологически диагностированный метастатический рак желудка на поздней стадии (включая рак, возникший в гастроэзофагеальном переходе);
4) оценка исследователями в качестве субъектов, подходящих для лечения путем инъекции липосомы митоксантрона гидрохлорида;
5) имеет по меньшей мере одно измеряемое поражение, которое удовлетворяет определению RECIST 1.1 в базовом состоянии;
6) имеет оценку ECOG 0-2;
7) имеет ожидаемое время выживаемости ≥трех месяцев;
8) восстанавливается до уровня ≤1 (за исключением облысения, пигментации или иной токсичности, которую рассматривают как не представляющую риск для безопасности исследуемого субъекта) в результате токсичности вследствие предыдущих противоопухолевых способов лечения;
9) имеет следующие показатели лабораторных тестов:
• абсолютный подсчет нейтрофилов (ANC) ≥1,5×109/л (отсутствие увеличивающей G-CSF терапии в течение одной недели перед лабораторными тестами);
• гемоглобин (Hb)≥9,0 г/дл (отсутствие эритроцитарной трансфузионной терапии в течение одной недели перед лабораторными тестами, и отсутствие лечения эритропоэтином в течение двух недель перед лабораторными тестами);
• тромбоциты ≥75×109/л (отсутствие трансфузии тромбоцитов в течение одной недели перед лабораторными тестами, и отсутствие лечения с использованием трмбопоэтина, интерлейкина-11 или других лекарственных средств, которые увеличивали уровень тромбоцитов, в течение двух недель перед лабораторными тестами);
• креатинин ≤1,5 × ВГН;
• общий билирубин ≤1,5 × ВГН (≤3 × ВГН для пациентов с метастазом в печени);
• аланинаминотрансфераза (ALT)/аспартатаминотрансфераза (AST) ≤2,5 × ВГН (≤5 × ВГН для пациентов с метастазом в печени);
• альбумин ≥3,0 г/дл;
• свертывание крови с протромбиновым временем (РТ) и международное нормализованное отношение (INR) ≤1,5 × ВГН;
10) являются отрицательными в отношении HCG в моче или крови (за исключением лиц, находящихся в состоянии менопаузы или лиц, перенесших гистерэктомию) для субъектов-женщин, и для лиц в детородном возрасте, способность устанавливать меры эффективной контрацепции (например, комбинация гормонов (включающие эстроген и прогестин) в комбинации с ингибированием овуляции, прогестиновая контрацепция в комбинации с ингибированием овуляции, внутриматочная спираль, внутриматочная система высвобождения гормонов, двусторонняя перевязка маточных труб, вазэктомия, или избегание сексуального поведения) во время исследования и в течение шести месяцев после окончательной дозы;
11) для субъектов-мужчин возможность применения одной из мер контрацепции, приведенных в п. (10), со своими супругами; и
12) способны хорошо общаться с исследователями и понимать и добровольно соблюдать требования исследования.
(2) Критерии исключения:
Субъекты, удовлетворяющие одному из следующих критериев, были исключены из этого исследования.
1) имеющие сильную аллергию на митоксантрон или липосомы;
2) имеющие местастазы в головном мозге или мозговых оболочках;
3) имеющие рак желудка, который может быть подходящим для радикальной резекции;
4) имеющие значимые клинические симптомы плеврального, перикардиального, или брюшинного выпота (за исключением субъекта, который будучи таким, что его лечили с использованием дренажа в течение 1 месяца перед отбором, не имел никаких значимых клинических симптомов, и только имел небольшое количество выпота в соответствии с визуализационной оценкой);
5) страдающие от кишечной непроходимости, имеющие значимые клинические симптомы и требующие вмешательства;
6) имеющий желудочно-кишечное кровотечение 3-4 уровня в соответствии с СТСАЕ 3 в течение трех месяцев перед первой дозой;
7) перенесшие аллогенную трансплантацию органов или аллогенную трансплантацию костного мозга;
8) имеющие активный гепатит В (положительные в отношении HbsAg или HBcAb и HBV DNA ≥2000 Ш/мл), или активный гепатит С (положительные в отношении антитела HCV и уровень РНК HCV выше нижнего предела, обнаруживаемого в исследовательском центре), или положительные в отношении антитела против HIV;
9) имеющие активную бактериальную инфекцию, грибковую инфекцию, вирусную инфекцию или интерстициальную пневмонию, требующую системного лечения в течение одной недели перед первой дозой;
10) получающие любое противоопухолевое лечение в течение четырех недель перед первой дозой;
11) получающие лечение при помощи лекарственного средства в другом клиническом исследовании в течение четырех недель перед первой дозой;
12) подвергнутые полостной хирургии в течение трех месяцев перед первой дозой (хирургическая сложность 3-4, за исключением имплантации внутривенного порта), или имеющие планы подвергнуться полостной хирургии во время исследования;
13) имеющие тромбозные или эмболические симптомы, такие как нарушения мозгового кровообращения (включающие преходящие ишемические нарушения мозгового кровообращения), или эмболию легких в течение последних шести месяцев;
14) имеющие другие активные злокачественные опухоли в течение последних трех лет, за исключением пролеченного локального поддающегося излечению рака, такого как базальный или плоскоклеточный рак кожи, поверхностный рак мочевого пузыря, или рак предстательной железы, шейки матки или молочной железы in situ;
15) имеющие сердечную дисфункцию, характеризующуюся:
• синдромом удлиненного интервала QTc или интервалом QTc ≥480 мс;
• полной блокадой левой ножки пучка Гиса, или предсердно-желудочковой блокадой II или III степени;
• тяжелыми и неконтролируемыми аритмиями, требующими медицинского лечения;
• NYHA ≥3 уровень;
• фракцией сердечного выброса ниже 50% или ниже нижнего предела, обнаруживаемого в исследовательском центре;
• СТСАЕ ≥2 порок сердечного клапана;
• неконтролируемой гипертензией (определенной как систолическое давление крови ≥150 мм рт. ст.или диастолическое давление крови ≥90 мм рт. ст. при множественных измерениях при лекарственной терапии); или
• инфарктом миокарда, нестабильной стенокардией, анамнезом тяжелого заболевания перикарда, электрокардиографическим доказательством острых ишемических нарушений или нарушений системы активного проведения, возникших в течение шести месяцев перед отбором;
16) получающие лечение доксорубицином или другими антрациклинами с накопленными дозами доксорубицина больше 350 мг/м2 (расчет эквивалентной дозы для антрациклинов: 1 мг доксорубицина =2 мг эпирубицина =2 мг даунорубицина =0,5 мг нордоксорубицина =0.45 мг митоксантрона);
17) являющиеся беременными или кормящими;
18) имеющие какое-либо тяжелое и/или неконтролируемое заболевание, которое по мнению исследователей может влиять на участие пациентов в исследовании (включающее без ограничения неконтролируемый сахарный диабет, заболевание почек, требующее диализа, тяжелые заболевания печени, угрожающие жизни аутоиммунные системные заболевания и геморрагические заболевания, злоупотребление наркотиками и заболевания нервной системы); и
19) имеющие другие факторы, не соответствующие участию в исследовании по мнению исследователей.
(3) Критерии досрочного выхода/прекращения
У субъектов, которые столкнулись с любым из следующих событий во время курса исследования, лечение тестируемым лекарственным средством было прекращено.
1) Субъект испытывал неприемлемую токсичность, и исследователи предположили, что риск продолжения лечения исследуемым лекарственным средством перевешивает пользу.
2) Прогресс заболевания обнаружен путем визуализационной оценки.
3) Обнаружено клинически оцененное прогрессирование заболевания, произошло серьезное нарушение протокола или субъект плохое соблюдал схему лечения, что, по мнению исследователей, не привело бы к пользе от продолжающейся терапии тестируемым лекарственным средством.
4) Субъект забеременел.
5) Субъект умер.
6) Субъект удовлетворяет любому из критериев досрочного выхода.
Все субъекты, которые вышли из лечения, по-прежнему будут наблюдаться в соответствии с протоколами исследования, за исключением того, что смерть субъекта является причиной прекращения лечения, или субъект удовлетворяет любому из следующих критериев для отказа от исследования.
Субъекты имели право выйти из исследования в любое время по любой причине. Субъекты будут исключены из исследования, если произойдет какое-либо из следующих событий.
1) С субъектом прекратилась связь после наблюдения.
2) Субъект отозвал согласие или сам субъект или член его/ее семьи попросил субъекта выйти из исследования.
3) Исследование прекращено.
4) Другие
III. Результаты исследования
Субъектов оценивали в отношении эффективности в соответствии с критериями RECIST 1.1, и оценивали в отношении побочных явлений в соответствии с критериями СТСАЕ 5.0.
Авторы настоящего изобретения ожидали, что липосома митоксантрона после попадания в организм человека путем внутривенной инфузии демонстрировала эффекты медленного высвобождения, направленного действия, облегчения и увеличенной эффективности. Вводимая доза была выше, чем доза обычной инъекции. В качестве лечения одним агентом, введение липосомы митоксантрона могло улучшить эффективность и снизить частоту возникновения побочных эффектов.
Пример 4 Клиническое исследование инъекции липосомы митоксантрона гидрохлорида при лечении рецидивирующей/метастатической плоскоклеточной карциномы головы и шеи.
Исследование в этом примере представляет собой несравнительное, без контроля плацебо, многоцентровое исследование фазы Ib, в котором участвующих субъектов лечили путем инъекции липосом митоксантрона гидрохлорида (PLM60) для того, чтобы оценить безопасность и эффективность инъекции липосом митоксантрона гидрохлорида субъектам, страдающим от рецидивирующей/метастатической плоскоклеточной карциномы головы и шеи.
I. Дизайн исследования
1. Протоколы исследований
Всех участвующих субъектов лечили исключительно при помощи инъекций липосом митоксантрона гидрохлорида в дозе 20 мг/м2 однократно в течение трех недель (q3w). План исследования включал участие не менее чем 30 субъектов (мужчин или женщин), страдающих от рецидивирующей/метастатической плоскоклеточной карциномы головы и шеи. За 28 суток до введения были завершены скрининговые тесты и выполнены базовые оценки. После определения критериев включения/исключения участвующие субъекты получали терапии. Все участвующие субъекты получили 8 курсов лечения. Лечение может быть прекращено, когда обнаружено прогрессирование заболевания (PD), непереносимая токсичность или смерть, или продолжительная польза не может быть достигнута по мнению исследователей. Введение может быть отложено после второго курса, но задержка не должна превышать трех недель. Корректировка дозы может быть выполнена после второго курса до минимальной дозы 12 мг/м2. Оценку безопасности и эффективности осуществляли после введения в соответствии с протоколами. Наблюдение осуществляли через 28 суток после последней дозы. Субъекты, которые рано вышли из исследования, должны наблюдаться по возможности после последней дозы.
После последней дозы начался период наблюдения. Оценки опухоли продолжались каждые шесть недель для субъектов, вышедших из исследования по причинам, за исключением радиографически анализируемого прогрессирования заболевания или получения новой противоопухолевой терапии до обнаружения прогрессирования заболевания. Наблюдение за выживаемостью проводилось каждые шесть недель, когда у субъекта развивалось радиологически анализируемое прогрессирование заболевания или он начинал получать новую противоопухолевую терапию.
Исследование каждого субъекта включает период отбора, период лечения и период наблюдения.
После того, как субъекты подписали форму информированного согласия и завершили все базовые тесты в период отбора, субъектов, которых квалифицировали для участия, лечили путем инъекции митоксантрона гидрохлоридом в порядке участия. В соответствии с протоколами все субъекты получали тесты, указанные в протоколах, в течение всего периода испытываемого лечения для оценки безопасности.
2. Длительность исследования
Исследование включало период скрининга из четырех недель (28 суток) и период лечения из 8 курсов (24 недели). Наблюдение за безопасностью осуществляли через четыре недели (28 дней) после последней дозы. Затем осуществляли наблюдения PFS каждые шесть недель, и наблюдения за выживаемостью каждые шесть недель после прогрессирования заболевания. Ожидаемая продолжительность исследования для каждого пациента составляла приблизительно 12 месяцев.
План исследования включал участие не менее чем 30 субъектов, и ожидается, что вся продолжительность исследования составит от 24 до 36 месяцев.
II. Исследуемая группа:
Субъекты, которые соответствовали всем следующим критериям участия и ни одному из критериев исключения, были вовлечены в это клиническое исследование. (1) Критерии включения
Субъекты должны удовлетворять всем из следующих критериев
1) добровольное участие в исследовании и подписание формы информированного согласия;
2) возраст ≥18 лет для мужчин и женщин;
3) гистопатологически диагностированная плоскоклеточная карцинома головы и шеи (включая назофарингеальную карциному);
4) страдающий от рецидивирующей/метастатической плоскоклеточной карциномы головы и шеи, который подвергся по меньшей мере неудачной терапии первой линии;
5) имеет по меньшей мере одно измеряемое поражение, которое удовлетворяет определению RECIST 1.1 в базовом состоянии;
6) имеет оценку ECOG 0-1;
7) восстанавливается до уровня ≤1 (за исключением облысения, пигментации или иной токсичности, которую рассматривают как не представляющую риск для безопасности исследуемого субъекта) в результате токсичности вследствие предыдущих противоопухолевых способов лечения;
8) имеет следующие показатели лабораторных тестов:
• абсолютный подсчет нейтрофилов (ANC) ≥1,5×109/л (отсутствие увеличивающей G-CSF терапии в течение одной недели перед лабораторными тестами);
• гемоглобин (Hb) ≥8,0 г/дл (отсутствие эритроцитарной трансфузионной терапии или эритропоэтиновой терапии в течение трех месяцев перед лабораторными тестами);
• тромбоциты ≥75×109/л (отсутствие трансфузии тромбоцитов, тромбопоэтина, интерлейкина-11, или других лекарственных средств, которые увеличивали уровень тромбоцитов в течение одной недели перед лабораторными тестами);
• креатинин ≤1,5 × ВГН;
• общий билирубин ≤1,5 × ВГН (≤3 × ВГН для пациентов с метастазом в печени);
• аланинаминотрансфераза (ALT)/аспартатаминотрансфераза (AST) ≤2,5 × ВГН (≤5 × ВГН для пациентов с метастазом в печени);
• альбумин ≥3,0 г/дл;
• свертывание крови с протромбиновым временем (РТ) и международное нормализованное отношение (INR) ≤1,5 × ВГН;
9) являются отрицательными в отношении HCG в моче или крови (за исключением лиц, находящихся в состоянии менопаузы или лиц, перенесших гистерэктомию) для субъектов-женщин, и для лиц в детородном возрасте, способность устанавливать меры эффективной контрацепции (например, комбинация гормонов (включающие эстроген и прогестин) в комбинации с ингибированием овуляции, прогестиновая контрацепция в комбинации с ингибированием овуляции, внутриматочная спираль, внутриматочная система высвобождения гормонов, двусторонняя перевязка маточных труб, вазэктомия, или избегание сексуального поведения) во время исследования и в течение шести месяцев после окончательной дозы; и
10) для субъектов-мужчин возможность применения одной из мер контрацепции, приведенных в п. (9), со своими супругами.
(2) Критерии исключения:
Субъекты, удовлетворяющие одному из следующих критериев, были исключены из этого исследования.
1) имеющие сильную аллергию на митоксантрон или липосомы;
2) имеющие местастазы в головном мозге или мозговых оболочках;
3) перенесшие аллогенную трансплантацию органов или аллогенную трансплантацию костного мозга;
4) имеющие ожидаемое время выживаемости меньше трех месяцев;
5) имеющие активный гепатит В (положительные в отношении HbsAg или HBcAb и HBV DNA≥2000 IU/мл), или активный гепатит С (положительные в отношении антитела HCV и уровень РНК HCV выше нижнего предела, обнаруживаемого в исследовательском центре), или положительные в отношении антитела против HIV;
6) имеющие активную бактериальную инфекцию, грибковую инфекцию, вирусную инфекцию или интерстициальную пневмонию, требующую системного лечения в течение одной недели перед первой дозой;
7) получающие любое противоопухолевое лечение в течение четырех недель перед первой дозой;
8) получающие лечение при помощи лекарственного средства в другом клиническом исследовании в течение четырех недель перед первой дозой;
9) подвергнутые полостной хирургии в течение трех месяцев перед первой дозой, или имеющие планы подвергнуться полостной хирургии во время исследования;
10) имеющие тромбозные или эмболические симптомы, такие как нарушения мозгового кровообращения (включающие преходящие ишемические нарушения мозгового кровообращения), или эмболию легких в течение последних шести месяцев;
11) имеющие другие активные злокачественные опухоли в течение последних трех лет, за исключением пролеченного локального поддающегося излечению рака, такого как базальный или плоскоклеточный рак кожи, поверхностный рак мочевого пузыря, или рак предстательной железы, шейки матки или молочной железы in situ;
12) имеющие сердечную дисфункцию, характеризующуюся:
• синдромом удлиненного интервала QTc или интервалом QTc≥480 мс;
• полной блокадой левой ножки пучка Гиса, или предсердно-желудочковой блокадой II или III степени;
• тяжелыми и неконтролируемыми аритмиями, требующими медицинского лечения;
• анамнез хронической застойной сердечной недостаточности и NYHA ≥3 уровень;
• фракцией сердечного выброса ниже 50% или ниже нижнего предела, обнаруживаемого в исследовательском центре;
• СТСАЕ ≥2 порок сердечного клапана;
• неконтролируемой гипертензией (определенной как систолическое давление крови ≥150 мм рт. ст.или диастолическое давление крови ≥90 мм рт. ст.при лечении лекарственным средством); или
• инфарктом миокарда, нестабильной стенокардией, анамнезом тяжелого заболевания перикарда, электрокардиографическим доказательством острых ишемических нарушений или нарушений системы активного проведения, возникших в течение шести месяцев перед отбором.
13) получающие лечение доксорубицином или другими антрациклинами с накопленными дозами доксорубицина больше 350 мг/м2 (расчет эквивалентной дозы для антрациклинов: 1 мг доксорубицина =2 мг эпирубицина =2 мг даунорубицина =0,5 мг нордоксорубицина =0,45 мг митоксантрона);
14) являющиеся беременными или кормящими;
15) имеющие какое-либо тяжелое и/или неконтролируемое заболевание, которое по мнению исследователей может влиять на участие пациентов в исследовании (включая без ограничения неконтролируемый сахарный диабет, заболевание почек, требующее диализа, тяжелые заболевания печени, угрожающие жизни аутоиммунные системные заболевания и геморрагические заболевания, злоупотребление наркотиками и заболевания нервной системы); и
16) имеющие другие факторы, не соответствующие для участия в исследовании, по мнению исследователей.
(3) Критерии досрочного выхода/прекращения
У субъектов, которые столкнулись с любым из следующих событий во время курса исследования, лечение тестируемым лекарственным средством было прекращено.
1) Субъект испытывал неприемлемую токсичность, и исследователи предположили, что риск продолжения лечения исследуемым лекарственным средством перевешивает пользу.
2) Прогресс заболевания обнаружен путем визуализационной оценки.
3) Обнаружено клинически оцененное прогрессирование заболевания, произошло серьезное нарушение протокола или субъект плохое соблюдал схему лечения, что, по мнению исследователей, не привело бы к пользе от продолжающейся терапии тестируемым лекарственным средством.
4) Субъект забеременел.
5) Субъект умер.
6) Субъект удовлетворяет любому из критериев досрочного выхода.
Все субъекты, которые вышли из лечения, по-прежнему будут наблюдаться в соответствии с протоколами исследования, за исключением того, что смерть субъекта является причиной прекращения лечения, или субъект удовлетворяет любому из следующих критериев для отказа от исследования.
Субъекты имели право выйти из исследования в любое время по любой причине. Субъекты будут исключены из исследования, если произойдет какое-либо из следующих событий.
1) С субъектом прекратилась связь после наблюдения.
2) Субъект отозвал согласие или сам субъект или член его/ее семьи попросил субъекта выйти из исследования.
3) Исследование прекращено.
4) Другие
III. Результаты исследования
Субъектов оценивали в отношении эффективности в соответствии с критериями RECIST 1.1, и оценивали в отношении побочных явлений в соответствии с критериями СТСАЕ 5.0.
Авторы изобретения ожидают применение липосомы митоксантрона. Лекарственное средство обладает эффектами медленного высвобождения, направленного действия, облегчения и увеличенной эффективности после внутривенной инфузии в организм человека. Доза не только выше, чем доза обычной инъекции, но также представляет собой монотерапию, которая может улучшить эффективность и снизить частоту возникновения побочных эффектов.
В общей сложности 34 субъекта участвовали на момент 5 ноября 2021 года (исследование продолжается до сих пор), включая 23 случая назофарингеальной карциномы и 11 случаев отличной от назофарингеальной карциномы (пять случаев карциномы языка, два случая гипофарингеальной карциномы, два случая карциномы миндалины, один случай карциномы гортани и один случай карциномы десен). Всем субъектам вводили липосому митоксантрона гидрохлорида путем инъекции в дозе 20 мг/м2 каждые три недели (q3w). Эффективность оценивали после каждых двух курсов. 19 Субъектов получали по меньшей мере одну оценку эффективности (включая 18 субъектов, страдающих от назофарингеальной карциномы и 1 субъект, страдающий от отличной от назофарингеальной карциномы (гипофарингеальная карцинома)). Результаты анализа эффективности показали, что общая ORR составила 42,1% (8/19), и DCR составила 78,9% (15/19). ORR для назофарингеальной карциномы составила 38,8% (7/18), и DCR - 77,8% (14/18). Один случай гипофарингеальной карциномы оценивали как PR. Ни у одного из пациентов не наблюдалось непереносимых побочных эффектов.
В соответствии с экспериментальными результатами до настоящего момента предположили, что липосомальная композиция митоксантрона гидрохлорида в соответствии с настоящей заявкой обеспечивает лечение второй линии плоскоклеточной карциномы головы и шеи и закладывает основу для последующей комбинированной терапии для обхода лечения первой линии.
Вышеприведенное описание представляет собой всего лишь приблизительно предпочтительные воплощения, которые приведены только в качестве примера и не ограничивают комбинацию признаков, необходимых для осуществления настоящего изобретения. Представленные заголовки не предназначены для ограничения различных воплощений в настоящей заявке на изобретение. Термины, такие как "содержащие", "включающий" и "содержащий" не предназначены для ограничения. Кроме того, если не указано иное, то никакая числовая модификация не включает множественное число и "или" означает "и/или". Если здесь не определено иное, то все технические и научные термины, использованные здесь, имеют то же самое значение, которое обычно понято специалистам в данной области техники. Все публикации и патенты, цитируемые в настоящей заявке на изобретение, включены сюда путем ссылки. Различные модификации и изменения способов и композиций, описанные здесь, будут очевидны специалистам в данной области техники, не отступая от объема и сущности настоящей заявки на изобретение. Хотя настоящая заявка на изобретение описана со ссылкой на конкретные предпочтительные воплощения, следует понимать, что заявленное изобретение не должны быть чрезмерно ограничено этими конкретными воплощениями.
Действительно, различные варианты описанных способов осуществления настоящей заявки на изобретение, которые будут очевидны специалистам в данной области техники, предназначены для включения в объем формулы изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПРИМЕНЕНИЕ ЛИПОСОМЫ МИТОКСАНТРОНА ГИДРОХЛОРИДА ДЛЯ ЛЕЧЕНИЯ РАКА МОЛОЧНОЙ ЖЕЛЕЗЫ | 2021 |
|
RU2806277C1 |
| ПРИМЕНЕНИЕ ЛИПОСОМЫ МИТОКСАНТРОНА ДЛЯ ЛЕЧЕНИЯ НЕХОДЖКИНСКОЙ ЛИМФОМЫ | 2019 |
|
RU2804477C2 |
| ПЕГИЛИРОВАННЫЙ ЛИПОСОМАЛЬНЫЙ ДОКСОРУБИЦИН В КОМБИНАЦИИ С ЭКТЕИНАСЦИДИНОМ 743 (ECTEINESCIDIN 743) | 2005 |
|
RU2359700C2 |
| ПРИМЕНЕНИЕ ЛИПОСОМ С ГИДРОХЛОРИДОМ МИТОКСАНТРОНА И ЦИКЛОФОСФАМИДА, ВИНКРИСТИНА И ПРЕДНИЗОНА | 2021 |
|
RU2828768C1 |
| ЛИПОСОМАЛЬНЫЙ ФАРМАЦЕВТИЧЕСКИЙ ПРЕПАРАТ И СПОСОБ ЕГО ИЗГОТОВЛЕНИЯ | 2007 |
|
RU2494729C2 |
| СРЕДСТВО ДЛЯ ЛЕЧЕНИЯ ОПУХОЛИ И НАБОР, СОДЕРЖАЩИЙ ЛИПОСОМАЛЬНУЮ КОМПОЗИЦИЮ ГЕМЦИТАБИНА | 2016 |
|
RU2761620C2 |
| КОМБИНАЦИИ BI853520 С ХИМИОТЕРАПЕВТИЧЕСКИМИ ПРЕПАРАТАМИ | 2021 |
|
RU2838493C1 |
| ПРИМЕНЕНИЕ ИНГИБИТОРА PARP В ЛЕЧЕНИИ РЕЗИСТЕНТНОГО К ХИМИОТЕРАПИИ РАКА ЯИЧНИКОВ ИЛИ РАКА МОЛОЧНОЙ ЖЕЛЕЗЫ | 2018 |
|
RU2777519C2 |
| СРЕДСТВО ДЛЯ ЛЕЧЕНИЯ ОПУХОЛИ И НАБОР, СОДЕРЖАЩИЙ ЛИПОСОМАЛЬНУЮ КОМПОЗИЦИЮ ГЕМЦИТАБИНА | 2016 |
|
RU2768178C2 |
| СРЕДСТВО ДЛЯ ЛЕЧЕНИЯ ОПУХОЛИ И НАБОР, СОДЕРЖАЩИЙ ЛИПОСОМАЛЬНУЮ КОМПОЗИЦИЮ ГЕМЦИТАБИНА | 2016 |
|
RU2738365C2 |
Группа изобретений относится к области фармацевтики, а именно к применению липосомы митоксантрона гидрохлорида в изготовлении лекарственного средства для лечения рака яичника, рака желудка или плоскоклеточной карциномы головы и шеи, а также к способу лечения рака яичника, рака желудка или плоскоклеточной карциномы головы и шеи у субъекта. Применение липосомы митоксантрона гидрохлорида в изготовлении лекарственного средства для лечения рака яичника, рака желудка или плоскоклеточной карциномы головы и шеи, где рак яичника представляет собой трудно поддающийся лечению препаратами платины или устойчивый к лечению препаратами платины рецидивирующий рак яичника, рак желудка представляет собой рак желудка на поздней стадии и плоскоклеточная карцинома головы и шеи представляет собой рецидивирующую или метастатическую плоскоклеточную карциному головы и шеи, для которой терапия первой линии оказалась неэффективной. Способ лечения рака яичника, рака желудка или плоскоклеточной карциномы головы и шеи у субъекта, включающий введение субъекту фармацевтической композиции, содержащей терапевтически эффективное количество липосомы митоксантрона гидрохлорида, где рак яичника представляет собой трудно поддающийся лечению препаратами платины или устойчивый к лечению препаратами платины рецидивирующий рак яичника, рак желудка представляет собой рак желудка на поздней стадии и плоскоклеточная карцинома головы и шеи представляет собой рецидивирующую или метастатическую плоскоклеточную карциному головы и шеи, для которой терапия первой линии оказалась неэффективной. Вышеописанная группа изобретений позволяет лечить трудно поддающийся лечению препаратами платины или устойчивый к лечению препаратами платины рецидивирующий рак яичника, рак желудка на поздней стадии и рецидивирующую или метастатическую плоскоклеточную карциному головы и шеи, для которой терапия первой линии оказалась неэффективной. 2 н. и 41 з.п. ф-лы, 4 пр.
1. Применение липосомы митоксантрона гидрохлорида в изготовлении лекарственного средства для лечения рака яичника, рака желудка или плоскоклеточной карциномы головы и шеи, где рак яичника представляет собой трудно поддающийся лечению препаратами платины или устойчивый к лечению препаратами платины рецидивирующий рак яичника, рак желудка представляет собой рак желудка на поздней стадии и плоскоклеточная карцинома головы и шеи представляет собой рецидивирующую или метастатическую плоскоклеточную карциному головы и шеи, для которой терапия первой линии оказалась неэффективной.
2. Применение по п. 1, где липосома митоксантрона гидрохлорида представляет собой единственный активный ингредиент в лекарственном средстве.
3. Применение по п. 1 или 2, где лекарственное средство или липосома митоксантрона гидрохлорида обладает одним или более чем одним из следующих свойств:
(1) липосома митоксантрона гидрохлорида имеет размер частиц от 30 до 80 нм;
(2) митоксантрона гидрохлорид взаимодействует с мультивалентным противоионом в липосоме с образованием плохо растворимого осадка;
(3) фосфолипидный бислой в липосоме митоксантрона гидрохлорида содержит фосфолипид, имеющий температуру фазового перехода (Tm) выше, чем температура тела, таким образом, что липосома имеет температуру фазового перехода выше, чем температура тела;
(4) фосфолипидный бислой в липосоме митоксантрона гидрохлорида содержит гидрированный соевый фосфатидилхолин, холестерин и дистеароилфосфатидилэтаноламин, модифицированный полиэтиленгликолем 2000 (DSPE-PEG2000).
4. Применение по п. 3, где липосома митоксантрона гидрохлорида имеет размер частиц от 35 до 75 нм.
5. Применение по п. 3, где липосома митоксантрона гидрохлорида имеет размер частиц от 40 до 70 нм.
6. Применение по п. 3, где липосома митоксантрона гидрохлорида имеет размер частиц от 40 до 60 нм.
7. Применение по п. 3, где липосома митоксантрона гидрохлорида имеет размер частиц 60 нм.
8. Применение по п. 3, где мультивалентный противоион представляет собой сульфат, цитрат или фосфат.
9. Применение по п. 3, где фосфолипид выбран из группы, состоящей из гидрированного соевого фосфатидилхолина, фосфатидилхолина, гидрированного лецитина яичного желтка, лецитина дипальмитата, лецитина дистеарата или любой их комбинации.
10. Применение по любому из пп. 1-9, где фосфолипидный бислой в липосоме митоксантрона гидрохлорида содержит гидрированный соевый фосфатидилхолин, холестерин и дистеароилфосфатидилэтаноламин, модифицированный PEG2000, в массовом отношении 3:1:1, митоксантрона гидрохлорид взаимодействует с мультивалентным ионом кислоты в липосоме с образованием плохо растворимого осадка и липосома митоксантрона гидрохлорида имеет размер частиц 60 нм в лекарственном средстве.
11. Применение по любому из пп. 1-10, где плоскоклеточная карцинома головы и шеи представляет собой плоскоклеточную карциному, возникающую в носовой полости, пазухе, носоглотке, ротоглотке, гортанной части глотки, шейном отделе пищевода, щитовидной железе, слюнной железе, ротовой полости, гортани и/или ухе.
12. Применение по п. 11, где терапия первой линии представляет собой комбинированную терапию цисплатином или карбоплатином и 5-FU (5-фторурацил) или паклитакселем, возможно дополнительно в комбинации с цетуксимабом.
13. Применение по любому из пп. 1-12, где лекарственное средство представлено в форме для инъекции.
14. Применение по п. 13, где лекарственное средство представляет собой жидкую инъекцию, порошок для инъекции или таблетку для инъекции.
15. Применение по п. 14, где лекарственное средство представляет собой жидкую инъекцию и содержание активного ингредиента в лекарственном средстве составляет 0,5-5 мг/мл в расчете на митоксантрон.
16. Применение по п. 14, где лекарственное средство представляет собой жидкую инъекцию и содержание активного ингредиента в лекарственном средстве составляет от 1 до 2 мг/мл в расчете на митоксантрон.
17. Применение по п. 14, где лекарственное средство представляет собой жидкую инъекцию и содержание активного ингредиента в лекарственном средстве составляет 1 мг/мл в расчете на митоксантрон.
18. Способ лечения рака яичника, рака желудка или плоскоклеточной карциномы головы и шеи у субъекта, включающий введение субъекту фармацевтической композиции, содержащей терапевтически эффективное количество липосомы митоксантрона гидрохлорида, где рак яичника представляет собой трудно поддающийся лечению препаратами платины или устойчивый к лечению препаратами платины рецидивирующий рак яичника, рак желудка представляет собой рак желудка на поздней стадии и плоскоклеточная карцинома головы и шеи представляет собой рецидивирующую или метастатическую плоскоклеточную карциному головы и шеи, для которой терапия первой линии оказалась неэффективной.
19. Способ по п. 18, где липосома митоксантрона гидрохлорида представляет собой единственный активный ингредиент в фармацевтической композиции.
20. Способ по п. 18 или 19, где фармацевтическая композиция или липосома митоксантрона гидрохлорида обладает одним или более чем одним из следующих свойств:
(1) липосома митоксантрона гидрохлорида имеет размер частиц от 30 до 80 нм;
(2) митоксантрона гидрохлорид взаимодействует с мультивалентным противоионом в липосоме с образованием плохо растворимого осадка;
(3) фосфолипидный бислой в липосоме митоксантрона гидрохлорида содержит фосфолипид, имеющий температуру фазового перехода (Tm) выше, чем температура тела, таким образом, что липосома имеет температуру фазового перехода выше, чем температура тела;
(4) фосфолипидный бислой в липосоме митоксантрона гидрохлорида содержит гидрированный соевый фосфатидилхолин, холестерин и дистеароилфосфатидилэтаноламин, модифицированный PEG2000 (DSPE-PEG2000).
21. Способ по п. 20, где липосома митоксантрона гидрохлорида имеет размер частиц от 35 до 75нм.
22. Способ по п. 20, где липосома митоксантрона гидрохлорида имеет размер частиц от 40 до 70 нм.
23. Способ по п. 20, где липосома митоксантрона гидрохлорида имеет размер частиц от 40 до 60 нм.
24. Способ по п. 20, где липосома митоксантрона гидрохлорида имеет размер частиц от 60 нм.
25. Способ по п. 20, где мультивалентный противоион представляет собой сульфат, цитрат или фосфат.
26. Способ по п. 20, где фосфолипид выбран из группы, состоящей из гидрированного соевого фосфатидилхолина, фосфатидилхолина, гидрированного лецитина яичного желтка, лецитина дипальмитата, лецитина дистеарата или любой их комбинации.
27. Способ по любому из пп. 18-26, где фосфолипидный бислой в липосоме митоксантрона гидрохлорида содержит гидрированный соевый фосфатидилхолин, холестерин и дистеароилфосфатидилэтаноламин, модифицированный PEG2000, в массовом отношении 3:1:1, митоксантрона гидрохлорид взаимодействует с мультивалентным ионом кислоты в липосоме с образованием плохо растворимого осадка и липосома митоксантрона гидрохлорида имеет размер частиц 60 нм в лекарственном средстве.
28. Способ по любому из пп.18-27, где плоскоклеточная карцинома головы и шеи представляет собой плоскоклеточную карциному, возникающую в носовой полости, пазухе, носоглотке, ротоглотке, гортанной части глотки, шейном отделе пищевода, щитовидной железе, слюнной железе, ротовой полости, гортани и/или ухе.
29. Способ по п. 18, где терапия первой линии представляет собой комбинированную терапию цисплатином или карбоплатином и 5-FU или паклитакселем, возможно дополнительно в комбинации с цетуксимабом.
30. Способ по любому из пп. 18-29, где фармацевтическая композиция представлена в форме для инъекции.
31. Способ по п. 30, где фармацевтическая композиция представляет собой жидкую инъекцию, порошок для инъекции или таблетку для инъекции.
32. Способ по п. 30, где фармацевтическая композиция представляет собой жидкую инъекцию.
33. Способ по п. 32, где содержание активного ингредиента в фармацевтической композиции составляет от 0,5 до 5 мг/мл в расчете на митоксантрон.
34. Способ по п. 32, где содержание активного ингредиента в фармацевтической композиции составляет от 1 до 2 мг/мл в расчете на митоксантрон.
35. Способ по п. 32, где содержание активного ингредиента в фармацевтической композиции составляет 1 мг/мл в расчете на митоксантрон.
36. Способ по любому из пп. 18-35, где фармацевтическую композицию вводят путем внутривенного введения.
37. Способ по п. 36, где в каждом внутривенном введении время инфузионного введения фармацевтической композиции составляет от 30 до 120 мин.
38. Способ по п. 36, где в каждом внутривенном введении время инфузионного введения фармацевтической композиции составляет от 60 до 120 мин.
39. Способ по п. 36, где в каждом внутривенном введении время инфузионного введения фармацевтической композиции составляет 60±15 мин.
40. Способ по п. 36, где фармацевтическую композицию вводят один раз в течение четырех недель или трех недель.
41. Способ по п. 40, где терапевтически эффективное количество составляет от 8 до 30 мг/м2 в расчете на митоксантрон.
42. Способ по п. 40, где терапевтически эффективное количество составляет от 12 до 20 мг/м2 в расчете на митоксантрон.
43. Способ по п. 40, где терапевтически эффективное количество составляет 20 мг/м2 в расчете на митоксантрон.
| CN 1469735 A, 21.01.2004 | |||
| CN 101209243 A, 02.07.2008 | |||
| CN 104971044 A, 14.10.2015 | |||
| CN 100539997 C, 06.09.2009 | |||
| Устройство для испытания соединений трубопроводов на герметичность | 1985 |
|
SU1242740A1 |
Авторы
Даты
2024-06-17—Публикация
2021-12-14—Подача