Предложены способы, полезные в лечении заболеваний, связанных с рецептором сфингозин-1-фосфата подтипа 1 (S1P1 или SIP1), и, более конкретно, атопического дерматита.
Атопический дерматит (АД, также известный как атопическая экзема) является наиболее распространенным хроническим рецидивирующим воспалительным заболеванием кожи. АтД представляет собой серьезное хроническое иммуноопосредованное заболевание, симптомы которого варьируют, но часто включают сильную сухость кожи, зуд, эритемы, отек кожи и приподнятые бугорки, из которых может выделяться жидкость.
Распространенность АтД в течение жизни составляет от 10% до 20% в развитых странах и, по-видимому, увеличивается (Weidinger 2016, Heratizadeh 2017). АтД может оставаться хроническим и пожизненным заболеванием с распространенностью у взрослых от 7% до 10% (Boguniewicz 2017). В ходе клинических исследований было обнаружено, что 50% пациентов с АтД живут с активным заболеванием более 27 лет (Simpson 2016b).
АтД характеризуется системным кожным воспалением и нарушением функции эпидермального барьера, что приводит к сухости, покраснению кожи и сильному зуду (Bieber 2008, Weidinger 2016). Важными признаками для диагностики АтД являются зуд, экзематозный дерматит и хронический или рецидивирующий анамнез заболевания (Weidinger 2016, Boguniewicz 2017). Пациенты с АтД более склонны к другим аллергическим или атопическим заболеваниям. В исследовании 2016 года среди 380 взрослых с АтД от средней до тяжелой степени 51,3% страдали аллергическим ринитом, 4 0,3% страдали астмой, 24,2% страдали аллергическим конъюнктивитом и 60,5% страдали другими видами аллергии. Бремя болезни у людей с атопическим дерматитом значительно влияет на качество жизни, и пациенты сообщают, что их состояние влияет на социальную деятельность и досуг (43,9%), на работу или учебу (41,8%) и даже на выбор одежды (57,9%) (Simpson 2016).
Сочетание генетических, экологических и иммунологических факторов, по-видимому, определяет предрасположенность к заболеванию, в то время как патогенез АтД, как полагают, связан с взаимоусиливающим взаимодействием между нарушенным эпидермальным барьером и неадекватным иммунным ответом в коже (Weidinger 2016, Heratizadeh 2017). Нарушение эпидермального барьера при АтД облегчает проникновение аллергенов, сенсибилизацию иммуноглобулина Е (IgE) и бактериальную колонизацию (особенно Staphylococcus aureus), которые индуцируют стойкие ответы хелперных Т-клеток 2 типа (Salava 2014, Zhu 2018).
В настоящее время существуют различные местные и системные возможные методы лечения, которые используются для лечения и облегчения симптомов АтД, включая кортикостероиды, увлажняющие средства и системные иммуносупрессанты. Однако эти существующие методы лечения ограничены из-за плохой комплаентности, профилей безопасности, которые препятствуют длительному использованию, ограниченной эффективности, которая обеспечивает только временное или незначительное облегчение симптомов, способами инвазивного введения или использованием не по показаниям. Таким образом, остается большая неудовлетворенная медицинская потребность в эффективном, безопасном и пероральном лечении.
Также остается потребность в эффективном лечении и способах лечения, которые уравновешивают риски, связанные с модуляторами рецептора S1P, такие как известный эффект снижения лимфоцитов у пациентов, получающих модуляторы рецептора S1P.
Сущность
Автор изобретения открыл новые способы лечения атопического дерматита от средней до тяжелой степени, включая способы, позволяющие проводить эффективное лечение заболевания с периодом перерыва, если наблюдаются определенные биомаркеры или нежелательные явления.
Три модулятора S1P одобрены для лечения рецидивирующих форм рассеянного склероза - финголимод (GILENYA), сипонимод (MAYZENT) и озанимод (ZEPOSIA) (MAYZENT (sipommod) (2020) Prescribing Information. Novartis AG., in.; MAYZENT (sipommod) (2020) Prescribing Information. Novartis AG., in; ZEPOSIA(ozanimod) (2020) Prescribing Information; Celgene, in.). Озанимод также находится в клиническом исследовании для лечения язвенного колита и болезни Крона (Peyrin-Biroulet L, Christopher R, Behan D and Lassen С (2017) Modulation of sphingosine-1-phosphate in inflammatory bowel disease. Autoimmun Rev 16:495-503). Этрасимод продемонстрировал эффективность в клинических исследованиях фазы 2 при язвенном колите (Sandborn WJ, Peyrin-Biroulet L, Zhang J, Chiorean M, Vermeire S, Lee SD, Kuhbacher T, Yacyshyn B, Cabell CH, Naik SU, Klassen P and  (2020) Efficacy and Safety of Etrasimod in a Phase 2 Randomized Trial of Patients With Ulcerative Colitis. Gastroenterology 158:550-561) и в настоящее время разрабатывается фаза 3 для язвенного колита и разрабатывается фаза 2/3 для болезни Крона.
(2020) Efficacy and Safety of Etrasimod in a Phase 2 Randomized Trial of Patients With Ulcerative Colitis. Gastroenterology 158:550-561) и в настоящее время разрабатывается фаза 3 для язвенного колита и разрабатывается фаза 2/3 для болезни Крона.
В настоящем документе описано первое клиническое исследование модулятора S1P у пациентов с дерматологическим признаком атопического дерматита. Снижение количества лимфоцитов является целевым эффектом этрасимода. Во время исследования некоторые исследователи прекратили прием этрасимода из-за того, что уровни лимфоцитов соответствовали критериям 3 степени СТСАЕ. Хотя это создало проблемы для исследования, оно также дало неожиданную возможность оценить эффекты от прерывания и возобновления лечения этрасимодом. Анализ результатов исследования показал, что в когорте пациентов, приостановивших прием, наблюдалось клиническое возобновление (или обострение атопического дерматита) после отмены и возобновление клинического эффекта после возобновления лечения этрасимодом. Кроме того, это наблюдение согласуется с фармакодинамическими наблюдениями в этой когорте пациентов. Важно отметить, что ни у одного из этих пациентов не было выявлено инфекции, которая потребовала бы прерывания лечения.
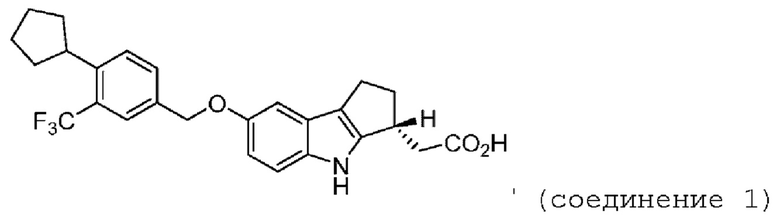
Предложен способ лечения или облегчения по меньшей мере одного симптома или признака атопического дерматита у индивидуума, нуждающегося в этом, включающий: введение индивидууму, нуждающемуся в этом, фармацевтической дозированной формы, содержащей терапевтически эффективное количество {R)-2-(7-(4-циклопентил-3-(трифторметил)бензилокси)-1,2,3,4-тетрагидроциклопента[b]индол-3-ил)уксусной кислоты (соединение 1) или ее фармацевтически приемлемой соли.
Также предложен способ лечения или облегчения по меньшей мере одного симптома или признака атопического дерматита у индивидуума, нуждающегося в этом, включающий: введение индивидууму, нуждающемуся в этом, фармацевтической дозированной формы, содержащей терапевтически эффективное количество (R)-2-(7-(4-циклопентил-3-(трифторметил)бензилокси)-1,2,3,4-тетрагидроциклопента[b]индол-3-ил)уксусной кислоты (соединение 1) или ее фармацевтически приемлемой соли, где соединение 1 или его фармацевтически приемлемую соль вводят в количестве, эквивалентном более 2 мг.
В некоторых вариантах осуществления способ лечения атопического дерматита от средней до тяжелой степени включает введение этрасимода или его фармацевтически приемлемой соли пациенту, нуждающемуся в этом, определение порогового значения абсолютного количества лимфоцитов (ALC) у пациента, прекращение введения этрасимода или его фармацевтически приемлемой соли в течение периода перерыва, и после прекращения введения в течение периода перерыва, продолжение введения этрасимода или его фармацевтически приемлемой соли в течение периода продолжения, при этом пациент, нуждающийся в этом, ощущает улучшение атопического дерматита от средней до тяжелой степени. В некоторых вариантах осуществления этрасимод или его фармацевтически приемлемую соль вводят с частотой один раз в день. В некоторых вариантах осуществления этрасимод или его фармацевтически приемлемую соль вводят с частотой один раз в день и улучшение состояния при атопическом дерматите от средней до тяжелой степени включает улучшение показателя по валидированной шкале общей оценки исследователя (vIGA). В соответствии с некоторыми вариантами осуществления этрасимод или его фармацевтически приемлемую соль вводят с частотой один раз в день в течение периода продолжения лечения. В некоторых вариантах осуществления этрасимод или его фармацевтически приемлемую соль вводят в количестве примерно 2 мг. В некоторых вариантах осуществления пороговое значение ALC составляет менее 500/мм3 или от 0,2×10е9 клеток/л до 0,5×10е9 клеток/л. В некоторых вариантах осуществления пороговое значение ALC составляет менее 200/мм3 или менее 0,2×10е9 клеток/л. В некоторых вариантах осуществления период перерыва составляет по меньшей мере одну неделю. В некоторых вариантах осуществления период перерыва составляет от примерно одной недели до примерно четырех недель. В некоторых вариантах осуществления период продолжения лечения составляет по меньшей мере один месяц. В некоторых вариантах осуществления у пациента диагностирован атопический дерматит средней степени и оценка по шкале vIGA составляет 3 балла. В некоторых вариантах осуществления у пациента диагностирован атопический дерматит тяжелой степени и оценка по шкале vIGA составляет 4 балла. В соответствии с некоторыми вариантами осуществления способ дополнительно включает стадию проверки уровня циркулирующих лимфоцитов в крови пациента. В некоторых вариантах осуществления способ дополнительно включает проверку уровня циркулирующих лимфоцитов в крови пациента в последующее время после периода перерыва, определение порогового значения ALC у пациента, и, если пороговое значение достигнуто, продолжение прекращения лечения. В некоторых вариантах осуществления пациент, нуждающийся в этом, имеет площадь поверхности тела (BSA), пораженную атопическим дерматитом, больше или равную 10%. В некоторых вариантах осуществления способ лечения атопического дерматита от средней до тяжелой степени включает введение этрасимода или его фармацевтически приемлемой соли пациенту, нуждающемуся в этом, мониторинг пациента на инфекции, прекращение введения этрасимода или его фармацевтически приемлемой соли в течение периода перерыва, и после прекращения введения в течение периода перерыва, продолжение введения этрасимода или его фармацевтически приемлемой соли в течение периода продолжения, при этом пациент, нуждающийся в этом, ощущает улучшение атопического дерматита от средней до тяжелой степени. В соответствии с некоторыми вариантами осуществления этрасимод или его фармацевтически приемлемую соль вводят с частотой один раз в день в течение периода продолжения лечения. В некоторых вариантах осуществления этрасимод или его фармацевтически приемлемую соль вводят в количестве примерно 2 мг. В некоторых вариантах осуществления у пациента диагностирован атопический дерматит средней степени тяжести.
ПОДРОБНОЕ ОПИСАНИЕ
Как используется в настоящем описании, следующие слова и фразы, как правило, имеют значения, указанные ниже, за исключением случаев, когда контекст, в котором они используются, указывает на иное.
СОЕДИНЕНИЕ 1: Используемый в настоящем описании термин «соединение 1» означает (R)-2-(7-(4-циклопентил-3-(трифторметил)бензилокси)-1,2,3,4-тетрагидроциклопента[b]индол-3-ил)уксусную кислоту, включая ее кристаллические формы.
См. заявку на патент РСТ, серийный No. PCT/US2009/004265, которая полностью включена в настоящее описание посредством ссылки. В качестве неограничивающего примера, соединение 1 может находиться в виде безводной, несольватированной кристаллической формы, как описано в WO 2010/011316 (полностью включенной в настоящее описание посредством ссылки). В качестве другого неограничивающего примера, L-аргининовая соль соединения 1 может находиться в виде безводной несольватированной кристаллической формы, как описано в WO 2010/011316 и WO 2011/094008 (каждая из которых включена в настоящий документ посредством ссылки в полном объеме). В качестве другого неограничивающего примера, кальциевая соль соединения 1 может находиться в виде кристаллической формы, как описано в WO 2010/011316 (полностью включенной в настоящее описание посредством ссылки). Соединение 1 также описано в настоящем описании как «этрасимод».
Соединение 1 или его фармацевтически приемлемая соль представляет собой селективный синтетический модулятор рецепторов 1, 4, 5 сфингозин-1-фосфата (S1P) для перорального введения. На сегодняшний день было обнаружено в клинических испытаниях, что соединение 1 или его фармацевтически приемлемая соль являются безопасными и хорошо переносимыми. Его безопасность и переносимость оценивали в исследованиях фазы 1 с участием здоровых взрослых субъектов при однократном приеме до 5 мг и повторных дозах до 4 мг один раз в день (QD). В исследовании фазы 2 у пациентов с ЯК лечение 2 мг QD в течение 12 недель приводило к клинически значимым и статистически значимым эндоскопическим и симптоматическим улучшениям по сравнению с плацебо. Устойчивые положительные эффекты наблюдались в последующем открытом расширенном исследовании.
АТОПИЧЕСКИЙ ДЕРМАТИТ ОТ СРЕДНЕЙ ДО ТЯЖЕЛОЙ СТЕПЕНИ: Используемый в настоящем описании термин «атопический дерматит от средней до тяжелой степени», в некоторых вариантах осуществления означает наличие одного или нескольких из следующих признаков: (1) минимальное поражение 10% площади поверхности тела (BSA); (2) независимо от BSA, отдельные поражения с признаками от средней до тяжелой степени; вовлечение хорошо видимых областей или областей, которые важны для функционирования (например, шея, лицо, гениталии, ладони и/или подошвы); и значительное ухудшение качества жизни. В соответствии с некоторыми вариантами осуществления, по валидированная общей оценки исследователя (vIGA) значение 3 считается атопическим дерматитом средней степени и значение vIGA 4 считается атопическим дерматитом тяжелой степени. Специалисты в данной области также распознают атопический дерматит от средней до тяжелой степени.
ВНЕШНИЙ ИЛИ АЛЛЕРГИЧЕСКИЙ АТОПИЧЕСКИЙ ДЕРМАТИТ: Внешний или аллергический атопический дерматит представляет собой атопический дерматит с высоким уровнем общего сывороточного IgE и наличием специфического IgE к аллергенам окружающей среды и пищевым аллергенам.
ВНУТРЕННИЙ ИЛИ НЕАЛЛЕРГИЧЕСКИЙ АТОПИЧЕСКИЙ ДЕРМАТИТ: Внутренний или неаллергический атопический дерматит представляет собой атопический дерматит с нормальными значениями общего IgE и отсутствием специфического IgE.
vIGA: Как используется в настоящем описании «vIGA» означает валидированную шкалу общей оценки исследователя для АтД, которая в настоящее время представляет собой пятибалльную шкалу для измерения тяжести заболевания. Оценка vIGA выбирается с использованием дескрипторов, которые лучше всего описывают общий внешний вид поражений кожи в данный момент времени, используя следующую оценку: 0=чистая (нет воспалительных признаков АтД); 1=почти чистая (едва заметная эритема и папуляции); 2=легкая степень (небольшая, но отчетливая эритема и папулы); 3=средняя степень (четко ощутимая эритема и папуляции); и 4=тяжелая степень (выраженная эритема папуляция). Шкала дополнительно описана на сайте https://www.eczemacouncil.org/assets/docs/Validated-Investigator-Global-Assessment-Scale_vIGA-AD_2017.pdf/, который включен в настоящий документ посредством ссылки во всей своей полноте. В некоторых вариантах осуществления стандарты для vIGA могут быть очевидны специалистам в данной области.
EASI: Как используется в настоящем описании «EASI» означает индекс распространенности и тяжести экземы (EASI). EASI представляет собой критерий оценки клинических признаков АтД. Текущий EASI представляет собой составной индекс с баллами от 0 до 72. Балльная оценка EASI умножает процент пораженной области на 4 специфические характеристики заболевания (эритема, толщина [уплотнение, папуляция, отек], расчесывание [экскориация] и лихенификация), степень тяжести которых оценивается врачом по шкале от "0" (отсутствует) до "3" (тяжелая). Оценка области EASI может быть задокументирована для четырех областей тела - область 1: голова и шея; область 2: туловище (включая область гениталий); область 3: верхние конечности; и область 4: нижние конечности (включая ягодицы), где площадь поражения АтД оценивается в процентах от площади тела и преобразуется в баллы от 0 до 6. В каждой области тела площадь выражается как 0, 1 (1% - 9%), 2 (10% - 29%), 3 (30% - 49%), 4 (50% - 69%), 5 (70% -89%) или 6 (90% - 100%). В некоторых вариантах осуществления стандарты для EASI могут быть очевидны специалистам в данной области.
EASI 75: Как используется в настоящем описании, "EASI 75" означает снижение EASI на 75% по сравнению с исходным уровнем.
EASI 50: Как используется в настоящем описании, "EASI 50" означает снижение EASI на 50% по сравнению с исходным уровнем.
EASI 90: Как используется в настоящем описании, "EASI 90" означает снижение EASI на 90% по сравнению с исходным уровнем.
Числовая рейтинговая шкала зуда (NRS): Как используется в настоящем описании, «числовая рейтинговая шкала зуда» или «NRS» относится к инструменту оценки, который пациенты используют для сообщения об интенсивности своего прурита (зуда). Шкала NRS составляет от 0 до 10, где 0 означает «отсутствие зуда», а 10 означает «самый сильный зуд, который только можно себе представить». Эта шкала дополнительно описана на сайте http://www.pruritussymposium.de/numericalratingscale.html, которая полностью включена в качестве ссылки. В некоторых вариантах осуществления, стандарты для NRS могут быть очевидны специалистам в данной области.
ВВЕДЕНИЕ: Как используется в настоящем описании, "введение" означает предоставление соединения или другой терапии, средства или лечения таким образом, что индивидуум интернализирует соединение.
НАЗНАЧЕНИЕ: Как используется в настоящем описании, «назначение» означает предписание, разрешение или рекомендацию использования лекарственного средства или другой терапии, средства или лечения. В некоторых вариантах осуществления практикующий врач может устно посоветовать, порекомендовать или разрешить использование соединения, режима дозирования или другого лечения индивидууму. В этом случае практикующий врач может назначить соединение, режим дозирования или лечение, а может и не назначать. Кроме того, практикующий врач может предоставить или не предоставить рекомендуемое соединение или лечение. Например, практикующий врач может посоветовать человеку, где можно получить соединение, не предоставляя соединение. В некоторых вариантах осуществления практикующий врач может предоставить индивидууму рецепт на соединение, схему дозирования или лечение. Например, практикующий врач может дать индивидууму письменный или устный рецепт. Рецепт может быть написан на бумаге или на электронном носителе, таком как компьютерный файл, например, на портативном компьютерном устройстве. Например, практикующий врач может преобразовать лист бумаги или электронный носитель в рецепт соединения, режим дозирования или лечение. Кроме того, рецепт можно выписать (устно), отправить по факсу (письменно) или отправить в электронном виде через интернет в аптеку или диспансер. В некоторых вариантах осуществления образец соединения или лечения может быть предоставлен индивидууму. Как используется в настоящем документе, предоставление образца соединения представляет собой подразумеваемое назначение соединения. Различные системы здравоохранения во всем мире используют разные способы для назначения и/или введения соединений или лечения, и эти способы охватываются настоящим описанием.
Рецепт может включать, например, имя индивидуума и/или идентифицирующую информацию, такую как дата рождения. Кроме того, например, рецепт может включать: название лекарства, содержание лекарства, дозу, частоту введения, способ введения, количество или количество, подлежащее выдаче, количество повторных получений, имя врача, подпись врача и тому подобное. Кроме того, например, рецепт может включать номер DEA и/или номер статуса.
Медицинский работник может включать, например, врача, медсестру, фельдшера или другого специалиста в области здравоохранения, который может назначать или вводить соединения (препараты) для лечения расстройства, связанного с рецептором сфингозин-1-фосфата подтипа 1 (S1P1). Кроме того, лечащий врач может включать любого, кто может рекомендовать, назначать, вводить или предотвращать получение человеком соединения или лекарства, включая, например, страховую компанию.
ПРЕДОТВРАЩАТЬ, ПРЕДОТВРАЩЕНИЕ ИЛИ ПРОФИЛАКТИКА: Как используется в настоящем описании, термин «предотвращать», «предотвращение» или «профилактика», например, предотвращение расстройства, связанного с рецептором сфингозин-1-фосфата подтипа 1 (S1P1), или возникновения или появления одного или нескольких симптомов, связанных с конкретным расстройством, и не обязательно означает полное предотвращение расстройства. Например, термин «предотвращать», «предотвращение» или «профилактика» означает назначение терапии на профилактической или профилактической основе индивидууму, у которого в конечном итоге может проявиться хотя бы один симптом заболевания или состояния, но который еще этого не появился. Такие индивидуумы могут быть идентифицированы на основе факторов риска, которые, как известно, коррелируют с последующим возникновением заболевания. В качестве альтернативы профилактическая терапия может быть назначена без предварительного выявления фактора риска в качестве профилактической меры. Задержка появления хотя бы одного симптома также может считаться профилактикой или предупреждением.
ЛЕЧИТВ, ЛЕЧЕНИЕ ИЛИ ТЕРАПИЯ: Как используется в настоящем документе, термин «лечить», «лечение» или «терапия» означает назначение терапии индивидууму, у которого уже проявляется по меньшей мере один симптом заболевания или состояния или у которого ранее проявлялся по меньшей мере один симптом заболевания или состояния. Например, «лечение» может включать облегчение, уменьшение или ослабление симптомов заболевания или состояния, предотвращение дополнительных симптомов, ослабление основных метаболических причин симптомов, ингибирование заболевания или состояния, например, остановку развития заболевания или состояния, облегчение симптомов заболевания или состояния, регрессию заболевания или состояния, облегчение состояния, вызванного заболеванием или состоянием, или остановку симптомов заболевания или состояния. Например, термин «лечение» в отношении расстройства означает уменьшение тяжести одного или нескольких симптомов, связанных с этим конкретным расстройством. Поэтому лечение расстройства не обязательно означает уменьшение тяжести всех симптомов, связанных с расстройством, и не обязательно означает полное уменьшение тяжести одного или нескольких симптомов, связанных с расстройством.
ПЕРЕНОСИТ: Как используется в настоящем документе, говорят, что индивидуум «переносит» дозу соединения, если введение этой дозы этому индивидууму не приводит к неприемлемому нежелательному явлению или неприемлемому сочетанию нежелательных явлений. Специалисту в данной области понятно, что переносимость является субъективной мерой и что то, что может быть допустимо для одного индивидуума, может быть неприемлемо для другого индивидуума. Например, один индивидуум может быть не в состоянии переносить головную боль, в то время как второй индивидуум может считать головную боль терпимой, но не в состоянии переносить рвоту, тогда как для третьего индивидуума терпима либо только головная боль, либо только рвота, но индивидуум не может терпеть сочетание головной боли и рвоты, даже если тяжесть каждого из них меньше, чем при по отдельности.
НЕЖЕЛАТЕЛЬНОЕ ЯВЛЕНИЕ: Как используется в настоящем описании, «нежелательное явление» представляет собой неблагоприятное медицинское явление, связанное с лечением соединением 1 или его фармацевтически приемлемой солью.
ИНФЕКЦИЯ: Как используется в настоящем описании, «инфекция» относится к инвазии и размножению микроорганизмов, таких как бактерии, вирусы и паразиты, которые обычно не присутствуют в организме. Инфекция может не вызывать симптомов и протекать субклинически, или она может вызывать симптомы и проявляться клинически. Инфекция может оставаться локализованной или распространяться через кровеносные или лимфатические сосуды, становясь системной (по всему организму). Инфекции могут включать, но не ограничиваются этим, инфекцию мочевыводящих путей, вирусную инфекцию верхних дыхательных путей, дифтерию, Е. coli, лямблиоз, ВИЧ/СПИД, мононуклеоз, инфлюэнца, лаймоборрелиоз, корь, менингит, инфекционный паротит, пневмония, сальмонеллезные инфекциии, респираторные инфекции, опоясывающий лишай, герпес, туберкулез, вирусный гепатит, COVID-19 и другие инфекции, известные специалистам в данной области.
НУЖДАЮЩИЙСЯ В ЛЕЧЕНИИ и НУЖДАЮЩИЙСЯ В ЭТОМ: Как используется в настоящем описании, «нуждающийся в лечении» и «нуждающийся в этом», когда речь идет о лечении, используются взаимозаменяемо для обозначения решения лица, осуществляющего уход (например, врача, медсестры, практикующей медсестры и т.д.), о том, что индивидууму требуется лечение или оно принесет ему пользу. Это решение принимается на основании множества факторов, которые находятся в сфере компетенции лица, осуществляющего уход, но которые включают знание того, что индивидуум болен или станет больным в результате заболевания, состояния или расстройства, которое поддается лечению соединениями по изобретению. Соответственно, соединения по изобретению можно использовать для защиты или профилактики; или соединения по изобретению могут быть использованы для облегчения, ингибирования или ослабления заболевания, состояния или расстройства.
ИНДИВИДУУМ: Как используется в настоящем описании, «индивидуум» означает человека. В некоторых вариантах осуществления индивидуума называют «субъектом» или «пациентом».
ДОЗА: Как используется в настоящем описании, «доза» означает количество соединения 1 или его фармацевтически приемлемой соли, вводимое индивидууму для лечения или профилактики заболевания или расстройства в одно конкретное время.
ТЕРАПЕВТИЧЕСКИ ЭФФЕКТИВНОЕ КОЛИЧЕСТВО: Как используется в настоящем описании, «терапевтически эффективное количество» средства, соединения, лекарственного средства, композиции или комбинации представляет собой количество, которое является нетоксичным и эффективным для получения желаемого терапевтического эффекта при введении субъекту или пациенту. Точное терапевтически эффективное количество для субъекта может зависеть, например, от размера и состояния здоровья субъекта, характера и тяжести состояния, терапевтических средств или комбинации терапевтических средств, выбранных для введения, и других переменных, известных специалистам в данной области. Эффективное количество для конкретной ситуации определяется путем обычного эксперимента и находится в компетенции врача. В некоторых вариантах осуществления терапевтически эффективное количество представляет собой стандартную дозу.
ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ: Как используется в настоящем описании, «фармацевтическая композиция» означает композицию, включающую по меньшей мере один активный ингредиент, такой как соединение 1; включая, но не ограничиваясь этим, соли соединения 1, при этом композиция поддается исследованию в отношении определенного, эффективного результата у млекопитающего (например, без ограничения, у человека). Специалисты в данной области поймут и оценят методы, подходящие для определения того, дает ли активный ингредиент желаемый эффективный результат, исходя из потребностей специалиста в данной области.
АГОНИСТ: Как используется в настоящем описании, «агонист» означает вещество, которое взаимодействует с рецептором, связанным с G-белком, таким как рецептор S1P1, и активирует его, таким образом, что он может инициировать физиологический или фармакологический ответ, характерный для этого рецептора.
Например, агонист активирует внутриклеточный ответ при связывании с рецептором или усиливает связывание GTP с мембраной. В некоторых вариантах осуществления агонист по настоящему изобретению представляет собой агонист рецептора S1P1, который способен способствовать устойчивой интернализации рецептора S1P1 (см., например, Matloubian et al., Nature, 427, 355, 2004).
Соединения по изобретению могут необязательно быть в виде фармацевтически приемлемых солей, включая фармацевтически приемлемые кислотно-аддитивные соли, полученные из фармацевтически приемлемых нетоксичных кислот, включая неорганические и органические кислоты. Репрезентативные кислоты включают, но не ограничиваются ими, уксусную, бензолсульфоновую, бензойную, камфорсульфоновую, лимонную, этенсульфоновую, дихлоруксусную, муравьиную, фумаровую, глюконовую, глутаминовую, гиппуровую, бромистоводородную, хлористоводородную, изетионовую, молочную, малеиновую, яблочную, миндальную, метансульфоновую, муциновую, азотную, щавелевую, памовую, пантотеновую, фосфорную, янтарную, серную, винную, щавелевую, п-толуолсульфоновую и тому подобное, такие как фармацевтически приемлемые соли, перечисленные Berge et al., Journal of Pharmaceutical Sciences, 66:1-19 (1977), включенные в настоящий документ посредством ссылки во всей своей полноте.
В некоторых вариантах осуществления соединение 1 или его фармацевтически приемлемую соль вводят перорально.
В некоторых вариантах осуществления соединение 1 или его фармацевтически приемлемая соль получены в виде капсул или таблеток, подходящих для перорального приема.
В некоторых вариантах осуществления соединение 1 или его фармацевтически приемлемая соль выбраны из: соединения 1; кальциевой соли соединения 1; и L-аргининовой соли соединения 1. В некоторых вариантах осуществления соединение 1 или его фармацевтически приемлемая соль представляет собой L-аргининовую соль соединения 1. В некоторых вариантах осуществления соединение 1 или его фармацевтически приемлемая соль представляет собой безводную несольватированную кристаллическую форму L-аргининовой соли соединения 1. В некоторых вариантах осуществления соединение 1 или его фармацевтически приемлемая соль представляет собой безводную несольватированную кристаллическую форму соединения 1.
Также предложены фармацевтические композиции, включающие стандартную дозу соединения 1 или его фармацевтически приемлемой соли и, необязательно, один или несколько фармацевтически приемлемых носителей. Также предложены фармацевтические композиции, включающие соединение 1 или его фармацевтически приемлемую соль, необязательно, один или несколько фармацевтически приемлемых носителей. Носитель(носители) должен быть "приемлемым" в том смысле, что он совместим с другими ингредиентами препарата и не должен быть чрезмерно вредным для его реципиента.
В некоторых вариантах осуществления соединение 1 или его фармацевтически приемлемую соль вводят в виде исходного или чистого химического вещества, например, в виде порошка в составе капсул.
В некоторых вариантах осуществления соединение 1 или его фармацевтически приемлемую соль получают в виде фармацевтической композиции, дополнительно включающей один или несколько фармацевтически приемлемых носителей.
Фармацевтические композиции могут быть получены любым подходящим способом, как правило, путем однородного смешивания активного(активных) соединения(соединений) с жидкостями или мелкодисперсными твердыми носителями или с тем и другим в требуемых пропорциях, а затем, при необходимости, придания полученной смеси желаемой формы.
Обычные эксципиенты, такие как связующие вещества, наполнители, приемлемые смачивающие агенты, скользящие вещества для таблеток и разрыхлители, могут использоваться в таблетках и капсулах для перорального приема. Соединения, описанные в настоящем документе, могут быть включены в фармацевтические композиции с использованием методов, хорошо известных специалистам в данной области. Подходящие фармацевтически приемлемые носители, помимо упомянутых в настоящем документе, известны в данной области; например, см. Remington, The Science and Practice of Pharmacy, 20th Edition, 2000, Lippincott Williams & Wilkins, (Editors: Gennaro et al.)
Для перорального введения фармацевтическая композиция может быть в форме, например, таблетки или капсулы. Фармацевтическая композиция предпочтительно получена в виде единицы дозирования, содержащей определенное количество активного ингредиента. Примерами таких единиц дозирования являются капсулы, таблетки, порошки, гранулы или суспензии с обычными добавками, такими как лактоза, маннит, кукурузный крахмал или картофельный крахмал; со связующими, такими как кристаллическая целлюлоза, производные целлюлозы, аравийская камедь, кукурузный крахмал или желатины; с разрыхлителями, такими как кукурузный крахмал, картофельный крахмал или карбоксиметилцеллюлоза натрия; и со скользящими веществами, такими как тальк или стеарат магния. Препараты в твердой форме включают порошки, таблетки, пилюли, капсулы, облатки, суппозитории и диспергируемые гранулы. Твердый носитель может представлять собой одно или несколько веществ, которые также могут действовать как разбавители, ароматизаторы, солюбилизаторы, скользящие вещества, суспендирующие агенты, связующие вещества, консерванты, вещества для улучшения распадаемости таблеток или инкапсулирующие материалы.
В порошках носитель представляет собой мелкодисперсное твердое вещество, находящееся в смеси с мелкодисперсным активным компонентом.
В таблетках активный компонент смешивают с носителем, обладающим необходимой связывающей способностью, в подходящих пропорциях и прессуют до нужной формы и размера.
Порошки и таблетки могут содержать различные процентные количества активного соединения. Репрезентативное количество в порошке или таблетке может составлять от 0,5 до примерно 90 процентов активного соединения. Однако специалист знает, когда необходимо количество, выходящее за пределы этого диапазона. Подходящие носители для порошков и таблеток включают карбонат магния, стеарат магния, тальк, сахар, лактозу, пектин, декстрин, крахмал, желатин, трагакант, метилцеллюлозу, карбоксиметилцеллюлозу натрия, низкоплавкий воск, масло какао и тому подобное. Термин «препарат» включает состав активного соединения с инкапсулирующим материалом в качестве носителя, обеспечивающего капсулу, в которой активный компонент с носителями или без них окружен носителем, который, таким образом, находится в связи с ним. Точно так же включены облатки и пастилки. Таблетки, порошки, капсулы, пилюли, облатки и пастилки можно использовать в виде твердых форм, подходящих для перорального введения.
Фармацевтические препараты предпочтительно находятся в единичных дозированных формах. В такой форме препарат разделен на стандартные дозы, содержащие соответствующие количества активного компонента. Единичная дозированная форма может представлять собой упакованный препарат, упаковку, содержащую отдельные количества препарата, такие как упакованные таблетки или капсулы. Кроме того, единичная дозированная форма может быть самой капсулой или таблеткой, или это может быть соответствующее количество любого из них в упакованной форме.
Кислотно-аддитивные соли можно получить как прямые продукты синтеза соединений. В качестве альтернативы свободное основание можно растворить в подходящем растворителе, содержащем соответствующую кислоту, и выделить соль путем выпаривания растворителя или иным способом разделения соли и растворителя. Соединения по настоящему изобретению могут образовывать сольваты со стандартными низкомолекулярными растворителями с использованием способов, известных специалисту в данной области.
В некоторых вариантах осуществления фармацевтическая дозированная форма вводится один раз в день индивидууму.
В некоторых вариантах осуществления индивидууму вводят количество, эквивалентное от приблизительно 0,5 до приблизительно 5,0 мг соединения 1. В некоторых вариантах осуществления индивидууму вводят количество, эквивалентное 1 мг соединения 1. В некоторых вариантах осуществления индивидууму вводят количество, эквивалентное 2 мг соединения 1. В некоторых вариантах осуществления пациенту вводят количество, эквивалентное более чем 2 мг соединения 1. В некоторых вариантах осуществления пациенту вводят количество, эквивалентное более чем 2,5 мг соединения 1. В некоторых вариантах осуществления индивидууму вводят количество, эквивалентное 2,25 мг соединения 1. В некоторых вариантах осуществления индивидууму вводят количество, эквивалентное 2,5 мг соединения 1. В некоторых вариантах осуществления индивидууму вводят количество, эквивалентное 2,75 мг соединения 1. В некоторых вариантах осуществления индивидууму вводят количество, эквивалентное 3 мг соединения 1. В некоторых вариантах осуществления пациенту вводят количество, эквивалентное или приблизительно равное 2,1, 2,2, 2,25, 2,3, 2,4, 2,5, 2,6, 2,7, 2,75, 2,8, 2,9, или 3,0 мг соединения 1. В некоторых вариантах осуществления пациенту вводят более чем или более чем приблизительно 2 мг соединения 1 для большей эффективности, чем может быть достигнуто при 2 мг соединения 1. В некоторых вариантах осуществления пациенту вводят более чем или более чем приблизительно, 2 мг соединения 1 для максимального изменения EASI по сравнению с исходным уровнем на 12 неделе.
В некоторых вариантах осуществления индивидууму вводят количество, эквивалентное 1 мг соединения 1 в течение первого периода времени и затем количество, эквивалентное 2 мг соединения 1 в течение второго периода времени. В некоторых вариантах осуществления первый период времени составляет по меньшей мере один месяц, например, один месяц, два месяца, три месяца, четыре месяца и т.д. В некоторых вариантах осуществления первый период времени составляет по меньшей мере одну неделю, например, одну неделю, две недели, три недели, четыре недели, пять недель, шесть недель, семь недель, восемь недель, девять недель, десять недель, одиннадцать недель, двенадцать недель, тринадцать недель, четырнадцать недель, пятнадцать недель и т.д. В некоторых вариантах осуществления второй период времени составляет по меньшей мере один месяц, например, один месяц, два месяца, три месяца, четыре месяца и т.д. В некоторых вариантах осуществления второй период времени составляет по меньшей мере одну неделю, например, одну неделю, две недели, три недели, четыре недели, пять недель, шесть недель, семь недель, восемь недель, девять недель, десять недель, одиннадцать недель, двенадцать недель, тринадцать недель, четырнадцать недель, пятнадцать недель и т.д. В некоторых вариантах осуществления второй период времени является неопределенным, например, хроническое введение.
В некоторых вариантах осуществления стандартную дозу вводят без титрования. В некоторых вариантах осуществления стандартную дозу вводят без титрования; и индивидуум не испытывает серьезного связанного с этим нежелательного явления. В некоторых вариантах осуществления стандартную дозу вводят без титрования, чтобы избежать эффекта первой дозы, наблюдаемого при применении других модуляторов рецептора S1P.
В некоторых вариантах осуществления дозированную форму вводят натощак. В некоторых вариантах осуществления дозированную форму вводят после еды.
В некоторых вариантах осуществления способ не зависит от пола.
В некоторых вариантах осуществления соединение 1 или его фармацевтически приемлемую соль вводят в комбинации со вторым терапевтическим средством или терапией, где второе терапевтическое средство или терапия выбраны из ингибитора IL-1бета, ингибитора IL-5, ингибитора IL-9, ингибитора IL-13, ингибитора IL-17, ингибитора IL-25, ингибитора TNFα, ингибитора эотаксин-3, ингибитора IgE, ингибитора простагландина D2, иммуносупрессанта, глюкокортикоида, ингибитора протонной помпы, НПВП, устранения аллергенов и соблюдения диеты.
В некоторых вариантах осуществления перед соединением 1 или его фармацевтически приемлемой солью вводили по меньшей мере одно терапевтическое средство или терапию, где терапевтическое средство или терапия выбраны из ингибитора IL-1beta, ингибитора IL-5, ингибитора IL-9, ингибитора IL-13, ингибитора IL-17, ингибитора IL-25, ингибитора TNFα, ингибитора эотаксина-3, ингибитора IgE, ингибитора простагландина D2, иммуносупрессантов, глюкокортикоида, ингибитора протонной помпы, НПВП, устранения аллергенов и соблюдения диеты.
В некоторых вариантах осуществления индивидуум получает или получал лечение ингибитором IL-1бета. В некоторых вариантах осуществления ингибитор IL-1бета представляет собой анакинра, рилонацепт или канакинумаб.
В некоторых вариантах осуществления индивидуум получает или получал лечение ингибитором IL-5. В некоторых вариантах осуществления ингибитор IL-5 представляет собой бенрализумаб, меполизумаб или реслизумаб.
В некоторых вариантах осуществления индивидуум получает лечение ингибитором IL-9.
В некоторых вариантах осуществления индивидуум получает или получал лечение ингибитором IL-13. В некоторых вариантах осуществления ингибитор IL-13 представляет собой лебрикизумаб, RPC4046 или тралокинумаб.
В некоторых вариантах осуществления индивидуум получает или получал лечение ингибитором IL-17. В некоторых вариантах осуществления ингибитор IL-17 представляет собой иксекизумаб или бродалумаб.
В некоторых вариантах осуществления индивидуум получает или получал лечение ингибитором IL-25.
В некоторых вариантах осуществления индивидуум получает или получал лечение ингибитором TNFα. В некоторых вариантах осуществления ингибитор TNFα представляет собой SIMPONI® (голимумаб), REMICADE® (инфликсимаб), HUMIRA® (адалимумаб) или CTMZIA® (цертолизумаба пэгол).
В некоторых вариантах осуществления индивидуум получает или получал лечение ингибитором эотаксин-3.
В некоторых вариантах осуществления индивидуум получает или получал лечение ингибитором IgE. В некоторых вариантах осуществления ингибитор IgE представляет собой омализумаб.
В некоторых вариантах осуществления индивидуум получает или получал лечение ингибитором простагландина D2.
В некоторых вариантах осуществления индивидуум получает или получал лечение иммуносупрессантом. В некоторых вариантах осуществления иммуносупрессанты представляет собой AZASAN® (azathioprine), IMURAN® (azathioprine), GENGRAF® (циклоспорин), NEORAL® (циклоспорин) или SANDIMMUNE® (циклоспорин).
Иммуносупрессанты также может упоминаться как иммунодепрессанты или иммуносупрессивные средства.
В некоторых вариантах осуществления индивидуум получает или получал лечение глюкокортикоидом. В некоторых вариантах осуществления глюкокортикоид представляет собой UCERIS® (будесонид); DELTASONE® (преднизон), MEDROL® (метилпреднизолон) или гидрокортизон. Глюкокортикостероиды также могут называться глюкокортикоидами или кортикостероиды.
В некоторых вариантах осуществления индивидуум получает или получал лечение НПВП. В некоторых вариантах осуществления НПВП представляет собой аспирин, целекоксиб, диклофенак, дифлунизал, этодолак, ибупрофен, индометацин, кетопрофен, кеторолак, набуметон, напроксен, оксапрозин, пироксикам, салсалат, сулиндак или толметин.
В некоторых вариантах осуществления индивидуум получает или получал лечение DUPIXENT® (дупилумаб).
В некоторых вариантах осуществления лечение направлено на достижение клинической ремиссии. В некоторых вариантах осуществления лечение направлено на поддержание клинической ремиссии. В некоторых вариантах осуществления лечение направлено на индукцию и поддержание клинической ремиссии.
В некоторых вариантах осуществления лечение предназначено для индукции клинического ответа. В некоторых вариантах осуществления лечение предназначено для поддержания клинического ответа. В некоторых вариантах осуществления лечение предназначено для индукции и поддержания клинического ответа.
Также предложен способ лечения индивидуума с атопическим дерматитом, включающий введение индивидууму, нуждающемуся в этом, терапевтически эффективного количества этрасимода или его фармацевтически приемлемой соли. В некоторых вариантах осуществления атопический дерматит представляет собой атопический дерматит от средней до тяжелой степени. В некоторых вариантах осуществления атопический дерматит представляет собой атопический дерматит средней степени. В некоторых вариантах осуществления атопический дерматит представляет собой атопический дерматит тяжелой степени. В некоторых вариантах осуществления атопический дерматит представляет собой хронический атопический дерматит. В некоторых вариантах осуществления индивидуум с атопическим дерматитом не достигает адекватного контроля местной терапией или непереносит местную терапию. В некоторых вариантах осуществления индивидуум с атопическим дерматитом не достигает адекватного контроля биологическими препаратами или не переносит их. В некоторых вариантах осуществления индивидуум с атопическим дерматитом не достигает адекватного контроля дупилумабом или не переносит дупилумаб.
Также предложен способ лечения индивидуума с пруритом, включающий введение индивидууму, нуждающемуся в этом, терапевтически эффективного количества этрасимода или его фармацевтически приемлемой соли. В некоторых вариантах осуществления прурит может быть от умеренного до сильного прурита. В некоторых вариантах осуществления прурит представляет собой умеренный прурит. В некоторых вариантах осуществления, прурит представляет собой сильный прурит.
В некоторых вариантах осуществления способы, описанные в настоящем документе, достигают терапевтического эффекта. В некоторых вариантах осуществления способ терапевтически эффективен для улучшения EASI по сравнению с исходным уровнем, для достижения EASI-75, для достижения оценки vIGA от 0 до 1 (по 5-балльной шкале), для уменьшения пикового прурита NRS у пациента, для снижения процента вовлечения BSA AD от исходного уровня, для достижения EASI-50, определяемого как снижение EASI на ≥50% по сравнению с исходным уровнем, или для достижения EASI-90 (определяемого как снижение EASI на ≥90% по сравнению с исходным уровнем).
В некоторых вариантах осуществления терапевтический эффект наблюдается через или примерно через четыре недели, пять недель, шесть недель, семь недель, восемь недель, десять недель, двенадцать недель или шестнадцать недель. В некоторых вариантах осуществления, терапевтический эффект наблюдается через или примерно через четыре недели, пять недель, шесть недель, семь недель, восемь недель, десять недель, двенадцать недель или шестнадцать недель после начала лечения. В некоторых вариантах осуществления, терапевтический эффект наблюдается через или примерно через четыре недели, пять недель, шесть недель, семь недель, восемь недель, десять недель, двенадцать недель или шестнадцать недель после возобновления лечения. В некоторых вариантах осуществления способ эффективен для лечения прурита у пациента с диагнозом АтД через четыре недели или примерно через четыре недели. В некоторых вариантах осуществления способ эффективен для демонстрации статистически значимого улучшения EASI по сравнению с исходным уровнем через четыре недели.
В некоторых вариантах осуществления улучшение атопического дерматита от средней до тяжелой степени включает улучшение исхода, о котором сообщают пациенты, оцениваемого с использованием дерматологического индекса качества жизни (DLQI), оценки тяжести проявлений экземы пациентом (РОЕМ) или общей оценки пациента (PGA).
В некоторых вариантах осуществления улучшение атопического дерматита от средней до тяжелой степени включает уменьшение прурита.
В соответствии с некоторыми вариантами осуществления способ лечения включает мониторинг уровней циркулирующих лимфоцитов в крови у пациента, страдающего атопическим дерматитом, и коррекцию лечения, если уровни абсолютного количества лимфоцитов (ALC) ниже установленного порога. В некоторых вариантах осуществления порог составляет ALC меньше или меньше примерно 500/мм3. В некоторых вариантах осуществления порог составляет ALC меньше или меньше примерно 500/мм3, 450/мм3, 400/мм3, 350/мм3, 300/мм3, 250/мм3 или 200/мм3. В некоторых вариантах осуществления ALC находится между или между примерно 0,2×10е9 клеток/л и 0,5×10е9 клеток/л. В некоторых вариантах осуществления ALC составляет меньше или меньше примерно 0,5×10е9 клеток/л, 0,45×10е9 клеток/л, 0,4×10е9 клеток/л, 0,35×10е9 клеток/л, 0,3×10е9 клеток/л, 0,25×10е9 клеток/л или 0,2×10е9 клеток/л. В некоторых вариантах осуществления пороговое значение представляет собой ALC, который соответствует критериям степени 3, как определено Общими терминологическими критериями нежелательных явлений (СТСАЕ), как описано в https://ctep.cancer.gov/protocolDevelopment/electronic_applications/docs/CTCAE_v5_Quick_Reference_8.5×11.pdf (снижение числа лимфоцитов), который полностью включен в настоящий документ посредством ссылки. В некоторых вариантах осуществления порогом является ALC, который соответствует критериям уровня 4, как определено СТСАЕ. В некоторых вариантах осуществления порог составляет ALC менее 200/мм3. В некоторых вариантах осуществления порог составляет ALC меньше или меньше примерно 0,2×10е9 клеток/л.
В некоторых вариантах осуществления пациента наблюдают или проверяют на инфекцию во время лечения. Инфекция может быть идентифицирована путем постановки диагноза врачом на основании физических признаков и симптомов. В некоторых вариантах осуществления пациент может быть проверен на определенные инфекции на основе известных диагностических тестов.
В некоторых вариантах осуществления, если уровни ALC ниже порогового уровня, инициируется период перерыва и лечение прекращается (пациент не получает этрасимод в течение периода перерыва). В некоторых вариантах осуществления период перерыва составляет от одного дня до двух месяцев. В некоторых вариантах осуществления период перерыва составляет от одной недели до шести недель. В некоторых вариантах осуществления период перерыва составляет от одной недели до четырех недель. В некоторых вариантах осуществления период перерыва составляет от одной недели до трех недель. В некоторых вариантах осуществления период перерыва составляет один день, два дня, три дня, четыре дня, пять дней, шесть дней, семь дней (одна неделя), десять дней, две недели, три недели, четыре недели, пять недель, шесть недель, семь недель, восемь недель, девять недель, десять недель, одиннадцать недель, двенадцать недель или тринадцать недель. После периода перерыва уровни ALC в сыворотке крови пациента могут быть проверены повторно, и если уровни ALC превышают пороговое значение, пациент может продолжать прием этрасимода в течение периода продолжения лечения. После периода перерыва можно повторно проверить уровень ALC в сыворотке крови пациента, и если уровень ALC ниже порогового уровня, то пациент может вступить в последующий период перерыва. В некоторых вариантах осуществления последующий период перерыва составляет от одного дня до двух месяцев. В некоторых вариантах осуществления последующий период перерыва составляет от одной недели до шести недель. В некоторых вариантах осуществления последующий период перерыва составляет от одной недели до четырех недель. В некоторых вариантах осуществления последующий период перерыва составляет от одной недели до трех недель. В некоторых вариантах осуществления последующий период перерыва составляет один день, два дня, три дня, четыре дня, пять дней, шесть дней, семь дней (одна неделя), десять дней, две недели, три недели, четыре недели, пять недель, шесть недель, семь недель, восемь недель, девять недель, десять недель, одиннадцать недель, двенадцать недель или тринадцать недель. После последующего периода перерыва можно повторно проверить уровень ALC в сыворотке крови пациента, и если уровень ALC выше порогового значения, то пациент может продолжить прием этрасимода в период продолжения. После периода прерывания уровни ALC в сыворотке крови пациента могут быть проверены повторно, и если уровни ALC ниже порогового значения, то пациент может вступить в следующий последующий период перерыва.
В некоторых вариантах осуществления, при выявлении инфекции инициируют период перерыва и прекращают лечение (пациент не получает этрасимод в период перерыва). В некоторых вариантах осуществления период перерыва составляет от одного дня до двух месяцев. В некоторых вариантах осуществления период перерыва составляет от одной недели до шести недель. В некоторых вариантах осуществления период перерыва составляет от одной недели до четырех недель. В некоторых вариантах осуществления период перерыва составляет от одной недели до трех недель. В некоторых вариантах осуществления период перерыва составляет один день, два дня, три дня, четыре дня, пять дней, шесть дней, семь дней (одна неделя), десять дней, две недели, три недели, четыре недели, пять недель, шесть недель, семь недель, восемь недель, девять недель, десять недель, одиннадцать недель, двенадцать недель или тринадцать недель. После периода перерыва пациент может быть вновь обследован на наличие инфекции, и если инфекция не выявлена, то пациент может продолжать принимать этрасимод в течение периода продолжения лечения. После периода перерыва пациент может быть снова обследован на наличие инфекции, и если инфекция выявлена, то пациент может перейти к последующему периоду перерыва. В некоторых вариантах осуществления последующий период перерыва составляет от одного дня до двух месяцев. В некоторых вариантах осуществления последующий период перерыва составляет от одной недели до шести недель. В некоторых вариантах осуществления последующий период перерыва составляет от одной недели до четырех недель. В некоторых вариантах осуществления последующий период перерыва составляет от одной недели до трех недель. В некоторых вариантах осуществления последующий период перерыва составляет один день, два дня, три дня, четыре дня, пять дней, шесть дней, семь дней (одна неделя), десять дней, две недели, три недели, четыре недели, пять недель, шесть недель, семь недель, восемь недель, девять недель, десять недель, одиннадцать недель, двенадцать недель или тринадцать недель. После последующего периода перерыва пациент может быть снова обследован на наличие инфекции, и, если инфекция не выявлена, пациент может продолжить прием этрасимода в течение периода продолжения. После последующего периода перерыва пациент может быть снова обследован на инфекцию, и если инфекция будет выявлена, то пациент может войти в следующий последующий период перерыва.
В течение периода продолжения лечения пациент возобновляет лечение этрасимодом или его фармацевтически приемлемой солью. В некоторых вариантах осуществления период продолжения составляет от одного дня до двух месяцев. В некоторых вариантах осуществления, период продолжения составляет от одной недели до шести недель. В некоторых вариантах осуществления период продолжения составляет от одного месяца до двух лет. В некоторых вариантах осуществления период продолжения длится до тех пор, пока АтД по существу не разрешится (например, оценка vIGA составит 0 или 1). В некоторых вариантах осуществления период продолжения составляет от одной недели до одного года. В некоторых вариантах осуществления период продолжения составляет от одной недели до четырех недель. В некоторых вариантах осуществления период продолжения составляет от одной недели до двух недель. В некоторых вариантах осуществления период продолжения составляет по меньшей мере одну неделю, один месяц, два месяца, три месяца, четыре месяца, пять месяцев, шесть месяцев, семь месяцев, десять месяцев, одиннадцать месяцев, двенадцать месяцев, тринадцать месяцев, пятнадцать месяцев, двадцать месяцев или двадцать четыре месяца. В некоторых вариантах осуществления в течение периода продолжения пациенту можно вводить этрасимод или его фармацевтически приемлемую соль с частотой один раз в сутки. В некоторых вариантах осуществления, в течение периода продолжения пациенту можно вводить этрасимод или его фармацевтически приемлемую соль в количестве, эквивалентном 1 мг, или 2 мг, или 3 мг этрасимода в сутки. В некоторых вариантах осуществления, в течение периода продолжения пациенту можно вводить этрасимод или его фармацевтически приемлемую соль в количестве, эквивалентном 2 мг этрасимода в сутки.
В некоторых вариантах осуществления способы, описанные в настоящем документе, достигают терапевтического эффекта в течение периода продолжения лечения. В некоторых вариантах осуществления способ терапевтически эффективен для улучшения EASI по сравнению с исходным уровнем, для достижения EASI-75, для достижения оценки vIGA от 0 до 1 (по 5-балльной шкале), для снижения vIGA пациента по меньшей мере на 1 балл, для уменьшения пикового прурита NRS у пациента, для снижения процента вовлечения BSA AD по сравнению с исходным уровнем, для достижения EASI-50, определяемого как снижение EASI на ≥50% по сравнению с исходным уровнем, или для достижения EASI-90, определяемого как снижение EASI на ≥90% по сравнению с исходным уровнем в течение периода продолжения лечения.
В некоторых вариантах осуществления после возобновления лечения у пациента наблюдается улучшение по шкале EASI, которое равно или находится в пределах 25% от оценки EASI, если у пациента не было периода перерыва в лечении. В некоторых вариантах осуществления после возобновления лечения у пациента наблюдается улучшение показателя vIGA, равное или в пределах 25% от показателя vIGA, если бы у пациента не было периода перерыва в лечении. В некоторых вариантах осуществления после возобновления лечения у пациента наблюдается уменьшение прурита, равное или находящееся в пределах 25% от эффекта лечения прурита, если бы у пациента не было периода перерыва в лечении.
В некоторых вариантах осуществления после возобновления лечения достигается быстрое восстановление терапевтического эффекта. В некоторых вариантах осуществления, когда происходит быстрое восстановление, пациент может продемонстрировать терапевтический эффект, равный или лучший, чем тот, который был измерен пациентом непосредственно перед началом периода перерыва. В некоторых вариантах осуществления пациент достигает оценки по шкале vIGA, равной или лучше, чем измерение эффекта пациентом непосредственно перед началом периода перерыва. В некоторых вариантах осуществления пациент достигает EASI, равного или лучше, чем измерение эффекта пациентом непосредственно перед началом периода перерыва. В некоторых вариантах осуществления пациент достигает NRC, равного или лучше, чем измерение эффекта пациентом непосредственно перед началом периода перерыва. В соответствии с некоторыми вариантами осуществления восстановление терапевтического эффекта происходит в течение одного дня, двух дней, трех дней, четырех дней, пяти дней, шести дней, семи дней (одной недели), десяти дней, двух недель, трех недель или одного месяца от начала периода продолжения лечения.
В некоторых вариантах осуществления уровень лимфоцитов у пациента используется в качестве биомаркера. В некоторых вариантах осуществления ALC у пациента используется в качестве биомаркера. В некоторых вариантах осуществления биомаркер используется для определения дозы и/или частоты введения пациенту. В некоторых вариантах осуществления биомаркер используется для определения необходимости прерывания лечения. В некоторых вариантах осуществления биомаркер используется для возобновления лечения после прерывания. В некоторых вариантах осуществления биомаркер используется для ускорения возобновления лечения после прерывания. В некоторых вариантах осуществления биомаркер представляет собой количество лимфоцитов,
соответствующее критериям 3 степени согласно определению СТСАЕ. В некоторых вариантах осуществления, биомаркер представляет собой количество лимфоцитов, соответствующее критериям 4 степени согласно определению СТСАЕ. В некоторых вариантах осуществления биомаркер представляет собой ALC, который соответствует критериям степени 3, как определено СТСАЕ. В некоторых вариантах осуществления биомаркер представляет собой ALC, который соответствует критериям 4 степени, как определено СТСАЕ.
Дополнительные варианты осуществления включают варианты осуществления, раскрытые в следующих примерах, которые никоим образом не должны рассматриваться как ограничивающие.
ПРИМЕРЫ
ПРИМЕР 1
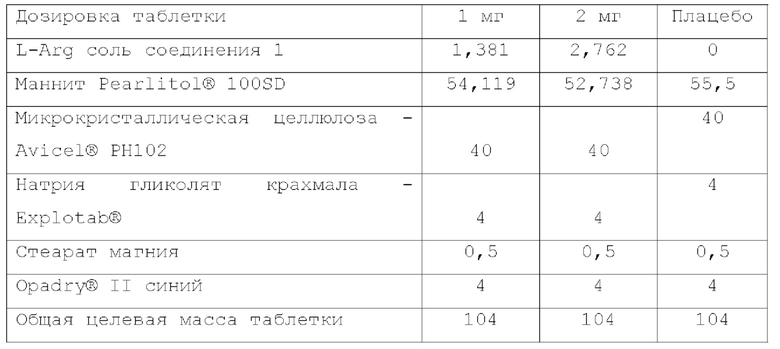
Составы, сформированные из таблеток с немедленным высвобождением, содержащих L-аргининовую соль соединения 1, получали, как показано в таблице 1.

ПРИМЕР 2
Фаза 2, многоцентровое, рандомизированное, двойное слепое, плацебо-контролируемое исследование проводили для оценки безопасности и эффективности этрасимода у пациентов с атопическим дерматитом от средней до тяжелой степени. Измеряемой первичной конечной точкой было процентное изменение индекса распространенности и тяжести экземы (EASI) от исходного уровня до недели 12 с последующим 4-недельным периодом наблюдения. Вторичные конечные точки включают долю участников, достигших EASI-75, долю участников со значением по валидированной шкале общей оценки исследователя (vIGA) 0-1 и процентное изменение пикового прурита. В исследовании приняли участие около 140 пациентов, и оно проводилось в исследовательских центрах США, Канады и Австралии. Продолжается открытое расширенное исследование.
Исследование включало несколько периодов:
(i) период скрининга до 4 недель (для определения пригодности субъекта);
(ii) 12-недельный период двойного слепого лечения с 4-недельным периодом последующего наблюдения для оценки безопасности; и
(iii) 52-недельный период дополнительного открытого лечения с последующим 4-недельным периодом последующего наблюдения для оценки безопасности. Субъекты с хроническим атопическим дерматитом в течение по меньшей мере одного года (согласно критериям Hanifin и Rajka (Hanifin 1980)), несмотря на оптимизированный уход за кожей (например, использование смягчающих средств, избегание раздражающих средств), чье заболевание недостаточно контролируется местной терапией или у которых эти методы лечения не рекомендуются, были одинаково рандомизированы (соотношение 1:1:1) для получения этрасимода (1 или 2 мг) или плацебо. Таблетки этрасимода 1 или 2 мг или соответствующие таблетки плацебо принимали перорально один раз в день в течение периода двойного слепого лечения. Таблетки этрасимода 2 мг принимают внутрь 1 раз в сутки в течение периода дополнительного открытого лечения. Терапия сравнения (плацебо) отсутствует в течение периода дополнительного открытого лечения.
Критерии включения: Субъекты должны соответствовать ВСЕМ следующим критериям включения, чтобы быть допущенными к участию в исследовании.
1. Мужчины или женщины в возрасте от ≥18 до ≤70 лет на момент информированного согласия.
2. Хронический АтД, определяемый по критериям Hanifin и Rajka (Hanifin 1980), который присутствует в течение по меньшей мере одного года до скринингового визита.
3. Индекс распространенности и тяжести экземы (EASI) ≥12 на скрининговом визите и ≥16 на исходном визите.
4. Оценка vIGA ≥3 (по шкале vIGA от 0 до 4, где 3=средняя и 4=тяжелая) при скрининговых и исходных визитах.
5. Площадь поверхности тела (BSA) ≥10% поражения АтД при скрининговых и исходных визитах.
6. Ближайший анамнез (в течение 6 месяцев до скринингового визита) неадекватного ответа на лечение препаратами для местного применения или когда местное лечение нецелесообразно с медицинской точки зрения (например, из-за важных побочных эффектов или рисков безопасности), что может быть задокументировано медицинскими записями или историей, предоставленной исследователю субъектом, несмотря на оптимизированный уход за кожей (например, избегание раздражителей, использование смягчающих средств).
7. Готовность применять дозу местного смягчающего средства/увлажняющего средства по меньшей мере один раз в день в течение ≥1 недели до исходного визита и готовность продолжать ежедневное применение в течение всего исследования без изменений (т.е. тип, частота, применение).
8. Желание и способность соблюдать все визиты в клинику и процедуры, связанные с исследованием, а также понимать и заполнять анкеты, связанные с исследованием.
9. Предоставление подписанного информированного согласия до проведения каких-либо процедур.
Критерий исключения
1. Лечение следующими препаратами в течение последних 4 недель перед скринингом или во время скрининга: а) системные иммунодепрессанты/иммуномодулирующие лекарственные средства (например, метотрексат, циклоспорин), включая пероральные ингибиторы Янус-киназы (JAK) по любым показаниям и использование вне показаний; b) системные глюкокортикоиды (исключая местное, ингаляционное или интраназальное введение, которые считаются местными по какой-либо причине); с) иммуноглобулин или препараты крови.
2. Лечение следующими препаратами в течение 1 недели после рандомизации: а) топические кортикостероиды, b) топические ингибиторы кальциневрина, с) топический кризаборол, d) топические ингибиторы JAK (если не исследуются).
3. Фототерапия АтД или искусственный загар (ложе, кабины или лампы) в течение 4 недель до скрининга или во время скрининга.
4. Наличие сопутствующих кожных заболеваний, которые будут мешать исследовательской оценке основного заболевания.
5. Любые средства, разрушающие клетки, включая, но не ограничиваясь ими, ритуксимаб, в течение 6 месяцев до исходного визита или до тех пор, пока количество лимфоцитов не вернется к норме, в зависимости от того, что дольше.
6. Использование дупилумаба в течение 8 недель до скрининга или во время скрининга.
7. Использование любых биологических средств, кроме дупилумаба (например, адалимумаб, устекинумаб, секукинумаб), независимо от показаний, в течение 5 периодов полувыведения (если известно) или 16 недель до скрининга, в зависимости от того, что дольше, или во время скрининга.
8. Получение любого исследуемого средства, включая небиологические средства и средства местного действия для лечения АтД, в течение 4 недель или 5 периодов полувыведения (в зависимости от того, что больше) до скрининга.
9. Начало в период скрининга лечения АтД с помощью рецептурных смягчающих средств или увлажняющих средств, содержащих добавки, такие как керамиды, гиалуроновая кислота, мочевина или продукты распада филаггрина. (Примечание: Субъекты могут продолжать использовать стабильные дозы таких смягчающих средств или увлажняющих средств, если они использовались в течение по меньшей мере 8 недель до скринингового визита.)
10. Умеренные или сильные индукторы/ингибиторы цитохрома Р450 (CYP)2C8 и CYP2C9 (например, клопидогрел, гемфиброзил, флуконазол и карбамазепин) во время скрининга (включая зверобой продырявленный). Исключающие критерии, связанные с историей болезни
11. Известная активная бактериальная, вирусная, грибковая, микобактериальная инфекция или другая инфекция (включая туберкулез [ТВ] или атипичное заболевание, вызванное микобактериями) или любой серьезный эпизод инфекции, который потребовал госпитализации или лечения внутривенными антибиотиками в течение 4 недель до скрининга или во время скрининга, или пероральными антибиотиками в течение 2 недель до скрининга или во время скрининга. Допускается поверхностное грибковое поражение ногтевого ложа.
12. Имеют любое из следующих состояний или факторов риска: а. Синдромы первичного или вторичного иммунодефицита (например, наследственный синдром иммунодефицита, приобретенный синдром иммунодефицита, иммунодефицит, вызванный лекарственными средствами); b. Пересадка органов в анамнезе (кроме трансплантации роговицы); с. Оппортунистическая инфекция в анамнезе (например, пневмоцистная пневмония, криптококковый менингит, прогрессирующая многоочаговая лейкоэнцефалопатия [PML]); d. История диссеминированного простого герпеса или диссеминированного опоясывающего герпеса или любого эпизода опоясывающего герпеса; е. Положительный результат теста на вирус иммунодефицита человека, гепатита В (положительный результат на поверхностный антиген вируса гепатита В [HBsAg]) или активный гепатит С (с определяемой вирусной нагрузкой) при скрининге; f. Положительный результат теста на активный ТВ с помощью анализа высвобождения гамма-интерферона (IGRA; например, QuantiFERON-TB Gold In-Tube, T-SPOT ТВ) во время скрининга. Лица с известным анамнезом активного ТВ или с положительным тестом на латентный ТВ при скрининге могут быть включены, если задокументировано 1 из следующего: К участию в исследовании допускаются субъекты с латентной формой туберкулеза, у которых активный туберкулез был исключен в соответствии с местными рекомендациями страны (например, рентгенография грудной клетки), которые прошли соответствующий курс профилактического лечения от туберкулеза и не имели недавнего тесного контакта с больным активным туберкулезом. В обязанности исследователя входит проверка адекватности предшествующего лечения ТВ и предоставление соответствующей документации; субъекты, у которых при скрининге был диагностирован латентный ТВ, у которых был исключен активный ТВ и которые получали по крайней мере 4 недели соответствующего режима профилактики ТВ, могут пройти повторный скрининг для зачисления в программу.
13. Получили любую живую или живую аттенуированную вакцину ≤4 недель до исходного уровня.
14. Злокачественное новообразование любой системы органов в анамнезе (кроме локализованного плоскоклеточного или базальноклеточного рака кожи, которые были иссечены или прошли), пролеченное или нелеченное в течение последних 5 лет.
15. Любая история следующих, если лечение не проводилось с помощью имплантированного кардиостимулятора или имплантированного кардиовертера-дефибриллятора с электрокардиостимуляцией: а) история или наличие симптоматической брадикардии; b) синдром слабости синусового узла или нейрокардиогенного обморока в анамнезе; с) атриовентрикулярная (АВ) блокада второй или третьей степени; d) периоды асистолии >3 секунд.
16. Начали или изменили дозу сердечной антиаритмической терапии класса I-IV в течение 1 недели до начала исследуемого лечения или ожидают начала антиаритмической терапии в течение 1 недели после начала исследуемого лечения.
17. Имеют любое из следующих состояний, которые могут повлиять на сердечно-сосудистую функцию: а) перенесенный инфаркт миокарда, нестабильная стенокардия, декомпенсированная сердечная недостаточность, требующая госпитализации, или сердечная недостаточность класса III/IV ≤2 месяцев до скрининга или во время скрининга; b) повторные обмороки в анамнезе или низкая частота сердечных сокращений (ЧСС) и артериальное давление (АД) при скрининге и в 1-й день перед введением дозы (взятие в положении сидя): ЧСС<50 ударов в минуту, систолическое АД<90 мм рт.ст. и диастолическое АД<55 мм рт.ст.; с) скрининговая и предрандомизированная электрокардиограмма (ЭКГ) в 12 отведениях, показывающая клинически значимые отклонения с интервалом PR≥220 мс, скорректированным интервалом QT по Фридериции (QTcF)≥450 мс (мужчины) или QTcF≥470 мс (женщины).
18. Наличие в анамнезе или активная диабетическая ретинопатия, увеит, пигментный ретинит или макулярный отек. Любая недавняя внутриглазная операция в течение одного года после скрининга.
19. Активное тяжелое заболевание легких (например, хроническая обструктивная болезнь легких, фиброз легких) или хроническое заболевание легких, требующее внутривенного лечения кортикостероидами или госпитализации ≤12 месяцев до скрининга или во время скрининга. Критерии исключения, связанные с результатами анализов или лабораторных исследований (проведенных центральной лабораторией) Примечание. Подтвержденный результат означает, что были проведены две последовательные оценки, показывающие постоянно аномальный, клинически значимый результат.
20. Подтвержденное абсолютное количество лимфоцитов <0,8×109 клеток/л при скрининге.
21. Подтвержденная рассчитанная скорость клубочковой фильтрации <30 мл/мин/1,73 м2 по формуле сотрудничества в области эпидемиологии хронических заболеваний почек при скрининге.
22. Любое из следующих значений показателей функции печени во время скрининга: • Аспартатаминотрансфераза (ACT)>2 × верхняя граница нормы (ВГН) • Аланинаминотрансфераза (АЛТ)>2 × ВГН • Прямой (конъюгированный) билирубин>1,5 × ВГН, за исключением случаев синдрома Жильбера.
Общие исключающие критерии
23. Кормящая женщина, которая кормит грудью.
24. Женщины должны быть небеременными, о чем свидетельствует отрицательный результат теста на беременность с бета-человеческим хорионическим гонадотропином (β-hCG) в сыворотке крови при скрининге и тест на беременность с помощью тест-полосок в моче в 1-й день, и соответствовать одному из следующих критериев а или b, а мужчины должны соответствовать критерию с, чтобы претендовать на участие в исследовании:
a. Женщина, не способная к деторождению, должна соответствовать одному из следующих условий: постменопауза, определяемая как отсутствие менструаций в течение 12 месяцев без альтернативной медицинской причины; процедуры постоянной стерилизации, такие как гистерэктомия, двусторонняя сальпингэктомия или двусторонняя овариэктомия;
b. Женщина, способная к деторождению, должна согласиться на использование высокоэффективного метода контрацепции во время лечения и в течение 4 недель после лечения, который при постоянном и правильном использовании может обеспечить частоту неудач менее 1% в год. К высокоэффективным методам контрацепции относятся следующие: комбинированная (содержащая эстроген и прогестаген) гормональная контрацепция, связанная с ингибированием овуляции, которая может быть пероральной, интравагинальной или трансдермальной; гормональная контрацепция, содержащая только прогестаген, связанная с ингибированием овуляции, которая может быть пероральной, инъекционной или имплантированной; внутриматочная спираль; внутриматочная гормон-рилизинг-система; двусторонняя окклюзия маточных труб; вазэктомированный партнер; сексуальное воздержание (полное сексуальное воздержание, определяемое как воздержание от гетеросексуальных контактов в течение всего периода риска, связанного с исследуемым лечением). Надежность сексуального воздержания необходимо оценивать в зависимости от продолжительности клинического исследования и предпочтительного и обычного образа жизни субъекта. Периодическое воздержание (календарный, симптотемпературный, постовуляционный методы) недопустимо;
с. Мужчина должен дать согласие на использование презервативов во время лечения и в течение 4 недель после лечения.
25. Любое острое заболевание или состояние здоровья, включая когнитивные нарушения и злоупотребление алкоголем/лекарственными средствами/зависимость, или признаки/симптомы, подозрительные на серьезное заболевание, которое, по мнению исследователя, может подвергнуть субъекта повышенному риску события(й) безопасности, может помешать участие в исследовании в соответствии с протоколом исследования или с возможностью субъекта сотрудничать и соблюдать процедуры исследования.
Эффективность оценивали по изменению тяжести атопического дерматита с помощью EASI, vIGA, шкалы атопического дерматита (SCORAD) и BSA. Симптомы зуда оценивали с помощью числовой рейтинговой шкалы зуда (NRS). Результаты на основе опроса пациентов также будут оцениваться с использованием дерматологического индекса качества жизни (DLQI), оценки тяжести проявлений экземы пациентом (РОЕМ) и общей оценки пациента (PGA). Исследуемые конечные точки эффективности включали (i) процентное изменение EASI от исходного уровня до 12-й недели, (ii) долю субъектов, достигших EASI-75 (определяемую как снижение EASI на 75% от исходного уровня до 12-й недели), (iii) долю субъектов с оценкой vIGA от 0 до 1 (по 5-балльной шкале) и снижением по сравнению с исходным уровнем ≥2 баллов на 12-й неделе, (iv) процентное изменение пикового прурита NRS из дневника ежедневной регистрации от исходного уровня до 12-й недели, (v) доля субъектов с улучшением (уменьшением) пикового прурита (vi) NRS ≥3 из дневника ежедневной регистрации прурита от исходного уровня до 12-й недели, (vii) изменение и процентное изменение процента вовлечения BSA АтД от исходного уровня до 12-й недели, (viii) долю субъектов, достигших EASI-50 (определяемую как снижение EASI на ≥50% от исходного уровня до 12-й недели), и (ix) долю субъектов, достигших EASI-90 (определяемую как снижение EASI на ≥90% от исходного уровня до 12-й недели).
В период двойного слепого лечения концентрации этрасимода в плазме и общий анализ крови (OAK), включая количество лимфоцитов, оценивали в день 1 и перед введением дозы во время последующих визитов в рамках исследования. Визиты в рамках исследования проводили в начале исследования, на неделе 1, неделе 2, неделе 4, неделе 6, неделе 8, неделе 12, в конце лечения и на неделе 16 для последующего наблюдения. Абсолютное количество лимфоцитов (ALC) было включено как часть оценки.
Результаты
Результаты двойного слепого периода лечения следующие. 140 пациентов рандомизировали в три группы лечения: этрасимод 1 мг (n=47), этрасимод 2 мг (n=47) и плацебо (n=46). Приблизительно у 83% пациентов, включенных в исследование, на исходном уровне был диагностирован атопический дерматит средней степени (vIGA 3), а у остальных на исходном уровне был диагностирован тяжелый атопический дерматит (vIGA 4).
Лечение этрасимодом в дозе 2 мг улучшало исходы, о которых сообщали пациенты, и исходы, оцениваемые врачом, по сравнению с плацебо в течение 12 недель. Лечение этрасимодом в дозе 2 мг приводило к значительно большему количеству пациентов, достигавших оценки vIGA 0 или 1, DLQI и РОЕМ на неделе 12 по сравнению с плацебо.
Как показано на фиг.1, у пациентов, получавших 1 мг этрасимода, наблюдалось снижение EASI на 58,7% от исходного уровня до 12-й недели. У пациентов, получавших 2 мг этрасимода, наблюдалось снижение EASI на 57,2% от исходного уровня до 12-й недели. Пациенты, получавшие плацебо, показали снижение EASI на 48,4% от исходного уровня до 12-й недели. Таким образом, показатели EASI улучшились во всех трех группах через 12 недель. Однако, как показано на фиг.3, пациенты в группе с дозой 2 мг продемонстрировали статистически значимое улучшение показателей EASI от исходного уровня до 4-й недели.
Как показано на фиг.2, 29,8% пациентов, получавших 2 мг этрасимода, достигли показателя vIGA 0 или 1 и снижения по сравнению с исходным уровнем более или равного 2 баллам на 12 неделе. 14,9% пациентов, получавших 1 мг этрасимода, достигли значения vIGA 0 или 1 и снижения по сравнению с исходным уровнем более чем на 2 балла на 12 неделе. 13,0% пациентов, принимавших плацебо, достигли показателя vIGA 0 или 1 и снижения по сравнению с исходным уровнем более или равным 2 баллам на 12 неделе. Группа 2 мг достигла статистически значимого успеха в этом показателе по сравнению с плацебо, дельта составила 16,8% (р<0,05).
Как показано на фиг.2 и 4, 38,3% пациентов, принимавших 2 мг этрасимода, достигли EASI-75. 27,7% пациентов, принимавших этрасимод в дозе 1 мг, достигли EASI-75. 26,1% пациентов из группы плацебо достигли EASI-75. Статистически значимое улучшение доли пациентов, достигших уровня EASI-75, наблюдалось на 4-й неделе в группе, получавшей этрасимод 2 мг.
В период двойного слепого лечения девять пациентов в группе этрасимода 2 мг продемонстрировали показатель ALC степени 3 (от 0.2×10е9 клеток/л до 0.5×10е9 клеток/л) между 4 и 8 неделями. Лечение было прекращено для этих пациентов и возобновлено для подгруппы. Средняя продолжительность перерыва в приеме препарата составляла 2 недели, при этом большинство пациентов продолжали терапию в течение 8 недель. Ответ на лечение был восстановлен после возобновления лечения этрасимодом. Как показано на фиг.5, между 4 и 8 неделями наблюдалось быстрое восстановление числа лимфоцитов. Большинство пациентов возобновили прием исследуемого препарата к 8 неделе с последующим снижением числа лимфоцитов между 8 и 12 неделями. Как показано на фиг.6, неожиданно, изменение EASI от исходного уровня у пациентов, прекративших лечение, а затем повторно начавших лечение, быстро улучшилось после возобновления, и их показатель EASI продолжал улучшаться до 12-й недели.
Что касается конечной точки прурита, данные показали дозозависимое численное уменьшение (улучшение) прурита, превышающее или равное 4 баллам. Доля пациентов, достигших этой конечной точки на 12-й неделе, составила 27,0%, 32,5 (р=0,61) и 42,1 (р=0,15) для плацебо, 1 мг и 2 мг этрасимода соответственно. Как видно на фиг.7, количество баллов по шкале прурита уменьшилось у пациентов, получавших 1 мг и 2 мг этрасимода в течение 12 недель лечения. Ранний и значительный эффект наблюдался на 6-й неделе с постоянным улучшением на 12-й неделе. Статистически значимое уменьшение прурита наблюдалось на 4-й неделе в группе, принимавшей 2 мг этрасимода.
Было показано, что этразимод 1 мг и 2 мг хорошо переносятся. Профиль нежелательных явлений показан на фиг.8. Не было случаев макулярного отека, был один случай одышки в группе плацебо и один случай в группе лечения этрасимодом 2 мг. Нежелательное явление, связанное с частотой сердечных сокращений, отсутствовало. Не было сообщений о конъюнктивите, акне, венозных тромбоэмболических событиях, оппортунистических или серьезных инфекциях.
Что касается влияния на частоту сердечных сокращений, как показано на фиг.9, при оценке влияния этрасимода на частоту сердечных сокращений максимальное среднее изменение частоты сердечных сокращений с поправкой на плацебо по сравнению с исходным уровнем наблюдалось через 2 часа. Было снижение на 1,5 ударов в минуту в группе 1 мг и снижение на 6,7 ударов в минуту в группе 2 мг. Эти изменения частоты сердечных сокращений не были связаны с какими-либо изменениями артериального давления или симптомами. После первой дозы различия в частоте сердечных сокращений в 3 группах сравнялись к 1-й неделе и были одинаковыми со 2-й по 12-ю недели. У одного участника в группе этрасимода 2 мг была транзиторная АВБ типа 1 2-й степени, которая была самокупирующейся и бессимптомной. Участник продолжил дальнейшее дозирование без каких-либо кардиологических изменений или симптомов.
Фиг. 10 иллюстрирует снижение количества лимфоцитов в течение периода двойного слепого лечения. Максимальное снижение числа периферических лимфоцитов наблюдалось в группе этрасимода, получавшей 2 мг, на 43,6% на 2-й неделе.
Чтобы лучше понять влияние перерывов в лечении, основные показатели эффективности были также оценены в группе этрасимода 2 мг, получавшей полное терапевтическое воздействие (т.е. в которой не было перерывов), в которой было 38 участников. Как показано на фиг.11, для процентного изменения EASI с течением времени наблюдалось четкое и раннее разделение в группе 2 мг по сравнению с плацебо, которое было значимым через 4 недели, и продолжало демонстрировать разделение до 12-й недели, что также было статистически значимым. Доля участников, достигших ответа IGA и EASI 75 на 12-й неделе, за исключением участников с прерыванием дозы, также была повторно проанализирована и показана на фиг.12 и 13. Что касается vIGA, 36,8% пациентов в группе 2 мг, у которых не было перерывов в исследовании, достигли vIGA 0 или 1 и снижение показателя vIGA по сравнению с исходным уровнем больше или равное 2 баллам, что было статистически значимым по сравнению с плацебо (дельта=23,8%, р<0,05). По шкале EASI 75 42,1% пациентов из группы этрасимода в дозе 2 мг, у которых не было перерывов в исследовании, достигли EASI-75 на 12-й неделе по сравнению с 26,1% пациентов в группе плацебо. Как показано на фиг.14, при рассмотрении изменений NRC прурита с течением времени в группе лечения этрасимодом по сравнению с группой плацебо статистически значимые изменения наблюдались со 2-й по 8-ю недели.
Другие варианты применения раскрытых способов станут очевидными для специалистов в данной области техники, в частности, на основании обзора этого патентного документа.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ЛЕЧЕНИЯ АТОПИЧЕСКОГО ДЕРМАТИТА ПОСРЕДСТВОМ ВВЕДЕНИЯ ИНГИБИТОРА ИЛ-4R | 2019 |
|
RU2801204C2 |
| СПОСОБЫ ЛЕЧЕНИЯ ТЯЖЕЛОГО АТОПИЧЕСКОГО ДЕРМАТИТА ПУТЕМ ВВЕДЕНИЯ ИНГИБИТОРА IL-4R | 2017 |
|
RU2759630C2 |
| СПОСОБЫ ЛЕЧЕНИЯ АТОПИЧЕСКОГО ДЕРМАТИТА ПОСРЕДСТВОМ ВВЕДЕНИЯ АНТАГОНИСТА IL-4R | 2020 |
|
RU2828020C2 |
| ПРИМЕНЕНИЕ АНТАГОНИСТОВ IL-13 ДЛЯ ЛЕЧЕНИЯ АТОПИЧЕСКОГО ДЕРМАТИТА | 2017 |
|
RU2752785C2 |
| СПОСОБЫ ПРЕДУПРЕЖДЕНИЯ ИЛИ ЛЕЧЕНИЯ АЛЛЕРГИИ ПОСРЕДСТВОМ ВВЕДЕНИЯ АНТАГОНИСТА IL-4R | 2017 |
|
RU2777328C2 |
| СПОСОБ ЛЕЧЕНИЯ КОЖНОЙ ИНФЕКЦИИ ПУТЕМ ВВЕДЕНИЯ АНТАГОНИСТА IL-4R | 2015 |
|
RU2704999C2 |
| СПОСОБЫ ПОВЫШЕНИЯ ЭФФЕКТИВНОСТИ ВАКЦИНЫ ПУТЕМ ВВЕДЕНИЯ АНТАГОНИСТА IL-4R | 2017 |
|
RU2753869C2 |
| СПОСОБЫ ЛЕЧЕНИЯ АТОПИЧЕСКОГО ДЕРМАТИТА С ПОМОЩЬЮ АНТАГОНИСТА IL-4R | 2013 |
|
RU2666630C2 |
| СПОСОБЫ ЛЕЧЕНИЯ АТОПИЧЕСКОГО ДЕРМАТИТА С ПОМОЩЬЮ АНТАГОНИСТА IL-4R | 2013 |
|
RU2698907C2 |
| НЕМОЛИЗУМАБ В ЛЕЧЕНИИ АТОПИЧЕСКОГО ДЕРМАТИТА С ЭКСКОРИАЦИЕЙ ОТ УМЕРЕННОЙ ДО ТЯЖЕЛОЙ | 2019 |
|
RU2758378C1 |
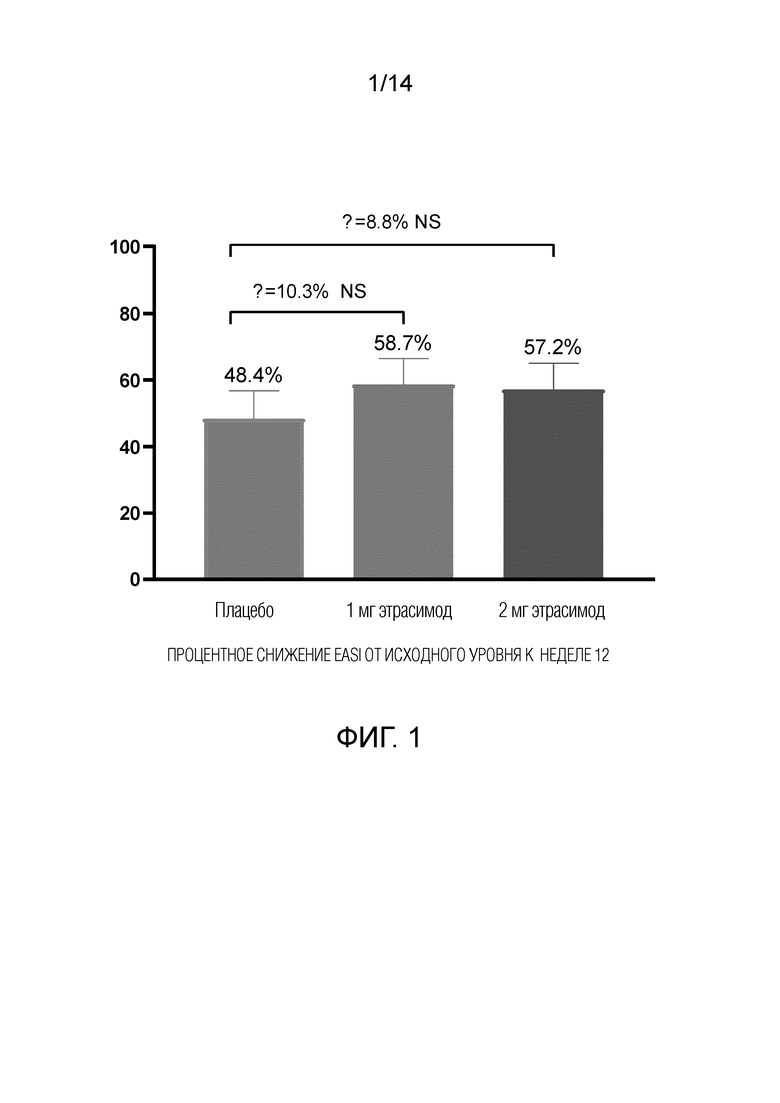
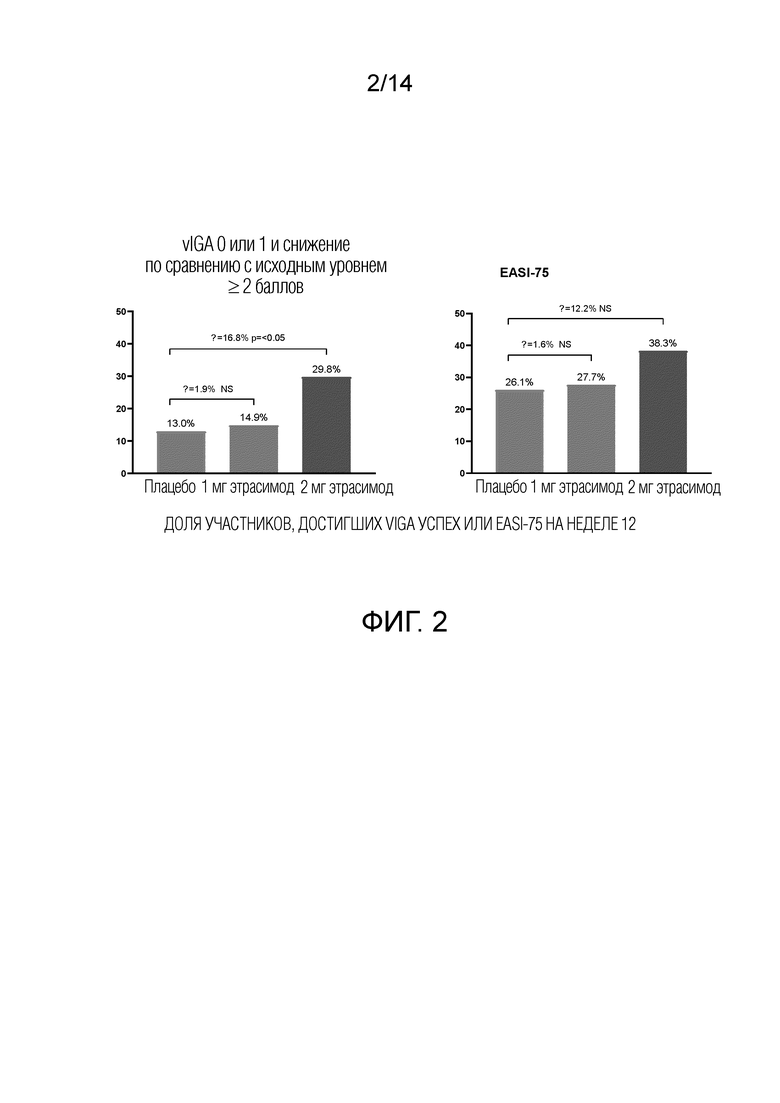
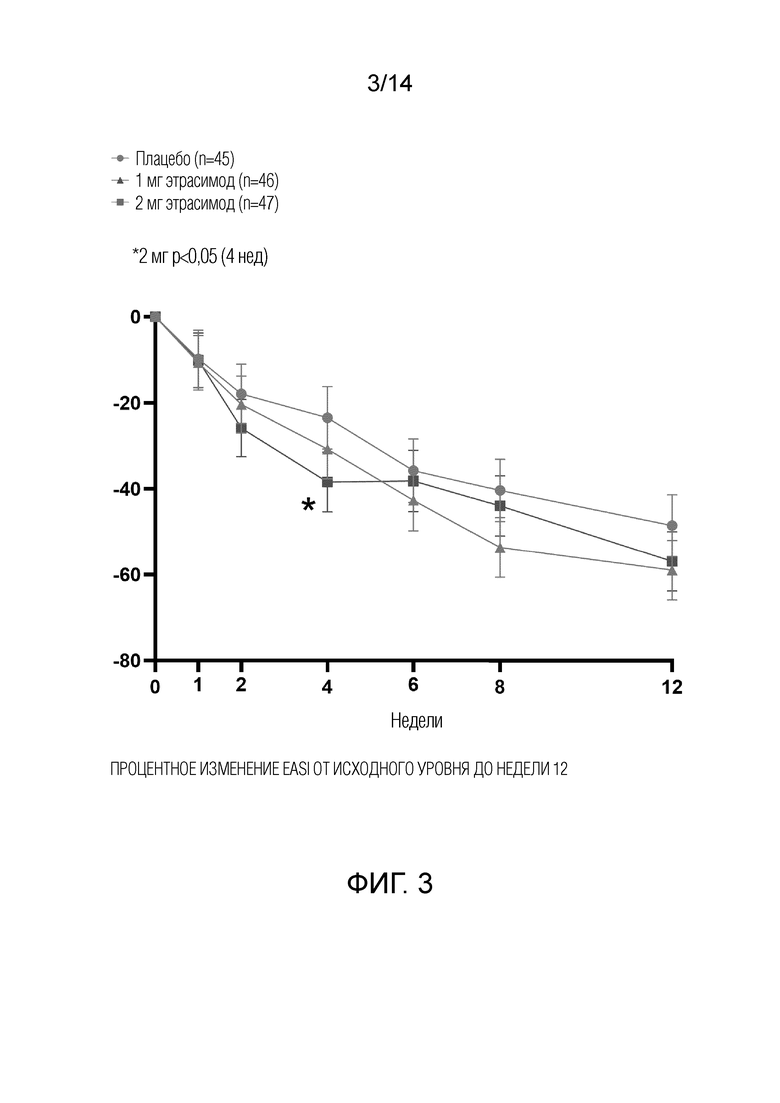
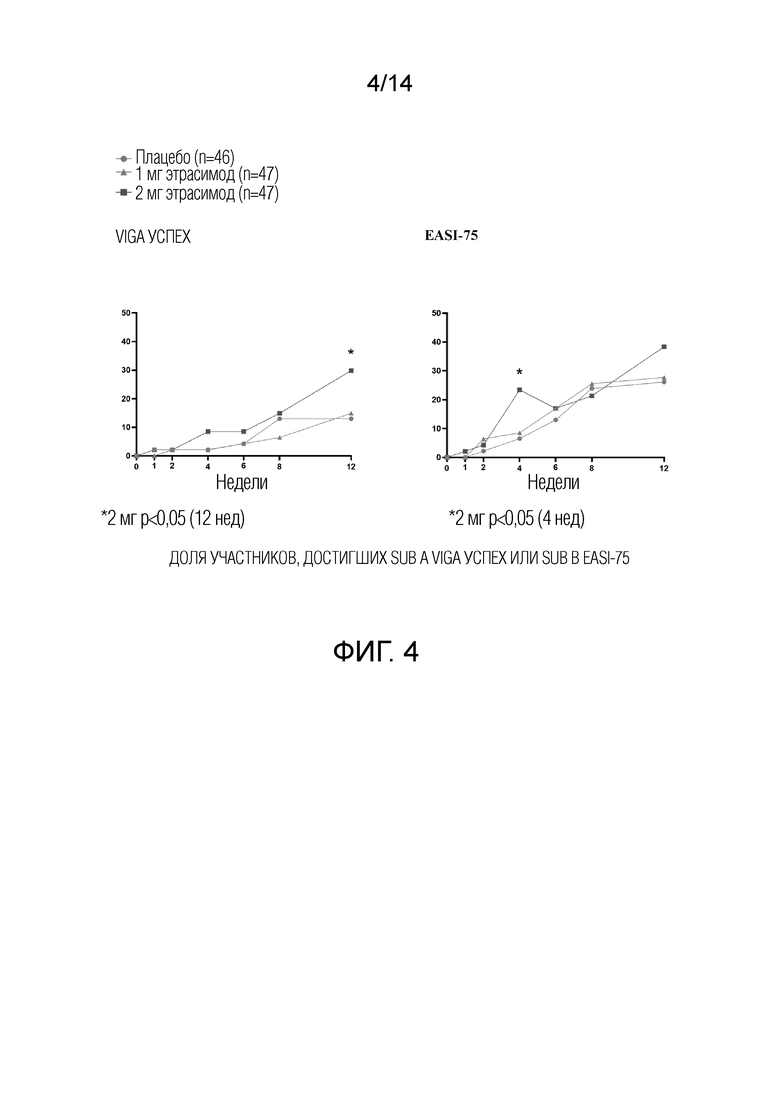
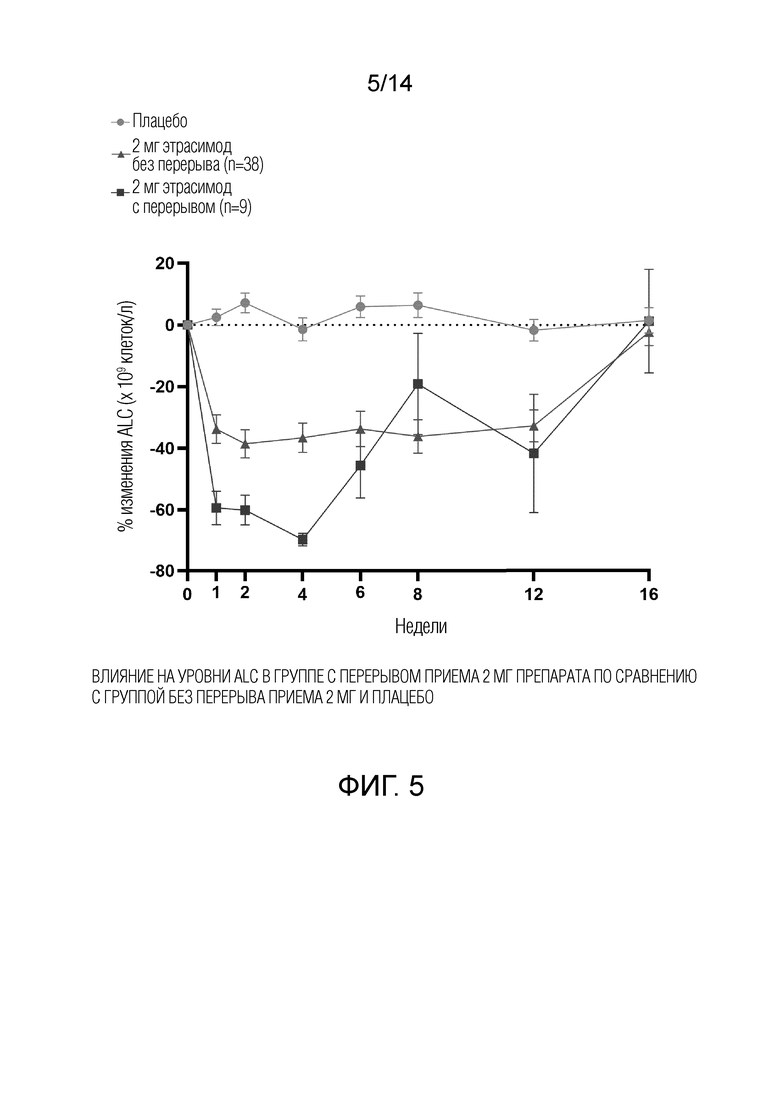
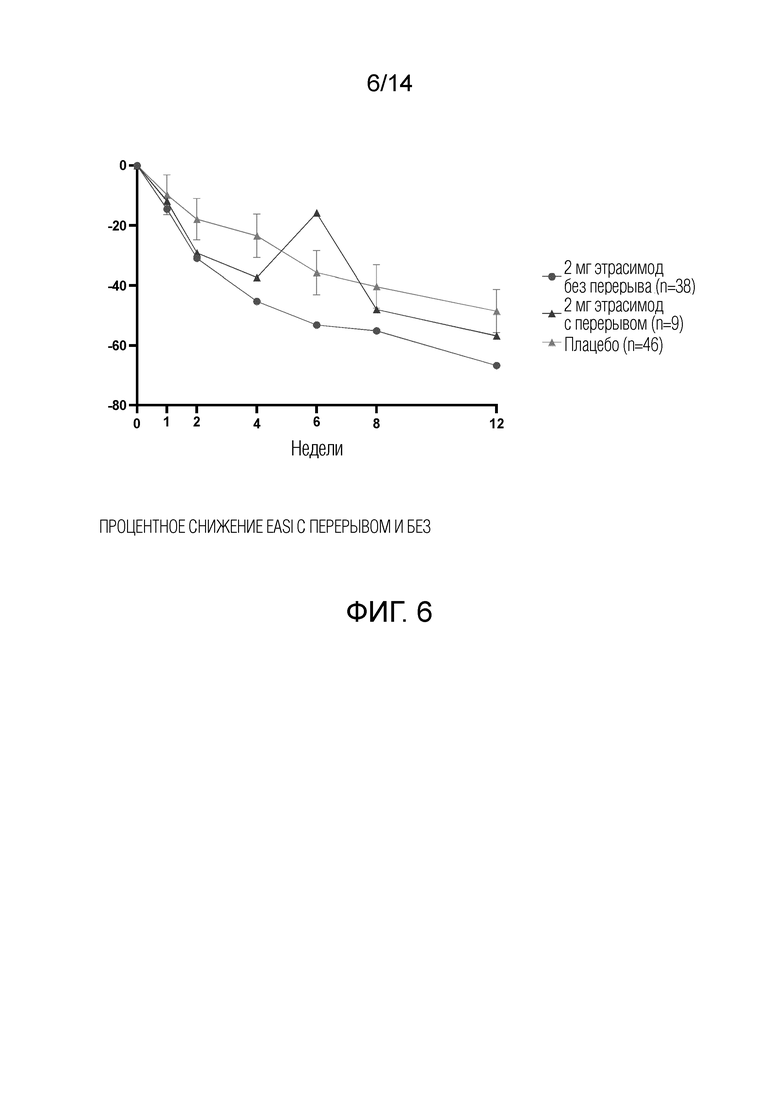
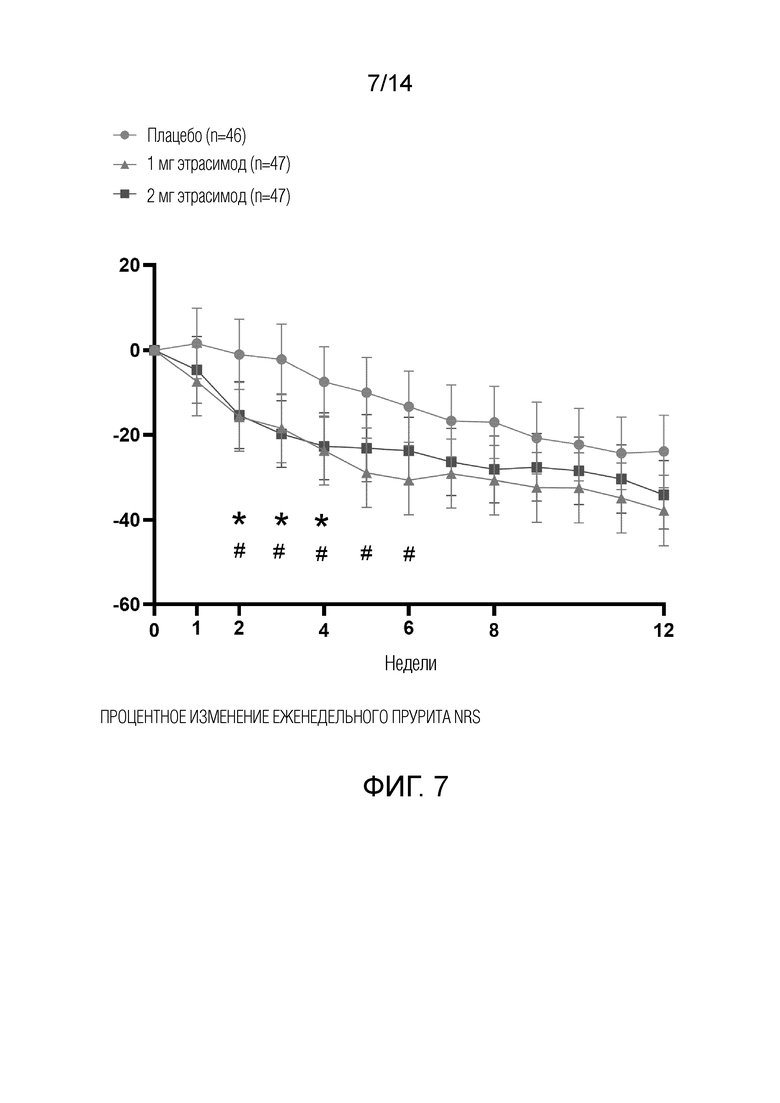
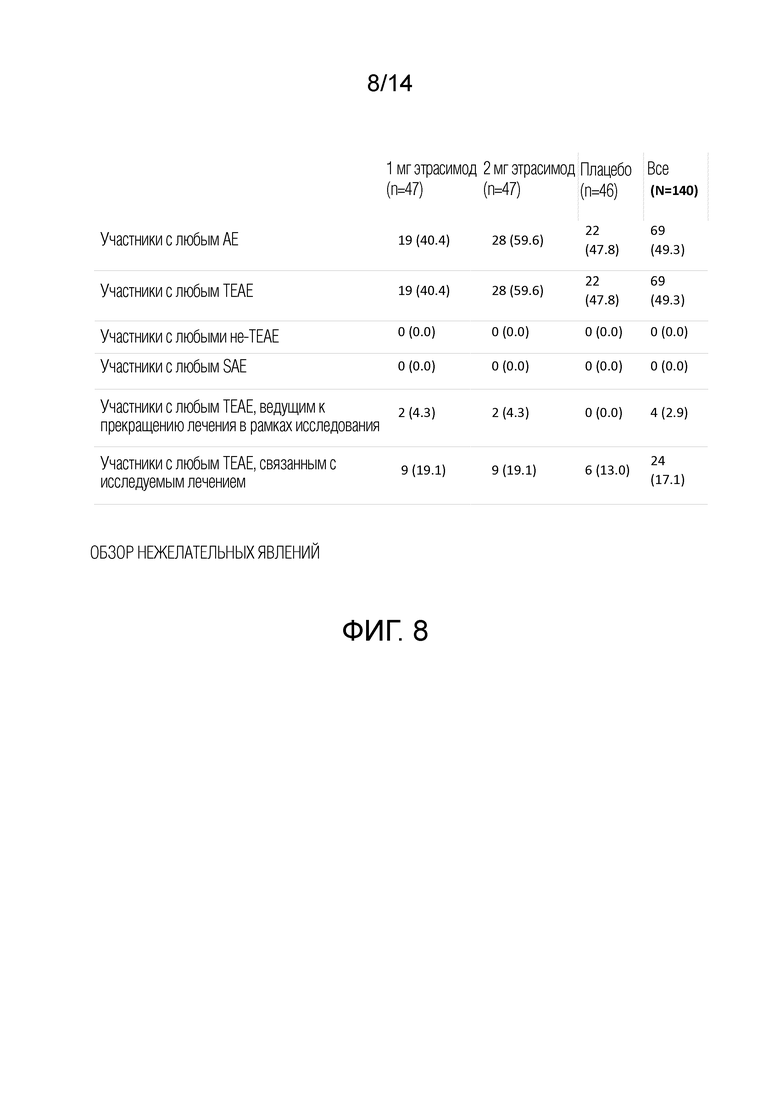
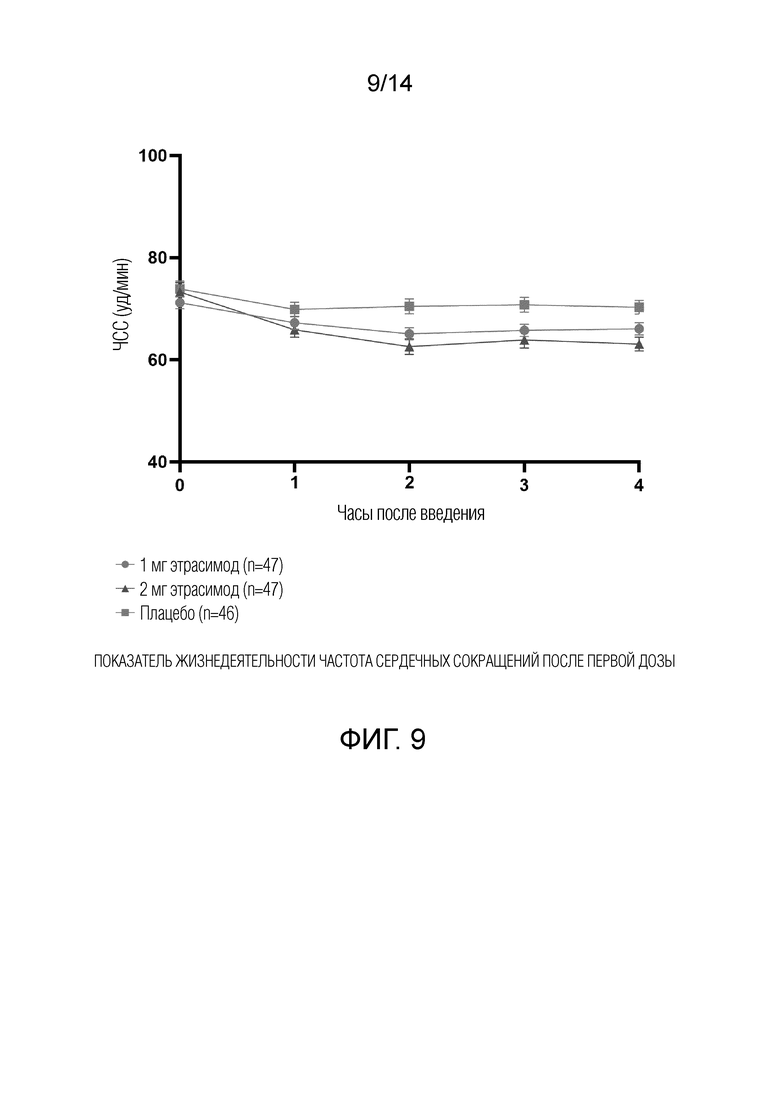
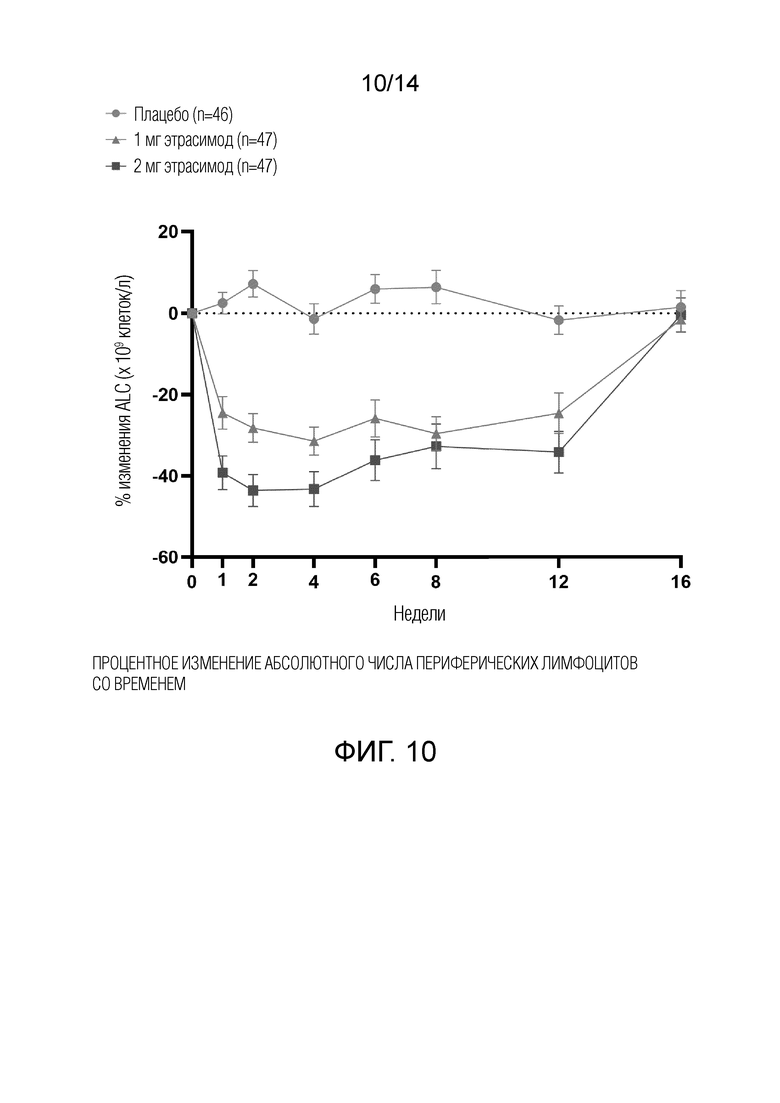
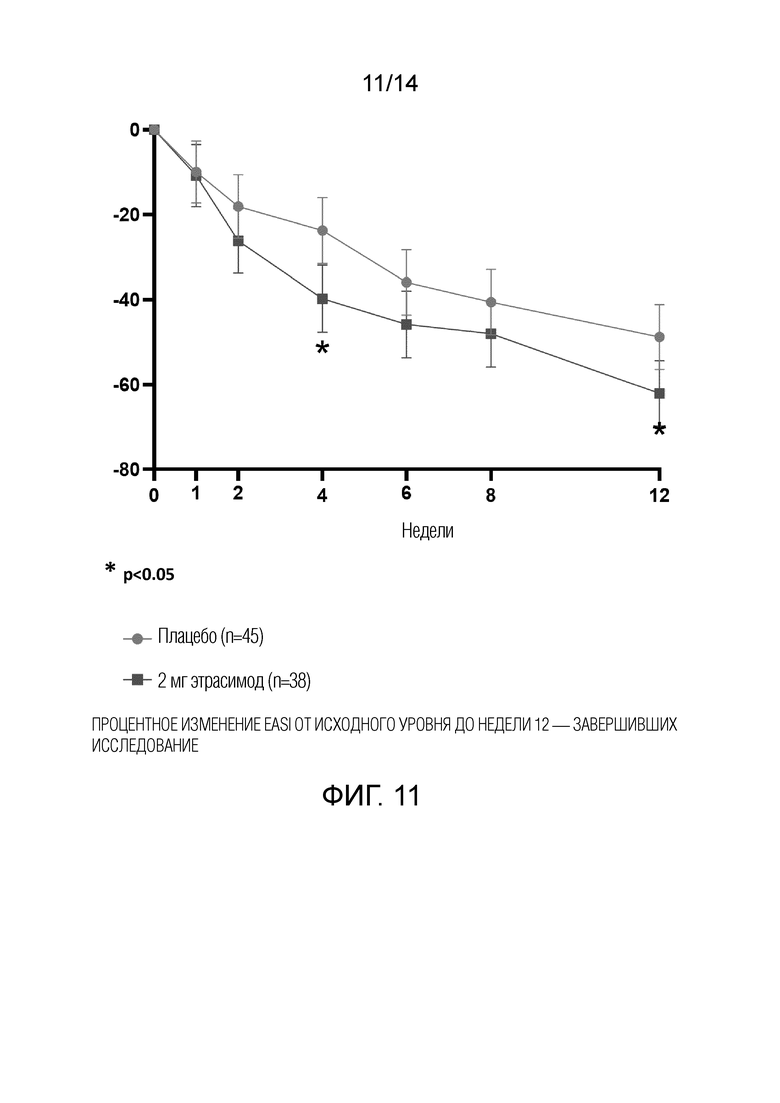
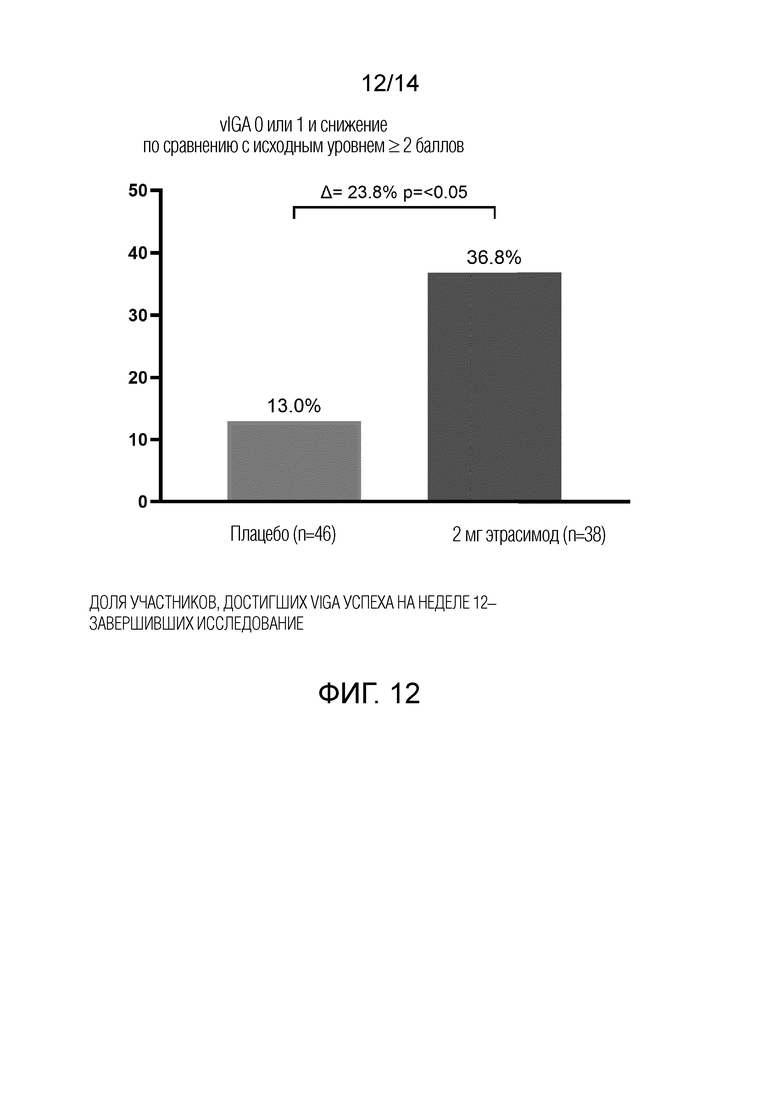
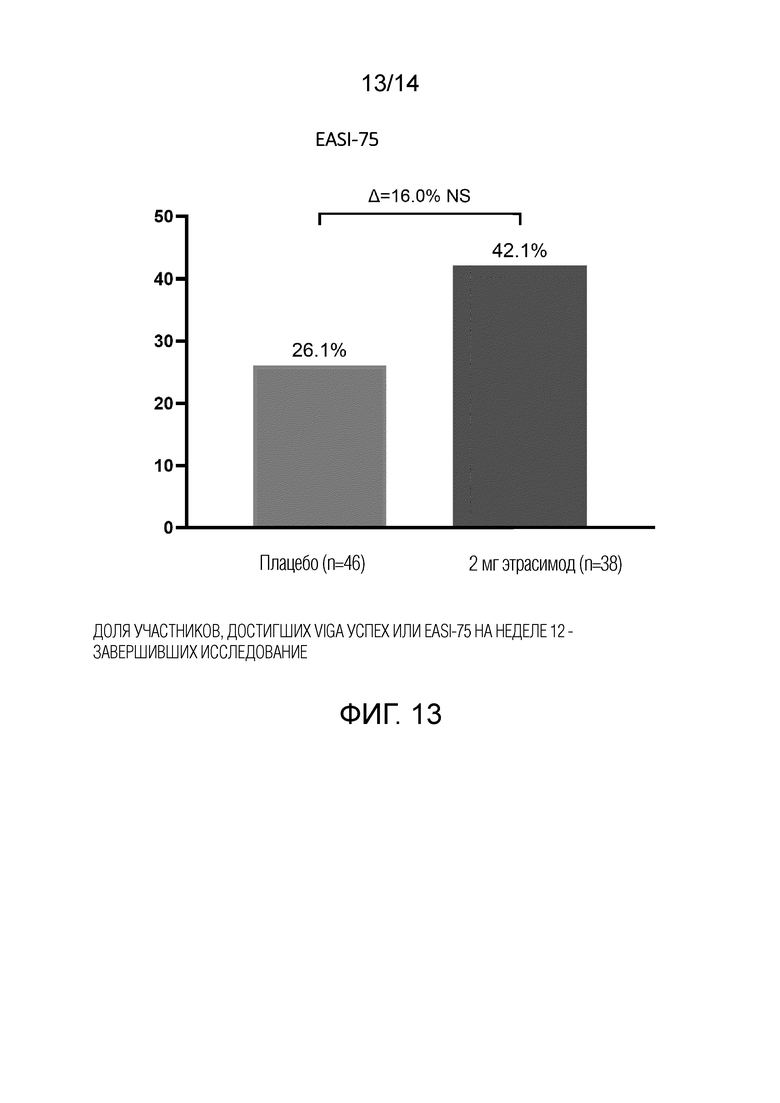
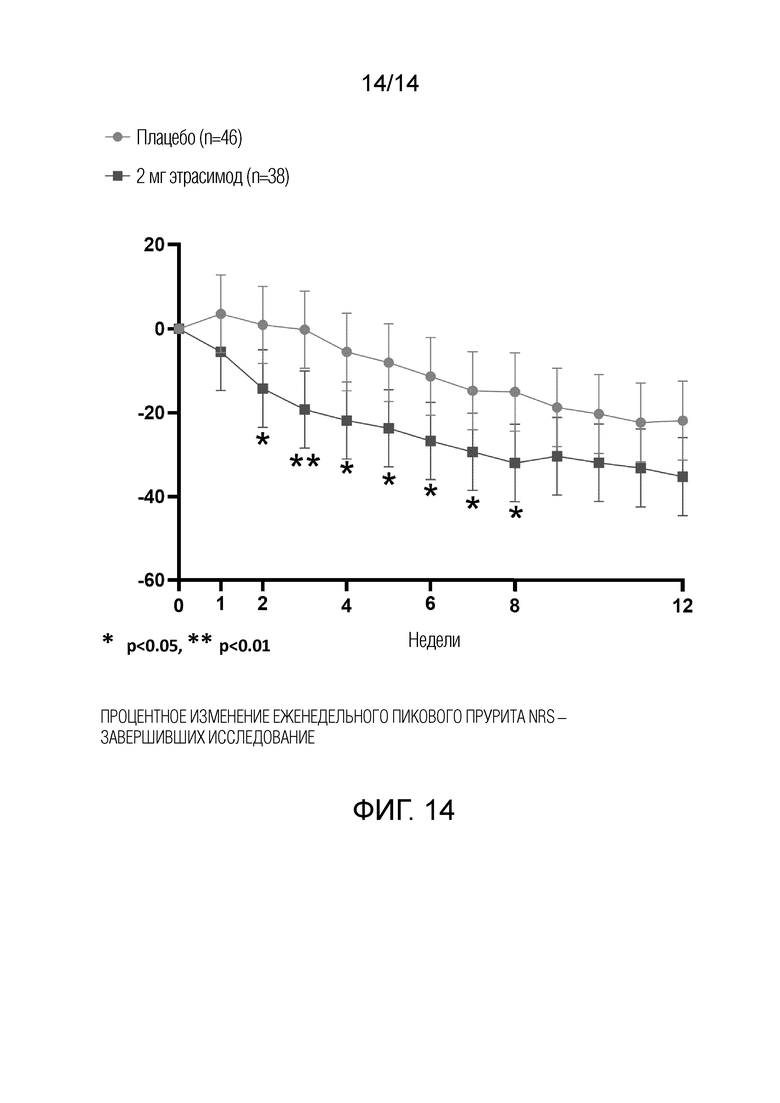
Группа изобретений относится к способам лечения атопического дерматита от средней до тяжелой степени. Способ лечения включает введение этрасимода или его фармацевтически приемлемой соли пациенту, нуждающемуся в этом, определение порогового значения абсолютного количества лимфоцитов (ALC) у пациента и, если уровни ALC ниже порогового уровня, прекращение введения этрасимода или его фармацевтически приемлемой соли в течение периода перерыва. После прекращения введения этрасимода в течение периода перерыва продолжают введение этрасимода или его фармацевтически приемлемой соли в течение периода продолжения. При этом пороговое значение ALC составляет менее 500/мм3 или от 0,2×109 кл./л до 0,5×109 кл./л, а этрасимод или его фармацевтически приемлемую соль вводят в количестве, эквивалентном 1-5 мг. Предложены также варианты указанного способа, предусматривающие мониторинг пациента на наличие одной или нескольких инфекций после введения этрасимода или его фармацевтически приемлемой соли, причем при выявлении одной или нескольких инфекций осуществляют прекращение введения этрасимода или его фармацевтически приемлемой соли в течение периода перерыва. Период перерыва может составлять от одного дня до четырех недель. Группа изобретений обеспечивает эффективное лечение атопического дерматита от средней до тяжелой степени. 3 н. и 30 з.п. ф-лы, 14 ил., 1 табл., 2 пр.
1. Способ лечения атопического дерматита от средней до тяжелой степени, включающий:
введение этрасимода или его фармацевтически приемлемой соли пациенту, нуждающемуся в этом;
определение порогового значения абсолютного количества лимфоцитов (ALC) у пациента, где пороговое значение ALC составляет менее 500/мм3 или от 0,2×109 кл./л до 0,5×109 кл./л;
если уровни ALC ниже порогового уровня, прекращение введения этрасимода или его фармацевтически приемлемой соли в течение периода перерыва; и,
после прекращения введения в течение периода перерыва, продолжение введения этрасимода или его фармацевтически приемлемой соли в течение периода продолжения;
где пациент, нуждающийся в этом, ощущает улучшение атопического дерматита от средней до тяжелой степени;
где этрасимод или его фармацевтически приемлемую соль вводят в количестве, эквивалентном 1-5 мг.
2. Способ по п. 1, где этрасимод или его фармацевтически приемлемую соль вводят с частотой один раз в сутки в течение периода продолжения лечения.
3. Способ по любому из предшествующих пунктов, где этрасимод или его фармацевтически приемлемую соль вводят в количестве, эквивалентном 2 мг этрасимода.
4. Способ по любому из предшествующих пунктов, где этрасимод или его фармацевтически приемлемую соль вводят в количестве, эквивалентном 3 мг этрасимода.
5. Способ по любому из предшествующих пунктов, где пороговое значение ALC составляет менее 200/мм3 или менее 0,2×109 кл./л.
6. Способ по любому из предшествующих пунктов, где период перерыва составляет по меньшей мере одну неделю.
7. Способ по любому из предшествующих пунктов, где период перерыва составляет от примерно одной недели до примерно четырех недель.
8. Способ по любому из предшествующих пунктов, где период продолжения составляет по меньшей мере один месяц.
9. Способ по любому из предшествующих пунктов, где атопический дерматит от средней до тяжелой степени представляет собой атопический дерматит средней степени.
10. Способ по любому из пп. 1-8, где атопический дерматит от средней до тяжелой степени представляет собой атопический дерматит тяжелой степени.
11. Способ по любому из пп. 1-8, где у пациента диагностирован атопический дерматит средней степени и оценка по шкале vIGA составляет 3 балла.
12. Способ по любому из пп. 1-8, где у пациента диагностирован атопический дерматит тяжелой степени и оценка по шкале vIGA составляет 4 балла.
13. Способ по любому из пп. 1-8, где пациент, нуждающийся в этом, имеет площадь поверхности тела (BSA), пораженную атопическим дерматитом, больше или равную 10%.
14. Способ по любому из предшествующих пунктов, дополнительно включающий стадию проверки уровня циркулирующих лимфоцитов в крови пациента.
15. Способ по любому из предшествующих пунктов, дополнительно включающий проверку уровня циркулирующих лимфоцитов в крови пациента в последующее время после периода перерыва, определение порогового значения ALC у пациента и, если пороговое значение достигнуто, прекращение лечения.
16. Способ лечения атопического дерматита от средней до тяжелой степени, включающий:
введение этрасимода или его фармацевтически приемлемой соли пациенту, нуждающемуся в этом;
мониторинг пациента на наличие одной или нескольких инфекций после введения этрасимода или его фармацевтически приемлемой соли;
при выявлении одной или нескольких инфекций, прекращение введения этрасимода или его фармацевтически приемлемой соли в течение периода перерыва;
после прекращения введения в течение периода перерыва, продолжение введения этрасимода или его фармацевтически приемлемой соли в течение периода продолжения;
где способ является терапевтически эффективным для лечения атопического дерматита от средней до тяжелой степени,
где этрасимод или его фармацевтически приемлемую соль вводят в количестве, эквивалентном 1-5 мг.
17. Способ по п. 16, где этрасимод или его фармацевтически приемлемую соль вводят с частотой один раз в сутки.
18. Способ по п. 16 или 17, где этрасимод или его фармацевтически приемлемую соль вводят с частотой один раз в сутки в течение периода продолжения лечения.
19. Способ по любому из пп. 16-18, где этрасимод или его фармацевтически приемлемую соль вводят в количестве, эквивалентном 2 мг этрасимода.
20. Способ по любому из пп. 16-18, где этрасимод или его фармацевтически приемлемую соль вводят в количестве, эквивалентном 3 мг этрасимода.
21. Способ по любому из пп. 16-20, где период перерыва составляет по меньшей мере одну неделю.
22. Способ по любому из пп. 16-20, где период перерыва составляет от примерно одной недели до примерно четырех недель.
23. Способ по любому из пп. 16-22, где период продолжения составляет по меньшей мере один месяц.
24. Способ по любому из пп. 16-23, где атопический дерматит от средней до тяжелой степени представляет собой атопический дерматит средней степени.
25. Способ по любому из пп. 16-23, где атопический дерматит от средней до тяжелой степени представляет собой атопический дерматит тяжелой степени.
26. Способ по любому из пп. 16-23, где у пациента диагностирован атопический дерматит средней степени и оценка по шкале vIGA составляет 3 балла.
27. Способ по любому из пп. 16-23, где у пациента диагностирован атопический дерматит тяжелой степени и оценка по шкале vIGA составляет 4 балла.
28. Способ по любому из пп. 16-23, где пациент, нуждающийся в этом, имеет площадь поверхности тела (BSA), пораженную атопическим дерматитом, больше или равную 10%.
29. Способ по любому из пп. 16-28, дополнительно включающий мониторинг пациента на наличие инфекции в последующее время после периода перерыва и, если выявлена инфекция, прекращение лечения.
30. Способ по любому из пп. 16-29, где одна или более инфекций выбраны из инфекции мочевыводящих путей, вирусной инфекции верхних дыхательных путей, дифтерии, Е. coli, лямблиоза, ВИЧ/СПИД, мононуклеоза, инфлюэнцы, лаймоборрелиоза, кори, менингита, инфекционного паротита, пневмонии, сальмонеллезной инфекциии, респираторных инфекций, опоясывающего лишая, герпеса, туберкулеза, вирусного гепатита или C0VID-19.
31. Способ лечения атопического дерматита от средней до тяжелой степени, включающий:
введение этрасимода или его фармацевтически приемлемой соли пациенту, нуждающемуся в этом;
определение уровня циркулирующих лимфоцитов в крови пациента;
определение порогового значения абсолютного количества лимфоцитов (ALC) у пациента, где пороговое значение ALC составляет менее 500/мм3 или от 0,2×109 кл./л до 0,5×109 кл./л;
если уровни ALC ниже порогового уровня, прекращение введения этрасимода или его фармацевтически приемлемой соли в течение периода перерыва от одного дня до четырех недель;
после прекращения введения в течение периода перерыва, продолжение введения этрасимода или его фармацевтически приемлемой соли в течение периода продолжения;
где пациент, нуждающийся в этом, ощущает улучшение атопического дерматита от средней до тяжелой степени;
где этрасимод или его фармацевтически приемлемую соль вводят в количестве, эквивалентном 1-5 мг.
32. Способ по п. 31, где атопический дерматит от средней до тяжелой степени представляет собой атопический дерматит средней степени.
33. Способ по п. 31, где атопический дерматит от средней до тяжелой степени представляет собой атопический дерматит тяжелой степени.
| C.M | |||
| CROSBY et al | |||
| Etrasimod, an oral, selective sphingosine 1-phosphate receptor modulator improves skin inflammation in a contact hypersensitivity dermatitis model | |||
| Adaptive Immunity and Autoimmunity, Volume 139, ISSUE 9, SUPPLEMENT, S219, September 2019 | |||
| [он-лайн], [найдено 21.12.2023] | |||
| Найдено в Интернет: |
Авторы
Даты
2024-06-17—Публикация
2021-11-08—Подача