Область техники, к которой относится изобретение
Настоящее изобретение относится к области фармацевтики, генной терапии и медицины, а именно к фармацевтическим композициям вектора на основе рекомбинантного безоболочечного вируса, в частности рекомбинантного аденоассоциированного вируса (rAAV), которые могут быть использованы для лечения и профилактики различных заболеваний.
Уровень техники
Типичными представителями безоболочечных вирусов являются парвовирусы, норовирусы, а также рота- и аденовирусы.
Простые или безоболочечные вирусы состоят из нуклеиновой кислоты и белковой оболочки, называемой капсидом. Капсид состоит из повторяющихся морфологических субъединиц - капсомеров. Нуклеиновая кислота и капсид взаимодействуют друг с другом, образуя нуклеокапсид. В каждом вирусе олигомеризация капсидных белков во время сборки капсида обычно приводит к определенному типу симметричной четвертичной структуры. Большинство вирусов имеют капсиды спиральной или икосаэдрической структуры (Lidmar J, Mirny L, Nelson DR. Virus shapes and buckling transitions in spherical shells. Phys Rev E Stat Nonlin Soft Matter Phys. 2003 Nov; 68(5 Pt 1):051910. doi: 10.1103/PhysRevE.68.051910. Epub 2003 Nov 25. PMID: 14682823).
В отличие от безоболочечных капсид оболочечных вирусов покрыт липидной мембраной, известной как суперкапсид. Оболочка приобретается капсидом из внутриклеточной мембраны хозяина вируса; примеры включают внутреннюю ядерную мембрану, мембрану аппарата Гольджи и внешнюю мембрану клетки. Наличие липидной оболочки делает вирусы менее устойчивыми к физико-химическим воздействиям (Alberts В, Bray D, Lewis J, Raff М, Roberts К, Watson JD (1994). Molecular Biology of the Cell (4th ed.). p. 280).
Капсид безоболочечных вирусов выполняет функцию защиты генома при длительном хранении, а также от химических и физических стресс-воздействий, таких как УФ излучение, экстремальные значения рН или температуры, протеолитические и нуклеолитические агенты. Безоболочечные вирусы могут продолжительное время сохранять свои свойства в высушенном состоянии на различных поверхностях как пористых, так и не пористых (Abad FX, Pinto RM, Bosch A. Survival of enteric viruses on environmental fomites. Appl Environ Microbiol. 1994 Oct;60(10):3704-10. doi: 10.1128/aem.60.10.3704-3710.1994. PMID: 7986043; PMCID: PMC201876).
Вирусы осуществляют внедрение своего генетического материала в геном клетки хозяина, поэтому было предложено использовать их в качестве векторов доставки генетической информации в клетки. В терапевтических целях используют векторы на основе ретровируса, аденовируса, аденоассоциированного вируса (AAV), вируса простого герпеса и др. Среди указанных вирусов аденовирус и AAV относятся к безоболочечным вирусам.
Векторы на основе рекомбинантного AAV и рекомбинантного аденовируса в настоящее время являются наиболее широко используемыми и разрабатываемыми продуктами генной терапии, а также они используются в разработке вакцин.
В настоящее время генная терапия рассматривается как потенциально универсальный подход к лечению широкого спектра заболеваний: инфекционных, генетических, злокачественных новообразований и т.д.
Вирусы или вирусные векторы (вирусные частицы) должны сохранять свою структурную целостность, чтобы проявлять инфекционную и биологическую активность в процессе производства, транспортировки, хранения и применения. Структурная целостность вирусного вектора может быть нарушена в процессе приготовления, транспортировки, хранения или применения вакцин или препаратов, содержащих вирусный вектор, что исключает его использование в качестве вектора доставки.
Из уровня техники известны жидкие фармацевтические композиции AAV (WO 2018/128689, WO 2019/094253, WO 2020/014479, WO 2020/214929), жидкие фармацевтические композиции аденовируса (WO 00/29024, WO 2017/013169).
Несмотря на это, по-прежнему существует потребность в улучшенных высокостабильных фармацевтических композициях, содержащих вектор на основе рекомбинантного безоболочечного вируса.
Краткое описание чертежей
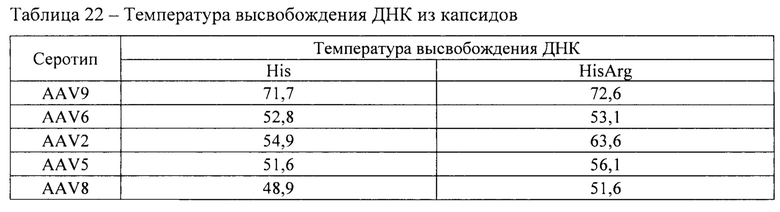
Фигура 1 представляет собой график изменения размера частиц вектора на основе аденоассоциированного вируса 9 серотипа в зависимости от времени в исследуемых составах при температурном воздействии 65°С.
HisArg, His, Tris, PBS, PhosCitr фармацевтические композиции HisArg AAV9, His AAV9, Tris AAV9, PBS AAV9, PhosCitr AAV9 соответственно, указанные в таблице 9.
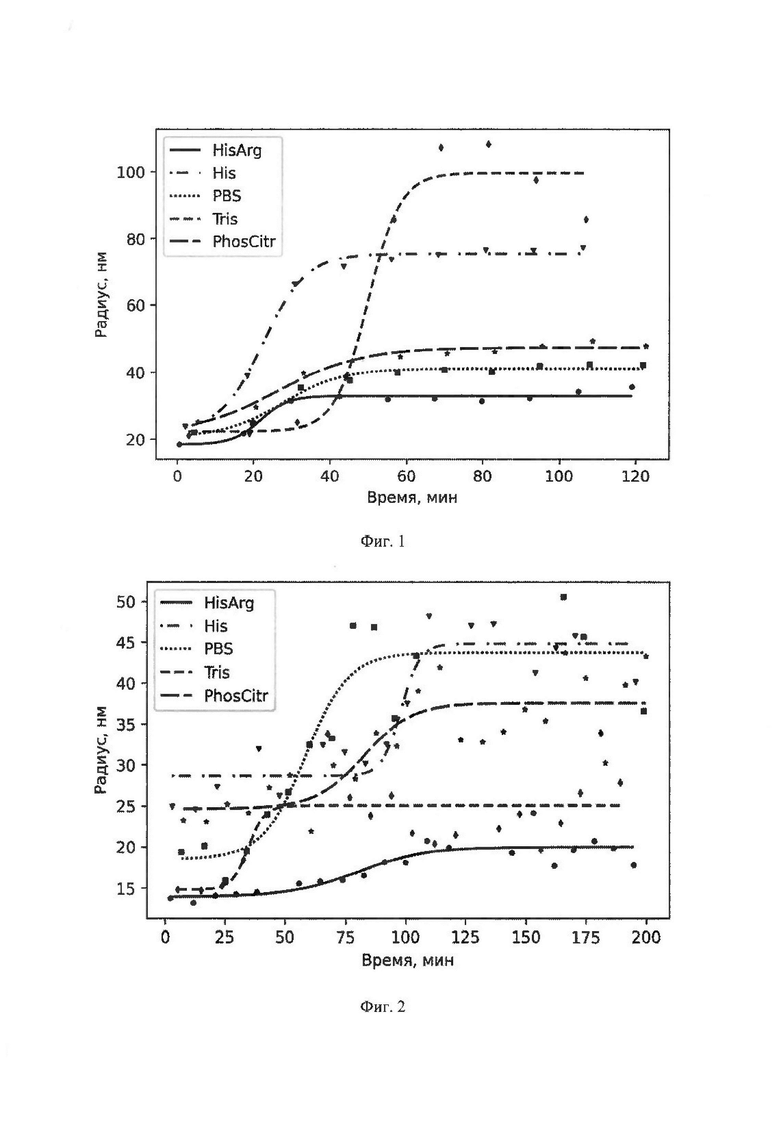
Фигура 2 представляет собой график изменения размера частиц вектора на основе аденоассоциированного вируса 5 серотипа в зависимости от времени в исследуемых составах при температурном воздействии 40°С
HisArg, His, Tris, PBS, PhosCitr фармацевтические композиции HisArg AAV5, His AAV5, Tris AAV5, PBS AAV5, PhosCitr AAV5 соответственно, указанные в таблице 18.
Подробное описание изобретения
Авторами изобретения были неожиданно получены стабильные фармацевтические композиции, содержащие вектор на основе рекомбинантного безоболочечного вируса, в частности рекомбинантного аденоассоциированного вируса (rAAV), которые обладают повышенной коллоидной стабильностью (более высокая температура агрегации), стабильностью к удержанию ДНК (более высокая температура высвобождения ДНК), обеспечивающие стабильность при хранении как в замороженном, так и в жидком виде (отсутствие падения титра при хранении при (5±3)°С, а также сниженное падение титра при термострессе). Разработанные фармацевтические композиции могут быть использованы для лечения и профилактики различных заболеваний.
Определения
Если иное не определено в настоящем документе, научные и технические термины, используемые в связи с настоящим изобретением, будут иметь значения, которые обычно понятны специалистам в данной области.
Кроме того, если по контексту не требуется иное, термины в единственном числе включают в себя термины во множественном числе, и термины во множественном числе включают в себя термины в единственном числе.
В настоящем описании и в последующей формуле изобретения, если контекстом не предусмотрено иное, слова «включать» и «содержать» или их вариации, такие как «включает», «включающий», «содержит» или «содержащий», следует понимать, как включение указанного целого или группы целых, но не исключение любого другого целого или группы целых.
Термин «фармацевтическая композиция» относится к композиции и/или составу, содержащему вектор на основе рекомбинантного безоболочечного вируса в терапевтически эффективном количестве и эксципиенты или вспомогательные вещества (носители, разбавители, наполнители, растворители и т.п.), выбор и соотношение которых зависит от их природы, способа назначения и дозировки.
Термин «водная композиция» при использовании в данном документе относится к композиции на основе воды, в качестве воды могут быть использованы: вода, вода для инъекций, физиологический раствор (0,9-1,0%-ный водный раствор хлористого натрия).
Термин «лиофилизированный», используемый в настоящем документе, относится к препарату, который был подвергнут процессу, известному в данной области техники как сушка из замороженного состояния, включающему в себя замораживание препарата и последующее удаление льда из замороженного содержимого.
Фармацевтическая композиция является «стабильной», если активный агент сохраняет свою физическую стабильность и/или химическую стабильность и/или биологическую активность в течение заявленного срока годности при температуре хранения, например, при (5±3)°С. При этом активный агент может сохранять и физическую, и химическую стабильность, и биологическую активность. Период хранения выбирается на основании результатов исследования стабильности при ускоренном и естественном хранении.
Термин «вектор» при использовании в настоящем документе означает молекулу нуклеиновой кислоты, способную транспортировать другую нуклеиновую кислоту, с которой она соединена. Кроме того, термин «вектор» в данном настоящем документе означает рекомбинантную вирусную частицу, способную транспортировать нуклеиновую кислоту.
Термин «длительное хранение» или «долговременная стабильность» следует понимать, как обозначение того, что фармацевтическая композиция может храниться в течение трех месяцев или более, в течение шести месяцев или более, в течение одного года или более, а также композиция может быть с минимальным сроком хранения в стабильном состоянии по меньшей мере два года. В общем, термины «длительное хранение» и «долговременная стабильность» дополнительно включают продолжительности хранения в стабильном состоянии, которые по меньшей мере сравнимы или лучше, чем срок хранения в стабильном состоянии, как правило, необходимый для доступных в настоящее время коммерческих составов без потерь в стабильности, которые могут сделать состав непригодным для определенного для него фармацевтического применения.
Термин «буферный агент» относится к кислотному или щелочному компоненту (обычно слабой кислоте или слабому основанию) буфера или буферного раствора. Буферный агент помогает поддерживать значение рН раствора при или около заранее определенного значения, и буферные агенты обычно выбирают для достижения заранее определенного значения. Буферный агент может представлять собой единственное соединение, которое приводит к желательному буферному эффекту, в особенности, если указанный буферный агент смешан с (и подходяще способен к протонному обмену с) подходящим количеством (в зависимости от заранее определенного желательного значения) его соответствующего «кислотного/щелочного конъюгата».
Термин «буфер» или «буферный раствор» относится к водному раствору, содержащему смесь кислоты (обычно слабой кислоты, такой как, например, уксусная кислота, лимонная кислота) и ее конъюгированного основания (такой как, например, ацетатной или цитратной соли, например, ацетат натрия, цитрат натрия, а также гидраты указанных солей, например, натрия ацетат тригидрат) или альтернативно смесь основания (обычно слабого основания, например, гистидина) и его конъюгированной кислоты (например, гистидина гидрохлорида или гистидина гидрохлорида моногидрата, или L-гистидина гидрохлорида (г/х) моногидрата (м/г), или L-гистидина г/х м/г, или гистидина г/х м/г). Значение рН «буферного раствора» мало изменяется при добавлении к нему небольшого количества сильного основания или сильной кислоты, а также при разбавлении и концентрировании, благодаря «буферному эффекту», обеспечиваемому «буферным агентом».
Как правило, аминокислоты представляют собой L-аминокислоты. Например, если используют гистидин и гистидина гидрохлорид моногидрат, как правило, это L-гистидин и L-гистидина гидрохлорид моногидрат. Например, если используют аргинин, то как правило, это L-аргинин. Можно также использовать эквиваленты аминокислот, например, фармацевтически приемлемые соли пролина (например, пролина гидрохлорид).
Сокращения
AAV - аденоассоциированный вирус
BHQ-1 - гаситель флуоресценции, применяемый при проведении ПЦР
Ct - количество циклов
FAM - краситель карбоксифлуоресцеин
GFP - зеленый флуоресцентный белок
GOI - ген интереса
MOI - множественность инфекции (количество вирусных частиц на одну клетку)
rAAV - рекомбинантный аденоассоциированный вирус
TU - единицы трансдукции
Вг - вирусные геномы
ПЦР - полимеразная цепная реакция
ИФА - иммуноферментный анализ
ФА - функциональная активность
Э ВЭЖХ - эксклюзионная высокоэффективная жидкостная хроматография
В настоящем изобретении раскрыты стабильные фармацевтические композиции вектора на основе рекомбинантного безоболочечного вируса, в частности рекомбинантного аденоассоциированного вируса (rAAV), которые могут быть использованы для лечения и профилактики различных заболеваний.
В одном из аспектов настоящее изобретение относится к фармацевтической композиции вектора на основе рекомбинантного безоболочечного вируса, содержащей:
(i) вектор на основе рекомбинантного безоболочечного вируса,
(ii) гистидин,
(iii) аргинин,
(iv) натрия хлорид,
(v) магния хлорид,
(vi) поверхностно-активное вещество и
(vii) воду для инъекций.
В некоторых вариантах осуществления изобретения гистидин содержится в концентрации 2,0-3,58 мг/мл, или 2,3-3,2 мг/мл, или 2,6-3,0 мг/мл, или 2,7-2,8 мг/мл, или 2,79 мг/мл.
В некоторых вариантах осуществления изобретения аргинин содержится в концентрации 0,248-0,448 мг/мл, или 0,28-0,416 мг/мл, или 0,3-0,396 мг/мл, или 0,340-0,350 мг/мл, или 0,348 мг/мл.
В некоторых вариантах осуществления изобретения натрия хлорид содержится в концентрации 8,0-15,0 мг/мл, или 9,5-13,5 мг/мл, или 10,5-12,5 мг/мл, или 11,0-12,0 мг/мл, или 11,7 мг/мл.
Магния хлорид может быть использован как в виде магния хлорида безводного, так и в виде его гидратов. В некоторых вариантах осуществления изобретения магния хлорид представляет собой магния хлорида гексагидрат.
В некоторых вариантах осуществления изобретения магния хлорид содержится в концентрации 0,15-0,50 мг/мл, или 0,16-0,35 мг/мл, или 0,18-0,25 мг/мл, 0,200-0,210 мг/мл или 0,203 мг/мл.
В качестве поверхностно-активного вещества может быть использовано любое фармацевтически приемлемое поверхностно-активное вещество. Поверхностно-активные вещества хорошо известны в данной области и включают, без ограничения, полисорбат 20, полисорбат 80, различные полоксамеры и плюроники, а также их смеси.
В некоторых вариантах осуществления изобретения поверхностно-активное вещество содержится в концентрации 0,01-1,0 мг/мл, или 0,01-0,5 мг/мл, или 0,01 0,2 мг/мл, или 0,03-0,15 мг/мл, или 0,05 мг/мл, или 0,1 мг/мл.
В некоторых вариантах осуществления изобретения фармацевтическая композиция содержит:
(i) вектор на основе рекомбинантного безоболочечного вируса,
(ii) гистидин 2,0-3,58 мг/мл,
(iii) аргинин 0,248-0,448 мг/мл,
(iv) натрия хлорид 8,0-15,0 мг/мл,
(v) магния хлорид 0,15-0,50 мг/мл,
(vi) поверхностно-активное вещество 0,01-1,0 мг/мл и
(vii) воду для инъекций до 1,0 мл.
В некоторых вариантах осуществления изобретения фармацевтическая композиция содержит:
(i) вектор на основе рекомбинантного безоболочечного вируса,
(ii) гистидин 2,3-3,2 мг/мл,
(iii) аргинин 0,28-0,416 мг/мл,
(iv) натрия хлорид 9,5-13,5 мг/мл,
(v) магния хлорид 0,16-0,35 мг/мл,
(vi) поверхностно-активное вещество 0,01-0,2 мг/мл и
(vii) воду для инъекций до 1,0 мл.
В некоторых вариантах осуществления изобретения фармацевтическая композиция содержит:
(i) вектор на основе рекомбинантного безоболочечного вируса,
(ii) гистидин 2,6-3,0 мг/мл,
(iii) аргинин 0,3-0,396 мг/мл,
(iv) натрия хлорид 10,5-12,5 мг/мл,
(v) магния хлорид 0,18-0,25 мг/мл,
(vi) поверхностно-активное вещество 0,03 0,15 мг/мл и
(vii) воду для инъекций до 1,0 мл.
В некоторых вариантах осуществления изобретения фармацевтическая композиция содержит:
(i) вектор на основе рекомбинантного безоболочечного вируса,
(ii) гистидин 2,7-2,8 мг/мл,
(iii) аргинин 0,340-0,350 мг/мл,
(iv) натрия хлорид 11,0-12,0 мг/мл,
(v) магния хлорид 0,200-0,210 мг/мл,
(vi) поверхностно-активное вещество 0,03-0,15 мг/мл и
(vii) воду для инъекций до 1,0 мл.
В некоторых вариантах осуществления изобретения фармацевтическая композиция содержит:
(i) вектор на основе рекомбинантного безоболочечного вируса,
(ii) гистидин 2,79 мг/мл,
(iii) аргинин 0,348 мг/мл,
(iv) натрия хлорид 11,7 мг/мл,
(v) магния хлорид 0,203 мг/мл,
(vi) поверхностно-активное вещество 0,05 мг/мл,
(vii) воду для инъекций до 1,0 мл.
В некоторых вариантах осуществления изобретения фармацевтическая композиция содержит:
(i) вектор на основе рекомбинантного безоболочечного вируса,
(ii) гистидин 2,79 мг/мл,
(iii) аргинин 0,348 мг/мл,
(iv) натрия хлорид 11,7 мг/мл,
(v) магния хлорид 0,203 мг/мл,
(vi) поверхностно-активное вещество 0,1 мг/мл,
(vii) воду для инъекций до 1,0 мл.
В некоторых вариантах осуществления изобретения магния хлорид представляет собой магния хлорида гексагидрат.
В некоторых вариантах осуществления изобретения поверхностно-активное вещество представляет собой полоксамер 188.
В некоторых вариантах осуществления изобретения фармацевтическая композиция содержит:
(i) вектор на основе рекомбинантного безоболочечного вируса,
(ii) гистидин 2,0-3,58 мг/мл,
(iii) аргинин 0,248-0,448 мг/мл,
(iv) натрия хлорид 8,0-15,0 мг/мл,
(v) магния хлорида гексагидрат 0,15 0,50 мг/мл,
(vi) поверхностно-активное вещество, 0,01 1,0 мг/мл и представляющее собой полоксамер 188
(vii) воду для инъекций до 1,0 мл.
В некоторых вариантах осуществления изобретения фармацевтическая композиция содержит:
(i) вектор на основе рекомбинантного безоболочечного вируса,
(ii) гистидин 2,3-3,2 мг/мл,
(iii) аргинин 0,28-0,416 мг/мл,
(iv) натрия хлорид 9,5-13,5 мг/мл,
(v) магния хлорида гексагидрат 0,16 0,35 мг/мл,
(vi) поверхностно-активное вещество, 0,01-0,2 мг/мл и представляющее собой полоксамер 188
(vii) воду для инъекций до 1,0 мл.
В некоторых вариантах осуществления изобретения фармацевтическая композиция содержит:
(i) вектор на основе рекомбинантного безоболочечного вируса,
(ii) гистидин 2,6-3,0 мг/мл,
(iii) аргинин 0,3-0,396 мг/мл,
(iv) натрия хлорид 10,5-12,5 мг/мл,
(v) магния хлорида гексагидрат 0,18 0,25 мг/мл,
(vi) поверхностно-активное вещество, представляющее 0,03-0,15 мг/мл и собой полоксамер 188
(vii) воду для инъекций до 1,0 мл.
В некоторых вариантах осуществления изобретения фармацевтическая композиция содержит:
(i) вектор на основе рекомбинантного безоболочечного вируса,
(ii) гистидин 2,7-2,8 мг/мл,
(iii) аргинин 0,340-0,350 мг/мл,
(iv) натрия хлорид 11,0-12,0 мг/мл,
(v) магния хлорида гексагидрат 0,200-0,210 мг/мл,
(vi) поверхностно-активное вещество, 0,03-0,15 мг/мл и представляющее собой полоксамер 188
(vii) воду для инъекций до 1,0 мл.
В некоторых вариантах осуществления изобретения фармацевтическая композиция содержит:
(i) вектор на основе рекомбинантного безоболочечного вируса,
(ii) гистидин 2,79 мг/мл,
(iii) аргинин 0,348 мг/мл,
(iv) натрия хлорид 11,7 мг/мл,
(v) магния хлорид гексагидрат 0,203 мг/мл,
(vi) поверхностно-активное вещество, представляющее 0,05 мг/мл, собой полоксамер 188
(vii) воду для инъекций до 1,0 мл.
В некоторых вариантах осуществления изобретения фармацевтическая композиция содержит:
(i) вектор на основе рекомбинантного безоболочечного вируса,
(ii) гистидин 2,79 мг/мл,
(iii) аргинин 0,348 мг/мл,
(iv) натрия хлорид 11,7 мг/мл,
(v) магния хлорид гексагидрат 0,203 мг/мл,
(vi) поверхностно-активное вещество, представляющее 0,1 мг/мл, собой полоксамер 188
(vii) воду для инъекций до 1,0 мл.
В некоторых вариантах осуществления изобретения гистидин представляет собой L-гистидин.
В некоторых вариантах осуществления изобретения аргинин представляет собой L-аргинин.
В некоторых вариантах осуществления изобретения фармацевтическая композиция имеет рН 7,0-9,0, 7,5-8,5 или 7,7-8,7, или 8,0, или 8,2.
В некоторых вариантах осуществления изобретения описанные выше фармацевтические композиции являются пригодными для лиофилизации, т.е. могут выступать в качестве предлиофилизационного раствора.
В одном из аспектов настоящее изобретение относится к фармацевтической композиции вектора на основе рекомбинантного безоболочечного вируса, представленной в сухой форме, то есть в форме порошка или гранул для растворения в подходящем растворителе (например, воде) перед введением. Такая фармацевтическая композиция может быть получена, например, с помощью лиофилизации, т.е. процесса, известного в данной области техники как сушка из замороженного состояния, включающая в себя замораживание препарата и последующее удаление растворителя из замороженного содержимого.
В одном из аспектов настоящее изобретение относится к лиофилизированной фармацевтической композиции вектора на основе рекомбинантного безоболочечного вируса, полученной лиофилизацией любой фармацевтической композиции, описанной выше. Таким образом фармацевтические композиции по настоящему изобретению могут быть как водными, так и лиофилизированными (лиофилизаты).
Описанные фармацевтические композиции подходят для доставки терапевтических агентов субъектам для лечения или профилактики различных заболеваний или расстройств. Они могут использоваться в генной терапии для лечения таких заболеваний как гемофилия А, гемофилия Б, злокачественные новообразования, спинальная мышечная атрофия и т.д., а также в разработке вакцин для профилактики, например, инфекционных заболеваний.
Фармацевтические композиции по изобретению могут содержать вектор на основе рекомбинантного безоболочечного вируса в различной концентрации. Концентрация вирусного вектора может зависеть, например, от заболевания, для профилактики или лечения которого будут использоваться описанные выше фармацевтические композиции, а также от возраста, веса и состояния здоровья пациента, и, таким образом, может варьироваться у разных пациентов. Подходящую дозу можно регулировать по решению лечащего врача так, что ее можно вводить пациенту один раз или посредством нескольких введений.
В некоторых вариантах осуществления изобретения вектор на основе рекомбинантного безоболочечного вируса содержится в концентрации 1,0*105 - 1,0*1014 вирусных геномов/мл, или 1,0*109 - 1,0*1014 вирусных геномов/мл, или 1,0*109 - 5,0*1013 вирусных геномов/мл, или 1,0*109 - 1,0*1013 вирусных геномов/мл, или (1,0±0,3)*105 вирусных геномов/мл, или (2,0±0,6)*105 вирусных геномов/мл, (5,0±1,5)*105 вирусных геномов/мл, или (1,0±0,3)*106 вирусных геномов/мл, или (2,0±0,6)*106 вирусных геномов/мл, (5,0±1,5)*106 вирусных геномов/мл, или (1,0±0,3)*107 вирусных геномов/мл, или (2,0±0,6)*107 вирусных геномов/мл, (5,0±1,5)*107 вирусных геномов/мл, или (1,0±0,3)*108 вирусных геномов/мл, или (2,0±0,6)*108 вирусных геномов/мл, (5,0±1,5)*108 вирусных геномов/мл, или (1,0±0,3)*109 вирусных геномов/мл, или (2,0±0,6)*109 вирусных геномов/мл, (5,0±1,5)*109 вирусных геномов/мл, или (1,0±0,3)*1010 вирусных геномов/мл, или (2,0±0,6)*1010 вирусных геномов/мл, (5,0±1,5)*1010 вирусных геномов/мл, или (1,0±0,3)*1011 вирусных геномов/мл, или (2,0±0,6)*1011 вирусных геномов/мл, (5,0±1,5)*1011 вирусных геномов/мл, или (1,0±0,3)*1012 вирусных геномов/мл, или (2,0±0,6)*1012 вирусных геномов/мл, (5,0±1,5)*1012 вирусных геномов/мл, или (1,0±0,3)*1013 вирусных геномов/мл, или (2,0±0,6)*1013 вирусных геномов/мл, (5,0±1,5)*1013 вирусных геномов/мл, или (1,0±0,3)*1014 вирусных геномов/мл.
В описанных выше фармацевтических композициях в качестве рекомбинантных безоболочечных вирусов могут быть использованы rAAV, рекомбинантные аденовирусы и другие типы рекомбинантных безоболочечных вирусов.
Вектор на основе рекомбинантного аденовируса может быть получен с использованием любого вида, штамма, серотипа или любой комбинации видов, штаммов или серотипов аденовируса или химерного аденовируса. Серотипы аденовируса человека включают любой из серотипов 2, 4, 5, 7, 11, 26, 34, 35, 36, 48, 49 или 50 или их комбинации, производные, модификации или псевдотипы.
В некоторых вариантах осуществления изобретения вектор на основе рекомбинантного безоболочечного вируса представляет собой вектор на основе rAAV. Он может быть получен с использованием любого штамма, серотипа AAV (например, AAV1, AAV2, AAV3, AAV4, AAV5, AAV6, AAV7, AAV8, AAV9, AAV10, AAV11, AAV12, AAV13, AAV14, AAV15 и AAV16) или любой комбинации штаммов, серотипов (например, вектор на основе rAAV, который включает два или более серотипов); может содержать капсидный белок (капсид) AAV любого серотипа (AAV1, AAV2, AAV3, AAV4, AAV5, AAV6, AAV7, AAV8, AAV9, AAV10, AAV11, AAV12, AAV13, AAV14, AAV15 и AAV16) или их комбинации, производные, модификации или псевдотипы.
В некоторых вариантах осуществления изобретения вектор на основе rAAV содержит капсид AAV5, или AAV6, или AAV9.
В некоторых вариантах осуществления изобретения капсид AAV5, или AAV6, или AAV9 может быть модифицированным.
Вектор на основе rAAV может быть модифицирован генетически и/или химически.
Вектор на основе rAAV может быть генетически модифицирован для создания векторов на основе rAAV с измененными использованием рецептора, антигенностью, эффективностью трансдукции и/или тканевым тропизмом, а также для вставки пептидных лигандов, антител, фрагментов антител, МНС (major histocompatibility complex, главный комплекс гистосовместимости) и/или рецепторов в вирусный капсид. Например, вектор на основе rAAV может быть генетически модифицирован путем введения одной или нескольких аминокислотных мутаций, например, точечных мутаций.
Под «несколькими точечными мутациями» подразумеваются две, три, четыре, пять, шесть, семь, восемь, девять или десять точечных замен.
Особенно предпочтительные варианты включают замены (мутации), которые являются консервативными по природе, т.е. те замены, которые имеют место в семействе аминокислот, которые объединены по их боковым цепям. В частности, аминокислоты обычно делят на четыре семейства: (1) кислые - аспартат и глутамат; (2) основные - лизин, аргинин, гистидин; (3) неполярные - аланин, валин, лейцин, изолейцин, пролин, фенилаланин, метионин, триптофан; и (4) незаряженные полярные - глицин, аспарагин, глутамин, цистеин, серии треонин, тирозин. Фенилаланин, триптофан и тирозин иногда классифицируют как ароматические аминокислоты. Например, достаточно обосновано предсказание о том, что выделенная замена лейцина на изолейцин или валин, аспартата на глутамат, треонина на серии или схожая консервативная замена аминокислоты на структурно родственную аминокислоту не окажет значимого влияния на биологическую активность. Например, полипептид, представляющий интерес, может включать вплоть до приблизительно 5 10 консервативных или неконсервативных аминокислотных замен, при условии, что желаемая функция молекулы остается незатронутой.
Вариант точечных мутаций в последовательностях белков VP1, VP2 или VP3 AAV с помощью аминокислотных замен представляет собой замену, по меньшей мере, одного аминокислотного остатка в белке VP1, VP2 или VP3 AAV на другой аминокислотный остаток.
Консервативные замены показаны в таблице А под заголовком «предпочтительные замены».
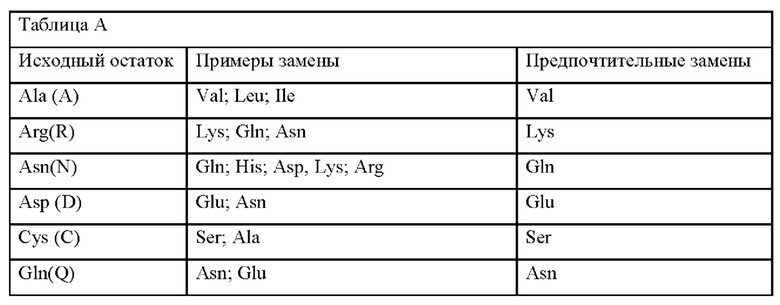
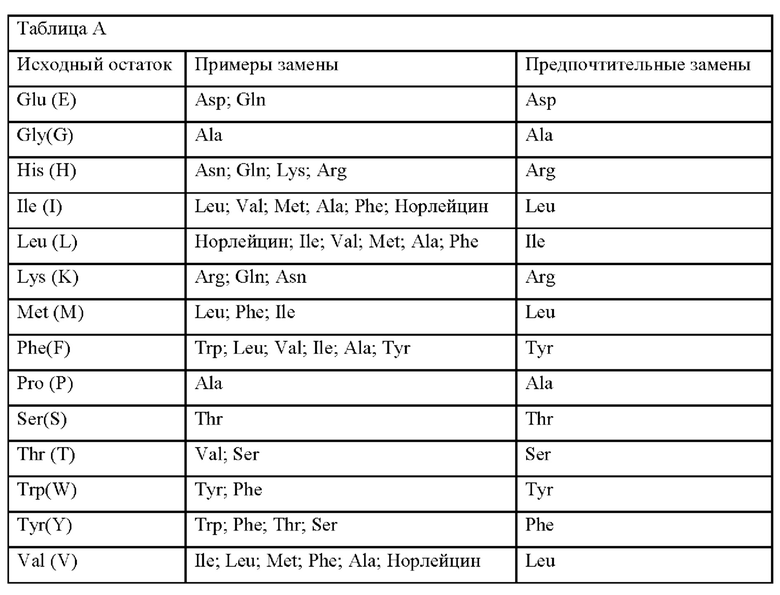
Например, в международной заявке WO 2012/145601 описаны вирионы аденоассоциированного вируса (AAV) с вариантным капсидным белком, где вирионы AAV демонстрируют большую инфекционность ретинальных клеток, когда вводятся интравитреальной инъекцией, по сравнению с AAV дикого типа. В международной заявке WO 2013/158879 описан вектор на основе аденоассоциированного вируса (AAV) для доставки субъекту гетерологичной последовательности нуклеиновой кислоты, содержащей капсидный белок VP1, который содержит одну или несколько замен лизина, где одна замена лизина представляет K137R, где упомянутая замена лизина является эффективной для ингибирования убиквитинилирования упомянутого капсидного белка, и тем самым увеличивается трансдукция упомянутого вектора AAV в клетке-мишени.
Вектор на основе rAAV может быть химически модифицирован для изменения тканевого тропизма. Также химически модифицированные векторы на основе rAAV могут проявлять измененное использование рецептора, антигенность, эффективность трансдукции и/или тканевой тропизм. Для создания химически модифицированных векторов на основе rAAV используются, например, хемоселективные реакции, которые могут быть нацелены на конкретные боковые цепи аминокислот, могут быть использованы для изменения заряда, полярности, гидрофобности и потенциала водородных связей внутри рецепторных связывающих доменов на капсидах AAV.
В некоторых вариантах осуществления изобретения указанная фармацевтическая композиция вектора на основе рекомбинантного безоболочечного вируса по настоящему изобретению предназначена для парентерального введения.
В некоторых вариантах осуществления изобретения указанная фармацевтическая композиция вектора на основе рекомбинантного безоболочечного вируса по настоящему изобретению предназначена для внутриглазного введения, в том числе интравитреального, субретинального или супрахориоидального введения, а также для внутримышечного, внутривенного или подкожного введения.
В некоторых вариантах осуществления изобретения указанная фармацевтическая композиция вектора на основе рекомбинантного безоболочечного вируса по настоящему изобретению может быть введена внутривенно в виде инфузии.
Фармацевтическая композиция вектора на основе рекомбинантного безоболочечного вируса по настоящему изобретению может быть использована после разведения. Для этого необходимое количество композиции из флакона переносят в емкость для инфузий, содержащую стерильный 0,9% раствор натрия хлорида, стерильный 5% раствор декстрозы или другие инфузионные растворы. Приготовленный раствор перемешивают путем осторожного переворачивания емкости для инфузий.
В некоторых вариантах осуществления изобретения субъект лечения или пациент является млекопитающим, предпочтительно человеческим субъектом. Вышеупомянутый субъект может быть мужского или женского пола любого возраста.
Фармацевтические композиции по настоящему изобретению можно хранить в любом подходящем для этого сосуде. Например, стеклянный или полимерный контейнер, флакон, ампула, шприц, картридж или бутылка необходимого объема. Сосуды могут снабжаться дополнительными средствами для введения, например капельницы, автоинжекторы.
Фармацевтическая композиция по данному изобретению может изготавливаться, упаковываться или продаваться в виде единичной стандартной дозы или множества единичных стандартных доз в виде готовой лекарственной формы. Используемый в данном документе термин «единичная стандартная доза» означает дискретное количество фармацевтической композиции, содержащей заранее определенное количество активного ингредиента. Количество активного ингредиента обычно равно дозировке активного ингредиента, который будет вводиться субъекту, или удобной части такой дозировки, например, половине или трети такой дозировки.
Фармацевтические композиции можно вводить в виде одного терапевтического средства или в комбинации с дополнительными терапевтическими средствами по мере необходимости. Таким образом, в одном варианте осуществления предлагаемые способы лечения и/или профилактики используют в комбинации с введением терапевтически эффективного количества другого активного средства. Другое активное средство можно вводить до, в течение или после введения фармацевтических композиций по настоящему изобретению. Другое активное средство можно вводить как часть предлагаемой композиции или, альтернативно, в виде отдельного состава.
Примеры
Для наилучшего понимания изобретения приводятся следующие примеры. Эти примеры приведены только в иллюстративных целях и не должны толковаться как ограничивающие сферу применения изобретения в любой форме.
Хотя вышеупомянутое изобретение было подробно описано путем иллюстрации и примера в целях исключения двусмысленного толкования, специалистам в данной области на основе идей, раскрытых в данном изобретении, будет понятно, что могут быть внесены определенные изменения и модификации без отклонения от сущности и объема прилагаемых вариантов осуществления изобретения.
Методики
1. Определение концентрации гена интереса (GOI) в препарате AAV методом ПЦР. Концентрацию GOI в препарате AAV определяли методом количественной полимеразной цепной реакции, используя прямой, обратный праймер и зонд, коньюгированный с красителем FAM и гасителем BHQ-1. Праймеры подобраны к участку гена, кодирующему белок GOI. В ходе пробоподготовки образец сначала обрабатывали ДНКазой для того, чтобы избавиться от остаточной плазмидной ДНК, затем протеиназой для того, чтобы разрушить капсид. Для построения калибровочной прямой использовали лианер изо ванную плазмиду (соответствующего GOI). Для построения калибровочной прямой зависимости логарифма концентрации от количества циклов (Ct) использовали стандарты с шагом уменьшения концентрации в 10 раз. Концентрацию вирусных геномов/мл (вг/мл) в препарате рассчитывали по калибровочной прямой зависимости логарифма концентрации от Ct.
2. Определение концентрации вирусных частиц методом иммуноферментного анализа.
Определение концентрации частиц вирусных векторов (капсидов аденоассоциированного вируса AAV) осуществляли с помощью иммуноферментного анализа с использованием коммерческих наборов PROGEN AAV5 titration ELIS A, PROGEN AAV6 titration ELISA и PROGEN AAV9 titration ELIS А.
96-луночные планшеты с высоким связыванием покрыты связывающими моноклональными мышиными антителами к капсиду AAV, распознающими конформационный эпитоп конкретного серотипа. Белки капсида AAV связываются с антителами при температурной инкубации, не связавшиеся компоненты образца удаляют с помощью многократной промывки планшета.
В качестве детектирующих антител использовали биотинилированные антитела, которые связываются с белками капсида AAV при температурной инкубации планшета. Не связавшиеся компоненты удаляют с помощью многократной промывки планшета.
Для проявления окраски в лунки планшета вносили стрептавидин, коньюгированный с пероксидазой хрена. Стрептавидин связывается с биотином, не связавшиеся компоненты удаляли с помощью многократной промывки планшета.
В качестве хромогена выступает тетраметилбензидин. При взаимодействии пероксидазы хрена, перекиси водорода и хромогена тетраметилбензидина развивается цветная реакция. Реакцию ИФА останавливали добавлением стоп раствора (1 н H2SO4) и измеряли оптическую плотность растворов в лунках при длине волны 450 нм. Концентрацию частиц вирусных векторов в препарате определяли по калибровочному графику, построенному с использованием данных оптической плотности стандартных растворов с известной концентрацией частиц AAV.
3. Определение функциональной активности препарата на основе рекомбинантного аденоассоциированного вирусного вектора, содержащего ген GFP.
Трансдукционную активность препарата на основе рекомбинантного аденоассоциированного вирусного вектора, содержащего ген GFP, оценивали по экспрессии GFP в трансдуцированных препаратом клетках СНО-К1.
Для трансдукции в день анализа клетки СНО-К1 высевали в 24-луночные планшеты в ростовой среде с антибиотиком (СКО-среда для количественного определения) из расчета 1×104 клеток на см2 (19000 клеток на лунку) и инкубировали при температуре+37°С в атмосфере с 5% С02 в течение 4-8 ч для прикрепления клеток к поверхности пластика. Затем вносили в лунки с клетками испытуемые образцы в трех дозах по три повтора на каждую. Дозировки препарата (MOI) для каждого серотипа AAV предварительно подбирали таким образом, чтобы получить после трансдукции порядка 5, 10 и 20% GFP-позитивных клеток, соответственно. Объем препарата, необходимый для трансдукции одной лунки, рассчитывали по следующей формуле:
У=MOI×S×КС,
где V необходимый объем препарата на одну лунку (мл), S площадь одной лунки (см2), MOI - необходимая доза препарата - множественность инфекции (multiplicity of infection) (вг/кл), К - плотность засева клеток в лунках (кл/см2), С - концентрация геном-содержащих капсидов в препарате (вг/мл).
Инкубировали планшеты с трансдуцированными клетками в CO2 инкубаторе (5% CO2, +37°С) в течение 2-3 дней. По истечении срока инкубации из лунок отбирали культуральную жидкость, промывали клетки раствором Хенкса и снимали клетки с пластика с помощью раствора TrypLE (по 150 мкл/лунку). После открепления клеток от пластика вносили в лунки раствор Хенкса (1:1 с TrypLE), собирали клетки в микропробирки на 1,5 мл и центрифугировали 5 мин при 300g. Осадок клеток ресуспендировали в 150 мкл раствора Хенкса. Вносили к каждому образцу, кроме 1 лунки изотопического контроля, по 50 мкл рабочего раствора красителя для определения жизнеспособных клеток в растворе Хенкса и инкубировали клетки 20 мин в темноте при комнатной температуре. Окрашенные клетки центрифугировали 5 минут при 300 g, аккуратно отбирали надосадочную жидкость и добавляли по 100 мкл фиксирующего буфера BD Cytofix. Клетки ресуспендировали и переносили весь объем получившейся взвеси клеток в 96-луночный планшет с V-образным дном для проточного цитометра, инкубировали планшет с клетками 20 мин в темноте при комнатной температуре. По истечении времени инкубации центрифугировали планшет 5 мин при 1200 об/мин, отбирали фиксирующий буфер и промывали клетки Stain Buffer (PBS с 0,1% Натрия азид и 0,5% БСА) по 100 мкл/лунку. Снова центрифугировали и отбирали буфер, после чего вносили по 150 мкл/лунку Stain Buffer и тщательно ресуспендировали клетки.
Анализировали клетки на проточном цитометре. Оценивали жизнеспособность клеток и экспрессию GFP. Рассчитывали для каждой дозы препарата значение ФА или TU (transduction unit)/мл по следующей формуле:
TU=P×NV×D,
где Р - количество GFP-позитивных жизнеспособных клеток в процентах, N - количество исходно посеянных клеток (N=S×K), V - объем внесенного препарата на лунку (мл), D фактор предразведения препарата.
За конечный результат принимали среднее значение TU, рассчитанное по трем дозам образца.
4. Определение концентрации вирусных частиц методом эксклюзионной высокоэффективной жидкостной хроматографии.
Определение концентрации вирусных частиц проводили путем измерения площади пиков испытуемых и стандартов на высокоэффективном жидкостном хроматографе Agilent с УФ-детектором. Длина волны детектора - 260 и 280 нм.
Колонка: TSK-gel G3000SWXL 7,8×300 мм, 5 мкм, 300  .
.
Фаза А: 0,1 М Na2SO4 в 0,1 М фосфатном буфере, рН=6,7.
Объем ввода: 30 мкл.
Скорость потока: 1 мл/мин.
Температура колонки: 35°С.
Длина волны детектора: 260 нм (4 нм), референсная длина волны (360 нм, bw 100 нм); 280 нм (4 нм), референсная длина волны (360 нм, bw 100 нм). Режим элюирования: изократический. Время хроматографирования: 15 мин.
На полученных хроматограммах идентифицировали пик при длине волны 280 и 260 нм и определяли его площадь. Исходя из полученных данных пиков на хроматограммах калибровочных растворов строили уравнение линейной регрессии для каждой из длин волн. Используя уравнение линейной регрессии при длине волны 280 нм, вычисляли концентрацию вирусных частиц.
Метод эксклюзионной высокоэффективной жидкостной хроматографии использовали как ортогональный метод для определения концентрации вирусных частиц.
5. Получение фармацевтических композиций.
Получение образцов с целевым содержанием вирусных геномов осуществляли в концентрационных ячейках Stirred Cell (Millipore) под давлением. Для этого раствор, содержащий вирусные частицы, в исходном составе помещали в емкость для диафильтрации, после чего вносили в ячейку не менее чем 10 кратный объем водного раствора с целевым составом, включающим буферные, осмотические агенты и, если необходимо, дополнительные водорастворимые стабилизаторы. По завершении процесса диафильтрации раствор концентрировали до оптической плотности, превышающей целевую, выгружали из установки, определяли концентрацию вирусных геномов методом ПЦР. Затем к образцу вносили соответствующий раствор вспомогательных веществ для получения раствора с целевым содержанием вирусных геномов.
Также получение образцов растворов, содержащих вирусные частицы, проводили в кассетах Pellicon (Millipore) в режиме тангенциального потока. Для этого раствор в исходном составе помещали в емкость для диафильтрации, после чего к системе подключали подачу не менее чем 10 кратного объема раствора с целевым составом, содержащим буферные, осмотические агенты и, если необходимо, дополнительные водорастворимые стабилизаторы. Допускается внесение концентрата осмотических агентов и водорастворимых стабилизаторов после завершения диафильтрации. По завершении процесса диафильтрации раствор концентрировали до оптической плотности, превышающей целевую, выгружали из системы и определяли точные значения оптической плотности и концентрации вирусных геномов. Затем к образцу вносили соответствующий раствор вспомогательных веществ для получения раствора с целевым содержанием вирусных геномов.
Перед асептическим наполнением в конечный контейнер (например, стеклянный или полимерный сосуд, флакон или шприц) раствор фильтровали в асептичных условиях через мембрану с размером пор 0.22 мкм.
6. Исследование стабильности.
Исследуемые образцы разделяли на несколько аликвот и помещали в отдельные стерильные стеклянные флаконы: по 1 флакону на каждую контрольную точку устанавливали в термостат, инкубировали при 25°С в течение 4 недель и (5±3)°С в течение 6 месяцев, периодически отбирая контрольные точки согласно плану. При отборе контрольных точек и после завершения хранения флаконы перемещали из термостата или холодильника и передавали на анализ.
7. Термостресс.
Исследуемые образцы разделяли на три аликвоты и помещали в стеклянные флаконы: по одному флакону на каждый состав откладывали в холодильник на хранение при (5±3)°С, остальные устанавливали в термостат и инкубировали при указанной температуре в течение указанного времени. При отборе контрольных точек или после окончания прогрева флаконы перемещали из термостата, выдерживали при комнатной температуре около 15 мин и передавали на анализ.
8. Шейкирование.
Исследуемые образцы разделяли на две аликвоты и помещали в стеклянные флаконы: по одному флакону на каждый состав откладывали в холодильник на хранение при температуре (5±3)°С, остальные устанавливали в термошейкер и шейкировали со скоростью 800 об/мин при температуре (5±3)°С в течение указанного времени. При отборе контрольных точек или после окончания стресса флаконы перемещали из термошейкера и передавали на анализ.
9. Замораживание и оттаивание.
Исследуемые образцы разделяли на две аликвоты и помещали в стеклянные флаконы: устанавливали в морозильную камеру и хранили при температуре минус 20°С и ниже. Большинство генотерапевтических продуктов хранят при температуре не выше минус 70°С, температура не выше минус 20°С выбрана в качестве «худшего случая», так как при таком способе хранения образец находится при температуре выше температуры стеклования, что дополнительно оказывает на образец стрессовое воздействие, аналогичное стрессовому воздействию, происходящему в процессе заморозки. После полной заморозки образца (через 8 16 часов) флаконы перемещали из морозильной камеры, выдерживали при комнатной температуре до полного оттаивания содержимого и при необходимости повторяли цикл заморозки-разморозки. Передавали на анализ образцы после указанного количества циклов замораживания-оттаивания.
10. Изотермическое исследование методом динамического светорассеяния. Анализ коллоидной стабильности исследуемых образцов осуществляли с использованием прибора DynaPro Plate Reader П. В лунки 384-луночного планшета из черного пластика с прозрачным дном помещали 35 мкл каждого исследуемого образца, после этого планшет заклеивали термоустойчивой самоклеящейся пленкой. Закрытый планшет центрифугировали в течение 3 минут при скорости 3000 об/мин и температуре не менее 20°С. Измерение проводили при указанной температуре в течение указанного времени.
Параметры измерения:
• Интенсивность рассеянного света при 9 (угол измерения рассеянного света) = 158°.
• Число измерений на один повтор - 3.
• Время одного измерения - 5 с.
Временной тренд анализировали с использованием ПО Dynamics (Wyatt, США).
11. Определение температуры агрегации.
Температуру агрегации определяли с использованием оборудования DynaPro Plate Reader П. В лунки 384-луночного планшета из черного пластика с прозрачным дном помещали 35 мкл каждого исследуемого образца, после этого планшет заклеивали термоустойчивой самоклеящейся пленкой. Закрытый планшет центрифугировали в течение 3 минут при скорости 3000 об/мин и температуре не менее 20°С.
Параметры измерения:
• Начальная температура измерения 25°С.
• Интенсивность рассеянного света при θ = 158°.
• Число измерений на один повтор - 3.
• Время одного измерения - 5 с.
• Скорость нагрева - 0,15°С/мин.
• Конечная температура 80°С.
Температурный тренд и точку агрегации определяли с использованием ПО Dynamics (Wyatt, США).
12. Определение температуры плавления белков капсидов.
Температуру плавления белков капсидов рекомбинантных аденоассоциированных вирусов определяли методом дифференциальной сканирующей флуорометрии. К 45 мкл исследуемого образца добавляли 5 мкл разбавленного флуоресцентного красителя SyproOrange (Thermo Fisher Scientific, США), специфически связывающегося с гидрофобными участками белковой молекулы, до конечного разведения красителя в 1000 раз. Полученную смесь переносили в 96-луночный планшет для ПЦР, заклеивали самоклеящейся термоустойчивой пленкой, центрифугировали в течение 3 минут при скорости 3000 об/мин и устанавливали в амплификатор с флуорометрическим детектором. Нагрев проводили от 25 до 85°С, шаг изменения температуры 0,15°С, в процессе нагрева детектировали флуоресценцию в соответствии с инструкцией производителя. Для обработки результатов использовали программное обеспечение CFX Manager (Bio-Rad, США).
13. Определение температуры высвобождения ДНК.
Температуру высвобождения ДНК из капсидов векторов на основе рекомбинантных аденоассоциированных вирусов определяли методом дифференциальной сканирующей флуорометрии. К 45 мкл исследуемого образца добавляли 5 мкл разбавленного флуоресцентного красителя SybrGOLD (Thermo Fisher Scientific, США), специфически связывающегося с нуклеиновыми кислотами, до конечного разведения красителя в 2000 раз. Полученную смесь переносили в 96-луночный планшет для ПЦР, заклеивали самоклеящейся термоустойчивой пленкой, центрифугировали в течение 3 минут при скорости 3000 об/мин и устанавливали в амплификатор с флуорометрическим детектором. Нагрев проводили от 25 до 85°С, шаг изменения температуры 0,15°С, в процессе нагрева детектировали флуоресценцию в соответствии с инструкцией производителя. Для обработки результатов использовали программное обеспечение CFX Manager (Bio-Rad, США).
14. Определение гомогенности образцов методом динамического светорассеяния.
Гомогенность образцов определяли методом динамического светорассеяния с использованием оборудования DynaPro Plate Reader П. В лунки 384-луночного планшета из черного пластика со прозрачным дном помещали 35 мкл каждого исследуемого образца, после этого планшет заклеивали термоустойчивой самоклеящейся пленкой. Закрытый планшет центрифугировали в течение 3 минут при скорости 3000 об/мин и температуре не менее 20°С.
Параметры измерения:
• Температура измерения 25°С.
• Выдерживание при температуре перед началом измерения 1 минута.
• Интенсивность рассеянного света при θ=158°.
• Число измерений на один повтор 10.
• Время одного измерения - 5 с.
Размер и полидисперсность образцов определяли с использованием ПО Dynamics (Wyatt, США).
Пример 1. Выбор состава вспомогательных веществ.
Целью исследования является оценка возможности хранения препаратов векторов на основе рекомбинантных аденоассоциированных вирусов в жидкой форме при температурном режиме (5±3)°С, а также выбор оптимального состава вспомогательных веществ для дальнейшего исследования стабильности препаратов различных серотипов.
Раствор вспомогательных веществ должен обеспечивать стабильность вирусного вектора в предполагаемых условиях хранения.
В скрининг были взяты следующие вспомогательные вещества: трис(гидроксиметил)аминометан (буферный агент, поддержание необходимого уровня рН), хлорид натрия (стабилизатор, осмолитик), хлорид магния гексагидрат (стабилизатор), трегалозы дигидрат (стабилизатор, осмолитик, криопротектор), полоксамер р 188 (солюбилизатор), L-гистидин (буферный агент, поддержание необходимого уровня рН, стабилизатор), L-аргинин (буферный агент, поддержание необходимого уровня рН, стабилизатор), L-пролин (стабилизатор).
Составы вспомогательных веществ исследуемых фармацевтических композиций представлены в таблице 1.

Исследование проводили для образцов, содержащих около 1*1010 вг/мл векторов на основе rAAV 5 серотипа, несущего GOI. Образцы с различным составом вспомогательных веществ получали методом диафильтрации в соответствии с методикой 5. Для выявления влияния различных вспомогательных веществ на стабильность векторов образцы в исследуемых составах подвергали стрессовым воздействиям в соответствии с методиками 7, 8, 9. Образцы до и после стрессирования анализировали в соответствии с методиками 1, 2, 3, 4. Результаты представлены в таблицах 2-5.
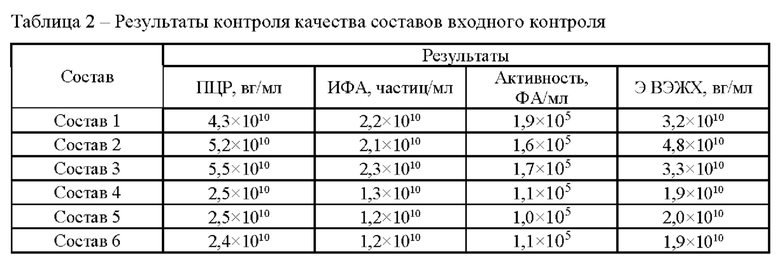
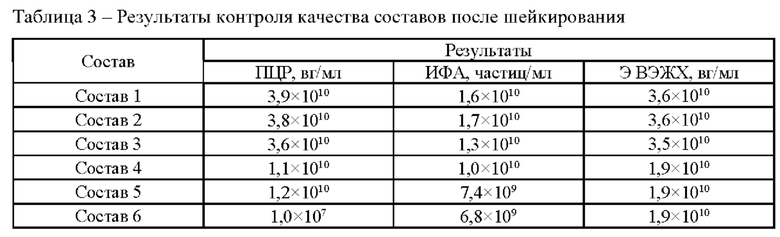
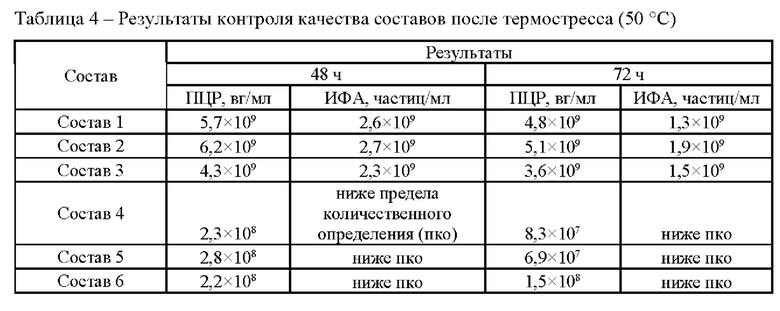
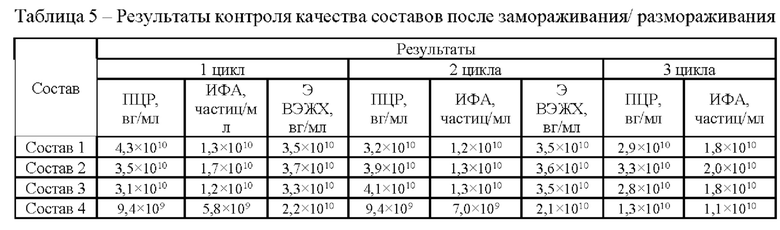

По результатам панели стрессовых воздействий неожиданно было выявлено положительное влияние использования гистидин-аргининового буферного раствора на стабильность AAV. Неожиданно было обнаружено, что состав, включающий гистидин-аргининовый буферный раствор показал высокую термическую стабильность. Для фармацевтических композиций на основе данной буферной системы наблюдали наименьшее падение концентрации векторных частиц при анализе методами ИФА и ПЦР после термостресса при 50°С.
Также для состава 2, представленного в таблице 1, были проведены исследования ускоренной стабильности в соответствии с методикой 6. Образцы в контрольных точках анализировали в соответствии с методиками 1, 2, 3. Результаты анализа представлены в таблицах 6-8.


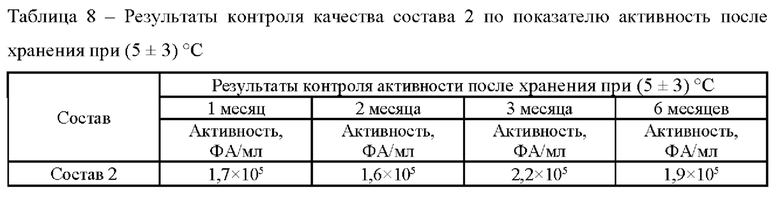
В соответствии с полученными данными стабильности в течение 6 месяцев при температуре (5±3)°С и в течение 1 месяца при температуре (25±2)°С состав 2 показал хорошую стабильность течение всего срока хранения.
Пример 2. Исследование фармацевтических композиций для векторов на основе рекомбинантного аденоассоциированного вируса 9 серотипа.
В ходе исследования были использованы 5 фармацевтических композиций, представленных в таблице 9 и содержащих материал вектора на основе рекомбинантного аденоассоциированного вируса 9 серотипа, состоящий преимущественно из пустых капсидов, в двух концентрациях: 1*1012 и 1*1013 частиц/мл. Исследуемые образцы были получены методом диафильтрации в соответствии с методикой 5.
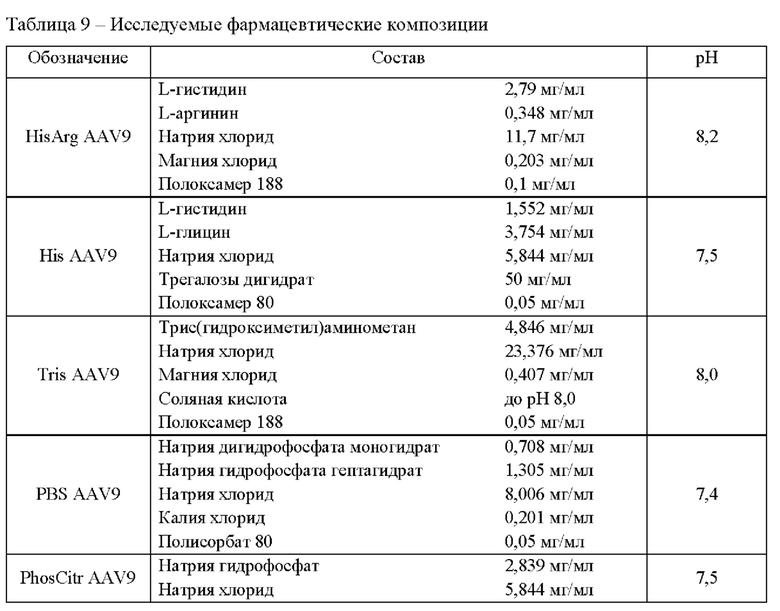

Исследование коллоидной стабильности при повышенной температуре.
Для исследования коллоидной стабильности определяли температуру агрегации векторов на основе рекомбинантных аденоассоциированных вирусных частиц в 5 составах в соответствии с методикой 11. Результаты представлены в таблице 10.
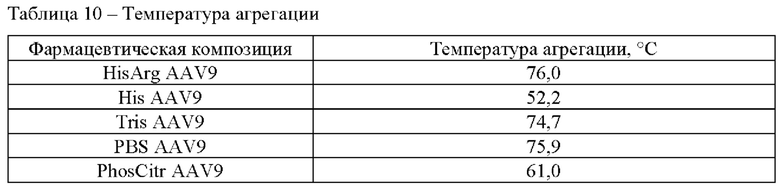
Также исследование термической стабильности проводили методом термостресса в соответствии методикой 7. До и после воздействия температуры 65°С в течение 96 часов анализировали гомогенность образцов методом динамического светорассеяния в соответствии с методикой 14. Результаты представлены в таблице 11.
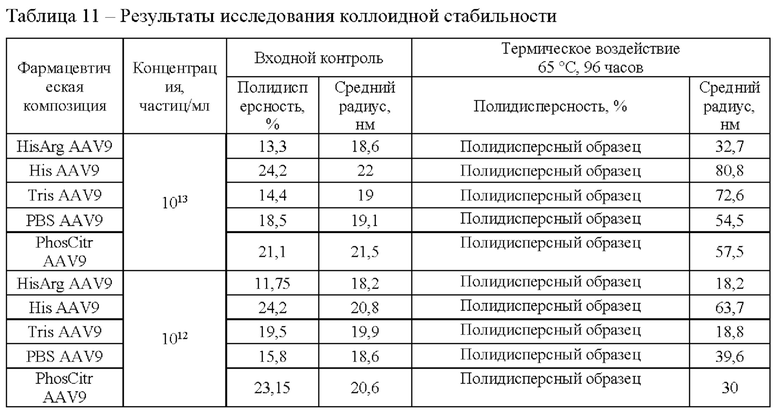
Помимо этого, контролировали образцы в процессе воздействия повышенной температуры 65°С в течение 120 мин методом динамического светорассеяния в соответствии с методикой 10. Данные представлены на Фиг. 1.
Фармацевтическая композиция HisArg AAV9 продемонстрировала наилучшие свойства с точки зрения коллоидной стабильности при повышенной температуре. Данная фармацевтическая композиция продемонстрировала наиболее высокую температуру агрегации 76,0°С, минимальный средний радиус частиц в процессе воздействия повышенной температуры, а также после окончания термического воздействия.
Исследование коллоидной стабильности при многократном замораживании-оттаивании.
Исследование влияния многократного замораживания-оттаивания на коллоидную стабильность векторов на основе рекомбинантных аденоассоциированных вирусных частиц проводили в соответствии с методикой 9 при двух концентрациях исследуемых образцов. До и после стрессового воздействия анализировали гомогенность образцов методом динамического светорассеяния в соответствии с методикой 14. Результаты представлены в таблице 12.
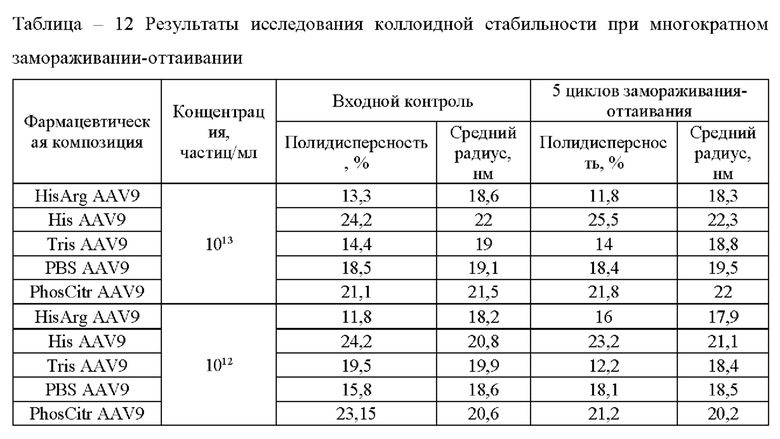
Фармацевтическая композиция HisArg AAV9 обладает минимальным радиусом и уровнем полидисперсности, что свидетельствует о сниженном уровне агрегации при замораживании в сравнении с другими растворами.
Пример 3. Исследование фармацевтических композиций для векторов на основе рекомбинантного аденоассоциированного вируса 6 серотипа.
В ходе исследования были использованы 5 фармацевтических композиций, содержащих материал вектора на основе rAAV 6 серотипа, несущего GOI. Перечень исследуемых фармацевтических композиций представлен в таблице 13. Исследуемые образцы получали методом диафильтрации в соответствии с методикой 5.
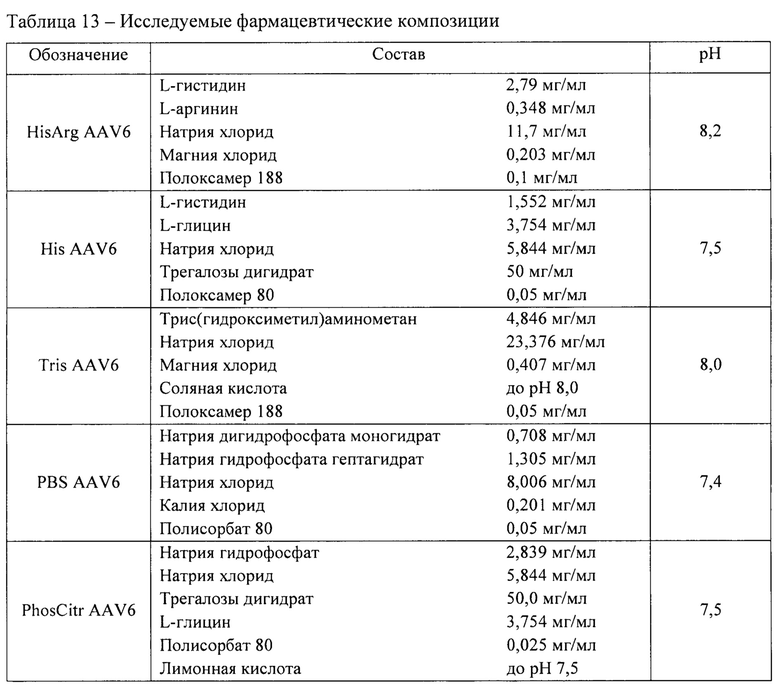
Исследование коллоидной стабильности при повышенной температуре.
Для исследования коллоидной стабильности определяли температуру агрегации векторов на основе рекомбинантных аденоассоциированных вирусных частиц в 5 составах в соответствии с методикой 11. Использовали фармацевтические композиции с концентрацией вирусных векторов 1 *1012 вг/мл. Результаты представлены в таблице 14. Результаты анализировали с использованием инструмента «heat-mapping» в ПО ((Microsoft Excel».

Фармацевтическая композиция HisArg AAV6 продемонстрировала наилучшие свойства с точки зрения коллоидной стабильности при повышенной температуре. Данная фармацевтическая композиция продемонстрировала наиболее высокую температуру агрегации - 72,9°С.
Исследование конформационной и химической стабильности фармацевтической композиции HisArg AAV6.
Исследование конформационной и химической стабильности проводили с использованием материала векторов на основе рекомбинантного аденоассоциированного вируса 6 серотипа с концентрацией 1 *1012 вг/мл путем определения температуры денатурации белков капсидов в соответствий с методикой 12 и температуры высвобождения ДНК из капсидов в соответствии с методикой 13. Результаты представлены в таблице 15.

Фармацевтическая композиция HisArg AAV6 продемонстрировала высокую конформационную и химическую стабильность: высокую температуру высвобождения ДНК и высокую температуру денатурации белков капсидов.
Пример 4. Исследование фармацевтических композиций для векторов на основе рекомбинантного аденоассоциированного вируса 5 серотипа.
В ходе исследования были использованы 5 фармацевтических композиций, содержащих материал вектора на основе rAAV 5 серотипа, несущего GOI. Перечень исследуемых фармацевтических композиций представлен в таблице 16. Исследуемые образцы получали методом диафильтрации в соответствии с методикой 5.
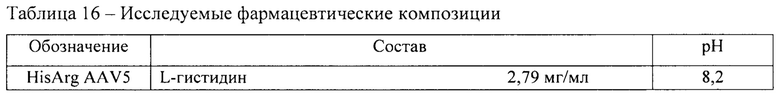
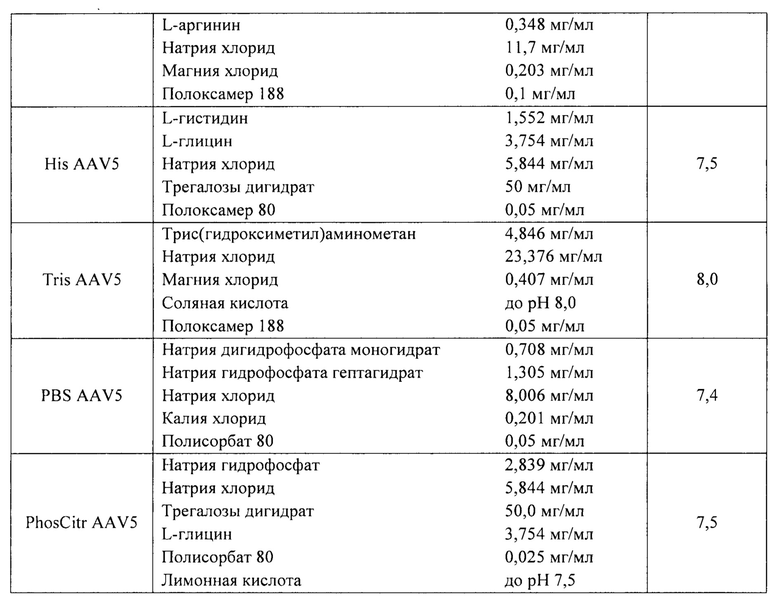
Исследование коллоидной стабильности при повышенной температуре.
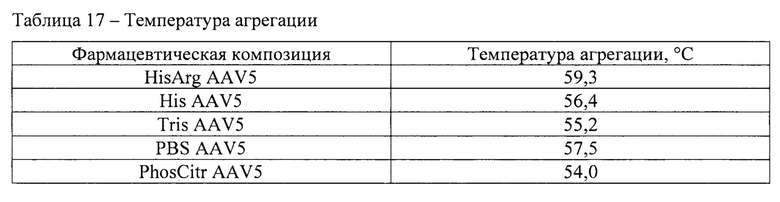
Для исследования коллоидной стабильности определяли температуру агрегации рекомбинантных аденоассоциированных вирусных частиц в 5 составах в соответствии с методикой 11. Использовали фармацевтические композиции с концентрацией вирусных векторов 1012 вг/мл. Результаты представлены в таблице 17.
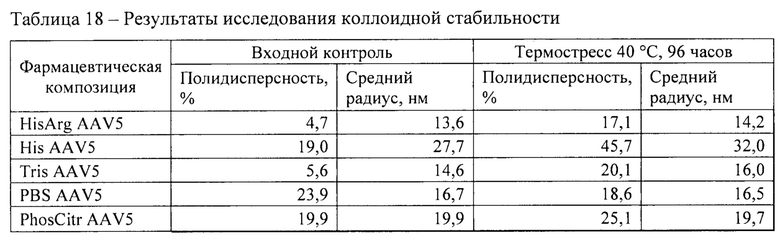
Также исследование термической стабильности проводили методом термостресса в соответствии методикой 7. До и после воздействия температуры 40°С в течение 96 часов анализировали гомогенность образцов методом динамического светорассеяния в соответствии с методикой 14. Результаты представлены в таблице 18.
Помимо этого, контролировали образцы в процессе воздействия повышенной температуры 40°С в течение 200 мин методом динамического светорассеяния в соответствии с методикой 10. Данные представлены на Фиг. 2.
Фармацевтическая композиция HisArg AAV5 продемонстрировала наилучшие свойства с точки зрения коллоидной стабильности при повышенной температуре. Данная композиция продемонстрировала наиболее высокую температуру агрегации - 59,3°С, минимальный средний радиус частиц в процессе воздействия повышенной температуры, а также минимальный средний радиус и полидисперсность после термического воздействия.
Исследование коллоидной стабильности при многократном замораживании-оттаивании.
Исследование влияния многократного замораживания-оттаивания на коллоидную стабильность рекомбинантных аденоассоциированных вирусных частиц проводили в соответствии с методикой 9. До и после стрессового воздействия анализировали гомогенность образцов методом динамического светорассеяния в соответствии с методикой 14. Результаты представлены в таблице 19.
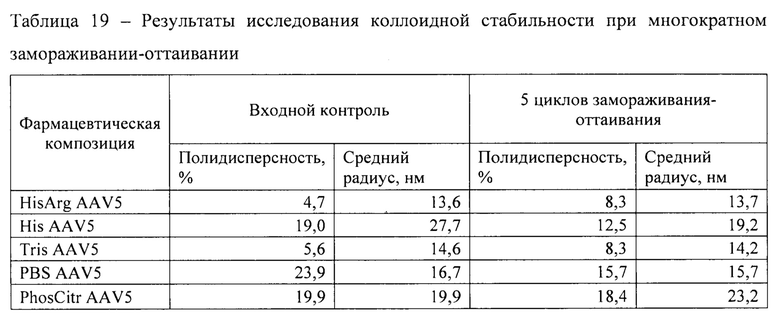
Фармацевтическая композиция HisArg AAV5 продемонстрировала минимальный размер и полидисперсность среди исследованных образцов.
Исследование конформационной и химической стабильности.
Исследование конформационной и химической стабильности проводили с использованием материала на основе рекомбинантного аденоассоциированного вируса 5 серотипа с концентрацией 1*1013 вг/мл путем определения температуры денатурации белков капсидов в соответствии с методикой 12 и температуры высвобождения ДНК из капсидов в соответствии с методикой 13. Результаты представлены в таблице 20.

Фармацевтическая композиция HisArg AAV5 продемонстрировала наиболее высокую температуру высвобождения ДНК, что свидетельствует о его высоких стабилизирующих свойствах. Фармацевтическая композиция HisArg AAV5 также продемонстрировала высокую температуру денатурации белков капсидов - 87,0°С.
Пример 5. Исследование влияния состава вспомогательных веществ на склонность векторов на основе рекомбинантных аденоассоциированных вирусов к высвобождению ДНК.
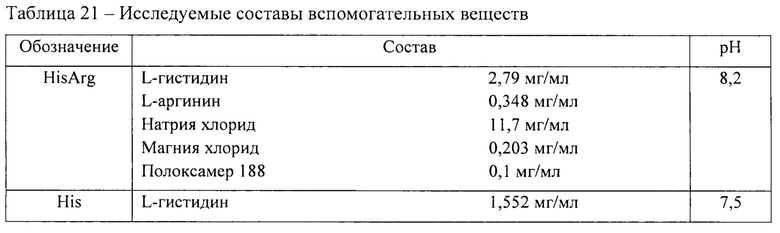
Для исследования влияния фармацевтической композиции на склонность к высвобождению ДНК из капсида были использованы две фармацевтические композиции, представленные в таблице 21. Данные составы продемонстрировали лучшие результаты при исследовании рекомбинантных аденоассоциированных частиц серотипа 5 в концентрации 1*1013 вг/мл.

Исследование проводили с использованием материала векторов на основе rAAV 2, 5, 6, 8, 9 серотипов, несущих GOI, с концентрацией 1*1012 вг/мл. Исследуемые образцы были получены методом диафильтрации в соответствии с методикой 5. Анализ проводили в соответствии с методикой 13.
Для всех исследованных векторов на основании аденоассоциированных вирусных
частиц различных серотипов использование фармацевтической композиции:
привело к увеличению температуры высвобождения ДНК по сравнению с альтернативной фармацевтической композицией на основе гистидиновой буферной системы, что свидетельствует о лучшей стабильности к сохранению ДНК внутри капсида исследуемых объектов в данном составе.
Разработанные композиции могут быть применимы для аденоассоциированных и других типов безоболочечных вирусов.
| название | год | авторы | номер документа |
|---|---|---|---|
| Выделенный модифицированный белок VPI капсида аденоассоциированного вируса 5 серотипа (AAV5), капсид и вектор на его основе | 2021 |
|
RU2820088C1 |
| Выделенный модифицированный белок VP1 капсида аденоассоциированного вируса 5 серотипа (AAV5), капсид и вектор на его основе | 2019 |
|
RU2751592C2 |
| СПОСОБЫ ЛЕЧЕНИЯ ФЕНИЛКЕТОНУРИИ | 2019 |
|
RU2788484C2 |
| АДЕНОАССОЦИИРОВАННЫЙ ВИРУСНЫЙ ВЕКТОР, СОСТОЯЩИЙ ИЗ БЕЛКОВ КАПСИДА РНР.В, НУКЛЕИНОВОЙ КИСЛОТЫ, КОДИРУЮЩЕЙ БЕЛОК SMN, И ЕГО ПРИМЕНЕНИЕ | 2022 |
|
RU2833225C2 |
| Кодон-оптимизированная нуклеиновая кислота, которая кодирует белок фактора свёртывания крови IX, и ее применение | 2021 |
|
RU2831751C2 |
| ВЕКТОР АДЕНОАССОЦИИРОВАННОГО ВИРУСА | 2015 |
|
RU2743382C2 |
| МАСШТАБИРУЕМЫЕ СПОСОБЫ ПОЛУЧЕНИЯ РЕКОМБИНАНТНОГО ВЕКТОРА НА ОСНОВЕ АДЕНОАССОЦИИРОВАННОГО ВИРУСА (AAV) В СИСТЕМЕ БЕССЫВОРОТОЧНОЙ СУСПЕНЗИОННОЙ КУЛЬТУРЫ КЛЕТОК, ПОДХОДЯЩЕГО ДЛЯ КЛИНИЧЕСКОГО ПРИМЕНЕНИЯ | 2016 |
|
RU2766583C2 |
| СПОСОБ ПОЛУЧЕНИЯ ЧАСТИЦ РЕКОМБИНАНТНОГО АДЕНОАССОЦИИРОВАННОГО ВИРУСНОГО ВЕКТОРА (rAAV) | 2017 |
|
RU2768045C2 |
| ПОЛНОСТЬЮ МАСШТАБИРУЕМЫЙ СПОСОБ ПРОИЗВОДСТВА rAAV НА ОСНОВЕ КОЛОНОК | 2017 |
|
RU2754467C2 |
| СПОСОБЫ И КОМПОЗИЦИИ ДЛЯ ЛЕЧЕНИЯ АМИЛОИДНЫХ ОТЛОЖЕНИЙ | 2013 |
|
RU2673484C2 |
Настоящее изобретение относится к области фармацевтики, генной терапии и медицины, а именно к фармацевтическим композициям вектора на основе рекомбинантного безоболочечного вируса, в частности рекомбинантного аденоассоциированного вируса (rAAV), которые могут быть использованы для лечения и профилактики различных заболеваний. Композиции обладают повышенной стабильностью. 45 з.п. ф-лы, 2 ил., 22 табл., 5 пр.
1. Фармацевтическая композиция вектора на основе рекомбинантного безоболочечного вируса на основе rAAV, содержащая:
2. Фармацевтическая композиция по п. 1, где гистидин содержится в концентрации 2,3–3,2 мг/мл.
3. Фармацевтическая композиция по п. 1, где гистидин содержится в концентрации 2,6–3,0 мг/мл.
4. Фармацевтическая композиция по п. 1, где гистидин содержится в концентрации 2,7–2,8 мг/мл.
5. Фармацевтическая композиция по п. 1, где аргинин содержится в концентрации 0,28–0,416 мг/мл.
6. Фармацевтическая композиция по п. 1, где аргинин содержится в концентрации 0,3–0,396 мг/мл.
7. Фармацевтическая композиция по п. 1, где аргинин содержится в концентрации 0,340–0,350 мг/мл.
8. Фармацевтическая композиция по п. 1, где натрия хлорид содержится в концентрации 9,5–13,5 мг/мл.
9. Фармацевтическая композиция по п. 1, где натрия хлорид содержится в концентрации 10,5–12,5 мг/мл.
10. Фармацевтическая композиция по п. 1, где натрия хлорид содержится в концентрации 11,0–12,0 мг/мл.
11. Фармацевтическая композиция по п. 1, где магния хлорид содержится в концентрации 0,16–0,35 мг/мл.
12. Фармацевтическая композиция по п. 1, где магния хлорид содержится в концентрации 0,18–0,25 мг/мл.
13. Фармацевтическая композиция по п. 1, где магния хлорид содержится в концентрации 0,200–0,210 мг/мл.
14. Фармацевтическая композиция по п. 1, где поверхностно-активное вещество содержится в концентрации 0,01–0,5 мг/мл.
15. Фармацевтическая композиция по п. 1, где поверхностно-активное вещество содержится в концентрации 0,01–0,2 мг/мл.
16. Фармацевтическая композиция по п. 1, где поверхностно-активное вещество содержится в концентрации 0,03–0,15 мг/мл.
17. Фармацевтическая композиция по п. 1, содержащая:
18. Фармацевтическая композиция по п. 1, содержащая:
вирусных геномов/мл
19. Фармацевтическая композиция по п. 1, содержащая:
20. Фармацевтическая композиция по п. 19, где гистидин содержится в концентрации 2,79 мг/мл.
21. Фармацевтическая композиция по п. 1, где аргинин содержится в концентрации 0,348 мг/мл.
22. Фармацевтическая композиция по п. 1, где натрия хлорид содержится в концентрации 11,7 мг/мл.
23. Фармацевтическая композиция по п. 1, где магния хлорид содержится в концентрации 0,203 мг/мл.
24. Фармацевтическая композиция по п. 1, где поверхностно-активное вещество содержится в концентрации 0,05 мг/мл или 0,1 мг/мл.
25. Фармацевтическая композиция по п. 1, содержащая:
26. Фармацевтическая композиция по п. 1, содержащая:
27. Фармацевтическая композиция по п. 1, где магния хлорид представляет собой магния хлорида гексагидрат.
28. Фармацевтическая композиция по п. 1, где поверхностно-активное вещество представляет собой полоксамер 188.
29. Фармацевтическая композиция по п. 1, содержащая:
30. Фармацевтическая композиция по п. 1, содержащая:
31. Фармацевтическая композиция по п. 1, содержащая:
32. Фармацевтическая композиция по п. 1, содержащая:
33. Фармацевтическая композиция по п. 1, содержащая:
34. Фармацевтическая композиция по п. 1, содержащая:
35. Фармацевтическая композиция по п. 1, где гистидин представляет собой L-гистидин.
36. Фармацевтическая композиция по п. 1, где аргинин представляет собой L-аргинин.
37. Фармацевтическая композиция по п. 1, где фармацевтическая композиция имеет pH 7,0–9,0.
38. Фармацевтическая композиция по п. 1, где фармацевтическая композиция имеет pH 7,7–8,7.
39. Фармацевтическая композиция по п. 1, где фармацевтическая композиция имеет pH 7,5–8,5.
40. Фармацевтическая композиция по п. 1, где фармацевтическая композиция имеет pH 8,2.
41. Фармацевтическая композиция по п. 1, где вектор на основе рекомбинантного безоболочечного вируса на основе rAAV содержится в концентрации 1,0*109–1,0*1013 вирусных геномов/мл.
42. Фармацевтическая композиция по п. 1, где вектор на основе рекомбинантного безоболочечного вируса содержится в концентрации (1,0 ± 0,3)*109 вирусных геномов/мл, (2,0 ± 0,6)*109 вирусных геномов/мл, (5,0 ± 1,5)*109 вирусных геномов/мл, (1,0 ± 0,3)*1010 вирусных геномов/мл, (2,0 ± 0,6)*1010 вирусных геномов/мл, (5,0 ± 1,5)*1010 вирусных геномов/мл, (1,0 ± 0,3)*1011 вирусных геномов/мл, (2,0 ± 0,6)*1011 вирусных геномов/мл, (5,0 ± 1,5)*1011 вирусных геномов/мл, (1,0 ± 0,3)*1012 вирусных геномов/мл, (2,0 ± 0,6)*1012 вирусных геномов/мл, (5,0 ± 1,5)*1012 вирусных геномов/мл, (1,0 ± 0,3)*1013 вирусных геномов/мл, (2,0 ± 0,6)*1013 вирусных геномов/мл, (5,0 ± 1,5)*1013 вирусных геномов/мл или (1,0 ± 0,3)*1014 вирусных геномов/мл.
43. Фармацевтическая композиция по пп. 1-42, где поверхностно-активное вещество представляет собой полоксамер 188, полисорбат 20, полисорбат 80.
44. Фармацевтическая композиция по пп. 1-42, где вектор на основе rAAV содержит капсид AAV5 серотипа, AAV6 серотипа или AAV9 серотипа.
45. Фармацевтическая композиция по п. 44, где капсид AAV5 серотипа, AAV6 серотипа или AAV9 серотипа может быть модифицированным.
46. Фармацевтическая композиция по любому из пп. 1–45, которая является пригодной для лиофилизации.
| US 10722470 B2, 2020.07.28 | |||
| US 6225289 B1, 2001.05.01 | |||
| WO 2005118792 A1, 2005.12.15 | |||
| US 9051542 B2, 2015.06.09 | |||
| WO 2018128689 A1, 2018.07.12 | |||
| Arvind Srivastava et al., Manufacturing Challenges and Rational Formulation Development for AAV Viral Vectors, Journal of Pharmaceutical Sciences Volume 110, Issue 7, July 2021, Pages 2609-2624, найдено |
Авторы
Даты
2024-06-25—Публикация
2022-11-24—Подача