Изобретение относится к области медицинской диагностики, в частности, к рекомендациям по прогнозированию и терапии на основе молекулярных биомаркеров.
Изобретение относится к способу определения того, следует ли предписывать для субъекта с диагнозом сердечно-сосудистого заболевания дистанционное ведение пациента, причем способ включает измерение конкретных биомаркеров в образце от указанного пациента. Таким образом, изобретение относится к способу терапевтического ведения, стратификации и/или мониторинга дистанционного ведения для пациентов с диагнозом сердечно-сосудистого заболевания, включающему получение по меньшей мере одного образца от пациента, определение уровня по меньшей мере одного биомаркера, выбранного из группы, состоящей из проадреномедуллина (проАДМ), предшественника мозгового натрийуретического пептида (проМНП) и предшественника предсердного натрийуретического пептида (проПНП) или их фрагмента (фрагментов), и сравнение указанного уровня по меньшей мере одного биомаркера с одним или несколькими референсными значениями, при этом указанный уровень указывает на целесообразность назначения или отказа от назначения дистанционного ведения для указанного пациента. В некоторых вариантах реализации изобретения уровень низкой пользы для по меньшей мере одного биомаркера указывает на нецелесообразность назначения дистанционного ведения пациента, в то время как в некоторых вариантах реализации уровень высокой пользы для по меньшей мере одного биомаркера указывает на целесообразность назначения дистанционного ведения пациента. В некоторых вариантах реализации сердечно-сосудистое заболевание представляет собой сердечную недостаточность, в частности, хроническую сердечную недостаточность, которая послужила причиной госпитализации на протяжении последних 12 месяцев.
Удаленное ведение пациентов, также известное как телемедицина, позволяет поставщикам медицинских услуг удаленно диагностировать и лечить пациентов, используя телекоммуникации в качестве альтернативы или наряду с личными посещениями (Cowie et al., 2016) и, следовательно, увеличивает доступность ухода за пациентами благодаря дистанционно-независимому приложению. Это закрывает пробел в отсутствии доступа к медицинскому обслуживанию для амбулаторных пациентов с заболеванием или с риском осложнений, связанных с уже диагностированным заболеванием. Телемедицина может упростить и сделать возможными консультации в режиме реального времени между лицами, осуществляющими уход, с помощью одной и той же технологии, для увеличения возможности предоставления своевременного и более качественного индивидуального ухода пациентам с хроническими диагнозами. Дистанционное ведение пациентов включает широкий спектр вмешательств, в том числе повышение дозы лекарственных средств в условиях амбулаторного лечения, обучение пациентов и ведение диагностированного заболевания или сопутствующих заболеваний, а также раннее выявление критических событий. Этот подход, как правило, может включать дополнительное вмешательство, помимо подхода дистанционного мониторинга, который традиционно фокусируется на раннем обнаружении клинического ухудшения. Тесная возможность взаимодействия и обмена данными в реальном времени может улучшать общий результат для пациента и позволять избегать критических состояний здоровья, что приводит к снижению (повторных) госпитализаций, уровня смертности и стоимости для системы здравоохранения ( et al., 2018).
et al., 2018).
Сердечная недостаточность представляет собой хроническое заболевание, при лечении которого потенциально может быть полезен дистанционный подход к ведению пациентов (Cowie et al. 2014, van Riet EE et al. 2016, Chioncel et al. 2017, Ponikowski et al. 2016). В частности, дистанционное ведение пациентов может помочь обнаружить ранние признаки и симптомы сердечной декомпенсации, что позволит незамедлительно начать соответствующее лечение и уход до полного проявления декомпенсации сердечной недостаточности.
Сердечная недостаточность - это распространенное заболевание, распространенное среди взрослых, на которое приходится значительная доля заболеваемости и смертности во всем мире. По оценкам, от одного до двух процентов населения развитых стран страдает сердечной недостаточностью, и такой уровень распространения увеличивается до 10% среди населения в возрасте 70 лет и старше. По оценкам, в Европе 10 миллионов человек страдают сердечной недостаточностью, связанной с желудочковой дисфункцией, и еще 10 миллионов - сердечной недостаточностью с сохраненной фракцией выброса (СНсФВ) (Hunt et al., 2009, McMurray et al., 2012)
Распространенность сердечной недостаточности увеличивается из-за старения населения и улучшения лечения острых сердечно-сосудистых событий, несмотря на эффективность многих методов лечения пациентов с сердечной недостаточностью со сниженной фракцией выброса, таких как ингибиторы ангиотензинпревращающего фермента (АПФ), блокаторы рецепторов ангиотензина (БРА), β-блокаторы и антагонисты минералокортикоидных рецепторов, и передовые аппаратные терапии (Marco et al., 2017).
Хроническая сердечная недостаточность приводит к низкой ожидаемой продолжительности жизни, ухудшению качества жизни, повторным госпитализациям и является значительным экономическим бременем для общества. За последние годы сочетание старения населения и роста затрат на здравоохранение усилило потребность в альтернативных стратегиях ухода за такими пациентами.
Учитывая распространенность заболевания и сложность терапевтических подходов, одной из самых сложных проблем при ведении пациентов с сердечной недостаточностью является уменьшение частоты госпитализаций и повторных госпитализаций в связи с обострением сердечной недостаточности (Cowie et al., 2014).
Современные программы оказания помощи при сердечной недостаточности сосредоточены на улучшении амбулаторной помощи при сердечной недостаточности для снижения риска повторных госпитализаций по поводу сердечной недостаточности. Частота повторной госпитализации на протяжении года после госпитализации по поводу сердечной недостаточности составляет примерно 50%, а годовая смертность составляет 15-20% (Cowie et al., 2014, van Riet et al., 2016). Затраты на госпитализацию по поводу декомпенсации сердечной недостаточности достигают примерно 60% от общих расходов на лечение сердечной недостаточности (Gheorghiade et al., 2005). Современные концепции телемедицины при сердечной недостаточности являются холистическими программами, которые включают дистанционный мониторинг и телемедицинские вмешательства, основанную на клинических рекомендациях амбулаторную помощь и структурированное обучение пациентов, сгруппированные вместе, и известны как дистанционное ведение пациентов (Anker et al., 2011,  et al., 2018).
et al., 2018).
Во многих рандомизированных контролируемых исследованиях изучалось влияние дистанционного ведения пациентов с сердечной недостаточностью на различные клинические исходы, включая BEAT-HF (Ong et al., 2016), CardioBBEAT (Hofmann et al., 2015), TIM-HF (Koehler et al., 2011, Koehler et al., 2012a), REM-HF (Morgan et al., 2017), OptiLink HF ( et al., 2016) IN-TIME (Hindricks et al., 2014) и CHAMPION (Abraham et al., 2011).
et al., 2016) IN-TIME (Hindricks et al., 2014) и CHAMPION (Abraham et al., 2011).
Результаты этих исследований не вполне согласуются в отношении заболеваемости и смертности. Это может быть объяснено различиями в используемых видах дистанционного вмешательства и характером гетерогенных популяций пациентов, включенных в исследования. Несмотря на различия в дизайне исследований и используемых видах дистанционного вмешательства при ведении пациентов (включая инвазивный или неинвазивный дистанционный мониторинг), одним из общих признаков является то, что пациенты с нестабильной сердечной недостаточностью с недавней (т.е. ≤12 месяцев) госпитализацией по поводу сердечной недостаточности до начала дистанционного ведения пациентов, по-видимому, имели в последующем пониженную частоту повторной госпитализации с сердечной недостаточностью, пониженную смертность и улучшенное качество жизни.
Недавний метаанализ позволяет предположить, что посещения медсестрой на дому и клиники по ведению заболеваний могут снизить смертность от всех причин и частоту повторных госпитализаций после недавней госпитализации по поводу сердечной недостаточности (Van Spall et al., 2017).
В 2016 г. Европейское общество кардиологов (ESC) предложило класс IIb для дистанционного мониторинга с инвазивными телемедицинскими устройствами в рекомендациях по лечению острой и хронической сердечной недостаточности (Ponikowski et al., 2016). Мета-анализ данных завершенных клинических испытаний по оценке помощи пациентам с сердечной недостаточностью на основании гемодинамических показателей пришел к выводу, что лечение сердечной недостаточности на основании гемодинамических показателей с использованием постоянно имплантированных датчиков и частой оценки давления наполнения превосходит традиционные стратегии клинического ведения в снижении риска госпитализации пациентов с сохраняющимися симптомами заболевания (Adamson et al., 2017).
Недавно было завершено проспективное рандомизированное контролируемое многоцентровое исследование «Телемедицинское вмешательство при сердечной недостаточности II» (TIM-HF2), которое продемонстрировало, что структурированное вмешательство с дистанционным ведением пациентов, при использовании в четко определенной популяции с сердечной недостаточностью может снизить процент дней, потерянных из-за незапланированной сердечно-сосудистой госпитализации, и смертность от всех причин (Koehler et al., 2018a, Koehler et al., 2018b).
Таким образом, предшествующий уровень техники демонстрирует, что дистанционное ведение пациентов имеет важное значение для улучшения качества жизни и продолжительности жизни пациентов, страдающих сердечной недостаточностью.
Однако эффективное дистанционное ведение пациентов связано со значительным техническим оборудованием, трудозатратами персонала и, следовательно, с финансовым бременем, и сочетает дистанционный мониторинг с телеэкспертизой и телеконсультациями. Учитывая распространенность сердечно-сосудистых заболеваний, таких как сердечная недостаточность, в современном обществе, простое назначение дистанционного ведения пациентов любым пациентам, страдающим сердечно-сосудистыми заболеваниями, может накладывать значительное экономическое бремя и создавать технические проблемы для поставщиков медицинских услуг.
Лишь в нескольких документах предшествующего уровня техники обсуждаются критерии принятия решения о том, для каких пациентов дистанционное ведение может быть полезным.
Koehler et al., 2012b предположили, что субпопуляции пациентов, страдающих сердечной недостаточностью, могут получать различную пользу от дистанционного ведения пациентов. В частности, предлагается использовать среднюю фракцию выброса левого желудочка (ФВЛЖ), оценку депрессии по PHQ-9 и предшествующую декомпенсацию сердечной недостаточности в качестве клинических показателей, полезных при управлении назначением дистанционного ведения пациентов.
Xiang et al., 2013 представляет собой метаисследование преимуществ дистанционного ведения пациентов с сердечной недостаточностью и позволяет предположить более высокую эффективность у пациентов с высокими оценками по классификации NYHA и низким возрастом.
Melilo et al., 2014 предлагает модель для отбора целевых групп пациентов с сердечной недостаточностью, которым будет полезно дистанционное ведение. Сообщается о положительном результате для NYHA 2 или 3, фракции выброса (ФВ) <40 и возраста >68.
Таким образом, в настоящее время известно лишь несколько критериев, которые могут помочь при принятии решения о дистанционном ведении пациентов.
В свете предшествующего уровня техники, существует потребность в обеспечении дополнительных надежных рекомендаций для принятия решения о том, для каких субъектов, страдающих сердечно-сосудистыми заболеваниями, дистанционное ведение пациентов будет полезным и должно быть назначено, и в каких случаях дистанционное ведение пациентов не приводит к значительному улучшению и может быть безопасно исключено.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
В свете трудностей известного уровня техники, техническая проблема, лежащая в основе данного изобретения, заключается в обеспечении улучшенных или альтернативных средств для терапевтического руководства, стратификации и/или мониторинга дистанционного ведения пациентов с сердечно-сосудистыми заболеваниями. Другие цели данного изобретения могут относиться к созданию средств для обеспечения руководства относительно того, получит ли пациент пользу от дистанционного ведения, и/или обеспечения указаний по назначению или не назначению дистанционного ведения для такого пациента.
Таким образом, данное изобретение направлено на создание способа, набора и дополнительных средств для терапевтического руководства, стратификации и/или мониторинга дистанционного ведения пациента, включая указание на то, будет ли назначение дистанционного ведения полезным для пациентов, страдающих от сердечной недостаточности.
Одним из объектов данного изобретения является использование биомаркера или комбинации биомаркеров для принятия решения о том, следует ли пациенту с сердечно-сосудистым заболеванием получать дистанционное ведение.
Решение технической задачи данного изобретения предложено в независимых пунктах формулы изобретения. Предпочтительные варианты реализации данного изобретения предложены в зависимых пунктах формулы изобретения.
Изобретение относится к способу терапевтического руководства, стратификации и/или мониторинга дистанционного ведения пациента с диагнозом сердечно-сосудистого заболевания, включающему:
- получение по меньшей мере одного образца от указанного пациента,
- определение уровня по меньшей мере одного биомаркера, выбранного из группы, состоящей из проадреномедуллина (проАДМ), предшественника мозгового натрийуретического пептида (проМНП) и/или предшественника предсердного натрийуретического пептида (проПНП) или их фрагмента (фрагментов) в указанном по меньшей мере одном образце,
- сравнение указанного уровня по меньшей мере одного биомаркера или его фрагмента (фрагментов) с одним или несколькими референсными значениями, при этом указанный уровень по меньшей мере одного биомаркера или его фрагмента (фрагментов) указывает на целесообразность назначения или отказа от назначения дистанционного ведения для указанного пациента.
Пациенты в способе по данному изобретению на момент взятия образца имеют диагноз сердечно-сосудистого заболевания, такого как сердечная недостаточность. В принципе, для этой группы пациентов дистанционное ведение может быть полезным. После определения уровня биомаркеров проАДМ, проМНП и/или проПНП можно оценить терапевтическую пользу от дистанционного ведения пациентов и, таким образом, руководить принятием решения о целесообразности назначения дистанционного ведения.
Указанный способ может быть очень полезным и ценным для крупномасштабного терапевтического руководства, стратификации и/или наблюдения за пациентами, страдающими сердечно-сосудистыми заболеваниями. Определение уровня биомаркеров позволяет обеспечить надежные средства, позволяющие принять верное терапевтическое решение.
Как показывают приведенные ниже данные, любой из биомаркеров проАДМ, проМНП и/или проПНП может с высокой статистической достоверностью указывать, является ли дистанционное ведение пациента терапевтически целесообразным, или его можно безопасно исключить, не рискуя отказать пациенту в необходимом и полезном терапевтическом подходе.
Было неожиданно обнаружено, что с помощью одного измерения, определяющего по меньшей мере один биомаркер, выбранный из группы проАДМ, проМНП и проПНП или их фрагмента (фрагментов), можно сделать точный и надежный вывод о том, получит ли пациент пользу от дистанционного ведения, или же дистанционное ведение только повлечет дополнительные расходы, не приводя к значительным терапевтическим преимуществам. Эта прогностическая способность проАДМ, проМНП и/или проПНП в контексте определения того, следует ли назначать дистанционное ведение пациентов, насколько известно авторам изобретения, является новой и неожиданной.
Благоприятный эффект снижения нагрузки на систему здравоохранения и обеспечения выделения медицинских ресурсов тем, кто действительно в них нуждается, можно проиллюстрировать на примере, основанном на данных, подробно описанных ниже.
Используя соответствующие референсные значения для биомаркеров проАДМ, проМНП и/или проПНП, примерно для одной трети пациентов, страдающих сердечной недостаточностью, можно безопасно исключить возможность дистанционного ведения. Для этих пациентов уровень биомаркеров проАДМ, проМНП и/или проПНП позволяет надежно предсказать, что дистанционное ведение не обеспечивает значительных терапевтических преимуществ. Независимо от того, будет ли назначено дистанционное ведение пациента или использован обычный уход без дистанционного ведения, пациенты имеют статистически такое же количество нежелательных эффектов, включая острую декомпенсацию при хронической сердечной недостаточности или смерть по любой причине. Кроме того, количество дней, проведенных в больнице, не снижается для пациентов, идентифицированных на ранней стадии по уровням биомаркеров как не получающих пользы от дистанционного ведения. Эта треть пациентов не получает пользы ни с точки зрения прогрессирования заболевания, ни с точки зрения качества жизни. Таким образом, можно безопасно избежать затрат и усилий, связанных с дополнительно используемым дистанционным ведением пациентов, не рискуя причинить вред пациентам.
Например, в испытаниях TIM-HF2 пациент, получающий дистанционное ведение, имел в среднем продолжительность телефонных контактов с медицинским работником 143 минуты в год. Для тысячи пациентов безопасное исключение примерно 30% пациентов из ненужного дистанционного ведения дает, таким образом, экономию времени на телефонные разговоры более 700 часов в год. Это время, которое может быть использовано для эффективной помощи и ухода за пациентами, действительно нуждающимися в этом. Кроме того, могут быть значительно сокращены затраты, связанные с предоставлением устройств для дистанционного ведения пациентов, обслуживанием указанных устройств, а также с инфраструктурой передачи и анализа данных, что позволяет оптимизировать направление ресурсов лицам, которые получат наибольшую пользу.
Насколько известно авторам изобретения, использование биомаркеров, выбранных из группы, состоящей из проАДМ, проМНП и проПНП, для принятия решения о том, назначать или не назначать дистанционное ведение пациента, не было раскрыто или предложено в исследованиях и подходах предшествующего уровня техники.
В этом отношении еще одним неожиданным результатом является то, что биомаркеры проАДМ, проМНП и проПНП демонстрируют аналогичный потенциал при использовании в качестве маркеров для терапевтического руководства, стратификации или мониторинга дистанционного ведения пациента с диагнозом сердечно-сосудистого заболевания, такого как сердечная недостаточность.
Пептид адреномедуллин (АДМ), содержащий 52 аминокислоты, был первоначально выделен из фенохромоцитомы человека (Kitamura K et al., 1993). Было показано, что АДМ проявляет гипотензивное, иммуномодулирующее, метаболическое и сосудистое действие. Это сильнодействующее сосудорасширяющее средство и его повсеместное продуцирование в тканях помогает поддерживать кровоснабжение отдельных органов. АДМ стабилизирует микроциркуляцию и защищает от проницаемости эндотелия и, как следствие, органной недостаточности, и показал большие перспективы, особенно в области сепсиса (Andaluz-Ojeda et al., 2015) или других заболеваний, таких как инфекции нижних дыхательных путей (Hartmann et al., 2012, Albrich et al., 2013), гипертония, хроническое заболевание почек (Jougasaki et al., 2000), цирроз (Kojima et al., 1998), рак и, особенно, сердечная недостаточность (Pousset et al., 2000, Albrecht et al., 2009).
Мозговой натрийуретический пептид (МНП) представляет собой полипептид, первоначально выделенный из головного мозга свиньи T. Sudoh и соавторами (Nature 1988; 332: 78-81). После клонирования и анализа последовательности кДНК, кодирующей пептид (T. Sudoh et al., 1989), было показано, что человеческий МНП продуцируется в сердце человека. Желудочки сердца вырабатывают натрийуретический пептид B-типа (БНП) в ответ на повышенную механическую нагрузку и растяжение стенок. МНП защищает сердце от неблагоприятных последствий перегрузки, увеличивая натрийурез и диурез, расслабляя гладкую мускулатуру сосудов, подавляя ренин-ангиотензин-альдостероновую систему и противодействуя гипертрофии и фиброзу сердца. МНП синтезируется сердечными миоцитами человека в виде прогормона (проМНП) из 108 аминокислот, который расщепляется до МНП, состоящего из 32 остатков, и N-концевого фрагмента проМНП (NT-проМНП) из 76 остатков.
Концентрация МНП в плазме увеличивается у пациентов, страдающих сердечными заболеваниями, приводящими к сердечной недостаточности. Сердечные моноциты секретируют другой фактор, а именно предсердный натрийуретический фактор (ПНФ), но секреторный ответ на сердечную недостаточность или начинающуюся сердечную недостаточность, по-видимому, намного больше в системе МНП по сравнению с системой ПНФ (Mukoyama et al., J Clin Invest 1991; 87: 1402-12). В настоящее время МНП признан универсальным биомаркером сердечных дисфункций, в частности, относительно дисфункции левого желудочка, и предиктором инфаркта миокарда или сердечной недостаточности (Vuolteenaho et al., 2005).
Предсердный натрийуретический полипептид (ПНП) в основном секретируется из предсердий здоровых взрослых людей и из левого желудочка пациентов с дисфункцией левого желудочка. Клиническое применение ПНП ограничено коротким периодом полувыведения; однако его предшественник NT-проПНП более стабилен в плазме и имеет более длительный период полувыведения. Недавно среднерегионарная последовательность натрийуретического пропептида A-типа (СР-проПНП), которая является промежуточным соединением натрийуретических пептидов и более стабильна, успешно использовалась в клинике в качестве биомаркера прогноза и диагностики сердечно-сосудистых заболеваний, таких как острая сердечная недостаточность или ишемическая болезнь сердца (Wild et al., 2011, Tzikas et al., 2013, Francis et al., 2016).
Таким образом, биомаркеры проАДМ, проМНП и проПНП проявляют общие биологические функции в отношении сердечно-сосудистой системы и активируются при сердечной недостаточности. Без желания ограничиваться теорией, неожиданное открытие общего потенциала проАДМ, проМНП и проПНП для руководства терапией, стратификации и/или мониторинга дистанционного ведения для пациентов, указанных в данных, может иметь отношение к их общим функциям в качестве биомаркеров, связанных с сердечно-сосудистыми заболеваниями, в частности, сердечной недостаточностью.
Кроме того, этот способ может быть ценным предиктором риска нежелательного явления и для руководства дистанционным ведением пациентов с диагнозом сердечно-сосудистого заболевания, предпочтительно, сердечной недостаточности. Когда уровень биомаркеров проАДМ, проМНП и проПНП указывает на повышенную вероятность нежелательного явления, может быть назначено дистанционное ведение пациента и, предпочтительно, можно регулировать вид и/или интенсивность дистанционного ведения пациента. В зависимости от прогноза нежелательных явлений при дистанционном ведении пациентов могут использоваться специализированные диагностические инструменты, а анализ данных о состоянии здоровья пациента может проводиться с более частыми интервалами.
В связи с этим, указанный способ особенно ценен для оценки или стратификации риска и позволяет группировать или классифицировать пациентов в разные группы, такие как группы риска, требующие более частого мониторинга или дополнительной диагностики, или группы терапии, получающие определенные дифференцированные терапевтические процедуры в зависимости от их классификации.
Таким образом, потенциал биомаркеров, описанных в данном документе, не только позволяет обеспечить соответствующее терапевтическое руководство для улучшения результатов лечения пациента, но также помогает определить стратегии, эффективные с точки зрения использования ресурсов.
В одном варианте реализации способ включает: сравнение указанного уровня по меньшей мере одного биомаркера или его фрагмента (фрагментов) с одним или несколькими референсными значениями, чтобы определить, является ли указанный уровень по меньшей мере одного биомаркера или его фрагмента (фрагментов) признаком целесообразности назначения или отказа от назначения дистанционного ведения для указанного пациента.
В одном варианте реализации уровень низкой пользы для по меньшей мере одного биомаркера или его фрагмента (фрагментов) указывает на нецелесообразность назначения дистанционного ведения пациента.
Используемый в данном документе термин «уровень низкой пользы», предпочтительно, относится к уровню по меньшей мере одного биомаркера, выбранного из группы, состоящей из проАДМ, проМНП и проПНП или их фрагмента (фрагментов), который указывает на то, что дистанционное ведение пациента не является терапевтически эффективным и не дает значительного улучшения для пациента.
Как подробно описано в приведенных ниже данных, для описанных в данном документе биомаркеров можно надежно установить уровни низкой пользы, которые указывают на то, что ни количество нежелательных явлений, таких как декомпенсация из-за сердечной недостаточности, ни смертность по любой причине значительно не снижаются при назначении дистанционного ведения пациентов. Точно так же количество дней, проведенных в больнице и, таким образом, частота госпитализаций, существенно не снижаются у пациентов, для которых определены уровни биомаркеров, соответствующие низкой пользе.
Таким образом, уровень биомаркеров, соответствующий низкой пользе, описанный в данном документе, позволяет безопасно исключить назначение дистанционного ведения пациентам, которым такой терапевтический подход не приносит пользы. Время и трудозатраты, связанные с дистанционным ведением пациентов, для которых определен уровень низкой пользы, могут быть более эффективно распределены для тех, кто действительно в них нуждается.
В одном варианте реализации, уровень по меньшей мере одного биомаркера или его фрагмента (фрагментов), соответствующий высокой пользе, указывает на целесообразность назначения дистанционного ведения пациента.
Используемый в данном документе термин «уровень высокой пользы», предпочтительно, относится к уровню по меньшей мере одного биомаркера, выбранного из группы, состоящей из проАДМ, проМНП и проПНП или их фрагмента (фрагментов), который указывает на то, что дистанционное ведение пациентов является терапевтически эффективным и действительно приводит к улучшенному исходу для пациентов.
Как подробно описано в приведенных ниже данных, для описанных в данном документе биомаркеров можно надежно установить уровни высокой пользы, которые указывают на то, что количество нежелательных явлений, таких как декомпенсация вследствие сердечной недостаточности, или смертность по любой причине, значительно сокращаются при назначении дистанционного ведения пациентов. Аналогичным образом, количество проведенных в больнице дней и, следовательно, частота госпитализаций снижаются для пациентов, у которых определен уровень биомаркеров, соответствующий высокой пользе.
Таким образом, уровень биомаркеров, соответствующий высокой пользе, описанный в данном документе, позволяет назначать дистанционное ведение тем пациентам, для которых этот терапевтический подход эффективен и обеспечивает наилучший результат лечения.
В одном варианте реализации уровень низкой пользы по меньшей мере одного биомаркера или его фрагмента (фрагментов) указывает на нецелесообразность назначения дистанционного ведения пациента в течение периода времени по меньшей мере 10 дней, предпочтительно, по меньшей мере 30 дней, 60 дней, 90 дней, 150 дней, 180 дней, 270 дней или 365 дней.
В одном варианте реализации уровень высокой пользы по меньшей мере одного биомаркера или его фрагмента (фрагментов) указывает на нецелесообразность назначения дистанционного ведения пациента в течение периода времени по меньшей мере 10 дней, предпочтительно, по меньшей мере 30 дней, 60 дней, 90 дней, 150 дней, 180 дней, 270 дней или 365 дней.
Совершенно удивительно, что на основе измерения биомаркеров, описанных в данном документе, можно сделать точный и надежный вывод о том, может ли пациент, страдающий сердечно-сосудистым заболеванием, получить пользу от дистанционного ведения, что позволяет принять обоснованное решение о назначении дистанционного ведения пациента. Такая прогностическая способность проАДМ, проМНП и/или проПНП в конкретных условиях - в частности, в течение предпочтительного периода времени, составляющего по меньшей мере 10 дней, предпочтительно, по меньшей мере 30 дней, 60 дней, 90 дней, 150 дней, 180 дней, 270 дней или 365 дней, описанная в данном документе, является новой и неожиданной, и позволяет осуществлять ресурсоэффективное терапевтическое руководство дистанционным ведением пациентов как новый терапевтический подход к улучшению клинического исхода для пациентов, страдающих сердечно-сосудистыми заболеваниями.
В некоторых вариантах реализации изобретения, где уровень по меньшей мере одного биомаркера или его фрагмента (фрагментов), соответствующий низкой и/или высокой пользе, указывает на нецелесообразность назначения дистанционного ведения пациента в течение периода времени, составляющего, по меньшей мере, 10 дней, предпочтительно, по меньшей мере 30 дней, 60 дней, 90 дней, 150 дней, 180 дней, 270 дней или 365 дней, предпочтительно, определение уровня биомаркеров по втором образце, как описано в данном документе, проводится через период времени, составляющий 10 дней, предпочтительно, 30 дней, 60 дней, 90 дней, 150 дней, 180 дней, 270 дней или 365 дней после первого определения уровня биомаркера, для повторной оценки целесообразности назначения дистанционного ведения пациентов.
В некоторых вариантах реализации предпочтительно, чтобы пациент проконсультировался с медицинским персоналом по поводу переоценки решения о назначении дистанционного ведения, если пациент замечает, что его или ее самочувствие ухудшается.
В соответствии с данным изобретением термин «указывать» в контексте «указывающий на целесообразность назначения дистанционного ведения пациента» и «указывающий на отказ от назначения дистанционного ведения пациента» должен рассматриваться как вероятностный критерий. Предпочтительно, «указание» относится к вероятности факта отсутствия терапевтического эффекта, например, в отношении избежания нежелательных явлений, и обычно не должно истолковываться в ограничительном смысле как определенно указывающее на абсолютное присутствие или отсутствие терапевтического эффекта, например, на определенное избежание нежелательных явлений в случае назначения или отказа от назначения дистанционного ведения пациентов.
Принимая во внимание вышеизложенное, использование референсных значений, раскрытых в данном документе, позволяет обеспечить надежное терапевтическое руководство, стратификацию и/или мониторинг дистанционного ведения пациентов, а также оценку рисков, связанных с возникновением нежелательных явлений, в зависимости от того, назначено ли пациенту дистанционное ведение, и позволяет медицинскому работнику предпринимать соответствующие меры.
Кроме того, следует понимать, что в вариантах реализации изобретения также раскрыты и заявлены отклонения от раскрытых возможных референсных значений, указанных ниже, такие как отклонения в ± 20%, 19%, 18%, 17%, 16%, 15%, 14%, 13%, 12%, 11%, 10%, 9%, 8%, 7%, 6%, 5%, 4%, 3%, 2% или 1%, а также точное референсное значение.
Референсные значения, раскрытые в данном документе, предпочтительно, относятся к измерениям уровня белка проАДМ, проМНП и/или проПНП или их фрагментов в образце плазмы, полученном от пациента с помощью анализа Thermoscientific B.R.A.H.M.S KRYPTOR или анализа, подходящего для автоматизированной системы. Соответственно, значения, раскрытые в данном документе, могут в некоторой степени варьироваться в зависимости от используемого способа определения/измерения, и конкретные значения, раскрытые в данном документе, должны также охватывать соответствующие значения, определенные другими способами.
Все описанные в данном документе референсные значения, относящиеся к уровню маркера или биомаркера, такого как проАДМ, проМНП или проПНП, следует понимать как «равные или выше» определенного референсного значения, или «равные или ниже» определенного референсного значения. Например, вариант реализации, относящийся к уровню проАДМ или его фрагмента (фрагментов) выше 0,75 нмоль/л, следует понимать как относящийся к уровню проАДМ или его фрагмента (фрагментов), равному или выше 0,75 нмоль/л.
Варианты реализации, относящиеся к определению проАДМ
В одном варианте реализации уровень низкой пользы проАДМ или его фрагмента (фрагментов) имеет значение ниже референсного ± 20% или менее, причем референсное значение выбирают из диапазона значений от 0,75 нмоль/л до 1,07 нмоль/л. Любое значение в этом диапазоне можно рассматривать как подходящее пороговое значение. Например, 0,75, 0,76, 0,77, 0,78, 0,79, 0,8, 0,81, 0,82, 0,83, 0,84, 0,85, 0,86, 0,87, 0,88, 0,89, 0,9, 0,91, 0,92, 0,93, 0,94, 0,95, 0,96, 0,97, 0,98, 0,99, 1, 1,01, 1,02, 1,03, 1,04, 1,05, 1,06 или 1,07 нмоль/л. Особенно предпочтительными референсными значениями являются 0,86 нмоль/л ± 20%, предпочтительно, 0,75 нмоль/л ± 20%.
В предпочтительном варианте реализации уровень низкой пользы проАДМ или его фрагмента (фрагментов), имеет величину ниже 1,07 нмоль/л ± 20% или менее, предпочтительно, 0,98 нмоль/л ± 20% или менее, ниже 0,91 нмоль/л ± 20% или менее, ниже 0,86 нмоль/л ± 20% или менее, или ниже 0,75 нмоль/л ± 20% или менее.
В одном варианте реализации уровень высокой пользы проАДМ или его фрагмента (фрагментов) выше референсного значения ± 20% или более, причем референсное значение выбирают из диапазона значений от 0,75 нмоль/л до 1,07 нмоль/л. Любое значение в этом диапазоне можно рассматривать как подходящее пороговое значение. Например, 0,75, 0,76, 0,77, 0,78, 0,79, 0,8, 0,81, 0,82, 0,83, 0,84, 0,85, 0,86, 0,87, 0,88, 0,89, 0,9, 0,91, 0,92, 0,93, 0,94, 0,95, 0,96, 0,97, 0,98, 0,99, 1, 1,01, 1,02, 1,03, 1,04, 1,05, 1,06 или 1,07 нмоль/л. Особенно предпочтительными референсными значениями являются 0,86 нмоль/л ± 20%, предпочтительно, 0,75 нмоль/л ± 20%.
В предпочтительном варианте реализации уровень высокой пользы проАДМ или его фрагмента (фрагментов) имеет величину выше 1,07 нмоль/л ± 20% или более, 0,98 ± 20% или более, предпочтительно, выше 0,91 нмоль/л ± 20% или более, выше 0,86 нмоль/л ± 20% или более, или выше 0,75 нмоль/л ± 20% или более.
Как подробно описано в приведенных ниже данных, уровни проАДМ, соответствующие низкой и высокой пользе, позволяют точно определить, является ли дистанционное ведение пациента целесообразным, т.е. терапевтически эффективным, и, таким образом, его следует назначить, или от дистанционного ведения пациента можно безопасно отказаться и не назначать его. Что касается нежелательных явлений или рисков, таких как острая декомпенсация из-за сердечной недостаточности или смерть по любой причине, желательно, в течение периода времени по меньшей мере 10 дней, 30 дней, наиболее предпочтительно, по меньшей мере 90 дней после получения образца, вышеупомянутый диапазон референсных значений от 0,75 нмоль/л до 1,07 нмоль/л обеспечивает максимальную чувствительность в диапазоне от 100% до 80%, причем предпочтительное референсное значение 0,75 нмоль/л для проАДМ или фрагмента (фрагментов) демонстрирует чувствительность 100%, при этом предпочтительное референсное значение 0,86 нмоль/л для проАДМ или его фрагмента (фрагментов) демонстрирует чувствительность по меньшей мере 95%, при этом референсное значение 0,91 нмоль/л для проАДМ или фрагмента (фрагментов) демонстрирует чувствительность по меньшей мере 91%, при этом референсное значение 0,98 нмоль/л для проАДМ или его фрагмента (фрагментов) демонстрирует чувствительность по меньшей мере 86%. Для референсного значения 1,07 нмоль/л установлена чувствительность не менее 80%.
Пациентам, имеющим результаты ниже этих граничных значений с чувствительностью 100-80%, рекомендуется отказ от назначения дистанционного ведения пациентов (исключение). В рамках стандартного лечения, в другой момент времени в будущем оценка с использованием проАДМ должна быть повторена. В зависимости от оцененного риска пациент может быть снова включен в группу недистанционного ведения пациентов или в группу дистанционного ведения пациентов.
Пациентам, имеющим результаты выше этих граничных значений с чувствительностью менее 80% рекомендуется назначать дистанционное ведение пациентов (включение). В рамках стандартного лечения, в другой момент времени в будущем оценка с использованием проАДМ должна быть повторена. В зависимости от оцененного риска пациент может быть вновь включен в группу дистанционного ведения пациентов или в группу недистанционного ведения пациентов.
Следует отметить, что предпочтительные референсные значения и связанные с ними высокий и низкий уровни пользы могут зависеть от периода времени, в течение которого уровень проАДМ должен указывать на целесообразность назначения или отказа от назначения дистанционного ведения пациентов. В общем, для безопасного отказа от назначения пациенту дистанционного ведения потребуется более низкое референсное значение в качестве верхней границы уровня низкой пользы. В некоторых вариантах реализации верхние границы предпочтительного уровня низкой пользы могут быть настолько же низкими, как известные пороги для диагностики сердечно-сосудистых заболеваний, предпочтительно, сердечной недостаточности.
Вышеупомянутые референсные значения, а также уровни высокой пользы и низкой пользы могут быть особенно предпочтительными, поскольку указывают на целесообразность назначения или отказа от назначения дистанционного ведения пациентов в течение периода времени не менее 10 дней, предпочтительно, по меньшей мере 30 дней, 60 дней или по меньшей мере 90 дней. Для значительных, более продолжительных периодов времени, например, по меньшей мере 150 дней, 180 дней, 270 дней или 365 дней, могут быть предпочтительны более низкие референсные значения.
В некоторых вариантах реализации уровень низкой пользы проАДМ или его фрагмента (фрагментов), имеет величину ниже референсного значения ± 20% или менее, причем референсное значение выбирают из диапазона значений от 0,60 нмоль/л до 0,75 нмоль/л, предпочтительно, от 0,63 до 0,75 нмоль/л или от 0,69 до 0,75 нмоль/л. Любое значение в этом диапазоне можно рассматривать как подходящее пороговое значение. Например 0,6, 0,61, 0,62, 0,63, 0,64, 0,65, 0,66, 0,67, 0,68, 0,69, 0,7, 0,71, 0,72, 0,73, 0,74 или 0,75 нмоль/л. Особенно предпочтительными референсными значениями являются 0,75 нмоль/л ± 20%, предпочтительно, 0,72 нмоль/л ± 20%, 0,69 нмоль/л или 0,63 нмоль/л ± 20%.
В предпочтительном варианте реализации уровень низкой пользы проАДМ или его фрагмента (фрагментов) имеет величину ниже 0,75 нмоль/л ± 20% или менее, предпочтительно, ниже 0,72 нмоль/л ± 20% или менее, ниже 0,69 нмоль/л ± 20% или менее, или ниже 0,63 нмоль/л ± 20%.
В некоторых вариантах реализации уровень высокой пользы проАДМ или его фрагмента (фрагментов) имеет величину выше референсного значения ± 20% или более, причем референсное значение выбирают из диапазона значений от 0,60 нмоль/л до 0,75 нмоль/л, предпочтительно, от 0,63 нмоль/л до 0,75 нмоль/л или от 0,69 нмоль/л до 0,75 нмоль/л. Любое значение в этом диапазоне можно рассматривать как подходящее пороговое значение. Например, 0,6, 0,61, 0,62, 0,63, 0,64, 0,65, 0,66, 0,67, 0,68, 0,69, 0,7, 0,71, 0,72, 0,73, 0,74 или 0,75 нмоль/л. Особенно предпочтительными референсными значениями являются 0,75 нмоль/л ± 20%, предпочтительно, 0,72 нмоль/л ± 20%, 0,69 нмоль/л ± 20% или 0,63 нмоль/л ± 20%.
В предпочтительном варианте реализации уровень высокой пользы проАДМ или его фрагмента (фрагментов) имеет величину выше 0,75 нмоль/л ± 20% или более, предпочтительно, выше 0,72 нмоль/л ± 20% или более, выше 0,69 нмоль/л ± 20% или более или выше 0,63 нмоль/л ± 20% или более.
Указанные референсные значения могут быть особенно предпочтительными, поскольку указывают на целесообразность назначения или отказа от назначения дистанционного ведения пациента в течение периода времени не менее 150 дней, 180 дней, 270 дней, наиболее предпочтительно, не менее 365 дней.
Что касается нежелательных явлений или рисков, таких как острая декомпенсация из-за сердечной недостаточности или смерть по любой причине, предпочтительно, в течение периода времени не менее 150 дней, 180 дней, 270 дней, наиболее предпочтительно, по меньшей мере 365 дней после получения образца, вышеупомянутый диапазон референсных значений от 0,69 нмоль/л до 0,75 нмоль/L обеспечивает максимальную чувствительность в диапазоне от 100% до 95%, при этом предпочтительное референсное значение, равное 0,63 нмоль/л или 0,69 нмоль/л для проАДМ или фрагмента (фрагментов), демонстрирует чувствительность 100%, в то время как предпочтительное референсное значение 0,72 нмоль/L для проАДМ или его фрагмента (фрагментов) демонстрирует чувствительность не менее 98%, а референсное значение 0,75 нмоль/л для проАДМ или его фрагмента (фрагментов) демонстрирует чувствительность не менее 95%.
Как подробно описано в примерах, соотношение между чувствительностью и референсными значениями может также зависеть от рассмотрения нежелательных явлений, т.е. конечных точек для сценария выбора, например, потерянных дней за год или смерти по любой причине (см. Таблицу 15).
Варианты реализации, относящиеся к определению проМНП
В одном варианте реализации уровень низкой пользы проМНП или его фрагмента (фрагментов) имеет величину ниже референсного значения ± 20% или менее, выбранного из диапазона значений от 237,6 пг/мл до 1595,8 пг/мл. Любое значение в этом диапазоне можно рассматривать как подходящее пороговое значение. Например, 250, 275, 300, 325, 350, 375, 400, 425, 450, 475, 500, 525, 550, 575, 600, 625, 650, 675, 700, 725, 750, 775, 800, 825, 850, 875, 900, 925, 950, 975, 1000, 1025, 1050, 1075, 1100, 1107,9, 1110, 1125, 1150, 1175, 1200, 1225, 1250, 1275, 1300, 1325, 1350, 1375, 1400, 1402,95, 1403, 1425, 1450, 1475, 1500, 1525, 1550 или 1575 пг/мл. Особенно предпочтительными референсными значениями являются 1595,8 пг/мл, предпочтительно, 1402,95 пг/мл, 1107,9 пг/мл, 609,4 пг/мл, 237,6 пг/мл.
В предпочтительном варианте реализации уровень низкой пользы проМНП или его фрагмента (фрагментов) имеет величину ниже 1595,8 пг/мл ± 20% или менее, 1402,95 пг/мл ± 20% или менее, 1107,9 пг/мл ± 20% или менее, ниже 609,4 пг/мл ± 20% или менее, ниже 237,6 пг/мл ± 20% или менее.
В одном варианте реализации уровень высокой пользы проМНП или его фрагмента (фрагментов) имеет величину выше референсного значения ± 20% или более, выбранного из диапазона значений от 237,6 пг/мл до 1595,8 пг/мл. Любое значение в этом диапазоне может рассматриваться как подходящее пороговое значение. Например, 250, 275, 300, 325, 350, 375, 400, 425, 450, 475, 500, 525, 550, 575, 600, 625, 650, 675, 700, 725, 750, 775, 800, 825, 850, 875, 900, 925, 950, 975, 1000, 1025, 1050, 1075, 1100, 1107,9, 1110, 1125, 1150, 1175, 1200, 1225, 1250, 1275, 1300, 1325, 1350, 1375, 1400, 1402,95, 1403, 1425, 1450, 1475, 1500, 1525, 1550 или 1575 пг/мл. Особенно предпочтительными референсными значениями являются 1595,8 пг/мл, предпочтительно, 1402,95 пг/мл, 1107,9 пг/мл, 609,4 пг/мл, 237,6 пг/мл.
В предпочтительном варианте реализации уровень высокой пользы проМНП или его фрагмента (фрагментов) имеет величину выше 1595,8 пг/мл ± 20% или более, предпочтительно, 1402,95 пг/мл ± 20% или более, 1107,9 пг/мл ± 20% или более, выше 609,4 пг/мл ± 20% или более, выше 237,6 пг/мл ± 20% или более.
Как подробно описано в приведенных ниже данных, уровни проМНП, соответствующие низкой и высокой пользе, позволяют точно определить, является ли дистанционное ведение пациента целесообразным, т.е. терапевтически эффективным, и должно быть назначено, или же дистанционное ведение пациента может быть безопасно пропущено и не назначено. Что касается неблагоприятных проявлений или рисков, таких как острая декомпенсация из-за сердечной недостаточности или смерть по любой причине, предпочтительно, в течение периода времени по меньшей мере 10 дней, 30 дней, наиболее предпочтительно, не менее 90 дней после получения образца, вышеупомянутый диапазон референсных значений от 237,6 пг/мл до 1595,8 пг/мл обеспечивает максимальную чувствительность в диапазоне от 100% до 80%, причем предпочтительное референсное значение 237,6 пг/мл для проМНП демонстрирует чувствительность 100%, в то время как предпочтительное референсное значение 609,4 пг/мл для проМНП демонстрирует чувствительность 95%. Для референсного значения 1595,8 пг/мл установлена чувствительность 80%.
Пациентам с результатами ниже этих пороговых значений с чувствительностью 100-80% назначение дистанционного ведения пациента не рекомендуется (исключение). В рамках стандартного лечения оценка с использованием проМНП должна быть повторена в другой момент времени в будущем. В зависимости от оцененного риска пациент может быть снова включен в группу недистанционного ведения пациентов или в группу дистанционного ведения пациентов.
Пациентам с результатами выше этих пороговых значений с чувствительностью менее 80% рекомендуется назначение дистанционного ведения пациентов (включение). В рамках стандартного лечения оценка с использованием проМНП должна быть повторена в другой момент времени в будущем. В зависимости от оцененного риска пациент может быть вновь включен в группу дистанционного ведения пациентов или в группу недистанционного ведения пациентов.
Следует отметить, что предпочтительные референсные значения и связанные с ними уровни высокой и низкой пользы могут зависеть от периода времени, в течение которого уровень проМНП должен указывать на целесообразность назначения или отказа от назначения дистанционного ведения пациентов. В общем, для безопасного отказа от назначения пациенту дистанционного ведения потребуется более низкое референсное значение в качестве верхней границы уровня низкой пользы. В некоторых вариантах реализации верхние границы предпочтительного уровня низкой пользы могут быть такими же низкими, как известные пороговые значения для диагностики сердечно-сосудистого заболевания, предпочтительно, сердечной недостаточности (для МНП, например, 125 пг/мл в соответствии с рекомендациями Европейского общества кардиологов 2016 г. (2016 ESC Guidelines, Ponikowski et al., 2016)).
Вышеупомянутые референсные значения, а также уровни высокой пользы и низкой пользы могут быть особенно предпочтительными, поскольку указывают на целесообразность назначения или отказа от назначения дистанционного ведения пациентов в течение периода времени не менее 10 дней, предпочтительно, по меньшей мере 30 дней, 60 дней или по меньшей мере 90 дней. Для значительных, более продолжительных периодов времени, например, не менее 150 дней, 180 дней, 270 дней или 365 дней могут быть предпочтительны более низкие референсные значения.
В некоторых вариантах реализации уровень низкой пользы проМНП или его фрагмента (фрагментов) имеет величину ниже референсного значения ± 20% или менее, причем референсное значение выбирают из диапазона значений от 125 пг/мл до 383,3 пг/мл или от 125 пг/мл до 413,7 пг/мл. Любое значение в этом диапазоне можно рассматривать как подходящее пороговое значение. Например, 125, 125,1, 135, 145, 155, 165, 175, 185, 195, 205, 215, 225, 235, 245, 255, 265, 275, 285, 295, 305, 315, 325, 335, 345, 355, 365, 375, 380, 383,3, 385, 390, 395, 400, 405, 410 или 413,7 пг/мл. Особенно предпочтительными референсными значениями являются 413,7 пг/мл ± 20%, предпочтительно, 383,3 пг/мл ± 20%, 145,4 пг/мл ± 20% или 125,1 пг/мл ± 20%.
В предпочтительном варианте реализации уровень низкой пользы проМНП или его фрагмента (фрагментов) имеет величину ниже 413,7 пг/мл ± 20% или менее, предпочтительно, 383,3 пг/мл ± 20% или менее, ниже 145,4 пг/мл ± 20% или менее, или ниже 125,1 пг/мл ± 20% или менее.
В некоторых вариантах реализации уровень высокой пользы проМНП или его фрагмента (фрагментов) имеет величину выше референсного значения ± 20% или более, при этом референсное значение выбирают из диапазона значений от 125 пг/мл до 237,6 пг/мл, от 125,1 пг/мл до 383,3 пг/мл, или от 125,1 пг/мл до 413,7 пг/мл. Любое значение в этом диапазоне можно рассматривать как подходящее пороговое значение. Например, 125, 125,1, 135, 145, 155, 165, 175, 185, 195, 205, 215, 225, 235, 245, 255, 265, 275, 285, 295, 305, 315, 325, 335, 345, 355, 365, 375, 380, 383,3, 385, 390, 395, 400, 405, 410 или 413,7 пг/мл. Особенно предпочтительными референсными значениями являются 413,7 пг/мл ± 20%, 383,3 пг/мл ± 20%, предпочтительно, 145,4 пг/мл ± 20% или 125,1 пг/мл ± 20%.
В предпочтительном варианте реализации уровень высокой пользы проМНП или его фрагмента (фрагментов) имеет величину выше 413,7 пг/мл ± 20% или более, 383,3 пг/мл ± 20% или более, предпочтительно, выше 145,4 пг/мл ± 20% или более, или выше 125,1 пг/мл ± 20% или более.
Указанные референсные значения могут быть особенно предпочтительными, поскольку указывают на целесообразность назначения или отказа от назначения дистанционного ведения пациента в течение периода времени не менее 150 дней, 180 дней, 270 дней, наиболее предпочтительно, не менее 365 дней.
Что касается неблагоприятных проявлений или рисков, таких как острая декомпенсация из-за сердечной недостаточности или смерть по любой причине, предпочтительно, в течение периода времени не менее 150 дней, 180 дней, 270 дней, наиболее предпочтительно, по меньшей мере 365 дней после получения образца, вышеупомянутый диапазон референсных значений от 125,1 пг/мл до 383,3 пг/мл или от 125,1 пг/мл до 413,7 пг/мл обеспечивает максимальную чувствительность в диапазоне от 100% до 95%, причем предпочтительное референсное значение 125,1 пг/мл для проМНП или фрагмента (фрагментов) демонстрирует чувствительность 100%, при этом предпочтительное референсное значение 145,4 пг/мл для проМНП или его фрагмента (фрагментов) демонстрирует чувствительность не менее 98%, и при этом референсное значение 383,3 пг/мл или 413,7 пг/мл для проМНП или его фрагмента (фрагментов) демонстрирует чувствительность не менее 95%.
Как подробно описано в примерах, соотношение между чувствительностью и референсным значением может также зависеть от рассмотрения нежелательных явлений, т.е. конечных точек для сценария выбора в виде, например, потерянных дней за год или смертей по любой причине (см. Таблицу 15).
Варианты реализации, относящиеся к определению проПНП
В одном варианте реализации уровень низкой пользы проПНП или его фрагмента (фрагментов) ниже референсного значения ± 20% или менее выбирают из диапазона значений от 106,9 пмоль/л до 248,3 пмоль/л. Любое значение в этом диапазоне можно рассматривать как подходящее пороговое значение. Например, 110, 115, 120, 125, 130, 135, 140, 145, 150, 155, 160, 165, 170, 175, 180, 185, 186,2, 190, 195, 200, 205, 210, 215, 220, 225, 230, 235, 235,6, 240, 245, 250 пмоль/л. Особенно предпочтительными референсными значениями являются 158,5 пмоль/л, предпочтительно, 106,9 пмоль/л.
В предпочтительном варианте реализации уровень низкой пользы проПНП или его фрагмента (фрагментов) имеет величину ниже 158,5 пмоль/л ± 20% или менее, предпочтительно, ниже 106,9 пмоль/л ± 20% или менее.
В одном варианте реализации уровень высокой пользы проПНП или его фрагмента (фрагментов) имеет величину выше референсного значения ± 20% или более, выбранного из диапазона значений от 106,9 пмоль/л до 248,3 пмоль/л. Любое значение в этом диапазоне можно рассматривать как подходящее пороговое значение. Например, 110, 115, 120, 125, 130, 135, 140, 145, 150, 155, 160, 165, 170, 175, 180, 185, 190, 195, 200, 205, 210, 215, 220, 225, 230, 235, 240, 245, 250 пмоль/л. Особенно предпочтительными референсными значениями являются 248,3 пмоль/л, предпочтительно, 235,6 пмоль/л, 186,2 пмоль/л, 158,5 пмоль/л или 106,9 пмоль/л.
В предпочтительном варианте реализации уровень высокой пользы проПНП или его фрагмента (фрагментов) имеет величину выше 248,3 пмоль/л ± 20% или более, предпочтительно, выше 235,6 пмоль/л ± 20% или более, 186,2 пмоль/л ± 20% или более, выше 158,5 пмоль/л или более, 106,9 пмоль/л ± 20% или более.
Как подробно описано в приведенных ниже данных, уровни проПНП, соответствующие низкой и высокой пользе, позволяют точно определить, является ли дистанционное ведение пациента целесообразным, т.е. терапевтически эффективным и, таким образом, его следует назначить, или же от дистанционного ведения пациента можно безопасно отказаться и не назначать. Что касается нежелательных явлений или рисков, таких как острая декомпенсация из-за сердечной недостаточности или смерть по любой причине, желательно в течение периода времени по меньшей мере 10 дней, 30 дней, наиболее предпочтительно, не менее 90 дней после получения образца, вышеупомянутый диапазон референсных значений от 106,9 пмоль/л до 248,3 пмоль/л обеспечивает максимальную чувствительность в диапазоне от 100% до 80%, причем предпочтительное референсное значение 106,9 пмоль/л для проПНП демонстрирует чувствительность 100%, при этом предпочтительное референсное значение 158,5 пмоль/л для проПНП демонстрирует чувствительность 95%, референсное значение 186,2 пмоль/л демонстрирует чувствительность 90%, референсное значение 235,6 пмоль/л демонстрирует чувствительность 85%. Для референсного значения 248,3 пмоль/л установлена чувствительность 80%.
Пациентам с результатами ниже этих пороговых значений с чувствительностью 100-80% рекомендуется отказ от назначения дистанционного ведения пациентов (исключение). В рамках стандартного лечения оценка с использованием проПНП должна быть повторена в другой момент времени в будущем. В зависимости от оцененного риска пациент может быть снова включен в группу недистанционного ведения пациента или в группу дистанционного ведения пациентов.
Пациентам с результатами выше этих пороговых значений с чувствительностью менее 80% рекомендуется назначать дистанционное ведение (включение). В рамках стандартного лечения оценка с использованием проПНП должна быть повторена в другой момент времени в будущем. В зависимости от оцененного риска пациент может быть вновь включен в группу дистанционного ведения пациентов или в группу недистанционного ведения пациентов.
Следует отметить, что предпочтительные референсные значения и связанные с ними уровни высокой и низкой пользы могут зависеть от периода времени, в течение которого уровень проПНП должен указывать на целесообразность назначения или отказ от назначения дистанционного ведения пациента. В общем, для безопасного отказа от назначения пациенту дистанционного ведения потребуется более низкое референсное значение в качестве верхней границы уровня низкой пользы. В некоторых вариантах реализации верхние границы предпочтительного уровня низкой пользы могут быть такими же низкими, как известные пороговые значения для диагностики сердечно-сосудистого заболевания, предпочтительно, сердечной недостаточности.
Вышеупомянутые референсные значения, а также уровни высокой и низкой пользы могут быть особенно предпочтительными, поскольку указывают на целесообразность назначения или отказа от назначения дистанционного ведения пациента в течение периода времени не менее 10 дней, предпочтительно, не менее 30 дней, 60 дней или по меньшей мере 90 дней. Для значительных, более длительных периодов времени, например, не менее 150 дней, 180 дней, 270 дней или 365 дней могут быть предпочтительны более низкие референсные значения.
В некоторых вариантах реализации уровень низкой пользы проПНП или его фрагмента (фрагментов) имеет величину ниже референсного значения ± 20% или менее, причем референсное значение выбирают из диапазона значений от 80 пмоль/л до 106,9 пмоль/л. Любое значение в этом диапазоне можно рассматривать как подходящее пороговое значение. Например, 80, 85, 90, 95, 100, 105 или 106,9 пмоль/л.
В некоторых вариантах реализации уровень высокой пользы проПНП или его фрагмента (фрагментов) выше референсного значения ± 20% или более, при этом референсное значение выбирают из диапазона значений от 80 пмоль/л до 106,9 пмоль/л. Любое значение в этом диапазоне можно рассматривать как подходящее пороговое значение. Например, 80, 85, 90, 95, 100, 105 или 106,9 пмоль/л.
Дополнительным неожиданным открытием является то, что одни и те же референсные значения могут использоваться для определения уровней проАДМ, проМНП и/или проПНП, соответствующих низкой и высокой пользе. При этом уровень низкой пользы соответствует уровню ниже установленного референсного значения, в то время как уровень высокой пользы соответствует уровню выше указанного референсного значения. Использование идентичных референсных значений в качестве пороговых значений для определения уровней низкой и высокой пользы упрощает процесс принятия решений и устраняет неоднозначные серые зоны.
В некоторых вариантах реализации уровень высокой пользы для по меньшей мере одного биомаркера, выбранного из группы, состоящей из проАДМ, проМНП и проПНП, имеет величину выше раскрытых предпочтительных референсных значений, но ниже верхнего порогового значения, при этом верхнее пороговое значение указывает на переход пациента в состояние высокого риска, при котором может потребоваться госпитализация.
В одном варианте реализации сердечно-сосудистое заболевание представляет собой сердечную недостаточность.
В одном варианте реализации сердечно-сосудистое заболевание представляет собой сердечную недостаточность, и пациент подвергался госпитализации в течение последних 12 месяцев вследствие сердечной недостаточности.
Термин госпитализация, предпочтительно, относится к постоянному контролю и/или оценке состояния здоровья пациента в больнице, будь то кабинет неотложной помощи, больничная палата, отделение интенсивной терапии или другое помещение больницы или клиники.
В одном варианте реализации сердечно-сосудистое заболевание представляет собой хроническую сердечную недостаточность.
В одном варианте реализации у пациента диагностировано сердечно-сосудистое заболевание и он был госпитализирован с неблагоприятным сердечно-сосудистым исходом по меньшей мере за 3 месяца, предпочтительно, по меньшей мере за 6 месяцев, 9 месяцев или 12 месяцев до получения образца.
В одном варианте реализации сердечно-сосудистое заболевание представляет собой застойную сердечную недостаточность.
В одном варианте реализации сердечно-сосудистое заболевание представляет собой сердечную недостаточность класса II или класса III в соответствии с системой классификации сердечной недостаточности Нью-Йоркской кардиологической ассоциации (NYHA).
В одном варианте реализации сердечно-сосудистое заболевание представляет собой сердечную недостаточность со сниженной фракцией выброса (СНснФВ) и/или сердечная недостаточность с сохраненной фракцией выброса (СНсохрФВ).
В одном варианте реализации сердечно-сосудистое заболевание представляет собой сердечную недостаточность с повышенным риском неблагоприятного исхода, предпочтительно, выбранного из группы, состоящей из острой декомпенсации и/или смерти.
В одном варианте реализации сердечно-сосудистое заболевание представляет собой сердечную недостаточность с повышенным риском неблагоприятного исхода, включая незапланированную госпитализацию вследствие сердечно-сосудистого события, предпочтительно, незапланированную госпитализацию из-за декомпенсированной сердечной недостаточности, ишемической болезни сердца, инсульта или транзиторной ишемической атаки (ТИА), аритмии, тромбоэмболии легочной артерии, эндокардита или других сердечно-сосудистых событий.
В предпочтительных вариантах реализации данного изобретения образец выбирают из группы, состоящей из образца крови, такого как образец цельной крови, образец сыворотки или образец плазмы, образца слюны и образца мочи.
В одном варианте реализации определение уровня проАДМ или его фрагмента (фрагментов) включает определение уровня СР-проАДМ в образце. Как продемонстрировано в приведенных ниже примерах, СР-проАДМ, предпочтительно, определяемый с использованием известной продукции для иммуноанализов фирмы B.R.A.H.M.S (Хеннигсдорф, Германия), позволяет осуществлять надежное и эффективное прогнозирование в соответствии с описанными в данном документе способами. Могут быть также использованы молекулы, альтернативные АДМ, такие как PAMP (20-членный N-концевой пептид проадреномедуллина) или зрелый адреномедуллин (включая биологически активную форму, также известную как био-АДМ), включая предшественники или фрагменты.
В одном варианте реализации определение уровня проМНП или его фрагмента (фрагментов) включает определение уровня NT-проМНП в образце. Как показано в приведенных ниже примерах, NT-проМНП, предпочтительно, определяемый с использованием известных продуктов для иммуноанализа фирмы BRAHMS GmbH (Хеннигсдорф, Германия) демонстрирует надежный и эффективный прогноз по методикам, описанным в данном документе. Также можно использовать альтернативные молекулы МНП, такие как зрелый МНП, включая предшественники или фрагменты.
В одном варианте реализации определение уровня проПНП или его фрагмента (фрагментов) включает определение уровня СР-проПНП в образце. Как продемонстрировано в приведенных ниже примерах, СР-проПНП, предпочтительно, определяемый с использованием известной продукции для иммуноанализа фирмы B.R.A.H.M.S (Хеннигсдорф, Германия), позволяет проводить надежное и эффективное прогнозирование в соответствии со способами, описанными в данном документе. Альтернативные молекулы ПНП, такие как NT-проПНП, включая предшественники или фрагменты, также могут быть использованы.
В одном варианте реализации первый образец берут у пациента в первый момент времени, и второй образец берут у пациента во второй момент времени.
При использовании в данном изобретении, определение более низкого уровня маркера во втором образце по сравнению с первым образцом может указывать на снижение уровней соответствующего маркера у пациента в течение времени наблюдения. Наоборот, повышенные уровни во втором образце по сравнению с первым образцом могут указывать на повышение уровней маркера в течение времени наблюдения.
Может быть предпочтительным, чтобы между первым и вторым моментами времени прошло, по меньшей мере, 1 день, 1 неделя, 2 недели, один месяц или три месяца. Также может быть предпочтительным, чтобы прошло менее 12 месяцев или менее, 6 месяцев, 3 месяца, так что предпочтительный промежуток времени между взятием двух образцов может составлять, например, от 1 недели до 3 месяцев, от одного месяца до 3 месяцев, от 1 недели до одного месяца, или соответствовать любой другой комбинации вышеупомянутых предпочтительных интервалов времени.
В одном варианте реализации первый образец берут у пациента в первый момент времени, а второй образец берут у пациента во второй момент времени, причем абсолютная разница, соотношение и/или скорость изменения уровня по меньшей мере одного биомаркера, выбранного из группы, состоящей из проАДМ, проМНП и проПНП или их фрагмента (фрагментов), в отношении первого и второго момента времени указывает на целесообразность назначения или отказа от назначения дистанционного ведения для указанного пациента.
Скорость изменения уровня биомаркера (биомаркеров) по отношению к указанным первому и второму моментам времени, предпочтительно, касается абсолютной разницы в уровне биомаркера (биомаркеров) за промежуток времени между указанными первым и вторым моментами времени. Однако скорость изменения может также касаться относительной разницы в уровне биомаркера (биомаркеров), например, в виде процентного увеличения и/или уменьшения за промежуток времени между указанными первым и вторым моментами времени.
Следует понимать, что в отношении первого и второго моментов времени любая комбинация раскрытых в данном документе моментов времени взятия образца может быть предпочтительной.
Кроме того, в некоторых вариантах реализации может быть предпочтительным взятие дополнительных образцов, таких как третий образец, четвертый образец и т.д., в соответствующие третий, четвертый и т.д. моменты времени, с целью использования абсолютной разницы, соотношения и/или скорости изменения уровня биомаркеров в разные моменты времени для назначения или отказа от назначения дистанционного ведения пациентов.
В одном варианте реализации уровень по меньшей мере одного биомаркера, выбранного из группы, состоящей из его проАДМ, проМНП и проПНП, указывает на целесообразность назначения некоторого вида дистанционного ведения пациента, предпочтительно, с указанием объема или типа многократно собираемых данных о состоянии здоровья пациента, частоту анализа данных медицинским персоналом или автоматизированной медицинской системой, частоту пересмотра доз лекарств и/или частоту дистанционных консультаций пациента.
Как раскрыто в данном документе, уровни биомаркеров, соответствующие высокой пользе, указывают на терапевтический эффект, служащий обоснованием назначения дистанционного ведения пациента. В некоторых вариантах реализации уровень биомаркера не только указывает на целесообразность назначения дистанционного ведения пациента, но и позволяет дополнительно указать вид и/или тип дистанционного ведения пациента.
Уровни биомаркеров, которые находятся на нижнем пределе уровня высокой пользы, предпочтительно, указывают на менее интенсивное дистанционное ведение пациентов, которое может характеризоваться сбором меньшего количества данных о состоянии здоровья пациента, уменьшенной частотой анализа данных медицинским персоналом или автоматизированной медицинской системой, а также меньшей частотой пересмотра доз лекарств или дистанционных консультаций пациентов по сравнению с уровнями биомаркеров, которые находятся на верхнем пределе уровня высокой пользы.
Таким образом, такой вариант реализации позволяет дополнительно оптимизировать дистанционное ведение пациентов, чтобы обеспечить оптимальную поддержку для каждого пациента при надлежащих усилиях, которые отражают вероятную пользу для пациентов от дистанционного мониторинга и/или телемедицинских вмешательств в рамках предписанного дистанционного ведения пациентов.
В одном варианте реализации уровни двух или трех биомаркеров или их фрагментов, выбранных из группы, состоящей из проАДМ, проМНП и проПНП, определяют и сравнивают с одним или несколькими референсными значениями, чтобы определить, указывают ли данные уровни на целесообразность назначения или отказа от назначения дистанционного ведения для указанного пациента.
В одном варианте реализации уровни проАДМ и проМНП определяют и сравнивают с одним или несколькими референсными значениями, чтобы определить, указывают ли данные уровни на целесообразность назначения или отказа от назначения дистанционного ведения для указанного пациента.
В одном варианте реализации уровни проАДМ и проПНП определяют и сравнивают с одним или несколькими референсными значениями, чтобы определить, указывают ли данные уровни на целесообразность назначения или отказа от назначения дистанционного ведения для указанного пациента.
В одном варианте реализации уровни проМНП и проПНП определяют и сравнивают с одним или несколькими референсными значениями, чтобы определить, указывают ли данные уровни на целесообразность назначения или отказа от назначения дистанционного ведения для указанного пациента.
В одном варианте реализации уровни проАДМ, проМНП и проПНП определяют и сравнивают с одним или несколькими референсными значениями, чтобы определить, указывают ли данные уровни на целесообразность назначения или отказа от назначения дистанционного ведения для указанного пациента.
В некоторых вариантах реализации определяют уровни двух биомаркеров или их фрагментов, выбранных из группы, состоящей из проАДМ, проМНП и проПНП, и уровень низкой пользы для обоих определенных биомаркеров указывает на нецелесообразность назначения дистанционного ведения для указанного пациента.
В некоторых вариантах реализации определяют уровни двух биомаркеров или их фрагмента (фрагментов), выбранных из группы, состоящей из проАДМ, проМНП и проПНП, и уровни высокой пользы для обоих определяемых биомаркеров свидетельствуют о целесообразности назначения дистанционного ведения для указанного пациента.
В некоторых вариантах реализации определяют уровни двух или трех биомаркеров или их фрагментов, выбранных из группы, состоящей из проАДМ, проМНП и проПНП, и уровень низкой пользы для по меньшей мере одного из определяемых биомаркеров указывает на целесообразность назначения дистанционного ведения для указанного пациента.
Определение двух или трех биомаркеров, выбранных из группы, состоящей из проАДМ, проМНП и проПНП или их фрагмента (фрагментов), обеспечивает статистически достоверное терапевтическое руководство, стратификацию и мониторинг дистанционного ведения пациентов, что гарантирует получение лечения максимальным количеством пациентов, которые могут получить пользу от дистанционного ведения пациентов, в то время как максимальное количество пациентов, которые не получат пользу, может быть безопасно исключено, чтобы сэкономить ресурсы.
Особо достоверное терапевтическое руководство при дистанционном ведении пациентов может быть достигнуто при определении уровней проАДМ и проМНП или их фрагмента (фрагментов).
Варианты реализации, связанные с определением проАДМ и проМНП
В одном варианте реализации уровни проАДМ и проМНП определяют у пациента и сравнивают с одним или несколькими референсными значениями, чтобы определить, свидетельствуют ли указанные уровни о целесообразности назначения или отказе от назначения дистанционного ведения для указанного пациента.
В одном варианте реализации уровень проАДМ или его фрагмента (фрагментов) ниже референсного значения ± 20% или менее, причем референсное значение выбрано из диапазона значений от 0,63 нмоль/л до 0,75 нмоль/л, и уровень проМНП или его фрагмента (фрагментов) ниже референсного значения ± 20% или менее, причем референсное значение выбрано из диапазона значений от 125 пг/мл до 413,7 пг/мл, свидетельствуют о том, что назначать дистанционное ведение пациентов нецелесообразно.
Для уровня проАДМ или фрагмента (фрагментов) любое значение в этом диапазоне может рассматриваться как подходящее пороговое значение. Например, 0,63, 0,64, 0,65, 0,66, 0,67, 0,68, 0,69, 0,7, 0,71, 0,72, 0,73, 0,74 или 0,75 нмоль/л. Особенно предпочтительными референсными значениями являются 0,63 нмоль/л ± 20%, предпочтительно, 0,69 ± 20%, 0,72 нмоль/л ± 20% или 0,75 нмоль/л ± 20%.
Для уровня проМНП или фрагмента (фрагментов) любое значение в этом диапазоне может рассматриваться как подходящее пороговое значение. Например, 125, 125,1, 135, 145, 145,4, 155, 165, 175, 185, 195, 205, 215, 225, 235, 245, 255, 265, 275, 285, 295, 305, 315, 325, 335, 345, 355, 365, 375, 380, 383,3, 385, 390, 395, 400, 405, 410 или 413,7 пг/мл. Особенно предпочтительными референсными значениями являются 413,7 пг/мл ± 20%, 383,3 пг/мл ± 20%, предпочтительно, 145,4 пг/мл ± 20% или 125,1 пг/мл ± 20%.
Таким образом, пороговые значения для выбора пациентов, которым не следует рекомендовать дистанционное ведение на основе определения проАДМ и проМНП, могут соответствовать уровням 125,1 и 413,7 пг/мл для NT-проМНП и 0,63 и 0,75 нмоль/л для СР-проАДМ, в зависимости от желаемой безопасности (чувствительность 100%; 98%; 95%) и критерия отбора пациентов (не менее 30 потерянных дней/год из-за незапланированной госпитализации с сердечно-сосудистыми заболеваниями или смерти от всех причин; смерть от всех причин). В общем, чем ниже желаемая чувствительность, тем выше будут критические пороговые значения биомаркеров, и тем выше доля пациентов, которым не рекомендуется дистанционное ведение (см. Таблицу 15).
В одном варианте реализации уровень проАДМ или его фрагмента (фрагментов) ниже референсного значения 0,63 нмоль/л ± 20% или менее и уровень проМНП или его фрагмента (фрагментов) ниже референсного значения 125,1 ± 20% или менее указывают на нецелесообразность назначения дистанционного ведения пациентов.
В одном варианте реализации уровень проАДМ или его фрагмента (фрагментов) ниже референсного значения 0,69 нмоль/л ± 20% или менее и уровень проМНП или его фрагмента (фрагментов) ниже референсного значения 125,1 ± 20% или менее указывают на нецелесообразность назначения дистанционного ведения пациентов.
В одном варианте реализации уровень проАДМ или его фрагмента (фрагментов) ниже референсного значения 0,72 нмоль/л ± 20% или менее и уровень проМНП или его фрагмента (фрагментов) ниже референсного значения 145,4 ± 20% или менее указывают на нецелесообразность назначения дистанционного ведения пациентов.
В одном варианте реализации уровень проАДМ или его фрагмента (фрагментов) ниже референсного значения 0,75 нмоль/л ± 20% или менее и уровень проМНП или его фрагмента (фрагментов) ниже референсного значения 383,3 ± 20% или менее указывают на нецелесообразность назначения дистанционного ведения пациентов.
В одном варианте реализации уровень проАДМ или его фрагмента (фрагментов) ниже референсного значения 0,75 нмоль/л ± 20% или менее и уровень проМНП или его фрагмента (фрагментов) ниже референсного значения 413,7 ± 20% или менее указывают на нецелесообразность назначения дистанционного ведения пациентов.
Что касается нежелательных явлений или рисков, таких как острая декомпенсация вследствие сердечной недостаточности, смерть по любой причине или потерянные дни из-за незапланированной госпитализации или смерти, вышеупомянутые комбинации уровней проАДМ и проМНП обеспечивают максимальную чувствительность в диапазоне от 100% до 95% (см. Таблицу 15).
Использование комбинации проАДМ и проМНП по сравнению с одним биомаркером позволяет с еще большей безопасностью сократить количество пациентов, для которых дистанционное ведение является полезным.
Уменьшение популяции, рекомендованной для ДВП по результатам совместного использования проМНП и проАДМ, позволяет исключить бессобытийных пациентов с довольно высокими уровнями проМНП, которые, тем не менее, имели довольно низкие уровни проАДМ, и наоборот, которые получили бы назначение на основании использования только одного из биомаркеров для стратификации риска.
Например, как подробно описано в примерах ниже, для максимальной 100% чувствительности рекомендации по терапии, основанные только на уровне проМНП, могут сократить популяцию, использующую дистанционное ведение пациентов, на 3,4% (в отношении смерти от всех причин). С использованием комбинации проМНП и проАДМ, популяция с рекомендованным ДВП может быть безопасно снижена на 13,9% (в отношении смерти от всех причин). Комбинация биомаркеров в этом случае позволяет сократить ресурсы на треть без ущерба для безопасности пациентов.
Более того, раскрытые референсные значения для терапевтического руководства с использованием комбинации проМНП и проАДМ аналогичным образом позволяют безопасно включать пациентов, которые должны получать дистанционное ведение.
В одном варианте реализации уровень проАДМ или его фрагмента (фрагментов) выше референсного значения ± 20% или более, причем референсное значение выбрано из диапазона значений от 0,63 нмоль/л до 0,75 нмоль/л, и уровень проМНП или его фрагмента (фрагментов) выше референсного значения ± 20% или более, причем референсное значение выбрано из диапазона значений от 125 пг/мл до 413,7 пг/мл, свидетельствуют о целесообразности назначения дистанционного ведения пациентов.
Для уровня проАДМ или фрагмента (фрагментов) любое значение в этом диапазоне может рассматриваться как подходящее пороговое значение. Например, 0,63, 0,64, 0,65, 0,66, 0,67, 0,68, 0,69, 0,7, 0,71, 0,72, 0,73, 0,74 или 0,75 нмоль/л. Особенно предпочтительными референсными значениями являются 0,63 нмоль/л ± 20%, предпочтительно, 0,69 ± 20%, 0,72 нмоль/л ± 20% или 0,75 нмоль/л ± 20%.
Для уровня проМНП или фрагмента (фрагментов) любое значение в этом диапазоне может рассматриваться как подходящее пороговое значение. Например, 125, 125,1, 135, 145, 145,4, 155, 165, 175, 185, 195, 205, 215, 225, 235, 245, 255, 265, 275, 285, 295, 305, 315, 325, 335, 345, 355, 365, 375, 380, 383,3, 385, 390, 395, 400, 405, 410 или 413,7 пг/мл. Особенно предпочтительными референсными значениями являются 413,7 пг/мл ± 20%, 383,3 пг/мл ± 20%, предпочтительно, 145,4 пг/мл ± 20% или 125,1 пг/мл ± 20%.
В одном варианте реализации уровень проАДМ или его фрагмента (фрагментов) выше референсного значения 0,63 нмоль/л ± 20% или более и уровень проМНП или его фрагмента (фрагментов) выше референсного значения 125,1 ± 20% или более свидетельствуют о целесообразности назначения дистанционного ведения пациента.
В одном варианте реализации уровень проАДМ или его фрагмента (фрагментов) выше референсного значения 0,69 нмоль/л ± 20% или более и уровень проМНП или его фрагмента (фрагментов) выше референсного значения 125,1 ± 20% или более свидетельствуют о целесообразности назначения дистанционного ведения пациента.
В одном варианте реализации уровень проАДМ или его фрагмента (фрагментов) выше референсного значения 0,72 нмоль/л ± 20% или более и уровень проМНП или его фрагмента (фрагментов) выше референсного значения 145,4 ± 20% или более свидетельствуют о целесообразности назначения дистанционного ведения пациента.
В одном варианте реализации уровень проАДМ или его фрагмента (фрагментов) выше референсного значения 0,75 нмоль/л ± 20% или более и уровень проМНП или его фрагмента (фрагментов) выше референсного значения 383,3 ± 20% или более свидетельствуют о целесообразности назначения дистанционного ведения пациента.
В одном варианте реализации уровень проАДМ или его фрагмента (фрагментов) выше референсного значения 0,75 нмоль/л ± 20% или более и уровень проМНП или его фрагмента (фрагментов) выше референсного значения 413,7 ± 20% или более свидетельствуют о целесообразности назначения дистанционного ведения пациента.
В дополнительном варианте реализации способ терапевтического руководства, стратификации и/или мониторинга дистанционного ведения пациента, у которого было диагностировано сердечно-сосудистое заболевание, дополнительно включает
- определение уровня по меньшей мере одного дополнительного биомаркера, предпочтительно, сердечно-сосудистого биомаркера, такого как тропонин, C-реактивный белок (СРБ), проэндотелин-1, провазопрессин или их фрагменты, и/или маркера почечной функции, такого как креатинин, мочевина, мочевая кислота, цистатин С, β-следовые протеины (BTB) или инулин,
- причем уровни по меньшей мере одного дополнительного биомаркера, предпочтительно, сердечно-сосудистого биомаркера и/или маркера почечной функции, и уровень по меньшей мере одного биомаркера, выбранного из группы, состоящей из проАДМ, проМНП и проПНП или их фрагмента (фрагментов), сравнивают с одним или несколькими референсными значениями, при этом указанные уровни указывают на целесообразность назначения или отказа от назначения дистанционного ведения для указанного пациента.
В одном варианте реализации способ терапевтического руководства, стратификации и/или мониторинга дистанционного ведения пациента, у которого было диагностировано сердечно-сосудистое заболевание, дополнительно включает
- определение по меньшей мере одного клинического параметра, причем по меньшей мере один клинический параметр, предпочтительно, представляет собой возраст, вес, индекс массы тела, пол, этническое происхождение, креатинин крови, фракцию выброса левого желудочка (ФВЛЖ), фракцию выброса правого желудочка (ФВПЖ), класс по NYHA, оценку риска сердечной недостаточности по шкале MAGGIC, статус лечения, артериальное давление (систолическое/диастолическое), частоту сердечных сокращений, сердечный ритм по электрокардиограмме (ЭКГ), показатель сатурации периферической крови кислородом (SpO2), самооценку состояния здоровья (по шкале) или параметр, указывающий на функцию почек, предпочтительно, скорость клиренса креатинина и/или скорость клубочковой фильтрации (СКФ),
- причем по меньшей мере один клинический параметр и уровень по меньшей мере одного биомаркера или его фрагмента сравнивают с одним или несколькими референсными значениями, при этом по меньшей мере один клинический параметр и уровень по меньшей мере одного биомаркера или его фрагмента (фрагментов) указывают на целесообразность назначения или отказа от назначения дистанционного ведения для указанного пациента.
В одном варианте реализации по меньшей мере один дополнительный биомаркер и/или по меньшей мере один дополнительный клинический параметр определяют не более чем за 2 недели, предпочтительно, не более чем за 1 неделю, за 1 день до взятия указанного образца и не более чем через 2 недели, предпочтительно, не более чем через 1 неделю, через 1 день после взятия указанного образца. Наиболее предпочтительно, по меньшей мере один дополнительный биомаркер и/или по меньшей мере один дополнительный клинический параметр определяют одновременно с биомаркером, выбранным из группы, состоящей из проАДМ, проМНП и проПНП. Например, в отношении дополнительного маркера может использоваться тот же самый образец и/или одновременно с ним может быть взят другой образец.
Определение уровня дополнительных биомаркеров и/или других клинических параметров позволяет дополнительно повысить статистическую достоверность для терапевтического руководства, стратификации и мониторинга дистанционного ведения пациентов и усилить описанные в данном документе преимущества, в частности, в отношении ресурсоэффективного распределения терапевтических средств при обеспечении положительного результата для пациента.
В одном варианте реализации способ терапевтического руководства, стратификации и/или мониторинга удаленного ведения пациента с диагностированным сердечно-сосудистым заболеванием дополнительно включает
- определение по меньшей мере одного параметра, характеризующего функцию почек, предпочтительно, скорости клиренса креатинина и/или скорости клубочковой фильтрации (СКФ),
- причем по меньшей мере один параметр, характеризующий функцию почек, предпочтительно, скорость клиренса креатинина и/или скорость клубочковой фильтрации, и уровень по меньшей мере одного биомаркера или его фрагмента сравнивают с одним или несколькими референсными значениями для определения того, указывают ли по меньшей мере один параметр, характеризующий функцию почек, предпочтительно, скорость клиренса креатинина и/или скорость клубочковой фильтрации, а также уровень по меньшей мере одного биомаркера или его фрагмента (фрагментов), на целесообразность назначения или отказа от назначения дистанционного ведения для указанного пациента.
Как обнаружили авторы изобретения, определение маркеров или параметров, указывающих на функцию почек, таких как скорость клиренса креатинина и/или скорость клубочковой фильтрации, в дополнение к определению биомаркеров, описанных в данном документе, позволяет оптимизировать терапевтическое руководство, как описано в данном документе.
Как показывают приведенные ниже данные, при нарушении функции почек повышение уровня по меньшей мере одного биомаркера, выбранного из группы, состоящей из проАДМ, проМНП и проПНП, может частично объясняться дисфункцией почек, независимо от прогностического потенциала биомаркеров при руководстве дистанционным ведением пациентов с учетом сердечно-сосудистых заболеваний.
Соответственно, когда определенный параметр, такой как скорость клиренса креатинина и/или скорость клубочковой фильтрации, указывает на то, что почка не функционирует должным образом, референсные значения и связанные с ними уровни биомаркеров низкой или высокой пользы для принятия решения о том, следует ли назначать дистанционное ведение пациента, предпочтительно, адаптируют.
Предпочтительно, когда почка не функционирует должным образом, референсные значения повышают, так чтобы уровень низкой пользы расширялся с включением более высоких определяемых уровней биомаркеров. Указанная адаптация, предпочтительно, может учитывать вышеупомянутый вывод о том, что повышенные уровни биомаркеров, описанных в данном документе, могут быть частично отнесены к почечной дисфункции, а не к процессам, связанным с сердечной недостаточностью.
Например, как подробно описано в приведенных ниже данных, предпочтительный уровень проАДМ или его фрагмента (фрагментов) низкой пользы, демонстрирующий чувствительность 95%, может быть расширен до уровней биомаркера ниже 1,06 нмоль/л ± 20% в случае нарушения функции почек по сравнению с уровнем низкой пользы ниже 0,86 нмоль/л ± 20% для пациентов без подтвержденного снижения функции почек.
Расширяя уровень низкой пользы, можно безопасно исключить большее количество пациентов из назначения дистанционного ведения, что позволяет дополнительно оптимизировать распределение ресурсов для тех пациентов, которые действительно в них нуждаются.
Варианты реализации, относящиеся к определению проАДМ и СКФ
В одном варианте реализации по меньшей мере один клинический параметр, который определяется дополнительно, представляет собой СКФ, предпочтительно, СКФ на основе CKD-EPI, при этом в случае, если СКФ имеет величину ниже 50, уровень низкой пользы проАДМ или его фрагмента (фрагментов) имеет величину ниже референсного значения ± 20% или менее, причем референсное значение выбирают из диапазона значений от 0,98 нмоль/л до 1,06 нмоль/л. Любое значение в этом диапазоне можно рассматривать как подходящее пороговое значение. Например, 0,98, 0,99, 1, 1,01, 1,02, 1,03, 1,04, 1,05 или 1,06 нмоль/л. Что касается нежелательных явлений или рисков, таких как острая декомпенсация из-за сердечной недостаточности или смерть по любой причине, вышеупомянутый диапазон референсных значений для проАДМ от 0,98 нмоль/л до 1,06 нмоль/л в случае СКФ на основе CKD-EPI ниже 50 обеспечивает максимальную чувствительность в диапазоне от 100% до 95%, при этом предпочтительное референсное значение 0,98 нмоль/л демонстрирует чувствительность 100%, в то время как предпочтительное референсное значение 1,06 нмоль/л соответствует чувствительности не менее 95% (см. Таблицу 10).
В предпочтительном варианте реализации СКФ, предпочтительно, СКФ на основе CKD-EPI, имеет величину ниже 50, а уровень проАДМ или его фрагмента (фрагментов) низкой пользы имеет величину ниже 0,98 нмоль/л ± 20% или менее, предпочтительно, ниже 1,06 нмоль/л ± 20% или менее.
В одном варианте реализации по меньшей мере один клинический параметр, который определяется дополнительно, представляет собой СКФ, предпочтительно, СКФ на основе CKD-EPI, при этом в случае, если СКФ ниже 60, уровень проАДМ или его фрагмента (фрагментов) низкой пользы имеет величину ниже референсного значения ± 20% или менее, причем референсное значение выбирают из диапазона значений от 0,97 нмоль/л до 1,05 нмоль/л. Любое значение в этом диапазоне можно рассматривать как подходящее пороговое значение. Например, 0,97, 0,98, 0,99, 1, 1,01, 1,02, 1,03, 1,04 или 1,05 нмоль/л. Что касается нежелательных явлений или рисков, таких как острая декомпенсация из-за сердечной недостаточности или смерть по любой причине, вышеупомянутый диапазон референсных значений для проАДМ от 0,97 нмоль/л до 1,05 нмоль/л в случае СКФ на основе CKD-EPI ниже 60 обеспечивает максимальную чувствительность в диапазоне от 100% до 95%, при этом предпочтительное референсное значение 0,97 нмоль/л демонстрирует чувствительность 100%, в то время как предпочтительное референсное значение 1,05 нмоль/л соответствует чувствительности не менее 95%.
В предпочтительном варианте реализации СКФ, предпочтительно, СКФ на основе CKD-EPI, имеет величину ниже 60 и 20 уровень проАДМ или его фрагмента (фрагментов) низкой пользы имеет величину ниже 0,97 нмоль/л ± 20% или менее, предпочтительно, ниже 1,05 нмоль/л ± 20% или менее (см. Таблицу 10).
В одном варианте реализации по меньшей мере один клинический параметр, который определяется дополнительно, представляет собой СКФ, предпочтительно, СКФ по Кокрофту-Голту, при этом в случае, если СКФ ниже 50, уровень проАДМ или фрагмента (фрагментов) низкой пользы имеет величину ниже референсного значения ± 20% или менее, причем референсное значение выбирают из диапазона значений от 0,84 нмоль/л до 1,05 нмоль/л. Любое значение в пределах этого диапазона можно рассматривать как подходящее пороговое значение. Например, 0,84, 0,85, 0,86, 0,87, 0,88, 0,89, 0,9, 0,91, 0,92, 0,93, 0,94, 0,95, 0,96, 0,97, 0,98, 0,99, 1, 1,01, 1,02, 1,03, 1,04 или 1,05 нмоль/л. Что касается нежелательных явлений или рисков, таких как острая декомпенсация из-за сердечной недостаточности или смерть по любой причине, вышеупомянутый диапазон референсных значений для проАДМ от 0,62 нмоль/л до 1,05 нмоль/л в случае СКФ по Кокрофту-Голту ниже 50 обеспечивает максимальную чувствительность в диапазоне от 100% до 95%, при этом предпочтительное референсное значение 0,84 нмоль/л демонстрирует чувствительность 99%, в товремя как предпочтительное референсное значение 1,05 нмоль/л соответствует чувствительности по меньшей мере 95%.
В предпочтительном варианте реализации СКФ, предпочтительно, СКФ на основе CKD-EPI, имеет величину ниже 50 и уровень проАДМ или его фрагмента (фрагментов) низкой пользы имеет величину ниже 0,84 нмоль/л ± 20% или менее, предпочтительно, ниже 1,05 нмоль/л ± 20% или менее.
В одном варианте реализации по меньшей мере один клинический параметр, который определяется дополнительно, представляет собой СКФ, предпочтительно, СКФ по Кокрофту-Голту, при этом в случае, когда СКФ ниже 60, уровень проАДМ или фрагмента (фрагментов) низкой пользы ниже референсного значения ± 20% или менее, причем референсное значение выбирают из диапазона значений от 0,75 нмоль/л до 0,92 нмоль/л. Любое значение в пределах этого диапазона можно рассматривать как подходящее пороговое значение. Например, 0,75, 0,76, 0,77, 0,78, 0,79, 0,8, 0,81, 0,82, 0,83, 0,84, 0,85, 0,86, 0,87, 0,88, 0,89, 0,9, 0,91 или 0,92 нмоль/л.
В предпочтительном варианте реализации СКФ, предпочтительно, СКФ по Кокрофту-Голту, имеет величину ниже 60, а уровень проАДМ или его фрагмента (фрагментов) низкой пользы составляет менее 0,75 нмоль/л ± 20% или менее, предпочтительно ниже 0,92 нмоль/л ± 20% или менее. Что касается нежелательных явлений или рисков, таких как острая декомпенсация из-за сердечной недостаточности или смерть по любой причине, вышеупомянутый диапазон референсных значений для проАДМ от 0,62 нмоль/л до 0,92 нмоль/л в случае СКФ по Кокрофту-Голту ниже 60 обеспечивает максимальную чувствительность в диапазоне от 100% до 95%, при этом предпочтительное референсное значение 0,75 нмоль/л демонстрирует чувствительность 99%, в то время как предпочтительное референсное значение 0,92 нмоль/л соответствует чувствительности не менее 95% (см. Таблицу 11).
В предпочтительном варианте реализации СКФ, предпочтительно, СКФ по Кокрофту-Голту, имеет величину ниже 30 и уровень проАДМ или его фрагмента (фрагментов) низкой пользы имеет величину ниже 1,14 нмоль/л ± 20% или менее.
В предпочтительном варианте реализации такой параметр, как скорость клиренса креатинина и/или скорость клубочковой фильтрации, указывает на почечную дисфункцию и уровень проАДМ или его фрагмента (фрагментов) низкой пользы имеет величину ниже 0,84 нмоль/л ± 20% или менее, предпочтительно, 0,98 нмоль/л ± 20% или менее, 1,05 нмоль/л ± 20% или менее, 1,06 нмоль/л ± 20% или менее, или 1,14 нмоль/л ± 20% или менее.
Следует отметить, что раскрытая адаптация предпочтительных уровней проАДМ или его фрагмента (фрагментов) низкой пользы аналогично применима к уровням проАДМ или его фрагмента (фрагментов) высокой пользы.
Например, в предпочтительном варианте реализации такой параметр, как скорость клиренса креатинина и/или скорость клубочковой фильтрации указывает на почечную дисфункцию и уровень высокой пользы проАДМ или его фрагмента (фрагментов) имеет величину выше 0,84 нмоль/л ± 20% или более, предпочтительно, 0,98 нмоль/л ± 20% или более, 1,05 нмоль/л ± 20% или более, 1,06 нмоль/л ± 20% или более, или 1,14 нмоль/л ± 20% или более.
Варианты реализации, относящиеся к определению проМНП и СКФ
В одном варианте реализации по меньшей мере один клинический параметр, который определяется дополнительно, представляет собой СКФ, предпочтительно, СКФ на основе CKD-EPI, при этом в случае, если СКФ имеет величину ниже 50, уровень проМНП или фрагмента (фрагментов) низкой пользы имеет величину ниже референсного значения ± 20% или менее, причем указанное референсное значение выбирают из диапазона значений от 237,6 пг/мл до 273,7 пг/мл. Любое значение в этом диапазоне можно рассматривать как подходящее пороговое значение. Например, 240, 250, 260 или 270 пг/мл.
В предпочтительном варианте реализации СКФ, предпочтительно, СКФ на основе CKD-EPI, имеет величину ниже 50, а уровень низкой пользы проМНП или его фрагмента (фрагментов) имеет величину ниже 237,6 пг/мл ± 20% или менее, предпочтительно, ниже 273,7 пг/мл ± 20% или менее.
В одном варианте реализации по меньшей мере один клинический параметр, который определяется дополнительно, представляет собой СКФ, предпочтительно, СКФ на основе CKD-EPI, при этом в случае, если СКФ имеет величину ниже 60, уровень низкой пользы проМНП или фрагмента (фрагментов) имеет величину ниже референсного значения ± 20% или менее, причем референсное значение выбирают из диапазона значений от 237,6 пг/мл до 402,6 пг/мл. Любое значение в этом диапазоне можно рассматривать как подходящее пороговое значение. Например, 240, 250, 260, 270, 280, 290, 300, 310, 320, 330, 340, 350, 360, 370, 380, 390 или 400 пг/мл. Что касается нежелательных явлений или рисков, таких как острая декомпенсация из-за сердечной недостаточности или смерть по любой причине, вышеупомянутый диапазон референсных значений для проМНП от 237,6 пг/мл до 402,6 пг/мл в случае СКФ на основе CKD-EPI ниже 60 обеспечивает максимальную чувствительность в диапазоне от 100% до 95%, при этом предпочтительное референсное значение 237,6 пг/мл демонстрирует чувствительность 100%, в то время как предпочтительное референсное значение 402,6 пг/мл соответствует чувствительности не менее 95%.
В предпочтительном варианте реализации СКФ, предпочтительно, СКФ на основе CKD-EPI, имеет величину ниже 60, а уровень низкой пользы проМНП или его фрагмента (фрагментов) имеет величину ниже 237,6 пг/мл ± 20% или менее, предпочтительно, ниже 402,6 пг/мл ± 20% или менее.
В одном варианте реализации по меньшей мере один клинический параметр, который определяется дополнительно, представляет собой СКФ, предпочтительно, СКФ по Кокрофту-Голту, при этом в случае, если СКФ ниже 50, уровень низкой пользы проМНП или фрагмента (фрагментов) имеет величину ниже референсного значения ± 20% или менее, причем референсное значение выбирают из диапазона значений от 237,6 пг/мл до 454,4 пг/мл. Любое значение в этом диапазоне можно рассматривать как подходящее пороговое значение. Например, 240, 250, 260, 270, 280, 290, 300, 310, 320, 330, 340, 350, 360, 370, 380, 390, 400, 410, 420, 430, 440, 450 пг/мл. Что касается нежелательных явлений или рисков, таких как острая декомпенсация из-за сердечной недостаточности или смерть по любой причине, вышеупомянутый диапазон референсных значений для проМНП от 237,6 пг/мл до 454,4 пг/мл в случае СКФ по Кокрофту-Голту ниже 50 обеспечивает максимальную чувствительность в диапазоне от 100% до 95%, при этом предпочтительное референсное значение 237,6 пг/мл демонстрирует чувствительность 100%, в то время как предпочтительное референсное значение 454,4 пг/мл соответствует чувствительности не менее 95%.
В предпочтительном варианте реализации СКФ, предпочтительно, СКФ по Кокрофту-Голту, имеет величину ниже 50, а уровень низкой пользы проМНП или его фрагмента (фрагментов) имеет величину ниже 237,6 пг/мл ± 20% или менее, предпочтительно, ниже 454,4 пг/мл ± 20% или менее.
В одном варианте реализации по меньшей мере один клинический параметр, который определяется дополнительно, представляет собой СКФ, предпочтительно, СКФ по Кокрофту-Голту, при этом в случае, если СКФ ниже 60, уровень низкой пользы проМНП или фрагмента (фрагментов) имеет величину ниже референсного значения ± 20% или менее, причем референсное значение выбирают из диапазона значений от 137,7 пг/мл до 402,6 пг/мл. Любое значение в этом диапазоне можно рассматривать как подходящее пороговое значение. Например, 140, 150, 160, 170, 180, 190, 200, 210, 220, 230, 240, 250, 260, 270, 280, 290, 300, 310, 320, 330, 340, 350, 360, 370, 380, 390, 400 пг/мл. Что касается нежелательных явлений или рисков, таких как острая декомпенсация из-за сердечной недостаточности или смерть по любой причине, вышеупомянутый диапазон референсных значений для проМНП от 137,7 пг/мл до 402,6 пг/мл в случае СКФ по Кокрофту-Голту ниже 60 обеспечивает максимальную чувствительность в диапазоне от 100% до 95%, при этом предпочтительное референсное значение 137,7 пг/мл демонстрирует чувствительность 100%, в то время как предпочтительное референсное значение 402,6 пг/мл соответствует чувствительности по меньшей мере 95%.
В предпочтительном варианте реализации СКФ, предпочтительно, СКФ по Кокрофту-Голту, имеет величину ниже 60, а уровень низкой пользы проМНП или его фрагмента (фрагментов) имеет величину ниже 137,7 пг/мл ± 20% или менее, предпочтительно, ниже 203,9 пг/мл ± 20% или менее, более предпочтительно, ниже 402,6 пг/мл ± 20% или менее.
В предпочтительном варианте реализации СКФ, предпочтительно, СКФ по Кокрофту-Голту, имеет величину ниже 30, а уровень низкой пользы проМНП или его фрагмента (фрагментов) имеет величину ниже 237,6 пг/мл ± 20% или менее.
В предпочтительном варианте реализации такой параметр, как скорость клиренса креатинина и/или скорость клубочковой фильтрации, указывает на почечную дисфункцию, и уровень низкой пользы проМНП или его фрагмента (фрагментов) имеет величину ниже 203,9 пг/мл ± 20% или менее, предпочтительно, ниже 237,6 пг/мл ± 20% или менее, ниже 273,7 пг/мл ± 20% или менее, ниже 402,6 пг/мл или менее, или ниже 454,4 пг/мл ± 20% или менее.
Как подробно описано в приведенных ниже данных, комбинирование любого одного из биомаркеров с измерением СКФ позволяет повысить прогнозирующую способность метода. Однако при объединении двух или более биомаркеров, например, при использовании проМНП и проАДМ, с параметром, характеризующим почечную функцию, таким как СКФ, достигается особенно сильное повышение прогнозирующей способности метода
Как показано в Таблицах 10 и 11 (столбцы 6 и 9) и в Таблице 13, благодаря объединению проАДМ и проМНП с СКФ можно безопасно исключить более чем вдвое или втрое большее количество пациентов из получения дистанционного ведения пациентов по сравнению с использованием только проМНП с СКФ. Таким образом, данный вариант реализации позволяет обеспечить особенно эффективное распределение ресурсов для тех пациентов, которым выгодно дистанционное ведение.
Следует отметить, что раскрытая адаптация предпочтительных уровней низкой пользы проМНП или его фрагмента (фрагментов) аналогично применима к предпочтительным уровням высокой пользы проМНП или его фрагмента (фрагментов).
Например, в предпочтительном варианте реализации такой параметр, как скорость клиренса креатинина и/или скорость клубочковой фильтрации указывает на почечную дисфункцию и уровень высокой пользы проМНП или его фрагмента (фрагментов) имеет величину выше 203,9 пг/мл ± 20% или более, предпочтительно, выше 237,6 пг/мл ± 20% или более, выше 273,7 пг/мл ± 20% или более, выше 402,6 пг/мл или более, или выше 454,4 пг/мл ± 20% или более.
В дополнительном варианте реализации данное изобретение относится к набору для осуществления способа по данному изобретению, включающему
- детектирующие реагенты для определения по меньшей мере одного биомаркера, выбранного из группы, состоящей из проАДМ, проМНП и проПНП или их фрагмента (фрагментов) в образце от пациента, и
- референсные данные, такие как референсные значения для определения того, указывает ли уровень по меньшей мере одного биомаркера, выбранного из группы, состоящей из проАДМ, проМНП и проПНП, на целесообразность назначения или отказа от назначения дистанционного ведения пациента, в частности, референсные данные для уровня низкой пользы по меньшей мере одного биомаркера, и уровня высокой пользы по меньшей мере одного биомаркера, при этом указанные референсные данные, предпочтительно, хранятся на машиночитаемом носителе и/или используются в форме исполняемого компьютером кода, скомпонованного для сравнения определяемого по меньшей мере одного биомаркера с референсными значениями,
- необязательно, детектирующие реагенты для определения уровня по меньшей мере одного дополнительного биомаркера или его фрагмента (фрагментов) в образце от пациента и/или средства для определения по меньшей мере одного клинического параметра, предпочтительно, возраста, веса, индекса массы тела, пола, этнического происхождения, креатинина крови, фракции выброса левого желудочка (ФВЛЖ), фракции выброса правого желудочка (ФВПЖ), класса NYHA, оценки риска сердечной недостаточности MAGGIC, состояния лечения, артериального давления (систолического/диастолического), частоты сердечных сокращений, сердечного ритма по электрокардиограмме (ЭКГ), сатурации периферической крови кислородом (SpO2), самооценки состояния здоровья (по шкале) или скорости клубочковой фильтрации (СКФ) и референсные данные, такие как референсные значения для определения того, указывают ли уровень по меньшей мере одного дополнительного биомаркера или его фрагмента (фрагментов) и/или по меньшей мере один клинический параметр на целесообразность назначения или отказе от назначения дистанционного ведения пациента, при этом указанные референсные данные, предпочтительно, хранятся на машиночитаемом носителе и/или используются в форме исполняемого компьютером кода, скомпонованного для сравнения определяемых уровней указанного по меньшей мере одного биомаркера или его фрагмента (фрагментов) и/или указанного по меньшей мере одного клинического параметра с референсными значениями.
ПОДРОБНОЕ ОПИСАНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Изобретение относится к способу терапевтического руководства, стратификации и/или мониторинга дистанционного ведения пациента, у которого диагностировано сердечно-сосудистое заболевание. Как видно из представленных в данном документе данных, потенциальная выгода от назначения дистанционного ведения пациенту, страдающему сердечно-сосудистым заболеванием, может быть предсказана на основе уровня проАДМ, проМНП и/или проПНП или их фрагмента (фрагментов), который, таким образом, дает ценную информацию о терапевтическом руководстве, стратификации и/или мониторинге.
Данное изобретение имеет следующие преимущества по сравнению с традиционными способами: способы и наборы по данному изобретению являются быстрыми, объективными, простыми в применении, надежными и точными для терапевтического руководства, стратификации и/или мониторинга дистанционного ведения пациента. Использование способов и наборов, описанных в данном документе, позволяет эффективно распределять ресурсы при назначении дистанционного ведения тем пациентам, которые вероятно получат пользу. Значительные трудозатраты и расходы на оказание медицинской помощи могут быть сэкономлены, если не назначать дистанционное ведение лицам, для которых на основе биомаркеров было определено ранее вероятное отсутствие пользы от дистанционного ведения пациентов.
Способы и наборы по данному изобретению относятся к маркерам, которые могут быть легко измерены рутинными методами в больницах или аналогичных клинических условиях, потому что уровни проАДМ, проМНП и проПНП могут быть определены в образцах крови, взятых обычным образом, или в других биологических жидкостях или образцах, полученных от субъекта. Таким образом, способы и наборы, описанные в данном документе, могут использоваться в обычных условиях для руководства дистанционным ведением пациентов с диагностированным сердечно-сосудистым заболеванием.
При использовании в данном документе, «пациент» или «субъект» может представлять собой позвоночное животное. При использовании в данном изобретении термин «субъект» или «пациент» включает как людей, так и животных, в частности, млекопитающих, и другие организмы.
«Сердечно-сосудистое заболевание» при использовании в данном документе характеризуется дисфункцией сердечной мышцы или системы кровеносных сосудов, снабжающих сердце, мозг и другие жизненно важные органы. Термин «сердечно-сосудистое заболевание» охватывает широкий спектр расстройств, включая артериосклероз, ишемическую болезнь сердца, порок сердечного клапана, аритмию, сердечную недостаточность, гипертонию, ортостатическую гипотензию, шок, эндокардит, заболевания аорты и ее ветвей, расстройства периферической сосудистой системы, врожденный порок сердца или инсульт.
В контексте изобретения у пациента, предпочтительно, было диагностировано сердечно-сосудистое заболевание, предпочтительно, до определения уровней биомаркеров. С этой целью могли быть использованы любые средства, известные в данной области для диагностики сердечно-сосудистых заболеваний. Использование данного изобретения не зависит от типа предшествующего диагноза сердечно-сосудистого заболевания.
Для некоторых вариантов реализации диагностика сердечно-сосудистого заболевания может включать обнаружение аномальной электрокардиограммы (ЭКГ) или электрограммы.
Термин «электрокардиограмма» определяется как электрические сигналы сердца от одного или нескольких поверхностных накожных электродов, которые размещаются в положениях, указывающих на электрическую активность сердца (деполяризация и реполяризация). Сегмент электрокардиограммы относится к записи данных электрокардиограммы или в течение определенного периода времени, такого как 10 секунд, или для определенного количества сердечных сокращений, такого как 10 ударов сердца. Сегмент PQ электрокардиограммы пациента - это, как правило, горизонтальный сегмент цикла электрокардиограммы, расположенный непосредственно перед зубцом R.
Термин «электрограмма» определяется как электрические сигналы сердца от одного или нескольких имплантированных электродов, которые размещаются в положениях, указывающих на электрическую активность сердца (деполяризация и реполяризация). Сегмент электрограммы относится к записи данных электрограммы в течение определенного периода времени, такого как 10 секунд, или определенного количества ударов сердца, такого как 10 ударов. Сегмент PQ электрограммы пациента - это обычно горизонтальный сегмент электрограммы, расположенный непосредственно перед зубцом R. Цикл, предпочтительно, представляет собой подсегмент электрограммы или сегмент электрокардиограммы, содержащий точно один зубец R.
Параметры сердечного сигнала относятся к измеренным или вычисленным значениям, полученным при обработке одного или нескольких циклов данных электрограмм, и могут использоваться для определения того, произошло ли сердечно-сосудистое событие. Параметры сердечного сигнала включают среднее значение сегмента PQ, среднее значение сегмента ST, пиковое значение зубца R, отклонение ST, сдвиг ST, средний уровень сигнала, высоту пика зубца Т, среднее значение зубца Т, отклонение зубца Т, частоту сердечных сокращений и интервал R-R.
Используемый в данном документе термин «сердечная недостаточность» относится к нарушенной систолической и/или диастолической функции сердца, сопровождающейся явными признаками сердечной недостаточности, как известно специалистам в данной области техники
Предпочтительно, сердечная недостаточность, упоминаемая в данном документе, также является «хронической сердечной недостаточностью» и, таким образом, относится к состоянию, которое не возникает внезапно, а проявляется на протяжении длительного периода времени.
Сердечная недостаточность согласно данному изобретению включает явную и/или выраженную сердечную недостаточность. При явной сердечной недостаточности у субъекта проявляются симптомы сердечной недостаточности, известные специалистам в данной области.
Термин сердечная недостаточность охватывает застойную сердечную недостаточность и/или хроническую сердечную недостаточность, согласно определениям Американского колледжа кардиологов и Американской кардиологической ассоциации, приведенным в отчете Рабочей группы по практическим рекомендациям Американского колледжа кардиологов/Американской кардиологической ассоциации (Yancy et al., 2013: ACCF/AHA guideline for the management of heart failure).
В некоторых вариантах реализации термин «сердечная недостаточность», используемый в данном документе, относится к стадиям C и D по классификации ACC/AHA; на этих стадиях у субъекта проявляются типичные симптомы сердечной недостаточности, т.е. субъект внешне выглядит нездоровым. У субъекта с сердечной недостаточностью, отнесенной к стадии C или D, произошли постоянные необратимые структурные и/или функциональные изменения в миокарде, и вследствие этих изменений полное восстановление здоровья невозможно.
Субъект, достигший стадии C или даже D по классификации ACC/AHA, обычно не может вернуться к стадии B или даже A.
Сердечная недостаточность также может быть классифицирована в соответствии с системой функциональной классификации Нью-Йоркской кардиологической ассоциации (NYHA). У пациентов I класса по NYHA отсутствуют явные симптомы сердечно-сосудистых заболеваний, но уже имеются объективные данные, свидетельствующие о функциональных нарушениях. Физическая активность не ограничена, и обычная физическая активность не вызывает чрезмерной усталости, сердцебиения или диспноэ (одышки). Пациенты II класса по NYHA имеют небольшие ограничения физической активности. Они комфортно чувствуют себя в покое, но обычная физическая активность приводит к усталости, сердцебиению или одышке. У пациентов III класса по NYHA наблюдается выраженное ограничение физической активности. Они комфортно чувствуют себя в покое, но активность меньше обычной вызывает усталость, сердцебиение или одышку. Пациенты IV класса по NYHA не могут без дискомфорта заниматься какой-либо физической активностью. Симптомы сердечной недостаточности проявляются у них в состоянии покоя. Более подробная информация о системе классификации NYHA приведена в “The Criteria Committee of the New York Heart Association. (1994). Nomenclature and Criteria for Diagnosis of Diseases of the Heart and Great Vessels (9th ed.). Boston: Little, Brown & Co. pp. 253-256.”
Сердечная недостаточность как нарушение систолической и/или диастолической функции сердца может быть также определена, например, с помощью эхокардиографии, ангиографии, сцинтиграфии или магнитно-резонансной томографии. Это функциональное нарушение может сопровождаться симптомами сердечной недостаточности, описанными выше (классы II-IV по NYHA), хотя у некоторых пациентов существенные симптомы могут отсутствовать (NYHA I). Кроме того, сердечная недостаточность также проявляется в снижении фракции выброса левого желудочка (ФВЛЖ). Более предпочтительно, сердечная недостаточность при использовании в данном документе сопровождается величиной фракции выброса левого желудочка (ФВЛЖ) менее 60%, предпочтительно, менее 45%.
Постоянные структурные или функциональные повреждения миокарда, типичные для сердечной недостаточности, известны специалистам в данной области и включают различные процессы молекулярного ремоделирования сердца, такие как интерстициальный фиброз, воспаление, инфильтрация, образование рубцов, апоптоз или некроз.
Более жесткая стенка желудочка из-за интерстициального фиброза приводит к недостаточному наполнению желудочка при диастолической дисфункции. Постоянные структурные или функциональные повреждения миокарда вызываются дисфункцией или разрушением сердечных миоцитов. Миоциты и их компоненты могут быть повреждены в результате воспаления или инфильтрации. Токсины и фармакологические агенты (например, этанол, кокаин и амфетамины) вызывают внутриклеточное повреждение и окислительный стресс. Распространенным механизмом повреждения является ишемия, вызывающая инфаркт и образование рубца. После инфаркта миокарда мертвые миоциты замещаются рубцовой тканью, пагубно влияя на функцию миокарда. На эхокардиограмме это проявляется аномальным движением стенки или его отсутствием.
Проявлениями (симптомами) сердечной недостаточности являются одышка, утомляемость и задержка жидкости, что может привести к застою в легких и периферическому отеку, типичными признаками при физикальном обследовании являются отеки и хрипы. Единого диагностического теста для сердечной недостаточности не существует, потому что это в основном клинический диагноз, основанный на тщательно собранном анамнезе и физикальном обследовании. Клинический синдром сердечной недостаточности может быть следствием расстройств перикарда, миокарда, эндокарда или крупных сосудов, но большинство пациентов с сердечной недостаточностью страдают нарушением функции миокарда левого желудочка (ЛЖ).
Сердечная недостаточность может быть связана с широким спектром функциональных нарушений ЛЖ, например, начиная с нормального размера ЛЖ и сохраняющейся фракции выброса (ФВ) и до тяжелой дилатации и/или заметно сниженной ФВ. У большинства пациентов аномалии систолической и диастолической дисфункции сосуществуют. Пациенты с нормальной ФВ могут иметь другое естественное течение и могут нуждаться в других стратегиях лечения, чем пациенты со сниженной ФВ.
Различные изменения систолической и диастолической функции, наблюдаемые при гипертрофии левого желудочка (ГЛЖ), очевидно, могут прогрессировать в застойную сердечную недостаточность (ЗСН).
Систолическая и диастолическая сердечная недостаточность может быть диагностирована методами, известными специалистам в данной области, предпочтительно, эхокардиографией, в частности, тканевой допплеровской эхокардиографией (ТДЭ).
В целом систолическая сердечная недостаточность проявляется в снижении фракции выброса левого желудочка (ФВЛЖ).
В варианте реализации данного изобретения сердечная недостаточность, в используемом в данном документе значении, сопровождается фракцией выброса левого желудочка (ФВЛЖ) менее 60%, предпочтительно, менее 45%.
Предполагается, что на диастолическую сердечную недостаточность (ДГФ) приходится более 50% всех пациентов с сердечной недостаточностью, ее также называют сердечной недостаточностью с нормальной фракцией выброса ФВЛЖ (СННФВ). Диагноз СННФВ требует выполнения следующих условий: (i) признаки или симптомы сердечной недостаточности; (ii) нормальная или слегка аномальная систолическая функция ЛЖ; (iii) данные, свидетельствующие о диастолической дисфункции ЛЖ. Нормальная или умеренно аномальная систолическая функция ЛЖ подразумевает как ФВЛЖ >50%, так и индекс конечного диастолического объема ЛЖ (ИКДОЛЖ) <97 мл/м2. Диастолическая дисфункция ЛЖ, предпочтительно, диагностируется с помощью тканевой допплеровской эхокардиографии (ТДЭ), при этом соотношение E/E' >15 рассматривается как диагностическое свидетельство диастолической дисфункции ЛЖ (E - скорость раннего кровотока в митральном клапане; E' - скорость раннего удлинения по данным ТДЭ). Если ТДЭ дает соотношение E/E', указывающее на диастолическую дисфункцию ЛЖ (15 > E/E' > 8), то необходимы дополнительные неинвазивные исследования для получения диагностических доказательств диастолической дисфункции ЛЖ (например, допплерография латерального митрального кольца, допплерография митрального клапана или легочных вен, эхографические измерения индекса массы ЛЖ или индекса объема левого предсердия, электрокардиографические подтверждения фибрилляции предсердий).
Более подробная информация о диастолической дисфункции левого желудочка приведена в Консенсусном заявлении о диагностике сердечной недостаточности с нормальной фракцией выброса левого желудочка Ассоциаций сердечной недостаточности и эхокардиографии Европейского общества кардиологов (Consensus statement on the diagnosis of heart failure with normal left ventricular ejection fraction by the Heart Failure and Echocardiography Associations of the European Society of Cardiology), European Heart Journal 2007, 28, 2359-2550)
«Острая сердечная недостаточность (ОСН)», также называемая «острой декомпенсированной сердечной недостаточностью», определяется как быстрое появление симптомов и признаков, вторичных по отношению к аномальной сердечной функции. Оно может происходить с предшествующим сердечным заболеванием или без него. Дисфункция сердца может быть связана с систолической или диастолической дисфункцией, нарушениями сердечного ритма или несоответствиями преднагрузки и постнагрузки. ОСН может проявляться как острая de novo (впервые возникающая ОСН у пациента без ранее известной сердечной дисфункции) или как острая декомпенсация хронической сердечной недостаточности (Nieminen et al. 2005. Eur Heart J 26: 384-416; Dickstein et al., 2008. Eur Hear J 29: 2388-442).
Дисфункция сердца может быть связана с систолической или диастолической дисфункцией, нарушениями сердечного ритма или несоответствиями преднагрузки и постнагрузки. Это часто опасно для жизни и требует срочного лечения. Согласно установленной классификации ОСН включает несколько различных клинических состояний вновь поступающих пациентов: (I) острая декомпенсированная застойная сердечная недостаточность, (II) ОСН с гипертензией/гипертоническим кризом, (III) ОСН с отеком легких, (IVa) кардиогенный шок/синдром низкого сердечного выброса, (IVb) тяжелый кардиогенный шок, (V) недостаточность высокого выброса и (VI) правосторонняя острая сердечная недостаточность. Подробное клиническое описание, классификация и диагностика ОСН, а также краткое изложение других систем классификации ОСН, включая классификацию Киллипа (Killip), классификацию Форрестера (Forrester) и классификацию «клинической тяжести», приведены, в частности, в работе Nieminen et al., 2005 (“Executive summary of the guidelines on the diagnosis and treatment of acute heart failure: the Task Force on Acute Heart Failure of the European Society of Cardiology”. Eur Heart J 26: 384-416) и в приведенных в ней ссылках.
Предпочтительно, указанная сердечная дисфункция представляет собой систолическую дисфункцию, более предпочтительно, характеризующуюся сниженной фракцией выброса левого желудочка (ФВЛЖ), предпочтительно, при которой указанная ФВЛЖ составляет менее 55% или менее 50% или менее 45%, и/или повышенным давлением наполнения сердца.
Термин «систолическая дисфункция», используемый в данном документе, имеет известное в данной области техники значение. Посредством дополнительных указаний термин «систолическая дисфункция» может использоваться взаимозаменяемо с синонимичными терминами, известными специалистам, такими как «систолическая желудочковая дисфункция или недостаточность» или «сердечная систолическая дисфункция или недостаточность». По сути, «систолическая дисфункция» означает отказ насосной функции сердца из-за снижения сократимости желудочка.
Термин «диастолическая дисфункция», используемый в данном документе, имеет принятое в данной области техники значение. Посредством дополнительных указаний термин «диастолическая дисфункция» может использоваться взаимозаменяемо с синонимичными терминами, известными специалистам, такими как «диастолическая желудочковая дисфункция или недостаточность» или «сердечная диастолическая дисфункция или недостаточность». По сути, «диастолическая дисфункция» относится к отказу насосной функции сердца из-за нарушения наполнения желудочков.
Используемый в данном документе термин «фракция выброса (левого) желудочка» означает выброс (левого) желудочка во время систолы и представляет собой долю крови, выталкиваемую из (левого) желудочка при каждом сердечном сокращении. По определению, объем крови в желудочке непосредственно перед сокращением известен как конечный диастолический объем. Аналогично, объем крови, оставшейся в желудочке в конце сокращения - это конечный систолический объем. Разница между конечным диастолическим и конечным систолическим объемами - это ударный объем, представляющий собой объем крови, выбрасываемой при каждом сокращении. Фракция выброса (ФВ) представляет собой долю конечного диастолического объема, которая выбрасывается при каждом сокращении; т.е., это ударный объем (УО), деленный на конечный диастолический объем (КДО): ФВ=УО/КДО = (КДО-КСО)/КДО.
«Сердечная недостаточность со сниженной фракцией выброса (СНснФВ)», предпочтительно, относится к сердечной недостаточности с фракцией ниже 50%, предпочтительно, ниже 45%, более предпочтительно, ниже 40%.
«Сердечная недостаточность с сохраненной фракцией выброса (СНсохрФВ)», предпочтительно, относится к сердечной недостаточности с фракцией выброса, равной 50% или выше.
Фракция выброса (ФВ), предпочтительно, относится к фракции выброса левого желудочка (ФВЛЖ).
Способы по данному изобретению также могут быть использованы для мониторинга, мониторинга терапии, терапевтического руководства и/или контроля терапии. «Мониторинг» относится к отслеживанию пациента и потенциально возникающих осложнений, например, к анализу прогресса процесса выздоровления или влияния конкретного вида лечения или терапии на состояние здоровья пациента.
Термин «мониторинг терапии» или «контроль терапии» в контексте данного изобретения относится к мониторингу и/или корректировке терапевтического лечения указанного пациента, например, путем получения в качестве обратной связи отзывов об эффективности терапии. Используемый в данном документе термин «терапевтическое руководство» относится к применению определенных терапий, терапевтических действий или медицинских вмешательств, основанных на значении/уровне одного или нескольких биомаркеров и/или клинических параметров и/или клинических оценок. Это определение включает решение о назначении или отказе от назначения терапии, корректировку терапии или прекращение терапии. В контексте данного изобретения «мониторинг терапии» у пациентов с сердечной недостаточностью можно реализовать с помощью дистанционного ведения или стандартного лечения без дистанционного ведения пациентов, в зависимости от заранее определенного для пациента с помощью биомаркеров риска неблагоприятного исхода.
В некоторых вариантах реализации способы, описанные в данном документе, также могут относиться к диагностике, прогнозу, оценке риска и/или стратификации риска нежелательного явления для здоровья пациента с диагнозом сердечно-сосудистого заболевания.
В контексте данного изобретения «неблагоприятное событие» относится к событию, которое указывает на осложнения или ухудшение состояния здоровья пациента, у которого диагностировано сердечно-сосудистое заболевание. Такие нежелательные явления включают, без ограничения, кардиологическое событие, сердечно-сосудистое событие, острую сердечную недостаточность, острую декомпенсацию или ухудшение общих клинических признаков или симптомов пациента, таких как гипотензия или гипертензия, тахикардия или брадикардия или смерть пациента.
Нежелательные явления могут также включать незапланированную госпитализацию из-за сердечно-сосудистых событий, в частности, незапланированную госпитализацию из-за декомпенсированной сердечной недостаточности, ишемической болезни сердца, инсульта или транзиторной ишемической атаки (ТИА), аритмии, эмболии легочной артерии, эндокардита или других сердечно-сосудистых заболеваний.
«Сердечно-сосудистое событие» используется в данном документе взаимозаменяемо с термином «кардиологическое событие» и может относиться к внезапной сердечной смерти, острым коронарным синдромам, таким как, без ограничений, разрыв бляшек, инфаркт миокарда, нестабильная стенокардия, а также несердечные острые артериоваскулярные явления, такие как кровяные сгустки в ногах, аневризмы, инсульт и другие артериоваскулярные ишемические события с нарушением артериально-сосудистого кровотока и оксигенации. Сердечно-сосудистое событие может также относиться к учащенному сердцебиению, брадикардии, тахикардии или аритмии, такой как фибрилляция предсердий, трепетание предсердий, фибрилляция желудочков и преждевременные сокращения желудочков или предсердий (ПСЖ или ПСП). Предпочтительно, сердечно-сосудистым событием является острая сердечная недостаточность (ОСН) или острая декомпенсация сердечной недостаточности (ОДСН).
В данном документе «нефатальная остановка сердца», предпочтительно, относится к отсутствию сердечного ритма или наличию хаотического ритма, требующему любого компонента базового или интенсивного кардиологического жизнеобеспечения. «Острый инфаркт миокарда», предпочтительно, относится к повышению и постепенному снижению уровня тропонина или более быстрому повышению и снижению при использовании изофермента креатининкиназы как маркера некроза миокарда в сочетании с по меньшей мере одним из следующих признаков: ишемические симптомы, аномальные зубцы Q на ЭКГ, подъем или депрессия сегмента ST, вмешательство на коронарной артерии (например, коронарная ангиопластика) или атипичное снижение повышенного уровня тропонина, обнаруженное на пике после операции у пациента. «Застойная сердечная недостаточность», предпочтительно, относится к вновь появившимся внутрибольничным признакам или симптомам одышки или усталости, ортопноэ, пароксизмальной ночной одышки, повышенного давления в яремной вене, легочных хрипов при физикальном осмотре, кардиомегалии или сосудистой гиперемии легкого
. «Вновь появившаяся сердечная аритмия», предпочтительно, относится к трепетанию предсердий, фибрилляции предсердий или блокаде атриовентрикулярной проводимости второй или третьей степени, возможно, подтверждаемой электрокардиограммой. «Стенокардия», предпочтительно, относится к тупому диффузному дискомфорту за грудиной, вызываемому напряжением или эмоциями и облегчаемому отдыхом или тринитратом глицерина.
Используемый в данном изобретении термин «диагноз» в контексте данного изобретения относится к распознаванию и (раннему) выявлению клинического состояния. Термин «диагноз» также может охватывать оценку тяжести.
«Прогноз» относится к предсказанию исхода или риска для субъекта. Этот термин также может включать оценку вероятности выздоровления или вероятности нежелательного исхода для указанного субъекта.
С точки зрения диагностики или прогноза нежелательных явлений этот метод особенно подходит для оценки или стратификации риска. Это означает, что способ по изобретению позволяет отличать пациентов с высоким риском, которые с большей вероятностью будут страдать от (последующих) осложнений, или состояние которых в будущем станет более критическим, от пациентов с низким риском, состояние здоровья которых является стабильным или даже улучшается, так что не ожидается, что они пострадали от нежелательного явления или будут страдать от нежелательного явления, которое может потребовать определенных терапевтических мер. Предпочтительно, риск может относиться к смерти или госпитализации из-за острой декомпенсации сердечной недостаточности.
В данном изобретении термины «оценка риска» и «стратификация риска» относятся к распределению субъектов в различные группы риска в соответствии с их дальнейшим прогнозом. Оценка риска также относится к стратификации с целью применения профилактических и/или лечебных мероприятий. Термин «стратификация терапии», в частности, относится к распределению или классификации пациентов по различным группам, таким как группы риска или группы лечения, которые получают определенные дифференцированные лечебные мероприятия в зависимости от их классификации. Термин «стратификация терапии» также относится к распределению или классификации пациентов по группам, которые нуждаются или не нуждаются в получении определенных лечебных мероприятий.
Описанный в данном документе способ относится к терапевтическому руководству, стратификации и/или мониторингу дистанционного ведения пациента, у которого было диагностировано сердечно-сосудистое заболевание на основе определения уровня по меньшей мере одного биомаркера, выбранного из группы, состоящей из проАДМ, проМНП и проПНП.
В частности, указанный способ включает сравнение уровней биомаркера с одним или несколькими референсными значениями (такими как пороговое или значение отсечения и/или среднее значение по популяции), чтобы определить, является ли уровень биомаркера показателем назначения или отказа от назначения дистанционного ведения пациента.
Используемый в данном документе термин «дистанционное ведение пациентов», предпочтительно, относится к терапевтическому подходу к дистанционному ведению пациентов с сердечно-сосудистыми заболеваниями, при котором данные о состоянии здоровья пациента неоднократно собираются на месте его пребывания (т.е. амбулаторно) и передаются дистанционно размещенному (географически удаленному) медицинскому персоналу или в автоматизированную систему, которые могут осуществлять или не осуществлять действия на основании указанных данных, чтобы связаться с пациентом, дать совет пациенту, инициировать или изменить сопутствующие методы лечения или предпринять любое другое медицинское вмешательство с целью улучшения и/или стабилизации состояния здоровья пациента.
Дистанционное ведение пациентов, предпочтительно, включает дистанционный мониторинг состояния здоровья пациента, а также телемедицинские вмешательства, амбулаторную помощь на основе рекомендаций и/или структурированное обучение пациентов.
Дистанционный мониторинг, предпочтительно, относится к неоднократному сбору данных на месте пребывания пациента и его дистанционной передаче в систему мониторинга или устройство, обеспечивающее возможность просмотра медицинским персоналом, или автоматизированную медицинскую систему.
«Медицинский персонал» при использовании в данном документе может относиться, без ограничений, к профессиональному медицинскому работнику или группе медицинских специалистов, включая врачей, медсестер или парамедиков. «Автоматизированная медицинская система», предпочтительно, означает компьютерную систему, которая позволяет автоматизировать обработку медицинских данных и создавать соответствующие выходные данные, например, генерировать предупредительные сообщения или советы для дистанционном ведомых пациентов. Автоматизированная медицинская система может, предпочтительно, использовать реализуемые с помощью компьютера методы, основанные на искусственном интеллекте и/или искусственных нейронных сетях, которые могут осуществлять доступ, и/или медицинские данные для генерации выходных данных.
В предпочтительных вариантах реализации сбор данных в месте нахождения пациента происходит в обычных домашних условиях, что обеспечивает минимальное вмешательство в распорядок дня пациентов.
Дистанционная передача означает, что данные передаются дистанционно размещенному медицинскому персоналу или автоматизированной медицинской системе, которая не расположена по месту нахождения пациента (т.е. географически удаленному персоналу или системе). Например, в типичных условиях, данные собирают от разных пациентов, которые они находятся дома, на работе или в любом другом месте, куда они обращаются (например, амбулаторных пациентов), и указанные данные передаются в центральный медицинский центр, оборудованный для мониторинга и/или обработки дистанционно передаваемых данных.
В предпочтительном варианте реализации расстояние между местом нахождения пациента и медицинским персоналом или автоматизированной медицинской системой, которым дистанционно передаются данные, составляет по меньшей мере 100 м, по меньшей мере 1 км, по меньшей мере 5 км или более.
В некоторых вариантах реализации пациенты могут также получать амбулаторную помощь или быть госпитализированы в момент сбора данных. В этих случаях данные также будут дистанционно передаваться медицинскому персоналу или автоматизированной медицинской системе. Например, пациенты могут получать амбулаторную помощь или быть госпитализированы в учреждения, не специализирующиеся на лечении сердечно-сосудистых заболеваний, таких как сердечная недостаточность, и данные передаются в медицинский центр, в котором специально обученный медицинский персонал или медицинский персонал с автоматизированными рабочими местами может наблюдать за данными и инициировать соответствующие медицинские вмешательства.
Данные о состоянии здоровья, предпочтительно, относятся к любым данным, подходящим для мониторинга состояния здоровья пациента, предпочтительно, в отношении статуса или прогрессирования сердечно-сосудистого заболевания, наиболее предпочтительно, сердечной недостаточности.
В одном варианте реализации данные о состоянии здоровья пациента включают в себя основные показатели или параметры жизнедеятельности, выбранные из группы, состоящей из температуры тела, кровяного давления, пульса (частоты сердечных сокращений), частоты дыхания (интенсивности дыхания), сатурации кислорода или уровня глюкозы в крови.
В предпочтительном варианте реализации данные о состоянии здоровья пациента включают кровянное давление.
В предпочтительном варианте реализации данные о состоянии здоровья пациента включают электрокардиограмму (ЭКГ).
В предпочтительном варианте реализации данные о состоянии здоровья пациента включают сатурацию кислородом периферической крови (SpO2).
В предпочтительном варианте реализации данные о состоянии здоровья пациента включают массу тела.
В предпочтительном варианте реализации данные о состоянии здоровья пациента включают самооценку состояния здоровья. Самооценка здоровья может, например, относиться к системе оценок или шкале с диапазоном субъективных оценок от хорошего состояния здоровья до плохого состояния здоровья, т.е. от «очень хорошо» до «очень плохо», с различными промежуточными уровнями. Типичное количество уровней может составлять от 3 до 10, предпочтительно, 5.
В предпочтительном варианте реализации данные о состоянии здоровья пациента включают самооценку типичного симптома, связанного с прогрессированием сердечно-сосудистого заболевания, предпочтительно, сердечной недостаточности, включая ноющую боль, одышку, жжение, спазмы, дискомфорт, чувство разрывающейся грудной клетки, ощущение тяжести, несварение желудка, предобморочное состояние, тошноту, онемение, покалывание, боль, чувство давления на грудную клетку, нехватку дыхания, потливость, головокружение, чувство сжатия в грудной клетке, стеснение, рвоту, нерегулярное сердцебиение, учащенное сердцебиение, усиленное сердцебиение, утомляемость, слабость, наличие периферических отеков и/или любых других соответствующих симптомов.
В предпочтительном варианте реализации данные о состоянии здоровья пациента включают два или более, предпочтительно, три, четыре, пять или более типов данных, выбранных из группы, состоящей из артериального давления, ЭКГ, SpO2, веса тела, самооценки состояния здоровья и/или симптома, связанного с прогрессированием сердечно-сосудистого заболевания.
В одном варианте реализации данные о состоянии здоровья пациента собираются и передаются удаленному медицинскому персоналу или автоматизированной медицинской системе через регулярные промежутки времени. Временные интервалы между сбором данных могут существенно отличаться для разных типов собираемых данных. Например, в случае мониторинга частоты сердечных сокращений с помощью мобильного пульсометра, сбор и передача данных могут происходить почти в реальном времени, с обновлением статуса каждую секунду, в то время как, например, вес можно измерять и передавать дистанционно только ежедневно.
Для сбора данных может использоваться любое подходящее устройство или система. К ним относятся системы, представляющие собой автономные устройства, которые могут быть размещены в доме пациента, или мобильные устройства, которые носит пациент, такие как часы, электронный зонд, размещенный на коже пациента или имплантированный.
Устройство сердечно-сосудистого мониторинга может включать в себя одно или несколько из: регистратора сердечного цикла (например, для записи сердечного ритма), монитора сердечного ритма, монитора артериального давления, монитора гемодинамики, детектирующего устройства биосигналов (например, электроокулографии, электромиографии, электрокардиографии, кожно-гальванической реакции, магнитоэнцефалограммы и т.д.), весы (например, интеллектуальные весы) и/или другое подходящее устройство для мониторинга сердечно-сосудистой активности. Как вариант, мобильное вычислительное устройство может выполнять функции сердечно-сосудистого устройства (например, смарт-часы, которые включают возможность мониторинга сердечного ритма).
Из уровня техники известны различные устройства для мониторинга, а также устройства передачи данных для дистанционного мониторинга данных о состоянии здоровья пациентов, в частности, в отношении параметров, относящихся к сердечно-сосудистым заболеваниям.
Например, ранние телеметрические системы типа, описанного Lewis в патенте США № 3943918 и Crovella et al. в патенте США № 4121573, используют телеметрические методы для передачи данных от сенсорного устройства, прикрепленного к груди пациента, с помощью РЧ на радиотелеметрический приемник для отображения и/или регистрации, при необходимости. S.S. Ng описал еще одну телеметрическую систему для мониторинга ЭКГ в статье, озаглавленной “Microprocesor-based Telemetry System for ECG Monitoring”, IEEE/Ninth Annual Conference of the Engineering in Medicine and Biology Society, CH2513-0, pages 1492-93 (1987). В этой работе Ng описал систему для обеспечения непрерывного мониторинга и анализа ЭКГ с помощью ПК AT посредством беспроводной связи. В системе Ng пациенту требуется передатчик, который пациент носит, для восприятия и передачи сигнала ЭКГ пациента на центральную базовую станцию посредством беспроводной связи. На базовой станции приемник восстанавливает исходный сигнал ЭКГ от нескольких пациентов одновременно для отображения.
Bornn et al. описывают портативную систему мониторинга/оповещения для физиологических данных в патентах США №№ 4784162; 4827943; 5214939; 5348008; 5353793; и 5564429, в которых один или несколько пациентов носят ременные датчики, включающие микропроцессор, который обнаруживает потенциально угрожающие жизни события и автоматически вызывает центральную базовую станцию посредством радиотелеметрии с использованием радиомодемной связи. В конфигурации домашних условий или альтернативного местонахождения связь между базовой станцией и удаленным устройством осуществляется по коммерческим телефонным линиям. Как правило, система автоматически вызывает «911» или аналогичную службу экстренного реагирования, когда монитор ЭКГ обнаруживает отклонение от нормы.
Segalowitz раскрывает беспроводную систему мониторинга основных показателей жизнедеятельности в патентах США №№ 4981141; 5168874; 5307818; и 5511553, включающую прекардиальный пластырь в форме полоски, содержащий гибкую многослойную структуру для телеметрической передачи данных по радиочастоте или одиночному проводу на аппаратное записывающее устройство и монитор дисплея. Микросенсоры и токопроводящие контактные элементы (CCE) устанавлены на пластыре в форме полоски для обеспечения одновременного и непрерывного обнаружения, обработки и передачи ЭКГ в 12 отведениях, сердечного выброса, частоты дыхания, оксиметрии периферической крови, температуры пациента и мониторинга ЭКГ сердца плода с помощью радиочастотной передачи на одной длине волны.
Platt et al. также раскрывают сенсорную накладку для беспроводного физиологического мониторинга пациентов в патенте США № 5634468. Platt et al. описывают датчик и систему для дистанционного мониторинга сигналов ЭКГ от пациентов, находящихся вне стационаров. В этой системе сенсорная накладка, содержащая чувствительные электроды, схемы обработки сигналов и схемы передачи в радио- или инфракрасном диапазоне, крепится к телу пациента, предпочтительно, для ношения в течение по меньшей мере недели, пока не будет исчерпан источник питания, после чего сенсорную накладку выбрасывают. Приемник в первичном пункте рядом с пациентом принимает данные, передаваемые сенсорной накладкой, и сохраняет полученные данные. Когда пациент испытывает дискомфорт или беспокойство, или если переносной блок подает сигнал тревоги, пациент звонит на станцию мониторинга и загружает сохраненные данные с переносного блока через стандартную сеть голосовой связи. Затем загруженные данные ЭКГ обрабатываются и анализируются на станции мониторинга. Приемник в непосредственной близости от пациента может представлять собой переносной блок, который пациент носит, причем переносной блок включает приемник, процессор для обработки полученных данных с целью выявления отклонений, память для хранения полученных данных и схемы для подключения к телефонной линии для отправки сигналов данных ЭКГ на станцию мониторинга. Станция мониторинга декодирует полученные сигналы ЭКГ и выполняет анализ сердечных сокращений и ритма для классификации данных ЭКГ. При обнаружении аномального состояния направляется обращение к медицинскому персоналу, находящемуся поблизости от пациента.
В патенте США № 5522396 Langer et al. раскрыли телеметрическую систему для мониторинга сердца пациента, в которой станция пациента включает телеметрическое устройство для передачи выходных сигналов электродов пациента на устройство дистанционной связи, подключенное к станции мониторинга по телефонным линиям. Как и в системе Platt et al., Langer et al. передают данные ЭКГ на центральную базу. Однако, в отличие от системы Platt et al., система Langer et al. проверяет данные ЭКГ на наличие заранее определенных событий и автоматически вызывает станцию мониторинга при обнаружении таких событий. Похожая телеметрическая система описана Davis et al. в патенте США № 5544661, в котором при обнаружении события инициируется соединение пациента с центральной станцией мониторинга по сотовому телефону.
В патенте США 6416471 B1 раскрыта система мониторинга основных показателей жизнедеятельности и дистанционного сбора данных от пациента с использованием методов радиотелеметрии. В системе используется беспроводная одноразовая сенсорная лента с датчиками для измерения формы полной волны ЭКГ, формы полной волны дыхания, температуры кожи и движения, а также схема передачи для обнаружения и передачи данных основных показателей жизнедеятельности пациента. Устройство передачи сигнала, которое пациент может носить, например, на поясе, или расположенное поблизости, принимает от сенсорной ленты данные, которые затем пересылает, например, радиопередачей на базовую станцию, предназначенную для подключения к обычным телефонным линиям для передачи собранных данных на станцию удаленного мониторинга для наблюдения медицинским персоналом. Базовая станция также может собирать дополнительные клинические данные, такие как кровяное давление.
В исследовании с целью проверки концепции, Spethmann et al. продемонстрировали возможность записи, передачи и анализа электрокардиограммы через мобильный телефон (потоковая передача электрокардиограммы) у марафонцев для удаленной передачи на станцию мониторинга (Spethmann et al. (2014).
Вышеупомянутые системы дистанционного мониторинга, а также приведенные в них ссылки должны иллюстрировать примерные устройства и системы, которые могут использоваться для дистанционного ведения пациентов в целях способа, описанного в данном документе, без намерения устанавливать ограничения.
Используемое в данном документе дистанционное ведение пациентов основывается на сборе данных, как описано в данном документе, с помощью подходящих средств, известных из уровня техники, и их передаче дистанционно размещенному медицинскому персоналу или автоматизированной медицинской системе. Различные технологические средства достижения этих целей известны специалистам в данной области техники и поэтому не должны подробно описываться в данном документе.
В особенно предпочтительном варианте реализации используется устройство для дистанционного ведения пациентов на основе Bluetooth-системы с цифровым планшетом (Physio-Gate® PG 1000, GETEMED Medizin- und Informationstechnik AG) в качестве центрального структурного элемента для передачи основных показателей жизнедеятельности из дома пациента на станцию мониторинга в медицинском центре. Предпочтительно, система содержит другое измерительное устройство, предпочтительно, 3-канальное устройство ЭКГ для сбора данных за определенный промежуток времени, например, за 2 минуты, или для потокового измерения ЭКГ (PhysioMem® PM 1000, GETEMED Medizin- und Informationstechnik AG), устройство для измерения сатурации кислородом периферических капилляров (SpO2; Masimo Signal Extraction Technology (SET®) и систему для сбора данных о кровяном давлении (UA767PBT, A&D) Ltd.) и весы для определения веса тела (Seca 861, seca GmbH & Co KG). Каждое устройство, желательно, оснащено чипом Bluetooth и подключено к цифровому планшету. В качестве программного обеспечения на станции мониторинга в телемедицинском центре используется Fontane (eHealth Connect 2.0, T- Systems International GmbH), разработанное специально для использования в исследовании TIM-HF2 и описанное Koehler et al., 2018.
В предпочтительном варианте реализации данные о состоянии здоровья пациента передаются на станцию мониторинга для наблюдения медицинским персоналом или медицинской автоматизированной системы. Особенно предпочтительно, чтобы станция мониторинга содержала средства для обработки передаваемых данных, предпочтительно, с целью оповещения и/или управления наблюдением медицинским персоналом.
В предпочтительном варианте реализации для каждого типа передаваемых данных может быть определена зона оповещения. Например, станция мониторинга может активно обрабатывать переданные данные и выдавать предупреждение, как только определенный передаваемый тип данных или комбинация типов данных оказываются в зоне предупреждения, указывающей на повышенный риск обострения болезни или нежелательного явления. Как следствие, станция мониторинга может отображать, озвучивать или отправлять оповещение непосредственно на мобильное устройство связи медицинского персонала.
В предпочтительных вариантах реализации дистанционное ведение пациентов включает телемедицинские вмешательства, которые предпочтительно относятся к любому контакту с пациентом, инициированному удаленным медицинским персоналом или автоматизированной медицинской системой. В предпочтительных вариантах реализации контакт инициируется посредством телефонного звонка, видеозвонка, электронной почты, программы чата, СМС или другим способом с помощью других средств обмена электронными сообщениями.
В некоторых вариантах реализации удаленное ведение пациента включает телемедицинское вмешательство в форме телефонного звонка или видеозвонка в случае, если данные о состоянии здоровья попадают в зону тревоги.
В некоторых вариантах реализации дистанционное ведение пациентов включает проводимые на регулярной основе структурированные консультации между медицинским персоналом и пациентами, предпочтительно, по телефону. Во время структурированных консультаций медицинский персонал, предпочтительно, обсуждает с пациентом на основе дистанционно переданных данных статус заболевания, оценивает симптомы депрессии или любой другой болезни, обсуждает текущие методы лечения, такие как медицинские рецепты, советы по инициированию или изменению текущих методов лечения.
В предпочтительных вариантах реализации структурированные консультации проводятся на регулярной основе с промежутком времени между контактами от 1 дня до 3 месяцев, предпочтительно, от 1 недели до 1 месяца, наиболее предпочтительно, один раз в месяц.
В некоторых вариантах реализации, структурированные консультации инициируются дополнительно, когда это считается целесообразным медицинским персоналом или автоматизированной медицинской системой, например, когда удаленно передаваемые данные указывают на изменения в статусе заболевания, в случае очевидных технических проблем, для проверки измерений показателей жизнедеятельности или других данных о состоянии здоровья пациента.
В некоторых вариантах реализации дистанционное ведение пациентов использует алгоритм для определения приоритетов наблюдения за удаленно ведомыми пациентов медицинским персоналом. С этой целью, например, могут быть определены отсекающие значения параметров, получаемых из передаваемых данных, таких как брадикардическая частота сердечных сокращений, тахикардическая частота сердечных сокращений, SpO2, вес тела, кровяное давление или самооценка состояния здоровья.
Основываясь на приоритезации, можно оптимизировать рабочую нагрузку и рабочий процесс дистанционного ведения пациентов, чтобы обеспечить своевременное лечение тех пациентов, которые в нем особенно нуждаются.
В предпочтительных вариантах реализации просмотр переданных данных проводится медицинским персоналом через регулярные интервалы, предпочтительно, с промежутками времени между просмотрами менее 1 недели, предпочтительно, менее 3 дней, менее одного дня или менее 12 часов. В некоторых вариантах реализации просмотр переданных данных проводится медицинским персоналом или медицинской автоматизированной системой в режиме реального времени.
При использовании алгоритма приоритезации наблюдения удаленно ведомых пациентов медицинским персоналом, такой временной интервал может быть соответственно выбран так, чтобы приоритетных пациентов проверяли чаще, например, два раза в день, в то время как пациентов без приоритета проверяли один раз в день или через день.
В некоторых вариантах реализации дистанционное ведение пациента включает консультацию, совет или инструкцию по лечению, или медицинскую помощь пациенту, находящемуся на дистанционном ведении.
В контексте данного изобретения «медикаментозное лечение» может включать различные методы лечения и терапевтические стратегии, которые включают, без ограничений в отношении сердечно-сосудистых заболеваний, предпочтительно, сердечной недостаточности, введение ингибиторов ангиотензинпревращающего фермента (АПФ), блокаторов рецептора ангиотензина II (БРА), антагонистов альдостерона, бета-блокаторов, диуретиков и/или антагонистов кальция.
Дистанционное ведение пациента может, предпочтительно, включать консультацию, инициирование госпитализации, начало усиленного ухода за пациентом, совет или инструкцию по типу, частоте и/или дозировке медикаментозных средств, предпочтительно, в отношении лечения сердечно-сосудистых заболеваний, таких как сердечная недостаточность.
В некоторых вариантах реализации для каждого типа или комбинации передаваемых данных может быть определена безопасная зона или зона улучшения. Например, на основании медицинских данных о пациентах, страдающих сердечно-сосудистыми заболеваниями, может быть определена зона, в которой пациент чувствует себя оптимально хорошо, несмотря на свое болезненное состояние, и/или зона, где следует ожидать улучшения болезненного состояния. В отличие от использования системы дистанционного ведения пациентов только для предотвращения острых и нежелательных явлений, такое дистанционное ведение пациентов позволяет изменять прогрессирование болезни или симптомов и оказывает значительное положительное влияние на клинические исходы.
Например, для безопасной зоны или зоны улучшения для пациентов, страдающих сердечной недостаточностью, могут быть определены одна или несколько или все из следующих целей: частота сердечных сокращений <75 ударов в минуту для пациентов с синусовым ритмом, контроль артериального давления: систолическое <140 мм рт. ст. и диастолическое <90 мм рт. ст., для пациентов с вновь обнаруженной фибрилляцией предсердий применение антикоагулянтной терапии в качестве долгосрочной терапии и антиаритмической терапии, для пациентов с II-IV классом по NYHA инициирование применения антагонистов минералокортикоидных рецепторов, по возможности.
Как продемонстрировали Koehler et al., 2018, внедрение телемедицинских вмешательств в дополнение к простому дистанционному мониторингу, как описано в данном документе, возможно с определением приоритета путем соответствующей обработки данных и/или инициирования зоны улучшения или зон безопасности, дает особенно хорошие результаты по улучшению качества и продолжительности жизни пациентов. Неожиданное дополнительное понимание описанных в данном документе методов связано с открытием того, что ранние биомаркеры могут использоваться для оценки терапевтической пользы для индивидуальных пациентов и принятия решения о назначении или отказе от назначения дистанционного ведения пациентов.
Описанный в данном документе метод относится к терапевтическому руководству, стратификации и/или мониторингу дистанционного ведения пациентов для какого-либо пациента на основе определения уровня по меньшей мере одного биомаркера, выбранного из группы, состоящей из проАДМ, проМНП и проПНП.
Выражение «по меньшей мере один биомаркер, выбранный из группы, состоящей из проАДМ, проМНП и проПНП», а также выражение «проАДМ, проМНП и/или проПНП», предпочтительно, следует понимать как включающие все возможные комбинации, включая определение точно одного из трех указанных биомаркеров, т.е. проАДМ, проМНП или проПНП, а также определение точно двух из указанных биомаркеров, т.е. комбинации проАДМ и проМНП, проАДМ и проПНП, или проМНП и проПНП, или определение всех трех биомаркеров проАДМ, проМНП и проПНП.
Кроме того, следует понимать, что указанные выражения не исключают дополнительного определения дополнительных биомаркеров или параметров.
Понятно, что в контексте данного изобретения «определение уровня проАДМ или его фрагмента (фрагментов)» и тому подобные выражения относятся к любым средствам определения проАДМ или его фрагмента. Фрагмент может иметь любую длину, например, по меньшей мере приблизительно 5, 10, 20, 30, 40, 50 или 100 аминокислот, при условии, что указанный фрагмент позволяет однозначно определить уровень проАДМ или его фрагмента. В конкретных предпочтительных аспектах данного изобретения «определение уровня проАДМ» относится к определению уровня среднерегионарного проадреномедуллина (СР-проАДМ). СР-проАДМ представляет собой фрагмент и/или область проАДМ.
«Проадреномедуллин» («проАДМ») относится к пре-проАДМ без сигнальной последовательности (аминокислоты 1-21), т.е. к аминокислотным остаткам 22-285 пре-проАДМ. «Среднерегионарный проадреномедуллин» («СР-проАДМ») относится к аминокислотам 42-95 пре-проАДМ.
Аминокислотная последовательность СР-проАДМ приведена в SEQ ID NO:4. В данном документе также предусматривается, что для описанных в данной заявке способов могут быть использованы пептид и его фрагмент пре-проАДМ или СР-проАДМ. Например, пептид и его фрагмент могут содержать аминокислоты 22-41 пре-проАДМ (пептид PAMP) или аминокислоты 95-146 пре-проАДМ (зрелый адреномедуллин). С-концевой фрагмент проАДМ (аминокислоты 153-185 пре-проАДМ) называется адренотензином. Фрагменты пептидов проАДМ или СР-проАДМ содержат, например, 5 или более аминокислот. Фрагменты пептидов проАДМ или фрагменты СР-проАДМ могут содержать, например, по меньшей мере около 5, 10, 20, 30 или более аминокислот. Соответственно, фрагмент проАДМ может, например, быть выбран из группы, состоящей из СР-проАДМ, PAMP, адренотензина и зрелого адреномедуллина, предпочтительно, в данном документе фрагмент представляет собой СР-проАДМ.
Кроме того, среднерегионарный проадреномедуллин (СР-проАДМ) раскрыт в EP1488209B1 для диагностических целей (Struck J, Tao C, Morgenthaler NG, Bergmann A. Identification of an Adrenomedullin precursor fragment in plasma of sepsis patients. Peptides 2004; 25: 1369-72; Morgenthaler NG, Struck J, Alonso C, Bergmann A. Measurement of mid-regional pro-adrenomedullin in plasma with an immunoluminometric assay. Clin Chem 2005; 51:1823-9; Christ-Crain M, Morgenthaler NG, Stolz D,  C, Bingisser R, Harbarth S, et al. Pro-adrenomedullin to predict severity and outcome in community-acquired pneumonia [ISRCTN04176397]. Crit Care 2006; 10:R96; Christ-Crain M, Morgenthaler NG, Struck J, Harbarth S, Bergmann A, Muller B. Mid-regional pro-adrenomedullin as a prognostic marker in sepsis: an observational study. Crit Care 2005; 9: R816-24).
C, Bingisser R, Harbarth S, et al. Pro-adrenomedullin to predict severity and outcome in community-acquired pneumonia [ISRCTN04176397]. Crit Care 2006; 10:R96; Christ-Crain M, Morgenthaler NG, Struck J, Harbarth S, Bergmann A, Muller B. Mid-regional pro-adrenomedullin as a prognostic marker in sepsis: an observational study. Crit Care 2005; 9: R816-24).
Пептид «адреномедуллин (АДМ)» был впервые описан в 1993 г. (Kitamura et al. (1993), Biochem. Biophys. Res. Commun. 192:553-560) как новый гипотензивный пептид, содержащий 52 аминокислоты, выделенный из феохромоцитомы человека. В том же году были также описаны кДНК, кодирующая пептид-предшественник, содержащий 185 аминокислот, и полная аминокислотная последовательность этого пептида-предшественника (Kitamura et al. (1993), Biochem. Biophys. Res. Commun. 194:720-725). Пептид-предшественник, который содержит, среди прочего, сигнальную последовательность из 21 аминокислоты на N-конце, называется «пре-про-адреномедуллин» (пре-проАДМ). Пептид АДМ содержит аминокислоты 95-146 пре-проАДМ, из которого он образуется путем протеолитического расщепления. Некоторые пептидные фрагменты из тех, которые образуются при расщеплении пре-проАДМ, были подробно охарактеризованы, в частности, физиологически активные пептиды адреномедуллин (АДМ) и «PAMP», представляющий собой пептид, содержащий 20 аминокислот (22-41), следующих за 21 аминокислотой сигнального пептида в пре-проАДМ. Еще одним фрагментом с неизвестной функцией и высокой стабильностью ex vivo является среднерегионарный проадреномедуллин (СР-проАДМ) (Struck et al. (2004), Peptides 25 (8):1369-72), для которого был разработан надежный метод количественной оценки (Morgenthaler et al. (2005), Clin. Chem. 51 (10):1823-9). АДМ представляет собой эффективное сосудорасширяющее средство. Гипотензивный эффект был связан, в частности, с пептидными сегментами в С-концевой части АДМ.
С другой стороны, пептидные последовательности N-конца АДМ проявляют гипертензивные эффекты (Kitamura et al. (2001), Peptides 22, 1713-1718). N-концевые фрагменты (пре)проадреномедуллина для диагностики также были описаны в EP0622458B1, такие как PAMP (Hashida S, Kitamura K, Nagatomo Y, Shibata Y, Imamura T, Yamada K, et al. Development of an ultra-sensitive enzyme immunoassay for human pro-adrenomedullin Nterminal peptide and direct measurement of two molecular forms of PAMP in plasma from healthy subjects and patients with cardiovascular disease. Clin Biochem 2004; 37: 14-21).
С-концевой фрагмент (пре)проадреномедуллина для диагностики также был описан в EP2111552B1, а именно, CT-проАДМ (адренотензин).
Кроме того, в предшествующем уровне техники описано, как определять проадреномедуллин (проАДМ) и адреномедуллин в диагностике (EP0622458B1, Lewis LK, Smith MW, Yandle TG, Richards AM, Nicholls MG. Adrenomedullin (1-52) measured in human plasma by radioimmunoassay: plasma concentration, adsorption, and storage. Clin Chem 1998; 44:571-7; Ueda S, Nishio K, Minamino N, Kubo A, Akai Y, Kangawa K, et al. Increased plasma levels of adrenomedullin in patients with systemic inflammatory response syndrome. Am J Respir Crit Care Med 1999;160:132-6; Kobayashi K, Kitamura K, Etoh T, Nagatomo Y, Takenaga M, Ishikawa T, et al. Increased plasma adrenomedullin levels in chronic congestive heart failure. Am Heart J 1996; 131:994-8; Kobayashi K, Kitamura K, Hirayama N, Date H, Kashiwagi T, Ikushima I, et al. Increased plasma adrenomedullin in acute myocardial infarction. Am Heart J 1996; 131: 676-80.), в частности, с целью диагностики сепсиса (EP1121600B1).
SEQ ID NO:1: аминокислотная последовательность пре-проАДМ, 185 аминокислот:
MKLVSVALMY LGSLAFLGAD TARLDVASEF RKKWNKWALS RGKRELRMSSSYPTGLADVK AGPAQTLIRP QDMKGASRSP EDSSPDAARI RVKRYRQSMNNFQGLRSFGC RFGTCTVQKL AHQIYQFTDK DKDNVAPRSK ISPQGYGRRRRRSLPEAGPG RTLVSSKPQA HGAPAPPSGS APHFL
SEQ ID NO:2: аминокислотная последовательность проАДМ (АК 22-185 пре-проАДМ):
ARLDVASEF RKKWNKWALS RGKRELRMSSSYPTGLADVK AGPAQTLIRP QDMKGASRSP EDSSPDAARI RVKRYRQSMNNFQGLRSFGC RFGTCTVQKL AHQIYQFTDK DKDNVAPRSK ISPQGYGRRRRRSLPEAGPG RTLVSSKPQA HGAPAPPSGS APHFL
SEQ ID NO:3: аминокислотная последовательность PAMP (АК 22-41 пре-проАДМ)
ARLDVASEFRKKWNKWALSR
SEQ ID NO:4: аминокислотная последовательность СР-проАДМ (АК 45-92 пре-проАДМ): ELRMSSSYPTGLADVKAGPAQTLIRPQDMKGASRSPEDSSPDAARIRV
SEQ ID NO: 5: аминокислотная последовательность зрелого АДМ (АК 95-146 пре-проАДМ):
YRQSMNNFQGLRSFGCRFGTCTVQKLAHQIYQFTDKDKDNVAPRSKISPQGY
SEQ ID NO: 6: аминокислотная последовательность адренотензина или С-концевого фрагмента АДМ (АК 148-185 пре-проАДМ):
RRRRRSLPEAGPGRTLVSSKPQAHGAPAPPSGSAPHFL (адреномедулин Uniprot №: P353118)
В данном документе также предполагается, что пептид и его фрагмент пре-проАДМ или СР-проАДМ могут быть использованы в способах, описанных в данном документе. Например, пептид или его фрагмент могут содержать аминокислоты 22-41 пре-проАДМ (пептид РАМР) или аминокислоты 95-146 пре-проАДМ (зрелый адреномедуллин, включая биологически активную форму, также известную как био-АДМ). С-концевой фрагмент проАДМ (аминокислоты 153-185 пре-проАДМ) называется адренотензином. Фрагменты пептидов проАДМ или фрагменты СР-проАДМ могут содержать, например, по меньшей мере приблизительно 5, 10, 20, 30 или более аминокислот. Соответственно, фрагмент проАДМ может, например, быть выбран из группы, состоящей из СР-проАДМ, PAMP, адренотензина и зрелого адреномедуллина, предпочтительно, в данном документе этот фрагмент представляет собой СР-проАДМ.
Определение таких различных форм АДМ или проАДМ и их фрагментов также включает измерение и/или обнаружение конкретных субобластей этих молекул, например, с использованием антител или других аффинных реагентов, нацеленных на определенный участок молекул, или путем определения присутствия и/или количества молекул путем измерения доли белка с помощью масс-спектрометрии. В данном изобретении может использоваться любой один или несколько «пептидов или фрагментов АДМ», описанных в данном документе.
Уровень проАДМ в образце, полученном от субъекта, может быть определен с помощью иммуноанализов, как описано в данном документе. Как описано в данном документе, может быть определен также уровень рибонуклеиновой кислоты или дезоксирибонуклеиновых кислот, кодирующих «проадреномедуллин» или «проАДМ». Методы определения проАДМ и его фрагмента (фрагментов) известны квалифицированным специалистам, например, путем использования продуктов, поставляемых фирмой Thermo Fisher Scientific/B⋅R⋅A⋅H⋅M⋅S GmbH.
Понятно, что в контексте данного изобретения «определение уровня проМНП или его фрагмента (фрагментов)» или подобные фразы относятся к любым средствам определения проМНП или его фрагмента.
Фрагмент может иметь любую длину, например, по меньшей мере приблизительно 5, 10, 20, 30, 40, 50 или 100 аминокислот, при условии, что указанный фрагмент позволяет однозначно определить уровень проМНП или его фрагмента. В особенно предпочтительных аспектах изобретения «определение уровня проМНП» относится к определению уровня N-концевого натрийуретического пропептида B-типа (NT-проМНП).
NT-проМНП представляет собой фрагмент и/или область проМНП.
«Натрийуретические пептиды B-типа (МНП)» являются количественными маркерами сердечной недостаточности. Использование натрийуретического пептида B-типа (МНП) и его аминоконцевого фрагмента, N-концевого натрийуретического пропептида B-типа (NT-проМНП) значительно повышает диагностическую точность в отделении неотложной помощи (ED) [Januzzi, J.L., Jr., et al., Am J Cardiol, 2005. 95(8): p. 948-54; Maisel, A.S., et al., N Engl J Med, 2002. 347(3): p. 161-7] и тем самым улучшает оценку пациентов и лечение [Moe, G.W., et al., Circulation, 2007. 115(24): p. 3103-10; Mueller, C., et al., N Engl J Med, 2004. 350(7): p. 647-54]. Концентрация предсердного натрийуретического пептида (ПНП) в кровотоке примерно в 50-100 раз выше, чем МНП [Pandey, K.N., Peptides, 2005. 26(6): p. 901-32]. Следовательно, биологический сигнал, отображаемый повышенным ПНП, может быть патофизиологически и, следовательно, диагностически еще более важным, чем сигнал МНП. Несмотря на это, о диагностических возможностях ПНП и его предшественников мало что известно [Cowie, M.R., et al., Lancet, 1997. 350(9088): p. 1349-53]. Зрелый ПНП образуется из предшественника N-концевого проПНП (NT-проПНП), который значительно более стабилен в кровотоке, чем зрелый пептид, и поэтому считается более надежным аналитом [Vesely, D.L., IUBMB Life, 2002. 53(3): p. 153-[Pandey, K.N., Peptides, 2005. 26(6): p. 901-32]. Тем не менее, в связи с тем, что NT-проПНП может подвергаться дальнейшей фрагментации [Cappellin, E., et al., Clin Chim Acta, 2001. 310(1): p. 49-52], иммуноанализы для измерения среднерегионарного проПНП (СР-проПНП) могут обладать определенными преимуществами [Morgenthaler, NG, et al., 2004. 50(1): p. 234-6].
Последовательность пептида-предшественника мозгового натрийуретического пептида из 134 аминокислот (пре-проМНП) представлена в SEQ ID NO: 7. проМНП относится к аминокислотным остаткам 27-134 пре-проМНП. Последовательность проМНП представлена в SEQ ID NO: 8. проМНП расщепляется на N-концевой проМНП (NT-проМНП) и зрелый МНП. NT-проМНП содержит аминокислотные остатки 27-102, а его последовательность показана в SEQ ID NO: 9. SEQ ID NO: 10 показывает последовательность МНП, содержащую аминокислотные остатки 103-134 пептида пре-проМНП.
SEQ ID NO: 7: (аминокислотная последовательность пре-проМНП):
MDPQTAPSRA LLLLLFLHLA FLGGRSHPLG SPGSASDLET SGLQEQRNHL
QGKLSELQVE QTSLEPLQES PRPTGVWKSR EVATEGIRGH RKMVLYTLRA
PRSPKMVQGS GCFGRKMDRI SSSSGLGCKV LRRH
SEQ ID NO: 8: (аминокислотная последовательность проМНП):
HPLGSPGSAS DLETSGLQEQ RNHLQGKLSE LQVEQTSLEP LQESPRPTGV
WKSREVATEG IRGHRKMVLY TLRAPRSPKM VQGSGCFGRK MDRISSSSGL
GCKVLRRH
SEQ ID NO: 9: (аминокислотная последовательность NT-проМНП):
HPLGSPGSAS DLETSGLQEQ RNHLQGKLSE LQVEQTSLEP LQESPRPTGV WKSREVATEG
IRGHRKMVLY TLRAPR
SEQ ID NO: 10: (аминокислотная последовательность МНП):
SPKMVQGSGC FGRKMDRISS SSGLGCKVLR RH
(МНП Uniprot №: P16860)
В особенно предпочтительном варианте реализации NT-проМНП измеряют для определения уровня проМНП.
Таким образом, длина фрагментов проМНП составляет, предпочтительно, по меньшей мере 12 аминокислот, предпочтительно, более 20 аминокислот, более предпочтительно, более 40 аминокислот.
Определение таких различных форм проМНП и их фрагментов также включает измерение и/или обнаружение конкретных субобластей этих молекул, например, с использованием антител или других аффинных реагентов, нацеленных на определенный участок молекул, или путем определения наличия и/или количества молекул путем измерения части белка с использованием масс-спектрометрии. В данном изобретении можно использовать любой один или несколько из «пептидов или фрагментов проМНП», описанных в данном документе.
Уровень проМНП в образце, полученном от субъекта, может быть определен с помощью иммуноанализов, как описано в данном документе. В используемом в данном документе значении, также может быть определен уровень рибонуклеиновой кислоты или дезоксирибонуклеиновых кислот, кодирующих «натрийуретические пептиды B-типа» или «проМНП». Методы определения проМНП и его фрагмента (фрагментов) известны квалифицированным специалистам, например, с использованием продуктов, поставляемых фирмой Thermo Fisher Scientific/B⋅R⋅A⋅H⋅M⋅S GmbH.
Понятно, что в контексте данного изобретения «определение уровня проПНП или его фрагмента (фрагментов)» или подобные фразы относятся к любым средствам определения проПНП или его фрагмента.
Фрагмент может иметь любую длину, например, по меньшей мере приблизительно 5, 10, 20, 30, 40, 50 или 100 аминокислот, при условии, что указанный фрагмент позволяет однозначно определить уровень проПНП или его фрагмента. В конкретных предпочтительных аспектах изобретения "определение уровня проПНП" относится к определению уровня среднерегионарного проПНП (СР-проПНП). СР-проПНП представляет собой фрагмент и/или область проПНП.
Аминокислотная последовательность «предсердного натрийуретического пептида (ПНП)» представлена в SEQ ID NO: 13. Последовательность пре-проПНП из 153 аминокислот показана в SEQ ID NO: 11. При отщеплении N-концевого сигнального пептида (25 аминокислот) и двух C-концевых аминокислот (127/128) высвобождается проПНП (SEQ ID NO: 12). ПНП включает остатки 99-126 от С-конца предшественника прогормона проПНП. Этот прогормон расщепляется на зрелый пептид ПНП из 28 аминокислот, также известный как ПНП(1-28) или α-ПНП, и аминоконцевой фрагмент ПНП(1-98) (NT-проПНП, SEQ ID NO: 14). Среднерегионарный проПНП (СР-проПНП) определяется как NT-проПНП или любые его фрагменты, содержащие по меньшей мере аминокислотные остатки 53-90 (SEQ ID NO: 15) проПНП. Два С-концевых остатка аргинина (положения 152 и 153 в пре-проПНП, SEQ ID NO: 11, не присутствуют в другом аллеле гена, кодирующего пре-проПНП, таким образом, пре-проПНП может содержать только остатки 1-151. Это, конечно, также верно для соответствующих фрагментов пре-проПНП, особенно, проПНП.
«Про-предсердный натрийуретический пептид» или «проПНП» относится к прогормону, содержащему 128 аминокислот.
В данном документе пептид, содержащий 28 аминокислот (99-126) С-концевой части прогормона, состоящего из 128 аминокислот (проПНП), называется фактическим гормоном ПНП. После высвобождения ПНП из его прогормона проПНП в кровоток высвобождается эквимолярное количество оставшегося более крупного частичного пептида проПНП - N-концевого проПНП, состоящего из 98 аминокислот (NT-проПНП; проПНП(1-98)). Поскольку NT-проПНП имеет значительно большие период полувыведения и стабильность, NT-проПНП может использоваться в качестве лабораторного параметра для диагностики, последующего наблюдения и контроля терапии; см., например, Lothar Thomas (Editor), Labor und Diagnose, 5th expanded ed., sub-chapter 2.14 of chapter 2, Kardiale Diagnostik, pages 116-118, и WO 2008/135571. Уровень проПНП, предпочтительно, измеряют в плазме или сыворотке субъекта.
«Предсердный натрийуретический пептид (ПНП)», являющийся членом семейства натрийуретических пептидов, регулирует несколько физиологических параметров, включая диурез и натрийурез, а также пониженное артериальное давление (АД). Он преимущественно продуцируется в предсердии сердца и составляет 98% натрийуретических пептидов, находящихся в кровотоке (Vesely DL. Life 2002; 53:153-159). ПНП образуется в результате расщепления своего прогормона-предшественника, который значительно более стабилен в кровотоке, чем зрелый пептид. Среднерегионарный фрагмент гормона-предшественника (аминокислоты 53-90 NT-проПНП), называется среднерегионарным проПНП (СР-проПНП), может быть относительно устойчивым к деградации под действием экзопротеаз, в отличие от эпитопов на N- или C-концах проПНП, использовавшихся ранее в иммуноанализах (Morgenthaler NG et al. Clin Chem 2004; 50: 234-236; Gerszten RE et al. 2008. Am J Physiol Lung Cell Mol Physiol).
SEQ ID NO: 11: (аминокислотная последовательность пре-проПНП, 153 АК):
MSSFSTTTVS FLLLLAFQLL GQTRANPMYN AVSNADLMDF KNLLDHLEEK
MPLEDEVVPP QVLSEPNEEA GAALSPLPEV PPWTGEVSPA QRDGGALGRG
PWDSSDRSAL LKSKLRALLT APRSLRRSSC FGGRMDRIGA QSGLGCNSFR
YRR
SEQ ID NO: 12: (аминокислотная последовательность проПНП):
NPMYNAVSNA DLMDFKNLLD HLEEKMPLED EVVPPQVLSE PNEEAGAALS
PLPEVPPWTG EVSPAQRDGG ALGRGPWDSS DRSALLKSKL RALLTAPRSL
RRSSCFGGRM DRIGAQSGLG CNSFRY
SEQ ID NO: 13: (аминокислотная последовательность ПНП, АК 124-151 пре-проПНП):
SLRRSSCFGG RMDRIGAQSG LGCNSFRY
SEQ ID NO: 14: (аминокислотная последовательность NT-проПНП, АК 26-123 пре-проПНП):
NPMYNAVSNA DLMDFKNLLD HLEEKMPLED EVVPPQVLSE PNEEAGAALS
PLPEVPPWTG EVSPAQRDGG ALGRGPWDSS DRSALLKSKL RALLTAPR
SEQ ID NO: 15: (аминокислотная последовательность СР-проПНП, АК 53-90 проПНП): PEVPPWT GEVSPAQRDG GALGRGPWDS SDRSALLKSK L
(Предсердный натрийуретический пептид Uniprot №: P01160)
Определение таких различных форм проПНП и его фрагментов также включает измерение и/или обнаружение конкретных субобластей этих молекул, например, с использованием антител или других аффинных реагентов, нацеленных против определенной части молекул, или путем определения наличия и/или количества молекул путем измерения части белка с помощью масс-спектрометрии. Любой один или несколько из описанных в данном документе «пептидов или фрагментов проПНП» может быть использован в данном изобретении.
Уровень проПНП в образце, полученном от субъекта, может быть определен с помощью иммуноанализов, как описано в данном документе. При использовании в данном документа также может быть определен уровень рибонуклеиновой кислоты или дезоксирибонуклеиновых кислот, кодирующих «предсердный натрийуретический пептид» или «проПНП». Способы определения проПНП и его фрагмента (фрагментов) известны квалифицированным специалистам, например, с использованием продуктов, полученных от фирмы Thermo Fisher Scientific/B⋅R⋅A⋅H⋅M⋅S GmbH.
Термин «фрагмент» относится к белкам или пептидам меньшего размера, полученным из более крупных белков или пептидов, которые, таким образом, содержат частичную последовательность более крупного белка или пептида. Указанные фрагменты могут быть получены из более крупных белков или пептидов путем делеции одной или нескольких аминокислот из более крупного белка или пептида. «Фрагменты» биомаркера, описанного в данном документе, предпочтительно относятся к фрагментам длиной по меньшей мере 6 аминокислот, наиболее предпочтительно, по меньшей мере 12 аминокислот
.Такие фрагменты предпочтительно, могут обнаруживаться с помощью иммунологических анализов, как описано в данном документе.
Соответственно, способы и наборы по данному изобретению могут также включать определение по меньшей мере одного дополнительного биомаркера, маркера, клинического показателя и/или параметра, в дополнение к проАДМ, проМНП и/или проПНП.
В используемом в данном документе значении, параметр представляет собой характеристику, признак или измеримый показатель, который может помочь в определении конкретной системы. Параметр является важным элементом для связанных со здоровьем и физиологией оценок, таких как риск заболевания/расстройства/клинического состояния, предпочтительно, органной дисфункции (дисфункций), оценка риска нежелательных явлений, или необходимость или возможность расширения дистанционного ведения пациентов. Кроме того, параметр определяется как характеристика, которая объективно измеряется и оценивается как индикатор нормальных биологических процессов, патогенных процессов, фармакологических ответов на терапевтическое вмешательство или заболевания или состояния здоровья, в частности, заболевания или состояния здоровья пациента, страдающего сердечно-сосудистым заболеванием.
Иллюстративный параметр может быть выбран из группы, состоящей из возраста, веса, пола, индекса массы тела, половой идентичности, употребления жевательного табака (quid intake), количества лейкоцитов, натрия, калия, температуры, этнического происхождения, креатинина крови, фракции выброса левого желудочка (ФВЛЖ), фракции выброса правого желудочка (ФВПЖ), класса по NYHA, оценки риска сердечной недостаточности по MAGGIC, класса по ACC/AHA, оценок риска сердечной недостаточности (включая, например, оценку риска CHARM, оценку риска CORONA, оценку I-Preserve, модель классификации и регрессионное дерево (CART) ADHERE, оценку риска EFFECT), типа лечения, частоты лечения, кровяного давления (систолического/диастолического), частоты сердечных сокращений, сердечного ритма по ЭКГ, парциального давления кислорода, концентрации кислорода в периферической крови (SpO2), давления в яремной вене, наличия периферического отека или ортопноэ, наличие подъема правого желудочка, состояния здоровья по самооценке (по шкале), симптомов прогрессирования сердечно-сосудистого заболевания по самооценке (включая ноющую боль, одышку, жжение, спазмы, дискомфорт, чувство разрывающейся грудной клетки, ощущение тяжести, несварение желудка, предобморочное состояние, тошноту, онемение, покалывание, боль, чувство давления на грудную клетку, нехватку дыхания, потливость, головокружение, чувство сжатия в грудной клетке, стеснение, рвоту, нерегулярное сердцебиение, учащенное сердцебиение, усиленное сердцебиение, утомляемость, слабость, наличие периферических отеков), параметра, указывающего на почечную функцию, предпочтительно, скорости клиренса креатинина, скорости клубочковой фильтрации (СКФ) или уровня по меньшей мере одного продукта метпболизма креатинина и мочевины, или параметра, характеризующего функцию печени.
В предпочтительных вариантах реализации по меньшей мере одним клиническим параметром, предпочтительно, является возраст, вес, индекс массы тела, пол, этническое происхождение, креатинин крови, фракция выброса левого желудочка (ФВЛЖ), класс по NYHA, оценка риска сердечной недостаточности по MAGGIC, статус лечения, кровяное давление (систолическое/диастолическое), частота сердечных сокращений, ритм сердца по ЭКГ, SpO2, самооценка состояния здоровья (по шкале), самооценка симптомов прогрессирования сердечно-сосудистых заболеваний или скорость клубочковой фильтрации (СКФ).
Используемый в данном документе термин «возраст» относится к продолжительности жизни индивидуума в годах.
В контексте данного документа «индекс массы тела (ИМТ)» представляет собой значение, полученное на основе массы (веса) и роста субъекта. ИМТ определяется как масса тела субъекта, т.е. вес, деленный на квадрат роста субъекта, и обычно выражается в кг/м2, при весе в килограммах и росте в метрах. ИМТ также можно определить с помощью таблицы или диаграммы (референсные значения), на которой ИМТ отображается как функция массы и роста с использованием контурных линий или цветов для разных категорий ИМТ, и могут использоваться две разные единицы измерения. ИМТ - это попытка количественно определить у индивидуума количество тканевой массы (мышцы, жир и кости), а затем классифицировать этого человека как особу с недостаточным весом, нормальным весом, избыточным весом или ожирением, в зависимости от этого значения. Общепринятыми диапазонами значений ИМТ являются недостаточный вес: до 18,5, нормальный вес: от 18,5 до 25, избыточный вес: от 25 до 30, ожирение: более 30.
Используемый в данном документе термин «вес» относится к массе субъекта в кг. В контексте данного изобретения нормальную массу тела теоретически можно рассчитать по формуле Девина (Devin) или методу Хамви (Hamwi). По методу Хамви идеальная масса тела мужчины составляет 48 кг плюс 2,7 кг на каждые 2,54 см свыше 1,5 м. Для женщин она составляет 45 кг плюс 2,3 кг на каждые 2,54 см свыше 1,5 м. Значения ниже или выше этих нормальных значений увеличивают риск нахождения субъекта в критическом состоянии и/или указывают на прогрессирование заболевания.
Используемый в данном документе термин «скорость клубочковой фильтрации (СКФ)» относится к скорости, с которой почки фильтруют кровь, удаляя избыточные отходы и жидкости, и обеспечивает расчет для измерения остаточной функции почек. Обычно СКФ не измеряется непосредственно у людей, а вместо этого оценивается по измерениям клиренса или уровням в сыворотке маркеров фильтрации, представляющих собой экзогенные или эндогенные растворенные вещества, которые выводятся в основном за счет клубочковой фильтрации. СКФ можно рассчитать с использованием математических формул, хорошо известных в данной области техники, например, путем сравнения размера, возраста, пола и/или расы человека с уровнями креатинина в сыворотке.
В некоторых вариантах реализации СКФ рассчитывается с использованием формулы для расчетной скорости клиренса креатинина (eCCr), опубликованной в Cockroft et al., 1976:
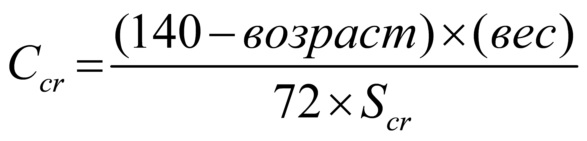
Здесь вес означает вес в килограммах (кг), а Scr относится к уровню креатинина сыворотки в мг/100 мл. Полученное значение, предпочтительно, умножают на коэффициент 0,85, если пациентом является женщина.
Когда креатинин сыворотки измеряется в мкмоль/л, формулу предпочтительно, адаптируют следующим образом:

Здесь вес означает вес в килограммах (кг), а Scr относится к уровню креатинина сыворотки в мкмоль/л. Полученное значение, предпочтительно, умножают на коэффициент 1,23, если пациент мужчина, и на 1,04, если пациент - женщина. Указанный вариант реализации, предпочтительно, называется СКФ на основе формулы Кокрофта-Голта.
В некоторых вариантах реализации СКФ рассчитывается с использованием формулы, называемой уравнением программы Сотрудничества в области эпидемиологии хронического заболевания почек (CKD-EPI), опубликованной в Levey, AS, et al. (2009) см.: Таблицу 2):
Указанный вариант реализации, предпочтительно, называют СКФ на основе CKD-EPI.
Следует понимать, что используемый в данном документе термин скорость клубочковой фильтрации (СКФ) не ограничивается вышеупомянутыми оценками, но может в равной степени использовать любую методику оценки или измерения, как описано, например, в Levey et al., 2017, а также в приведенных там ссылках.
В некоторых вариантах реализации образец крови небольшого объема используется для контроля функции почек. Используемый в данном документе термин «почечная функция» используется для описания состояния здоровья почек пациента, включая их выделительную функцию, определяемую тестом или анализом, описаннным в данном документе или хорошо известным в данной области техники. В некоторых вариантах реализации функцию почек можно контролировать путем определения скорости клубочковой фильтрации путем определения скорости клиренса креатинина или путем определения уровня по меньшей мере одного продукта метаболизма креатинина и мочевины.
В некоторых вариантах реализации мониторинг почечной функции осуществляется путем определения уровня креатинина, азота мочевины крови (АМК) или обоих в образце с использованием стандартных методов (см., например, Alfawassermann ACE Clinical Chemistry System Operator's Manual, August 2005 revision). Если функция почек в норме, уровни креатинина в крови будут находиться в пределах от примерно 0,6 до примерно 1,2 мг/дл или от примерно 53 до примерно 106 мкмоль/л для мужчин, в пределах от примерно 0,5 до примерно 1,1 мг/дл или от примерно 44 до примерно 97 мкмоль/л для женщин, от примерно 0,5 до примерно 1,0 мг/дл для подростков, от примерно 0,3 до примерно 0,7 мг/дл для детей, и от примерно 0,3 до примерно 1,2 мг/дл для новорожденных. Если функция почек в норме, то отношение АМК к креатинину составляет от примерно 10:1 до примерно 20:1 для пациентов старше 12 месяцев и до примерно 30:1 для пациентов младше 12 месяцев.
В некоторых вариантах реализации значение СКФ ниже 60, предпочтительно, ниже 50, более предпочтительно, ниже 30, указывает на нарушение функции почек, т.е. на то, что почка не функционирует должным образом.
В некоторых вариантах реализации помимо определения уровня одного или нескольких биомаркеров, как описано в данном документе, оценка риска сердечной недостаточности MAGGIC используется для принятия решения о назначении или отказе от назначения дистанционного ведения пациента.
Шкала риска сердечной недостаточности MAGGIC была введена Pocock et al., 2013, и учитывает 13 независимых клинических параметров (возраст, пол, диабет, сопутствующая патология ХОБЛ, диагноз сердечной недостаточности в течение последних 18 месяцев, статус курения, класс по NYHA, лечение бета-блокаторами, лечение ингибиторами ангиотензинпревращающего фермента/блокаторами рецептора ангиотензина (ACEi/ARB), ИМТ, систолическое артериальное давление, креатинин и фракцию выброса). Шкала риска Глобальной группы метаанализа по хронической сердечной недостаточности (MAGGIC) была описана для помощи в прогнозировании нежелательных явлений, таких как смертность, у пациентов, страдающих сердечной недостаточностью. Однако, сердечная недостаточность по MAGGIC может, кроме того, способствовать повышению уверенности в терапевтических решениях, касающихся назначения дистанционного ведения пациента, в сочетании с измерениями биомаркеров, как описано в данном документе. В целом, более низкий балл оценки риска сердечной недостаточности по MAGGIC может расширить уровень низкой пользы биомаркеров, при котором пациенты могут быть безопасно исключены из дистанционного ведения пациентов.
Термины «маркер», «суррогат», «прогностический маркер», «фактор», «биомаркер» или «биологический маркер» используются взаимозаменяемо и относятся к измеримым и количественно определяемым биологическим маркерам (например, концентрация определенного фермента или его фрагмента, концентрация определенного гормона или его фрагмента, распределение фенотипа конкретного гена в популяции, присутствие биологических веществ или их фрагментов), которые служат показателями для оценок, связанных со здоровьем и физиологией, таких как риск болезни/расстройства/клинического состояния. Кроме того, биомаркер определяется как характеристика, которая объективно измеряется и оценивается как индикатор нормальных биологических процессов, патогенных процессов или фармакологических ответов на терапевтическое вмешательство. Биомаркер можно измерить в биопробе (например, как тест крови, мочи или ткани), он может представлять собой запись, полученную от человека (кровяное давление, ЭКГ или холтеровское мониторирование), или он может быть визуализирующим тестом (эхокардиограмма или компьютерная томография) (Vasan et al., 2006, Circulation 113:2335-2362). Биомаркеры могут указывать на различные характеристики здоровья или заболевания, включая уровень или тип воздействия фактора окружающей среды, генетическую восприимчивость, генетическую реакцию на воздействия, биомаркеры субклинического или клинического заболевания или индикаторы ответа на терапию. Таким образом, упрощенно биомаркеры можно рассматривать как индикаторы признака заболевания (фактора риска или биомаркера риска), состояния заболевания (доклиническое или клиническое) или степени заболевания (прогрессирование). Соответственно, биомаркеры можно классифицировать на продромальные биомаркеры (идентифицирующие риск развития заболевания), скрининговые биомаркеры (скрининг субклинического заболевания), диагностические биомаркеры (распознавание явного заболевания), биомаркеры стадирования (определение степени тяжести заболевания) или прогностические биомаркеры (прогнозирование будущего течения заболевания, включая рецидивы и ответ на терапию, и мониторинг эффективности терапии). Биомаркеры могут также служить суррогатными конечными точками. Суррогатная конечная точка - это конечная точка, которую можно использовать в качестве результата в клинических испытаниях для оценки безопасности и эффективности лечения вместо измерения истинного результата, представляющего интерес. Основополагающий принцип заключается в том, что изменения суррогатной конечной точки тесно связаны с изменениями результата, представляющего интерес. Суррогатные конечные точки имеют то преимущество, что они могут быть собраны в более короткие сроки и с меньшими затратами, чем такие конечные точки, как заболеваемость и смертность, для оценки которых требуются крупные клинические испытания. Дополнительной ценностью суррогатных конечных точек является их близость к представляющему интерес воздействию/вмешательству, вследствие чего для них легче установить причинную связь, чем для более отдаленных клинических событий. Важным недостатком суррогатных конечных точек является то, что, если интересующий клинический результат находится под влиянием множества факторов (в дополнение к суррогатной конечной точке), то остаточное искажение может снизить достоверность суррогатной конечной точки. Было высказано предположение, что достоверность суррогатной конечной точки выше, если она может объяснить не менее 50% эффекта воздействия или вмешательства на интересующий результат. Количественное определение биомаркера может быть выполнено путем измерения соответствующей рибонуклеиновой кислоты, дезоксирибонуклеиновой кислоты, белка, пептида или их фрагментов.
Указанный по меньшей мере один дополнительный биомаркер и/или параметр указанного субъекта может быть выбран из группы, состоящей из уровня лактата в указанном образце, уровня креатина, уровня гемоглобина, уровня гематокрита, уровня лейкоцитов, уровня тромбоцитов, уровня натрия, уровня калия, растворимой fms-подобной тирозинкиназы-1 (sFlt-1), гистона H2A, гистона H2B, гистона H3, гистона H4, аргинина вазопрессина (AVP), предсердного натрийуретического пептида (ПНП), миоглобина, креатинкиназы липокалина, ассоциированного с желатиназой нейтрофилов (NGAL), тропонина, сердечного тропонина T (cnTNT), C-реактивного белка (СРБ), литостатина (PSP), триггерного рецептора, экспрессируемого на миелоидных клетках 1 (TREM1), интерлейкина-6 (IL-6), интерлейкина-1, интерлейкина-24 (IL-24), интерлейкина-22 (IL-22), интерлейкина-20 (IL-20), других ИЛ, пресепсина (sCD14-ST), липополисахарид-связывающего белка (LBP), альфа-1-антитрипсина, матричной металлопротеиназы 2 (MMP2), металлопротеиназы 8 (MMP8), матричной металлопротеиназы 9 (MMP9), матричной металлопротеиназы 7 (MMP7), плацентарного фактора роста (PlGF), хромогранина A, белка S100A, белка S100B и фактора некроза опухоли α (TNFα), неоптерина, альфа-1-антитрипсина, проаргинина вазопрессина (AVP, проAVP или копептин), эндотелина-1, прокальцитонина (ПКТ), CCL1/TCA3, CCL11, CCL12/MCP-5, CCL13/MCP-4, CCL14, CCL15, CCL16, CCL17/TARC, CCL18, CCL19, CCL2/MCP-1, CCL20, CCL21, CCL22/MDC, CCL23, CCL24, CCL25, CCL26, CCL27, CCL28, CCL3, CCL3L3, CCL4, CCL4L1/LAG-1, CCL5, CCL6, CCL7, CCL8, CCL9, CX3CL1, CXCL1, CXCL15, CXCL11, CX13CL, CXCL12, CXCL11, CX13CL, CXCL12, CXCL15 CXCL16, CXCL17, CXCL2/MIP-2, CXCL3, CXCL4, CXCL5, CXCL6, CXCL7/Ppbp, CXCL9, IL8/CXCL8, XCL1, XCL2, FAM19A1, FAM19A2, FAM19A3, FAM19A5, FAM19A4, FAM19A4, FAM19A4, CLCF1, CNTF, IL11, IL31, IL6, лептина, LIF, OSM, IFNA1, IFNA10, IFNA13, IFNA14, IFNA2, IFNA4, IFNA7, IFNB1, IFNE, IFNG, IFNZ, IFNA8, IFNA5/IFNaG, IFNω/IFNW1, BAFF, 4-1BBL, TNFSF8, CD40LG, CD70, CD95L/CD178, EDA-A1, TNFSF14, LTA/TNFB, LTB, LTB TNFa, TNFSF10, TNFSF11, TNFSF12, TNFSF13, TNFSF15, TNFSF4, IL18, IL18BP, IL1A, IL1B, IL1F10, IL1F3/IL1RA, IL1F5, IL1F6, IL1F7, IL1F8, IL1RL2, IL1F9, IL33 или их фрагментов.
В предпочтительных вариантах реализации дополнительный биомаркер представляет собой «сердечно-сосудистый маркер», который связан с диагнозом и/или прогнозом сердечно-сосудистых заболеваний, такой как миоглобин, тропонины T (cTnT) и I (cTnI), креатининкиназа MB (CK-MB), FABP, GDF-15, ST-2, прокальцитонин (ПКТ), C-реактивный белок (СРБ), включая проэндотелин-1 и его фрагменты, включая C-концевой проэндотелин-1 (CT-proET-1), большой эндотелин-1, эндотелин-1, NT-проэндотелин-1, проПНП и его фрагменты, включая среднерегионарный предсердный натрийуретический пропептид (СР-проПНП), N-концевой проПНП (NT-проПНП), ПНП, провазопрессин и их фрагменты, включая C-концевой аргинин-вазопрессиновый пропептид (CT-proAVP), вазопрессин, нейрофизин II, проМНП и его фрагменты, включая МНП и N-концевой проМНП (NT-проМНП).
В предпочтительных вариантах реализации дополнительный биомаркер представляет собой «маркер функции почек», который связан с функцией почек или диагнозом и/или прогнозом почечных заболеваний, включая острое повреждение почек (ОПП) или хроническое заболевание почек (CKD), такой как креатинин, креатинин сыворотки, мочевина, мочевая кислота, цистатин C, β-следовые протеины (BTB), инулин, йогексол, радиоактивные маркеры, протеинурия, альбумин мочи, маркер повреждения почек-1 (KIM-1), липокалин, связанный с желатиназой нейтрофилов (NGAL), интерлейкин-18, белок, связывающий жирные кислоты печеночного типа (L-FABP), асимметричный диметиларгинин (АДМА), лактатдегидрогеназа (ЛДГ), глутатион-S-трансфераза (GST), N-ацетил-β-глюкозаминидаза (NAG), аланинаминопептидаза (ААП), γ-глутамилтрансфераза (ГГТ), тканевой ингибитор металлопротеиназы-2 (ТИМП-2) и/или инсулиноподобный белок, связывающий фактор роста 7 (IGFBPT).
За дополнительным описанием предпочтительных биомаркеров, связанных с функцией почек, специалист в данной области может также обратиться к опубликованным обзорным статьям, таким как Krstic et al., 2016 или Gowda et al., 2010.
Используемый в данном документе термин «образец» означает биологический образец, полученный или взятый от пациента или субъекта. «Образец», как используется в данной заявке, может, например, относиться к образцу биологической жидкости или ткани, полученному с целью диагностики, прогнозирования, руководства терапией, стратификации, мониторинга или контроля или оценки представляющего интерес субъекта, такого как пациент. Предпочтительно, в данном документе образец представляет собой образец биологической жидкости, такой как кровь, сыворотка, плазма, спинномозговая жидкость, моча, слюна, мокрота, плевральные выпоты, клетки, клеточный экстракт, образец ткани, биопсия ткани, образец кала и т.п. В частности, образец представляет собой кровь, плазму крови, сыворотку крови или мочу.
Варианты реализации данного изобретения относятся к выделению первого образца и выделению второго образца, необязательно, «третьего образца», «четвертого образца» и т.д. В контексте способа по данному изобретению термины «первый образец» и «второй образец», а также возможные «третьи образцы» или «четвертые образцы» и т.д. относятся к относительному определению временного порядка выделения образцов, используемых в способе по данному изобретению. При использовании терминов первый образец и второй образец в описании способа по данному изобретению, эти образцы не должны рассматриваться как абсолютные определения числа взятых образцов. Таким образом, дополнительные образцы могут быть получены от пациента до, во время или после взятия первого и/или второго образца, или между первым или вторым образцами, при этом такие дополнительные образцы могут быть использованы или не использоваться в способе по данному изобретению. Таким образом, первым образцом может считаться любой ранее полученный образец. Вторым образцом может считаться любой последующий или позднее полученный образец.
«Плазма» в контексте данного изобретения представляет собой практически бесклеточный супернатант крови, содержащий антикоагулянт, полученный после центрифугирования. Иллюстративные примеры антикоагулянтов включают соединения, связывающие ионы кальция, такие как ЭДТА или цитрат, и ингибиторы тромбина, такие как гепаринаты или гирудин. Бесклеточную плазму можно получить центрифугированием крови с добавленным антикоагулянтом (например, обработанной цитратом, ЭДТА или гепаринизированной крови), например, в течение по меньшей мере 15 минут при 2000-3000 g.
«Сыворотка» в контексте данного изобретения представляет собой жидкую фракцию цельной крови, которую собирают после свертывания крови. При центрифугировании коагулированной крови (свернувшейся крови) сыворотка может быть получена в виде супернатанта.
Используемый в данном документе термин "моча" представляет собой жидкий продукт организма, выделяемый почками в процессе, называемом мочевыделением (или мочеиспусканием), и выводится через уретру.
Согласно данному изобретению проАДМ, проМНП и/или проПНП и/или, необязательно, другие маркеры или клинические показатели используются в качестве маркеров для терапевтического руководства, стратификации терапии и/или контроля терапии пациента, у которого было диагностировано сердечно-сосудистое заболевание, а также, необязательно, в качестве прогноза, диагноза, оценки риска и стратификации риска нежелательного явления для здоровья пациента с диагнозом сердечно-сосудистого заболевания, предпочтительно, сердечной недостаточности.
Квалифицированный специалист способен получить или разработать средства для идентификации, измерения, определения и/или количественного определения любой из вышеупомянутых молекул проАДМ, проМНП и/или проПНП или их фрагментов или вариантов, а также других маркеров по данному изобретению в соответствии со стандартной практикой молекулярной биологии.
Уровень проАДМ, проМНП и/или проПНП или их фрагментов, а также уровни других маркеров по данному изобретению можно определить с помощью любого анализа, который достоверно определяет концентрацию маркера. В частности, могут быть использованы масс-спектрометрия (МС) и/или иммуноанализы, как проиллюстрировано в прилагаемых примерах. При использовании в данном документа, иммуноанализ представляет собой биохимический тест, в котором измеряют наличие или концентрацию макромолекулы/полипептида в растворе с помощью антитела или связывающего фрагмента антитела или иммуноглобулина.
Методы определения проАДМ, проМНП и/или проПНП или других маркеров, используемых в контексте данного изобретения предусматриваются в данном изобретении. В качестве примера, может быть использован способ, выбранный из группы, состоящей из масс-спектрометрии (МС), люминесцентного иммуноанализа (ЛИА), радиоиммуноанализа (РИА), хемилюминесцентного и флуоресцентного иммуноанализов, иммуноферментного анализ (ИФА, EIA), твердофазного иммуноферментного анализа (ELISA), анализов с использованием чипов с люминесцентными гранулами, анализов с использованием чипов с магнитными гранулами, анализов с использованием белковых микрочипов, экспресс-тестов таких форматов, как, например, иммунохроматографические полоски, анализа c использованием криптатов редкоземельных элементов и автоматизированных систем/анализаторов.
Определение проАДМ, проМНП и/или проПНП и, необязательно, других маркеров на основе распознавания антителами является предпочтительным вариантом реализации данного изобретения. Используемый в данном документе термин «антитело» относится к молекулам иммуноглобулина и иммунологически активным частям молекул иммуноглобулина (Ig), т.е. к молекулам, содержащим антигенсвязывающий сайт, который специфически связывает антиген (иммуно реагирует с антигеном). В соответствии с данным изобретением, антитела могут представлять собой как моноклональные, так и поликлональные антитела. В частности, используются антитела, которые специфически связываются по меньшей мере с проАДМ, проМНП и/или проПНП или их фрагментами.
Антитело считается специфическим, если его аффинность к представляющей интерес молекуле, например, проАДМ, проМНП и/или проПНП, или ее фрагменту, по меньшей мере в 50 раз выше, предпочтительно, в 100 раз выше, наиболее предпочтительно, по меньшей мере в 1000 раз выше, чем по отношению к другим молекулам, присутствующим в образце, содержащем представляющую интерес молекулу. В данной области техники хорошо известно, как разработать и выбрать антитела с заданной специфичностью. В контексте данного изобретения предпочтительными являются моноклональные антитела. Антитело или связывающий фрагмент антитела специфически связывается с описанными в данном документе маркерами или их фрагментами. В частности, антитело или связывающий фрагмент антитела связывается с описанными в данном документе пептидами проАДМ, проМНП и/или проПНП. Таким образом, описанные в данном документе пептиды также могут представлять собой эпитопы, с которыми указанные антитела специфически связываются. Кроме того, антитело или связывающий фрагмент антитела используют в способах и наборах по данному изобретению, которые специфически связываются с АДМ или проАДМ, в частности, с СР-проАДМ, с проМНП, в частности, с NT-проМНП, и/или с проПНП, в частности, с СР-проПНП.
Кроме того, антитело или связывающий фрагмент антитела используют в способах и наборах по данному изобретению, которые специфически связываются с проАДМ, проМНП и/или проПНП или их фрагментами и, необязательно, с другими маркерами по данному изобретению. Иллюстративными примерами иммуноанализов могут быть люминесцентный иммуноанализ (ЛИА), радиоиммуноанализ (РИА), хемилюминесцентный и флуоресцентный иммуноанализы, ферментный иммуноанализ (ИФА), твердофазный иммуноферментный анализ (ELISA), анализы с использованием чипов с люминесцентными гранулами, анализы с использованием чипов с магнитными гранулами, анализы с использованием белковых микрочипов, форматы экспресс-методов тестирования или анализ с использованием криптатов редкоземельных элементов. Кроме того, могут применяться тесты, пригодные для проведения тестирования в пунктах оказания медицинской помощи, и форматы экспресс-методов тестирования, такие как, например, тесты с иммунохроматографическими полосками.
Также предусматривается использование автоматизированных иммуноанализов, таких как анализ с использованием анализатора KRYPTOR.
В качестве альтернативы, вместо антител в объем данного изобретения могут входить другие молекулы захвата или молекулярные каркасы, которые специфично и/или селективно распознают проАДМ, проМНП и/или проПНП. В данном документе термины «молекулы захвата» или «молекулярные каркасы» включают молекулы, которые можно использовать для связывания молекул-мишеней или молекул, представляющих интерес, т.е. аналитов (например, проАДМ, проАДМ, СР-проАДМ, проМНП, NT-проМНП, проПНП и/или СР-проПНП) из образца. Таким образом, молекулы захвата должны иметь подходящую форму, как пространственную, так и с точки зрения характеристик поверхности, таких как поверхностный заряд, гидрофобность, гидрофильность, наличие или отсутствие доноров и/или акцепторов Льюиса, чтобы специфически связывать молекулы-мишени или молекулы, представляющие интерес. Таким образом, связывание может, например, быть опосредовано ионными, ван-дер-ваальсовыми, пи-пи, сигма-пи, гидрофобными или водородными взаимодействиями или комбинацией двух или более из вышеупомянутых взаимодействий, или ковалентными взаимодействиями между молекулами захвата или молекулярными каркасами и молекулами-мишенями или молекулами, представляющими интерес. В контексте данного изобретения молекулы захвата или молекулярные каркасы могут быть, например, выбраны из группы, состоящей из молекулы нуклеиновой кислоты, молекулы углевода, молекулы ПНК (пептидно-нуклеиновой кислоты), белка, пептида и гликопротеина. Молекулы захвата или молекулярные каркасы включают, например, аптамеры, дарпины (сконструированные белки с анкириновым повтором). Также включены аффимеры и т.п.
В определенных аспектах изобретения способ представляет собой иммуноанализ, включающий стадии:
a) введения образца в контакт с
i. первым антителом или его антигенсвязывающим фрагментом или производным, специфичным к первому эпитопу проАДМ, проМНП и/или проПНП, и
ii. вторым антителом или его антигенсвязывающим фрагментом или производным, специфичным ко второму эпитопу проАДМ, проМНП и/или проПНП; и
b) обнаружения связывания двух антител или антигенсвязывающих фрагментов или их производных с проАДМ, проМНП и/или проПНП.
Предпочтительно, одно из антител может быть меченым, а другое антитело может быть связано с твердой фазой или может селективно связываться с твердой фазой. В особенно предпочтительном аспекте анализа одно из антител является меченым, в то время как другое либо связано с твердой фазой, либо может селективно связываться с твердой фазой. Первое антитело и второе антитело могут быть диспергированы в жидкой реакционной смеси, причем первый метящий компонент, который является частью системы мечения на основе гашения или усиления флуоресценции или хемилюминесценции, связан с первым антителом, и второй метящий компонент указанной системы мечения связан со вторым антителом, так что после связывания обоих антител с детектируемыми проАДМ, проМНП и/или проПНП или их фрагментами генерируется измеримый сигнал, позволяющий детектировать образующиеся сэндвич-комплексы в измеряемом растворе. Система мечения может содержать криптат или хелат редкоземельного элемента в сочетании с флуоресцентным или хемилюминесцентным красителем, в частности, цианинового типа.
В предпочтительном варианте реализации способ проводится как гетерогенный сэндвич-иммуноанализ, причем одно из антител иммобилизовано на произвольно выбранной твердой фазе, например, на стенках пробирок с покрытием (например, полистирольных пробирок; пробирок с покрытием (СТ)) или микротитровальных планшетах, например, изготовленных из полистирола, или на частицах, таких как, например, магнитные частицы, при этом другое антитело содержит группу, напоминающую детектируемую метку или позволяющую селективно прикрепляться к метке, которая служит для обнаружения образующихся сэндвич-структур. Также возможна временно задержанная или последующая иммобилизация с использованием подходящих твердых фаз.
Способ согласно данному изобретению может, кроме того, быть реализован как гомогенный способ, причем сэндвич-комплексы, образуемые антителом/антителами и детектируемыми маркером, проАДМ, проМНП и/или проПНП или их фрагментами, остаются суспендированными в жидкой фазе. В этом случае предпочтительно, чтобы при использовании двух антител оба антитела были помечены частями системы обнаружения, что приводит к генерации сигнала или инициированию сигнала, если оба антитела интегрированы в одну сэндвич-структуру. Такие способы должны быть реализованы, в частности, как способы детектирования усиления или гашения флуоресценции. Особенно предпочтительный аспект относится к использованию реагентов для детектирования, которые должны применяться попарно, таких как, например, описанные в US4882733, EP0180492 или EP0539477 и в описанном в них известном уровне техники. Таким образом, становятся возможными измерения, при которых детектируются только продукты реакции, включающие оба метящих компонента в одном иммунном комплексе, непосредственно в реакционной смеси. Например, такие технологии предлагаются под торговыми марками TRACE® (усиленное излучение криптата с временным разрешением) или KRYPTOR®, реализующие идеи вышеуказанных заявок. Поэтому в конкретных предпочтительных аспектах для реализации предложенного в данной заявке способа используют диагностическое устройство. Например, определяют уровень проАДМ, проМНП и/или проПНП или их фрагментов и/или уровень любого другого маркера предлагаемого в данном документе способа. В особенно предпочтительных аспектах диагностическое устройство представляет собой KRYPTOR® или коррелирующие автоматизированные системы.
Уровень маркера по данному изобретению, например, проАДМ, проМНП и/или проПНП или их фрагментов, или других маркеров, также может быть определен с помощью методов на основе масс-спектрометрии (МС). Такой метод может включать определение наличия, количества или концентрации одного или нескольких модифицированных или немодифицированных фрагментов пептидов, например, проАДМ, проМНП и/или проПНП в указанном биологическом образце или белковом лизате (например, триптическом лизате) из указанного образца и, необязательно, разделение образца хроматографическими методами и исследование подготовленного и необязательно разделенного образца с помощью МС-анализа. Например, масс-спектрометрия с мониторингом выбранных реакций (SRM), мониторингом множественных реакций (MRM) или мониторингом параллельных реакций (PRM) может использоваться в МС-анализе, в частности, для определения количества проАДМ, проМНП и/или проПНП или их фрагментов.
В данном документе термин «масс-спектрометрия» или «МС» относится к аналитической методике, позволяющей идентифицировать соединения по их массе. В целях повышения возможностей масс-спектрометрии по массовому разрешению и определению массы образцы могут подвергаться обработке перед МС-анализом.
Соответственно, изобретение относится к способам МС-детектирования, которые можно комбинировать с технологиями иммунообогащения, способами, связанными с подготовкой образца и/или хроматографическими методами, предпочтительно, с жидкостной хроматографией (ЖХ), более предпочтительно, с высокоэффективной жидкостной хроматографией (ВЭЖХ) или сверхвысокоэффективной жидкостной хроматографией (СВЭЖХ).
Способы подготовки образцов включают методики лизиса, фракционирования, гидролиза образца до пептидов, истощения, обогащения, диализа, обессоливания, алкилирования и/или восстановления пептидов. Однако, эти стадии являются необязательными. Селективное детектирование ионов аналита может быть проведено с помощью тандемной масс-спектрометрии (МС/МС). Тандемная масс-спектрометрия характеризуется стадией массового отбора (используемый в данном документе термин «массовый отбор» означает выделение ионов, имеющих указанное значение m/z или узкий диапазон значений m/z) с последующей фрагментацией выбранных ионов и анализом масс ионов образовавшихся продуктов (фрагментов).
Специалистам в данной области техники известно, как количественно определить уровень маркера в образце с помощью масс-спектрометрических методов. Например, может быть использовано определение относительного количества «оМСР» (rSRM) или определение абсолютного количества, как описано выше.
Кроме того, указанные уровни (включая референсные уровни) могут быть определены с помощью масс-спектрометрических методов, таких как методы, определяющие относительные количества или абсолютные количества данного белка или его фрагмента, представляющего интерес.
Определение относительного количества «оМСР» может быть осуществлено путем:
1. Определения повышенного или пониженного присутствия целевого белка путем сравнения площади пика сигнатуры SRM (мониторинг селективных реакций) для данного целевого пептидного фрагмента, обнаруженного в образце, с площадью того же пика сигнатуры SRM целевого пептидного фрагмента во втором, третьем, четвертом или более биологических образцах.
2. Определения повышенного или пониженного присутствия целевого белка путем сравнения площади пика сигнатуры SRM для данного целевого пептида, обнаруженного в образце, с площадями пиков сигнатур SRM, полученных для пептидных фрагментов из других белков, в других образцах, полученных из других и различных биологических источников, причем сравнение площадей пиков сигнатур SRM для пептидного фрагмента между двумя образцами нормируют, например, по количеству белка, анализируемого в каждом образце.
3. Определения повышенного или пониженного присутствия целевого белка путем сравнения площади пика сигнатуры SRM для данного целевого пептида с площадями пиков сигнатуры SRM от других пептидных фрагментов, полученных из других белков в том же биологическом образце, с целью нормирования изменяющихся уровней белка гистонов с уровнями других белков, которые не изменяют свои уровни экспрессии при различных клеточных условиях.
4. Эти анализы могут применяться как к немодифицированным фрагментным пептидам, так и к модифицированным пептидным фрагментам целевых белков, причем такие модификации включают, без ограничений, фосфорилирование и/или гликозилирование, ацетилирование, метилирование (моно-, ди-, три-), цитруллинирование, убиквитинилирование и при этом относительные уровни модифицированных пептидов определяют таким же образом, как и при определении относительных количеств немодифицированных пептидов.
Определение абсолютного количества данного пептида может быть осуществлено путем:
1. Сравнения площади пика сигнатуры SRM/MRM для данного фрагмента пептида из целевых белков в отдельном биологическом образце с площадью пика сигнатуры SRM/MRM внутреннего стандарта фрагмента пептида, добавленного в лизат белка из биологического образца. Внутренним стандартом может быть меченый синтетический вариант фрагмента пептида из исследуемого целевого белка, или меченый рекомбинантный белок. Этот стандарт добавляют в образец в известном количестве до (обязательно для рекомбинантного белка) или после гидролиза, и площадь пика сигнатуры SRM/MRM может быть определена по отдельности как для внутреннего стандарта фрагмента пептида, так и для нативного пептидного фрагмента в биологическом образце, с последующим сравнением площадей обоих пиков. Эта процедура может быть применена к немодифицированным фрагментам пептидов и модифицированным фрагментам пептидов, причем модификации включают, без ограничений, фосфорилирование и/или гликозилирование, ацетилирование, метилирование (например, моно-, ди- или триметилирование), цитруллинирование, убиквитинилирование, и абсолютные уровни модифицированных пептидов могут быть определены таким же образом, как и при определении абсолютных уровней немодифицированных пептидов.
2. Пептиды также могут быть количественно определены с использованием внешних калибровочных кривых. В подходе с нормальной кривой используют постоянное количество тяжелого пептида в качестве внутреннего стандарта и варьирующееся количество легкого синтетического пептида, добавленного в образец. Репрезентативная матрица, аналогичная матрице тестируемых образцов, должна использоваться для построения калибровочных кривых для учета эффекта матрицы. Кроме того, метод обратной кривой позволяет обойти проблему эндогенного аналита в матрице, когда для создания внутреннего стандарта к эндогенному аналиту добавляют постоянное количество легкого пептида, и варьирующиеся количества тяжелого пептида добавляют для создания набора стандартных концентраций
В тестовые образцы для сравнения с нормальными или обратными кривыми добавляют такое же количество стандартного пептида, что и для внутреннего стандарта, добавленного в матрицу, использованную для создания калибровочной кривой.
Изобретение также относится к наборам, применению наборов и способам, в которых применяются такие наборы. Изобретение относится к наборам для реализации способов, представленных выше и ниже в данном документе. Приведенные в данной заявке определения, например, в связи с указанными способами, также применимы к наборам по изобретению. В частности, изобретение касается наборов для терапевтического руководства, стратификации и/или мониторинга дистанционного ведения пациента, у которого было диагностировано сердечно-сосудистое заболевание, причем набор содержит
- детектирующие реагенты для определения по меньшей мере одного биомаркера, выбранного из группы, состоящей из проАДМ, проМНП и проПНП или их фрагмента (фрагментов) в образце от пациента, и
- референсные данные, такие как референсные значения для определения того, является ли уровень по меньшей мере одного биомаркера, выбранного из группы, состоящей из проАДМ, проМНП и проПНП, показателем назначения или отказа от назначения дистанционного ведения пациента, в частности, референсные данные для уровня низкой пользы по меньшей мере одного биомаркера и уровня высокой пользы по меньшей мере одного биомаркера, при этом указанные референсные данные, предпочтительно, хранятся на машиночитаемом носителе и/или используются в форме исполняемого компьютером кода, сконфигурированного для сравнения определяемого по меньшей мере одного биомаркера с референсными значениями,
- необязательно, детектирующие реагенты для определения уровня по меньшей мере одного дополнительного биомаркера или его фрагмента (фрагментов) в образце от пациента и/или средства для определения по меньшей мере одного клинического параметра, предпочтительно, возраста, веса, индекса массы тела, пола, этнического происхождения, креатинина крови, фракции выброса левого желудочка (ФВЛЖ), фракции выброса правого желудочка (ФВПЖ), класса по NYHA, оценки риска сердечной недостаточности MAGGIC, состояния лечения, кровянного давления (систолического/диастолического), частоты сердечных сокращений, сердечного ритма по электрокардиограмме (ЭКГ), показателя насыщения кислородом периферической крови (SpO2), самооценки состояния здоровья (по шкале), или параметра, являющегося показателем функции почек, предпочтительно, скорости клиренса креатинина и/или скорости клубочковой фильтрации (СКФ), и референсные данные, такие как референсные значения для определения того, является ли уровень по меньшей мере одного дополнительного биомаркера или его фрагмента (фрагментов) и/или по меньшей мере одного клинического параметра показателем назначения или отказа от назначения дистанционного ведения пациента, при этом указанные референсные данные, предпочтительно, хранятся на машиночитаемом носителе и/или используются в форме исполняемого компьютером кода, сконфигурированного для сравнения определяемых уровней указанного по меньшей мере одного биомаркера или его фрагмента (фрагментов) и/или указанного по меньшей мере одного клинического параметра с референсными значениями.
Используемый в данном документе термин «референсные данные» включает референсный уровень (уровни) проАДМ, проМНП и/или проПНП и, необязательно, дополнительных маркеров, как описано в данном документе. Уровни проАДМ, проМНП и/или проПНП в образце от субъекта можно сравнивать с референсными уровнями, содержащимися в референсных данных набора. Референсные уровни описаны в данном документе выше и проиллюстрированы также в прилагаемых примерах. Референсные данные могут также включать эталонный образец, с которым сравнивают уровень проАДМ, проМНП и/или проПНП и, необязательно, других биомаркеров. Референсные данные также могут включать руководство по использованию наборов по изобретению.
Набор может дополнительно включать предметы, полезные для получения образца, такого как образец крови, например, набор может включать контейнер, причем указанный контейнер содержит устройство для присоединения указанного контейнера к канюле или шприцу, представляет собой шприц, подходящий для взятия крови, имеет внутреннее давление ниже атмосферного, чтобы втягивать заранее определенный объем образца в указанный контейнер, и/или дополнительно содержит детергенты, хаотропные соли, ингибиторы рибонуклеазы, хелатирующие агенты, такие как изотиоцианат гуанидиния, гидрохлорид гуанидиния, додецилсульфат натрия, монолаурат полиоксиэтиленсорбитана, белки-ингибиторы РНКазы и их смеси и/или фильтрующую систему, содержащую нитроцеллюлозу, кремнеземную матрицу, ферромагнитные сферы, чашку для сбора разлитых материалов, трегалозу, фруктозу, лактозу, маннозу, полиэтиленгликоль, глицерин, ЭДТА, Трис, лимонен, ксилол, бензоил, фенол, минеральное масло, анилин, пиррол, цитрат и их смеси.
Используемый в данном документе термин «детектирующий реагент» или подобные представляет собой реагенты, подходящие для определения описанного (описанных) в данном документе маркера (маркеров), например, проАДМ, проМНП и/или проПНП. Примерами таких детектирующих реагентов являются, например, лиганды, например, антитела или их фрагменты, которые специфически связываются с пептидом или эпитопами описанного (описанных) в данном документе маркера (маркеров). Такие лиганды могут применяться в иммуноанализах, как описано выше. Набор может также включать дополнительные реагенты, которые используются в иммуноанализах для определения уровня маркера (маркеров), и рассматриваются в данной заявке в качестве детектирующих реагентов. Детектирующие реагенты также могут относиться к реагентам, которые используются для обнаружения маркеров или их фрагментов методами на основе МС. Таким образом, такой детектирующий реагент также может представлять собой реагенты, например, ферменты, химические вещества, буферы и т.д., применяемые для подготовки образца к проведению МС-анализа. Масс-спектрометр также можно рассматривать в качестве детектирующего реагента. Детектирующие реагенты согласно изобретению также могут представлять собой калибровочный раствор(ы), который может быть использован, например, для определения и сравнения уровней маркера(ов).
Термины «отсекающие значения», «референсные значения» или «пороговые значения» могут использоваться взаимозаменяемо, и конкретные значения, описанные в данном документе, могут различаться в разных анализах, если они были «откалиброваны» иначе, чем системы анализа, используемые в данном изобретении. Таким образом, отсекающие значения или референсные значения должны быть применимыми для таких по-разному откалиброванных анализов, соответственно, с учетом различий в калибровке. Одной из возможностей количественной оценки разницы в калибровке является сравнительный анализ (корреляция) рассматриваемого метода анализа (например, анализа биомаркера x) с соответствующим анализом биомаркера, используемым в данном изобретении (например, анализа x), путем измерения соответствующего биомаркера (например, биомаркера x) в образцах с использованием обоих методов. Другая возможность состоит в том, чтобы определить с помощью рассматриваемого анализа, при условии, что этот тест имеет достаточную аналитическую чувствительность, средний уровень биомаркеров репрезентативной нормальной популяции, сравнить результаты со средними уровнями биомаркеров, описанными в литературе (например, приведенными для нормальной популяции), и пересчитать калибровку на основе разницы, полученной в результате этого сравнения.
Чувствительность и специфичность диагностического и/или прогностического теста зависят не только от аналитического "качества" теста, но и от определения того, что считается аномальным результатом. На практике «кривые соотношений правильного и ложного обнаружения сигналов» (ROC-кривые) обычно рассчитывают путем построения графика зависимости значения переменной от ее относительной частоты в «нормальной» (т.е., у очевидно здоровых людей, не имеющих инфекции) и «больной» популяциях, например, у субъектов с инфекцией. Для любого конкретного маркера (такого как проАДМ, проМНП и/или проПНП) распределения уровней маркеров для субъектов с заболеванием/состоянием и без него, вероятно, будут перекрываться.
При таких условиях, тест не способен абсолютно различать нормальное состояние и заболевание со 100% точностью, а область перекрывания может указывать, где тест не может отличить норму от болезни. Выбирают пороговое значение, ниже которого тест считается аномальным, и выше которого тест считается нормальным, или ниже или выше которого тест указывает на особое состояние, например, инфекцию или сердечно-сосудистое или цереброваскулярное событие. Площадь под кривой ROC является мерой вероятности того, что оцениваемое измерение позволит правильно идентифицировать состояние. Кривые ROC могут применяться, даже если результаты тестов не обязательно дают точное число. ROC-кривую можно построить при условии, что результаты можно ранжировать. Например, результаты теста на образцах «заболевания» могут быть ранжированы в соответствии со степенью (например, 1=низкая, 2=нормальная и 3=высокая). Такое ранжирование может быть сопоставлено с результатами в "нормальной" популяции, и построена ROC-кривая. Эти способы хорошо известны в данной области техники; см., например, Hanley et al., 1982. Radiology 143: 29-36. Предпочтительно, пороговое значение выбирают так, чтобы получить площадь кривой ROC больше примерно 0,5, более предпочтительно, больше примерно 0,7, еще более предпочтительно, больше примерно 0,8, еще более предпочтительно, больше примерно 0,85 и наиболее предпочтительно, больше примерно 0,9. Термин «примерно» в данном контексте относится к +/- 5% от данного измерения.
По горизонтальной оси кривой ROC откладываются значение (1-специфичность), которое возрастает с частотой ложноположительных результатов. Вертикальная ось кривой представляет собой чувствительность, которая возрастает с частотой истинно положительных результатов. Таким образом, для конкретного выбранного отсекающего значения, может быть определена величина (1-специфичность) и может быть получена соответствующая чувствительность. Площадь под ROC-кривой является мерой вероятности того, что измеренный уровень маркера позволит правильно идентифицировать заболевание или состояние. Таким образом, площадь под кривой ROC может использоваться для определения эффективности теста.
Подтверждение определяет минимальную долю субъектов, у которых действительно разовьется заболевание, расстройство или неблагоприятное событие, и гарантирует, что в этой истинно положительной группе будет достаточно большая часть субъектов с положительным результатом тестирования. Такой тест должен достигать максимальной специфичности и максимальной положительной прогностической ценности (ППЦ). В данном случае подтверждение, предпочтительно, означает указание на то, что дистанционное ведение пациента является полезным и должно быть назначено.
Исключение определяет минимальную долю субъектов, у которых определенно не разовьется заболевание, расстройство или нежелательное явление, и гарантирует, что заболевание разовьется у достаточно немногих из субъектов, получивших отрицательный результат (ложноотрицательные результаты). Таким образом, такой тест должен достигать максимальной чувствительности и максимальной отрицательной прогностической ценности (ОПЦ). В данном случае, исключение, предпочтительно, означает указание на то, что дистанционное ведение пациентов не приносит пользы и не должно назначаться.
Способы по данному изобретению могут быть частично компьютеризированы. Например, стадия сравнения выявленного уровня маркера, например, проАДМ, проМНП и/или проПНП или их фрагментов, с референсным уровнем может быть проведена в компьютерной системе. В компьютерной системе определенный уровень маркера (маркеров) можно комбинировать с уровнями других маркеров и/или параметрами субъекта для расчета оценки, являющейся показателем для диагноза, прогноза, оценки риска и/или стратификации риска. Например, определяемые значения могут быть введены (либо вручную медицинским работником, либо автоматически с устройства (устройств), в которых были определены уровень (уровни) соответствующих маркеров) в компьютерную систему. Компьютерная система может находиться непосредственно в телемедицинском центре, пункте оказания медицинской помощи (например, первичной медико-санитарной помощи, интенсивной терапии или неотложной помощи), или может быть расположена удаленно с подключением через компьютерную сеть (например, через Интернет или специализированные медицинские облачные системы, которые необязательно можно комбинировать с другими ИТ-системами или платформами, такими как больничная информационная система (БИС)). Обычно, компьютерная система будет хранить указанные значения (например, уровень маркера или параметры, такие как возраст, кровяное давление, вес, пол и т.д., или системы оценки клинических показателей, например, по шкале SOFA, qSOFA, BMI и т.д.) на машиночитаемом носителе и рассчитывать оценку на основании предварительно определенных и/или предварительно сохраненных референсных уровней или референсных значений. Полученная оценка будет отображаться и/или распечатываться для пользователя (обычно, медицинского работника, такого как врач). В качестве альтернативы или в дополнительно, связанный с этим прогноз, диагноз, оценка, терапевтическое руководство, руководство по ведению больного или стратификация будут отображаться и/или распечатываться для пользователя (обычно, медицинского работника, такого как врач).
В одном варианте реализации данного изобретения может использоваться система программного обеспечения, в которой целесообразно используется алгоритм машинного обучения, предпочтительно, для выявления госпитализированных пациентов с риском сепсиса, тяжелого сепсиса и септического шока, с использованием данных из электронных медицинских карт (ЭМК). Подход машинного обучения может обучаться с помощью классификатора случайного леса с использованием данных ЭМК (таких как данные лабораторных исследований, экспрессия биомаркеров, жизненно важные показатели и демографические характеристики) пациентов. Машинное обучение представляет собой тип искусственного интеллекта, который дает компьютерам возможность изучать сложные структуры данных без явного программирования, в отличие от более простых систем, основанных на правилах. В более ранних исследованиях использовались данные электронных медицинских карт для инициирования предупреждений с целью выявления клинического ухудшения в целом. В одном варианте реализации данного изобретения обработка уровней проАДМ, проМНП и/или проПНП может быть включена в соответствующее программное обеспечение для сравнения с существующими наборами данных, например, уровни проАДМ, проМНП и/или проПНП могут также обрабатываться в программном обеспечении машинного обучения, чтобы помочь в диагностике или прогнозировании возникновения нежелательного явления или принятия решения о назначении или отказе от назначения дистанционного ведения пациентов.
Используемые в контексте данного документа термины «содержащий» и «включающий» или их грамматические варианты следует понимать как обозначающие указанные признаки, целые числа, стадии или компоненты, но не исключающие добавления одного или нескольких дополнительных признаков, целых чисел, стадий, компонентов или их групп. Этот термин включает термины «состоящий из» и «состоящий по существу из».
Таким образом, термины «содержащий»/«включающий»/«имеющий» означают возможность присутствия любого дополнительного компонента (или, аналогично, признаков, целых чисел, стадий и т.п.). Термин «состоящий из» означает отсутствие каких-либо дополнительных компонентов (или, аналогично, признаков, целых чисел, стадий и т.п.).
Термин «состоящий по существу из» или его грамматические варианты при использовании в данном документе следует понимать как определяющий указанные признаки, целые числа, стадии или компоненты, но не исключающий добавления одного или нескольких дополнительных признаков, целых чисел, стадий, компонентов или их групп, но только в том случае, если дополнительные признаки, целые числа, стадии, компоненты или их группы не изменяют существенным образом основные и новые характеристики заявляемых композиции, устройства или способа.
Таким образом, термин «состоящий по существу из» означает возможность присутствия конкретных дополнительных компонентов (или, аналогично, признаков, целых чисел, стадий и т.п.), а именно таких, которые не оказывают существенного влияния на основные характеристики композиции, устройства или способа. Другими словами, термин «состоящий по существу из» (который может использоваться в данной заявке взаимозаменяемо с термином «содержащий по существу»), допускает присутствие других компонентов в композиции, устройстве или способе в дополнение к обязательным компонентам (или, аналогично, признакам, целым числам, стадиям и т.п.), при условии, что наличие других компонентов не оказывает существенного влияния на основные характеристики устройства или способа.
Термин "способ" относится к приемам, средствам, методикам и процедурам выполнения данной задачи, включая, без ограничений, приемы, средства, методики и процедуры, известные или без труда разрабатываемые на основе известных приемов, средств, методик и процедур специалистами-практиками в области химии, биологии и биофизики.
ФИГУРЫ
Данное изобретение дополнительно описано со ссылкой на следующие фигуры. Фигуры иллюстрируют неограничивающие и потенциально предпочтительные варианты реализации, представленные с целью дополнительной иллюстрации изобретения.
Краткое описание графических материалов
ПРИМЕРЫ
Данное изобретение дополнительно описано со ссылкой на следующие неограничительные примеры. Примеры описывают неограничительные и практические варианты реализации, представленные для дополнительной иллюстрации изобретения.
Методы, используемые в примерах:
Дизайн исследования и участники
Настоящее исследование является частью рандомизированного контролируемого исследования «Телемедицинское интервенционное ведение при сердечной недостаточности II» (TIM-HF2), посвященного изучению влияния телемедицины на незапланированные госпитализации с сердечно-сосудистыми заболеваниями и смертность при сердечной недостаточности. Подробная информация о методе исследования и, частично, некоторые результаты были опубликованы в работах Koehler et al., 2018a и Koehler et al., 2018b, которые включены в данный документ посредством ссылок.
Исследование TIM-HF2 было проспективными рандомизированными контролируемыми параллельно-групповыми немаскированными (со скрытой рандомизацией) многоцентровыми испытаниями с прагматическими элементами, введенными для сбора данных (идентификатор ClinicalTrials.gov: NCT01878630). Испытания проводились в Германии, и пациенты были набраны в 200 университетских, местных и региональных больницах, у кардиологов и терапевтов общей практики (ВОП). Были включены в общей сложности 113 объектов, расположенных в 14 городских агломерациях с населением более 200000 человек и/или с медицинским университетом (т.е., в Берлине, Дрездене, Гамбурге, Штутгарте, Франкфурте-на-Майне, Лейпциге, Ганновере) и в 11 сельских районах Германии (а именно: Бранденбург, Бавария, Тюрингия, Саксония, Саксония-Анхальт, Гессен, Баден-Вюртемберг, Нижняя Саксония, Мекленбург-Передняя Померания, Северный Рейн-Вестфалия, Саар). Сорок три объекта были больницами, 10 - университетскими больницами и 60 - местными кардиологическими практиками. Кроме того, в исследовании принимали участие 87 врачей общей практики (ВОП), проводя скрининг и наблюдение за своими пациентами.
Пациенты соответствовали критериям включения, если они были госпитализированы по поводу обострения сердечной недостаточности на протяжении 12 месяцев до рандомизации, относились к функциональному классу II или III Нью-Йоркской кардиологической ассоциации, имели фракцию выброса левого желудочка 45% или ниже (или, при значении выше 45%, лечились пероральными диуретиками). Пациенты исключались, если у них была глубокая депрессия (например, оценка >9 по PHQ-9), они находились на гемодиализе или были госпитализированы по любой причине на протяжении 7 дней перед рандомизацией. Кроме того, исключались пациенты с левожелудочковым аппаратом вспомогательного кровообращения или подвергавшиеся коронарной реваскуляризации или имплантации бивентрикулярного кардиостимулятора на протяжении 28 дней до рандомизации, а также имеющие назначения на коронарную реваскуляризацию, транскатетерную имплантацию аортального клапана, имплантацию зажима митрального клапана или имплантацию устройства сердечной ресинхронизирующей терапии в течение 3 месяцев после рандомизации. Критерии включения и исключения приведены в Таблице 1.
Исследования TIM-HF2 были разработаны, реализованы и контролировались независимым руководящим комитетом. Данный отчет был подготовлен и предоставлен для публикации руководящим комитетом. Независимый совет по мониторингу безопасности данных постоянно контролировал данные по безопасности. Комитет по клиническим конечным точкам, замаскированный под комитет по распределению в исследуемые группы, выносил заключения по всем случаям смерти и госпитализации с использованием критериев, проспективно определенных в уставе комитета по клиническим конечным точкам. Подтвержденные данные использовались для оценки результатов, касающихся госпитализаций и смертей. Исследования соответствовали требованиям к надлежащей клинической практике в соответствии с Хельсинкской декларацией и законами и нормативными актами, действующими в Германии. Было получено письменное одобрение соответствующих комитетов по этике.
Пациенты предоставляли письменное информированное согласие, дающее разрешение телемедицинскому центру обращаться к их страховым компаниям для перекрестной сверки госпитализаций, о которых сообщали исследователи, с данными, внесенными в записи медицинского страхования. Этот процесс был одобрен Федеральным управлением социального страхования Германии и проводился для пациентов обеих исследуемых групп.
Рандомизация и маскирование
Потенциально подходящие пациенты были проверены на соответствие критериям, а те, кто согласились участвовать и предоставили письменное информированное согласие, затем подвергались скринингу и проведению базовых измерений и оценок. Подходящие и желающие участвовать пациенты были распределены случайным образом (1:1) с использованием защищенной веб-системы на дистанционное ведение пациентов плюс стандартное лечение (группа дистанционного ведения пациентов) или на одно лишь стандартное лечение (группа стандартного лечения). Чтобы обеспечить баланс важных клинических ковариат между двумя исследуемыми группами, мы использовали алгоритм минимизации Покока с 10% остаточной случайности. Рандомизация была скрыта, но ни участники, ни исследователи не были замаскированы для распределения по группам в этом открытом исследовании.
Процедуры и дистанционное ведение пациентов
Дистанционное ведение пациентов включало следующее: ежедневная передача данных о массе тела, систолическом и диастолическом артериальном давлении, частоте сердечных сокращений, анализе сердечного ритма, сатурации периферических капилляров кислородом (SpO2) и самооценке состояния здоровья (диапазон шкалы от одного до пяти) в телемедицинский центр; определение категории риска пациента с использованием данных биомаркеров исходного и последующих визитов в сочетании с ежедневно передаваемыми данными; обучение пациентов; и сотрудничество между телемедицинским центром и терапевтом (ВОП) и кардиологом пациента.
Домашняя система дистанционного мониторинга
Система дистанционного мониторинга, которая устанавливалась в доме пациента в течение 7 дней после рандомизации, представляла собой многокомпонентную систему:
Используемая система основана на Bluetooth-системе с цифровым планшетом (Physio-Gate® PG 1000, GETEMED Medizin- und Informationstechnik AG) в качестве центрального структурного элемента для передачи измеряемых жизненных показателей из дома пациента в ТМЦ в университетской клинике Шарите в Берлине ( Berlin). В состав системы входят четыре измерительных устройства: 3-канальное устройство ЭКГ для проведения 2-минутного или потокового измерения ЭКГ (PhysioMem® PM 1000, GETEMED Medizin- und Informationstechnik AG), устройство для измерения сатурации периферических капилляров кислородом (SpO2; Masimo Signal Extraction Technology (SET®), система для измерения артериального давления (UA767PBT, A&D Ltd.) и весы для измерения веса тела (Seca 861, seca GmbH & Co KG). Каждое устройство оснащено чипом Bluetooth и подключено к цифровому планшету. Используется программное обеспечение ТМЦ «Fontane» (eHealth Connect 2.0, T-Systems International GmbH), специально разработанное для применения в исследовании TIM-HF2. Ключевым нововведением Fontane является новое самоадаптирующееся промежуточное ПО ТМЦ, состоящее из трех ключевых компонентов:
Berlin). В состав системы входят четыре измерительных устройства: 3-канальное устройство ЭКГ для проведения 2-минутного или потокового измерения ЭКГ (PhysioMem® PM 1000, GETEMED Medizin- und Informationstechnik AG), устройство для измерения сатурации периферических капилляров кислородом (SpO2; Masimo Signal Extraction Technology (SET®), система для измерения артериального давления (UA767PBT, A&D Ltd.) и весы для измерения веса тела (Seca 861, seca GmbH & Co KG). Каждое устройство оснащено чипом Bluetooth и подключено к цифровому планшету. Используется программное обеспечение ТМЦ «Fontane» (eHealth Connect 2.0, T-Systems International GmbH), специально разработанное для применения в исследовании TIM-HF2. Ключевым нововведением Fontane является новое самоадаптирующееся промежуточное ПО ТМЦ, состоящее из трех ключевых компонентов:
• Алгоритм для передаваемых данных пациента для определения критических значений или отсутствующих данных, который позволяет немедленно идентифицировать пациентов, нуждающихся в немедленном (медицинском) внимании,
• Телекоммуникационное программное обеспечение для прямой связи между персоналом ТМЦ, пациентами, врачами общей практики (ВОП) и местными кардиологами, а также
• Электронные медицинские карты для всей необходимой медицинской информации (например, план приема лекарств; отчеты о предыдущей госпитализации; лабораторные данные).
Пациентам также предоставляли мобильный телефон для прямого обращения в телемедицинский центр в экстренных ситуациях. Мобильный телефон (DORO Easy 510/Doro HandlePlus 334gsm, Doro AB), позволял напрямую позвонить в ТМЦ в случае возникновения чрезвычайной ситуации. В таких ситуациях также можно было запустить потоковую ЭКГ в реальном времени с помощью устройства ЭКГ. Планшет использует сеть мобильной связи для автоматической передачи данных пациента в зашифрованном виде (GSM-шифрование через VPN-туннель) на центральный сервер ТМЦ в Берлине, предоставленный партнером проекта Deutsche Telekom AG. Объединение измерений и персональных данных с различными информационными кодами осуществляется только на сервере университетской клиники Шарите в Берлине. Для обеспечения безопасности пациентов априори требуется, чтобы среднее время передачи данных в ТМЦ составляло <90 с. Наличие подключения к сети мобильной связи обеспечивает провайдер Deutsche Telekom AG. Полный процесс сбора, передачи и обработки данных осуществляется в строгом соответствии с современными стандартами конфиденциальности и техническими стандартами, по согласованию с и после заверки соответствующим специалистом по защите данных. Для аутентификации отдельных измерений все передачи данных включали уникальную идентификационную информацию устройства. Заключали соглашение об уровнях обслуживания с техническим провайдером на поддержку первого и второго уровня и соответствующие принципы обслуживания и эскалации.
Удаленное ведение пациентов
В процессе установки системы дистанционного мониторинга сертифицированные медсестры обеспечивали обучение пациентов навыкам работы с системой и инициировали программу обучения пациентов с сердечной недостаточностью; последняя продолжалась ежемесячно путем структурированных телефонных интервью с пациентом. Ежемесячные телефонные интервью были неотъемлемой частью вмешательства в дистанционное ведение пациентов. В сочетании с ежедневной передачей данных в телемедицинский центр, оценивался клинический и симптоматический статус пациента и сопутствующие лекарства, а также соблюдение режима дистанционного ведения пациента и другие социальные и технические вопросы, которые обсуждались пациентом и медсестрой телемедицинского центра. С помощью беспроводной системы с цифровым планшетом, данные пациента передавались из дома в центр. Это делалось посредством мобильной телефонной сети (защищенной с помощью туннеля виртуальной частной сети), и передача данных пациента проводилась ежедневно в установленное время.
Телемедицинский центр обеспечивал медицинскую поддержку под руководством врача и круглосуточное ведение пациентов, без выходных, на протяжении всего периода исследования с помощью системы Fontane, программного обеспечения телемедицинского анализа, имеющей маркировку CE (T-Systems International GmbH, Франкфурт, Германия). В этой системе были запрограммированы и реализованы алгоритмы, управляющие ведением пациентов и позволяющие врачам телемедицинского центра действовать незамедлительно (например, менять сопутствующие лекарства, инициировать амбулаторную оценку домашним врачом или госпитализировать пациента) и приоритезировать пациентов из группы высокого риска.
Пациенты были классифицированы на группы низкого и высокого риска с использованием комбинации значений среднерегионарного про-адреномедуллина (СР-проАДМ) и передаваемых пациентом данных.
Во время исходного визита и при каждом последующем визите брали биомаркеры и анализировали в независимой лаборатории. Результаты направлялись в CTC (сертифицированный тестовый (испытательный) центр) и ТМЦ. В зависимости от определенных отсекающих значений среднерегионарного проадреномедуллина (СР-проАДМ), пациентов классифицировали на группы риска следующим образом: пациенты с низким риском (СР-проАДМ ≤1,2 нмоль/л) и пациенты с высоким риском (СР-проАДМ >1,2 нмоль/л). За пациентами с высоким риском наблюдали в основном врачи ТМЦ («наблюдение врача»), а за пациентами из группы низкого риска - дипломированные медсестры ТМЦ («сестринский уход»). Переоценку категории риска проводили каждые 3 месяца с использованием результатов СР-проАДМ, полученных при каждом последующем визите.
Приоритезация передаваемых данных осуществлялась в соответствии с указанными ниже критериями, причем врачи и медсестры определяли приоритеты рабочей нагрузки и рабочего процесса таким образом, чтобы ведение пациентов, соответствующих любым из указанных значений пределов отсечения данных, проводилось с приоритетом:
Брадикардия, частота сердечных сокращений < 50 уд/мин
Тахикардия, ЧСС > 100 уд/мин
Вентрикулярная тахикардия
Вновь возникшая фибрилляция предсердий
Интервал PQ > 200 мс
Продолжительность QRS ≥120 мс
Интервал QTc > 460 мс
SpO2<94%
Масса тела (прибавка в весе >1 кг за 1 день, >2 кг за 3 дня; >2,5 кг за 8 дней)
Артериальное давление - систолическое: <90 или >140 мм рт. ст., диастолическое <40 или >90 мм рт. ст.
Самооценка состояния здоровья (оценки от 1-очень хорошее до 5-очень плохое): ухудшение примерно на 2 балла, начиная с 1, или 4 или 5 баллов)
Система Fontane также обеспечивала прямую связь между персоналом телемедицинского центра и пациентом, терапевтом пациента и местными кардиологами, которые все принимали участие в ведении пациента. С помощью системы Fontane в телемедицинском центре создавался электронный файл пациента, относящийся к данному исследованию, который был доступен как персоналу телемедицинского центра, так и лечащему врачу.
Пациенты в обеих исследуемых группах наблюдались в течение по меньшей мере 365 дней и до 393 дней после рандомизации. Все пациенты были осмотрены лечащим кардиологом во время скринингового и исходного визита, а также во время последнего предусматриваемого исследованием визита; последний проводился в день 365 (с 28-дневным временным окном) после рандомизации. В промежутке, визиты пациентов были запланированы через 3, 6 и 9 месяцев, и их проводили терапевт пациента или местный кардиолог. При всех посещениях данные собирались в индивидуальной регистрационной форме, которая включала показатели жизненно важных функций и массу тела, и пациентов спрашивали о случаях госпитализаций с момента последнего контакта в рамках исследования. Схема исследования показана на Фиг. 1. Оценки, выполняемые при каждом визите, представлены в Таблице 2.
Во избежание предвзятости при сборе контактной информации и данных, учитывая ежедневный контакт с пациентами в группе дистанционного ведения пациентов, была внедрена система контроля качества, чтобы гарантировать точную и полную отчетность о госпитализациях как в группе дистанционного ведения пациентов плюс стандартное лечения, так и в группе стандартного лечения. Этот процесс требовал сотрудничества пациентов, исследователей и соответствующих медицинских страховых компаний пациентов. Достоверность данных о госпитализации подтверждалась с использованием данных страховых медицинских компаний, и проводили перекрестную проверку данных о госпитализациях, о которых сообщали исследователи.
Таким образом, вмешательство при ДВП состояло, в частности, из следующих элементов:
Ежедневная передача данных о весе тела, артериальном давлении (систолическом/диастолическом), частоте сердечных сокращений, анализе сердечного ритма, полученном на основе 2-минутной 3-канальной электрокардиограммы (ЭКГ), сатурации кислородом периферических капилляров (SpO2) и самооценке состояния здоровья (диапазон шкалы 1-5)
Определение категории риска для пациента с использованием значениий биомаркера исходного и последующих визитов
Обучение пациентов и сотрудничество между телемедицинским центром (ТМЦ), врачем общей практики и кардиологом («сценарий телемедицины от доктора к доктору») в отношении ведения пациентов.
Пациенты, рандомизированные в группу СЛ, наблюдались в соответствии с действующими стандартами (т.е. рекомендациями Европейского общества кардиологов (ESC) по ведению сердечной недостаточности) на усмотрение лечащих врачей (Ponikowski et al., 2016).
Кроме того, для пациентов, отнесенных к группе ДВП, ежедневно проводили структурированный обзор принимаемых ими сопутствующих лекарств на основе переданных данных. По согласованию с врачами исследовательского центра врачи ТМЦ оптимизируют сопутствующее лечение, при необходимости, для достижения следующих целей:
Частота сердечных сокращений <75 уд/мин для пациентов с синусовым ритмом.
Контроль артериального давления: систолическое <140 мм рт. ст. и диастолическое <90 мм рт. ст.
Пациенты с вновь возникшей фибрилляцией предсердий: использование антикоагулянтной терапии в качестве долгосрочного лечения и антиаритмической терапии.
Пациенты с классами II-IV по NYHA: по возможности рекомендовать использование антагонистов минералокортикоидных рецепторов. Это делается с целью обеспечения назначения пациентам максимально переносимых доз для достижения этих целей и, кроме того, дозы диуретиков адаптируют в случае увеличения веса и ухудшения симптомов.
Команда телемедицинских специалистов информирует терапевта или лечащего врача пациента по телефону, факсу или электронной почте о любых новых событиях или важных клинических данных, полученных в ходе ежемесячного телефонного разговора, контактов с врачом неотложной помощи, или о любом вмешательстве в терапию пациентов по результатам телемедицинских измерений жизненно важных параметров. ТМЦ, предпочтительно, только консультирует основного врача пациента - именно последний несет полную ответственность за организацию лечения пациентов.
Результаты исследования
Первичным результатом был процент дней, потерянных из-за незапланированной госпитализации с сердечно-сосудистыми заболеваниями или смерти по любой причине, при сравнении дистанционного ведения пациентов плюс стандартное лечение с одним лишь стандартным лечением на протяжении периода наблюдения за отдельными пациентами. Основными вторичными исходами были смертность от всех причин и смертность от сердечно-сосудистых заболеваний в течение периода наблюдения отдельного пациента плюс 28 дней после последнего предусмотренного исследованиями визита, но не более 393 дней; процент дней, потерянных из-за незапланированных госпитализаций с сердечно-сосудистыми заболеваниями, и процент дней, потерянных из-за незапланированных госпитализаций с сердечной недостаточностью; изменение глобального балла по опроснику «Жизнь с сердечной недостаточностью в Миннесоте» (MLHFQ); и изменение N-концевого фрагмента прогормона мозгового натрийуретического пептида (NT-проМНП) и СР-проАДМ в период между рандомизацией и последним визитом исследования.
Основные вторичные результаты при сравнении ДВП со стандартным лечением включали:
а) Смертность от всех причин в течение периода наблюдения за отдельным пациентом (+28 дней после последнего визита до максимум 393 дней)
б) Смертность от сердечно-сосудистых заболеваний в течение периода наблюдения за отдельным пациентом (+28 дней после последнего визита до максимум 393 дней)
в) Процент дней, потерянных из-за незапланированных госпитализаций по поводу сердечно-сосудистых заболеваний в течение периода наблюдения за отдельным пациентом
г) Процент дней, потерянных из-за незапланированных госпитализаций с сердечной недостаточностью в течение периода наблюдения за отдельным пациентом
д) Изменение глобального балла по опроснику MLHFQ за период от исходной даты до 365 дней
е) Изменение уровней NT-проМНП и СР-проАДМ за период от исходной даты до 365 дней
Был проведен анализ следующих повторяющихся событий:
а) Незапланированные госпитализации по поводу сердечно-сосудистых заболеваний и смертность от сердечно-сосудистых заболеваний.
б) Незапланированные госпитализации по поводу сердечно-сосудистых заболеваний и смертность от всех причин.
в) Незапланированные госпитализации с сердечной недостаточностью и смертность от сердечно-сосудистых заболеваний.
г) Незапланированные госпитализации с сердечной недостаточностью и смертность от всех причин.
Проводят анализ подгрупп по первичному результату для оценки согласованности эффектов вмешательства в следующих подгруппах:
Сравнение медицинского обслуживания в городской и сельской местности.
Сравнение мужчин против женщин.
Выше/ниже среднего возраста.
ФВЛЖ ≤45% по сравнению с ФВЛЖ >45%.
Функциональные классы I/II по NYHA по сравнению с классами III/IV.
Сердечная ресинхронизирующая терапия (СРТ) на момент включения в исследование да/нет.
Имплантируемый кардиовертер-дефибриллятор (ИКД) на момент включения в исследование да/нет.
СР-проАДМ на момент включения в исследование ≤1,2 нмоль/л по сравнению с >1,2 нмоль/л.
Статистический анализ
Для расчета размера выборки использовались данные для конкретных подгрупп исследования TIM-HF. Для подгруппы пациентов, отображающей популяцию, которую предполагалось включить в исследование TIM-HF2, было потеряно 19 дней из-за смерти от всех причин или незапланированных госпитализаций по поводу сердечно-сосудистых заболеваний за 12 месяцев в группе стандартного лечения, и 12 дней было потеряно для пациентов в группе дистанционного ведения пациентов, что соответствует снижению на 38%. Было подсчитано, что при оценке совокупного стандартного отклонения, равной 48, в каждой группе должно быть 750 пациентов, чтобы выявить эту разницу с мощностью 80% и двусторонним уровнем значимости (α) 5%.
Для анализа использовались R (версия 3.4.4) и Stata (версия 14.2). Первичный и вторичный анализы эффективности были выполнены на полном наборе анализов в соответствии с принципом назначенного лечения. Полное анализируемое множество состояло из всех рандомизированных пациентов, которые дали согласие и начали назначенное им лечение.
Исходные характеристики были суммированы как количество пациентов (%) для категориальных переменных и как среднее значение (СКО) для непрерывных переменных; для всех исходных лабораторных тестов использовались медиана и интерквартильный размах (ИКР).
Для первичного анализа процента дней, потерянных из-за смерти от всех причин или незапланированной госпитализации с сердечно-сосудистыми заболеваниями, доля периода наблюдения, потерянная из-за смерти или незапланированной госпитализации с сердечно-сосудистыми заболеваниями, определялась как количество потерянных дней, деленное на предполагаемый период наблюдения. Для умерших пациентов подсчитывали количество дней, потерянных от даты смерти до даты предполагаемого периода наблюдения плюс количество дней, проведенных в больнице по сердечно-сосудистым причинам. Для пациентов, которые завершили исследование в соответствии с планом или досрочно вышли из исследования, доля времени наблюдения определялась как количество потерянных дней (из-за госпитализации по поводу сердечно-сосудистых заболеваний), деленное на период проведенных наблюдений (т.е. до даты цензурирования). Для первичного результата использовался тест на перестановку для сравнения средневзвешенных значений процента потерянных дней между двумя группами. Значение p двустороннего критерия перестановки вычисляли как долю перестановок, имеющих абсолютное значение тестовой статистики по крайней мере не меньше наблюдаемой тестовой статистики при применении средней p-поправки в случае равенства. Для этого анализа использовалось 2000 случайно выбранных перестановок.
Доверительные интервалы (ДИ) рассчитывались с использованием метода, описанного Гартуэйтом (Garthwaite PH. Confidence intervals from randomization tests. Biometrics 1996; 52: 1387-93), который основан на методе Роббинса-Монро. Вкратце, этот метод выполняет отдельный поиск каждой конечной точки ДИ путем последовательного обновления оценок, причем величина шагов определяется расстоянием между исходной тестовой статистикой и тестовой статистикой для подвергнутых перестановке данных, и порядковым номером шага. Период наблюдения был взвешен с использованием средневзвешенных арифметических значений, и представлены среднегодовые значения.
Вкратце, этот метод выполняет отдельный поиск для каждой конечной точки ДИ путем последовательного обновления оценок, причем величина шагов определяется расстоянием между исходной тестовой статистикой и тестовой статистикой для подвергнутых перестановке данных, и порядковым номером шага. Период наблюдения был взвешен с использованием средневзвешенных арифметических значений, и представлены среднегодовые значения.
Все анализы выживаемости проводились на основе времени до первого события. Кривые кумулятивной инцидентности для смертности от всех причин были построены по методу Каплана-Мейера и различия между кривыми анализировали с помощью лог-ранговой статистики. Для смертности от сердечно-сосудистых заболеваний использовался анализ конкурирующих рисков, чтобы принять во внимание, что представляющее интерес событие не могло произойти из-за другого предшествующего смертельного события. Модели регрессии пропорциональных рисков Кокса использовались для оценки (зависящих от причины) отношений рисков (ОР). Частота событий выражается как количество событий на 100 пациенто-лет наблюдения с учетом цензурирования данных наблюдения.
При анализах чувствительности летальных исходов проверялась надежность результатов с использованием полного анализируемого множества всех пациентов, цензурированных в день 393 после рандомизации, как определено в плане статистического анализа. Мы проанализировали данные о количестве госпитализаций с помощью отрицательных биномиальных моделей. Для непрерывных переменных, таких как глобальная оценка MLHFQ, изменения средних групповых значений для обеих исследуемых групп через 12 месяцев сравнивались с помощью моделей ковариационного анализа (ANCOVA) с поправкой на исходное значение. Результаты теста на биомаркеры были проанализированы с использованием моделей логарифмической шкалы и ANCOVA.
Соблюдение условия ежедневной передачи данных в телемедицинский центр определялось как количество дней между днем проведения первой передачи данных в телемедицинский центр и окончанием наблюдения за индивидуальным пациентом, минус любые дни, когда пациент был госпитализирован по любой причине. Был проведен статистический тест на взаимодействие, чтобы оценить, было ли влияние дистанционного ведения пациентов на первичный результат согласованным по заранее определенным подгруппам. Тесты взаимодействия для анализа подгрупп выполняли путем добавления члена, характеризующего взаимодействие, в соответствующие модели.
Пример 1: Преимущества дистанционного ведения для пациентов, страдающих сердечной недостаточностью
В период с 13 августа 2013 г. по 12 мая 2017 г. 1571 пациент был распределен случайным образом (796 на дистанционное ведение пациентов плюс стандартное лечение и 775 на только стандартное лечение, из которых 765 в группе дистанционного ведения пациентов и 773 в группе стандартного лечения были включены в полное анализируемое множество; Фиг. 2). Исходные клинические и лабораторные характеристики и применение сердечно-сосудистых препаратов были схожими для двух групп (см. Таблицу 3).
Средний возраст для всех пациентов составлял 70 лет (СКО 10), 70% были мужчинами.
Среди пациентов, случайным образом распределенных на дистанционное ведение пациентов, 743 (97%) не менее чем на 70% выполняли условие ежедневной передачи данных в телемедицинский центр. Кроме того, со всеми пациентами связались в течение 24 часов после пропуска передачи данных. Статус выживаемости был известен для всех пациентов до максимального периода наблюдения для каждого пациента (т.е. до дня 393 после рандомизации).
265 (35%) из 765 пациентов в группе дистанционного ведения пациентов и 290 (38%) из 773 пациентов в группе стандартного лечения были госпитализированы по незапланированной сердечно-сосудистой причине или умерли. Процент дней, потерянных из-за незапланированной госпитализации с сердечно-сосудистыми заболеваниями или смерти от всех причин, был статистически сниженным у пациентов, которым было назначено дистанционное ведение пациентов (4,88%, 95% ДИ 4,55-5,23) по сравнению со стандартным лечением (6,64%, 95% ДИ 6,19-7,13; соотношение 0,80, 95% ДИ 0,65-1,00; р=0,0460; Таблица 2). Пациенты, назначенные на дистанционное ведение, потеряли по средневзвешенной оценке 17,8 дней в году по сравнению с 24,2 днями в году для пациентов, назначенных на стандартное лечение, для данного исхода.
Уровень смертности от всех причин составил 7,9 на 100 человеко-лет наблюдения в группе дистанционного ведения пациентов и 11,3 на 100 человеко-лет наблюдения в группе стандартного лечения (ОР 0,70, 95% ДИ 0,50-0,96; р=0,0280; Таблица 4; Фиг. 3). Различия между группами дистанционного ведения пациентов и стандартного лечения в отношении смерти от сердечно-сосудистой причины не были статистически значимыми (ОР 0,67, 95% ДИ 0,45-1,01; p=0,0560).
Пациенты, назначенные на дистанционное ведение, теряли меньше дней, чем группа стандартного лечения, вследствие незапланированной госпитализации из-за обострения сердечной недостаточности (в среднем 3,8 дней в году [95% ДИ 3,5-4,1] против 5,6 дней в году [5,2-6,0], соответственно). Процент дней, потерянных при этом исходе для групп дистанционного ведения пациентов и стандартного лечения, составил 1,04% (95% ДИ 0,96-1,11) и 1,53% (1,43-1,64), соответственно (отношение 0,80, 95% ДИ 0,67-0,95; p=0,0070). При сравнении дистанционного ведения пациентов с группой стандартного лечения, аналогичные результаты были получены в анализе чувствительности, проведенном для смертности от всех причин (отношение 0,74, 95% ДИ 0,54-1,02; p=0,0633).
Процент дней, потерянных из-за незапланированной госпитализации с сердечно-сосудистыми заболеваниями, составил 1,71% (95% ДИ 1,59-1,83) для группы дистанционного ведения пациентов и 2,29% (2,13-2,45) для группы стандартного лечения (отношение 0,89, 95% ДИ 0,74-1,07; р=0,208).
Отклонение от исходного уровня глобальной оценки по опроснику «Жизнь с сердечной недостаточностью в Миннесоте» (MLHFQ) через 12 месяцев статистически не различалось между группами дистанционного ведения пациентов и стандартного лечения (Таблица 5).
На Фиг. 3 показаны результаты анализов подгруппы для первичного результата. Мы не отметили никакого влияния предварительно определенных подгрупп на разницу между группами лечения по первичному результату.
2251 внеплановых госпитализаций были зарегистрированы и классифицированы комитетом по клиническим конечным точкам (приложение, стр. 4). Из этих госпитализаций 262 (14 в группе дистанционного ведения пациентов) и 248 в группе стандартного лечения) были выявлены в ходе процедуры перекрестной сверки с записями медицинского страхования. В телемедицинский центр было передано 1026078 основных показателей жизнедеятельности (в среднем 1421 на пациента [диапазон значений 6-3962]); в Таблице 6 представлена сводная информация о переданных данных и предпринятых действиях.
Пример 2: Прогностическая способность определения биомаркера для назначения или отказа от назначения дистанционного ведения пациентов
В отношении исследуемой популяции и данных, собранных в ходе исследования TIM-HF II, как описано выше и в работах Koehler et al., 2018a и Koehler et al., 2018b, был проведен дальнейший анализ для оценки прогностической способности биомаркеров проАДМ, проМНП и/или проПНП прогнозировать пользу назначения или отказа от назначения дистанционного ведения пациентов.
Методы анализа биомаркеров
Как подробно описано выше, в исследовании TIM-HF II в общей сложности 1538 пациентов (средний возраст: 73, ИКР: 64-78; 70% мужчины) были случайным образом распределены либо на ДВП (N=765), либо на СЛ (N=773). Термины SOC (стандартное лечение, СЛ) и группа обычного лечения (UC) используются в данном документе взаимозаменяемо. Пациенты совершали визиты в рамках исследования через каждые 90 дней на протяжении одного года наблюдения. Для анализа биомаркеров кровь брали в исходный момент времени и при каждом посещении.
NT-проМНП, MR-ПНП и СР-проАДМ оценивались в отношении (i) их связи с первичной конечной точкой исходного исследования - % потерянных дней из-за незапланированной госпитализации с сердечно-сосудистыми заболеваниями или смерти от всех причин, (ii) их связь с заранее определенной конечной точкой смерти от всех причин или повторной госпитализации по поводу сердечной недостаточности считается решающим фактором при выборе пациентов для ДВП, и (iii) их прогностическая эффективность при использовании в комбинации для идентификации пациентов, которых можно безопасно исключить из ДВП на следующие 90 дней (отсутствие смерти от всех причин или повторной госпитализации по поводу сердечной недостаточности).
Для последнего пункта, мы получили статистическую мощность путем объединения всех многократных наблюдений биомаркеров и последующего 90-дневного наблюдения за всеми пациентами на СЛ (как и ожидалось, не наблюдалось никаких тенденций, связанных с повторными измерениями). С учетом почечной недостаточности и ее связи с уровнями биомаркеров с помощью стратификации по расчетной скорости клубочковой фильтрации (рСКФ) (формула CKD-EPI) или СКФ по Кокрофту-Голту, мы рассчитали отсекающие значения биомаркеров для безопасного исключения (чувствительность 100%, 99%, 95%) и их гипотетическую эффективность по снижению усилий, затрачиваемых на ДВП (% исключенных пациентов из ДВП), а также с точки зрения эффективности ДВП для включенных пациентов (снижение риска события, число больных в экспериментальной группе, необходимое для получения дополнительного благоприятного исхода (ЧБНЛБИ)). Благодаря уникальному доступному набору данных для пациентов на ДВП алгоритм исключения может быть дополнительно оценен с использованием подробных данных о чрезвычайных ситуациях, телефонных звонках и лекарствах.
Результаты анализа биомаркеров СР-проАДМ, проМНП или проПНП в течение 90 дней от исходного момента времени
Для конечной точки «Смерть от всех причин или незапланированная сердечно-сосудистая госпитализация из-за острой декомпенсации в течение 90 дней от исходного момента времени», в качестве ориентира был проведен ROC-анализ и анализ пороговых значений эффективности биомаркеров у пациентов на СЛ.
На Фиг. 5-7 показаны кривые ROC для смерти или острой декомпенсации в течение 90 дней после исходных измерений (пациенты на стандартном лечении). Площадь под кривой (ППК) для СР-проАДМ составляет 0,755, для NT-проМНП - 0,736, и для СР-проПНП - 0,69. Таким образом, все биомаркеры демонстрируют высокий прогностический потенциал, который можно использовать для терапевтического руководства, мониторинга или стратификации дистанционного ведения пациентов, как описано в данном документе.
Пациенты с более высокими уровнями NT-проМНП или СР-проАДМ при исходном визите TIM-HF2 имели более высокий уровень потерянных дней и большую вероятность развития нежелательных явлений на протяжении года испытаний. Это указывает на их потенциал при назначении ДВП.
В Таблицах 7-9 приведены результаты анализа отсекающих значений для биомаркеров проАДМ, проМНП и проПНП. В частности, предпочтительные отсекающие значения для установления уровней низкой пользы и высокой пользы при назначении или отказе от назначения относятся к порогам, для которых достигается чувствительность 100% или 95%.
Как показано в Таблице 7 для СР-проАДМ, отсекающее значение 0,75 нмоль/л соответствует чувствительности 100%, а 0,86 нмоль/л - чувствительности 95%.
Как показано в Таблице 8 для NT-проМНП, пороговое значение 237,6 пг/мл соответствует чувствительности 100%, а 609,4 пг/мл - чувствительности 95%.
Как показано в Таблице 9 для СР-проПНП, пороговое значение 106,9 пмоль/л соответствует чувствительности 100%, а 158,5 пмоль/л - чувствительности 95%.
Результаты анализа биомаркеров в сочетании с определением СКФ в течение 90 дней от исходного момента времени
В частности, хорошие результаты были достигнуты при использовании NT-проМНП и СР-проАДМ в сочетании с определением параметра, характеризующего функцию почек, такого как СКФ.
Алгоритм на основе NT-проМНП и СР-проАДМ, стратифицированный по рСКФ<60 и рСКФ>=60, может идентифицировать значительную часть бессобытийных в течение 90 дней пациентов уже на СЛ, в то же время, с другой стороны, выявляя критических пациентов на СЛ с событием с идеальной или почти идеальной чувствительностью. При 100% (99%, 95%) чувствительности, 9% (15%, 25%) пациентов на СЛ гипотетически могут быть исключены из ДВП. Для сравнения, при 100% чувствительности использование NT-проМНП отдельно или в комбинации с рСКФ позволило бы безопасно исключить только 0,8% или 2,7% пациентов, соответственно.
Для алгоритма исключения со 100% чувствительностью риск возникновения события в течение 90 дней для пациентов на СЛ составлял 11% для пациентов, гипотетически отнесенных к ДВП, и 0% для пациентов, оставленных на СЛ. Путем сравнения таких субпопуляций между исследуемыми группами (опять же, объединяя все наблюдения для биомаркеров и последующие 90-дневные наблюдения; не наблюдалось каких-либо тенденций для биомаркеров при повторных измерениях) было показано, что ДВП может значимо снизить риск возникновения события среди гипотетически включенных пациентов с 11% до 8%. Кроме того, ЧБНЛБИ было снижено с 42 (все пациенты) до 34 (гипотетически включенные пациенты). Наконец, действительные пациенты на ДВП, которые были бы исключены из ДВП с помощью представленного алгоритма, имели значительную меньшую вероятность возникновения неотложных состояний, реже меняли лекарства и меньше общались с врачами ДВП, чем те, которые были бы включены. Это также позволило предположить, что идентифицированные пациенты с низким риском меньше нуждались в ДВП, чем идентифицированные пациенты с высоким риском, на основе характеристики по биомаркерам.
В Таблице 10 сведены результаты и положительное влияние на стратификацию для пороговых значений биомаркеров по СКФ на основе CKD-EPI.
В Таблицах 11 и 13 сведены результаты и положительное влияние на стратификацию для пороговых значений биомаркеров по СКФ по Кокрофту-Голту.
Особенно хорошие результаты достигаются при использовании комбинации проАДМ, проМНП и СКФ. Как видно из столбцов 6 и 9 обеих таблиц, в таком случае в два или три раза больше пациентов может быть безопасно исключено из дистанционного ведения по сравнению с использованием только проМНП и СКФ без проАДМ для назначения или отказа от назначения дистанционного ведения пациента.
Результаты анализа биомаркеров в течение одного года от исходного момента времени
Кроме того, была оценена прогностическая сила биомаркеров в отношении нежелательных явлений в течение одного года после рандомизации и получения образцов. NT-проМНП и СР-проАДМ использовались в исходный момент времени. Первичной конечной точкой были потерянные дни из-за смерти по любой причине или госпитализации с сердечно-сосудистым заболеванием, вторичной конечной точкой была смерть в течение одного года после рандомизации.
Первичный анализ квинтилей двух биомаркеров в отношении прогноза первичной конечной точки показывает, что заболеваемость увеличивалась в группе СЛ с 1,4% потерянных дней (СР-проАДМ ≤ 0,75 нмоль/л; нижний квинтиль) до 17,6% в высшем квинтиле. В группе ДВП значения были аналогичными в низшем квинтиле (1,4%), и 12,1% - в высшем квинтиле (p=0,21 по сравнению с СЛ).
Эффект лечения (отношение % потерянных дней ДВП к СЛ) увеличился с 0,98 до 0,69 (p для взаимодействия 0,29). NT-проМНП имел аналогичную прогностическую силу с лечебным эффектом от 0,87 в нижнем до 0,63 в высшем квинтиле (p для взаимодействия 0,33). Результаты для вторичной конечной точки (смерть от всех причин) были аналогичными. Соответственно, наблюдалась тенденция к снижению % потерянных дней и риска смерти, а также меньшая польза от ДВП для пациентов с более низкими уровнями биомаркера
Основываясь на этом наблюдении, был исследован алгоритм отбора пациентов для ДВП на основе биомаркеров с целью снижения количества пациентов, рекомендуемых для ДВП.
После того, как биомаркеры были объединены для идентификации пациентов без событий (смерть от всех причин), которые поэтому не могли получить пользу от ДВП, 13,7% пациентов с СР-проАДМ <0,69 нмоль/л или NT-проМНП <125,1 нг/л могли быть исключены из группы СЛ. Если принять процент пропусков <2,5% или <5%, относительная доля исключенных пациентов возрастает до 16,9% или 25,3%, соответственно. Во всех трех сценариях отношение рисков для положительного эффекта лечения при ДВП оставалось значимым на уровне 0,71 (p <0,05) и взаимно совпадало с первичным исследованием (ОР=0,70).
Таким образом, используя отбор пациентов на основе биомаркеров, число больных в экспериментальной группе, необходимое для предотвращения одной смерти, может быть снижено с 28 до 26 (чувствительность 100%, ни одно событие не пропущено) и минимум до 23 (чувствительность 95,5%, СР-проАДМ <0,75 нмоль/л, NT-проМНП <383,3 нг/л).
В Таблице 12 сведены результаты, а на Фиг. 8 показана кривая Каплана-Мейера для когорты пациентов, модифицированной на основе биомаркеров (пациенты без событий исключены на основе пороговых значений биомаркеров, указанных выше для 100% чувствительности).
В заключение, использование СР-проАДМ и NT-проМНП по отдельности или в комбинации позволяет безопасно, более точно, эффективно и, следовательно, экономично распределять пациентов с сердечной недостаточностью для дистанционного ведения пациентов. Число больных в экспериментальной группе, необходимое, чтобы спасти одну жизнь с помощью ДВП, можно снизить с 28 в исходном исследовании до 23 при подходе с использованием биомаркеров.
Пример 3: Прогностическая способность комбинации проМНП и АДМ для назначения или отказа от назначения дистанционного ведения пациентов
В отношении исследуемой популяции и данных, собранных в ходе исследования TIM-HF II, как описано выше и у Koehler et al., 2018a и Koehler et al., 2018b был проведен дополнительный статистический анализ для определения особенно выгодных сценариев использования проАДМ и/или проМНП для прогнозирования выгоды от назначения или отказа от назначения дистанционного ведения пациентов.
Исходы и анализ биомаркеров
Вкратце, в качестве исходов, первичной конечной точкой исследования был «процент дней, потерянных из-за незапланированной госпитализации по поводу сердечно-сосудистого заболевания (ССЗ) или из-за смерти от всех причин в течение периода наблюдения индивидуума». Регулярный период индивидуального наблюдения охватывал 365 дней после рандомизации для всех пациентов плюс различное время до последнего визита в рамках исследования, который должен был состояться в течение 4 недель после дня 365. Вторичные конечные точки включают смертность от всех причин (a), смертность от сердечно-сосудистых заболеваний (b), % потерянных дней из-за незапланированных сердечно-сосудистых госпитализаций (c), и % потерянных дней из-за госпитализации с ухудшением сердечной недостаточности (d).
Для анализа биомаркеров использовали исходные уровни NT-проМНП и СР-проАДМ. Цельную кровь брали венепункцией во время визитов в рамках исследования. NT-проМНП измеряли с помощью хемилюминесцентного иммуноанализа NT-проМНП фирмы Roche (Roche Diagnostics GmbH, Мангейм, Германия) с диапазоном измерения от 5 до 35000 пг/мл и функциональной чувствительностью анализа 50 пг/мл (информация производителя, вкладыш в упаковке). СР-проАДМ измеряли с помощью иммунофлуоресцентного анализа на СР-проАДМ B⋅R⋅A⋅H⋅M⋅S MR-proADM KRYPTOR (B⋅R⋅A⋅H⋅M⋅S GmbH, Хеннигсдорф, Германия). Анализ СР-проАДМ имеет общий диапазон измерения от 0,05 до 100 нмоль/л с функциональной чувствительностью анализа 0,25 нмоль/л.
Статистика
Связь NT-проМНП и СР-проАДМ с конечными точками
Линейная регрессия рисков и пропорциональная регрессия риска по Коксу использовались для проверки связи процента потерянных дней из-за незапланированной госпитализации по поводу сердечно-сосудистых заболеваний и времени до смерти от всех причин, соответственно, с обоими биомаркерами. Для моделирования уровни биомаркеров были преобразованы в логарифмическую форму. Кроме того, % потерянных дней были преобразованы в логарифмическую форму после приписывания значения 0,1% для пациентов, имеющих 0,0% потерянных дней, по аналогии с предыдущими исследованиями. Модели, включающие оба биомаркера, сравнивали с моделями, включающими только NT-проМНП в качестве прогностической переменной, чтобы оценить значимость добавления СР-проАДМ (с помощью F-теста и теста отношения правдоподобия, соответственно).
Дополнительно, был рассчитан средний % потерянных дней из-за незапланированной госпитализации с сердечно-сосудистыми заболеваниями (с использованием средневзвешенного времени индивидуального наблюдения, по аналогии с предыдущими анализами исследования), а также уровень смертности от всех причин как для группы СЛ, так и для ДВП, для всех квинтилей обоих биомаркеров. Для каждого квинтиля рассчитывали значение p для эффекта ДВП по сравнению с СЛ на эти конечные точки с использованием тестов перестановки (% потерянных дней из-за незапланированной госпитализации с сердечно-сосудистыми заболеваниями) и пропорциональные регресси рисков по Коксу (смерть от всех причин). Также было рассчитано p-значение для взаимодействия квинтилей и ДВП, чтобы проверить убедительность доказательств того, что эффект ДВП различается по квинтилям биомаркеров.
Сценарии выбора для пациентов, рекомендуемых для ДВП
При определении критериев для подгруппы исходной популяции, которой может быть рекомендовано ДВП на основе дополнительной оценки биомаркеров, использовались только те пациенты, которые были отнесены к экспериментальной группе СЛ. Таким образом, они служили эталонной популяцией для вывода и оценки рекомендаций по биомаркерам. Причина этого заключается в том, что только для этой группы можно было предположить, что ДВП не предотвратило ни одной клинической конечной точки.
Для первичной конечной точки событие было определено как по меньшей мере 30 потерянных дней из 365 дней наблюдения, т.е. как показатель потерянных дней не менее 8,2%. В последующем описании этого примера этот сценарий будет называться «≥30 потерянных дней за год». При таком подходе включается подавляющее большинство умерших пациентов (82 из 89 в группе СЛ), но также и все пациенты, которые в течение одного года провели в больницах месяц или более из-за незапланированной госпитализации по поводу сердечно-сосудистых заболеваний. С помощью такой бинарной меры только те смерти, которые были относительно отдалены по времени от исходного измерения биомаркера (по меньшей мере, 11 месяцев для пациента, находившегося под наблюдением в течение одного года) были классифицированы как отсутствие события. Фиг. 12 дополнительно иллюстрирует это определение события. Вторичная конечная точка была заранее определена как смерть от всех причин.
Сценарии отбора на основе биомаркеров для пациентов, рекомендуемых для ДВП, были дополнительно оптимизированы для обеспечения высокой безопасности. Для обеих конечных точек были изучены разные сценарии с желаемой чувствительностью 100%, 98% и 95%, что означает, что определенные пороговые значения биомаркера не должны пропускать более 0%, 2% или 5% пациентов с событием за период наблюдения. Чтобы использовать информацию, содержащуюся в обоих биомаркерах, пациентам рекомендовали ДВП, если у них был по меньшей мере определенный уровень NT-проМНП и, одновременно, по меньшей мере определенный уровень СР-проАДМ.
Следует отметить, что теоретически для всех сценариев с чувствительностью <100% существует более одной возможной комбинации пороговых значений биомаркеров, которая реализует желаемую чувствительность. Анализ в соответствии с данным примером оставался ограниченным теми случаями, когда оба биомаркера сами по себе достигали одинаковой чувствительности. Это эквивалентно предположению о том, что оба биомаркера должны иметь одинаковые веса при их совместном использовании для отбора пациентов (вместо предположения, что один должен быть более пермиссивным при более высоких уровнях NT-проМНП, чем при уровнях СР-проАДМ, или наоборот). Фиг. 9 иллюстрирует, как оценивались рекомендации по биомаркерам при совместном использовании NT-проМНП и СР-проАДМ. Для сравнения был также рассчитан процент пациентов, которых можно было исключить из популяции рекомендуемых на ДВП при использовании только NT-проМНП.
Оценка сценариев эффективности ДВП
Основная цель рекомендаций по использованию биомаркеров при ДВП состоит в том, чтобы назначить вмешательство тем пациентам, которые получат от него наибольшую пользу, и предпочтительно исключить тех, которые такой пользы не получат. Следовательно, для всех шести сценариев (две конечные точки (% потерянных дней из-за незапланированной госпитализации с сердечно-сосудистыми заболеваниями; смерть от всех причин) и три желаемые чувствительности) было важно показать, как влияет на конечные точки TIM-HF2 и, следовательно, эффективность ДВП при сердечной недостаточности, ретроспективное сокращение исходной популяции до субпопуляции, рекомендуемой на ДВП на основе биомаркеров. Оценки эффекта и p-значения для субпопуляции, удовлетворяющей критериям рекомендации (т.е. для которой NT-проМНП и СР-проАДМ превышали соответствующие пороговые значения), в полном соответствии со всеми статистическими процедурами в исходной популяции исследования были рассчитаны в более ранней публикации (Koehler et al. 2018a).
Вкратце, для определения соотношений % потерянных дней между курсами лечения (первичная конечная точка и вторичные конечные точки c и d), среднее геометрическое значение % потерянных дней в группе ДВП делили на среднее геометрическое % потерянных дней в группе СЛ. Перед этим приписывали 0,1% потерянных дней пациентам с 0,0% потерянных дней. Соответствующие p-значения были рассчитаны с помощью тестов на перестановки с 2000 перестановками и разностью средних в качестве тестовой статистики. В анализах времени до события для смерти от всех причин (вторичная конечная точка a) и смерти от сердечно-сосудистых заболеваний (вторичная конечная точка b), использовали регрессии пропорциональных рисков по Коксу при оценке отношений рисков, доверительных интервалов и значений p. Следует отметить, что, при интерпретации результатов, возростающие изменения p-значений, по меньшей мере, до некоторой степени являются механическими, поскольку в сокращенных субпопуляциях статистические тесты имеют меньшую способность к выявлению эффектов на том же уровне значимости. Для последней конечной точки, смерти, не связанные с сердечно-сосудистыми заболеваниями, рассматривались как обычные события цензуры (окончание наблюдения). Кроме этого, были получены кривая Каплана-Мейера и лог-ранговый критеорий для конечной точки смерти от всех причин для одного из сценариев отбора пациентов.
Дополнительный анализ наиболее эффективного сценария: характеристики пациентов и вмешательства ДВП
Для наиболее эффективного из оцениваемых сценариев рекомендаций по двум биомаркерам (с наибольшим уменьшением популяции, рекомендуемой для ДВП), который имел 95% чувствительность в отношении ≥30 потерянных дней в год, сравнивали характеристики пациентов на исходном уровне между группой, рекомендуемой на ДВП, и группой, не рекомендуемой на ДВП. Кроме того, сравнивали характеристики пациентов на исходном уровне между группами СЛ и ДВП для пациентов, рекомендуемых для ДВП (т.е. для групп, которые были основой для расчетов конечных точек, описанных в предыдущем подразделе).
Доступность уникальных данных электронной истории болезни и перекрестно проверенных данных о чрезвычайных ситуациях для пациентов из исходной группы ДВП позволили провести дальнейшие сравнения. В ходе телемедицинского лечения ТМЦ применял различные вмешательства и регистрировал случаи возникновения чрезвычайных ситуаций для пациентов ДВП. Таким образом, эти данные ДВП позволяли сравнивать (i) частоту возникновения чрезвычайных ситуаций; (ii) среднее время, затрачиваемое врачами ТМЦ на оказание помощи тем пациентам, которые были бы рекомендованы на ДВП в этом ретроспективном сценарии, в соответствии с их первоначальным рандомизированным распределением на группы в исследовании, и теми, кому не было бы рекомендовано ДВП в этом сценарии, в отличие от их первоначального распределения на группы в исследовании. Для расчета затрат времени, все вмешательства ТМЦ, документированные в электронной карате пациента, были разделены на медицинские и немедицинские действия. Среднюю продолжительность каждого действия рассчитывали с помощью эмпирических значений и значений из электронной карты пациента. Экстренные ситуации и трудозатраты на оказание медицинской помощи визуализировали в соответствии с Allen et al. (2019).
Кроме того, суммируя время на медицинскую и немедицинскую помощь для всех пациентов, которым не было бы рекомендовано ДВП в ретроспективном сценарии, но которым ДВП было назначено в исходных испытаниях, можно было приблизительно оценить трудозатраты, которые можно было бы сэкономить, используя исследуемые рекомендации по биомаркерам.
Все статистические анализы проводились и документировались с помощью скриптов с использованием R версии 3.5.1 (R. Core Team 2018), представляющим собой язык и среду для обработки данных, статистических вычислений и графики. Модели пропорциональных рисков Кокса были рассчитаны с использованием пакета survival 2.42.3 (Terry et al., 2000).
Результаты использования комбинации проМНП и АДМ для назначения дистанционного ведения пациентов
Связь NT-проМНП и СР-проАДМ с конечными точками
Модели линейной регрессии и регрессии пропорциональных рисков Кокса показали, что как NT-проМНП, так и СР-проАДМ имели значимую связь с % потерянных дней из-за незапланированной госпитализации по поводу сердечно-сосудистых заболеваний и временем до смерти от всех причин (все p <0,001). При сравнении моделей, линейные модели рисков и модели пропорциональных рисков Кокса, которые включали оба биомаркера, демонстрировали значительно лучшие результаты, чем модели, включавшие в качестве предиктора только NT-проМНП (все p <0,001). Необработанные данные о связи биомаркеров с первичной конечной точкой показаны на Фиг. 12.
В соответствии с этим, первичный анализ квинтилей двух биомаркеров и их связи с частотой событий для первичной конечной точки показал, что для СР-проАДМ % потерянных дней возрастал в группе СЛ по квинтилям с 1,4% (СР-проАДМ ≤0,75 нмоль/л; нижний квинтиль; Таблица 14A) до 17,6% (СР-проАДМ до измеренного максимума 7,8 нмоль/л; верхний квинтиль). В группе ДВП эта тенденция была аналогичной (с 1,4% до 12,1%). Та же тенденция к более высокому риску пострадать от событий при более высоких уровнях биомаркеров наблюдается также для NT-проМНП (Таблица 14A), а также для конечной точки смерти от всех причин (Таблица 14B).
Кроме того, влияние ДВП на эти две конечные точки имело тенденцию к увеличению по квинтилям. Например, NT-проМНП имел прогностическую силу для лечебного эффекта ДВП на % потерянных дней, поскольку пациенты в нижнем квинтиле (с ≤487,9 пг/мл) имели немного больший % потерянных дней на ДВП, чем на СЛ, но для пациентов в верхнем квинтиле (с 3701,2-35000 пг/мл) % потерянных дней был заметно ниже в группе СЛ. Та же тенденция сохранялась для СР-проАДМ, а также для конечной точки смерти от всех причин.
Сценарии выбора для пациентов, рекомендуемых для ДВП
Пороговые значения для выбора пациентов, которым не следует рекомендовать ДВП, варьировались от 125,1 до 413,7 пг/мл для NT-проМНП и от 0,63 до 0,75 нмоль/л для СР-проАДМ, в зависимости от желаемой безопасности (чувствительность 100%; 98%; 95%) и критерия отбора пациентов (не менее 30 потерянных дней/год из-за незапланированной госпитализации с сердечно-сосудистыми заболеваниями или смерти от всех причин или; смерть от всех причин), как показано в Таблице 15.
Чем ниже желаемая чувствительность, тем выше критические пороговые значения биомаркеров и тем выше доля пациентов, которым не следует рекомендовать ДВП. Кроме того, чем ниже желаемая чувствительность, тем выше была положительная прогностическая ценность (ППЦ) рекомендаций по биомаркерам. Например, если принять, что 5% пациентов, пострадавших от 30 или более потерянных дней из 365, не получали ДВП (чувствительность 95%), то это событие испытают 21,5% пациентов, которым будет рекомендовано ДВП по комбинации биомаркеров. Для сравнения, показатель этого события в полной группе СЛ в исходной популяции испытаний составлял 16,4%. Это увеличение ППЦ было связано с сокращением популяции, которой было рекомендовано ДВП, на 27,0%.
Этот сценарий руководства по биомаркерам показан на Фиг. 9, панель B. Таким образом, биомаркеры позволили более точно и эффективно определить критическую популяцию. Примечательно, что доля пациентов, которым будет рекомендовано ДВП, может быть сокращена примерно на четверть в обоих сценариях с чувствительностью 95%. Даже для 100% чувствительности, при совместном использовании NT-проМНП и СР-проАДМ 10,8% и 13,9% можно было бы исключить из ДВП (Таблица 15).
Уменьшение рекомендуемой для ДВП популяции за счет совместного использования NT-проМНП и СР-проАДМ позволило исключить бессобытийных пациентов с достаточно высокими уровнями NT-проМНП, которые, тем не менее, имели довольно низкие уровни СР-проАДМ (нижний правый квадрант на Фиг. 9B). Они были бы включены в ДВП при использовании одного лишь NT-проМНП для стратификации риска (Фиг. 9, панель A).
При сравнении рекомендаций на основе одного биомаркера с изученным использованием двух биомаркеров, превосходство использования двух биомаркеров было, в частности, очевидным из-за высокой безопасности: для 100% чувствительности в отношении 30 или более потерянных дней из 365 (смерть от всех причин, соответственно), использование одного лишь NT-проМНП уменьшило бы популяцию с рекомендуемым ДВП на 3,4% (3,4%) пациентов, достигая специфичности 4,0% (3,9%). Эти показатели возрастают более чем в три раза при использовании комбинации NT-проМНП и СР-проАДМ, для которой популяция с рекомендованным ДВП будет безопасно сокращена на 10,8% (13,9%) пациентов, достигая специфичности 12,9% (15,7%).
Для 95% чувствительности в отношении 30 или более потерянных дней из 365, один лишь NT-проМНП снизил бы популяцию с рекомендуемым ДВП на 23,4% пациентов (Фиг. 9, панель A), достигнув специфичности 27,1%. Этот показатель, снова, возрастает при использовании дополнительно СР-проАДМ, причем популяция с рекомендованным ДВП может быть уменьшена на 27,0% пациентов, достигнув специфичности 31,4% (Фиг. 9, панель B).
Примечательно, что для всех значений чувствительности <100% эти числа зависят от точного алгоритма комбинирования, который используется для интеграции информации обоих биомаркеров. Например, следуя подходу, исследованному в примере, где оба биомаркера имеют равные веса (см. Методы), в сценарии 95% чувствительности к смерти от всех причин, один лишь NT-проМНП будет уменьшать популяцию, рекомендуемую для ДВП, на 32,3% (пороговое значение ≥383,3 пг/мл), в то время как для рекомендаций по двум биомаркерам в этом сценарии было обнаружено снижение только на 25,6% (Таблица 15). Показатель исключения может быть еще увеличен до 36,0% за счет дополнительного использования в процедуре отбора СР-проАДМ (с чувствительностью для одного маркера на уровне 100%).
Оценка сценариев эффективности ДВП
Таблица 15 демонстрирует эффект сокращения рандомизированных групп на основе биомаркеров в отношении первичной и всех вторичных конечных точек. Влияние на конечные точки оставалось в основном значимым, особенно для наиболее эффективного сценария и конечной точки смертности от всех причин. В частности, поскольку на p-значения влияет сокращение выборки на основе биомаркеров, оценки эффекта оставались очень схожими с результатами исходного исследования, что указывает на эффективность ДВП для большинства конечных точек. Этот вывод также подтверждает кривая Каплана-Мейера для последнего сценария и конечной точки смерти от всех причин (см. Фиг. 11). Число больных в экспериментальной группе, необходимое для получения дополнительного благоприятного исхода (ЧБНЛБИ), для смерти от всех причин можно снизить за счет исключения пациентов: для сценариев 95% чувствительности в отношении ≥30 потерянных дней/год (смерть от всех причин) показатель ЧБНЛБИ снижался с 28 в исходной популяции до 23 (21) в сокращенной субпопуляции, выбранной с использованием биомаркеров.
Дальнейший анализ для сценария 95%: характеристики пациентов и вмешательства ДВП
Для сценария руководства по биомаркерам с 95% чувствительностью относительно конечной точки ≥30 потерянных дней/год (т.е. ≥8,2% потерянных дней) описаны характеристики пациентов в идентифицированных подгруппах. Пороговые значения биомаркеров для этого сценария были следующими: для ДВП рекомендовались только пациенты с уровнем NT-проМНП ≥413,7 пг/мл и уровнем СР-проАДМ ≥0,75 нмоль/л (см. Таблицу 16).
При этом, в отношении первичной конечной точки, с чувствительностью 95%, n=1098/1538 (71,4%) пациентов остались в наборе данных, выбранном по биомаркерам. В Таблице 16a показаны характеристики таких пациентов по рандомизированным экспериментальным группам, а в Таблице 16b приведено сравнение характеристик выбранных и невыбранных пациентов. Данные в Таблице 16a подтверждают, что, несмотря на отбор на основе биомаркеров, обе рандомизированные экспериментальные группы остаются сопоставимыми без значимых различий. Таблица 16b показывает, что отобранные по биомаркерам пациенты имели повышенный риск более низкой ФВЛЖ и более высоких категорий NYHA.
Дополнительные результаты были получены на основе уникальных данных электронных историй болезни, имеющихся для пациентов, которые входили в группу ДВП во время испытания. Для сценария, рассмотренного в данном примере, частота возникновения неотложных состояний у пациентов, которые были бы исключены из ДВП, была значительно ниже, чем у тех, которым рекомендовали бы ДВП (медиана 0, ИКР 0-1 против медианы 1, ИКР 0-2; критерий суммы рангов Вилкоксона, p <0,001; Фиг. 10A). Таким образом, этот результат согласуется с целью выявления тех пациентов, которые из-за риска возникновения у них побочных эффектов, больше нуждаются в ДВП. Кроме того, как и следовало ожидать, трудозатраты на медицинскую помощь, оказанную персоналом ТМЦ пациентам, которым не было бы рекомендовано ДВП с учетом исследованного сценария руководства по биомаркерам, были значительно меньше трудозатрат на пациентов, которым было бы рекомендовано ДВП (в среднем 305 минут, СКО 88 минут, по сравнению со средним 355 минут, СКО 141 минута; t-критерий, p <0,001; Фиг. 10B).
На основе данных об усилиях, которые можно оценить из электронных медицинских карт для каждого отдельного пациента, который был назначен на ДВП в первоначальном исследовании, значительное количество времени персонала можно было бы сэкономить с помощью этого сценария руководства по биомаркерам. Общее расчетное время трудозатрат на медицинскую помощь, оказанную ТМЦ пациентам в группе ДВП испытаний, составило 4332 часа (приблизительно 5,7 часов на пациента). Время трудозатрат ТМЦ, не связанных с оказанием медицинской помощи, составило 356 часов (приблизительно 0,5 часа на пациента). Из них 1170 часов трудозатрат на медицинскую помощь и 99 часов трудозатрат, не связанных с оказанием медицинской помощи, можно было бы сэкономить, если бы ДВП не рекомендовали пациентам, которые имели показатели ниже пороговых значений биомаркеров, исследованых в данном документе (см. подробное описание этой субпопуляции пациентов в Таблицах 16a, b). Следует отметить, что эти результаты качественно схожи с другими сценариями руководства по биомаркерам, основанными на другой желаемой чувствительности или другой конечной точке (смерть от всех причин).
Дополнительные результаты относятся к пациентам, отобранным с 95% чувствительности в отношении конечной точки смертности от всех причин. На Фиг. 11 показана кривая Каплана-Мейера для двух экспериментальных групп в когортах, персонализированных на основе биомаркеров.
В общем, в данном примере подысследования биомаркеров TIM-HF2 было обнаружено, что при комбинации NT-проМНП (отсекающее значение <383,3 пг/мл) и СР-проАДМ (отсекающее значение <0,75 нмоль/л) можно было отобрать 72,5% первоначально рандомизированных пациентов, которые получили бы ту же пользу, что и исходная когорта. Таким образом, путем простого измерения этих двух биомаркеров в исходный момент времени назначение ДВП может быть персонализировано для когорты с более высоким риском. Следует отметить, что тест на биомаркеры может быть легко проведен любым лицом, предоставляющим медицинские услуги, и не требует других предварительных аналитических процедур. Образец крови может быть отправлен стандартной почтовой службой в централизованную базовую лабораторию, что очень экономично, как было доказано на практике в основном исследовании (Koehler et al 2018a).
В Примере 3 в первую очередь анализировался прогностический эффект NT-проМНП и СР-проАДМ, которые оба в значительной степени связаны с исходом. При сравнении двух рандомизированных групп эффекты лечения достоверно не предсказываются обоими маркерами. Таким образом, подход к использованию этих маркеров применялся в первую очередь для выявления пациентов, которые не получат пользы от ДВП. Это достигается путем анализа биомаркеров в группе СЛ с отсутствием событий. Отсекающие значения, определенные с использованием этого подхода, были применены к рандомизированным когортам, и выбранные популяции сравнивались по эффективности.
Пример 3 показывает, что эффект ДВП остался в основном без изменений. Подход позволил персонализировать рекомендации на ДВП и сократить для данного примера соответствующую критериям включения когорту до 71,4% от полной популяции и, таким образом, отказаться от использования по сути ненужных дорогостоящих методов лечения.
Таблица 1. Критерии включения и исключения пациентов для участия в исследовании
Сокращения: СРТ - сердечная ресинхронизирующая терапия; СН - сердечная недостаточность; NYHA - Нью-Йоркская кардиологическая ассоциация; PHQ - опросник состояния здоровья пациента.
Таблица 2: Последовательность проведения исследования и оценки, выполняемые во время различных посещений
исключения
Сокращения: EQ-5D-3L, Европейский опросник оценки качества жизни по 5 категориям с 3 уровнями; G9-EHFScBS, Немецкая версия Европейской шкалы оценки способности к самопомощи пациентов с сердечной недостаточностью из 9 пунктов; MLHFQ, опросник «Жизнь с сердечной недостаточностью в Миннесоте»; СР-проАДМ, среднерегионарный проадреномедуллин; СР-проПНП, среднерегионарный натрийуретический пропептид А-типа; NT-проМНП, N-концевой натрийуретический пропептид B-типа; PHQ-9D, опросник состояния здоровья пациента из девяти вопросов, на немецком языке
Таблица 3: Исходные характеристики:
Продолжение Таблицы 3:
Продолжение Таблицы 3
Продолжение Таблицы 3
АРН=ангиотензиновый рецептор/неприлизин; НПАК=новый пероральный антикоагулянт.


Таблица 6: Избранные вмешательства врачей и медсестер ТМЦ в группе дистанционного ведения пациентов
Таблица 7: Анализ отсекающих значений для проАДМ
Таблица 8: Анализ отсекающих значений для проМНП
Таблица 9: Анализ отсекающих значений для проПНП
Таблица 10: Стратификация пороговых значений биомаркеров по СКФ на основе CKD-EPI
Таблица 11: Стратификация пороговых значений биомаркеров по СКФ по Кокрофту-Голту
=)
Таблица 12:
для ДВП-
Таблица 13:
для 100%
чувствительности
Таблица 14A: Средний % потерянных дней из-за незапланированной госпитализации с сердечно-сосудистыми заболеваниями для различных квинтилей биомаркеров в подгруппах СЛ и ДВП. Представлены p-значения для эффекта лечения, а также для взаимодействия лечения с квинтилем.
СЛ - ДВП
Сравнение СЛ - ДВП
Взаимодействие
л]
* верхние пределы включены в соответствующие квинтили, нижние пределы - нет.
Таблица 14В. Уровень смертности от всех причин для различных квинтилей биомаркеров для подгрупп СЛ и ДВП. Представлены p-значения для эффекта лечения, а также для взаимодействия лечения с квинтилем.
СЛ (%)
ДВП (%)
СЛ/ДВП
Сравнение СЛ - ДВП
Взаимодействие
* верхние пределы включены в соответствующие квинтили, нижние пределы - нет.
Таблица 15. Сценарии рекомендаций ДВП на основе биомаркеров и соответствующие эффекты ДВП для первичных и вторичных конечных точек.
Сравнение ДВП с СЛ для подгруппы пациентов, рекомендуемых для ДВП
Таблица 16a. Характеристики пациентов, отобранных на основе биомаркеров, по рандомизированным экспериментальным группам.
(1107-3927)
(1075-4119)
(1146-3779)
Таблица 16b. Характеристики пациентов, выбранных на основе биомаркеров по сравнению с не-выбранными пациентами
(605-3097)
(200-983)
(1107-3927)
СКО, стандартное отклонение; *p-значение ДВП по сравнению с СЛ; ФВЛЖ, фракция выброса левого желудочка
Таблица 17. Медиана и интерквартильный размах (ИКР) ФВЛЖ по квинтилям биомаркеров в популяции TIM-HF2. Концентрация NT-проМНП коррелировала с ФВЛЖ (коэффициент Спирмена = -0,30, p <0,001), в то время как СР-проАДМ не коррелировала (коэффициент Спирмена = -0,01, p=0,70).
* верхние пределы включены в соответствующие квинтили, нижние пределы - нет
Таблица 18. Сценарии рекомендаций на основе биомаркеров с различными уровнями безопасности (Таблица, часть 1: «Сценарии выбора пациентов, рекомендуемых для ДВП») и оценка эффекта ДВП-вмешательства (Таблица, часть 2: «Оценка эффекта ДВП-вмешательства: Сравнение ДВП с СЛ для подмножества пациентов, рекомендованных для ДВП») для более строгих бинарных определений первичной конечной точки % дней, потерянных из-за незапланированной госпитализации с сердечно-сосудистыми заболеваниями или смерти от всех причин, используемых для получения пороговых значений отбора пациентов с рекомендациями ДВП на основе биомаркеров (≥15 потерянных дней/год, ≥1 потерянного дня/год); аналогично Таблице 15 (см. выше, ≥30 потерянных дней/год).

СПИСОК ЛИТЕРАТУРЫ
Abraham WT, Adamson PB, Bourge RC, Aaron MF, Costanzo MR, Stevenson LW, Strickland W, Neelagaru S, Raval N, Krueger S, Weiner S, Shavelle D, Jeffries B, Yadav JS, CHAMPION Trial Study Group. Wireless pulmonary artery haemodynamic monitoring in chronic heart failure: a randomised controlled trial. Lancet 2011; 377:658-666.
Adamson PB, Ginn G, Anker SD, Bourge RC, Abraham WT. Remote haemodynamic-guided care for patients with chronic heart failure: a meta-analysis of completed trials. Eur J Heart Fail 2017;19:426-443.
Albrich WC, Ruegger K, Dusemund F, et al. (2013) Biomarker-enhanced triage in respiratory infections: a proof-of-concept feasibility trial. Eur Respir J.; 42(4):1064-1075.
Allen, M., Poggiali, D., Whitaker, K., Marshall, T. R., & Kievit, R. A. (2019). Raincloud plots: a multi-platform tool for robust data visualization. Wellcome Open Research, 4 (https://doi.org/10.12688/wellcomeopenres.15191.1).
Anker S, Koehler F, Abraham W. Telemedicine and remote management of patients with heart failure. Lancet 2011; 378:731-739.
 E., Talha S., Zulfiqar AA, Hajjam M,
E., Talha S., Zulfiqar AA, Hajjam M,  S, Hajjam J,
S, Hajjam J,  B, Hajjam E, Hassani A. (2018) Current Research and New Perspectives of Telemedicine in Chronic Heart Failure: Narrative Review and Points of Interest for the Clinician. J Clin Med. 2018 Dec 13; 7(12).
B, Hajjam E, Hassani A. (2018) Current Research and New Perspectives of Telemedicine in Chronic Heart Failure: Narrative Review and Points of Interest for the Clinician. J Clin Med. 2018 Dec 13; 7(12).
 M, Drexler H, Oswald H, Rybak K, Bosch R, Butter C, Klein G, Gerritse B, Monteiro J, Israel C, Bimmel D,
M, Drexler H, Oswald H, Rybak K, Bosch R, Butter C, Klein G, Gerritse B, Monteiro J, Israel C, Bimmel D,  S, Huegl B, Brachmann J; OptiLink HF Study Investigators. Fluid status telemedicine alerts for heart failure: a randomized controlled trial. Eur Heart J 2016; 37:3154-3163.
S, Huegl B, Brachmann J; OptiLink HF Study Investigators. Fluid status telemedicine alerts for heart failure: a randomized controlled trial. Eur Heart J 2016; 37:3154-3163.
Chioncel O, Lainscak M, Seferovic PM, et al. Epidemiology and one-year outcomes in patients with chronic heart failure and preserved, mid-range and reduced ejection fraction: an analysis of the ESC Heart Failure Long-Term Registry. Eur J Heart Fail 2017; 19: 1574-85.
Christopher Adlbrecht, Martin  , Guido Strunk, Rudolf Berger, Deddo
, Guido Strunk, Rudolf Berger, Deddo  , Joachim Struck, Nils G. Morgenthaler, Andreas Bergmann, Johannes Jakowitsch, Gerald Maurer, Irene M. Lang, and Richard Pacher (2009) European Journal of Heart Failure (2009) 11, 361-366.
, Joachim Struck, Nils G. Morgenthaler, Andreas Bergmann, Johannes Jakowitsch, Gerald Maurer, Irene M. Lang, and Richard Pacher (2009) European Journal of Heart Failure (2009) 11, 361-366.
Cockcroft, D. W., & Gault, M. H. (1976). Prediction of creatinine clearance from serum creatinine. Nephron, 16, 31-41.
Cowie MR, Anker SD, Cleland JGF, et al. Improving care for patients with acute heart failure: before, during and after hospitalization. ESC Heart Fail 2014; 1: 110-45.
Cowie MR, Bax J, Bruning N, et al. e-Health: a position statement of the European Society of Cardiology. Eur Heart J 2016; 37: 63-66.
Francis GS, Felker GM, Tang WH. (2016) A test in context: critical evaluation of natriuretic peptide testing in heart failure. J Am Coll Cardiol; 67:331-7.
Gheorghiade M, Zannad F, Sopko G, Klein L,  IL, Konstam MA, Massie BM, Roland E, Targum S, Collins SP, Filippatos G, Tavazzi L; International Working Group on Acute Heart Failure Syndromes. International working group on acute heart failure syndromes. Acute heart failure syndromes: current state and framework for future research. Circulation. 2005; 112(25):3958-68.
IL, Konstam MA, Massie BM, Roland E, Targum S, Collins SP, Filippatos G, Tavazzi L; International Working Group on Acute Heart Failure Syndromes. International working group on acute heart failure syndromes. Acute heart failure syndromes: current state and framework for future research. Circulation. 2005; 112(25):3958-68.
Gowda S., Prakash B. Desai, Shruthi S. Kulkarni, Vinayak V. Hull, Avinash A. K. Math, and Sonal N. Vernekar Markers of renal function tests, N Am J Med Sci. 2010 Apr; 2(4): 170-173.
Hartmann O, Schuetz P, Albrich WC, Anker SD, Mueller B, Schmidt T (2012). Time-dependent Cox regression: serial measurement of the cardiovascular biomarker proadrenomedullin improves survival prediction in patients with lower respiratory tract infection. Int J Cardiol.; 161(3):166-173.
Hindricks G, Taborsky M, Glikson M, Heinrich U, Schumacher B, Katz A, Brachmann J, Lewalter T, Goette A, Block M, Kautzner J, Sack S, Husser D, Piorkowski C, Sogaard P; IN-TIME Study Group. Implant-based multiparameter telemonitoring of patients with heart failure (IN-TIME): a randomised controlled trial. Lancet 2014; 384:583-590.
Hofmann R, Voeller H, Nagels K, Bindl D, Vettorazzi E, Dittmar R, Wohlgemuth W, Neumann T, Stork S, Bruder O, Wegscheider K, Nagel E, Fleck E. First outline and baseline data of a randomized, controlled multicenter trial to evaluate the health economic impact of home telemonitoring in chronic heart failure - CardioBBEAT. Trials 2015;16:343.
Hunt SA, Abraham WT, Chin MH, Feldman AM, Francis GS, Ganiats TG, et al. 2009 focused update incorporated into the ACC/AHA 2005 Guidelines for the Diagnosis and Management of Heart Failure in Adults: a report of the American College of Cardiology Foundation/American Heart Association Task Force on Practice Guidelines: developed in collaboration with the International Society for Heart and Lung Transplantation. Circulation. 2009; 119(14).
Jougasaki M, Burnett Jr JC (2000). Adrenomedullin: potential in physiology and pathophysiology. Life Sci; 66:855-72.
Koehler F, Koehler K, Deckwart O, Prescher S, Wegscheider K, Winkler S, Vettorazzi E, Polze A, Stangl K, Hartmann O, Marx A, Neuhaus P, Scherf M, Kirwan BA, Anker SD. Telemedical Interventional Management in Heart Failure II (TIM-HF2), a randomised, controlled trial investigating the impact of telemedicine on unplanned cardiovascular hospitalisations and mortality in heart failure patients: study design and description of the intervention. Eur J Heart Fail. 2018 Oct; 20(10):1485-1493. doi: 10.1002/ejhf.1300. Epub 2018b Sep 19.
Koehler F, Winkler S, Schieber M, Sechtem U, Stangl K, Bohm M, de Brouwer S, Perrin E, Baumann G, Gelbrich G, Boll H, Honold M, Koehler K, Kirwan BA, Anker SD. Telemedicine in heart failure: pre-specified and exploratory subgroup analyses from the TIM-HF trial. Int J Cardiol 2012a; 161:143-150.
Koehler F, Winkler S, Schieber M, Sechtem U, Stangl K,  M, Brouwer S, Perrin E, Baumann G, Goetz G, Boll H, Honold M, Koehler K, Kirwan B-A, Anker S, „Telemedicine in heart faiIure: Pre- specified and exploratory subgroup analyses from the TIM-HF trial”, Int J Cardiology 2012b, 161, 3 143-150.
M, Brouwer S, Perrin E, Baumann G, Goetz G, Boll H, Honold M, Koehler K, Kirwan B-A, Anker S, „Telemedicine in heart faiIure: Pre- specified and exploratory subgroup analyses from the TIM-HF trial”, Int J Cardiology 2012b, 161, 3 143-150.
Koehler F, Winkler S, Schieber M, SechtemU, Stangl K, BohmM, Boll H, Baumann G, Honold M, Koehler K, Gelbrich G, Kirwan BA, Anker SD; Telemedical Interventional Monitoring in Heart Failure Investigators. Impact of remote telemedical management on mortality and hospitalisations in ambulatory patients with chronic heart failure: the Telemedical Interventional Monitoring in Heart Failure study. Circulation 2011; 123:1873-1880.
Koehler, Friedrich & Koehler, Kerstin & Deckwart, Oliver & Prescher, Sandra & Wegscheider, Karl & Kirwan, Bridget-Anne & Winkler, Sebastian & Vettorazzi, Eik & Bruch, Leonhard & Oeff, Michael & Zugck, Christian & Doerr, Gesine & Naegele, Herbert &  , Stefan & Butter, Christian & Sechtem, Udo & Angermann, Christiane & Gola, Guntram & Prondzinsky, Roland & Stangl, Karl (2018a). Efficacy of telemedical interventional management in patients with heart failure (TIM- HF2): a randomised, controlled, parallel-group, unmasked trial. The Lancet. Volume 392, ISSUE 10152, P1047-1057, September 22, 2018a.
, Stefan & Butter, Christian & Sechtem, Udo & Angermann, Christiane & Gola, Guntram & Prondzinsky, Roland & Stangl, Karl (2018a). Efficacy of telemedical interventional management in patients with heart failure (TIM- HF2): a randomised, controlled, parallel-group, unmasked trial. The Lancet. Volume 392, ISSUE 10152, P1047-1057, September 22, 2018a.
Koehler F., Koehler K., Deckwart O., Prescher S., Wegscheider K., Winkler S., Vettorazzi E., Polze A., Stangl K., Hartmann O., Marx A., Neuhaus P., Scherf M., Kirwan BA, Anker SD (2018b) Telemedical Interventional Management in Heart Failure II (TIM-HF2), a randomised, controlled trial investigating the impact of telemedicine on unplanned cardiovascular hospitalisations and mortality in heart failure patients: study design and description of the intervention. Eur J Heart Fail. 2018 Oct; 20(10):1485-1493.
Kojima H, Tsujimoto T, Uemura M, et al. (1998) Significance of increased plasma adrenomedullin concentration in patients with cirrhosis. J Hepatol; 28:840-6.
Krstic, Danijela &  , Nenad &
, Nenad &  , Branimir &
, Branimir &  ,
,  & Dragutinovic, Vesna &
& Dragutinovic, Vesna & 
 , Sanja &
, Sanja &  , Mirjana. (2016). Biochemical Markers of Renal Function. Current medicinal chemistry. 23: 2018-2040.
, Mirjana. (2016). Biochemical Markers of Renal Function. Current medicinal chemistry. 23: 2018-2040.
Levey A.S., Inker L.A. Assessment of Glomerular Filtration Rate in Health and Disease: A State of the Art Review, Clin Pharmacol Ther. 2017 Sep; 102(3):405-419.
Levey, A. S., et al. (2009). A new equation to estimate glomerular filtration rate. Annals of internal medicine, 150(9), 604-612.
Marco Metra, MD John R Teerlink, MD The LANCET: Volume 390, ISSUE 10106, P1981-1995 (2017).
McMurray JJ, Adamopoulos S, Anker SD, Auricchio A,  M, Dickstein K, Falk V, Filippatos G, Fonseca C, Gomez-Sanchez MA, Jaarsma T,
M, Dickstein K, Falk V, Filippatos G, Fonseca C, Gomez-Sanchez MA, Jaarsma T,  L, Lip GY, Maggioni AP, Parkhomenko A, Pieske BM, Popescu BA,
L, Lip GY, Maggioni AP, Parkhomenko A, Pieske BM, Popescu BA,  PK, Rutten FH, Schwitter J, Seferovic P, Stepinska J, Trindade PT, Voors AA, Zannad F, Zeiher A; Task Force for the Diagnosis and Treatment of Acute and Chronic Heart Failure 2012 of the European Society of Cardiology, Bax JJ, Baumgartner H, Ceconi C, Dean V, Deaton C, Fagard R, Funck-Brentano C, Hasdai D, Hoes A, Kirchhof P, Knuuti J, Kolh P, McDonagh T, Moulin C, Popescu BA, Reiner Z, Sechtem U, Sirnes PA, Tendera M, Torbicki A, Vahanian A, Windecker S, McDonagh T, Sechtem U, Bonet LA, Avraamides P, Ben Lamin HA, Brignole M, Coca A, Cowburn P, Dargie H, Elliott P, Flachskampf FA, Guida GF, Hardman S, Iung B, Merkely B, Mueller C, Nanas JN, Nielsen.
PK, Rutten FH, Schwitter J, Seferovic P, Stepinska J, Trindade PT, Voors AA, Zannad F, Zeiher A; Task Force for the Diagnosis and Treatment of Acute and Chronic Heart Failure 2012 of the European Society of Cardiology, Bax JJ, Baumgartner H, Ceconi C, Dean V, Deaton C, Fagard R, Funck-Brentano C, Hasdai D, Hoes A, Kirchhof P, Knuuti J, Kolh P, McDonagh T, Moulin C, Popescu BA, Reiner Z, Sechtem U, Sirnes PA, Tendera M, Torbicki A, Vahanian A, Windecker S, McDonagh T, Sechtem U, Bonet LA, Avraamides P, Ben Lamin HA, Brignole M, Coca A, Cowburn P, Dargie H, Elliott P, Flachskampf FA, Guida GF, Hardman S, Iung B, Merkely B, Mueller C, Nanas JN, Nielsen.
Melillo P and Pecchia L. “A Preliminary Model to Choose the Most Approriate Taget Population for Home Monitoring Telemedicine Interventions Basing on the Best Available Evidence”, COMPUTER ANALYSIS OF IMAGES AND PATTERNS (CAIP) 2014; 406-408.
Morgan JM, Kitt S, Gill J, McComb JM, Ng GA, Raftery J, Roderick P, Seed A, Williams SG, Witte KK, Wright DJ, Harris S, Cowie MR. Remote management of heart failure using implantable electronic devices. Eur Heart J 2017; 38:2352-2360.
Mukoyama et al, (1991) Brain natriuretic peptide as a novel cardiac hormone in humans. Evidence for an exquisite dual natriuretic peptide system, atrial natriuretic peptide and brain natriuretic peptide. J Clin Invest; 87: 1402-12.
Ong MK, Romano PS, Edgington S, Aronow HU, Auerbach AD, Black JT, De Marco T, Escarce JJ, Evangelista LS, Hanna B, Ganiats TG, Greenberg BH, Greenfield S, Kaplan SH, Kimchi A, Liu H, Lombardo D, Mangione CM, Sadeghi B, Sadeghi B, Sarrafzadeh M, Tong K, Fonarow GC; Better Effectiveness After Transition-Heart Failure (BEAT-HF) Research Group. Effectiveness of remote patient monitoring after discharge of hospitalised patients with heart failure: The Better Effectiveness After Transition-Heart Failure (BEAT-HF) randomized clinical trial. JAMA Intern Med 2016; 176:310-318.
OW, Orn S, Parissis JT, Ponikowski P; ESC Committee for Practice Guidelines. ESC guidelines for the diagnosis and treatment of acute and chronic heart failure 2012: The Task Force for the Diagnosis and Treatment of Acute and Chronic Heart Failure 2012 of the European Society of Cardiology. Developed in collaboration with the Heart Failure Association (HFA) of the ESC. Eur J Heart Fail. 2012;14(8):803-69. Erratum in: Eur J Heart Fail. 2013;15(3):361-2. e391-479.
Pocock SJ, Ariti CA, McMurray JJ, Maggioni A, Køber L, Squire IB, Swedberg K, Dobson J, Poppe KK, Whalley GA, Doughty RN; Meta-Analysis Global Group in Chronic Heart Failure: Predicting survival in heart failure: a risk score based on 39 372 patients from 30 studies. Eur Heart J. 2013 May; 34(19):1404-13.
Ponikowski P, Voors AA, Anker SD, Bueno H, Cleland JG, Coats AJ, Falk V, Gonzalez-Juanatey JR, Harjola VP, Jankowska EA, Jessup M, Linde C, Nihoyannopoulos P, Parissis JT, Pieske B, Riley JP, Rosano GM, Ruilope LM, Ruschitzka F, Rutten FH, van der Meer P. ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure: The Task Force for the diagnosis and treatment of acute and chronic heart failure of the European Society of Cardiology (ESC). Developed with the special contribution of the Heart Failure Association (HFA) of the ESC. Eur J Heart Fail 2016; 18:891-975.
Ponikowski P, Voors AA, Anker SD, Bueno H, Cleland JG, Coats AJ, Falk V, Gonzalez-Juanatey JR, Harjola VP, Jankowska EA, Jessup M, Linde C, Nihoyannopoulos P, Parissis JT, Pieske B, Riley JP, Rosano GM, Ruilope LM, Ruschitzka F, Rutten FH, van der Meer P. ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure: The Task Force for the diagnosis and treatment of acute and chronic heart failure of the European Society of Cardiology (ESC). Developed with the special contribution of the Heart Failure Association (HFA) of the ESC. Eur J Heart Fail 2016; 37(27):2129-2200.
Pousset F, Masson F, Chavirovskaia O, et al. (2000) Plasma adrenomedullin, a new independent predictor of prognosis in patients with chronic heart failure. Eur Heart J; 21:1009-14.
Spethmann S., Prescher S., Dreger H., Nettlau H., Baumann G., Knebel F., Koehler F. Electrocardiographic monitoring during marathon running: a proof of feasibility for a new telemedical approach. Eur J Prev Cardiol. 2014 Nov; 21(2 Suppl):32-7. doi:10.1177/2047487314553736.
Sudoh, T., Kangawa K., Minamino N. and Matsuo H. (1988) A new natriuretic peptide in porcine brain, Nature; 332: 78-81.
R Core Team (2018). R: A language and environment for statistical computing. R Foundation for Statistical Computing, Vienna, Austria. URL https://www.R-project.org/. T. Sudoh BBRC 1989; 159: 1427-34.
Terry M. Therneau, Patricia M. Grambsch (2000). Modeling Survival Data: Extending the Cox Model. Springer, New York. ISBN 0-387-98784-3
Tzikas S, Keller T, Ojeda FM, et al. (2013) MR-proANP and MR-proADM for risk stratification of patients with acute chest pain. Heart; 99:388-95.
van Riet EE, Hoes AW, Wagenaar KP, Limburg A, Landman MA, Rutten FH. Epidemiology of heart failure: the prevalence of heart failure and ventricular dysfunction in older adults over time. A systematic review. Eur J Heart Fail 2016; 18: 242-52.
Van Spall HGC, Rahman T, Mytton O, Ramasundarahettige C, Ibrahim Q, Kabali C, Coppens M, Brian Haynes R, Connolly S. Comparative effectiveness of transitional care services in patients discharged from the hospital with heart failure: a systematic review and network meta-analysis. Eur J Heart Fail 2017; 19:1427-1443.
Vuolteenaho O., Ala-Kopsala M, Ruskoaho H. (2005) BNP as a biomarker in heart disease. Adv Clin Chem.; 40:1-36.
Wild PS, Schnabel RB, Lubos E, et al. (2011) Midregional proadrenomedullin for prediction of cardiovascular events in coronary artery disease: results from the AtheroGene study. Clin Chem; 58:226-36.
Xiang R, Li L, Liu S “Meta-analysis and meta-regression of telehealth programmes for patients with chronic heart failure” J Telemedicine and Telecare 2013; vol. 19, 5 249-259.
Yancy CW, Jessup M, Bozkurt B, Butler J, Casey DE Jr, Drazner MH, Fonarow GC, Geraci SA, Horwich T, Januzzi JL, Johnson MR, Kasper EK, Levy WC, Masoudi FA, McBride PE, McMurray JJV, Mitchell JE, Peterson PN, Riegel B, Sam F, Stevenson LW, Tang WHW, Tsai EJ, Wilkoff BL. 2013 ACCF/AHA guideline for the management of heart failure: a report of the American College of Cardiology Foundation/American Heart Association Task Force on Practice Guidelines. J Am Coll Cardiol 2013; 62:e147-239.
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> B.R.A.H.M.S GmbH
<120> НАЗНАЧЕНИЕ ДИСТАНЦИОННОГО ВЕДЕНИЯ ПАЦИЕНТОВ НА ОСНОВЕ БИОМАРКЕРОВ
<130> XII 2276/18WO
<150> EP19175720.2
<151> 2019-05-21
<150> EP19166382.2
<151> 2019-03-29
<150> EP19166425.9
<151> 2019-03-29
<160> 15
<170> BiSSAP 1.3.6
<210> 1
<211> 185
<212> PRT
<213> Homo sapiens
<400> 1
Met Lys Leu Val Ser Val Ala Leu Met Tyr Leu Gly Ser Leu Ala Phe
1 5 10 15
Leu Gly Ala Asp Thr Ala Arg Leu Asp Val Ala Ser Glu Phe Arg Lys
20 25 30
Lys Trp Asn Lys Trp Ala Leu Ser Arg Gly Lys Arg Glu Leu Arg Met
35 40 45
Ser Ser Ser Tyr Pro Thr Gly Leu Ala Asp Val Lys Ala Gly Pro Ala
50 55 60
Gln Thr Leu Ile Arg Pro Gln Asp Met Lys Gly Ala Ser Arg Ser Pro
65 70 75 80
Glu Asp Ser Ser Pro Asp Ala Ala Arg Ile Arg Val Lys Arg Tyr Arg
85 90 95
Gln Ser Met Asn Asn Phe Gln Gly Leu Arg Ser Phe Gly Cys Arg Phe
100 105 110
Gly Thr Cys Thr Val Gln Lys Leu Ala His Gln Ile Tyr Gln Phe Thr
115 120 125
Asp Lys Asp Lys Asp Asn Val Ala Pro Arg Ser Lys Ile Ser Pro Gln
130 135 140
Gly Tyr Gly Arg Arg Arg Arg Arg Ser Leu Pro Glu Ala Gly Pro Gly
145 150 155 160
Arg Thr Leu Val Ser Ser Lys Pro Gln Ala His Gly Ala Pro Ala Pro
165 170 175
Pro Ser Gly Ser Ala Pro His Phe Leu
180 185
<210> 2
<211> 164
<212> PRT
<213> Homo sapiens
<400> 2
Ala Arg Leu Asp Val Ala Ser Glu Phe Arg Lys Lys Trp Asn Lys Trp
1 5 10 15
Ala Leu Ser Arg Gly Lys Arg Glu Leu Arg Met Ser Ser Ser Tyr Pro
20 25 30
Thr Gly Leu Ala Asp Val Lys Ala Gly Pro Ala Gln Thr Leu Ile Arg
35 40 45
Pro Gln Asp Met Lys Gly Ala Ser Arg Ser Pro Glu Asp Ser Ser Pro
50 55 60
Asp Ala Ala Arg Ile Arg Val Lys Arg Tyr Arg Gln Ser Met Asn Asn
65 70 75 80
Phe Gln Gly Leu Arg Ser Phe Gly Cys Arg Phe Gly Thr Cys Thr Val
85 90 95
Gln Lys Leu Ala His Gln Ile Tyr Gln Phe Thr Asp Lys Asp Lys Asp
100 105 110
Asn Val Ala Pro Arg Ser Lys Ile Ser Pro Gln Gly Tyr Gly Arg Arg
115 120 125
Arg Arg Arg Ser Leu Pro Glu Ala Gly Pro Gly Arg Thr Leu Val Ser
130 135 140
Ser Lys Pro Gln Ala His Gly Ala Pro Ala Pro Pro Ser Gly Ser Ala
145 150 155 160
Pro His Phe Leu
<210> 3
<211> 20
<212> PRT
<213> Homo sapiens
<400> 3
Ala Arg Leu Asp Val Ala Ser Glu Phe Arg Lys Lys Trp Asn Lys Trp
1 5 10 15
Ala Leu Ser Arg
20
<210> 4
<211> 48
<212> PRT
<213> Homo sapiens
<400> 4
Glu Leu Arg Met Ser Ser Ser Tyr Pro Thr Gly Leu Ala Asp Val Lys
1 5 10 15
Ala Gly Pro Ala Gln Thr Leu Ile Arg Pro Gln Asp Met Lys Gly Ala
20 25 30
Ser Arg Ser Pro Glu Asp Ser Ser Pro Asp Ala Ala Arg Ile Arg Val
35 40 45
<210> 5
<211> 52
<212> PRT
<213> Homo sapiens
<400> 5
Tyr Arg Gln Ser Met Asn Asn Phe Gln Gly Leu Arg Ser Phe Gly Cys
1 5 10 15
Arg Phe Gly Thr Cys Thr Val Gln Lys Leu Ala His Gln Ile Tyr Gln
20 25 30
Phe Thr Asp Lys Asp Lys Asp Asn Val Ala Pro Arg Ser Lys Ile Ser
35 40 45
Pro Gln Gly Tyr
50
<210> 6
<211> 38
<212> PRT
<213> Homo sapiens
<400> 6
Arg Arg Arg Arg Arg Ser Leu Pro Glu Ala Gly Pro Gly Arg Thr Leu
1 5 10 15
Val Ser Ser Lys Pro Gln Ala His Gly Ala Pro Ala Pro Pro Ser Gly
20 25 30
Ser Ala Pro His Phe Leu
35
<210> 7
<211> 134
<212> PRT
<213> Homo sapiens
<400> 7
Met Asp Pro Gln Thr Ala Pro Ser Arg Ala Leu Leu Leu Leu Leu Phe
1 5 10 15
Leu His Leu Ala Phe Leu Gly Gly Arg Ser His Pro Leu Gly Ser Pro
20 25 30
Gly Ser Ala Ser Asp Leu Glu Thr Ser Gly Leu Gln Glu Gln Arg Asn
35 40 45
His Leu Gln Gly Lys Leu Ser Glu Leu Gln Val Glu Gln Thr Ser Leu
50 55 60
Glu Pro Leu Gln Glu Ser Pro Arg Pro Thr Gly Val Trp Lys Ser Arg
65 70 75 80
Glu Val Ala Thr Glu Gly Ile Arg Gly His Arg Lys Met Val Leu Tyr
85 90 95
Thr Leu Arg Ala Pro Arg Ser Pro Lys Met Val Gln Gly Ser Gly Cys
100 105 110
Phe Gly Arg Lys Met Asp Arg Ile Ser Ser Ser Ser Gly Leu Gly Cys
115 120 125
Lys Val Leu Arg Arg His
130
<210> 8
<211> 108
<212> PRT
<213> Homo sapiens
<400> 8
His Pro Leu Gly Ser Pro Gly Ser Ala Ser Asp Leu Glu Thr Ser Gly
1 5 10 15
Leu Gln Glu Gln Arg Asn His Leu Gln Gly Lys Leu Ser Glu Leu Gln
20 25 30
Val Glu Gln Thr Ser Leu Glu Pro Leu Gln Glu Ser Pro Arg Pro Thr
35 40 45
Gly Val Trp Lys Ser Arg Glu Val Ala Thr Glu Gly Ile Arg Gly His
50 55 60
Arg Lys Met Val Leu Tyr Thr Leu Arg Ala Pro Arg Ser Pro Lys Met
65 70 75 80
Val Gln Gly Ser Gly Cys Phe Gly Arg Lys Met Asp Arg Ile Ser Ser
85 90 95
Ser Ser Gly Leu Gly Cys Lys Val Leu Arg Arg His
100 105
<210> 9
<211> 76
<212> PRT
<213> Homo sapiens
<400> 9
His Pro Leu Gly Ser Pro Gly Ser Ala Ser Asp Leu Glu Thr Ser Gly
1 5 10 15
Leu Gln Glu Gln Arg Asn His Leu Gln Gly Lys Leu Ser Glu Leu Gln
20 25 30
Val Glu Gln Thr Ser Leu Glu Pro Leu Gln Glu Ser Pro Arg Pro Thr
35 40 45
Gly Val Trp Lys Ser Arg Glu Val Ala Thr Glu Gly Ile Arg Gly His
50 55 60
Arg Lys Met Val Leu Tyr Thr Leu Arg Ala Pro Arg
65 70 75
<210> 10
<211> 32
<212> PRT
<213> Homo sapiens
<400> 10
Ser Pro Lys Met Val Gln Gly Ser Gly Cys Phe Gly Arg Lys Met Asp
1 5 10 15
Arg Ile Ser Ser Ser Ser Gly Leu Gly Cys Lys Val Leu Arg Arg His
20 25 30
<210> 11
<211> 153
<212> PRT
<213> Homo sapiens
<400> 11
Met Ser Ser Phe Ser Thr Thr Thr Val Ser Phe Leu Leu Leu Leu Ala
1 5 10 15
Phe Gln Leu Leu Gly Gln Thr Arg Ala Asn Pro Met Tyr Asn Ala Val
20 25 30
Ser Asn Ala Asp Leu Met Asp Phe Lys Asn Leu Leu Asp His Leu Glu
35 40 45
Glu Lys Met Pro Leu Glu Asp Glu Val Val Pro Pro Gln Val Leu Ser
50 55 60
Glu Pro Asn Glu Glu Ala Gly Ala Ala Leu Ser Pro Leu Pro Glu Val
65 70 75 80
Pro Pro Trp Thr Gly Glu Val Ser Pro Ala Gln Arg Asp Gly Gly Ala
85 90 95
Leu Gly Arg Gly Pro Trp Asp Ser Ser Asp Arg Ser Ala Leu Leu Lys
100 105 110
Ser Lys Leu Arg Ala Leu Leu Thr Ala Pro Arg Ser Leu Arg Arg Ser
115 120 125
Ser Cys Phe Gly Gly Arg Met Asp Arg Ile Gly Ala Gln Ser Gly Leu
130 135 140
Gly Cys Asn Ser Phe Arg Tyr Arg Arg
145 150
<210> 12
<211> 126
<212> PRT
<213> Homo sapiens
<400> 12
Asn Pro Met Tyr Asn Ala Val Ser Asn Ala Asp Leu Met Asp Phe Lys
1 5 10 15
Asn Leu Leu Asp His Leu Glu Glu Lys Met Pro Leu Glu Asp Glu Val
20 25 30
Val Pro Pro Gln Val Leu Ser Glu Pro Asn Glu Glu Ala Gly Ala Ala
35 40 45
Leu Ser Pro Leu Pro Glu Val Pro Pro Trp Thr Gly Glu Val Ser Pro
50 55 60
Ala Gln Arg Asp Gly Gly Ala Leu Gly Arg Gly Pro Trp Asp Ser Ser
65 70 75 80
Asp Arg Ser Ala Leu Leu Lys Ser Lys Leu Arg Ala Leu Leu Thr Ala
85 90 95
Pro Arg Ser Leu Arg Arg Ser Ser Cys Phe Gly Gly Arg Met Asp Arg
100 105 110
Ile Gly Ala Gln Ser Gly Leu Gly Cys Asn Ser Phe Arg Tyr
115 120 125
<210> 13
<211> 28
<212> PRT
<213> Homo sapiens
<400> 13
Ser Leu Arg Arg Ser Ser Cys Phe Gly Gly Arg Met Asp Arg Ile Gly
1 5 10 15
Ala Gln Ser Gly Leu Gly Cys Asn Ser Phe Arg Tyr
20 25
<210> 14
<211> 98
<212> PRT
<213> Homo sapiens
<400> 14
Asn Pro Met Tyr Asn Ala Val Ser Asn Ala Asp Leu Met Asp Phe Lys
1 5 10 15
Asn Leu Leu Asp His Leu Glu Glu Lys Met Pro Leu Glu Asp Glu Val
20 25 30
Val Pro Pro Gln Val Leu Ser Glu Pro Asn Glu Glu Ala Gly Ala Ala
35 40 45
Leu Ser Pro Leu Pro Glu Val Pro Pro Trp Thr Gly Glu Val Ser Pro
50 55 60
Ala Gln Arg Asp Gly Gly Ala Leu Gly Arg Gly Pro Trp Asp Ser Ser
65 70 75 80
Asp Arg Ser Ala Leu Leu Lys Ser Lys Leu Arg Ala Leu Leu Thr Ala
85 90 95
Pro Arg
<210> 15
<211> 38
<212> PRT
<213> Homo sapiens
<400> 15
Pro Glu Val Pro Pro Trp Thr Gly Glu Val Ser Pro Ala Gln Arg Asp
1 5 10 15
Gly Gly Ala Leu Gly Arg Gly Pro Trp Asp Ser Ser Asp Arg Ser Ala
20 25 30
Leu Leu Lys Ser Lys Leu
35
<---

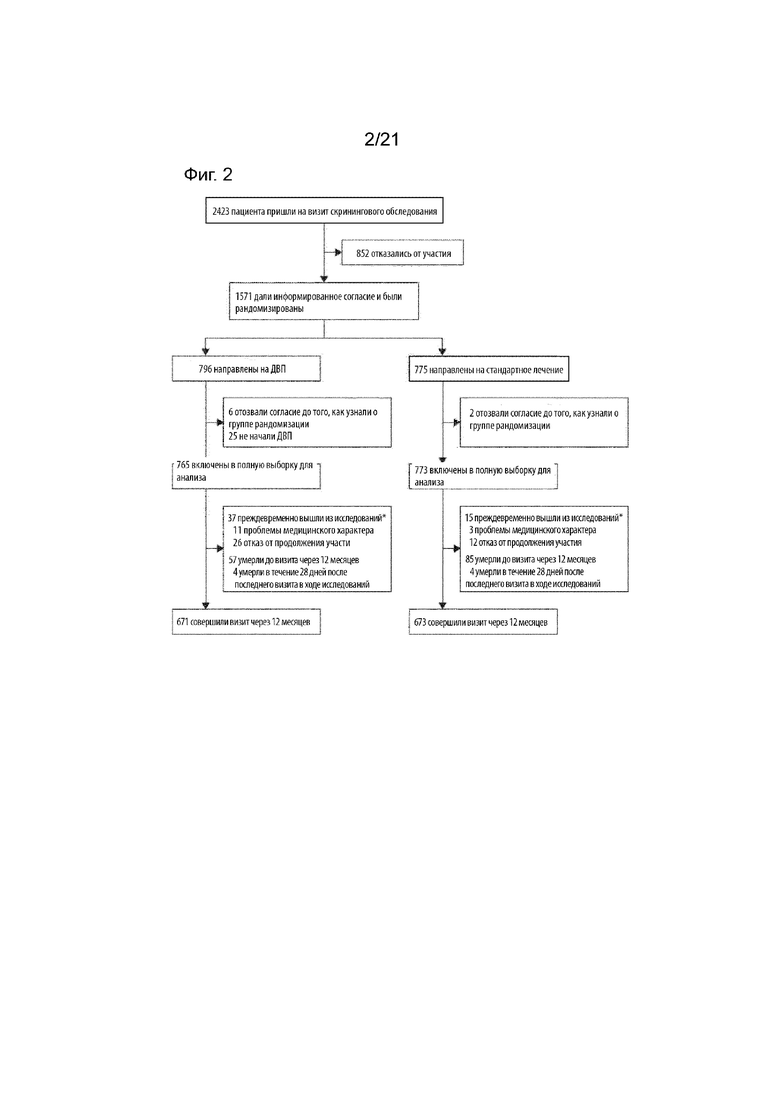


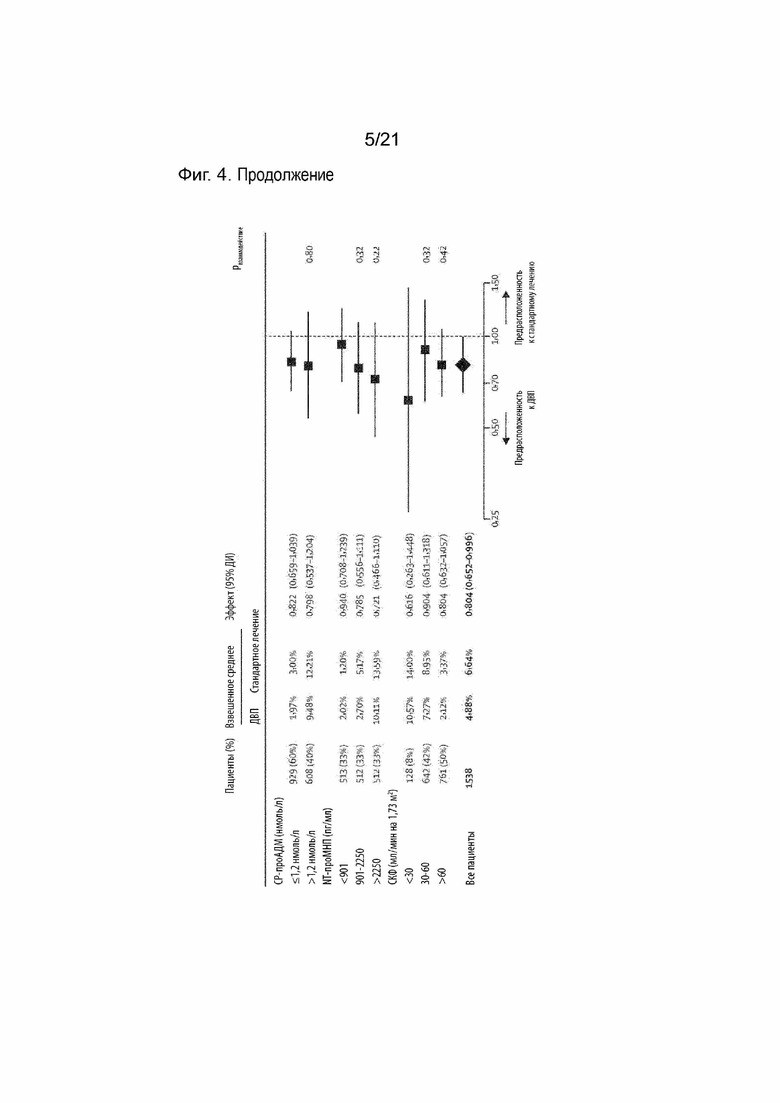


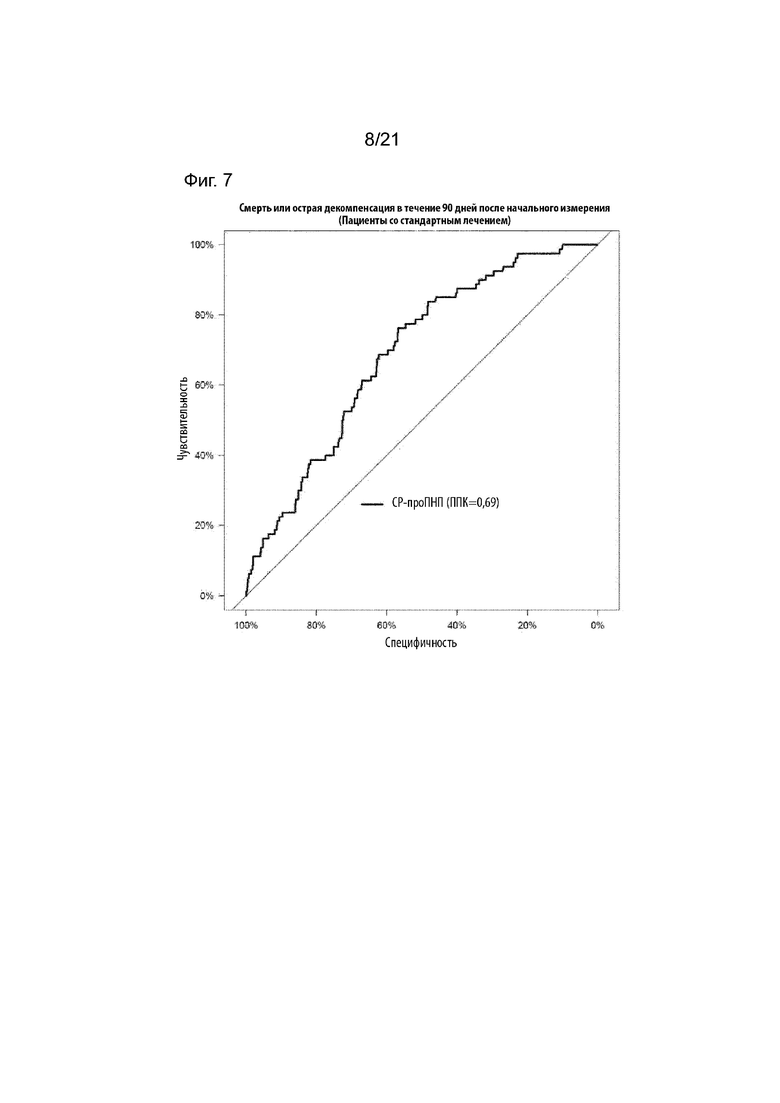





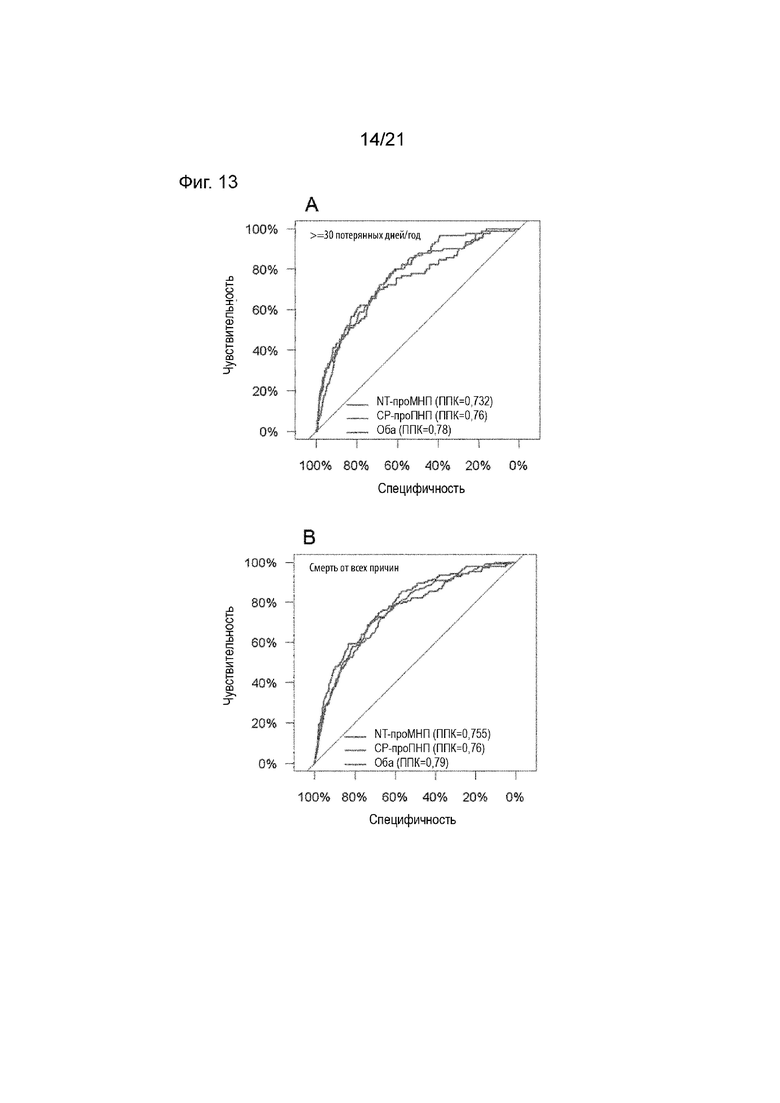
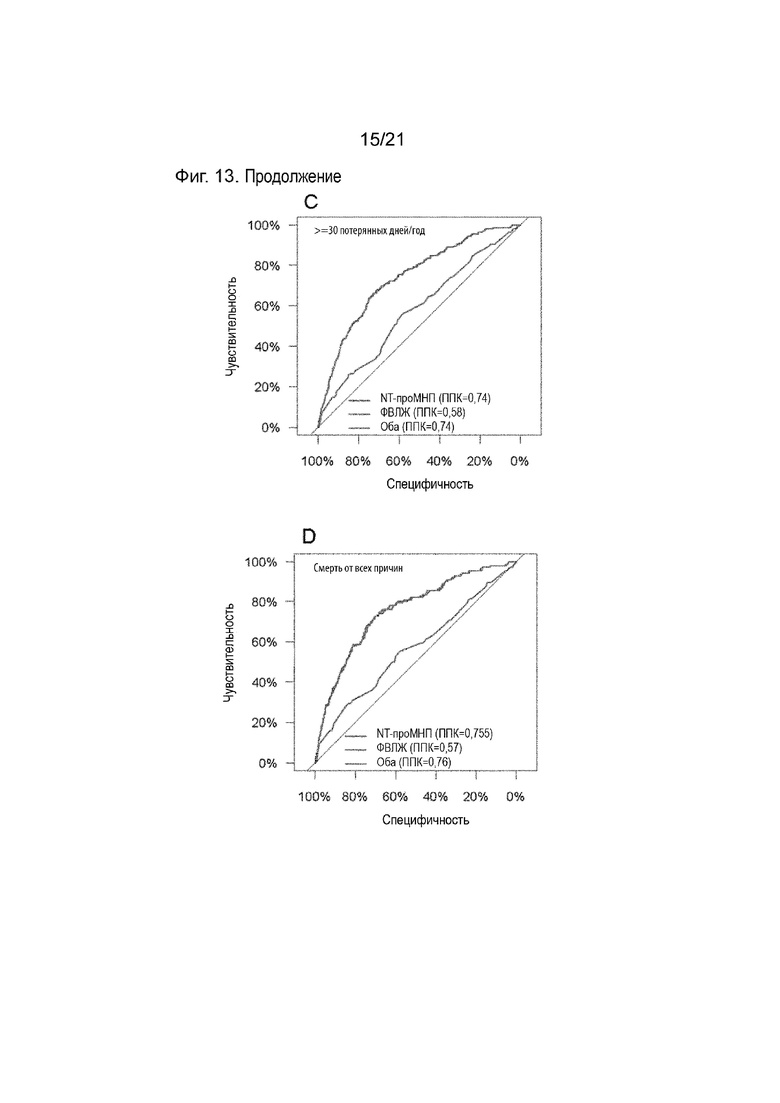

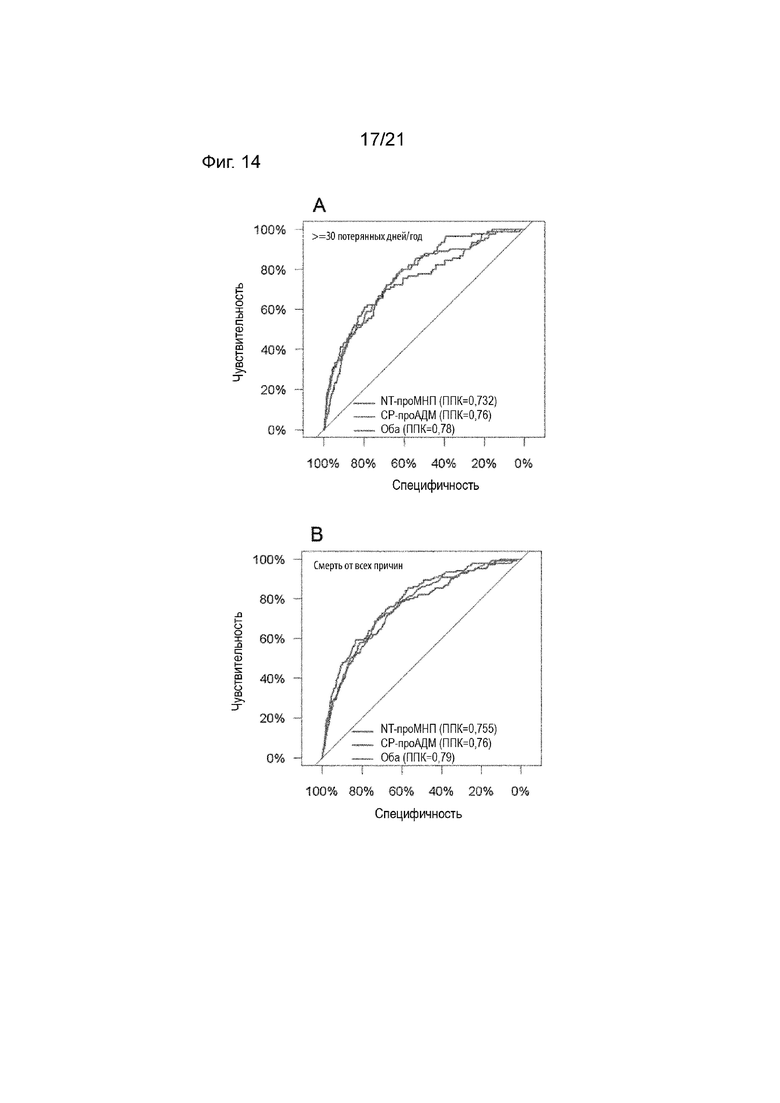



Предложенная группа изобретений относится к медицине, а именно к медицинской диагностике. Предложены способ и набор для оценки терапевтической пользы дистанционного ведения пациента с сердечной недостаточностью, включающий сравнение уровня по меньшей мере одного биомаркера, выбранного из группы, состоящей из среднерегионарного проадреномедуллина (СР-проАДМ), N-концевого натрийуретического пропептида B-типа (NT-проМНП) и/или среднерегионарного натрийуретического пропептида A-типа (СР-проПНП) с одним или несколькими референсными значениями, при этом указанный уровень по меньшей мере одного биомаркера указывает на целесообразность назначения или отказа от назначения дистанционного ведения для указанного пациента. Предложенная группа изобретений обеспечивает терапевтическую пользу дистанционного ведения пациента с сердечной недостаточностью за счет определения уровня СР-проАДМ, NT-проМНП и/или СР-проПНП в образце. 2 н. и 14 з.п. ф-лы, 15 ил., 20 табл., 3 пр.
1. Способ оценки терапевтической пользы дистанционного ведения пациента с диагнозом сердечно-сосудистого заболевания, где сердечно-сосудистое заболевание представляет собой сердечную недостаточность, включающий:
- получение по меньшей мере одного образца от указанного пациента,
- определение уровня по меньшей мере одного биомаркера, выбранного из группы, состоящей из среднерегионарного проадреномедуллина (СР-проАДМ), N-концевого натрийуретического пропептида B-типа (NT-проМНП) и/или среднерегионарного натрийуретического пропептида A-типа (СР-проПНП) в указанном по меньшей мере одном образце,
- сравнение указанного уровня по меньшей мере одного биомаркера с одним или несколькими референсными значениями, при этом указанный уровень по меньшей мере одного биомаркера указывает на целесообразность назначения или отказа от назначения дистанционного ведения для указанного пациента.
2. Способ по п. 1, где уровень низкой пользы по меньшей мере одного биомаркера указывает на нецелесообразность назначения дистанционного ведения пациента и/или где уровень высокой пользы по меньшей мере одного биомаркера указывает на целесообразность назначения дистанционного ведения пациента.
3. Способ по п. 2, где уровень низкой пользы по меньшей мере одного биомаркера указывает на нецелесообразность назначения дистанционного ведения в течение периода времени, составляющего по меньшей мере 10 дней, и/или где уровень высокой пользы по меньшей мере одного биомаркера указывает на целесообразность назначения дистанционного ведения пациента в течение периода времени по меньшей мере 10 дней.
4. Способ по п. 2 или 3, где уровень низкой пользы СР-проАДМ имеет величину ниже референсного значения и/или уровень высокой пользы СР-проАДМ имеет величину выше референсного значения, причем референсное значение выбирают из диапазона значений от 0,75 нмоль/л до 1,07 нмоль/л.
5. Способ по п. 2 или 3, где уровень низкой пользы NT-проМНП имеет величину ниже референсного значения и/или уровень высокой пользы NT-проМНП имеет величину выше референсного значения, причем референсное значение выбирают из диапазона значений от 237,6 пг/мл до 1595,8 пг/мл.
6. Способ по п. 2 или 3, где уровень низкой пользы СР-проПНП имеет величину ниже референсного значения и/или где уровень высокой пользы СР-проПНП имеет величину выше референсного значения, причем референсное значение выбирают из диапазона значений от 106,9 пмоль/л до 248,3 пмоль/л.
7. Способ по п. 1, где пациент госпитализировался в течение последних 12 месяцев по поводу сердечной недостаточности.
8. Способ по п. 1, где сердечно-сосудистое заболевание представляет собой сердечную недостаточность с повышенным риском неблагоприятного исхода.
9. Способ по п. 1, дополнительно включающий
определение по меньшей мере одного клинического параметра,
причем по меньшей мере один клинический параметр и уровень по меньшей мере одного биомаркера указывают на целесообразность назначения или отказа от назначения дистанционного ведения для указанного пациента.
10. Способ по п. 9, где по меньшей мере один клинический параметр представляет собой возраст, вес, индекс массы тела, пол, этническое происхождение, креатинин крови, фракцию выброса левого желудочка (ФВЛЖ), фракцию выброса правого желудочка (ФВПЖ), класс по NYHA, статус лечения, артериальное давление (систолическое/диастолическое), частоту сердечных сокращений, сердечный ритм по электрокардиограмме (ЭКГ), показатель сатурации периферической крови кислородом (SpO2), самооценку состояния здоровья (по шкале) или параметр, указывающий на функцию почек, например скорость клиренса креатинина и/или скорость клубочковой фильтрации (СКФ).
11. Способ по п. 10, где по меньшей мере один клинический параметр представляет собой параметр, указывающий на функцию почек.
12. Способ по п. 10 или 11, где по меньшей мере один клинический параметр представляет собой скорость клиренса креатинина и/или СКФ.
13. Способ по п. 1, где первый образец получают от пациента в первый момент времени, а второй образец получают от пациента во второй момент времени, при этом абсолютная разница, соотношение и/или скорость изменения уровня по меньшей мере одного биомаркера по отношению к первому и второму моментам времени указывает на целесообразность назначения или отказа от назначения дистанционного ведения для указанного пациента.
14. Способ по п. 1, где образец выбирают из группы, состоящей из образца крови, такого как образец цельной крови, образец сыворотки или образец плазмы, образца слюны и/или образца мочи.
15. Набор для осуществления способа по любому из пп. 1-14, включающий:
- детектирующие реагенты для определения по меньшей мере одного биомаркера, выбранного из группы, состоящей из СР-проАДМ, NT-проМНП и СР-проПНП в образце от пациента, и
- референсные данные, включающие референсные значения для определения того, является ли уровень по меньшей мере одного биомаркера показателем назначения или отказа от назначения дистанционного ведения пациента, причем указанные референсные данные хранятся на машиночитаемом носителе и/или используются в форме исполняемого компьютером кода, предназначенного для сравнения определяемого значения по меньшей мере одного биомаркера с референсными значениями.
16. Набор по п. 15, дополнительно включающий детектирующие реагенты для определения уровня по меньшей мере одного дополнительного биомаркера в образце от пациента и/или средства для определения по меньшей мере одного клинического параметра, а также референсные данные, включающие референсные значения для определения того, указывает ли уровень по меньшей мере одного дополнительного биомаркера и/или по меньшей мере одного клинического параметра на целесообразность назначения или отказа от назначения дистанционного ведения пациента, при этом указанные референсные данные хранятся на машиночитаемом носителе и/или имеют форму исполняемого компьютером кода, предназначенного для сравнения определяемых уровней указанного по меньшей мере одного биомаркера и/или указанного по меньшей мере одного клинического параметра с референсными значениями.
| WO 2018141840 A1, 09.08.2018 | |||
| Сердечно-сосудистые заболевания | |||
| Всемирная организация здравоохранения | |||
| Насос | 1917 |
|
SU13A1 |
| Видоизменение прибора с двумя приемами для рассматривания проекционные увеличенных и удаленных от зрителя стереограмм | 1919 |
|
SU28A1 |
Авторы
Даты
2024-06-28—Публикация
2020-03-27—Подача