РОДСТВЕННЫЕ ЗАЯВКИ
[0001] Данная заявка испрашивает приоритет согласно 35 U.S.C. § 119(e) по предварительной заявке США № 62/797803, поданной 28 января 2019 г., и предварительной заявке США № 62/809404, поданной 22 февраля 2019 г., полное содержание которых включено в данный документ посредством ссылки.
ОБЛАСТЬ ТЕХНИКИ
[0002] В данном документе описаны способы лечения поражений кожи и зуда у субъекта, имеющего хроническую почесуху (ХП), включая узловатую почесуху (УП), фармацевтические композиции для применения в лечении поражений кожи и зуда у субъекта, имеющего ХП, применения немолизумаба или его эквивалента в производстве лекарственного средства для лечения поражений кожи и зуда у субъекта, имеющего ХП.
УРОВЕНЬ ТЕХНИКИ
[0003] Нижеследующее обсуждение приведено, чтобы помочь читателю понять изобретение, и не признается таким, которое описывает или составляет известный уровень техники.
[0004] Хроническая почесуха (ХП) представляет собой кожное заболевание вследствие нейрональной сенсибилизации к зуду и развитию цикла зуд - расчесывание. Узловатая почесуха (УП) является подтипом ХП и представляет собой кожное заболевание, которое приводит к образованию на коже твердых зудящих уплотнений (узелков). Зуд (зуд)может быть интенсивным, заставляя людей расчесывать себя до крови или болевого ощущения. Расчесывание может приводить к появлению дополнительных поражений кожи. Зуд ухудшается при повышении температуры, потении или раздражении от одежды. В некоторых случаях люди с УП имеют в анамнезе другие заболевания, включая экзему (атопический дерматит), диабет, лимфому, ВИЧ-инфекцию, тяжелую анемию или заболевание почек.
[0005] Точная причина ХП или УП неизвестна. Хотя известно, что расчесывание приводит к появлению большего числа узелков, непонятно, что изначально вызывает зуд. Диагноз заболевания основан на констатации признаков, таких как чрезвычайно зудящая кожа с образованием узелков. В некоторых случаях, чтобы подтвердить диагноз, используют биопсию кожи. Имеющееся на сегодня лечение может включать крема с кортикостероидами, пероральные лекарственные средства, криотерапию или фотохимиотерапию.
[0006] Остается потребность в разработке новых терапевтических схем для лечения пациентов с УП, в частности, страдающих хронической почесухой.
КРАТКОЕ ОПИСАНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
[0007] В данном документе предложены способы лечения поражений кожи и зуда у субъекта, имеющего хроническую почесуху (ХП), включая узловатую почесуху (УП), фармацевтические композиции для применения в лечении поражений кожи и зуда у субъекта, имеющего ХП, включая УП, применения немолизумаба или его эквивалента в производстве лекарственного средства для лечения поражений кожи и зуда у субъекта, имеющего ХП, включая УП.
[0008] В соответствии с некоторыми вариантами осуществления предложены способы лечения поражений кожи и зуда у субъекта, имеющего ХП, включающие, состоящие из или состоящие преимущественно из введения субъекту эффективного количества немолизумаба или его эквивалента.
[0009] В некоторых вариантах осуществления способов субъект имеет узловатую почесуху (УП). В некоторых вариантах осуществления способов УП диагностирована у субъекта в течение по меньшей мере около 6 месяцев. В конкретных вариантах осуществления способов субъект имеет по меньшей мере около 20 узелков на своем теле с двухсторонним распределением. В конкретных вариантах осуществления способов субъект имеет связанные с почесухой поражения на верхних конечностях с поражениями на туловище или нижних конечностях или без них. В конкретных вариантах осуществления способов зуду приписана оценка по меньшей мере 4, тогда как в некоторых вариантах осуществления зуду приписана оценка по меньшей мере 7 по цифровой рейтинговой шкале (ЦРШ). В конкретных вариантах осуществления способов среднее значение оценки ЦРШ для наихудшей суточной интенсивности составляет по меньшей мере 7 в течение предыдущих 3 суток. В других конкретных вариантах осуществления способов среднее значение оценки ЦРШ для наихудшей суточной интенсивности составляет по меньшей мере 7 в течение предыдущей недели.
[0010] В некоторых вариантах осуществления способов субъект не имеет атопический дерматит. В некоторых вариантах осуществления способов субъект не имеет хроническую почесуху в результате патологического состояния, отличного от УП, такого как чесотка, укус насекомого, простой хронический лишай, псориаз, акне, фолликулит, привычная дерматилломания, лимфоматоидный папулез, хронический лучевой дерматит, герпетиформный дерматит, споротрихоз, буллезное заболевание. В некоторых вариантах осуществления способов субъект не имеет невропатическую или психогенную почесуху, такую как парестетическая ноталгия, плечелучевая почесуха, дилюционный паразитоз, патомимия.
[0011] В некоторых вариантах осуществления способов эффективное количество немолизумаба или его эквивалента находится в диапазоне от около 0,01 мг/кг до около 0,1 мг/кг, от около 0,1 мг/кг до около 0,5 мг/кг, от около 0,5 мг/кг до около 1,5 мг/кг, от около 1,5 мг/кг до около 2,5 мг/кг или от около 2,5 мг/кг до около 10 мг/кг. В конкретных вариантах осуществления эффективное количество немолизумаба или его эквивалента составляет около 0,1 мг/кг, около 0,5 мг/кг, около 1 мг/кг, около 1,5 мг/кг, около 2 мг/кг или около 2,5 мг/кг. В конкретных вариантах осуществления эффективное количество немолизумаба или его эквивалента составляет постоянную дозу 40 мг. В других конкретных вариантах осуществления эффективное количество немолизумаба или его эквивалента составляет 30 мг с нагрузочной дозой 60 мг. В других конкретных вариантах осуществления эффективное количество немолизумаба или его эквивалента составляет постоянную дозу 6 60 мг, которую вводят один раз каждые 4 недели. В некоторых вариантах осуществления способов немолизумаб или его эквивалент вводят местным или парентеральным путем. В некоторых вариантах осуществления способов немолизумаб или его эквивалент вводят подкожно. В некоторых вариантах осуществления немолизумаб или его эквивалент вводят один раз в неделю, один раз в две недели, один раз в три недели, один раз в четыре недели, один раз в пять недель, один раз в шесть недель, один раз в семь недель или один раз в восемь недель. В определенных вариантах осуществления немолизумаб вводят в течение периода, составляющего по меньшей мере 2 недели, 3 недели, 1 месяц, 1,5 месяца, 2 месяца, 3 месяца, 4 месяца, 5 месяцев, 6 месяцев или больше.
[0012] В соответствии с некоторыми вариантами осуществления предложены фармацевтические композиции для применения в лечении поражений кожи и зуда у субъекта, имеющего хроническую почесуху (ХП), содержащие, состоящие из или состоящие преимущественно из немолизумаба или его эквивалента.
[0013] В некоторых вариантах осуществления фармацевтических композиций субъект имеет узловатую почесуху (УП). В некоторых вариантах осуществления композиций УП диагностирована у субъекта в течение по меньшей мере около 6 месяцев. В конкретных вариантах осуществления композиций субъект имеет по меньшей мере около 20 узелков на своем теле с двухсторонним распределением. В конкретных вариантах осуществления композиций субъект имеет связанные с почесухой поражения на верхних конечностях с поражениями на туловище или нижних конечностях или без них. В конкретных вариантах осуществления композиций зуду приписана оценка по меньшей мере 4, тогда как в некоторых вариантах осуществления зуду приписана оценка по меньшей мере 7 по цифровой рейтинговой шкале (ЦРШ). В конкретных вариантах осуществления композиций среднее значение оценки ЦРШ для наихудшей суточной интенсивности составляет по меньшей мере 7 в течение предыдущих 3 суток. В других конкретных вариантах осуществления композиций среднее значение оценки ЦРШ для наихудшей суточной интенсивности составляет по меньшей мере 7 в течение предыдущей недели.
[0014] В некоторых вариантах осуществления фармацевтических композиций субъект не имеет атопический дерматит. В некоторых вариантах осуществления композиций субъект не имеет хроническую почесуху в результате патологического состояния, отличного от УП, такого как чесотка, укус насекомого, простой хронический лишай, псориаз, акне, фолликулит, привычная дерматилломания, лимфоматоидный папулез, хронический лучевой дерматит, герпетиформный дерматит, споротрихоз, буллезное заболевание. В некоторых вариантах осуществления композиций субъект не имеет невропатическую или психогенную почесуху, такую как парестетическая ноталгия, плечелучевая почесуха, дилюционный паразитоз, патомимия.
[0015] В некоторых вариантах осуществления фармацевтическая композиция дополнительно содержит носитель. В некоторых вариантах осуществления носитель представляет собой фармацевтически приемлемый носитель.
[0016] В некоторых вариантах осуществления фармацевтических композиций немолизумаб или его эквивалент вводят в соответствии со схемой с постоянной дозой, тогда как в некоторых вариантах осуществления немолизумаб или его эквивалент вводят в соответствии со схемой с нагрузочной дозой, в которой нагрузочная доза может быть выше, чем последующие серийные дозы (например, нагрузочная доза 60 мг, за которой следуют серийные дозы по 30 мг).
[0017] В некоторых вариантах осуществления фармацевтических композиций немолизумаб или его эквивалент вводят в дозе от около 0,01 мг/кг до около 0,1 мг/кг, от около 0,1 мг/кг до около 0,5 мг/кг, от около 0,5 мг/кг до около 1,5 мг/кг, от около 1,5 мг/кг до около 2,5 мг/кг или от около 2,5 мг/кг до около 10 мг/кг, тогда как в некоторых вариантах осуществления немолизумаб или его эквивалент вводят в дозе около 10 мг, около 15 мг, около 20 мг, около 25 мг, около 30 мг, около 35 мг, около 40 мг, около 45 мг, около 50 мг, около 55 мг, около 60 мг, около 65 мг, около 70 мг, около 75 мг, около 80 мг, около 85 мг, около 90 мг немолизумаба или его эквивалента.
[0018] В соответствии с некоторыми вариантами осуществления предложены применения немолизумаба или его эквивалента в производстве лекарственного средства для лечения почесухи у субъекта, имеющего УП.
[0019] В некоторых вариантах осуществления применений почесуха является умеренной или тяжелой. В некоторых вариантах осуществления применений УП диагностирована у субъекта в течение по меньшей мере 6 месяцев. В конкретных вариантах осуществления применений субъект имеет по меньшей мере 20 узелков на своем теле с двухсторонним распределением. В конкретных вариантах осуществления применений субъект имеет связанные с почесухой поражения на верхних конечностях с поражениями на туловище или нижних конечностях или без них. В конкретных вариантах осуществления применений зуду приписана оценка по меньшей мере 4, тогда как в некоторых вариантах осуществления зуду приписана оценка по меньшей мере 7 по цифровой рейтинговой шкале (ЦРШ). В конкретных вариантах осуществления применений среднее значение оценки ЦРШ для наихудшей суточной интенсивности составляет по меньшей мере 7 в течение предыдущих 3 суток. В других конкретных вариантах осуществления применений среднее значение оценки ЦРШ для наихудшей суточной интенсивности составляет по меньшей мере 7 в течение предыдущей недели.
[0020] В некоторых вариантах осуществления применений субъект не имеет атопический дерматит. В некоторых вариантах осуществления применений субъект не имеет хроническую почесуху в результате патологического состояния, отличного от УП, такого как чесотка, укус насекомого, простой хронический лишай, псориаз, акне, фолликулит, привычная дерматилломания, лимфоматоидный папулез, хронический лучевой дерматит, герпетиформный дерматит, споротрихоз, буллезное заболевание. В некоторых вариантах осуществления применений субъект не имеет невропатическую или психогенную почесуху, такую как парестетическая ноталгия, плечелучевая почесуха, дилюционный паразитоз, патомимия.
[0021] В некоторых вариантах осуществления применений немолизумаб или его эквивалент вводят в соответствии со схемой с постоянной дозой, тогда как в некоторых вариантах осуществления немолизумаб или его эквивалент вводят в соответствии со схемой с нагрузочной дозой, в которой нагрузочная доза может быть выше, чем последующие серийные дозы (например, нагрузочная доза 60 мг, за которой следуют серийные дозы по 30 мг).
[0022] В некоторых вариантах осуществления применений немолизумаб или его эквивалент вводят в дозе от около 0,01 мг/кг до около 0,1 мг/кг, от около 0,1 мг/кг до около 0,5 мг/кг, от около 0,5 мг/кг до около 1,5 мг/кг, от около 1,5 мг/кг до около 2,5 мг/кг или от около 2,5 мг/кг до около 10 мг/кг, тогда как в некоторых вариантах осуществления немолизумаб или его эквивалент вводят в дозе около 10 мг, около 15 мг, около 20 мг, около 25 мг, около 30 мг, около 35 мг, около 40 мг, около 45 мг, около 50 мг, около 55 мг, около 60 мг, около 65 мг, около 70 мг, около 75 мг, около 80 мг, около 85 мг, около 90 мг немолизумаба или его эквивалента.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
[0023] Фиг. 1 Обзор клинического исследования лечения почесухи у пациентов, имеющих узловатую почесуху (УП), немолизумабом. Многоцентровое (20 центров в ЕС и США), рандомизированное, двойное слепое, плацебо-контролируемое исследование в параллельных группах проводили приблизительно с 70 пациентами, рандомизированными на 2 группы (по 35 на группу) и стратифицированными на фоне атопии. Включенные пациенты получали немолизумаб или плацебо в дозе 0,5 мг/кг каждые 4 недели от исходного уровня до 8 недели.
[0024] Фиг. 2 иллюстрирует процентное изменение относительно исходного уровня недельной средней оценки максимального зуда по цифровой рейтинговой шкале (ЦРШ) на 4 неделе.
[0025] Фиг. 3 иллюстрирует процентное изменение относительно исходного уровня недельной средней оценки ЦРШ максимального зуда в течение 18 недель.
[0026] Фиг. 4 иллюстрирует абсолютное изменение относительно исходного уровня недельной средней оценки ЦРШ максимального зуда в течение 18 недель.
[0027] Фиг. 5 иллюстрирует абсолютное изменение относительно исходного уровня недельной средней оценки ЦРШ максимального зуда в течение 18 недель у пациентов без атопии.
[0028] Фиг. 6 иллюстрирует абсолютное изменение относительно исходного уровня недельной средней оценки ЦРШ максимального зуда в течение 18 недель у пациентов с атопией.
[0029] Фиг. 7 иллюстрирует долю субъектов, достигших успеха по общей оценке исследователя (ООИ) (0/1). Значения общей оценки исследователя (ООИ) находятся в диапазоне от 0 (чисто) до 4 (тяжелое заболевание) и представлены как процентная доля пациентов в указанной популяции.
[0030] Фиг. 8 иллюстрирует распределение ООИ у пациентов в течение 18 недель лечения.
[0031] Фиг. 9 иллюстрирует процентное изменение по вербальной рейтинговой шкале (ВРШ) в течение 18 недель лечения. Вербальная рейтинговая шкала (ВРШ) представляет собой одномерную шкалу, которая дает возможность пациентам описывать интенсивность зуда посредством постепенно возрастающих характеристик.
[0032] Фиг. 10 иллюстрирует пациентов с ответом по дерматологическому индексу качества жизни (ДИКЖ) (≥ 4) на 4 неделе и на 12 неделе. Оценки дерматологического индекса качества жизни (ДИКЖ) находятся в диапазоне от 0 до 30, при этом более высокие оценки указывают на более низкое качество жизни.
[0033] Фиг. 11 иллюстрирует изменение относительно исходного уровня ДИКЖ на 4 неделе и на 12 неделе.
[0034] Фиг. 12 иллюстрирует сравнение изображения всего тела пациентов до лечения немолизумабом (A и C) и после лечения в течение 16 недель (B и D).
[0035] Фиг. 13 иллюстрирует сравнение изображения всего тела пациентов до лечения немолизумабом (A и C) и после лечения в течение 16 недель (B и D).
[0036] Фиг. 14 иллюстрирует сравнение изображения всего тела пациентов до лечения немолизумабом (A и C) и после лечения в течение 16 недель (B и D).
[0037] Фиг. 15 иллюстрирует процентное изменение оценки зуда по цифровой рейтинговой шкале (ЦРШ) в течение 18 недель лечения.
[0038] Фиг. 16 иллюстрирует долю субъектов с оценкой активности почесухи (ОАП) 75%, излеченных течение 18 недель лечения.
[0039] Фиг. 17 иллюстрирует долю субъектов с оценкой активности почесухи (ОАП) 50%, излеченных течение 18 недель лечения.
[0040] Фиг. 18 иллюстрирует долю субъектов с оценкой активности почесухи (ОАП) 0-24%, излеченных течение 18 недель лечения.
[0041] Фиг. 19 иллюстрирует процентное изменение относительно исходного уровня нарушения сна по ЦРШ на 4 неделе.
[0042] Фиг. 20 иллюстрирует процентное изменение нарушения сна по ЦРШ на 4 неделе.
ПОДРОБНОЕ ОПИСАНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
[0043] Далее варианты осуществления в соответствии с настоящим изобретением будут описаны более полно. При этом аспекты изобретения можно осуществлять в разных формах, и их не следует воспринимать как ограниченные вариантами осуществления, приведенными в данном документе. Скорее, эти варианты осуществления приведены, чтобы данное описание было доскональным и полным и в полной мере передавало объем изобретения для специалистов в данной области техники. Терминология, используемая в описании в данном документе, предназначена только для описания конкретных вариантов осуществления и не подразумевает ограничения.
[0044] Если не указано иное, все употребляемые в данном документе термины (включая технические и научные термины) имеют те же значения, которые обычно понимаются специалистом в области техники, к которой относится это изобретение. Следует дополнительно понимать, что термины, такие как термины, определенные в общепринятых справочниках, следует интерпретировать как имеющие значения, согласующиеся с их значениями в контексте представленной заявки и релевантного уровня техники, и не следует интерпретировать в идеализированном или слишком формальном смысле, если это явно не определено в данном документе. Хотя они явным образом не определены ниже, эти термины следует интерпретировать в соответствии с их общепринятым значением.
[0045] Терминология, используемая в описании в данном документе, предназначена только для описания конкретных вариантов осуществления и не подразумевает ограничения изобретения. Все публикации, патентные заявки, патенты и другие литературные источники, упоминаемые в данном документе, в полном объеме включены посредством ссылки.
[0046] Если из контекста не следует иное, явным образом подразумевается, что различные признаки изобретения, описанные в данном документе, можно использовать в любой комбинации. Кроме того, в изобретении также предусмотрено, что в некоторых вариантах осуществления любые признак или комбинация признаков, приведенные в данном документе, могут быть исключены или опущены. В качестве иллюстрации, если в тексте указано, что комплекс содержит компоненты A, B и C, явным образом подразумевается, что любой из A, B или C или их комбинация могут быть опущены и исключены по отдельности или в любой комбинации.
[0047] Если явным образом не указано иное, подразумевается, что все конкретные варианты осуществления, признаки и термины включают как указанные вариант осуществления, признак или термин, так и их биологические эквиваленты.
Определения
[0048] В контексте данного документа формы единственного числа обозначают как единственное, так и множественное число, если явно не указано, что они обозначают исключительно единственное число.
[0049] Следует понимать, что, хотя это не всегда указано в явном виде, всем числовым обозначениям предшествует термин «около». Термин «около» означает, что включенное число не ограничено конкретным числом, приведенным в данном документе, и подразумевает, что оно относится к числам, приближенным к указанному числу, не выходя при этом за рамки объема изобретения. В контексте данного документа термин «около» будет понятен специалистам в данной области техники и будет в некоторой степени варьироваться в зависимости от контекста, в котором он используется. В случае использования этого термина, которое не понятно специалистам в данной области техники в том контексте, в котором он используется, «около» означает плюс или минус 15%, 10%, 5%, 1% или 0,1% от конкретного термина.
[0050] Также в контексте данного документа термин «и/или» относится к и включает каждую и все возможные комбинации одного или более связанных перечисляемых элементов, а также отсутствие комбинаций при интерпретации в качестве альтернативного варианта («или»).
[0051] В контексте данного документа термины «вводить» или «введение» относятся к (1) обеспечению, предоставлению, дозированию и/или предписанию, например, работником здравоохранения или его или ее уполномоченным агентом, или под его руководством, и (2) введению, приему или употреблению, например, работником здравоохранения или субъектом. Введение включает, без ограничения, введение пероральным, парентеральным (например, с помощью внутримышечной, внутрибрюшинной, внутривенной, ИЦВ, интрацистернальной инъекции или инфузии, подкожной инъекции или имплантата), назальным посредством ингаляционного спрея, вагинальным, ректальным, подъязычным, уретральным (например, с помощью уретрального суппозитория) или местным путями введения (например, геля, мази, крема, аэрозоля и т. д.), и может быть составлено, отдельно или вместе, в подходящих составах с единичной дозировкой, содержащих традиционные нетоксичные фармацевтически приемлемые носители, адъюванты, эксципиенты и базовые растворы для каждого пути введения. Изобретение не ограничено путем введения, составом или режимом дозирования.
[0052] В контексте данного документа термины «лечить» или «лечение» включают облегчение, смягчение или ослабление УП, почесухи или одного или более их симптомов, вне зависимости от того, считаются ли УП и/или почесуха «излеченными» или «исцеленными», и вне зависимости от того, разрешены ли все симптомы. Эти термины также включают снижение или предотвращение прогрессирования УП и/или почесухи или одного или более их симптомов, сдерживание или предотвращение основного механизма УП и/или почесухи или одного или более их симптомов и достижение любой терапевтической и/или профилактической пользы.
[0053] Субъединица альфа рецептора интерлейкина 31 («IL-31RA», также известная как NR10, glm-r и GPL) представляет собой белок, который образует гетеродимер с рецептором онкостатина M (OSMR) и функционирует как рецептор IL-31. Существует несколько известных сплайс-вариантов человеческого IL-31RA (WO 00/075314): NR10.1 состоит из 662 аминокислот и содержит трансмембранный домен. NR10.2 представляет собой растворимый подобный рецептору белок, состоящий из 252 аминокислот без трансмембранного домена. В то же время известные сплайс-варианты IL-31RA, которые функционируют как белки трансмембранных рецепторов, включают NR10.3 и IL-31RAv3. Предпочтительные варианты IL-31RA включают NR10.3 (также называемый ILRAv4 (Nat Immunol 5, 752-60, 2004) и IL-31RAv3. NR 10.3 (IL31RAv4) состоит из 662 аминокислот (WO 00/075314; Nat Immunol 5, 752-60, 2004), а IL31RAv3 состоит из 732 аминокислот (номер доступа GenBank №: NM-139017).
[0054] Аминокислотная последовательность IL31RAv4 представляет собой:
MKLSPQPSCVNLGMMWTWALWMLPSLCKFSLAALPAKPENISCVYYYRKNLTCTWSPGKETSYTQYTVKRTYAFGEKHDNCTTNSSTSENRASCSFFLPRITIPDNYTIEVEAENGDGVIKSHMTYWRLENIAKTEPPKIFRVKPVLGIKRMIQIEWIKPELAPVSSDLKYTLRFRTVNSTSWMEVNFAKNRKDKNQTYNLTGLQPFTEYVIALRCAVKESKFWSDWSQEKMGMTEEEAPCGLELWRVLKPAEADGRRPVRLLWKKARGAPVLEKTLGYNIWYYPESNTNLTETMNTTNQQLELHLGGESFWVSMISYNSLGKSPVATLRIPAIQEKSFQCIEVMQACVAEDQLVVKWQSSALDVNTWMIEWFPDVDSEPTTLSWESVSQATNWTIQQDKLKPFWCYNISVYPMLHDKVGEPYSIQAYAKEGVPSEGPETKVENIGVKTVTITWKEIPKSERKGIICNYTIFYQAEGGKGFSKTVNSSILQYGLESLKRKTSYIVQVMASTSAGGTNGTSINFKTLSFSVFEIILITSLIGGGLLILIILTVAYGLKKPNKLTHLCWPTVPNPAESSIATWHGDDFKDKLNLKESDDSVNTEDRILKPCSTPSDKLVIDKLVVNFGNVLQEIFTDEARTGQENNLGGEKNGTRILSSCPTSI (SEQ ID NO: 1)
[0055] Аминокислотная последовательность IL31RAv3 представляет собой:
MMWTWALWMLPSLCKFSLAALPAKPENISCVYYYRKNLTCTWSPGKETSYTQYTVKRTYAFGEKHDNCTTNSSTSENRASCSFFLPRITIPDNYTIEVEAENGDGVIKSHMTYWRLENIAKTEPPKIFRVKPVLGIKRMIQIEWIKPELAPVSSDLKYTLRFRTVNSTSWMEVNFAKNRKDKNQTYNLTGLQPFTEYVIALRCAVKESKFWSDWSQEKMGMTEEEAPCGLELWRVLKPAEADGRRPVRLLWKKARGAPVLEKTLGYNIWYYPESNTNLTETMNTTNQQLELHLGGESFWVSMISYNSLGKSPVATLRIPAIQEKSFQCIEVMQACVAEDQLVVKWQSSALDVNTWMIEWFPDVDSEPTTLSWESVSQATNWTIQQDKLKPFWCYNISVYPMLHDKVGEPYSIQAYAKEGVPSEGPETKVENIGVKTVTITWKEIPKSERKGIICNYTIFYQAEGGKGFSKTVNSSILQYGLESLKRKTSYIVQVMASTSAGGTNGTSINFKTLSFSVFEIILITSLIGGGLLILIILTVAYGLKKPNKLTHLCWPTVPNPAESSIATWHGDDFKDKLNLKESDDSVNTEDRILKPCSTPSDKLVIDKLVVNFGNVLQEIFTDEARTGQENNLGGEKNGYVTCPFRPDCPLGKSFEELPVSPEIPPRKSQYLRSRMPEGTRPEAKEQLLFSGQSLVPDHLCEEGAPNPYLKNSVTAREFLVSEKLPEHTKGEV (SEQ ID NO: 2)
[0056] Мышиный IL-31RA включает белки, содержащие аминокислотную последовательность:
MWTLALWAFSFLCKFSLAVLPTKPENISCVFYFDRNLTCTWRPEKETNDTSYIVTLTYSYGKSNYSDNATEASYSFPRSCAMPPDICSVEVQAQNGDGKVKSDITYWHLISIAKTEPPIILSVNPICNRMFQIQWKPREKTRGFPLVCMLRFRTVNSSRWTEVNFENCKQVCNLTGLQAFTEYVLALRFRFNDSRYWSKWSKEETRVTMEEVPHVLDLWRILEPADMNGDRKVRLLWKKARGAPVLEKTFGYHIQYFAENSTNLTEINNITTQQYELLLMSQAHSVSVTSFNSLGKSQEAILRIPDVHEKTFQYIKSMKAYIAEPLLVVNWQSSIPAVDTWIVEWLPEAAMSKFPALSWESVSQVTNWTIEQDKLKPFTCYNISVYPVLGHRVGEPYSIQAYAKEGTPLKGPETRVENIGLRTATITWKEIPKSARNGFINNYTVFYQAEGGKELSKTVNSHALQCDLESLTRRTSYTVWVMASTRAGGTNGVRINFKTLSISVFEIVLLTSLVGGGLLLLSIKTVTFGLRKPNRLTPLCCPDVPNPAESSLATWLGDGFKKSNMKETGNSGDTEDVVLKPCPVPADLIDKLVVNFENFLEVVLTEEAGKGQASILGGEANEYVTSPSRPDGPPGKSFKEPSVLTEVASEDSHSTCSRMADEAYSELARQPSSSCQSPGLSPPREDQAQNPYLKNSVTTREFLVHENIPEHSKGEV (SEQ ID NO: 3)
[0057] IL-31RA яванского макака включает белки, содержащие аминокислотную последовательность:
MMWTWALWMFPLLCKFGLAALPAKPENISCVYYYRKNLTCTWSPGKETSYTQYTAKRTYAFGKKHDNCTTSSSTSENRASCSFFLPRITIPDNYTIEVEAENGDGVIKSDMTCWRLEDIAKTEPPEIFSVKPVLGIKRMIRIEWIKPELAPVSSDLKYALRFRTVNSTSWMEVNFAKNRKDTNQTYNLMGLQAFTEYVVALRCAVKESKFWSDWSQEKMGMTEEEAPCGLELWRVLKPTEVDGRRPVRLLWKKARGAPVLEKTLGYNIWYFPENNTNLTETVNTTNQQLELHLGGESYWVSMISYNSLGKSPVTTLRIPAIQEKSFRCIEVMQACLAEDQLVVKWQSSALDVNTWMIEWFPDMDSEHPTLSWESVSQATNWTIQQDKLKPFWCYNISVYPMLHDKVGEPYSIQAYAKEGIPSKGPETKVENIGVKTVTITWKEIPKSERKGIICNYTIFYQAEGGKGFSKTVNSSILQYGLESLKRKTSYTVRVMASTSAGGINGTSINFKTLSFSVFEIILITSLIGGGLLILIILTVAYGLKKPNKLTHLCWPSVPNPAESSIATWRGDDFKDKLNLKESDDSVNTEDRILKPCSTPSDKLVIDKSVVNFGNVLQEMFTDEARTGQENNLGGEKNEYVTHPFRADCPLGKSFEELPVSPEIPPRKSQYLRSRMPEGTCLEAEEQLLVSGQSLESLAPDHVREAAAPNPYLKNSVTTREFLVSQKLPEHTKGEV (SEQ ID NO: 4)
[0058] В контексте данного документа термин «субъект» используется взаимозаменяемо с термином «пациент» и означает млекопитающее, в частности человека, представителя лошадиных, бычьих, свиных, кошачьих, собачьих, мышь, крысу или отличного от человека примата. В предпочтительных вариантах осуществления субъект представляет собой человека. В некоторых вариантах осуществления УП диагностирована у субъекта в течение по меньшей мере 6 месяцев. В конкретных вариантах осуществления субъект имеет по меньшей мере 20 узелков на своем теле с двухсторонним распределением. В конкретных вариантах осуществления субъект имеет связанные с почесухой поражения на верхних конечностях с поражениями на туловище или нижних конечностях или без них. В конкретных вариантах осуществления субъект имеет зуд, которому была приписана оценка по меньшей мере 7 по цифровой рейтинговой шкале (ЦРШ). В конкретных вариантах осуществления среднее значение оценки ЦРШ для наихудшей суточной интенсивности составляет по меньшей мере 7 в течение предыдущих 3 суток. В других конкретных вариантах осуществления среднее значение оценки ЦРШ для наихудшей суточной интенсивности составляет по меньшей мере 7 в течение предыдущей недели.
[0059] В некоторых вариантах осуществления субъект не имеет атопический дерматит. В некоторых вариантах осуществления субъект не имеет хроническую почесуху в результате патологического состояния, отличного от УП, такого как чесотка, укус насекомого, простой хронический лишай, псориаз, акне, фолликулит, привычная дерматилломания, лимфоматоидный папулез, хронический лучевой дерматит, герпетиформный дерматит, споротрихоз, буллезное заболевание. В некоторых вариантах осуществления субъект не имеет невропатическую или психогенную почесуху, такую как парестетическая ноталгия, плечелучевая почесуха, дилюционный паразитоз, патомимия.
[0060] В контексте данного документа термин «хроническая почесуха» или («ХП») соответствует определению в данной области техники и означает выраженное заболевание, определяемое наличием хронического зуда и множественных локализованных или генерализованных связанных с почесухой поражений. Состояние хронического зуда характеризуется наличием содранных, чешуйчатых или корковых бляшек и/или папул, и/или узелков, часто с беловатым или розовым центром и гиперпигментированными краями и рубцами. Существует четыре подтипа хронического зуда: узловатый тип (узловатая почесуха или УП), папулезный тип (папулезная почесуха), бляшечный тип и вдавленный тип (тип Кирле). ХП возникает вследствие нейрональной сенсибилизации к зуду и развитию цикла зуд - расчесывание. ХП может иметь дерматологическое, системное, неврологическое, психиатрическое/психосоматическое, многофакторное или неопределенное происхождение. Термин ХП включает все стадии и проявления хронической почесухи. Наиболее известным подтипом ХП является узловатая почесуха (УП). Смотрите Pereira et al., Journal of European Academy of Dermatology and Venereology (2018) 32:1059-1065.
[0061] В контексте данного документа термин «узловатая почесуха» (или «УП») соответствует определению в данной области техники и означает кожное заболевание, которое приводит к образованию на коже твердых зудящих уплотнений (узелков). Зуд (зуд) может быть интенсивным, заставляя людей расчесывать себя до крови или болевого ощущения. Расчесывание может приводить к появлению дополнительных поражений кожи. Зуд ухудшается при повышении температуры, потении или раздражении от одежды. В некоторых случаях люди с УП имеют в анамнезе другие заболевания, включая экзему (атопический дерматит), диабет, лимфому, ВИЧ-инфекцию, тяжелую анемию или заболевание почек. Точная причина УП не до конца понятна. Считается, что узелки вероятнее всего образуются, когда кожа была некоторым образом расцарапана или раздражена. Следовательно, действия человека, расчесывающего кожу, могут привести к образованию узелков. Однако причина, по которой кожа становится интенсивно зудящей, неясна. Многие люди с УП имеют в анамнезе экзему (атопический дерматит), другие патологические состояния кожи или аллергии. Основным симптомом узловатой почесухи (УП) является образование на коже твердых сильно зудящих уплотнений (узелков). Размер узелков может находиться в диапазоне от очень маленьких до около половины дюйма в диаметре. Узелки часто имеют жесткую, сухую поверхность, а их количество может находится в диапазоне от нескольких до сотен. Наиболее часто узелки образуются на внешней стороне рук, плеч и ног. Узелки также могут образовываться на шее и туловище и редко образуются на лице и ладонях. По цвету они могут быть светлее или темнее окружающей кожи. После того, как узелки начинают заживать, может возникать рубцевание. Симптомы УП могут появляться в любом возрасте, но чаще всего - у взрослых 20-60 лет. Люди, имеющие УП, могут сильно переживать о внешнем виде узелков, а интенсивно зудящая кожа может мешать спать или заниматься повседневными делами. Это может приводить к развитию у людей с УП стресса и депрессии.
[0062] В контексте данного документа термин «зуд» соответствует определению в данной области техники и относится к зудящей коже и/или ощущению зуда. Зуд может быть вызван УП или другими заболеваниями или патологическими состояниями, такими как сухость кожи. В некоторых случаях зуд включает генерализованный зуд кожи по всему телу. В некоторых случаях зуд локализован в конкретных областях тела, например, на руках или ногах. Зуд может быть хроническим или острым. Симптомы зуда включают, но не ограничиваются этим, экскориацию кожи, покраснение, волдыри, пятна, пузыри, сухость кожи, растрескивание кожи и жесткую или чешуйчатую текстуру кожи. В некоторых случаях зуд не приводит к выявляемым изменениям кожи. Поведенческие реакции на зуд включают, но не ограничиваются этим, расчесывание кожи и/или массирование кожи. В некоторых случаях расчесывание кожи может приводить к экскориации в диапазоне от слабой до тяжелой. В некоторых случаях пациенты с зудом удерживаются от расчесывания и/или массирования кожи. Традиционные варианты лечения зуда включают, но не ограничиваются этим, увлажнители кожи, местные смягчающие средства, антигистаминные средства, такие как дифенгидрамин, кортикостероиды, такие как местный гидрокортизоновый крем, средства, снимающие раздражение, такие как мятное масло, ментол или камфора, кротамитон, противозудный агент, часто используемый для лечения чесотки, местные анестетики, такие как местный бензокаиновый крем, и фототерапию. Обычным типом света, используемым для фототерапии, является УФВ.
[0063] В контексте данного документа термин «антитело» в целом относится к иммуноглобулинам или иммуноглобулин-подобным молекулам, включая, например и без ограничения, IgA, IgD, IgE, IgG и IgM, их комбинации или их фрагменты. Фрагменты антител включают, например и без ограничения, фрагменты Fab и одноцепочечные вариабельные фрагменты (scFv), а также сходные молекулы, вырабатываемые во время иммунного ответа в организме любого позвоночного, например, млекопитающих, таких как люди, козы, кролики и мыши, а также отличных от млекопитающих видов, например, иммуноглобулины акул.
[0064] В терминах структуры антитела иммуноглобулин в общем случае имеет тяжелые (H) цепи и легкие (L) цепи, связанные между собой дисульфидными связями. Существует два типа легкой цепи, лямбда (λ) и каппа (κ). Существует пять основных классов (или изотипов) тяжелой цепи, которые определяют функциональную активность молекулы антитела: IgM, IgD, IgG, IgA и IgE. Каждая тяжелая и легкая цепь содержит константную область и вариабельную область (области также известны как «домены»). В комбинации вариабельные области тяжелой и легкой цепей, также называемые «Fab-областью», специфически связывают антиген. Вариабельные области тяжелой и легкой цепей содержат «каркасную» область, перемежающуюся тремя гипервариабельными областями, также называемыми «определяющими комплементарность областями» или «CDR». Был определен объем каркасной области и CDR (смотрите Kabat et al., Sequences of Proteins of Immunological Interest, U.S. Department of Health and Human Services, 1991, которая включена в данный документ посредством ссылки). База данных Kabat доступна онлайн. Последовательности каркасных областей различных легких или тяжелых цепей относительно консервативны в пределах вида. Каркасная область антитела, которая представляет собой объединенные каркасные области составляющих легких и тяжелых цепей, в целом принимает β-складчатую конформацию, а CDR образуют петли, которые соединяют и, в некоторых случаях, образуют часть β-складчатой структуры. Таким образом, каркасные области образуют остов, который обеспечивает расположение CDR в правильной ориентации за счет межцепочечных нековалентных взаимодействий.
[0065] CDR главным образом отвечают за связывание с эпитопом антигена. CDR каждой цепи обычно обозначают как CDR1, CDR2 и CDR3, пронумерованные последовательно, начиная с N-конца, и также обычно идентифицируют по цепи, в которой расположена конкретная CDR. Таким образом, VHCDR3 расположена в вариабельном домене тяжелой цепи антитела, в котором она находится, тогда как VLCDR1 представляет собой CDR1 из вариабельного домена легкой цепи антитела, в котором она находится. Антитело, которое связывает IL-31RA, имеет конкретную последовательность VH-области и VL-области и, таким образом, конкретные последовательности CDR. Антитела с разной специфичностью (т. е. разными комбинированными сайтами для разных антигенов) имеют разные CDR. Хотя именно CDR отличаются между антителами, в связывании антигена напрямую участвует только ограниченное число аминокислотных позиций в CDR. Эти позиции в CDR называются определяющими специфичность остатками (SDR). Основа антитела играет роль в модуляции активности иммунных клеток. Эта область называется областью Fc-фрагмента (Fc) и состоит из двух тяжелых цепей, которые содержат два или три константных домена в зависимости от класса антитела. Функцией Fc-области является гарантия того, что каждое антитело генерирует соответствующий иммунный ответ в отношении заданного антигена путем связывания с конкретным классом белков, находящихся на определенных клетках, таких как B-лимфоциты, фолликулярные дендритные клетки, естественные клетки-киллеры, макрофаги, нейтрофилы и т. д., и называющихся «Fc-рецепторами». Поскольку константные домены тяжелых цепей составляют Fc-область антитела, классы тяжелых цепей в антителах определяют их классовые эффекты. Тяжелые цепи антител включают альфа, гамма, дельта, эпсилон и мю и коррелируют с изотипами антител IgA, G, D, E и M, соответственно. Это придает разным изотипам антител разные классовые эффекты вследствие наличия разных Fc-областей, связывающих и активирующих разные типы рецепторов.
[0066] Существует четыре подкласса IgG, который является наиболее распространенным изотипом антител, встречающимся в сыворотке человека. Четыре подкласса IgG1, IgG2, IgG3 и IgG4 являются высококонсервативными. В целом, смотрите информацию в сети Интернет: ncbi.nlm.nih.gov/pmc/articles/PMC4202688/. Аминокислотные последовательности константных областей этих пептидов известны в данной области техники, например, смотрите Rutishauser, U. et al. (1968) “Amino acid sequence of the Fc region of a human gamma G-immunoglobulin” PNAS 61(4):1414-1421; Shinoda et al. (1981) “Complete amino acid sequence of the Fc region of a human delta chain” PNAS 78(2):785-789; и Robinson et al. (1980) “Complete amino acid sequence of a mouse immunoglobulin alpha chain (MOPC 511)” PNAS 77(8):4909-4913.
Терапевтические антитела
[0067] «Немолизумаб» представляет собой гуманизированное моноклональное антитело, которое связывается с IL-31RA. Немолизумаб аннотирован следующим образом: иммуноглобулин G2-каппа, анти-[Homo sapiens IL31RA (субъединица альфа рецептора интерлейкина 31)], гуманизированное моноклональное антитело; тяжелая цепь гамма 2 (1-445) [гуманизированная VH (Homo sapiens IGHV1-2*02 (83.70%) -(IGHD)-IGHJ5*01) [8.8.14] (1-121) -Homo sapiens IGHG2*01 (CH1 C10>S (135), R12>K (137), E16>G (141), S17>G (142) (122-219), шарнир C4>S (223) (220-231), CH2 H30>Q (268) (232-340), CH3 R11>Q (355), Q98>E (419) (341-445)) (122-445)], (224- 214')-дисульфид с легкой цепью каппа (1’-214’) [гуманизированная V-каппа (Homo sapiens IGKV1-39*01 (82.10%) - IGKJ4*01) [6.3.9] (1'-107') -Homo sapiens IGKC*01 (108'- 214')]; димер (227-227":230-230")-бидисульфид. Немолизумаб имеет дисульфидные мостики в следующих положениях: внутри H (C23-C104) 22-96 148-204 261-321 367-425 22''-96'' 148''-204'' 261''-321'' 367''-425''; внутри L (C23-C104) 23'-88' 134'-194' 23'''-88''' 134'''-194'''; между H-L (h 5-CL 126) 224-214' 224''-214'''; между H-H (h 8, h 11) 227-227'' 230-230''. Немолизумаб имеет сайты N-гликозилирования в следующих положениях: H CH2 N84.4: 297, 297''. В немолизумабе отсутствуют C-концевые глицин и лизин H-цепи (CHS G1>del, K2>del).
[0068] Аминокислотная последовательность тяжелой цепи немолизумаба:
QVQLVQSGAEVKKPGASVKVSCKASGYTFTGYIMNWVRQAPGQGLEWMGLINPYNGGTDYNPQFQDRVTITADKSTSTAYMELSSLRSEDTAVYYCARDGYDDGPYTLETWGQGTLVTVSSASTKGPSVFPLAPSSKSTSGGTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSNFGTQTYTCNVDHKPSNTKVDKTVERKSCVECPPCPAPPVAGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSQEDPEVQFNWYVDGVEVHNAKTKPREEQFNSTFRVVSVLTVVHQDWLNGKEYKCKVSNKGLPAPIEKTISKTKGQPREPQVYTLPPSQEEMTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPMLDSDGSFFLYSKLTVDKSRWQEGNVFSCSVMHEALHNHYTQKSLSLSP (SEQ ID NO: 5)
[0069] Аминокислотная последовательность легкой цепи немолизумаба:
DIQMTQSPSSLSASVGDRVTITCQASEDIYSFVAWYQQKPGKAPKLLIYNAQTEAQGVPSRFSGSGSGTDFTLTISSLQPEDFATYYCQHHYDSPLTFGGGTKVEIKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC (SEQ ID NO: 6)
[0070] Вариабельные домены последовательностей тяжелой и легкой цепей выделены выше жирным шрифтом, а последовательности CDR подчеркнуты/выделены курсивом.
[0071] Эквивалентные немолизумабу антитела включают, но не ограничиваются этим: (i) антитела с тяжелыми цепями, имеющими по меньшей мере 55%, по меньшей мере 65%, по меньшей мере 70%, по меньшей мере 75%, по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 97%, по меньшей мере 98%, по меньшей мере 99% или 100% идентичности аминокислотной последовательности с последовательностью тяжелой цепи немолизумаба, (ii) антитела с легкими цепями, имеющими по меньшей мере 55%, по меньшей мере 65%, по меньшей мере 70%, по меньшей мере 75%, по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 97%, по меньшей мере 98%, по меньшей мере 99% или 100% идентичности аминокислотной последовательности с последовательностью легкой цепи немолизумаба, (iii) антитела с вариабельными областями, имеющими по меньшей мере 55%, по меньшей мере 65%, по меньшей мере 70%, по меньшей мере 75%, по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 97%, по меньшей мере 98%, по меньшей мере 99% или 100% идентичности аминокислотной последовательности с последовательностями вариабельных областей немолизумаба, (iv) антитела с CDR, имеющими по меньшей мере 55%, по меньшей мере 65%, по меньшей мере 70%, по меньшей мере 75%, по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 97%, по меньшей мере 98%, по меньшей мере 99% или 100% идентичности аминокислотной последовательности с последовательностями CDR немолизумаба, (v) антитела, которые связываются с той же изоформой IL-31RA, что и немолизумаб (например, IL31-RAv3), необязательно, тем же эпитопом IL-31RA, (vi) антитела, которые блокируют или нейтрализуют IL-31RA, (vii) антитела, которые связываются с рецептором онкостатина M (OSMR), и (viiii) их комбинации. Например, подходящие эквиваленты включают иммуноглобулины или иммуноглобулин-подобные молекулы с такими же или по существу сходными аминокислотными последовательностями тяжелой и легкой цепей, что и немолизумаб. Дополнительные примеры эквивалентов немолизумаба описаны, например, в WO 2010/064697.
[0072] Эквиваленты немолизумаба могут представлять собой моноклональные или поликлональные антитела. Такие моноклональные антитела, обладающие IL31-RA-связывающей и/или нейтрализующей активностью, можно получать, например, посредством следующей процедуры: анти-IL31-RA моноклональные антитела получают, используя в качестве антигена IL31-RA или его фрагмент, который получен от млекопитающего, такого как человек или мышь, известными способами, после чего антитела, обладающие IL31-RA-связывающей и/или нейтрализующей активностью, отбирают из полученных таким образом анти-IL31-RA моноклональных антител. В частности, необходимый антиген или клетки, экспрессирующие необходимый антиген, используют как сенсибилизирующий антиген для иммунизации в соответствии с традиционными методами иммунизации. Анти-IL31-RA моноклональные антитела можно получать путем слияния полученных иммунных клеток с известными родительскими клетками, используя традиционные методы клеточного слияния, и проводить их скрининг в отношении клеток, вырабатывающих моноклональные антитела (гибридом), традиционными методами скрининга. Подлежащие иммунизации животные включают, например, млекопитающих, таких как мыши, крысы, кролики, овцы, обезьяны, козы, ослы, коровы, лошади и свиньи. Антиген можно получить, используя известную генную последовательность IL31-RA, в соответствии с известными методами, например, методами с использованием бакуловирусов (например, WO 98/46777).
[0073] Гибридомы можно получать, например, в соответствии с методом Milstein et al. (Kohler, G. and Milstein, C., Methods Enzymol. (1981) 73: 3-46). Когда иммуногенность антигена является низкой, иммунизацию можно проводить после связывания антигена с обладающей иммуногенностью макромолекулой, такой как альбумин. Антигены, используемые для получения моноклональных антител, которые обладают связывающей и/или нейтрализующей активностью против человеческого IL31-RA, особенно не ограничены при условии, что они позволяют получать препараты антител, которые обладают связывающей и/или нейтрализующей активностью против человеческого IL31-RA. Например, известно, что существует ряд вариантов человеческого IL31-RA, и любой вариант можно использовать в качестве иммуногена при условии, что он позволяет получать препараты антител, которые обладают связывающей и/или нейтрализующей активностью против человеческого IL31-RA. В альтернативном варианте в тех же условиях в качестве иммуногена можно использовать пептидный фрагмент IL31-RA или белок, в котором в природную последовательность IL31-RA были внесены искусственные мутации. В настоящем изобретении человеческий IL31-RA является одним из предпочтительных иммуногенов при получении антител, которые обладают связывающей и/или нейтрализующей IL31-RA активностью.
[0074] IL31-RA-связывающую активность эквивалентных антител можно определить способами, известными специалистам в данной области техники. Методы определения антигенсвязывающей активности антитела включают, например, ELISA (ферментный иммуносорбентный анализ), ИФА (иммуноферментный анализ), РИА (радиоиммуноанализ) и флуоресцентный метод для антител. Например, если используют иммуноферментный анализ, содержащие антитела образцы, такие как очищенные антитела и культуральные супернатанты вырабатывающих антитела клеток, добавляют в покрытые антигеном планшеты. Добавляют вторичное антитело, меченное ферментом, таким как щелочная фосфатаза, и инкубируют планшеты. После промывки добавляют ферментный субстрат, такой как п-нитрофенилфосфат, и измеряют поглощение, чтобы оценить антигенсвязывающую активность. Связывающую и/или нейтрализующую активность эквивалентного антитела против IL31-RA можно измерить, например, по определению наличия эффекта подавления роста IL-31-зависимой линии клеток. Например, активность очищенного мышиного антитела к IL-31можно оценить, анализируя IL-31-зависимый рост клеток Ba/F3, трансфицированных генами рецептора α IL-31 мыши и OSMR мыши.
[0075] Авторы изобретения предположили, что противозудное лекарственное средство может оказывать большее влияние на УП у пациентов, которые имеют умеренный или сильный зуд.
[0076] В некоторых вариантах осуществления зуд оценивается как отсутствующий, слабый, умеренный или сильный. «Отсутствующий», «слабый», «умеренный» и «сильный» представляются собой термины в данной области техники, описывающие наличие, степень и/или интенсивность экскориаций. Специалистам в данной области техники известны пределы и границы этих терминов.
[0077] В некоторых вариантах осуществления зуд характеризуют в соответствии с одним или более из следующих способов, известных специалистам в данной области техники. Например, быстрое определение интенсивности можно провести с помощью одномерных шкал, которые обычно используются в клинической практике. Смотрите Pereira et al., Allergology International (2017) 66:3-78, включенную в данный документ посредством ссылки. Например, пациентов можно попросить оценить интенсивность зуда от 0 («отсутствие зуда») до 10 «наихудший зуд, который можно представить») по цифровой рейтинговой шкале (ЦРШ). Другая одномерная шкала, визуальная аналоговая шкала (ВАШ), предоставляет пациентам возможность указать интенсивность зуда с помощью отметки на 10 см шкале в форме линейки. Обе конечные точки обозначены числом, соответствующим интенсивности, при этом 0 представляет «отсутствие зуда», а 10 - «наихудший зуд, который можно представить». Оценки ниже 3,0 баллов по ВАШ/ЦРШ в общем случае связаны со слабым зудом, тогда как оценки выше 6,9 иллюстрируют сильный зуд. Оценки выше 9,0 представляют очень сильный зуд. Вербальная рейтинговая шкала (ВРШ) представляет собой дополнительную одномерную шкалу, которая дает возможность пациентам описывать интенсивность зуда посредством постепенно возрастающих характеристик (0 - отсутствие зуда, 4 - наихудший зуд, который можно представить). ЦРШ, ВАШ и ВРШ были валидированы в крупномасштабных исследованиях, в которых участвовали пациенты с хроническим зудом с зудящими дерматозами или зудом разного происхождения. Эти инструменты имеют высокую воспроизводимость, а между шкалами наблюдалась высокая степень корреляции 6, 7, 8. Хронический зуд может сильно ухудшать качество жизни пациентов. По этой причине был валидирован и широко используется дерматологический индекс качества жизни (ДИКЖ). Оценки ДИКЖ находятся в диапазоне от 0 до 30, при этом более высокие оценки указывают на более низкое качество жизни. Значения общей оценки исследователя (ООИ) находятся в диапазоне от 0 (чисто) до 5 (очень тяжелое заболевание) и представлены как процентная доля пациентов в указанной популяции. В представленном исследовании оценки ООИ находятся в диапазоне от 0 до 4.
Фармацевтические композиции
[0078] В данном документе предложены фармацевтические композиции для применения в лечении поражений кожи и зуда у субъекта, имеющего хроническую почесуху (ХП), содержащие, состоящие из или состоящие преимущественно из немолизумаба или его эквивалента. Кроме того, в настоящем изобретении предложены терапевтические агенты для ХП, которые содержат немолизумаб или его эквивалент в качестве активного ингредиента.
[0079] В некоторых вариантах осуществления субъект имеет узловатую почесуху (УП). В некоторых вариантах осуществления УП диагностирована у субъекта в течение по меньшей мере около 6 месяцев. В конкретных вариантах осуществления субъект имеет по меньшей мере около 20 узелков на своем теле с двухсторонним распределением. В конкретных вариантах осуществления субъект имеет связанные с почесухой поражения на верхних конечностях с поражениями на туловище или нижних конечностях или без них. В конкретных вариантах осуществления зуду была приписана оценка по меньшей мере 7 по цифровой рейтинговой шкале (ЦРШ). В конкретных вариантах осуществления среднее значение оценки ЦРШ для наихудшей суточной интенсивности составляет по меньшей мере 7 в течение предыдущих 3 суток. В других конкретных вариантах осуществления среднее значение оценки ЦРШ для наихудшей суточной интенсивности составляет по меньшей мере 7 в течение предыдущей недели.
[0080] В некоторых вариантах осуществления субъект не имеет атопический дерматит. В некоторых вариантах осуществления субъект не имеет хроническую почесуху в результате патологического состояния, отличного от УП, такого как чесотка, укус насекомого, простой хронический лишай, псориаз, акне, фолликулит, привычная дерматилломания, лимфоматоидный папулез, хронический лучевой дерматит, герпетиформный дерматит, споротрихоз, буллезное заболевание. В некоторых вариантах осуществления субъект не имеет невропатическую или психогенную почесуху, такую как парестетическая ноталгия, плечелучевая почесуха, дилюционный паразитоз, патомимия.
[0081] Выражение «содержит(ат) немолизумаб или его эквивалент в качестве активного ингредиента» означает содержание немолизумаба или его эквивалента в качестве по меньшей мере одного из активных ингредиентов и не ограничивает содержание антитела. Кроме того, терапевтические агенты для УП по настоящему изобретению также могут содержать в комбинации с немолизумабом или его эквивалентом другие ингредиенты, которые усиливают лечение УП. Например, композиция может содержать одно или более из кремов или инъекций с местными кортикостероидами, мазей с ментолом или фенолом для охлаждения и успокоения зудящей кожи, капсаицинового крема, пероральных кортикостероидов, селективных ингибиторов обратного захвата серотонина (СИОЗС) и пероральных антигистаминных средств.
[0082] Фармацевтические композиции немолизумаба или его эквивалента по настоящему изобретению можно получать в виде составов в соответствии со стандартными методами (смотрите, например, Remington's Pharmaceutical Science, Mark Publishing Company, Easton, USA). В некоторых вариантах осуществления фармацевтическая композиция содержит носитель и/или добавку. В некоторых вариантах осуществления носитель представляет собой фармацевтически приемлемый носитель. Например, в некоторых вариантах осуществления фармацевтическая композиция содержит одно или более из поверхностно-активных веществ (например, ПЭГ и Твин), эксципиентов, антиоксидантов (например, аскорбиновую кислоту), красителей, ароматизаторов, консервантов, стабилизаторов, буферных агентов (например, фосфорную кислоту, лимонную кислоту и другие органические кислоты), хелатирующих агентов (например, ЭДТА), суспендирующих агентов, изотонизирующих агентов, связующих веществ, разрыхлителей, лубрикантов, агентов, способствующих текучести, корригентов, легкой безводной кремниевой кислоты, лактозы, кристаллической целлюлозы, маннита, крахмала, кармелозы кальция, кармелозы натрия, гидроксипропилцеллюлозы, гидроксипропилметилцеллюлозы, поливинилацетальдиэтиламиноацетата, поливинилпирролидона, желатина, триглицерида среднецепочечной жирной кислоты, полиоксиэтиленового гидрогенизированного касторового масла 60, сахарозы, карбоксиметилцеллюлозы, кукурузного крахмала и неорганической соли. В некоторых вариантах осуществления фармацевтическая композиция содержит один или более других низкомолекулярных полипептидов, белков, таких как сывороточный альбумин, желатин и иммуноглобулин, и аминокислот, таких как глицин, глутамин, аспарагин, аргинин и лизин.
[0083] Когда немолизумаб или его эквивалент получают в виде водного раствора для инъекции, немолизумаб или его эквивалент можно растворять в изотоническом растворе, содержащем, например, физиологический солевой раствор, декстрозу или другие адъюванты. Адъюванты могут включать, например, D-сорбит, D-маннозу, D-маннит и хлорид натрия. Кроме того, одновременно можно использовать солюбилизирующие агенты, например, спирты (например, этанол), полиспирты (например, пропиленгликоли и ПЭГ) и неионные детергенты (полисорбат 80 и HCO-50).
[0084] При необходимости немолизумаб или его эквивалент могут быть инкапсулированы в микрокапсулах (микрокапсулах из гидроксиметилцеллюлозы, желатина, полиметилметакрилата и т. п.) и заключены в компонентах коллоидных систем доставки лекарственных препаратов (липосомах, альбуминовых микросферах, микроэмульсиях, наночастицах и нанокапсулах) (например, смотрите “Remington's Pharmaceutical Science 16th edition” &, Oslo Ed. (1980)). Кроме того, известны способы получения лекарственных препаратов с замедленным высвобождением, которые можно применять к немолизумабу или его эквиваленту (Langer et al., J. Biomed. Mater. Res. (1981) 15, 167-277; Langer, Chem. Tech. (1982) 12, 98-105; патент США № 3773919; заявка на Европейский патент (EP) № 58481; Sidman et al., Biopolymers (1983) 22, 547-56; EP 133988).
[0085] Фармацевтические композиции по настоящему изобретению можно вводить перорально или парентерально, но предпочтительно их вводят парентерально. В частности, фармацевтические композиции вводят пациентам путем инъекции или чрескожного введения. Инъекции включают, например, внутривенные инъекции, внутримышечные инъекции и подкожные инъекции для системного или локального введения. Фармацевтические композиции можно применять в местах, в которых необходимо подавить воспаление, или участках, окружающих эти места, путем локальной инфузии или внутримышечной инъекции. В некоторых вариантах осуществления фармацевтические композиции вводят в месте одной или более кожных экскориаций или вблизи места одной или более кожных экскориаций.
[0086] Способы введения можно выбрать надлежащим образом в соответствии с возрастом и состоянием пациента. Рассчитанную на одно введение дозу можно выбрать, например, из диапазона от 0,0001 до 100 мг активного ингредиента на кг массы тела. В альтернативном варианте, когда агенты вводят пациентам-людям, дозу активного ингредиента можно выбрать, например, из диапазона от 0,001 до 1000 мг/кг массы тела. В некоторых вариантах осуществления композиция составлена для введения дозы, содержащей, например, от около 0,01 до 50 мг/кг, от около 0,01 мг/кг до около 0,1 мг/кг, от около 0,05 мг/кг до 0,15 мг/кг, от около 0,1 мг/кг до около 0,6 мг/кг, от около 0,1 мг/кг до около 1 мг/кг, от около 0,25 мг/кг до около 0,75 мг/кг, от около 0,4 мг/кг до около 0,8 мг/кг, от около 0,4 мг/кг до около 1,8 мг/кг, от около 0,5 до около 2,5 мг/кг, от около 0,8 мг/кг до около 2,2 мг/кг, от около 1 мг/кг до около 2,5 мг/кг, от около 1 мг/кг до около 3,5 мг/кг, от около 1 мг/кг до около 5 мг/кг, от около 2 мг/кг до около 4 мг/кг, от около 2,5 мг/кг до около 10 мг/кг, от около 5 мг/кг до около 10 мг/кг, от около 10 мг/кг до около 20 мг/кг, от около 10 мг/кг до около 40 мг/кг, от около 20 мг/кг до около 50 мг/кг, от около 25 мг/кг до около 75 мг/кг, от около 50 мг/кг до около 100 мг/кг или от около 100 мг/кг до около 500 мг/кг, или от около 100 мг/кг до около 1000 мг/кг массы тела немолизумаба или его эквивалента. В предпочтительных вариантах осуществления доза находится в диапазоне от около 0,01 мг/кг до около 0,1 мг/кг, от около 0,1 мг/кг до около 0,5 мг/кг, от около 0,5 мг/кг до около 1,5 мг/кг, от около 1,5 мг/кг до около 2,5 мг/кг или от около 2,5 мг/кг до около 10 мг/кг. В некоторых вариантах осуществления доза составляет около 0,01 мг/кг, около 0,02 мг/кг, около 0,03 мг/кг, около 0,04 мг/кг, около 0,05 мг/кг, около 0,06 мг/кг, около 0,07 мг/кг, около 0,08 мг/кг, около 0,09 мг/кг, около 0,1 мг/кг, около 0,2 мг/кг, около 0,3 мг/кг, около 0,4 мг/кг, около 0,5 мг/кг, около 0,6 мг/кг, около 0,7 мг/кг, около 0,8 мг/кг, около 0,9 мг/кг, около 1 мг/кг, около 1,1 мг/кг, около 1,2 мг/кг, около 1,3 мг/кг, около 1,4 мг/кг, около 1,5 мг/кг, около 1,6 мг/кг, около 1,7 мг/кг, около 1,8 мг/кг, около 1,9 мг/кг, около 2 мг/кг, около 2,1 мг/кг, около 2,2 мг/кг, около 2,3 мг/кг, около 2,4 мг/кг, около 2,5 мг/кг, около 2,6 мг/кг, около 2,7 мг/кг, около 2,8 мг/кг, около 2,9 мг/кг, около 3 мг/кг, около 3,5 мг/кг, около 4 мг/кг, около 4,5 мг/кг, около 5 мг/кг, около 6 мг/кг, около 7 мг/кг, около 8 мг/кг, около 9 мг/кг, около 10 мг/кг, около 15 мг/кг, около 25 мг/кг, около 50 мг/кг, около 75 мг/кг, около 100 мг/кг, около 500 мг/кг или около 1000 мг/кг. В конкретных вариантах осуществления эффективное количество немолизумаба или его эквивалента составляет около 0,1 мг/кг, около 0,5 мг/кг, около 1 мг/кг, около 1,5 мг/кг, около 2 мг/кг или около 2,5 мг/кг. В предпочтительным варианте осуществления доза составляет около 0,5 мг/кг.
Способы лечения
[0087] В соответствии с некоторыми вариантами осуществления предложены способы лечения поражений кожи и зуда у субъекта, имеющего узловатую почесуху (УП), включающие, состоящие из или состоящие преимущественно из введения субъекту эффективного количества немолизумаба или его эквивалента.
[0088] В некоторых вариантах осуществления почесуха является умеренной или тяжелой. В некоторых вариантах осуществления способов УП диагностирована у субъекта в течение по меньшей мере 6 месяцев. В конкретных вариантах осуществления способов субъект имеет по меньшей мере 20 узелков на своем теле с двухсторонним распределением. В конкретных вариантах осуществления способов субъект имеет связанные с почесухой поражения на верхних конечностях с поражениями на туловище или нижних конечностях или без них. В конкретных вариантах осуществления способов зуду была приписана оценка по меньшей мере 7 по цифровой рейтинговой шкале (ЦРШ). В конкретных вариантах осуществления способов среднее значение оценки ЦРШ для наихудшей суточной интенсивности составляет по меньшей мере 7 в течение предыдущих 3 суток. В других конкретных вариантах осуществления способов среднее значение оценки ЦРШ для наихудшей суточной интенсивности составляет по меньшей мере 7 в течение предыдущей недели.
[0089] В некоторых вариантах осуществления способов субъект не имеет атопический дерматит. В некоторых вариантах осуществления способов субъект не имеет хроническую почесуху в результате патологического состояния, отличного от УП, такого как чесотка, укус насекомого, простой хронический лишай, псориаз, акне, фолликулит, привычная дерматилломания, лимфоматоидный папулез, хронический лучевой дерматит, герпетиформный дерматит, споротрихоз, буллезное заболевание. В некоторых вариантах осуществления способов субъект не имеет невропатическую или психогенную почесуху, такую как парестетическая ноталгия, плечелучевая почесуха, дилюционный паразитоз, патомимия.
[0090] «Эффективное количество» представляет собой количество, достаточное для того, чтобы принести пользу или желаемые результаты, такие как облегчение по меньшей мере одного или более симптомов УП и/или зуда. В контексте данного документа эффективное количество также включает количество, достаточное для замедления развития АД и/или зуда, изменения течения симптомов УП и/или зуда (например, эффективности сна) или обращения симптомов УП и/или зуда. Таким образом, невозможно определить точное значение «эффективного количества». Однако в любом заданном случае специалист в данной области техники сможет определить соответствующее «эффективное количество», используя лишь рутинные эксперименты.
[0091] Эффективное количество можно вводить в одном или более введениях, применениях или дозировках. Такая доставка зависит от ряда переменных, включая период времени, в течение которого предполагается использовать индивидуальную единичную дозировку, биодоступность терапевтического агента, путь введения и т. д. При этом следует понимать, что конкретные уровни доз терапевтических агентов по настоящему изобретению для любого конкретного субъекта зависят от ряда факторов, включая активность конкретного применяемого соединения, возраст, массу тела, общее состояние здоровья, пол и рацион субъекта, время введения, скорость выведения, лекарственную комбинацию и тяжесть конкретного заболевания, подлежащего лечению, и форму введения. Лечебные дозировки в общем случае можно титровать для оптимизации безопасности и эффективности. Дозировка может быть определена врачом и при необходимости скорректирована в соответствии с наблюдаемыми эффектами лечения. Как правило, взаимосвязь дозировка - эффект из in vitro и/или in vivo тестов изначально может обеспечить полезное руководство по надлежащим дозам для введения пациентам. В общем случае желательно вводить количество соединения, которое является эффективным для достижения сывороточного уровня, соразмерного концентрациям, которые, как было обнаружено, являются эффективными in vitro. Определение этих параметров входит в компетенцию специалистов в данной области техники. Эти аспекты, а также эффективные составы и процедуры введения хорошо известны в данной области техники и описаны в стандартных руководствах.
[0092] Схемы дозирования для лечения ХП и УП могут включать введение постоянной дозы (т. е. повторное введение одной и той же дозы через предопределенные интервалы) или введение нагрузочной дозы (т. е. введение начальной дозы, которая превышает или отличается от последующих серийных доз). В целях схемы дозирования любого типа эффективную дозу можно вводить местно, парентерально, подкожно, субдермально, интрадермально или внутримышечно.
[0093] В некоторых вариантах осуществления нагрузочную дозу и последующие серийные дозы можно вводить одним путем (например, подкожно), тогда как в некоторых вариантах осуществления нагрузочную дозу и последующие серийные дозы можно вводить разными путями (например, парентерально и подкожно, соответственно). В некоторых вариантах осуществления нагрузочная доза может составлять около 5 мг, около 10 мг, около 15 мг, около 20 мг, около 25 мг, около 30 мг, около 35 мг, около 40 мг, около 45 мг, около 50 мг, около 55 мг, около 60 мг, около 65 мг, около 70 мг, около 75 мг, около 80 мг, около 85 мг, около 90 мг, около 95 мг, около 100 мг, около 105 мг, около 110 мг, около 115 мг, около 120 мг или больше. В некоторых вариантах осуществления нагрузочная доза может составлять 5 мг, 10 мг, 15 мг, 20 мг, 25 мг, 30 мг, 35 мг, 40 мг, 45 мг, 50 мг, 55 мг, 60 мг, 65 мг, 70 мг, 75 мг, 80 мг, 85 мг, 90 мг, 95 мг, 100 мг, 105 мг, 110 мг, 115 мг, 120 мг или больше. В некоторых вариантах осуществления нагрузочная доза может составлять около 0,01 мг/кг, около 0,02 мг/кг, около 0,03 мг/кг, около 0,04 мг/кг, около 0,05 мг/кг, около 0,06 мг/кг, около 0,07 мг/кг, около 0,08 мг/кг, около 0,09 мг/кг, около 0,1 мг/кг, около 0,2 мг/кг, около 0,3 мг/кг, около 0,4 мг/кг, около 0,5 мг/кг, около 0,6 мг/кг, около 0,7 мг/кг, около 0,8 мг/кг, около 0,9 мг/кг, около 1 мг/кг, около 1,1 мг/кг, около 1,2 мг/кг, около 1,3 мг/кг, около 1,4 мг/кг, около 1,5 мг/кг, около 1,6 мг/кг, около 1,7 мг/кг, около 1,8 мг/кг, около 1,9 мг/кг, около 2 мг/кг, около 2,1 мг/кг, около 2,2 мг/кг, около 2,3 мг/кг, около 2,4 мг/кг, около 2,5 мг/кг, около 2,6 мг/кг, около 2,7 мг/кг, около 2,8 мг/кг, около 2,9 мг/кг, около 3 мг/кг, около 3,5 мг/кг, около 4 мг/кг, около 4,5 мг/кг, около 5 мг/кг, около 6 мг/кг, около 7 мг/кг, около 8 мг/кг, около 9 мг/кг, около 10 мг/кг, около 15 мг/кг, около 25 мг/кг, около 50 мг/кг, около 75 мг/кг, около 100 мг/кг, около 500 мг/кг или около 1000 мг/кг. В некоторых вариантах осуществления нагрузочная доза может составлять 0,01 мг/кг, 0,02 мг/кг, 0,03 мг/кг, 0,04 мг/кг, 0,05 мг/кг, 0,06 мг/кг, 0,07 мг/кг, 0,08 мг/кг, 0,09 мг/кг, 0,1 мг/кг, 0,2 мг/кг, 0,3 мг/кг, 0,4 мг/кг, 0,5 мг/кг, 0,6 мг/кг, 0,7 мг/кг, 0,8 мг/кг, 0,9 мг/кг, 1 мг/кг, 1,1 мг/кг, 1,2 мг/кг, 1,3 мг/кг, 1,4 мг/кг, 1,5 мг/кг, 1,6 мг/кг, 1,7 мг/кг, 1,8 мг/кг, 1,9 мг/кг, 2 мг/кг, 2,1 мг/кг, 2,2 мг/кг, 2,3 мг/кг, 2,4 мг/кг, 2,5 мг/кг, 2,6 мг/кг, 2,7 мг/кг, 2,8 мг/кг, 2,9 мг/кг, 3 мг/кг, 3,5 мг/кг, 4 мг/кг, 4,5 мг/кг, 5 мг/кг, 6 мг/кг, 7 мг/кг, 8 мг/кг, 9 мг/кг, 10 мг/кг, 15 мг/кг, 25 мг/кг, 50 мг/кг, 75 мг/кг, 100 мг/кг, 500 мг/кг или 1000 мг/кг. В некоторых вариантах осуществления нагрузочную дозу вводят в виде одной инъекции. В некоторых вариантах осуществления нагрузочную дозу вводят в виде некоторого количества инъекций, которые можно вводить одновременно или разделять по времени на определенные интервалы.
[0094] Последующие серийные дозы схемы с нагрузочной дозой в общем случае ниже, чем нагрузочная доза. Например, в некоторых вариантах осуществления схема дозирования может включать нагрузочную дозу 60 мг и серийную дозу 30 мг, которые можно вводить через определенные интервалы, например, 4 недели. В некоторых вариантах осуществления серийная доза схемы дозирования может составлять около 5 мг, около 10 мг, около 15 мг, около 20 мг, около 25 мг, около 30 мг, около 35 мг, около 40 мг, около 45 мг, около 50 мг, около 55 мг, около 60 мг, около 65 мг, около 70 мг, около 75 мг, около 80 мг, около 85 мг, около 90 мг, около 95 мг, около 100 мг, около 105 мг, около 110 мг, около 115 мг, около 120 мг или больше. В некоторых вариантах осуществления серийная доза может составлять 5 мг, 10 мг, 15 мг, 20 мг, 25 мг, 30 мг, 35 мг, 40 мг, 45 мг, 50 мг, 55 мг, 60 мг, 65 мг, 70 мг, 75 мг, 80 мг, 85 мг, 90 мг, 95 мг, 100 мг, 105 мг, 110 мг, 115 мг, 120 мг или больше. В некоторых вариантах осуществления серийная доза может составлять около 0,01 мг/кг, около 0,02 мг/кг, около 0,03 мг/кг, около 0,04 мг/кг, около 0,05 мг/кг, около 0,06 мг/кг, около 0,07 мг/кг, около 0,08 мг/кг, около 0,09 мг/кг, около 0,1 мг/кг, около 0,2 мг/кг, около 0,3 мг/кг, около 0,4 мг/кг, около 0,5 мг/кг, около 0,6 мг/кг, около 0,7 мг/кг, около 0,8 мг/кг, около 0,9 мг/кг, около 1 мг/кг, около 1,1 мг/кг, около 1,2 мг/кг, около 1,3 мг/кг, около 1,4 мг/кг, около 1,5 мг/кг, около 1,6 мг/кг, около 1,7 мг/кг, около 1,8 мг/кг, около 1,9 мг/кг, около 2 мг/кг, около 2,1 мг/кг, около 2,2 мг/кг, около 2,3 мг/кг, около 2,4 мг/кг, около 2,5 мг/кг, около 2,6 мг/кг, около 2,7 мг/кг, около 2,8 мг/кг, около 2,9 мг/кг, около 3 мг/кг, около 3,5 мг/кг, около 4 мг/кг, около 4,5 мг/кг, около 5 мг/кг, около 6 мг/кг, около 7 мг/кг, около 8 мг/кг, около 9 мг/кг, около 10 мг/кг, около 15 мг/кг, около 25 мг/кг, около 50 мг/кг, около 75 мг/кг, около 100 мг/кг, около 500 мг/кг или около 1000 мг/кг. В некоторых вариантах осуществления серийная доза может составлять 0,01 мг/кг, 0,02 мг/кг, 0,03 мг/кг, 0,04 мг/кг, 0,05 мг/кг, 0,06 мг/кг, 0,07 мг/кг, 0,08 мг/кг, 0,09 мг/кг, 0,1 мг/кг, 0,2 мг/кг, 0,3 мг/кг, 0,4 мг/кг, 0,5 мг/кг, 0,6 мг/кг, 0,7 мг/кг, 0,8 мг/кг, 0,9 мг/кг, 1 мг/кг, 1,1 мг/кг, 1,2 мг/кг, 1,3 мг/кг, 1,4 мг/кг, 1,5 мг/кг, 1,6 мг/кг, 1,7 мг/кг, 1,8 мг/кг, 1,9 мг/кг, 2 мг/кг, 2,1 мг/кг, 2,2 мг/кг, 2,3 мг/кг, 2,4 мг/кг, 2,5 мг/кг, 2,6 мг/кг, 2,7 мг/кг, 2,8 мг/кг, 2,9 мг/кг, 3 мг/кг, 3,5 мг/кг, 4 мг/кг, 4,5 мг/кг, 5 мг/кг, 6 мг/кг, 7 мг/кг, 8 мг/кг, 9 мг/кг, 10 мг/кг, 15 мг/кг, 25 мг/кг, 50 мг/кг, 75 мг/кг, 100 мг/кг, 500 мг/кг или 1000 мг/кг.
[0095] В целях схемы с нагрузочной дозой первую серийную дозу можно вводить через 1 сутки, 2 суток, 3 суток, 4 суток, 5 суток, 6 суток, 7 суток, 8 суток, 9 суток, 10 суток, 11 суток, 12 суток, 13 суток, 1 неделю, 2 недели, 3 недели, 4 недели, 5 недель, 6 недель, 7 недель, 8 недель, 9 недель или 10 недель после начальной нагрузочной дозы. В некоторых вариантах осуществления серийную дозу вводят через 4 недели после начальной нагрузочной дозы. В некоторых вариантах осуществления последующие серийные дозы вводят один раз каждые 1 сутки, 2 суток, 3 суток, 4 суток, 5 суток, 6 суток, 7 суток, 8 суток, 9 суток, 10 суток, 11 суток, 12 суток, 13 суток, 1 неделю, 2 недели, 3 недели, 4 недели, 5 недель, 6 недель, 7 недель, 8 недель, 9 недель или 10 недель. В некоторых вариантах осуществления серийные дозы разнесены по времени на 4 недели (т. е. немолизумаб или его эквивалент вводят один раз каждые 4 недели).
[0096] В некоторых вариантах осуществления доза немолизумаба или его эквивалента, вводимая субъекту, находится в диапазоне от 0,001 до 1000 мг/кг массы тела субъекта. В некоторых вариантах осуществления доза находится в диапазоне от около 0,01 до 50 мг/кг, от около 0,01 мг/кг до около 0,1 мг/кг, от около 0,05 мг/кг до 0,15 мг/кг, от около 0,1 мг/кг до около 0,6 мг/кг, от около 0,1 мг/кг до около 1 мг/кг, от около 0,25 мг/кг до около 0,75 мг/кг, от около 0,4 мг/кг до около 0,8 мг/кг, от около 0,4 мг/кг до около 1,8 мг/кг, от около 0,5 до около 2,5 мг/кг, от около 0,8 мг/кг до около 2,2 мг/кг, от около 1 мг/кг до около 2,5 мг/кг, от около 1 мг/кг до около 3,5 мг/кг, от около 1 мг/кг до около 5 мг/кг, от около 2 мг/кг до около 4 мг/кг, от около 2,5 мг/кг до около 10 мг/кг, от около 5 мг/кг до около 10 мг/кг, от около 10 мг/кг до около 20 мг/кг, от около 10 мг/кг до около 40 мг/кг, от около 20 мг/кг до около 50 мг/кг, от около 25 мг/кг до около 75 мг/кг, от около 50 мг/кг до около 100 мг/кг или от около 100 мг/кг до около 500 мг/кг, или от около 100 мг/кг до около 1000 мг/кг массы тела немолизумаба или его эквивалента. В предпочтительных вариантах осуществления доза находится в диапазоне от около 0,01 мг/кг до около 0,1 мг/кг, от около 0,1 мг/кг до около 0,5 мг/кг, от около 0,5 мг/кг до около 1,5 мг/кг, от около 1,5 мг/кг до около 2,5 мг/кг или от около 2,5 мг/кг до около 10 мг/кг. В некоторых вариантах осуществления доза составляет около 0,01 мг/кг, около 0,02 мг/кг, около 0,03 мг/кг, около 0,04 мг/кг, около 0,05 мг/кг, около 0,06 мг/кг, около 0,07 мг/кг, около 0,08 мг/кг, около 0,09 мг/кг, около 0,1 мг/кг, около 0,2 мг/кг, около 0,3 мг/кг, около 0,4 мг/кг, около 0,5 мг/кг, около 0,6 мг/кг, около 0,7 мг/кг, около 0,8 мг/кг, около 0,9 мг/кг, около 1 мг/кг, около 1,1 мг/кг, около 1,2 мг/кг, около 1,3 мг/кг, около 1,4 мг/кг, около 1,5 мг/кг, около 1,6 мг/кг, около 1,7 мг/кг, около 1,8 мг/кг, около 1,9 мг/кг, около 2 мг/кг, около 2,1 мг/кг, около 2,2 мг/кг, около 2,3 мг/кг, около 2,4 мг/кг, около 2,5 мг/кг, около 2,6 мг/кг, около 2,7 мг/кг, около 2,8 мг/кг, около 2,9 мг/кг, около 3 мг/кг, около 3,5 мг/кг, около 4 мг/кг, около 4,5 мг/кг, около 5 мг/кг, около 6 мг/кг, около 7 мг/кг, около 8 мг/кг, около 9 мг/кг, около 10 мг/кг, около 15 мг/кг, около 25 мг/кг, около 50 мг/кг, около 75 мг/кг, около 100 мг/кг, около 500 мг/кг или около 1000 мг/кг. В конкретных вариантах осуществления эффективное количество немолизумаба или его эквивалента составляет около 0,1 мг/кг, около 0,5 мг/кг, около 1 мг/кг, около 1,5 мг/кг, около 2 мг/кг или около 2,5 мг/кг. В предпочтительным варианте осуществления доза составляет около 0,5 мг/кг.
[0097] В некоторых вариантах осуществления доза немолизумаба или его эквивалента, вводимая субъекту, находится в диапазоне от 1 до 100 мг, от 25 до 75 мг, от 30 до 60 мг, от 40 до 80 мг, от 20 до 80 мг, от 1 до 25 мг, от 1 до 50 мг, от 10 до 90 мг, от 15 до 85 мг или диапазонах между этими значениями. В некоторых вариантах осуществления доза может составлять около 5 мг, около 10 мг, около 15 мг, около 20 мг, около 25 мг, около 30 мг, около 35 мг, около 40 мг, около 45 мг, около 50 мг, около 55 мг, около 60 мг, около 65 мг, около 70 мг, около 75 мг, около 80 мг, около 85 мг, около 90 мг, около 95 мг, около 100 мг, около 105 мг, около 110 мг, около 115 мг, около 120 мг или больше. В некоторых вариантах осуществления доза может составлять 5 мг, 10 мг, 15 мг, 20 мг, 25 мг, 30 мг, 35 мг, 40 мг, 45 мг, 50 мг, 55 мг, 60 мг, 65 мг, 70 мг, 75 мг, 80 мг, 85 мг, 90 мг, 95 мг, 100 мг, 105 мг, 110 мг, 115 мг, 120 мг или больше.
[0098] В конкретных вариантах осуществления нагрузочную дозу, составляющую около 60 мг немолизумаба или его эквивалента, можно вводить нуждающемуся в этом субъекту, после чего следует введение последующих серийных доз немолизумаба или его эквивалента в количестве около 30 мг один раз каждые 4 недели.
[0099] В некоторых вариантах осуществления способов немолизумаб или его эквивалент вводят местным или парентеральным путем. В некоторых вариантах осуществления способов немолизумаб или его эквивалент вводят подкожно. В некоторых вариантах осуществления дозу вводят подкожно в месте одного или более узелков или вблизи него.
[0100] В некоторых вариантах осуществления немолизумаб или его эквивалент вводят ежесуточно, через сутки, дважды в неделю, три раза в неделю, четыре раза в неделю, пять раз в неделю, шесть раз в неделю, один раз в неделю, один раз каждые две недели, один раз каждые три недели, один раз каждые четыре недели, один раз каждые пять недель, один раз каждые шесть недель, один раз каждые семь недель, один раз каждые восемь недель, один раз каждые девять недель, один раз каждые 10 недель, один раз каждые 11 недель, один раз каждые 12 недель, дважды в год, один раз в год и/или по необходимости на основании внешнего вида и симптомов атопического дерматита или зуда (например, ХП или УП). В предпочтительных вариантах осуществления немолизумаб или его эквивалент вводят каждые четыре недели или каждые восемь недель.
[0101] В некоторых вариантах осуществления длительность лечения составляет около одних суток, около одной недели, около двух недель, около трех недель, около четырех недель, около пяти недель, около шести недель, около семи недель, около восьми недель, около девяти недель, около 10 недель, около 11 недель, около 12 недель, около 13 недель, около 14 недель, около 15 недель, около 16 недель, около 17 недель, около 18 недель, около 19 недель, около 20 недель, около 24 недель, около 30 недель, около 36 недель, около 40 недель, около 48 недель, около 50 недель, около одного года, около двух лет, около трех лет, около четырех лет, около пяти лет или по необходимости на основании внешнего вида и симптомов атопического дерматита или зуда (например, ХП или УП). В предпочтительных вариантах осуществления длительность лечения составляет от около 12 недель до около 24 недель, от около 12 до около 36 недель, от около 12 до около 48 недель или от около 24 до около 36 недель.
[0102] В соответствии с некоторыми вариантами осуществления предложены применения немолизумаба или его эквивалента в производстве лекарственного средства для лечения почесухи у субъекта, имеющего узловатую почесуху (УП).
[0103] В некоторых вариантах осуществления применений почесуха является умеренной или тяжелой. В некоторых вариантах осуществления применений УП диагностирована у субъекта в течение по меньшей мере 6 месяцев. В конкретных вариантах осуществления применений субъект имеет по меньшей мере 20 узелков на своем теле с двухсторонним распределением. В конкретных вариантах осуществления применений субъект имеет связанные с почесухой поражения на верхних конечностях с поражениями на туловище или нижних конечностях или без них. В конкретных вариантах осуществления способов зуду была приписана оценка по меньшей мере 7 по цифровой рейтинговой шкале (ЦРШ). В конкретных вариантах осуществления применений среднее значение оценки ЦРШ для наихудшей суточной интенсивности составляет по меньшей мере 7 в течение предыдущих 3 суток. В других конкретных вариантах осуществления применений среднее значение оценки ЦРШ для наихудшей суточной интенсивности составляет по меньшей мере 7 в течение предыдущей недели.
[0104] В некоторых вариантах осуществления применений субъект не имеет атопический дерматит. В некоторых вариантах осуществления применений субъект не имеет хроническую почесуху в результате патологического состояния, отличного от УП, такого как чесотка, укус насекомого, простой хронический лишай, псориаз, акне, фолликулит, привычная дерматилломания, лимфоматоидный папулез, хронический лучевой дерматит, герпетиформный дерматит, споротрихоз, буллезное заболевание. В некоторых вариантах осуществления применений субъект не имеет невропатическую или психогенную почесуху, такую как парестетическая ноталгия, плечелучевая почесуха, дилюционный паразитоз, патомимия.
ПРИМЕРЫ
Пример 1. Определение эффективности немолизумаба в лечении зуда у пациентов с УП.
[0105] Проводили многоцентровое (20 центров в ЕС и США), рандомизированное, двойное слепое, плацебо-контролируемое исследование в параллельных группах, включающее приблизительно 70 рандомизированных пациентов в 2 группах (по 35 на группу), стратифицированных на фоне атопии. Включенные пациенты подкожно получали немолизумаб или плацебо в дозе 0,5 мг/кг каждые 4 недели. Пациентов отбирали на основании следующих критериев.
[0106] Критерии включения:
[0107] 1. Мужчина или женщина возрастом по меньшей мере 18 лет на момент скрининга.
[0108] 2. Клинический диагноз УП в течение по меньшей мере 6 месяцев с: (a) связанными с почесухой поражениями на верхних конечностях с поражениями на туловище или нижних конечностях или без них, и (b) по меньшей мере 20 узелками на всем теле с двухсторонним распределением
[0109] 3. Сильный зуд по цифровой рейтинговой шкале (ЦРШ). ЦРШ определяют как во время скринингового визита, так и во время визита для оценки исходного уровня. Скрининговый визит: Среднее значение оценки ЦРШ для наихудшей суточной интенсивности ≥ 7 в течение предыдущих 3 суток. Визит для оценки исходного уровня: Среднее значение оценки ЦРШ для наихудшей суточной интенсивности ≥ 7 в течение предыдущей недели.
[0110] 4. Субъекты женского пола должны соответствовать следующим критериям: (a) субъекты женского пола, неспособные к деторождению (после менопаузы, т. е. отсутствие менструального кровотечения в течение 1 года до скрининга без любой другой медицинской причины, гистероэктомии или двусторонней овариэктомии); (b) субъекты женского пола, способные к деторождению, которые согласились придерживаться полного воздержания (если это соответствует предпочитаемому и обычному образу жизни субъекта) или использовать эффективный метод контрацепции на протяжении клинического исследования и в течение 120 суток после последнего введения исследуемого лекарственного препарата.
[0111] Пациенты со следующими патологическими состояниями исключаются.
[0112] Критерии исключения:
[0113] 1. Хроническая почесуха в результате патологического состояния, отличного от УП, такого как чесотка, укус насекомого, простой хронический лишай, псориаз, акне, фолликулит, привычная дерматилломания, лимфоматоидный папулез, хронический лучевой дерматит, герпетиформный дерматит, споротрихоз, буллезное заболевание.
[0114] 2. Односторонние связанные с почесухой поражения (например, поражена только одна рука).
[0115] 3. Кожная бактериальная или вирусная инфекция в течение 1 недели до визита для оценки исходного уровня.
[0116] 4. Инфекция, требующая лечения пероральными или парентеральными антибиотиками, противовирусными препаратами, противопаразитарными препаратами или противогрибковыми препаратами, в течение 1 недели до скринингового визита или во время периода скрининга, если она не полностью разрешена на момент скринингового визита/визита для оценки исходного уровня, соответственно.
[0117] 5. Любое неконтролируемое или серьезное заболевание или любое медицинское или хирургическое состояние, которое может помешать интерпретировать результаты клинического исследования и/или подвергнуть субъекта значительному риску по мнению Исследователя (например, солидный рак, СПИД, серьезное или неконтролируемое сердечное заболевание), на момент скрининга или на исходном уровне.
[0118] 6. Любые активные дерматозы, для которых необходима немедленная терапия.
[0119] 7. Активный атопический дерматит или повторяющиеся вспышки атопического дерматита.
[0120] 8. Невропатический или психогенный зуд (парестетическая ноталгия, плечелучевая почесуха, дилюционный паразитоз, патомимия).
[0121] 9. Положительные серологические результаты в отношении поверхностного антигена гепатита B (HBsAg) или корового антитела гепатита B (HBcAb), антител к гепатиту C или антител к вирусу иммунодефицита человека (ВИЧ) на момент скринингового визита.
[0122] 10. Аномальные лабораторные показатели, перечисленные ниже, на момент скринингового визита: повышение АЛТ/АСТ ≥ 3 ВПН , повышение КФК > 1,5 ВПН, число нейтрофилов < 1,5×103/мкл , клиренс креатинина < 60 мл/мин/1,73 м²;
[0123] 11. Наличие в анамнезе астмы, которая соответствует любому одному или более из условий:(i) ухудшение астмы, требующее госпитализации, за последние 12 месяцев до скринингового визита; (ii) астма не подлежит нормальному контролю (т. е. симптомы > 2 суток в неделю, пробуждение в ночное время > 1-3 раза в неделю или некоторые препятствия обычным видам деятельности) во время последних 3 месяцев до скринингового визита; ПСВ < 80% от прогнозируемого значения на момент скринингового визита или визита для оценки исходного уровня.
[0124] 12. Латентный или активный туберкулез, определяемый по положительному результату квантиферонового теста на туберкулез на момент скринингового визита.
[0125] 13. Получение любых запрещенных видов лечения в определенных временных рамках до визита для оценки исходного уровня:
Таблица 1. Запрещенная терапия
[0126] Если Исследователь посчитает это необходимым с медицинской точки зрения, с 29 суток с исследуемым лекарственным препаратом можно применять экстренные варианты лечения. Все оценки по эффективности и безопасности должны быть завершены до начала применения экстренных вариантов лечения.
[0127] Таблица 2. Экстренная терапия
совместное применение антигистаминных средств и
МКС умеренной силы
[0128] Конечные точки:
[0129] Первичной конечной точкой исследования было процентное снижение относительно исходного уровня (ИУ) оценки зуда по ЦРШ на 4 неделе.
[0130] Вторичными конечными точками исследования было снижение на момент каждого визита до 18 недели, характеризуемой ЦРШ, ВРШ или DPS. Оценки безопасности также проводили во вторичной конечной точке. Ремиссию почесухи характеризовали по оценке активности почесухи (ОАП) и ООИ.
Определяли фармакокинетический (ФК) профиль пациентов с УП. Фармакодинамический (ФД) профиль пациентов с УП определяли по образцам крови, биопсии и D-чешуек пациентов. Качество жизни пациентов с УП определяли по ДИКЖ. Для оценки улучшения сна и расчесывания применяли актиграфию (с помощью Actiwatch). Фотографии пациентов с УП получали с помощью системы fotofinder в выбранных центрах.
[0131] Результаты клинического исследования представлены в таблицах ниже.
Таблица 3. Демография и исходные характеристики
(N=36)
0,5 мг/кг (N=34)
Мужской
Женский
Раса
Белые
Черные/афроамериканцы
Азиаты
Другие
Возраст (в годах)
Среднее значение (СО)
Диапазон
22 (61,1%)
35 (97,2%)
1 (2,8%)
0
0
52,4 (17,47)
20-77
19 (55,9%)
33 (97,1%)
1 (2,9%)
0
0
59,7 (13,16)
26-85
41 (58,6%)
68 (97,1%)
2 (2,9%)
0
0
56,0 (15,85)
20-85
Среднее значение (СО) (кг)
80,30 (20,716)
81,61 (21,766)
80,94 (21,088)
Примечание: Процентные значения получены с учетом числа субъектов, имеющих не пропущенное значение, в соответствующей группе лечения.
[0132] Как показано в таблице 3, группа плацебо и группа лечения немолизумабом имели в исследовании сравнимые составы по полу, расе, возрасту и массе.
Таблица 4. Исходные клинические характеристики заболевания
(N=36)
0,5 мг/кг (N=34)
Атопический фон
Присутствует
Отсутствует
Число узелков на всем теле, n (%)
20-100
> 100
Недельная оценка ЦРШ максимального зуда
Среднее ± СО
Диапазон
Недельная средняя оценка ЦРШ зуда
Среднее (СО)
Общая оценка исследователем (ООИ), n (%)
Умеренный
Сильный
Исходная оценка ДИКЖ (диапазон 0-30)
Среднее ± СО
6 (16,7%)
30 (83,3%)
21 (58,3)
15 (41,7)
8,4 (1,18)
(7-9)
34
7,9 (1,28)
22 (61,1)
14 (38,9)
15,8 ± 6,0
5 (14,7%)
29 (85,3%)
21 (61,8)
13 (38,2)
8,4 (1,19)
(8-9)
33
7,8 (1,66)
16 (47,1)
18 (52,9)
16,9 ± 7,5
1
1 (15,7%)
59 (84,3%)
42 (60,0)
28 (40,0)
8,4 (1,17)
(8-9)
67
7,9 (1,47)
38 (54,3)
32 (45,7)
[0133] Как показано в таблице 4, группа плацебо и группа лечения немолизумабом имели в исследовании сравнимые исходные уровни зуда, определяемые по числу узелков на всем теле, недельной оценке максимального зуда по цифровой рейтинговой шкале (ЦРШ), недельной средней оценке зуда по ЦРШ и общей оценке исследователем (ООИ).
Таблица 5. Частота применения препаратов экстренной терапии
(N=36)
(N=34)
(N=70)
Местный препарат экстренной терапии (n)
Системный препарат экстренной терапии (n)
3 (8,3%)
2 (5,9%)
5 (7,1%)
[0134] Как показано в таблице 5, в группе плацебо было больше случаев применения местных препаратов экстренной терапии и системных препаратов экстренной терапии.
[0135] Результаты по эффективности приведены на Фиг. 2-15. В частности, в первичной конечной точке лечение немолизумабом существенно снижало зуд на 4 неделе, как проиллюстрировано процентным изменением относительно исходного уровня недельной средней оценки максимального зуда по ЦРШ (Фиг. 2). Таким образом, лечение немолизумабом в дозировке 0,5 мг/кг превосходит плацебо (-38%, 95% ДИ =[-51%, -25%], а результат является статистически значимым (p < 0,001) на 4 неделе.
[0136] Во вторичных конечных точках группа лечения немолизумабом соответственно демонстрирует большее снижение зуда в течение 18 недель исследования, на что указывают как процентное изменение (Фиг. 3), так и абсолютное изменение (Фиг. 4) оценки максимального зуда по ЦРШ, а результаты являются статистически значимыми (p < 0,001). Такие же результаты наблюдали как у пациентов с атопическим дерматитом, так и без него (Фиг. 5 и 6).
[0137] Значения общей оценки исследователя (ООИ) находятся в диапазоне от 0 (чисто) до 4 (тяжелое заболевание) и представлены как процентная доля пациентов в указанной популяции. Намного больший процент пациентов, которых лечили немолизумабом, достиг успеха по ООИ (ООИ 0/1) по сравнению с группой плацебо (Фиг. 7). Кроме того, распределение ООИ показывает, что в группе лечения немолизумабом был соответственно больший процент пациентов с меньшей ООИ, чем в группе плацебо (Фиг. 8). Эти результаты являются статистически значимыми (p < 0,05) на 12 неделе и 18 неделе.
[0138] Вербальная рейтинговая шкала (ВРШ) представляет собой одномерную шкалу, которая дает возможность пациентам описывать интенсивность зуда посредством постепенно возрастающих характеристик (1=отсутствие зуда и 4=очень сильный зуд). Другими словами, группа лечения немолизумабом демонстрирует соответственно большее процентное изменение отрицательного значения, что транслируется в большее снижение зуда в течение 18 недель исследования по сравнению с группой плацебо (Фиг. 9). Эти результаты являются статистически значимыми (p < 0,001).
[0139] Оценки дерматологического индекса качества жизни (ДИКЖ) находятся в диапазоне от 0 до 30, при этом более высокие оценки указывают на более низкое качество жизни. Как показано на Фиг. 10, в группе лечения немолизумабом был больший процент пациентов с ответом с ДИКЖ ≥ 4 по сравнению с группой плацебо как на 4 неделе, так и на 12 неделе. Как показано на Фиг. 11, изменение ДИКЖ относительно исходного уровня было статистически значимым (p < 0,01) в пользу немолизумаба на 4 неделе, но не на 12 неделе.
[0140] Изображения всего тела получали для репрезентативных пациентов. Как показано на Фиг. 12-14, лечением немолизумабом существенно снижало число узелков на теле пациентов через 16 недель.
[0141] Предварительные результаты по безопасности
[0142] Как показано в таблицах 6 и 7, группа лечения немолизумабом и группа плацебо демонстрируют сравнимое число нежелательных явлений, возникших в ходе лечения (НЯВЛ) по всем причинам и сравнимую частоту НЯВЛ по системно-органному классу (СОК) по всем причинам. В целом, переносимость немолизумаба была хорошей.
Таблица 6. Общее резюме по безопасности по нежелательным явлениям, возникшим в ходе лечения (НЯВЛ) по всем причинам
(N=36)
0,5 мг/кг (N=34)
(N=70)
Субъекты с по меньшей мере одним НЯВЛ
Серьезное НЯВЛ
Тяжелое НЯВЛ
Летальное НЯВЛ
НЯВЛ, которое привело к временному прекращению приема лекарственного препарата
НЯВЛ, которое привело к постоянному прекращению приема лекарственного препарата
НЯВЛ, которое привело к прекращению участия в исследовании
24 (66,7%)
3 (8,3%)
1 (2,8%)
0
1 (2,8%)
1 (2,8%)
2 (5,6%)
23 (67,6%)
4 (11,8%)
5 (14,7%)
0
0
2 (5,9%)
2 (5,9%)
47 (67,1%)
7 (10,0%)
6 (8,6%)
0
1 (1,4%)
3 (4,3%)
4 (5,7%)
Таблица 7. Частота НЯВЛ по системно-органному классу (СОК) (> 5%), все случаи
0,5 мг/кг (N=34)
Нарушения со стороны кожи и подкожных тканей
Нарушения со стороны желудочно-кишечного тракта
Нарушения со стороны скелетно-мышечной и соединительной ткани
Общие нарушения и состояния в месте введения
Повреждение, отравление и процедурное осложнение
Нарушения со стороны почек и мочевых путей
Нарушения со стороны нервной системы
Респираторные, торакальные и медиастинальные нарушения
Нарушения со стороны кровеносной и лимфатической системы
Нарушения, связанные с метаболизмом и питанием
Психиатрические нарушения
Нарушения со стороны сосудов
12 (33,3%)
5 (13,9%)
5 (13,9%)
4 (11,1%)
2 (5,6%)
2 (5,6%)
1 (2,8%)
3 (8,3%)
2 (5,6%)
0
2 (5,6%)
2 (5,6%)
10 (29,4%)
7 (20,6%)
6 (17,6%)
5 (14,7%)
4 (11,8%)
2 (5,9%)
2 (5,9%)
0
0
2 (5,9%)
0
0
22 (31,4%)
12 (17,1%)
11 (15,7%)
9 (12,9%)
6 (8,6%)
4 (5,7%)
3 (4,3%)
3 (4,3%)
2 (2,9%)
2 (2,9%)
2 (2,9%)
2 (2,9%)
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> Nestle Skin Health S.A.
Christophe, Piketty
<120> ЛЕЧЕНИЕ ПОРАЖЕНИЙ КОЖИ И ЗУДА У ПАЦИЕНТОВ С УЗЛОВАТОЙ ПОЧЕСУХОЙ
<130> 105153-3004
<150> US 62/797,803
<151> 2019-01-28
<150> US 62/809,404
<151> 2019-02-22
<160> 6
<170> PatentIn, версия 3.5
<210> 1
<211> 662
<212> Белок
<213> Homo sapiens
<400> 1
Met Lys Leu Ser Pro Gln Pro Ser Cys Val Asn Leu Gly Met Met Trp
1 5 10 15
Thr Trp Ala Leu Trp Met Leu Pro Ser Leu Cys Lys Phe Ser Leu Ala
20 25 30
Ala Leu Pro Ala Lys Pro Glu Asn Ile Ser Cys Val Tyr Tyr Tyr Arg
35 40 45
Lys Asn Leu Thr Cys Thr Trp Ser Pro Gly Lys Glu Thr Ser Tyr Thr
50 55 60
Gln Tyr Thr Val Lys Arg Thr Tyr Ala Phe Gly Glu Lys His Asp Asn
65 70 75 80
Cys Thr Thr Asn Ser Ser Thr Ser Glu Asn Arg Ala Ser Cys Ser Phe
85 90 95
Phe Leu Pro Arg Ile Thr Ile Pro Asp Asn Tyr Thr Ile Glu Val Glu
100 105 110
Ala Glu Asn Gly Asp Gly Val Ile Lys Ser His Met Thr Tyr Trp Arg
115 120 125
Leu Glu Asn Ile Ala Lys Thr Glu Pro Pro Lys Ile Phe Arg Val Lys
130 135 140
Pro Val Leu Gly Ile Lys Arg Met Ile Gln Ile Glu Trp Ile Lys Pro
145 150 155 160
Glu Leu Ala Pro Val Ser Ser Asp Leu Lys Tyr Thr Leu Arg Phe Arg
165 170 175
Thr Val Asn Ser Thr Ser Trp Met Glu Val Asn Phe Ala Lys Asn Arg
180 185 190
Lys Asp Lys Asn Gln Thr Tyr Asn Leu Thr Gly Leu Gln Pro Phe Thr
195 200 205
Glu Tyr Val Ile Ala Leu Arg Cys Ala Val Lys Glu Ser Lys Phe Trp
210 215 220
Ser Asp Trp Ser Gln Glu Lys Met Gly Met Thr Glu Glu Glu Ala Pro
225 230 235 240
Cys Gly Leu Glu Leu Trp Arg Val Leu Lys Pro Ala Glu Ala Asp Gly
245 250 255
Arg Arg Pro Val Arg Leu Leu Trp Lys Lys Ala Arg Gly Ala Pro Val
260 265 270
Leu Glu Lys Thr Leu Gly Tyr Asn Ile Trp Tyr Tyr Pro Glu Ser Asn
275 280 285
Thr Asn Leu Thr Glu Thr Met Asn Thr Thr Asn Gln Gln Leu Glu Leu
290 295 300
His Leu Gly Gly Glu Ser Phe Trp Val Ser Met Ile Ser Tyr Asn Ser
305 310 315 320
Leu Gly Lys Ser Pro Val Ala Thr Leu Arg Ile Pro Ala Ile Gln Glu
325 330 335
Lys Ser Phe Gln Cys Ile Glu Val Met Gln Ala Cys Val Ala Glu Asp
340 345 350
Gln Leu Val Val Lys Trp Gln Ser Ser Ala Leu Asp Val Asn Thr Trp
355 360 365
Met Ile Glu Trp Phe Pro Asp Val Asp Ser Glu Pro Thr Thr Leu Ser
370 375 380
Trp Glu Ser Val Ser Gln Ala Thr Asn Trp Thr Ile Gln Gln Asp Lys
385 390 395 400
Leu Lys Pro Phe Trp Cys Tyr Asn Ile Ser Val Tyr Pro Met Leu His
405 410 415
Asp Lys Val Gly Glu Pro Tyr Ser Ile Gln Ala Tyr Ala Lys Glu Gly
420 425 430
Val Pro Ser Glu Gly Pro Glu Thr Lys Val Glu Asn Ile Gly Val Lys
435 440 445
Thr Val Thr Ile Thr Trp Lys Glu Ile Pro Lys Ser Glu Arg Lys Gly
450 455 460
Ile Ile Cys Asn Tyr Thr Ile Phe Tyr Gln Ala Glu Gly Gly Lys Gly
465 470 475 480
Phe Ser Lys Thr Val Asn Ser Ser Ile Leu Gln Tyr Gly Leu Glu Ser
485 490 495
Leu Lys Arg Lys Thr Ser Tyr Ile Val Gln Val Met Ala Ser Thr Ser
500 505 510
Ala Gly Gly Thr Asn Gly Thr Ser Ile Asn Phe Lys Thr Leu Ser Phe
515 520 525
Ser Val Phe Glu Ile Ile Leu Ile Thr Ser Leu Ile Gly Gly Gly Leu
530 535 540
Leu Ile Leu Ile Ile Leu Thr Val Ala Tyr Gly Leu Lys Lys Pro Asn
545 550 555 560
Lys Leu Thr His Leu Cys Trp Pro Thr Val Pro Asn Pro Ala Glu Ser
565 570 575
Ser Ile Ala Thr Trp His Gly Asp Asp Phe Lys Asp Lys Leu Asn Leu
580 585 590
Lys Glu Ser Asp Asp Ser Val Asn Thr Glu Asp Arg Ile Leu Lys Pro
595 600 605
Cys Ser Thr Pro Ser Asp Lys Leu Val Ile Asp Lys Leu Val Val Asn
610 615 620
Phe Gly Asn Val Leu Gln Glu Ile Phe Thr Asp Glu Ala Arg Thr Gly
625 630 635 640
Gln Glu Asn Asn Leu Gly Gly Glu Lys Asn Gly Thr Arg Ile Leu Ser
645 650 655
Ser Cys Pro Thr Ser Ile
660
<210> 2
<211> 732
<212> Белок
<213> Homo sapiens
<400> 2
Met Met Trp Thr Trp Ala Leu Trp Met Leu Pro Ser Leu Cys Lys Phe
1 5 10 15
Ser Leu Ala Ala Leu Pro Ala Lys Pro Glu Asn Ile Ser Cys Val Tyr
20 25 30
Tyr Tyr Arg Lys Asn Leu Thr Cys Thr Trp Ser Pro Gly Lys Glu Thr
35 40 45
Ser Tyr Thr Gln Tyr Thr Val Lys Arg Thr Tyr Ala Phe Gly Glu Lys
50 55 60
His Asp Asn Cys Thr Thr Asn Ser Ser Thr Ser Glu Asn Arg Ala Ser
65 70 75 80
Cys Ser Phe Phe Leu Pro Arg Ile Thr Ile Pro Asp Asn Tyr Thr Ile
85 90 95
Glu Val Glu Ala Glu Asn Gly Asp Gly Val Ile Lys Ser His Met Thr
100 105 110
Tyr Trp Arg Leu Glu Asn Ile Ala Lys Thr Glu Pro Pro Lys Ile Phe
115 120 125
Arg Val Lys Pro Val Leu Gly Ile Lys Arg Met Ile Gln Ile Glu Trp
130 135 140
Ile Lys Pro Glu Leu Ala Pro Val Ser Ser Asp Leu Lys Tyr Thr Leu
145 150 155 160
Arg Phe Arg Thr Val Asn Ser Thr Ser Trp Met Glu Val Asn Phe Ala
165 170 175
Lys Asn Arg Lys Asp Lys Asn Gln Thr Tyr Asn Leu Thr Gly Leu Gln
180 185 190
Pro Phe Thr Glu Tyr Val Ile Ala Leu Arg Cys Ala Val Lys Glu Ser
195 200 205
Lys Phe Trp Ser Asp Trp Ser Gln Glu Lys Met Gly Met Thr Glu Glu
210 215 220
Glu Ala Pro Cys Gly Leu Glu Leu Trp Arg Val Leu Lys Pro Ala Glu
225 230 235 240
Ala Asp Gly Arg Arg Pro Val Arg Leu Leu Trp Lys Lys Ala Arg Gly
245 250 255
Ala Pro Val Leu Glu Lys Thr Leu Gly Tyr Asn Ile Trp Tyr Tyr Pro
260 265 270
Glu Ser Asn Thr Asn Leu Thr Glu Thr Met Asn Thr Thr Asn Gln Gln
275 280 285
Leu Glu Leu His Leu Gly Gly Glu Ser Phe Trp Val Ser Met Ile Ser
290 295 300
Tyr Asn Ser Leu Gly Lys Ser Pro Val Ala Thr Leu Arg Ile Pro Ala
305 310 315 320
Ile Gln Glu Lys Ser Phe Gln Cys Ile Glu Val Met Gln Ala Cys Val
325 330 335
Ala Glu Asp Gln Leu Val Val Lys Trp Gln Ser Ser Ala Leu Asp Val
340 345 350
Asn Thr Trp Met Ile Glu Trp Phe Pro Asp Val Asp Ser Glu Pro Thr
355 360 365
Thr Leu Ser Trp Glu Ser Val Ser Gln Ala Thr Asn Trp Thr Ile Gln
370 375 380
Gln Asp Lys Leu Lys Pro Phe Trp Cys Tyr Asn Ile Ser Val Tyr Pro
385 390 395 400
Met Leu His Asp Lys Val Gly Glu Pro Tyr Ser Ile Gln Ala Tyr Ala
405 410 415
Lys Glu Gly Val Pro Ser Glu Gly Pro Glu Thr Lys Val Glu Asn Ile
420 425 430
Gly Val Lys Thr Val Thr Ile Thr Trp Lys Glu Ile Pro Lys Ser Glu
435 440 445
Arg Lys Gly Ile Ile Cys Asn Tyr Thr Ile Phe Tyr Gln Ala Glu Gly
450 455 460
Gly Lys Gly Phe Ser Lys Thr Val Asn Ser Ser Ile Leu Gln Tyr Gly
465 470 475 480
Leu Glu Ser Leu Lys Arg Lys Thr Ser Tyr Ile Val Gln Val Met Ala
485 490 495
Ser Thr Ser Ala Gly Gly Thr Asn Gly Thr Ser Ile Asn Phe Lys Thr
500 505 510
Leu Ser Phe Ser Val Phe Glu Ile Ile Leu Ile Thr Ser Leu Ile Gly
515 520 525
Gly Gly Leu Leu Ile Leu Ile Ile Leu Thr Val Ala Tyr Gly Leu Lys
530 535 540
Lys Pro Asn Lys Leu Thr His Leu Cys Trp Pro Thr Val Pro Asn Pro
545 550 555 560
Ala Glu Ser Ser Ile Ala Thr Trp His Gly Asp Asp Phe Lys Asp Lys
565 570 575
Leu Asn Leu Lys Glu Ser Asp Asp Ser Val Asn Thr Glu Asp Arg Ile
580 585 590
Leu Lys Pro Cys Ser Thr Pro Ser Asp Lys Leu Val Ile Asp Lys Leu
595 600 605
Val Val Asn Phe Gly Asn Val Leu Gln Glu Ile Phe Thr Asp Glu Ala
610 615 620
Arg Thr Gly Gln Glu Asn Asn Leu Gly Gly Glu Lys Asn Gly Tyr Val
625 630 635 640
Thr Cys Pro Phe Arg Pro Asp Cys Pro Leu Gly Lys Ser Phe Glu Glu
645 650 655
Leu Pro Val Ser Pro Glu Ile Pro Pro Arg Lys Ser Gln Tyr Leu Arg
660 665 670
Ser Arg Met Pro Glu Gly Thr Arg Pro Glu Ala Lys Glu Gln Leu Leu
675 680 685
Phe Ser Gly Gln Ser Leu Val Pro Asp His Leu Cys Glu Glu Gly Ala
690 695 700
Pro Asn Pro Tyr Leu Lys Asn Ser Val Thr Ala Arg Glu Phe Leu Val
705 710 715 720
Ser Glu Lys Leu Pro Glu His Thr Lys Gly Glu Val
725 730
<210> 3
<211> 716
<212> Белок
<213> Mus musculus
<400> 3
Met Trp Thr Leu Ala Leu Trp Ala Phe Ser Phe Leu Cys Lys Phe Ser
1 5 10 15
Leu Ala Val Leu Pro Thr Lys Pro Glu Asn Ile Ser Cys Val Phe Tyr
20 25 30
Phe Asp Arg Asn Leu Thr Cys Thr Trp Arg Pro Glu Lys Glu Thr Asn
35 40 45
Asp Thr Ser Tyr Ile Val Thr Leu Thr Tyr Ser Tyr Gly Lys Ser Asn
50 55 60
Tyr Ser Asp Asn Ala Thr Glu Ala Ser Tyr Ser Phe Pro Arg Ser Cys
65 70 75 80
Ala Met Pro Pro Asp Ile Cys Ser Val Glu Val Gln Ala Gln Asn Gly
85 90 95
Asp Gly Lys Val Lys Ser Asp Ile Thr Tyr Trp His Leu Ile Ser Ile
100 105 110
Ala Lys Thr Glu Pro Pro Ile Ile Leu Ser Val Asn Pro Ile Cys Asn
115 120 125
Arg Met Phe Gln Ile Gln Trp Lys Pro Arg Glu Lys Thr Arg Gly Phe
130 135 140
Pro Leu Val Cys Met Leu Arg Phe Arg Thr Val Asn Ser Ser Arg Trp
145 150 155 160
Thr Glu Val Asn Phe Glu Asn Cys Lys Gln Val Cys Asn Leu Thr Gly
165 170 175
Leu Gln Ala Phe Thr Glu Tyr Val Leu Ala Leu Arg Phe Arg Phe Asn
180 185 190
Asp Ser Arg Tyr Trp Ser Lys Trp Ser Lys Glu Glu Thr Arg Val Thr
195 200 205
Met Glu Glu Val Pro His Val Leu Asp Leu Trp Arg Ile Leu Glu Pro
210 215 220
Ala Asp Met Asn Gly Asp Arg Lys Val Arg Leu Leu Trp Lys Lys Ala
225 230 235 240
Arg Gly Ala Pro Val Leu Glu Lys Thr Phe Gly Tyr His Ile Gln Tyr
245 250 255
Phe Ala Glu Asn Ser Thr Asn Leu Thr Glu Ile Asn Asn Ile Thr Thr
260 265 270
Gln Gln Tyr Glu Leu Leu Leu Met Ser Gln Ala His Ser Val Ser Val
275 280 285
Thr Ser Phe Asn Ser Leu Gly Lys Ser Gln Glu Ala Ile Leu Arg Ile
290 295 300
Pro Asp Val His Glu Lys Thr Phe Gln Tyr Ile Lys Ser Met Lys Ala
305 310 315 320
Tyr Ile Ala Glu Pro Leu Leu Val Val Asn Trp Gln Ser Ser Ile Pro
325 330 335
Ala Val Asp Thr Trp Ile Val Glu Trp Leu Pro Glu Ala Ala Met Ser
340 345 350
Lys Phe Pro Ala Leu Ser Trp Glu Ser Val Ser Gln Val Thr Asn Trp
355 360 365
Thr Ile Glu Gln Asp Lys Leu Lys Pro Phe Thr Cys Tyr Asn Ile Ser
370 375 380
Val Tyr Pro Val Leu Gly His Arg Val Gly Glu Pro Tyr Ser Ile Gln
385 390 395 400
Ala Tyr Ala Lys Glu Gly Thr Pro Leu Lys Gly Pro Glu Thr Arg Val
405 410 415
Glu Asn Ile Gly Leu Arg Thr Ala Thr Ile Thr Trp Lys Glu Ile Pro
420 425 430
Lys Ser Ala Arg Asn Gly Phe Ile Asn Asn Tyr Thr Val Phe Tyr Gln
435 440 445
Ala Glu Gly Gly Lys Glu Leu Ser Lys Thr Val Asn Ser His Ala Leu
450 455 460
Gln Cys Asp Leu Glu Ser Leu Thr Arg Arg Thr Ser Tyr Thr Val Trp
465 470 475 480
Val Met Ala Ser Thr Arg Ala Gly Gly Thr Asn Gly Val Arg Ile Asn
485 490 495
Phe Lys Thr Leu Ser Ile Ser Val Phe Glu Ile Val Leu Leu Thr Ser
500 505 510
Leu Val Gly Gly Gly Leu Leu Leu Leu Ser Ile Lys Thr Val Thr Phe
515 520 525
Gly Leu Arg Lys Pro Asn Arg Leu Thr Pro Leu Cys Cys Pro Asp Val
530 535 540
Pro Asn Pro Ala Glu Ser Ser Leu Ala Thr Trp Leu Gly Asp Gly Phe
545 550 555 560
Lys Lys Ser Asn Met Lys Glu Thr Gly Asn Ser Gly Asp Thr Glu Asp
565 570 575
Val Val Leu Lys Pro Cys Pro Val Pro Ala Asp Leu Ile Asp Lys Leu
580 585 590
Val Val Asn Phe Glu Asn Phe Leu Glu Val Val Leu Thr Glu Glu Ala
595 600 605
Gly Lys Gly Gln Ala Ser Ile Leu Gly Gly Glu Ala Asn Glu Tyr Val
610 615 620
Thr Ser Pro Ser Arg Pro Asp Gly Pro Pro Gly Lys Ser Phe Lys Glu
625 630 635 640
Pro Ser Val Leu Thr Glu Val Ala Ser Glu Asp Ser His Ser Thr Cys
645 650 655
Ser Arg Met Ala Asp Glu Ala Tyr Ser Glu Leu Ala Arg Gln Pro Ser
660 665 670
Ser Ser Cys Gln Ser Pro Gly Leu Ser Pro Pro Arg Glu Asp Gln Ala
675 680 685
Gln Asn Pro Tyr Leu Lys Asn Ser Val Thr Thr Arg Glu Phe Leu Val
690 695 700
His Glu Asn Ile Pro Glu His Ser Lys Gly Glu Val
705 710 715
<210> 4
<211> 735
<212> Белок
<213> Macaca fascicularis
<400> 4
Met Met Trp Thr Trp Ala Leu Trp Met Phe Pro Leu Leu Cys Lys Phe
1 5 10 15
Gly Leu Ala Ala Leu Pro Ala Lys Pro Glu Asn Ile Ser Cys Val Tyr
20 25 30
Tyr Tyr Arg Lys Asn Leu Thr Cys Thr Trp Ser Pro Gly Lys Glu Thr
35 40 45
Ser Tyr Thr Gln Tyr Thr Ala Lys Arg Thr Tyr Ala Phe Gly Lys Lys
50 55 60
His Asp Asn Cys Thr Thr Ser Ser Ser Thr Ser Glu Asn Arg Ala Ser
65 70 75 80
Cys Ser Phe Phe Leu Pro Arg Ile Thr Ile Pro Asp Asn Tyr Thr Ile
85 90 95
Glu Val Glu Ala Glu Asn Gly Asp Gly Val Ile Lys Ser Asp Met Thr
100 105 110
Cys Trp Arg Leu Glu Asp Ile Ala Lys Thr Glu Pro Pro Glu Ile Phe
115 120 125
Ser Val Lys Pro Val Leu Gly Ile Lys Arg Met Ile Arg Ile Glu Trp
130 135 140
Ile Lys Pro Glu Leu Ala Pro Val Ser Ser Asp Leu Lys Tyr Ala Leu
145 150 155 160
Arg Phe Arg Thr Val Asn Ser Thr Ser Trp Met Glu Val Asn Phe Ala
165 170 175
Lys Asn Arg Lys Asp Thr Asn Gln Thr Tyr Asn Leu Met Gly Leu Gln
180 185 190
Ala Phe Thr Glu Tyr Val Val Ala Leu Arg Cys Ala Val Lys Glu Ser
195 200 205
Lys Phe Trp Ser Asp Trp Ser Gln Glu Lys Met Gly Met Thr Glu Glu
210 215 220
Glu Ala Pro Cys Gly Leu Glu Leu Trp Arg Val Leu Lys Pro Thr Glu
225 230 235 240
Val Asp Gly Arg Arg Pro Val Arg Leu Leu Trp Lys Lys Ala Arg Gly
245 250 255
Ala Pro Val Leu Glu Lys Thr Leu Gly Tyr Asn Ile Trp Tyr Phe Pro
260 265 270
Glu Asn Asn Thr Asn Leu Thr Glu Thr Val Asn Thr Thr Asn Gln Gln
275 280 285
Leu Glu Leu His Leu Gly Gly Glu Ser Tyr Trp Val Ser Met Ile Ser
290 295 300
Tyr Asn Ser Leu Gly Lys Ser Pro Val Thr Thr Leu Arg Ile Pro Ala
305 310 315 320
Ile Gln Glu Lys Ser Phe Arg Cys Ile Glu Val Met Gln Ala Cys Leu
325 330 335
Ala Glu Asp Gln Leu Val Val Lys Trp Gln Ser Ser Ala Leu Asp Val
340 345 350
Asn Thr Trp Met Ile Glu Trp Phe Pro Asp Met Asp Ser Glu His Pro
355 360 365
Thr Leu Ser Trp Glu Ser Val Ser Gln Ala Thr Asn Trp Thr Ile Gln
370 375 380
Gln Asp Lys Leu Lys Pro Phe Trp Cys Tyr Asn Ile Ser Val Tyr Pro
385 390 395 400
Met Leu His Asp Lys Val Gly Glu Pro Tyr Ser Ile Gln Ala Tyr Ala
405 410 415
Lys Glu Gly Ile Pro Ser Lys Gly Pro Glu Thr Lys Val Glu Asn Ile
420 425 430
Gly Val Lys Thr Val Thr Ile Thr Trp Lys Glu Ile Pro Lys Ser Glu
435 440 445
Arg Lys Gly Ile Ile Cys Asn Tyr Thr Ile Phe Tyr Gln Ala Glu Gly
450 455 460
Gly Lys Gly Phe Ser Lys Thr Val Asn Ser Ser Ile Leu Gln Tyr Gly
465 470 475 480
Leu Glu Ser Leu Lys Arg Lys Thr Ser Tyr Thr Val Arg Val Met Ala
485 490 495
Ser Thr Ser Ala Gly Gly Ile Asn Gly Thr Ser Ile Asn Phe Lys Thr
500 505 510
Leu Ser Phe Ser Val Phe Glu Ile Ile Leu Ile Thr Ser Leu Ile Gly
515 520 525
Gly Gly Leu Leu Ile Leu Ile Ile Leu Thr Val Ala Tyr Gly Leu Lys
530 535 540
Lys Pro Asn Lys Leu Thr His Leu Cys Trp Pro Ser Val Pro Asn Pro
545 550 555 560
Ala Glu Ser Ser Ile Ala Thr Trp Arg Gly Asp Asp Phe Lys Asp Lys
565 570 575
Leu Asn Leu Lys Glu Ser Asp Asp Ser Val Asn Thr Glu Asp Arg Ile
580 585 590
Leu Lys Pro Cys Ser Thr Pro Ser Asp Lys Leu Val Ile Asp Lys Ser
595 600 605
Val Val Asn Phe Gly Asn Val Leu Gln Glu Met Phe Thr Asp Glu Ala
610 615 620
Arg Thr Gly Gln Glu Asn Asn Leu Gly Gly Glu Lys Asn Glu Tyr Val
625 630 635 640
Thr His Pro Phe Arg Ala Asp Cys Pro Leu Gly Lys Ser Phe Glu Glu
645 650 655
Leu Pro Val Ser Pro Glu Ile Pro Pro Arg Lys Ser Gln Tyr Leu Arg
660 665 670
Ser Arg Met Pro Glu Gly Thr Cys Leu Glu Ala Glu Glu Gln Leu Leu
675 680 685
Val Ser Gly Gln Ser Leu Glu Ser Leu Ala Pro Asp His Val Arg Glu
690 695 700
Ala Ala Ala Pro Asn Pro Tyr Leu Lys Asn Ser Val Thr Thr Arg Glu
705 710 715 720
Phe Leu Val Ser Gln Lys Leu Pro Glu His Thr Lys Gly Glu Val
725 730 735
<210> 5
<211> 445
<212> Белок
<213> Искусственная последовательность
<220>
<223> Аминокислотная последовательность тяжелой цепи немолизумаба
<400> 5
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Gly Tyr
20 25 30
Ile Met Asn Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Leu Ile Asn Pro Tyr Asn Gly Gly Thr Asp Tyr Asn Pro Gln Phe
50 55 60
Gln Asp Arg Val Thr Ile Thr Ala Asp Lys Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Asp Gly Tyr Asp Asp Gly Pro Tyr Thr Leu Glu Thr Trp Gly
100 105 110
Gln Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser
115 120 125
Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala
130 135 140
Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val
145 150 155 160
Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala
165 170 175
Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val
180 185 190
Pro Ser Ser Asn Phe Gly Thr Gln Thr Tyr Thr Cys Asn Val Asp His
195 200 205
Lys Pro Ser Asn Thr Lys Val Asp Lys Thr Val Glu Arg Lys Ser Cys
210 215 220
Val Glu Cys Pro Pro Cys Pro Ala Pro Pro Val Ala Gly Pro Ser Val
225 230 235 240
Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr
245 250 255
Pro Glu Val Thr Cys Val Val Val Asp Val Ser Gln Glu Asp Pro Glu
260 265 270
Val Gln Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys
275 280 285
Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser Thr Phe Arg Val Val Ser
290 295 300
Val Leu Thr Val Val His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys
305 310 315 320
Cys Lys Val Ser Asn Lys Gly Leu Pro Ala Pro Ile Glu Lys Thr Ile
325 330 335
Ser Lys Thr Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro
340 345 350
Pro Ser Gln Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu
355 360 365
Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn
370 375 380
Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Met Leu Asp Ser
385 390 395 400
Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg
405 410 415
Trp Gln Glu Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu
420 425 430
His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro
435 440 445
<210> 6
<211> 214
<212> Белок
<213> Искусственная последовательность
<220>
<223> Аминокислотная последовательность легкой цепи немолизумаба
<400> 6
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Gln Ala Ser Glu Asp Ile Tyr Ser Phe
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Asn Ala Gln Thr Glu Ala Gln Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln His His Tyr Asp Ser Pro Leu
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys Arg Thr Val Ala Ala
100 105 110
Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly
115 120 125
Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala
130 135 140
Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln
145 150 155 160
Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser
165 170 175
Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr
180 185 190
Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser
195 200 205
Phe Asn Arg Gly Glu Cys
210
<---
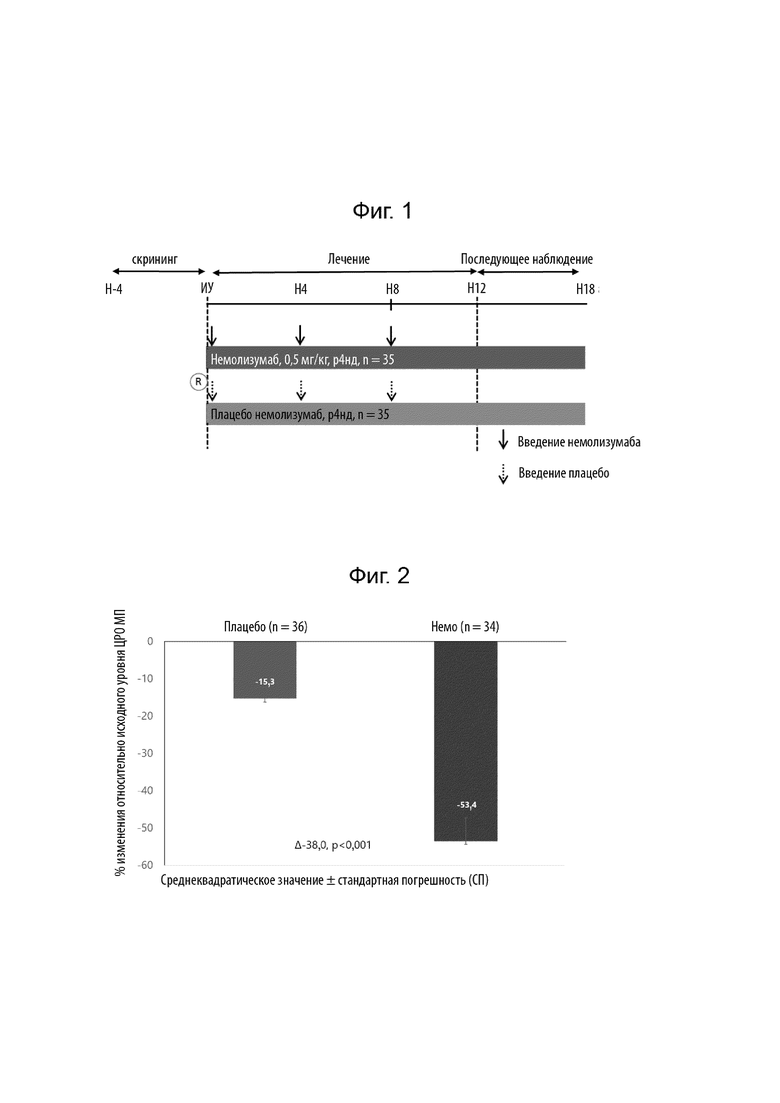
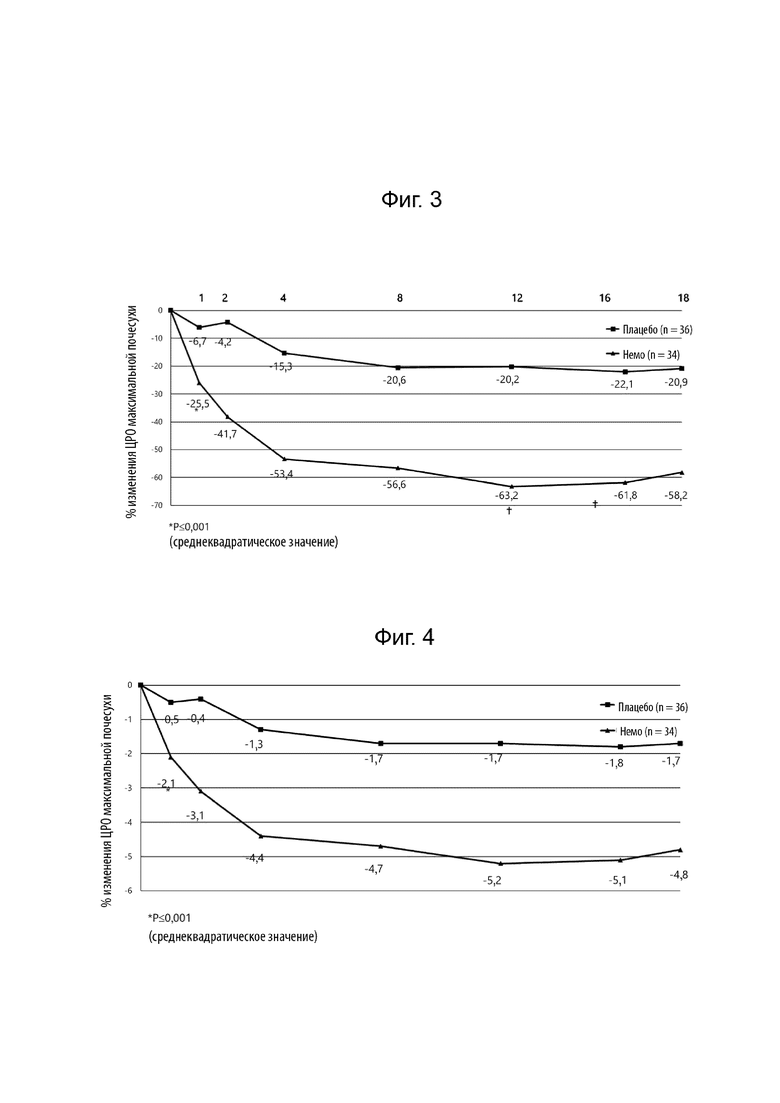
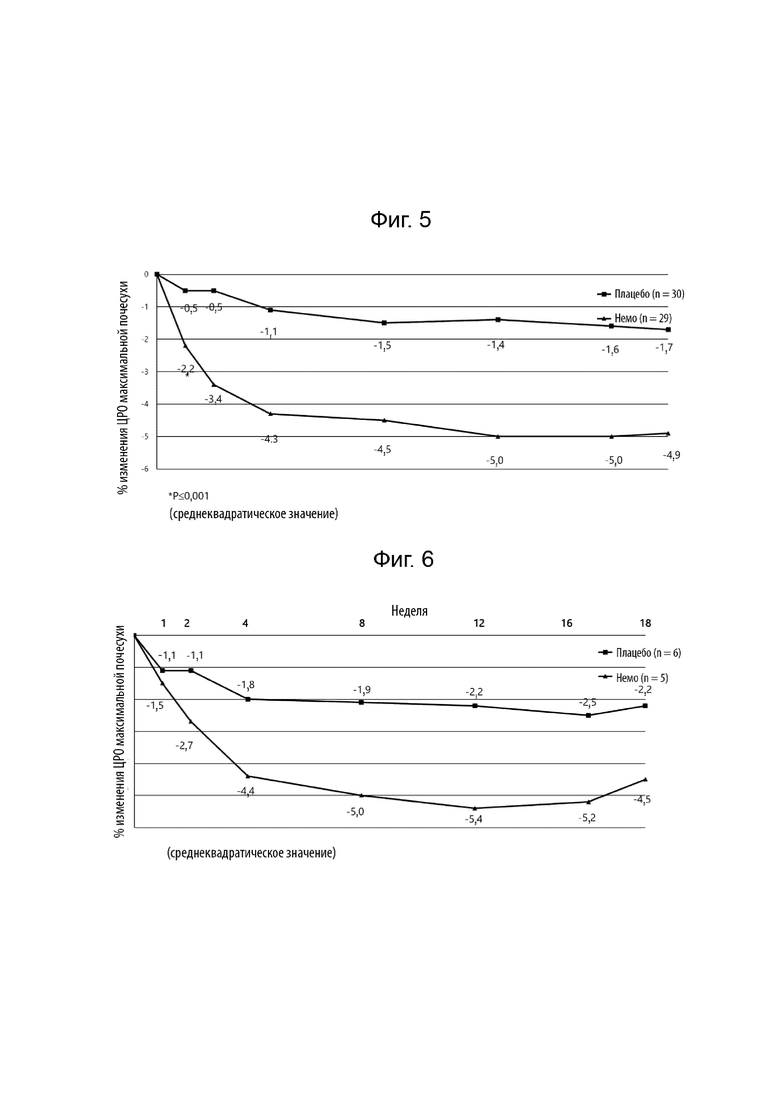
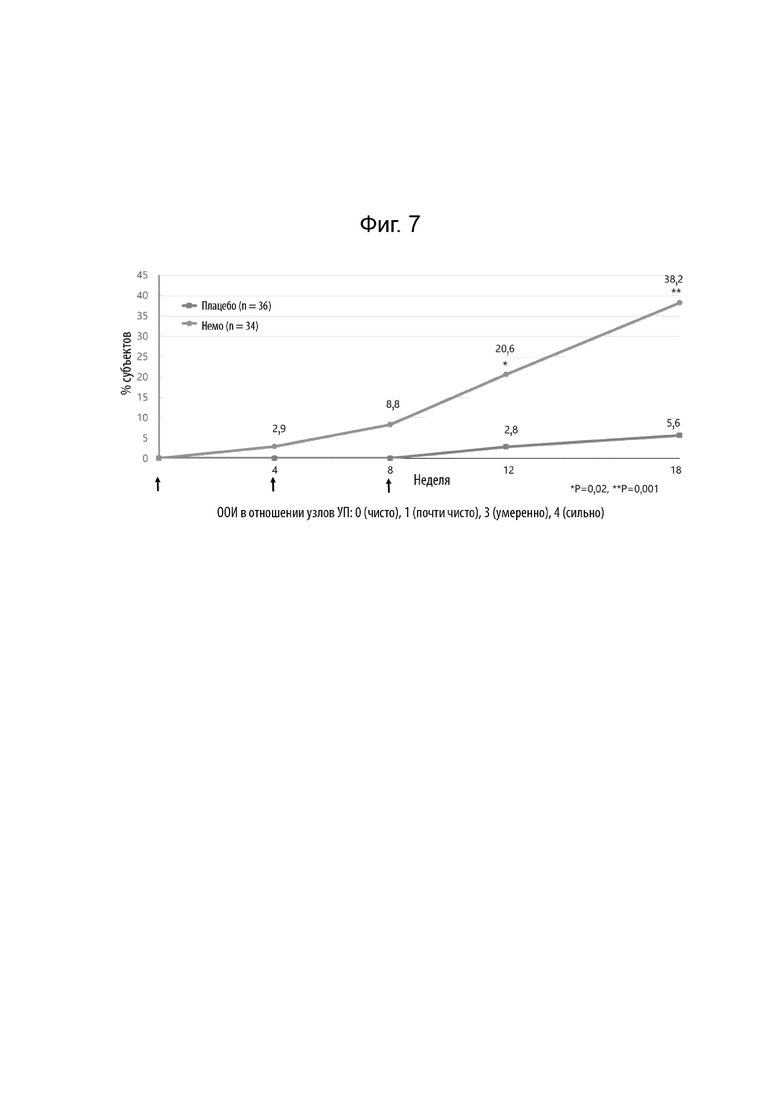
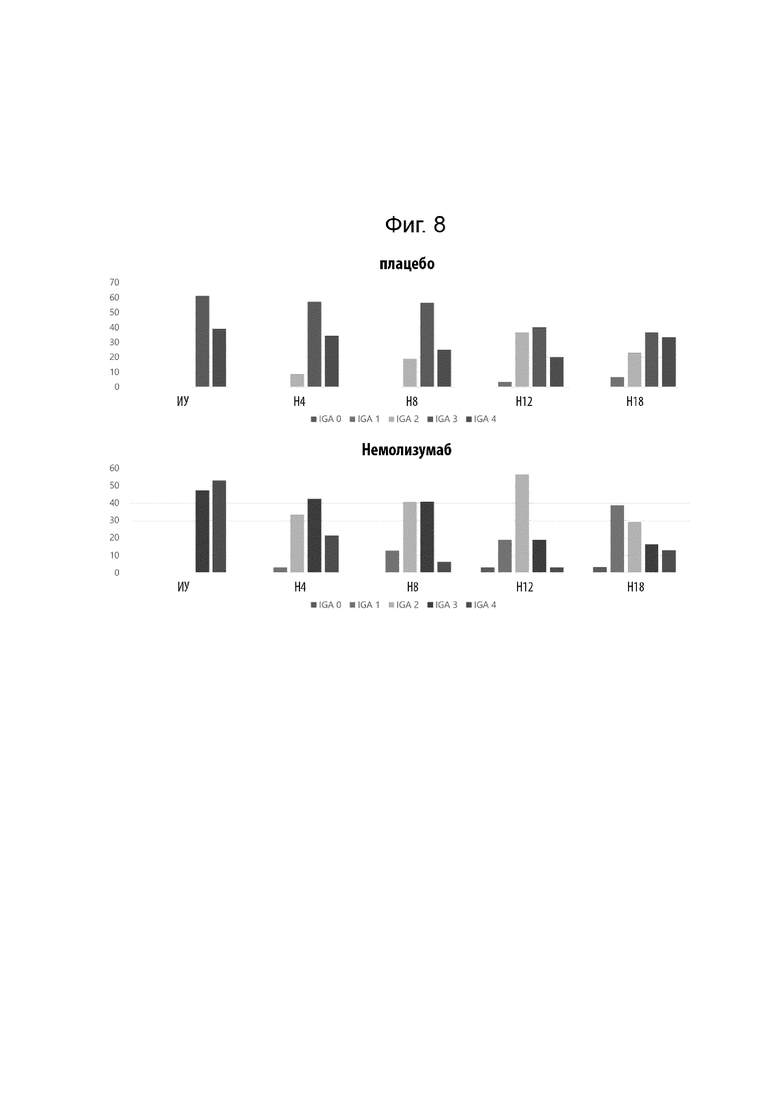
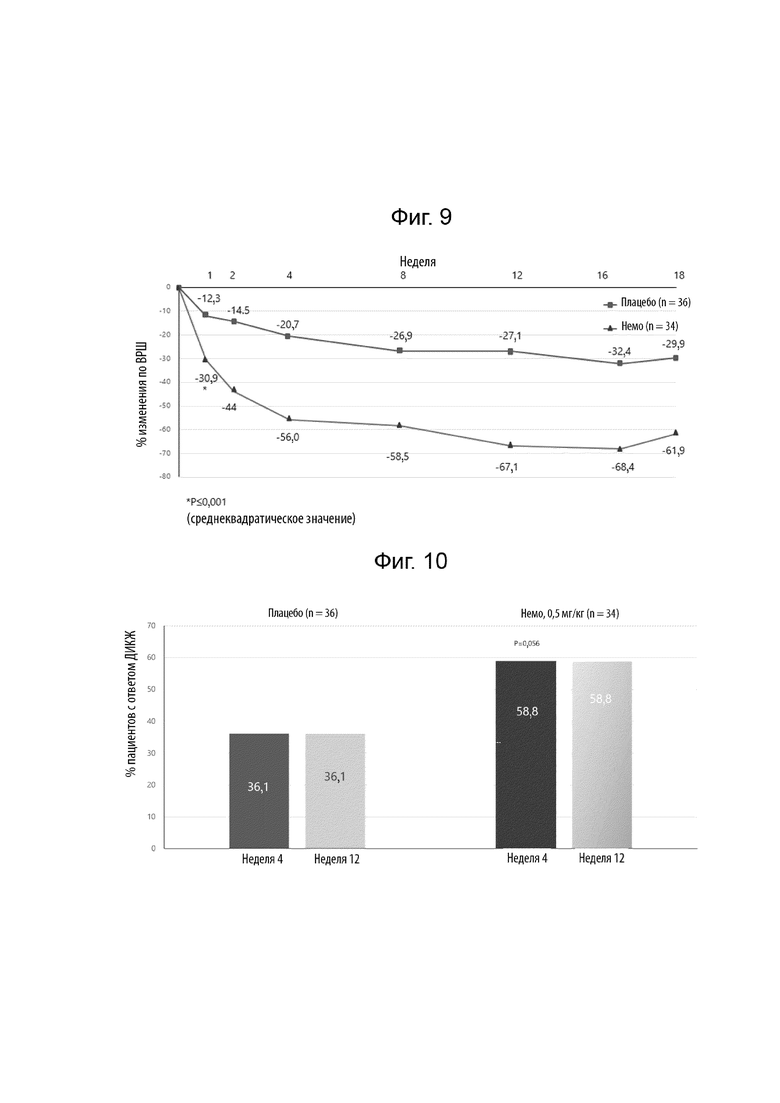
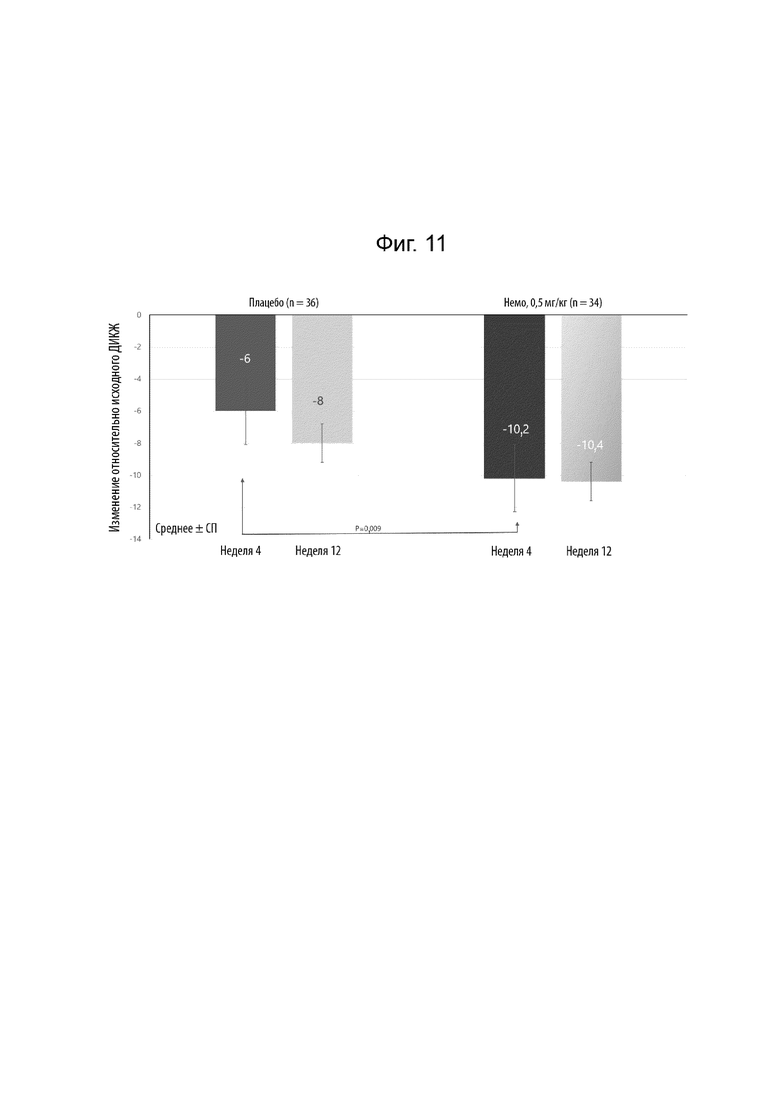
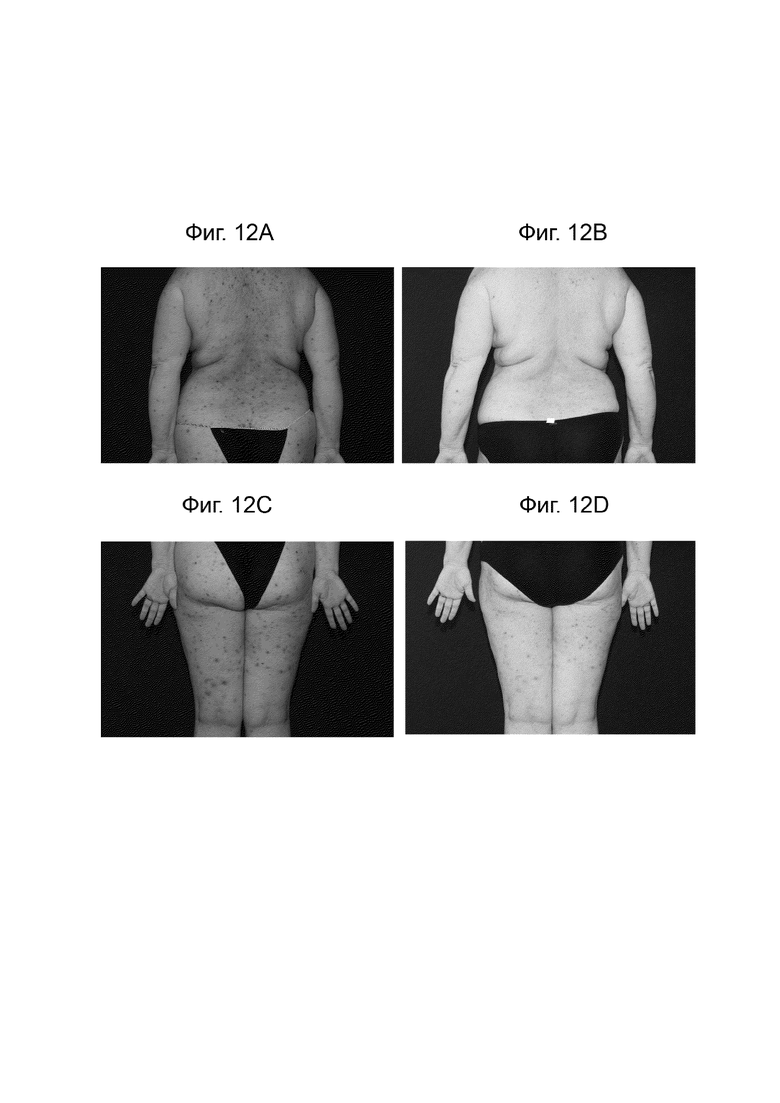
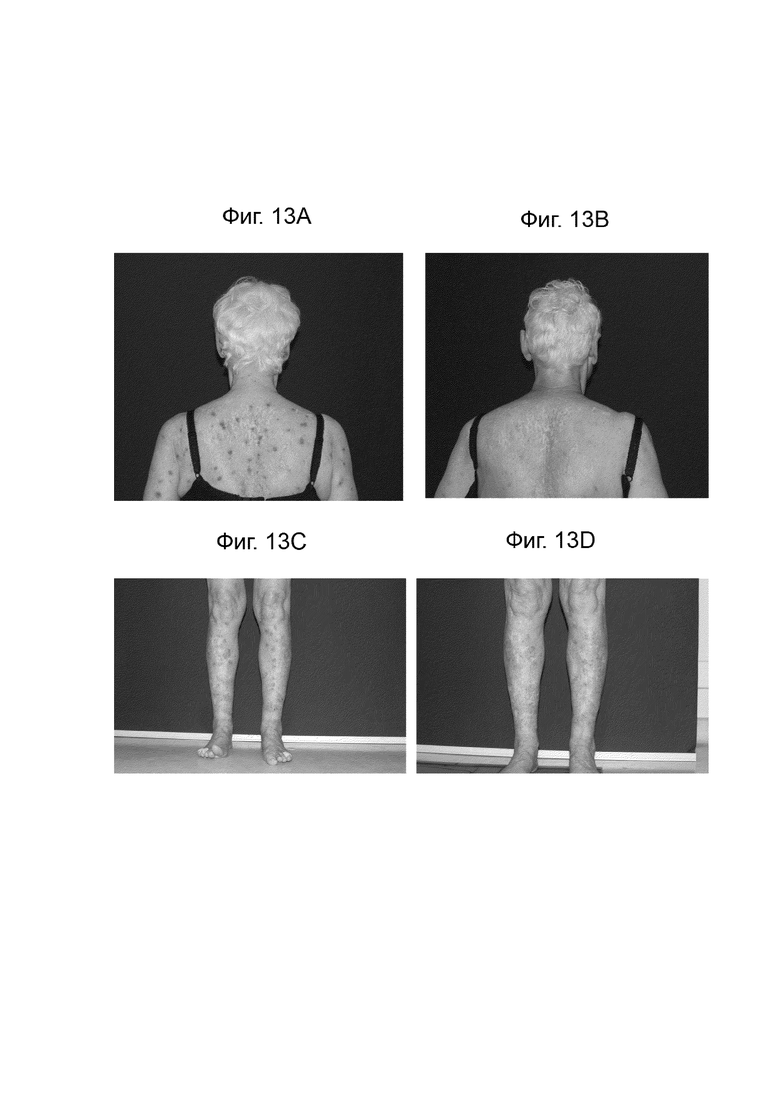
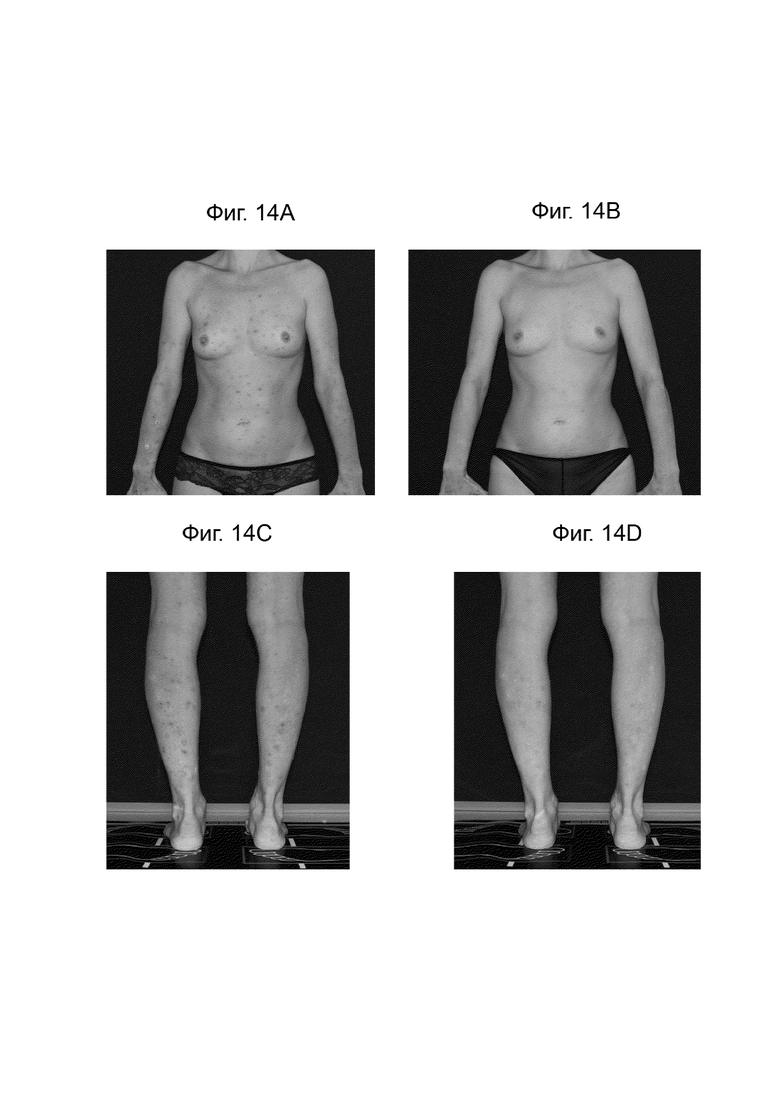
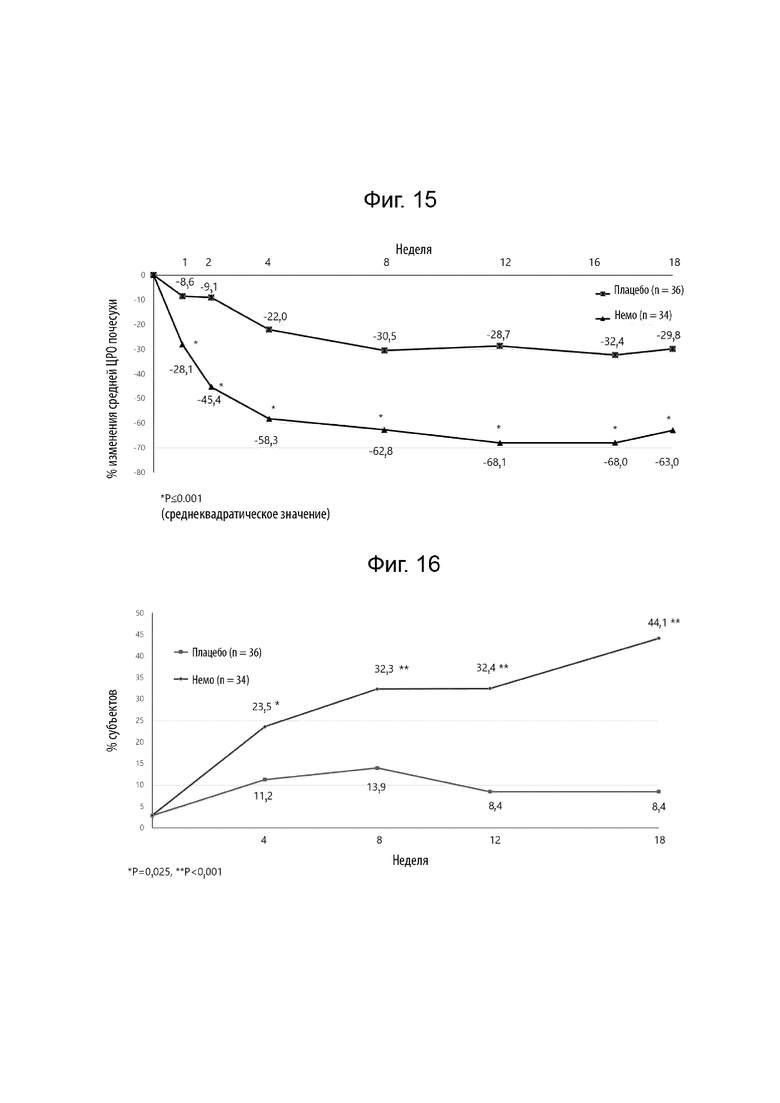
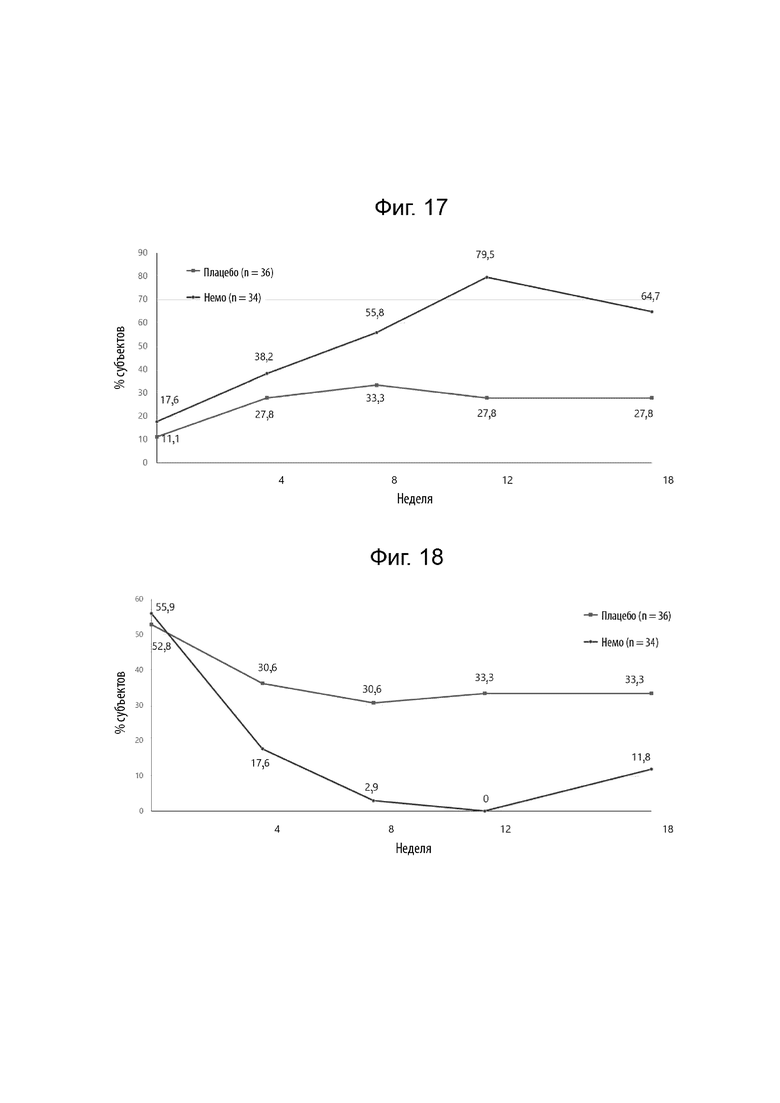
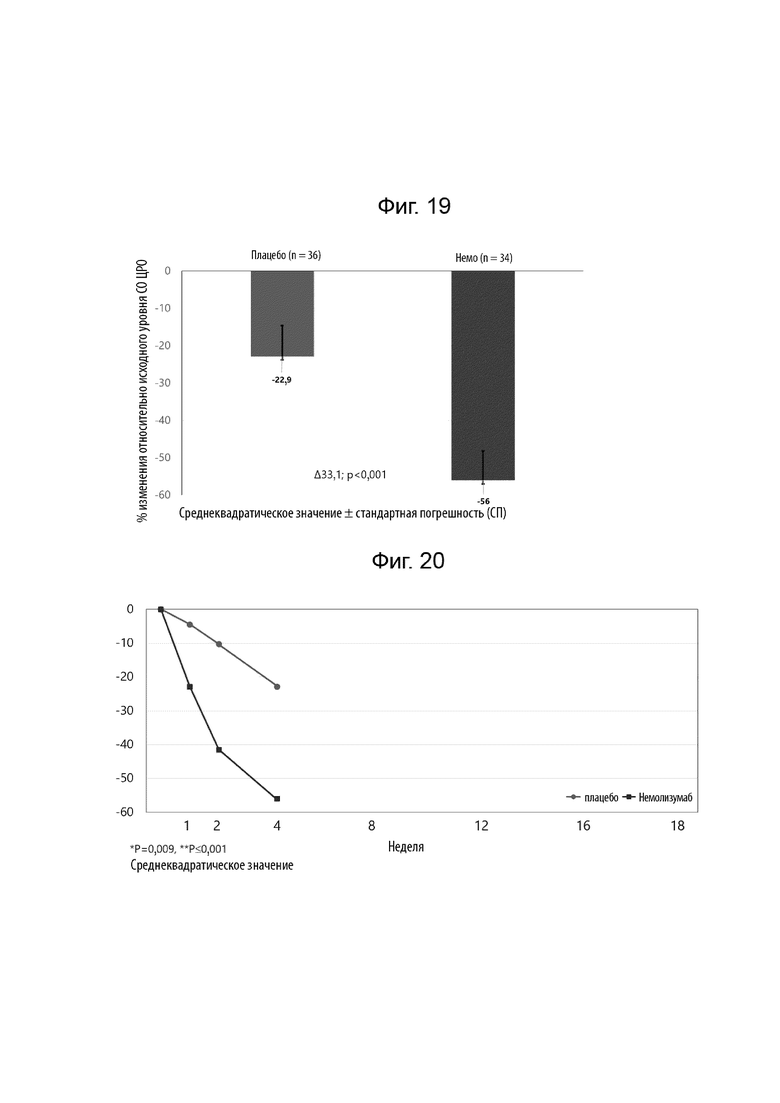
Изобретение относится к области биотехнологии. Предложен способ лечения поражений кожи и зуда у субъекта, имеющего хроническую почесуху (ХП), включая узловатую почесуху. Способ включает введение субъекту эффективного количества немолизумаба. Также предложены фармацевтические композиции для лечения зуда у субъекта, имеющего ХП, включающие немолизумаб, и применение немолизумаба в производстве лекарственного средства для лечения поражений кожи и зуда у субъекта, имеющего ХП. Изобретение может найти дальнейшее применение в терапии. 5 н. и 49 з.п. ф-лы, 29 ил., 7 табл., 1 пр.
1. Способ лечения поражений кожи и зуда у субъекта, имеющего хроническую почесуху (ХП), включающий введение субъекту эффективного количества немолизумаба.
2. Способ по п. 1, отличающийся тем, что субъект имеет узловатую почесуху (УП).
3. Способ по п. 2, отличающийся тем, что УП диагностирована у субъекта в течение по меньшей мере около 6 месяцев.
4. Способ по любому из предшествующих пунктов, отличающийся тем, что субъект имеет по меньшей мере около 20 узелков на своем теле с двухсторонним распределением.
5. Способ по любому из предшествующих пунктов, отличающийся тем, что субъект имеет связанные с почесухой поражения на верхних конечностях.
6. Способ по любому из предшествующих пунктов, отличающийся тем, что зуду была приписана оценка по меньшей мере 4 по цифровой рейтинговой шкале (ЦРШ).
7. Способ по любому из предшествующих пунктов, отличающийся тем, что зуду была приписана оценка по меньшей мере 7 по цифровой рейтинговой шкале (ЦРШ).
8. Способ по любому из предшествующих пунктов, отличающийся тем, что субъект не имеет атопический дерматит.
9. Способ по любому из предшествующих пунктов, отличающийся тем, что эффективное количество немолизумаба находится в диапазоне от около 0,01 мг/кг до около 0,1 мг/кг, от около 0,1 мг/кг до около 0,5 мг/кг, от около 0,5 мг/кг до около 1,5 мг/кг, от около 1,5 мг/кг до около 2,5 мг/кг или от около 2,5 мг/кг до около 10 мг/кг.
10. Способ по любому из предшествующих пунктов, отличающийся тем, что эффективное количество немолизумаба составляет около 10 мг, около 15 мг, около 20 мг, около 25 мг, около 30 мг, около 35 мг, около 40 мг, около 45 мг, около 50 мг, около 55 мг, около 60 мг, около 65 мг, около 70 мг, около 75 мг, около 80 мг, около 85 мг, около 90 мг.
11. Способ по любому из предшествующих пунктов, отличающийся тем, что немолизумаб вводят в соответствии со схемой с постоянной дозой.
12. Способ по любому из предшествующих пунктов, отличающийся тем, что немолизумаб вводят в соответствии со схемой с нагрузочной дозой.
13. Способ по любому из предшествующих пунктов, отличающийся тем, что немолизумаб вводят местным или парентеральным путем.
14. Способ по любому из предшествующих пунктов, отличающийся тем, что немолизумаб вводят подкожно.
15. Способ по любому из предшествующих пунктов, отличающийся тем, что немолизумаб вводят один раз в неделю, один раз в две недели, один раз в три недели, один раз в четыре недели, один раз в пять недель, один раз в шесть недель, один раз в семь недель или один раз в восемь недель.
16. Способ по любому из предшествующих пунктов, отличающийся тем, что эффективное количество немолизумаба составляет от 30 до 60 мг.
17. Способ по п. 16, отличающийся тем, что немолизумаб вводят один раз в четыре недели.
18. Фармацевтическая композиция для применения в лечении поражений кожи и зуда у субъекта, имеющего хроническую почесуху (ХП), содержащая немолизумаб и фармацевтически приемлемый носитель.
19. Фармацевтическая композиция по п. 18, отличающаяся тем, что субъект имеет узловатую почесуху (УП).
20. Фармацевтическая композиция по п. 19, отличающаяся тем, что УП диагностирована у субъекта в течение по меньшей мере около 6 месяцев.
21. Фармацевтическая композиция по любому из пп. 18-20, отличающаяся тем, что субъект имеет по меньшей мере около 20 узелков на своем теле с двухсторонним распределением.
22. Фармацевтическая композиция по любому из пп. 18-21, отличающаяся тем, что субъект имеет связанные с почесухой поражения на верхних конечностях.
23. Фармацевтическая композиция по любому из пп. 18-22, отличающаяся тем, что зуду была приписана оценка по меньшей мере 4 по цифровой рейтинговой шкале (ЦРШ).
24. Фармацевтическая композиция по любому из пп. 18-23, отличающаяся тем, что зуду была приписана оценка по меньшей мере 7 по цифровой рейтинговой шкале (ЦРШ).
25. Фармацевтическая композиция по любому из пп. 18-24, отличающаяся тем, что субъект не имеет атопический дерматит.
26. Фармацевтическая композиция по любому из пп. 18-25, отличающаяся тем, что немолизумаб вводят в соответствии со схемой с постоянной дозой.
27. Фармацевтическая композиция по любому из пп. 18-25, отличающаяся тем, что немолизумаб вводят в соответствии со схемой с нагрузочной дозой.
28. Фармацевтическая композиция по любому из пп. 18-27, отличающаяся тем, что композиция содержит от около 0,01 мг/кг до около 0,1 мг/кг, от около 0,1 мг/кг до около 0,5 мг/кг, от около 0,5 мг/кг до около 1,5 мг/кг, от около 1,5 мг/кг до около 2,5 мг/кг или от около 2,5 мг/кг до около 10 мг/кг немолизумаба.
29. Фармацевтическая композиция по любому из пп. 18-27, отличающаяся тем, что композиция содержит около 10 мг, около 15 мг, около 20 мг, около 25 мг, около 30 мг, около 35 мг, около 40 мг, около 45 мг, около 50 мг, около 55 мг, около 60 мг, около 65 мг, около 70 мг, около 75 мг, около 80 мг, около 85 мг, около 90 мг немолизумаба.
30. Фармацевтическая композиция по любому из пп. 18-29, где композиция содержит от 30 до 60 мг немолизумаба.
31. Фармацевтическая композиция по п. 30, где композицию вводят один раз в четыре недели.
32. Применение немолизумаба в производстве лекарственного средства для лечения поражений кожи и зуда у субъекта, имеющего хроническую почесуху (ХП).
33. Применение по п. 32, отличающееся тем, что субъект имеет узловатую почесуху (УП).
34. Применение по п. 33, отличающееся тем, что УП диагностирована у субъекта в течение по меньшей мере около 6 месяцев.
35. Применение по любому из пп. 32-34, отличающееся тем, что субъект имеет по меньшей мере около 20 узелков на своем теле с двухсторонним распределением.
36. Применение по любому из пп. 32-35, отличающееся тем, что субъект имеет связанные с почесухой поражения на верхних конечностях.
37. Применение по любому из пп. 32-36, отличающееся тем, что зуду была приписана оценка по меньшей мере 4 по цифровой рейтинговой шкале (ЦРШ).
38. Применение по любому из пп. 32-37, отличающееся тем, что зуду была приписана оценка по меньшей мере 7 по цифровой рейтинговой шкале (ЦРШ).
39. Применение по любому из пп. 32-38, отличающееся тем, что субъект не имеет атопического дерматита.
40. Применение по любому из пп. 32-39, отличающееся тем, что немолизумаб вводят в соответствии со схемой с постоянной дозой.
41. Применение по любому из пп. 32-40, отличающееся тем, что немолизумаб вводят в соответствии со схемой с нагрузочной дозой.
42. Применение по любому из пп. 30-39, отличающееся тем, что немолизумаб вводят в дозе, составляющей от около 0,01 мг/кг до около 0,1 мг/кг, от около 0,1 мг/кг до около 0,5 мг/кг, от около 0,5 мг/кг до около 1,5 мг/кг, от около 1,5 мг/кг до около 2,5 мг/кг или от около 2,5 мг/кг до около 10 мг/кг.
43. Применение по любому из пп. 30-42, отличающееся тем, что немолизумаб вводят в дозе, составляющей около 10 мг, около 15 мг, около 20 мг, около 25 мг, около 30 мг, около 35 мг, около 40 мг, около 45 мг, около 50 мг, около 55 мг, около 60 мг, около 65 мг, около 70 мг, около 75 мг, около 80 мг, около 85 мг, около 90 мг.
44. Применение по любому из пп. 32-43, где лекарственное средство используют таким образом, что немолизумаб вводят субьекту в количестве от 30 до 60 мг.
45. Применение по п. 44, где лекарственное средство используют таким образом, что немолизумаб вводят субьекту один раз в четыре недели.
46. Фармацевтическая композиция, содержащая немолизумаб и фармацевтически приемлемый носитель, для применения в лечении поражений кожи и зуда у субъекта, имеющего узловатую почесуху (УП), где субъект не страдает атопическим дерматитом.
47. Фармацевтическая композиция, содержащая немолизумаб и фармацевтически приемлемый носитель, для применения в лечении поражений кожи и зуда у субъекта, имеющего узловатую почесуху (УП).
48. Фармацевтическая композиция по п. 46 или 47, отличающаяся тем, что субъект имеет по меньшей мере около 20 узелков на своем теле с двухсторонним распределением.
49. Фармацевтическая композиция по любому из пп. 46-48, отличающаяся тем, что субъект имеет связанные с почесухой поражения на верхних конечностях.
50. Фармацевтическая композиция по любому из пп. 46-49, отличающаяся тем, что немолизумаб вводят в соответствии со схемой с постоянной дозой.
51. Фармацевтическая композиция по любому из пп. 46-49, отличающаяся тем, что немолизумаб вводят в соответствии со схемой с нагрузочной дозой.
52. Фармацевтическая композиция по любому из пп. 46-51, где композицию один раз в четыре недели.
53. Фармацевтическая композиция по любому из пп. 46-52, где композиция содержит от 30 до 60 мг немолизумаба.
54. Фармацевтическая композиция по любому из пп. 46-52, где композиция содержит 30 или 60 мг немолизумаба.
| WO 2018081273 A1, 03.05.2018 | |||
| CN 104248691 A, 31.12.2014 | |||
| US 9683037 B2, 20.06.2017 | |||
| Galderma: "NCT03181503 Safety and Efficacy of Nemolizumab in PN Official Title: A Study to Assess the Safety and Efficacy of Nemolizumab (CD14152) in Subjects With Prurigo Nodularis (PN)", Clinical Trials, 07.06.2017 | |||
| ZEIDLER C | |||
| et al | |||
| Prurigo Nodularis and Its |
Авторы
Даты
2024-07-02—Публикация
2020-01-28—Подача