Изобретение относится к химии органических гетероциклических соединений, а именно к новым производным ципрофлоксацина со структурными формулами (I) и (II)
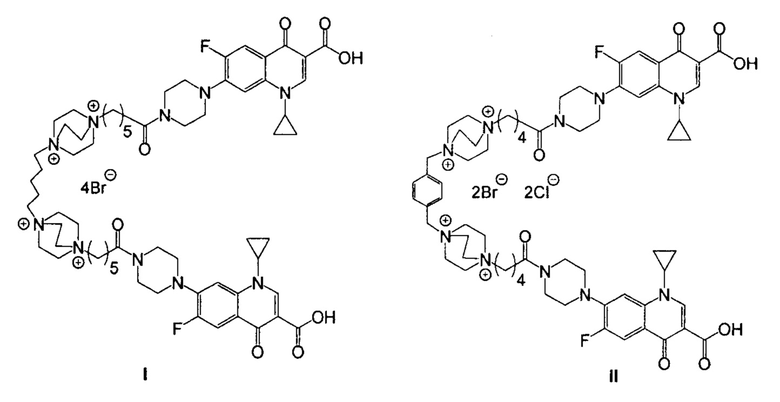
обладающими антибактериальной активностью.
Микробная антибиотикорезистентность (MAP) постепенно становится глобальной проблемой. По оценкам экспертов ВОЗ, если не взять данный вопрос под контроль, к 2050 году от бактериальных инфекций в мире будут погибать до 10 млн человек, а убытки составят более $100 трлн в год.
Одной из причин развития MAP, лежащей на стыке медицинской и ветеринарной науки, является бесконтрольное применение антибиотиков в животноводстве и передача антибиотико-устойчивых микроорганизмов человеку при непосредственном контакте с животными-носителями и/или через продукты питания. Среди данных микроорганизмов наблюдаются возбудители пищевых токсикоинфекций (сальмонеллы, кампилобактерии и листерии) и зооантропонозов (болезней, общих для человека и животных): поли- и панрезистентные энтерококки, синегнойная палочка, кишечные палочки различных типов и др.
Развитие резистентности к антибиотикам обусловлено выработанными в ходе эволюции высокой изменчивостью, быстрым накоплением мутаций и молекулярными механизмами «очистки» и защиты от антибактериальных соединений природного происхождения [De Oliveira D.M.P. al Antimicrobial Resistance in ESKAPE Pathogens // Clin Microbiol Rev. 2020, V. 33(3), P. E00181-19; Darby, E.M. et al Molecular mechanisms of antibiotic resistance revisited // Nat Rev Microbiol. 2023, V. 21, P. 280-295]. Как показывает практика, эта «защитная машина» эффективно противостоит и синтетическим антибиотикам.
В течение продолжительного времени считалось, что антибиотики, нацеленные на одну мишень, являются идеальными антибактериальными препаратами, так как такая высокая специфичность автоматически влечет за собой минимизацию количества побочных эффектов. Однако в последние десятилетия было показано, что устойчивость к антибиотикам со специфическими белками-мишенями развивается слишком быстро. Зачастую штаммы бактерий, обладающие устойчивостью к новому препарату, обнаруживаются до того, как он попадает на рынок. Анализ механизмов действия антибиотиков показывает, что большинство наиболее успешно зарекомендовавших себя антибиотиков нацелены на более чем одну молекулу или обладают мишенями, которые кодируются несколькими генами, т.е., являются мультитаргетными. Данные антибиотики условно можно разделить на два класса: (1) препараты, действующие на более чем один белок одного биохимического пути; (2) препараты, нацеленные на разные молекулы, вовлеченные в различные клеточные процессы. Примером первого класса являются хинолоновые антибиотики, действующие на топоизомеразы II и IV [Anderson VE et al. Type II topoisomerases as targets for quinolone antibacterials: turning Dr. Jekyll into Mr. Hyde // Curr Pharm Des. 2001, V. 7(5), P. 337-53., Spencer AC et al DNA Gyrase as a Target for Quinolones // Biomedicines. 2023, V.11(2), P. 371]. Примером антибиотиков второго типа является хелокардин - антибиотик тетрациклинового ряда, обладающий ингибирующим действием в отношении бактериальных рибосом, а также вызывающий деполяризацию цитоплазматической мембраны [Stepanek JJ et al Dual mechanism of action of the atypical tetracycline chelocardin // Biochim Biophys Acta. 2016 V. 64(6) P. 645-654, Rusu A et al. The Development of Third-Generation Tetracycline Antibiotics and New Perspectives // Pharmaceutics. 2021, V. 13(12), P. 2085].
В тоже время антибактериальные препараты, имеющие единственную белковую мишень (например, рифампицин, нацеленный на РНК-полимеразу), известны высоким уровнем развития к ним резистентности. Анализ всех этих фактов побудил изменить общую стратегию разработки новых антибактериальных препаратов в сторону поиска соединений, направленных на несколько мишеней. Основные достижения в этой области представлены в обзорах [Gray DA et al Multitarget Approaches against Multiresistant Superbugs // ACS Infect Dis. 2020, V. 6(6), P. 1346-1365, Bremner JB. An Update Review of Approaches to Multiple Action-Based Antibacterials // Antibiotics (Basel), 2023, V. 12(5), P. 865].
Наиболее очевидным путем создания мультитаргетных антибактериальных препаратов является объединение (конъюгация) двух антибиотиков различного класса, либо их фармакофорных частей посредством некой линкерной группы [Bremner JB et al. Dual action-based approaches to antibacterial agents // Curr. Med Chem, 2007, V. 14(13), P. 1459-1477, Gupta V et al Next-generation strategy for treating drug resistant bacteria: Antibiotic hybrids // Indian J Med Res. 2019, V. 149(2), P. 97-106, Domalaon R et al. Antibiotic Hybrids: the Next Generation of Agents and Adjuvants against Gram-Negative Pathogens? // Clin Microbiol Rev. 2018, V. 31(2), P. e00077-17].
По данным интернет-ресурса https://www.pewtrusts.org/ на данный момент несколько мультитаргетных конъюгатов антибиотиков участвуют в клинических испытаниях.
Другим направлением создания мультитаргетных препаратов является создание гибридов антибактериальных препаратов различных классов. Одной из альтернатив антибиотикам в качестве антибактериальных препаратов рассматриваются природные антимикробные пептиды (АМП) [Cardoso P et al. Rational design of potent ultrashort antimicrobial peptides with programmable assembly into nanostructured hydrogels // Front Chem., 2023 10:1009468, Cardoso P et al. Molecular engineering of antimicrobial peptides: microbial targets, peptide motifs and translation opportunities // Biophys Rev. 2021, V. 13, P. 35-69].
Отличительной особенностью АМП является высокая скорость бактерицидного действия [Pranting М et al. Mechanism and fitness costs of PR-39 resistance in Salmonella enterica serovar Typhimurium LT2 // Antimicrob Agents Chemother., 2008, V. 52(8), P. 2734-2741., Irazazabal LN et al. Fast and potent bactericidal membranelytic activity of PaDBS1R1, a novel cationic antimicrobial peptide // Biochim Biophys Acta Biomembr., 2019, V. 1861(1), P. 178-190.], обусловленная, как правило, образованием пор в мембране бактерий под действием АМП [Brogden KA. Antimicrobial peptides: pore formers or metabolic inhibitors in bacteria? // Nat Rev Microbiol. 2005, V.3(3), P. 238-250].
Применение АМП в создании гибридных конструкций и не только, ограничивается высокой стоимостью их синтеза и чувствительностью к действию протеолитических ферментов. Определенной альтернативой природным катионным АМП могут служить катионные амфифилы (КА) -молекулы с одной или несколькими положительно заряженными группами и липофильными фрагментами [Ghosh С et al. Membrane-Active Small Molecules: Designs Inspired by Antimicrobial Peptides // Chem. Med. Chem, 2015, V. 10(10), P. 1606-1624., Molchanova N et al. Advances in Development of Antimicrobial Peptidomimetics as Potential Drugs // Molecules. 2017, V. 22(9), Р. 1430].
Данные соединения, аналогично катионным природным АМП, способны вызывать нарушение трансмембранного потенциала, утечку цитоплазматического содержимого и, в конечном итоге, гибель клеток [Ghosh С et al. Membrane-Active Small Molecules: Designs Inspired by Antimicrobial Peptides // Chem. Med. Chem, 2015, V. 10(10), P. 1606-1624].
Разнообразная архитектура катионных амфифилов значительно облегчает задачу синтеза гибридных структур. Описан синтез и антибактериальная активность ряда амфифилов на основе аминогликозидных антибиотиков (неомицин, канамицин, амиксин). [Bera S et al. Antibacterial activities of aminoglycoside antibiotics-derived cationic amphiphiles. Polyol-modified neomycin B-, kanamycin A-, amikacin-, and neamine-based amphiphiles with potent broad spectrum antibacterial activity // J. Med. Chem., 2010, V. 53(9), P. 3626-3631., Zimmermann L et al. New Broad-Spectrum Antibacterial Amphiphilic Aminoglycosides Active against Resistant Bacteria: From Neamine Derivatives to Smaller Neosamine Analogues // J Med Chem., 2016, V. 59(20), P. 9350-9369, Zimmermann Let al. Broad-spectrum antibacterial amphiphilic aminoglycosides: A new focus on the structure of the lipophilic groups extends the series of active dialkyl neamines // Eur J. Med. Chem. 2018, V. 157, Р. 1512-1525].
Наиболее близкими структурными аналогами к заявляемым соединениям - прототипом, являются гибридные структуры, включающие антибиотик линезолид и катионный амфифил на основе четвертичных аммониевых солей [Bai P.Y. et al. Synthesis and antibacterial bioactivities of cationic deacetyl linezolid amphiphiles // Eur J. Med. Chem. 2018. Vol. 155, P. 925-945].
Недостатками известных структурных аналогов являются значительно более низкая активность в отношении грамотрицательных микроорганизмов и не полное восстановление активности конъюгата по отношению к штаммам микроорганизмов, выработавших устойчивость к линезалиду.
Задачей изобретения является получение новых производных ципрофлоксацина, обладающих антибактериальной активностью и воздействующих на различные молекулярные мишени микроорганизмов.
Технический результат: расширение ассортимента производных ципрофлоксацина, обладающих антибактериальной активностью в отношении различных штаммов микроорганизмов.
Поставленная задача достигается средством обладающим антибактериальной активностью, представляющим собой одно из гибридных производных ципрофлоксацина и катионного амфифила со структурными формулами (I) и (II).
В предлагаемом средстве молекула катионного амфифила, для которого ранее была показана антибактериальная активность, реализуемая через разрушение бактериальных мембран, одновременно является линкерной группой, объединяющей две молекулы широко применяемого антибиотика ципрофлоксацина.
На фиг. 1 представлена схема синтеза производного ципрофлоксацина со структурной формулой I (соединение 1).
На фиг. 2 представлена схема синтеза производного ципрофлоксацина со структурной формулой II (соединение 2).
Предлагаемые соединения (1-2) получают следующим образом: на первой стадии проводят реакцию ацилирования гидрохлорида ципрофлоксацина с помощью активированных пентафторфениловых эфиров соответствующих со-бромкарбоновых кислот, в результате чего получают промежуточные соединения А и С. На второй стадии с помощью соединений А или С проводят реакцию алкилирования 1,4-диазабицикло[2.2.2]октана (DABCO), в результате чего получают промежуточные соединения В и D. На третьей стадии проводят реакцию алкилирования с соответствующими дигалогенпроизводными, в результате которой образуются целевые соединения 1 и 2.
Полученные новые производные ципрофлоксацина, проявляют эффективность для лечения бактериальных инфекций, вызванных грамположительными и грамотрицательными бактериями, воздействующих на различные молекулярные мишени патогенов.
Изобретение иллюстрируется следующими примерами.
Пример 1. Синтез соединения 1.
К раствору гидрохлорида ципрофлоксацина (1.0 ммоль) в хлористом метилене (8 мл) приливают диизопропилэтиламин (1.5 ммоль) и раствор пентафторфенилового эфира 6-бромгексановой кислоты (1 ммоль) в хлористом метилене (1 мл). Реакционную смесь перемешивают при комнатной температуре в течение 3 часов, после чего фильтруют от образовавшегося осадка. Продукт реакции осаждают из хлористого метилена 10-кратным объемом диэтилового эфира. Полученный осадок фильтруют, промывают диэтиловым эфиром и сушат в вакууме. Выход промежуточного соединения А составляет 98%. К раствору соединения А (0.5 ммоль) в хлороформе (7 мл) добавляют DABCO (0.75 ммоль). Реакционную смесь кипятят при перемешивании с обратным холодильником и хлоркальциевой трубкой в течение 2 часов, затем 24 часа без нагревания. Реакционную смесь упаривают на ротационном испарителе. Продукт осаждают из хлористого метилена 10-кратным объемом диэтилового эфира. Осадок фильтруют, промывают диэтиловым эфиром и сушат в вакууме. Выход промежуточного соединения В составляет 93%. К раствору соединения В (0.16 ммоль) в метаноле (1 мл) добавляют 1,5-дибромпентан (0.08 ммоль). Реакционную смесь перемешивают при 50°С в течение 48 часов. Продукт осаждают 10-кратным объемом ацетона. Выпавший осадок отделяют центрифугированием, промывают ацетоном и сушат в вакууме. Выход соединения 1 составляет 84%. Спектр ЯМР 1Н (400 МГц, ДМСО-d6): δ 1.19 (м,4Н, 2СН2), 1.33 (м, 10Н, 5СН2), 1.60 (м, 4Н, 2СН2), 1.77 (м, 8Н, 4СН2), 2.43 (т, J=7.2 Гц, 4Н, 2СН2), 3.27-3.74 (м, 24Н, 12СН2), 3.83 (м, 2Н, СН), 3.94 (м, 24Н, CH2.DABCO), 7.58 (д, J=7.1 Гц, 2HAr), 7.94 (д, J=12.9 Гц, 2HAr), 8.68 (с, 2HAr), 15.21 (с, 2Н, СООН).
Спектр ЯМР 13С (126 МГц, ДМСО-d6): δ 7.6, 21.3, 24.1, 25.3, 31.8, 35.9, 44.5, 49.7, 50.4, 63.3, 106.6, 106.7, 111.1, 118.8, 139.1, 144.9, 148.1, 153.7, 153.7, 165.9, 170.5, 176.3. Масс-спектр. Найдено: m/z [М-Н]3+ 383.00, [М-2Н]2+ 574.00. Вычислено: [М-Н]3+ 383.22, [М-2Н]2+ 574.33.
Пример 2. Синтез соединения 2.
К раствору гидрохлорида ципрофлоксацина (1.0 ммоль) в хлористом метилене (8 мл) приливают диизопропилэтиламин (1.5 ммоль) и раствор пентафторфенилового эфира 5-бромпентановой кислоты (1 ммоль) в хлористом метилене (1 мл). Реакционную смесь перемешивают при комнатной температуре в течение 3 часов, после чего фильтруют от образовавшегося осадка. Продукт реакции осаждают из хлористого метилена 10-кратным объемом диэтилового эфира. Полученный осадок фильтруют, промывают диэтиловым эфиром и сушат в вакууме. Выход соединения С составляет 96%. К раствору соединения С (0.5 ммоль) в хлороформе (7 мл) добавляют DABCO (0.75 ммоль). Реакционную смесь кипятят при перемешивании с обратным холодильником и хлоркальциевой трубкой в течение 2 часов, затем 24 часа без нагревания. Реакционную смесь упаривают на ротационном испарителе. Продукт осаждают из хлористого метилена 10-кратным объемом диэтилового эфира. Осадок фильтруют, промывают диэтиловым эфиром и сушат в вакууме. Выход соединения D составляет 77%. К раствору соединения D (0.16 ммоль) в метаноле (1 мл) добавляют n-дихлорксилол (0.08 ммоль). Реакционную смесь перемешивают при 50°С в течение 48 часов. Выпавший осадок отделяют центрифугированием, промывают метанолом и сушат в вакууме. Выход соединения 2 составляет 34%. Спектр ЯМР 1Н (500 МГц, ДМСО-d6): δ 1.18 (м, 4Н, 2СН2), 1.32 (м, 4Н, 2СН2), 1.54 (м, 4Н, 2СН2), 1.70 (м, 4Н, 2СН2), 2.47 (т, J=6.7 Hz, 4Н, 2СН2), 3.28 (м, 8Н, 4СН2), 3.53 (м, 4Н, 2СН2), 3.68 (м, 8Н, 4СН2), 3.79 (м, 2Н, 2СН), 3.91 (м, 12Н, CH2.DABCO), 4.02 (м, 12Н, CH2.DABCO), 4.97 (с, 4Н, 2СН2), 7.52 (д, J=7.8 Гц, 2HAr), 7.74 (с, 4Н, СНХу1), 7.81 (д, J=13.1 Гц, 2HAr Cip, 5), 8.62 (с, 2Н, CHArCip), 15.09 (с, 2Н, СООН).
Спектр ЯМР, 13С (126 МГц, ДМСО-d6): 6 7.8, 21.3, 31.7, 36.1, 44.7, 50.8, 63.6, 65.9, 107.0, 111.1, 118.8, 129.3, 134.0, 139.2, 145.0, 148.1, 152.0, 154.0, 166.0, 170.4, 176.4.
Масс-спектр. Найдено: m/z [M+Br]3+ 411.90, [M+2Br]2+ 658.40. Вычислено: [M+Br]3+ 411.85, [M+2Br]2+ 658.23.
Пример 3. Определение антибактериальной активности соединений 1-2 в отношении патогенных тест-штаммов: Staphylococcus aureus АТСС 25923; Escherichia coli АТСС 25922; Salmonella enterica АТСС 14028; Citrobacter freundii АТСС 8090; Pseudomonas aeruginosa ATCC 9027.
Определение чувствительности к препаратам проводили методом последовательных разведений в 96-луночных планшетах (ТРР, Trasadingen, Швейцария) согласно рекомендациям Европейского комитета по определению чувствительности к антимикробным препаратам (Determination of minimum inhibitory concentrations (MICs) of antibacterial agents by broth dilution. (2003). Clinical Microbiology and Infection, 9(8), ix-xv. doi: 10.1046/j. 1469-0691. 2003. 00790.x).
Культуру, выращенную на агаризованной среде LB (Luria-Bertani, BD, Нью-Джерси, США), засевали в бульон Мюллера-Хинтона (МХБ, OXOID, Basingstoke, Великобритания) и культивировали в течение ночи. Стоковые растворы препаратов в ДМСО имели концентрацию 20 мкмоль/мл. Конечную концентрацию клеток ночной бульонной культуры штаммов доводили до ~5х 105 КОЕ/мл в МХБ. Рост культуры оценивали через 24 часа, измеряя оптическую плотность при длине волны 595 нм в каждой лунке (Униплан, ПИКОН, Москва, Россия). В результате для препаратов была установлена минимальная подавляющая концентрация (МПК). За МПК принимали минимальную концентрацию, при которой отсутствовал видимый рост культуры. Все эксперименты проводили в трех повторах. Из трех полученных значений МПК выбирали наибольшее.
В таблице 1 представлены значения МПК (мкмоль/мл) для соединений 1 и 2.
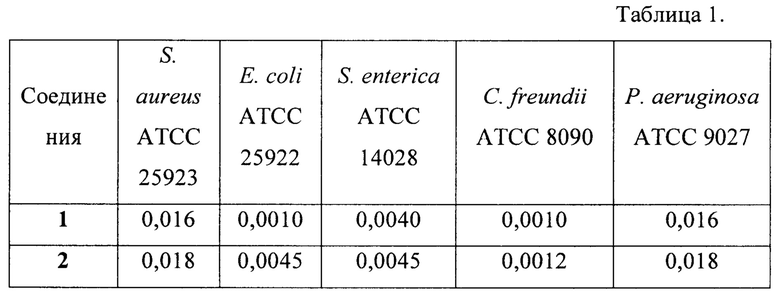
Полученные результаты свидетельствуют о высокой антибактериальной активности соединений 1 и 2.
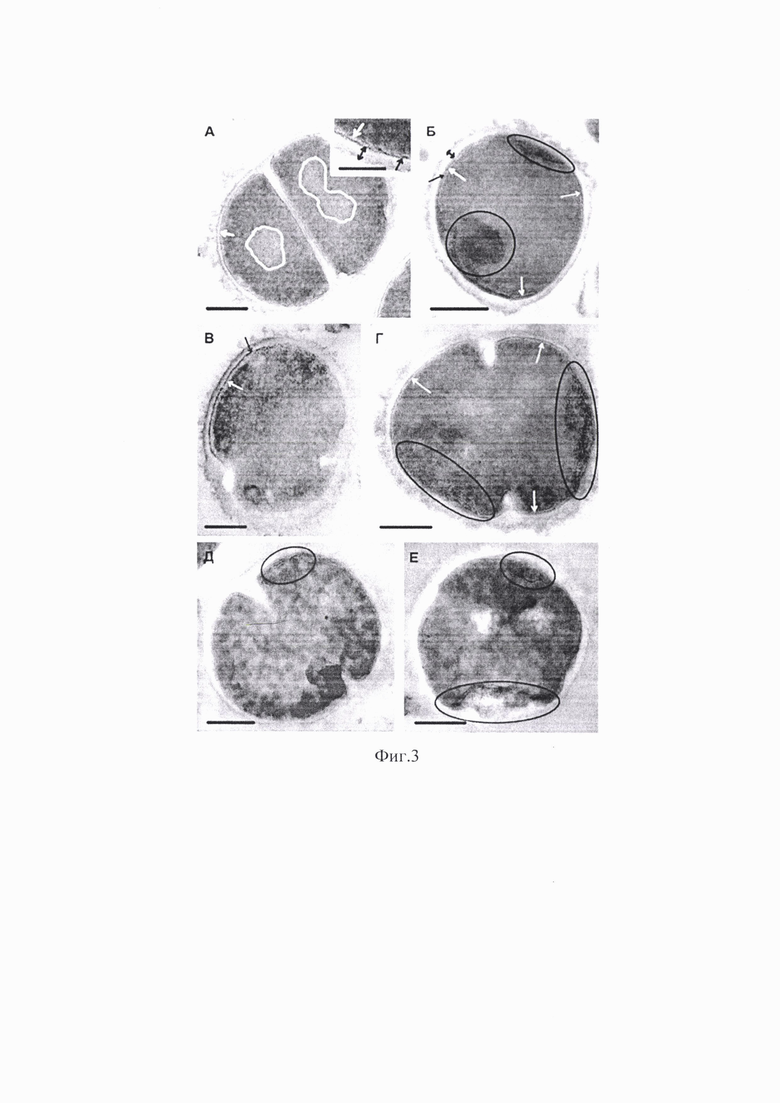
На фиг. 3 (А-Е) представлена иллюстрация воздействия соединения 1 на различные молекулярные мишени в клетках S. aureus (электронная микроскопия, ультратонкие срезы), где: А - контроль (делящаяся клетка), Б - клетка, инкубированная 45 мин с катионным амфифильным соединением. В - клетка, инкубированная 45 мин с ципрофлоксацином. Клетки, инкубированные с соединением 1: Г - 15 мин, Д-Е - 45 мин. Белой стрелкой показана плазмолемма, черной - пространство между плазмолеммой и стенкой, двойной стрелкой - толщина стенки. Кривой линией выделена зона нуклеоида, овалами - зоны накопления электронно-плотных нитей. Длина масштабной линии соответствует 200 нм, на врезке - 50 нм.
Таким образом, заявляемое средство обладает антибактериальной активностью и воздействует на различные молекулярные мишени микроорганизмов.
| название | год | авторы | номер документа |
|---|---|---|---|
| Производное ципрофлоксацина, обладающее антибактериальной активностью в отношении антибиотикоустойчивых штаммов микроорганизмов | 2021 |
|
RU2757741C1 |
| 3,3'[(гексано-1,6-диилбис(азанедиил)]бис-(7-гидрокси-6-метоксикарбонил-2-оксо-2H-хромен), обладающий антибактериальной активностью | 2021 |
|
RU2764522C1 |
| Фторхинолоны на основе 4-дезоксипиридоксина | 2016 |
|
RU2634122C1 |
| ПРОИЗВОДНЫЕ ГЕМИНА, ОБЛАДАЮЩИЕ АНТИМИКРОБНОЙ АКТИВНОСТЬЮ, ИЛИ ИХ ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМЫЕ СОЛИ, СПОСОБ ПОЛУЧЕНИЯ, ФАРМКОМПОЗИЦИЯ И ПРИМЕНЕНИЕ | 2009 |
|
RU2415868C1 |
| Антибактериальные средства на основе производных ципрофлоксацина | 2016 |
|
RU2636751C1 |
| Незаряженный липид, композиция на его основе с поликатионным амфифилом и нейтральным фосфолипидом и способ ее получения для доставки нуклеиновых кислот in vitro | 2020 |
|
RU2747559C1 |
| АНТИБАКТЕРИАЛЬНЫЕ СОЕДИНЕНИЯ НА ОСНОВЕ СУЛЬФАНИЛОВОЙ КИСЛОТЫ И ПИРИДОКСИНА | 2012 |
|
RU2480471C1 |
| Полиэтиленгликоль-содержащий липид, композиция на его основе с катионным амфифилом и нейтральным фосфолипидом и способ ее получения для доставки нуклеиновых кислот in vivo | 2017 |
|
RU2683572C1 |
| ДИСУЛЬФИДНЫЙ ПОЛИКАТИОННЫЙ АМФИФИЛ, КОМПОЗИЦИЯ НА ЕГО ОСНОВЕ С НЕЙТРАЛЬНЫМ ФОСФОЛИПИДОМ И СПОСОБ ЕЕ ПОЛУЧЕНИЯ | 2016 |
|
RU2610271C1 |
| Бета-шпилечный пептид, обладающий антимикробной активностью в отношении бактерий с множественной лекарственной устойчивостью | 2023 |
|
RU2812977C1 |
Изобретение относится к средству, представляющему собой одно из гибридных производных ципрофлоксацина и катионного амфифила со следующими структурными формулами (I) и (II): 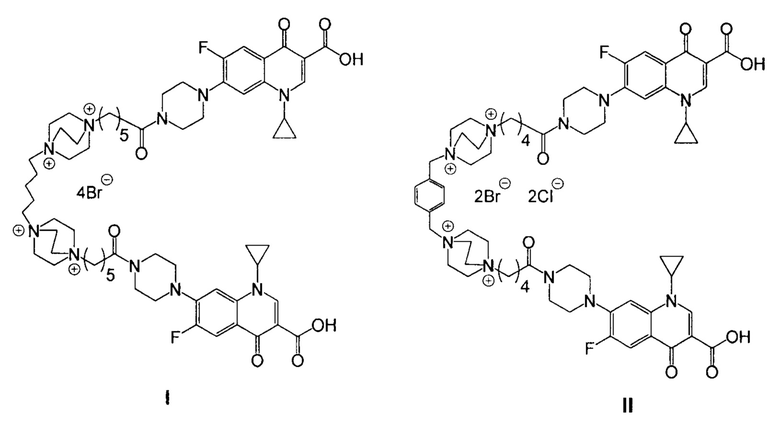 . Технический результат: получены новые производные ципрофлоксацина, обладающие антибактериальной активностью. 3 ил., 1 табл., 3 пр.
. Технический результат: получены новые производные ципрофлоксацина, обладающие антибактериальной активностью. 3 ил., 1 табл., 3 пр.
Средство, обладающее антибактериальной активностью, представляющее собой одно из гибридных производных ципрофлоксацина и катионного амфифила со следующими структурными формулами:
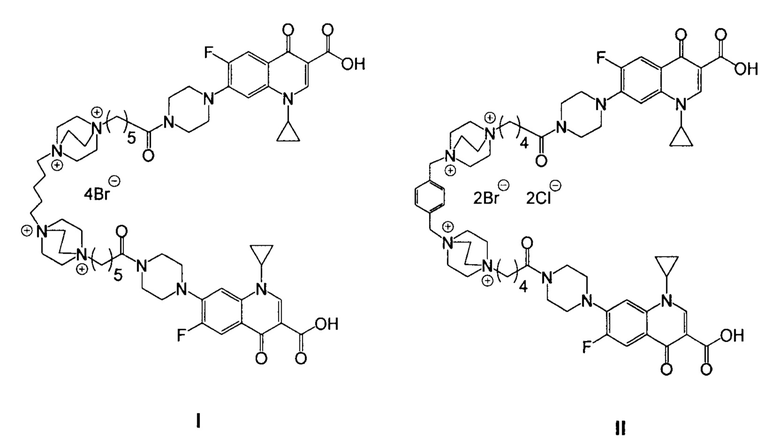 .
.
| Производное ципрофлоксацина, обладающее антибактериальной активностью в отношении антибиотикоустойчивых штаммов микроорганизмов | 2021 |
|
RU2757741C1 |
| Антибактериальные средства на основе производных ципрофлоксацина | 2016 |
|
RU2636751C1 |
| Ekaterina A | |||
| Burakova et al | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
Авторы
Даты
2024-07-10—Публикация
2023-12-18—Подача