Область техники, к которой относится изобретение
Изобретение относится к области молекулярной биологии, эпидемиологии и медицине и представляет собой способ получения функционально активного белка NSP1 и любых его мутантных форм при помощи гетерологичной экспрессии в клетках Escherichia coli с последующей очисткой металл-хелатной аффинной хроматографией и удалением дополнительных аминокислотных последовательностей, а также способ тестирования in vitro лекарственных соединений против COVID-19, направленных на ингибирование NSP1 SARS-CoV-2.
Уровень техники
В декабре 2019 года впервые был выявлен новый коронавирус, вызывающий опасное инфекционное заболевание у людей (Gralinski, L.E., Menachery, V.D. Viruses, 2020, v. 12(2), p.135., https://doi.org/10.3390/v12020135). 7 марта 2020 года Всемирная организация здравоохранения (ВОЗ) в технических руководящих указаниях объявила официальное наименование вируса - SARS-CoV-2 и вызываемого им заболевания - COVID-19. 11 марта 2020 года ВОЗ признала COVID-19 пандемией (WHO Director-General's opening remarks at the media briefing on COVID-19 - 11 March 2020). По состоянию на декабрь 2020 года в мире выявлено около 70 млн. случаев COVID-19 из которых более 1,5 млн со смертельным исходом (https://coronavirus.jhu.edu/map.html).
Семейство коронавирусов обладает самым большим геномом среди всех РНК-вирусов (у SARS-CoV-2 около 30000 нт). Каждый вирусный транскрипт имеет 5'-кэп-структуру и 3'-поли (А) последовательность, что позволяет ему маскироваться под мРНК клеток хозяина. Геном SARS-CoV-2 содержит 14 открытых рамок считывания (ORF), в которых закодирована аминокислотная последовательность 27 белков. Две первые перекрывающиеся 5'-концевые рамки ORF1a и ORF1b кодируют крупные полипептиды с молекулярной массой 490 и 794 кДа, соответственно, которые в последующем протеолитически расщепляются вирусными протеазами (NSP3 и NSP5), генерируя неструктурные белки NSP1-NSP16. Полипептид ORF1b возникает при -1 сдвиге рамки считывания непосредственно перед стоп-кодоном ORF1a. Генерируемая при расщеплении ORF1b РНК-зависимая РНК полимераза NSP12 обеспечивает репликацию генома вируса, продуцируя также дополнительные укороченные РНК продукты, содержащие открытые рамки считывания для синтеза остальных белков SARS-CoV-2. Эти укороченные мРНК продукты содержат лидерную последовательность из 5'UTR SARS-CoV-2 длиной около 70 нуклеотидов, включающую SL1-шпильку. Эта лидерная последовательность необходима для эффективной трансляции с РНК продуктов вируса (Kim, D., Lee, J.Y. et al. Cell, 2020, https://doi.org/10.1016/j.cell.2020.04.011).
NSP1 является самым первым белковым продуктом, продуцируемым вирусом SARS-CoV-2 и основной функцией этого белка является ингибирование глобальной трансляции в клетках хозяина и подавление иммунного ответа, в частности (Banerjee, А.K., Blanco M.R. et al. Cell., 2020, https://doi.org/10.1016/j.cell.2020.10.004; Schubert, K., Karousis, E.D. et al. Nature structural & molecular biology, 2020, v. 27(10), p.959-966., https://doi.org/10.1038/s41594-020-0511-8; Yuan, S., Peng, L., et al. Molecular cell., 2020, https://doi.org/10.1016/j.molcel.2020.10.034). NSP1 вируса SARS-CoV-2 представляет собой небольшой белок из 180 аминокислотных остатков, состоящий из N- и С-концевых доменов, соединенных неструктурированным линкером. С-домен NSP1 связывается с 40S субъединицей рибосомы блокируя входной канал для мРНК. Связанная с NSP1 40S субъединица не способна образовывать нативный комплекс инициации трансляции. N-домен NSP1 взаимодействует с SL1 шпилькой в составе 5'UTR мРНК SARS-CoV-2 при этом нарушается взаимодействие С-домена NSP1 с 40S субъединицей рибосомы, что необходимо для эффективной трансляции вирусных белков (Shi, M., Wang, L., et al. BioRxiv, 2020 https://doi.org/10.1101/2020.09.18.302901; Banerjee, A.K., Blanco M.R. et al. Cell., 2020, https://doi.org/10.1016/j.cell.2020.10.004). Таким образом, NSP1 в первую очередь необходим для развития SARS-CoV-2, обеспечивая захват аппарата трансляции хозяина для размножения вируса и подавляя имунный ответ. Для NSP1 известен также ряд мутантов с единичными аминокислотными заменами, которые нарушают эффект по ингибированию трансляции хозяина, например мутанты K164A/Н165А, Y154A/F157A.
В связи с выполняемой функцией NSP1 является одной из главных мишеней для скрининга потенциальных лекарственных препаратов, нарушающих его активность и способных эффективно лечить COVID-19. В настоящее время применяются подходы in silico для поиска потенциальных лекарств, направленных на ингибирование активности NSP1 SARS-CoV-2 (de Lima Menezes, G., da Silva, R.A. Journal of Biomolecular Structure and Dynamics, 2020, p.1-11, https://doi.org/10.1080/07391102.2020.1792992; Vankadari, N., Jeyasankar, N.N., Lopes, W.J. The journal of physical chemistry letters, 2020, v. 11, p. 9659-9668, https://doi.org/10.1021/acs.jpclett.0c02818; Marak, B.N., Dowarah, J., Khiangte, L., Singh, V.P. Drug development research, 2020, https://doi.org/10.1002/ddr.21757). Использование таких подходов требует обязательной последующей валидации на натуральных моделях. Дальнейшее направленное усовершенствование эффективности лекарственных препаратов возможно только после понимания их точного механизма действия. Точный механизм действия лекарственного препарата сложно объяснить на модели целого вируса в культуре клеток. Экспрессия NSP1 в клетках возможна только под индуцибельным промотором, вследствие токсичности NSP1, что также затрудняет идентификацию точного механизма действия лекарственного соединения, из-за необходимости создания особых условий для индукции синтеза NSP1, способных исказить наблюдаемые эффекты.
Таким образом можно сделать вывод, что для эффективной разработки лекарственных препаратов против NSP1 SARS-CoV-2 направленных на лечение COVID-19 необходимо создание простых экспериментальных моделей, позволяющих однозначно интерпретировать наблюдаемые эффекты.
Раскрытие сущности изобретения
Целью изобретения являлось создание способа получения очищенного функционально активного белка NSP1 и последующего тестирования in vitro лекарственных соединений, направленных на ингибирование NSP1 SARS-CoV-2.
В настоящем изобретении предложен способ получения очищенного функционально активного белка NSP1 и любых его мутантных форм, а также способ тестирования in vitro лекарственных соединений против COVID-19, направленных на ингибирование NSP1. Этот способ может быть использован для скрининга и изучения механизма действия лекарственных препаратов и соединений против NSP1, которые можно было бы использовать для лечения COVID-19. Предлагаемый способ выгодно отличается простотой получения целевого продукта функционально активного рекомбинантного NSP1 и возможностью более точно интерпретировать механизм действия лекарственных соединений, направленных на ингибирование активности NSP1. Еще одной сильной стороной предлагаемого способа является высокая гибкость, позволяющая подбирать широкий спектр дополнительных условий и концентраций (как NSP1, так и лекарственных препаратов), использовать различные комбинации лекарственных препаратов при скрининге, производить более точную количественную оценку воздействия лекарственных препаратов.
Для осуществления изобретения необходимы следующие стадии:
а) создание экспрессионного вектора для синтеза рекомбинантного белка NSP1 или любой его производной формы;
б) трансформацию экспрессионного вектора с последующей гетерологичной экспрессией рекомбинантного белка NSP1 в клетки E.coli;
в) выделение целевого белка методом металл-хелатной аффинной хроматографии;
г) удаление из целевого белка дополнительных аминокислотных последовательностей и последующая его очистка от всех примесей повторным раундом металл-хелатной аффинной хроматографии;
д) тестирование в системе in vitro лекарственных соединений, направленных против полученного рекомбинантного препарата NSP1, которые потенциально можно использовать для лечения COVID-19.
В одном из воплощений способ характеризуется тем, что NSP1 SARS-CoV-2 или его измененная форма клонируются методом сборки Гибсона в вектор petSUMO (Thermo Fisher (Invitrogen)) для создания экспрессионной конструкции pET-6xHis-SUMO-NSP1.
В другом своем воплощении способ характеризуется тем, что полученными экспрессионными конструкциями трансформируются клетки Е. coli и, при определенных условиях, индуцируется синтез целевого белка. Конструкция вектора pET-6xHis-SUMO-NSP1 предполагает индуцированную экспрессию с Т7-промотора, а в аминокислотную последовательность целевого белка с N-конца включены 6xHis-tag, сайт для расщепления тромбином и метка SUMO.
В следующем воплощении способ характеризуется тем, что наличие 6xHis-tag позволяет проводить очистку рекомбинантного белка с помощью металл-хелатной аффинной хроматографии с использованием гравитационных хроматографических колонок, содержащих хелатирующий лиганд, матрицу в виде агарозы с заряженным Ni2+, обеспечивающих связывание белков с 6xHis-tag с последующей их элюцией имидазолом.
В еще одном из воплощений метод характеризуется тем, что метка SUMO позволяет в последующем с помощью 6xHis-tag содержащей Ulp протеазы удалить из аминокислотной последовательности NSP1 дополнительные элементы, таким образом, что целевой белковой продукт по последовательности точно соответствует белку NSP1 SARS-CoV-2. После этого, полученную смесь 6xHis-SUMO, 6xHis-Ulp, NSP1 и любые возможные примеси из лизата, оставшиеся после первого этапа очистки, подвергают второму раунду металл-хелатной аффинной хроматографии и на выходе получается высокоочищенный целевой препарат NSP1 SARS-CoV-2.
В очередном своем воплощении способ характеризуется тем, что полученный препарат NSP1 SARS-CoV-2 используется в любой эукариотической системе трансляции in vitro для скрининга лекарственных препаратов способных специфично нейтрализовать ингибирующий эффект NSP1 на терминацию трансляции. Для примера была использована система трансляции на основе лизата ретикулоцитов кролика (RRL, Flexi Rabbit Reticulocyte Lysate System (Promega, кат. L4540)), но возможно использование любой системы трансляции, в том числе и на основе клеточных линий человека. Проверка эффекта NSP1 на ингибирование трансляции основана на использовании мРНК, полученной из оптимизированной конструкции, содержащей последовательность, кодирующую нанолюциферазу NanoLuc (Promega). Данная конструкция содержит промотор для Т7 полимеразы и 5'-UTR из гена бетта-глобина человека, который обеспечивает эффективную трансляцию даже не кэпированной мРНК (Фигура 4) и позволяет получить линейную ДНК, дополнительно несущую поли(Т) последовательность, вносимую с помощью ПЦР-праймера. Степень ингибирования трансляции в присутствии NSP1 измеряется по изменению кинетики хемилюминесценции в лизате RRL, содержащем мРНК NanoLuc и субстрат NanoGlo (Promega, кат. N1110).
Краткое описание фигур и таблиц
Фигура 1. Схема экспрессионной конструкции pET-6xHis-SUMO-NSP1.
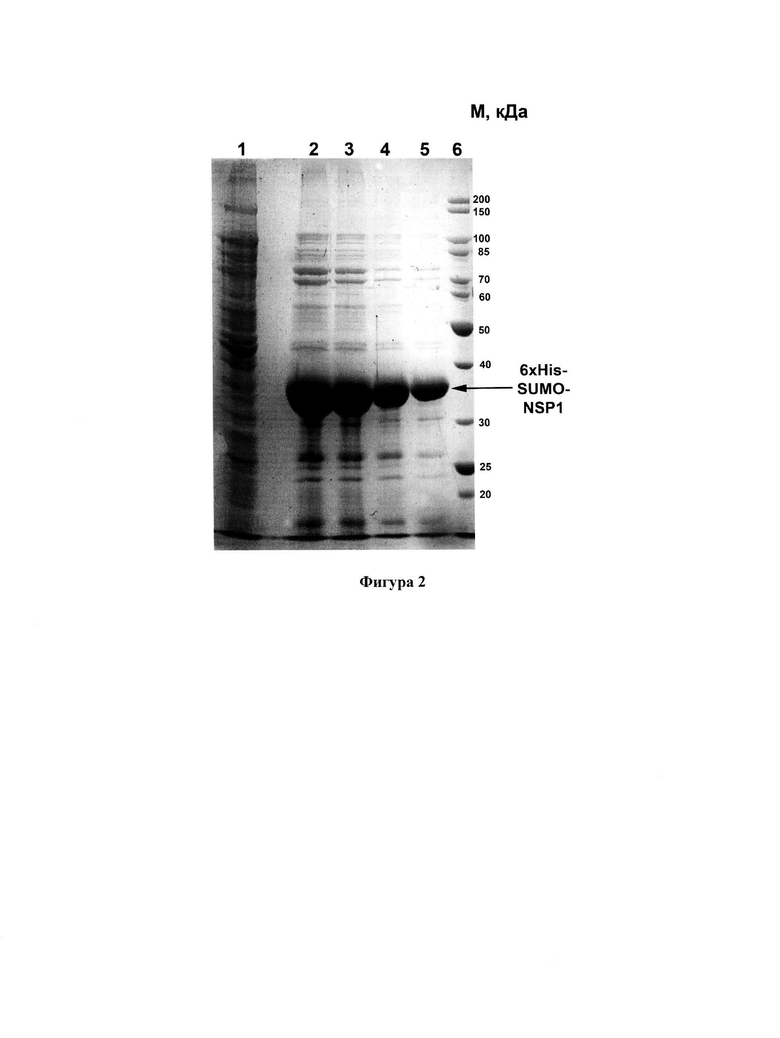
Фигура 2. ПААГ-электрофорез фракций элюата 6xHis-SUMO-NSP1 после очистки целевого белка металл-хелатной хроматографией. 1 - материал клеточного лизата, не связавшийся с Ni-агарозой, 2-5 - с первой по четвертую фракции элюата. Целевой белок указан стрелкой. Справа показаны молекулярные массы в кДа.
Фигура 3. ПААГ-электрофорез фракций NSP1 после отщепления 6xHis-SUMO и второго раунда очистки металл-хелатной хроматографией. 1 - объединенная (1-4) и диализованная фракция элюатов 6xHis-SUMO-NSP1 после первого раунда металл-хелатной хроматографии, 2 - 6xHis-SUMO и NSP1 после инкубации 6xHis-SUMO-NSP1 с протеазой 6xHis-Ulp.Справа показаны молекулярные массы в кДа.
Фигура 4. Схема фрагмента конструкции для получения мРНК нанолюциферазы.
Фигура 5. Активность NSP1 и его мутантов. Изменение относительной хемилюминесценции при инкубации NSP1 и его мутантных форм в компетентном для трансляции RRL в присутствии мРНК NanoLuc и субстрата для нанолюциферазы. Интенсивность хемилюминесценции прямо пропорциональна интенсивности трансляции в лизате. Хорошо видно, что NSP1 значительно ингибирует трансляцию относительно контролей, где NSP1 не добавлен или добавлены его не функциональные мутанты. Разбросы показывают стандартное отклонение в трехкратной повторности эксперимента.
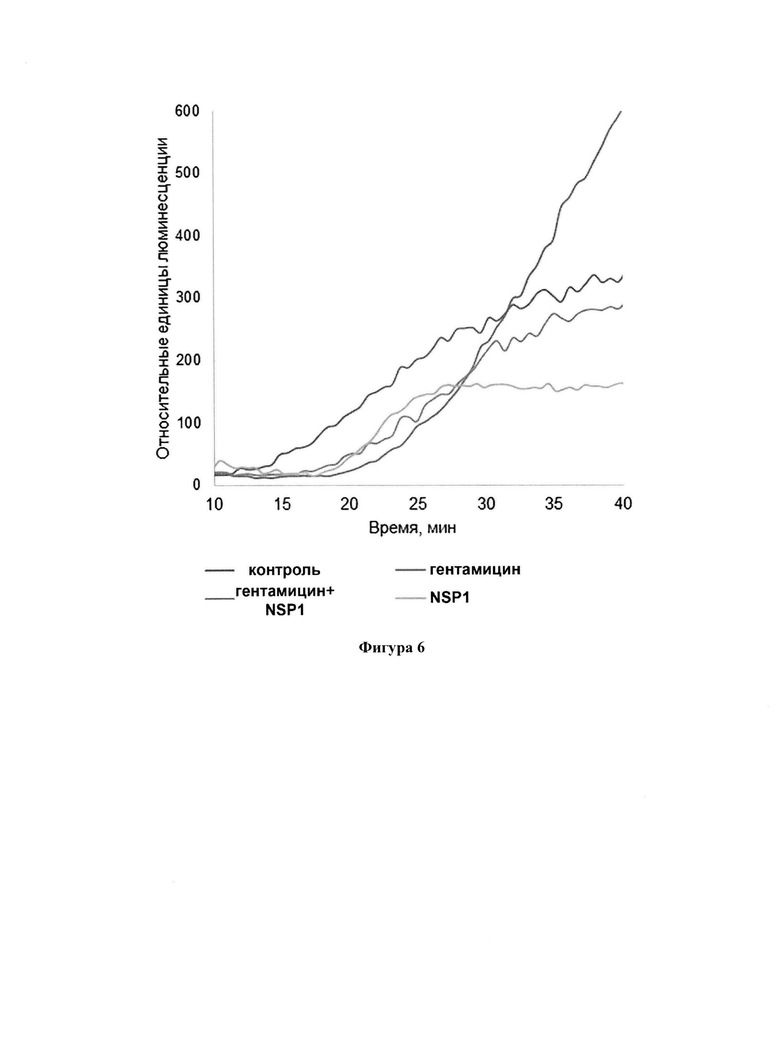
Фигура 6. Влияние гентамицина на трансляцию в присутствии NSP1 в модели с преждевременным стоп-кодоном. Изменение относительной хемилюминесценции при инкубации NSP1 в компетентном для трансляции RRL в присутствии мРНК NanoLuc с преждевременным стоп-кодоном в дополнительном пептиде на N-конце и субстрата для нанолюциферазы.
Осуществление изобретения
На первой стадии авторами настоящего изобретения была сконструирована конструкция pET-6xHis-SUMO-NSP1 (Фигура 1) методом сборки Гибсона на основе вектора petSUMO (Thermo Fisher (Invitrogen)) и кодон-оптимизированной для трансляции в бактериях последовательности NSP1 из вектора pDONR207_SARS-CoV-2_NSP1, депонированной в репозитории ADDGENE (https://www.addgene.org/141255). Для этого с помощью набора для высокоточной амплификации Q5 High-Fidelity 2Х Master Mix (NEB, кат. M0492L) были получены линейные ПЦР продукты: a) PetSUMO с использованием праймеров petSUMO_F (SEQ ID NO: 1) и petSUMO_R (SEQ ID NO: 2) (Перечень последовательностей); б) NSP1 с праймерами petSUMO_NSP1_F (SEQ ID NO: 3) и petSUMO_NSP1_R (SEQ ID NO: 4) (Перечень последовательностей). Эти ПЦР продукты были слиты методом сборки Гибсона с использованием готовой смеси Gibson Assembly Master Mix (NEB, кат. E2611L), после чего ими были трансформированы компетентные клетки Е. coli штамма Тор10. Несколько выросших колоний были размножены в ночной жидкой культуре LB и из них выделены плазмиды, соответствие которых ожидаемой конструкции pET-6xHis-SUMO-NSP1 было подтверждено секвенированием по Сэнгеру в ЦКП «Геном» (ИМБ РАН)
Стоит отметить, что для последующей интерпретации результатов по ингибированию активности NSP1 необходимы корректные отрицательные контроли. В качестве таких контролей могут выступать неактивные мутанты NSP1, например K164A/Н165А и Y154A/F157A. Мутантные формы NSP1 с аминокислотными заменами были созданы авторами настоящего изобретения на основе полученного вектора рЕТ-6xHis-SUMO-NSP1 с использованием набора QuikChange Site-Directed Mutagenesis Kits (Agilent, кат. 200518) в соответствии с протоколом производителя. Для получения NSP1(Y154A/F157A) были использованы праймеры NSP1_Y154A_F157A_F (SEQ ID NO: 5) и NSP1_Y154A_F157A_R (SEQ ID NO: 6), а для NSP1(K164A/H165A) праймеры NSP1_K164A_H165A_F (SEQ ID NO: 7) и NSP1_K164A_H165A_R (SEQ ID NO: 8) (Перечень последовательностей).
Далее экспрессионные векторы pET-6xHis-SUMO-NSP1 (дикого типа и мутантных форм) были трансформированы в штамм компетентных клеток Е. coli Bl21 (DE3). Ночная культура трансформированных бактерий была пересажена в среду x2LB и культивировалась при +37°С до оптической плотности (OD) 0,6 при длине волны 600 нм (D600), после чего культуру клеток остужали до +18°С и добавляли индуктор экспрессии изопропил-β-D-1-тиогалактопиранозид (ИПТГ) до конечной концентрации 500 мкМ. Экспрессию целевого белка проводили в течение 18 часов при +18°С. Клетки осаждали центрифугированием. Осадок клеток ресуспендировали в 40 мл лизис буфера и подвергали разрушению с помощью ультразвукового дезинтегратора VCX 130 РВ (Sonics & Materials, США). Полученный гомогенат осветляли центрифугированием и инкубировали в течении часа с 1 мл Ni агарозы (His-Select Nickel Affinity Gel, Sigma, кат. P6611-100ML), предварительно уравновешенной в лизис буфере. После этого смесь пропускали через гравитационные колонки (Biorad, кат. 7321010), промывали смолу промывочным буфером и элюировали буфером с 0,3М имидазолом (Фигура 2). Фракции элюата, содержащие целевой белок, объединяли и диализовали в течении 4-12 часов в буфере для Ulp протеазы. После диализа к белку 6xHis-SUMO-NSP1 добавляли рекомбинантную протеазу 6xHis-Ulp и инкубировали ночь при 4°С. После этого к полученной смеси 6xHis-SUMO, 6xHis-Ulp и NSP1 вновь добавляли Ni-агарозу, предварительно уравновешенную в буфере для Ulp протеазы, и инкубировали в течение 20 мин при +4°С в ротационном смесителе с перемешиванием 15 об/мин. Затем смесь вновь пропускали через гравитационную колонку (Biorad, кат. 7321010) и собирали проходящий сквозь нее раствор, содержащий чистый NSP1. 6xHis-SUMO, 6xHis-Ulp и любые примеси из лизата остаются связанными со смолой на колонке. Все фракции анализировали в 10% ПААГ методом Tricine-SDS-PAGE (электрофорез в полиакриламидном геле с трицином и додецилсульфатом натрия) с окраской красителем Кумасси G-250 (Фигура 3). Фракцию, содержащую чистый NSP1 диализовали в буфере для хранения (100 мМ KCl,20 мМ Tris-HCl с рН-7.5, 2 мМ DTT, 10% глицерин) в течение 4-12 часов при +4°С. После этого измеряли концентрацию NSP1, фасовали на аликвоты, замораживали в жидком азоте и в дальнейшем хранили на -70°С. Таким же образом выделяли и мутантные формы NSP1.
Активность выделенного NSP1 тестировали в RRL (лизате ретикулоцитов кролика Flexi Rabbit Reticulocyte Lysate System (Promega, кат. L4540)) в присутствии мРНК NanoLuc и субстрата NanoGlo. Люминесценцию измеряли с помощью Tecan Infinite 200 Pro (Tecan, Mannedorf, Швейцария). мРНК нанолюциферазы, используемой в тесте получали из имевшейся у нас конструкции плазмиды, содержавшей кодирующую последовательность нанолюциферазы - pNL-globine, перед которой вставлена нуклеотидная последовательность 5'UTR из бетта-глобина человека (GGGACACTTGCTTTTGACACAACTGTGTTTACTTGCAATCCCCCAAAACAGACACC) и перед ним промотор для Т7 РНК полимеразы (TAATACGACTCACTATA). На Фигуре 5 продемонстрирована визуализация результата измерения активности NSP1 и его мутантных форм по ингибированию трансляции in vitro в RRL. Ожидаемо, NSP1 сильно подавляет трансляцию, в то время как его мутантные формы не оказывают влияние на трансляцию.
Добавляя совместно с NSP1 различные соединения, можно производить скрининг потенциальных лекарственных препаратов для выявления таких из них, которые способны ингибировать функциональную активность NSP1 и в его присутствии восстанавливать трансляцию. Способ позволяет в широких пределах менять условия скрининга. Таким образом, нами был проведен скрининг некоторых соединений (нескольких аминогликозидных антибиотиков и мефлохина), связывающихся с рибосомами и, потенциально способных конкурировать с NSP1. Было обнаружено, что аминогликозидные антибиотики (канамицин, гентамицин) сами по себе значительно подавляют трансляцию, а мефлохин не способен отменить ингибирующий эффект NSP1.
Далее изобретение будет проиллюстрировано примерами, которые предназначены для обеспечения лучшего понимания сущности заявленного изобретения, но не должны рассматриваться как ограничивающие данное изобретение.
Пример 1. Создание экспрессионных конструкций pET-6xHis-SUMO-NSP1 для синтеза, последующей очистки и использования NSP1.
Синтез праймеров SEQ ID NO: 1-10 (Перечень последовательностей) был заказан в компании Евроген (Россия). Для получения линейного продукта вектора pET-6xHis-SUMO смешивали в ПЦР-пробирках (SSIbio, кат. 3225-00) линеаризованный вектор PetSUMO (Thermo Fisher (Invitrogen)) (конечная концентрация 0,1 нг/мкл), выступавшего в качестве матрицы с праймерами petSUMO_F (SEQ ID NO: 1) и petSUMO_R (SEQ ID NO: 2) (с конечной концентрацией по 500 нМ каждый) и с 25 мкл готовой смеси Q5 High-Fidelity 2Х Master Mix (NEB, кат. M0492L). Конечный объем ПЦР смеси доводили до 50 мкл деионизованной водой и амплифицировали в амплификаторе T100 Thermal Cycler (Biorad) по следующей программе: +98°С - 30 сек (1 цикл);+98°С - 10 сек., +69°С - 15 сек., +72°С - 3 мин. (28 циклов); +72°С - 5 мин. (1 цикл); хранение +4°С. Для получения линейного продукта вставки NSP1 смешивали в ПЦР-пробирках (SSIbio, кат. 3225-00) плазмиду pDONR207_SARS-CoV-2_NSP1 (Addgene, Plasmid #141255) (конечная концентрация 0,1 нг/мкл), выступавшей в качестве матрицы с праймерами petSUMO_NSP1_F (SEQ ID NO: 3) и petSUMO_NSP1_R (SEQ ID NO: 4) (с конечной концентрацией по 500 нМ каждый) и с 10 мкл готовой смеси Q5 High-Fidelity 2Х Master Mix (NEB, кат. M0492L). Конечный объем ПЦР смеси доводили до 20 мкл деионизованной водой и амплифицировали в амплификаторе T100 Thermal Cycler (Biorad) по следующей программе: +98°С - 30 сек (1 цикл); +98°С - 10 сек., +71°С - 10 сек., +72°С - 15 сек. (28 циклов); +72°С - 1 мин. (1 цикл); хранение +4°С.
По 1 мкл ПЦР продуктов pET-6xHis-SUMO и NSP1 смешивали с 3 мкл деионизованной воды и 5 мкл готовой смеси Gibson Assembly Master Mix (NEB, кат. E2611L), после чего в течение 1 часа инкубировали в амплификаторе T100 Thermal Cycler (Biorad) при +50°C с нагреванием крышки термоблока до +70°С. В последующем, полученной смесью трансформировали компетентные клетки Е. coli штамма Тор10: в 1,5 мл пробирке (SSIbio, кат. 1260-00) смешивали 10 мкл полученной Гибсон смеси со 100 мкл компетентных клеток и инкубировали при 0°С во льду в течение 30 мин, после чего смесь переносили в твердотельный термостат (модель «Гном», ДНК-Технология) и инкубировали 1,5 мин при +42°С, а затем смесь вновь переносили в лед и инкубировали 3 мин и далее добавляли 300 мкл стандартной среды LB (VWR Life science, кат. J106-2KG) и инкубировали в твердотельном термостате (модель «Гном», ДНК-Технология) при +37°С в течение 40 мин, каждые 10 мин переворачивая пробирки для перемешивания клеток. После этого смесь LB с трансформированными клетками равномерно распределяли по поверхности 10-см чашки со средой LB, приготовленной на 2% агаре с добавлением канамицина до конечной концентрации 30 мг/л, и инкубировали 20 часов в термостате (Jouan ЕВ 53, Франция) при +37°С.Три из выросших на чашке колоний были посажены в пробирках (Deltalab, кат. 916150, Испания) с крышками (Schuett biotec, кат. 3624583, Германия) в 2 мл жидкой среды LB каждая, и инкубировались в шейкере-инкубаторе (Biosan ES-29/60, Латвия) при перемешивании 200 об/мин в течение 16 часов при +37°С. Из выросших в каждой пробирке бактерий выделяли плазмиды набором Plasmid Miniprep (Евроген, кат. BC021S) в соответствии с протоколом производителя. Выделенные плазмиды были секвенированы по Сэнгеру в ЦКП «Геном» (ИМБ РАН). Анализ полученных нуклеотидных последовательностей показал, что все плазмиды точно соответствуют ожидаемому продукту pET-6xHis-SUMO-NSP1.
Мутантные формы NSP1 с аминокислотными заменами были созданы на основе полученного вектора pET-6xHis-SUMO-NSP1 с использованием набора QuikChange Site-Directed Mutagenesis Kits (Agilent, кат. 200518) в соответствии с протоколом производителя. Для получения NSP1(Y154A/F157A) были использованы праймеры NSP1_Y154A_F157A_F (SEQ ID NO: 5) и NSP1_Y154A_F157A_R (SEQ ID NO: 6), a NSP1(K164A/H165A) праймеры NSP1_K164A_H165A_F (SEQ ID NO: 7) и NSP1K164AH165AR (SEQ ID NO: 8). Скрининг и выделение целевых плазмид проводили также, как это описано для pET-6xHis-SUMO-NSP1. Таким образом были получены конструкции pET-6xHis-SUMO-NSP1(Y154A/F157A) и pET-6xHis-SUMO-NSP1(K164A/H165A).
Пример 2. Экспрессия, выделение и очистка NSP1 для последующего использования в тестах in vitro для поиска соединений, ингибирующих активность белка NSP1.
Экспрессионным вектором pET-6xHis-SUMO-NSP1 (10 нг) трансформировали 100 мкл компетентных клеток Е. coli штамма BL21(DE3), таким же образом, как это было описано для трансформации штамма Тор10. Ночную культуру трансформированных бактерий (среда LB с добавлением канамицина в концентрации 30 мг/л) в количестве 2 мл вносили в 2-литровую коническую колбу с 500 мл среды 2х LB (20 г/л триптона, 10 г/л дрожжевого экстракта, 10 г/л NaCl, 30 мг/л канамицин) и культивировали при +37°С в шейкере-инкубаторе (Biosan ES-29/60, Латвия) при перемешивании при 200 об/мин. Рост клеток контролировали измерением оптической плотности на измерителе клеточной плотности Ultrospec 10 (Amersham Biosciences). При достижении оптической плотности значения 0,6 культуру клеток остужали до +18°С и добавляли индуктор экспрессии изопропил-β-D-1-тиогалактопиранозид (ИПТГ) до конечной концентрации 500 мкМ. Экспрессию целевого белка проводили в течение 18 часов при +18°С в шейкере-инкубаторе New Brunswick Excella E25R (Eppendorf) при перемешивании при 140 об/мин. После этого культуру клеток переливали в центрифужную бутыль (Eppendorf, кат. 5820708000) и осаждали на центрифуге Eppendorf 5910R в бакет-роторе S-4x500 при 4000 об/мин в течение 30 мин. Полученный осадок клеток тщательно ресуспендировали в 40 мл лизис буфера (500 мМ KCl, 20 мМ Tris-HCl с рН-7.5, 1 мМ DTT, 7.5% глицерин, 0.1% Triton Х-100) переливали в 50-мл центрифужную пробирку (ТРР, кат. 91050) и подвергали разрушению с помощью ультразвукового дезинтегратора VCX 130 РВ (Sonics & Materials, США) 5 раз по 4 мин на 60% мощности. Полученный гомогенат осветляли центрифугированием на центрифуге Eppendorf 5910R в угловом роторе FA-6x50 при 20000 g в течение 40 мин при +4°С. Супернатант после центрифугирования переливали в новую 50-мл центрифужную пробирку и добавляли 1 мл Ni-агарозы (His-Select Nickel Affinity Gel, Sigma, кат. P6611-100ML), предварительно уравновешенной в лизис буфере, и инкубировали в ротационном смесителе RM-1 (Elmi, Латвия) в течение 60 мин с перемешиванием при 15 об/мин при +4°С. После этого смесь пропускали через гравитационные колонки (Biorad, кат. 7321010). Ni-агарозу со связанным целевым белком 6xHis-SUMO-NSP1, оставшуюся в колонке, промывали 3 раза по 10 мл промывочным буфером (500 мМ KCl, 20 мМ Tris-HCl с рН-7.5, 1 мМ DTT, имидазол 5 мМ, 7.5% глицерин). После промывки колонки, связавшийся материал элюировали 4 раза по 1 мл буфером для элюции (500 мМ KCl, 20 мМ Tris-HCl с рН-7.5, 1 мМ DTT, имидазол 300 мМ, 7.5% глицерин). Фракции анализировали в 10% ПААГ методом электрофореза по Лэммли с окраской красителем Кумасси G-250 («Bio-Rad», США) (Фигура 2). Все 4 фракции элюата, содержащие целевой белок, объединяли и диализовали в диализном мешке (Cellu-Sep Т3, Кат 123045) в течение 4-12 часов в 1 л буфера для Ulp протеазы (250 мМ KCl, 20 мМ Tris-HCl с рН-7.5, 1 мМ DTT, 7.5% глицерин). После диализа измеряли по OD280 концентрацию 6xHis-SUMO-NSP1 с использованием Tecan Infinite 200Pro (Tecan,  Швейцария) и, рассчитав его общую массу в растворе, добавляли 1/50 массы рекомбинантной протеазы 6xHis-Ulp, после чего ставили инкубацию в ротационном смесителе RM-1 (Elmi, Латвия) на ночь при +4°С с перемешиванием 10 об/мин. После этого к полученной смеси 6xHis-SUMO, 6xHis-Ulp и NSP1 вновь добавляли 1 мл 6His-Select Nickel Affinity Gel (Sigma, кат. P6611-100ML), предварительно уравновешенной в буфере для Ulp протеазы, и инкубировали в течение 20 мин при +4°С в ротационном смесителе с перемешиванием при 15 об/мин. Затем смесь вновь пропускали через гравитационную колонку (Biorad, кат. 7321010) и собирали проходящий сквозь нее раствор, содержащий чистый NSP1. 6xHis-SUMO, 6xHis-Ulp и любые примеси из лизата остаются связанными с Ni-агарозой на колонке. Все фракции анализировали в 10% ПААГ методом Tricine-SDS-PAGE (электрофорез в полиакриламидном геле с трицином и додецилсульфатом натрия) с окраской красителем Кумасси G-250 (Фигура 3.). Фракцию, содержащую чистый NSP1, диализовали в буфере для хранения (100 мМ KCl, 20 мМ Tris-HCl с рН-7.5, 2 мМ DTT, 10% глицерин) в течение 4-12 часов при +4°С. После этого измеряли концентрацию NSP1 по OD280 на Tecan Infinite 200Pro (Tecan,
Швейцария) и, рассчитав его общую массу в растворе, добавляли 1/50 массы рекомбинантной протеазы 6xHis-Ulp, после чего ставили инкубацию в ротационном смесителе RM-1 (Elmi, Латвия) на ночь при +4°С с перемешиванием 10 об/мин. После этого к полученной смеси 6xHis-SUMO, 6xHis-Ulp и NSP1 вновь добавляли 1 мл 6His-Select Nickel Affinity Gel (Sigma, кат. P6611-100ML), предварительно уравновешенной в буфере для Ulp протеазы, и инкубировали в течение 20 мин при +4°С в ротационном смесителе с перемешиванием при 15 об/мин. Затем смесь вновь пропускали через гравитационную колонку (Biorad, кат. 7321010) и собирали проходящий сквозь нее раствор, содержащий чистый NSP1. 6xHis-SUMO, 6xHis-Ulp и любые примеси из лизата остаются связанными с Ni-агарозой на колонке. Все фракции анализировали в 10% ПААГ методом Tricine-SDS-PAGE (электрофорез в полиакриламидном геле с трицином и додецилсульфатом натрия) с окраской красителем Кумасси G-250 (Фигура 3.). Фракцию, содержащую чистый NSP1, диализовали в буфере для хранения (100 мМ KCl, 20 мМ Tris-HCl с рН-7.5, 2 мМ DTT, 10% глицерин) в течение 4-12 часов при +4°С. После этого измеряли концентрацию NSP1 по OD280 на Tecan Infinite 200Pro (Tecan,  Швейцария), фасовали на аликвоты, замораживали в жидком азоте и в дальнейшем хранили на -70°С.
Швейцария), фасовали на аликвоты, замораживали в жидком азоте и в дальнейшем хранили на -70°С.
Таким же образом выделяли и мутантные формы NSP1 в векторах pET-6xHis-SUM0-NSP1(Y154A/F157A) и pET-6xHis-SUMO-NSP1(K164A/H165A).
Пример 3. Проверка активности NSP1 и его мутантов в тестах in vitro и проверка влияния лекарственных соединений на активность NSP1 в системе RRL.
Активность выделенного NSP1, а также мутантов NSP1(Y154A/F157A) и NSP1(K164A/H165A) тестировали в RRL (лизате ретикулоцитов кролика Flexi Rabbit Reticulocyte Lysate System (Promega, кат. L4540)). Смесь для трансляции содержала 70% RRL, дополненного 20 мМ Hepes-KOH (рН 7.5), 80 мМ KOAc, 0.5 мМ Mg(OAc)2, 0.36 мМ АТФ (Thermo Scientific, кат. R0441), 0.2 мМ ГТФ (Thermo Scientific, кат. R0461), 0.05 мМ каждой из 20 аминокислот (Promega, кат. L4461), 0.5 мМ спермидин (Sigma, кат. 85558-5G), 5 нг/мкл тотальной тРНК кролика, 10 мМ креатинфосфат (Roche, кат. 10621714001), 0.003 ед/мкл креатинкиназы (Sigma, C3755-17.5Ku), 2 мМ DTT (Диаэм, кат. D3483123.0100), 0.2 Ед/мкл ингибитор РНКаз RiboLock (ThermoFisher, кат. ЕО0381), 1% субстрата для нанолюциферазы (Nano-Glo, Promega, кат. N1110), 16 пг/мкл мРНК нанолюциферазы (получение описано ниже) и 0,6 мкМ белка Nsp1 или его мутантов в качестве отрицательного контроля. Люминесценцию измеряли при +30°С в течение 1 ч с помощью Tecan Infinite 200 Pro (Tecan,  Швейцария). При этом интенсивность люминесценции прямо пропорциональна трансляционной активности в лизате.
Швейцария). При этом интенсивность люминесценции прямо пропорциональна трансляционной активности в лизате.
Для получения линейного ПЦР продукта нанолюциферазы смешивали в ПЦР-пробирках (SSIbio, кат. 3225-00) линеаризованный вектор pNL-globine (конечная концентрация 0,1 нг/мкл), выступавшего в качестве матрицы с праймерами RV3L (SEQ ID NO: 9) и FLA50 (SEQ ID NO: 10) (с конечной концентрацией по 500 нМ каждый) и с 25 мкл готовой смеси Q5 High-Fidelity 2Х Master Mix (NEB, кат. M0492L). Конечный объем ПЦР смеси доводили до 50 мкл деионизованной водой и амплифицировали в амплификаторе T100 Thermal Cycler (Biorad) по следующей программе: +98°С - 30 сек (1 цикл); +98°C - 10 сек, +65°С - 15 сек, +72°С - 20 сек (28 циклов); +72°С - 5 мин (1 цикл); хранение при +4°С. Полученный ПЦР продукт очищали на колонках Illustra (GE, кат. 28903471) в соответствии с протоколом производителя и использовали для синтеза мРНК нанолюциферазы с использованием набора для синтеза мРНК с помощью Т7 РНК полимеразы RiboMAX (Promega, кат. P1300) в соответствии с протоколом производителя. Полученная мРНК нанолюциферазы представлена последовательностью SEQ ID: NO 11 (Перечень последовательностей).
Данные анализа ингибирующей активности NSP1 на трансляцию представлены в виде кривой изменения времени люминесценции со стандартными отклонениями, построенной в Microsoft Excel. На Фигуре 5. продемонстрирована визуализация результата измерения активности NSP1 и его мутантных форм по ингибированию трансляции in vitro в RRL. Ожидаемо, NSP1 сильно подавляет трансляцию, в то время как его мутантные формы не оказывают влияние на трансляцию.
В качестве примера тестирования воздействия лекарственного соединения на NSP1 вышеописанным способом использовали гентамицин (Sigma, G3632-5G) в конечной концентрации 100 мкМ. Так же в этом примере использовалась мРНК видоизмененной нанолюциферазы (SEQ ID NO: 12), содержавшей преждевременный стоп-кодон UGA в регионе мРНК, кодирующем дополнительную аминокислотную область с N-конца. Данную мРНК получали вышеописанным способом.
Мы наблюдали что гентамицин частично отменяет ингибирующий эффект NSP1 (Фигура 6.). В данном случае мы наблюдали непрямой эффект гентамицина на трансляцию матрицы с преждевременным стоп-кодоном в присутствии NSP1. Известно и хорошо видно из наших данных (Фигура 6.), что гентамицин стимулирует сквозное прочтение преждевременных стоп-кодонов, на чем основано его использование для терапии некоторых орфанных заболеваний. В случае гентамицина с NSP1, мы наблюдали наложение двух эффектов: стимулирование сквозного прочтения гентамицином и ингибирование трансляции белком NSP1. Проверенные нами соединения не описаны как препараты против NSP1 и приведены для оценки работоспособности способа в целом. Используя предложенный способ можно проверять любые соединения, для которых in silico предсказана ингибирующая активность в отношении NSP1.
| название | год | авторы | номер документа |
|---|---|---|---|
| Пептидные иммуногены и вакцинная композиция против коронавирусной инфекции COVID-19 с использованием пептидных иммуногенов | 2020 |
|
RU2738081C1 |
| Вакцинная композиция против коронавирусной инфекции COVID-19 | 2020 |
|
RU2743595C1 |
| Пептидные иммуногены и вакцинная композиция против коронавирусной инфекции COVID-19 с использованием пептидных иммуногенов | 2020 |
|
RU2743593C1 |
| Пептидные иммуногены, используемые в качестве компонентов вакцинной композиции против коронавирусной инфекции COVID-19 | 2020 |
|
RU2743594C1 |
| СПОСОБ ПОЛУЧЕНИЯ РЕКОМБИНАНТНОГО АНТИГЕНА MBP_RBD_6His ВИРУСА SARS-CoV-2 с C-КОНЦЕВОЙ АФФИННОЙ МЕТКОЙ 6xHIS-tag, ПРЕДНАЗНАЧЕННОГО ДЛЯ ИСПОЛЬЗОВАНИЯЧ В КАЧЕСТВЕ КОМПОНЕНТА НАБОРА РЕАГЕНТОВ ДЛЯ СЕРОДИАГНОСТИКИ COVID-19 | 2023 |
|
RU2813324C1 |
| Средство для ингибирования репликации вируса SARS-CoV-2, опосредованного РНК-интерференцией | 2020 |
|
RU2733361C1 |
| Рекомбинантный белок, связывающийся с RBD S-белка SARS-CoV-2 | 2022 |
|
RU2778942C1 |
| Регуляторная последовательность для увеличения экспрессии генов | 2022 |
|
RU2804421C1 |
| Рекомбинантная ДНК, обеспечивающая получение рекомбинантного белка Cov1, обладающего иммуногенными свойствами в отношении вируса SARS-CoV-2 | 2021 |
|
RU2776484C1 |
| ИММУНОЛИПОСОМА, СВЯЗЫВАЮЩАЯСЯ С RBD S-БЕЛКА SARS-COV-2 | 2023 |
|
RU2827165C1 |








Изобретение относится к области биотехнологии. Описана группа изобретений, включающая способ получения высокоочищенного, функционально активного белка NSP1 SARS-CoV-2 и способ тестирования активности высокоочищенного белка NSP1 SARS-CoV-2, полученного вышеописанным способом, по подавлению трансляции в RRL системе трансляции in vitro. Способ получения белка NSP1 SARS-CoV-2 включает создание экспрессионной конструкции pET-6xHIS-SUMO-NSP1 с использованием набора праймеров с последовательностями SEQ ID NO: 1-4 и выделение рекомбинантного белка NSP1 SARS-CoV-2 в ходе двух раундов металл-хелатной аффинной хроматографии. Изобретение расширяет арсенал способов получения очищенного функционально активного белка NSP1 SARS-CoV-2. 2 н.п. ф-лы, 6 ил., 3 пр.
1. Способ получения высокоочищенного, функционально активного белка NSP1 SARS-CoV-2, включающий создание экспрессионной конструкции pET-6xHis-SUMO-NSP1, трансформацию клеток бактерии Escherichia coli конструкцией pET-6xHis-SUMO-NSP1, качественно отличающийся тем, что при создании экспрессионной модели используется оригинальный набор праймеров, представленный последовательностями SEQ ID NO: 1 - SEQ ID NO: 4, и выделение рекомбинантного белка NSP1 SARS-CoV-2 осуществляется в ходе двух раундов металл-хелатной аффинной хроматографии с получением высокоочищенного целевого белка, полностью идентичного натуральному с отсутствием дополнительных аминокислотных последовательностей.
2. Способ тестирования активности высокоочищенного белка NSP1 SARS-CoV-2, полученного способом по п. 1, по подавлению трансляции в RRL системе трансляции in vitro, качественно отличающегося тем, что тестирование проводится в присутствии мРНК нанолюциферазы, имеющей 5'UTR от гена бета-глобина человека и обеспечивающей повышенный уровень экспрессии продукта трансляции в ретикулоцитах, а также поли(А)-последовательности в 3'UTR, что обеспечивает стабильность мРНК и повышает уровень трансляции.
| Petty K | |||
| J | |||
| Metal-Chelate Affinity Chromatography | |||
| Current Protocols in Molecular Biology | |||
| Перекатываемый затвор для водоемов | 1922 |
|
SU2001A1 |
| Xinyuan He et al | |||
| Functional genetic encoding of sulfotyrosine in mammalian cells | |||
| NATURE COMMUNICATIONS, 2020, 11:4820 | |||
| Hua J., Patton J | |||
| T | |||
| Веникодробильный станок | 1921 |
|
SU53A1 |
Авторы
Даты
2024-07-12—Публикация
2021-10-25—Подача