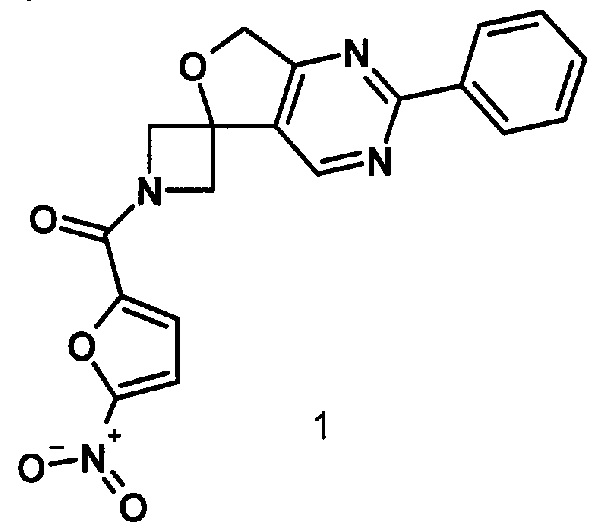
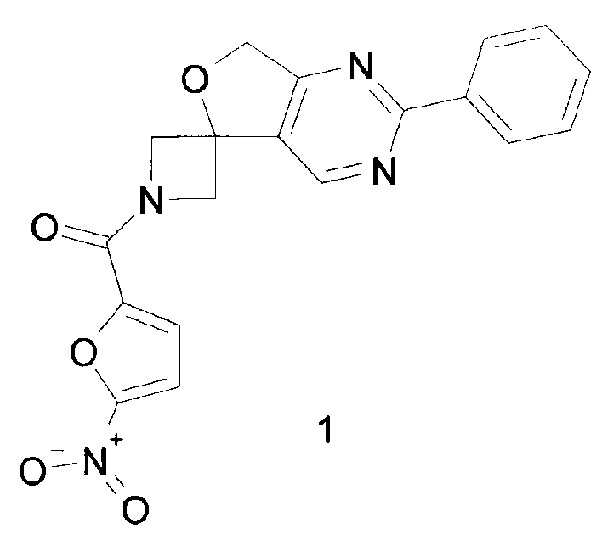
1-[(5-нитрофуран-2-ил)карбонил]-2'-фенил-1//,7'H-спиро[азетидин-3,5'-фуро[3,4-rf] пиримидин],обладающий противотуберкулезной активностью в отношении возбудителя туберкулеза с множественной лекарственной устойчивостью, и способ его получения
Изобретение относится к химии органических гетероциклических соединений, а именно к индивидуальному 1-[(5-нитрофуран-2-ил)карбонил]-2'-фенил-1H,7'H-спиро[азетидин-3,5'-фуро[3,4-d]пиримидину]формулы 1, проявляющему противотуберкулезные свойства, и способу его получения.
Успехи химиотерапии туберкулеза всецело зависят от создания новых препаратов с противотуберкулезной активностью и от скорости формирования лекарственной устойчивости микобактерий туберкулеза (ЛУ МБТ) к препаратам уже введенным в клиническую практику, при которой лечение имеет низкую эффективность, а его длительность составляет уже 2 года в отличие от 6-месячного курса при лекарственно-чувствительном туберкулезе. Лекарственно-устойчивый туберкулез (ЛУ-ТБ) представляет собой растущую глобальную проблему здравоохранения. Так, в 2021 году было зарегистрировано 450 000 случаев МЛУ туберкулеза (туберкулеза с множественной лекарственной устойчивостью), что на 3,1% больше, чем в 2020 году [Global Tuberculosis Report 2022. https://www.who.int/teams/global-tuberculosis-programme/tb-reports/global-tuberculosis-report-2022].
В начале XXI века ситуация усугубилась расширением спектра лекарственной устойчивости МБТ штаммов, что было обозначено как «широкая лекарственнаяустойчивость МБТ (ШЛУ МБТ)», в 2019 году ее дефиниция была пересмотрена за счет включения всех основных противотуберкулезных препаратов: устойчивость МБТ к изониазиду, рифампицину, фторхинолонам, линезолиду или бедаквилину. По данным исследования с использованием систематического обзора и метаанализа существующих исследовательских работ, изучавших распространенность различных типов туберкулеза, на 2022 год глобальная распространенность туберкулеза с МЛУ, монорезистентностью к изониазиду, рифампицину и ШЛУ составляет 11,6%, 15,7%, 9,4% и 2,5% соответственно [Salari К, Kanjoori А.К, Hosseinian-Far A., Hasheminezhad R., Mansouri К., Mohammadi М. Global prevalence of drug-resistant tuberculosis: a systematic review and meta-analysis. Infect Dis Poverty. 2023;12(1):57].
На сегодняшний день хорошо известны все обстоятельства, препятствующие эффективному лечебному процессу при МЛУ/ШЛУ туберкулезе: длительные сроки химиотерапии, недостаточный выбор препаратов для формирования схем на основе тестов лекарственной чувствительности МБТ, ограниченный доступ к полной информации по всем препаратам с противотуберкулезной активностью, индивидуальная плохая переносимость препаратов, низкая приверженность пациентов к лечению. Сочетание этих обстоятельств, в разных вариантах у каждого пациента, снижает общую эффективность лечения туберкулеза с лекарственной устойчивостью возбудителя до 62% при новых случаях, до 49% - при ранее леченых случаях и до 41% - среди ВИЧ-позитивных случаев [Васильева И.А., Самойлова А.Г., Зимина В.К, Ловачева О.В., Абрамченко А.В. Химиотерапия туберкулеза в России -история продолжается//Туберкулез и болезни легких. 2023. Т. 101, №2. С. 8-12].
К сожалению, в последние несколько десятилетий двадцатого века исследованиям по созданию лекарств от туберкулеза не уделялось должного внимания. В 2022 году ВОЗ выступила с инициативой по разработке новых противотуберкулезных препаратов и даже ежегодно выделяет средства на эти исследования [Global Tuberculosis Report2022. https://www.who.int/teams/global-tuberculosis-programme/tb-reports/global-tuberculosis-report-2022]. В настоящее время 17 кандидатов из 14 различных химических классов находятся на различных стадиях клинической разработки [Samanta S., Kumar S., Aratikatla Е.К., Ghorpade S.R., Singh V. Recent developments of imidazo[1,2-a]pyridine analogues as antituberculosis agents. RSC Med Chem. 2023;14(4):644-657\.
Задачей предлагаемого изобретения является создание нового неописанного в литературе соединения 1-[(5-нитрофуран-2-ил) карбонил]-2'-фенил-1H,7'H-спиро[азетидин-3,5'-фуро[3,4-d]пиримидина]формулы 1, что позволит расширить арсенал потенциальных противотуберкулезных препаратов для борьбы с МЛУ ТБ.
Техническим результатом при использовании изобретения является получение нового соединения формулы 1, которое потенциально может быть применено в медицине в качестве лекарственного средства; разработка способа его синтеза; выявленная противотуберкулезная активность in vitro в отношении стандартного и клинических лекарственно устойчивых штаммов М. tuberculosis.
Задача решается также тем, что способ получения соединения 1-[(5-нитрофуран-2-ил)карбонил]-2'-фенил-1H,7'H-спиро[азетидин-3,5'-фуро[3,4-d]пиримидина] формулы 1, осуществляется путем взаимодействия в сухом диметилформамидеимидазолида 5-нитрофуран-2-карбоновой кислоты и спироциклического амина, получаемого непосредственно перед реакцией обработкой 2-тре/и-бутил-2'-фенил-1H,7'H-спиро[азетидин-3,5'-фуро[3,4-d]пиримидин]-1-карбоксилата(формулы 5) раствором трифторуксусной кислоты в сухом хлористом метилене при температуре 0°С.
Задача решается также тем, что соединение формулы 1 обладает противотуберкулезной активностью, проявляемой в отношении чувствительного стандартного штамма H37RV и лекарственно устойчивых клинических изолятов МБТ.
Изобретение поясняется чертежами, где:
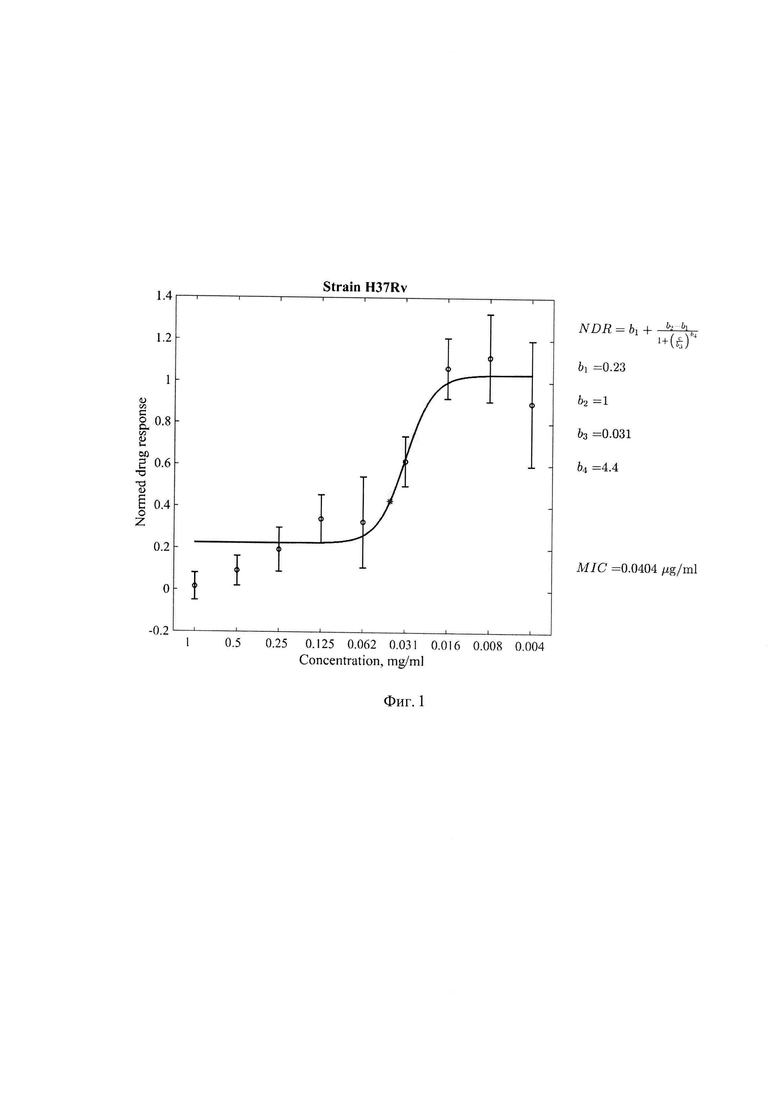
Фиг 1. Минимальная ингибирующая концентрация (МИК) соединения 1-[(5-нитрофуран-2-ил)карбонил]-2'-пропил-1H,7'H-спиро[азетидин-3,5'-фуро[3,4-d]пиримидин]формулы 1 в отношении международного тест-штамма H37Rv, где по оси абсцисс - концентрация соединения (мкг/мл) формулы 1, по оси ординат - индикатор роста культуры, нормированный на контрольные значения медианных величин цвета чистого резазурина без культуры МБТ и культуры МБТ без добавления соединения формулы 1. Значение МИК=0,0404 мкг/мл.
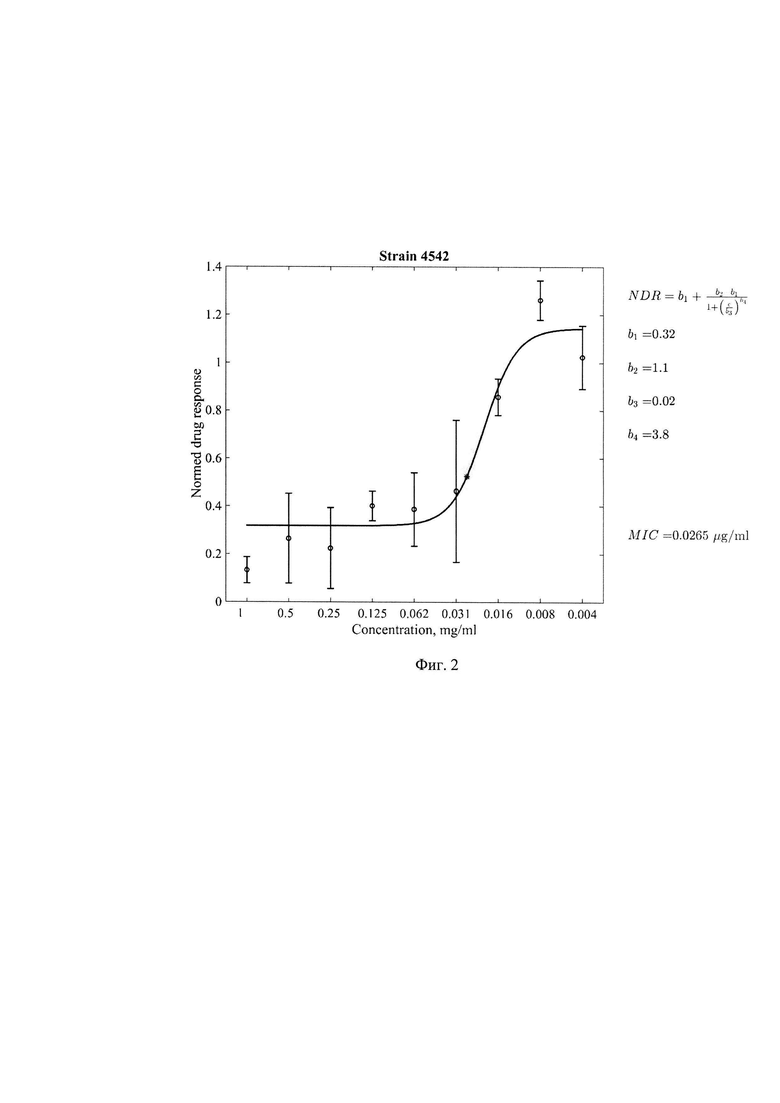
Фиг. 2. Минимальная ингибирующая концентрация(МИК) соединения 1-[(5-нитрофуран-2-ил)карбонил] -2'-пропил-1H,7'H-спиро[азетидин-3,5'-фуро[3,4-d]пиримидин]формулы 1 в отношении клинического штамма 4542 с множественной лекарственной устойчивостью, где по оси абсцисс - концентрация соединения (мкг/мл) формулы 1, по оси ординат - индикатор роста культуры, нормированный на контрольные значения медианных величин цвета чистого резазурина без культуры МБТ и культуры МБТ без добавления соединения формулы 1. Значение МИК=0,0265 мкг/мл.
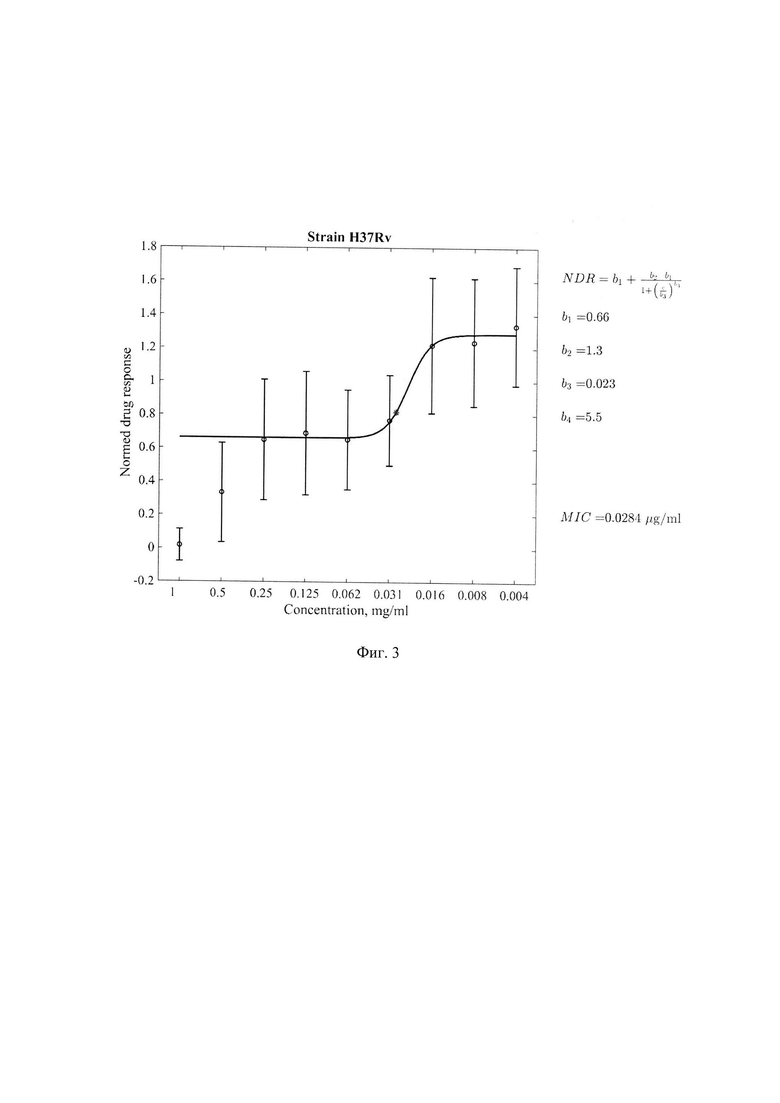
Фиг. 3. Минимальная ингибирующая концентрация (МИК) соединения 1-[(5-нитрофуран-2-ил)карбонил]-2'-пропил-1H,7'H-спиро[азетидин-3,5'-фуро[3,4-d]пиримидин]формулы 1 в отношении клинического штамма 7074 с множественнойлекарственной устойчивостью, где по оси абсцисс - концентрация соединения (мкг/мл) формулы 1, по оси ординат - индикатор роста культуры, нормированный на контрольные значения медианных величин цвета чистого резазурина без культуры МБТ и культуры МБТ без добавления соединения формулы 1. Значение МИК=0,0606 мкг/мл.
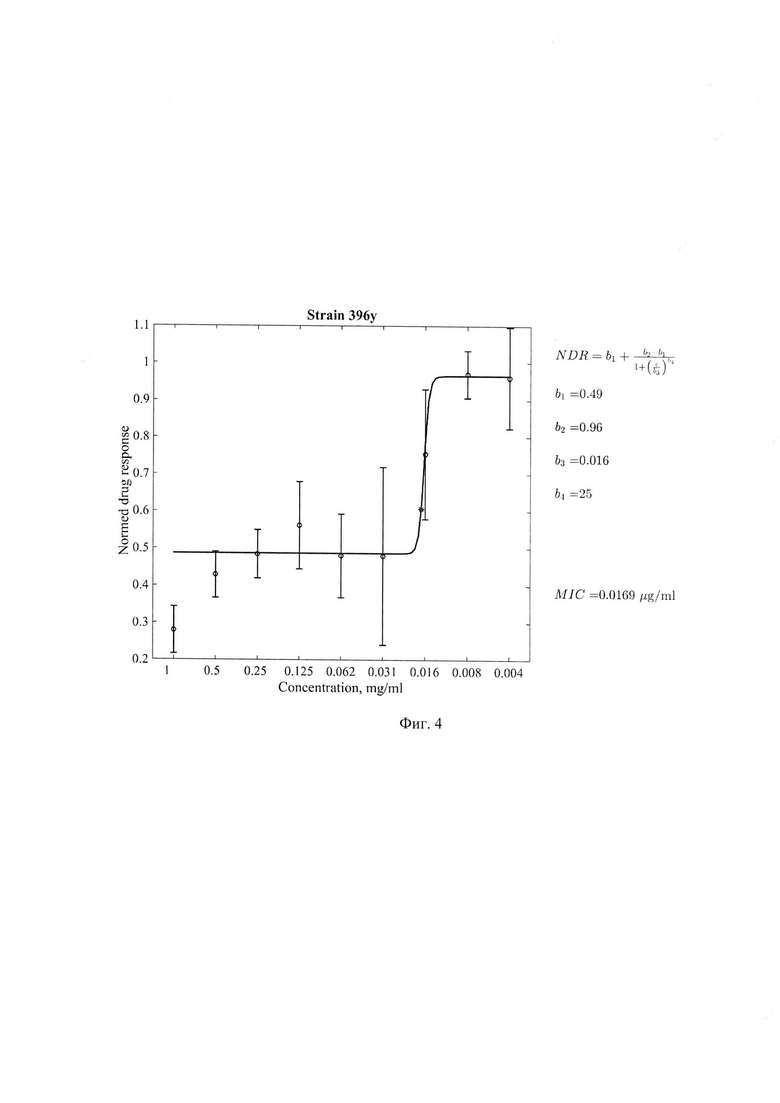
Фиг. 4. Минимальная ингибирующая концентрация (МИК) соединения 1-[(5-нитрофуран-2-ил) карбонил] -2'-пропил-1H,7'H-спиро [азетидин-3,5 '-фуро[3,4-
d]пиримидин]формулы 1 в отношении клинического штамма 396у с множественной лекарственной устойчивостью, где по оси абсцисс - концентрация соединения (мкг/мл) формулы 1, по оси ординат - индикатор роста культуры, нормированный на контрольные значения медианных величин цвета чистого резазурина без культуры МБТ и культуры МБТ без добавления соединения формулы 1. Значение МИК=0,0169 мкг/мл.
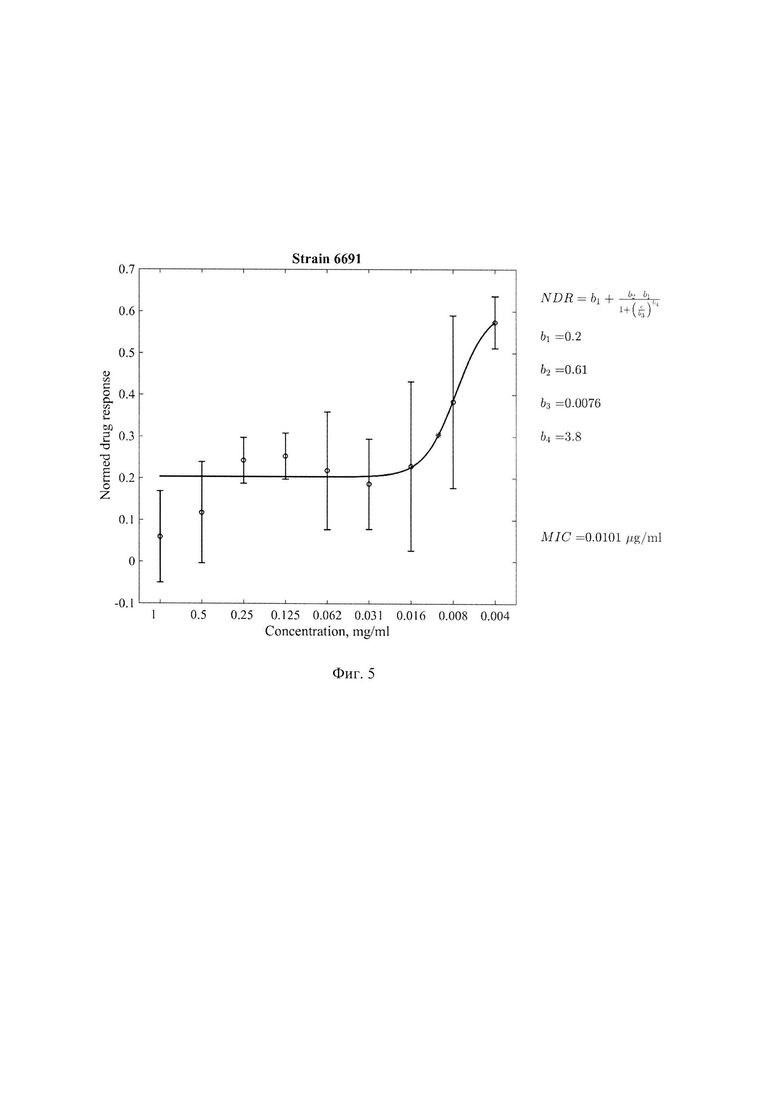
Фиг. 5. Минимальная ингибирующая концентрация(МИК)соединения 1-[(5-нитрофуран-2-ил)карбонил]-2'-пропил-1H,7'H-спиро[азетидин-3,5,-фуро[3,4-d]пиримидин]формулы 1 в отношении клинического штамма 6691 с множественной лекарственной устойчивостью, где по оси абсцисс - концентрация соединения (мкг/мл) формулы 1, по оси ординат - индикатор роста культуры, нормированный на контрольные значения медианных величин цвета чистого резазурина без культуры МБТ и культуры МБТ без добавления соединения формулы 1. Значение МИК=0,0101 мкг/мл.
Фиг. 6. Цитотоксические свойства соединения формулы 1в клетках Vero.
Примеры практического осуществления.
Пример 1. Методика получения 1-[(5-нитрофуран-2-ил)карбонил]-2'-фенил-1H,7'H-спиро[азетидин-3,5'-фуро[3,4-d]пиримидина]формулы 1.
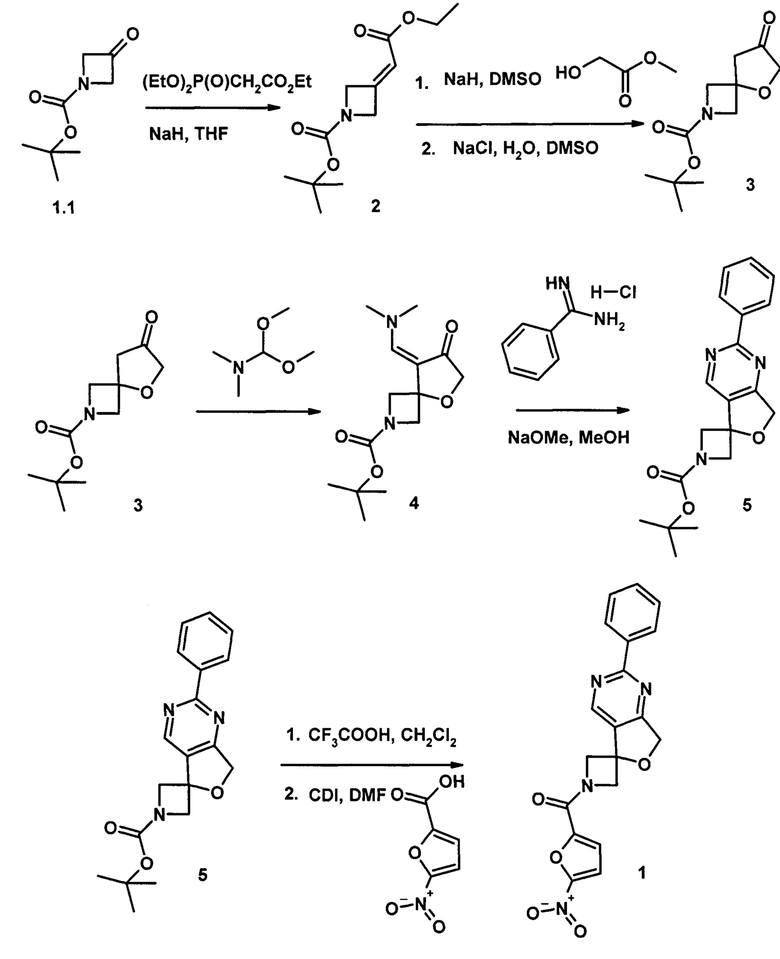
трет-Бутил 3-(2-оксо-2-этоксиэтилиден)азетидин-1-карбоксилат(2)
Синтезировали по методике, описанной в литературе [Le Manach С; Dam J.; Woodland et al. Identification and Profiling of a Novel Diazaspiro [3.4]octane Chemical SeriesActive against Multiple Stages of the Human Malaria Parasite Plasmodium falciparum and Optimization Efforts. J. Med. Chem. 2021, 64, 2291-2309.]. К суспензии NaH (60%-ная дисперсия в вазелиновом масле, 1,88 г, 0,047 моль, 1,15 экв.) в ТГФ (150 мл) прикапывали триэтилфосфоноацетат (11 г, 0,054 моль, 1,2 экв.) при 0°С.Полученную смесь нагревали до комнатной температуры и перемешивали в течение 30 минут.Затем снова охлаждали до 0°С и добавляли трет-бутил-3-оксазетидин-1-карбоксилат (7 г, 0,041 моль, 1,0 экв.) в ТГФ (50 мл). Реакционную смесь вновь нагревали до комнатной температуры и перемешивали в этих условиях в течение ночи. Затем реакцию разбавляли этилацетатом, промывали насыщенным водным раствором NaHCO3, водой и насыщенным водным раствором NaCl. Органическую фазу отделяли, сушили над безводным Na2SO4, фильтровали и концентрировали в вакууме. Остаток очищали колоночной хроматографией на силикагеле, элюируя смесью этилацетата в гексане 0→10%. Выход 2-9 г (92%), прозрачное масло. Спектральные данные соединения 2 соответствовали литературным данным: 1Н NMR (300 MHz, CDCl3) δ 5.74 (дд, J=4.5, 2.2 Hz, 1H), 4.80 (дд, J=6.3, 2.9 Hz, 2H), 4.57 (дт, J=5.3, 2.7 Hz, 2H), 4.31-4.02 (м, 2Н), 1.45 (с, 9Н), 1.26 (т, J=7.1 Hz, 3Н); LCMS (ESI): m/z рассчитанный для C21H30N2O4 (М+Н), 242.3; обнаруженный 242.2.
трет-Бутил 7-оксо-5-окса-2-азаспиро[3.4]октан-2-карбоксилат (3)
Синтезировали по методике, описанной в литературе [Li D.B., Rogers-Evans М., Carreira Е.М.. Construction of multifunctional modules for drug discovery: synthesis of novel thia/oxa-azaspiro[3.4]octanes. Org. Lett. 2013, 15, 4766-4769].
К суспензии NaH (60% дисперсия в вазелиновом масле, 4.2 г, 0.105 моль,) в сухом эфире (150 мл) под аргоном по каплям добавляется метиловый эфир гликолевой кислоты (8.1 мл, 105 ммоль). Полученная смесь перемешивается 30 мин при комнатной температуре, после чего растворители удаляются в вакууме, затем добавляется 200 мл сухого ДМСО. После охлаждения до 0°С, добавляется раствор непредельного эфира 2(21 г, 87.2 ммоль) в сухом ДМСО (20 мл). Реакционная смесь нагревается до комнатной температуры и оставляется перемешиваться на ночь. Смесь разбавляется водной НС1 (5%) и эфиром, водная фаза дважды экстрагируется эфиром. Органическая фаза отделяется, сушится Na2SO4 и концентрируется под вакуумом с образованием желтоватого масла. Полученное масло растворяется в смеси ДМСО (300 мл) и воды (30 мл) с добавлением NaCl (10.2 г, 175 ммоль). Полученная смесь нагревается при 120°С 2 ч под аргоном. После охлаждения до комнатной температуры смесь разбавляется насыщенным раствором NaCl и диэтиловым эфиром, водный слой дважды экстрагируется диэтиловым эфиром. Органические фазы объединяются, полученный раствор промывается водой, сушится над Na2SO4 и концентрируется под вакуумом с образованием желтоватого масла которое очищается колоночной хроматографией на силикагеле (элюент гексан: этилацетат 4.5: 1). Выход 2-12 г (61%), прозрачное масло. Спектральные данные соединения 3 соответствовали литературным данным
1HNMR (300 MHz, DMSO-d6) δ 4.06-3.81 (м, 6Н), 2.78 (с, 2Н), 1.36 (с, 9Н); LCMS (ESI): m/z (М+Н) рассчитанный для С11Н18NO4,228.3; обнаруженный, 228.2.
трет-Бутил-2'-фенил-1H,7'Н-спиро[азетидин-3,5'-фуро[3,4-d]пиримидин]-1-карбоксилат (5)
Кетон 3 (2.24 г, 0.01 моль) растворяют в диметилацетале ДМФА (13 мл, 10 экв) и перемешивают при кипячении ночь. Избыток ацеталя ДМФА удаляют в вакууме, затем перерастворяют смесь в толуоле и снова упаривают. Остаток растворяют в 10 мл метанола и прикапывают к предварительно приготовленному охлажденному до 0°С раствору гидрохлорида фенилкарбоксимидамида (2.35 г, 0.015 моль, 1.5 зкв.) в 30 мл метанола и метилата натрия (0.9 г, 0.017 моль, 1.7 экв), раствор нагревают при кипении 8 часов. Растворитель упаривают, распределяют вещество между водным раствором лимонной кислоты и хлористым метиленом. Органическую фазу отделяют, промывают водой, сушат над сульфатом натрия и упаривают. Полученный продукт выделяют хроматографией на силикагеле, система этилацетаттексан 1:1 - чистый этилацетат. Выход соединения 5 2.13 г (63%), белое твердое вещество, tпл.=98-99°C.1HNMR (300 MHz, CDCl3) δ 8.88 (с, 1H), 8.51 -8.40 (м, 2H), 7.59-7.37 (м, 3Н), 5.11 (с, 2Н), 4.39 (дд, J=9.6, 0.9 Hz, 2Н), 4.28-4.14 (м, 2Н), 1.51 (с, 9Н); 13CNMR(75 MHz, CDC13) δ 169.83, 165.40, 156.32, 149.94, 136.93, 131.07, 130.25, 128.64, 128.32, 80.72, 80.29, 71.87, 63.76, 28.29. HRMS (ESI) m/z, рассчитанный для C19H22N3O3 [М+Н+] 340.1655, обнаруженный, 340.1658.
1-[(5-Нитрофуран-2-ил)карбонил]-2'-фенил-1H,7'Н-спиро/азетидин-3,5'-фуро[3,4-d]пиримидин](1)
Раствор А. К раствору 5-нитрофурановой кислоты (75 мг, 0.47 ммоль) в 3 мл DMFnpn 0°С добавляли карбонилдиимидазол (97 мг, 0.6 ммоль) и перемешивали 1 час.
Раствор В. К раствору соединения 5 (0.20 г, 0.6 ммоль) в 5 мл хлористого метилена при 0°С прикапывают 1 мл CF3COOH, перемешивают 1 час (контроль реакции по ТСХ), упаривают под вакуумом при температуре не более 30°С.Остаток растворяют в 3 мл ДМФА, прикапывают триэтиламин (0.19 г, 1.9 ммоль), перемешивают 30 минут и прикапывают к раствору А. Реакционную массу перемешивают ночь, выливают в 25 мл воды и экстрагируют этилацетатом (3 раза по 20 мл). Органические фазы объединяют, промывают насыщенным раствором NaCl, сушили над Na2SO4 и упаривали под вакуумом. Остаток очищали колоночной хроматографией на силикагеле (элюент CH2CI2:МеОН10: 1). Выход соединения 1 78 мг (44%), белое твердое вещество, tпл.=120-121°С.1HNMR (300 MHz, DMSO-d6) δ 9.24 (с, 1Н), 8.42 (дд, J=6.3, 2.8 Hz, 2Н), 7.82 (д, J=3.9 Hz, 1Н), 7.60-7.49 (м, 3Н), 7.41 (д, J=3.9 Hz, 1H), 5.16 (с, 2Н), 4.94 (АВкв, JAB=10.5 Hz, ΔνAB=42.8 Hz, 2H), 4.49 (АВкв, JAB=11.2 Hz, ΔνAB =65.7 Hz, 2H); 13CNMR (75 MHz, DMSO-d6) δ 170.69, 164.15, 156.85, 152.10, 151.89, 147.80, 137.09, 131.54, 129.94, 129.22, 128.31, 117.58, 113.59, 82.09, 71.59, 66.65, 63.26; HRMS (ESI) m/z, рассчитанный для C19H14N4O5 [M+H+] 378.0964, обнаруженный, 378.0969.
Способполучениясоединения1-[(5-нитрофуран-2-ил)карбонил]-2'-фенил-1H,7'H-спиро[азетидин-3,5'-фуро[3,4-d]пиримидина]формулы 1 разработан и проведен в лабораторных условиях. Преимущество данного способа получения заключается в том, что он позволяет напрямую вводить в реакцию ацилирования соединение 5 без предварительного выделения спироциклического амина, что сокращает число синтетических операций и упрощает синтез.
Пример 2. Противотуберкулезная активность соединения 1-[(5-нитрофуран-2-ил)карбонил]-2'-фенил-1Н,7'H-спиро[азетидин-3,5'-фуро[3,4-d]пиримидина] формулы 1 (исследование in vitro)
Исследование антимикобактериальной активности проводили методом двукратных серийных микроразведений в жидкой синтетической среде Миддлбрука (Middlebrook 7Н9 BrothBase, Sigma-Aldrich, кат.№M0178) с 10% ростовой добавки OADC (BBL Middlebrook OADC Enrichment, BectonDickinson, кат.№245116) в 96-луночном планшете с индикацией роста микобактерий с помощью 0,01% резазурина (Resazurinsodiumsalt, Sigma, KaT.№R7017) [метод REMA - Resazurin Microdilution Assay; Palomino J.-C, Martin A., Camacho M., Guerra Я, Swings J., Portaels F. Resazurin Microtitre Assay Plate Simple and Inexpensive method for Detection of Drug Resistance in Mycobacterium tuberculosis // Antimicrob. Agents Chemother. 2002. 46(80): 2720-2722]. Исследованный диапазон доз соединения 1 - от 100 до 0.4 мкг/мл и от 1,0 до 0,004 мкг/мл. Во все лунки вносили рабочие суспензии М. tuberculosis H37Rv иликлинических штаммов МБТ в объеме 100 мкл, кроме: ряд 10 - контроль суспензии МБТ, ряд 11 - контроль роста суспензии МБТ, разведенной в 100 раз (1% контроль); ряд 12 - контроль питательной среды/«бланк» (200 мкл). На 7 сутки инкубации при +35°С во все лунки добавляли по 30 мкл водного раствора резазурина с концентрацией 0.01%. Планшеты повторно инкубировали 18 ч при +35°С.Рост микобактерий регистрировали визуально по изменению цвета индикатора резазурина (с голубого на розовый).
Величину минимальной ингибирующей концентрация (МИК) вычисляли как средние значения интенсивности свечения индикатора роста (резаруфина, в который превращается резазурин при воздействии комплекса редуктаз микроорганизмов).
В качестве кривой «доза-эффект» использовалась стандартная для биохимических и биомедицинских исследований [Motulsky К, Christopoulos A. Fittingmodels to biological data usinglinear and nonlinear regression: a practical guide to curvefitting. Oxford University Press, 2004] функция Хилла
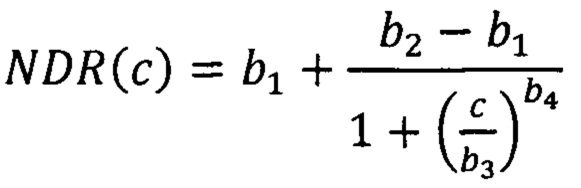
с четырьмя параметрами: b1 и b2 задают, соответственно, верхнюю и нижнюю асимптоты кривой отклика построенной регрессией непосредственно экспериментальных данных (в силу экспериментальной неопределенности данных они могут отличаться от 0 и 1), b3=IС50 - концентрация, при которой кривая ингибирования принимает половинное значение между асимптотами; b4 - феноменологический степенной показатель функции Хилла. Применимость данного подхода для нахождения МИК в резазуриновом тесте с использованием данных о флуоресценции резоруфина была установлена ранее [Postnikov Е.В., Lavrova A.I. Statistical features of REMA data of antimycobacterial drug screening and determining the minimal inhibitory concentration. 2021 6th International Conference on Intelligent Informatics and Biomedical Sciences (ICIIBMS). IEEE, 2021. P. 107-108].
В подходе данной работы за значение МИК принимается концентрация, соответствующая увеличению отклика на 1/4 расстояния между асимптотами кривой Хилла, полученной нелинейной регрессией (на основе алгоритма Левенберга-Марквардта), что соответствует бинарному характеру классифицирующего метода и характерному масштабу медианного отклонения данных. Для функции Хилла с известными параметрами это значение находится аналитически как 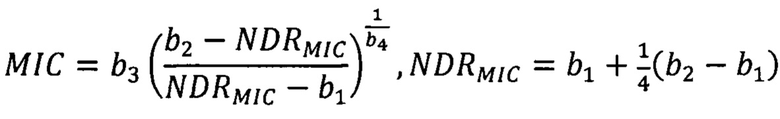
В качестве тест-штаммов использовали:
1) международный стандартный тест-штамм MycobacteriumtuberculosisW-ц^м -чувствительный к противотуберкулезным препаратам (ТВС # 1/47, источник - Институт гигиены и эпидемиологии, Прага, 1976 г., получен из ФГБУ «Научный центр экспертизы средств медицинского применения» Минздрава России).
2) 4 клинических штамма Mycobacteriumtuberculosis с множественной лекарственной устойчивостью и различными сочетаниями мутаций в генах rpoB(резистентность к рифампицину), katG, inhA, ahpC (устойчивость к изониазиду) из коллекции ФГБУ «Санкт-Петербургского научно-исследовательского института фтизиопульмонологии» Минздрава России:
- штаммы 4542 (SIT266) и 7074 (SIT252) Евро-Американской линии (Lineage 4), генотип Latin-American Mediterranean (LAM):
- штаммы 396y (SIT1) и 6691 (SIT269) Восточно-Азиатской линии (Lineage 2) генотип Beijing, сублиния earlyancient Beijing RD181 -intact.
Результаты определения МИК соединения формулы 1 для стандартного штамма M.tuber miosis H37Rv и лекарственно устойчивых штаммов M.tuberculosis представлены в таблице 1 и Фиг. 1-5.
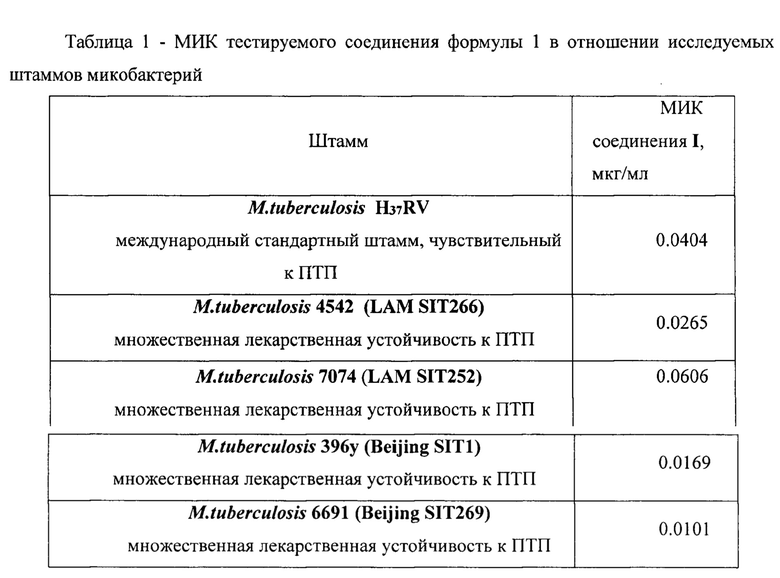
Из представленных в таблице 1 данных видно, что тестируемое соединение формулы I проявляет антимикобактериальную активность в отношении всех использованных штаммов МБТ. Наиболее выраженная минимальная ингибирующая эффективность выявлена в отношении клинических штаммов 396у и 6691 с множественной лекарственной устойчивостью генотипа Beijing.
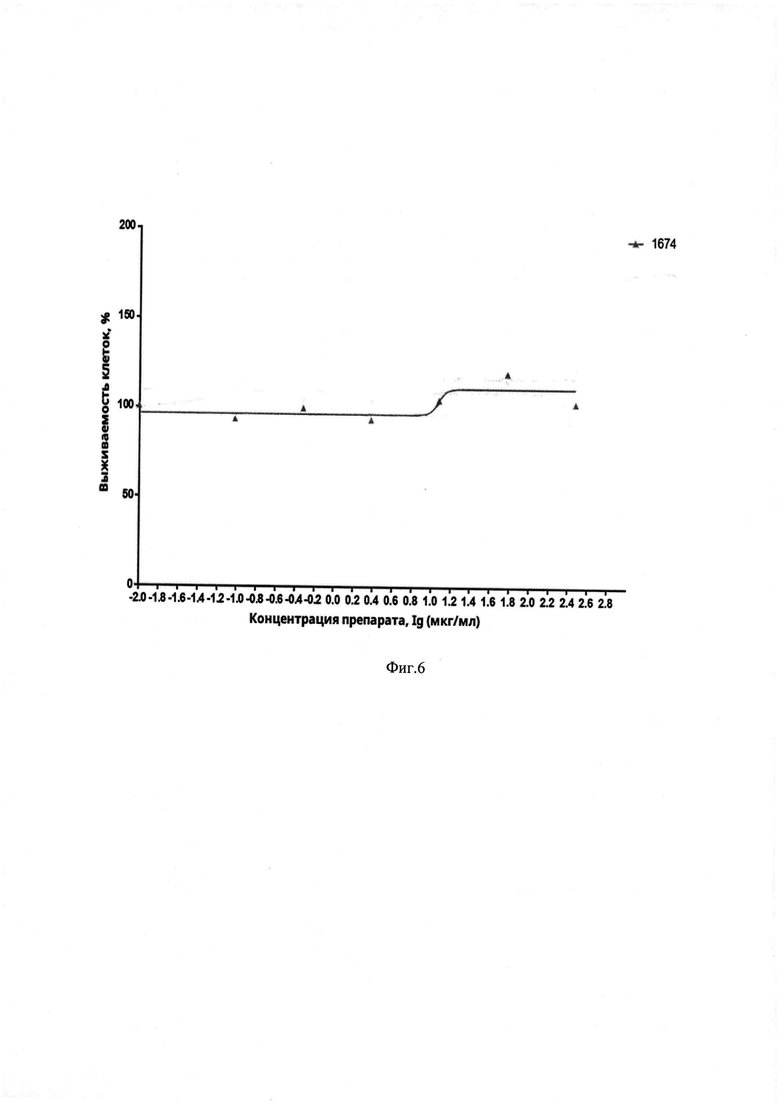
Пример 3. Исследование цитотоксичности соединения 1-[(5-нитрофуран-2-ил)карбонил]-2'-фенил-1H,7'H-спиро[азетидин-3,5'-фуро[3,4-d]пиримидина] формулы \invitro
Оценка цитотоксичности соединения формулы I проводилась на клеточной линии Vero (АТСС CCL-81) при помощи метилтетразолиевого метода (МТТ) [Mosmann Т. Rapid colorimetric assay for cellular growth and survival: application to proliferation and cytotoxicity assays // Journal of Immunological Methods. 1983. Dec 16;65(l-2):55-63.]. Использовали серию трехкратных разведений тестируемого соединения от 300 до 3,7 мкг/мл. Оптическую плотность измеряли с помощью планшетного анализатора Multiscan FC (Thermo Scientific) при длине волны 540 нм.
Процент жизнеспособных клеток в лунке вычисляли по формуле:
V=(ODd/ODc)×ODc, где V - процент жизнеспособных клеток, ODd и ODc -оптическая плотность в лунках с препаратом и в контроле клеток без препарата, соответственно. На основании полученных данных рассчитывали 50% цитотоксическую концентрацию (СС50), т.е. концентрацию соединения1, снижающую оптическую плотность в лунках вдвое по сравнению с контрольными клетками без препаратов. Расчет СС50 проводили при помощи пакета программ GraphPadPrism 6.01 с использованием расчетной опции «нелинейная регрессия, 4-параметрическое уравнение».
Согласно полученным данным, значение СС50 для тестируемого соединения I составило больше 300 мкг/мл, что свидетельствует об отсутствии цитотоксического эффект в клетках Vero (Фиг. 6).
Пример 4. Исследование острой токсичности 1-[(5-нитрофуран-2-ил)карбонил]-2'-фенил-1H,7'H-спиро[азетидин-3,5'-фуро[3,4-d]пиримидина] на мышах линии C57black/6
Исследование острой токсичности соединения выполнено на 70 мышах-самцах линии C57black/6 (6-8 недель, 22-25 г), полученных из питомника “Андреевка” - филиала ФГБУН «Научный центр биомедицинских технологий» ФМБА. Животные содержались в условиях сертифицированного вивария ФГБУ «СПбНИИФ» Минздрава России. Все животные были синхронизированы по условиям содержания и кормления. Свежеприготовленные растворы соединения формулы 1 с применением ТВИН-80 (в виде суспензии) вводили мышам однократно внутрибрюшинно в возрастающих дозах. Диапазон исследуемых доз составил 100-3000 мг/кг, интервал между дозами - 500 мг/кг, каждую дозу исследовали на 5 особях. Контрольные животные получали аналогичные объемы стерильной дистиллированной воды. Токсическое действие тестируемого соединения исследовали по параметрам общего состояния, объемам потребления корма и воды, вегетативным реакциям. Период наблюдения составил 14 дней.
Расчет ЛД50 производили по методу Першина [Методы экспериментальной медицины (Практическое руководство) / под редакцией Г.Н. Першина. - Москва: Медицина, 1971. - С. 529] по формуле:
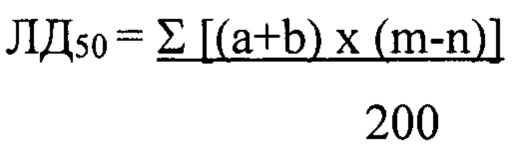
где (а+b) - сумма смежных доз; числа животных, погибших; (m-n) - разность % смертности от двух последующих доз. 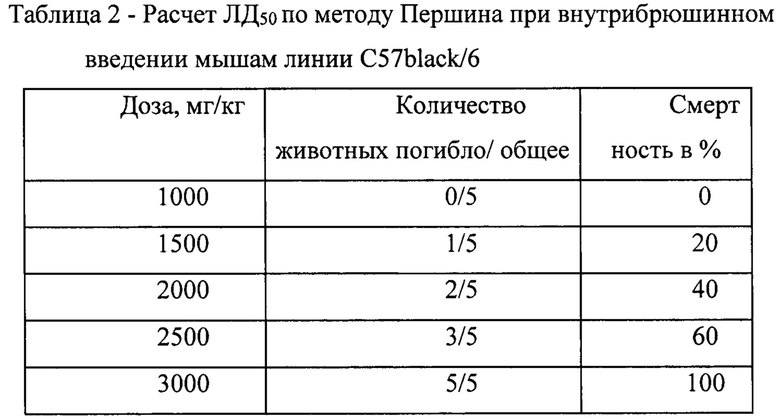
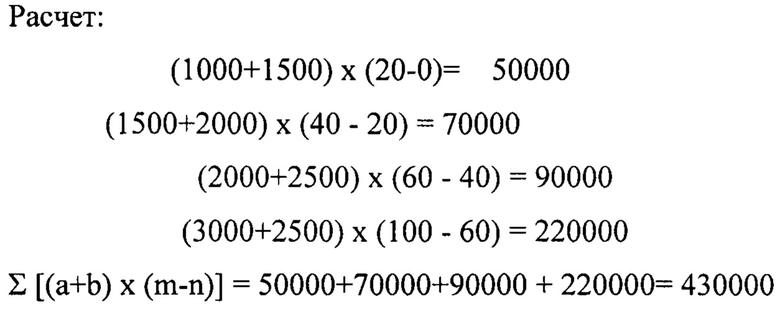
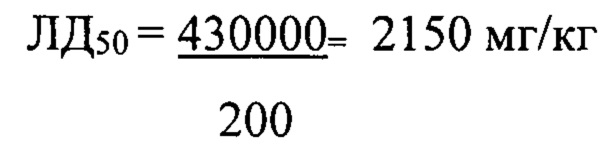
Установлено, что величина ЛД50 тестируемого соединения составила 2150 мг/кг. Гибель животных при внутрибрюшинном введении смертельных доз (более 3000 мг/кг) наблюдалась в течение 1-х - 2-х суток от момента введения исследуемого вещества. При аутопсии животных, переживших интоксикацию, не обнаружено видимых изменений внутренних органов.
Анализ изученных параметров острой токсичности, а именно: результаты токсикометрии и наблюдений за экспериментальными животными в постинтоксикационном периоде острого отравления, позволяет отнести тестируемое соединение к V классу -практически не токсично [Hodge H.et al. Clinical Toxicology of Commercial Products. Acute Poisoning.Ed. IV, Baltimor, 1975, 427p.]
Таким образом, соединение 1-[(5-нитрофуран-2-ил)карбонил]-2'-фенил-1H,7'H-спиро[азетидин-3,5'-фуро[3,4-с/]пиримидин]формулы 1 обладает выраженным ингибирующим действием in vitro в отношении чувствительного и клинических лекарственно устойчивых штаммов М. tuberculosis, в том числе с множественной лекарственной устойчивостью, не оказывает цитотоксического эффекта в клетках Vero in vitro. Величина ЛД,5о(2150 мг/кг) и хорошая переносимость при внутрибрюшинном введении мышам линии C57black/6 позволяет рассматривать тестируемое соединение в качестве перспективного для применения в медицинской практике.
| название | год | авторы | номер документа |
|---|---|---|---|
| 1-[(5-Нитрофуран-2-ил)карбонил]-2'-пропил-1H,7'H-спиро[азетидин-3,5'-фуро[3,4-d]пиримидин], обладающий противотуберкулезной активностью в отношении возбудителя туберкулеза с множественной лекарственной устойчивостью, и способ его получения | 2023 |
|
RU2824817C1 |
| 1-[(5-нитрофуран-2-ил)карбонил]-2'-циклогексил-1H,7'H-спиро[азетидин-3,5'-фуро[3,4-d]пиримидин], обладающий противотуберкулезной активностью в отношении возбудителя туберкулеза с множественной лекарственной устойчивостью, и способ его получения | 2023 |
|
RU2825647C1 |
| 8-(4-Метил-4Н-1,2,4-триазол-3-ил)-6-(метилсульфонил)-2-(5-нитро-2-фуроил)-2,6-диазаспиро[3.4]октан, обладающий противотуберкулезной активностью в отношении возбудителя туберкулеза с множественной лекарственной устойчивостью, и способ его получения | 2023 |
|
RU2825646C1 |
| 5-метил-7-(3-нитро-[1,2,4]триазол-1-ил)-[1,2,4]триазоло[1,5-а]пиримидина, обладающий противотуберкулезной активностью в отношении возбудителя с множественной лекарственной устойчивостью, и способ его получения | 2018 |
|
RU2705591C1 |
| (4-(3-гидроксифенил)пиперазин-1-ил)(5-нитрофуран-2-ил)метанон, обладающий противотуберкулезной активностью в отношении возбудителя туберкулеза с множественной лекарственной устойчивостью, и способ его получения | 2021 |
|
RU2784399C1 |
| Противотуберкулезное средство на основе 4'-гидрокси-1'-(2-гидроксифенил)-3'-ацил-спиро[бензо[b][1,4]тиазин-2,2'-пиррол]-3,5'(1'H,4H)-дионов | 2023 |
|
RU2806097C1 |
| Противотуберкулезное средство на основе производного пиридоксина | 2021 |
|
RU2772219C1 |
| ПРОТИВОТУБЕРКУЛЕЗНОЕ ЛЕКАРСТВЕННОЕ СРЕДСТВО: КОМПОЗИЦИЯ ИМИДАЗО[1,2-b]ТЕТРАЗИНА С ПИРАЗИНАМИДОМ | 2013 |
|
RU2545458C2 |
| НОВЫЙ АНТИБАКТЕРИАЛЬНЫЙ АГЕНТ 3-(КАРБОКСИМЕТИЛ)-1-(ИМИДАЗО[1,2-b][1,2,4,5]ТЕТРАЗИН-3-ИЛ)-1Н-БЕНЗО[d]ИМИДАЗОЛ-3-ИУМ ХЛОРИД, ОБЛАДАЮЩИЙ АКТИВНОСТЬЮ ОТНОСИТЕЛЬНО NEISSERIA GONORRHOEAE И MYCOBACTERIUM TUBERCULOSIS | 2023 |
|
RU2828876C1 |
| Применение 3-арил-6H-спиро[бензо[b]фуро[3',4':2,3]пирроло[1,2-d][1,4]оксазин-5,3'-индолин]-1,2,2',6-тетраонов в качестве средств, обладающих противотуберкулезной активностью | 2024 |
|
RU2831345C1 |
Изобретение относится к области органической химии и медицины, а именно к индивидуальному 1-[(5-нитрофуран-2-ил)карбонил]-2'-фенил-1/H,7'H-спиро[азетидин-3,5'-фуро[3,4-d] пиримидину] формулы 1, обладающему противотуберкулезной активностью в отношении возбудителя с множественной лекарственной устойчивостью, а также к способу его получения. Техническим результатом изобретения является получение нового соединения формулы 1, которое потенциально может быть применено в медицине в качестве лекарственного средства, разработка способа его синтеза, а также выявленная противотуберкулезная активность in vitro в отношении стандартного и клинических лекарственно устойчивых штаммов М. tuberculosis. 2 н.п. ф-лы, 6 ил., 2 табл., 4 пр.
1. 1-[(5-Нитрофуран-2-ил)карбонил]-2'-фенил-1H,7'H-спиро[азетидин-3,5'-фуро[3,4-d]пиримидин]формулы 1, обладающий противотуберкулезной активностью в отношении возбудителя туберкулеза с множественной лекарственной устойчивостью
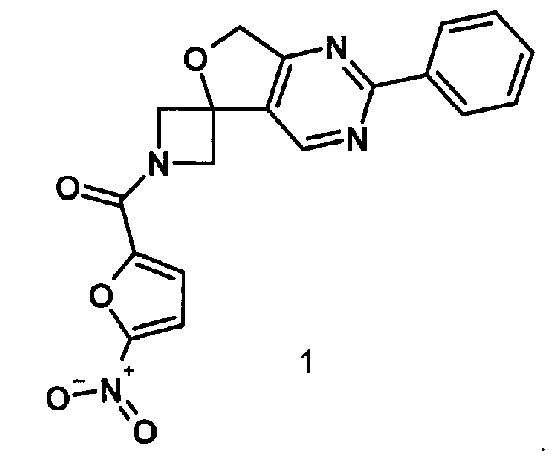
2. Способ получения соединения по п.1, заключающийся во взаимодействии в сухом диметилформамиде имидазолида 5-нитрофуран-2-карбоновой кислоты и спироциклического амина, получаемого непосредственно перед реакцией обработкой 2-трет-бутил-2'-фенил-1H,7'H-спиро[азетидин-3,5'-фуро[3,4-d]пиримидин]-1-карбоксилата раствором трифторуксусной кислоты в сухом хлористом метилене при температуре 0°С.
| ХИМОВА Е.С | |||
| и др | |||
| Станок для придания концам круглых радиаторных трубок шестигранного сечения | 1924 |
|
SU2019A1 |
| Приспособление для записи звуковых явлений на светочувствительной поверхности | 1919 |
|
SU101A1 |
| 5-Фтор-2-(4-этоксикарбонилпиперазин-1-ил)-1,3-бензотиазин-4-он, обладающий противотуберкулезной активностью | 2018 |
|
RU2663848C1 |
| 5-метил-7-(3-нитро-[1,2,4]триазол-1-ил)-[1,2,4]триазоло[1,5-а]пиримидина, обладающий противотуберкулезной активностью в отношении возбудителя с множественной лекарственной устойчивостью, и способ его получения | 2018 |
|
RU2705591C1 |
Авторы
Даты
2024-08-14—Публикация
2023-11-20—Подача