Настоящее изобретение относится к гемостатическому (кровоостанавливающему) материалу для применения в борьбе с кровотечениями.
Существует большое число ситуаций в которых живые существа, как люди, так и животные, могут получить повреждение или ранение, вызывающее кровотечение. В случае незначительных ран кровотечение может остановиться за счет имеющихся в организме природных гемостатических механизмов, которые приводят к коагуляции крови с образованием твердых сгустков, предотвращающих дальнейшее кровотечение и способствующих восстановлению поврежденных кровеносных сосудов.
Традиционно основным способом, предназначенным для остановки кровотечения из раны является приложение к ране постоянного давления. Это дает возможность факторам сворачивания крови сконцентрироваться в месте нахождения раны и сформировать застывшую кровяную массу, которая останавливает кровотечение. Однако такой способ не подходит для тяжелых ран и ран, в которых кровь выделяется из нескольких точек. Таким образом, кровотечение из раны продолжается, что является основной причиной наступления смерти.
Смерть, вызванная кровотечением, является особенно острой проблемой при боевых действиях. Как правило, раны, возникающие на поле боя, сопровождаются значительным кровотечением и многие из них приводят к смерти. Кровотечение в результате травм также является существенной причиной смертности среди гражданского населения.
Предпринимались попытки получения продуктов, облегчающих остановку кровотечения из раны. В число таких веществ входит продукт, предлагаемый к продаже под торговым наименованием Quick-clot®. Не вдаваясь в подробности, этот продукт включает несущий материал, покрытый действующим соединением, который при прикладывании к ране под давлением способен остановить кровотечение.
Более конкретно, продукт Quick-clot® включает цеолит, который поглощает воду из крови, вытекающей из раны, в результате чего присутствующие в крови факторы тромбообразования концентрируются, кровь коагулирует быстрее, и цеолит вместе со свернувшейся кровью образуют сгусток, останавливающий кровотечение.
Хотя описанная композиция проявляет эффективность, ее применение связано с определенными проблемами, поскольку для подавления кровотечения необходимо постоянное давление. В директиве, приведенной в Tactical Combat Casualty Care (Руководство по тактическому уходу за раненными в бою) (TCCC) в 2009 году, указано, что при использовании кровоостанавливающего бандажа, а именно Combat Gauze®, должна применяться минимум трехминутная компрессия.
Таким образом, цель настоящего изобретения заключается в разработке гемостатического материала, который проявляет эффективность в борьбе с кровотечением из раны, является легким и безопасным в применении и требует уменьшенного времени компрессии.
Согласно первому аспекту настоящего изобретения, разработан гемостатический материал, включающий гемостатический агент и биоадгезивный агент.
Под «гемостатическим агентом» подразумевается вещество, которое способствует гемостазу (остановке кровотечения). Этот гемостатический агент, при приведении в контакт с кровью, может вызывать образование сгустка или тромба, который останавливает или уменьшает кровотечение.
Целевым участком организма для применения гемостатического материала по настоящему изобретению может являться любой участок в или на теле живого существа. Упомянутое живое существо может являться человеком или животным кроме человека. Указанный целевой участок организма может представлять собой рану или отверстие в теле, возникшее в результате медицинской процедуры, например, при операции. Далее по тексту целевой участок организма только для удобства и с иллюстративными целями именуется «раной».
Преимуществом гемостатического материала по настоящему изобретению является то, что его может применять человек, обладающий лишь базовыми медицинскими навыками. Это применение заключается просто в наложении материала на целевой участок организма с последующим приложением давления.
Кроме того, гемостатический материал по настоящему изобретению прост в обработке и применении. Как правило, перед применением его хранят в сухом виде.
Продукты, в которых используются преимущества биологических процессов, имеют склонность к зависимости от температуры. Пациенты, страдающие потерей крови, часто имеют повышенную температуру вследствие физических усилий на поле боя или пониженную температуру в результате воздействия холода. Имеющиеся в настоящее время продукты менее эффективны при подобных экстремальных температурах. Преимущество материала по настоящему изобретению заключается в том, что на него практически не влияют изменения температуры и, следовательно, он действует одинаково хорошо при температурах, как выше, так и ниже нормальной температуры тела. Под «нормальной температурой тела» подразумевается температура около 37°C.
Гемостатический материал по настоящему изобретению способен эффективно бороться с кровотечением при уменьшении периода компрессии по сравнению с указанным в директиве TCCC, который составляет как минимум три минуты при применении гемостатического бандажа. Это дает благоприятный эффект более быстрой стабилизации состояния субъекта перед перемещением в район оказания медицинской помощи.
Гемостатический агент может представлять собой любой материал с гемостатическими свойствами. Примеры гемостатических агентов включают окисленную регенерированную целлюлозу, каолин, желатин, ионы кальция, цеолит, коллаген или хитозан. Предпочтительно, гемостатический агент представляет собой соль хитозана. Хитозан представляет собой вещество, получаемое из твердых отходов переработки моллюсков, и его можно выделить из грибковых культур. Хитозан представляет собой нерастворимое в воде катионное полимерное вещество. Поэтому для применения в настоящем изобретении хитозан прежде всего превращают в водорастворимую соль. Соль хитозана растворяется в крови с образованием геля, который останавливает кровотечение.
Соли хитозана прекрасно подходят для применения в настоящем изобретении, поскольку хитозан легко расщепляется в организме. Хитозан превращается в глюкозамин под действием фермента лизоцима и, вследствие этого, выводится из организма естественным путем. Нет необходимости предпринимать какие-либо усилия для удаления хитозана из организма.
Кроме того, соли хитозана демонстрируют умеренные антибактериальные свойства, вследствие чего их применение уменьшает опасность инфекции.
Примеры солей хитозана, которые подходят для применения в настоящем изобретении, включают, не ограничиваясь этим, любую из следующих солей, индивидуально, либо в комбинации: ацетат, лактат, сукцинат, малат, сульфат или акрилат. Как правило, они имеют форму порошка.
Хорошие результаты были получены при применении сукцината хитозана в качестве соли хитозана.
Соль хитозана получают взаимодействием хитозана с подходящей кислотой. Следует понять, что эта кислота может являться неорганической или органической кислотой, образующей соль хитозана, которая является растворимой в условиях, характерных для организма человека или животного, в частности, растворима в крови. Подходящие кислоты может определить специалист в данной области техники. Например, фосфат хитозана в указанных условиях является нерастворимым, и поэтому фосфорная кислота не подходит для применения в настоящем изобретении.
Содержание гемостатического агента может составлять как минимум 20 масс.% от массы гемостатического материала по настоящему изобретению, или, чаще, не менее примерно 80% от массы. Обычно содержание гемостатического агента составляет 20-99% от массы гемостатического материала, предпочтительно 45-95% от массы гемостатического материала.
Гемостатический агент, как правило, является гранулированным, но может включать короткие волокна, губчатые вещества, волокнистые вещества, пленки, порошки, жидкости, гели или жидкие покрытия. Короткие волокна могут иметь длину не более примерно 7,5 мм, чаще не более чем примерно 5 мм.
Значение pH гемостатического агента как правило находится в пределах от примерно 3,5 до примерно 8,0. Значение pH в существенной степени зависит от конкретного применяемого гемостатического агента, поскольку все они имеют разные значения pH.
Под «биоадгезивным агентом» подразумевается природное или синтетическое биосовместимое вещество, которое связывается с биологическим субстратом. Биологический субстрат может представлять собой, например, мокрую ткань вокруг раны. Фактически биоадгезивный агент может способствовать адгезии между двумя материалами, один из которых имеет биологическую природу, с тем чтобы удерживать эти материалы в соприкосновении друг с другом в течение продолжительного периода времени. Как правило, биоадгезивный агент демонстрирует низкую адгезию к сухим поверхностям, например, перчаткам или неповрежденной коже, и высокую адгезию к мокрым/влажным поверхностям, например, ранам или внутренним органам. Вследствие этого, гемостатический материал по настоящему изобретению, включающий биоадгезивный агент и гемостатический агент, должен предпочтительно демонстрировать низкую адгезию к сухим поверхностям и высокую адгезию к мокрым/влажным поверхностям. Предпочтительно, гемостатический материал не обладает адгезией к сухим поверхностям. Это свойство биоадгезивного агента обеспечивает благоприятные свойства гемостатического материала, который одновременно прост в обращении и эффективно препятствует кровотечению при уменьшенном периоде компрессии по сравнению с указанным в директиве TCCC, который составляет минимум три минуты.
Биоадгезивный агент предпочтительно должен быть совместимым с гемостатическим агентом и не препятствовать эффективному действию гемостатического материала. Биоадгезивный агент, как правило, представляет собой твердое, сухое вещество.
Под «низкой адгезией» подразумевается адгезия к поверхности с силой отлипания, равной 0,05 н на 25 мм материала (т.е. 0,05 н/25 мм) или менее. Отсутствие адгезии определяется эффективным результатом измерения 0,0 н/25 мм.
Под «высокой адгезией» подразумевается адгезия к поверхности с силой отлипания 0,25 н/25 мм или более. Предпочтительно, адгезия к мокрой/влажной поверхности характеризуется силой отлипания 0,7 н/25 мм или выше и, более предпочтительно, 1,0 н/25 мм или выше. Адгезия к мокрой/влажной поверхности, как правило, характеризуется силой отлипания в диапазоне 0,6-2,0 н/25 мм.
Таким образом, биоадгезивный агент может способствовать адгезии гемостатического агента к мокрой ткани вокруг раны. Благоприятным образом, это позволяет уменьшить время компрессии, необходимое для сворачивания крови, без выдавливания гемостатического агента из раны под действием кровяного давления.
Содержание биоадгезивного агента может составлять до 90 масс.% от массы гемостатического материала. Предпочтительно, содержание биоадгезивного агента может составлять до 20 масс.% от массы гемостатического материала, более предпочтительно, от 2 до 20 масс.% от массы гемостатического материала, еще более предпочтительно от 5 до 10 масс.% от массы гемостатического материала и, наиболее предпочтительно, от 7 до 8 масс.% от массы гемостатического материала. В этих предпочтительных диапазонах биоадгезивный агент оптимизирован для адгезии к мокрой или влажной ткани и не вызывает нежелательных эффектов, например, повторного открытия раны при удалении.
Биоадгезивный агент должен представлять собой вещество, которое развивает высокую адгезию при нанесении на мокрые/влажные субстраты. Биоадгезивный агент может быть выбран из любого из следующих веществ, индивидуально или в комбинации: карбомеров, поливинилового спирта (PVA), поливинилпирролидона (PVP), 2-акриламидо-2-метилпропансульфоновой кислоты или полимера акриловой кислоты высокой молекулярной массы, сшитого дивинилгликолем, или солей полиакриловой кислоты, сшитых дивинилгликолем. Предпочтительно, биоадгезивный агент включает сшитые полимеры акриловой кислоты высокой молекулярной массы. Под «высокой молекулярной массой» подразумевается молекулярная масса не менее 50000 г/моль. Предпочтительно, молекулярная масса составляет не менее 60000 г/моль и более предпочтительно от 100 000 до 300000 г/моль. В этих вариантах осуществления, биоадгезивный агент может представлять собой гомополимер, включающий полимер акриловой кислоты, сшитый аллил сахарозой или аллил пентаэритритом; сополимер, включающий полимер акриловой кислоты и C10-C30 алкилакрилата, сшитый аллил пентаэритритом; карбомерный гомополимер или сополимер, включающий блок-сополимер полиэтиленгликоля и эфира жирной кислоты с длинной цепью; или их смеси.
Например, биоадгезивный агент может быть выбран из любого из следующих продуктов, индивидуально или в комбинации: Carbopol® NF934, NF974, NF971 и NF980.
Биоадгезивный агент придает композиции по настоящему изобретению отличные клейкие свойства во влажном состоянии. Под «клейкими свойствами во влажном состоянии» подразумевается адгезия к мокрой или влажной ткани. Эти свойства позволяют биоадгезивному агенту обеспечивать адгезию между гемостатическим агентом и мокрой тканью вокруг раны.
В некоторых вариантах осуществления, гемостатический агент и биоадгезивный агент, как правило, присутствуют в соотношении не менее 3:1. Обычно гемостатический агент и биоадгезивный агент присутствуют в соотношении не менее 4:1 и более предпочтительно в соотношении не менее 9:1.
Гемостатический материал по настоящему изобретению должен включать достаточное количество биоадгезивного агента, чтобы эффективно препятствовать кровотечению при уменьшенном периоде компрессии по сравнению с указанным в директиве TCCC, который составляет минимум три минуты. Однако в некоторых вариантах осуществления, высокое содержание биоадгезивного материала может не приводить к улучшению характеристик. Поэтому лучше всего осуществлять реализацию настоящего изобретения, используя указанные в тексте заявки диапазоны содержания биоадгезивного материала.
Гемостатический материал по настоящему изобретению может включать анионный биоадгезивный агент в комбинации с катионным гемостатическим агентом. В таких вариантах осуществления, как минимум часть анионного биоадгезивного агента может взаимодействовать с катионным гемостатическим агентом. Взаимодействие между биоадгезивным агентом и гемостатическим агентом может происходить в различной степени. Например, весь анионный биоадгезивный агент может не вступить в реакцию с катионным гемостатическим агентом, в результате чего полученный гемостатический материал включает смесь не вступившего в реакцию гемостатического агента, не вступившего в реакцию биоадгезивного агента и/или продукта реакции биоадгезивного агента с гемостатическим агентом, или же все количество анионного биоадгезивного агента может вступить в реакцию с катионным гемостатическим агентом.
Гемостатический агент может дополнительно включать инертный материал. Под «инертным» подразумевается материал, который не имеет гемостатических свойств или имеет слабые гемостатические свойства, и имеет слабую адгезию к влажным/мокрым поверхностям.
Примеры инертных материалов включают, не ограничиваясь этим, не гемостатическую целлюлозу, негемостатический песок, негемостатическую глину, негемостатический альгинат, микрокристаллическую целлюлозу, гуаровую камедь, ксантановую камедь, негемостатический хитозан, негемостатический хитин, декстран, сахарозу, лактозу, пектин, карбоксиметилцеллюлозу, гидроэтилцеллюлозу, измельченную кукурузную муку, полиакриловую кислоту, сульфат бария, крахмал или комбинации двух или нескольких указанных продуктов. Как правило, применяют один или несколько инертных материалов, выбранных из негемостатического хитозана, негемостатического хитина и карбоксиметилцеллюлозы.
Этот инертный материал можно добавлять к гемостатическому агенту в количестве до примерно 95% по массе от общей массы композиции, как правило, до примерно 80% по массе и, чаще, до примерно 50% по массе. Инертный материал, как правило, смешивают с гемостатическим агентом, но его можно диспергировать в растворе гемостатического агента и затем высушить.
Инертный материал обычно является гранулированным, но он может иметь форму порошка, пены, волокон или пленок.
Гемостатический агент может дополнительно включать ПАВ, подходящее для медицинского применения. Под «ПАВ, подходящим для медицинского применения» подразумевается любое ПАВ, которое фармацевтически приемлемо для контакта с тканями организма или введения в организм человека или животного, и не вызывает каких-либо значимых вредных воздействий на организм человека или животного. Примеры ПАВ, подходящих для применения в настоящем изобретении включают любые из следующих веществ, индивидуально, либо в комбинации: блок-сополимеры на основе этиленоксида или пропиленоксида (например, BASF Pluronics®), глицерин, полиэтиленгликоль, пропиленгликоль, жирные кислоты, такие как лауриновая кислота, олеиновая кислота, другие жирные кислоты и соли жирных кислот, ПАВ и эмульгаторы на основе силикона. Как правило, подходящие для медицинского применения ПАВ включают лауриновую кислоту и олеиновую кислоту.
Подходящие для медицинского применения ПАВ обычно могут входить в состав гемостатического агента в количестве от примерно 0,001 до примерно 10 масс.% от массы последнего.
Более предпочтительно, подходящее для медицинского применения ПАВ входит в состав в количестве от примерно 0,5 до примерно 1 масс.% от массы гемостатического агента. Предпочтительно, присутствие ПАВ приводит к получению отличной смачивающей способности. Путь, которым происходит смачивание гемостатическим агентом, важен для его эффективности. Т.е. если гемостатический агент способен поглощать кровь слишком быстро и просто смешиваться с ней без существенного гелеобразования, не формируется гелевый сгусток, который способен остановить кровотечение. С другой стороны, если гемостатический агент поглощает кровь слишком медленно, в гель превращается лишь незначительное количество гемостатического агента, как правило, первые несколько миллиметров толщины слоя гемостатического агента, ближайших к ране. В этом случае образовавшийся гелевый сгусток будет недостаточно плотным для остановки кровотечения на период времени, достаточный для перемещения пациента в медицинский центр. Как правило, подобный гелевый сгусток подвергается разрушению при перемещении пациента, что приводит к повторному кровотечению.
Было обнаружено, что при добавлении к гемостатическому агенту определенного количества инертного материала и/или определенного количества подходящего для медицинского применения ПАВ, т.е. при разбавлении гемостатического агента, эффективность последнего на практике дополнительно повышается. Комбинация инертного материала и подходящего для медицинского применения ПАВ является особенно предпочтительной, поскольку присутствие инертного материала дополнительно усиливает свойства ПАВ и наоборот.
Размер частиц гемостатического агента может влиять на эффективность гемостатического материала по настоящему изобретению. Размер частиц определяют размером сита, через которое проходят или которым задерживаются эти частицы.
Например, если гемостатический агент имеет форму частиц или гранул, средний размер его частиц может быть равен или превышать примерно 200 меш, чтобы они не проходили через сито 200 меш. Как правило, средний размер частиц может превышать примерно 100 меш, еще чаще превышать примерно 50 меш, и нежелательно, чтобы частицы или гранулы могли проходить через сито 40 меш.
Более предпочтительно, размер частиц инертного материала должен быть практически эквивалентен размеру частиц гемостатического агента. Под термином «практически эквивалентен» подразумевается, что относительный размер частиц не отличается более, чем примерно на 25%, чаще не более, чем на 10%. Оптимальный размер частиц достигается измельчением гемостатического агента и сортировкой частиц с помощью любых подходящих средств, например, путем просеивания. Такие способы получения частиц необходимого размера хорошо известны специалистам в данной области и не будут описываться более подробно.
Гемостатический материал по настоящему изобретению можно доставлять к ране в любой конкретной форме, как, например, в форме сухого порошка, раствора, пены или геля.
Гемостатический материал можно наносить на несущий материал для наложения на участок, где находится рана. Этот несущий материал может включать вискозный нетканый материал или, в качестве альтернативы, он может включать тонкий гибкий субстрат, тканую марлю, пленку, пену или листовой гель. Этот материал может подвергаться или не подвергаться разрушению в условиях, которые существуют в области раны, или в организме человека или животного. В одном из вариантов осуществления несущий материал может обладать способностью безопасно разрушаться в организме, с тем, чтобы весь объем гемостатического материала мог оставаться на месте после хирургического применения или лечения. Примеры безопасных и способных к разрушению материалов включают, не ограничиваясь этим, окисленную целлюлозу, желатин, декстран, коллаген, поликаприлактон, полимолочную кислоту, сополимер полилактид-гликолид, полигликолид, хитин и т.д.
Гемостатический агент можно наносить на несущий материал целым рядом способов. Эти способы включают связывание гемостатического агента с несущим материалом с помощью клейкого состава; нанесение раствора, содержащего гемостатический агент, на несущий материал, покрытие несущего материала и высушивание раствора; или связывание гемостатического агента путем нагревания. Гемостатический агент можно также включить в несущий материал при производстве самого несущего материала.
Гемостатический материал по настоящему изобретению может принимать любую подходящую форму и иметь самый разный размер, форму и толщину, необходимую для обработки раны, например, представлять собой квадрат, прямоугольник, круг или эллипс. Например, материал может быть практически плоским, с небольшой высотой по отношению к длине/ширине. Может применяться материал, имеющий любую правильную или неправильную форму. Материал может поставляться в виде больших листов, которые можно резать на куски необходимого размера.
Если в материале по настоящему изобретению в качестве гемостатического агента применяется соль хитозана, действующее начало получают путем приготовления смеси хитозана в виде частиц, гранул, порошка, хлопьев или коротких волокон с подходящей кислотой в растворителе, который не растворяет хитозан (как правило, смеси 80:20 этанол:вода). Растворитель выпаривают получая практически чистое действующее вещество. Затем действующее вещество можно смешать с желаемым инертным материалом или ПАВ, подходящим для медицинского применения, с получением гемостатического агента.
Гемостатический материал по настоящему изобретению можно получать в стерильной или нестерильной форме. Если материал получают в стерильной форме, стерилизацию можно проводить с применением любого из известных стандартных способов, например, облучения гамма лучами, воздействия электронных пучков, температурной обработки, стерилизации с помощью оксида этилена (EtO) и т.д. Материал в нестерильной форме может быть получен в комбинации с одним или несколькими консервантами или антимикробными агентами, например, серебром и его солями.
Согласно второму аспекту настоящего изобретения, разработан способ гемостаза (остановки кровотечения), где указанный способ включает стадии нанесения гемостатического материала, описанного в тексте настоящей заявки, на целевой участок организма; и приложения давления к гемостатическому материалу.
Согласно третьему аспекту настоящего изобретения, разработан гемостатический материал, описанный в тексте заявки, для применения при остановке кровотечения из целевого участка организма.
Давление может прилагаться к целевому участку в течение как минимум одной минуты. В некоторых вариантах осуществления давление может прилагаться к участку вокруг раны в течение как минимум двух минут. Преимущество настоящего изобретения заключается в относительно непродолжительном времени, которое требуется крови, вытекающей из раны, для образования достаточного сгустка. Так, поскольку сгусток достаточного размера формируется в течение трех минут, давление к целевому участку для получения желаемого эффекта может прилагаться в течение более короткого времени. В некоторых вариантах осуществления для достижения желаемого эффекта давление к участку вокруг раны может прилагаться в течение двух минут и, предпочтительно, в течение менее чем одной минуты.
Согласно четвертому аспекту настоящего изобретения, разработан несущий материал, включающий гемостатический материал, описанный в настоящей заявке, который нанесен на несущий материал.
Этот несущий материал может включать любую из разновидностей несущих материалов, описанных выше по тексту заявки. Предпочтительно, несущий материал включает марлю из вискозы.
Согласно пятому аспекту настоящего изобретения, разработан способ производства гемостатического материала, где указанный способ включает стадию смешивания гемостатического агента с биоадгезивным агентом.
Предпочтительно, способ изготовления гемостатического материала включает стадии (1) введения заранее определенного количества гемостатического агента и, необязательно, инертного материала в сосуд для смешивания; (2) введения заранее определенного количества биоадгезивного агента в сосуд для смешивания, содержащий гемостатический агент и, необязательно, инертный материал; и (3) смешивания гемостатического агента и биоадгезивного агента.
Гемостатический агент может быть диспергирован в растворе с инертным материалом и биоадгезивным агентом и перемешан. Затем этот раствор можно упарить.
Далее по тексту настоящее изобретение будет описано более подробно с привлечением следующих не ограничивающих примеров, в которых приводятся ссылки на сопроводительный иллюстративный материал, где:
Фиг.1 представляет собой график, на котором отображена зависимость силы отлипания, необходимой для отделения гемостатического материала от раны, от времени для композиций по настоящему изобретению и известных материалов.
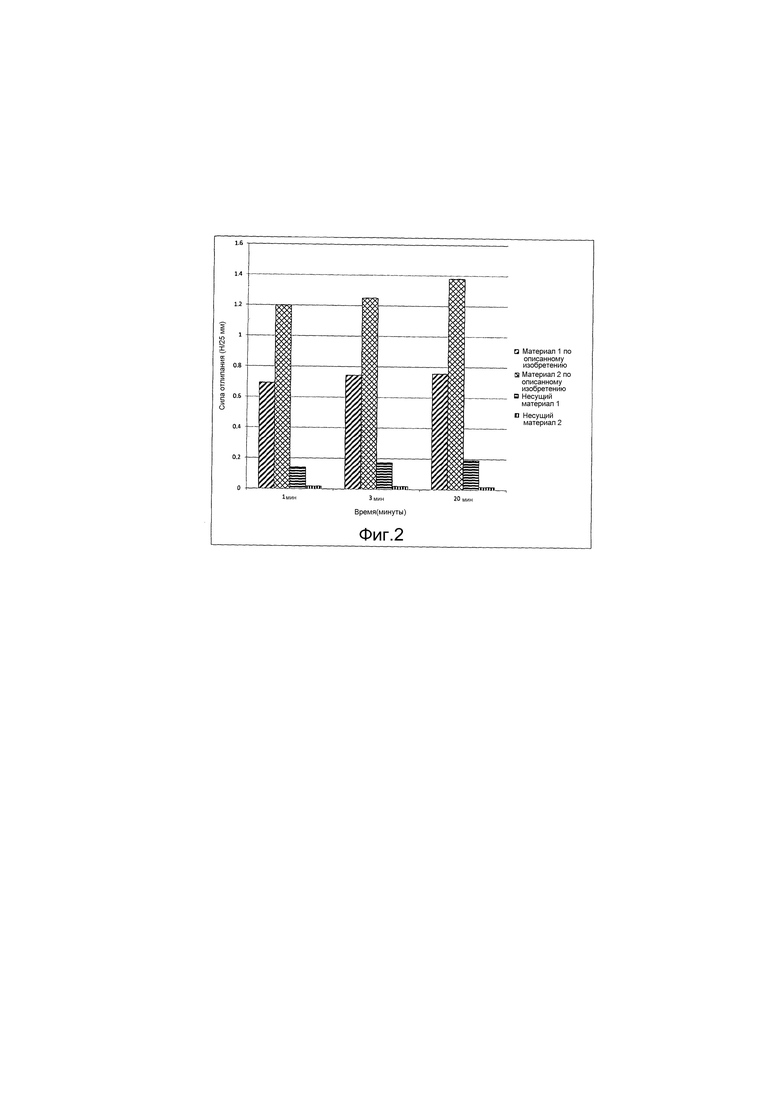
Фиг.2 представляет собой график, на котором отображена зависимость силы отлипания, необходимой для отделения гемостатического материала от раны, от времени для композиций по настоящему изобретению и сравнительных примеров.
Пример 1:
5 масс.% биоадгезивного агента (сшитого полимера акриловой кислоты высокой молекулярной массы (Carbopol® NF934)) перемешивали со смесью лактат хитозана/не гемостатический хитозан. Полученную смесь в две стадии наносили на марлю из вискозы, получая массу покрытия 40 г/кв.м. Описанный способ позволял получить гемостатический материал, именуемый в тексте заявки, как «материал по описанному изобретению».
Пример 2:
10 масс.% биоадгезивного агента (сшитого полимера акриловой кислоты высокой молекулярной массы (Carbopol® NF934)) перемешивали со смесью лактат хитозана/не гемостатический хитозан. Полученную смесь в две стадии наносили на марлю из вискозы, получая массу покрытия 40 г/кв.м.
Эффективность гемостатических материалов примеров 1 и 2 оценивали in vivo и in vitro по описанным ниже методикам.
In vitro
Для определения способности гемостатического материала прилипать к мокрой ткани использовали in vitro модель адгезии. Эта модель включала использование нижней поверхности свиной грудинки. До проведения теста свиную грудинку хранили на холоде (3°C) в течение 24 часов, для гарантии того, что вся влага останется в грудинке. Нарезали мясо грудинки полосками шириной 25 мм. Тестируемые образцы наносили на эти полоски и сверху ставили груз массой 5 кг. Адгезию к мокрой поверхности свиной грудинки измеряли через 1 мин, 3 мин и 20 мин с использованием тензиометра.
Результаты измерений, приведенные на Фиг.1, показывают, что гемостатический материал по настоящему изобретению демонстрировал значительно более высокую адгезию по сравнению с известными материалами. Протестированные средства обработки ран включали Hemcon Chitogauze®, марлю Celox® gauze и Quickclot® Combat Gauze®.
Для сравнительного анализа усиления действия гемостатического материала по настоящему изобретению по сравнению с гемостатическим агентом при его индивидуальном применении, были предприняты дополнительные исследования, в которых использовали окисленную регенерированную целлюлозу с или без сшитых полимеров акриловой кислоты высокой молекулярной массы и марли, пропитанной каолином с или без сшитых полимеров акриловой кислоты высокой молекулярной массы.
Окисленная регенерированная целлюлоза, включающая 5 масс.% сшитого полимера акриловой кислоты высокой молекулярной массы (Carbopol® NF980), показана на чертежах, как «Материал по описанному изобретению 1». Марля, пропитанная каолином, включающим 20 масс.% сшитого полимера акриловой кислоты высокой молекулярной массы (Carbopol® NF980), показана на чертежах, как «Материал по описанному изобретению 2». Носитель 1 и носитель 2 включают окисленную регенерированную целлюлозу и марлю, пропитанную каолином, соответственно. Результаты показаны на Фиг.2. Как можно видеть из чертежа, гемостатические материалы по настоящему изобретению обладают значительно более высокой адгезией к ткани по сравнению с окисленной регенерированной целлюлозой и марлей, пропитанной каолином.
In vivo
Для подтверждения того, что мокрая адгезия составов по настоящему изобретению обеспечивает реальные преимущества с точки зрения времени компрессии и получения доказательства эффективности 1-минутной компрессии, композиции примеров 1 и 2 тестировали на свиной модели, используя модель 6 мм надреза бедренной артерии. 6-мм надрез бедренной артерии свиньи осуществляли хирургическим путем. Кровотечению из артерии давали осуществиться в течение 45 секунд, после чего на место кровотечения наносили гемостатический материал и прилагали давление в течение 1 минуты. После этого периода компрессии оценивали кровотечение из раны. Если кровотечение возобновлялось, гемостатический материал удаляли и на место кровотечения повторно накладывали новый образец, после чего опять прилагали давление в течение одной минуты. После этого любое повторение кровотечения классифицировали как неудачный результат эксперимента.
Полученные результаты показали, что в 94% случаев в описанном протоколе модели надреза бедренной артерии достигалась остановка кровотечения.
Адгезия
Проводили дополнительное тестирование для определения адгезии гемостатического материала по настоящему изобретению к поверхности сухой ткани, по сравнению с описанными выше тестами по определению адгезии к поверхности мокрой ткани. Гемостатический материал по описываемому изобретению, гемостатический материал 1 по описываемому изобретению и гемостатический материал 2 по описываемому изобретению тестировали в сравнении с материалами известного уровня техники, в т.ч. Hemcon Chitogauze®, Celox® gauze, Quickclot Combat Gauze® и окисленной регенерированной целлюлозой. Силу отлипания для каждого материала определяли на сухой и мокрой ткани через промежутки времени, составлявшие 1, 3 и 20 минут. Результаты показаны ниже в таблице 1.
Как можно видеть из таблицы 1, гемостатические материалы по настоящему изобретению не продемонстрировали адгезии к сухим тканям и продемонстрировали высокую адгезию к мокрым тканям на каждом из трех временных интервалов. Результаты показали более высокую мокрую адгезию гемостатических материалов по настоящему изобретению по сравнению с материалами известного уровня техники.
Следует безусловно понимать, что не предполагается ограничение настоящего изобретения приведенными выше примерами, которые описаны только в качестве примеров.
| название | год | авторы | номер документа |
|---|---|---|---|
| ГЕМОСТАТИЧЕСКИЙ МАТЕРИАЛ | 2019 |
|
RU2830588C2 |
| Гемостатический материал, гемостатическое средство и перевязочный материал на его основе | 2016 |
|
RU2635465C1 |
| Местное гемостатическое средство | 2023 |
|
RU2807892C1 |
| Гемостатическое средство | 2023 |
|
RU2826361C1 |
| Суперабсорбирующая полимерная гидрогелевая ксерогелевая губка, способ ее получения и применение | 2017 |
|
RU2759898C2 |
| МАТЕРИАЛЫ, ОБЛАДАЮЩИЕ АДГЕЗИЕЙ К ТКАНЯМ | 2005 |
|
RU2396985C2 |
| Композиция для временной остановки кровотечений | 2023 |
|
RU2819603C1 |
| ГЕМОСТАТИЧЕСКОЕ СРЕДСТВО НА ОСНОВЕ ХИТОЗАНОВОГО АЭРОГЕЛЯ | 2020 |
|
RU2743425C1 |
| ГЕМОСТАТИЧЕСКИЙ ПОРОШОК | 2020 |
|
RU2820476C2 |
| ГЕМОСТАТИЧЕСКАЯ ГУБКА | 2011 |
|
RU2562569C2 |

Изобретение относится к гемостатическому кровоостанавливающему материалу для применения в борьбе с кровотечениями. Гемостатический материал содержит гемостатический агент в форме гранул, коротких волокон, губчатых веществ, или волокнистых веществ, где гемостатический агент выбран из списка, состоящего из желатина, цеолита, коллагена, хитозана и соли хитозана, и биоадгезивный агент, где биодгезивный агент выбран из группы, состоящей из карбомеров, полимера акриловой кислоты, имеющего молекулярную массу не менее 50000 г/моль, сшитого дивинилгликолем, или солей полиакриловой кислоты, сшитых дивинилгликолем, или их комбинаций, и где содержание биоадгезивного агента составляет от 2 до 20 масс.% от массы гемостатического материала. Также изобретение относится к способу изготовления гемостатического материала и к применению гемостатического материала при ослаблении или остановке кровотечения из целевого участка организма. Технический результат изобретения заключается в разработке гемостатического материала, который проявляет эффективность в борьбе с кровотечением из раны, является легким и безопасным в применении и требует уменьшенного времени компрессии, с возможностью связываться с влажной или мокрой поверхностью с адгезией, превышающей целевое значение адгезии 0,02 Н/см. 3 н. и 32 з. п. ф-лы, 2 ил., 1 табл., 3 пр.
1. Гемостатический материал, включающий гемостатический агент в форме гранул, коротких волокон, губчатых веществ, или волокнистых веществ, где гемостатический агент выбран из списка, состоящего из желатина, цеолита, коллагена, хитозана и соли хитозана, и биоадгезивный агент, где биодгезивный агент выбран из группы, состоящей из карбомеров, полимера акриловой кислоты, имеющего молекулярную массу не менее 50000 г/моль, сшитого дивинилгликолем, или солей полиакриловой кислоты, сшитых дивинилгликолем, или их комбинаций, и где содержание биоадгезивного агента составляет от 2 до 20 масс.% от массы гемостатического материала.
2. Гемостатический материал по п.1, где гемостатический агент представляет собой соль хитозана.
3. Гемостатический материал по п.2, где соль хитозана включает одну или несколько солей хитозана, выбранных из: ацетата хитозана, лактата хитозана, сукцината хитозана, малата хитозана, сульфата хитозана и акрилата хитозана.
4. Гемостатический материал по п.3, где соль хитозана представляет собой сукцинат хитозана.
5. Гемостатический материал по п.1, где содержание гемостатического агента составляет не менее 20 масс.% от массы гемостатического материала.
6. Гемостатический материал по п.5, где содержание гемостатического агента составляет не менее 80 масс.% от массы гемостатического материала.
7. Гемостатический материал по п.5, где содержание гемостатического агента составляет от 45 до 95 масс.% от массы гемостатического материала.
8. Гемостатический материал по п.1, где короткие волокна имеют длину не более 7,5 мм.
9. Гемостатический материал по п.8, где короткие волокна имеют длину не более 5 мм.
10. Гемостатический материал по п.1, где гемостатический агент имеет значение pH от 3,5 до 8,0.
11. Гемостатический материал по п.1, где адгезия материала к сухим поверхностям характеризуется силой отлипания 0,05 Н на 25 мм или менее, и адгезия к влажным/мокрым поверхностям характеризуется силой отлипания 0,25 Н на 25 мм или выше.
12. Гемостатический материал по п.11, где адгезия к влажной/мокрой поверхности характеризуется силой отлипания 0,7 Н на 25 мм или выше.
13. Гемостатический материал по п.12, где адгезия к влажной/мокрой поверхности характеризуется силой отлипания 1,0 Н на 25 мм или выше.
14. Гемостатический материал по п.1, где адгезия этого материала к влажным/мокрым поверхностям характеризуется силой отлипания в диапазоне 0,6-2,0 Н на 25 мм.
15. Гемостатический материал по п.1, где содержание биоадгезивного агента составляет от 2 до 10 масс.% от массы гемостатического материала.
16. Гемостатический материал по п.15, где содержание биоадгезивного агента составляет от 7 до 8 масс.% от массы гемостатического материала.
17. Гемостатический материал по п.1, где биоадгезивный агент содержит гомополимер, включающий полимер акриловой кислоты, сшитый аллил сахарозой или аллил пентаэритритом; сополимер, включающий полимер акриловой кислоты и C10-C30 алкилакрилат, сшитый аллил пентаэритритом; карбомерный гомополимер или сополимер, включающий блок-сополимер полиэтиленгликоля и эфира жирной кислоты с длинной алкильной цепью, или их смеси.
18. Гемостатический материал по п.1, где биоадгезивный агент имеет анионный характер и гемостатический агент имеет катионный характер.
19. Гемостатический материал по п.1, дополнительно включающий инертный материал.
20. Гемостатический материал по п.19, где инертный материал включает один или несколько компонентов, выбранных из: негемостатической целлюлозы, негемостатического песка, негемостатической глины, негемостатического альгината, микрокристаллической целлюлозы, гуаровой камеди, ксантановой камеди, негемостатического хитозана, негемостатического хитина, декстрана, сахарозы, лактозы, пектина, карбоксиметилцеллюлозы, гидроэтилцеллюлозы, измельченной кукурузной муки, полиакриловой кислоты, сульфата бария, крахмала или комбинаций двух или нескольких из перечисленных компонентов.
21. Гемостатический материал по п.19 или 20, где содержание инертного материала составляет до 95 масс.% от массы гемостатического материала.
22. Гемостатический материал по п.19 или 20, где инертный материал находится в форме гранул, порошка, пены, волокон или пленки.
23. Гемостатический материал по п.1, дополнительно включающий ПАВ, подходящее для медицинского применения.
24. Гемостатический материал по п.23, где ПАВ, подходящее для медицинского применения, включает один или несколько компонентов, выбранных из: блок-сополимеров на основе оксида этилена и оксида пропилена, глицерина, полиэтиленгликоля, пропиленгликоля, жирных кислот, солей жирных кислот, ПАВ и эмульгаторов на основе силикона.
25. Гемостатический материал по п.24, где ПАВ, подходящее для медицинского применения, представляет собой жирную кислоту, выбранную из лауриновой кислоты и олеиновой кислоты.
26. Гемостатический материал по п.24 или 25, где содержание ПАВ, подходящего для медицинского применения, составляет от 0,001 до 10 масс.% от массы гемостатического агента.
27. Гемостатический материал по п.1, где гемостатический агент включает частицы, которые не проходят через сито 200 меш.
28. Гемостатический материал по любому из пп.19-20, 23-25 и 27, где размер частиц инертного материала практически эквивалентен размеру частиц гемостатического агента.
29. Гемостатический материал по п.1 в форме сухого порошка, раствора, пены или геля.
30. Гемостатический материал по любому из пп. 1-20, 23-25, 27 и 29, нанесенный на несущий материал.
31. Гемостатический материал по п.30, где несущий материал находится в форме нетканого материала из вискозы, тканой марли, пленки, пены или листового геля.
32. Гемостатический материал по п.30, где несущий материал изготовлен из окисленной целлюлозы, желатина, декстрана, коллагена, поликаприлактона, полимолочной кислоты, сополимера полилактид-гликолид, полигликолида, хитина.
33. Гемостатический материал по любому из пп. 1-20, 23-25, 27, 29, 31 и 32 для применения при остановке кровотечения из целевого участка организма.
34. Способ изготовления гемостатического материала, где указанный способ включает стадию смешивания гемостатического агента, где гемостатический агент выбран из списка, состоящего из желатина, цеолита, коллагена, хитозана и соли хитозана, с биоадгезивным агентом, где биодгезивный агент выбран из группы, состоящей из карбомеров, полимера акриловой кислоты, имеющего молекулярную массу не менее 50000 г/моль, сшитого дивинилгликолем, или солей полиакриловой кислоты, сшитых дивинилгликолем, или их комбинаций, где содержание биоадгезивного агента составляет от 2 до 20 масс.% от массы гемостатического материала.
35. Применение гемостатического материала по любому из пп.1-30 при ослаблении или остановке кровотечения из целевого участка организма.
| US 20070154509 A1, 05.07.2007 | |||
| US 2010228174 A1, 09.09.2010 | |||
| ЗУБНАЯ НИТЬ, ПОКРЫТАЯ ГЕМОСТАТИЧЕСКИМ АГЕНТОМ, ЗУБНАЯ ЛЕНТА, ПОКРЫТАЯ ГЕМОСТАТИЧЕСКИМ АГЕНТОМ, И СПОСОБ ИХ ВЫПОЛНЕНИЯ | 2001 |
|
RU2279864C2 |
| US 4616644 A1, 14.10.1986 | |||
| RU 2007104938 A, 10.09.2008 | |||
| МЕДИЦИНСКАЯ МНОГОСЛОЙНАЯ ПОВЯЗКА И ИЗДЕЛИЯ НА ЕЕ ОСНОВЕ | 2002 |
|
RU2240140C2 |
| ГЕМОСТАТИЧЕСКАЯ КОМПОЗИЦИЯ, ВКЛЮЧАЮЩАЯ ГИАЛУРОНОВУЮ КИСЛОТУ | 2005 |
|
RU2369408C2 |
| СРЕДСТВО ДЛЯ ЛЕЧЕНИЯ РАН И ОКАЗАНИЯ ПЕРВОЙ МЕДИЦИНСКОЙ ПОМОЩИ | 1993 |
|
RU2031661C1 |
| КОМПОЗИЦИОННЫЙ ГЕМОСТАТИЧЕСКИЙ МАТЕРИАЛ И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 1993 |
|
RU2063246C1 |
Авторы
Даты
2024-08-19—Публикация
2012-03-12—Подача