Изобретение относится к разрушающейся или распадающейся в водной среде плоскостной лекарственной форме для высвобождения действующих веществ, которые посредством лекарственной формы можно применять прежде всего орально и которые имеют матрицу на основе водорастворимых полимеров в качестве основных веществ. В частности, изобретение относится к лекарственным формам указанного выше типа, выполненным в виде пастилок. Изобретение относится также к способу изготовления этих лекарственных форм.
Для применения действующих веществ через слизистую оболочку полости рта обычно используют буккальные или сублингвальные таблетки, которые высвобождают действующее вещество в полости рта. Всасывание действующего вещества через слизистую оболочку полости рта отличается, например, следующими преимуществами по сравнению с другими пероральными лекарственными формами: орально принимать лекарства могут также пациенты с затрудненным глотанием; лекарство минует желудочно-кишечный тракт, поэтому лекарственное действие наступает быстро; достигается высокая эффективность использования действующего вещества.
Альтернативой известным буккальным и сублингвальным таблеткам являются плоскостные лекарственные формы в виде облаток, называемые также пастилками.
Так, например, в патенте США US 5,529,782 описан быстро растворимый пленочный фабрикат из растворимого полимерного материала или комплексных полисахаридов, используемый главным образом для применения контрацептивов. Указанный пленочный фабрикат должен обладать толщиной от 3 до 4,5 мм, а также должно быть возможно такое регулирование его растворимости, чтобы после приема фабрикат разрушался в течение промежутка времени, составляющего от 5 до 60 секунд. Подобный пленочный фабрикат может находиться также в виде многослойного материала, снабженного формируемыми вспененивающим газом полыми пространствами.
Из европейского патента ЕР 0450 141 B1 известен материал-носи-тель для применения лекарственных средств, который быстро разрушается при контакте со слюной. Подобным материалом-носителем является пористое, дегидратированное, скелетообразное несущее вещество, в частности, основанное на протеинах и полисахаридах. Сформированные посредством дегидратации полые пространства используют для заполнения жидкими действующими веществами.
В международной заявке WO 98/26764 описана быстро распадающаяся при контакте с жидкостью, содержащая действующее вещество лекарственная форма в виде пленки, причем жирорастворимая фаза в виде жидких капелек распределена в наружной водорастворимой фазе.
В международной заявке WO 00/18365 предложена съедобная пленка, которая должна обладать быстрой растворимостью, а также способностью хорошо прилипать к слизистой оболочке полости рта, позволяющей высвобождать противомикробные вещества и сокращать количество нежелательных микроорганизмов в микрофлоре полости рта. Под противомикробными веществами подразумеваются эфирные масла, которые в качестве липофильной фазы смешивают в водной фазе предпочтительно с пуллуланом в качестве матричного материала.
В патенте США US 2001/006677 описаны пленкообразные лекарственные формы, вспенивающиеся и растворимые или набухающие в воде, которые легко прилипают к слизистой оболочке полости рта.
В международной заявке WO 02/02085 описаны быстро распадающиеся лекарственные формы для высвобождения действующих веществ в полости рта или других естественных отверстиях, причем лекарственная форма включает матрицу, содержащую в качестве основного вещества по меньшей мере один водорастворимый полимер и снабженную полыми пространствами.
В немецком патенте DE 10 2005 058 569 описан фабрикат в виде вспененной пастилки для высвобождения в полости рта действующих веществ, в частности, никотина, причем указанный фабрикат основан на привитом сополимере поливинилового спирта и полиэтиленгликоля.
Принцип действия описанных выше пастилок основан на том, что при контакте с водой, соответственно слюной, полимеры, используемые в качестве матрицы для соответствующих действующих веществ, растворяются, а, следовательно, пастилка распадается с высвобождением действующего вещества. Начало и временной ход высвобождения действующего вещества сильно зависят от толщины пастилки. Чем тоньше пастилка, тем быстрее она распадается в водной среде, поскольку растворитель способен быстрее проникать во внутренние области лекарственной формы. С другой стороны, соответствующие пастилки должны обладать определенной минимальной толщиной, позволяющей реализовать определяемую их назначением функцию и вместе с тем быть достаточно удобными для применения. Кроме того, толщина подобных лекарственных форм зависит от типа и количества действующего вещества, которое они должны содержать и высвобождать. По мере увеличения толщины пастилки наблюдается замедление ее распада, соответственно разрушения.
Прежде всего толстые пастилки, а также пастилки с относительно небольшой толщиной при замедленном распаде склонны прилипать и приклеиваться к небу или другим поверхностям слизистой оболочки полости рта, поскольку подобные пастилки обладают плоской гладкой формой. Прилипание пастилок, в частности, обусловлено растворяющимися на их поверхности полимерными слоями, которые образуют липкую и вязкую пленку. В связи с этим в рецептуру современных лекарственных систем в виде пастилок, как правило, вводят действующие вещества, лишь незначительные количества которых подлежат использованию, поскольку благодаря этому удается избежать больших толщин, обусловленных большими количествами действующего вещества. Подобные пленки должны обладать необходимыми физико-химическими свойствами (например, достаточной прочностью), поэтому в случае, если требуется применение больших количеств действующего вещества, в настоящее время вынуждены обходиться обычными лекарственными системами, например, таблетками.
Другой проблемой, характерной для толстых пастилок, является замедленное высвобождение из них действующего вещества или других компонентов, в частности, маскирующих вкус средств. В случае если последние находятся в виде нерастворимых или труднорастворимых твердых веществ, подобные твердые вещества вследствие замедленного высвобождения дольше остаются во рту, что может вызывать у пациента неприятные ощущения. Для улучшения обусловленных присутствием пастилки ощущений в полости рта в цитированной выше международной заявке WO 02/02085 предложена быстро распадающаяся или быстро разрушающаяся в водной среде плоскостная лекарственная форма, в полимерной матрице которой имеются свободные объемы или полые пространства, причем агрегатное состояние содержимого этих свободных объемов / полых пространств отличается от содержимого матрицы.
Однако исследования показывают, что чувствительные пациенты испытывают неприятные или мешающие ощущения в полости рта также и в случае применения предложенной в международной заявке WO 02/02085 плоскостной лекарственной формы. Таким образом, существует потребность в улучшенной лекарственной форме, в частности, пастилке, разрушение которой не должно вызывать неприятных ощущений во рту, причем улучшению подлежит способность к разрушению пленок, которые должны обладать высокими значениями массы в пересчете на единицу площади, необходимыми для высвобождения эффективной дозы действующего вещества.
В основу настоящего изобретения была положена задача удовлетворить указанную потребность.
Указанная выше задача согласно изобретению решается с помощью разрушающейся или распадающейся в водной среде плоскостной лекарственной формы по п. 1 формулы изобретения, предназначенной для высвобождения по меньшей мере одного действующего вещества в естественном отверстии или полости тела, причем лекарственная форма включает полимерную матрицу в виде имеющей полые пространства затвердевшей пены, а также по меньшей мере одно фармацевтическое действующее вещество, и обладает массой в пересчете на единицу площади, составляющей от 50 до 350 г/м2. Таким образом, предлагаемая в изобретении лекарственная форма содержит заполненные газом, в частности, воздухом или азотом, пространственные области, которые способствуют ускоренному разрушению лекарственной формы. Полые пространства могут находиться только внутри полимерной матрицы, однако они могут продолжаться также до наружного края лекарственной формы.
Благодаря наличию предлагаемых в изобретении полых пространств и обусловленной этим большой поверхности пленок, в частности, облегчается доступ воды, соответственно слюны или других содержащихся в организме жидкостей внутрь лекарственной формы, а, следовательно, разрушение лекарственной формы и высвобождение действующего вещества ускоряются настолько, что в некоторых случаях недостаточно хорошо растворимые частицы действующего вещества могут быстро распределяться во рту и горле и становиться неощутимыми. Благодаря этому предотвращается пребывание таких частиц на одном месте, причем высвобожденное действующее вещество удается быстро проглотить. Результатом этого является улучшенное «вкусовое ощущение» предлагаемой в изобретении лекарственной формы, а, следовательно, более высокая степень ее признания потребителями или пациентами. Кроме того, при сублинг-вальном применении действующего вещества предлагаемая в изобретении форма применения способствует ускоренной готовности действующего вещества для трансмукозального поглощения.
Наряду с этим в случае быстро всасывающегося действующего вещества благодаря быстрому разрушению лекарственной формы, например, при сублингвальном применении, может улучшаться трансмукозальное всасывание. С другой стороны, поскольку указанные выше полые пространства представляют собой, например, затвердевшие пузырьки, их стенки обладают незначительной толщиной, что обусловливает быструю дезинтеграцию или разрушение полых пространств.
Другое преимущество предлагаемой в изобретении лекарственной формы состоит в том, что несмотря на сравнительно высокую массу в пересчете на единицу площади ее производство в виде пены позволяет выполнять сушку быстрее по сравнению с сопоставимой невспененной композицией.
Предлагаемая в изобретении лекарственная форма предпочтительно обладает массой в пересчете на единицу площади, составляющей от 50 до 300 г/м2, в частности, от 100 до 280 г/м², предпочтительно от 130 до 250 г/м², более предпочтительно от 150 до 220 г/м², наиболее предпочтительно от 165 до 210 г/м².
В качестве матричного полимера можно использовать водорастворимые полимеры или смеси водорастворимых полимеров. При этом предпочтительно используют эмульгирующие синтетические или полусинтетические полимеры или биополимеры природного происхождения, которые обладают пленкообразующей способностью, растворимостью в воде и/или пригодностью для пенообразования. В качестве альтернативы можно использовать полимеры, которые сами не являются эмульгирующими и подлежат использованию в комбинации с поверхностно-активными веществами.
К пригодным синтетическим полимерам относятся, например, поливиниловый спирт, полиакрилаты и поливинилпирролидон. Особенно пригодным из указанных полимеров является поливиниловый спирт. Еще более пригодный поливиниловый спирт обладает средневесовой молекулярной массой в диапазоне от 15000 до 60000, в частности, от 25000 до 50000. Примером пригодного коммерчески доступного поливинилового спирта является Mowiol 4-88, поставляемый, например, фирмой Sigma Aldrich.
Наряду с указанными выше гомополимерами в качестве синтетических полимеров можно использовать также сополимеры. Пригодными сополимерами являются, например, привитые сополимеры поливинилового спирта и полиэтиленгликоля, в частности, поставляемые фирмой BASF под торговым названием Kollicoat® IR, или сополимеры поливинилпирролидона и поливинилацетата, в частности, поставляемые фирмой BASF под торговым названием Kollidon VA 64.
Пригодными полусинтетическими полимерами являются производные целлюлозы, примером которых являются, гидроксипропилметилцеллюлоза, карбоксиметилцеллюлоза, гидроксипропилцеллюлоза, гидроксиметилцеллюлоза и метилцеллюлоза, а также другие замещенные производные целлюлозы. Особенно пригодным производным целлюлозы является гидроксипропилметилцеллюлоза, в частности, гидроксипропилметилцеллюлоза со степенью метоксизамещения примерно от 28 до 30 % и степенью гидроксипропоксизамещения примерно от 7 до 12 %. Подобная гидроксипропилметилцеллюлоза может быть поставлена, например, фирмой Dow Chemical под торговым названием Methocel E. Предпочтительными являются также водорастворимые полисахариды растительного, микробиологического или синтетического происхождения, прежде всего те из них, которые не являются производными целлюлозы, например, пуллулан, ксантан, альгинаты, декстраны, агар-агар, пектины и карраген. Кроме того, пригодными являются также протеины, предпочтительно желатин или другие гелеобразующие белки, а также белковые гидролизаты. К пригодным белковым гидролизатам относятся, в частности, казеинат, молочная сыворотка, растительные белки, желатин, а также (яичный) белок и соответствующие смеси. Предпочтительными белками являются казеинаты, производимые из подвергнутых распылительной сушке молочных продуктов.
Особенно предпочтительными матричными полимерами в соответствии с настоящим изобретением являются поливиниловый спирт, привитой сополимер поливинилового спирта и полиэтиленгликоля, а также гидроксипропилметилцеллюлоза. Наиболее предпочтительным матричным полимером является поливиниловый спирт. Под поливиниловым спиртом предпочтительно подразумевается продукт гидролиза гомополимера винилацетата. В этом продукте могут присутствовать также остаточные количества негидролизованного поливинилацетата (предпочтительно не более 20 % мол., в частности, не более 15 % мол., соответственно в пересчете на общее мольное количество мономерных винилового спирта и винилацетата). Преимущество указанных предпочтительных матричных полимеров состоит в том, что добавление других поверхностно-активных веществ или тензидов для формирования затвердевшей пены не требуется.
Матричный полимер наряду с фармацевтическим действующим веществом является основным компонентом предлагаемой в изобретении лекарственной формы. Пригодное содержание матричного полимера составляет от 20 до 65 % масс., в частности, от 30 до 60 % масс., наиболее предпочтительно от 32 до 52 % масс., соответственно в пересчете на вес сухого вещества.
Как указано выше, полые пространства в предлагаемой в изобретении лекарственной форме могут находиться в полимерной матрице соответственно изолированно друг от друга предпочтительно в виде упрочненных пузырьков.
Согласно другому варианту осуществления изобретения полые пространства соединены друг с другом и предпочтительно образуют сплошную канальную систему, пронизывающую полимерную матрицу.
Указанные полые пространства предпочтительно заполнены газом или газовой смесью, в частности, воздухом или азотом. Однако наряду с этим может быть предпочтительным также, если полые пространства содержат другие газы или газовые смеси, которые не реагируют с остальными компонентами лекарственной формы. Особенно предпочтительными газами являются азот, диоксид углерода и гелий, а также смесь этих газов или нескольких этих газов.
Объемная доля указанных полых пространств в пересчете на общий объем лекарственной формы предпочтительно составляет от 5 до 98 %, предпочтительно от 50 до 80 %. Варьирование доли полых пространств позволяет оптимальным образом влиять на достигаемый в соответствии с изобретением эффект ускоренного разрушения лекарственной формы.
Другим важным параметром, оказывающим влияние на свойства предлагаемой в изобретении лекарственной формы, является диаметр полых пространств или пузырьков. Пузырьки или полые пространства предпочтительно формируют с помощью взбивающего пену устройства, посредством которого диаметр пузырьков можно регулировать в широком, почти любом диапазоне. Так, например, диаметр пузырьков или полых пространств может находиться в диапазоне от 0,01 до 60 мкм. Диаметр пузырьков или полых пространств особенно предпочтительно составляет от 10 до 50 мкм.
Поверхность лекарственной формы может быть гладкой, однако лекарственная форма может обладать также неровной или неоднородной, например, волнистой или рельефной поверхностью. Подобная неоднородная структура поверхности может быть обусловлена, например, внедренными в полимерную матрицу полыми пространствами в виде пузырьков и/или последующей сушкой.
Предлагаемые в изобретении лекарственные формы предпочтительно являются тонкими фабрикатами, например, в виде пастилок. Толщина лекарственной формы предпочтительно составляет от 100 мкм до 5 мм, особенно предпочтительно от 0,5 до 3 мм.
Настоящее изобретение не имеет никаких существенных ограничений в отношении типа фармацевтического действующего вещества за исключением требования, согласно которому должно быть возможным оральное, в частности, трансмукозальное, сублингвальное или десневое, и/или гастроинтестинальное всасывание этого действующего вещества.
В соответствии с этим пригодными действующими веществами являются, в частности, средства для лечения инфекционных заболеваний; противовирусные средства; анальгетики, например, фентанил, суфентанил и бупренорфин; анестезирующие средства; средства, подавляющие аппетит; действующие вещества для лечения артрита и астмы, например, тетрабуталин; противосудорожные средства; антидепрессивные средства; антидиабетические средства; противогистаминные средства; антидиарейные средства; средства против мигрени, зуда, тошноты и позывов на рвоту; средства против укачивания, соответственно морской болезни, например, скополамин или ондансетрон; средства для лечения болезни Паркинсона; антипсихотические средства; жаропонижающие средства, спазмолитические средства, антихолинергические средства, средства против язвенной болезни, например, ранитидин; симпатомиметические средства; блокаторы кальциевых каналов, например, нифедипин; бетаблокаторы; бета-агонисты, например, добутамин; средства против аритмии; гипотензивные средства, например, атенолол; ингибиторы АПФ, например, эналаприл; бензодиазепин-агонисты, например, флумазенил; коронарные, периферийные и церебральные сосудорасширяющие средства; средства для стимуляции центральной нервной системы; гормоны; снотворные средства; иммунодепрессанты; миорелаксанты; антагонисты рецептора N-метил-D-аспартата (NMDA); парасимпатолитики; парасимпатомиметики; простагландины; протеины, пептиды; психостимуляторы; седативные средства; транквилизаторы; адреналин.
В соответствии с настоящим изобретением особенно предпочтительными действующими веществами являются антагонисты рецептора N-метил-D-аспартата (NMDA), в частности, в виде декстрометорфана, кетамина или соответствующего фармацевтически активного производного. Кетамин можно использовать в виде рацемата, однако в предпочтительном варианте кетамин включают в предлагаемую в изобретении лекарственную форму в виде S-кетамина. Пригодными фармацевтически активными производными кетамина являются, например, нор-S-кетамин, S-дегидроноркетамин или (S,S)-6-гидроксиноркетамин. Согласно изобретению можно использовать также фармацевтически приемлемые соли указанных действующих веществ.
Количество действующего вещества в дозируемой порции составляет до 100 мг, предпочтительно до 50 мг, особенно предпочтительно до 30 мг и наиболее предпочтительно до 20 мг. С другой стороны, минимальное количество действующего вещества в дозируемой порции предпочтительно должно составлять 5 мг, более предпочтительно 10 мг, наиболее предпочтительно 12 мг. В зависимости от назначения лекарственной формы количество действующего вещества в дозируемой порции может соответствовать также верхнему диапазону указанных выше значений, составляя, например, от более 50 до 100 мг или от 30 до 50 мг.
Целесообразное количество действующего вещества в пересчете на единицу площади лекарственной формы находится в диапазоне от 1 до 15 мг/см², предпочтительно от 2,8 до 10 мг/см².
Содержание действующего вещества в предлагаемой в изобретении лекарственной форме можно варьировать в относительно широких пределах. Пригодное содержание действующего вещества составляет от 20 до 60 % масс. в пересчете на сухой вес лекарственной формы. В одном варианте осуществления изобретения более приемлемым является нижний диапазон значений содержания действующего вещества в лекарственной форме, например, в случае, если действующее вещество обладает чрезвычайно неприятным вкусом, для компенсации которого необходимо использовать большие количества маскирующих вкус средств. В подобном случае пригодное содержание действующего вещества в лекарственной форме может находиться в диапазоне от 21 до 30 % масс., в частности, от 22 до 28 % масс.. В другом варианте осуществления изобретения более приемлемым является верхний диапазон значений содержания действующего вещества в предлагаемой в изобретении лекарственной форме, причем особенно предпочтительным является содержание действующего вещества, составляющее от 42 до 55 % масс., в частности, от 45 до 52 % масс..
Помимо фармацевтического действующего вещества предлагаемая в изобретении лекарственная форма может включать также другие добавки, назначением которых является, например, воздействие на цветовые или вкусовые ощущения, сопровождающие прием лекарственной формы.
Особенно пригодной добавкой подобного типа является маскирующее вкус средство, которое способствует улучшению вкусовых ощущений, например, при приеме действующих веществ с горьким вкусом. Предпочтительным маскирующим вкус средством является ионообменная смола.
Ионообменные смолы, предпочтительно ипользуемые в предлагаемой в изобретении лекарственной форме, нерастворимы в воде и состоят из фармакологически инертной органической или неорганической матрицы, содержащей ковалентно связанные функциональные группы, которые являются ионными группами или могут быть ионизированы при соответствующем показателе рН. Органическая матрица может быть синтетической (например, полимеры или сополимеры акриловой кислоты, метакриловой кислоты, сульфированного стирола, сульфированного дивинилбензола) или полусинтетической (например, модифицированная целлюлоза и декстраны). Матрица может быть также неорганической, например, может являться силикагелем, модифицированным посредством введения ионных групп. Ковалентно связанные ионные группы могут быть сильнокислыми (например, группами сульфокислоты), слабокислыми (например, группами карбоновой кислоты), сильнощелочными (например, группами четвертичного аммония), слабощелочными (например, группами первичного амина) или комбинированными кислыми и щелочными группами. В общем случае для использования в предлагаемых в изобретении лекарственных формах пригодны те виды ионообменных веществ, которые используют в ионообменной хроматографии, а также для других целей, например, для деионизации воды.
Согласно изобретению ионообменной смолой предпочтительно является смола на основе сшитого полистирола. Полистирол сшивают посредством сшивающего агента, выбранного из бифункциональных соединений, которые способны сшивать полистиролы. Сшивающим агентом предпочтительно является дивиниловое или поливиниловое соединение. Наиболее предпочтительно сшивающим агентом является дивинилбензол.
В общем случае целесообразная степень сшивания полистирола находится в примерном диапазоне от 3 до 20 %, предпочтительно от 4 до 16 %, более предпочтительно от 6 до 10 % и наиболее предпочтительно около 8 % масс., соответственно в пересчете на общий полистирол. Сшивание полистирола посредством сшивающего агента осуществляют известными методами.
В соответствии с настоящим изобретением обменная емкость ионообменных смол, особенно пригодных для использования в качестве маскирующих вкус средств, составляет примерно менее 6 мэкв/г, предпочтительно менее 5,5 мэкв/г («мэкв» означает миллиэквиваленты).
Размер частиц ионообменной смолы предпочтительно должен находиться в примерном диапазоне от 20 до 200 микрометров. С частицами, размер которых значительно меньше указанного нижнего предела, трудно обращаться на всех стадиях переработки. Продукты с существенным превышением верхнего предела размера частиц, например, торговые ионообменные смолы с частицами сферической формы диаметром примерно до 1000 микрометров, в жидких формах дозирования являются крупнозернистыми и при реализации циклов сухой гидратации имеют выраженную тенденцию к разрушению.
К репрезентативным смолам, которые можно использовать в соответствии с настоящим изобретением, относятся AMBERLITE IRP-69 (продукт фирмы Dow Chemical) и Dow XYS-40010.00 (продукт фирмы Dow Chemical Company). Оба продукта являются сульфированными полимерами из сшитого посредством 8 % дивинилбензола полистирола, ионообменная емкость которых находится в примерном диапазоне от 4,5 до 5,5 мэкв/г сухой смолы (Н+ форма). Эти продукты отличаются друг от друга главным образом физической формой. Продукт AMBERLITE IRP-69 состоит из частиц неоднородной формы с размерами в диапазоне от 47 до 149 микрометров, полученных фрезерованием более крупных шариков, образующих продукт AMBER-LITE IRP-120. Продукт Dow XYS-40010.00 включает сферические частицы с размерами в диапазоне от 45 до 150 микрометров. Другой пригодной ионообменной смолой является Dow XYS-40013.00 - полимер, состоящий из полистирола, сшитого посредством 8 % дивинилбензола и функционализованного группой четвертичного аммония. Обменная емкость данного продукта обычно находится в примерном интервале от 3 до 4 мэкв/г сухой смолы. Другой пригодной смолой является продукт AMBERLITE IRP-64.
Согласно менее предпочтительному варианту осуществления изобретения маскирующее вкус средство не обязательно является ионообменной смолой. При этом маскирующим вкус средством может являться трисиликат магния, полимер, например, продукт EUDRAGIT E фирмы Evonik, и/или целлюлоза, например, этилцеллюлоза, а также другие вещества подобного типа.
Содержание маскирующего вкус средства, вводимого в предлагаемую в изобретении лекарственную форму, определяется тем, обладает ли фармацевтическое действующее вещество неприятным, например, горьким вкусом. Содержание маскирующего вкус средства, как правило, варьируют в диапазоне от 0,3 до 45 % масс., в частности, от 0,5 до 27 % масс., соответственно в пересчете на сухой вес лекарственной формы.
Для модифицирования вкусовых ощущений предлагаемая в изобретении лекарственная форма помимо маскирующего вкус средства или в качестве альтернативы может содержать подслащивающее вещество. Пригодными синтетическими подслащивающими веществами являются, например, сукралоза, аспартам, цикламат, сахарин, неогесперидин, тауматин, стевия и ацесульфам, а также соответствующие соли.
Кроме того, предлагаемая в изобретении лекарственная форма может содержать одно или несколько душистых веществ, эфирных масел или ментол.
При изготовлении предлагаемой в изобретении лекарственной форма для придания пене приятного кисловатого вкуса можно примешивать также одну или несколько кислот. Примерами подобных кислот, в частности, являются лимонная кислота, молочная кислота, уксусная кислота, бензойная кислота, пропионовая кислота, щавелевая кислота, малоновая кислота, янтарная кислота, яблочная кислота и винная кислота. Кроме того, добавление кислоты может быть необходимым или желательным, если нужно понизить рН пены. Это может потребоваться прежде всего в том случае, если содержащееся в лекарственной форме действующее вещество относительно нерастворимо в щелочных условиях или действующие вещества нестабильны в щелочных условиях.
Кроме того, для улучшения эстетических свойств и уменьшения ломкости высохших пен к предлагаемой в изобретении лекарственной форме, в частности, к пенам, можно добавлять увлажняющие средства, соответственно стабилизаторы влажности и/или пластификаторы. Примерами подобных добавок являются, в частности, глицерин, пропиленгликоль и сложные эфиры полиглицерина. Содержание пластификатора целесообразно варьировать в диапазоне от 2 до 10 % масс., в частности, от 3 до 8 % масс., наиболее предпочтительно от 4 до 6 % масс., соответственно в пересчете на сухой вес лекарственной формы.
В одном варианте осуществления изобретения для повышения стабильности пены перед или после сушки к матричному полимеру, соответственно к используемой для вспенивания полимерной матрице, или к полученной пене перед или после сушки можно добавлять поверхностно-активные вещества, соответственно тензиды. Примерами пригодных поверхностно-активных веществ, в частности, являются замещенные производные сорбитана прежде всего серии «Tween» (ICI) или «Span» (TCI). Поверхностно-активные вещества могут находиться также в виде стабилизирующих пену полимеров (например, полимеров целлюлозы или акрилатов, не указанных выше в качестве матричных полимеров) или в виде казеина или желатина.
Содержание тензида в предлагаемой в изобретении лекарственной форме в первую очередь зависит от того, нуждается ли матричный полимер в использовании тензида для стабилизации пены, причем, например, в случае эмульгирующих матричных полимеров, таких как поливиниловый спирт, необходимость в использовании тензида отсутствует. Пригодное содержание тензида в предлагаемой в изобретении лекарственной форме находится в диапазоне от 0 до 15 % масс. в пересчете на сухой вес лекарственной формы.
В одном варианте осуществления изобретения матричный полимер не требует использования поверхностно-активных веществ или тензидов для стабилизации пены. В этом случае содержание поверхностно-активных веществ и/или тензидов в предлагаемой в изобретении лекарственной форме предпочтительно составляет менее 0,5 % масс., особенно предпочтительно менее 0,1 % масс., соответственно в пересчете на сухой вес лекарственной формы. При этом следует заметить, что материалы, указанные выше в качестве матричных полимеров, в контексте настоящего изобретения не рассматриваются в качестве поверхностно-активных веществ, даже если некоторые из таких материалов и обладают поверхностно-активными свойствами. Наличие поверхностно-активных свойств у матричных полимеров считается даже преимуществом, поскольку в этом случае отсутствует необходимость введения указанных выше поверхностно-активных веществ или тензидов в пену.
Для придания лекарственной форме необходимого цвета в нее может быть введено красящее вещество или красящее средство. Пригодными красящими веществами являются, например, азокрасители, в частности, продукт Allurarot АС, поставляемый также под торговым названием FD&C Red 40.
Другими добавками, в частности, могут являться вещества, выбранные из группы, включающей карбоксиметилцеллюлозу, гуммиарабик, метилцеллюлозу, пектины, модифицированные и немодифицированные крахмалы, желатин, животные и/или растительные протеины, яичный белок, альгинаты, эфиры полиоксиэтилена (эмульгатор), этилцитрат, октилгаллат, 1,2-пропиленгликат, стеарат магния, стеариновую кислоту, микрокристаллическую целлюлозу, аэросил, лецитин, твин, пропилгаллат и амилогам.
Дополнительно в пене может быть растворен сахар (или смесь сахаров) или другой углевод. Сахар или углевод повышает массу пены, которой она обладает после сушки. Кроме того, сушка и кристаллизация сахара или другого углевода придают высохшей пене дополнительную прочность и стабильность. Сахар или другие углеводы могут придавать высохшей пене сладковатый вкус или иным образом улучшать ее органолептические свойства. Примерами используемого для этой цели сахара являются, в частности, мальтоза, лактоза, сахароза, декстроза (глюкоза) и трегалоза, а также сахарные спирты, например, маннит, сорбит, ксилит, мальтит и другие. Примерами других углеводов являются мальтодекстрин, гликозная патока (из кукурузы), растворимые крахмалы и другие вещества.
В отсутствие особых указаний содержание добавок в лекарственной форме составляет от 0,01 до 10 % масс., в частности, от 0,1 до 8 % масс., соответственно в пересчете на сухой вес лекарственной формы.
Помимо указанных выше ингредиентов предлагаемая в изобретении лекарственная форма может содержать влагу (воду). Пригодное влагосодержание составляет от 2 до 15 % масс., в частности, от 5 до 12 % масс..
Предлагаемая в изобретении лекарственная форма в первую очередь предназначена для применения в качестве оральной лекарственной формы, высвобождающей действующие вещества в ротовой полости. Однако ее можно использовать также в качестве лекарственной формы, вводимой в другие полости тела или естественные отверстия и высвобождающей в них действующие вещества. Речь при этом идет, например, о ректальных, вагинальных или интраназальных лекарственных формах.
Высвобожденное из лекарственной формы действующее вещество всасывается в месте применения, например, через слизистую оболочку полости рта, или транспортируется в другое место организма и всасывается в этом месте (например, в желудочно-кишечном тракте после проглатывания высвобожденного в ротовой полости действующего вещества). Время пребывания предлагаемой в изобретении лекарственной формы в месте ее применения (например, в полости рта), соответственно время распада предпочтительно составляет от 1 секунды до 5 минут, более предпочтительно от 2 секунд до 1 минуты, еще более предпочтительно от 3 до 10 секунд, наиболее предпочтительно от 3 до 5 секунд.
В случае если лекарственная форма в качестве действующего вещества содержит кетамин или S-кетамин, подобную лекарственную форму можно эффективно использовать для лечения болезней, при которых кетамин или S-кетамин способствует успокоению. В соответствии с этим другой аспект настоящего изобретения относится к лекарственной форме с указанными выше характеристиками, содержащей кетамин, S-кетамин или фармацевтически приемлемые соли этих веществ, предназначенной для терапевтического или профилактического лечения болей, предпочтительно хронических болей, более предпочтительно болей, выбранных из группы, включающей пронизывающие боли, комплексный местный болевой синдром, стойкие боли при опухолях, невропатические боли, боли при посттравматическом синдроме, ишемические боли в конечностях и острые боли. В качестве альтернативы настоящее изобретение относится к лекарственной форме с указанными выше характеристиками, содержащей кетамин, S-кетамин или фармацевтически приемлемые соли этих веществ и предназначенной для терапевтического или профилактического лечения депрессий. Указанные лекарственные формы особенно предпочтительно подлежат сублингвальному применению, поскольку оно позволяет обеспечить быструю доступность кетамина для трансмукозального поглощения.
В случае если лекарственная форма в качестве действующего вещества содержит декстрометорфан, подобную лекарственную форму можно эффективно использовать для лечения болезней, при которых декстрометорфан способствует успокоению. В соответствии с этим другой аспект настоящего изобретения относится к лекарственной форме с указанными выше характеристиками, содержащей декстрометорфан или фармацевтически приемлемую соль декстрометорфана и предназначенной для терапевтического или профилактического лечения кашля, нарушений эмоциональной регуляции или амиотрофического бокового склероза.
В случае если лекарственная форма в качестве действующего вещества содержит адреналин, подобную лекарственную форму можно эффективно использовать для лечения болезней, при которых адреналин способствует успокоению. В соответствии с этим другой аспект настоящего изобретения относится к лекарственной форме с указанными выше характеристиками, содержащей адреналин или фармацевтически приемлемую соль адреналина и предназначенной для терапевтического лечения анафилактического шока.
Ниже описывается целесообразный способ изготовления предлагаемых в изобретении лекарственных форм.
Сначала осуществляют приготовление раствора или дисперсии, содержащего(-ей) по меньшей мере один водорастворимый пленкообразующий полимер и по меньшей мере одно действующее вещество. Затем полученный раствор, соответственно дисперсию, который(-ая) могут представлять собой также концентрированный раствор или вязкую массу, вспенивают посредством введения газа или газовой смеси (например, воздуха). Подобное вспенивание можно осуществлять с помощью диспергирующего устройства или машины для взбивания пены, а также иными методами, например, посредством ультразвука. В качестве газов пригодны также, в частности, инертные газы, например, азот, диоксид углерода или гелий, а также их смеси.
Для стабилизации полученных указанным образом пен или материалов, содержащих воздушные, соответственно газовые пузырьки, до или во время вспенивания можно добавлять стабилизирующее пену средство. Пригодные стабилизирующие пену средства, например, тензиды, известны специалистам. В заключение, содержащий воздушные пузырьки материал или пену распределяют на пригодной подложке в виде пленки или слоя, а затем сушат.
Под «сушкой» подразумевается удаление из лекарственной формы растворителя, в частности, воды. При этом удалять из лекарственной формы весь растворитель, в частности, воду, не требуется, а достаточно удалить лишь основное количество растворителя, чтобы произошло затвердевание пены. Следовательно, лекарственная форма после сушки может обладать остаточным влагосодержанием, указанным выше для предлагаемой в изобретении лекарственной формы.
Вследствие удаления растворителя пена в процессе сушки затвердевает, причем формируется долговременная структура образовавшихся полых пространств. Пастилки с необходимыми поверхностными размерными параметрами или геометрической формой получают благодаря тому, что вспененную массу перед сушкой выливают в соответствующие формы или отдельные пастилки вырубают из плоского куска большей площади.
Изготовленные указанным выше образом лекарственные формы, содержащие действующее вещество, обладают характерными для настоящего изобретения свойствами и преимуществами.
На форму, количество и размер формируемых полых пространств можно оказывать воздействие посредством варьирования технологических параметров, например, типа и концентрации полимеров, вязкости полимерной композиции, а также благодаря регулированию процесса вспенивания, выбору стабилизирующего пену средства и так далее.
В качестве альтернативы описанному выше способу предлагаемые в изобретении лекарственные формы можно изготавливать способом, в соответствии с которым формирование полых пространств внутри полимерной матрицы осуществляют посредством введения гидрофобного растворителя, который не смешивается с растворителем, используемым для приготовления указанного выше раствора или дисперсии.
При этом получают эмульсию, которая содержит гидрофобный растворитель в виде тонко распределенных капелек.
В результате удаления растворителя в процессе последующей сушки в полимерной матрице остаются каплеобразные или пузыреобразные полые пространства. В случае двухфазной системы сначала подлежит удалению растворитель внутренней фазы.
Кроме того, в варианте описанного выше способа полые пространства можно формировать посредством добавления к раствору или дисперсии, содержащему(-ей) полимер и действующее вещество, вспомогательных веществ, которые образуют газ или газы, благодаря чему композиция вспенивается. Подобное вспенивание посредством генерирования газа можно осуществлять во время приготовления полимерной композиции, в процессе ее нанесения на подложку или только во время последующей сушки. Пригодные газообразующие вещества или смеси известны специалистам. Кроме того, вспенивание можно осуществлять также посредством снижения давления предварительно растворенного газа. В качестве газа, в частности, можно использовать инертный газ, например, азот, диоксид углерода или гелий, или смесь этих газов.
В качестве альтернативы при изготовлении предлагаемых в изобретении лекарственных форм можно исходить также из расплава матричного полимера, соответственно смеси матричных полимеров. Соответствующий технологический процесс в принципе осуществляют подобно известному из уровня техники нанесению покрытий из полимерного расплава.
При этом для вспенивания полимерного расплава в него одним из указанных выше методов вводят газ или газовую смесь. Затем полимерный расплав наносят или экструдируют на пригодную подложку или выливают в форму и оставляют остывать, соответственно затвердевать. Технологию переработки из расплава нельзя использовать, если соответствующее действующее вещество при температуре плавления полимера является нестабильным или летучим. Для снижения точки плавления к полимерному расплаву при необходимости можно добавлять вспомогательные вещества. В принципе можно использовать также известную из уровня техники технологию нанесения покрытий из раплава, если это не противоречит требованиям, указанным в пункте 1 формулы изобретения.
Согласно другому варианту осуществления указанного выше способа сначала изготавливают полимерную матрицу в виде блока. После сушки, соответственно затвердевания от блока отрезают необходимую лекарственную форму.
Предлагаемая в изобретении лекарственная форма предпочтительно пригодна для введения лекарств в ротовую полость, а также для ректального, вагинального или интраназального применения. Ее можно использовать как в медицине, так и в ветеринарии.
Примеры изготовления
Пример 1
Получают вспененную пластинку с декстрометорфаном, которая обладает следующим составом:
Для формирования затвердевшей пены сначала получают предварительный раствор поливинилацетата в воде, в котором диспергируют действующее вещество. Затем дисперсию вспенивают посредством введения воздуха и наносят на используемую в качестве подложки полиэтиленовую пленку с помощью ракли и аппретурного ящика. В течение последующих 15 минут пену сушат в сушильном шкафу при температуре около 70°С, получая затвердевшую пену. Масса полученной пены в пересчете на единицу площади составляет 200 г/м².
Пример 2
Указанный в таблице 1 состав в соответствии с приведенной в примере 1 методикой перерабатывают в затвердевшую пену с использованием кетамина HCl в качестве действующего вещества. Параллельно состав перерабатывают в сравнительную пленку без вспенивания.
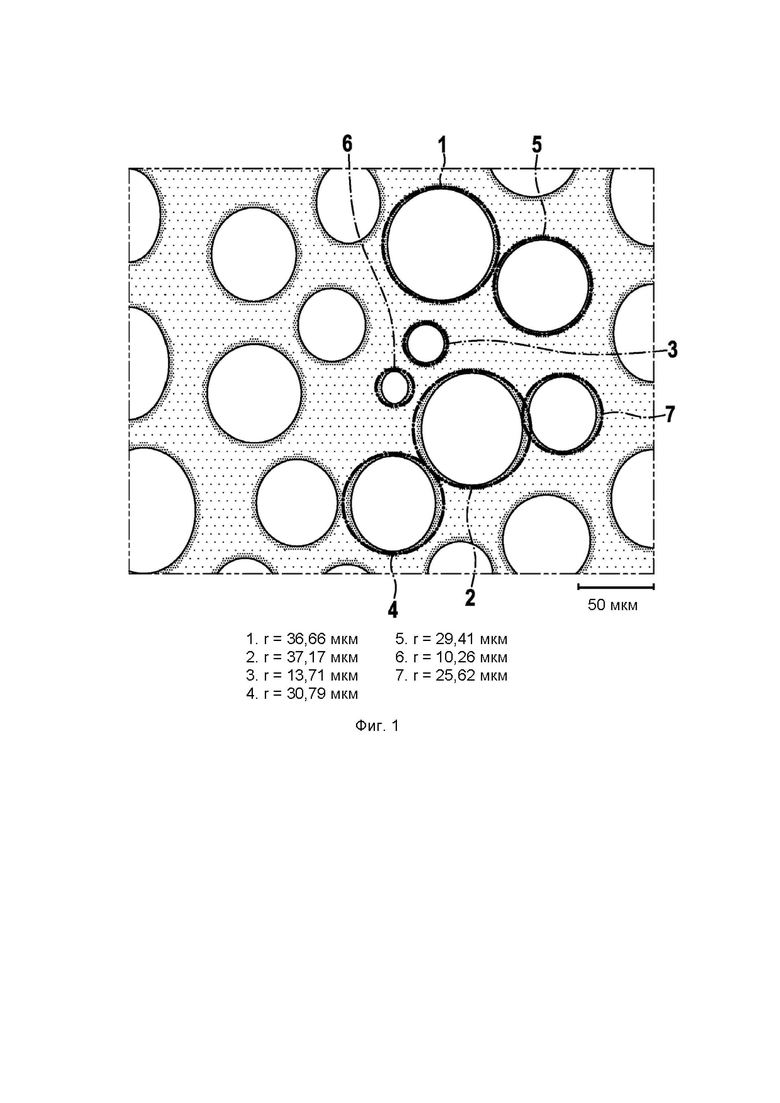
Упрочненную пену исследуют под микроскопом. Как показано на полученном при этом снимке (фиг. 1), пленки имеют полые пространства, диаметру которого соответствует примерный диапазон от 10-37 мкм до 50 мкм. В целом в пленке могут быть обнаружены полые пространства, диаметр которых находится в диапазоне от 10 до 50 мкм.
Оценивают дезинтеграцию полученных пен и сравнительных пленок. При этом время дезинтеграции пен составляет около 13 секунд (среднее значение из результатов шести измерений). Дезинтеграция сравнительных пленок происходит гораздо медленнее: время дезинтеграции составляет около 38 секунд.
| название | год | авторы | номер документа |
|---|---|---|---|
| МНОГОСЛОЙНАЯ ПЕРОРАЛЬНАЯ ТОНКАЯ ПЛЕНКА | 2022 |
|
RU2832736C1 |
| ПЕРОРАЛЬНАЯ ТОНКАЯ ПЛЕНКА | 2022 |
|
RU2829451C1 |
| ВСПЕНЕННАЯ ПАСТИЛКА, СОДЕРЖАЩАЯ ПРИВИТОЙ СОПОЛИМЕР ПОЛИВИНИЛОВОГО СПИРТА И ПОЛИЭТИЛЕНГЛИКОЛЯ | 2006 |
|
RU2437648C2 |
| ТОНКАЯ ПЛЕНКА ДЛЯ ПЕРОРАЛЬНОГО ПРИМЕНЕНИЯ | 2021 |
|
RU2838392C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПЕРОРАЛЬНОЙ ТОНКОЙ ПЛЕНКИ, СОДЕРЖАЩЕЙ МИКРОЧАСТИЦЫ | 2021 |
|
RU2811825C1 |
| ПРЕССОВАННЫЙ ФАРМАЦЕВТИЧЕСКИЙ ПРЕПАРАТ | 2016 |
|
RU2744270C2 |
| НЕВЫПЛЕВЫВАЕМАЯ, БЫСТРОРАСПАДАЮЩАЯСЯ ПЛЕНКА ДЛЯ ОРАЛЬНОГО ПРИМЕНЕНИЯ, СОДЕРЖАЩАЯ НЕЙРОЛЕПТИК | 2006 |
|
RU2427374C2 |
| КАРМАНООБРАЗНЫЕ ПЕРОРАЛЬНЫЕ РАСТВОРИМЫЕ ПЛЕНКИ С ВЫСОКОЙ ЗАГРУЗКОЙ АКТИВНОГО ВЕЩЕСТВА | 2018 |
|
RU2742415C1 |
| Биоразлагаемая система трансмукозальной доставки дротаверина | 2017 |
|
RU2699808C2 |
| НАНОЧАСТИЦЫ, СОДЕРЖАЩИЕ ТАКРОЛИМУС | 2019 |
|
RU2828228C2 |
В заявке описаны разрушающиеся или распадающиеся в водной среде плоскостные лекарственные формы, предназначенные для высвобождения по меньшей мере одного действующего вещества в естественном отверстии или полости тела, образованные из полимерной матрицы в виде имеющей полые пространства затвердевшей пены, а также по меньшей мере одного фармацевтического действующего вещества и обладающие высокой массой в пересчете на единицу площади, составляющей от 150 до 220 г/м2. Указанные лекарственные формы несмотря на высокую массу в пересчете на единицу площади и обусловленную этим высокую дозировку действующего вещества во время применения отличаются гораздо лучшим ощущением во рту по сравнению с обычными пленочными лекарственными формами. Кроме того, в заявке описаны способы изготовления указанной лекарственной формы. 5 н. и 12 з.п. ф-лы, 1 ил., 1 табл., 2 пр.
1. Плоскостная лекарственная форма, растворяющаяся или разлагающаяся в водной среде, для орального высвобождения по меньшей мере одного действующего вещества, включающая полимерную матрицу в виде имеющей полые пространства затвердевшей пены, а также по меньшей мере одно фармацевтическое действующее вещество, отличающаяся тем, что указанная лекарственная форма обладает массой в пересчете на единицу площади в интервале от 150 до 220 г/м2, причем матричный полимер представляет собой водорастворимый полимер в виде поливинилового спирта, и причем количество действующего вещества в лекарственной форме составляет от более 50 до 100 мг.
2. Лекарственная форма по п. 1, отличающаяся тем, что она обладает массой в пересчете на единицу площади в интервале от 165 до 210 г/м2.
3. Лекарственная форма по п. 1, отличающаяся тем, что полые пространства изолированы друг от друга и предпочтительно находятся в виде пузырьков.
4. Лекарственная форма по п. 1, отличающаяся тем, что полые пространства соединены друг с другом и предпочтительно образуют канальную систему, пронизывающую полимерную матрицу.
5. Лекарственная форма по п. 1, отличающаяся тем, что полые пространства заполнены воздухом или газом, предпочтительно инертным газом, особенно предпочтительно азотом, диоксидом углерода, гелием, смесью этих газов или смесью нескольких этих газов.
6. Лекарственная форма по п. 1, отличающаяся тем, что объемная доля полых пространств составляет от 5 до 98%, предпочтительно от 50 до 80%, в пересчете на общий объем лекарственной формы.
7. Лекарственная форма по п. 1, отличающаяся тем, что она выполнена в виде пастилки, причем толщина лекарственной формы предпочтительно составляет от 100 мкм до 5 мм, особенно предпочтительно от 0,5 до 3 мм.
8. Лекарственная форма по п. 1, отличающаяся тем, что фармацевтическое действующее вещество содержит кетамин предпочтительно в виде S-кетамина, или декстрометорфан, или их фармацевтически приемлемую соль.
9. Лекарственная форма по п. 1, отличающаяся тем, что содержание фармацевтического действующего вещества в ней находится в интервале от 38 до 60% масс., предпочтительно от 42 до 55% масс., особенно предпочтительно от 45 до 52% масс., в пересчете на общий вес лекарственной формы.
10. Лекарственная форма по одному из пп. 1-9, отличающаяся тем, что указанная лекарственная форма содержит маскирующий вкус компонент, предпочтительно в виде ионообменной смолы.
11. Способ получения лекарственной формы по одному из пп. 1-10, включающий:
- приготовление раствора или дисперсии, содержащего(-ей) по меньшей мере один матричный полимер и по меньшей мере одно фармацевтическое действующее вещество,
- вспенивание раствора или дисперсии посредством введения газа или газовой смеси, или химического генерирования газа или снижения давления растворенного газа,
- нанесение вспененного раствора или дисперсии на подложку для покрытия, и
- затвердевание нанесенного раствора или дисперсии, обусловленное сушкой и удалением растворителя.
12. Способ получения лекарственной формы по одному из пп. 1-10, включающий:
a) приготовление раствора или дисперсии, содержащего(-ей) по меньшей мере один матричный полимер и по меньшей мере одно фармацевтическое действующее вещество,
b) добавление вспомогательного вещества или комбинации вспомогательных веществ, способных к газообразованию,
c) нанесение раствора или дисперсии на подложку для покрытия, и
d) затвердевание нанесенного раствора или дисперсии, обусловленное сушкой и удалением растворителя.
13. Способ получения лекарственной формы по одному из пп. 1-10, включающий:
a) приготовление содержащего полимер расплава (hot melt), который содержит по меньшей мере один матричный полимер и по меньшей мере одно фармацевтическое действующее вещество,
b) вспенивание расплава посредством введения газа или газовой смеси, или химического генерирования газа или снижения давления растворенного газа,
c) нанесение расплава на подложку для покрытия, и
d) обусловленное охлаждением затвердевание пленки.
14. Способ по одному из пп. 11-13, отличающийся тем, что стадии с) и d) заменяют или модифицируют следующими стадиями е) и f):
e) приготовление из раствора или дисперсии, соответственно из расплава, полимерной матрицы в виде блока,
f) резка затвердевшего блока для получения плоскостных лекарственных форм.
15. Применение лекарственной формы по одному из пп. 1-10 или лекарственной формы, полученной способом по одному из пп. 13, 14, для введения фармацевтических действующих веществ в ротовой полости.
16. Лекарственная форма по одному из пп. 8-10, содержащая кетамин, S-кетамин или их фармацевтически приемлемую соль, для терапевтического или профилактического лечения болей, предпочтительно хронических болей, или депрессий.
17. Лекарственная форма по одному из пп. 8-10, содержащая декстрометорфан или его фармацевтически приемлемую соль, для терапевтического или профилактического лечения кашля, нарушений эмоциональной регуляции или амиотрофического бокового склероза.
| СПОСОБ ПОЛУЧЕНИЯ ХЛОРИСТОГО АММОНИЯ и ТЕХНИЧЕСКОЙ ПОВАРЕННОЙ СОЛИ | 0 |
|
SU202085A1 |
| WO 02066016 A2, 2002.08.29 | |||
| US 6117437 A, 2000.09.12 | |||
| Robert A Schoevers et al., Oral ketamine for the treatment of pain and treatment-resistant depression, Br J Psychiatry | |||
| Токарный резец | 1924 |
|
SU2016A1 |
| Ariel Millera et al., Therapeutic use of dextromethorphan: Key learnings from treatment of pseudobulbar affect, Journal | |||
Авторы
Даты
2024-09-12—Публикация
2018-06-07—Подача