Изобретение относится к медицине, а именно аллергологии и иммунологии, к оториноларингологии и может быть использовано для персонализированного выбора вида генно-инженерной биологической терапии (анти-IgE или анти-IL4R,13 или анти-IL5 терапии) при лечении хронических воспалительных заболеваний носа и околоносовых пазух.
В настоящее время международный согласительный документ EPOS 2020 дает рекомендации по отбору пациентов на таргетную терапию, но не дает рекомендаций, какой вид таргетной терапии выбирать в зависимости от фенотипа хронических воспалительных заболеваний носа и околоносовых пазух (ХВЗН): анти-IgE или анти-IL4R,13 или анти-IL5 терапию [1]. Кроме этого, ни одна из предложенных ныне классификаций ХВЗН также не позволяет осуществить персонализированный выбор ГИБТ.
В согласительном документе EPOS 2020 была предложена классификация хронического риносинусита, включающая следующие варианты (не являются взаимоисключающими):
1) хронический аллергический ринит (АР) с синуситом;
2) хронический эозинофильный риносинусит с назальными полипами;
3) хронический нейтрофильный риносинусит с назальными полипами;
4) хронический риносинусит без назальных полипов;
5) аллергический риносинусит с грибковой гиперчувствительностью;
6) хронический риносинусит, ассоциированный с другими системными заболеваниями.
Использование данной классификации недоступно для многих клиницистов, так как включает довольно обширный объем специфических исследований.
Известна классификация, предложенная группой ученых университета Маккуори (Сидней) [2], она предполагает деление ХРС на 3 группы:
1. Аллергическое (IgE-опосредованное) воспаление дыхательных путей.
2. Эозинофильное воспаление дыхательных путей.
3. Не эозинофильное воспаление дыхательных путей.
По данной классификации в первую группу входят пациенты с ранним дебютом назальных симптомов (до 20 лет), у которых, как правило, не отмечается аносмия, и которые имеют сопутствующую аллергопатологию (бронхиальная астма в детском возрасте, атопический дерматит, симптомы конъюнктивита). При оценке сенсибилизации - это, зачастую, моносенсибилизированные пациенты с бытовой аллергией. Также, эти пациенты имеют специфическую эндоскопическую (отек средней носовой раковины, возможно, полипоидные изменения носовых раковин и перегородки, отсутствие густого муцина) и гистологическую картину (повышенная тканевая эозинофилия, часто без активации (нет эозинофильных агрегатов и кристаллов Шарко-Лейдена)), в лабораторных анализах часто - нормальный уровень эозинофилов в общем анализе крови, повышенный общий и специфический IgE. При проведении рентгенографии придаточных пазух носа (ППН) часто отмечается центральное утолщение перегородки и носовых раковин, снижающееся к периферии. Ко второй группе относятся пациенты с дебютом симптомов в среднем 30-50 лет; иногда дебют - после респираторного вируса. Такие пациенты не отмечают симптомов ринита до этого периода или, если имеют аллергию, то она, как правило, ограничивается детским возрастом, аносмия с положительным ответом на лечение глюкокортикостероидами. Часто пациенты данной группы отмечают обострение симптомов, вызванные приемом пищи и алкоголем. Бронхиальная астма (БА) возникает одновременно с клиникой ХРС. При эндоскопии отмечаются: множественные полипы мелкие и крупные среднего носового хода, эозинофильный муцин, вторичный гнойный. При лучевой диагностике - пансинусит. Также характерны: повышенная тканевая эозинофилия (>10 клеток в поле зрения), эозинофильные агрегаты и кристаллы Шарко-Лейдена, эозинофилия сыворотки крови. При проведении аллергодиагностики: либо отрицательные результаты sIgE, либо определяется полисенсибилизация. Для третьей группы пациентов характерно начало назальных симптомов в возрасте старше 50 лет, преимущественно женского пола, страдающие ожирением, часто отмечают кашель. БА у таких пациентов, как правило, плохо отвечает на лечение глюкокортикостероидами. На рентгенограммах придаточных пазух носа (ППН) картина не отличима от эозинофильного воспаления (пансинусит). При эндоскопии: визуализируются полипы или полипоидный отек, гнойные выделения, нет эозинофильного муцина; при лабораторном обследовании/скарификационных кожных тестах - без сенсибилизации, тканевой эозинофилии.
Приводя данную классификацию, авторы допускают дальнейшие вариации в подходах к фенотипированию ХРС.
В утвержденных в 2014 году Клинических рекомендациях (КР) (Российская Федерация) по лечению полипозного риносинусита (ПРС), где последний рассматривается, как синдром, была предложена классификация Г.З. Пискунова (позже была дополнена) [3], в ней особая роль уделялась нарушению аэродинамики полости носа. Автор предложил разделить ПРС с учетом этиопатогенетического принципа на следующие группы:
1. ПРС в результате нарушения аэродинамики в полости носа и околоносовых пазух.
2. ПРС в результате хронического гнойного воспаления слизистой оболочки полости носа и околоносовых пазух.
3. ПРС в результате грибкового поражения слизистой оболочки.
4. ПРС в сочетании с бронхиальной астмой.
5. ПРС при муковисцидозе и синдроме Картагенера.
Однако и здесь существуют сложности определения фенотипа. По данным эпидемиологических исследований, среди больных ПРС БА диагностируют в 45-76% случаев. Стоит отметить, что у части пациентов дебют болезни может начинаться с развития назальных полипов и только со временем присоединяется легочная симптоматика, а у 10% больных данные заболевания дыхательных путей выявлялись одновременно. Таким образом, фенотип может меняться со временем, за счет чего прогнозирование тяжелого течения у впервые выявленного пациента весьма затруднительно.
В отечественных клинических рекомендациях от 2019 года (не утверждены, представлены для рассмотрения) - не приводится классификация ПРС по этиологическому принципу, но отмечаются эндоскопическая картина, выраженность обтурации, гистологические различия, и дается комментарий о том, что единая классификация ПРС в настоящее время отсутствует [4]. С учетом этого обстоятельства, представленные варианты стадирования патологического процесса рекомендуются в качестве инструмента, способствующего формулированию клинического диагноза, определению лечебной тактики и оценке ее эффективности.
Таким образом, в настоящее время отсутствует простой понятный и доступный для практических врачей механизм персонализированного выбора вида ГИБТ для больных с ХВЗН, которым, согласно рекомендациям EPOS 2020, показана таргетная терапия.
Задача изобретения - Унифицировать, оптимизировать и упростить выделение фенотипов хронических воспалительных заболеваний носа и околоносовых пазух для персонализированного выбора вида генно-инженерной биологической терапии (анти-IgE или анти-IL4R,13 или анти-IL5 терапии), при наличии показаний к таргетной терапии.
Сущность изобретения
Оптимизация выделения фенотипов ХВЗН, в основе которых лежит Т2-воспаление, осуществляется на основе показателей по трем направлениям: аллергический, эозинофильный фенотипы и дополнительно смешанный, что повышает точность фенотипирования пациента.
При исследовании все пациенты, отобранные для проведения иммунобиологической терапии, имели признаки Т2-воспаления, определенные EPOS 2020 (наличие сенсибилизации с положительным аллергоанамнезом и/или эозинофилию периферической крови ≥250 кл/мкл, и/или эозинофилы в назальном секрете >10 клеток в поле зрения), что обусловлено фармакологическими свойствами генно-инженерных биофармацевтических препаратов (ГИБП), используемых в настоящее время для лечения ХВЗН.
Диагноз аллергический ринит определялся по данным клинико-аллергологического обследования, согласно клиническим рекомендациям по АР, утвержденным в 2018 г. с последующими изменениями [5, 6]. Критерии диагноза: наличие ежедневно проявляющихся в течение часа и более хотя бы двух из следующих симптомов: заложенность (обструкция) носа, выделения из носа (ринорея), чихание, зуд в полости носа, развивающиеся под действием аллергена; или наличие положительного аллергологического анамнеза в сочетании с положительными кожными аллерготестами; или сочетание положительного аллергоанамнеза и положительного клинически значимого специфического IgE; или положительный аллергоанамнез в сочетании с положительным тестом на ингаляционные аллергены Фадиатоп.
В настоящее время для диагностики АР используются 3 основных метода: сбор аллергологического анамнеза, проведение кожных аллергопроб и определение специфических иммуноглобулинов Е (IgE) к подозреваемым по анамнезу аллергенам.
Сбор аллергологического анамнеза включает:
• выявление четкой связи развития болезни и ее манифестации с воздействием определенного причинного фактора (аллергена), исчезновение симптомов при элиминации этого фактора и возобновление симптомов при повторном контакте;
• выявление предположительно этиологически значимых аллергенов;
• выявление факторов риска, способствующих развитию аллергического заболевания;
• выявление наследственной предрасположенности к аллергическим заболеваниям (наличие у близких родственников бронхиальной астмы и/или аллергического ринита и/или экземы и/или крапивницы, отека Квинке, наличие гиперчувствительности к пищевым продуктам и/или лекарственным средствам, насекомым); у больных аллергическими заболеваниями наследственная предрасположенность к аллергическим заболеваниям встречается в 2-3 раза чаще, чем у здоровых лиц;
• определение наличия у пациента других аллергических заболеваний;
• выявление влияния факторов окружающей среды (климата, погоды, физических факторов) на развитие и течение заболевания;
• определение сезонности симптомов заболевания;
• выявление влияния бытовых факторов на развитие и течение заболевания - сырость в помещении, наличие мягкой мебели и ковров, домашних животных, рыб и птиц;
• определение связи симптомов с приемом пищи и/или лекарственными препаратами, с профессиональными факторами;
• оценка клинического эффекта от применения противоаллергических средств и/или элиминации аллергенов.
При оценке данных аллергологического анамнеза делается предположение о вероятном наличии АР.
Аллергический механизм развития должен быть подтвержден результатами кожных проб и/или специфическими IgE. Кожные пробы выполняются чаще всего на внутренней поверхности предплечья скарификацией поверхностных слоев кожи (или методом укола) и нанесением капель стандартизованных аллергенов в места скарификации. Оценка результатов происходит через 20 минут экспозиции аллергенов в соответствии с данными таблицы №1.
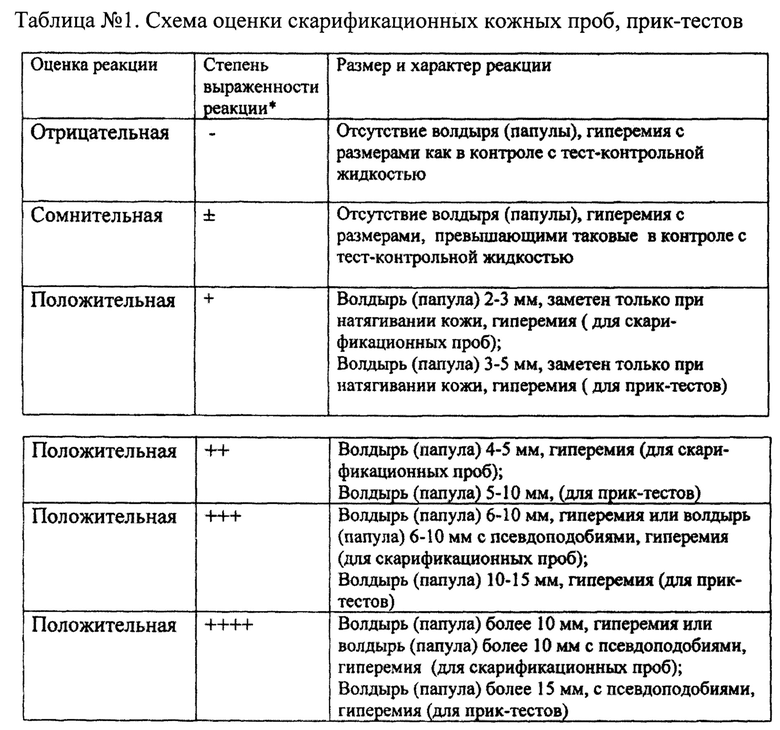
Положительные кожные пробы (от + до ++++) выявляют причинно-значимый аллерген в случае сочетания с данными анамнеза. Если при сборе анамнеза пациент не отмечает связи симптомов астмы с воздействием аллергена, на который получен положительный результат кожных проб, то данная сенсибилизация расценивается как латентная (клинически незначимая). При невозможности проведения кожных аллергопроб или при несовпадении результатов кожного тестирования с данными аллергоанамнеза, проводят определение специфических IgE к аллергенам в крови. Пациент сдает венозную кровь. Результат считается положительным при уровне специфического IgE≥0,35 kUA/l. Клиническая значимость выявленной сенсибилизации также оценивается в совокупности с данными аллергоанамнеза.
Спектр аллергенов, используемых в диагностике, зависит от данных аллергоанамнеза. Так, в случае вероятного АР необходимо определять специфические IgE к респираторным аллергенам: бытовым (домашняя пыль, библиотечная пыль, клещи домашней пыли), эпидермальным (аллергены кошки, собаки и других животных), пыльцевым (пыльца деревьев, луговых и сорных трав), аллергенам плесневых грибков.
Диагноз хронического риносинусита (ХРС) устанавливается, согласно критериям EPOS 2020: не менее 12 недель сохранение двух или более симптомов, к которым относятся заложенность носа / затрудненное носовое дыхание; выделения из носа (передняя/задняя ринорея); боль / давление в области лица; снижение или потеря обоняния; наличие назальных полипов подтверждается в ходе эндоскопического осмотра полости носа и/или по результатам компьютерной томографии придаточных пазух носа (снижение пневматизации пазух носа за счет утолщенной полипозной слизистой оболочки).
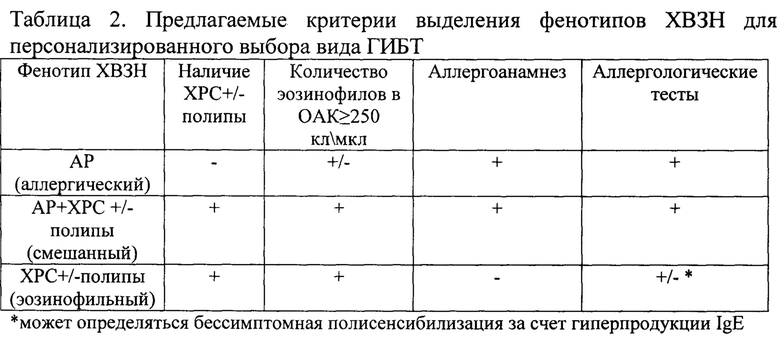
Таким образом, при использовании вышеописанных критериев для определения фенотипа и введении смешанного типа ХВЗН возможно более точное фенотипирование пациентов. Данный подход к классификации можно рекомендовать в клиническую практику, как способ отбора пациентов с ХВЗН для проведения иммунобиологической терапии.
Осуществление изобретения
Пример 1. Пациентка Б., 35 лет, отмечает эпизоды бронхообструктивного синдрома с раннего возраста. Диагноз бронхиальной астмы выставлен в 1 год, тогда же отмечались симптомы риноконъюнктивита, которые возникали при контакте с домашними животными. С 3 лет аналогичная клиника - в мае ежегодно. Длительно отмечает при употреблении в пищу киви, грецкого ореха реакцию по типу орального аллергического синдрома. У бабушки пациентки - атопический дерматит. В детстве по поводу астмы получала терапию низкими дозами ингаляционных глюкокортикостероидов (ИГКС) с контролем симптомов. В подростковом возрасте проводились кожные пробы с бытовыми, эпидермальными, пыльцевыми аллергенами - со слов пациентки выявлена сенсибилизация на шерсть кошки, собаки, пыльцу деревьев, домашнюю пыль (бланк с результатами утерян). С этого периода отмечает ухудшение течения астмы - стали появляться эпизоды обострений во время ОРВИ и в период цветения деревьев, также нарастала выраженность риноконънктивита, что требовало назначения системных ГКС, госпитализаций. Последние 3 года получает терапию 4-й ступени: средние дозы ИГКС + длительно действующий В2-агонист (ДДБА), круглогодично потребность в сальбутамоле 3-4 р/сут, ночные симптомы 2-3 р/нед, обострения 2 р/год с в/в введением ГКС, в отношении назальных симптомов: на постоянной основе - интраназальные ГКС (мометазона фуроат) в дозе 400 мкг/сут, монтелукаст, антигистаминные препараты. Пациентка направлен для рассмотрения вопроса о назначении генно-инженерной биологической терапии.
Результат Фадиатоп теста - 24,5 PAU/l. Уровень эозинофилов в общем клиническом анализе крови (OAK) - 200 кл/мкл. Осмотрена оториноларингологом: Аллергический ринит. Вышеперечисленные критерии указывают на аллергический механизм заболеваний, что позволяет назначить генно-инженерный биофармацевтический анти-IgE препарат, показанный при аллергической астме и аллергическом рините.
Пример 2. Пациентка Б., 62 года, страдает хроническим риносинуситом с 52 лет, тогда же появились симптомы бронхиальной астмы. За 10 лет от начала дебюта симптомов ХРС было проведено 3 полипотомии. Пациентка отрицает аллергические заболевания у себя и родственников. Реакции на животных, цветение растений, пищу и лекарства пациентка не отмечала. Проведение кожных проб противопоказано из-за неконтролируемого течения астмы. Определение специфических IgE - отрицательно. Результаты лабораторных исследований: Эозинофилы OAK - 630 кл/мкл, глистная инвазия исключена. Количество эозинофилов в OAK (630 кл/мкл), а также отрицательный аллергоанамнез и отрицательный результат обследования на специфические IgE подтверждают неаллергический (эозинофильный) фенотип ХВЗН. Пациентке показан препарат анти-IL5.
Пример 3. Пациентка К., 71 год, страдает хроническим риносинуситом с 28 лет. С 1980 года было проведено 5 полипотомий. Больная отмечает симптомы ринита при контакте с пыльцевыми и эпидермальными аллергенами. По результатам скарификационных кожных тестов выявлена сенсибилизация к бытовым, эпидермальным, пыльцевым аллергенам. Наследственность по атопии отягощена: у матери, сестры - аллергический ринит. Профессиональных вредностей - нет. Непереносимости лекарственных препаратов не отмечает. Результаты лабораторных исследований: Эозинофилы OAK - 719 кл/мкл, глистная инвазия исключена. Результат Фадиатоп теста - 10,3 PAU/l.
Количество эозинофилов в OAK (719 кл/мкл), а также положительные результаты скарификационных кожных тестов, фадиатопа в сочетании с данными аллергоанамнеза, подтверждающими клиническую значимость сенсибилизации подтверждают смешанный фенотип ХВЗН. Пациентке показан препарат анти-IL4R,13.
Таким образом, использование предлагаемых критериев позволяет упростить проведение фенотипирования ХВЗН, что важно для выбора иммунобиологического препарата при лечении, кроме того, данный способ достаточно прост, а также не требует большого объема обследования.
Список литературы
1. Fokkens W., Lund V., Hopkins С. et al. European Position Paper on Rhinosinusitis and Nasal Polyps 2020 // Rhinology. 2020; 58(Suppl S29):1-464. doi: 10.4193/Rhin20.600. PMID: 32077450.
2. Grayson J.W., Cavada M., Harvey R.J. Clinically relevant phenotypes in chronic rhinosinusitis // Journal of Otolaryngology - Head & Neck Surgery. 2019; 1 (48): 23.
3. Пискунов Г.З. Клинические фенотипы полипозного риносинусита // Российская ринология. 2019; 4 (27): 224.
4. Полипозный риносинусит. Клинические рекомендации. Российская ассоциация оториноларингологов, 2019. Режим доступа: https://clck.ru/34NX9s. Дата обращения: 10.05.2023
5. Аллергический ринит. Клинические рекомендации. Российская ассоциация аллергологов и клинических иммунологов, 2018. Режим доступа: https://nrcii.ru/docs/2.allergic_rhinitis.pdf. Дата обращения: 15.01.2022.
6. Аллергический ринит. Клинические рекомендации. 2020. Российская ассоциация аллергологов и клинических иммунологов, Национальная медицинская ассоциация оториноларингологов, Союз педиатров России. Режим доступа: https://cr.minzdrav.gov.ru/recomend/261_1. Дата обращения: 10.05.2023.
Изобретение относится к медицине, а именно аллергологии и иммунологии, к оториноларингологии, и может быть использовано для персонализированного выбора вида генно-инженерной биологической терапии при лечении хронических воспалительных заболеваний носа и околоносовых пазух. При наличии показаний к таргетной терапии у пациента выявляют наличие хронического риносинусита с полипами или без полипов, количество эозинофилов в общем анализе крови - OAK, исследуют аллергоанамнез и проводят аллергологические тесты. Затем определяют фенотип хронических воспалительных заболеваний. Аллергический фенотип: отсутствие хронического риносинусита, наличие эозинофилов в OAK, положительные аллергоанамнез и аллергологические тесты. Смешанный фенотип: наличие хронического риносинусита с полипами или без полипов, количество эозинофилов в ОАК≥250 кл/мкл, положительные аллергоанамнез и аллергологические тесты. Эзинофильный фенотип: наличие хронического риносинусита с полипами или без полипов, количество эозинофилов в ОАК≥250 кл/мкл, отрицательные аллергоанамнез и аллергологические тесты. Изобретение обеспечивает повышение точности и упрощение выделения фенотипов хронических воспалительных заболеваний носа и околоносовых пазух для персонализированного выбора вида генно-инженерной биологической терапии при наличии показаний к таргетной терапии. 2 табл., 3 пр.
Способ определения фенотипа хронических воспалительных заболеваний носа и околоносовых пазух, характеризующийся тем, что при наличии показаний к таргетной терапии у пациента выявляют наличие хронического риносинусита с полипами или без полипов, количество эозинофилов в общем анализе крови - OAK, исследуют аллергоанамнез и проводят аллергологические тесты, после чего по этим критериям определяют фенотип хронических воспалительных заболеваний:
- аллергический фенотип: отсутствие хронического риносинусита, наличие эозинофилов в OAK, положительные аллергоанамнез и аллергологические тесты;
- смешанный фенотип: наличие хронического риносинусита с полипами или без полипов, количество эозинофилов в ОАК≥250 кл/мкл, положительные аллергоанамнез и аллергологические тесты;
- эозинофильный фенотип: наличие хронического риносинусита с полипами или без полипов, количество эозинофилов в ОАК≥250 кл/мкл, отрицательные аллергоанамнез и аллергологические тесты.
| СПОСОБ ДИАГНОСТИКИ ОСТРОГО И ХРОНИЧЕСКОГО РИНОСИНУСИТА | 2011 |
|
RU2465594C1 |
| СПОСОБ ДИФФЕРЕНЦИАЛЬНОЙ ДИАГНОСТИКИ ОСТРОГО РИНОСИНУСИТА | 2016 |
|
RU2617044C1 |
| CA 3087630 A1, 25.04.2019 | |||
| CN 105849280 B, 06.11.2020 | |||
| Киселева Д.В., Бельтюков Е.К., Наумова В.В | |||
| Клинико-аллергологическая характеристика хронических воспалительных заболеваний носа у пациентов с тяжелой бронхиальной астмой, получающих иммунобиологическую терапию в Свердловской области | |||
Авторы
Даты
2024-09-17—Публикация
2023-07-07—Подача