1. Область техники, к которой относится изобретение
Изобретение представляет собой применение соединения класса пиридо[1,2-а]индола 1 (Фиг. 1) в качестве противоракового агента и может использоваться в практике исследовательских и медицинских лабораторий для подавления жизнедеятельности опухолевых клеток, в частности клеток глиобластомы, in vitro.
2. Уровень техники
Превращение нормальной клетки в опухолевую сопровождается различными мутациями изменениями нуклеотидной последовательности генов. Все злокачественные новообразования содержат результаты генетических событий, приводящих к активации онкогенов и инактивации генов-супрессоров опухолевого роста. Известно, что нарушение запрограммированной гибели клеток приводит к неконтролируемому росту. Одним из перспективных способов влияния на развитие онкопатологии является воздействия на злокачественно перерожденные клетки азолопиридоиндолами, сопровождающееся прекращением неконтролируемого роста опухолевых клеток [Gour J. et al. Facile synthesis of 1, 2, 3-triazole-fused indolo-and pyrrolo [1,4] diazepines, DNA-binding and evaluation of their anticancer activity //Bioorganic chemistry. - 2019. - T. 93. - C. 103306. doi: 10.1016/j.bioorg.2019.103306].
Термин мультиформная глиобластома был введен Кушингом во второй половине девятнадцатого века [Urbanska К. et al. Glioblastoma multiforme an overview // Contemporary Oncology/Wspolczesna Onkologia. - 2014. - T. 18. - №. 5. - C. 307-312. doi: 10.5114/wo.2014.40559]. Сегодня глиомы составляют более 50% всех опухолей головного мозга и являются наиболее распространенными первичными опухолями головного мозга у взрослых [Lefranc F., Brotchi J., Kiss R. Possible future issues in the treatment of glioblastomas: special emphasis on cell migration and the resistance of migrating glioblastoma cells to apoptosis // Journal of clinical oncology. - 2005. - T. 23. - №. 10. - C. 2411-2422. doi: 10.1200/JCO.2005.03.089]. Стандартная схема лечения глиобластом чаще всего включает темозоломид. Механизм действия препарата основан на присоединении соединения с алкильной группой к ДНК и, как следствие, нарушении структуры ДНК и невозможности деления злокачественной клетки [Friedman Н.S., Kerby Т., Calvert Н. Temozolomide and treatment of malignant glioma // Clinical cancer research. 2000. - T. 6. - №. 7. - C. 2585-2597; Zhang J., FG Stevens M., D Bradshaw T. Temozolomide: mechanisms of action, repair and resistance // Current molecular pharmacology. - 2012. - T. 5. - №. 1. C. 102-114. doi: 10.2174/1874467211205010102]. Однако, по меньшей мере, 50% пациентов, получающих темозоломид, не демонстрируют достаточной эффективности лечебных мероприятий. Это происходит, в первую очередь, из-за избыточной экспрессии О6-метилгуанин-метилтрансферазы и/или отсутствия пути репарации ДНК в клетках глиобластомы [Lee S.Y. Temozolomide resistance in glioblastoma multiforme // Genes & diseases. - 2016. - T. 3. - №. 3. - C. 198 210. doi: 10.1016/j.gendis.2016.04.007]. Более того, темозоломид обладаетрядом выраженных побочных эффектов, таких как тошнота, рвота, тромбоцитопения, нейтропения, миелодиспластический синдром и апластическая анемия [Dixit S. et al. Temozolomide-related idiosyncratic and other uncommon toxicities: a systematic review // Anti-cancer drugs. - 2012. - T. 23. -№. 10. - C. 1099-1106.]. Необходим поиск противоопухолевых средств, позволяющих избегать интоксикации и вызывать иной путь программированной гибели опухолевой клетки, обходя возникновение резистентности. Возможным вариантом подавления активности опухолевых клеток является применение соединений класса азолопиридоиндолов.
Значительная часть соединений, обладающих целевой структурой пиридо[1,2-а]индолов, обладает противоопухолевой активностью [Journal of Pharmaceutical Sciences; vol. 27; nb. 2; (2019); p. 613; European Journal of Medicinal Chemistry; vol. 223; (2021); Art. No: 113656]. Между тем механизмы ингибирования опухолевого роста остаются неясными. Показана возможность влияния соединений близкой структуры на клеточный цикл в виде его остановки в фазах G2 и S с последующей индукцией апоптотических процессов [Iqbal J. et al. Exploration of quinolone and quinoline derivatives as potential anticancer agents //DARU Journal of Pharmaceutical Sciences. - 2019. - T. 27. - №. 2. - C. 613-626]. В работе [Zhidkov M. E., Sidorova M.A., Lyakhova I.A. One-step transformation of the marine alkaloid fascaplysin into homofascaplysins В and B-1. The first syntheses of 3-bromohomofascaplysin В and 3 bromohomofascaplysin B-l //Tetrahedron Letters. 2018. T. 59. - №. 14. - C. 1417-1420] отмечается возможность влияния на метаболические внутриклеточные пути через пируватдегидрогеназу, управляющую митохондриальным образованием ацетил-КоА из пирувата одной из важнейших катаболических реакций клетки. Кроме того, описано действие соединений данного класса на активность белков, осуществляющих эпигенетическую регуляцию экспрессии генов [патент WO 2012/7007; (2012); (А1)]. Предполагается, что данные регуляторные системы могут иметь существенную роль в онтогенезе, эмбриогенезе, а также в механизмах канцерогенеза.
Поскольку в обозримой научной литературе не было обнаружено близкого подобия заявляемого изобретения, нами предлагается применение 10-(1Н-1,2,3-триазол-1-ил)пиридо[1,2-а]индола 1 (Фиг. 1) в качестве избирательного ингибитора жизнедеятельности клеток злокачественных новообразований.
3. Сущность изобретения
Сущность изобретения заключается в применении соединения 1 для ингибирования клеток злокачественных новообразований в концентрации токсической для неопластических клеток человека и неэффективной для нормальных in vitro. Концентрация полу-максимального ингибирования составляет 7,78±1,34 μМ (IC50±SE) для клеток глиобластомы (А-172), в то время как эффекта на нормальных клетках почки эмбриона человека (НЕК-293) не наблюдается и IC50 >128 μМ, что подтверждено в плане эффективности и избирательности в дополнительных анализах с флуоресцентными красителями, такими как акридиновый оранжевый и этидия бромид, Annexin V-FITC/PI и JC-1.
4. Сведения, подтверждающие возможность осуществления изобретения
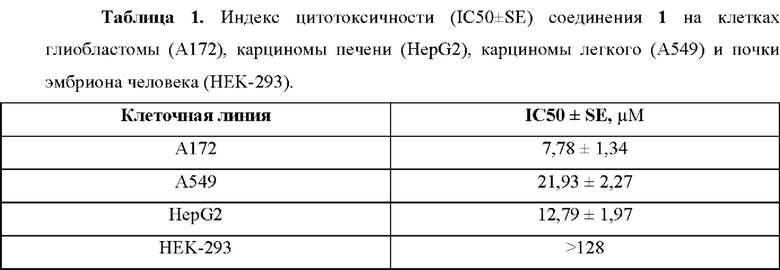
Синтез соединения 1 был осуществлен по описанной ранее методике [Kopchuk D.S. et al. Studies on the interactions of 5-R-3-(2-pyridyl)-l,2,4-triazines with arynes: inverse demand aza-Diels Alder reaction versus aryne-mediated domino process // Organic and Biomolecular Chemistry. - 2018. -T. 16. - C. 5119-5135. doi: 10.1039/c8ob00847g] посредством домино-трансформации исходного 3-(2-пиридил)-6-фенил-5-циано-1,2,4-триазина 2 в реакции с генерируемым in situ из антраниловой кислоты 1,2-дегидробензолом (Фиг. 1).
Последующая оценка биологической активности проводится посредством МТТ-теста, позволяющего определить токсическую дозу для опухолевых клеток при сохранении жизнедеятельности нормальных клеток на максимальном уровне; полученная концентрация используется для ингибирования клеток злокачественных новообразований in vitro.
4.1. Определение цитотоксичности и оценка избирательности действия 10-(4-фенил-5-циано-1H-1,2,3-триазол-1-ил)пиридо[1,2-a]индола в отношении подавления жизнедеятельности клеток злокачественных новообразований
Исследования по заявляемому изобретению были выполнены на культивируемых клетках глиобластомы человека (А172, АТСС CRL 1620), карциномы легкого человека (А549, АТСС CCL 185), карциномы печени человека (HepG2, АТСС НВ 8065) и почки эмбриона человека (НЕК-293, АТСС CRL 1573), полученных из ЦКП «Коллекция культур клеток позвоночных» Института цитологии РАН (Россия, г. Санкт-Петербург). Клетки культивировали с использованием среды DMEM/F-12 (Gibco,™ Thermo Fisher Scientific, USA) с содержанием 10% фетальной бычьей сыворотки (Gibco,™ Thermo Fisher Scientific, USA) при 37°C, 5% CO2 и 98% влажности. Субкультивирование с применением раствора трипсина 0.25% (Biolot Ltd., St. Petersburg, Russia) проводили при достижении культурой ≥90% конфлюентности.
Влияние соединения 1 и его избирательность в отношении опухолевых клеток оценивали с помощью МТТ-теста. Клетки рассеивали в лунки 96-луночного планшета в посевной концентрации 4×103 клеток на лунку за день до внесения вещества. Через 24 часа в лунки планшета вносили соединение в заданном диапазоне концентраций. Затем клетки инкубировали в течение 24 часов, после чего в культуры вносили раствор МТТ (3-(4,5-Dimethyl-2-thiazolyl)-2,5-diphenyl-2H-tetrazolium bromide) по 20 μL (5 mg/mL) на лунку. Через 2 часа из лунок удаляли среду и добавляли по 200 μL смеси ДМСО и изопропанола, 1:1. Оптическую плотность измеряли на планшетном спектрофотометре при длине волны 570 нм.
Статистическая обработка данных была проведена в программе RStudio (Version 2022.07.01 © 2009-2022 RStudio, РВС) с использованием пакета R (version 4.2.1.). Индекс цитотоксичности (IC50) рассчитан с построением кривых доза-эффект с помощью пакета «drc» [Ritz, С., Baty, F., Streibig, J.С., Gerhard, D. (2015) Dose-Response Analysis Using R PLOS ONE, 10(12), e0146021]. Данные представлены в виде среднего арифметического ± стандартная ошибка (SE).
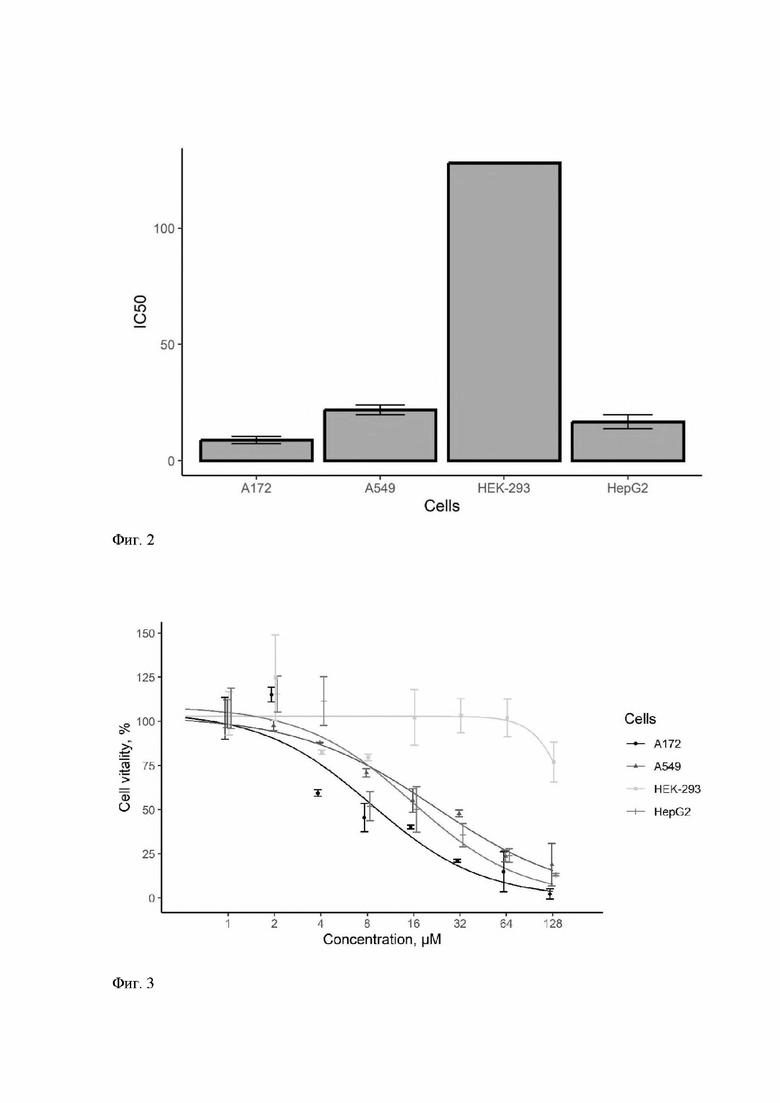
Результаты МТТ-теста, представленные в табл. 1, показали выраженную избирательность соединения 1 в отношении ингибирования жизнедеятельности клеток злокачественных новообразований, в особенности против клеток глиобластомы А172 (Фиг. 2).
Построение кривых ингибирования клеточного роста (Фиг. 3) позволила подтвердить избирательность соединения 1 в отношении клеток опухолевого генеза и установить концентрацию/дозу подавления жизнеспособности клеток глиобластомы А172 при которой большая часть неопластических клеток погибает, а нормальные клетки сохраняют свою жизнеспособность. Цитотоксическая доза составила 16 μМ.
4.2. Подтверждение избирательности действия 10-(4-фенил-5-циано-1H-1,2,3-триазол-1-ил)пиридо[1,2-a]индола посредством флуоресцентного окрашивания клеточных культур
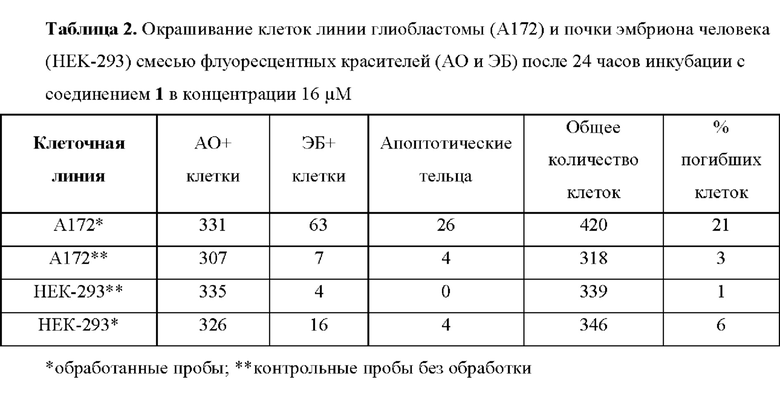
Для оценки клеточной гибели при воздействии выбранной концентрации использовали метод окрашивания смесью флуоресцентных красителей витального акридинового оранжевого (АО) и этидия бромида (ЭБ) в концентрациях 5 мкг/мл и 15 мкг/мл соответственно. Культуры клеток рассаживали в чашки Петри за день до внесения исследуемого вещества и инкубировали. Затем вносили суспензию соединения 1 в культуральной среде в концентрации 16 μМ. Клетки инкубировали в течение 24 часов. Далее клетки снимали и осаждали для каждого образца в центрифуге при 200g 5 мин. Осадок ресуспендировали в 25 мкл фосфатного буфера, имеющего температуру от +25°С и к полученной суспензии, добавляли 25 мкл свежеприготовленной смеси ЭБ и АО. Сразу же после этого по 10 мкл окрашенной суспензии клеток помещали на предметное стекло, накрывали покровным стеклом и незамедлительно анализировали под флуоресцентным микроскопом XDS-3FL4 (OPTIKA, Италия).
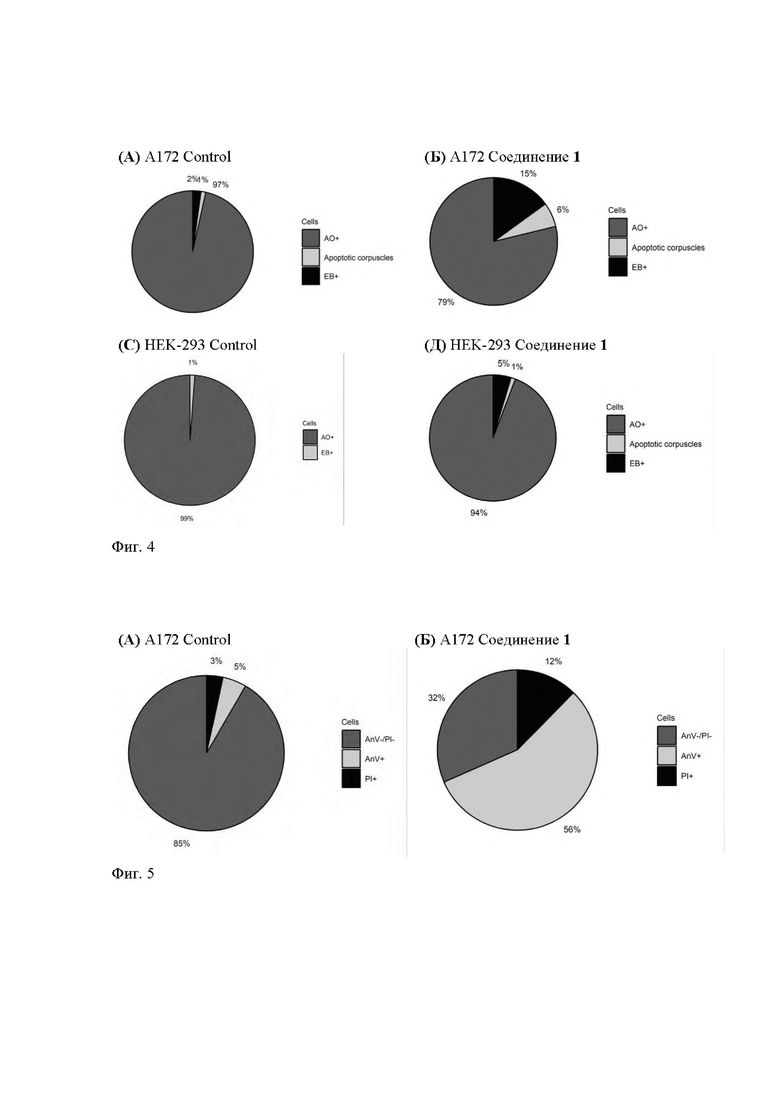
Проведение окрашивания линии А172 и линии НЕК-293 смесью флуоресцентных красителей акридинового оранжевого (АО) и этидия бромида (ЭБ) после суточного воздействия на них соединения 1 в концентрации 16 μМ подтвердило избирательность воздействия соединения на опухолевые клетки глиобластомы (Фиг. 4).
Результаты подсчета клеток представлены в Табл. 2. Суточная инкубация линии А172 с соединением 1 приводила к гибели 21% клеток, в то время как в контрольной пробе 97% клеток сохраняли свою жизнеспособность. На линии нормальных клеток НЕК-293 не наблюдалось выраженных различий между контрольной пробой и пробой, обработанной 10-(4-фенил-5-циано-1H-1,2,3-триазол-1-ил)пиридо[1,2-а]индолом (99% и 94% живых клеток соответственно).
4.3. Определение запуска программируемой клеточной гибели (апоптоза) в злокачественно перерожденных клетках под действием 10-(4-фенил-5-циано-1H-1,2,3-триазол-1-ил)пиридо[1,2-a]индола
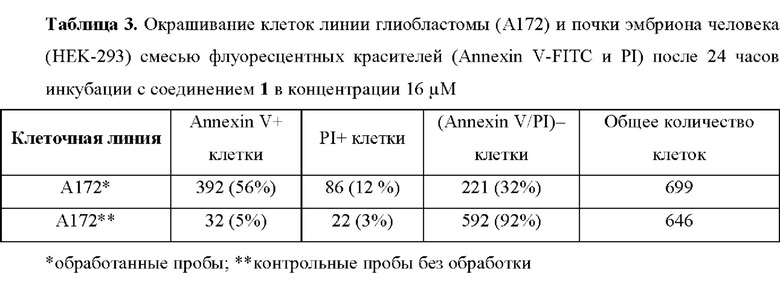
Для оценки апоптоза в клеточных культурах был использован метод окрашивания клеток а Annexin V-FITC и пропидием йодидом (PI), который был проведен в соответствии с протоколом производителя (G1511, Wuhan Servicebio Technology Co., Ltd., Китай): осадок клеток ресуспендировали в 25 мкл 1х связывающего буфера, имеющего температуру от +8°С и к полученной суспензии добавляли по 2,5 мкл каждого из флуоресцентных красителей (Annexin V-FITC и PI). После 10 минут выдержки в темноте, 10 мкл окрашенной суспензии клеток помещали в одноразовый слайд и вели подсчет клеток в автоматическом счетчике клеток С100 (RWD Life Science, Китай).
Оценка апоптоза в клеточных культурах позволила выявить значительное количество клеток глиобластомы в раннем апоптозе после их инкубации с соединением 1 (24 ч.) в концентрации 16 μМ, что подтверждает свойства соединения ингибировать рост клеток злокачественного генеза, в то время как в контрольных пробах без обработки клетки сохраняли свою жизнеспособность на максимальных уровнях (Фиг. 5). Результаты подсчета клеток с помощью автоматического счетчика представлены в Табл. 3.
4.4. Определение влияния 10-(4-фенил-5-циано-1H-1,2,3-триазол-1-ил)пиридо[1,2-а]индола на трансмембранный потенциал митохондрий в неопластических клетках
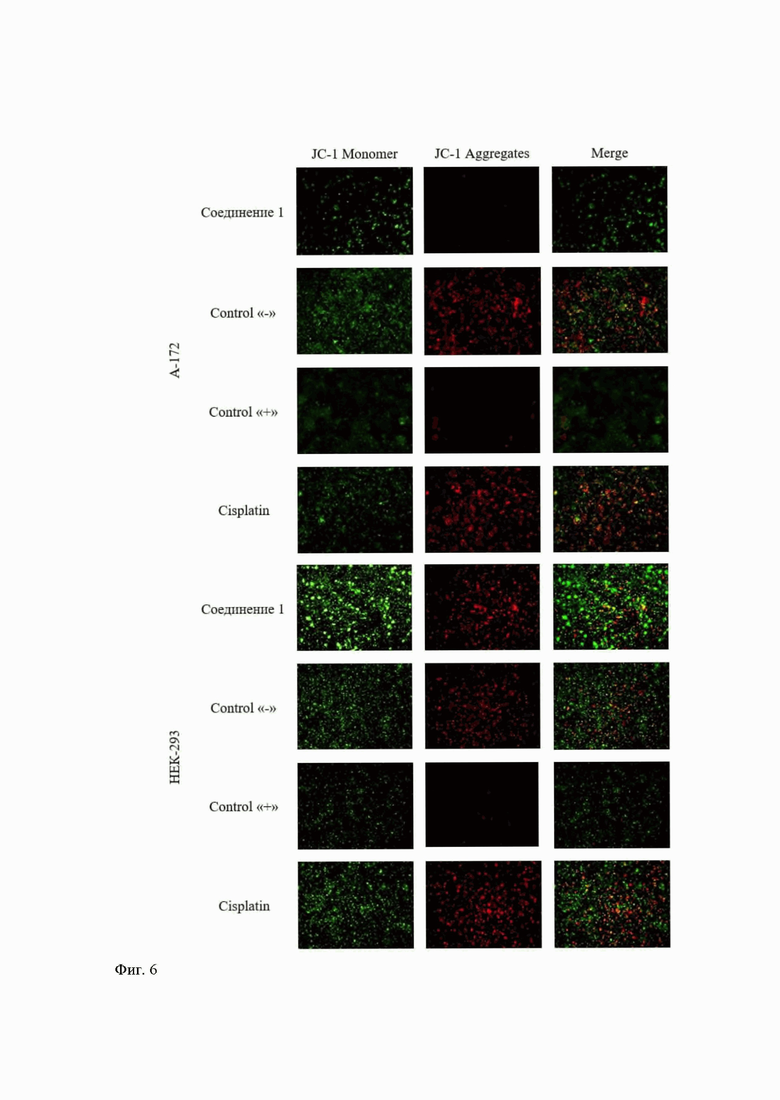
Определение трансмембранного потенциала (ΔΨm) митохондрий проводили с использованием красителя JC-1 (5,5',6,6' тетрахлоро-1,1',3,3'-тетраэтилбензимидазолил-карбоцианин йодид) согласно протоколу производителя (G1515-100T, Wuhan Servicebio Technology Co., Ltd., Китай).
Исследование митохондриального потенциала клеток под действием соединения 1 с применением красителя JC-1 показало, что клетки опухолевой линии теряют свой митохондриальный потенциал под действием вещества по уровню практически сопоставимому с положительным контролем. И в то же время соединение 1 практически не действует на митохондриальный потенциал клеток нормальной линии человека (Фиг. 6).
Представленные исследования свидетельствуют о применимости соединения 1 в качестве агента для избирательного ингибирования жизнедеятельности клеток злокачественных новообразований. Использованное решение обладает преимуществом перед существующими аналогами в связи с уникальностью структуры соединения 1 и его выраженной активностью в отношении неопластических клеток в сравнении с нормальными.
| название | год | авторы | номер документа |
|---|---|---|---|
| ХИМИЧЕСКИЙ СЕНСОР ДЛЯ ОПРЕДЕЛЕНИЯ НИТРОАРОМАТИЧЕСКИХ ВЗРЫВЧАТЫХ ВЕЩЕСТВ (ВВ) - 10-(4,5-ДИ-p-ТОЛИЛ-1H-1,2,3-ТРИАЗОЛ-1-ИЛ)-2,3-ДИМЕТОКСИ-ПИРИДО[1,2-a]ИНДОЛ | 2020 |
|
RU2756790C1 |
| Бромсодержащие пространственно-затрудненные фенолы, обладающие противоопухолевой активностью | 2023 |
|
RU2822270C1 |
| Средство, обладающее цитотоксической активностью в отношении культуры клеток глиомы U87MG | 2024 |
|
RU2839886C1 |
| 4-(2-(ПИРИДИН-2-ИЛ)-9H-ПИРИДО[2,3-b]ИНДОЛ-8-ИЛ)АНИЛИН - КЛЕТОЧНЫЙ ФЛУОРЕСЦЕНТНЫЙ КРАСИТЕЛЬ | 2024 |
|
RU2836779C1 |
| Средство, обладающее противоопухолевым действием в отношении опухоли легких | 2021 |
|
RU2765472C1 |
| 1,1'-(Гексан-1,6-диил)бис(3-(((1R,4aS,10aR)-7-изопропил-1,4а-диметил-1,2,3,4,4а,9,10,10а-октагидрофенантрен-1-ил)метил)мочевина, проявляющая ингибирующее действие в отношении фермента тирозил-ДНК-фосфодиэстеразы 1 человека и увеличивающая активность темозоломида в отношении клеток глиобластомы | 2019 |
|
RU2724882C1 |
| 1-Адамантил-3-(((1R,4aS,10aR)-7-изопропил-1,4а-диметил-1,2,3,4,4а,9,10,10а-октагидрофенантрен-1-ил)метил)мочевина, проявляющая ингибирующее действие в отношении фермента тирозил-ДНК-фосфодиэстеразы 1 человека и увеличивающая активность темозоломида в отношении клеток глиобластомы | 2019 |
|
RU2697409C1 |
| ((3β-АЦЕТОКСИ-УРС-12-ЕН-28-ОИЛ-ОКСИАЦЕТОКСИ)МЕТИЛ)-1H-1,2,3-ТРИАЗОЛ-1-ИЛ) МЕТИЛ)-4-МЕТИЛ-1,2,5-ОКСАДИАЗОЛ-2-ОКСИД, ОБЛАДАЮЩИЙ СЕЛЕКТИВНОЙ ПРОТИВООПУХОЛЕВОЙ АКТИВНОСТЬЮ В ОТНОШЕНИИ КЛЕТОК РАКА МОЛОЧНОЙ ЖЕЛЕЗЫ MCF-7 | 2020 |
|
RU2739559C1 |
| БИОЛОГИЧЕСКИ ДОСТУПНАЯ ДЛЯ ПЕРОРАЛЬНОГО ПРИМЕНЕНИЯ КОФЕЙНАЯ КИСЛОТА, ОТНОСЯЩАЯСЯ К ПРОТИВООПУХОЛЕВЫМ ЛЕКАРСТВЕННЫМ СРЕДСТВАМ | 2007 |
|
RU2456265C2 |
| Новые пространственно-затрудненные фенолы, содержащие бензофуроксановые фрагменты, обладающие противоопухолевой активностью | 2022 |
|
RU2796810C1 |
Изобретение относится к применению 10-(4-фенил-5-циано-1H-1,2,3-триазол-1-ил)пиридо[1,2-a]индола в качестве противоопухолевого агента в концентрации 16 μМ, являющейся токсической для неопластических клеток и безопасной для нормальных клеток человека in vitro. Изобретение позволяет применять соединения класса пиридо[1,2-а]индола в качестве противоракового агента и может использоваться в практике исследовательских и медицинских лабораторий для подавления жизнедеятельности опухолевых клеток, в частности клеток глиобластомы, in vitro. 6 ил., 3 табл.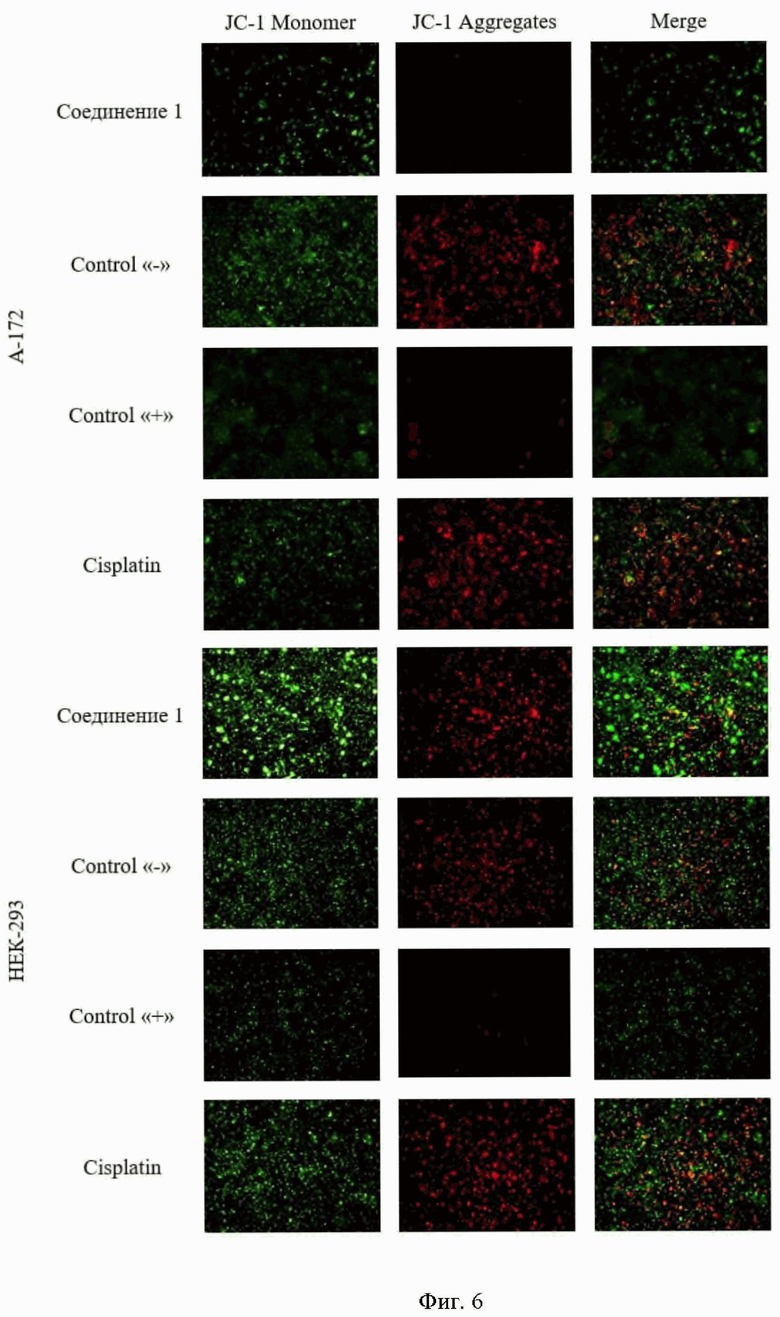
Применение 10-(4-фенил-5-циано-1H-1,2,3-триазол-1-ил)пиридо[1,2-a]индола в качестве противоопухолевого агента в концентрации 16 μМ, являющейся токсической для неопластических клеток и безопасной для нормальных клеток человека in vitro.
| WO 2012007007 A1, 19.01.2012 | |||
| PECNARD S | |||
| et al | |||
| Очаг для массовой варки пищи, выпечки хлеба и кипячения воды | 1921 |
|
SU4A1 |
| Способ исправления пайкой сломанных алюминиевых предметов | 1921 |
|
SU223A1 |
| ЗАМЕЩЕННЫЕ ПИРРОЛЫ И ИХ ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМЫЕ СОЛИ | 1990 |
|
RU2142460C1 |
| KOPCHUK D.S | |||
| et al | |||
| Кипятильник для воды | 1921 |
|
SU5A1 |
Авторы
Даты
2024-10-07—Публикация
2023-12-13—Подача