Область техники, к которой относится изобретение
Настоящее изобретение относится к применению способа на основе среды для индукции специфической дифференцировки дентальных стволовых клеток в дофаминергические нейроны.
Уровень техники для изобретения
Одним из источников мезенхимальных стволовых клеток в организме человека является дентальная ткань. Охарактеризованы стволовые клетки, выделенные из различных частей зуба. Их примерами являются клетки, выделенные из дентальной пульпы, периодонтальной соединительной ткани и незрелого ретенированного зуба [1]. Стволовые клетки дентального происхождения (DDSC) являются примечательными, поскольку они происходят из нейроэктодермальных клеток (клеток нервного гребня), образованных из эктодермы нервной трубки во время эмбрионального периода [2]. Эти клетки имеют способность к дифференцировке во множество разнообразных типов клеток и тканей. Обнаружено также, что эти клетки имеют способность к остеогенезу, адипогенезу, хондрогенезу и нейрогенезу, помимо одонтогенеза [1]. Поскольку они происходят из клеток нервного гребня, и для них показаны некоторые специфические для нейронов профили экспрессии, DDSC рассматривают как многообещающие типы клеток для лечения нейродегенеративных заболеваний. Встречаемость нейродегенеративных заболеваний, возникающих в результате увеличивающейся и необратимой потери функции или смерти нервных клеток, увеличивается день ото дня. Такие причины, как ограниченное образование новых нейронов в центральной нервной системе, присутствие факторов, замедляющих восстановление, и структура черепа, делающая хирургические вмешательства сложными, делают сложными лечение этих типов заболеваний.
Одним из значимых способов лечения этих заболеваний, вызванных разрушением или потерей нервных клеток, является применение стволовых клеток [3]. Наблюдали, что после введения в определенной локализации с использованием подходящего способа, стволовые клетки могут мигрировать к поврежденной области, имеют способность к дифференцировке, и вносят вклад в процесс репарации повреждения посредством стимуляции эндогенных стволовых клеток [4]. В настоящее время, ткани, такие как ткани зубов, костного мозга, крови, хряща и жировые ткани, можно использовать в качестве источника взрослых стволовых клеток [5]. Способность этих типов стволовых клеток к дифференцировке в типы клеток, которые теряются при нейродегенеративных заболеваниях, может сделать возможным создание специфических для индивидуумов моделей заболевания в лабораторном окружении, с использованием клеток, полученных из тканей, которые можно отбирать у пациентов более просто, чем ткани центральной нервной системы [6]. Исследование способности к нейрогенной дифференцировке этих различных типов стволовых клеток может позволять определение типа клеток и способа, которые могут вносить наибольший вклад как в замещение мертвых нервных клеток при лечении нейродегенеративных заболеваний, так и в разработку различных способов терапии посредством создания моделей этих заболеваний на основе специфических для индивидуумов культур клеток.
Дифференцировка индуцированных плюрипотентных стволовых клеток в нейроны имеет такие недостатки, как низкий выход дифференцировки в культуре, высокая частота мутаций, более высокая стоимость, чем для культивирования и дифференцировки мезенхимальных клеток, клетки-источники, содержащие вирусные гены, и следовательно, имеющие заметно высокий потенциал к вызову канцерогенеза при переносе клеток in vivo. Кроме того, известно, что из-за того факта, что дентальные стволовые клетки ближе к нервной ткани, по отношению к эмбриологическому происхождению, происходящие из жировой ткани и костного мозга мезенхимальные стволовые клетки, используемые в нейрогенной дифференцировке, занимают более длительный период времени для трансформации в нервные клетки и не имеют настолько большой потенциальной способности, как дентальные стволовые клетки. При получении мезенхимальных стволовых клеток, возникают такие недостатки, как методологическая сложность получения клеток, в частности, из костного мозга и хряща, и невозможности получения высоких количеств клеток. Наконец, при дифференцировке стволовых клеток из различных источников, использование в среде таких веществ, как DMSO, BHA или β-меркаптоэтанол, которые разрушают морфологическую структуру клетки и вызывают псевдонейрогенез в клетках, делает невозможным продолжать культивирование дифференцированных клеток.
В китайском патентном документе no. CN 104726406, заявке, известной в данной области, описан способ индукции дифференцировки мезенхимальных стволовых клеток дентальной пульпы в нервные клетки. В патентной заявке авторов настоящего изобретения, добавляли дополнительные химические вещества (VPA и IBMX), как описано в разделе способы и показано на фигуре 1, для остановки клеточного цикла, когда плотность клеток составляет между 40 и 50 процентами, во время дифференцировки стволовых клеток в нейроны. Этим способом, клетки подвергали дифференцировке здоровым образом и таким образом, индуцировали по направлению к образованию нервных линий не из-за высокой плотности, но из-за используемого способа.
В китайском патентном документе no. CN 1590537, заявке, известной в данной области, описан способ разделения и культивирования эктомезенхимальных стволовых клеток. В рамках объема изобретения, способ можно использовать для модификации костной ткани, модификации мышечной ткани, модификации ткани зуба и репарации клеток периферического нерва. Кроме того, способ дифференцировки для глиальных линий вместо нервных линий использовали в указанной патентной заявке для обеспечения регенерации клеток периферических нервов. Кроме того, он отличается от способов патентной заявки авторов настоящего изобретения, поскольку используют только химическое средство форсколин, и он состоит из одной стадии. Как известно в литературе, показано, что использования только активаторов циклического amp, таких как форсколин, в дифференцировке недостаточно. В то же самое время, надежность способа дифференцировки в патентной заявке авторов настоящего изобретения доказана как морфологически, так и с использованием окрашивания крезиловым фиолетовым (фигуры 2-3). По всем причинам, объясненным выше, наблюдали, что способ в патентной заявке авторов настоящего изобретения является более эффективным.
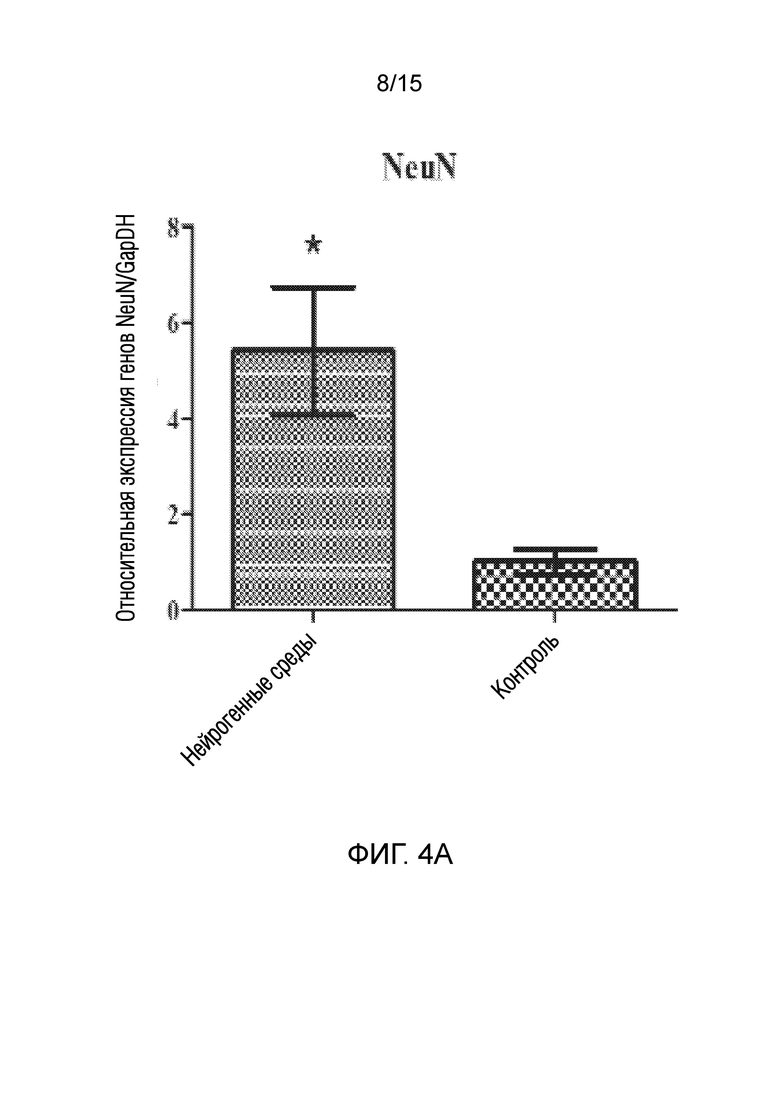
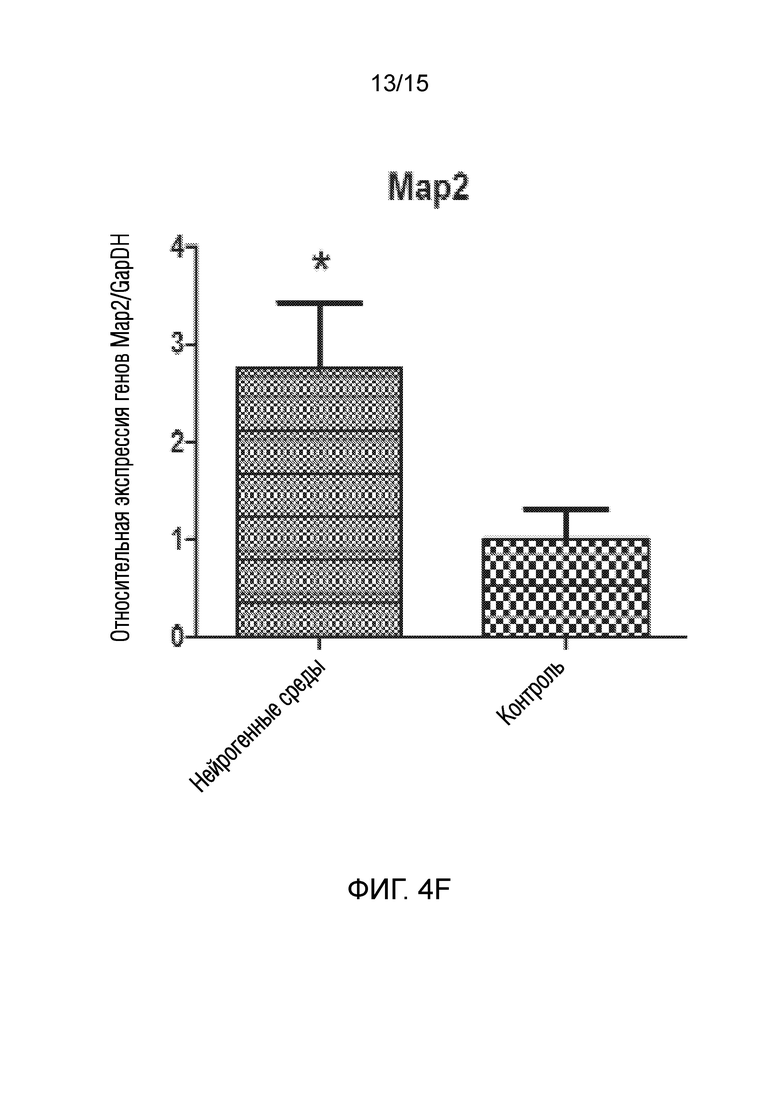
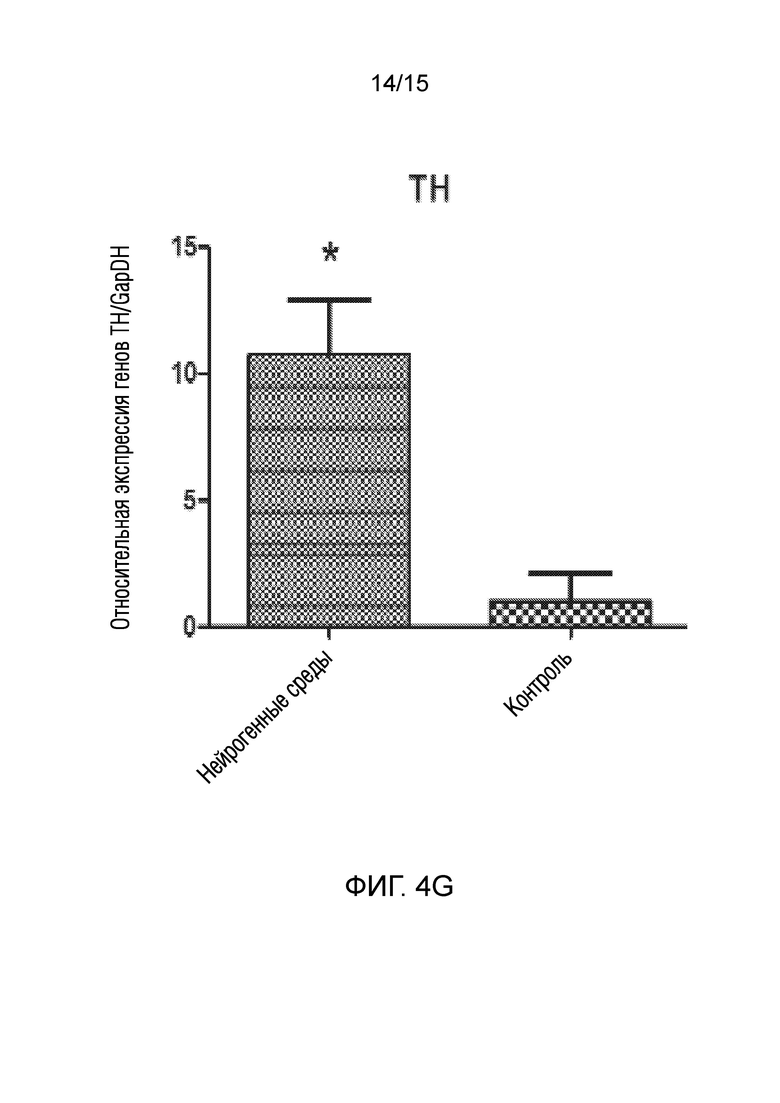
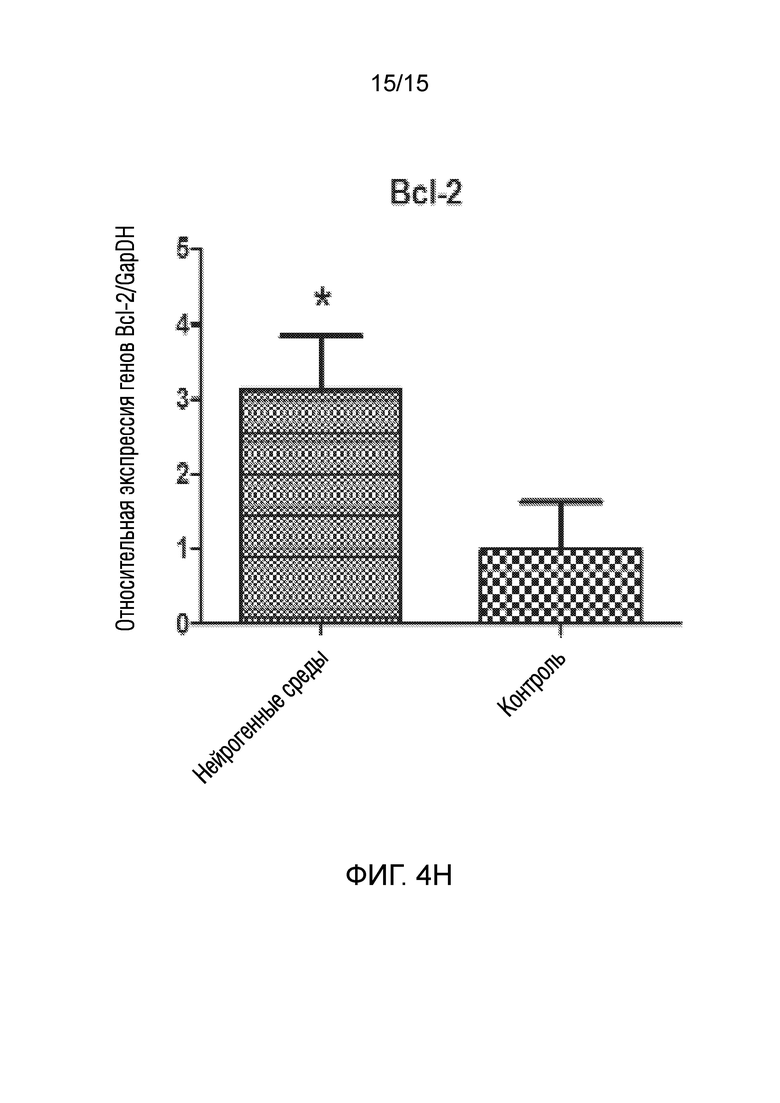
В документе патентной заявки США номер US 2016296669, одной из заявок предшествующего уровня, описан способ получения материала трансплантата для лечения повреждения нерва. Способ по указанному изобретению включает стадию культивирования стволовых клеток дентальной пульпы в среде, не содержащей факторов роста, за исключением FGF2 (или bFGF (основного фактора роста фибробластов)). Кроме того, известно, что фактор FGF2, используемый в указанном патентном документе, активирует только гены, ассоциированные с нервными линиями происходящих из дентальной пульпы стволовых клеток. Однако, известно, что многие пути передачи сигналов, включая клеточный цикл, играют ключевую роль в дифференцировке стволовых клеток. Таким образом, ясно, что введение только фактора FGF2 в стволовые клетки не обеспечивает действенную трансформацию в нервные клетки. Принимая это во внимание, показано, что по изобретению из патентной заявки авторов настоящего изобретения получена генетическая экспрессия зрелого и функционального нейрона, как показано на фиг. 4, в результате следования протоколу, состоящему из двух стадий, как для активации путей дифференцировки, так и для созревания нервных клеток, как также описано в способе.
Сущность изобретения
Целью настоящего изобретения является дифференцировка на основе среды стволовых клеток дентального происхождения в дофаминергические нейроны.
Другой целью настоящего изобретения является разработка клеточных применений для использования в лечении нейродегенеративных заболеваний и в лекарственных средствах, связанных с указанными заболеваниями.
Подробное описание изобретения
«Способ на основе среды для дифференцировки дентальных стволовых клеток в нейроны», разработанный для достижения цели настоящего изобретения, проиллюстрирован на сопутствующих фигурах, на которых:
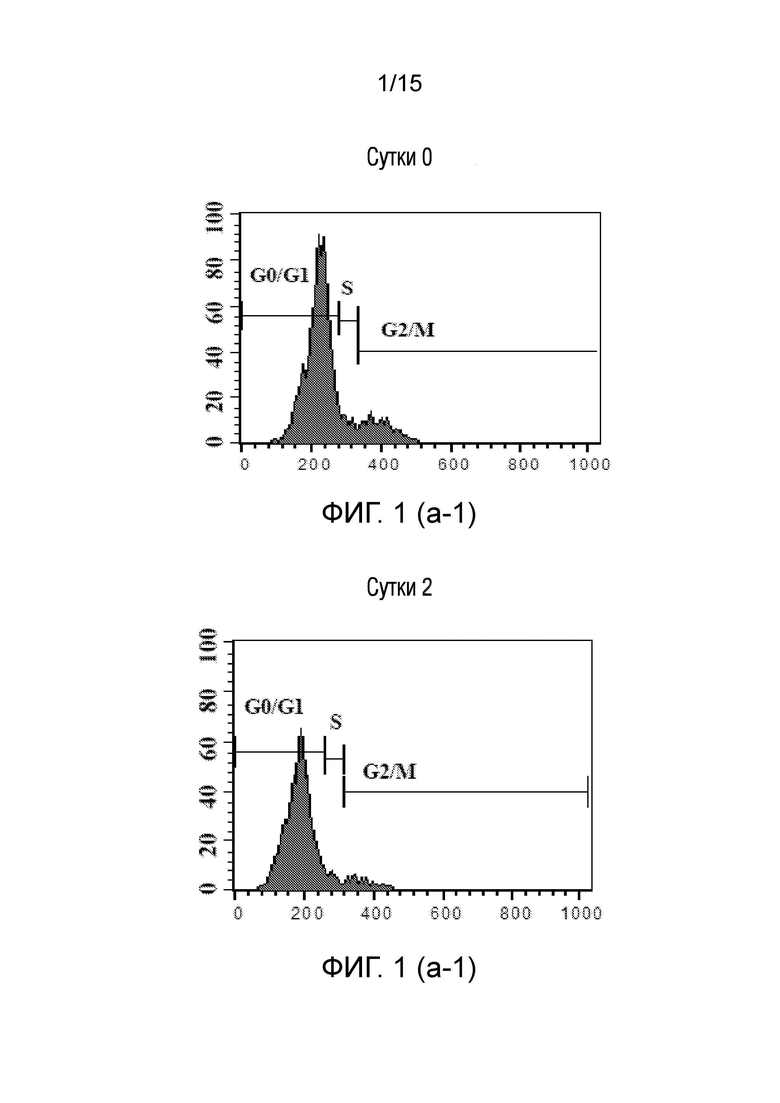
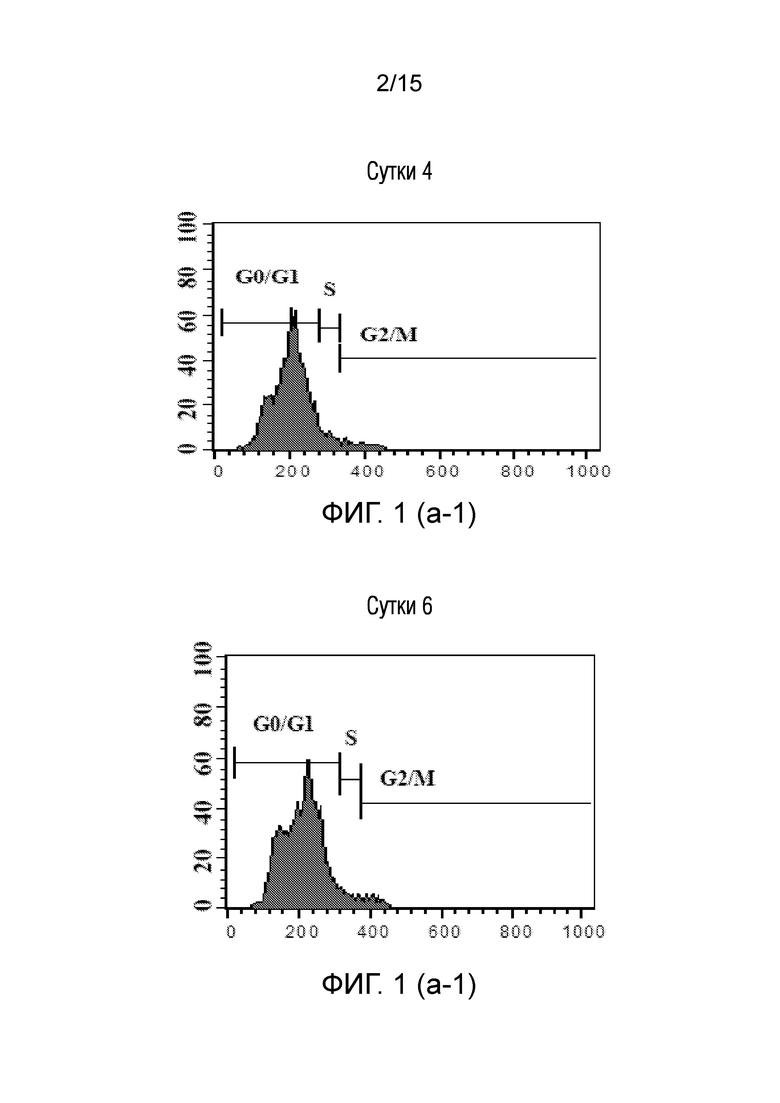
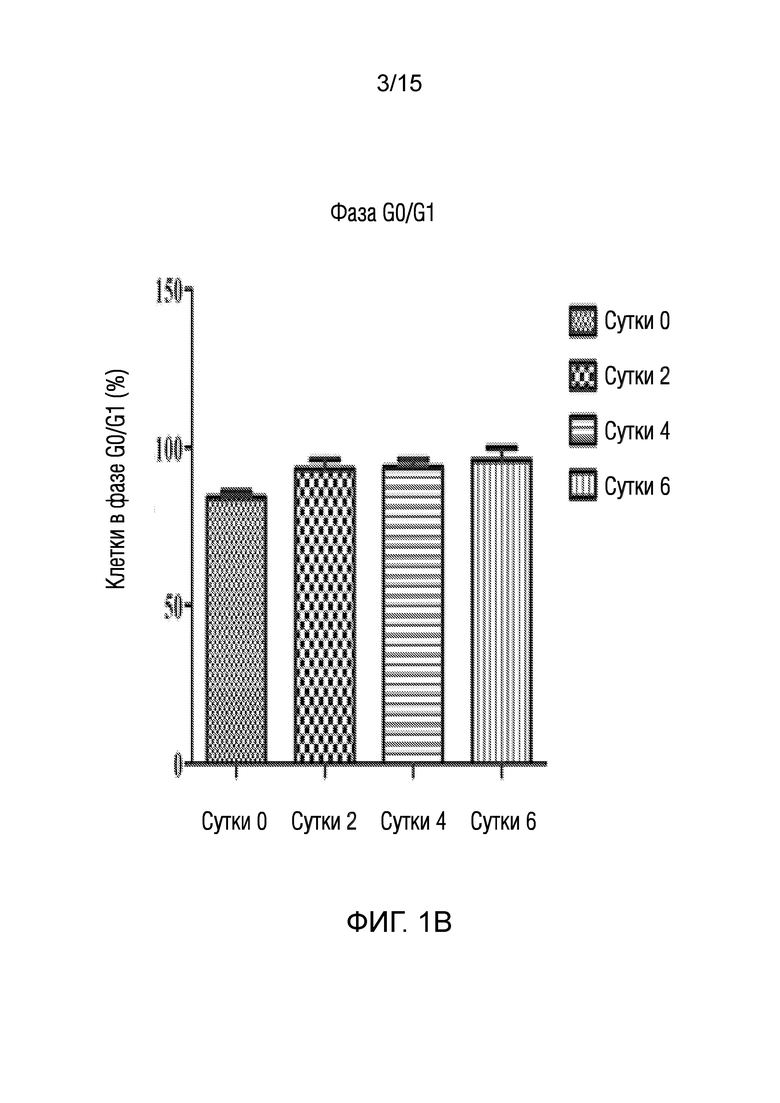
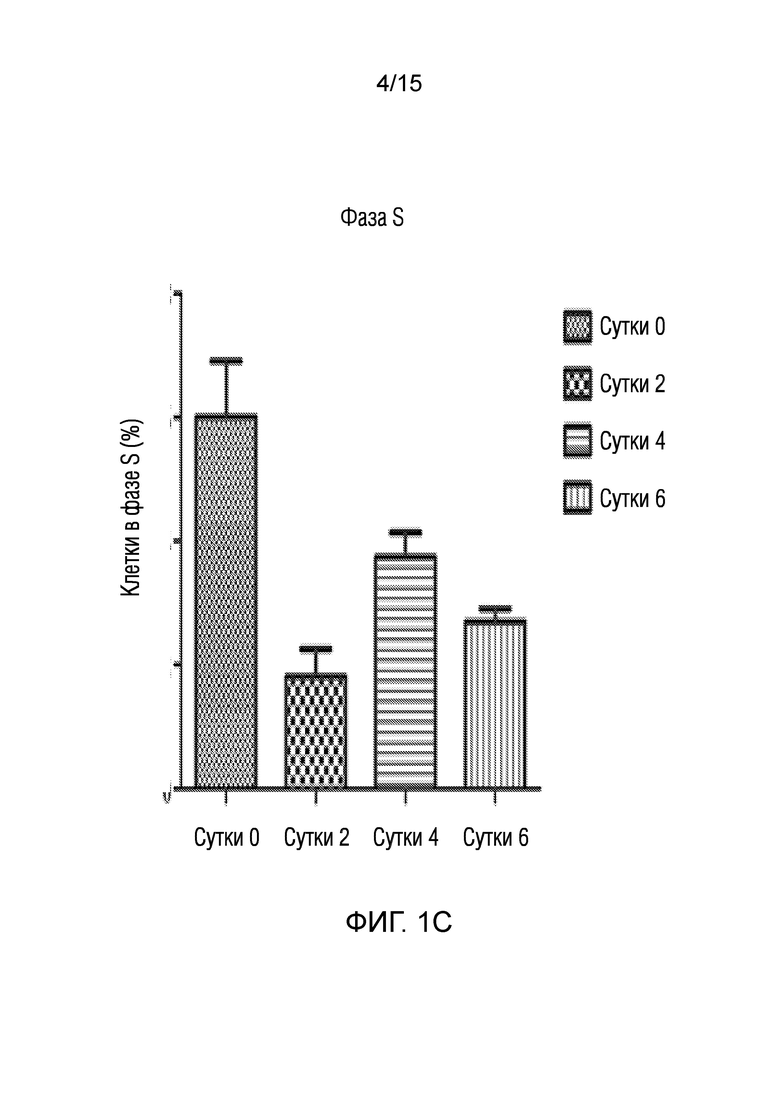
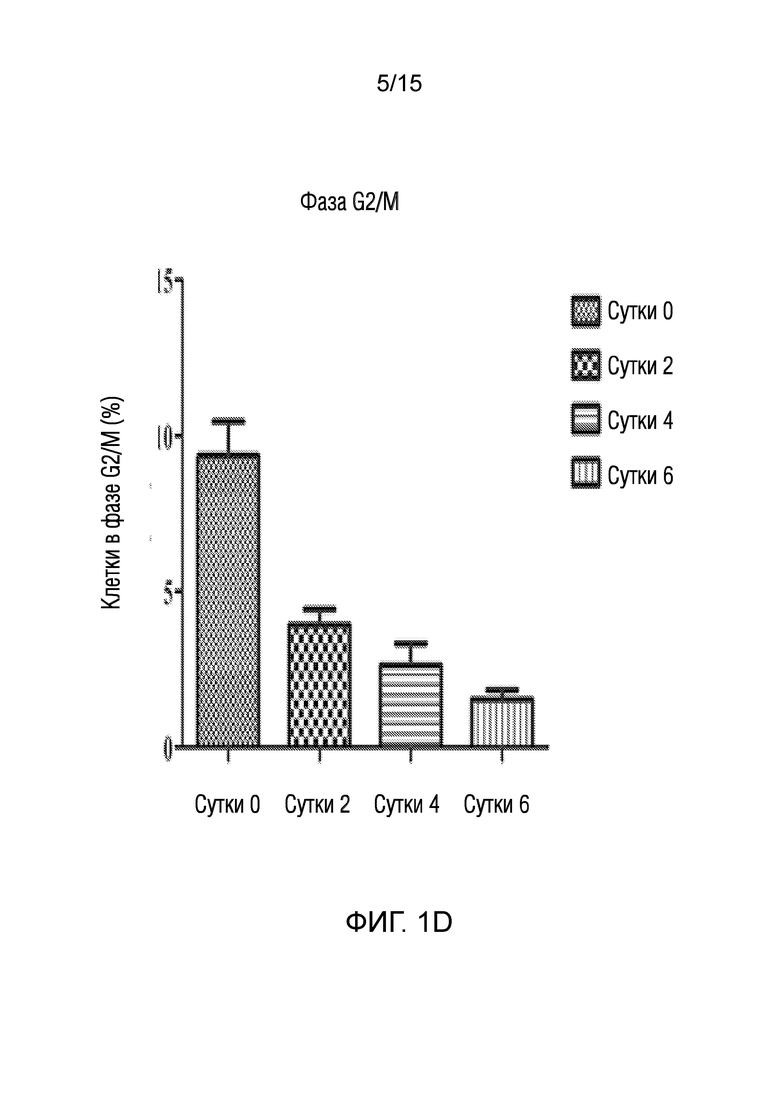
На фиг. 1 показано представление эффекта среды для нейрогенной индукции, полученной в рамках объема изобретения, на клеточный цикл клеток, в зависимости от суток [((a) графики клеточного цикла клеток, обработанных средой для нейрогенной индукции в течение 0, 2, 4 и 6 суток ((a-1), (a-2), (a-3) и (a-4)), (b) графическое представление клеток в фазе G0/G1 в процентах, (c) графическое представление клеток в фазе S в процентах, (d) графическое представление клеток в фазе G2/M в процентах].
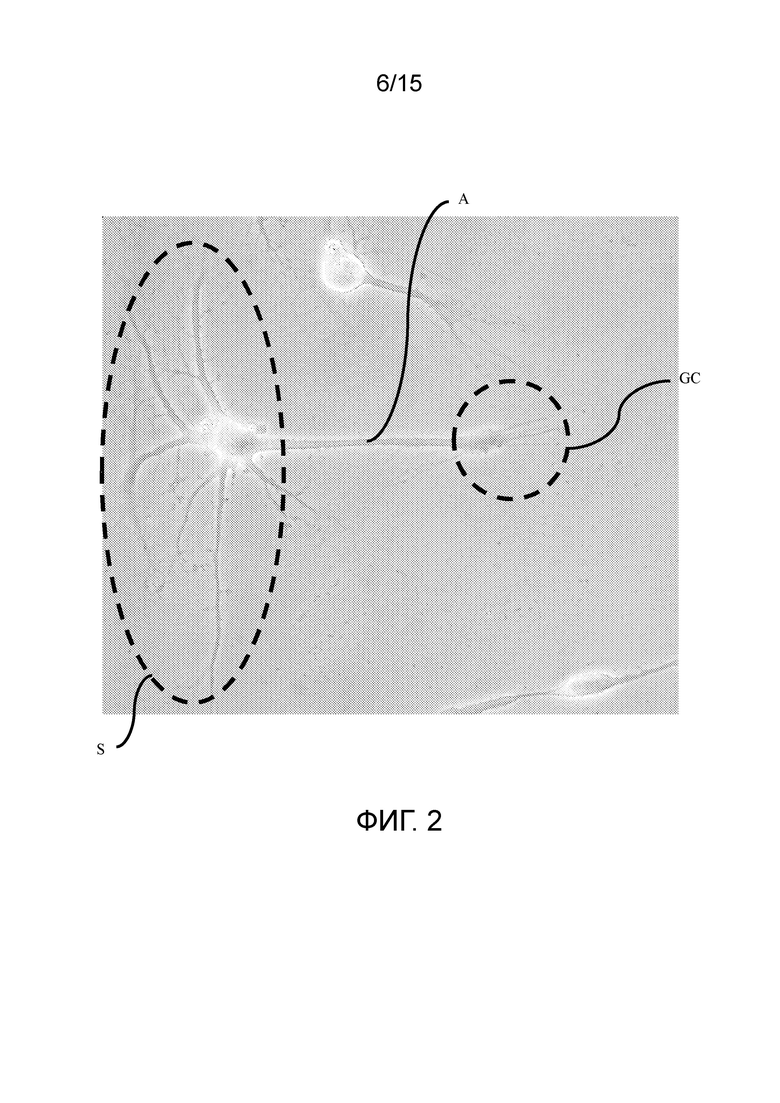
На фиг. 2 показано морфологическое исследование клеток, которые подвергали воздействию среды для нейрогенной индукции в течение 6 суток, в рамках объема изобретения; микроскопическое изображение клеточной сомы, специфической для нейронов, растущего аксона и конуса роста в указанной клетке.
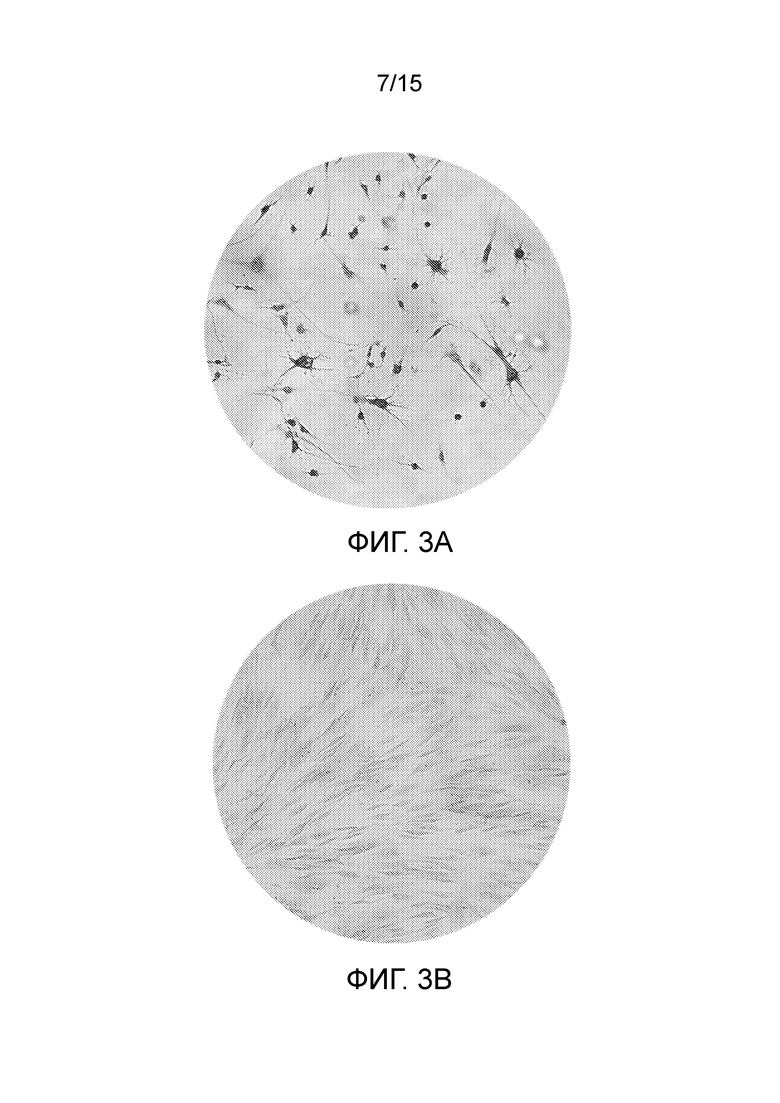
На фиг. 3 показано изображение световой микроскопии клеток, которые подвергали воздействию среды для нейрогенной индукции в течение 6 суток в рамках объема изобретения, и контрольных клеток, выращенных только в среде, после окрашивания красителем крезиловым фиолетовым, специфическим для нейрогенных клеток [((a) Нейрогенная среда, (b) Контроль].
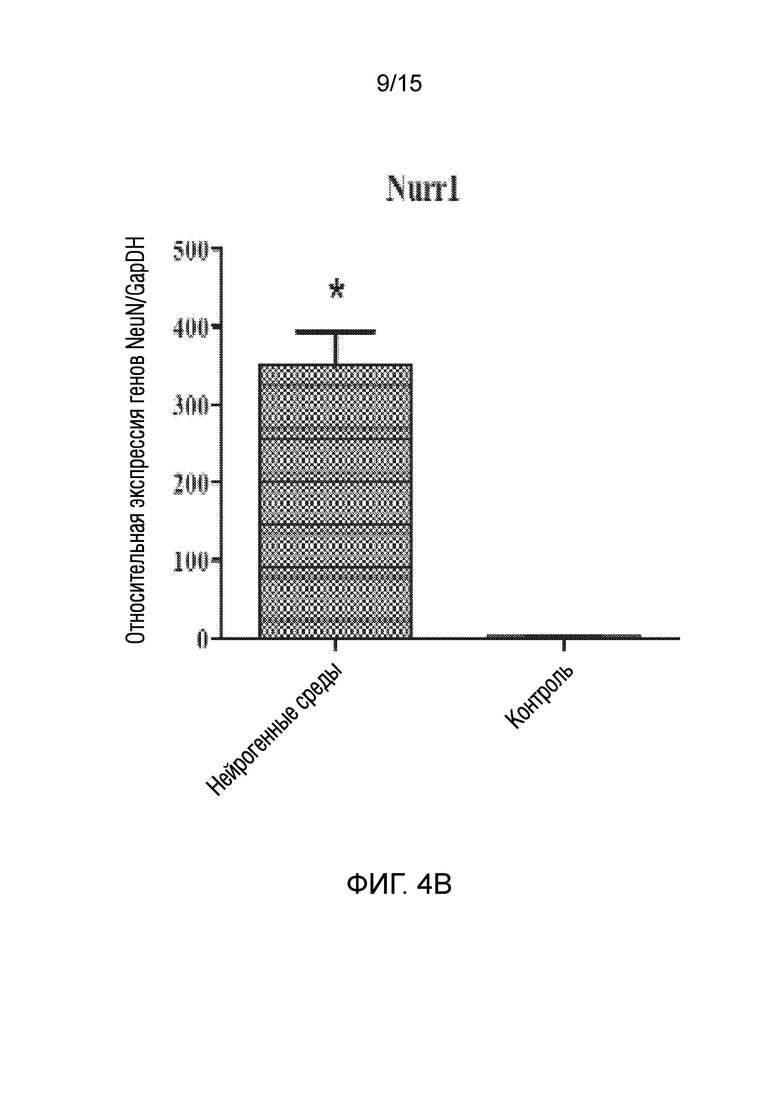
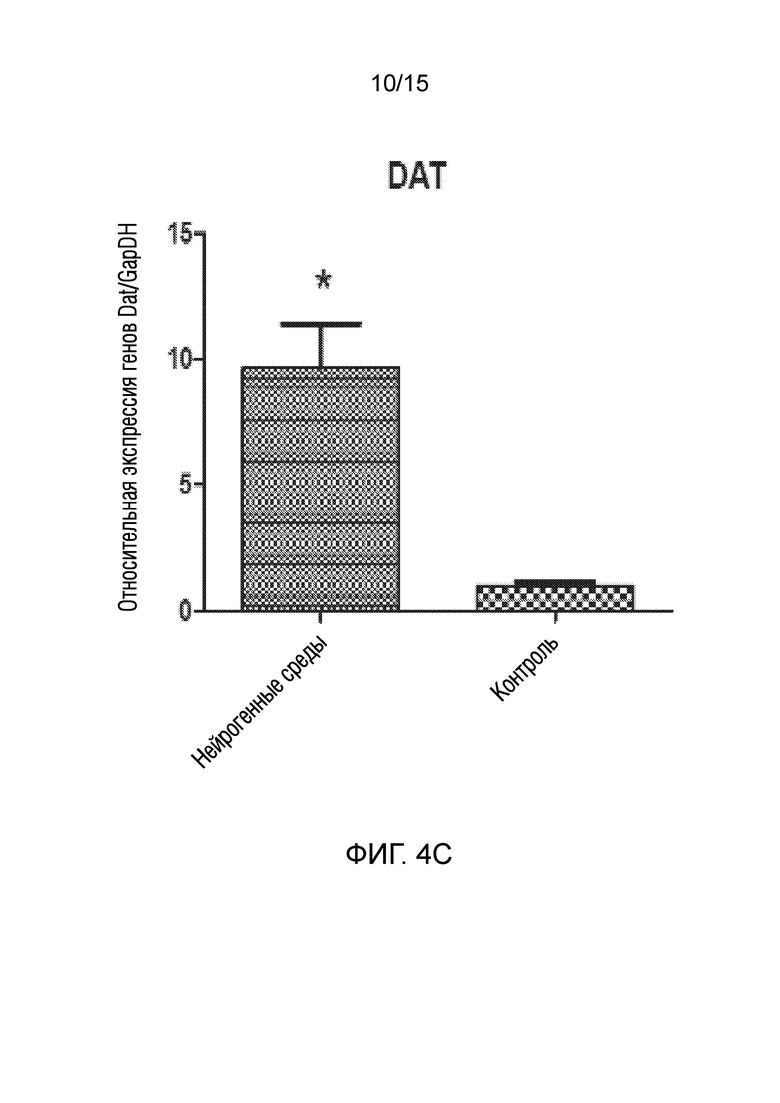
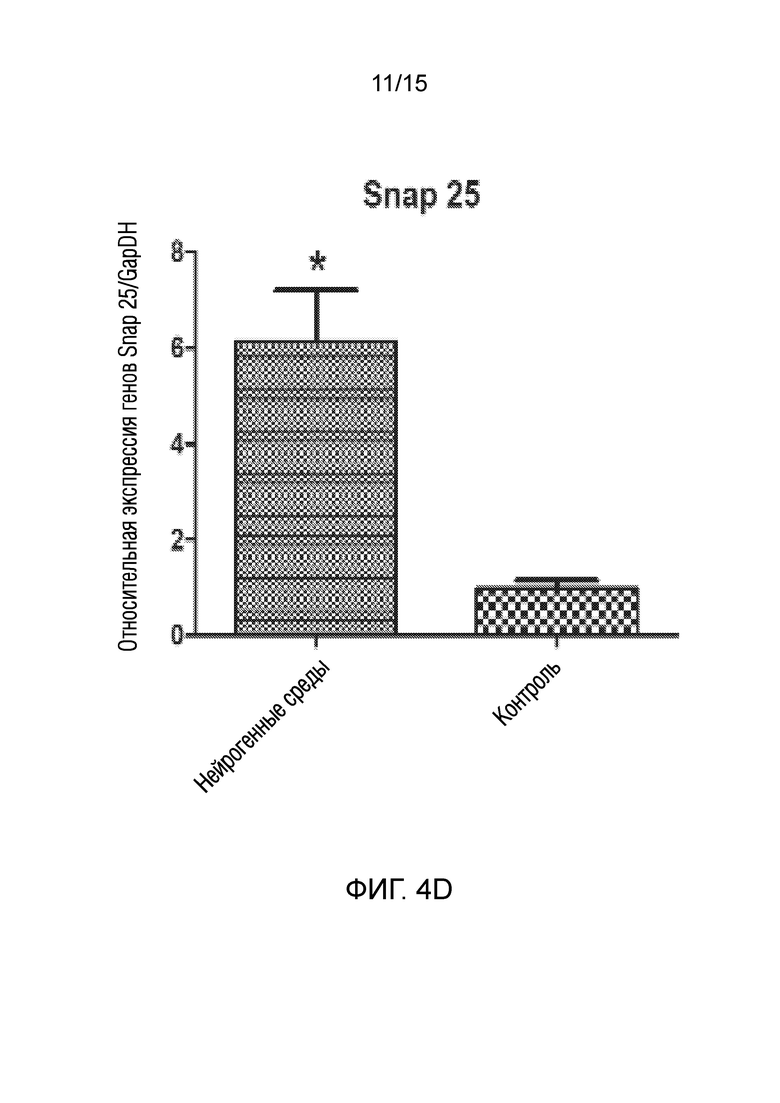
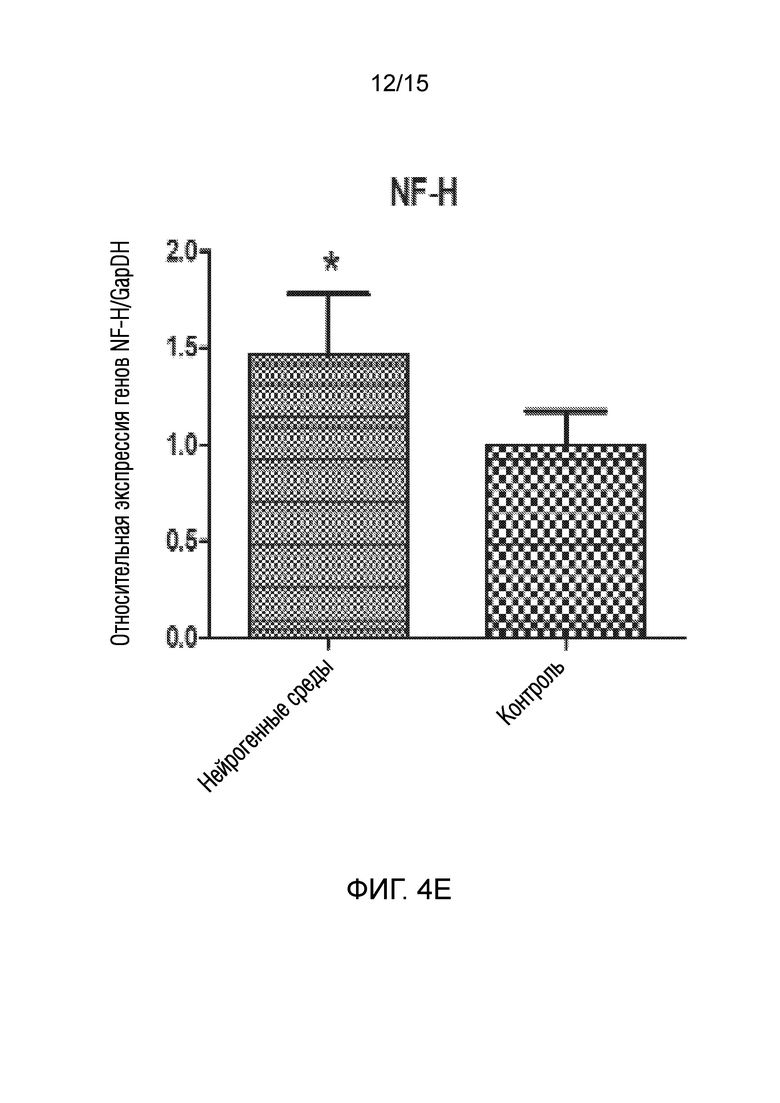
На фиг. 4 показано графическое представление измерения генов, специфических для нейрогенных клеток, в клетках, которые подвергали воздействию среды для нейрогенной индукции в течение 6 суток, в рамках объема изобретения, и контрольных клеток, выращенных только в среде [(a) ген NeuN, (b) ген Nurr 1, (c) ген DAT, (d) ген Snap 25, (e) ген NF-H, (f) ген Map2, (g) ген TH и (h) ген Bcl-2].
Каждому из компонентов, показанных на фигурах, присвоены ссылочные идентификаторы следующим образом:
A. Аксон
S. Сома
GC. Конус роста
В рамках объема изобретения, проводят исследование в области клеточных применений для использования в лечении нейродегенеративных заболеваний и разработке лекарственных средств, связанных с этими заболеваниями, исследовании дифференцировки клеток в лаборатории, разработке лекарственных средств для лечения таких типов злокачественных опухолей, как нейробластома. Соответственно, новое применение на основе среды разработано, в рамках объема изобретения, для специфической индукции дифференцировки стволовых клеток, полученных из зубов, в дофаминергические нейроны.
В применениях дифференцировки из стволовых клеток в нейроны, с учетом тех фактов, что дентальные стволовые клетки ближе к нервной ткани, по отношению к эмбриологическому происхождению, и что трансформация происходящих из жировой ткани (хряща) и костного мозга мезенхимальных стволовых клеток, которые используют на современном уровне техники в нейрогенной дифференцировке, в нейроны занимает более длительный период времени, наблюдают, что дентальные стволовые клетки имеют более высокую потенциальную способность для дифференцировки в нейроны, по сравнению с применениями, известными в данной области.
Способ нейрогенной дифференцировки дентальных стволовых клеток, осуществляемый в рамках объема изобретения, включает следующие стадии:
- Рассев дентальных стволовых клеток при концентрации 5000 клеток/см2,
- После 24-часовой инкубации, введение клеток в первую часть среды для нейрогенной индукции и продолжение воздействия среды в течение 4 суток,
- Затем введение клеток во вторую часть среды для нейрогенной индукции и продолжение воздействия среды в течение 2 суток,
- Остановка дифференцировки по окончании 6 суток.
Содержимое первой части и второй части среды для нейрогенной индукции, описанной в вышеуказанном способе, является следующим:
Среда для нейрогенной индукции, часть 1:
• Dmem/F12, дополненная Glutamax
• Добавка B-27, 1%
• 3-изобутил-1-метилксантин (IBMX), 100 мкМ
• Вальпроевая кислота, натриевая соль (VPA), 2 мМ
• Форсколин, 0,1 мкМ
• Основный фактор роста фибробластов (bFGF), 20 нг/мл
• Эпидермальный фактор роста (EGF), 20 нг/мл
Среда для нейрогенной индукции, часть 2:
• Dmem/F12, дополненная Glutamax
• Добавка B-27, 1%
• 3-изобутил-1-метилксантин (IBMX) 100 мкМ
• Вальпроевая кислота, натриевая соль (VPA) 2 мМ
• Форсколин 0,1 мкМ
• Основный фактор роста фибробластов (bFGF) 20 нг/мл
• Эпидермальный фактор роста (EGF) 20 нг/мл
• Нейротрофический фактор головного мозга 30 нг/мл
Преимущества, предоставляемые посредством настоящего изобретения, можно перечислить следующим образом:
♦ Предоставляет эффективную нейрональную дифференцировку для мезенхимальных стволовых клеток вместо индуцированных плюрипотентных стволовых клеток.
♦ Нейрональную дифференцировку наблюдают за более короткий период времени, по сравнению с другими средами и способами для дифференцировки.
♦ Наблюдают более эффективное формирование нейронов, по сравнению с другими средами и способами для дифференцировки.
♦ В то время как нейрональная дифференцировка клеток, дифференцированных посредством других сред, является обратимой, для клеток, дифференцированных в рамках объема настоящего изобретения, показана терминальная трансформация.
♦ Как показано также на фигурах, клеточный цикл останавливается на сутки 2, что является необходимым для эффективной дифференцировки.
♦ Не вызывает никакой токсичности для клеток, по сравнению с другими средами.
♦ В то время как эти нейрональные клетки можно использовать в регенерации и трансплантации тканей, они также вносят большой вклад в нейронаучные исследования.
Экспериментальные исследования
Анализ клеточного цикла
Анализы проточной цитометрии дентальных стволовых клеток, обработанных нейрогенными средами, проводят, чтобы наблюдать изменения фаз их клеточного цикла. Для анализа клеточного цикла, клетки, фиксированные на вторые, четвертые и шестые сутки в процессе нейрогенной дифференцировки, анализировали посредством обработки с использованием РНКазы A и Nonidet P40, и окрашивания с использованием иодида пропидия.
Полимеразная цепная реакция с детекцией в реальном времени
Анализ полимеразной цепной реакции с детекцией в реальном времени проводят для наблюдения изменений в уровнях генов для клеток, обработанных нейрогенной средой. Эти изменения присутствуют как на морфологическом уровне, так и на уровне экспрессии генов. Использованные праймеры конструировали с использованием программного обеспечения Primer BLAST (The National Center for Biotechnology=NCBI). Тотальные РНК выделяли из клеток, для которых использовали комбинацию гелей, и синтезировали кДНК. Синтезированные кДНК смешивали с праймерами в продукте смеси Fermentas Maxima с SYBR зеленым, таким образом, чтобы конечный объем составлял 20 мкл, и уровни экспрессии генов анализировали посредством использования устройства BIO-RAD.
Морфологический анализ дифференцированных клеток
На последние сутки процесса дифференцировки клеток, обработанных нейрогенной средой, проводили морфологические анализы клеток под световым микроскопом. Во время анализа дифференцированных клеток, морфологически исследовали развитие и существование характерных клеток и структур в нейронах.
Окрашивание дифференцированных клеток крезиловым фиолетовым
На последние сутки процесса дифференцировки клеток, обработанных нейрогенной средой, проводили окрашивание характерных телец Ниссля, наблюдаемых в клетках, которые являются специфическими для нейронов. Краситель крезиловый фиолетовый, который вводят в клетки, окрашивает гранулярный эндоплазматический ретикулум, обнаруженный в соме (S) нервных клеток, и выявляет темно-синий-пурпурный цвет. Недифференцированные дентальные стволовые клетки, с другой стороны, могут быть детектированы как бледно-розовые.
СПИСОК ЛИТЕРАТУРЫ
[1]. Huang, G.T., S. Gronthos, and S. Shi, Mesenchymal stem cells derived from dental tissues vs. those from other sources: their biology and role in regenerative medicine. J Dent Res, 2009. 88(9): p. 792-806.
[2]. Niibe, K., et al. The potential of enriched mesenchymal stem cells with neural crest cell phenotypes as a cell source for regenerative dentistry. Jpn Dent Sci Rev, 2017. 53(2): p. 25-33.
[3]. Goldman, S.A., Stem and Progenitor Cell-Based Therapy of the Central Nervous System: Hopes, Hype, and Wishful Thinking. Cell Stem Cell, 2016. 18(2): p. 174-88.
[4]. Qu, J. and H. Zhang, Roles of Mesenchymal Stem Cells in Spinal Cord Injury. Stem Cells Int, 2017. 2017: p. 5251313.
[5]. Passier, R. and C. Mummery, Origin and use of embryonic and adult stem cells in differentiation and tissue repair. Cardiovasc Res, 2003. 58(2): p. 324-35.
[6]. Ruiz-Lozano, P. and P. Rajan, Stem cells as in vitro models of disease. Curr Stem Cell Res Ther, 2007. 2(4): p. 280-92.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПОЛУЧЕНИЕ ГАМКергических НЕЙРОНОВ in vitro ИЗ ЭМБРИОНАЛЬНЫХ СТВОЛОВЫХ КЛЕТОК И ИХ ПРИМЕНЕНИЕ ПРИ ЛЕЧЕНИИ НЕВРОЛОГИЧЕСКИХ РАССТРОЙСТВ | 2004 |
|
RU2380410C2 |
| СПОСОБ ВЫДЕЛЕНИЯ ПРОИСХОДЯЩИХ ИЗ ПУПОВИННОЙ КРОВИ ПЛЮРИПОТЕНТНЫХ СТВОЛОВЫХ КЛЕТОК, ЭКСПРЕССИРУЮЩИХ ZNF281 | 2010 |
|
RU2511417C2 |
| ПОЛУЧЕНИЕ ТЕРМИНАЛЬНО ДИФФЕРЕНЦИРОВАННЫХ ДОФАМИНЕРГИЧЕСКИХ НЕЙРОНОВ ИЗ ЭМБРИОНАЛЬНЫХ СТВОЛОВЫХ КЛЕТОК ЧЕЛОВЕКА | 2004 |
|
RU2345133C2 |
| СПОСОБ ПОЛУЧЕНИЯ ПОПУЛЯЦИИ СТРОМАЛЬНЫХ КЛЕТОК ЖИРОВОЙ ТКАНИ, ИНДУЦИРОВАННЫХ К НЕЙРАЛЬНОЙ ДИФФЕРЕНЦИРОВКЕ | 2008 |
|
RU2396345C1 |
| СПОСОБ ПОЛУЧЕНИЯ ИНДУЦИРОВАННЫХ ПЛЮРИПОТЕНТНЫХ СТВОЛОВЫХ КЛЕТОК ПАЦИЕНТОВ С СИНДРОМОМ ДАУНА | 2012 |
|
RU2492233C1 |
| СПОСОБ ОЦЕНКИ МОРФОФУНКЦИОНАЛЬНОГО СОСТОЯНИЯ ДИФЕРЕНЦИРОВАННЫХ В ДОФАМИНЕРГИЧЕСКИЕ НЕЙРОНЫ ИНДУЦИРОВАННЫХ ПЛЮРИПОТЕНТНЫХ СТВОЛОВЫХ КЛЕТОК БОЛЬНЫХ ПАРКИНСОНИЗМОМ | 2012 |
|
RU2501853C1 |
| ПРИМЕНЕНИЕ СТВОЛОВЫХ КЛЕТОК, ЭКСПРЕССИРУЮЩИХ МЕЗЕНХИМАЛЬНЫЕ И НЕЙРОНАЛЬНЫЕ МАРКЕРЫ, И ИХ КОМПОЗИЦИЙ ДЛЯ ЛЕЧЕНИЯ НЕВРОЛОГИЧЕСКИХ ЗАБОЛЕВАНИЙ (ВАРИАНТЫ) | 2017 |
|
RU2742828C2 |
| КОНВЕРСИЯ СОМАТИЧЕСКИХ КЛЕТОК В ИНДУЦИРОВАННЫЕ РЕПРОГРАМИРОВАННЫЕ НЕЙРОНАЛЬНЫЕ СТВОЛОВЫЕ КЛЕТКИ (ИРНСК) | 2011 |
|
RU2562111C2 |
| СТВОЛОВЫЕ КЛЕТКИ, ЭКСПРЕССИРУЮЩИЕ МЕЗЕНХИМАЛЬНЫЕ И НЕЙРОНАЛЬНЫЕ МАРКЕРЫ, ИХ КОМПОЗИЦИИ И СПОСОБЫ ИХ ПОЛУЧЕНИЯ | 2017 |
|
RU2741839C2 |
| Способ оценки нейропротекторных свойств веществ in vitro и тест-система для его осуществления | 2016 |
|
RU2646446C1 |
Изобретение относится к биотехнологии, в частности к способу специфической дифференцировки дентальных стволовых клеток в дофаминергические нейроны. Изобретение обеспечивает разработку клеточных применений для использования в лечении нейродегенеративных заболеваний и в лекарственных средствах, связанных с указанными заболеваниями. 4 ил.
Способ для дифференцировки дентальных стволовых клеток в нейроны, который обеспечивает дифференцировку мезенхимальных стволовых клеток, полученных из дентальной ткани, в дофаминергические нейроны и включает стадии
– Рассева дентальных стволовых клеток при концентрации 5000 клеток/см2,
– После 24-часовой инкубации, введения клеток в первую часть среды для нейрогенной индукции и продолжения воздействия среды в течение 4 суток,
– Затем введения клеток во вторую часть среды для нейрогенной индукции и продолжения воздействия среды в течение 2 суток,
– Остановки дифференцировки по окончании 6 суток, где первая часть среды для нейрогенной индукции содержит:
– Dmem/F12, дополненную Glutamax,
– Добавку B-27, 1%,
– 3-изобутил-1-метилксантин (IBMX), 100 мкМ,
– Вальпроевую кислоту, натриевую соль (VPA), 2 мМ,
– Форсколин, 0,1 мкМ,
– Основный фактор роста фибробластов (bFGF), 20 нг/мл,
– Эпидермальный фактор роста (EGF), 20 нг/мл и
где вторая часть среды для нейрогенной индукции содержит:
– Dmem/F12, дополненную Glutamax,
– Добавку B-27, 1%,
– 3-изобутил-1-метилксантин (IBMX), 100 мкМ,
– Вальпроевую кислоту, натриевую соль (VPA), 2 мМ,
– Форсколин, 0,1 мкМ,
– Основный фактор роста фибробластов (bFGF), 20 нг/мл,
– Эпидермальный фактор роста (EGF), 20 нг/мл,
– Нейротрофический фактор головного мозга, 30 нг/мл.
| US 20150265652 A1, 24.09.2015 | |||
| NAKAJI-HIRABAYASHI T | |||
| et al | |||
| Functional surfaces for efficient differentiation of neural stem/progenitor cells into dopaminergic neurons, J Biomed Mater Res A, 2019, v | |||
| Счетный сектор | 1919 |
|
SU107A1 |
| Очаг для массовой варки пищи, выпечки хлеба и кипячения воды | 1921 |
|
SU4A1 |
| Машина для печатания в виде таблиц данных, отмеченных просечками в регистрационных карточках | 1925 |
|
SU860A1 |
| ПАВЛОВА Г.В | |||
| и др | |||
| Молекулярно-генетические основы роли GDNF в дифференцировке и жизнеспособности нервных клеток | |||
Авторы
Даты
2024-12-02—Публикация
2021-05-04—Подача