ПЕРЕКРЕСТНАЯ ССЫЛКА НА СМЕЖНЫЕ ЗАЯВКИ
[0001] Настоящая заявка испрашивает приоритет по предварительной заявке на патент США № 62/816 464, поданной 11 марта 2019 г., содержание которой полностью включено в настоящий документ посредством ссылки.
ОБЛАСТЬ ПРИМЕНЕНИЯ ИЗОБРЕТЕНИЯ
[0002] Данное изобретение относится к биспецифическим моноклональным антителам к Vβ17/CD123, нуклеиновым кислотам и векторам экспрессии, кодирующим антитела, рекомбинантным клеткам, содержащим векторы, и композициям, содержащим антитела. Также предлагаются способы получения антител и способы применения антител для уничтожения злокачественных клеток.
ССЫЛКА НА ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ, ПОДАННЫЙ В ЭЛЕКТРОННОМ ВИДЕ
[0003] Данная заявка содержит перечень последовательностей, представленный в электронном виде через EFS-Web как перечень последовательностей в формате ASCII с именем файла «PRD4012WOPCT Sequence Listing», датой создания 11 марта 2020 г. и размером 85 кБ. Перечень последовательностей, представленный посредством EFS-Web, является частью описания и полностью включен в настоящий документ путем ссылки.
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
[0004] Цитотоксические Т-клетки (например, Т-клетки CD8+) можно использовать для прямого уничтожения раковых клеток. Обнаружение способа направления цитотоксических Т-клеток к раковой клетке может позволить уничтожать такие клетки и ингибировать их распространение. Было продемонстрировано, что цитотоксические Т-клетки можно активировать против раковых клеток, экспрессирующих связанные с раком антигены, путем приведения указанных цитотоксических Т-клеток в непосредственную близость к раковым клеткам в течение продолжительного периода времени с использованием биспецифического антитела, которое связывается как с цитотоксической Т-клеткой, так и с раковой клеткой. Данный подход к уничтожению раковых клеток характеризуется рядом потенциальных осложнений, таких как отбор Т-клеток и антигенов раковых клеток, которые опосредуют Т-клеточную активацию, выбор исходных антител, которые будут иметь достаточную аффинность для опосредования связывания в контексте биспецифического антитела, и выбор антигена раковых клеток, который будет активировать Т-клетки для оказания специфического воздействия на раковые клетки, вместо инициализации неспецифической активации Т-клеток. Данные осложнения усугубляются только в контексте попыток активации Т-клеток для разрушения раковых клеток у субъекта-животного.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
[0005] В настоящем документе предлагаются биспецифические антитела, способные связываться с Vβ17, антигеном, ассоциированным с Т-клетками, и CD123, антигеном, ассоциированным с раковыми клетками. Цитотоксические Т-клетки экспрессируют Т-клеточные рецепторы, которые состоят из α- и β-цепей, например, Vβ17. Предполагается, что биспецифическое антитело, связывающееся с Vβ17 и антигеном раковых клеток, таким как CD123, может направлять цитотоксическую Т-клетку к экспрессирующей антиген раковой клетке. Использование биспецифического антитела такого рода для рекрутирования или перенаправления цитотоксической Т-клетки к экспрессирующей антиген раковой клетке и может позволить Т-клетке уничтожить раковую клетку.
[0006] В одном общем аспекте настоящее описание относится к выделенным биспецифическим антителам или их антигенсвязывающим фрагментам, которые связывают Vβ17 и CD123.
[0007] В настоящем документе предлагаются выделенные биспецифические антитела Vβ17 или их антигенсвязывающие фрагменты. Выделенное биспецифическое антитело Vβ17 или его антигенсвязывающий фрагмент включает:
a. первую тяжелую цепь (HC1);
b. вторую тяжелую цепь (HC2);
c. первую легкую цепь (LC1); и
d. вторую легкую цепь (LC2),
где HC1 связана с LC1, а HC2 связана с LC2, и при этом HC1 содержит определяющую комплементарность область тяжелой цепи 1 (HCDR1), HCDR2 и HCDR3, содержащие аминокислотные последовательности SEQ ID NO:1, SEQ ID NO:2 и SEQ ID NO:3, соответственно, и LC1 содержит определяющую комплементарность область легкой цепи 1 (LCDR1), LCDR2 и LCDR3, содержащие аминокислотные последовательности SEQ ID NO:4, SEQ ID NO:5 и SEQ ID NO:6, соответственно, с образованием сайта связывания для первого антигена, и при этом HC2 и LC2 образуют сайт связывания для второго антигена. В определенных вариантах осуществления сайт связывания для первого антигена связывается с Vβ17 на поверхности Т-клетки CD8+ или CD4+. В определенных вариантах осуществления сайт связывания для второго антигена связывается с опухолевым антигеном, присутствующим на поверхности раковой клетки.
[0008] В определенных вариантах осуществления связывание биспецифического антитела с Vβ17, присутствующим на поверхности Т-клетки CD8+ или CD4+, и связывание опухолевого антигена, присутствующего на поверхности раковых клеток, приводят к уничтожению раковой клетки.
[0009] В определенных вариантах осуществления HC2 и LC2 связываются с CD123.
[0010] В определенных вариантах осуществления биспецифическое антитело или его антигенсвязывающий фрагмент представляет собой изотип IgG, например, IgG4.
[0011] В определенных вариантах осуществления биспецифическое антитело или его антигенсвязывающий фрагмент индуцирует цитотоксичность, зависимую от Т-клеток CD8+ или CD4+, раковой клетки in vitro, а значение EC50 при этом составляет менее около 0,2 пМ.
[0012] Также предлагаются выделенные биспецифические антитела к Vβ17/CD123 или их антигенсвязывающие фрагменты. Биспецифические антитела к Vβ17/CD123 или их антигенсвязывающие фрагменты включают:
a. первую тяжелую цепь (HC1);
b. вторую тяжелую цепь (HC2)
c. первую легкую цепь (LC1); и
d. вторую легкую цепь (LC2),
где HC1 связана с LC1, а HC2 связана с LC2, и при этом HC1 содержит определяющую комплементарность область тяжелой цепи 1 (HCDR1), HCDR2 и HCDR3, содержащие аминокислотные последовательности SEQ ID NO:1, SEQ ID NO:2 и SEQ ID NO:3, соответственно, а LC1 содержит определяющую комплементарность область легкой цепи 1 (LCDR1), LCDR2 и LCDR3, содержащие аминокислотные последовательности SEQ ID NO:4, SEQ ID NO:5 и SEQ ID NO:6, соответственно, с образованием сайта связывания для первого антигена, который специфически связывается с Vβ17, и при этом HC2 содержит определяющую комплементарность область тяжелой цепи 1 (HCDR1), HCDR2 и HCDR3, содержащие аминокислотные последовательности SEQ ID NO:34, SEQ ID NO:35 и SEQ ID NO:36, соответственно, и LC2 содержит определяющую комплементарность область легкой цепи 1 (LCDR1), LCDR2 и LCDR3, содержащие аминокислотные последовательности SEQ ID NO:37, SEQ ID NO:38 и SEQ ID NO:39, соответственно, с образованием сайта связывания для второго антигена, который специфически связывается с CD123. В определенных вариантах осуществления HC1 содержит аминокислотную последовательность SEQ ID NO:13, LC1 содержит аминокислотную последовательность SEQ ID NO:14, HC2 содержит аминокислотную последовательность SEQ ID NO:15, а LC2 содержит аминокислотную последовательность SEQ ID NO:16. В определенных вариантах осуществления Vβ17 находится на поверхности Т-клетки CD8+ или CD4+. В определенных вариантах осуществления CD123 находится на поверхности раковой клетки. В определенных вариантах осуществления биспецифическое антитело или его антигенсвязывающий фрагмент индуцирует цитотоксичность, зависимую от Т-клеток CD8+ или CD4+, раковой клетки in vitro, а значение EC50 при этом составляет менее около 0,2 пМ.
[0013] В определенных вариантах осуществления биспецифические антитела к Vβ17/CD123 или их антигенсвязывающие фрагменты являются химерными, частично гуманизированными или полностью гуманизированными.
[0014] Также предлагаются выделенные гуманизированные моноклональные антитела Vβ17 или их антигенсвязывающие фрагменты. Выделенное гуманизированное моноклональное антитело Vβ17 или его антигенсвязывающий фрагмент может содержать аминокислотную последовательность, по меньшей мере на 95% идентичную аминокислотной последовательности SEQ ID NO:28. В определенных вариантах осуществления выделенное гуманизированное моноклональное антитело Vβ17 или его антигенсвязывающий фрагмент содержит аминокислотную последовательность SEQ ID NO:28.
[0015] Также предлагаются выделенные нуклеиновые кислоты, кодирующие моноклональные антитела или их антигенсвязывающие фрагменты, и биспецифические антитела или их антигенсвязывающие фрагменты, описанные в настоящем документе.
[0016] Также предлагаются векторы, содержащие выделенные нуклеиновые кислоты, кодирующие моноклональные антитела или их антигенсвязывающие фрагменты, и биспецифические антитела или их антигенсвязывающие фрагменты, описанные в настоящем документе.
[0017] Также предлагаются клетки-хозяева, содержащие векторы, содержащие выделенные нуклеиновые кислоты, описанные в настоящем документе.
[0018] Также предлагаются способы направления Vβ17-экспрессирующей Т-клетки CD8+ или CD4+ к раковой клетке. Способы включают приведение Vβ17-экспрессирующей Т-клетки CD8+ или CD4+ в контакт с биспецифическими антителами к Vβ17/CD123 или их антигенсвязывающими фрагментами, описанными в настоящем документе. Приведение Vβ17-экспрессирующей Т-клетки CD8+ или CD4+ в контакт с биспецифическими антителами к Vβ17/CD123 или их антигенсвязывающими фрагментами может применяться для направления Vβ17-экспрессирующей Т-клетки CD8+ или CD4+ к раковой клетке.
[0019] Также предлагаются способы ингибирования роста или пролиферации раковых клеток. Способы включают в себя приведение раковых клеток в контакт с биспецифическими антителами, описанными в настоящем документе. Приведение раковых клеток в контакт с описанными антителами может, например, ингибировать рост или пролиферацию раковых клеток или способствовать опосредованному Т-клетками уничтожению раковых клеток.
[0020] Также предлагаются способы получения биспецифических антител или их антигенсвязывающих фрагментов, описанных в данном документе. Способы включают в себя культивирование клетки, содержащей нуклеиновую кислоту, кодирующую одну пару тяжелой и легкой цепей биспецифического антитела, в условиях, обеспечивающих получение тяжелой и легкой цепей или их антигенсвязывающего фрагмента, и восстановление тяжелой и легкой цепей биспецифического антитела или его антигенсвязывающего фрагмента из клетки или культуры. После сбора тяжелых и легких цепей для обоих плеч биспецифического антитела пары тяжелых и легких цепей смешивают в условиях, подходящих для обеспечения самосборки, после чего собирают самособранные биспецифические антитела.
[0021] Также предлагаются способы получения композиций, содержащих биспецифические антитела или антигенсвязывающие фрагменты, описанные в настоящем документе, например, композиции, содержащие буфер, или очищенные композиции и т. п. Например, способы могут включать в себя комбинирование биспецифического антитела или его антигенсвязывающего фрагмента с буфером, приемлемым для хранения и применения биспецифического антитела.
[0022] Также предлагаются наборы, содержащие биспецифические антитела или их антигенсвязывающие фрагменты, описанные в настоящем документе, и упаковку для них.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
[0023] Приведенное выше краткое описание, а также приведенное ниже подробное описание предпочтительных вариантов осуществления настоящего изобретения будут более понятны при изучении вместе с приложенными графическими материалами. Однако необходимо понимать, что применение не ограничено точными вариантами осуществления, показанными на графических материалах.
[0024] На ФИГ. 1 представлена схема, демонстрирующая связывание биспецифического антитела к Vβ17/противоопухолевого антигена для рекрутирования Т-клеток в раковую клетку и индукции гибели раковых клеток.
[0025] На ФИГ. 2A - 2B показано, что Т-клетки Vβ17+ CD8+ существуют в организмах здоровых субъектов, и после культивирования с применением пептида М1 эти клетки могут быть размножены in vitro. На ФИГ. 2A приведены гистограммы анализа сортировки гейтированных мононуклеарных клеток периферической крови (PBMC) с активированной флуоресценцией для Т-клеток CD8+, экспрессирующих Vβ17 (Vβ17+), на поверхности клеток здоровых субъектов. На ФИГ. 2B показан подтип HLA различных доноров и наличие процента Т-клеток Vβ17+ CD8+, выявленных в день 0, и после размножения in vitro пептидом М1 в течение 14 суток (день 14).
[0026] На ФИГ. 3 показано, что Т-клетки Vβ17+ CD8+ имеют отличительные признаки киллерных цитотоксических клеток. Гистограмма показывает экспрессию CD107a, CD69, Гранзима B (Gzb) и Интерферона-γ(IFNγ) на гейтированных PBMC для Т-клеток CD8+, экспрессирующих Vβ17 (Vβ17+) на клеточной поверхности в день 0 (без M1) и на 14 сутки после стимуляции пептидом М1 (+M1).
[0027] На ФИГ. 4 показано связывание биспецифических антител VB11 [к Vβ17/CD123], а также антител VB13 [контрольных биспецифических, к Vβ17 null] с Т-клетками CD8+. Данные представлены по Т-клеткам CD8+, выделенным из PBMC от 3 различных доноров (D203517, HPU09381 и HPU08694). В таблице под каждым графиком представлены значения EC50 для связывания в нМ.
[0028] На ФИГ. 5 показано связывание биспецифических антител Vβ17 и CD123 (VB11), а также контрольных биспецифических антител Vβ17 null (VB13) с клеточной линией ОМЛ. Представленные данные показывают связывание биспецифических антител с клеточной линией ОМЛ Kasumi3. В таблице ниже представлены значения EC50 для связывания в нМ.
[0029] На ФИГ. 6 показано перенаправление Т-клеток Vβ17+ биспецифическими антителами, которые индуцируют эффективное уничтожение раковых клеток ОМЛ. Данные на левом графике отражают уничтожение раковых клеток Kasumi3 в соотношении эффектор - мишень (E:T), равном 0,5:1, и титрование дозы биспецифических антител. Данные на среднем графике отражают уничтожение раковых клеток Kasumi3 в соотношении E:T, равном 1:1, и титрование дозы биспецифических антител. Данные на правом графике отражают уничтожение раковых клеток Kasumi3 в соотношении E:T, равном 5:1, и титрование дозы биспецифических антител. В приведенной ниже таблице представлены значения ЕС50, рассчитанные на основании приведенных выше графиков в пМ.
[0030] На ФИГ. 7A - 7B показано специфическое связывание биспецифического антитела к Vβ17/CD123 (VB11) и биспецифического антитела к Vβ17 null (VB13) с Т-клетками CD8+, выделенными из PBMC. На ФИГ. 7A приведены гистограммы анализа сортировки гейтированных PBMC с активированной флуоресценцией для Т-клеток CD8+, экспрессирующих Vβ17 (Vβ17+), на поверхности клеток здоровых субъектов (левый график, необедненные Vβ17) и PBMC, обедненных Vβ17+ Т-клетками, с использованием негативной селекции (правый график, обедненные Vβ17). На ФИГ. 7B показано специфическое связывание биспецифического антитела к Vβ17/CD123 (VB11) и биспецифического антитела к Vβ17 null (VB13) с Т-клетками CD8+ по ФИГ. 7A. На фигуре показан дозозависимый эффект биспецифических антител. В приведенной ниже таблице показаны значения EC50 для связывания, рассчитанные на основании приведенного выше графика в нМ.
[0031] На ФИГ. 8 показано специфическое рекрутирование Т-клеток Vβ17 биспецифическим антителом Vβ17- для уничтожения раковых клеток Kasumi3. На фигуре слева показано уничтожение клеточной линии ОМЛ Kasumi3 при выделении эффекторных клеток из PBMC, содержащих Т-клетки CD8+, экспрессирующие Vβ17 (Vβ17+) на клеточной поверхности (нетронутые Т-клетки CD8). Вставка показывает присутствие 10,1% Т-клеток Vβ17+ CD8 в популяции эффекторных клеток. На фигуре справа показано уничтожение клеточной линии ОМЛ Kasumi3 при выделении эффекторных T-клеток CD8+ из PBMC, но Т-клетки Vβ17+ были обеднены путем негативной селекции. Вставка показывает присутствие малой популяции (0,086%) Vβ17+ CD8+ T-клеток в популяции эффекторных клеток.
[0032] На ФИГ. 9A - 9B показано, что при использовании биспецифических антител Vβ17 не происходит пан-активации Т-клеток. На ФИГ. 9A показаны графики анализа сортировки гейтированных Vβ17+ и Vβ17- Т-клеток CD8+ с активированной флуоресценцией. При активации Т-клеток биспецифическим антителом Vβ17 наблюдался высокий уровень повышения экспрессии CD69 (62,5%) на Vβ17+ по сравнению с Т-клетками Vβ17- CD8+ (1,80%). На ФИГ. 9B показана гистограмма повышения экспрессии CD69 на гейтированных Vβ17+ и Vβ17- Т-клетках CD8+ при активации с использованием биспецифического антитела Vβ17.
[0033] На ФИГ. 10 показано, что Т-клетки Vβ17+ от HLA A2-отрицательного донора также являются эффекторными клетками-киллерами и не требуют предварительной стимуляции клеток Vβ17+. Эффективная цитотоксичность, опосредованная биспецифическим антителом Vβ17 в раковых клетках Kasumi3, показана на примере PBMC, содержащих Т-клетки Vβ17+ от HLA A2-отрицательного донора (HPU 09381).
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[0034] Описание документов, актов, материалов, устройств, изделий или т. п., которые были включены в настоящее описание, приведено в качестве контекста для изобретения. Такое описание не является допущением того, что любой из таких источников или все такие источники являются частью предшествующего уровня техники в отношении каких-либо описываемых или заявленных изобретений.
[0035] Если не указано иное, все технические и научные термины в настоящем документе имеют общепринятое значение, понятное любому специалисту в области, к которой относится данное изобретение. В ином случае, определенные термины в настоящем документе имеют значения, установленные в настоящем описании.
[0036] Если не указано иное, любые числовые значения, такие как концентрация или диапазон концентраций, описанные в настоящем документе, следует понимать как модифицированные во всех случаях термином «около». Таким образом, числовое значение, как правило, включает ±10% от указанного значения. Например, концентрация 1 мг/мл включает от 0,9 мг/мл до 1,1 мг/мл. Аналогичным образом диапазон концентраций от 1% до 10% (масс./об.) включает от 0,9% (масс./об.) до 11% (масс./об.). В настоящем документе применение числового диапазона явным образом включает все возможные поддиапазоны, все отдельные числовые значения в пределах этого диапазона, включая целые числа в пределах таких диапазонов и дробные значения, если из контекста явно не следует иное.
[0037] Если не указано иное, термин «по меньшей мере», предшествующий ряду элементов, следует понимать как относящийся к каждому элементу в этом ряду. Специалисты в данной области смогут определять или с помощью лишь стандартных экспериментов смогут устанавливать множество эквивалентов конкретных вариантов осуществления изобретения, как описано в настоящем документе. Подразумевается, что такие эквиваленты включены в изобретение.
[0038] Необходимо отметить, что в настоящем документе и в приложенной формуле изобретения форма единственного числа включает объекты и во множественном числе, если из контекста явно не следует иное.
[0039] В настоящем документе термины «содержит», «содержащий», «включает», «включающий», «имеет», «имеющий», «содержит» или «содержащий» или любая другая их вариация подразумевают включение указанного целого числа или группы целых чисел, но не исключение из него какого-либо другого целого числа или группы целых чисел, и они являются не исключающими или неограничивающими. Например, композиция, смесь, процесс, способ, изделие или устройство, которое содержит перечень элементов, не обязательно ограничивается только этими элементами, но может включать другие элементы, не перечисленные прямо или присущие такой композиции, смеси, процессу, способу, изделию или устройству. Кроме того, если в явной форме не указано иное, союз «или» относится к включающему «или», а не к исключающему «или». Например, условие «A или B» выполняется в любой одной из следующих ситуаций: A истинно (или присутствует), а B ложно (или отсутствует), A ложно (или отсутствует), а B истинно (или присутствует), и оба элемента A и B истинны (или присутствуют).
[0040] В настоящем документе соединительный термин «и/или» между множеством перечисляемых элементов следует понимать как включающий как отдельные, так и комбинированные варианты. Например, если два элемента соединены «и/или», первый вариант относится к возможности применения первого элемента без второго. Второй вариант относится к возможности применения второго элемента без первого. Третий вариант относится к возможности применения первого и второго элементов вместе. Подразумевается, что любой из этих вариантов соответствует значению и, соответственно, удовлетворяет требованию термина «и/или» в контексте данного документа. Кроме того, подразумевается, что одновременное применение более одного из этих вариантов соответствует значению и, соответственно, удовлетворяет требованию термина «и/или».
[0041] Следует также понимать, что термины «около», «приблизительно», «по существу», «главным образом» и подобные термины, используемые в данном документе при упоминании размера или характеристики компонента предпочтительного изобретения, указывают на то, что описанный размер/характеристика не является строгой границей или параметром и не исключает незначительных отклонений от них, которые функционально одинаковы или аналогичны, как будет понятно обычному специалисту в данной области. Как минимум такие ссылки, содержащие числовой параметр, будут включать отклонения, которые при использовании математических и промышленных принципов, принятых в данной области (например, округление, измерение или другие систематические ошибки, производственные допуски и т. д.), не изменят наименьшую значащую цифру.
[0042] Термины «идентичный» или процентная «идентичность» в контексте двух или более нуклеиновых кислот или полипептидных последовательностей (например, антитела к Vβ17/CD123 и кодирующие их полинуклеотиды, полипептиды Vβ17 и кодирующие их полинуклеотиды Vβ17, полипептиды CD123 и кодирующие их полинуклеотиды CD123), две или более последовательностей или подпоследовательностей, которые являются одинаковыми или имеют указанную процентную долю аминокислотных остатков или нуклеотидов, которые являются одинаковыми при сравнении и выравнивании для максимального соответствия, при измерении с применением одного из следующих алгоритмов сравнения последовательностей или визуальной проверки.
[0043] Для сравнения последовательностей, как правило, одна последовательность выступает в качестве эталонной последовательности, с которой сравнивают испытуемую последовательность. При использовании алгоритма сравнения последовательностей в компьютер вводят испытуемую и эталонную последовательности, при необходимости определяют координаты подпоследовательности и определяют параметры программы алгоритма последовательности. Впоследствии алгоритм сравнения последовательностей рассчитывает процентную идентичность последовательности для испытуемой (-ых) последовательности (-ей) по отношению к эталонной последовательности на основе заданных параметров программы.
[0044] Оптимальное выравнивание последовательностей для сравнения можно проводить, например, с помощью алгоритма локальной гомологии по Smith & Waterman, Adv. Appl. Math. 2:482 (1981), с использованием алгоритма выравнивания областей гомологии по Needleman & Wunsch, J. Mol. Biol. 48:443 (1970), с помощью способа поиска подобия по Pearson & Lipman, Proc. Nat'l. Acad. Sci. USA 85:2444 (1988), с помощью компьютеризированных реализаций этих алгоритмов (GAP, BESTFIT, FASTA и TFASTA в пакете программного обеспечения Wisconsin Genetics, Genetics Computer Group, 575 Science Dr., Madison, WI) или путем визуальной проверки (см. по существу Current Protocols in Molecular Biology, F.M. Ausubel et al., eds., Current Protocols, совместное предприятие компаний Greene Publishing Associates, Inc. и John Wiley & Sons, Inc., (1995 Supplement) (Ausubel)).
[0045] Примерами алгоритмов, приемлемых для определения процентной идентичности последовательности и сходства последовательностей, являются алгоритмы BLAST и BLAST 2.0, описанные в работе Altschul et al. (1990) J. Mol. Biol. 215: 403-410 и Altschul et al. (1997) Nucleic Acids Res. 25: 3389-3402, соответственно. Программное обеспечение для проведения BLAST-анализов общедоступно через Национальный центр биотехнологической информации. Данный алгоритм включает, во-первых, идентификацию пар высококачественных последовательностей (HSP) путем идентификации коротких слов длиной W в искомой последовательности, которые либо совпадают, либо удовлетворяют некоторому положительному пороговому показателю T при совмещении со словом той же длины в последовательности базы данных. T называют пороговым показателем сходства соседних слов (Altschul et al. выше). Эти начальные совпадения соседних слов действуют как образец для инициации поиска, чтобы найти более длинные HSP с ними. Совпадения слов затем расширяются в обоих направлениях вдоль каждой последовательности до тех пор, пока совокупный показатель выравнивания можно увеличивать.
[0046] Совокупные баллы вычисляются с использованием параметров М для нуклеотидных последовательностей (балл вознаграждения для пары совпадающих остатков; всегда > 0) и N (штрафной балл за не совпадающие остатки; всегда < 0). Для аминокислотных последовательностей матрицу подсчета балов используют для расчета совокупного балла. Расширение зачетов слов в каждом направлении прекращает, когда: совокупный балл выравнивания падает на величину X от его максимального достигнутого значения; совокупный балл стремится к нулю или ниже вследствие накопления одного или более отрицательных баллов выравнивания остатков; или в конце каждой последовательности. Параметры W, T и X алгоритма BLAST определяют чувствительность и скорость выравнивания. В программе BLASTN (для нуклеотидных последовательностей) по умолчанию используют длину слова (W), равную 11, ожидание (E), равное 10, M=5, N=-4, а также сравнение обоих цепей. Для аминокислотных последовательностей в программе BLASTP по умолчанию используют длину слова (W), равную 3, ожидание (E), равное 10, и матрицу замен BLOSUM62 (см., Henikoff & Henikoff, Proc. Natl. Acad. Sci. USA 89:10915 (1989)).
[0047] В дополнение к проценту идентичности последовательности алгоритм BLAST также выполняет статистический анализ сходства двух последовательностей (см., например, Karlin & Altschul, Proc. Nat'l. Acad. Sci. USA 90:5873-5787 (1993)). Одно измерение сходства, проводимое алгоритмом BLAST, заключается в определении наименьшей суммарной вероятности (P(N)), которая указывает на вероятность, при которой совпадение двух нуклеотидных или аминокислотных последовательностей будет происходить случайным образом. Например, нуклеиновая кислота считается аналогичной эталонной последовательности, если наименьшая суммарная вероятность при сравнении исследуемой нуклеиновой кислоты с эталонной нуклеиновой кислотой составляет менее около 0,1, более предпочтительно менее около 0,01, а наиболее предпочтительно менее около 0,001.
[0048] Дополнительным показателем по существу идентичности двух нуклеотидных последовательностей или двух полипептидов является иммунологическое перекрестное реагирование полипептида, кодируемого первой нуклеиновой кислотой, с полипептидом, кодируемым второй нуклеиновой кислотой, как описано ниже. Таким образом, полипептид, как правило, по существу идентичен второму полипептиду, например, когда два пептида отличаются только консервативными заменами. Другим признаком по существу идентичности двух последовательностей нуклеиновых кислот является гибридизация этих двух молекул друг с другом в строгих условиях.
[0049] Антитела
[0050] В настоящем документе описаны выделенные биспецифические антитела к Vβ17 или их антигенсвязывающие фрагменты, нуклеиновые кислоты и векторы экспрессии, кодирующие антитела, рекомбинантные клетки, содержащие векторы, и композиции, содержащие антитела. Данное изобретение дополнительно относится к выделенным биспецифическим антителам к Vβ17/CD123 или их антигенсвязывающим фрагментам, нуклеиновым кислотам и векторам экспрессии, кодирующим антитела, рекомбинантным клеткам, содержащим векторы, и композициям, содержащим биспецифические антитела. Также предлагаются способы получения антител и способы применения антител для лечения заболеваний, включая злокачественное новообразование. Антитела, описанные в настоящем документе, обладают одним или более желательными функциональными свойствами, включая, без ограничений, высокую аффинность связывания с Vβ17 и/или CD123, высокую специфичность к Vβ17 и/или CD123 и способность лечить или предотвращать злокачественное новообразование при введении отдельно или в комбинации с другими противораковыми терапевтическими средствами.
[0051] В контексте данного документа термин «антитело» используется в широком смысле и включает иммуноглобулин или молекулы антител, включая человеческие, гуманизированные, составные и химерные антитела и фрагменты антител, которые являются моноклональными или поликлональными. В целом антитела представляют собой белки или пептидные цепи, которые демонстрируют специфичность связывания с конкретным антигеном. Структуры антител хорошо известны. Иммуноглобулины можно отнести к пяти основным классам (т.е. I, IgA, IgD, IgE, IgG and IgM), в зависимости от аминокислотной последовательности константного домена тяжелой цепи. IgA и IgG дополнительно подразделяются на изотипы IgA1, IgA2, IgG1, IgG2, IgG3 и IgG4. Легкие цепи антител видов позвоночных можно относить в зависимости от аминокислотных последовательностей их константных доменов к одному из двух четко отличающихся типов, а именно, каппа и лямбда., соответственно, антитела изобретения могут содержать константный домен легкой цепи каппа или лямбда. В соответствии с конкретными вариантами осуществления антитела, описанные в настоящем документе, включают константные области тяжелой и/или легкой цепи, мышиных или человеческих антител. В дополнение к константным доменам тяжелой и легкой цепей антитела содержат антигенсвязывающую область, которая состоит из вариабельной области легкой цепи и вариабельной области тяжелой цепи, каждая из которых содержит три домена (т. е. определяющие комплементарность области 1-3; CDR1, CDR2, и CDR3). Домены вариабельной области легкой цепи альтернативно называются LCDR1, LCDR2 и LCDR3, а домены вариабельной области тяжелой цепи альтернативно называются HCDR1, HCDR2 и HCDR3.
[0052] В контексте данного документа термин «выделенное антитело» относится к антителу, которое по существу не содержит других антител, обладающих другой антигенной специфичностью (например, выделенное антитело, которое специфически связывается с Vβ17, по существу не содержит антител, которые не связываются с Vβ17; выделенное антитело, которое специфически связывается с CD123, по существу не содержит антител, которые не связываются с CD123). Более того, выделенное антитело может по существу не содержать другого клеточного материала и/или химических веществ.
[0053] В контексте данного документа термин «моноклональное антитело» относится к антителу, полученному из популяции в значительной степени однородных антител, то есть отдельные антитела в составе популяции являются идентичными, за исключением мутаций, происходящих по естественным причинам, которые могут присутствовать в небольших количествах. Моноклональные антитела, описанные в настоящем документе, можно получать с использованием гибридомного способа, технологии фагового дисплея, технологии клонирования генов одиночных лимфоцитов или способов рекомбинантной ДНК. Например, моноклональные антитела могут быть получены с помощью гибридомы, которая включает B-клетку, полученную от трансгенного не относящегося к человеку животного, такого как трансгенная мышь или крыса, имеющего геном, содержащий человеческий трансген тяжелой цепи и трансген легкой цепи.
[0054] При использовании в настоящем документе термин «антигенсвязывающий фрагмент» относится к фрагменту антитела, такому как, например, диатело, Fab, Fab', F(ab')2, Fv-фрагмент, стабилизированный дисульфидными связями Fv-фрагмент (dsFv), (dsFv)2, биспецифический dsFv (dsFv-dsFv'), стабилизированное дисульфидными связями диатело (ds-диатело), одноцепочечная молекула антитела (scFv), однодоменное антитело (sdab), scFv-димер (двухвалентное антитело), мультиспецифическое антитело, образованное из части антитела, содержащей одну или более CDR, верблюжье однодоменное антитело, нанотело, доменное антитело, двухвалентное доменное антитело или любой другой фрагмент антитела, который связывается с антигеном, но не содержит полной структуры антитела. Антигенсвязывающий фрагмент обладает возможностью связывания с тем же антигеном, с которым связывается исходное антитело или исходный фрагмент антитела. В соответствии с конкретными вариантами осуществления антигенсвязывающий фрагмент содержит вариабельную область легкой цепи, константную область легкой цепи и Fd-сегмент тяжелой цепи. В соответствии с другими конкретными вариантами осуществления антигенсвязывающий фрагмент содержит Fab и F(ab').
[0055] В контексте данного документа термин «гуманизированное антитело» относится к нечеловеческому антителу, которое модифицировано для увеличения гомологии последовательности по сравнению с антителом человека, так что антигенсвязывающие свойства антитела сохраняются, но его антигенность в человеческом теле уменьшается.
[0056] В контексте данного документа термин «мультиспецифическое антитело» относится к антителу, которое содержит множество последовательностей вариабельного домена иммуноглобулина, где первая последовательность вариабельного домена иммуноглобулина из множества обладает специфичностью связывания к первому эпитопу, а вторая последовательность вариабельного домена иммуноглобулина из множества обладает специфичностью связывания ко второму эпитопу. В варианте осуществления первый и второй эпитопы не перекрываются или по существу не перекрываются. В варианте осуществления первый и второй эпитопы расположены на различных антигенах, например на различных белках (или различных субъединицах мультимерного белка). В варианте осуществления мультиспецифическое антитело содержит третий, четвертый или пятый вариабельный домен иммуноглобулина. В варианте осуществления мультиспецифическое антитело представляет собой молекулу биспецифического антитела, триспецифического антитела или тетраспецифического антитела.
[0057] В контексте данного документа термин «биспецифическое антитело» относится к мультиспецифическому антителу, которое связывает не более двух эпитопов или двух антигенов. Биспецифическое антитело характеризуется первой парой тяжелой и легкой цепей иммуноглобулина, которая обладает специфичностью связывания к первому эпитопу (например, эпитопу на антигене Vβ17), и второй парой тяжелой и легкой цепей иммуноглобулина, которая обладает специфичностью связывания ко второму эпитопу (например, эпитопу на антигене CD123). В варианте осуществления первый и второй эпитопы расположены на различных антигенах, например на различных белках (или различных субъединицах мультимерного белка). В варианте осуществления биспецифическое антитело содержит последовательность вариабельного домена тяжелой цепи и последовательность вариабельного домена легкой цепи, которые обладают специфичностью связывания к первому эпитопу, а также последовательность вариабельного домена тяжелой цепи, и последовательность вариабельного домена легкой цепи, которая обладают специфичностью связывания ко второму эпитопу. В варианте осуществления биспецифическое антитело содержит полуантитело или его фрагмент, обладающий специфичностью связывания к первому эпитопу, и полуантитело или его фрагмент, обладающий специфичностью связывания ко второму эпитопу. В варианте осуществления биспецифическое антитело содержит scFv или его фрагмент, имеющий специфичность связывания к первому эпитопу, и scFv или его фрагмент, имеющий специфичность связывания ко второму эпитопу. В варианте осуществления первый эпитоп расположен на Vβ17, а второй эпитоп расположен на CD123. В одном варианте осуществления первый эпитоп расположен на Vβ17, а второй эпитоп расположен на PD-1, PD-L1, CTLA-4, EGFR, HER-2, CD19, CD20, CD3 и/или других связанных с опухолью иммунных супрессорах или поверхностных антигенах.
[0058] Термин «полуантитело» при использовании в настоящем документе означает одну тяжелую цепь иммуноглобулина, связанную с одной легкой цепью иммуноглобулина. Пример полуантитела показан в SEQ ID NO:28. Специалисту в данной области будет понятно, что полуантитело может включать ее фрагмент и может также иметь антигенсвязывающий домен, состоящий из одиночного вариабельного домена, например, происходящего от представителей семейства верблюдовых.
[0059] Используемый в настоящем документе термин «Vβ17» относится к Т-клеточному рецептору, который экспрессируется в ответ на иммунный ответ на цитотоксическую Т-клетку. Vβ17-экспрессирующие CD8+ T-клетки обычно продуцируются у субъекта в ответ на воздействие вируса гриппа А. Vβ17-экспрессирующие CD8+ T-клетки обеспечивают сильный эффект в ответ на воздействие гриппа на организм субъекта. Термин Vβ17 включает в себя любой вариант, изоформу и видовой гомолог Vβ17, который в природе экспрессируется клетками (включая Т-клетки) или который может экспрессироваться на клетках, трансфицированных генами или кДНК, кодирующей полипептид. Если не указано иное, Vβ17 предпочтительно представляет собой Vβ17 человека. Аминокислотная последовательность Vβ17 человека представлена в GenBank под учетным номером AAB49730.1.
[0060] Термин «CD123» относится к молекуле, присутствующей на клетках, которая помогает передавать сигнал интерлейкина-3, представляющего собой растворимый цитокин, играющий важную роль в иммунной системе. CD123 также может называться «рецептором интерлейкина-3». Рецептор относится к семейству цитокиновых рецепторов I типа и представляет собой гетеродимер с уникальной альфа-цепью в паре с общей бета-субъединицей (бета с или CD131). Рецептор CD123 находится на плюрипотентных клетках-предшественниках и может индуцировать фосфорилирование тирозина внутри клетки и стимулировать пролиферацию и дифференциацию в гемопоэтических клеточных линиях. CD123 может также экспрессироваться в подтипах острого миелоидного лейкоза (ОМЛ). Термин CD123 при отсутствии особых указаний включает в себя любой вариант, изоформу, и видовой гомолог CD123, который в природе экспрессируется клетками (включая Т-клетки) или который может экспрессироваться на клетках, трансфицированных генами или кДНК, кодирующей эти полипептиды, предпочтительно «CD123» представляет собой человеческий CD123. Аминокислотная последовательность человеческого CD123 представлена в GenBank под учетным номером AY789109.1.
[0061] В контексте настоящего документа антитело, которое «специфически связывается с Vβ17», относится к антителу, которое связывается с Vβ17, предпочтительно с Vβ17 человека, с KD 1×10-7 М или менее, предпочтительно 1×10-8 М или менее, более предпочтительно 5×10-9 М или менее, 1×10-9 М или менее, 5×10-10 М или менее или 1×10-10 М или менее. Термин KD означает константу диссоциации, которая представляет собой отношение Kd к Ka (т. е. Kd/Ka) и выражается в молярной концентрации (M). Значения KD для антител можно определять с помощью способов данной области техники, относящихся к настоящему описанию. Например, KD антитела может быть определена с помощью поверхностного плазмонного резонанса, например, с помощью системы биосенсоров, например, системы Biacore®, или с использованием технологии интерферометрии биослоев, например, системы Octet RED96.
[0062] В контексте настоящего документа антитело, которое «специфически связывается с CD123», относится к антителу, которое связывается с CD123, предпочтительно с CD123 человека, с KD 1×10-7 М или менее, предпочтительно 1×10-8 М или менее, более предпочтительно 5×10-9 М или менее, 1×10-9 М или менее, 5×10-10 М или менее или 1×10-10 М или менее. Термин KD означает константу диссоциации, которая представляет собой отношение Kd к Ka (т. е. Kd/Ka) и выражается в молярной концентрации (M). Значения KD для антител можно определять с помощью способов данной области техники, относящихся к настоящему описанию. Например, KD антитела может быть определена с помощью поверхностного плазмонного резонанса, например, с помощью системы биосенсоров, например, системы Biacore®, или с использованием технологии интерферометрии биослоев, например, системы Octet RED96.
[0063] Чем меньше значение KD антитела, тем выше аффинность, с которой антитело связывается с целевым антигеном.
[0064] В соответствии с конкретным аспектом изобретение относится к выделенному биспецифическому антителу Vβ17 или его антигенсвязывающему фрагменту, содержащему (a) первую тяжелую цепь (HC1); (b) вторую тяжелую цепь (HC2); (c) первую легкую цепь (LC1); и (d) вторую легкую цепь (LC2). HC1 может быть связана с LC1, а HC2 может быть связана с LC2. HC1 может содержать определяющую комплементарность область тяжелой цепи 1 (HCDR1), HCDR2 и HCDR3, содержащие аминокислотные последовательности SEQ ID NO:1, SEQ ID NO:2 и SEQ ID NO:3, соответственно, и LC1 может содержать определяющую комплементарность область легкой цепи 1 (LCDR1), LCDR2 и LCDR3, содержащие аминокислотные последовательности SEQ ID NO:4, SEQ ID NO:5 и SEQ ID NO:6, соответственно.
[0065] HC1 и LC1 образуют сайт связывания для первого антигена, а HC2 и LC2 образуют сайт связывания для второго антигена. В качестве примера сайт связывания для первого антигена может связываться с Vβ17 на Т-клетке CD8+ или CD4+, а сайт связывания для второго антигена может, например, связываться с опухолевым антигеном, присутствующим на поверхности раковой клетки. Связывание биспецифического антитела Vβ17 с Vβ17, присутствующим на поверхности Т-клетки CD8+ или CD4+, и связывание опухолевого антигена, присутствующего на поверхности раковых клеток, может, например, приводить к уничтожению раковой клетки.
[0066] Также в данном документе предложены биспецифические антитела к Vβ17/CD123 или их антигенсвязывающие фрагменты, содержащие антитело к Vβ17 или его антигенсвязывающий фрагмент и антитело к CD123 или его антигенсвязывающий фрагмент. В определенных вариантах осуществления биспецифическое антитело к Vβ17/CD123 или его антигенсвязывающий фрагмент содержит: (а) первую тяжелую цепь (НС1); (b) вторую тяжелую цепь (HC2); (c) первую легкую цепь (LC1); и вторую легкую цепь (LC2), HC1 связана с LC1, а HC2 связана с LC2. В определенных вариантах осуществления HC1 содержит определяющую комплементарность область тяжелой цепи 1 (HCDR1), HCDR2 и HCDR3, содержащие аминокислотные последовательности SEQ ID NO:1, SEQ ID NO:2 и SEQ ID NO:3, соответственно, и LC1 содержит определяющую комплементарность область легкой цепи 1 (LCDR1), LCDR2 и LCDR3, содержащие аминокислотные последовательности SEQ ID NO:4, SEQ ID NO:5 и SEQ ID NO:6, соответственно. В определенных вариантах осуществления HC2 содержит определяющую комплементарность область тяжелой цепи 1 (HCDR1), HCDR2 и HCDR3, содержащие аминокислотные последовательности SEQ ID NO:34, SEQ ID NO:35 и SEQ ID NO:36, соответственно, и LC2 содержит определяющую комплементарность область легкой цепи 1 (LCDR1), LCDR2 и LCDR3, содержащие аминокислотные последовательности SEQ ID NO:37, SEQ ID NO:38 и SEQ ID NO:39, соответственно
[0067] В определенных вариантах осуществления HC1 может, например, содержать аминокислотную последовательность SEQ ID NO:13, а LC1 может, например, содержать аминокислотную последовательность SEQ ID NO:14 с образованием сайта связывания для первого антигена, который специфически связывается с Vβ17. HC2 может, например, содержать аминокислотную последовательность SEQ ID NO:15, а LC2 может, например, содержать аминокислотную последовательность SEQ ID NO:16 с образованием сайта связывания для второго антигена, который специфически связывается с CD123.
[0068] В определенных вариантах осуществления Vβ17 находится на поверхности Т-клетки CD8+ или CD4+. В определенных вариантах осуществления CD123 находится на поверхности раковой клетки (например, лейкозной клетки).
[0069] В некоторых вариантах осуществления биспецифические антитела, описанные в настоящем документе, могут иметь форму диатела, кросс-тела или биспецифического антитела, полученного посредством контролируемого обмена Fab-плечами, как описано в настоящем документе.
[0070] В некоторых вариантах осуществления биспецифические антитела включают в себя IgG-подобные молекулы с комплементарными доменами CH3, которые способствуют гетеродимеризации; рекомбинантные IgG-подобные молекулы с двойным нацеливанием, где каждая из двух сторон молекулы содержит Fab-фрагмент или часть Fab-фрагмента по меньшей мере двух разных антител; слитые молекулы IgG, в которых полноразмерные антитела IgG слиты с дополнительным Fab-фрагментом или частями Fab-фрагмента; слитые молекулы Fc, в которых одноцепочечные молекулы Fv или стабилизированные диатела слиты с константными доменами тяжелой цепи, областями Fc или их частями; слитые молекулы Fab, в которых разные Fab-фрагменты слиты друг с другом; антитела из тяжелых цепей на основе ScFv и диател (например, доменные антитела, нанотела), в которых разные одноцепочечные молекулы Fv, или разные диатела, или разные антитела из тяжелых цепей (например, доменные антитела, нанотела) слиты друг с другом, или с другим белком, или молекулой-носителем.
[0071] В некоторых вариантах осуществления IgG-подобные молекулы с комплементарными доменами CH3 включают в себя молекулы Triomab/Quadroma (Trion Pharma/Fresenius Biotechthe), «выступы во впадины» (Genentech), CrossMAb (Roche) и электростатически-спариваемые (Amgen), LUZ-Y (Genentech), сконструированное посредством обмена цепей доменное антитело (SEEDbody) (EMD Serono), Biclonic (Merus) и DuoBody (Genmab A/S).
[0072] В некоторых вариантах осуществления рекомбинантные IgG-подобные молекулы двойного нацеливания включают в себя молекулы (DT)-Ig двойного нацеливания (GSK/Domantis), антитело «два в одном» (Genentech), поперечносшитые Mab (Karmanos Cancer Center), mAb2 (F-Star) и CovX-body (CovX/Pfizer).
[0073] В некоторых вариантах осуществления слитые молекулы IgG включают в себя молекулы (DVD)-Ig с двойным вариабельным доменом (DVD) (Abbott), IgG-подобную биспецифическую молекулу (InnClone/Eli Lilly), Ts2Ab (MedImmune/AZ) и BsAb (Zymogenetics), HERCULES (Biogen Idec) и TvAb (Roche).
[0074] В некоторых вариантах осуществления слитые Fc-молекулы могут включать в себя слияния ScFv/Fc (Academic Institution), SCORPION (Emergent BioSolutions/Trubion, Zymogenetics/BMS), перенацеливающиеся антитела с двойной аффинностью (Fc-DART) (MacroGenics) и Dual(ScFv) 2-Fab (National Research Center for Antibody Medicine, Китай).
[0075] В некоторых вариантах осуществления биспецифические антитела со слитыми Fab включают в себя F(ab)2 (Medarex/AMGEN), «двойного действия» или Bis-Fab (Genentech), Dock-and-Lock (DNL) (ImmunoMedics), двухвалентное биспецифическое антитело (Biotecnol) и Fab-Fv (UCB-Celltech). Антитела на основе ScFv, диател и доменные антитела включают в себя, без ограничений, биспецифический T-клеточный активатор (BiTE) (Micromet), тандемное диатело (Tandab) (Affimed), перенацеливающиеся антитела с двойной аффинностью (DART) (MacroGenics), одноцепочечное диатело (Academic), TCR-подобные антитела (AIT, ReceptorLogics), слитый белок ScFv и человеческого сывороточного альбумина (Merrimack), COMBODY (Epigen Biotech), нанотела с двойным нацеливанием (Ablynx), доменные антитела с двойным нацеливанием, имеющие только тяжелую цепь.
[0076] Полноразмерные биспецифические антитела, описанные в настоящем документе, можно получать, например, путем обмена Fab-плечами (или обмена полумолекулами) между двумя моноспецифическими двухвалентными антителами, посредством введения в CH3-интерфейс тяжелой цепи в каждой полумолекуле замен, способствующих образованию гетеродимера из двух полумолекул антител, имеющих разную специфичность, либо in vitro в бесклеточной среде, либо с использованием совместной экспрессии. Реакция обмена Fab-плечами является результатом реакции дисульфидной изомеризации и диссоциации-ассоциации CH3-доменов. Восстанавливаются дисульфидные связи тяжелых цепей в шарнирных участках исходных моноспецифических антител. Полученные свободные цистеины одного из исходных моноспецифических антител образуют дисульфидную связь тяжелых цепей с цистеиновыми остатками второй исходной молекулы моноспецифического антитела, и одновременно CH3-домены исходных антител высвобождаются и происходит переформирование путем диссоциации-ассоциации. CH3-домены Fab-плеч можно конструировать с возможностью обеспечения гетеродимеризации, а не гомодимеризации. Полученный продукт представляет собой биспецифическое антитело, имеющее два Fab-плеча или полумолекулы, каждая из которых связывает отдельный эпитоп, то есть эпитоп на Vβ17 и эпитоп на опухолевом антигене.
[0077] Термин «гомодимеризация» в настоящем документе обозначает взаимодействие двух тяжелых цепей, имеющих идентичные аминокислотные последовательности CH3. Термин «гомодимер» в настоящем документе обозначает антитело, имеющее две тяжелые цепи с идентичными аминокислотными последовательностями CH3.
[0078] Термин «гетеродимеризация» в настоящем документе обозначает взаимодействие двух тяжелых цепей, имеющих неидентичные аминокислотные последовательности CH3. Термин «гетеродимер» в настоящем документе обозначает антитело, имеющее две тяжелые цепи с неидентичными аминокислотными последовательностями CH3.
[0079] Для создания полноразмерных биспецифических антител можно использовать стратегию «выступ во впадину» (см., например, международную публикациях № WO 2006/028936). Вкратце, выбранные аминокислоты, образующие интерфейс между доменами CH3 в человеческом IgG, можно подвергать мутации в положениях, влияющих на взаимодействия доменов CH3 и тем самым способствовать образованию гетеродимера. Аминокислоту с короткой боковой цепью (впадина) вводят в тяжелую цепь антитела, которое специфически связывается с первым антигеном, а аминокислоту с длинной боковой цепью (выступ) вводят в тяжелую цепь антитела, которое специфически связывается со вторым антигеном. После совместной экспрессии двух антител в результате предпочтительного взаимодействия тяжелой цепи с «впадиной» и тяжелой цепи с «выступом» образуется гетеродимер. Примерами пар замен в CH3, образующих выступ и впадину, являются (указано как модифицированное положение в первом домене CH3 первой тяжелой цепи/модифицированное положение во втором домене CH3 второй тяжелой цепи): T366Y/F405A, T366W/F405W, F405W/Y407A, T394W/Y407T, T394S/Y407A, T366W/T394S, F405W/T394S и T366W/T366S_L368A_Y407V.
[0080] Можно использовать другие стратегии, такие как стимулирование гетеродимеризации тяжелых цепей с использованием электростатических взаимодействий путем введения замен положительно заряженных остатков на одной поверхности CH3 и отрицательно заряженных остатков на другой поверхности CH3, как описано в патентной публикации США № US2010/0015133; патентной публикации США № US2009/0182127; патентной публикации США № US2010/028637; или патентной публикации США № US2011/0123532. В других стратегиях гетеродимеризацию можно стимулировать путем следующих замен (указано модифицированное положение в первом домене CH3 первой тяжелой цепи/модифицированное положение во втором домене CH3 второй тяжелой цепи): L351Y_F405AY407V/T394W, T366I_K392M_T394W/F405A_Y407V, T366L_K392M_T394W/F405A_Y407V, L351Y_Y407A/T366A_K409F, L351Y_Y407A/T366V K409F Y407A/T366A_K409F или T350V_L351Y_F405A Y407V/T350V_T366L_K392L_T394W, как описано в патентной публикации США № US2012/0149876 или патентной публикации США № US2013/0195849.
[0081] В дополнение к вышеописанным способам биспецифические антитела, описанные в настоящем документе, можно создавать in vitro в бесклеточной среде посредством введения асимметричных мутаций в CH3-участках двух моноспецифических гомодимерных антител и образования биспецифических гетеродимерных антител из двух исходных моноспецифических гомодимерных антител в восстановительных условиях, что способствует изомеризации дисульфидной связи, в соответствии со способами, описанными в публикации международной патентной заявки № W02011/131746. В этих способах первое моноспецифическое двухвалентное антитело (например, антитело к CD33) и второе моноспецифическое двухвалентное антитело (например, антитело к CD3) конструируют так, чтобы они имели определенные замены в домене CH3, обеспечивающие стабильность гетеродимера; антитела инкубируют вместе в восстановительных условиях, достаточных для обеспечения подверженности цистеинов в шарнирной области изомеризации дисульфидной связи; получая таким образом биспецифическое антитело в результате обмена плечами Fab. При необходимости условия инкубации можно вернуть к невосстановительным условиям. Примерами восстанавливающих агентов, которые можно использовать, являются 2-меркаптоэтиламин (2-MEA), дитиотреитол (DTT), дитиоэритрит (DTE), глутатион, трис(2-карбоксиэтил)фосфин (TCEP), L-цистеин и бета-меркаптоэтанол, предпочтительно восстанавливающий агент выбирают из группы, состоящей из: 2-меркаптоэтиламина, дитиотреитола и трис(2-карбоксиэтил)фосфина. Например, можно использовать инкубирование в течение по меньшей мере 90 мин при температуре по меньшей мере 20°C в присутствии по меньшей мере 25 мМ 2-MEA или в присутствии по меньшей мере 0,5 мМ дитиотреитола при уровне pH 5-8, например при pH=7,0 или при pH=7,4.
[0082] В определенных вариантах антитело к Vβ17 или его антигенсвязывающий фрагмент содержит определяющую комплементарность область 1 тяжелой цепи (HCDR1), HCDR2, HCDR3 и определяющую комплементарность область 1 легкой цепи (LCDR1), LCDR2 и LCDR3, имеющие полипептидную последовательность:
a. SEQ ID NO:1, 2, 3, 4, 5 и 6, соответственно;
и антитело к CD123 или его антигенсвязывающий фрагмент содержит определяющую комплементарность область 1 тяжелой цепи (HCDR1), HCDR2, HCDR3 и определяющую комплементарность область 1 легкой цепи (LCDR1), LCDR2 и LCDR3, имеющие полипептидную последовательность:
1. SEQ ID NO:34, 35, 36, 37, 38 и 39, соответственно.
[0083] В соответствии с другим конкретным аспектом данное изобретение относится к выделенному биспецифическому антителу к Vβ17/CD123 или его антигенсвязывающему фрагменту, которое индуцирует антителозависимую клеточно-опосредованную цитотоксичность (ADCC). Биспецифическое антитело или его антигенсвязывающий фрагмент может, например, индуцировать ADCC in vitro. Биспецифическое антитело или его антигенсвязывающий фрагмент может индуцировать ADCC с EC50 менее чем около 1 пМ. В определенных вариантах осуществления значение EC50 составляет менее около 1 пМ, менее около 0.9 пМ, менее около 0,8 пМ, менее около 0,7 пМ, менее около 0,6 пМ, менее около 0,5 пМ, менее около 0,4 пМ, менее около 0,300 пМ, менее около 0,2 пМ, менее около 0,19 пМ, менее около 0,18 пМ, менее около 0,17 пМ, менее около 0,16 пМ, менее около 0,15 пМ, менее около 0,14 пМ, менее около 0,13 пМ, менее около 0,12 пМ, менее около 0,11 пМ, менее около 0,1 пМ, менее около 0,09 пМ, менее около 0,08 пМ, менее около 0,07 пМ, менее около 0,06 пМ, менее около 0,05 пМ, менее около 0,04 пМ, менее около 0,03 пМ, менее около 0,02 пМ, or менее около 0,01 пМ. В определенных вариантах осуществления биспецифическое антитело к Vβ17/CD123 или его антигенсвязывающий фрагмент содержит каркас IgG1, IgG2, IgG3 или IgG4. В одном таком варианте осуществления биспецифическое антитело к Vβ17/ CD123 или его антигенсвязывающий фрагмент имеет каркас изотипа IgG4.
[0084] В некоторых вариантах осуществления, описанных в данном документе, иммуноэффекторные свойства биспецифических антител к Vβ17/CD123 могут быть усилены или ослаблены за счет модификаций Fc с помощью методик, известных специалистам в данной области техники. Например, эффекторные функции Fc-фрагмента, такие как связывание Clq, комплементзависимая цитотоксичность (CDC), антителозависимая клеточно-опосредованная цитотоксичность (ADCC), антителозависимый клеточно-опосредованный фагоцитоз (ADCP), понижающая регуляция рецепторов клеточной поверхности (например, рецептора B-клетки; BCR) и т.п., могут обеспечиваться и/или управляться модифицирующими остатками в Fc-фрагменте, ответственными за эти действия.
[0085] «Антителозависимая клеточно-опосредованная цитотоксичность», или ADCC, представляет собой клеточно-опосредованную реакцию, при которой неспецифические цитотоксические клетки, экспрессирующие рецепторы Fc (FcRc) (например, естественные киллерные (ЕК) клетки, нейтрофилы и макрофаги), распознают связанное антитело на клетке-мишени и впоследствии вызывают лизис клетки-мишени.
[0086] Способность антител индуцировать ADCC можно усилить путем конструирования их олигосахаридного компонента. IgG1 или IgG3 человека претерпевают N-гликозилирование по Asn297 большинством гликанов в хорошо известных 2-антеннальных формах G0, G0F, G1, G1F, G2 или G2F. Антитела, продуцируемые несконструированными клетками CHO, как правило, имеют содержание фукозы в гликанах по меньшей мере около 85%. Удаление центральной фукозы из олигосахаридов типа 2-антеннального комплекса, присоединенных к областям Fc, усиливает ADCC антител посредством улучшенного связывания FcγRIIIa без изменения связывания с антигеном или активности CDC. Такие Ab можно получать с помощью различных способов, которые, по имеющимся данным, приводят к успешной экспрессии антител с относительно высокой степенью дефукозилирования, несущих Fc-олигосахариды типа 2-антеннарного комплекса, такими способами, как контроль осмоляльности культуральной среды (Konno et al., Cytotechnology 64:249-65, 2012), применение в качестве линии клеток-хозяев вариантной линии CHO Lec13 (Shields et al., J Biol Chem 277:26733-26740, 2002), применение в качестве линии клеток-хозяев вариантной линии клеток CHO EB66 (Olivier et al., MAbs; 2(4), 2010; электронное издание до печатного издания; PMID:20562582), применение линии клеток гибридомы крыс YB2/0 в качестве линии клеток-хозяев (Shinkawa et al., J Biol Chem 278:3466-3473, 2003), введение малой интерферирующей РНК, специфической к гену α-1,6-фукозилтрансферазы (FUT8) (Mori et al., Biotechnol Bioeng88:901-908, 2004), или коэкспрессия β-1,4-N-ацетилглюкозаминилтрансферазы III и α-маннозидазы II комплекса Гольджи, или применение сильного ингибитора альфа-маннозидазы I, кифунензина (Ferrara et al., J Biol Chem 281:5032-5036, 2006, Ferrara et al., Biotechnol Bioeng 93:851-861, 2006; Xhou et al., Biotechnol Bioeng 99:652-65, 2008).
[0087] В некоторых вариантах осуществления, описанных в настоящем документе, ADCC, вызванную биспецифическими антителами к Vβ17/CD123, также можно усилить путем введения некоторых замен в Fc-область антитела. Примеры замен включают, например, замены в аминокислотных позициях 256, 290, 298, 312, 356, 330, 333, 334, 360, 378 или 430 (нумерация остатков в соответствии с индексом ЕС), как описано в патенте США № 6,737,056.
[0088] В соответствии с другим конкретным аспектом изобретение относится к выделенному биспецифическому антителу к Vβ17/CD123 или его антигенсвязывающему фрагменту, способному индуцировать Т-клеточно-зависимую цитотоксичность в Vβ17-экспрессирующих клетках и/или CD123-экспрессирующих клетках. Биспецифическое антитело или его антигенсвязывающий фрагмент могут, например, индуцировать Т-клеточно-зависимую цитотоксичность в Vβ17-экспрессирующих клетках и/или CD123-экспрессирующих клетках in vitro, а значение EC50 при этом составляет менее около 2 нМ. В определенных вариантах осуществления EC50 составляет менее около 2,0 нМ, менее около 1,9 нМ, менее около 1,8 нМ, менее около 1,7 нМ, менее около 1,6 нМ, менее около 1,5 нМ, менее около 1,4 нМ, менее около 1,3 нМ, менее около 1,2 нМ, менее около 1,1 нМ, менее около 1,0 нМ, менее около 0,9 нМ, менее около 0,8 нМ, менее около 0,7 нМ, менее около 0,6 нМ, менее около 0,5 нМ, менее около 0,4 нМ, менее около 0,3 нМ, менее около 0,2 нМ и менее около 0,1 нМ.
[0089] В соответствии с другим конкретным аспектом изобретение относится к выделенному биспецифическому антителу к Vβ17/CD123 или его антигенсвязывающему фрагменту, где биспецифическое антитело к Vβ17/CD123 или его антигенсвязывающий фрагмент является химерным.
[0090] В соответствии с другим конкретным аспектом изобретение относится к выделенному биспецифическому антителу к Vβ17/CD123 или его антигенсвязывающему фрагменту, где биспецифическое антитело к Vβ17/CD123 или его антигенсвязывающий фрагмент являются человеческими или гуманизированными.
[0091] В другом общем аспекте данное изобретение относится к выделенному гуманизированному моноклональному антителу к Vβ17 или его антигенсвязывающему фрагменту. Выделенное гуманизированное моноклональное антитело Vβ17 или его антигенсвязывающий фрагмент содержит аминокислотную последовательность, по меньшей мере на 85%, предпочтительно на 90%, более предпочтительно на 95% или более, например на 95%, на 96%, на 97%, на 98% или на 99% идентичную аминокислотной последовательности SEQ ID NO:28. В определенных вариантах осуществления гуманизированное моноклональное антитело Vβ17 или его антигенсвязывающий фрагмент содержит аминокислотную последовательность SEQ ID NO:28.
[0092] В другом общем аспекте данное изобретение относится к выделенным нуклеиновым кислотам, кодирующим моноклональные антитела или их антигенсвязывающие фрагменты, описанные в данном документе. В другом общем аспекте данное изобретение относится к выделенным нуклеиновым кислотам, кодирующим биспецифические антитела или их антигенсвязывающие фрагменты, описанные в данном документе. Специалистам в данной области техники будет понятно, что кодирующая последовательность белка может быть изменена (например, путем замены, делеции, вставки и т.п.) без изменения аминокислотной последовательности белка., соответственно, специалистам в данной области техники будет понятно, что последовательности нуклеиновых кислот, кодирующие моноклональные антитела и/или биспецифические антитела, описанные в настоящем документе, могут быть изменены без изменения аминокислотных последовательностей белков.
[0093] В еще одном общем аспекте настоящее изобретение относится к векторам, содержащим выделенные нуклеиновые кислоты, описанные в настоящем документе. Можно использовать любой вектор, известный специалистам в данной области техники с учетом данного описания, такой как плазмида, космида, фаговый вектор или вирусный вектор. В некоторых вариантах осуществления вектор представляет собой рекомбинантный экспрессионный вектор, такой как плазмида. Вектор может включать любой элемент для обеспечения стандартной функции экспрессионного вектора, например промотор, элемент для связывания с рибосомой, терминатор, энхансер, селективный маркер и точку начала репликации. Промотор может представлять собой конститутивный, индуцируемый или репрессируемый промотор. Ряд экспрессионных векторов, способных доставлять нуклеиновые кислоты в клетку, известны в данной области и могут быть использованы в настоящем изобретении для получения в клетке антитела или его антигенсвязывающего фрагмента. Для генерации рекомбинантного экспрессионного вектора по вариантам осуществления, описанным в настоящем документе, можно использовать традиционные клональные методы или синтез искусственных генов. Такие методики хорошо известны специалистам в данной области техники в контексте данного описания.
[0094] В другом общем аспекте изобретение относится к клеткам-хозяевам, содержащим выделенные нуклеиновые кислоты, кодирующие моноклональные антитела и/или биспецифические антитела или их антигенсвязывающие фрагменты, описанные в данном документе. В контексте настоящего описания для рекомбинантной экспрессии антител или их антигенсвязывающих фрагментов, описанных в настоящем документе, можно применять любую клетку-хозяин, известную специалистам в данной области. В некоторых вариантах осуществления клетки-хозяева представляют собой клетки E. coli TG1 или BL21 (для экспрессии, например, scFv или Fab-антитела), клетки CHO-DG44, или CHO-K1, или клетки HEK293 (для экспрессии, например, полноразмерного антитела IgG). В соответствии с конкретными вариантами осуществления рекомбинантный вектор экспрессии трансформируют в клетки-хозяева традиционными способами, такими как химическая трансфекция, тепловой шок или электропорация, где он стабильно интегрируется в геном клетки-хозяина так, что рекомбинантная нуклеиновая кислота эффективно экспрессируется.
[0095] В другом общем аспекте изобретение относится к способу получения биспецифического антитела или его антигенсвязывающего фрагмента, описанному в данном документе. Способы включают культивирование клетки, содержащей нуклеиновую кислоту, кодирующую биспецифическое антитело или его антигенсвязывающий фрагмент, в условиях для получения биспецифического антитела или его антигенсвязывающего фрагмента, описанного в данном документе, и восстановление антитела или его антигенсвязывающего фрагмента из клетки или клеточной культуры (например, из супернатанта). Экспрессированные антитела или их антигенсвязывающие фрагменты можно собирать из клеток и очищать в соответствии с общепринятыми методиками, известными в данной области техники и как описано в данном документе.
Способы применения изобретения
[0096] В другом общем аспекте изобретение относится к способу нацеливания на CD123 на поверхности раковой клетки, включающему воздействие на раковую клетку биспецифического антитела к Vβ71/CD123 или его антигенсвязывающего фрагмента.
[0097] Функциональная активность биспецифических антител и их антигенсвязывающих фрагментов, которые связывают Vβ17 и/или CD123, может быть охарактеризована способами, известными в данной области техники и описанными в данном документе. Способы характеризации антител и их антигенсвязывающих фрагментов, которые связывают Vβ17 и/или CD123, включают, но не ограничиваются ими, анализы аффинности и специфичности, включая анализ Biacore, ИФА и проточную цитометрию; анализы связывания для обнаружения связывания антител с CD123 на раковых клетках с помощью метода анализа сортировки клеток с активированной флуоресценцией; анализы связывания для обнаружения связывания антител с Vβ17 на Т-клетках CD8+ или CD4+. В соответствии с конкретными вариантами осуществления способы характеризации антител и их антигенсвязывающих фрагментов, которые связываются с Vβ17 и/или CD123, включают способы, описанные ниже.
[0098] В еще одном общем аспекте изобретение относится к способу направления Vβ17-экспрессирующих Т-клеток CD8+ или CD4+ к раковой клетке. Способы включают приведение Vβ17-экспрессирующей Т-клетки CD8+ или CD4+ в контакт с биспецифическим антителом к Vβ71/CD123 или его антигенсвязывающим фрагментом, а антитело или фрагмент антитела направляет Vβ17-экспрессирующую Т-клетку CD8+ или CD4+ к раковой клетке, имеющей на своей поверхности CD123.
[0099] В еще одном общем аспекте настоящее изобретение относится к способу ингибирования роста или пролиферации раковых клеток. Способы включают приведение Vβ17-экспрессирующих Т-клеток CD8+ в контакт с биспецифическим антителом к Vβ71/CD123 или его антигенсвязывающим фрагментом, и приведение раковых клеток в контакт с антителом или фрагментом антитела ингибирует рост или пролиферацию раковых клеток.
[00100] В соответствии с вариантами осуществления настоящего изобретения описанное биспецифическое антитело к Vβ71/CD123 или его антигенсвязывающий фрагмент могут быть представлены в композиции, содержащей буфер для хранения или применения. Приемлемые буферы для хранения описанного биспецифического антитела к Vβ71/CD123 или его антигенсвязывающего фрагмента будут служить для поддержания стабильности антитела или фрагмента антитела путем сведения к минимуму деградации при хранении, не способствуя агрегации антитела или фрагмента антитела, или сведения к минимуму адгезии к сосуду для хранения.
ВАРИАНТЫ ОСУЩЕСТВЛЕНИЯ
[00101] В данном изобретении предложены следующие не имеющие ограничительного характера варианты осуществления.
[00102] Вариант осуществления 1 представляет собой выделенное биспецифическое антитело Vβ17 или его антигенсвязывающий фрагмент, где выделенное биспецифическое антитело Vβ17 или его антигенсвязывающий фрагмент содержит:
a. первую тяжелую цепь (HC1);
b. вторую тяжелую цепь (HC2);
c. первую легкую цепь (LC1); и
d. вторую легкую цепь (LC2),
где HC1 связана с LC1, а HC2 связана с LC2, и при этом HC1 содержит определяющую комплементарность область тяжелой цепи 1 (HCDR1), HCDR2 и HCDR3, содержащие аминокислотные последовательности SEQ ID NO:1, SEQ ID NO:2 и SEQ ID NO:3, соответственно, и LC1 содержит определяющую комплементарность область легкой цепи 1 (LCDR1), LCDR2 и LCDR3, содержащие аминокислотные последовательности SEQ ID NO:4, SEQ ID NO:5 и SEQ ID NO:6, соответственно, с образованием сайта связывания для первого антигена, и при этом HC2 и LC2 образуют сайт связывания для второго антигена.
[00103] Вариант осуществления 2 представляет собой биспецифическое антитело Vβ17 или его антигенсвязывающий фрагмент по варианту осуществления 1, в котором сайт связывания для первого антигена связывается с Vβ17 на Т-клетке CD8+ или CD4+.
[00104] Вариант осуществления 3 представляет собой биспецифическое антитело Vβ17 или его антигенсвязывающий фрагмент по варианту осуществления 1 или 2, в котором сайт связывания для второго антигена связывается с опухолевым антигеном, присутствующим на поверхности раковой клетки.
[00105] Вариант осуществления 4 представляет собой биспецифическое антитело Vβ17 или антигенсвязывающий фрагмент по любому из вариантов осуществления 1-3, в котором HC1 и LC1 гуманизированы.
[00106] Вариант осуществления 5 представляет собой биспецифическое антитело Vβ17 или его антигенсвязывающий фрагмент по любому из вариантов осуществления 1-4, в котором HC2 и LC2 связываются с CD123.
[00107] Вариант осуществления 6 представляет собой биспецифическое антитело Vβ17 или его антигенсвязывающий фрагмент по любому из вариантов осуществления с 1 по 5, где биспецифическое антитело или его антигенсвязывающий фрагмент является изотипом IgG.
[00108] Вариант осуществления 7 представляет собой биспецифическое антитело Vβ17 или его антигенсвязывающий фрагмент по любому из вариантов осуществления с 1 по 6, где биспецифическое антитело или его антигенсвязывающий фрагмент является изотипом IgG4.
[00109] Вариант осуществления 8 представляет собой биспецифическое антитело Vβ17 или его антигенсвязывающий фрагмент по любому из вариантов осуществления с 1 по 7, где биспецифическое антитело или его антигенсвязывающий фрагмент индуцирует цитотоксичность, зависимую от Т-клеток CD8+ или CD4+, раковой клетки in vitro, а значение EC50 при этом составляет менее около 0,2 пМ.
[00110] Вариант 9 осуществления представляет собой выделенную нуклеиновую кислоту, кодирующую HC1 и LC1 биспецифического антитела Vβ17 или его антигенсвязывающего фрагмента по любому из вариантов осуществления 1-8.
[00111] Вариант осуществления 10 представляет собой выделенную нуклеиновую кислоту, кодирующую HC2 и LC2 биспецифического антитела Vβ17 или его антигенсвязывающего фрагмента по любому из вариантов осуществления 1-8.
[00112] Вариант осуществления 11 представляет собой вектор, содержащий выделенную нуклеиновую кислоту по варианту осуществления 9 или варианту осуществления 10.
[00113] Вариант осуществления 12 представляет собой клетку-хозяина, содержащую вектор по варианту осуществления 11.
[00114] Вариант осуществления 13 представляет собой композицию, содержащую буфер, также содержащую выделенное биспецифическое антитело Vβ17 или его антигенсвязывающий фрагмент по любому из вариантов осуществления 1-8 и буферный раствор.
[00115] Вариант осуществления 14 представляет собой выделенное биспецифическое антитело к Vβ17/CD123 или его антигенсвязывающий фрагмент, содержащие:
a. первую тяжелую цепь (HC1);
b. вторую тяжелую цепь (HC2)
c. первую легкую цепь (LC1); и
d. вторую легкую цепь (LC2),
где HC1 связана с LC1, а HC2 связана с LC2, и при этом HC1 содержит определяющую комплементарность область тяжелой цепи 1 (HCDR1), HCDR2 и HCDR3, содержащие аминокислотные последовательности SEQ ID NO:1, SEQ ID NO:2 и SEQ ID NO:3, соответственно, а LC1 содержит определяющую комплементарность область легкой цепи 1 (LCDR1), LCDR2 и LCDR3, содержащие аминокислотные последовательности SEQ ID NO:4, SEQ ID NO:5 и SEQ ID NO:6, соответственно, с образованием сайта связывания для первого антигена, который специфически связывается с Vβ17, и при этом HC2 содержит определяющую комплементарность область тяжелой цепи 1 (HCDR1), HCDR2 и HCDR3, содержащие аминокислотные последовательности SEQ ID NO:34, SEQ ID NO:35 и SEQ ID NO:36, соответственно, и LC2 содержит определяющую комплементарность область легкой цепи 1 (LCDR1), LCDR2 и LCDR3, содержащие аминокислотные последовательности SEQ ID NO:37, SEQ ID NO:38 и SEQ ID NO:39, соответственно, с образованием сайта связывания для второго антигена, который специфически связывается с CD123.
[00116] Вариант осуществления 15 представляет собой выделенное биспецифическое антитело к Vb17/CD123 или антигенсвязывающий фрагмент по варианту осуществления 14, в котором HC1 содержит аминокислотную последовательность SEQ ID NO:13, а LC1 содержит аминокислотную последовательность SEQ ID NO:14, и при этом HC2 содержит аминокислотную последовательность SEQ ID NO:15, а LC2 содержит аминокислотную последовательность SEQ ID NO:16.
[00117] Вариант осуществления 16 представляет собой выделенное биспецифическое антитело к Vβ17/CD123 или его антигенсвязывающий фрагмент по варианту осуществления 14 или варианту осуществления 15, в котором Vβ17 находится на поверхности Т-клетки CD8+ или CD4+.
[00118] Вариант осуществления 17 представляет собой выделенное биспецифическое антитело к Vβ17/CD123 или его антигенсвязывающий фрагмент по любому из вариантов осуществления 14-16, в котором CD123 находится на поверхности раковой клетки.
[00119] Вариант осуществления 18 представляет собой выделенное биспецифическое антитело к Vβ17/CD123 или его антигенсвязывающий фрагмент по любому из вариантов осуществления с 14 по 17, где биспецифическое антитело или его антигенсвязывающий фрагмент индуцирует цитотоксичность, зависимую от Т-клеток CD8+ или CD4+, раковой клетки in vitro, а значение EC50 при этом составляет менее около 0,2 пМ.
[00120] Вариант осуществления 19 представляет собой изолированную нуклеиновую кислоту, кодирующую HC1 и LC1 биспецифического антитела к Vβ17/CD123 или его антигенсвязывающего фрагмента по любому из вариантов осуществления с 14 по 18.
[00121] Вариант осуществления 20 представляет собой выделенную нуклеиновую кислоту, кодирующую HC2 и LC2 биспецифического антитела к Vβ17/CD123 или его антигенсвязывающего фрагмента по любому из вариантов осуществления с 14 по 18.
[00122] Вариант осуществления 21 представляет собой вектор, содержащий выделенную нуклеиновую кислоту по варианту осуществления 19 или варианту осуществления 20.
[00123] Вариант осуществления 22 представляет собой клетку-хозяина, содержащую вектор по варианту осуществления 21.
[00124] Вариант осуществления 23 представляет собой композицию, содержащую буфер, также содержащую выделенное биспецифическое антитело к Vβ17/CD123 или его антигенсвязывающий фрагмент по любому из вариантов осуществления 14-18 и буферный раствор.
[00125] Вариант осуществления 24 представляет собой способ направления Vβ17-экспрессирующей Т-клетки CD8+ или CD4+ к раковой клетке, где способ включает приведение Vβ17-экспрессирующей Т-клетки CD8+ или CD4+ в контакт с биспецифическим антителом к Vβ17/CD123 или его антигенсвязывающим фрагментом по любому из вариантов осуществления с 1 по 8 или с 14 по 18, при этом при приведении Vβ17-экспрессирующей Т-клетки CD8+ или CD4+ в контакт с биспецифическим антителом к Vβ17/CD123 или его антигенсвязывающим фрагментом Vβ17-экспрессирующая Т-клетка CD8+ или CD4+ направляется к раковой клетке, имеющей на поверхности CD123.
[00126] Вариант осуществления 24(a) представляет собой способ по варианту осуществления 24, в котором Vβ17-экспрессирующую Т-клетку CD8+ или CD4+ приводят в контакт с биспецифическим антителом к Vβ17/CD123 по любому из вариантов осуществления с 1 по 8 или с 14 по 18.
[00127] Вариант осуществления 24(b) представляет собой способ по варианту осуществления 24, в котором экспрессирующую Vβ17 Т-клетку CD8+ или CD4+ приводят в контакт с биспецифическим фрагментом антитела к Vβ17/CD123 по любому из вариантов осуществления с 1 по 8 или с 14 по 18.
[00128]
[00129] Вариант осуществления 25 представляет собой способ ингибирования роста или пролиферации раковых клеток, экспрессирующих CD123 на своей поверхности, включающий приведение раковых клеток в контакт с биспецифическим антителом к Vβ17/CD123 или его фрагментом с любым из вариантов осуществления с 1 по 8 или с 14 по 18, где приведение раковых клеток в контакт с указанным антителом или фрагментом антитела ингибирует рост или пролиферацию раковых клеток.
[00130] Вариант осуществления 25(a) представляет собой способ по варианту осуществления 25, в котором экспрессирующая CD123 раковая клетка находится в присутствии экспрессирующей Vβ17 Т-клетки CD8+ при контакте с биспецифическим антителом к Vβ17/CD123 или его фрагментом.
[00131] Вариант осуществления 25(b) представляет собой способ по варианту осуществления 25 или 25(a), в котором экспрессирующая CD123 раковая клетка контактирует с биспецифическим антителом к Vβ17/CD123 по любому из вариантов осуществления с 1 по 8 или с 14 по 18.
[00132] Вариант осуществления 25(c) представляет собой способ по варианту осуществления 25 или 25(a), в котором экспрессирующая CD123 раковая клетка контактирует с биспецифическим фрагментом антитела к Vβ17/CD123 по любому из вариантов осуществления с 1 по 8 или с 14 по 18.
[00133] Вариант осуществления 26 представляет собой набор, содержащий биспецифическое антитело Vβ17 или его антигенсвязывающий фрагмент по любому из вариантов осуществления 1-8 и упаковку для него.
[00134] Вариант осуществления 27 представляет собой набор, содержащий биспецифическое антитело к Vβ17/CD123 или его антигенсвязывающий фрагмент по любому из вариантов осуществления 14-18 и упаковку для него.
[00135] Вариант осуществления 28 представляет собой способ получения биспецифического антитела Vβ17 или его антигенсвязывающего фрагмента, при этом способ содержит этапы, на которых: культивируют клетку-хозяина по варианту осуществления 12 в условиях, позволяющих получать биспецифическое антитело Vβ17 или его антигенсвязывающий фрагмент, и восстанавливают биспецифическое антитело Vβ17 или его антигенсвязывающий фрагмент из клетки или культуры.
[00136] Вариант осуществления 29 представляет собой способ получения биспецифического антитела к Vβ17/CD123 или его антигенсвязывающего фрагмента по любому из вариантов осуществления с 14 по 18, включающий культивирование клетки-хозяина по варианту осуществления 22 в условиях получения биспецифического антитела к Vβ17/CD123 или его антигенсвязывающего фрагмента и восстановление биспецифического антитела к Vβ17/CD123 или его антигенсвязывающего фрагмента из клетки или культуры.
[00137] Вариант осуществления 30 представляет собой выделенное гуманизированное моноклональное антитело Vβ17 или его антигенсвязывающий фрагмент, где моноклональное антитело Vβ17 или его антигенсвязывающий фрагмент содержит аминокислотную последовательность, по меньшей мере, на 95% идентичную аминокислотной последовательности SEQ ID NO:28.
[00138] Вариант осуществления 31 представляет собой выделенное гуманизированное моноклональное антитело Vβ17 или его антигенсвязывающий фрагмент по варианту осуществления 30, в котором моноклональное антитело Vβ17 или его антигенсвязывающий фрагмент содержит аминокислотную последовательность SEQ ID NO:28.
[00139] Вариант осуществления 32 представляет собой выделенную нуклеиновую кислоту, кодирующую гуманизированное моноклональное антитело Vβ17 или его антигенсвязывающий фрагмент согласно варианту осуществления 30 или варианту осуществления 31.
[00140] Вариант осуществления 33 представляет собой вектор, содержащий выделенную нуклеиновую кислоту по варианту осуществления 32.
[00141] Вариант осуществления 34 представляет собой клетку-хозяина, содержащую вектор по варианту осуществления 33.
[00142] Вариант осуществления 35 представляет собой композицию, содержащую буфер, содержащую выделенное гуманизированное моноклональное антитело Vβ17 или его антигенсвязывающий фрагмент по варианту осуществления 30 или варианту осуществления 31.
ПРИМЕРЫ
[00143] Следующие примеры основаны на предположении, что пептид M1, полученный из вируса гриппа, способен к размножению выбранного набора Т-клеток. Данные клетки экспрессируют TCR-гаплотип-Vβ17, и большинство данных клеток показывают эффективную цитотоксичность для опухолевых клеток-мишеней. Эта способность затем используется с применением биспецифических антител, сконструированных таким образом, что одно плечо связывается со структурой Vβ17, а другое плечо связывается с антигеном, экспрессируемым раковыми клетками. Таким образом, биспецифическое антитело связывает эффекторные клетки и клетки-мишени, что приводит к уничтожению раковых клеток. Данный механизм действия описан на схеме, изображенной на ФИГ. 1.
[00144] Последующие примеры можно разделить на следующие категории: (1) Создание биспецифических антител, способных связываться с плечом Vβ17 Т-клеточных рецепторов (TCR) на ЦТЛ (примеры 1 и 2); и (2) Основание для уничтожения клеток-мишеней с помощью биспецифических антител посредством ЦТЛ, размноженных in vitro (пример 3).
[00145] Пример 1. Адаптация к человеческому каркасу mAb E17.5F к Vβ17
[00146] Клон E17.5F мышиного IgG1 античеловеческого Т-клеточного рецептора Vβ17 был приобретен у компании BeckmanCoulter, Inc. (г. Брея, штат Калифорния, США). Приготовление образцов и анализ ЖХ/МС-МС проводились в компании Protea Bioscience Inc. (г. Моргантаун, штат Западная Виргиния, США). Пробу восстанавливали и алкилировали, разделяли на семь аликвот и протеолитически расщепляли ферментами трипсин/LysC, химотрипсина, LysC, пепсина и AspN, эластазы и протеиназы K. Полученные пептиды обессоливали с помощью микродозатора ZipTip C18 и разделяли на технологической линии с помощью хроматографии с обращенной фазой. Масс-спектрометрию выполняли на спектрометре Thermo Q-Exactive с использованием фрагментации высокой хроматической четкости. Наборы данных МС анализировали с помощью программного обеспечения PEAKS путем сопоставления тегов первичной последовательности с базой данных последовательностей антител на основе IMGT. Пробелы в последовательности определяли с использованием сборки последовательности Contig вновь идентифицированных пептидов. Все CDR и гипермутации были подтверждены путем анализа спектров МС/МС.
[00147] Полученные последовательности показаны в Таблицах 1 и 2.
[00148] Таблица 1: Последовательности CDR клона E17.5F TCR Vβ17.
[00149] Таблица 2: Последовательности тяжелой и легкой цепей клона E17.5F TCR Vb17.
[00150] В последовательности вносили изменения для получения биспецифических антител (Таблица 3). Были внесены следующие изменения: (1) каркасная мутация Asn1 тяжелой цепи не была консервативной, поэтому последовательность была модифицирована с получением последовательности DVQLW; (2) другая мутация, выявленная в Fc, K337Y, была сочтена нехарактерной, и, таким образом, конструкция была синтезирована без этой мутации; и (3) на тяжелой цепи наблюдался потенциальный вторичный сайт гликозилирования, и, таким образом, синтезировали две версии этого mAb с N-связанным сайтом и без него (N82a, по нумерации Chothia).
[00151] Таблица 3: Последовательности тяжелой и легкой цепей для вариантов клона E17.5F антитела Vβ17
[00152] Два антитела (B17B1 и B17B2) экспрессировали в клетках HEK293Expi. Супернатанты тестировали на связывание с Vβ17 (B17B1 и B17B2), и связывание проявлялось только у B17B1. Таким образом, экспрессировали B17B1, имеющее константную область IgG4 с заменами Fc.
[00153] Мышиное mAb B17B1 к человеческому TCR Vβ17 гуманизировали с использованием метода адаптации к человеческому каркасу (HFA) (Fransson J, et al. J. Mol. Biol. 2010; 398:214-231). Несколько последовательностей вариабельной области человека были выбраны для тестирования с целью поиска наилучшей комбинации гуманизированных тяжелой и легкой цепи (Таблица 4). Выбор зародышевых линий человека основывался исключительно на общем сходстве последовательностей с мышиным антителом в каркасной области (FR). При отборе не учитывались ни последовательности CDR, ни их длина или канонические структуры.
[00154] Используемое в HFA определение CDR описано в (Fransson J, et al. J. Mol. Biol. 2010; 398:214-231) и соответствует определению Мартин (Abhinandan KR and Martin AC. Мол. Immunol. 2008; 45:3832-3839). CDR (Таблица 1) были определены следующим образом (с использованием схемы нумерации Chothia [Chothia C, and Lesk A. J. Mol. Biol. 1987; 196:901-917]):
HCDR1 (SEQ ID NO:1) 26-35
HCDR2 (SEQ ID NO:2) 50-58
HCDR3 (SEQ ID NO:3) 95-102
LCDR1 (SEQ ID NO:4) 24-34
LCDR2 (SEQ ID NO:5) 50-56
LCDR3 (SEQ ID NO:6) 89-97
[00155] Выбранные человеческие зародышевые линии представлены в Таблице 4 (в заметке IMGT).
[00156] Таблица 4: Варианты VH и VL
YISYDGSNNYNPSLKNRISITRDTSKNQFFLKLNSVTTEDTATYYCASPSPG
TGYAVDYWGQGTSVTVSS
YISYDGSNNYADSVKGRFTISRDNSKNTLYLQMNSLRAEDTAVYYCAKPSP
GTGYAVDYWGQGTLVTVSS
YISYDGSNNYADSVKGRFTISRDNSKNTLYLQMNSLRAEDTAVYYCASPSPG
TGYAVDYWGQGTLVTVSS
YDGSNNYNPSLKSRVTISRDTSKNQFSLKLSSVTAADTAVYYCASPSPGTGY
AVDYWGQGTLVTVSS
KVSNRFSGVPDRFSGGGSGTEFTLKISRVEAEDLGVYFCSQSTHVPFTFGSGTKL
EIK
KVSNRFSGVPSRFSGSGSGTDFTLTISSLQPEDFATYYCSQSTHVPFTFGQGTKL
EIK
KVSNRFSGVPSRFSGSGSGTDFTLTISSLQPEDFATYYCSQSTHVPFTFGQGTKL
EIK
KVSNRFSGVPDRFSGSGSGTDFTLKISRVEAEDVGVYYCSQSTHVPFTFGQGTKL
EIK
CDR 1-3 подчеркнуты
[00157] В нескольких вариантах в положениях FR вводили «обратные мутации», которые, как известно, важны для спаривания VL/VH и конформации CDR. Выбранные человеческие зародышевые линии представлены в Таблице 5 (в заметке IMGT) с отмеченными обратными мутациями.
[00158] Таблица 5: Выбранные J-области
[00159] Аминокислотные последовательности всех девяти попарных комбинаций трех тяжелых цепей и трех легких цепей подвергали обратной трансляции в ДНК и получали кДНК с использованием методик синтеза генов (патент США № 6,670,127; патент США № 6,521,427). Вариабельные области тяжелых цепей (HC) субклонировали в константную область человеческого IgG4 с применением экспрессионного вектора собственной разработки с промотором CMV, используя стандартные методы молекулярной биологии. Вариабельные области легких цепей (LC) субклонировали на человеческие константные области лямбда (λ) с применением экспрессионного вектора собственной разработки с промотором CMV, используя стандартные методы молекулярной биологии. Полученные плазмиды трансфицировали в клетки HEK EXPI (LifeTechnologies; г. Карлсбад, штат Калифорния, США) и экспрессировали mAb. Очистку выполняли стандартными способами на колонке с белком A (колонка hiTrap MAbSelect SuRe). После элюирования пулы диализировали в D-PBS, pH 7,2.
[00160] Таблица 6: Тяжелая и легкая цепи девяти гуманизированных антител Vβ17
[00161] Гуманизированные антитела проверяли на связывание с гибридным белком TCRVβ17 (SEQID NO:27)/Va10.2-Fc (SEQ ID NO:44) методом ИФА. Биотинилированный гибридный белок TCRVβ17/Va10,2-Fc добавляли на покрытый стрептавидином планшет для ИФА. Несвязанный белок смывали и добавляли mAb в диапазоне концентраций (0,01-10 мкг/мл). Планшеты промывали и добавляли детекторное антитело против каппа:HRP. Планшеты промывали, добавляли реагент для хемилюминесцентного детектирования и считывали люминесценцию в планшетах на сканирующем спектрофотометре Perkin Elmer EnVision. B17B20 и B17B21 продемонстрировали положительное связывание с белком ТКР-Vβ17. B17B22 демонстрировало слабое связывание с этим белком. Впоследствии эти антитела очищали для дальнейших исследований, как описано выше. B17B21 продемонстрировало наилучшее связывание с рекомбинантным белком TCR-Vβ17 и стимулированными М1 Т-клетками и, таким образом, его выбрали в качестве молекулы для дополнительных функциональных исследований, в частности, для его исследования в качестве биспецифического антитела при перенаправленном Т-клетками уничтожении раковых клеток.
[00162] Таким образом, последовательность вариабельной области B17B21 (к Vβ17) и I3RB217 (к CD123) использовали для получения биспецифического антитела для исследования перенаправленного Т-клетками уничтожения клеток острого миелоидного лейкоза (ОМЛ).
[00163] Пример 2. Получение биспецифических антител к Vβ17/CD123
[00164] Биспецифические антитела VB11 (к Vβ17/CD123) и VB13 (Vβ17 x Null) получали в виде полноразмерных антител в формате «выступ во впадину», как человеческий IgG4, как описано ранее (Atwell et al. J. Mol. Biol. 270: 26-35, 1997). Нуклеотидные последовательности, кодирующие вариабельные участки, субклонировали в специализированные экспрессионные векторы млекопитающего, содержащие константный участок экспрессионных кассет IgG4, с использованием стандартных методик клонирования на основе рестрикционных ферментов и ПЦР. Биспецифические антитела экспрессировали путем временной трансфекции в линии клеток яичника китайского хомяка. Антитела сначала очищали на колонке Mab Select SuRe Protein A (GE Healthcare, г. Пискатауэй, штат Нью-Джерси, США) (Brown, Bottomley et al. 1998). Колонку уравновешивали фосфатно-солевым буфером (PBS), pH 7,2, и вносили ферментационный супернатант при скорости потока в 2 мл/мин. После загрузки колонку промывали PBS (4 объема колонки) с последующим элюированием в 30 мМ ацетата натрия, pH 3,5. Фракции, содержащие пики белка, установленные по признаку поглощения при 280 нм в системе Akta Explorer (GE Healthcare), объединяли и нейтрализовали до pH 5,0 путем добавления 1% 3M ацетата натрия, pH 9,0. На стадии полировки антитела очищали посредством препаративной эксклюзионной хроматографии (SEC) с использованием колонки Superdex 200 (GE Healthcare). Целостность образца оценивали путем измерения концентрации эндотоксина и электрофореза в полиакриламидном геле в присутствии додецилсульфата натрия (SDS) в восстановительных и невосстановительных условиях. Конечные концентрации белка составляли 0,48 мг/мл для антител к Vβ17/CD123 и 0.24 мг/мл для Vβ17 x Null. Конечные уровни ЕЭ антител к Vβ17/CD123 и Vβ17 x Null, исходя из данных концентраций белков, составляли 2,053 ЕЭ/мг и 4,219 ЕЭ/мг, соответственно.
[00165] Таблица 7: Последовательности полуантител, экспрессированных в клетках CHO
[00166] Таблица 8: Последовательности тяжелых и легких цепей для биспецифических антител Vβ17
[00167] Пример 3. Оценка связывающих и цитотоксических свойств биспецифического антитела к Vβ17/CD123 с использованием клеток Kasumi-3 и человеческих Т-клеток CD8+
[00168] Стимуляция и размножение Т-клеток Vβ17+ CD8+ из всех PBMC
[00169] Для размножения Т-клеток Vβ17+ CD8+ целые PBMC от донора HLA A2 (HPU-08694) стимулировали с помощью 1 мкг/мл пептида FLU MP 58 (в ДМСО). Частоту встречаемости клеток Vβ17+ из всех T-клеток CD8+ определяли на 8 и 14 сутки периода культивирования. Для подсчета частоты встречаемости клеток Vβ17+ из всех Т-клеток CD8+ сначала гейтировали общее количество живых PBMC, исключали дублеты, гейтировали общее количество Т-клеток CD8+ и затем гейтировали клетки Vβ17+ (ФИГ. 3A). По сравнению с частотой встречаемости клеток Vβ17+ из всех Т-клеток CD8+ в день 0 наблюдалось значительное размножение данных клеток на 8 сутки периода культивирования (ФИГ. 3B). Большая фракция Т-клеток CD8+ на 8 сутки представляла собой клетки Vβ17+ (ФИГ. 3B) у данного донора.
[00170] Анализ связывания биспецифических антител к Vβ17/CD123
[00171] На клетках Kasumi-3
[00172] Чтобы понять кинетику связывания биспецифического антитела к Vβ17/CD123, клетки Kasumi-3 инкубировали с биспецифическим антителом к Vβ17/CD123 и контрольным антителом к Vβ17XNULL в различных концентрациях (диапазон концентраций от 5 мкг/мл до 0 мкг/мл). Связанное с клетками биспецифическое антитело обнаруживали с помощью мышиного вторичного античеловеческого антитела IgG4 Fc-PE. В Таблице 9 показана частота встречаемости PE-положительных клеток Kasumi-3 (вторичное антитело), при обработке разными концентрациями биспецифических антител. Значение EC50 для антител к Vβ17/CD123 и NULLXCD123 составило 6 и 42,7 нм, соответственно (Таблица 9).
[00173] Таблица 9. Аффинность связывания клеток Kasumi-3 для биспецифических антител.
[00174] Аффинность связывания биспецифических антител с клетками Kasumi-3 определяли методом проточной цитометрии. Значения полумаксимальной эффективной концентрации (EC50) рассчитывали как биспецифическую концентрацию, обеспечивающую 50% от максимального связывания (PE-положительные клетки). (Н/О): Не определено.
[00175] На обогащенных Т-клетках CD8+
[00176] Обогащенные пептидом FLU MP 58 Т-клетки CD8+ (с 14 суток культивирования) инкубировали с различными концентрациями биспецифических антител к Vβ17/CD123 и контрольных антител к Vβ17XNULL. Для обнаружения биспецифического антитела использовали мышиное вторичное античеловеческое антитело IgG4 Fc-PE. В Таблице 10 показана частота встречаемости PE-положительных Т-клеток CD8+ (вторичное антитело), при обработке разными концентрациями биспецифических антител. Значение EC50 для антител к Vβ17/CD123, Vβ17XNULL, составило 9.0 нм, 18.7 нм, соответственно (Таблица 10).
[00177] Таблица 10: Активность связывания Т-клетки CD8+ с биспецифическими антителами.
[00178] Аффинности связывания биспецифических антител с Т-клетками CD8+ определяли методом проточной цитометрии. Значения полумаксимальной эффективной концентрации (EC50) рассчитывали как концентрацию антител, обеспечивающую 50% от максимального связывания (PE-положительные клетки). (Н/О): Не определено
[00179] Анализ цитотоксичности, опосредованной биспецифическим антителом
[00180] Для анализа эффективности цитотоксичности, опосредованной биспецифическим антителом к Vβ17/CD123, меченые карбоксифлуоресцеин сукцинимидиловым эфиром (CFSE) клетки-мишени (Kasumi-3) совместно культивировали со стимулированными Т-клетками CD8+ (эффекторами) с 14 суток культивирования в соотношении эффектор - мишень (ET) в 0,5:1, 1:1, 5:1 в течение 14 и 24 часов с различными концентрациями биспецифического антитела к Vβ17/CD123 и контрольного антитела к Vβ17XNULL. Экспрессию CD123 на клетках-мишенях Kasumi-3 проверяли с использованием доступного в продаже антитела к CD123. Клетки-мишени (Kasumi-3) помечали CFSE для идентификации их как CFSE+ при анализе методом проточной цитометрии. В течение периода после совместного культивирования добавляли 7-AAD для анализа процента клеток 7-AAD+ CFSE+ в качестве средства измерения цитотоксичности. Базовую цитотоксичность, наблюдаемую в отсутствие биспецифического антитела, вычитали для получения специфической цитотоксичности в ответ на биспецифическое антитело. Анализ проводили один раз с одним донором (HPU-08694). Значения EC50 для биспецифического антитела к Vβ17/CD123 в соотношениях ET в 0,5:1, 1:1 и 5:1 на контрольный момент времени в 14 часов составляли 3,7, 0.1 и 0.133 пМ, соответственно (Таблица 11).
[00181] Таблица 11: Сводная информация по значениям ЕС50 для различных биспецифических антител при совместном культивировании стимулированных пептидом FLU MP 58 Т-клеток CD8+ с клетками Kasumi-3 в соотношениях ET в 0,5:1, 1:1 и 5:1 в течение 14 часов.
Н/О: Не обнаружено, поскольку активность была слишком низкой для правильной аппроксимации кривой.
[00182] Значения EC50 для биспецифического антитела к Vβ17/CD123 в соотношениях ЕТ в 0.5:1,1:1 и 5:1 на контрольный момент времени в 24 часа составляли 0,4, 0,2 и 1,0 пМ, соответственно (Таблица 12).
[00183] Таблица 12: Сводная информация по значениям ЕС50 для различных биспецифических антител при совместном культивировании стимулированных пептидом FLU MP 58 Т-клеток CD8+ с клетками Kasumi-3 в соотношениях ET в 0.5:1, 1:1 и 5:1 в течение 24 часов.
Н/О: Не обнаружено
[00184] Аналогичным образом, опосредованную биспецифическими антителами к Vβ17/CD123 цитотоксичность нестимулированных Т-клеток CD8+ исследовали при соотношении ET в 0,5:1, 1:1, 5:1 в течение 14 часов (Таблица 13) и 24 часов (Таблица 14). При концентрации биспецифических антител к Vβ17/CD123 в 5 нг/мл на контрольный момент времени в 14 часов нестимулированные Т-клетки CD8+ в соотношении ET в 0,5:1 и 1:1 показали цитотоксичность клеток-мишеней в 2,8% и 9,8%, соответственно (Таблица 13) по сравнению с цитотоксичностью при стимуляции Т-клеток CD8+ в 77% и 73%. При соотношении 5:1 ET нестимулированные Т-клетки CD8+ показывали 31,65% цитотоксичность мишени по сравнению с 70,9% стимулированными Т-клетками CD8+. Аналогичные результаты были получены на контрольный момент времени в 24 часа (Таблицы 12, 15, 16 и 17). При самой высокой концентрации (5 нг/мл) протестированных биспецифических антител к Vβ17/CD123 нестимулированные Т-клетки CD8+ показывали более высокую цитотоксичность в отношении клеток-мишеней при более высоком соотношении ET.
[00185] Таблица 13: Анализ цитотоксичности с использованием нестимулированных Т-клеток CD8+ в различных соотношениях ET в течение 14 часов. Частота появления CFSE и 7-AAD-положительных клеток при обработке различными концентрациями биспецифических антител.
[00186] Таблица 14: Анализ цитотоксичности с использованием нестимулированных Т-клеток CD8+ в различных соотношениях ET в течение 24 часов. Частота появления CFSE и 7-AAD-положительных клеток при обработке различными концентрациями биспецифических антител.
[00187] Таблица 15: Анализ цитотоксичности при соотношении ET в 0,5:1 (стимулированные Т-клетки CD8+: Клетки Kasumi-3) при инкубации в течение 14 ч. Частота появления CFSE и 7-AAD-положительных клеток при обработке различными концентрациями биспецифических антител в соотношении ЕТ в 0,5:1 в течение 14 часов.
[00188] Значения полумаксимальной эффективной концентрации (EC50) рассчитывали как концентрацию антител, обеспечивающую 50% клеток максимальной цитотоксичности (CFSE+ 7AAD+). (Н/О): Не определено.
[00189] Таблица 16: Анализ цитотоксичности при соотношении ET в 1:1 (стимулированные Т-клетки CD8+: Клетки Kasumi-3) при инкубации в течение 14 ч. Частота появления CFSE и 7-AAD-положительных клеток при обработке различными концентрациями биспецифических антител в соотношении ЕТ в 11 в течение 14 часов.
[00190] Значения полумаксимальной эффективной концентрации (EC50) рассчитывали как концентрацию антител, обеспечивающую 50% клеток максимальной цитотоксичности (CFSE+ 7AAD+). (Н/О): Не определено
[00191] Таблица 17: Анализ цитотоксичности при соотношении ET в 5:1 (стимулированные Т-клетки CD8+: Клетки Kasumi-3) при инкубации в течение 14 ч. Частота появления CFSE и 7-AAD-положительных клеток при обработке различными концентрациями биспецифических антител в соотношении ЕТ в 5:1 в течение 14 часов.
[00192] Значения полумаксимальной эффективной концентрации (EC50) рассчитывали как концентрацию антител, обеспечивающую 50% клеток максимальной цитотоксичности (CFSE+ 7AAD+). Н/О: Не обнаружено.
[00193] Специалистам в данной области следует понимать, что в варианты осуществления, описанные выше, можно вносить изменения без отступления от общей концепции, обладающей признаками изобретения, представленной в настоящем документе. Таким образом, следует понимать, что данное изобретение не ограничено конкретными описанными вариантами осуществления, но предполагается, что оно охватывает модификации в пределах сущности и объема настоящего изобретения, определяемых настоящим описанием.
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> ЯНССЕН БАЙОТЕК, ИНК.
<120> Биспецифические антитела к VB17/CD123 и их применение
<130> PRD4012WOPCT
<150> US62/816,464
<151> 2019-03-11
<160> 44
<170> PatentIn, версия 3.5
<210> 1
<211> 11
<212> Белок
<213> Искусственная последовательность
<220>
<223> B17B01 HCDR1
<400> 1
Gly Tyr Ser Ile Thr Ser Gly Tyr Phe Trp Asn
1 5 10
<210> 2
<211> 9
<212> Белок
<213> Искусственная последовательность
<220>
<223> B17B01 HCDR2
<400> 2
Tyr Ile Ser Tyr Asp Gly Ser Asn Asn
1 5
<210> 3
<211> 11
<212> Белок
<213> Искусственная последовательность
<220>
<223> B17B01 HCDR3
<400> 3
Pro Ser Pro Gly Thr Gly Tyr Ala Val Asp Tyr
1 5 10
<210> 4
<211> 16
<212> Белок
<213> Искусственная последовательность
<220>
<223> B17B01 LCDR1
<400> 4
Arg Ser Ser Gln Ser Leu Val His Ser Asn Gly Asn Thr Tyr Leu His
1 5 10 15
<210> 5
<211> 7
<212> Белок
<213> Искусственная последовательность
<220>
<223> B17B01 LCDR2
<400> 5
Lys Val Ser Asn Arg Phe Ser
1 5
<210> 6
<211> 9
<212> Белок
<213> Искусственная последовательность
<220>
<223> B17B01 LCDR3
<400> 6
Ser Gln Ser Thr His Val Pro Phe Thr
1 5
<210> 7
<211> 444
<212> Белок
<213> Искусственная последовательность
<220>
<223> Тяжелая цепь B17B01
<400> 7
Asn Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Gln
1 5 10 15
Ser Leu Ser Leu Thr Cys Ser Val Ala Gly Tyr Ser Ile Thr Ser Gly
20 25 30
Tyr Phe Trp Asn Trp Ile Arg Gln Phe Pro Gly Asn Lys Leu Glu Trp
35 40 45
Met Gly Tyr Ile Ser Tyr Asp Gly Ser Asn Asn Tyr Asn Pro Ser Leu
50 55 60
Lys Asn Arg Ile Ser Ile Thr Arg Asp Thr Ser Lys Asn Gln Phe Phe
65 70 75 80
Leu Lys Leu Asn Ser Val Thr Thr Glu Asp Thr Ala Thr Tyr Tyr Cys
85 90 95
Ala Ser Pro Ser Pro Gly Thr Gly Tyr Ala Val Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Ser Val Thr Val Ser Ser Ala Lys Thr Thr Pro Pro Ser Val
115 120 125
Tyr Pro Leu Ala Pro Gly Ser Ala Ala Gln Thr Asn Ser Met Val Thr
130 135 140
Leu Gly Cys Leu Val Lys Gly Tyr Phe Pro Glu Pro Val Thr Val Thr
145 150 155 160
Trp Asn Ser Gly Ser Leu Ser Ser Gly Val His Thr Phe Pro Ala Val
165 170 175
Leu Gln Ser Asp Leu Tyr Thr Leu Ser Ser Ser Val Thr Val Pro Ser
180 185 190
Ser Thr Trp Pro Ser Gln Thr Val Thr Cys Asn Val Ala His Pro Ala
195 200 205
Ser Ser Thr Lys Val Asp Lys Lys Ile Val Pro Arg Asp Cys Gly Cys
210 215 220
Lys Pro Cys Ile Cys Thr Val Pro Glu Val Ser Ser Val Phe Ile Phe
225 230 235 240
Pro Pro Lys Pro Lys Asp Val Leu Thr Ile Thr Leu Thr Pro Lys Val
245 250 255
Thr Cys Val Val Val Asp Ile Ser Lys Asp Asp Pro Glu Val Gln Phe
260 265 270
Ser Trp Phe Val Asp Asp Val Glu Val His Thr Ala Gln Thr Lys Pro
275 280 285
Arg Glu Glu Gln Ile Asn Ser Thr Phe Arg Ser Val Ser Glu Leu Pro
290 295 300
Ile Met His Gln Asp Trp Leu Asn Gly Lys Glu Phe Lys Cys Arg Val
305 310 315 320
Asn Ser Ala Ala Phe Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Thr
325 330 335
Tyr Gly Arg Pro Lys Ala Pro Gln Val Tyr Thr Ile Pro Pro Pro Lys
340 345 350
Glu Gln Met Ala Lys Asp Lys Val Ser Leu Thr Cys Met Ile Thr Asn
355 360 365
Phe Phe Pro Glu Asp Ile Thr Val Glu Trp Gln Trp Asn Gly Gln Pro
370 375 380
Ala Glu Asn Tyr Lys Asn Thr Gln Pro Ile Met Asp Thr Asp Gly Ser
385 390 395 400
Tyr Phe Val Tyr Ser Lys Leu Asn Val Gln Lys Ser Asn Trp Glu Ala
405 410 415
Gly Asn Thr Phe Thr Cys Ser Val Leu His Glu Gly Leu His Asn His
420 425 430
His Thr Glu Lys Ser Leu Ser His Ser Pro Gly Lys
435 440
<210> 8
<211> 219
<212> Белок
<213> Искусственная последовательность
<220>
<223> Легкая цепь B17B01
<400> 8
Asn Val Val Met Thr Gln Thr Pro Leu Ser Leu Pro Val Ser Leu Gly
1 5 10 15
Asp Gln Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Leu Val His Ser
20 25 30
Asn Gly Asn Thr Tyr Leu His Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Lys Phe Leu Ile Tyr Lys Val Ser Asn Arg Phe Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Gly Gly Ser Gly Thr Glu Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Leu Gly Val Tyr Phe Cys Ser Gln Ser
85 90 95
Thr His Val Pro Phe Thr Phe Gly Ser Gly Thr Lys Leu Glu Ile Lys
100 105 110
Arg Ala Asp Ala Ala Pro Thr Val Ser Ile Phe Pro Pro Ser Ser Glu
115 120 125
Gln Leu Thr Ser Gly Gly Ala Ser Val Val Cys Phe Leu Asn Asn Phe
130 135 140
Tyr Pro Lys Asp Ile Asn Val Lys Trp Lys Ile Asp Gly Ser Glu Arg
145 150 155 160
Gln Asn Gly Val Leu Asn Ser Trp Thr Asp Gln Asp Ser Lys Asp Ser
165 170 175
Thr Tyr Ser Met Ser Ser Thr Leu Thr Leu Thr Lys Asp Glu Tyr Glu
180 185 190
Arg His Asn Ser Tyr Thr Cys Glu Ala Thr His Lys Thr Ser Thr Ser
195 200 205
Pro Ile Val Lys Ser Phe Asn Arg Asn Glu Cys
210 215
<210> 9
<211> 447
<212> Белок
<213> Искусственная последовательность
<220>
<223> Тяжелая цепь B17B1
<400> 9
Asn Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Gln
1 5 10 15
Ser Leu Ser Leu Thr Cys Ser Val Ala Gly Tyr Ser Ile Thr Ser Gly
20 25 30
Tyr Phe Trp Asn Trp Ile Arg Gln Phe Pro Gly Asn Lys Leu Glu Trp
35 40 45
Met Gly Tyr Ile Ser Tyr Asp Gly Ser Asn Asn Tyr Asn Pro Ser Leu
50 55 60
Lys Asn Arg Ile Ser Ile Thr Arg Asp Thr Ser Lys Asn Gln Phe Phe
65 70 75 80
Leu Lys Leu Asn Ser Val Thr Thr Glu Asp Thr Ala Thr Tyr Tyr Cys
85 90 95
Ala Ser Pro Ser Pro Gly Thr Gly Tyr Ala Val Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Ser Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val
115 120 125
Phe Pro Leu Ala Pro Cys Ser Arg Ser Thr Ser Glu Ser Thr Ala Ala
130 135 140
Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser
145 150 155 160
Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val
165 170 175
Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro
180 185 190
Ser Ser Ser Leu Gly Thr Lys Thr Tyr Thr Cys Asn Val Asp His Lys
195 200 205
Pro Ser Asn Thr Lys Val Asp Lys Arg Val Glu Ser Lys Tyr Gly Pro
210 215 220
Pro Cys Pro Pro Cys Pro Ala Pro Glu Ala Ala Gly Gly Pro Ser Val
225 230 235 240
Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr
245 250 255
Pro Glu Val Thr Cys Val Val Val Asp Val Ser Gln Glu Asp Pro Glu
260 265 270
Val Gln Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys
275 280 285
Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser Thr Tyr Arg Val Val Ser
290 295 300
Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys
305 310 315 320
Cys Lys Val Ser Asn Lys Gly Leu Pro Ser Ser Ile Glu Lys Thr Ile
325 330 335
Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro
340 345 350
Pro Ser Gln Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu
355 360 365
Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn
370 375 380
Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser
385 390 395 400
Asp Gly Ser Phe Leu Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg
405 410 415
Trp Gln Glu Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu
420 425 430
His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Leu Gly Lys
435 440 445
<210> 10
<211> 219
<212> Белок
<213> Искусственная последовательность
<220>
<223> Легкая цепь B17B1
<400> 10
Asn Val Val Met Thr Gln Thr Pro Leu Ser Leu Pro Val Ser Leu Gly
1 5 10 15
Asp Gln Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Leu Val His Ser
20 25 30
Asn Gly Asn Thr Tyr Leu His Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Lys Phe Leu Ile Tyr Lys Val Ser Asn Arg Phe Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Gly Gly Ser Gly Thr Glu Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Leu Gly Val Tyr Phe Cys Ser Gln Ser
85 90 95
Thr His Val Pro Phe Thr Phe Gly Ser Gly Thr Lys Leu Glu Ile Lys
100 105 110
Arg Ala Asp Ala Ala Pro Thr Val Ser Ile Phe Pro Pro Ser Ser Glu
115 120 125
Gln Leu Thr Ser Gly Gly Ala Ser Val Val Cys Phe Leu Asn Asn Phe
130 135 140
Tyr Pro Lys Asp Ile Asn Val Lys Trp Lys Ile Asp Gly Ser Glu Arg
145 150 155 160
Gln Asn Gly Val Leu Asn Ser Trp Thr Asp Gln Asp Ser Lys Asp Ser
165 170 175
Thr Tyr Ser Met Ser Ser Thr Leu Thr Leu Thr Lys Asp Glu Tyr Glu
180 185 190
Arg His Asn Ser Tyr Thr Cys Glu Ala Thr His Lys Thr Ser Thr Ser
195 200 205
Pro Ile Val Lys Ser Phe Asn Arg Asn Glu Cys
210 215
<210> 11
<211> 447
<212> Белок
<213> Искусственная последовательность
<220>
<223> Тяжелая цепь B17B2
<400> 11
Asp Val Gln Leu Lys Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Gln
1 5 10 15
Ser Leu Ser Val Thr Cys Ser Val Thr Gly Tyr Ser Ile Thr Ser Gly
20 25 30
Tyr Tyr Trp Asn Trp Tyr Arg Gln Phe Pro Gly Asn Lys Leu Glu Trp
35 40 45
Met Gly Tyr Ile Ser Tyr Asp Gly Ser Asn Asn Tyr Asn Pro Ser Leu
50 55 60
Lys Asn Arg Ile Ser Ile Thr Arg Asp Thr Ser Lys Asn Gln Ile Leu
65 70 75 80
Leu Lys Leu Thr Tyr Val Thr Thr Glu Asp Thr Ala Thr Tyr Tyr Cys
85 90 95
Thr Arg Pro Ser Pro Gly Thr Gly Tyr Ala Val Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val
115 120 125
Phe Pro Leu Ala Pro Cys Ser Arg Ser Thr Ser Glu Ser Thr Ala Ala
130 135 140
Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser
145 150 155 160
Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val
165 170 175
Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro
180 185 190
Ser Ser Ser Leu Gly Thr Lys Thr Tyr Thr Cys Asn Val Asp His Lys
195 200 205
Pro Ser Asn Thr Lys Val Asp Lys Arg Val Glu Ser Lys Tyr Gly Pro
210 215 220
Pro Cys Pro Pro Cys Pro Ala Pro Glu Ala Ala Gly Gly Pro Ser Val
225 230 235 240
Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr
245 250 255
Pro Glu Val Thr Cys Val Val Val Asp Val Ser Gln Glu Asp Pro Glu
260 265 270
Val Gln Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys
275 280 285
Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser Thr Tyr Arg Val Val Ser
290 295 300
Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys
305 310 315 320
Cys Lys Val Ser Asn Lys Gly Leu Pro Ser Ser Ile Glu Lys Thr Ile
325 330 335
Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro
340 345 350
Pro Ser Gln Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu
355 360 365
Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn
370 375 380
Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser
385 390 395 400
Asp Gly Ser Phe Leu Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg
405 410 415
Trp Gln Glu Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu
420 425 430
His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Leu Gly Lys
435 440 445
<210> 12
<211> 219
<212> Белок
<213> Искусственная последовательность
<220>
<223> Легкая цепь B17B2
<400> 12
Asp Ile Val Met Thr Gln Ser Pro Asp Ser Leu Ala Val Ser Leu Gly
1 5 10 15
Glu Arg Ala Thr Ile Asn Cys Arg Ser Ser Gln Ser Leu Val His Ser
20 25 30
Asn Gly Asn Thr Tyr Leu His Trp Tyr Gln Gln Lys Pro Gly Gln Pro
35 40 45
Pro Lys Leu Leu Ile Tyr Lys Val Ser Asn Arg Phe Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile
65 70 75 80
Ser Ser Leu Gln Ala Glu Asp Val Ala Val Tyr Tyr Cys Ser Gln Ser
85 90 95
Thr His Val Pro Phe Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105 110
Arg Ala Asp Ala Ala Pro Thr Val Ser Ile Phe Pro Pro Ser Ser Glu
115 120 125
Gln Leu Thr Ser Gly Gly Ala Ser Val Val Cys Phe Leu Asn Asn Phe
130 135 140
Tyr Pro Lys Asp Ile Asn Val Lys Trp Lys Ile Asp Gly Ser Glu Arg
145 150 155 160
Gln Asn Gly Val Leu Asn Ser Trp Thr Asp Gln Asp Ser Lys Asp Ser
165 170 175
Thr Tyr Ser Met Ser Ser Thr Leu Thr Leu Thr Lys Asp Glu Tyr Glu
180 185 190
Arg His Asn Ser Tyr Thr Cys Glu Ala Thr His Lys Thr Ser Thr Ser
195 200 205
Pro Ile Val Lys Ser Phe Asn Arg Asn Glu Cys
210 215
<210> 13
<211> 447
<212> Белок
<213> Искусственная последовательность
<220>
<223> Тяжелая цепь B17B21
<400> 13
Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Thr Val Ser Gly Tyr Ser Ile Thr Ser Gly
20 25 30
Tyr Phe Trp Asn Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp
35 40 45
Ile Gly Tyr Ile Ser Tyr Asp Gly Ser Asn Asn Tyr Asn Pro Ser Leu
50 55 60
Lys Ser Arg Val Thr Ile Ser Arg Asp Thr Ser Lys Asn Gln Phe Ser
65 70 75 80
Leu Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Ser Pro Ser Pro Gly Thr Gly Tyr Ala Val Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val
115 120 125
Phe Pro Leu Ala Pro Cys Ser Arg Ser Thr Ser Glu Ser Thr Ala Ala
130 135 140
Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser
145 150 155 160
Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val
165 170 175
Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro
180 185 190
Ser Ser Ser Leu Gly Thr Lys Thr Tyr Thr Cys Asn Val Asp His Lys
195 200 205
Pro Ser Asn Thr Lys Val Asp Lys Arg Val Glu Ser Lys Tyr Gly Pro
210 215 220
Pro Cys Pro Pro Cys Pro Ala Pro Glu Ala Ala Gly Gly Pro Ser Val
225 230 235 240
Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr
245 250 255
Pro Glu Val Thr Cys Val Val Val Asp Val Ser Gln Glu Asp Pro Glu
260 265 270
Val Gln Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys
275 280 285
Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser Thr Tyr Arg Val Val Ser
290 295 300
Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys
305 310 315 320
Cys Lys Val Ser Asn Lys Gly Leu Pro Ser Ser Ile Glu Lys Thr Ile
325 330 335
Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro
340 345 350
Pro Ser Gln Glu Glu Met Thr Lys Asn Gln Val Ser Leu Ser Cys Ala
355 360 365
Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn
370 375 380
Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser
385 390 395 400
Asp Gly Ser Phe Phe Leu Val Ser Arg Leu Thr Val Asp Lys Ser Arg
405 410 415
Trp Gln Glu Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu
420 425 430
His Asn Arg Phe Thr Gln Lys Ser Leu Ser Leu Ser Leu Gly Lys
435 440 445
<210> 14
<211> 219
<212> Белок
<213> Искусственная последовательность
<220>
<223> Легкая цепь B17B21
<400> 14
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ser Ser Gln Ser Leu Val His Ser
20 25 30
Asn Gly Asn Thr Tyr Leu His Trp Tyr Gln Gln Lys Pro Gly Lys Ala
35 40 45
Pro Lys Phe Leu Ile Tyr Lys Val Ser Asn Arg Phe Ser Gly Val Pro
50 55 60
Ser Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile
65 70 75 80
Ser Ser Leu Gln Pro Glu Asp Phe Ala Thr Tyr Tyr Cys Ser Gln Ser
85 90 95
Thr His Val Pro Phe Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105 110
Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu
115 120 125
Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe
130 135 140
Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln
145 150 155 160
Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser
165 170 175
Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu
180 185 190
Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser
195 200 205
Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
210 215
<210> 15
<211> 445
<212> Белок
<213> Искусственная последовательность
<220>
<223> Тяжелая цепь I3RB217
<400> 15
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Glu
1 5 10 15
Ser Leu Lys Ile Ser Cys Lys Gly Ser Gly Tyr Ser Phe Thr Ser Tyr
20 25 30
Trp Ile Ser Trp Val Arg Gln Met Pro Gly Lys Gly Leu Glu Trp Met
35 40 45
Gly Ile Ile Asp Pro Ser Asp Ser Asp Thr Arg Tyr Ser Pro Ser Phe
50 55 60
Gln Gly Gln Val Thr Ile Ser Ala Asp Lys Ser Ile Ser Thr Ala Tyr
65 70 75 80
Leu Gln Trp Ser Ser Leu Lys Ala Ser Asp Thr Ala Met Tyr Tyr Cys
85 90 95
Ala Arg Gly Asp Gly Ser Thr Asp Leu Asp Tyr Trp Gly Gln Gly Thr
100 105 110
Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro
115 120 125
Leu Ala Pro Cys Ser Arg Ser Thr Ser Glu Ser Thr Ala Ala Leu Gly
130 135 140
Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn
145 150 155 160
Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln
165 170 175
Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser
180 185 190
Ser Leu Gly Thr Lys Thr Tyr Thr Cys Asn Val Asp His Lys Pro Ser
195 200 205
Asn Thr Lys Val Asp Lys Arg Val Glu Ser Lys Tyr Gly Pro Pro Cys
210 215 220
Pro Pro Cys Pro Ala Pro Glu Ala Ala Gly Gly Pro Ser Val Phe Leu
225 230 235 240
Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu
245 250 255
Val Thr Cys Val Val Val Asp Val Ser Gln Glu Asp Pro Glu Val Gln
260 265 270
Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys
275 280 285
Pro Arg Glu Glu Gln Phe Asn Ser Thr Tyr Arg Val Val Ser Val Leu
290 295 300
Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys
305 310 315 320
Val Ser Asn Lys Gly Leu Pro Ser Ser Ile Glu Lys Thr Ile Ser Lys
325 330 335
Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser
340 345 350
Gln Glu Glu Met Thr Lys Asn Gln Val Ser Leu Trp Cys Leu Val Lys
355 360 365
Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln
370 375 380
Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly
385 390 395 400
Ser Phe Phe Leu Tyr Ser Arg Leu Thr Val Asp Lys Ser Arg Trp Gln
405 410 415
Glu Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn
420 425 430
His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Leu Gly Lys
435 440 445
<210> 16
<211> 215
<212> Белок
<213> Искусственная последовательность
<220>
<223> Легкая цепь I3RB217
<400> 16
Glu Ile Val Leu Thr Gln Ser Pro Gly Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Ser Ser Ser
20 25 30
Tyr Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu
35 40 45
Ile Tyr Gly Ala Ser Ser Arg Ala Thr Gly Ile Pro Asp Arg Phe Ser
50 55 60
Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Arg Leu Glu
65 70 75 80
Pro Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Asp Tyr Gly Phe Pro
85 90 95
Trp Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Arg Thr Val Ala
100 105 110
Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser
115 120 125
Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu
130 135 140
Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser
145 150 155 160
Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu
165 170 175
Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val
180 185 190
Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys
195 200 205
Ser Phe Asn Arg Gly Glu Cys
210 215
<210> 17
<211> 447
<212> Белок
<213> Искусственная последовательность
<220>
<223> Без тяжелой цепи
<400> 17
Gln Ile Thr Leu Lys Glu Ser Gly Pro Thr Leu Val Lys Pro Thr Gln
1 5 10 15
Thr Leu Thr Leu Thr Cys Thr Phe Ser Gly Phe Ser Leu Ser Thr Ser
20 25 30
Gly Met Gly Val Ser Trp Ile Arg Gln Pro Pro Gly Lys Ala Leu Glu
35 40 45
Trp Leu Ala His Ile Tyr Trp Asp Asp Asp Lys Arg Tyr Asn Pro Ser
50 55 60
Leu Lys Ser Arg Leu Thr Ile Thr Lys Asp Thr Ser Lys Asn Gln Val
65 70 75 80
Val Leu Thr Met Thr Asn Met Asp Pro Val Asp Thr Ala Thr Tyr Tyr
85 90 95
Cys Ala Arg Leu Tyr Gly Phe Thr Tyr Gly Phe Ala Tyr Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val
115 120 125
Phe Pro Leu Ala Pro Cys Ser Arg Ser Thr Ser Glu Ser Thr Ala Ala
130 135 140
Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser
145 150 155 160
Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val
165 170 175
Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro
180 185 190
Ser Ser Ser Leu Gly Thr Lys Thr Tyr Thr Cys Asn Val Asp His Lys
195 200 205
Pro Ser Asn Thr Lys Val Asp Lys Arg Val Glu Ser Lys Tyr Gly Pro
210 215 220
Pro Cys Pro Pro Cys Pro Ala Pro Glu Ala Ala Gly Gly Pro Ser Val
225 230 235 240
Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr
245 250 255
Pro Glu Val Thr Cys Val Val Val Asp Val Ser Gln Glu Asp Pro Glu
260 265 270
Val Gln Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys
275 280 285
Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser Thr Tyr Arg Val Val Ser
290 295 300
Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys
305 310 315 320
Cys Lys Val Ser Asn Lys Gly Leu Pro Ser Ser Ile Glu Lys Thr Ile
325 330 335
Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro
340 345 350
Pro Ser Gln Glu Glu Met Thr Lys Asn Gln Val Ser Leu Trp Cys Leu
355 360 365
Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn
370 375 380
Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser
385 390 395 400
Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu Thr Val Asp Lys Ser Arg
405 410 415
Trp Gln Glu Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu
420 425 430
His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Leu Gly Lys
435 440 445
<210> 18
<211> 218
<212> Белок
<213> Искусственная последовательность
<220>
<223> Без легкой цепи
<400> 18
Asp Ile Val Met Thr Gln Ser Pro Asp Ser Leu Ala Val Ser Leu Gly
1 5 10 15
Glu Arg Ala Thr Ile Asn Cys Arg Ala Ser Gln Ser Val Asp Tyr Asn
20 25 30
Gly Ile Ser Tyr Met His Trp Tyr Gln Gln Lys Pro Gly Gln Pro Pro
35 40 45
Lys Leu Leu Ile Tyr Ala Ala Ser Asn Pro Glu Ser Gly Val Pro Asp
50 55 60
Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser
65 70 75 80
Ser Leu Gln Ala Glu Asp Val Ala Val Tyr Tyr Cys Gln Gln Ile Ile
85 90 95
Glu Asp Pro Trp Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Arg
100 105 110
Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln
115 120 125
Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr
130 135 140
Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser
145 150 155 160
Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr
165 170 175
Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys
180 185 190
His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro
195 200 205
Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
210 215
<210> 19
<211> 119
<212> Белок
<213> Искусственная последовательность
<220>
<223> B17H3
<400> 19
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Tyr Ser Ile Thr Ser Gly
20 25 30
Tyr Phe Trp Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp
35 40 45
Val Ser Tyr Ile Ser Tyr Asp Gly Ser Asn Asn Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Lys Pro Ser Pro Gly Thr Gly Tyr Ala Val Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser
115
<210> 20
<211> 120
<212> Белок
<213> Искусственная последовательность
<220>
<223> B17H4
<400> 20
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Tyr Ser Ile Thr Ser Gly
20 25 30
Tyr Phe Trp Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp
35 40 45
Val Ser Tyr Ile Ser Tyr Asp Gly Ser Asn Asn Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Ser Pro Ser Pro Gly Thr Gly Tyr Ala Val Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 21
<211> 120
<212> Белок
<213> Искусственная последовательность
<220>
<223> B17H5
<400> 21
Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Thr Val Ser Gly Tyr Ser Ile Thr Ser Gly
20 25 30
Tyr Phe Trp Asn Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp
35 40 45
Ile Gly Tyr Ile Ser Tyr Asp Gly Ser Asn Asn Tyr Asn Pro Ser Leu
50 55 60
Lys Ser Arg Val Thr Ile Ser Arg Asp Thr Ser Lys Asn Gln Phe Ser
65 70 75 80
Leu Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Ser Pro Ser Pro Gly Thr Gly Tyr Ala Val Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 22
<211> 112
<212> Белок
<213> Искусственная последовательность
<220>
<223> B17L3
<400> 22
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ser Ser Gln Ser Leu Val His Ser
20 25 30
Asn Gly Asn Thr Tyr Leu His Trp Tyr Gln Gln Lys Pro Gly Lys Ala
35 40 45
Pro Lys Leu Leu Ile Tyr Lys Val Ser Asn Arg Phe Ser Gly Val Pro
50 55 60
Ser Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile
65 70 75 80
Ser Ser Leu Gln Pro Glu Asp Phe Ala Thr Tyr Tyr Cys Ser Gln Ser
85 90 95
Thr His Val Pro Phe Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 23
<211> 112
<212> Белок
<213> Искусственная последовательность
<220>
<223> B17L4
<400> 23
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ser Ser Gln Ser Leu Val His Ser
20 25 30
Asn Gly Asn Thr Tyr Leu His Trp Tyr Gln Gln Lys Pro Gly Lys Ala
35 40 45
Pro Lys Phe Leu Ile Tyr Lys Val Ser Asn Arg Phe Ser Gly Val Pro
50 55 60
Ser Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile
65 70 75 80
Ser Ser Leu Gln Pro Glu Asp Phe Ala Thr Tyr Tyr Cys Ser Gln Ser
85 90 95
Thr His Val Pro Phe Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 24
<211> 112
<212> Белок
<213> Искусственная последовательность
<220>
<223> B17L5
<400> 24
Asp Val Val Met Thr Gln Ser Pro Leu Ser Leu Pro Val Thr Leu Gly
1 5 10 15
Gln Pro Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Leu Val His Ser
20 25 30
Asn Gly Asn Thr Tyr Leu His Trp Phe Gln Gln Arg Pro Gly Gln Ser
35 40 45
Pro Arg Phe Leu Ile Tyr Lys Val Ser Asn Arg Phe Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Ser Gln Ser
85 90 95
Thr His Val Pro Phe Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 25
<211> 120
<212> Белок
<213> Искусственная последовательность
<220>
<223> B17H1
<400> 25
Asn Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Gln
1 5 10 15
Ser Leu Ser Leu Thr Cys Ser Val Ala Gly Tyr Ser Ile Thr Ser Gly
20 25 30
Tyr Phe Trp Asn Trp Ile Arg Gln Phe Pro Gly Asn Lys Leu Glu Trp
35 40 45
Met Gly Tyr Ile Ser Tyr Asp Gly Ser Asn Asn Tyr Asn Pro Ser Leu
50 55 60
Lys Asn Arg Ile Ser Ile Thr Arg Asp Thr Ser Lys Asn Gln Phe Phe
65 70 75 80
Leu Lys Leu Asn Ser Val Thr Thr Glu Asp Thr Ala Thr Tyr Tyr Cys
85 90 95
Ala Ser Pro Ser Pro Gly Thr Gly Tyr Ala Val Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Ser Val Thr Val Ser Ser
115 120
<210> 26
<211> 112
<212> Белок
<213> Искусственная последовательность
<220>
<223> B17L1
<400> 26
Asn Val Val Met Thr Gln Thr Pro Leu Ser Leu Pro Val Ser Leu Gly
1 5 10 15
Asp Gln Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Leu Val His Ser
20 25 30
Asn Gly Asn Thr Tyr Leu His Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Lys Phe Leu Ile Tyr Lys Val Ser Asn Arg Phe Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Gly Gly Ser Gly Thr Glu Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Leu Gly Val Tyr Phe Cys Ser Gln Ser
85 90 95
Thr His Val Pro Phe Thr Phe Gly Ser Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 27
<211> 493
<212> Белок
<213> Искусственная последовательность
<220>
<223> Слитый пептид TCR-Vbeta17_Fc
<400> 27
Met Ala Trp Val Trp Thr Leu Leu Phe Leu Met Ala Ala Ala Gln Ser
1 5 10 15
Ile Gln Ala Val Asp Gly Gly Ile Thr Gln Ser Pro Lys Tyr Leu Phe
20 25 30
Arg Lys Glu Gly Gln Asn Val Thr Leu Ser Cys Glu Gln Asn Leu Asn
35 40 45
His Asp Ala Met Tyr Trp Tyr Arg Gln Asp Pro Gly Gln Gly Leu Arg
50 55 60
Leu Ile Tyr Tyr Ser Gln Ile Val Asn Asp Phe Gln Lys Gly Asp Ile
65 70 75 80
Ala Glu Gly Tyr Ser Val Ser Arg Glu Lys Lys Glu Ser Phe Pro Leu
85 90 95
Thr Val Thr Ser Ala Gln Lys Asn Pro Thr Ala Phe Tyr Leu Cys Ala
100 105 110
Ser Ser Ser Arg Ser Ser Tyr Glu Gln Tyr Phe Gly Pro Gly Thr Arg
115 120 125
Leu Thr Val Thr Glu Asp Leu Lys Asn Val Phe Pro Pro Glu Val Ala
130 135 140
Val Phe Glu Pro Ser Glu Ala Glu Ile Ser His Thr Gln Lys Ala Thr
145 150 155 160
Leu Val Cys Leu Ala Thr Gly Phe Tyr Pro Asp His Val Glu Leu Ser
165 170 175
Trp Trp Val Asn Gly Lys Glu Val His Ser Gly Val Ser Thr Asp Pro
180 185 190
Gln Pro Leu Lys Glu Gln Pro Ala Leu Asn Asp Ser Arg Tyr Ser Leu
195 200 205
Ser Ser Arg Leu Arg Val Ser Ala Thr Phe Trp Gln Asn Pro Arg Asn
210 215 220
His Phe Arg Cys Gln Val Gln Phe Tyr Gly Leu Ser Glu Asn Asp Glu
225 230 235 240
Trp Thr Gln Asp Arg Ala Lys Pro Val Thr Gln Ile Val Ser Ala Glu
245 250 255
Ala Trp Gly Arg Ala Asp Glu Pro Lys Ser Cys Asp Lys Thr His Thr
260 265 270
Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe
275 280 285
Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro
290 295 300
Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val
305 310 315 320
Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr
325 330 335
Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val
340 345 350
Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys
355 360 365
Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser
370 375 380
Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Val Leu Pro Pro
385 390 395 400
Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu Leu Cys Leu Val
405 410 415
Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly
420 425 430
Gln Pro Glu Asn Asn Tyr Leu Thr Trp Pro Pro Val Leu Asp Ser Asp
435 440 445
Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp
450 455 460
Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His
465 470 475 480
Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly
485 490
<210> 28
<211> 719
<212> Белок
<213> Искусственная последовательность
<220>
<223> Полуантитело B17B21
<400> 28
Met Ala Trp Val Trp Thr Leu Leu Phe Leu Met Ala Ala Ala Gln Ser
1 5 10 15
Ile Gln Ala Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala
20 25 30
Ser Val Gly Asp Arg Val Thr Ile Thr Cys Arg Ser Ser Gln Ser Leu
35 40 45
Val His Ser Asn Gly Asn Thr Tyr Leu His Trp Tyr Gln Gln Lys Pro
50 55 60
Gly Lys Ala Pro Lys Phe Leu Ile Tyr Lys Val Ser Asn Arg Phe Ser
65 70 75 80
Gly Val Pro Ser Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr
85 90 95
Leu Thr Ile Ser Ser Leu Gln Pro Glu Asp Phe Ala Thr Tyr Tyr Cys
100 105 110
Ser Gln Ser Thr His Val Pro Phe Thr Phe Gly Gln Gly Thr Lys Leu
115 120 125
Glu Ile Lys Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro
130 135 140
Ser Asp Glu Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu
145 150 155 160
Asn Asn Phe Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn
165 170 175
Ala Leu Gln Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser
180 185 190
Lys Asp Ser Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala
195 200 205
Asp Tyr Glu Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly
210 215 220
Leu Ser Ser Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys Gly Gly
225 230 235 240
Ser Glu Gly Lys Ser Ser Gly Ser Gly Ser Glu Ser Lys Ser Thr Glu
245 250 255
Gly Lys Ser Ser Gly Ser Gly Ser Glu Ser Lys Ser Thr Gly Gly Ser
260 265 270
Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Glu
275 280 285
Thr Leu Ser Leu Thr Cys Thr Val Ser Gly Tyr Ser Ile Thr Ser Gly
290 295 300
Tyr Phe Trp Asn Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp
305 310 315 320
Ile Gly Tyr Ile Ser Tyr Asp Gly Ser Asn Asn Tyr Asn Pro Ser Leu
325 330 335
Lys Ser Arg Val Thr Ile Ser Arg Asp Thr Ser Lys Asn Gln Phe Ser
340 345 350
Leu Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr Cys
355 360 365
Ala Ser Pro Ser Pro Gly Thr Gly Tyr Ala Val Asp Tyr Trp Gly Gln
370 375 380
Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val
385 390 395 400
Phe Pro Leu Ala Pro Cys Ser Arg Ser Thr Ser Glu Ser Thr Ala Ala
405 410 415
Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser
420 425 430
Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val
435 440 445
Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro
450 455 460
Ser Ser Ser Leu Gly Thr Lys Thr Tyr Thr Cys Asn Val Asp His Lys
465 470 475 480
Pro Ser Asn Thr Lys Val Asp Lys Arg Val Glu Ser Lys Tyr Gly Pro
485 490 495
Pro Cys Pro Pro Cys Pro Ala Pro Glu Ala Ala Gly Gly Pro Ser Val
500 505 510
Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr
515 520 525
Pro Glu Val Thr Cys Val Val Val Asp Val Ser Gln Glu Asp Pro Glu
530 535 540
Val Gln Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys
545 550 555 560
Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser Thr Tyr Arg Val Val Ser
565 570 575
Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys
580 585 590
Cys Lys Val Ser Asn Lys Gly Leu Pro Ser Ser Ile Glu Lys Thr Ile
595 600 605
Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro
610 615 620
Pro Ser Gln Glu Glu Met Thr Lys Asn Gln Val Ser Leu Ser Cys Ala
625 630 635 640
Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn
645 650 655
Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser
660 665 670
Asp Gly Ser Phe Phe Leu Val Ser Arg Leu Thr Val Asp Lys Ser Arg
675 680 685
Trp Gln Glu Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu
690 695 700
His Asn Arg Phe Thr Gln Lys Ser Leu Ser Leu Ser Leu Gly Lys
705 710 715
<210> 29
<211> 4320
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Полуантитело B17B21
<400> 29
atggcctggg tgtggaccct gctgttcctg atggccgccg cccagagcat ccaggccgac 60
atccagatga cccagagccc aagcagcctg agcgccagcg tgggcgaccg cgtgaccatc 120
acctgccgca gcagccagag cctggtgcac agcaacggca acacctacct gcactggtac 180
cagcagaagc caggcaaggc cccaaagttc ctgatctaca aggtgagcaa ccgcttcagc 240
ggcgtgccaa gccgcttcag cggcagcggc agcggcaccg acttcaccct gaccatcagc 300
agcctgcagc cagaggactt cgccacctac tactgcagcc agagcaccca cgtgccattc 360
accttcggcc agggcaccaa gctggagatc aagcgcaccg tggccgcccc aagcgtgttc 420
atcttcccac caagcgacga gcagctgaag agcggcaccg ccagcgtggt gtgcctgctg 480
aacaacttct acccacgcga ggccaaggtg cagtggaagg tggacaacgc cctgcagagc 540
ggcaacagcc aggagagcgt gaccgagcag gacagcaagg acagcaccta cagcctgagc 600
agcaccctga ccctgagcaa ggccgactac gagaagcaca aggtgtacgc ctgcgaggtg 660
acccaccagg gcctgagcag cccagtgacc aagagcttca accgcggcga gtgcggcggc 720
agcgagggca agagcagcgg cagcggcagc gagagcaaga gcaccgaggg caagagcagc 780
ggcagcggca gcgagagcaa gagcaccggc ggcagccagg tgcagctgca ggagagcggc 840
ccaggcctgg tgaagccaag cgagaccctg agcctgacct gcaccgtgag cggctacagc 900
atcaccagcg gctacttctg gaactggatc cgccagccac caggcaaggg cctggagtgg 960
atcggctaca tcagctacga cggcagcaac aactacaacc caagcctgaa gagccgcgtg 1020
accatcagcc gcgacaccag caagaaccag ttcagcctga agctgagcag cgtgaccgcc 1080
gccgacaccg ccgtgtacta ctgcgccagc ccaagcccag gcaccggcta cgccgtggac 1140
tactggggcc agggcaccct ggtgaccgtg agcagcgcca gcaccaaggg cccaagcgtg 1200
ttcccactgg ccccatgcag ccgcagcacc agcgagagca ccgccgccct gggctgcctg 1260
gtgaaggact acttcccaga gccagtgacc gtgagctgga acagcggcgc cctgaccagc 1320
ggcgtgcaca ccttcccagc cgtgctgcag agcagcggcc tgtacagcct gagcagcgtg 1380
gtgaccgtgc caagcagcag cctgggcacc aagacctaca cctgcaacgt ggaccacaag 1440
ccaagcaaca ccaaggtgga caagcgcgtg gagagcaagt acggcccacc atgcccacca 1500
tgcccagccc cagaggccgc cggcggccca agcgtgttcc tgttcccacc aaagccaaag 1560
gacaccctga tgatcagccg caccccagag gtgacctgcg tggtggtgga cgtgagccag 1620
gaggacccag aggtgcagtt caactggtac gtggacggcg tggaggtgca caacgccaag 1680
accaagccac gcgaggagca gttcaacagc acctaccgcg tggtgagcgt gctgaccgtg 1740
ctgcaccagg actggctgaa cggcaaggag tacaagtgca aggtgagcaa caagggcctg 1800
ccaagcagca tcgagaagac catcagcaag gccaagggcc agccacgcga gccacaggtg 1860
tacaccctgc caccaagcca ggaggagatg accaagaacc aggtgagcct gagctgcgcc 1920
gtgaagggct tctacccaag cgacatcgcc gtggagtggg agagcaacgg ccagccagag 1980
aacaactaca agaccacccc accagtgctg gacagcgacg gcagcttctt cctggtgagc 2040
cgcctgaccg tggacaagag ccgctggcag gagggcaacg tgttcagctg cagcgtgatg 2100
cacgaggccc tgcacaaccg cttcacccag aagagcctga gcctgagcct gggcaagatg 2160
gcctgggtgt ggaccctgct gttcctgatg gccgccgccc agagcatcca ggccgacatc 2220
cagatgaccc agagcccaag cagcctgagc gccagcgtgg gcgaccgcgt gaccatcacc 2280
tgccgcagca gccagagcct ggtgcacagc aacggcaaca cctacctgca ctggtaccag 2340
cagaagccag gcaaggcccc aaagttcctg atctacaagg tgagcaaccg cttcagcggc 2400
gtgccaagcc gcttcagcgg cagcggcagc ggcaccgact tcaccctgac catcagcagc 2460
ctgcagccag aggacttcgc cacctactac tgcagccaga gcacccacgt gccattcacc 2520
ttcggccagg gcaccaagct ggagatcaag cgcaccgtgg ccgccccaag cgtgttcatc 2580
ttcccaccaa gcgacgagca gctgaagagc ggcaccgcca gcgtggtgtg cctgctgaac 2640
aacttctacc cacgcgaggc caaggtgcag tggaaggtgg acaacgccct gcagagcggc 2700
aacagccagg agagcgtgac cgagcaggac agcaaggaca gcacctacag cctgagcagc 2760
accctgaccc tgagcaaggc cgactacgag aagcacaagg tgtacgcctg cgaggtgacc 2820
caccagggcc tgagcagccc agtgaccaag agcttcaacc gcggcgagtg cggcggcagc 2880
gagggcaaga gcagcggcag cggcagcgag agcaagagca ccgagggcaa gagcagcggc 2940
agcggcagcg agagcaagag caccggcggc agccaggtgc agctgcagga gagcggccca 3000
ggcctggtga agccaagcga gaccctgagc ctgacctgca ccgtgagcgg ctacagcatc 3060
accagcggct acttctggaa ctggatccgc cagccaccag gcaagggcct ggagtggatc 3120
ggctacatca gctacgacgg cagcaacaac tacaacccaa gcctgaagag ccgcgtgacc 3180
atcagccgcg acaccagcaa gaaccagttc agcctgaagc tgagcagcgt gaccgccgcc 3240
gacaccgccg tgtactactg cgccagccca agcccaggca ccggctacgc cgtggactac 3300
tggggccagg gcaccctggt gaccgtgagc agcgccagca ccaagggccc aagcgtgttc 3360
ccactggccc catgcagccg cagcaccagc gagagcaccg ccgccctggg ctgcctggtg 3420
aaggactact tcccagagcc agtgaccgtg agctggaaca gcggcgccct gaccagcggc 3480
gtgcacacct tcccagccgt gctgcagagc agcggcctgt acagcctgag cagcgtggtg 3540
accgtgccaa gcagcagcct gggcaccaag acctacacct gcaacgtgga ccacaagcca 3600
agcaacacca aggtggacaa gcgcgtggag agcaagtacg gcccaccatg cccaccatgc 3660
ccagccccag aggccgccgg cggcccaagc gtgttcctgt tcccaccaaa gccaaaggac 3720
accctgatga tcagccgcac cccagaggtg acctgcgtgg tggtggacgt gagccaggag 3780
gacccagagg tgcagttcaa ctggtacgtg gacggcgtgg aggtgcacaa cgccaagacc 3840
aagccacgcg aggagcagtt caacagcacc taccgcgtgg tgagcgtgct gaccgtgctg 3900
caccaggact ggctgaacgg caaggagtac aagtgcaagg tgagcaacaa gggcctgcca 3960
agcagcatcg agaagaccat cagcaaggcc aagggccagc cacgcgagcc acaggtgtac 4020
accctgccac caagccagga ggagatgacc aagaaccagg tgagcctgag ctgcgccgtg 4080
aagggcttct acccaagcga catcgccgtg gagtgggaga gcaacggcca gccagagaac 4140
aactacaaga ccaccccacc agtgctggac agcgacggca gcttcttcct ggtgagccgc 4200
ctgaccgtgg acaagagccg ctggcaggag ggcaacgtgt tcagctgcag cgtgatgcac 4260
gaggccctgc acaaccgctt cacccagaag agcctgagcc tgagcctggg caagtgatag 4320
<210> 30
<211> 713
<212> Белок
<213> Искусственная последовательность
<220>
<223> Полуантитело I3RB217
<400> 30
Met Ala Trp Val Trp Thr Leu Leu Phe Leu Met Ala Ala Ala Gln Ser
1 5 10 15
Ile Gln Ala Glu Ile Val Leu Thr Gln Ser Pro Gly Thr Leu Ser Leu
20 25 30
Ser Pro Gly Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val
35 40 45
Ser Ser Ser Tyr Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro
50 55 60
Arg Leu Leu Ile Tyr Gly Ala Ser Ser Arg Ala Thr Gly Ile Pro Asp
65 70 75 80
Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser
85 90 95
Arg Leu Glu Pro Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Asp Tyr
100 105 110
Gly Phe Pro Trp Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Arg
115 120 125
Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln
130 135 140
Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr
145 150 155 160
Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser
165 170 175
Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr
180 185 190
Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys
195 200 205
His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro
210 215 220
Val Thr Lys Ser Phe Asn Arg Gly Glu Cys Gly Gly Ser Glu Gly Lys
225 230 235 240
Ser Ser Gly Ser Gly Ser Glu Ser Lys Ser Thr Glu Gly Lys Ser Ser
245 250 255
Gly Ser Gly Ser Glu Ser Lys Ser Thr Gly Gly Ser Glu Val Gln Leu
260 265 270
Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Glu Ser Leu Lys Ile
275 280 285
Ser Cys Lys Gly Ser Gly Tyr Ser Phe Thr Ser Tyr Trp Ile Ser Trp
290 295 300
Val Arg Gln Met Pro Gly Lys Gly Leu Glu Trp Met Gly Ile Ile Asp
305 310 315 320
Pro Ser Asp Ser Asp Thr Arg Tyr Ser Pro Ser Phe Gln Gly Gln Val
325 330 335
Thr Ile Ser Ala Asp Lys Ser Ile Ser Thr Ala Tyr Leu Gln Trp Ser
340 345 350
Ser Leu Lys Ala Ser Asp Thr Ala Met Tyr Tyr Cys Ala Arg Gly Asp
355 360 365
Gly Ser Thr Asp Leu Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr Val
370 375 380
Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Cys
385 390 395 400
Ser Arg Ser Thr Ser Glu Ser Thr Ala Ala Leu Gly Cys Leu Val Lys
405 410 415
Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu
420 425 430
Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu
435 440 445
Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr
450 455 460
Lys Thr Tyr Thr Cys Asn Val Asp His Lys Pro Ser Asn Thr Lys Val
465 470 475 480
Asp Lys Arg Val Glu Ser Lys Tyr Gly Pro Pro Cys Pro Pro Cys Pro
485 490 495
Ala Pro Glu Ala Ala Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys
500 505 510
Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val
515 520 525
Val Val Asp Val Ser Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr
530 535 540
Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu
545 550 555 560
Gln Phe Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His
565 570 575
Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys
580 585 590
Gly Leu Pro Ser Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln
595 600 605
Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met
610 615 620
Thr Lys Asn Gln Val Ser Leu Trp Cys Leu Val Lys Gly Phe Tyr Pro
625 630 635 640
Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn
645 650 655
Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu
660 665 670
Tyr Ser Arg Leu Thr Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val
675 680 685
Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln
690 695 700
Lys Ser Leu Ser Leu Ser Leu Gly Lys
705 710
<210> 31
<211> 2139
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Полуантитело I3RB217
<400> 31
atggcctggg tgtggaccct gctgttcctg atggccgccg cccagagcat ccaggccgag 60
atcgtgctga cccagagccc aggcaccctg agcctgagcc caggcgagcg cgccaccctg 120
agctgccgcg ccagccagag cgtgagcagc agctacctgg cctggtacca gcagaagcca 180
ggccaggccc cacgcctgct gatctacggc gccagcagcc gcgccaccgg catcccagac 240
cgcttcagcg gcagcggcag cggcaccgac ttcaccctga ccatcagccg cctggagcca 300
gaggacttcg ccgtgtacta ctgccagcag gactacggct tcccatggac cttcggccag 360
ggcaccaagg tggagatcaa gcgcaccgtg gccgccccaa gcgtgttcat cttcccacca 420
agcgacgagc agctgaagag cggcaccgcc agcgtggtgt gcctgctgaa caacttctac 480
ccacgcgagg ccaaggtgca gtggaaggtg gacaacgccc tgcagagcgg caacagccag 540
gagagcgtga ccgagcagga cagcaaggac agcacctaca gcctgagcag caccctgacc 600
ctgagcaagg ccgactacga gaagcacaag gtgtacgcct gcgaggtgac ccaccagggc 660
ctgagcagcc cagtgaccaa gagcttcaac cgcggcgagt gcggcggcag cgagggcaag 720
agcagcggca gcggcagcga gagcaagagc accgagggca agagcagcgg cagcggcagc 780
gagagcaaga gcaccggcgg cagcgaggtg cagctggtgc agagcggcgc cgaggtgaag 840
aagccaggcg agagcctgaa gatcagctgc aagggcagcg gctacagctt caccagctac 900
tggatcagct gggtgcgcca gatgccaggc aagggcctgg agtggatggg catcatcgac 960
ccaagcgaca gcgacacccg ctacagccca agcttccagg gccaggtgac catcagcgcc 1020
gacaagagca tcagcaccgc ctacctgcag tggagcagcc tgaaggccag cgacaccgcc 1080
atgtactact gcgcccgcgg cgacggcagc accgacctgg actactgggg ccagggcacc 1140
ctggtgaccg tgagcagcgc cagcaccaag ggcccaagcg tgttcccact ggccccatgc 1200
agccgcagca ccagcgagag caccgccgcc ctgggctgcc tggtgaagga ctacttccca 1260
gagccagtga ccgtgagctg gaacagcggc gccctgacca gcggcgtgca caccttccca 1320
gccgtgctgc agagcagcgg cctgtacagc ctgagcagcg tggtgaccgt gccaagcagc 1380
agcctgggca ccaagaccta cacctgcaac gtggaccaca agccaagcaa caccaaggtg 1440
gacaagcgcg tggagagcaa gtacggccca ccatgcccac catgcccagc cccagaggcc 1500
gccggcggcc caagcgtgtt cctgttccca ccaaagccaa aggacaccct gatgatcagc 1560
cgcaccccag aggtgacctg cgtggtggtg gacgtgagcc aggaggaccc agaggtgcag 1620
ttcaactggt acgtggacgg cgtggaggtg cacaacgcca agaccaagcc acgcgaggag 1680
cagttcaaca gcacctaccg cgtggtgagc gtgctgaccg tgctgcacca ggactggctg 1740
aacggcaagg agtacaagtg caaggtgagc aacaagggcc tgccaagcag catcgagaag 1800
accatcagca aggccaaggg ccagccacgc gagccacagg tgtacaccct gccaccaagc 1860
caggaggaga tgaccaagaa ccaggtgagc ctgtggtgcc tggtgaaggg cttctaccca 1920
agcgacatcg ccgtggagtg ggagagcaac ggccagccag agaacaacta caagaccacc 1980
ccaccagtgc tggacagcga cggcagcttc ttcctgtaca gccgcctgac cgtggacaag 2040
agccgctggc aggagggcaa cgtgttcagc tgcagcgtga tgcacgaggc cctgcacaac 2100
cactacaccc agaagagcct gagcctgagc ctgggcaag 2139
<210> 32
<211> 713
<212> Белок
<213> Искусственная последовательность
<220>
<223> Полуантитело B23B49
<400> 32
Met Ala Trp Val Trp Thr Leu Leu Phe Leu Met Ala Ala Ala Gln Ser
1 5 10 15
Ile Gln Ala Glu Ile Val Leu Thr Gln Ser Pro Gly Thr Leu Ser Leu
20 25 30
Ser Pro Gly Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val
35 40 45
Ser Ser Ser Tyr Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro
50 55 60
Arg Leu Leu Ile Tyr Gly Ala Ser Ser Arg Ala Thr Gly Ile Pro Asp
65 70 75 80
Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser
85 90 95
Arg Leu Glu Pro Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Asp Tyr
100 105 110
Gly Phe Pro Trp Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Arg
115 120 125
Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln
130 135 140
Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr
145 150 155 160
Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser
165 170 175
Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr
180 185 190
Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys
195 200 205
His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro
210 215 220
Val Thr Lys Ser Phe Asn Arg Gly Glu Cys Gly Gly Ser Glu Gly Lys
225 230 235 240
Ser Ser Gly Ser Gly Ser Glu Ser Lys Ser Thr Glu Gly Lys Ser Ser
245 250 255
Gly Ser Gly Ser Glu Ser Lys Ser Thr Gly Gly Ser Glu Val Gln Leu
260 265 270
Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Glu Ser Leu Lys Ile
275 280 285
Ser Cys Lys Gly Ser Gly Tyr Ser Phe Thr Ser Tyr Trp Ile Ser Trp
290 295 300
Val Arg Gln Met Pro Gly Lys Gly Leu Glu Trp Met Gly Ile Ile Asp
305 310 315 320
Pro Ser Asp Ser Asp Thr Arg Tyr Ser Pro Ser Phe Gln Gly Gln Val
325 330 335
Thr Ile Ser Ala Asp Lys Ser Ile Ser Thr Ala Tyr Leu Gln Trp Ser
340 345 350
Ser Leu Lys Ala Ser Asp Thr Ala Met Tyr Tyr Cys Ala Arg Gly Asp
355 360 365
Gly Ser Thr Asp Leu Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr Val
370 375 380
Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Cys
385 390 395 400
Ser Arg Ser Thr Ser Glu Ser Thr Ala Ala Leu Gly Cys Leu Val Lys
405 410 415
Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu
420 425 430
Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu
435 440 445
Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr
450 455 460
Lys Thr Tyr Thr Cys Asn Val Asp His Lys Pro Ser Asn Thr Lys Val
465 470 475 480
Asp Lys Arg Val Glu Ser Lys Tyr Gly Pro Pro Cys Pro Pro Cys Pro
485 490 495
Ala Pro Glu Ala Ala Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys
500 505 510
Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val
515 520 525
Val Val Asp Val Ser Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr
530 535 540
Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu
545 550 555 560
Gln Phe Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His
565 570 575
Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys
580 585 590
Gly Leu Pro Ser Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln
595 600 605
Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met
610 615 620
Thr Lys Asn Gln Val Ser Leu Trp Cys Leu Val Lys Gly Phe Tyr Pro
625 630 635 640
Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn
645 650 655
Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu
660 665 670
Tyr Ser Arg Leu Thr Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val
675 680 685
Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln
690 695 700
Lys Ser Leu Ser Leu Ser Leu Gly Lys
705 710
<210> 33
<211> 2154
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Полуантитело B23B49
<400> 33
atggcctggg tgtggaccct gctgttcctg atggccgccg cccagagcat ccaggccgac 60
atcgtgatga cccagagccc agacagcctg gccgtgagcc tgggcgagcg cgccaccatc 120
aactgccgcg ccagccagag cgtggactac aacggcatca gctacatgca ctggtaccag 180
cagaagccag gccagccacc aaagctgctg atctacgccg ccagcaaccc agagagcggc 240
gtgccagacc gcttcagcgg cagcggcagc ggcaccgact tcaccctgac catcagcagc 300
ctgcaggccg aggacgtggc cgtgtactac tgccagcaga tcatcgagga cccatggacc 360
ttcggccagg gcaccaaggt ggagatcaag cgcaccgtgg ccgccccaag cgtgttcatc 420
ttcccaccaa gcgacgagca gctgaagagc ggcaccgcca gcgtggtgtg cctgctgaac 480
aacttctacc cacgcgaggc caaggtgcag tggaaggtgg acaacgccct gcagagcggc 540
aacagccagg agagcgtgac cgagcaggac agcaaggaca gcacctacag cctgagcagc 600
accctgaccc tgagcaaggc cgactacgag aagcacaagg tgtacgcctg cgaggtgacc 660
caccagggcc tgagcagccc agtgaccaag agcttcaacc gcggcgagtg cggcggcagc 720
gagggcaaga gcagcggcag cggcagcgag agcaagagca ccgagggcaa gagcagcggc 780
agcggcagcg agagcaagag caccggcggc agccagatca ccctgaagga gagcggccca 840
accctggtga agccaaccca gaccctgacc ctgacctgca ccttcagcgg cttcagcctg 900
agcaccagcg gcatgggcgt gagctggatc cgccagccac caggcaaggc cctggagtgg 960
ctggcccaca tctactggga cgacgacaag cgctacaacc caagcctgaa gagccgcctg 1020
accatcacca aggacaccag caagaaccag gtggtgctga ccatgaccaa catggaccca 1080
gtggacaccg ccacctacta ctgcgcccgc ctgtacggct tcacctacgg cttcgcctac 1140
tggggccagg gcaccctggt gaccgtgagc agcgccagca ccaagggccc aagcgtgttc 1200
ccactggccc catgcagccg cagcaccagc gagagcaccg ccgccctggg ctgcctggtg 1260
aaggactact tcccagagcc agtgaccgtg agctggaaca gcggcgccct gaccagcggc 1320
gtgcacacct tcccagccgt gctgcagagc agcggcctgt acagcctgag cagcgtggtg 1380
accgtgccaa gcagcagcct gggcaccaag acctacacct gcaacgtgga ccacaagcca 1440
agcaacacca aggtggacaa gcgcgtggag agcaagtacg gcccaccatg cccaccatgc 1500
ccagccccag aggccgccgg cggcccaagc gtgttcctgt tcccaccaaa gccaaaggac 1560
accctgatga tcagccgcac cccagaggtg acctgcgtgg tggtggacgt gagccaggag 1620
gacccagagg tgcagttcaa ctggtacgtg gacggcgtgg aggtgcacaa cgccaagacc 1680
aagccacgcg aggagcagtt caacagcacc taccgcgtgg tgagcgtgct gaccgtgctg 1740
caccaggact ggctgaacgg caaggagtac aagtgcaagg tgagcaacaa gggcctgcca 1800
agcagcatcg agaagaccat cagcaaggcc aagggccagc cacgcgagcc acaggtgtac 1860
accctgccac caagccagga ggagatgacc aagaaccagg tgagcctgtg gtgcctggtg 1920
aagggcttct acccaagcga catcgccgtg gagtgggaga gcaacggcca gccagagaac 1980
aactacaaga ccaccccacc agtgctggac agcgacggca gcttcttcct gtacagccgc 2040
ctgaccgtgg acaagagccg ctggcaggag ggcaacgtgt tcagctgcag cgtgatgcac 2100
gaggccctgc acaaccacta cacccagaag agcctgagcc tgagcctggg caag 2154
<210> 34
<211> 5
<212> Белок
<213> Искусственная последовательность
<220>
<223> I3RB217 HCDR1
<400> 34
Ser Tyr Trp Ile Ser
1 5
<210> 35
<211> 17
<212> Белок
<213> Искусственная последовательность
<220>
<223> I3RB217 HCDR2
<400> 35
Ile Ile Asp Pro Ser Asp Ser Asp Thr Arg Tyr Ser Pro Ser Phe Gln
1 5 10 15
Gly
<210> 36
<211> 9
<212> Белок
<213> Искусственная последовательность
<220>
<223> I3RB217 HCDR3
<400> 36
Gly Asp Gly Ser Thr Asp Leu Asp Tyr
1 5
<210> 37
<211> 11
<212> Белок
<213> Искусственная последовательность
<220>
<223> I3RB217 LCDR1
<400> 37
Arg Ala Ser Gln Ser Val Ser Ser Ser Tyr Leu
1 5 10
<210> 38
<211> 7
<212> Белок
<213> Искусственная последовательность
<220>
<223> I3RB217 LCDR2
<400> 38
Gly Ala Ser Ser Arg Ala Thr
1 5
<210> 39
<211> 9
<212> Белок
<213> Искусственная последовательность
<220>
<223> I3RB217 LCDR3
<400> 39
Gln Gln Asp Tyr Gly Phe Pro Trp Thr
1 5
<210> 40
<211> 118
<212> Белок
<213> Искусственная последовательность
<220>
<223> I3RB217 HC
<400> 40
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Glu
1 5 10 15
Ser Leu Lys Ile Ser Cys Lys Gly Ser Gly Tyr Ser Phe Thr Ser Tyr
20 25 30
Trp Ile Ser Trp Val Arg Gln Met Pro Gly Lys Gly Leu Glu Trp Met
35 40 45
Gly Ile Ile Asp Pro Ser Asp Ser Asp Thr Arg Tyr Ser Pro Ser Phe
50 55 60
Gln Gly Gln Val Thr Ile Ser Ala Asp Lys Ser Ile Ser Thr Ala Tyr
65 70 75 80
Leu Gln Trp Ser Ser Leu Lys Ala Ser Asp Thr Ala Met Tyr Tyr Cys
85 90 95
Ala Arg Gly Asp Gly Ser Thr Asp Leu Asp Tyr Trp Gly Gln Gly Thr
100 105 110
Leu Val Thr Val Ser Ser
115
<210> 41
<211> 108
<212> Белок
<213> Искусственная последовательность
<220>
<223> I3RB217 LC
<400> 41
Glu Ile Val Leu Thr Gln Ser Pro Gly Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Ser Ser Ser
20 25 30
Tyr Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu
35 40 45
Ile Tyr Gly Ala Ser Ser Arg Ala Thr Gly Ile Pro Asp Arg Phe Ser
50 55 60
Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Arg Leu Glu
65 70 75 80
Pro Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Asp Tyr Gly Phe Pro
85 90 95
Trp Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 42
<211> 11
<212> Белок
<213> Искусственная последовательность
<220>
<223> IGHJ1*01 HC
<400> 42
Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
1 5 10
<210> 43
<211> 10
<212> Белок
<213> Искусственная последовательность
<220>
<223> IGKJ2*01 LC
<400> 43
Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
1 5 10
<210> 44
<211> 449
<212> Белок
<213> Искусственная последовательность
<220>
<223> Слитый пептид Va10.2_Fc
<400> 44
Met Ala Trp Val Trp Thr Leu Leu Phe Leu Met Ala Ala Ala Gln Ser
1 5 10 15
Ile Gln Ala Gln Leu Leu Glu Gln Ser Pro Gln Phe Leu Ser Ile Gln
20 25 30
Glu Gly Glu Asn Leu Thr Val Tyr Cys Asn Ser Ser Ser Val Phe Ser
35 40 45
Ser Leu Gln Trp Tyr Arg Gln Glu Pro Gly Glu Gly Pro Val Leu Leu
50 55 60
Val Thr Val Val Thr Gly Gly Glu Val Lys Lys Leu Lys Arg Leu Thr
65 70 75 80
Phe Gln Phe Gly Asp Ala Arg Lys Asp Ser Ser Leu His Ile Thr Ala
85 90 95
Ala Gln Pro Gly Asp Thr Gly Leu Tyr Leu Cys Ala Gly Ala Gly Ser
100 105 110
Gln Gly Asn Leu Ile Phe Gly Lys Gly Thr Lys Leu Ser Val Lys Pro
115 120 125
Asn Ile Gln Asn Pro Asp Pro Ala Val Tyr Gln Leu Arg Asp Ser Lys
130 135 140
Ser Ser Asp Lys Ser Val Cys Leu Phe Thr Asp Phe Asp Ser Gln Thr
145 150 155 160
Asn Val Ser Gln Ser Lys Asp Ser Asp Val Tyr Ile Thr Asp Lys Thr
165 170 175
Val Leu Asp Met Arg Ser Met Asp Phe Lys Ser Asn Ser Ala Val Ala
180 185 190
Trp Ser Asn Lys Ser Asp Phe Ala Cys Ala Asn Ala Phe Asn Asn Ser
195 200 205
Ile Ile Pro Glu Asp Thr Phe Phe Pro Ser Glu Pro Lys Ser Cys Asp
210 215 220
Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly
225 230 235 240
Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile
245 250 255
Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu
260 265 270
Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His
275 280 285
Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg
290 295 300
Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys
305 310 315 320
Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu
325 330 335
Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr
340 345 350
Val Tyr Pro Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu
355 360 365
Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp
370 375 380
Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val
385 390 395 400
Leu Asp Ser Asp Gly Ser Phe Ala Leu Val Ser Lys Leu Thr Val Asp
405 410 415
Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His
420 425 430
Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro
435 440 445
Gly
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| НАЦЕЛЕННЫЕ НА ОПУХОЛЬ АГОНИСТИЧЕСКИЕ CD28-АНТИГЕНСВЯЗЫВАЮЩИЕ МОЛЕКУЛЫ | 2019 |
|
RU2837821C1 |
| ХИМЕРНЫЙ АНТИГЕННЫЙ РЕЦЕПТОР (CAR) ПРОТИВ CD123 ДЛЯ ИСПОЛЬЗОВАНИЯ В ЛЕЧЕНИИ ЗЛОКАЧЕСТВЕННЫХ ОПУХОЛЕЙ | 2015 |
|
RU2724999C2 |
| НАЦЕЛЕННЫЕ НА ОПУХОЛЬ АГОНИСТИЧЕСКИЕ CD28-АНТИГЕНСВЯЗЫВАЮЩИЕ МОЛЕКУЛЫ | 2019 |
|
RU2808030C2 |
| УЛУЧШЕННЫЕ АНТИ-FLT3 АНТИГЕНСВЯЗЫВАЮЩИЕ БЕЛКИ | 2019 |
|
RU2830982C2 |
| Биспецифическое антитело анти-HER2/анти-4-1BB и его применение | 2020 |
|
RU2831838C2 |
| БИСПЕЦИФИЧЕСКИЕ 2+1 КОНТОРСТЕЛА | 2018 |
|
RU2797305C2 |
| АНТИТЕЛО К CD3 И ЕГО ФАРМАЦЕВТИЧЕСКОЕ ПРИМЕНЕНИЕ | 2019 |
|
RU2802272C2 |
| ИММУНОАКТИВИРУЮЩАЯ АНТИГЕНСВЯЗЫВАЮЩАЯ МОЛЕКУЛА | 2015 |
|
RU2722788C2 |
| БИСПЕЦИФИЧЕСКИЕ АНТИГЕНСВЯЗЫВАЮЩИЕ МОЛЕКУЛЫ, СОДЕРЖАЩИЕ АНТИ-FAP КЛОН 212 | 2019 |
|
RU2799429C2 |
| БИФУНКЦИОНАЛЬНЫЕ БЕЛКИ, КОМБИНИРУЮЩИЕ БЛОКАДУ КОНТРОЛЬНОЙ ТОЧКИ, ДЛЯ ТАРГЕТНОЙ ТЕРАПИИ | 2019 |
|
RU2756899C1 |
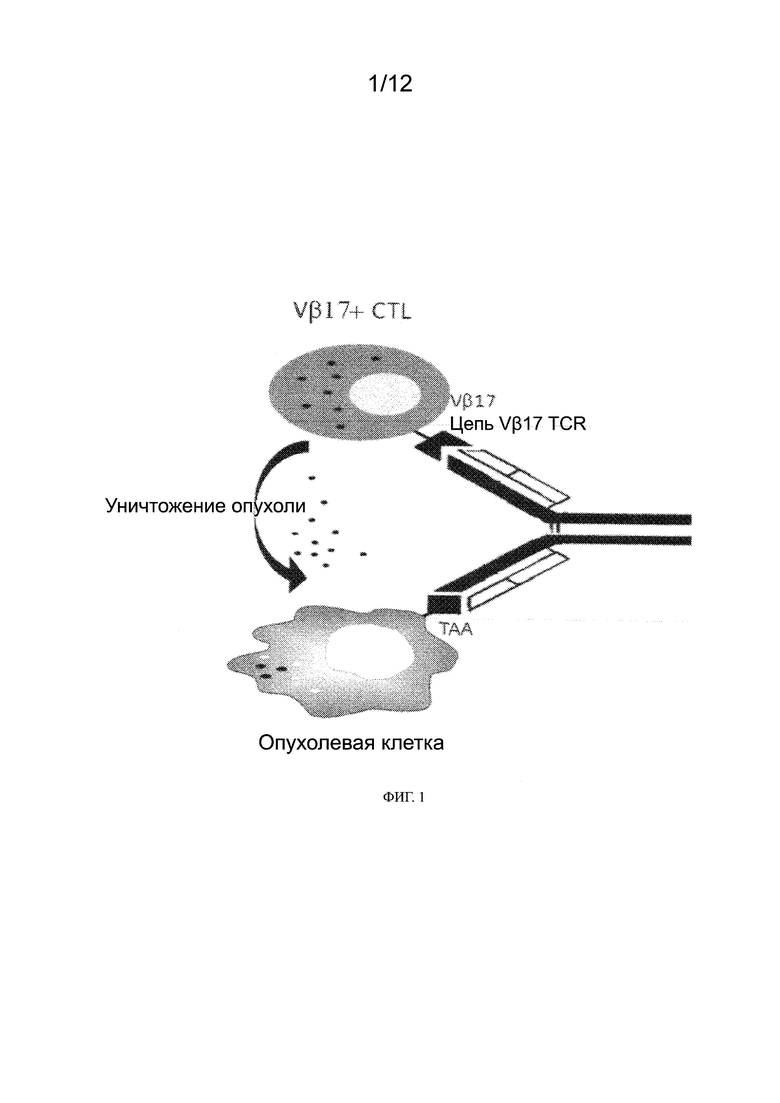
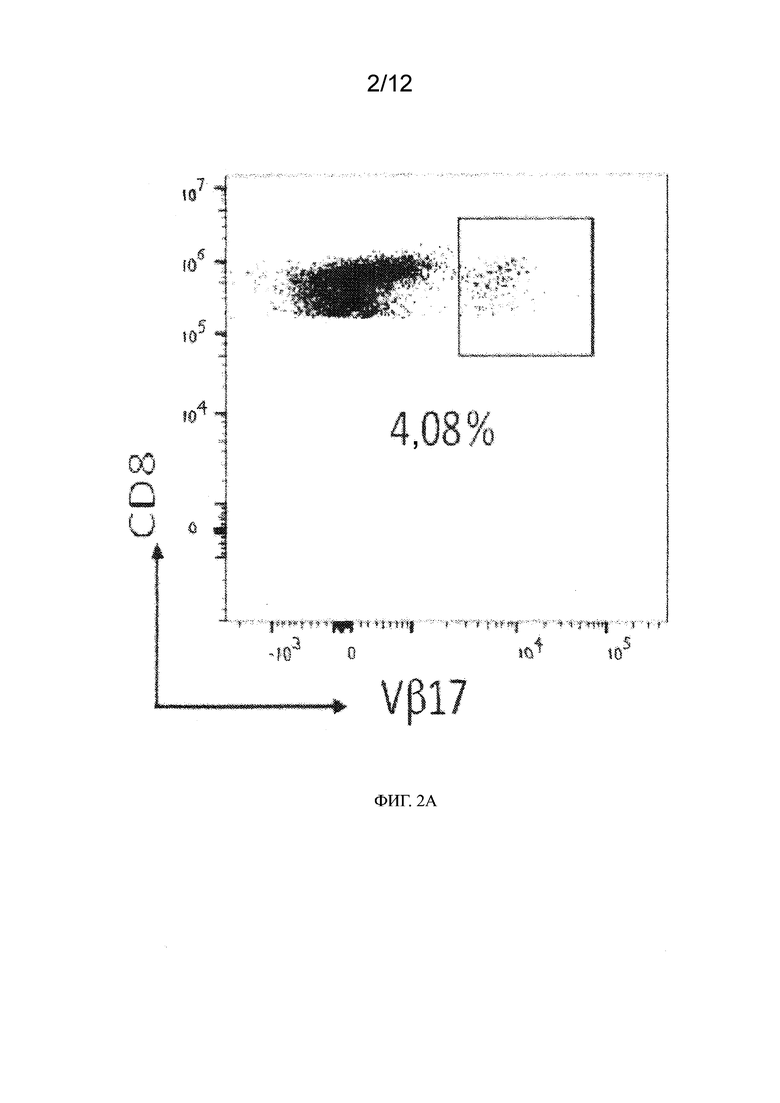
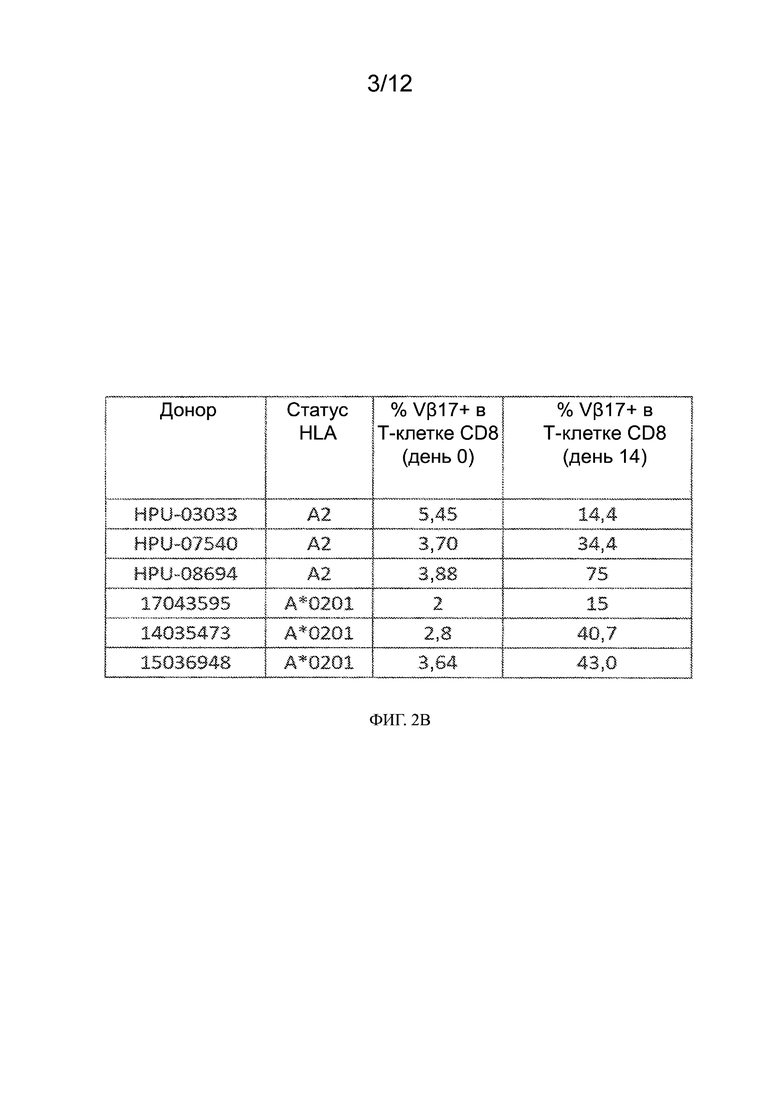
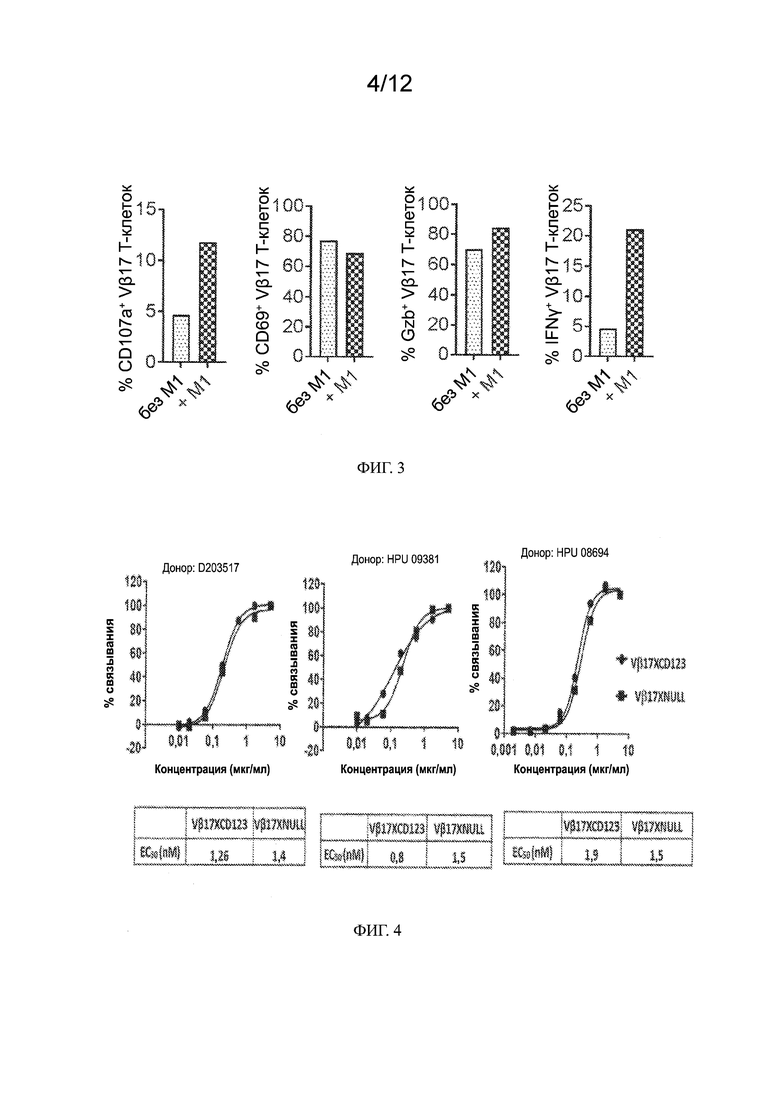
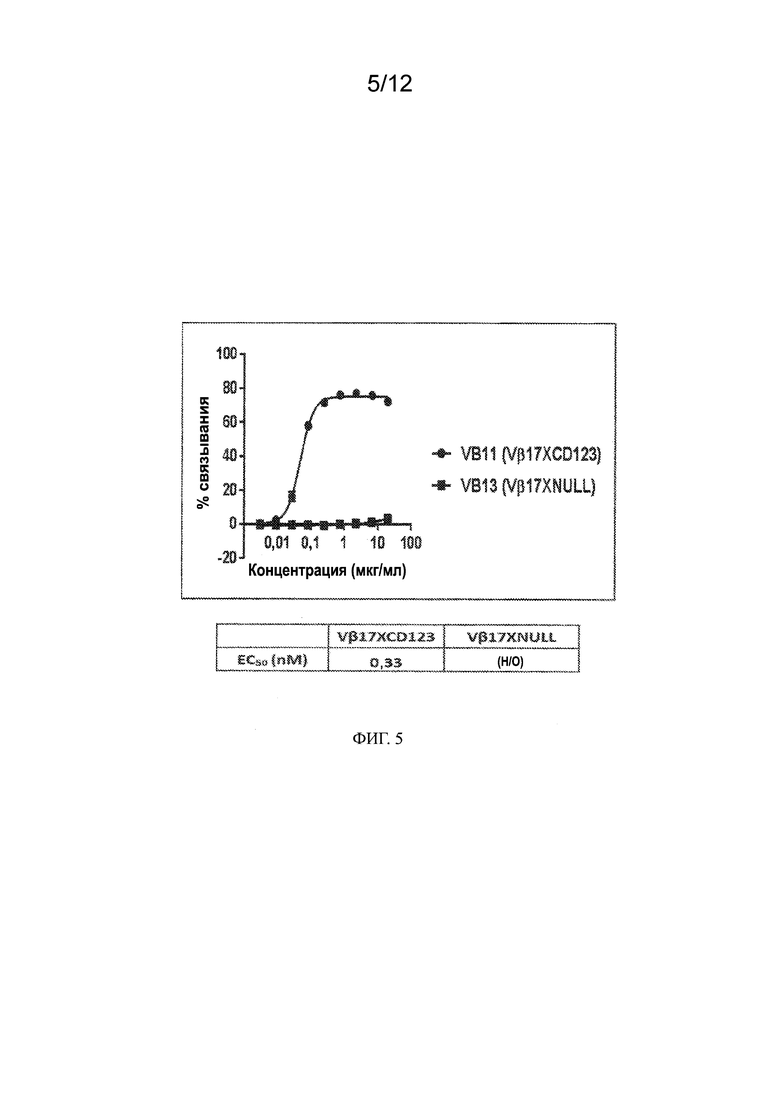
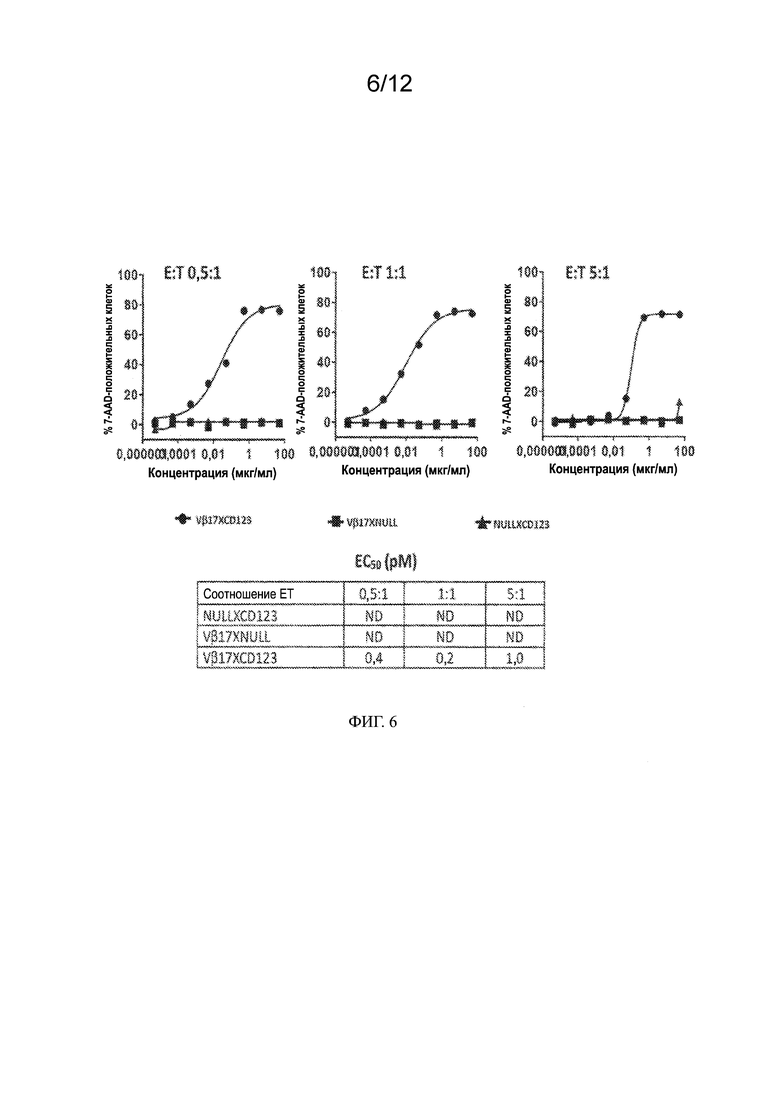
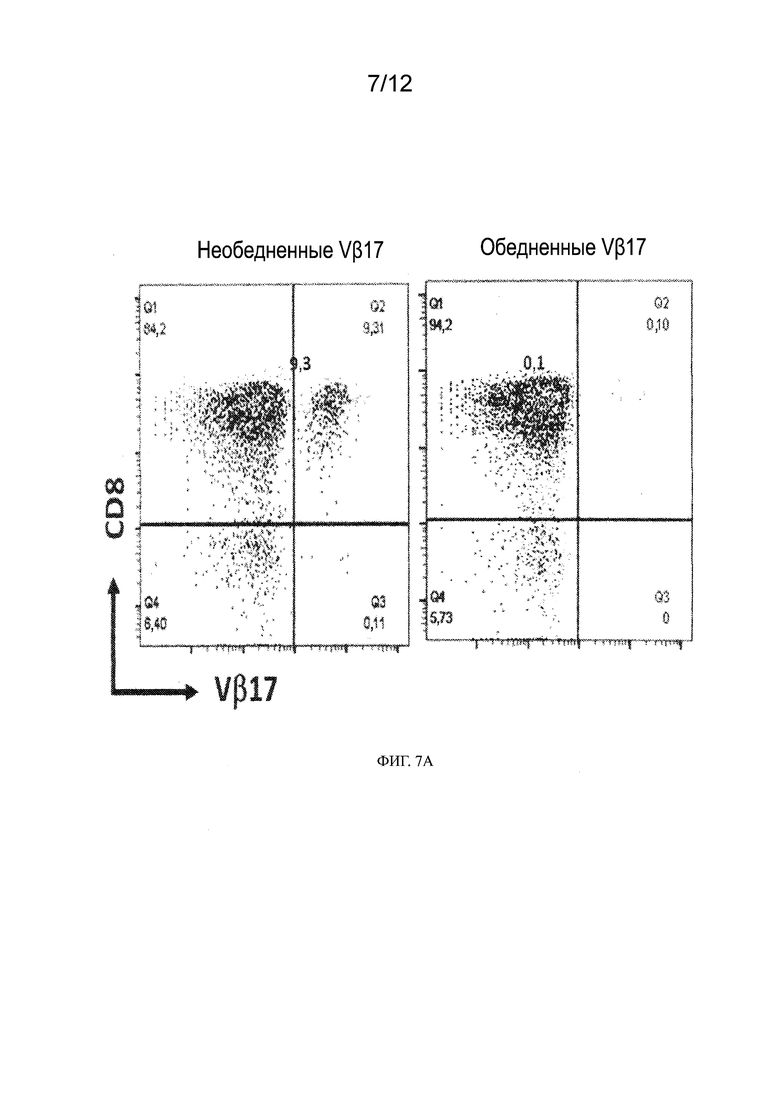
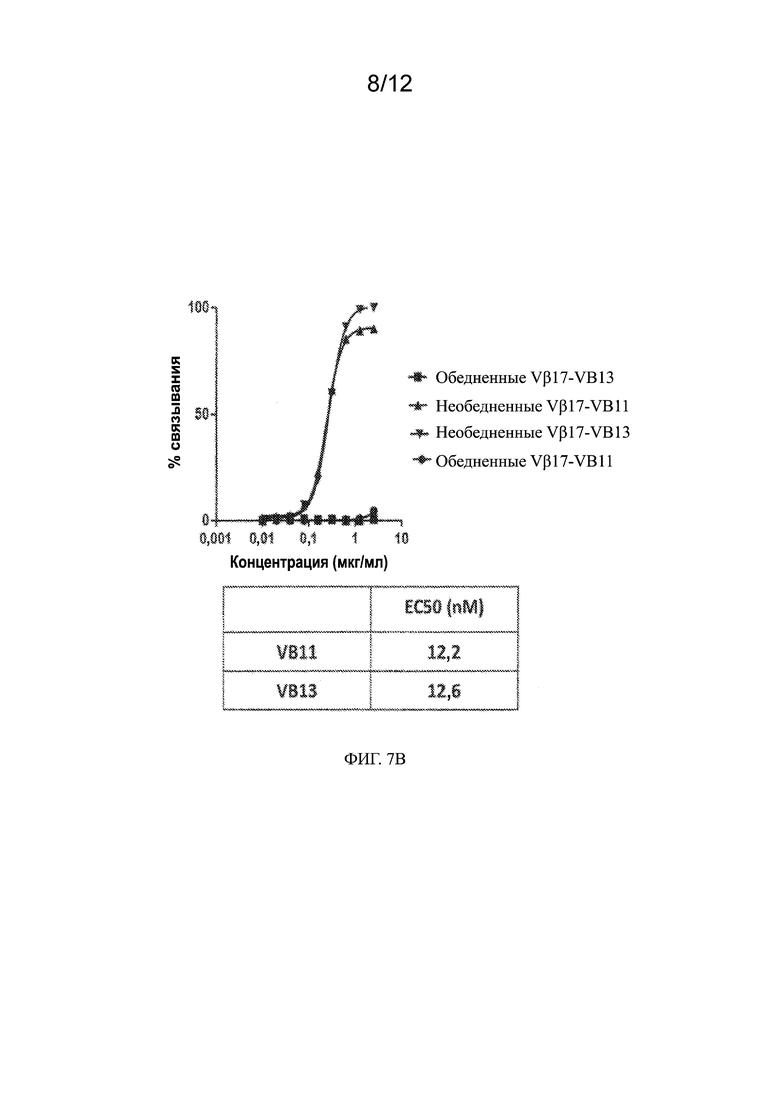
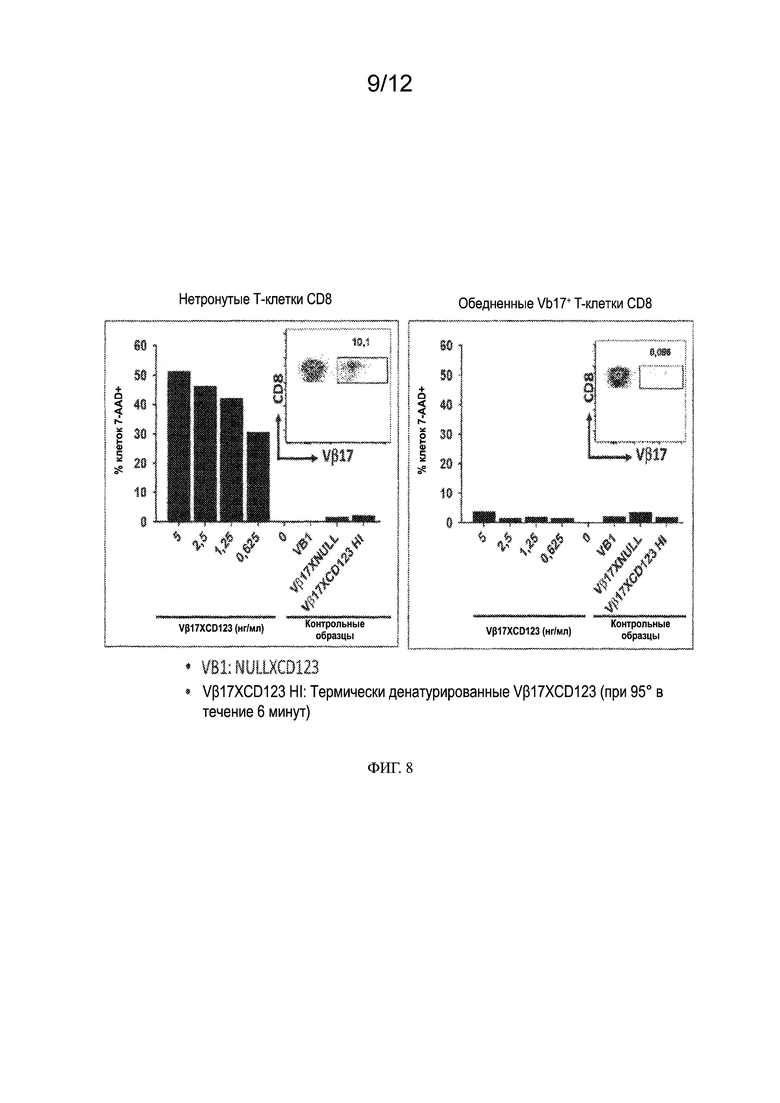

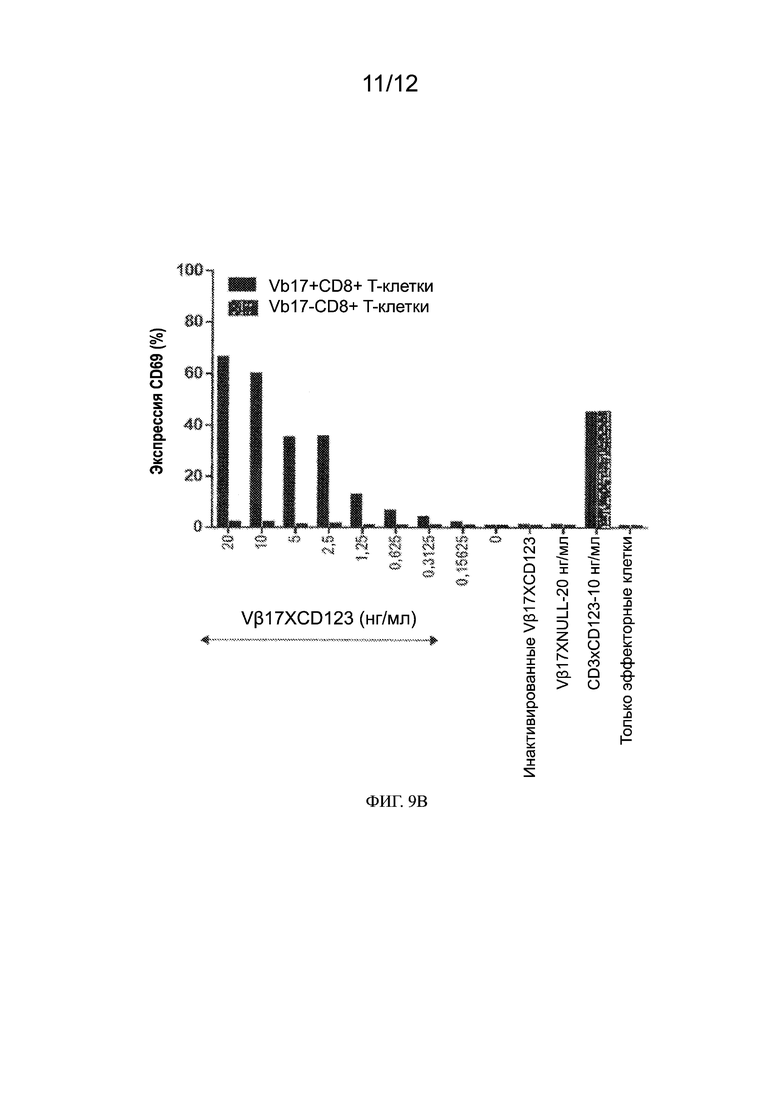
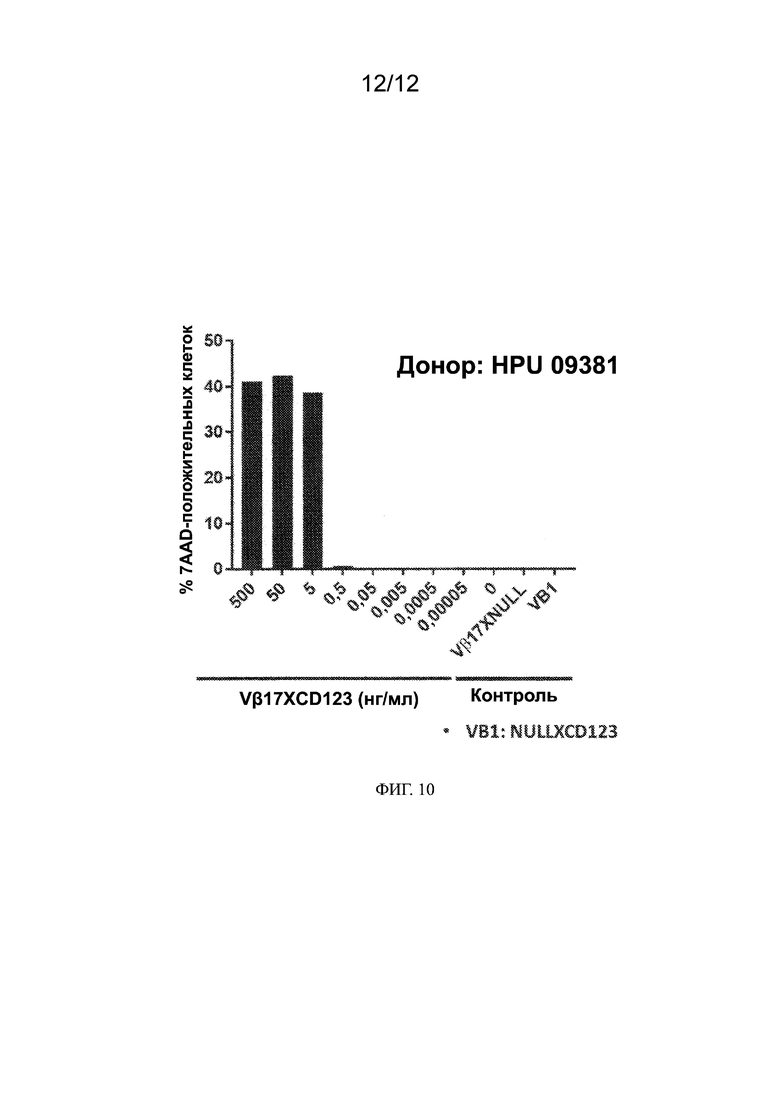
Группа изобретений относится к биотехнологии. Представлены: выделенное биспецифическое антитело к Vβ17/CD123 или его антигенсвязывающий фрагмент, выделенная нуклеиновая кислота, кодирующая НС1 и LC1 биспецифического антитела к Vβ17/CD123, выделенная нуклеиновая кислота, кодирующая НС2 и LC2 биспецифического антитела к Vβ17/CD123, вектор, содержащий выделенную нуклеиновую кислоту, и клетка-хозяин, его содержащая. Также раскрыты: буферная композиция, содержащая выделенное биспецифическое антитело к Vβ17/CD123 или его антигенсвязывающий фрагмент, способ направления экспрессирующей Vβ17 Т-клетки CD8+ или CD4+ к раковой клетке, включающий приведение экспрессирующей Vβ17 Т-клетки CD8+ или CD4+ в контакт с биспецифическим антителом к Vβ17/CD123 или его антигенсвязывающим фрагментом и способ ингибирования роста или пролиферации раковых клеток, включающий приведение раковых клеток в контакт с биспецифическим антителом к Vβ17/CD123 или его антигенсвязывающим фрагментом и набор. Изобретение применяется для ингибирования роста или пролиферации раковых клеток. 10 н. и 5 з.п. ф-лы, 13 ил., 17 табл., 3 пр.
1. Выделенное биспецифическое антитело к Vβ17/CD123 или его антигенсвязывающий фрагмент, содержащее:
a. первую тяжелую цепь (НС1);
b. вторую тяжелую цепь (НС2);
c. первую легкую цепь (LC1); и
d. вторую легкую цепь (LC2),
где НС1 связана с LC1, а НС2 связана с LC2, и при этом НС1 содержит определяющую комплементарность область тяжелой цепи 1 (HCDR1), HCDR2 и HCDR3, содержащие аминокислотные последовательности SEQ ID NO: 1, SEQ ID NO: 2 и SEQ ID NO: 3, соответственно, a LC1 содержит определяющую комплементарность область легкой цепи 1 (LCDR1), LCDR2 и LCDR3, содержащие аминокислотные последовательности SEQ ID NO: 4, SEQ ID NO: 5 и SEQ ID NO: 6, соответственно, с образованием сайта связывания для первого антигена, который специфически связывается с Vβ17, и при этом НС2 содержит определяющую комплементарность область тяжелой цепи 1 (HCDR1), HCDR2 и HCDR3, содержащие аминокислотные последовательности SEQ ID NO: 34, SEQ ID NO: 35 и SEQ ID NO: 36, соответственно, и LC2 содержит определяющую комплементарность область легкой цепи 1 (LCDR1), LCDR2 и LCDR3, содержащие аминокислотные последовательности SEQ ID NO: 37, SEQ ID NO: 38 и SEQ ID NO: 39, соответственно, с образованием сайта связывания для второго антигена, который специфически связывается с CD123.
2. Выделенное биспецифическое антитело к Vβ17/CD123 или его антигенсвязывающий фрагмент по п. 1, в котором НС1 содержит аминокислотную последовательность SEQ ID NO: 13, a LC1 содержит аминокислотную последовательность SEQ ID NO: 14, и при этом НС2 содержит аминокислотную последовательность SEQ ID NO: 15, a LC2 содержит аминокислотную последовательность SEQ ID NO: 16.
3. Выделенное биспецифическое антитело к Vβ17/CD123 или его антигенсвязывающий фрагмент по п. 1 или 2, где Vβ17 находится на поверхности Т-клетки CD8+ или CD4+.
4. Выделенное биспецифическое антитело к Vβ17/CD123 или его антигенсвязывающий фрагмент по любому из пп. 1-3, в котором CD123 находится на поверхности раковой клетки или стволовой клетки CD34+.
5. Выделенное биспецифическое антитело к Vβ17/CD123 или его антигенсвязывающий фрагмент по любому из пп. 1-4, где биспецифическое антитело или его антигенсвязывающий фрагмент индуцирует цитотоксичность, зависимую от Т-клеток CD8+ или CD4+, в отношении раковой клетки in vitro, а значение ЕС50 при этом составляет менее около 0,2 пМ.
6. Выделенная нуклеиновая кислота, кодирующая НС1 и LC1 биспецифического антитела к Vβ17/CD123 или его антигенсвязывающего фрагмента по любому из пп. 1-5.
7. Выделенная нуклеиновая кислота, кодирующая НС2 и LC2 биспецифического антитела к Vβ17/CD123 или его антигенсвязывающего фрагмента по любому из пп. 1-5.
8. Вектор, содержащий выделенную нуклеиновую кислоту по п. 6 или 7, для экспрессии биспецифического антитела к Vβ17/CD123 или его антигенсвязывающего фрагмента по любому из пп. 1-5.
9. Клетка-хозяин, содержащая вектор по п. 8, для получения биспецифического антитела к Vβ17/CD123 или его антигенсвязывающего фрагмента по любому из пп. 1-5.
10. Буферная композиция, содержащая выделенное биспецифическое антитело к Vβ17/CD123 или его антигенсвязывающий фрагмент по любому из пп. 1-5 для ингибирования роста или пролиферации раковых клеток, экспрессирующих на их поверхности CD123.
11. Способ направления экспрессирующей Vβ17 Т-клетки CD8+ или CD4+ к раковой клетке, включающий приведение экспрессирующей Vβ17 Т-клетки CD8+ или CD4+ в контакт с биспецифическим антителом к Vβ17/CD123 или его антигенсвязывающим фрагментом по п. 1, при этом при приведении Vβ17-экспрессирующей Т-клетки CD8+ или CD4+ в контакт с биспецифическим антителом к Vβ17/CD123 или его антигенсвязывающим фрагментом происходит направление Vβ17-экспрессирующей Т-клетки CD8+ или CD4+ к раковой клетке.
12. Способ ингибирования роста или пролиферации раковых клеток, включающий приведение раковых клеток в контакт с биспецифическим антителом к Vβ17/CD123 или его антигенсвязывающим фрагментом по п. 1, где приведение раковых клеток в контакт с биспецифическим антителом к Vβ17/CD123 или его антигенсвязывающим фрагментом ингибирует рост или пролиферацию раковых клеток.
13. Способ по п. 11 или 12, где раковая клетка представляет собой раковую клетку, экспрессирующую CD123.
14. Набор, содержащий биспецифическое антитело к Vβ17/CD123 или его антигенсвязывающий фрагмент по любому из пп. 1-5 и упаковку для него для ингибирования роста или пролиферации раковых клеток, экспрессирующих на их поверхности CD123.
15. Способ получения биспецифического антитела к Vβ17/CD123 или его антигенсвязывающего фрагмента, включающий культивирование клетки-хозяина по п. 9 для получения биспецифического антитела к Vβ17/CD123 или его антигенсвязывающего фрагмента и восстановление биспецифического антитела к Vβ17/CD123 или его антигенсвязывающего фрагмента из клетки или культуры.
| WO 2018223002 A1, 06.12.2023; | |||
| WO 2018015340 A1, 25.01.2018; | |||
| Приспособление для точного наложения листов бумаги при снятии оттисков | 1922 |
|
SU6A1 |
| RU 2016129045 A, 23.01.2018. | |||
Авторы
Даты
2024-12-13—Публикация
2020-03-11—Подача