Область техники
Настоящее изобретение относится к димеру полипептида, включающему рецептор для Fc-области IgE и характеризующемуся высоким содержанием сиаловой кислоты, и содержащей его фармацевтической композиции.
Предпосылки создания изобретения
По мере индустриализации современного общества и вестернизации пищевых привычек растет заболеваемость аллергическими заболеваниями, такими как аллергический ринит, атопический дерматит и пищевая аллергия, включая астму. Также увеличивается развитие анафилаксии, тяжелого аллергического заболевания. Эти хронические иммунные заболевания серьезно ухудшают качество жизни индивидуумов, и соответственно возрастают социально-экономические издержки. Таким образом, существует острая необходимость в мерах по преодолению таких заболеваний.
Большинство аллергических заболеваний вызвано чрезмерным иммунным ответом иммуноглобулина E (IgE). IgE представляет собой антитело, которое в нормальных условиях присутствует в крови в очень низкой концентрации. IgE также обычно продуцируется в ответ на безвредные антигены. Отмечен случай, когда количество IgE увеличивается без какого-либо специфического стимула. Такой случай может привести к аллергическим заболеваниям. Аномально увеличенное количество IgE может связываться с высокоаффинными рецепторами для Fc-области IgE (FcεRI), которые экспрессируются на поверхности тучных клеток, базофилов и т.п. Такое связывание заставляет тучные клетки или базофилы выбрасывать химические медиаторы, такие как гистамин, лейкотриен, простагландин, брадикинин и факторы, активирующие тромбоциты. Выброс этих химических медиаторов приводит к появлению аллергических симптомов. В частности, аллергические заболевания могут проявляться ухудшением симптомов из-за связывания между IgE и FcεRI. Кроме того, известно, что количество клеток, экспрессирующих FcεRI, увеличивается у пациентов с аллергией.
В настоящее время для лечения аллергических заболеваний были предложены различные способы, такие как избегание аллергенов, введение противоаллергических средств, модуляция синтеза IgE в организме и выработка антител против IgE. Однако еще остается много недостатков, таких как недостаточная эффективность лекарственных средств и возникновение серьезных побочных эффектов. Недавно была изучена композиция, способная к связыванию с IgE и FcγRIIb с высоким сродством и к ингибированию клеток, экспрессирующих заякоренный в мембране IgE. Сообщалось, что эта композиция применима для лечения IgE-опосредованных заболеваний, в том числе аллергии и астмы (KR10-1783272B).
В частности, омализумаб (торговое название: Xolair), мишенью которого является Fc-область антитела IgE, был разработан и применен в качестве терапевтического средства при трудноизлечимой тяжелой астме и трудноизлечимой крапивнице. Однако введение высоких доз омализумаба для поддержания терапевтических эффектов приводит к высокому бремени расходов и побочным эффектам, таким как ангионевротический отек и анафилактическая реакция (The Journal of Clinical Investigation Volume 99, Number 5, March 1997, 915-925). Кроме того, по результатам постмаркетинговых исследований сообщалось о серьезных побочных реакциях, таких как аллергический гранулематозный васкулит и тяжелая идиопатическая тромбоцитопения.
Подробное описание настоящего изобретения
Техническая задача
Соответственно, авторы настоящего изобретения изучили возможность разработки безопасного и эффективного терапевтического средства против аллергических заболеваний. В результате было обнаружено, что когда содержание сиаловой кислоты в димере полипептида, содержащем два мономера (FcεRIα-ECD), включающих экстраклеточный домен альфа-субъединицы рецептора для Fc-области IgE, является высоким, вышеуказанный димер полипептида обладает превосходным сродством связывания с IgE, а также сохраняет высокую концентрацию в крови. В частности, настоящее изобретение было завершено подтверждением того, что даже при подкожном введении димера полипептида с высоким содержанием сиаловой кислоты возможна эффективная доставка в организм.
Решение задачи
В одном аспекте настоящего изобретения предусматривается димер полипептида, содержащий два мономера, включающих экстраклеточный домен (FcεRIα-ECD) альфа-субъединицы рецептора для Fc-области IgE, причем молярное отношение сиаловой кислоты к димеру полипептида составляет по крайней мере 8.
В другом аспекте настоящего изобретения предусматривается фармацевтическая композиция для профилактики или лечения аллергических заболеваний, содержащая димер полипептида с высоким содержанием сиаловой кислоты.
В другом аспекте настоящего изобретения предусматривается трансдермальный пластырь, содержащий фармацевтическую композицию.
В другом аспекте настоящего изобретения предусматривается пластырь для местного применения, содержащий фармацевтическую композицию.
В другом аспекте настоящего изобретения предусматривается пищевая смесь для уменьшения интенсивности или облегчения аллергических симптомов, содержащая димер полипептида с высоким содержанием сиаловой кислоты.
В другом аспекте настоящего изобретения предусматривается применение димера полипептида с высоким содержанием сиаловой кислоты для профилактики или лечения аллергических заболеваний.
Результат изобретения
Димер полипептида с высоким содержанием сиаловой кислоты в соответствии с настоящим изобретением не только обладает превосходной безопасностью и сохраняемостью в организме по сравнению с обычно используемыми антителами против IgE, но также очень прочно связывается с IgE, что дает преимущество пролонгированного цикла введения. Кроме того, димер полипептида с высоким содержанием сиаловой кислоты в соответствии с настоящим изобретением представляет собой вещество с единственной мишенью - IgE и, в отличие от обычных антител против IgE, к которым относится Fc-область IgG1, не связывается с Fcγ-рецептором. Таким образом, он может ингибировать выброс медиаторов, вызванный связыванием с Fcγ-рецептором на поверхности тучных клеток, так что серьезные побочные эффекты, такие как возникновение анафилаксии, которые могут быть вызваны связыванием между IgG1 и Fcγ-рецептором III на тучных клетках, могут быть сведены к минимуму. Кроме того, димер полипептида с высоким содержанием сиаловой кислоты может сохранять высокую концентрацию в крови даже в случае подкожного введения. Соответственно, димер полипептида с высоким содержанием сиаловой кислоты в соответствии с настоящим изобретением может успешно применяться для профилактики или лечения аллергических заболеваний.
Краткое описание чертежей
Фиг. 1 представляет собой изображение, демонстрирующее результаты электрофореза в SDS-ПААГ, подтверждающие, что димер полипептида продуцируется в каждой линии клеток.
Фиг. 2 представляет собой изображение, демонстрирующее результаты электрофореза в SDS-ПААГ для невосстановленной формы и восстановленной формы димера полипептида в соответствии с одним вариантом осуществления.
Фиг. 3 представляет собой изображение, демонстрирующее сродство связывания омализумаба с IgE.
Фиг. 4 представляет собой изображение, демонстрирующее сродство связывания димера полипептида (IgETRAP) в соответствии с одним вариантом осуществления настоящего изобретения с IgE.
Фиг. 5а представляет собой изображение, демонстрирующее сродство связывания димера полипептида (IgETRAP) в соответствии с одним вариантом осуществления настоящего изобретения или омализумаба с рецептором I для Fc-гамма IgG (FcγRI).
Фиг. 5b представляет собой изображение, демонстрирующее сродство связывания димера полипептида (IgETRAP) в соответствии с одним вариантом осуществления настоящего изобретения или омализумаба с рецептором IIА для Fc-гамма IgG (FcγRIIA).
Фиг. 5c представляет собой изображение, демонстрирующее сродство связывания димера полипептида (IgETRAP) в соответствии с одним вариантом осуществления настоящего изобретения или омализумаба с рецептором IIB для Fc-гамма IgG (FcγRIIB).
Фиг. 5d представляет собой изображение, демонстрирующее сродство связывания димера полипептида (IgETRAP) в соответствии с одним вариантом осуществления настоящего изобретения или омализумаба с рецептором IIIА для Fc-гамма IgG (FcγRIIIA).
Фиг. 5e представляет собой изображение, демонстрирующее сродство связывания димера полипептида (IgETRAP) в соответствии с одним вариантом осуществления настоящего изобретения или омализумаба с рецептором IIIB для Fc-гамма IgG (FcγRIIIB).
Фиг. 6 представляет собой график, полученный путем количественного анализа сродства связывания между димером полипептида (IgETRAP) в соответствии с одним вариантом осуществления настоящего изобретения или омализумабом и рецепторами для Fc-гамма IgG.
Фиг. 7 представляет собой изображение, демонстрирующее степень связывания с IgE в зависимости от концентрации димера полипептида в соответствии с одним вариантом осуществления настоящего изобретения.
Фиг. 8 представляет собой изображение, показывающее сравнение ингибирующих способностей, в отношении активности тучных клеток мыши, экспрессирующих FcεRI человека, димера полипептида (IgETRAP) в соответствии с одним вариантом осуществления настоящего изобретения и Xolair (омализумаба) в зависимости от их концентраций.
Фиг. 9 представляет собой изображение, подтверждающее противоаллергический эффект димера полипептида в соответствии с одним вариантом осуществления настоящего изобретения путем измерения частоты диареи в модели пищевой аллергии.
Фиг. 10 представляет собой изображение, демонстрирующее результаты электрофореза в SDS-ПААГ для невосстановленной формы и восстановленной формы димера полипептида в соответствии с одним вариантом осуществления настоящего изобретения (SAнизкое, SAсреднее и SAвысокое).
Фиг. 11 представляет собой изображение, подтверждающее изоэлектрическую точку димера полипептида в соответствии с одним вариантом осуществления настоящего изобретения (SAнизкое, SAсреднее и SAвысокое).
Фиг. 12 представляет собой изображение, подтверждающее противоаллергический эффект подкожной инъекции димера полипептида в соответствии с одним вариантом осуществления настоящего изобретения (SAнизкое и SAвысокое) путем измерения частоты диареи в модели пищевой аллергии.
Фиг. 13 представляет собой изображение, подтверждающее противоаллергический эффект димера полипептида в соответствии с одним вариантом осуществления настоящего изобретения (SAнизкое и SAвысокое) путем измерения концентрации IgE в крови в модели пищевой аллергии.
Фиг. 14 представляет собой изображение, подтверждающее противоаллергический эффект димера полипептида в соответствии с одним вариантом осуществления (SAнизкое и SAвысокое) путем измерения концентрации MCPT-1 в крови в модели пищевой аллергии.
Фиг. 15 представляет собой изображение, показывающее результаты анализа фармакокинетического профиля димера полипептида в соответствии с одним вариантом осуществления в зависимости от содержания сиаловой кислоты в модели на мыши.
Фиг. 16 представляет собой изображение, подтверждающее противоаллергический эффект димера полипептида в соответствии с одним вариантом осуществления в зависимости от содержания сиаловой кислоты путем измерения температуры тела у модели пассивной системной анафилаксии на мыши.
Подробное описание настоящего изобретения
В одном аспекте настоящего изобретения предусматривается димер полипептида с высоким содержанием сиаловой кислоты, который включает два мономера, включающих экстраклеточный домен (FcεRIα-ECD) альфа-субъединицы рецептора для Fc-области IgE, причем мономер содержит Fc-область, и Fc-область и FcεRIα-ECD связаны через шарнирную область, и димер полипептида характеризуется тем, что молярное отношение сиаловой кислоты к димеру полипептида составляет по крайней мере 8.
Используемый здесь термин «IgE» означает антитело, известное как иммуноглобулин E. IgE обладает сродством к тучным клеткам, базофилам и т.п. Кроме того, реакция между IgE и соответствующим ему антигеном (аллергеном) вызывает воспалительную реакцию. Кроме того, известно, что IgE являются основной причиной анафилаксии.
Используемый здесь термин «рецептор для Fc-области IgE» также упоминается как Fcε-рецептор и указывает на связывание рецептора с Fc-областью IgE. Есть два типа рецепторов. Рецептор, обладающий высоким сродством к Fc-области IgE, называется Fcε-рецептором I (FcεRI). Рецептор, обладающий низким сродством к Fc-области IgE, называется Fcε-рецептором II (FcεRII). FcεRI экспрессируется в тучных клетках и базофилах. В случае, когда антитела IgE, связанные с FcεRI, поперечно сшиваются поливалентными антигенами, в тучных клетках или базофилах происходит дегрануляция, приводя тем самым к выбросу различных химических веществ-медиаторов, в том числе гистамина. Этот выброс приводит к немедленной аллергической реакции.
FcεRI представляет собой мембранный белок, состоящий из одной α-цепи, одной β-цепи и двух γ-цепей, связанных дисульфидной связью. Среди этих цепей часть, с которой связывается IgE, представляет собой α-цепь (FcεRIα). FcεRIα имеет размер, составляющий приблизительно 60 кДа, и состоит из гидрофобного домена, существующего внутри клеточной мембраны, и гидрофильного домена, существующего вне клеточной мембраны. В частности, IgE связывается с экстраклеточным доменом α-цепи. FcεRIα может взаимозаменяемо использоваться в качестве альфа-субъединицы рецептора для Fc-области IgE.
В частности, альфа-субъединица рецептора для Fc-области IgE может иметь аминокислотную последовательность, представленную в NP_001992.1. Кроме того, экстраклеточный домен (FcεRIα-ECD) альфа-субъединицы рецептора для Fc-области IgE может иметь аминокислотную последовательность SEQ ID NO:1. FcεRIα-ECD может быть фрагментом или вариантом FcεRIα-ECD при условии, что фрагмент или вариант способен к связыванию с IgE. Кроме того, FcεRIα-ECD с SEQ ID NO:1 может кодироваться полинуклеотидом, имеющим последовательность SEQ ID NO:5.
Вариант может быть получен с помощью метода замены, удаления или добавления одной или более аминокислот в FcεRIα-ECD дикого типа при условии, что этот метод не изменяет функцию FcεRIα-ECD. Такой вариант может быть на 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или более идентичен аминокислотной последовательности SEQ ID NO:1.
Здесь, Fc-область может быть Fc-областью дикого типа или модифицированной Fc-областью. Кроме того, используемый здесь термин «модифицированная Fc-область» означает область, в которой часть Fc-области антитела была модифицирована. Здесь Fc-область относится к белку, который содержит константную область 2 тяжелой цепи (CH2) и константную область 3 тяжелой цепи (CH3) иммуноглобулина, и не содержит вариабельные области тяжелой и легкой цепей и константную область 1 легкой цепи (CH1) иммуноглобулина. В частности, модифицированная Fc-область может быть получена путем замены некоторых аминокислот в Fc-области или путем комбинирования различных типов Fc-областей. В частности, модифицированная Fc-область может иметь аминокислотную последовательность SEQ ID NO:2. Кроме того, модифицированная Fc-область с SEQ ID NO:2 может кодироваться полинуклеотидом, имеющим последовательность SEQ ID NO:6.
Кроме того, модификациями Fc-области может быть сахарные цепи в нативной форме или выросшие сахарные цепи по сравнению с нативной формой. Сахарные цепи Fc-области иммуноглобулина можно модифицировать обычными методами, такими как химические методы, ферментативные методы и методы генной инженерии, используя микроорганизмы. Кроме того, модифицированная Fc-область может быть областью, в которой отсутствуют функции антителозависимой клеточной цитотоксичности (ADCC) и комплемент-зависимой цитотоксичности (CDC) из-за отсутствия сайта связывания для Fcγ-рецепторов (FcγR) или компонента комплемента 1q(C1q).
В одном из вариантов осуществления модифицированная Fc-область и FcεRIα-ECD могут быть связаны через шарнирную область IgD. Шарнирная область может быть шарнирной областью, происходящей из иммуноглобулина IgD или его варианта. Шарнирная область нативного IgD состоит из 64 аминокислот. Шарнирная область, происходящая из иммуноглобулина IgD или его варианта, может состоять из 20-60 следующих друг за другом аминокислот, 25-50 следующих друг за другом аминокислот или 30-40 аминокислот. Здесь вариант шарнирной области может быть получен путем модификации некоторых аминокислот в аминокислотной последовательности шарнирной области IgD, чтобы свести к минимуму образование усеченных форм в процессе продукции белка.
В одном варианте осуществления шарнирная область, происходящая из иммуноглобулина IgD или его варианта, может состоять из 30 или 49 аминокислот. Кроме того, шарнирная область, происходящая из иммуноглобулина IgD или его варианта, может содержать по крайней мере один цистеин.
В одном варианте осуществления шарнирная область, происходящая из иммуноглобулина IgD или его варианта, может содержать следующую последовательность:
Arg Asn Thr Gly Arg Gly Gly Glu Glu Lys Lys Xaa1 Xaa2 Lys Glu Lys Glu Glu Gln Glu Glu Arg Glu Thr Lys Thr Pro Glu Cys Pro (SEQ ID NO:17), где Xaa1 может представлять собой Lys или Gly, а Xaa2 может представлять собой Glu, Gly или Ser. В частности, шарнирная область, происходящая из иммуноглобулина IgD или его варианта, может иметь аминокислотную последовательность SEQ ID NO:3 или SEQ ID NO:19, тем самым сводя к минимуму образование усеченных форм в процессе продукции белка.
В другом варианте осуществления шарнирная область, происходящая из иммуноглобулина IgD или его варианта, может содержать следующую последовательность:
Ala Gln Pro Gln Ala Glu Gly Ser Leu Ala Lys Ala Thr Thr Ala Pro Ala Thr Thr Arg Asn Thr Gly Arg Gly Gly Glu Glu Lys Lys Xaa3 Xaa4 Lys Glu Lys Glu Glu Gln Glu Glu Arg Glu Thr Lys Thr Pro Glu Cys Pro (SEQ ID NO:18), где Xaa3 может представлять собой Lys или Gly, а Xaa4 может представлять собой Glu, Gly или Ser. В частности, шарнирная область, происходящая из иммуноглобулина IgD или его варианта, может иметь аминокислотную последовательность SEQ ID NO:4, тем самым сводя к минимуму образование усеченных форм в процессе продукции белка.
В частности, в шарнирной области, происходящей из иммуноглобулина IgD или его варианта, имеющей последовательность SEQ ID NO: 4, по крайней мере один из Thr может быть гликозилированным. В частности, среди аминокислот SEQ ID NO:18 13, 14, 18 или 19 Thr могут быть гликозилироваными. Предпочтительно все четыре Thr могут быть гликозилированными. Здесь гликозилирование может быть O-гликозилированием.
Сахарная цепь, присоединенная к гликопротеинам в качестве фармацевтических препаратов, является одним из основных факторов, определяющих качество, которое играет важную роль в терапевтической эффективности, сохраняемости в организме, таргетировании и иммунном ответе и т.п. Было подтверждено, что димер полипептида, у которого конец сахарной цепи не заканчивается сиаловой кислотой, быстро удалялся из организма.
Используемый здесь термин «сиаловая кислота» может включать N-ацетилнейраминовую кислоту (Neu5Ac) формулы 1 ниже и N-гликолилнейраминовую кислоту (Neu5Gc) формулы 2 ниже.
[Формула 1]
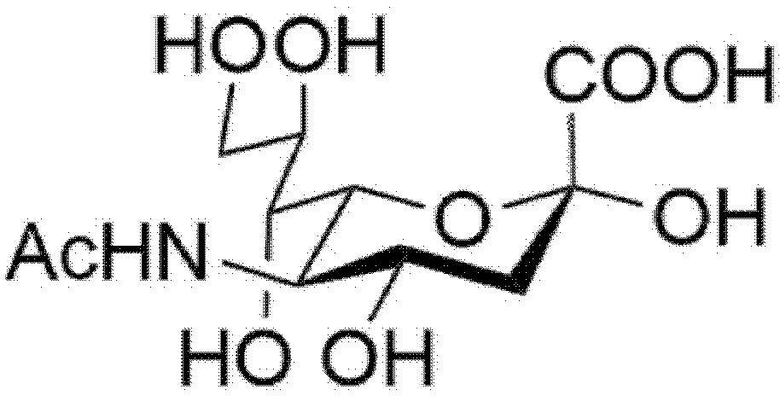
[Формула 2]
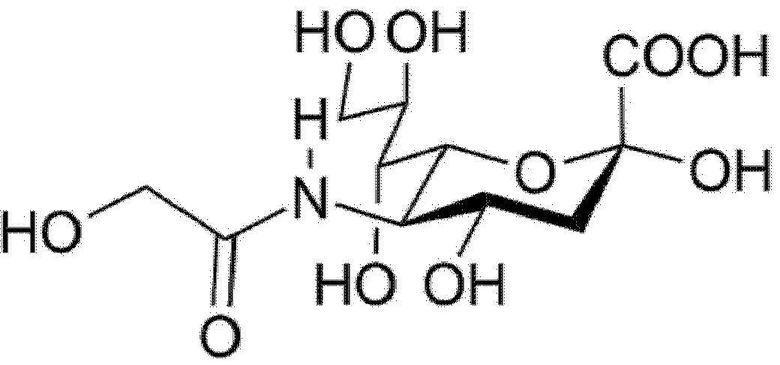
В этом случае, в одном варианте осуществления димер полипептида с высоким содержанием сиаловой кислоты может характеризоваться высоким содержанием N-ацетилнейраминовой кислоты.
Кроме того, содержание сиаловой кислоты в димере полипептида может быть увеличено с помощью метода очистки. Кроме того, содержание сиаловой кислоты в димере полипептида может быть увеличено путем продуцирования димера полипептида в клетке, в которую введен ген сиалилтрансферазы.
Димер полипептида с высоким содержанием сиаловой кислоты, может характеризоваться тем, что молярное отношение сиаловой кислоты к димеру полипептида составляет 8 или более. Например, молярное отношение сиаловой кислоты к димеру полипептида в димере полипептида с высоким содержанием сиаловой кислоты может составлять 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29 или 30. Предпочтительно молярное отношение сиаловой кислоты к димеру полипептида в димере полипептида с высоким содержанием сиаловой кислоты может составлять 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24 или 25.
В одном варианте осуществления молярное отношение сиаловой кислоты к димеру полипептида в димере полипептида с высоким содержанием сиаловой кислоты может составлять по крайней мере 8, по крайней мере 9, по крайней мере 10, по крайней мере 11, по крайней мере 12, по крайней мере 13, по крайней мере 14, по крайней мере 15, по крайней мере 16, по крайней мере 17, по крайней мере 18, по крайней мере 19, по крайней мере 20 или по крайней мере 21. Кроме того, молярное отношение сиаловой кислоты к димеру полипептида в димере полипептида с высоким содержанием сиаловой кислоты может составлять от 8 до 30 или от 12 до 25. Кроме того, молярное отношение сиаловой кислоты к димеру полипептида в димере полипептида с высоким содержанием сиаловой кислоты может составлять от 10 до 25, от 11 до 24 или от 12 до 23. Кроме того, молярное отношение сиаловой кислоты к димеру полипептида в димере полипептида с высоким содержанием сиаловой кислоты может составлять от 13 до 22, от 14 до 22, от 15 до 22, от 16 до 22, от 17 до 22, от 18 до 22 или от 19 до 22. Здесь сиаловая кислота может представлять собой N-ацетилнейраминовую кислоту.
Кроме того, сиаловая кислота может связываться с 8 положениями в мономере, содержащем экстраклеточный домен (FcεRIα-ECD) альфа-субъединицы рецептора для Fc-области IgE и Fc-область. В этом случае сиаловая кислота может связываться с по крайней мере 4 или более из вышеуказанных положений. В частности, сиаловая кислота может связываться с 4, 5, 6, 7 или 8 положениями в мономере.
Как описано выше, димер полипептида с высоким содержанием сиаловой кислоты, предусмотренный настоящим изобретением, может быть в форме, в которой два мономера связаны друг с другом, и каждый мономер получен путем связывания экстраклеточного домена альфа-субъединицы рецептора для Fc-области IgE и модифицированной Fc-области. Димер полипептида с высоким содержанием сиаловой кислоты, может быть в форме, в которой те же два мономера связаны друг с другом цистеином, расположенным в месте шарнирной области. Кроме того, димер полипептида с высоким содержанием сиаловой кислоты может быть в форме, в которой два разных мономера связаны друг с другом.
В этом случае каждый мономер в виде полипептида может содержать сиаловую кислоту в одном и том же положении, но может содержать сиаловую кислоту в другом положении. Кроме того, если молярное отношение сиаловой кислоты к димеру полипептида составляет 8 или более, каждый мономер, составляющий димер, может иметь отличное молярное отношение сиаловой кислоты к полипептиду.
Кроме того, димер полипептида может содержать два мономера, отличающихся друг от друга. В частности, он может быть в форме, в которой один мономер может содержать экстраклеточный домен альфа-субъединицы рецептора для Fc-области IgE, а другой мономер содержит фрагмент экстраклеточного домена альфа-субъединицы рецептора для Fc-области IgE. Здесь вариант мономера может состоять из аминокислотной последовательности, представленной SEQ ID NO:20, SEQ ID NO:21 или SEQ ID NO:22.
Кроме того, димер полипептида с высоким содержанием сиаловой кислоты, предусмотренный настоящим изобретением, проявляет сродство связывания с IgE, которое в 10-100 раз, 20-90 раз, 20-70 раз, 30-70 раз или в 40-70 раз выше, чем у омализумаба, антитела против IgE, и может предпочтительно проявлять сродство связывания с IgE, которое в приблизительно 70 раз выше, чем у омализумаба.
В другом аспекте настоящего изобретения предусматривается фармацевтическая композиция для профилактики или лечения аллергических заболеваний, содержащая димер полипептида с высоким содержанием сиаловой кислоты.
Димер полипептида является таким же, как описано выше. В частности, фармацевтическая композиция может характеризоваться предназначением для подкожной инъекции. Было подтверждено, что димер полипептида с высоким содержанием сиаловой кислоты является эффективным при лечении и/или профилактики аллергических заболеваний по сравнению с димером полипептида с низким содержанием сиаловой кислоты при подкожной инъекции.
Используемый здесь термин «аллергическое заболевание» означает патологический симптом, вызванный аллергической реакцией, опосредованной активацией тучных клеток, такой как дегрануляция тучных клеток. Например, такими аллергическими заболеваниями могут быть заболеваниями, выбранные из группы, состоящей из пищевой аллергии, атопического дерматита, астмы, аллергического ринита, аллергического конъюнктивита, аллергического дерматита, хронической идиопатической крапивницы и аллергического контактного дерматита, но без ограничения этим. В частности, аллергические заболевания могут быть опосредованы IgE.
В фармацевтической композиции димер полипептида может содержаться в любом количестве (эффективном количестве) в зависимости от применения, препарата, цели смешивания и т.п., при условии, что димер полипептида может проявлять противоаллергическую активность. Типичное эффективное количество димера полипептида будет определяться в диапазоне от 0,001% до 20,0% по весу от общего веса композиции. Здесь эффективное количество относится к количеству, которое способно вызвать противоаллергический эффект. Такое эффективное количество могут определить специалисты со средним уровнем компетентности в данной области техники.
Фармацевтическая композиция может, кроме того, содержать фармацевтически приемлемый носитель. В частности, фармацевтическая композиция содержит фармацевтически приемлемый носитель и может быть приготовлена в виде препарата для перорального или парентерального введения в зависимости от пути введения обычным способом, известным в данной области техники.
В случае, когда фармацевтическая композиция по настоящему изобретению готовится в виде препарата для перорального применения, фармацевтическая композиция может быть приготовлена в виде таких препаратов, как порошки, гранулы, таблетки, пилюли, таблетки с сахарным покрытием, капсулы, жидкости, гели, сиропы, суспензии и пластины, вместе с подходящими носителями, в соответствии со способами, известными в данной области техники. Здесь примеры подходящих фармацевтически приемлемых носителей могут включать сахара, такие как лактоза, глюкоза, сахароза, декстроза, сорбит, маннит и ксилит, крахмалы, такие как кукурузный крахмал, картофельный крахмал и пшеничный крахмал, целлюлозы, такие как целлюлоза, метилцеллюлоза, этилцеллюлоза, карбоксиметилцеллюлоза натрия и гидроксипропилметилцеллюлоза, поливинилпирролидон, воду, метилгидроксибензоат, пропилгидроксибензоат, стеарат магния, минеральное масло, солод, желатин, тальк, полиол, растительное масло и т.п. В случае приготовления в виде препаратов, препараты могут быть получены, если необходимо, путем включения разбавителей и/или наполнителей, таких как наполнитель, наполнитель, связующее, смачивающее вещество, разрыхлитель и поверхностно-активное вещество.
В случае, когда фармацевтическая композиция по настоящему изобретению готовится в виде препарата для парентерального введения, фармацевтическая композиция может быть приготовлена в виде препаратов в форме инъекций, трансдермальных препаратов, назальных ингаляторов и суппозиториев, вместе с подходящими носителями, в соответствии со способами, известными в данной области техники. В случае приготовления для инъекций в качестве подходящего носителя может использоваться стерилизованная вода, этанол, полиол, такой как глицерин и пропиленгликоль, или их смесь. В качестве носителя могут предпочтительно использоваться изотонические растворы, такие как раствор Рингера, забуференный фосфатом физиологический раствор (PBS), содержащий триэтаноламин, стерильная вода для инъекций и 5% декстроза и т.п.
Приготовление фармацевтической композиции известно в данной области техники, и, в частности, можно сделать ссылку на Remington's Pharmaceutical Sciences (19-е изд., 1995) и т.п.
Предпочтительная суточная доза фармацевтической композиции по настоящему изобретению находится в диапазоне от 0,01 мкг/кг до 10 г/кг, и предпочтительно от 0,01 мг/кг до 1 г/кг, в зависимости от состояния пациента, веса тела, пола, возраста, тяжести заболевания или пути введения. Фармацевтическая композиция может вводиться один раз в день или несколько раз в день в случае высокой дозы.
Субъектом, которому может быть назначена композиция по настоящему изобретению, является млекопитающее, и им может быть, например, человек, собака и кошка, при этом человек является особенно предпочтительным, но без ограничения этим. Фармацевтическая композиция может, кроме того, включать любое соединение или натуральный экстракт, безопасность которого уже подтверждена и которое(ый), как известно, обладает противоаллергической активностью, с целью повышения и усиления противоаллергической активности.
Авторы настоящего изобретения изучили возможность разработки безопасного и эффективного терапевтического средства от аллергических заболеваний. В результате было подтверждено, что димер полипептида с высоким содержанием сиаловой кислоты обладает превосходным сродством связывания с IgE по сравнению с димером полипептида с низким содержанием сиаловой кислоты (табл. 3). Кроме того, было подтверждено, что когда димер полипептида с высоким содержанием сиаловой кислоты вводится подкожно субъекту, страдающему аллергическим заболеванием, концентрация IgE и MCPT-1 в крови эффективно снижается по сравнению с димером полипептида с низким содержанием сиаловой кислоты, и эффект сохраняется даже по прошествии заданного времени (фиг. 13 и 14).
Соответственно, в другом аспекте настоящего изобретения предусматривается трансдермальный пластырь, содержащий фармацевтическую композицию. Кроме того, в другом аспекте настоящего изобретения предусматривается пластырь для местного применения, содержащий фармацевтическую композицию.
В другом аспекте настоящего изобретения предусматривается пищевая смесь для уменьшения интенсивности или облегчения аллергических симптомов, содержащая димер полипептида с высоким содержанием сиаловой кислоты.
Димер полипептида с высоким содержанием сиаловой кислоты является таким же, как описано выше. Кроме того, димер полипептида с высоким содержанием сиаловой кислоты, может быть связан с подходящими средствами доставки для эффективной доставки в кишечник.
Кроме того, пищевая смесь может быть приготовлена в любой форме и может быть, например, приготовлена в форме напитков, таких как чай, сок, газированный напиток и ионный напиток, подвергнутых технологической обработке молочных продуктов, таких как молоко и йогурт, здоровой функциональной пищи, препаратов, таких как таблетки, капсулы, пилюли, гранулы, жидкости, порошки, хлопья, пасты, сиропы, гели, желе и батончики или т.п.
Пищевая смесь может подпадать под любую категорию продуктов по юридической или функциональной классификации при условии, что пищевая смесь соответствует нормативным требованиям на момент производства и распространения. Например, пищевая смесь может быть здоровым функциональным продуктом питания в соответствии с Законом о здоровых функциональных продуктах питания или может относиться к кондитерским изделиям, бобам, чаям, напиткам, продуктам специального назначения и т.п. в соответствии с каждым типом продуктов питания в Кодексе продуктов питания Закона о пищевой санитарии (стандартах и спецификациях для пищевых продуктов, утвержденных Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов). Что касается других пищевых добавок, которые могут содержаться в пищевой смеси по настоящему изобретению, можно сделать ссылку на Кодекс продуктов питания или Кодекс пищевых добавок в соответствии с Законом о пищевой санитарии.
В другом аспекте настоящего изобретения предусматривается способ лечения или профилактики аллергических заболеваний, включающий стадию введения субъекту димера полипептида с высоким содержанием сиаловой кислоты. Димер полипептида с высоким содержанием сиаловой кислоты является таким же, как описано выше.
Субъектом может быть млекопитающее, предпочтительно человек, собака и кошка. Здесь введение может осуществляться перорально или парентерально. Здесь парентеральное введение может осуществляться такими способами, как подкожное введение, внутривенное введение, введение через слизистые оболочки и мышечное введение.
Аллергическими заболеваниями могут быть заболевания, выбранные из группы, состоящей из пищевой аллергии, атопического дерматита, астмы, аллергического ринита, аллергического конъюнктивита, аллергического дерматита, хронической идиопатической крапивницы и аллергического контактного дерматита.
В другом аспекте настоящего изобретения предусматривается применение димера полипептида с высоким содержанием сиаловой кислоты для профилактики или лечения аллергических заболеваний.
Далее настоящее изобретение будет описано более подробно со ссылкой на следующие примеры. Однако следующие примеры предназначены только для иллюстрации настоящего изобретения, и объем настоящего изобретения не ограничивается только этим.
Пример 1. Получение полипептида, содержащего FcεRIα-ECD и Fc-область.
С-концевой модифицированный полипептид экстраклеточного домена (FcεRIα-ECD) альфа-субъединицы рецептора для Fc-области IgE получали в соответствии со способом, описанным в патенте США № 7867491.
Сначала, для экспрессии белка (FcεRIαECD-Fc1), белка (FcεRIαECD-Fc2) и белка (FcεR1αECD-Fc3), в которых экстраклеточный домен α-цепи FcεRI, имеющий аминокислотную последовательность SEQ ID NO:1, и модифицированная Fc-область иммуноглобулина с SEQ ID NO:2 связаны посредством шарнирной области с SEQ ID NO:19, шарнирной области SEQ ID NO:3 и шарнирной области с SEQ ID NO:4, соответственно, кассеты, полученные путем связывания гена, кодирующего каждый белок, клонировали в векторы pAD15 (Genexin, Inc.) для конструирования векторов для экспрессии белка FcεRIαECD-Fc. Затем каждый из экспрессионных векторов трансдуцировали в клетки CHO DG44 (от Dr. Chasin, Columbia University, США).
Здесь, во время трансдукции в линию клеток экспрессионный вектор, полученный путем клонирования гена α-2,6-сиалилтрансферазы в вектор pCI Hygro (Invitrogen), одновременно трансдуцировали для раздельного получения линий клеток, способных к экспрессии белков FcεRIαECD-Fc2ST и FcεRIαECD-Fc3ST, к которым добавлена сиаловая кислота.
В качестве процедуры первичного скрининга отбор с использованием НТ проводили с использованием среды 10% dFBS без 5-гидрокситриптамина (HT) (Gibco, США, 30067-334), среды MEMα (Gibco, 12561, США, каталожный номер 12561-049) и среды HT+ (Gibco, США, 11067-030). Затем размножение в присутствии метотрексата (MTX) выполняли, используя HT-отобранные клоны, для увеличения продуктивности с использованием системы дигидрофолатредуктазы (DHFR).
После завершения размножения в присутствии МТХ субкультивирование проводили от 1 до 5 раз для стабилизации клеток с целью оценки продуктивности. Впоследствии была проведена оценка продуктивности клеток, размноженных в присутствии МТХ. Результаты представлены в табл. 1 ниже.
Таблица 1
Как показано в табл. 1, клеточная линия FcεRIαECD-Fc3 продемонстрировала продуктивность, составляющую 16,9 мкг/106 клеток после размножения в присутствии 2 мкМ метотрексата. С другой стороны, линия клеток FcεRIαECD-Fc3 (FcεRIαECD-Fc3ST), котрансдуцированная 2,6-сиалилтрансферазой, продемонстрировала продуктивность, составляющую 10,2 мкг/106 клеток после размножения в присутствии 1 мкМ метотрексата. Кроме того, клеточная линия FcεRIαECD-Fc2 продемонстрировала продуктивность, составляющую 20,9 мкг/106 клеток в условиях размножения в присутствии 0,5 мкМ метотрексата. Кроме того, клеточная линия FcεRIαECD-Fc2 (FcεRIαECD-Fc2ST), котрансдуцированная 2,6-сиалилтрансферазой, продемонстрировала продуктивность, составляющую 25,1 мкг/106 клеток после размножения в присутствии 0,1 мкМ метотрексата. Таким образом, было определено, что линия клеток FcεRIαECD-Fc2, котрансдуцированная 2,6-сиалилтрансферазой, которая была отобрана в условиях амплификации в присутствии 0,1 мкМ метотрексата, демонстрирует самую высокую продуктивность.
Полипептид (FcεRIαECD-Fc), продуцируемый клеточной линией FcεRIαECD-Fc2, обозначается как «FcεRIαECD-Fc2», а полипептид, продуцируемый клеточной линией FcεRIαECD-Fc2+a2,6-ST, обозначается как «FcεRIαECD-FcST". Кроме того, полипептид, продуцируемый клеточной линией FcεRIαECD-Fc3, обозначается как «FcεRIαECD-Fc3», а полипептид, продуцируемый клеточной линией FcεRIαECD-Fc3+a2,6-ST, обозначается как «FcεRIαECD-FcST».
Пример 2. Подтверждение очистки и степени чистоты полипептида (FcεRIα ECD-Fc)
Среди клеточных линий, отобранных в примере 1 выше, i) клеточную линию FcεRIαECD-Fc3, ii) клеточную линию FcεRIαECD-Fc3+a2,6-ST и iii) клеточную линию FcεRIαECD-Fc2+a2,6-ST культивировали в объеме 60 мл методом периодического культивирования. Полученные культуры очищали с использованием аффинной колонки с белком-A для получения FcεRIα ECD-Fc, а затем очищенный FcεRIα ECD-Fc подвергали SE-HPLC (эксклюзионной высокоэффективной жидкостной хроматографии) и электрофорезу в SDS-ПААГ для определения степени чистоты полипептид.
В частности, электрофорез в SDS-ПААГ выполняли в невосстанавливающих условиях. В невосстанавливающих условиях каждый очищенный полипептид смешивали с невосстанавливающим буфером для образцов, а затем проводили электрофорез в течение 30 минут в гелях Mini-Protean TGX™ (Bio-Rad) в буфере TGS (Егс-глицин-SDS) в условиях 200 В. После электрофореза белок окрашивали раствором Кумасси бриллиантового синего. Результаты представлены в табл. 2 и на фиг. 1 ниже:
Таблица 2
(SE-HPLC)
Как показано в табл. 2 выше, было подтверждено, что степень чистоты каждого полипептида, очищенного методом SE-HPLC, составляла 93% или более. Было подтверждено, что такие примеси, как усеченная форма, не появлялись в невосстанавливающих условиях, и, в частности, степень чистоты составляла 93% или более, и примеси отсутствовали даже после процесса оттаивания/замораживания.
Экспериментальный пример 1. Подтверждение образования димера полипептида (FcεRIα ECD-Fc)
Среди клеточных линий, отобранных в примере 1 выше, i) клеточную линию FcεRIαECD-Fc3, ii) клеточную линию FcεRIαECD-Fc3+a2,6-ST и iii) клеточную линию FcεRIαECD-Fc2+a2,6-ST культивировали в объеме 60 мл методом периодического культивирования. Впоследствии проводили SE-HPLC и электрофорез в SDS-ПААГ для очищенного продукта, полученного в результате очистки полипептида с использованием культурального супернатанта и колонки для аффинной хроматографии с белком-A. В этом случае они были выполнены на культуральном супернатанте и очищенном продукте в невосстанавливающих условиях и в восстанавливающих условиях, соответственно.
Невосстанавливающие условия выполняли таким же образом, как в примере 2. С другой стороны, в восстанавливающих условиях каждый очищенный полипептид смешивали с восстанавливающим буфером для образцов, содержащим 2-меркаптоэтанол, и затем подвергали денатурации при температуре 100°C в течение 5 минут. Впоследствии проводили электрофорез в течение 30 минут при 200 В с использованием буфера TGS в гелях Mini-Protean TGX™ (Bio-Rad). После электрофореза белок окрашивали раствором Кумасси бриллиантового синего.
В результате полипептид размером, составляющим приблизительно 150 кДа, был обнаружен в невосстанавливающих условиях, а полипептид размером, составляющим приблизительно 75 кДа, обнаружен в восстанавливающих условиях. Благодаря этому было подтверждено, что полипептид образует димер (фиг. 2). В частности, было подтверждено, что степень чистоты димера полипептида является высокой даже в культуральном супернатанте, соответствующем материалу на входе, и полипептид не был обнаружен в образце (FT; Flow Through, материале, проходящем через колонку без связывания), полученном при пропускании культурального супернатанта через аффинную колонку, но в элюированном образце был обнаружен полипептид. Кроме того, не наблюдалось значительной разницы, даже когда образец (Elute_N), который был немедленно нейтрализован 1 М Трис-буфером (pH 9,0) из-за низкого pH элюированного образца, сравнивался с образцом (Elute), который не был нейтрализован (фиг.2).
Кроме того, было установлено, что очищаются не только полипептиды с очень высокой степенью чистоты (98% или выше), но также полипептиды с очень высокой чистотой представлены даже в культуральном супернатанте. Это указывает на то, что этапы разработки процесса могут быть упрощены при разработке полипептидов, которые были экспрессированы в рассматриваемых клеточных линиях, в виде медицинского продукта, и в результате весьма вероятно, что стоимость разработки медицинского продукта будет значительно снижена.
Экспериментальный пример 2. Подтверждение сродства связывания димера полипептида с IgE
Сродство связывания с IgE была сравнительно определено для очищенных продуктов, полученных путем очистки полипептидов, которые были получены в примере 1, i) FcεRIαECD-Fc2, ii) FcεRIαECD-Fc2ST, iii) FcεRIαECD-Fc3 и iv) FcεRIαECD-Fc3ST, используя метод из примера 2 выше, и коммерчески доступного антитела против IgE, омализумаба (торговое название: Xolair).
В частности, сродства связывания с IgE измеряли путем нанесения IgE в виде покрытия на канал сенсорного чипа Protein GLC (Bio-Rad Laboratories, Inc., каталожный № 176-5011) и принуждения к протеканию омализумаба или каждого белка FcεR1αECD-Fc в различных концентрациях со скоростью 30 мкл в минуту. Здесь эксперименты проводились путем определения нулевого основания, используя 25 мМ NaOH в качестве буфера для регенерации, а затем повторения вышеуказанных стадий. Впоследствии кривую связывания определяли с использованием анализатора связывания белков (ProteOn XPR36, Bio-Rad Laboratories, Inc., США). Результаты представлены в табл. 3.
Таблица 3
Как показано в табл. 3, определенное значение скорости ассоциации (ka) димера полипептида в соответствии с вариантом осуществления настоящего изобретения и IgE было в 1,5-2,0 раза меньше, чем у омализумаба. Т.е. было обнаружено, что его сродство связывания с веществами, отличными от IgE, в 1,5-2,0 раза ниже, чем у омализумаба. Кроме того, определенное значение скорости диссоциации (kd) димера полипептида в соответствии с вариантом осуществления настоящего изобретения было в 40-106 раз выше, чем у омализумаба. В результате было подтверждено, что димер полипептида в соответствии с вариантом осуществления настоящего изобретения имеет значение константы равновесной диссоциации (KD <kd/ka>), которое в 22-69 раз выше, чем у омализумаба. На основании этого было определено, что димер полипептида в соответствии с вариантом осуществления настоящего изобретения обладает значительно повышенным сродством связывания с IgE по сравнению с омализумабом. В частности, было определено, что димер полипептида, к которому добавлена сиаловая кислота (FcεRIαECD-Fc2ST), демонстрирует наибольшее сродство связывания с IgE, которое в 69 раз выше, чем у омализумаба.
Кроме того, как показано на фиг. 3 и 4, было подтверждено, что омализумаб утрачивает связывание с IgE по прошествии определенного периода времени после связывания, тогда как димер полипептида в соответствии с вариантом осуществления настоящего изобретения (FcεRIαECD-Fc2ST, IgETRAP) не отделяется от IgE после связывания с IgE. Т.е. было подтверждено, что димер полипептида в соответствии с вариантом осуществления настоящего изобретения нелегко отделить от IgE, и он обладает гораздо большей способностью к сохранению своего связанного состояния, чем омализумаб.
Экспериментальный пример 3. Подтверждение сродства связывания димера полипептида с рецепторами IgG
Сродство связывания димера полипептида в соответствии с вариантом осуществления настоящего изобретения (FcεRIαECD-Fc2ST, IgETRAP) или омализумаба (Xolair) с рецепторами для Fc-гамма IgG подтверждали с использованием системы Octet RED384 (Pall ForteBio, CA, США).
В частности, рекомбинантные белки FcγRI, FcγRIIA, FcγRIIB, FcγRIIIA и FcγRIIIB (R&D Systems Inc., 5 мкг/мл), которые являются Fc-гамма-рецепторами, иммобилизовали в 300 мМ ацетатном буфере (pH 5) на активированном биосенсоре AR2G. В качестве рабочего буфера использовали PBS, содержащий 0,1% Tween-20 и 1% бычью сыворотку. Все измерения проводили при 30°C на встряхивающем устройстве для планшетов со скоростью 1000 об./мин. Результаты представлены фиг. 5a-5e, а сродство связывания омализумаба и димера полипептида с рецепторами для Fc-гамма IgG количественно определено и показано на фиг. 6.
В результате было подтверждено, что омализумаб демонстрирует высокое сродство связывания с рецепторами для Fc-гамма IgG, тогда как димер полипептида имел значительно более низкое сродство связывания с рецепторами для Fc-гамма IgG. Благодаря этому было подтверждено, что димер полипептида не связывается с рецепторами для Fc-гамма IgG.
Экспериментальный пример 4. Подтверждение активности димера полипептида с помощью анализа бета-гексозаминидазы в тучных клетках, полученных из костного мозга мыши
Анализ бета-гексозаминидазы выполняли для анализа активности in vitro димера полипептида в соответствии с вариантом осуществления настоящего изобретения.
В частности, димер полипептида (FcεRIαECD-Fc2) в соответствии с вариантом осуществления настоящего изобретения смешивали в каждой концентрации с IgE (1 мкг/мл) и инкубировали при 20°C в течение 30 минут для приготовления образцов. Тучные клетки, полученные из костного мозга мыши, в культуре для активации тучных клеток промывали буфером сбалансированным солевым раствором Хэнка (HBSS) для удаления среды, измеряли количество клеток, и затем 5×105 клеток повторно переносили в 40 мкл буфера HBSS.
50 мкл приготовленного таким образом образца добавляли к активированным тучным клеткам. Затем полученный продукт инкубировали в термостате с 5% CO2 при 37°C в течение 30 минут. Впоследствии, после добавления каждых 10 мкл DNP (2,4-динитрофенола, 100 нг/мл), который является чужеродным антигеном, инкубацию проводили снова при 37°C в течение 30 минут в 5% CO2, а затем отделяли 30 мкл супернатанта.
30 мкл отделенного супернатанта и 30 мкл субстрата (4-нитрофенил-N-ацетил-β-D-глюкозаминида, 5,84 мМ) хорошо перемешивали, а затем инкубировали при 37°C в течение 20 минут в 5% CO2. Затем для остановки реакции добавляли 140 мкл 0,1 М буфера карбоната натрия (pH 10) в качестве стоп-раствора. Впоследствии измеряли оптическую плотность при 405 нм для определения величины секреции β-гексозаминидазы, секретируемой под стимулом чужеродного антигена в активированных тучных клетках. Результаты представлены на фиг. 7.
Как показано на фиг. 7, было подтверждено, что активность IgE значительно ингибируется в случае, когда концентрация IgE и димера полипептида по настоящему изобретению составляет 1:1. Т.е. было подтверждено, что димер полипептида в соответствии с вариантом осуществления настоящего изобретения реагирует, даже если его концентрация такая же, как у IgE.
Экспериментальный пример 5. Сравнение активности димера полипептида и антитела против IgE человека, используя анализ β-гексозаминидазы в тучных клетках, полученных из костного мозга мыши, экспрессирующих FcεRI человека.
Для сравнения активности димера полипептида в соответствии с вариантом осуществления настоящего изобретения (FcεRIαECD-Fc2ST, IgETRAP) и Xolair (омализумаб), который представляет собой человеческое антитело против IgE, был проведен анализ бета-гексозаминидазы.
Соответствующие димеры полипептидов и Xolair получали в каждой концентрации, а затем смешивали с IgE человека (1 мкг/мл). Затем проводили инкубацию при комнатной температуре в течение 30 минут для приготовления образцов. Кроме того, получали тучные клетки, полученные из костного мозга мыши и дифференцированные из него, в которые был введен ген FcεRI человека и удален ген FcεRI мыши. Приготовленные тучные клетки промывали буфером HBSS, а затем 5×105 клеток повторно переносили в 60 мкл буфера HBSS.
Затем 20 мкл приготовленного таким образом образца добавляли к тучным клеткам и затем инкубировали в термостате с 5% CO2 при 37°C в течение 30 минут. Впоследствии после добавления 20 мкл человеческого антитела против IgE (BioLegend, каталожный № 325502, 0,5 мкг/мл) полученную смесь снова инкубировали в термостате с 5% CO2 при 37°C в течение 30 минут. Затем после центрифугирования при 1500 об/мин при 4°C отделяли 30 мкл супернатанта. 30 мкл отделенного супернатанта и 30 мкл субстрата (4-нитрофенил-N-ацетил-β-глюкозаминида, 5,84 мМ) хорошо перемешивали, а затем инкубировали в термостате с 5% CO2 при 37°C в течение 25 минут. Затем добавляли 140 мкл 0,1 М натрий-карбонатного буфера (pH 10) для прекращения реакции. Впоследствии измеряли оптическую плотность при 405 нм для сравнения относительных количеств секретируемой β-гексозаминидазы, и определяли ингибирующий эффект против тучных клеток в зависимости от каждой концентрации образца. Результаты представлены на фиг. 8.
Как показано на фиг. 8, измеренная IC50 димера полипептида составляла приблизительно 11,16 нг/мл, а измеренная IC50 Xolair составляла приблизительно 649,8 нг/мл. Следовательно, было установлено, что димер полипептида обладает большей в 58 раз ингибирующей способностью в отношении активности тучных клеток, чем Xolair.
Экспериментальный пример 6. Подтверждение активности димера полипептида посредством анализа in vivo в модели пищевой аллергии
50 мкг овальбумина (OVA) и 1 мг квасцов вводили внутрибрюшинно мышам Balb/c (Orientbio Inc.) два раза с 14-дневным интервалом для вызова сенсибилизации. Впоследствии 50 мг OVA вводили перорально всего пять раз в дни 28, 30, 32, 34 и 36 для индукции пищевой аллергии в кишечнике.
После двукратного перорального введения OVA, т.е. в день 31, мышей разделили на три группы по 7 мышей в каждой. Тремя разделенными группы были следующие группы: группа 1, получающая димер полипептида (FcεRIαECD-Fc2ST) в высокой концентрации (200 мкг), группа 2, получающая димер полипептида (FcεRIαECD-Fc2ST) в низкой концентрации (20 мкг), и группа 3, ничего не получающая.
При пероральном введении OVA наблюдали, возникает ли диарея из-за индукции пищевой аллергии. Кроме того, мышей умерщвляли в день 37, и количество тучных клеток в тонком кишечнике, концентрацию IgE в крови и концентрацию фермента дегрануляции тучных клеток (протеазы-1 тучных клеток (MCPT-1)) в крови анализировали у мышей, относящихся к каждой группе.
В результате, как показано на фиг. 9, диарея возникла у мышей группы 3 после второго перорального введения OVA. С другой стороны, диарея возникла у мышей группы 1 и группы 2 после третьего перорального введения OVA. В частности, частота диареи у мышей группы 1 была ниже, чем у мышей группы 2. Благодаря этому было подтверждено, что эффект против пищевой аллергии увеличивался пропорционально концентрации димера полипептида.
Экспериментальный пример 7. Анализ содержания сиаловой кислоты в димере полипептида
Основываясь на тех аспектах, что скорость продукции полипептида, продуцируемого клеточной линией FcεRIαECD-Fc2+a2,6-ST, полученной в примере 1 выше, является самой высокой, и противоаллергический эффект димера полипептида (FcεRIαECD-Fc2ST) в экспериментальных примерах 4-6 является превосходным, анализировали содержание сиаловой кислоты в димере полипептида для исследования противоаллергической эффективности димера полипептида в зависимости от содержания сиаловой кислоты.
В частности, для измерения содержания сиаловой кислоты, содержащейся в гликановой структуре димера полипептида (FcεRIαECD-Fc2ST), полученного из клеточной линии FcεRIαECD-Fc2+a2,6-ST, полученной в примере 1 выше, сиаловую кислоту сначала отделяли путем обработки сиалидазой, ферментом, связанным с катаболизмом сиаловой кислоты. Впоследствии отделенную сиаловую кислоту выделяли, детектировали и количественно анализировали с помощью ВЭЖХ (Waters, alliance e2659).
Димер полипептида был разделен на три образца в соответствии с градиентом pH, выделен и очищен. Три образца помещали в фильтр AmiconUltra 10K (Millipore, UFC501096) и центрифугировали в течение 10 минут при 13000 об/мин, температуре 4°C и повторяли 5 раз, буфер концентрата заменяли деионизированной водой, и осуществляли концентрирование. Концентрация образца была установлена на уровне 10 мг/мл или более при измерении на длине волны 280 нм.
Впоследствии отбирали 0,5 мг каждого образца и помещали в пробирку EP, и добавляли 1 мкл сиалидазы (Roche, 10 269 611 001) и 40 мкл натрий-фосфатного буфера (pH 7,0) в концентрации 10 мМ, и затем добавляли деионизированную воду так, чтобы конечный объем составлял 100 мкл. Отбирали 2 мкл каждого образца для определения концентрации при длине волны 280 нм, и подтвержденное значение концентрации использовали в качестве конечной концентрации анализа.
Образец подвергали реакции в течение 18 часов в термостате при 37°C, затем помещали в фильтр AmiconUltra 10K и центрифугировали в течение 15 минут при 13000 об/мин, 4°C, и фильтрат, прошедший через фильтр, использовали для анализа. Условия анализа ВЭЖХ показаны в табл. 4 ниже.
Таблица 4
RHM-моносахарид H+ (8%) 50 Х 7,8 мм (Rezex); предколонка
Стандартным веществом для расчета содержания сиаловой кислоты является смесь N-ацетилнейраминовой кислоты (далее называемой NANA) и N-гликолилнейраминовой кислоты (далее называемой NGNA). Уравнение линейной регрессии для стандартной кривой было получено для расчета молярных концентраций NGNA и NANA в аналите. Используемые смеси представлены ниже в табл. 5.
Таблица 5
Содержание сиаловой кислоты NANA в образце рассчитывали, используя содержание NANA. Содержание сиаловой кислоты в образце представляли в виде молярного отношения сиаловой кислоты к образцу (моль/моль).
Уравнение 1:
Содержание сиаловой кислоты в образце=(Молярная концентрация NANA в образце)/(молярную концентрацию образца).
Кроме того, содержание NGNA в образце рассчитывали, используя содержание NGNA. Содержание NGNA в образце представляли в виде молярного отношения NGNA к аналиту (моль/моль).
Уравнение 2:
Содержание NGNA в образце=(Молярная концентрация NGNA в аналите)/(молярную концентрацию аналита).
Результаты представлены в табл. 6 ниже.
Таблица 6
Как показано в табл. 6, осуществляли разделение на три образца в соответствии с градиентом pH, осуществляли отделение и очистку, и содержание сиаловой кислоты в образцах измеряли по-разному. Для сравнения противоаллергической эффективности в соответствии с содержанием сиаловой кислоты димер полипептида обозначается как «SAнизкое, «SAсреднее» и «SAвысокое в порядке содержания сиаловой кислоты.
Экспериментальный пример 8. Подтверждение изменения образования димера полипептида в соответствии с содержанием сиаловой кислоты
Для подтверждения, имело ли место изменение образования димера полипептида в соответствии с содержанием сиаловой кислоты, SAнизкое, SAсреднее» и SAвысокое, разделенные в примере 9 подвергали анализу с помощью электрофореза в SDS-ПААГ в невосстанавливающих условиях и восстанавливающих условиях таким же образом, как в экспериментальном примере 1.
В результате во всех SAнизкое, SAсреднее» и SAвысокое полипептид размером, составляющим приблизительно 150 кДа, был обнаружен в невосстанавливающих условиях, а полипептид размером, составляющим приблизительно 75 кДа, был обнаружен в восстанавливающих условиях. Благодаря этому было подтверждено, что полипептид образует димер (фиг. 10).
Экспериментальный пример 9. Подтверждение изоэлектрической точки димера полипептида в соответствии с содержанием сиаловой кислоты.
Для подтверждения, изменяется ли изоэлектрическая точка димера полипептида в соответствии с содержанием сиаловой кислоты, SAнизкое, SAсреднее» и SAвысокое, разделенные в экспериментальном примере 7, смешивали с раствором для образца для IEF, а затем загружали в гель для IEF с pH 3-7 (Invitrogen), и электрофорез последовательно проводили в течение 1 часа при 100 В, в течение 1 часа при 200 В и 30 минут при 500 В. После завершения электрофореза гель подвергали реакции в фиксирующем растворе, содержащем 12% трихлоруксусной кислоты и 3,5% сульфосалициловой кислоты, в течение 30 минут, а затем промывали дистиллированной водой. Белок окрашивали раствором Кумасси бриллиантового синего.
В результате изоэлектрические точки SAнизкое, SAсреднее» и SAвысокое немного различались в зависимости от содержания сиаловой кислоты, и было обнаружено, что они составляют приблизительно 5,3, 4,9 и 4,7, соответственно (фиг. 11).
Экспериментальный пример 10. Подтверждение противоаллергической активности димера полипептида в соответствии с содержанием сиаловой кислоты в модели пищевой аллергии на животном: измерение частоты диареи.
Для подтверждения, изменяется ли активность димера полипептида в зависимости от содержания сиаловой кислоты, индуцировали сенсибилизацию путем внутрибрюшинного введения 50 мкг OVA и 1 мг квасцов дважды с интервалом в 14 дней для мышей Balb/c (Orient Bio). Впоследствии в день 28, 30, 32, 34, 36, 38, 40 всего 7 раз пищевую аллергию индуцировали путем перорального введения 50 мг OVA. В этом случае пероральное введение OVA осуществляли после 4 часов голодания.
OVA вводили перорально дважды, а затем в день 40 мышей разделили на 3 группы по 7 мышей. Мыши были разделены на группу 1, группу, которой димер полипептида с высоким содержанием сиаловой кислоты (SAвысокое) вводится подкожно в высокой концентрации (200 мкг), группу 2, группу, которой димер полипептида с низким содержанием содержание сиаловой кислоты (SAнизкое) вводится подкожно в высокой концентрации (200 мкг), и группу 3, группу, которой PBS вводится подкожно. Подтверждали, возникла ли диарея в связи с индукцией пищевой аллергии, когда OVA вводили перорально.
В результате у мышей группы 3 после четвертого перорального введения OVA возникла диарея. Диарея возникла у мышей группы 2 после пятого перорального введения OVA. В частности, частота диареи быстро увеличивалась у мышей группы 2 после шестого перорального введения OVA. С другой стороны, диарея возникла у мышей группы 1 после шестого перорального введения OVA, но частота диареи сохранялась, но не увеличивалась у мышей группы 1 даже после седьмого перорального введения OVA (фиг. 12). Благодаря этому было подтверждено, что димер полипептида с высоким содержанием сиаловой кислоты (SAвысокое) обладает превосходным противоаллергическим эффектом по сравнению с димером полипептида с низким содержанием сиаловой кислоты (SAнизкое).
Экспериментальный пример 11. Подтверждение противоаллергической активности димера полипептида в соответствии с содержанием сиаловой кислоты в модели пищевой аллергии на животном: измерение концентрации IgE в крови
Кровь собирали методом глазного отбора образцов у мышей каждой группы, которой было выполнено седьмое пероральное введение OVA экспериментального примера 10. После реакции в течение 30 минут при температуре окружающей среды сыворотку отделяли центрифугированием в течение 15 минут при 13000 об./мин при температуре 4°C. Для измерения концентрации свободного IgE в крови использовали набор ELISA для общего IgE мыши (BioLegend), и в этом случае ELISA выполняли в соответствии с протоколом производителя, за исключением того, что димер полипептида (SAнизкое и SAвысокое) в соответствии с одним вариантом осуществления настоящее изобретение использовали в качестве вещества, наносимого в качестве покрытия на 96-луночный планшет, вместо антитела против IgE.
В частности, 96-луночный планшет покрывали димером полипептида (SAнизкое и SAвысокое), разбавленным PBS, и подвергали реакции в течение ночи при температуре 4°C. На следующий день после промывки PBS, содержащим 0,05% Tween 20 (далее буфером для промывки), добавляли блокирующий буфер (разбавитель анализа), и осуществляли реакцию в течение 1 часа. Впоследствии его промывали буфером для промывки, а затем мышиный IgE, используемый в качестве стандартного раствора, и образцы сыворотки мышей разводили 1Х разбавителем анализа, помещали в планшет, и проводили реакцию в течение 2 часов.
После повторной промывки буфером для промывки добавляли меченное биотином мышиное антитело против IgE, и реакцию проводили в течение 1 часа. После промывки буфером для промывки добавляли меченный HRP (пероксидазой хрена) авидин (Avidin-HRP) и оставляли реагировать на 30 минут. После промывки буфером для промывки добавляли раствор субстрата, который реагировал в течение 20 минут, блокируя свет, а затем добавляли стоп-раствор (1 М H2SO4) для остановки реакции. Впоследствии значение оптической плотности измеряли при длине волны 450 нм с помощью считывающего устройства для микропланшетов (Epoch Microplate Spectrophotometer), и рассчитывали концентрацию.
В результате в случае мышей группы 3, которым подкожно вводили PBS, рассчитанная концентрация IgE в крови составила приблизительно 8000 нг/мл. Кроме того, в случае мышей группы 2, которым подкожно вводили димер полипептида с низким содержанием сиаловой кислоты (SAнизкое), рассчитанная концентрация IgE в крови составила приблизительно 7000 нг/мл. С другой стороны, в случае мышей группы 1, которым подкожно вводили димер полипептида с высоким содержанием сиаловой кислоты (SAвысокое), рассчитанная концентрация IgE в крови составила приблизительно 4900 нг/мл, и наблюдалось существенное отличие от значений концентрации IgE в крови между мышами группы 2 и группы 3 (фиг. 13).
На основе этих результатов было установлено, что при подкожном введении димера полипептида с высоким содержанием сиаловой кислоты содержание IgE в крови снижается. Кроме того, на основании такого снижения уровня IgE в крови было предсказано, что димер полипептида с высоким содержанием сиаловой кислоты является эффективным при лечении аллергии.
Экспериментальный пример 12. Подтверждение противоаллергической активности димера полипептида в соответствии с содержанием сиаловой кислоты в модели пищевой аллергии на животном: измерение концентрации MCPT-1 в крови
Сыворотку готовили путем отбора крови у мышей каждой группы через 2 дня после завершения эксперимента по пищевой аллергии. Для измерения концентрации MCPT-1 (протеазы-1 тучных клеток) в крови, использовали набор ELISA для MCPT-1 (Invitrogen) для выполнения процедуры в соответствии с протоколом производителя.
В частности, 96-луночный иммунизированный планшет был покрыт мышиным антителом против MCPT-1 и подвергнут реакции в течение ночи при температуре 4°C. На следующий день после промывки PBS, содержащим 0,05% Tween 20 (далее буфером для промывки), добавляли PBS, содержащий 1% BSA (бычьего сывороточного альбумина) (далее блокирующий буфер, разбавитель для анализа), и осуществляли реакцию в течение 1 часа. Впоследствии его промывали буфером для промывки, а затем MCPT-1, используемый в качестве стандартного раствора, и образцы сыворотки мышей разводили 1Х разбавителем для анализа, помещали в планшет, и проводили реакцию в течение 2 часов.
Через 2 часа добавляли меченное биотином мышиное антитело против MCPT-1, и осуществляли реакцию в течение 1 часа. После промывки буфером для промывки добавляли меченный HRP (пероксидазой хрена) авидин (Avidin-HRP) и оставляли реагировать на 30 минут. После промывки буфером для промывки добавляли раствор субстрата, который реагировал в течение 20 минут, блокируя свет, а затем добавляли стоп-раствор (1 М H2SO4) для остановки реакции. Впоследствии значение оптической плотности, исключая значение, измеренное при длине волны 570 нм, из значения, измеренного при длине волны 450 нм, определяли с помощью считывающего устройства для микропланшетов (Epoch Microplate Spectrophotometer), и рассчитывали концентрацию.
В результате в случае мышей группы 3, которым подкожно вводили PBS, рассчитанная концентрация MCPT-1 в крови составила приблизительно 4000 нг/мл. Кроме того, в случае мышей группы 2, которым подкожно вводили димер полипептида с низким содержанием сиаловой кислоты (SAнизкое), рассчитанная концентрация MCPT-1 в крови составила приблизительно 4200 нг/мл. С другой стороны, в случае мышей группы 1, которым подкожно вводили димер полипептида с высоким содержанием сиаловой кислоты (SAвысокое), рассчитанная концентрация MCPT-1 в крови составила приблизительно 2800 нг/мл, и наблюдалось значительное отличие от значений концентрации MCPT-1 в крови между мышами группы 2 и группы 3 (фиг. 14).
Пример 3. Получение димера полипептида с высоким содержанием сиаловой кислоты посредством очистки
Для подтверждения физических свойств димера полипептида в соответствии с содержанием сиаловой кислоты был получен димер полипептида, содержащий сиаловую кислоту в широком диапазоне. В частности, димер полипептида, полученный из линии клеток FcεRIαECD-Fc2+a2,6-ST, был очищен, используя аффинную хроматографию и анионообменную хроматографию.
Сначала раствор культуры клеток подвергали аффинной хроматографии для удаления первичных примесей из культурального раствора. Аффинную хроматографию выполняли с использованием предварительно упаковочной колонки Amsphere™ A3 (высота слоя=5 см, объем=5 мл), заполненной смолой Amsphere™ A3, и оборудования AKTA Avant 25, системы жидкостной хроматографии. Здесь ее выполняли с использованием 100 мМ глицина, pH 3,3 в качестве буфера для элюирования.
Впоследствии проводили анионообменную хроматографию с использованием Hiscreen QFF (высота слоя=10 см, объем=5 мл), заполненного смолой Q Sepharose Fast Flow, и оборудования AKTA Avant 25, системы жидкостной хроматографии. В качестве буфера для элюирования использовали 20 мМ фосфоцитратный буфер, pH 3,5. В этом случае концентрацию 20 мМ фосфоцитрата, pH 4,0, в качестве буфера для промывки доводили до получения димеров с различным содержанием сиаловой кислоты. Анализ содержания сиаловой кислоты проводили методом анализа, использованным в экспериментальном примере 7. Благодаря этому были получены димеры полипептидов с содержанием сиаловой кислоты, составляющим 7,0 моль/моль, 10,3 моль/моль, 12,9 моль/моль, 14,9 моль/моль и 21,4 моль/моль.
Экспериментальный пример 13. Фармакокинетический анализ димера полипептида в соответствии с содержанием сиаловой кислоты в модели на мыши
Для проведения фармакокинетического анализ в соответствии с содержанием сиаловой кислоты в димере полипептида, димеры полипептида с содержанием сиаловой кислоты, составляющим 7,0 моль/моль, 10,3 моль/моль, 12,9 моль/моль, 14,9 моль/моль и 21,4 моль/моль, полученные в примере 3, вводили подкожно мышам в концентрации 10 мг/кг, соответственно. Для анализа фармакокинетики димера полипептида кровь собирали в час 0, час 3, час 10, час 24, час 72, час 168 и час 240 после введения вещества и анализировали следующим образом.
Антитело против FcεRI (Invitrogen) разводили 1X PBS (Welgene) до концентрации 0,5 мкг/мл и добавляли в иммунопланшет (Thermo), и осуществляли реакцию в течение ночи в условиях 4°C. После завершения реакции иммунопланшет промывали 1X PBST, в каждую лунку добавляли раствор I-Block (Invitrogen), блокирующий раствор, и проводили реакцию при температуре окружающей среды в течение 1 часа. Во время блокировки были приготовлены стандартные и аналитические образцы. Димер полипептида разводили в 1% BSA/PBS, содержащем контрольную сыворотку мыши в концентрации от 0,19 нг/мл до 200 нг/мл, для приготовления стандартного вещества, и разведение 1/20-1/300 с использованием 1% BSA/PBS, содержащего контрольную сыворотку, также выполняли для приготовления аналитического образца.
После завершения блокирования планшет промывали 1X PBST, и подготовленные стандартные и аналитические образцы добавляли в каждую лунку, а затем проводили реакцию при температуре окружающей среды в течение 1 часа. Впоследствии его промывали 1X PBST, и добавляли антитело против человеческого IgG4, меченное HRP, (Southern biotech), разведенное до 1:10000, и затем проводили реакцию при температуре окружающей среды в течение 1 часа. После завершения реакции планшет промывали 1X PBST, и раствор TMB (Thermo) добавляли в каждую лунку, и осуществляли реакцию. Когда значение оптической плотности измеряли в диапазоне 0,8-1,0 при длине волны 650 нм с использованием считывающего устройства для микропланшетов (Molecular devices), в каждую лунку добавляли стоп-раствор (Sigma) для остановки реакции. После завершения реакции измеряли оптическую плотность в планшете при длине волны 450 нм в пределах 5 минут, и анализировали численные значения. Полученный фармакокинетический график и фармакокинетические параметры димера полипептида в соответствии с содержанием сиаловой кислоты представлены на фиг. 15 и табл. 7.
В результате, как показано в табл. 7, было подтверждено, что чем выше содержание сиаловой кислоты в димере полипептида, вводимого мыши, тем выше концентрация в крови.
Таблица 7
Экспериментальный пример 14. Подтверждение эффективности в соответствии с содержанием сиаловой кислоты в димере полипептида в модели пассивной системной анафилаксии на мыши
Для подтверждения разницы в противоаллергическом эффекте in vivo в соответствии с содержанием сиаловой кислоты в димере полипептида, метод, описанный в литературе, использовали для индукции пассивной системной анафилаксии (PSA) у мышей следующим образом (Methods and Protocols, Methods in Molecular Biology, vol. 1032, DOI 10.1007/978-1-62703-496-8_10). Известно, что тучные клетки активируются при индукции анафилаксии, а температура тела снижается при увеличении тучных клеток. При индукции PSA у мышей, используя этот метод, вводили димер полипептида с соответствующим содержанием сиаловой кислоты, а затем измеряли температуру тела для сравнения противоаллергического эффекта.
Температуру тела измеряли у мышей Balb/c со вставленным транспондером (Orient Bio), а затем внутрибрюшинно вводили 20 мкг антитела против DNP изотипа IgE (Sigma) с 0,9% NaCl, а затем димеры полипептидов с различным содержанием сиаловой кислоты, соответственно, вводили подкожно в дозе 10 мг/кг. Через 24 часа температуру тела мышей измеряли перед введением DNP-HAS (Sigma) с 0,9% NaCl, чужеродного антигена. Впоследствии внутривенно вводили 1 мг антигена. После введения температуру тела мышей измеряли с 10-минутным интервалом в течение 1 часа с помощью удаленного измерителя температуры тела (системы данных Bio medic). Результаты экспериментов представлены на фиг. 16.
В результате было подтверждено, что температура тела мышей была снижена в группах, которым вводили носитель и димер полипептида с содержанием сиаловой кислоты, составляющим 10,3 моль/моль, и температура тела мышей не снижалась в группах, которым вводили димер полипептида с содержанием сиаловой кислоты, составляющим 14,9 моль/моль или более. Благодаря этому было подтверждено, что димер полипептида с высоким содержанием сиаловой кислоты обладает превосходным эффектом ослабления индукции пассивной системной анафилаксии по сравнению с димером полипептида с низким содержанием сиаловой кислоты.
--->
<110> ДжиАй ИННОВЕЙШН, ИНК.
<120> ДИМЕР ПОЛИПЕПТИДА С ВЫСОКИМ СОДЕРЖАНИЕМ СИАЛОВОЙ КИСЛОТЫ,
ВКЛЮЧАЮЩЕГО ЭКСТРАКЛЕТОЧНЫЙ ДОМЕН АЛЬФА-СУБЪЕДИНИЦЫ РЕЦЕПТОРА
ДЛЯ FC-ОБЛАСТИ IGE, И СОДЕРЖАЩАЯ ЕГО ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ
<130> SPO20-022-PCT-GII
<150> KR 10-2019-0082217
<151> 2019-07-08
<160> 22
<170> KopatentIn 2.0
<210> 1
<211> 180
<212> Белок
<213> Искусственная последовательность
<220>
<223> FCeRI1 ECD
<400> 1
Val Pro Gln Lys Pro Lys Val Ser Leu Asn Pro Pro Trp Asn Arg Ile
1 5 10 15
Phe Lys Gly Glu Asn Val Thr Leu Thr Cys Asn Gly Asn Asn Phe Phe
20 25 30
Glu Val Ser Ser Thr Lys Trp Phe His Asn Gly Ser Leu Ser Glu Glu
35 40 45
Thr Asn Ser Ser Leu Asn Ile Val Asn Ala Lys Phe Glu Asp Ser Gly
50 55 60
Glu Tyr Lys Cys Gln His Gln Gln Val Asn Glu Ser Glu Pro Val Tyr
65 70 75 80
Leu Glu Val Phe Ser Asp Trp Leu Leu Leu Gln Ala Ser Ala Glu Val
85 90 95
Val Met Glu Gly Gln Pro Leu Phe Leu Arg Cys His Gly Trp Arg Asn
100 105 110
Trp Asp Val Tyr Lys Val Ile Tyr Tyr Lys Asp Gly Glu Ala Leu Lys
115 120 125
Tyr Trp Tyr Glu Asn His Asn Ile Ser Ile Thr Asn Ala Thr Val Glu
130 135 140
Asp Ser Gly Thr Tyr Tyr Cys Thr Gly Lys Val Trp Gln Leu Asp Tyr
145 150 155 160
Glu Ser Glu Pro Leu Asn Ile Thr Val Ile Lys Ala Pro Arg Glu Lys
165 170 175
Tyr Trp Leu Gln
180
<210> 2
<211> 215
<212> Белок
<213> Искусственная последовательность
<220>
<223> Модифицированная Fc-область
<400> 2
Ser His Thr Gln Pro Leu Gly Val Phe Leu Phe Pro Pro Lys Pro Lys
1 5 10 15
Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val
20 25 30
Asp Val Ser Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp
35 40 45
Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe
50 55 60
Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp
65 70 75 80
Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu
85 90 95
Pro Ser Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg
100 105 110
Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met Thr Lys
115 120 125
Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp
130 135 140
Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys
145 150 155 160
Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser
165 170 175
Arg Leu Thr Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val Phe Ser
180 185 190
Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser
195 200 205
Leu Ser Leu Ser Leu Gly Lys
210 215
<210> 3
<211> 30
<212> Белок
<213> Искусственная последовательность
<220>
<223> Вариант шарнирной области IgD
<400> 3
Arg Asn Thr Gly Arg Gly Gly Glu Glu Lys Lys Gly Ser Lys Glu Lys
1 5 10 15
Glu Glu Gln Glu Glu Arg Glu Thr Lys Thr Pro Glu Cys Pro
20 25 30
<210> 4
<211> 49
<212> Белок
<213> Искусственная последовательность
<220>
<223> Вариант шарнирной области IgD
<400> 4
Ala Gln Pro Gln Ala Glu Gly Ser Leu Ala Lys Ala Thr Thr Ala Pro
1 5 10 15
Ala Thr Thr Arg Asn Thr Gly Arg Gly Gly Glu Glu Lys Lys Gly Ser
20 25 30
Lys Glu Lys Glu Glu Gln Glu Glu Arg Glu Thr Lys Thr Pro Glu Cys
35 40 45
Pro
<210> 5
<211> 540
<212> ДНК
<213> Искусственная последовательность
<220>
<223> нуклеотидная последовательность FCeRI1 ECD
<400> 5
gtgccccaga agcccaaggt gagcctgaac cctccctgga acagaatctt caagggcgag 60
aacgtgaccc tgacctgcaa cggcaacaac ttcttcgagg tgagcagcac caagtggttc 120
cacaatggca gcctgagcga ggagaccaac agctccctga acatcgtgaa cgccaagttc 180
gaggacagcg gcgagtacaa gtgccagcac cagcaggtga acgagagcga gcccgtgtac 240
ctggaggtgt tcagcgactg gctgctgctg caggccagcg ccgaggtggt gatggagggc 300
cagcccctgt tcctgagatg ccacggctgg agaaactggg acgtgtacaa ggtgatctac 360
tacaaggatg gcgaggccct gaagtactgg tacgagaacc acaacatctc catcaccaac 420
gccaccgtgg aggacagcgg cacctactac tgcacaggca aggtgtggca gctggactac 480
gagagcgagc ccctgaacat caccgtgatc aaggctccca gagagaagta ctggctgcag 540
540
<210> 6
<211> 561
<212> ДНК
<213> Искусственная последовательность
<220>
<223> нуклеотидная последовательность модифицированной Fc-области
<400> 6
tgcgtggtcg tggatgtgag ccaggaagat cccgaagtgc agttcaactg gtacgtggat 60
ggcgtggaag tgcacaacgc caagaccaag cccagagaag agcagttcaa ctccacctac 120
agagtggtga gcgtgctgac cgtgctgcac caggactggc tgaacggcaa ggagtacaag 180
tgcaaggtgt ccaacaaagg cctgcccagc tccatcgaga agaccatcag caaagccaaa 240
ggccagccca gagaacccca ggtgtacacc ctgcctccca gccaggaaga gatgaccaag 300
aaccaggtgt ccctgacctg cctggtgaaa ggcttctacc ccagcgacat cgccgtggag 360
tgggaaagca acggccagcc cgagaacaat tacaagacaa cccctcccgt gctggatagc 420
gatggcagct tctttctgta cagcagactg accgtggaca agagcagatg gcaggaaggc 480
aacgtgttca gctgcagcgt gatgcacgaa gccctgcaca accactacac ccagaagagc 540
ctgtccctga gcctgggcaa g 561
<210> 7
<211> 174
<212> ДНК
<213> Искусственная последовательность
<220>
<223> нуклеотидная последовательность варианта шарнирной области IgD
<400> 7
aggaacaccg gcagaggagg cgaggaaaag aaaggaagca aggagaagga ggagcaggag 60
gaaagagaaa ccaagacccc cgagtgcccc agccacaccc agcccctggg cgtgttcctg 120
ttccccccca agcccaagga caccctgatg atcagcagaa cccccgaggt gacc 174
<210> 8
<211> 231
<212> ДНК
<213> Искусственная последовательность
<220>
<223> нуклеотидная последовательность варианта шарнирной области IgD
<400> 8
gcccagcccc aggccgaggg cagcctggct aaggccacca cagctcccgc caccaccagg 60
aacaccggca gaggaggcga ggaaaagaaa ggaagcaagg agaaggagga gcaggaggaa 120
agagaaacca agacccccga gtgccccagc cacacccagc ccctgggcgt gttcctgttc 180
ccccccaagc ccaaggacac cctgatgatc agcagaaccc ccgaggtgac c 231
<210> 9
<211> 25
<212> Белок
<213> Искусственная последовательность
<220>
<223> сигнальный пептид
<400> 9
Met Asp Ala Met Leu Arg Gly Leu Cys Cys Val Leu Leu Leu Cys Gly
1 5 10 15
Ala Val Phe Val Ser Pro Ser His Ala
20 25
<210> 10
<211> 75
<212> ДНК
<213> Искусственная последовательность
<220>
<223> нуклеотидная последовательность сигнального пептида
<400> 10
atggacgcca tgctgagagg cctgtgctgt gtgctgctgc tgtgcggcgc cgtgttcgtg 60
tcccctagcc acgcc 75
<210> 11
<211> 450
<212> Белок
<213> Искусственная последовательность
<220>
<223> FceRIa ECD-шарнирная область-Fc2
<400> 11
Met Asp Ala Met Leu Arg Gly Leu Cys Cys Val Leu Leu Leu Cys Gly
1 5 10 15
Ala Val Phe Val Ser Pro Ser His Ala Val Pro Gln Lys Pro Lys Val
20 25 30
Ser Leu Asn Pro Pro Trp Asn Arg Ile Phe Lys Gly Glu Asn Val Thr
35 40 45
Leu Thr Cys Asn Gly Asn Asn Phe Phe Glu Val Ser Ser Thr Lys Trp
50 55 60
Phe His Asn Gly Ser Leu Ser Glu Glu Thr Asn Ser Ser Leu Asn Ile
65 70 75 80
Val Asn Ala Lys Phe Glu Asp Ser Gly Glu Tyr Lys Cys Gln His Gln
85 90 95
Gln Val Asn Glu Ser Glu Pro Val Tyr Leu Glu Val Phe Ser Asp Trp
100 105 110
Leu Leu Leu Gln Ala Ser Ala Glu Val Val Met Glu Gly Gln Pro Leu
115 120 125
Phe Leu Arg Cys His Gly Trp Arg Asn Trp Asp Val Tyr Lys Val Ile
130 135 140
Tyr Tyr Lys Asp Gly Glu Ala Leu Lys Tyr Trp Tyr Glu Asn His Asn
145 150 155 160
Ile Ser Ile Thr Asn Ala Thr Val Glu Asp Ser Gly Thr Tyr Tyr Cys
165 170 175
Thr Gly Lys Val Trp Gln Leu Asp Tyr Glu Ser Glu Pro Leu Asn Ile
180 185 190
Thr Val Ile Lys Ala Pro Arg Glu Lys Tyr Trp Leu Gln Arg Asn Thr
195 200 205
Gly Arg Gly Gly Glu Glu Lys Lys Gly Ser Lys Glu Lys Glu Glu Gln
210 215 220
Glu Glu Arg Glu Thr Lys Thr Pro Glu Cys Pro Ser His Thr Gln Pro
225 230 235 240
Leu Gly Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile
245 250 255
Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser Gln Glu
260 265 270
Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp Gly Val Glu Val His
275 280 285
Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser Thr Tyr Arg
290 295 300
Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys
305 310 315 320
Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu Pro Ser Ser Ile Glu
325 330 335
Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr
340 345 350
Thr Leu Pro Pro Ser Gln Glu Glu Met Thr Lys Asn Gln Val Ser Leu
355 360 365
Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp
370 375 380
Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val
385 390 395 400
Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu Thr Val Asp
405 410 415
Lys Ser Arg Trp Gln Glu Gly Asn Val Phe Ser Cys Ser Val Met His
420 425 430
Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Leu
435 440 445
Gly Lys
450
<210> 12
<211> 1350
<212> ДНК
<213> Искусственная последовательность
<220>
<223> нуклеотидная последовательность FceRIa ECD-шарнирная область-Fc2
<400> 12
atggacgcca tgctgagagg cctgtgctgt gtgctgctgc tgtgcggcgc cgtgttcgtg 60
tcccctagcc acgccgtgcc ccagaagccc aaggtgagcc tgaaccctcc ctggaacaga 120
atcttcaagg gcgagaacgt gaccctgacc tgcaacggca acaacttctt cgaggtgagc 180
agcaccaagt ggttccacaa tggcagcctg agcgaggaga ccaacagctc cctgaacatc 240
gtgaacgcca agttcgagga cagcggcgag tacaagtgcc agcaccagca ggtgaacgag 300
agcgagcccg tgtacctgga ggtgttcagc gactggctgc tgctgcaggc cagcgccgag 360
gtggtgatgg agggccagcc cctgttcctg agatgccacg gctggagaaa ctgggacgtg 420
tacaaggtga tctactacaa ggatggcgag gccctgaagt actggtacga gaaccacaac 480
atctccatca ccaacgccac cgtggaggac agcggcacct actactgcac aggcaaggtg 540
tggcagctgg actacgagag cgagcccctg aacatcaccg tgatcaaggc tcccagagag 600
aagtactggc tgcagaggaa caccggcaga ggaggcgagg aaaagaaagg aagcaaggag 660
aaggaggagc aggaggaaag agaaaccaag acccccgagt gccccagcca cacccagccc 720
ctgggcgtgt tcctgttccc ccccaagccc aaggacaccc tgatgatcag cagaaccccc 780
gaggtgacct gcgtggtcgt ggatgtgagc caggaagatc ccgaagtgca gttcaactgg 840
tacgtggatg gcgtggaagt gcacaacgcc aagaccaagc ccagagaaga gcagttcaac 900
tccacctaca gagtggtgag cgtgctgacc gtgctgcacc aggactggct gaacggcaag 960
gagtacaagt gcaaggtgtc caacaaaggc ctgcccagct ccatcgagaa gaccatcagc 1020
aaagccaaag gccagcccag agaaccccag gtgtacaccc tgcctcccag ccaggaagag 1080
atgaccaaga accaggtgtc cctgacctgc ctggtgaaag gcttctaccc cagcgacatc 1140
gccgtggagt gggaaagcaa cggccagccc gagaacaatt acaagacaac ccctcccgtg 1200
ctggatagcg atggcagctt ctttctgtac agcagactga ccgtggacaa gagcagatgg 1260
caggaaggca acgtgttcag ctgcagcgtg atgcacgaag ccctgcacaa ccactacacc 1320
cagaagagcc tgtccctgag cctgggcaag 1350
<210> 13
<211> 469
<212> Белок
<213> Искусственная последовательность
<220>
<223> FceRIa ECD-шарнирная область-Fc3
<400> 13
Met Asp Ala Met Leu Arg Gly Leu Cys Cys Val Leu Leu Leu Cys Gly
1 5 10 15
Ala Val Phe Val Ser Pro Ser His Ala Val Pro Gln Lys Pro Lys Val
20 25 30
Ser Leu Asn Pro Pro Trp Asn Arg Ile Phe Lys Gly Glu Asn Val Thr
35 40 45
Leu Thr Cys Asn Gly Asn Asn Phe Phe Glu Val Ser Ser Thr Lys Trp
50 55 60
Phe His Asn Gly Ser Leu Ser Glu Glu Thr Asn Ser Ser Leu Asn Ile
65 70 75 80
Val Asn Ala Lys Phe Glu Asp Ser Gly Glu Tyr Lys Cys Gln His Gln
85 90 95
Gln Val Asn Glu Ser Glu Pro Val Tyr Leu Glu Val Phe Ser Asp Trp
100 105 110
Leu Leu Leu Gln Ala Ser Ala Glu Val Val Met Glu Gly Gln Pro Leu
115 120 125
Phe Leu Arg Cys His Gly Trp Arg Asn Trp Asp Val Tyr Lys Val Ile
130 135 140
Tyr Tyr Lys Asp Gly Glu Ala Leu Lys Tyr Trp Tyr Glu Asn His Asn
145 150 155 160
Ile Ser Ile Thr Asn Ala Thr Val Glu Asp Ser Gly Thr Tyr Tyr Cys
165 170 175
Thr Gly Lys Val Trp Gln Leu Asp Tyr Glu Ser Glu Pro Leu Asn Ile
180 185 190
Thr Val Ile Lys Ala Pro Arg Glu Lys Tyr Trp Leu Gln Ala Gln Pro
195 200 205
Gln Ala Glu Gly Ser Leu Ala Lys Ala Thr Thr Ala Pro Ala Thr Thr
210 215 220
Arg Asn Thr Gly Arg Gly Gly Glu Glu Lys Lys Gly Ser Lys Glu Lys
225 230 235 240
Glu Glu Gln Glu Glu Arg Glu Thr Lys Thr Pro Glu Cys Pro Ser His
245 250 255
Thr Gln Pro Leu Gly Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr
260 265 270
Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val
275 280 285
Ser Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp Gly Val
290 295 300
Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser
305 310 315 320
Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu
325 330 335
Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu Pro Ser
340 345 350
Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro
355 360 365
Gln Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met Thr Lys Asn Gln
370 375 380
Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala
385 390 395 400
Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr
405 410 415
Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu
420 425 430
Thr Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val Phe Ser Cys Ser
435 440 445
Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser
450 455 460
Leu Ser Leu Gly Lys
465
<210> 14
<211> 1407
<212> ДНК
<213> Искусственная последовательность
<220>
<223> нуклеотидная последовательность FceRIa ECD-шарнирная область-Fc3
<400> 14
atggacgcca tgctgagagg cctgtgctgt gtgctgctgc tgtgcggcgc cgtgttcgtg 60
tcccctagcc acgccgtgcc ccagaagccc aaggtgagcc tgaaccctcc ctggaacaga 120
atcttcaagg gcgagaacgt gaccctgacc tgcaacggca acaacttctt cgaggtgagc 180
agcaccaagt ggttccacaa tggcagcctg agcgaggaga ccaacagctc cctgaacatc 240
gtgaacgcca agttcgagga cagcggcgag tacaagtgcc agcaccagca ggtgaacgag 300
agcgagcccg tgtacctgga ggtgttcagc gactggctgc tgctgcaggc cagcgccgag 360
gtggtgatgg agggccagcc cctgttcctg agatgccacg gctggagaaa ctgggacgtg 420
tacaaggtga tctactacaa ggatggcgag gccctgaagt actggtacga gaaccacaac 480
atctccatca ccaacgccac cgtggaggac agcggcacct actactgcac aggcaaggtg 540
tggcagctgg actacgagag cgagcccctg aacatcaccg tgatcaaggc tcccagagag 600
aagtactggc tgcaggccca gccccaggcc gagggcagcc tggctaaggc caccacagct 660
cccgccacca ccaggaacac cggcagagga ggcgaggaaa agaaaggaag caaggagaag 720
gaggagcagg aggaaagaga aaccaagacc cccgagtgcc ccagccacac ccagcccctg 780
ggcgtgttcc tgttcccccc caagcccaag gacaccctga tgatcagcag aacccccgag 840
gtgacctgcg tggtcgtgga tgtgagccag gaagatcccg aagtgcagtt caactggtac 900
gtggatggcg tggaagtgca caacgccaag accaagccca gagaagagca gttcaactcc 960
acctacagag tggtgagcgt gctgaccgtg ctgcaccagg actggctgaa cggcaaggag 1020
tacaagtgca aggtgtccaa caaaggcctg cccagctcca tcgagaagac catcagcaaa 1080
gccaaaggcc agcccagaga accccaggtg tacaccctgc ctcccagcca ggaagagatg 1140
accaagaacc aggtgtccct gacctgcctg gtgaaaggct tctaccccag cgacatcgcc 1200
gtggagtggg aaagcaacgg ccagcccgag aacaattaca agacaacccc tcccgtgctg 1260
gatagcgatg gcagcttctt tctgtacagc agactgaccg tggacaagag cagatggcag 1320
gaaggcaacg tgttcagctg cagcgtgatg cacgaagccc tgcacaacca ctacacccag 1380
aagagcctgt ccctgagcct gggcaag 1407
<210> 15
<211> 406
<212> Белок
<213> Искусственная последовательность
<220>
<223> a-2,6-сиалилтрансфераза человека
<400> 15
Met Ile His Thr Asn Leu Lys Lys Lys Phe Ser Cys Cys Val Leu Val
1 5 10 15
Phe Leu Leu Phe Ala Val Ile Cys Val Trp Lys Glu Lys Lys Lys Gly
20 25 30
Ser Tyr Tyr Asp Ser Phe Lys Leu Gln Thr Lys Glu Phe Gln Val Leu
35 40 45
Lys Ser Leu Gly Lys Leu Ala Met Gly Ser Asp Ser Gln Ser Val Ser
50 55 60
Ser Ser Ser Thr Gln Asp Pro His Arg Gly Arg Gln Thr Leu Gly Ser
65 70 75 80
Leu Arg Gly Leu Ala Lys Ala Lys Pro Glu Ala Ser Phe Gln Val Trp
85 90 95
Asn Lys Asp Ser Ser Ser Lys Asn Leu Ile Pro Arg Leu Gln Lys Ile
100 105 110
Trp Lys Asn Tyr Leu Ser Met Asn Lys Tyr Lys Val Ser Tyr Lys Gly
115 120 125
Pro Gly Pro Gly Ile Lys Phe Ser Ala Glu Ala Leu Arg Cys His Leu
130 135 140
Arg Asp His Val Asn Val Ser Met Val Glu Val Thr Asp Phe Pro Phe
145 150 155 160
Asn Thr Ser Glu Trp Glu Gly Tyr Leu Pro Lys Glu Ser Ile Arg Thr
165 170 175
Lys Ala Gly Pro Trp Gly Arg Cys Ala Val Val Ser Ser Ala Gly Ser
180 185 190
Leu Lys Ser Ser Gln Leu Gly Arg Glu Ile Asp Asp His Asp Ala Val
195 200 205
Leu Arg Phe Asn Gly Ala Pro Thr Ala Asn Phe Gln Gln Asp Val Gly
210 215 220
Thr Lys Thr Thr Ile Arg Leu Met Asn Ser Gln Leu Val Thr Thr Glu
225 230 235 240
Lys Arg Phe Leu Lys Asp Ser Leu Tyr Asn Glu Gly Ile Leu Ile Val
245 250 255
Trp Asp Pro Ser Val Tyr His Ser Asp Ile Pro Lys Trp Tyr Gln Asn
260 265 270
Pro Asp Tyr Asn Phe Phe Asn Asn Tyr Lys Thr Tyr Arg Lys Leu His
275 280 285
Pro Asn Gln Pro Phe Tyr Ile Leu Lys Pro Gln Met Pro Trp Glu Leu
290 295 300
Trp Asp Ile Leu Gln Glu Ile Ser Pro Glu Glu Ile Gln Pro Asn Pro
305 310 315 320
Pro Ser Ser Gly Met Leu Gly Ile Ile Ile Met Met Thr Leu Cys Asp
325 330 335
Gln Val Asp Ile Tyr Glu Phe Leu Pro Ser Lys Arg Lys Thr Asp Val
340 345 350
Cys Tyr Tyr Tyr Gln Lys Phe Phe Asp Ser Ala Cys Thr Met Gly Ala
355 360 365
Tyr His Pro Leu Leu Tyr Glu Lys Asn Leu Val Lys His Leu Asn Gln
370 375 380
Gly Thr Asp Glu Asp Ile Tyr Leu Leu Gly Lys Ala Thr Leu Pro Gly
385 390 395 400
Phe Arg Thr Ile His Cys
405
<210> 16
<211> 1218
<212> ДНК
<213> Искусственная последовательность
<220>
<223> нуклеотидная последовательность a-2,6-сиалилтрансферазы человека
<400> 16
atgatccaca ccaacctgaa gaagaagttc agctgctgcg tgctggtgtt cctgctgttc 60
gccgtgatct gcgtgtggaa ggagaagaag aaaggcagct actacgacag cttcaagctg 120
cagaccaagg agttccaggt gctgaagagc ctgggcaagc tggccatggg cagcgacagc 180
cagagcgtgt ccagctcctc cacccaggat ccccacagag gcagacagac cctgggcagc 240
ctgagaggcc tggccaaggc caagcccgag gccagcttcc aggtgtggaa caaggacagc 300
agcagcaaga acctgatccc cagactgcag aagatctgga agaactacct gagcatgaac 360
aagtacaagg tgagctacaa aggacccgga cccggcatca agttcagcgc cgaggccctg 420
aggtgccacc tgagagacca cgtgaacgtg agcatggtgg aagtgaccga cttccccttc 480
aacaccagcg agtgggaagg ctacctgccc aaggagagca tcaggaccaa ggctggcccc 540
tggggcagat gcgccgtggt gagcagcgct ggcagcctga agagctccca gctgggcaga 600
gagatcgacg accacgatgc cgtgctgagg ttcaatggcg ctcccaccgc caacttccag 660
caggacgtgg gcaccaagac cacaatccgg ctgatgaaca gccagctggt gacaaccgag 720
aagcggttcc tgaaggacag cctgtacaac gagggcatcc tgatcgtgtg ggatcccagc 780
gtgtaccaca gcgacatccc caagtggtac cagaatcccg actacaactt cttcaacaac 840
tacaagacct atagaaagct gcaccccaac cagcccttct acatcctgaa gccccagatg 900
ccctgggagc tgtgggacat cctgcaggag atcagccctg aagagatcca gcccaaccct 960
ccctccagcg gcatgctggg cattatcatc atgatgaccc tgtgcgacca ggtggacatc 1020
tacgagttcc tgcccagcaa gagaaagacc gacgtgtgct actactatca gaagttcttc 1080
gacagcgcct gcaccatggg cgcctaccac cccctgctgt acgagaagaa cctggtgaag 1140
cacctgaacc agggcaccga cgaggacatc tacctgctgg gcaaagccac cctgcccggc 1200
ttcagaacca tccactgc 1218
<210> 17
<211> 30
<212> Белок
<213> Искусственная последовательность
<220>
<223> вариант шарнирной области IgD
<400> 17
Arg Asn Thr Gly Arg Gly Gly Glu Glu Lys Lys Xaa Xaa Lys Glu Lys
1 5 10 15
Glu Glu Gln Glu Glu Arg Glu Thr Lys Thr Pro Glu Cys Pro
20 25 30
<210> 18
<211> 49
<212> Белок
<213> Искусственная последовательность
<220>
<223> вариант шарнирной области IgD
<400> 18
Ala Gln Pro Gln Ala Glu Gly Ser Leu Ala Lys Ala Thr Thr Ala Pro
1 5 10 15
Ala Thr Thr Arg Asn Thr Gly Arg Gly Gly Glu Glu Lys Lys Xaa Xaa
20 25 30
Lys Glu Lys Glu Glu Gln Glu Glu Arg Glu Thr Lys Thr Pro Glu Cys
35 40 45
Pro
<210> 19
<211> 30
<212> Белок
<213> Искусственная последовательность
<220>
<223> шарнирная область IgD
<400> 19
Arg Asn Thr Gly Arg Gly Gly Glu Glu Lys Lys Lys Glu Lys Glu Lys
1 5 10 15
Glu Glu Gln Glu Glu Arg Glu Thr Lys Thr Pro Glu Cys Pro
20 25 30
<210> 20
<211> 425
<212> Белок
<213> Искусственная последовательность
<220>
<223> FceRIa ECD-шарнирная область-Fc1
<400> 20
Val Pro Gln Lys Pro Lys Val Ser Leu Asn Pro Pro Trp Asn Arg Ile
1 5 10 15
Phe Lys Gly Glu Asn Val Thr Leu Thr Cys Asn Gly Asn Asn Phe Phe
20 25 30
Glu Val Ser Ser Thr Lys Trp Phe His Asn Gly Ser Leu Ser Glu Glu
35 40 45
Thr Asn Ser Ser Leu Asn Ile Val Asn Ala Lys Phe Glu Asp Ser Gly
50 55 60
Glu Tyr Lys Cys Gln His Gln Gln Val Asn Glu Ser Glu Pro Val Tyr
65 70 75 80
Leu Glu Val Phe Ser Asp Trp Leu Leu Leu Gln Ala Ser Ala Glu Val
85 90 95
Val Met Glu Gly Gln Pro Leu Phe Leu Arg Cys His Gly Trp Arg Asn
100 105 110
Trp Asp Val Tyr Lys Val Ile Tyr Tyr Lys Asp Gly Glu Ala Leu Lys
115 120 125
Tyr Trp Tyr Glu Asn His Asn Ile Ser Ile Thr Asn Ala Thr Val Glu
130 135 140
Asp Ser Gly Thr Tyr Tyr Cys Thr Gly Lys Val Trp Gln Leu Asp Tyr
145 150 155 160
Glu Ser Glu Pro Leu Asn Ile Thr Val Ile Lys Ala Pro Arg Glu Lys
165 170 175
Tyr Trp Leu Gln Arg Asn Thr Gly Arg Gly Gly Glu Glu Lys Lys Lys
180 185 190
Glu Lys Glu Lys Glu Glu Gln Glu Glu Arg Glu Thr Lys Thr Pro Glu
195 200 205
Cys Pro Ser His Thr Gln Pro Leu Gly Val Phe Leu Phe Pro Pro Lys
210 215 220
Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val
225 230 235 240
Val Val Asp Val Ser Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr
245 250 255
Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu
260 265 270
Gln Phe Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His
275 280 285
Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys
290 295 300
Gly Leu Pro Ser Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln
305 310 315 320
Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met
325 330 335
Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro
340 345 350
Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn
355 360 365
Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu
370 375 380
Tyr Ser Arg Leu Thr Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val
385 390 395 400
Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln
405 410 415
Lys Ser Leu Ser Leu Ser Leu Gly Lys
420 425
<210> 21
<211> 425
<212> Белок
<213> Искусственная последовательность
<220>
<223> FceRIa ECD-шарнирная область-Fc2
<400> 21
Val Pro Gln Lys Pro Lys Val Ser Leu Asn Pro Pro Trp Asn Arg Ile
1 5 10 15
Phe Lys Gly Glu Asn Val Thr Leu Thr Cys Asn Gly Asn Asn Phe Phe
20 25 30
Glu Val Ser Ser Thr Lys Trp Phe His Asn Gly Ser Leu Ser Glu Glu
35 40 45
Thr Asn Ser Ser Leu Asn Ile Val Asn Ala Lys Phe Glu Asp Ser Gly
50 55 60
Glu Tyr Lys Cys Gln His Gln Gln Val Asn Glu Ser Glu Pro Val Tyr
65 70 75 80
Leu Glu Val Phe Ser Asp Trp Leu Leu Leu Gln Ala Ser Ala Glu Val
85 90 95
Val Met Glu Gly Gln Pro Leu Phe Leu Arg Cys His Gly Trp Arg Asn
100 105 110
Trp Asp Val Tyr Lys Val Ile Tyr Tyr Lys Asp Gly Glu Ala Leu Lys
115 120 125
Tyr Trp Tyr Glu Asn His Asn Ile Ser Ile Thr Asn Ala Thr Val Glu
130 135 140
Asp Ser Gly Thr Tyr Tyr Cys Thr Gly Lys Val Trp Gln Leu Asp Tyr
145 150 155 160
Glu Ser Glu Pro Leu Asn Ile Thr Val Ile Lys Ala Pro Arg Glu Lys
165 170 175
Tyr Trp Leu Gln Arg Asn Thr Gly Arg Gly Gly Glu Glu Lys Lys Gly
180 185 190
Ser Lys Glu Lys Glu Glu Gln Glu Glu Arg Glu Thr Lys Thr Pro Glu
195 200 205
Cys Pro Ser His Thr Gln Pro Leu Gly Val Phe Leu Phe Pro Pro Lys
210 215 220
Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val
225 230 235 240
Val Val Asp Val Ser Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr
245 250 255
Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu
260 265 270
Gln Phe Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His
275 280 285
Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys
290 295 300
Gly Leu Pro Ser Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln
305 310 315 320
Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met
325 330 335
Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro
340 345 350
Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn
355 360 365
Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu
370 375 380
Tyr Ser Arg Leu Thr Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val
385 390 395 400
Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln
405 410 415
Lys Ser Leu Ser Leu Ser Leu Gly Lys
420 425
<210> 22
<211> 444
<212> Белок
<213> Искусственная последовательность
<220>
<223> FceRIa ECD-шарнирная область-Fc3
<400> 22
Val Pro Gln Lys Pro Lys Val Ser Leu Asn Pro Pro Trp Asn Arg Ile
1 5 10 15
Phe Lys Gly Glu Asn Val Thr Leu Thr Cys Asn Gly Asn Asn Phe Phe
20 25 30
Glu Val Ser Ser Thr Lys Trp Phe His Asn Gly Ser Leu Ser Glu Glu
35 40 45
Thr Asn Ser Ser Leu Asn Ile Val Asn Ala Lys Phe Glu Asp Ser Gly
50 55 60
Glu Tyr Lys Cys Gln His Gln Gln Val Asn Glu Ser Glu Pro Val Tyr
65 70 75 80
Leu Glu Val Phe Ser Asp Trp Leu Leu Leu Gln Ala Ser Ala Glu Val
85 90 95
Val Met Glu Gly Gln Pro Leu Phe Leu Arg Cys His Gly Trp Arg Asn
100 105 110
Trp Asp Val Tyr Lys Val Ile Tyr Tyr Lys Asp Gly Glu Ala Leu Lys
115 120 125
Tyr Trp Tyr Glu Asn His Asn Ile Ser Ile Thr Asn Ala Thr Val Glu
130 135 140
Asp Ser Gly Thr Tyr Tyr Cys Thr Gly Lys Val Trp Gln Leu Asp Tyr
145 150 155 160
Glu Ser Glu Pro Leu Asn Ile Thr Val Ile Lys Ala Pro Arg Glu Lys
165 170 175
Tyr Trp Leu Gln Ala Gln Pro Gln Ala Glu Gly Ser Leu Ala Lys Ala
180 185 190
Thr Thr Ala Pro Ala Thr Thr Arg Asn Thr Gly Arg Gly Gly Glu Glu
195 200 205
Lys Lys Gly Ser Lys Glu Lys Glu Glu Gln Glu Glu Arg Glu Thr Lys
210 215 220
Thr Pro Glu Cys Pro Ser His Thr Gln Pro Leu Gly Val Phe Leu Phe
225 230 235 240
Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val
245 250 255
Thr Cys Val Val Val Asp Val Ser Gln Glu Asp Pro Glu Val Gln Phe
260 265 270
Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro
275 280 285
Arg Glu Glu Gln Phe Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr
290 295 300
Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val
305 310 315 320
Ser Asn Lys Gly Leu Pro Ser Ser Ile Glu Lys Thr Ile Ser Lys Ala
325 330 335
Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Gln
340 345 350
Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly
355 360 365
Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro
370 375 380
Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser
385 390 395 400
Phe Phe Leu Tyr Ser Arg Leu Thr Val Asp Lys Ser Arg Trp Gln Glu
405 410 415
Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His
420 425 430
Tyr Thr Gln Lys Ser Leu Ser Leu Ser Leu Gly Lys
435 440
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| ВНЕКЛЕТОЧНЫЙ ДОМЕН АЛЬФА-СУБЪЕДИНИЦЫ FC-РЕЦЕПТОРА IGE, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, СОДЕРЖАЩАЯ ЕГО, И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2019 |
|
RU2796162C2 |
| КОМПОЗИЦИЯ, СОДЕРЖАЩАЯ ПРОБИОТИКИ И ПОЛИПЕПТИД, ОБЛАДАЮЩИЙ АФФИННОСТЬЮ СВЯЗЫВАНИЯ В ОТНОШЕНИИ IGE, И ЕЕ ПРИМЕНЕНИЕ | 2019 |
|
RU2786578C2 |
| САЙТ-СПЕЦИФИЧЕСКАЯ КОНЪЮГАЦИЯ АНТИТЕЛО-ЛЕКАРСТВЕННОЕ СРЕДСТВО ПОСРЕДСТВОМ ГЛИКОИНЖЕНЕРИИ | 2014 |
|
RU2831409C2 |
| СЛИТЫЙ БЕЛОК GDF15 ДЛИТЕЛЬНОГО ДЕЙСТВИЯ И СОДЕРЖАЩАЯ ЕГО ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 2020 |
|
RU2836280C1 |
| КОНСТРУКЦИИ, ИМЕЮЩИЕ SIRP-АЛЬФА ДОМЕН ИЛИ ЕГО ВАРИАНТ | 2016 |
|
RU2740672C2 |
| ВАРИАНТЫ FC-ОБЛАСТИ С ИЗМЕНЕННЫМ СВЯЗЫВАНИЕМ С НЕОНАТАЛЬНЫМ FC-РЕЦЕПТОРОМ (FCRN) ДЛЯ ПРИМЕНЕНИЯ В ВЕТЕРИНАРИИ | 2019 |
|
RU2830231C2 |
| СРЕДСТВА НА ОСНОВЕ КОНСТАНТНОЙ ОБЛАСТИ ИММУНОГЛОБУЛИНА, СВЯЗЫВАЮЩИЕ Fc-РЕЦЕПТОР | 2008 |
|
RU2729829C2 |
| СЛИТАЯ С Fc α-ЦЕПЬ ВЫСОКОАФФИННОГО РЕЦЕПТОРА IgE | 2016 |
|
RU2715606C2 |
| СЛИТЫЕ СЕРПИНОВЫЕ ПОЛИПЕПТИДЫ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2012 |
|
RU2698655C2 |
| СЛИТЫЕ СЕРПИНОВЫЕ ПОЛИПЕПТИДЫ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2019 |
|
RU2728861C1 |

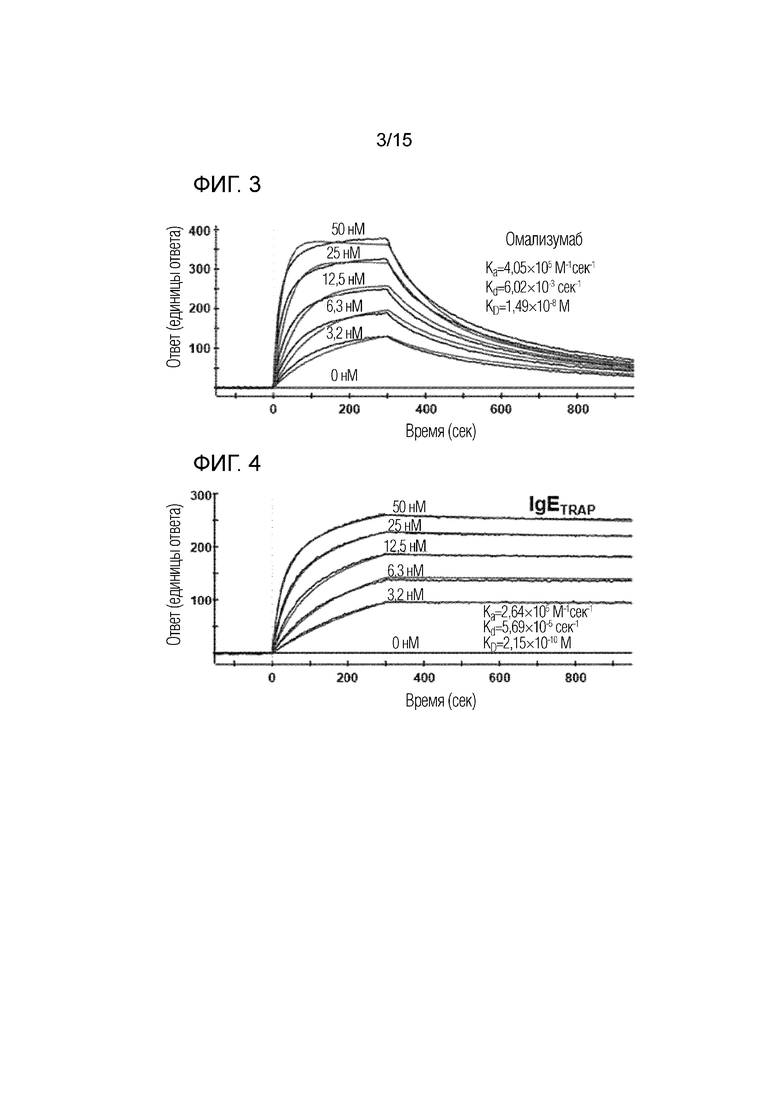
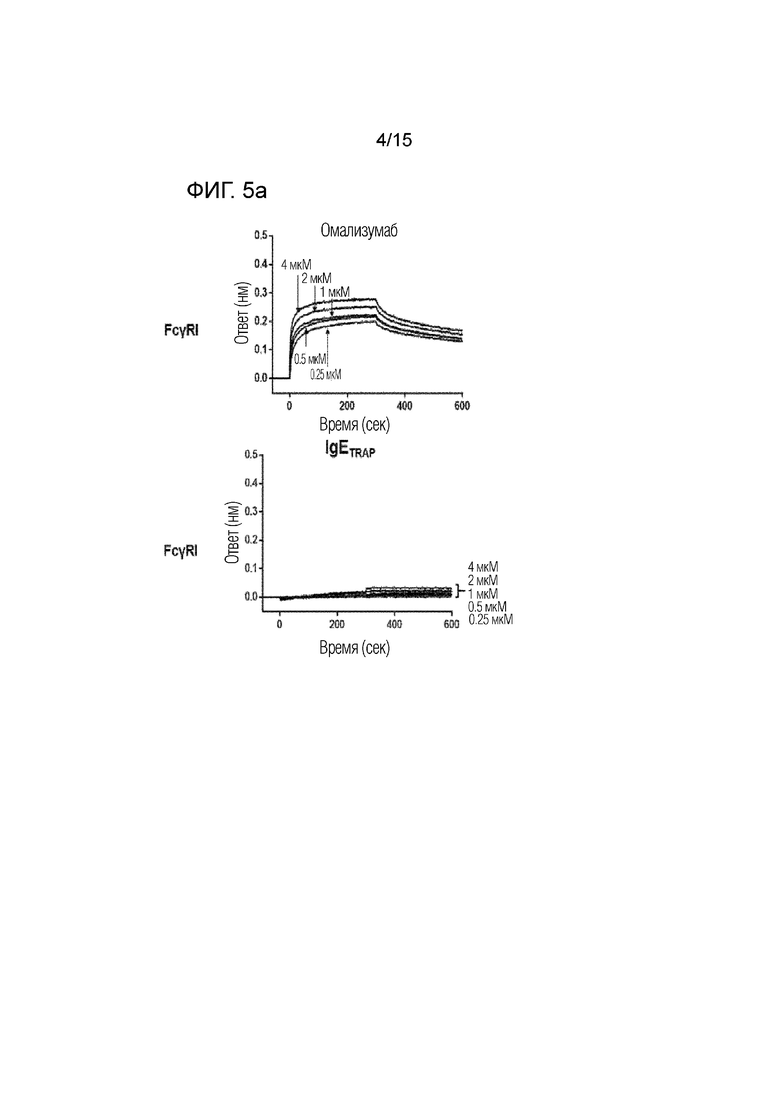
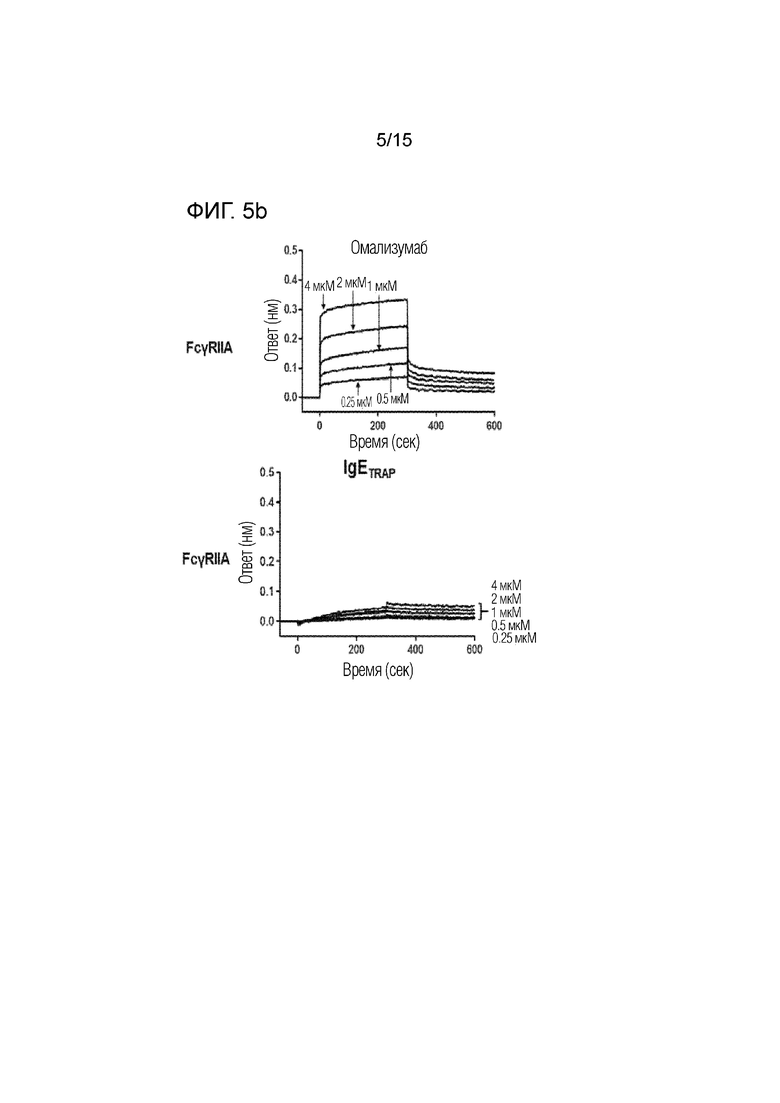
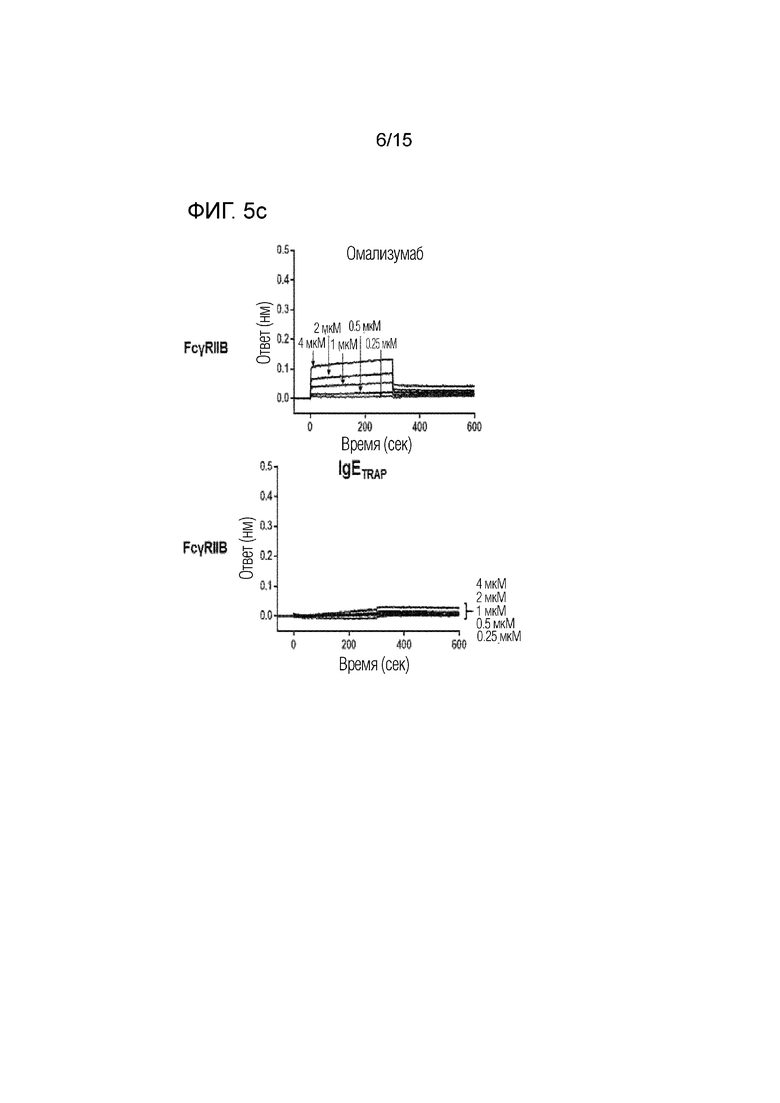
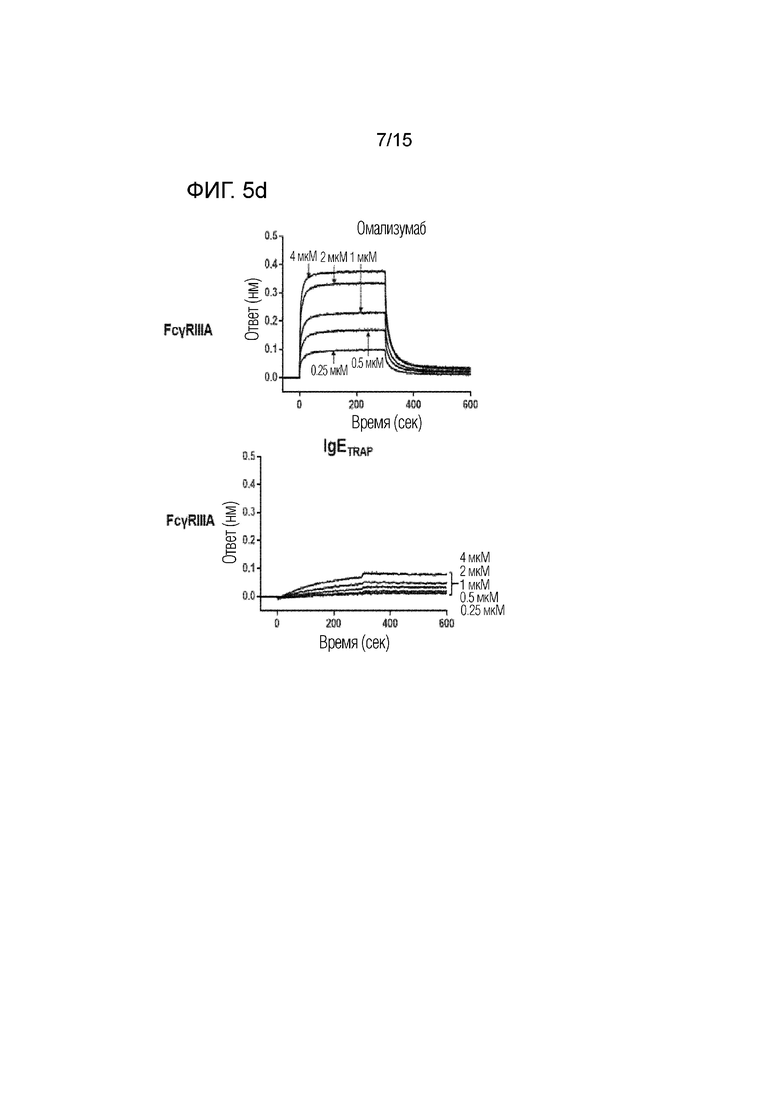
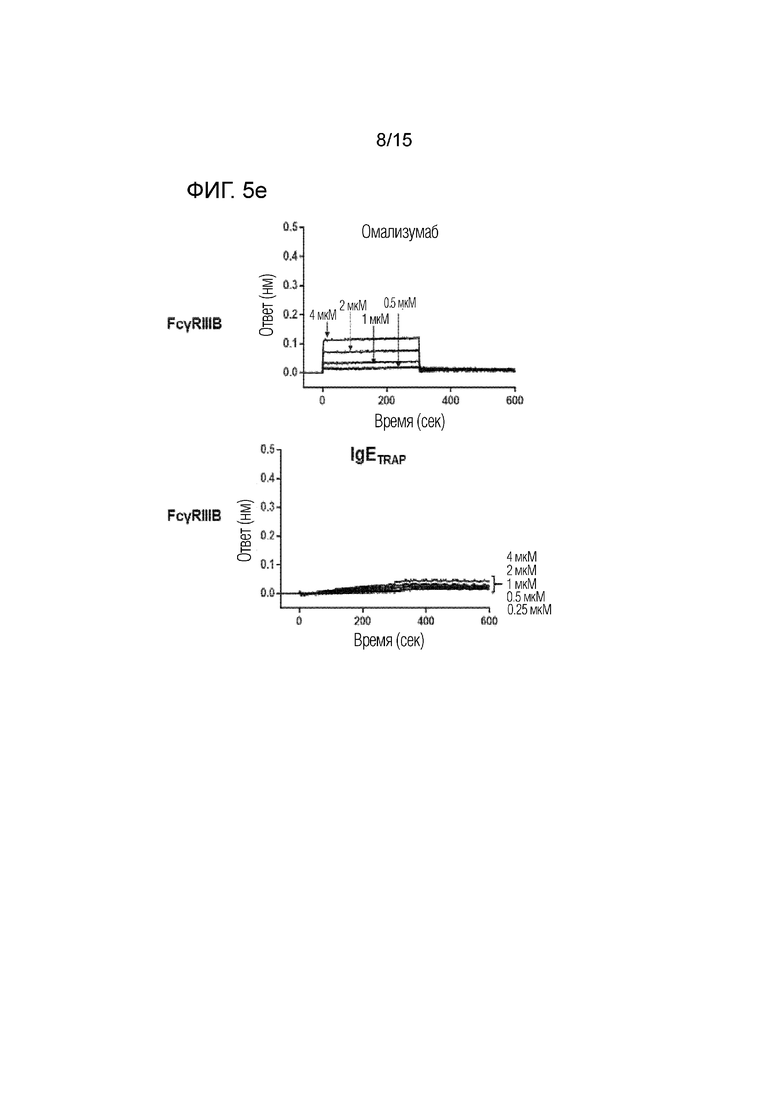
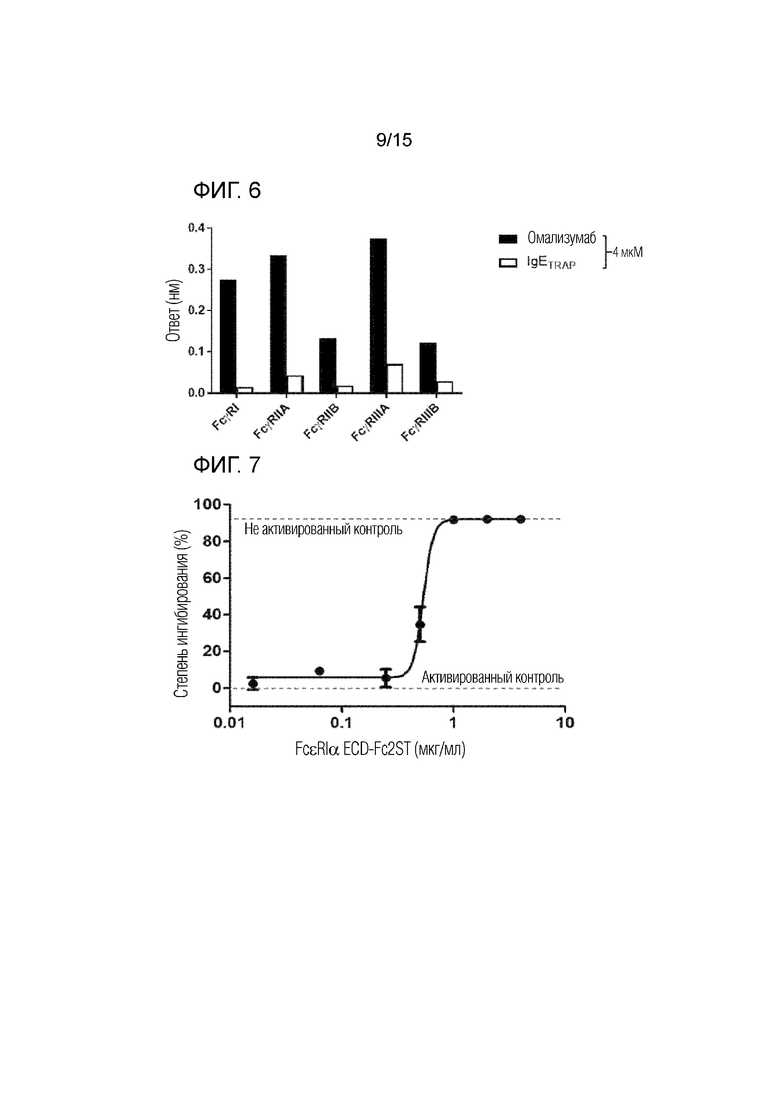
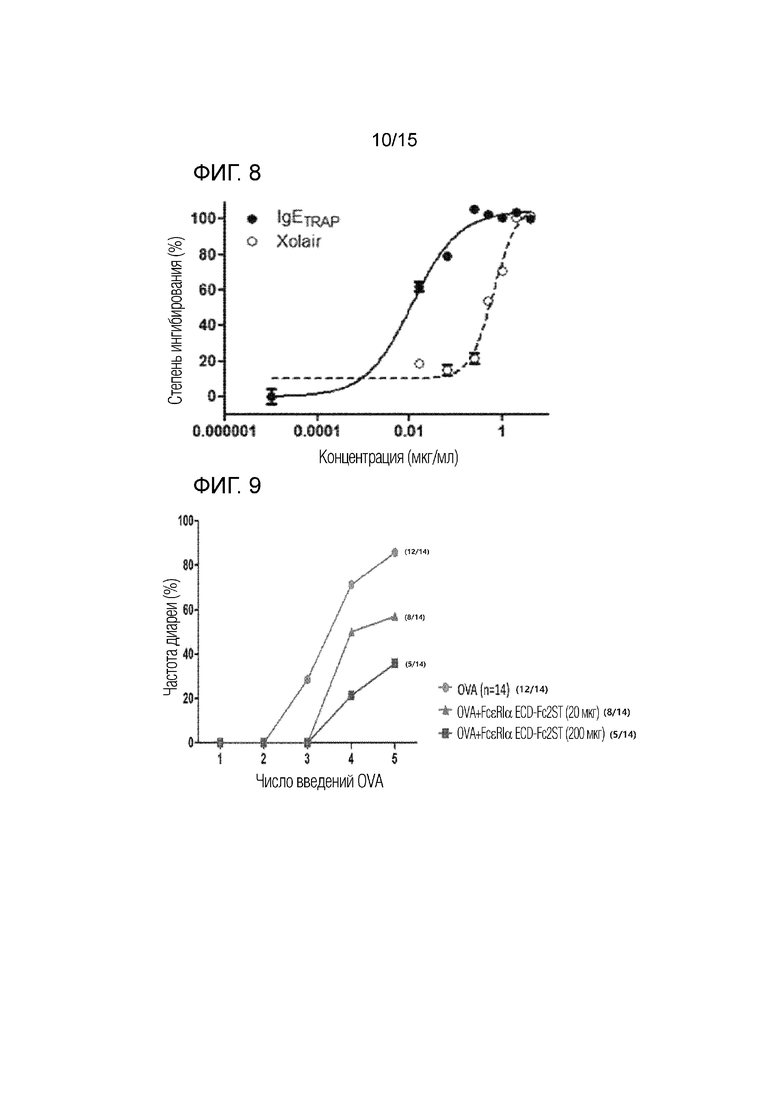

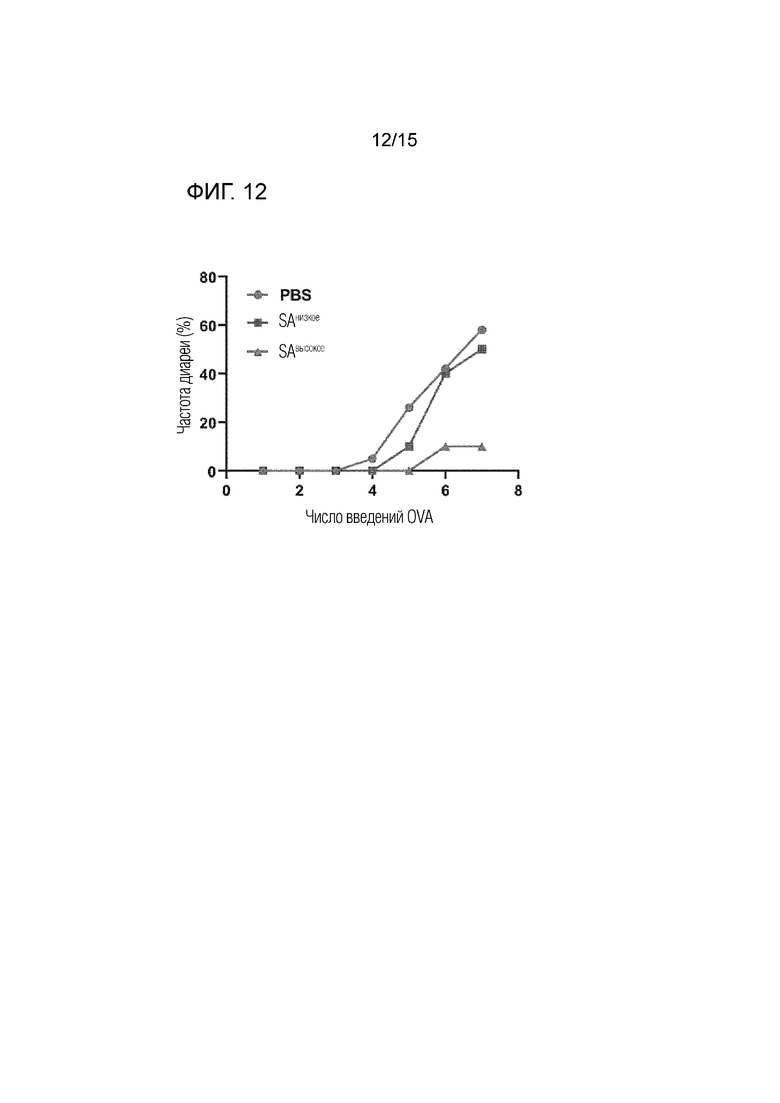
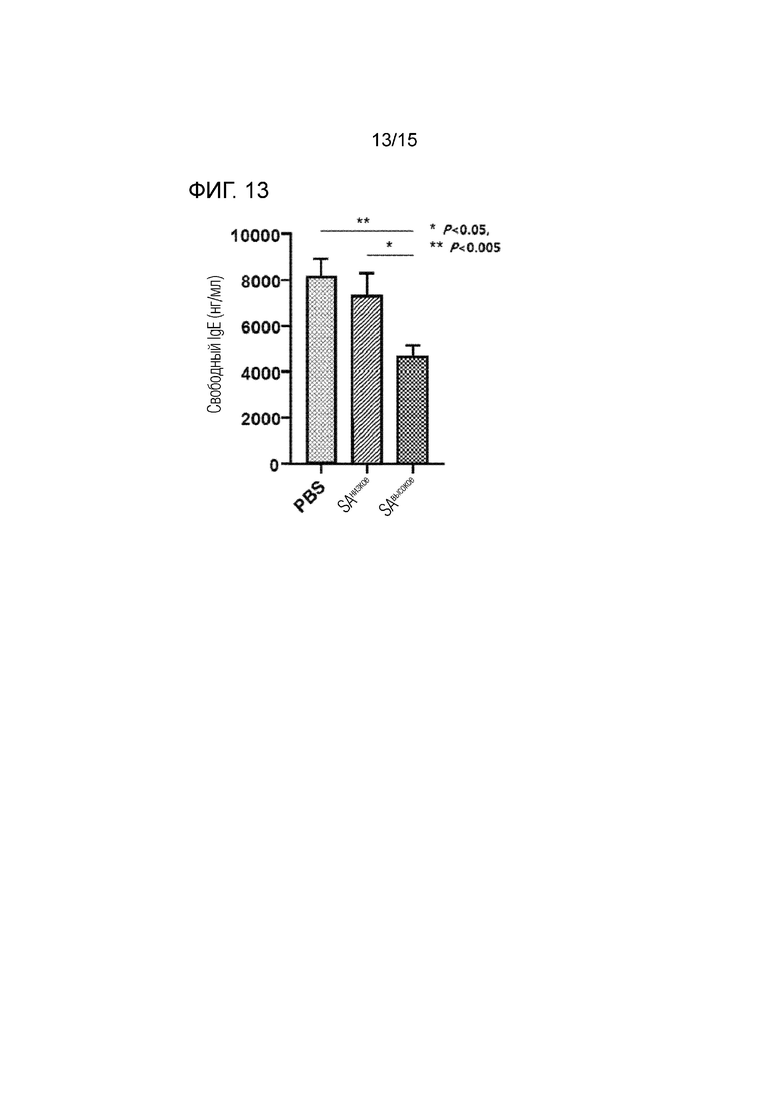
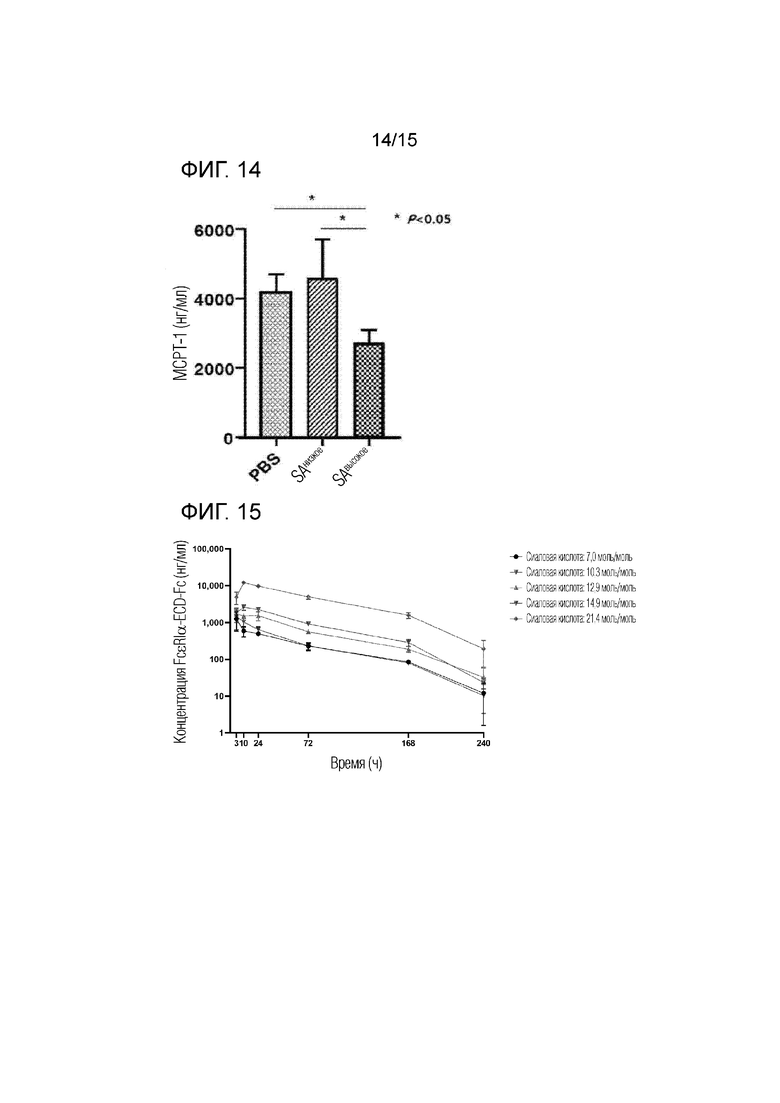
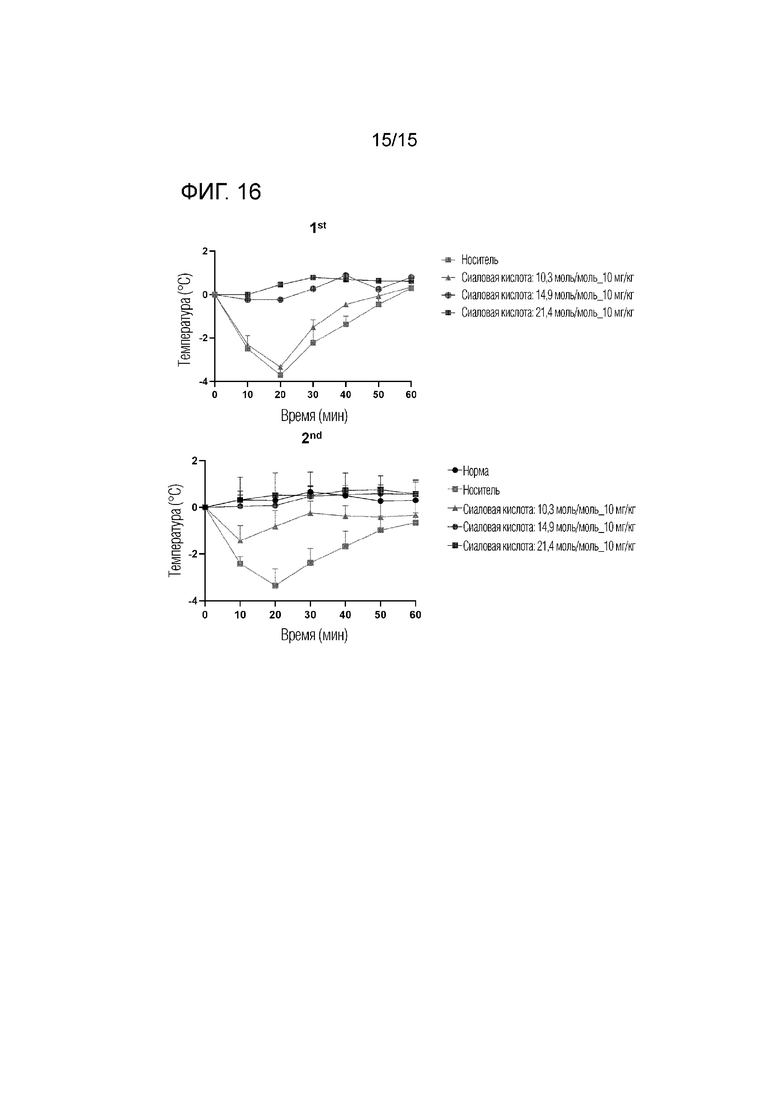
Настоящая группа изобретений относится к области биотехнологии и может быть применима в медицине и пищевой промышленности. Раскрывается модифицированный рецептор для Fc-области иммуноглобулина IgE, профиль гликозилирования которого характеризуется высоким содержанием сиаловой кислоты. Димерный полипептид согласно настоящему изобретению обеспечивает прочное связывание и увеличенное время полувыведения, также способен ингибировать выброс медиаторов, вызванный связыванием с Fcγ-рецептором на поверхности тучных клеток, что позволяет свести к минимуму серьезные побочные аллергические реакции, например, возникновение анафилаксии. Димер полипептида с высоким содержанием сиаловой кислоты в соответствии с настоящим изобретением может успешно применяться для профилактики или лечения аллергических заболеваний. 4 н. и 3 з.п. ф-лы, 20 ил., 7 табл., 17 пр.
1. Димер полипептида с высоким содержанием сиаловой кислоты, имеющий способность к связыванию с IgE, включающий:
два мономера, каждый из которых содержит экстраклеточный домен (FcεRIα-ECD) альфа-субъединицы рецептора для Fc-области IgE, состоящий из аминокислотной последовательности SEQ ID NO:1,
причем мономер содержит Fc-область, состоящую из аминокислотной последовательности SEQ ID NO:2, и
Fc-область и FcεRIα-ECD связаны через шарнирную область,
где шарнирная область, происходящая из иммуноглобулина IgD или его варианта, имеет последовательность:
Arg Asn Thr Gly Arg Gly Gly Glu Glu Lys Lys Xaa1 Xaa2 Lys Glu Lys Glu Glu Gln Glu Glu Arg Glu Thr Lys Thr Pro Glu Cys Pro (SEQ ID NO:17),
где Xaa1 представляет собой Lys или Gly, и
Xaa2 представляет собой Glu, Gly или Ser; или
Ala Gln Pro Gln Ala Glu Gly Ser Leu Ala Lys Ala Thr Thr Ala Pro Ala Thr Thr Arg Asn Thr Gly Arg Gly Gly Glu Glu Lys Lys Xaa3 Xaa4 Lys Glu Lys Glu Glu Gln Glu Glu Arg Glu Thr Lys Thr Pro Glu Cys Pro (SEQ ID NO:18),
где Xaa3 представляет собой Lys или Gly, и
Xaa4 представляет собой Glu, Gly или Ser, и
причем молярное отношение сиаловой кислоты к димеру полипептида составляет от 12 до 25.
2. Димер полипептида с высоким содержанием сиаловой кислоты по п. 1, где сиаловой кислотой является N-ацетилнейраминовая кислота.
3. Димер полипептида с высоким содержанием сиаловой кислоты по п. 1, где шарнирная область, происходящая из иммуноглобулина IgD или его варианта, имеет любую аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO:3, SEQ ID NO:4 и SEQ ID NO:19.
4. Фармацевтическая композиция для лечения или профилактики аллергического заболевания, содержащая димер полипептида с высоким содержанием сиаловой кислоты по любому из пп. 1-3,
где димер полипептида содержится в эффективном количестве от 0,001% до 20,0% по весу от общего веса композиции,
и где аллергическим заболеванием является любое заболевание, выбранное из группы, состоящей из пищевой аллергии, атопического дерматита, астмы, аллергического ринита, аллергического конъюнктивита, аллергического дерматита, хронической идиопатической крапивницы и аллергического контактного дерматита.
5. Фармацевтическая композиция для лечения или профилактики аллергического заболевания по п. 4, которая предназначена для подкожной инъекции.
6. Пищевая смесь, содержащая димер полипептида с высоким содержанием сиаловой кислоты по любому из пп. 1-3, где димер полипептида содержится в эффективном количестве от 0,001% до 20,0% по весу от общего веса композиции.
7. Применение димера полипептида с высоким содержанием сиаловой кислоты по любому из пп. 1-3 для профилактики или лечения аллергического заболевания, где аллергическим заболеванием является любое заболевание, выбранное из группы, состоящей из пищевой аллергии, атопического дерматита, астмы, аллергического ринита, аллергического конъюнктивита, аллергического дерматита, хронической идиопатической крапивницы и аллергического контактного дерматита.
| WO 2016133197 A1, 25.08.2016 | |||
| WO 2017061780 A1, 13.04.2017 | |||
| US 20080300188 A1, 04.12.2008 | |||
| WO 2008028068 A2, 06.03.2008 | |||
| TAKAHASHI K | |||
| et al., The High Affinity IgE Receptor (FcεRI) as a Target for Anti-allergic Agents, Allergology International, 2005, v | |||
| Видоизменение прибора для получения стереоскопических впечатлений от двух изображений различного масштаба | 1919 |
|
SU54A1 |
| N-КОНЦЕВОЕ ПОЛИСИАЛИЛИРОВАНИЕ | 2007 |
|
RU2432175C2 |
Авторы
Даты
2025-01-27—Публикация
2020-07-07—Подача