ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение относится к области генной инженерии. Более конкретно, целью изобретения является улучшение производства новой рекомбинантной β-фруктофуранозидазы, кодируемой геном fopA Aspergillus niger в виде секретируемого белка.
УРОВЕНЬ ТЕХНИКИ
Олигомеры фруктозы, также известные как фруктоолигосахариды (FOS), представляют собой ряд гомологичных олигосахаридов. Фруктоолигосахариды обычно представлены формулой GFn и, в основном, состоят из 1-кестозы (GF2), нистозы (GF3) и β-фруктофуранозилнистозы (GF4), в которых две, три и четыре фруктозильные единицы связаны в β-2,1 положении глюкозы.
Фруктоолигосахариды (FOS) характеризуются многими полезными свойствами, такими как низкая степень сладости, а также полезен в качестве пребиотика. Благодаря низкой степени сладости (примерно на одну-две трети по сравнению с сахарозой) и низкой калорийности (примерно 0-3 ккал/г) фруктоолигосахариды можно использовать в различных видах пищевых продуктов в качестве заменителя сахара. Далее, сообщалось, что фруктоолигосахариды в качестве пребиотиков используются как защитные средства против рака толстой кишки, улучшая различные параметры иммунной системы, улучшая адсорбцию минералов, благотворно влияя на концентрацию липидов и холестерина в сыворотке крови и осуществляя гликемический контроль для борьбы с ожирением и диабетом (Dominguez, Ana Luisa et al. «An overview of the recent developments on fructooligosaccharide production and applications» Food and bioprocess technology 7.2 (2014): 324-337).
Однако фруктоолигосахариды содержатся лишь в следовых количествах в качестве натуральных компонентов во фруктах, овощах и меде. В связи с такой низкой концентрацией практически невозможно извлечь фруктоолигосахариды из пищи.
Предпринимались попытки получения фруктоолигосахаридов путем ферментативного синтеза из сахарозы микробными ферментами, обладающими трансфруктозилирующей активностью. Однако основными ограничениями в предыдущих попытках были более низкая каталитическая эффективность, ингибирование фермента глюкозой с обратной связью, приводящее к снижению выхода FOS, и необходимость в более длительных периодах времени для превращения сахарозы с помощью ферментов, экспрессируемых в рекомбинантной системе хозяина. Кроме того, промышленное производство микробных ферментов, проявляющих трансфруктозилирующая активность, является сложной задачей из-за дополнительных ограничений, связанных с крупномасштабной экспрессией фермента, стабильностью фермента, процессами ферментации и очистки.
Промышленное производство фруктоолигосахаридов требует идентификации и массового производства эффективных ферментов. Из-за вышеуказанных ограничений получение микробных ферментов с эффективной трансфруктозилирующей активностью является дорогостоящим процессом, что, в свою очередь, увеличивает стоимость производства фруктоолигосахаридов.
Таким образом, существует давняя потребность в выявлении и предоставлении эффективных, дешевых средств в промышленных масштабах для получения микробных ферментов с превосходной трансфруктозилирующей активностью, что, в свою очередь, снижает стоимость производства фруктоолигосахаридов.
РАСКРЫТИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Техническая задача
Техническая задача, которую необходимо решить в этом изобретении, заключается в идентификации и повышении выхода новой β-фруктофуранозидазы (UniProtKB: Q96VC5_ASPNG) Aspergillus niger.
Решение задачи
Задача была решена путем сверхэкспрессии новой β-фруктофуранозидазы Aspergillus niger путем разработки последовательностей нуклеиновых кислот, белковых последовательностей, промоторов, рекомбинантных векторов, клеток хозяина и секреторных сигнальных пептидов для достижения высокого выхода новой рекомбинантной β-фруктофуранозидазы.
Кроме того, стратегия ферментации была модифицирована для получения высокого выхода примерно 2-5 г/л рекомбинантной β-фруктофуранозидазы.
Обзор изобретения
Настоящее изобретение относится к нуклеиновым кислотам, белковым последовательностям, векторам и клеткам хозяина для рекомбинантной экспрессии новой β-фруктофуранозидазы. Настоящее изобретение также относится к пептидам-предшественникам, содержащим сигнальные пептиды, подвергнутые слиянию с новыми ферментами β-фруктофуранозидазы, которые обеспечивают получение более высокого выхода эффективного фермента в качестве секреторного белка.
Изобретение также относится к способу экспрессии новой рекомбинантной β-фруктофуранозидазы в виде секретируемого белка. Установлено, что концентрация β-фруктофуранозидазы составляет около 2-5 г/л. Фермент обладает чистотой почти 85% после фильтрации, что устраняет необходимость в дорогостоящих хроматографических процедурах.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Особенности настоящего изобретения станут полностью ясными из следующего описания, в сочетании с прилагаемыми фигурами. Виду того, что фигуры изображают только несколько вариантов осуществления изобретения и не должны рассматриваться как ограничивающие его объем, изобретение будет описано далее с использованием соответствующих фигур.
На фигуре 1 изображено выравнивание последовательностей нативного гена. fopA и модифицированного гена.fopA, кодирующего β-фруктофуранозидазу.
На фигуре 2 представлена схема построения вектора pPICZαA.
На фигуре 3 показаны результаты анализа рестрикционного расщепления, проведенного на рекомбинантной плазмиде pPICZαA-fopA.
На фигуре 4 показаны результаты ПЦР-скрининга колоний, выполненного на интегриантах Pichia.
На фигуре 5 показана экспрессия β-фруктофуранозидазы при индукции из рекомбинантных клеток хозяина Pichia pastoris.
На фигуре 6(а) показан SDS-PAGE анализ образцов, собранных через разные промежутки времени во время ферментации штамма Pichia pastoris КМ71Н, экспрессирующего рекомбинантный фермент β-фруктофуранозидазу. На фигуре 6(b) показан SDS-PAGE анализ рекомбинантного фермента β-фруктофуранозидазы после очистки.
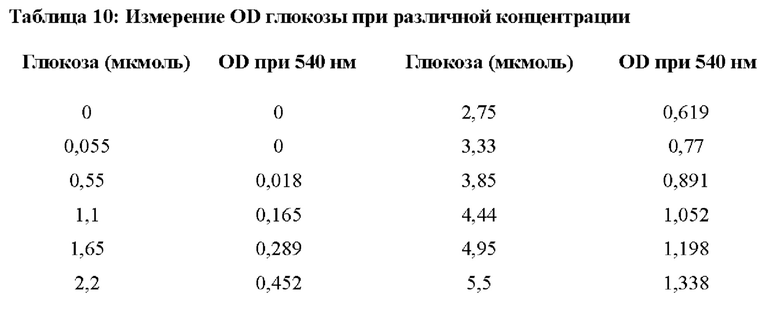
На фигуре 7 изображена стандартная кривая глюкозы, используемая для оценки активности фермента β-фруктофуранозидазы.
На фигуре 8 показано получение фруктоолигосахаридов (FOS) из сахарозы и рекомбинантного фермента β-фруктофуранозидазы.
На фигуре 9 изображена хроматограмма ВЭЖХ-анализа (HPLC) образцов FOS.
КРАТКОЕ ОПИСАНИЕ ПОСЛЕДОВАТЕЛЬНОСТЕЙ И ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
SEQ ID NO: 1 - Аминокислотная последовательность новой β-фруктофуранозидазы (654 аминокислоты).
SEQ ID NO: 2 - Модифицированная последовательность нуклеиновой кислоты гена, кодирующего новую β-фруктофуранозидазу (1965 пар оснований).

Во все последовательности секреторных сигнальных пептидов был добавлен участок из четырех аминокислот (LEKR) для эффективного процессинга препротеина Kех2.

SEQ ID NO: 23 - Нативная последовательность нуклеиновой кислоты гена fopA (1965 пар оснований), кодирующая секретируемую β-фруктофуранозидазу.

ОПРЕДЕЛЕНИЯ
Если не указано иное, все технические и научные термины, используемые здесь, имеют то же значение, которое обычно понимается специалистом в той области техники, к которой относятся способы. Не смотря на то, что любые векторы, клетки хозяина, способы и композиции, сходные или эквивалентные описанным здесь, также могут быть использованы на практике или при тестировании векторов, клеток хозяина, способов и композиций, здесь представлены репрезентативные иллюстрации.
Там, где предусмотрен диапазон значений, подразумевается, что каждое промежуточное значение между верхним и нижним пределом этого диапазона и любым другим указанным или промежуточным значением в этом указанном диапазоне рассматривается в рамках способов и композиций. Верхний и нижний пределы этих меньших диапазонов могут независимо включаться в меньшие диапазоны и также рассматриваться в рамках способов и композиций с учетом любого специально исключенного предела в указанном диапазоне. Там, где указанный диапазон включает в себя один или оба предела, диапазоны, исключающие один или оба этих включенных пределов, также включены в способы и композиции.
Следует понимать, что определенные признаки способов, которые для ясности описаны в контексте отдельных вариантов осуществления изобретения, также могут быть представлены в комбинации в одном варианте осуществления изобретения. И наоборот, различные признаки способов и композиций, которые для краткости описаны в контексте одного варианта осуществления изобретения, также могут быть представлены отдельно или в любой подходящей субкомбинации. Следует отметить, что, согласно употреблению здесь, а также в прилагаемой формуле изобретения, формы единственного числа ссылаются и на множественное число, если контекст явно не предписывает иное. Далее отмечается, что формула изобретения может быть составлена таким образом, чтобы исключить любой необязательный элемент. Как таковое, это утверждение должно служить основой для предпосылок использования такой исключительной терминологии, как «исключительно», «единственно» и т.п. в связи с перечислением элементов формулы изобретения или использованием «негативного» ограничения.
Как будет очевидно специалистам в данной области после ознакомления с настоящим изобретением, каждый из отдельных вариантов осуществления изобретения, описанных и проиллюстрированных здесь, имеет отдельные компоненты и признаки, которые могут быть легко отделены от признаков любого из других вариантов осуществления изобретения или объединены с ними без отступления от объема или сути настоящих способов. Любой описанный способ может быть осуществлен в порядке описываемых событий или в любом другом порядке, который логически возможен.
Термин «клетка(и) хозяина» включает индивидуальную клетку или клеточную культуру, которая может быть или была реципиентом для объекта экспрессионных конструкций. Клетки хозяина включают потомство одной клетки хозяина. Клетки хозяина для целей настоящего изобретения относятся к любому штамму Pichia pastoris, который может быть подходящим образом использован для целей изобретения. Примеры штаммов, которые могут быть использованы для целей настоящего изобретения, включают штаммы дикого типа, mut+, mux S, mux- штаммы Pichia, такие как КМ71Н, КМ71, SMD1168H, SMD1168, GS115,X33.
Термин «рекомбинантный штамм» или «рекомбинантная клетка(и) хозяина» относится к клетке(ам) хозяина, которая была трансфицирована или трансформирована экспрессионными структурами или векторами данного изобретения.
Термин «вектор экспрессии» относится к любому вектору, плазмиде или носителю, разработанному для обеспечения экспрессии введенной последовательности нуклеиновой кислоты после трансформации в организм хозяина.
Термин «промотор» относится к последовательностям ДНК, которые определяют, где начинается транскрипция гена. Промоторные последовательности обычно расположены непосредственно выше или на 5'-конце сайта инициации транскрипции. РНК-полимераза и необходимые факторы транскрипции связываются с промоторной последовательностью и инициируют транскрипцию. Промоторы могут быть либо конститутивными, либо индуцируемыми промоторами. Конститутивные промоторы - это промоторы, которые обеспечивают непрерывную транскрипцию ассоциированных с ними генов, поскольку их экспрессия обычно не обусловлена факторами окружающей среды и развития. Конститутивные промоторы являются очень полезными инструментами в генной инженерии, поскольку конститутивные промоторы стимулируют экспрессию генов в условиях без индукторов и часто демонстрируют лучшие характеристики, чем широко используемые индуцируемые промоторы. Индуцируемые промоторы - это промоторы, которые индуцируются присутствием или отсутствием биотических или абиотических и химических или физических факторов. Индуцируемые промоторы являются очень мощным инструментом в генной инженерии, поскольку экспрессия генов, функционально связанных с ними, может быть включена или выключена на определенных стадиях развития или роста организма или в определенной ткани или типе клеток.
Термин «функционально связанный» относится к объединению последовательностей нуклеиновых кислот на одном фрагменте нуклеиновой кислоты таким образом, что функция одной регулируется другой. Например, промотор функционально связан с кодирующей последовательностью, когда он способен регулировать экспрессию этой кодирующей последовательности (т.е. кодирующая последовательность находится под транскрипционным контролем промотора).
Термин «транскрипция» относится к процессу создания РНК-копии последовательности гена. Эта копия, называемая молекулой РНК-мессенджера (мРНК), покидает ядро клетки и попадает в цитоплазму, где управляет синтезом белка, который она кодирует.
Термин «трансляция» относится к процессу трансляции последовательности молекулы РНК-мессенджера (мРНК) в последовательность аминокислот во время синтеза белка. Генетический код описывает взаимосвязь между последовательностью пар оснований в гене и соответствующей аминокислотной последовательностью, которую он кодирует. В цитоплазме клетки для сборки белка рибосома считывает последовательность мРНК в группах по три основания.
Термин «экспрессия» относится к биологическому получению продукта, закодированного кодирующей последовательностью. В большинстве случаев последовательность ДНК, включая кодирующую последовательность, транскрибируется с образованием мессенджерной РНК (мРНК). Затем мессенджерная РНК транслируется с образованием полипептидного продукта, обладающего соответствующей биологической активностью. Кроме того, процесс экспрессии может включать в себя дополнительные этапы обработки продукта транскрипции РНК, такие как сплайсинг для удаления интронов и/или посттрансляционный процессинг полипептидного продукта.
Термин «модифицированная нуклеиновая кислота», используемый здесь, используется для обозначения нуклеиновой кислоты, кодирующей β-фруктофуранозидазу, подвергнутую слиянию с сигнальным пептидом. В вариантах осуществления изобретения модифицированная нуклеиновая кислота представлена последовательностями SEQ ID NO: 13, SEQ ID NO: 14, SEQ ID NO: 15, SEQ ID NO: 16, SEQ ID NO: 17, SEQ ID NO: 18, SEQ ID NO: 19, SEQ ID NO: 20, SEQ ID NO: 21, SEQ ID NO: 22 или их функционально эквивалентным вариантом. Функциональный вариант включает любую нуклеиновую кислоту, имеющую существенную идентичность последовательности или сходство с SEQ ID NO: 13-22, и которая сохраняет ту же биологическую активность.
Термины «полипептид», «пептид» и «белок» используются здесь взаимозаменяемо для обозначения двух или более аминокислотных остатков, соединенных друг с другом с помощью пептидных связей или модифицированных пептидных связей. Термины применимы к аминокислотным полимерам, в которых один или более аминокислотных остатков являются искусственным химическим имитатором соответствующей природной аминокислоты, а также к встречающимся в природе аминокислотным полимерам, включая указанные полимеры, содержащие модифицированные остатки, и к неприродному аминокислотному полимеру. «Полипептид» относится как к коротким цепям, обычно называемым пептидами, олигопептидами или олигомерами, так и к длинным цепям, обычно называемым белками. Полипептиды могут содержать аминокислоты, помимо 20 аминокислот, закодированных геном. Аналогично, «белок» относится, по меньшей мере, к двум ковалентно присоединенным аминокислотам, которые включают белки, полипептиды, олигопептиды и пептиды. Белок может состоять из встречающихся в природе аминокислот и петидных связей или синтетических пептидомиметических структур. Таким образом, «аминокислота» или «пептидный остаток», как используется здесь, означает как встречающиеся в природе, так и синтетические аминокислоты.
«Аминокислота» включает иминокислотные остатки, такие как пролин и гидроксипролин. Боковые цепи могут быть как в конфигурации (R), так и в конфигурации (S).
Термин «сигнальный пептид» или «сигнальная пептидная последовательность» обозначенная здесь как пептидная последовательность, обычно присутствующая на N-терминальном конце вновь синтезированных секреторных или мембранных полипептидов, которая направляет полипептид через клеточную мембрану или в нее (плазматическую мембрану у прокариот и мембрану эндоплазматического ретикулума у эукариот). Обычно впоследствии он удаляется. В частности, указанный сигнальный пептид может быть способен направлять полипептид в секреторный путь клетки.
Термин «пептид-предшественник», используемый здесь, относится к пептиду, содержащему сигнальный пептид (также известный как лидерные последовательности), функционально связанный с β-фруктофуранозидазой Aspergillus niger. Сигнальные пептиды отщепляются во время посттрансляционных модификаций внутри клеток хозяина Pichia, и зрелая β-фруктофуранозидаза (SEQ ID NO: 1) высвобождается в среду.
Термин «вариант», используемый здесь в отношении пептидов/белков-предшественников, относится к пептидам с аминокислотными заменами, добавлениями, делециями или изменениями, которые существенно не снижают активность сигнального пептида или фермента. Варианты включают в себя как структурные, так и функциональные варианты. Термин «вариант» также включает использование замещенной аминокислоты вместо незамещенной исходной аминокислоты.
Таблицы замещения аминокислот, обеспечивающие функционально сходные аминокислоты, хорошо известны специалистам в данной области. Следующие шесть групп являются примерами аминокислот, которые считаются вариантами друг для друга:

ОСУЩЕСТВЛЕНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение раскрывает нуклеиновые кислоты, векторы и рекомбинантные клетки хозяина для эффективного получения биологически активной и растворимой рекомбинантной β-фруктофуранозидазы Aspergillus niger в виде секретируемого белка. Кроме того, изобретение обеспечивает способ промышленного производства рекомбинантной β-фруктофуранозидазы.
Изобретение предусматривает многомерный подход для достижения высокого выхода новой рекомбинантной β-фруктофуранозидазы в гетерологичном хозяине. Нативный ген β-фруктофуранозидазы был модифицирован для экспрессии в Pichia pastoris. Далее, модифицированный ген был подвергнут слиянию с одним или несколькими сигнальными пептидами.
В одном варианте осуществления изобретения модифицированная нуклеиновая кислота, кодирующая новую β-фруктофуранозидазу Aspergillus niger, представлена последовательностью SEQ ID NO: 2.
В другом варианте осуществления изобретения модифицированную нуклеиновую кислоту подвергают слиянию с одним или несколькими сигнальными пептидами.
В другом варианте осуществления изобретения сигнальный пептид выбирают из Альфа-фактора S. cerevisiae (FAK), альфа-фактора полного S. cerevisiae (FAKS), альфа-фактора_T S. cerevisiae (AT), Альфа-амилазы Aspergillus niger (АА), Глюкоамилазы Aspergillus awamori (GA), Инулиназы Kluyveromyces maxianus (IN), Инвертазы S. cerevisiae (IV), киллер-белка S. cerevisiae (KP), Лизоцима Gallus gallus (LZ), сывороточного альбумина Ноmо sapiens (SA)
В другом варианте осуществления изобретения сигнальный пептид представлен в приведенной ниже таблице 5.

В другом варианте осуществления изобретения сигнальный пептид выбирают из перечня модифицированных сигнальных пептидов, как описано в таблице 1.
В другом варианте осуществления изобретения нуклеиновая кислота, подвергнутая слиянию с одним или более модифицированным сигнальным пептидом, выбрана из группы, включающей SEQ ID NO: 13, SEQ ID NO: 14, SEQ ID NO: 15, SEQ ID NO: 16, SEQ ID NO: 17, SEQ ID NO: 18, SEQ ID NO: 19, SEQ ID NO: 20, SEQ ID NO: 21, SEQ ID NO: 22 и их варианты.
В другом варианте модифицированную нуклеиновую кислоту клонируют в векторе экспрессии.
В другом варианте осуществления изобретения вектор экспрессии сконфигурирован для секреторной или внутриклеточной экспрессии рекомбинантной β-фруктофуранозидазы из Aspergillus niger.
В еще одном варианте осуществления изобретения вектор экспрессии выбирают из группы, включающей pPICZαA, pPICZαB, pPICZαC, pGAPZαA, pGAPZαB, pGAPZαC, pPIC3, pPIC3.5, pPIC3.5K, PAOS15, pPIC9, pPIC9K, IL-D2 и pHIL-S1.
Экспрессия модифицированного гена β-фруктофуранозидазы (fopA), подвергнутого слиянию с сигнальным пептидом, предпочтительно управляется конститутивным или индуцируемым промотором.
В другом варианте осуществления изобретения нуклеиновая кислота, подлежащая экспрессии, функционально связана с промотором.
В другом варианте конститутивный или индуцируемый промотор выбирают из группы, указанной в таблице 6.

В другом варианте осуществления изобретения промотором является промотор АОХ1, который индуцируется метанолом и подавляется глюкозой.
В варианте осуществления изобретения вектор экспрессии, содержащий представляющий интерес модифицированный ген (ген β-фруктофуранозидазы, подвергнутый слиянию с сигнальным пептидом, кодирующим нуклеиновую кислоту), трансформируют в подходящем хозяине.
В другом варианте осуществления изобретения вектор экспрессии, содержащий представляющий интерес ген, трансформируют в дрожжевых клетках.
В другом варианте дрожжевая клетка представляет собой Pichia pastoris.
В еще одном варианте осуществления изобретения клетка хозяина Pichia Pastoris представляет собой mut+, mut S или mut-штаммы. Mut+ представляет собой фенотип «утилизация метанола плюс».
В еще одном варианте осуществления изобретения штамм клеток хозяина Yichia Pastoris выбирают из группы, включающей КМ71Н, КМ71, SMD1168H, SMD1168, GS115, X33.
В другом варианте осуществления изобретение раскрывает пептиды-предшественники β-фруктофуранозидазы, в которых β-фруктофуранозидаза Aspergillus niger подвергнута слиянию с одним или несколькими сигнальными пептидами.
В другом варианте осуществления изобретения β-фрукто фуранозидаза Aspergillus niger имеет аминокислотную последовательность, как указано в SEQ ID NO: 1, и ее функциональные варианты. Функциональный вариант включает любую последовательность белка, имеющую существенную или значимую идентичность последовательности или сходство с SEQ ID NO: 1 и или имеющую существенную или значимую структурную идентичность или сходство с SEQ ID NO: 1, и которая сохраняет ту же биологическую активность.
В другом варианте осуществления изобретения сигнальный пептид выбирают из группы, включающей Альфа-фактор полный S. cerevisiae (FAK), как указано в SEQ ID NO: 3, Альфа-фактор полный S. cerevisiae (FAKS), как указано в SEQ ID NO: 4, Альфа-фактор_T S. cerevisiae (AT), как указано в SEQ ID NO: 5, Альфа-амилаза Aspergillus niger (АА) как указано в SEQ ID NO: 6, Глюкоамилаза Aspergillus awamori (GA) как указано в SEQ ID NO: 7, Инулиназа Kluyveromyces maxianus (IN) как указано в SEQ ID NO: 8, Инвертаза S. cerevisiae (IV), как указано в SEQ ID NO: 9, Киллерный белок S. cerevisiae (KP), как указано в SEQ ID NO: 10, Лизоцим Gallus gallus (LZ), как указано в SEQ ID NO: 11, Сывороточный альбумин Homo sapiens (SA), как указано в SEQ ID NO: 12, и их варианты.
В варианте осуществления изобретения представлен способ получения рекомбинантной β-фруктофуранозидазы Aspergillus niger.
Аспекты настоящего изобретения относятся к ферментации рекомбинантных клеток Pichia pastoris, содержащих модифицированный ген рекомбинантной β-фруктофуранозидазы (fopA). После завершения ферментации ферментационный бульон подвергают центрифугированию и фильтруют с использованием микрофильтрации, а рекомбинантный фермент отделяют. Выделенный рекомбинантный фермент концентрируют с использованием ультрафильтрации тангенциальным потоком или выпаривания и, в итоге, получают концентрированный фермент.
В одном варианте осуществления изобретения способ экспрессии β-фруктофуранозидазы Aspergillus niger на высоких уровнях включает этапы:
a. культивирование рекомбинантных клеток хозяина в подходящей ферментационной среде для получения рекомбинантного фермента β-фруктофуранозидазы, секретируемого в ферментационный бульон;
b. сбор супернатанта из ферментационного бульона, где супернатант содержит рекомбинантную β-фруктофуранозидазу; и
c. очистка рекомбинантной β-фруктофуранозидазы.
В другом варианте осуществления изобретения среда для ферментации представляет собой базовую солевую среду, как описано в таблице 7.
В еще одном варианте осуществления изобретения супернатант из ферментационного бульона собирают с помощью центрифугирования.
В одном варианте осуществления изобретения процентное содержание инокулята или закваски для инициирования культуры в ферментере находится в диапазоне от 2,0% до 15,0% (об./об.).
В другом варианте осуществления изобретения рН ферментационной среды поддерживается в диапазоне от 4,0 до 7,5, поскольку секретируемый фермент подвергается надлежащему сворачиванию и является биологически активным в этом диапазоне рН.
В еще одном варианте осуществления изобретения температура процесса ферментации находится в диапазоне от 15°С до 40°С.
В другом варианте осуществления изобретения время процесса ферментации находится в диапазоне 50-150 часов.
В другом варианте осуществления изобретения ферментационный бульон центрифугируют со скоростью в диапазоне от 2000 xg до 15000 xg, используя непрерывное центрифугирование в режиме онлайн.
Супернатант, полученный после центрифугирования, подвергают микрофильтрации и очищают для выделения биологически активной рекомбинантной β-фруктофуранозидазы.
В одном варианте осуществления изобретения супернатант, полученный после центрифугирования, концентрируют с использованием ультрафильтрационной системы на основе тангенциальной фильтрации потока.
Размер отсечения мембран, используемых в системах фильтрации с тангенциальным потоком (TFF), которые могут использоваться для удаления примесей и концентрирования собранного супернатанта культуры, может составлять от 5 до 100 кДа.
В другом варианте осуществления изобретения для процесса не требуется центрифугирование из-за высокого выхода и чистоты секретируемого фермента.
Установлено, что концентрация β-фруктофуранозидазы, полученная в соответствии с этим изобретением, находится в диапазоне 2-5 г/л, а чистота составляет около 85%.
ПРИМЕРЫ
Следующие примеры, в частности, описывают способ, с помощью которого должно быть выполнено изобретение. Но варианты осуществления изобретения, раскрытые здесь, никоим образом не ограничивают объем изобретения.
Пример 1: Модифицированные нуклеиновые кислоты для экспрессии рекомбинантной β-фруктофуранозидазы Aspergillus niger в Pichia pastoris
кДНК нативной β-фруктофуранозидазы (fopA) Aspergillus niger представлена последовательностью SEQ ID NO: 23, а аминокислотная последовательность новой β-фруктофуранозидазы представлена последовательностью SEQ ID NO: 1.
Нативную кДНК модифицировали для максимальной экспрессии в Pichia pastoris. Модифицированная нуклеиновая кислота представлена последовательностью SEQ ID NO: 2. Различия между нативной и модифицированной последовательностью показаны на фигуре 1.
Кассета экспрессии, кодирующая β-фруктофуранозидазу, была модифицирована для максимизации экспрессии в Pichia pastoris. Модифицированная открытая рамка считывания содержит модифицированную нуклеотидную последовательность (SEQ ID NO: 2), кодирующую β-фруктофуранозидазу, подвергнутую слиянию с сигнальным пептидом. Нуклеиновые кислоты были сконструированы таким образом, что закодированные сигнальные пептиды содержат дополнительный участок из четырех аминокислот (LEKR) для эффективного процессинга Kех2 пептида-предшественника.
Предпочтительные кодоны для экспрессии в Pichia pastoris были использованы вместо редких кодонов.
Ниже приведена нуклеотидная последовательность модифицированных открытых рамок считывания, кодирующих β-фруктофуранозидазу, подвергнутую слиянию с модифицированными сигнальными пептидами:
- Альфа-фактор S. cerevisiae (FAK) представлен последовательностью SEQ ID NO: 13
- Альфа-фактор полный S. cerevisiae (FAKS), представлен последовательностью SEQ ID NO: 14
- Альфа-фактор Т S. cerevisiae (AT) представлен последовательностью SEQ ID NO: 15
- Альфа-амилаза Aspergillus niger (АА) представлена последовательностью SEQ ID NO: 16
- Глюкоамилаза Aspergillus awamori (GA) представлена последовательностью SEQ ID NO: 17
- Инулиназа Kluyveromyces maxianus (IN) представлена последовательностью SEQ ID NO: 18
- Инвертаза S. cerevisiae (IV) представлена последовательностью SEQ ID NO: 19
- Киллерный белок S. cerevisiae (KP), представлен последовательностью SEQ ID NO: 20
- Лизоцим Gallus gallus (LZ) представлен последовательностью SEQ ID NO: 21
- Сывороточный альбумин Homo sapiens (SA) представлен последовательностью SEQ ID NO: 22.
Последовательность нуклеиновой кислоты SEQ ID NO: 13 была химически синтезирована и клонирована в вектор pPICZαA, а остальные модифицированные последовательности нуклеиновых кислот были получены методом ПЦР с расширением перекрытия с использованием экспрессионной кассеты SEQ ID NO: 13 в качестве матрицы.
Пример 2: Полипептидные последовательности β-фруктофуранозидазы, подвергнутые слиянию с сигнальными пептидами
Рекомбинантные белки-предшественники были получены путем трансляции гена, кодирующего β-фруктофуранозидазу Aspergillus niger, в сочетании с сигнальными пептидами
Сигнальными пептидами, использованными в модифицированных пептидах-предшественниках, были Альфа-фактор S. cerevisiae (FAK), представленный последовательностью SEQ ID NO: 3, Альфа-фактор полный S. cerevisiae (FAKS), представленный последовательностью SEQ ID NO: 4, Альф α-фактор Т S. cerevisiae (AT), представленный последовательностью SEQ ID NO: 5, Альфа-амилаза Aspergillus niger (АА) представленная последовательностью SEQ ID NO: 6, Глюкоамилаза Aspergillus awamori (GA) представленная последовательностью SEQ ID NO: 7, Инулиназа Kluyveromyces maxianus (IN) представленная последовательностью SEQ ID NO: 8, Инвертаза S. cerevisiae (IV) представленная последовательностью SEQ ID NO: 9, Киллерный белок S. cerevisiae (KP), представленный последовательностью SEQ ID NO: 10, Лизоцим Gallus gallus (LZ), представленный последовательностью SEQ ID NO: 11, и Сывороточный альбумин Homo sapiens (SA), представленный последовательностью SEQ ID NO: 12. Модифицированные сигнальные пептиды содержат дополнительный участок из четырех аминокислот (LEKR) для эффективного процессинга Kех2 пептида-предшественника.
Сигнальные пептиды отщепляются во время посттрансляционных модификаций внутри клеток хозяина Pichia, и зрелая рекомбинантная β-фруктофуранозидаза, содержащая аминокислотную последовательность SEQ ID NO: 1, высвобождается в среду.
Пример 3: Получение рекомбинантных клеток хозяина путем трансформации рекомбинантными плазмидами
Вектором, использованным в этом процессе, был pPICZαA. Векторы содержали модифицированные открытые рамки считывания, как описано в примере 1, и индуцируемый промотор АОХ1. Модифицированную последовательность, кодирующую рекомбинантный белок, клонировали в вектор pPICZαA.
Модифицированную нуклеиновую кислоту SEQ ID NO: 2, кодирующую ген β-фруктофуранозидазы (fopA), клонировали между сайтами рестрикции XhoI/SacII, присутствующими в MCS вектора pPICZαA, чтобы ввести Альфа-фактор S. cerevisiae (FAK) сигнальной последовательности в рамку для создания кассеты экспрессии SEQ ID NO: 13 с использованием обычной процедуры, известной из молекулярной биологии. Векторная карта для pPICZαA представлена на фигуре 2.
Предполагаемые рекомбинантные плазмиды отбирали на на низкосолевой среде LB, содержащей 25 мкг/мл Zeocin, и подвергали скринингу с помощью анализа рестрикционного расщепления XhoI/SacII.
Рекомбинантная плазмида pPICZαA-/bpL4 была подтверждена анализом рестрикционного расщепления XhoI/SacII, который привел к высвобождению 1980 фрагментов пар оснований. Результаты анализа рестрикционного расщепления показаны на фигуре 3.
После этого клетки Pichia pastoris КМ71Н электропорировали линеаризованной рекомбинантной ДНК pPICZαA-fopA. Интегранты Pichia были отобраны на дрожжевом экстракте пептон-декстроза-сорбитол-агар (YPDSA), содержащем 100 мкг/мл Zeocin.
Интеграцию проверяли с помощью скрининга ПЦР колоний (cPCR). Для cPCR методом щелочного лизиса была сгенерирована матрица из каждого из интегрантов Pichia. Результаты ПЦР-скрининга колоний показаны на фигуре 4.
Интегранты Pichia выращивали в течение 48 часов в среде BMD1 и дополнительно индуцировали сначала средой ВММ2, а затем последовательно средой ВММ10, которая обеспечивала конечную концентрацию 0,5% метанола в культуральной среде. В конце 96-часового периода индукции собирали культуральные супернатанты от разных клонов. Общий белок из каждого из собранных супернатантов осаждали 20% ТСА и анализировали с помощью SDS-PAGE.
При индукции β-фруктофуранозидазы были видны белковые полосы размером приблизительно 110 кДа, как показано на фигуре 5.
Расчетная молекулярная масса составляла около 70,85 кДа. Увеличению молекулярной массы, возможно, способствовало гликозилирование.
Пример 4: Ферментация рекомбинантной Pichia pastoris, экспрессирующей β-фруктофуранозидазу Aspergillus niger
Ферментацию рекомбинантных клеток Pichia pastoris, содержащих модифицированный ген β-фруктофуранозидазы (fopA), как описано в примере 1, проводили в 50-литровом ферментере. Ферментацию проводили в базально-солевой среде, как описано здесь. Выбранным рекомбинантный хозяином был КМ71Н, который представляет собой штамм mut S, медленно метаболизирующий метанол.
Приготовление предпосевного и посевного материала:
Предпосевной материал получали путем инокуляции из исходного глицерина в 25 мл стерильной среды YEPG и выращивания при 30°С в орбитальном шейкере с регулируемой температурой в течение ночи. Для получения семян инокулят выращивали в базовой солевой среде в колбах для взбалтывания с ребрами при температуре 30°С в орбитальном шейкере с регулируемой температурой до достижения OD600 15-25.
Процесс ферментации
Весь процесс ферментации от посева в ферментер семенной культуры до окончательного сбора занял около 130 часов. Базовую солевую среду готовили и стерилизовали in situ в ферментере.
Состав базовой солевой среды, оптимизированной для процесса ферментации, приведен в таблице 7.

Солевой раствор Pichia Trace Minerals (РТМ) готовили, как описано в таблице 8. Соли РТМ растворяли и доводили до объема 1 л, а фильтр стерилизовали. Солевой раствор РТМ добавляли из расчета 4 мл на литр исходного объема среды после стерилизации базовой солевой среды.

Фаза роста:
Фаза роста начинается с инокуляции базовой солевой среды в 50-литровом ферментере 5%-ной культурой семян и продолжается около 24 часов. Уровни растворенного кислорода (DO) постоянно контролировались и никогда не опускались ниже 40%.
Через 18 часов наблюдался резкий скачок DO, указывающий на истощение источника углерода (глицерина). Партия, насыщенная глицерином, была запущена путем подачи 50% глицерина (с использованием 12 мл солей РТМ на литр сырья) в течение примерно шести часов, до достижения OD600 200.
Фаза индукции:
Как только было получено достаточное количество биомассы, начинали фазу индукции, прекращая подачу глицерина и начиная подачу метанола. Метанол (с добавлением 12 мл солей РТМ на литр сырья) подавали из расчета от 0,5 г до 3 г на литр исходного объема ферментации. DO поддерживали на уровне 40% и соответствующим образом регулировали подачу метанола.
Индукцию гена β-фруктофуранозидазы (fopA) периодически контролировали путем анализа супернатанта культуры методом анализа активности фермента. Фазу индукции продолжали в течение примерно 100 часов, пока OD600 не достиг 600 и влажная биомасса не составила -560 граммов на литр культурального бульона.
Ферментацию прекращали через 130 часов, и активность ферментов в бульоне ферментера в конце ферментации определяли как 10573 единицы по методу DNS (Miller, 1959). Одна единица представляет собой количество фермента, необходимое для высвобождения одного микромоля редуцирующих Сахаров (эквивалентов глюкозы) из 10% раствора сахарозы в 100 мм цитратном буфере с рН 5,5 при 55°С. Общее количество рекомбинантной β-фруктофуранозидазы в культуральном бульоне оценивали с помощью анализа Брэдфорда.
Условия ферментации:
Рассмотренные параметры ферментации были такими, как приведены в таблице 9. Эти важные параметры контролировались в процессе ферментации.

Пример 5: Сбор и очистка клеток
Сбор фермента осуществляют непрерывным центрифугированием при 8000 оборотах в минуту. Прозрачный супернатант, полученный после центрифугирования, подвергали микрофильтрации с использованием отсекающей спирально-витой мембраны TFF толщиной 0,1 мкм, намотанной спирально. Фильтрат дополнительно подвергают ультрафильтрации и диафильтрации с использованием отсекающей спирально-витой мембраны TFF с плотностью 10 кДа и концентрируют в достаточной степени для достижения желаемой активности. Фермент был разработан путем включения в конечный продукт 35-50% глицерина и пищевых консервантов. Наблюдалось, что конечная чистота фермента составила 85%, как было определено с помощью анализа SDS-PAGE.
На фигуре 6 (а) показан SDS-PAGE анализ образцов, собранных через разные промежутки времени во время ферментации штамма Pichia pastoris КМ71Н, экспрессирующего рекомбинантный фермент β-фруктофуранозидазу. На фигуре 6 (b) показан SDS-PAGE анализ рекомбинантного фермента β-фруктофуранозидазы после очистки.
Было обнаружено, что концентрация β-фруктофуранозидазы составляет около 2,4 г/ л. В большинстве партий концентрация составляла 2-5 г/л. Наблюдалось, что чистота рекомбинантной β-фруктофуранозидазы составляет около 85%.
Пример 6: Оценка активности β-фруктофуранозидазы
Были проведены исследования для оценки активности β-фруктофуранозидазы. Для оценочных исследований количество редуцирующего сахара, образующегося в результате действия фермента β-фруктофуранозидазы, рассчитывали с использованием метода DNS (3,5-динитросалициловая кислота) (G.L. Miller, «Use of dinitrosalicylic acid reagent for determination of reducing sugar», Anal. Chem., 1959, 31, 426-428).
Для проведения анализа активности фермента в качестве субстрата использовали 10% сахарозу (растворенную в 100 мм цитратном буфере), β-фруктофуранозидазу выделяли из ферментационного бульона и подвергали ультрафильтрации. Затем ультрафильтрованный образец разбавляли в 25000 раз путем последовательного разведения в 100 мм цитратном буфере и использовали. Реакционный объем составлял 2,5 мл. Поддерживали рН на уровне 5,5 и реакцию продолжали в течение 15 минут.
После инкубации к каждой реакционной смеси добавляли по 3 мл DNS (3,5-динитросалициловой кислоты) и кипятили в течение 10 мин, охлаждали и спектрофотометрически измеряли поглощение при 540 нм.
OD глюкозы в различных концентрациях измеряли, как показано в таблице 10 и изображено на фигуре 7. Затем, основываясь на измерении поглощения после реакции, рассчитывали активность фермента, как показано в таблице 11. На фигуре 7 изображена стандартная кривая глюкозы, используемая для оценки активности фермента β-фруктофуранозидазы.

Пример 7: Получение фруктоолигосахаридов (FOS) из сахарозы и рекомбинантного фермента β-фруктофуранозидазы
Были проведены исследования, чтобы понять способность фермента к образованию фруктоолигосахаридов. 100 мл раствора 90%-ной (по массе) сахарозы готовили в 150 мм буфере цитрата натрия с рН 5,5. К этому добавляли 96,7 мкл фермента β-фруктофуранозидазы, имеющего активность 51692 ед/мл (что эквивалентно общему количеству 5000 единиц фермента).
Реакцию проводили в конической колбе объемом 250 мл и инкубировали при 65°С и 220 оборотах в минуту. Через равные промежутки времени отбирали пробы и анализировали на тонкослойных хроматографических планшетах (ТСХ).
Глюкозу, сахарозу, фруктозу и FOS (содержащие кестозу, нистозу и фруктофуранозилнистозу) использовали в качестве стандартов для тонкослойного хроматографического анализа. В качестве подвижной фазы использовался н-бутанол: Уксусная кислота ледяная: Вода (4:2:2 об./об.), а в качестве проявляющего/окрашивающего раствора использовался фосфат мочевины.
На фигуре 8 показан анализ методом ТСХ, проведенный для получения фруктоолигосахаридов (FOS) из сахарозы и рекомбинантного фермента β-фруктофуранозидазы.
Образец был дополнительно подвергнут высокоэффективной жидкостной хроматографии (ВЭЖХ) для количественной оценки образования фруктоолигосахаридов. Анализ ВЭЖХ проводили с использованием аминовой колонки (колонка Zorbax NH2, Agilent Technologies), имеющей 4,6 (ID) × 150 мм (длина) и 5 мкм (размер частиц). Для получения стандартных кривых использовали стандартные растворы глюкозы, фруктозы, кестозы, нистозы, фруктофуранозилнистозы и сахарозы различных концентраций.
На фигуре 9 показана хроматограмма ВЭЖХ-анализа образцов FOS. В таблице 12 показано процентное содержание фруктоолигосахаридов (FOS) и выделенных глюкозы, фруктозы и сахарозы в конце 60-минутного периода реакции.

100 мл 90%-ного (по массе) раствора сахарозы реагировали с ферментом β-фруктофуранозидазой с целью превращения сахарозы в FOS. Количества выделенных из реакции FOS, сахарозы, глюкозы и фруктозы после прекращения реакции нагреванием в конце 60-минутного периода измеряли и представляли в виде 90% и 100% сахарозой основы.
Исследования показали, что очищенные ферменты способны эффективно преобразовывать очень большое количество сахаров во фруктоолигосахариды.
Пример 8: Характеристика рекомбинантной β-фруктофуранозидазы Aspergillus niger
Собранная β-фруктофуранозидаза Aspergillus niger была исследована с целью выявления биологически активных фрагментов. Было обнаружено, что следующие биоактивные фрагменты β-фруктофуранозидазы сохраняются и обусловливают каталитическую активность:

Далее было обнаружено, что следующие аминокислотные остатки в β-фруктофуранозидазе Aspergillus niger участвовали в формирование сети водородных связей вокруг каталитической триады. Сеть водородных связей важна для стабильной стереохимии вокруг каталитической триады:
- Arg-190,
- Tyr-369,
- Glu-318,
- His-332,
- Asp-191,
- Thr-293,
- Asp-119,
- His-144.
Также было обнаружено, что следующие гидрофобные остатки в β-фруктофуранозидазе Aspergillus niger принимают участие в формировании отрицательно заряженного кармана вокруг активного сайта:
- Leu-78,
- Phe-118,
- Ala-370,
- Trp-398,
- Ile-143.
Далее, были обнаружены следующие важные остатки β-фруктофуранозидазы Aspergillus niger, которые принимают участие во взаимодействиях на входе в активный карман:
- Glu-405,
- His-332,
- Tyr-404.
--->
СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> РЕВЕЛЕЙШНС БИОТЕК ПВТ ЛТД
<120> НУКЛЕИНОВЫЕ КИСЛОТЫ, ВЕКТОРЫ, КЛЕТКИ ХОЗЯИНА И СПОСОБЫ ПОЛУЧЕНИЯ
БЕТА-ФРУКТОФУРАНОЗИДАЗЫ ИЗ ASPERGILLUS NIGER
<130> IP51142
<150> IN201941048686
<151> 2019-11-27
<160> 27
<170> PatentIn version 3.5
<210> 1
<211> 654
<212> PRT
<213> Aspergillus niger
<400> 1
Met Lys Leu Thr Thr Thr Thr Leu Ala Leu Ala Thr Gly Ala Ala Ala
1 5 10 15
Ala Glu Ala Ser Tyr His Leu Asp Thr Thr Ala Pro Pro Pro Thr Asn
20 25 30
Leu Ser Thr Leu Pro Asn Asn Thr Leu Phe His Val Trp Arg Pro Arg
35 40 45
Ala His Ile Leu Pro Ala Glu Gly Gln Ile Gly Asp Pro Cys Ala His
50 55 60
Tyr Thr Asp Pro Ser Thr Gly Leu Phe His Val Gly Phe Leu His Asp
65 70 75 80
Gly Asp Gly Ile Ala Gly Ala Thr Thr Ala Asn Leu Ala Thr Tyr Thr
85 90 95
Asp Thr Ser Asp Asn Gly Ser Phe Leu Ile Gln Pro Gly Gly Lys Asn
100 105 110
Asp Pro Val Ala Val Phe Asp Gly Ala Val Ile Pro Val Gly Val Asn
115 120 125
Asn Thr Pro Thr Leu Leu Tyr Thr Ser Val Ser Phe Leu Pro Ile His
130 135 140
Trp Ser Ile Pro Tyr Thr Arg Gly Ser Glu Thr Gln Ser Leu Ala Val
145 150 155 160
Ala Arg Asp Gly Gly Arg Arg Phe Asp Lys Leu Asp Gln Gly Pro Val
165 170 175
Ile Ala Asp His Pro Phe Ala Val Asp Val Thr Ala Phe Arg Asp Pro
180 185 190
Phe Val Phe Arg Ser Ala Lys Leu Asp Val Leu Leu Ser Leu Asp Glu
195 200 205
Glu Val Ala Arg Asn Glu Thr Ala Val Gln Gln Ala Val Asp Gly Trp
210 215 220
Thr Glu Lys Asn Ala Pro Trp Tyr Val Ala Val Ser Gly Gly Val His
225 230 235 240
Gly Val Gly Pro Ala Gln Phe Leu Tyr Arg Gln Asn Gly Gly Asn Ala
245 250 255
Ser Glu Phe Gln Tyr Trp Glu Tyr Leu Gly Glu Trp Trp Gln Glu Ala
260 265 270
Thr Asn Ser Ser Trp Gly Asp Glu Gly Thr Trp Ala Gly Arg Trp Gly
275 280 285
Phe Asn Phe Glu Thr Gly Asn Val Leu Phe Leu Thr Glu Glu Gly His
290 295 300
Asp Pro Gln Thr Gly Glu Val Phe Val Thr Leu Gly Thr Glu Gly Ser
305 310 315 320
Gly Leu Pro Ile Val Pro Gln Val Ser Ser Ile His Asp Met Leu Trp
325 330 335
Ala Ala Gly Glu Val Gly Val Gly Ser Glu Gln Glu Gly Ala Lys Val
340 345 350
Glu Phe Ser Pro Ser Met Ala Gly Phe Leu Asp Trp Gly Phe Ser Ala
355 360 365
Tyr Ala Ala Ala Gly Lys Val Leu Pro Ala Ser Ser Ala Val Ser Lys
370 375 380
Thr Ser Gly Val Glu Val Asp Arg Tyr Val Ser Phe Val Trp Leu Thr
385 390 395 400
Gly Asp Gln Tyr Glu Gln Ala Asp Gly Phe Pro Thr Ala Gln Gln Gly
405 410 415
Trp Thr Gly Ser Leu Leu Leu Pro Arg Glu Leu Lys Val Gln Thr Val
420 425 430
Glu Asn Val Val Asp Asn Glu Leu Val Arg Glu Glu Gly Val Ser Trp
435 440 445
Val Val Gly Glu Ser Asp Asn Gln Thr Ala Arg Leu Arg Thr Leu Gly
450 455 460
Ile Thr Ile Ala Arg Glu Thr Lys Ala Ala Leu Leu Ala Asn Gly Ser
465 470 475 480
Val Thr Ala Glu Glu Asp Arg Thr Leu Gln Thr Ala Ala Val Val Pro
485 490 495
Phe Ala Gln Ser Pro Ser Ser Lys Phe Phe Val Leu Thr Ala Gln Leu
500 505 510
Glu Phe Pro Ala Ser Ala Arg Ser Ser Pro Leu Gln Ser Gly Phe Glu
515 520 525
Ile Leu Ala Ser Glu Leu Glu Arg Thr Ala Ile Tyr Tyr Gln Phe Ser
530 535 540
Asn Glu Ser Leu Val Val Asp Arg Ser Gln Thr Ser Ala Ala Ala Pro
545 550 555 560
Thr Asn Pro Gly Leu Asp Ser Phe Thr Glu Ser Gly Lys Leu Arg Leu
565 570 575
Phe Asp Val Ile Glu Asn Gly Gln Glu Gln Val Glu Thr Leu Asp Leu
580 585 590
Thr Val Val Val Asp Asn Ala Val Val Glu Val Tyr Ala Asn Gly Arg
595 600 605
Phe Ala Leu Ser Thr Trp Ala Arg Ser Trp Tyr Asp Asn Ser Thr Gln
610 615 620
Ile Arg Phe Phe His Asn Gly Glu Gly Glu Val Gln Phe Arg Asn Val
625 630 635 640
Ser Val Ser Glu Gly Leu Tyr Asn Ala Trp Pro Glu Arg Asn
645 650
<210> 2
<211> 1965
<212> DNA
<213> Artificial Sequence
<220>
<223> Modified nucleic acid sequence of the gene encoding
beta-fructofuranosidase
<400> 2
atgaaattga ctactactac tttggctttg gctactggtg ctgctgctgc tgaagcttct 60
taccatttgg atactactgc tccacctcca actaatttgt ctactttgcc taacaacact 120
ttgtttcatg tttggagacc aagagcccat attttgccag ctgaaggtca aattggagat 180
ccatgtgctc actacactga tccatctact ggtttgtttc atgttggttt cttgcacgat 240
ggagatggta ttgctggtgc tactactgct aatttggcta cttatactga tacttctgat 300
aacggttctt tcttgattca accaggtggt aaaaacgatc cagttgctgt tttcgatggt 360
gctgttattc ctgttggtgt taacaatact ccaactttgt tgtacacttc tgtttctttc 420
ttgcctattc attggtctat tccatatact agaggttctg aaactcaatc tttggctgtt 480
gctagagatg gtggtagaag attcgataaa ttggatcaag gtcctgttat tgctgatcac 540
ccatttgctg ttgatgttac tgctttcaga gatccttttg tttttagatc cgctaagttg 600
gatgttttgt tgtctttgga tgaagaggtt gctagaaatg agactgctgt tcaacaagct 660
gttgatggtt ggactgaaaa gaacgctcct tggtacgttg ctgtttctgg tggtgttcat 720
ggtgttggtc cagctcaatt tttgtataga caaaacggtg gtaatgcttc tgaattccaa 780
tactgggaat atttgggtga atggtggcaa gaagctacta attcttcttg gggagatgag 840
ggtacttggg ctggtagatg gggttttaac ttcgaaactg gtaacgtttt gtttttgact 900
gaagagggtc acgatccaca aactggagag gttttcgtta ctttgggtac tgaaggttct 960
ggtttgccta ttgttccaca agtttcttct attcacgata tgttgtgggc tgctggtgaa 1020
gttggtgttg gttctgaaca agagggtgct aaggttgaat tttctccttc tatggctggt 1080
ttcttggatt ggggtttctc tgcttacgct gctgctggta aagttttgcc agcttcttct 1140
gctgtttcta aaacttctgg tgttgaggtt gatagatacg tttcttttgt ttggttgact 1200
ggagatcaat atgaacaagc tgatggtttc cctactgctc aacaaggttg gactggttct 1260
ttgttgttgc caagagaatt gaaagttcaa actgttgaga acgttgttga taatgaattg 1320
gttagagaag agggtgtttc ttgggttgtt ggagagtctg ataatcaaac tgctagattg 1380
agaactttgg gtattactat tgctagagaa actaaggctg ctttgttggc taacggttct 1440
gttactgctg aagaggatag aactttgcaa actgctgctg ttgttccttt cgctcaatct 1500
ccatcttcta agtttttcgt tttgactgct caattggagt ttcctgcttc tgctagatcc 1560
tctccattgc aatctggttt cgaaattttg gcttctgaat tggagagaac tgctatctac 1620
taccaattct ctaacgagtc tttggttgtt gatagatccc aaacttctgc tgctgctcct 1680
actaacccag gtttggattc ttttactgag tctggtaaat tgagattgtt cgatgttatc 1740
gaaaacggtc aagaacaagt tgagactttg gatttgactg ttgttgttga taacgctgtt 1800
gttgaagttt acgctaatgg tagatttgct ttgtctactt gggctagatc ctggtacgat 1860
aactctactc aaatcagatt tttccacaat ggtgaaggag aggttcaatt cagaaacgtt 1920
tctgtttctg agggtttgta taacgcttgg ccagaaagaa attga 1965
<210> 3
<211> 85
<212> PRT
<213> Artificial Sequence
<220>
<223> Modified Alpha-factor of S. cerevisiae (FAK)
<400> 3
Met Arg Phe Pro Ser Ile Phe Thr Ala Val Leu Phe Ala Ala Ser Ser
1 5 10 15
Ala Leu Ala Ala Pro Val Asn Thr Thr Thr Glu Asp Glu Thr Ala Gln
20 25 30
Ile Pro Ala Glu Ala Val Ile Gly Tyr Ser Asp Leu Glu Gly Asp Phe
35 40 45
Asp Val Ala Val Leu Pro Phe Ser Asn Ser Thr Asn Asn Gly Leu Leu
50 55 60
Phe Ile Asn Thr Thr Ile Ala Ser Ile Ala Ala Lys Glu Glu Gly Val
65 70 75 80
Ser Leu Glu Lys Arg
85
<210> 4
<211> 89
<212> PRT
<213> Artificial Sequence
<220>
<223> Modified Alpha-factor full of S. cerevisiae (FAKS)
<400> 4
Met Arg Phe Pro Ser Ile Phe Thr Ala Val Leu Phe Ala Ala Ser Ser
1 5 10 15
Ala Leu Ala Ala Pro Val Asn Thr Thr Thr Glu Asp Glu Thr Ala Gln
20 25 30
Ile Pro Ala Glu Ala Val Ile Gly Tyr Ser Asp Leu Glu Gly Asp Phe
35 40 45
Asp Val Ala Val Leu Pro Phe Ser Asn Ser Thr Asn Asn Gly Leu Leu
50 55 60
Phe Ile Asn Thr Thr Ile Ala Ser Ile Ala Ala Lys Glu Glu Gly Val
65 70 75 80
Ser Leu Glu Lys Arg Glu Ala Glu Ala
85
<210> 5
<211> 23
<212> PRT
<213> Artificial Sequence
<220>
<223> Modified Alpha factor_T of S. cerevisiae (AT)
<400> 5
Met Arg Phe Pro Ser Ile Phe Thr Ala Val Leu Phe Ala Ala Ser Ser
1 5 10 15
Ala Leu Ala Leu Glu Lys Arg
20
<210> 6
<211> 24
<212> PRT
<213> Artificial Sequence
<220>
<223> Modified Alpha-amylase of Aspergillus niger (AA)
<400> 6
Met Val Ala Trp Trp Ser Leu Phe Leu Tyr Gly Leu Gln Val Ala Ala
1 5 10 15
Pro Ala Leu Ala Leu Glu Lys Arg
20
<210> 7
<211> 22
<212> PRT
<213> Artificial Sequence
<220>
<223> Modified Glucoamylase of Aspergillus awamori (GA)
<400> 7
Met Ser Phe Arg Ser Leu Leu Ala Leu Ser Gly Leu Val Cys Ser Gly
1 5 10 15
Leu Ala Leu Glu Lys Arg
20
<210> 8
<211> 20
<212> PRT
<213> Artificial Sequence
<220>
<223> Modified Inulinase of Kluyveromyces maxianus (IN)
<400> 8
Met Lys Leu Ala Tyr Ser Leu Leu Leu Pro Leu Ala Gly Val Ser Ala
1 5 10 15
Leu Glu Lys Arg
20
<210> 9
<211> 23
<212> PRT
<213> Artificial Sequence
<220>
<223> Modified Invertase of S. cerevisiae (IV)
<400> 9
Met Leu Leu Gln Ala Phe Leu Phe Leu Leu Ala Gly Phe Ala Ala Lys
1 5 10 15
Ile Ser Ala Leu Glu Lys Arg
20
<210> 10
<211> 30
<212> PRT
<213> Artificial Sequence
<220>
<223> Modified Killer protein of S. cerevisiae (KP)
<400> 10
Met Thr Lys Pro Thr Gln Val Leu Val Arg Ser Val Ser Ile Leu Phe
1 5 10 15
Phe Ile Thr Leu Leu His Leu Val Val Ala Leu Glu Lys Arg
20 25 30
<210> 11
<211> 30
<212> PRT
<213> Artificial Sequence
<220>
<223> Modified Lysozyme of Gallus gallus (LZ)
<400> 11
Met Leu Gly Lys Asn Asp Pro Met Cys Leu Val Leu Val Leu Leu Gly
1 5 10 15
Leu Thr Ala Leu Leu Gly Ile Cys Gln Gly Leu Glu Lys Arg
20 25 30
<210> 12
<211> 22
<212> PRT
<213> Artificial Sequence
<220>
<223> Modified Serum albumin of Homo sapiens (SA)
<400> 12
Met Lys Trp Val Thr Phe Ile Ser Leu Leu Phe Leu Phe Ser Ser Ala
1 5 10 15
Tyr Ser Leu Glu Lys Arg
20
<210> 13
<211> 2220
<212> DNA
<213> Artificial Sequence
<220>
<223> Alpha-factor (FAK) of S. cerevisiae fused to modified nucleic
acid of beta-fructofuranosidase gene
<400> 13
atgagatttc cttcaatttt tactgctgtt ttattcgcag catcctccgc attagctgct 60
ccagtcaaca ctacaacaga agatgaaacg gcacaaattc cggctgaagc tgtcatcggt 120
tactcagatt tagaagggga tttcgatgtt gctgttttgc cattttccaa cagcacaaat 180
aacgggttat tgtttataaa tactactatt gccagcattg ctgctaaaga agaaggggta 240
tctctcgaga agagaatgaa attgactact actactttgg ctttggctac tggtgctgct 300
gctgctgaag cttcttacca tttggatact actgctccac ctccaactaa tttgtctact 360
ttgcctaaca acactttgtt tcatgtttgg agaccaagag cccatatttt gccagctgaa 420
ggtcaaattg gagatccatg tgctcactac actgatccat ctactggttt gtttcatgtt 480
ggtttcttgc acgatggaga tggtattgct ggtgctacta ctgctaattt ggctacttat 540
actgatactt ctgataacgg ttctttcttg attcaaccag gtggtaaaaa cgatccagtt 600
gctgttttcg atggtgctgt tattcctgtt ggtgttaaca atactccaac tttgttgtac 660
acttctgttt ctttcttgcc tattcattgg tctattccat atactagagg ttctgaaact 720
caatctttgg ctgttgctag agatggtggt agaagattcg ataaattgga tcaaggtcct 780
gttattgctg atcacccatt tgctgttgat gttactgctt tcagagatcc ttttgttttt 840
agatccgcta agttggatgt tttgttgtct ttggatgaag aggttgctag aaatgagact 900
gctgttcaac aagctgttga tggttggact gaaaagaacg ctccttggta cgttgctgtt 960
tctggtggtg ttcatggtgt tggtccagct caatttttgt atagacaaaa cggtggtaat 1020
gcttctgaat tccaatactg ggaatatttg ggtgaatggt ggcaagaagc tactaattct 1080
tcttggggag atgagggtac ttgggctggt agatggggtt ttaacttcga aactggtaac 1140
gttttgtttt tgactgaaga gggtcacgat ccacaaactg gagaggtttt cgttactttg 1200
ggtactgaag gttctggttt gcctattgtt ccacaagttt cttctattca cgatatgttg 1260
tgggctgctg gtgaagttgg tgttggttct gaacaagagg gtgctaaggt tgaattttct 1320
ccttctatgg ctggtttctt ggattggggt ttctctgctt acgctgctgc tggtaaagtt 1380
ttgccagctt cttctgctgt ttctaaaact tctggtgttg aggttgatag atacgtttct 1440
tttgtttggt tgactggaga tcaatatgaa caagctgatg gtttccctac tgctcaacaa 1500
ggttggactg gttctttgtt gttgccaaga gaattgaaag ttcaaactgt tgagaacgtt 1560
gttgataatg aattggttag agaagagggt gtttcttggg ttgttggaga gtctgataat 1620
caaactgcta gattgagaac tttgggtatt actattgcta gagaaactaa ggctgctttg 1680
ttggctaacg gttctgttac tgctgaagag gatagaactt tgcaaactgc tgctgttgtt 1740
cctttcgctc aatctccatc ttctaagttt ttcgttttga ctgctcaatt ggagtttcct 1800
gcttctgcta gatcctctcc attgcaatct ggtttcgaaa ttttggcttc tgaattggag 1860
agaactgcta tctactacca attctctaac gagtctttgg ttgttgatag atcccaaact 1920
tctgctgctg ctcctactaa cccaggtttg gattctttta ctgagtctgg taaattgaga 1980
ttgttcgatg ttatcgaaaa cggtcaagaa caagttgaga ctttggattt gactgttgtt 2040
gttgataacg ctgttgttga agtttacgct aatggtagat ttgctttgtc tacttgggct 2100
agatcctggt acgataactc tactcaaatc agatttttcc acaatggtga aggagaggtt 2160
caattcagaa acgtttctgt ttctgagggt ttgtataacg cttggccaga aagaaattga 2220
<210> 14
<211> 2232
<212> DNA
<213> Artificial Sequence
<220>
<223> Alpha-factor full (FAKS) of S. cerevisiae fused to modified
nucleic acid of beta-fructofuranosidase gene
<400> 14
atgagatttc cttcaatttt tactgctgtt ttattcgcag catcctccgc attagctgct 60
ccagtcaaca ctacaacaga agatgaaacg gcacaaattc cggctgaagc tgtcatcggt 120
tactcagatt tagaagggga tttcgatgtt gctgttttgc cattttccaa cagcacaaat 180
aacgggttat tgtttataaa tactactatt gccagcattg ctgctaaaga agaaggggta 240
tctctcgaga agagagaggc tgaagctatg aaattgacta ctactacttt ggctttggct 300
actggtgctg ctgctgctga agcttcttac catttggata ctactgctcc acctccaact 360
aatttgtcta ctttgcctaa caacactttg tttcatgttt ggagaccaag agcccatatt 420
ttgccagctg aaggtcaaat tggagatcca tgtgctcact acactgatcc atctactggt 480
ttgtttcatg ttggtttctt gcacgatgga gatggtattg ctggtgctac tactgctaat 540
ttggctactt atactgatac ttctgataac ggttctttct tgattcaacc aggtggtaaa 600
aacgatccag ttgctgtttt cgatggtgct gttattcctg ttggtgttaa caatactcca 660
actttgttgt acacttctgt ttctttcttg cctattcatt ggtctattcc atatactaga 720
ggttctgaaa ctcaatcttt ggctgttgct agagatggtg gtagaagatt cgataaattg 780
gatcaaggtc ctgttattgc tgatcaccca tttgctgttg atgttactgc tttcagagat 840
ccttttgttt ttagatccgc taagttggat gttttgttgt ctttggatga agaggttgct 900
agaaatgaga ctgctgttca acaagctgtt gatggttgga ctgaaaagaa cgctccttgg 960
tacgttgctg tttctggtgg tgttcatggt gttggtccag ctcaattttt gtatagacaa 1020
aacggtggta atgcttctga attccaatac tgggaatatt tgggtgaatg gtggcaagaa 1080
gctactaatt cttcttgggg agatgagggt acttgggctg gtagatgggg ttttaacttc 1140
gaaactggta acgttttgtt tttgactgaa gagggtcacg atccacaaac tggagaggtt 1200
ttcgttactt tgggtactga aggttctggt ttgcctattg ttccacaagt ttcttctatt 1260
cacgatatgt tgtgggctgc tggtgaagtt ggtgttggtt ctgaacaaga gggtgctaag 1320
gttgaatttt ctccttctat ggctggtttc ttggattggg gtttctctgc ttacgctgct 1380
gctggtaaag ttttgccagc ttcttctgct gtttctaaaa cttctggtgt tgaggttgat 1440
agatacgttt cttttgtttg gttgactgga gatcaatatg aacaagctga tggtttccct 1500
actgctcaac aaggttggac tggttctttg ttgttgccaa gagaattgaa agttcaaact 1560
gttgagaacg ttgttgataa tgaattggtt agagaagagg gtgtttcttg ggttgttgga 1620
gagtctgata atcaaactgc tagattgaga actttgggta ttactattgc tagagaaact 1680
aaggctgctt tgttggctaa cggttctgtt actgctgaag aggatagaac tttgcaaact 1740
gctgctgttg ttcctttcgc tcaatctcca tcttctaagt ttttcgtttt gactgctcaa 1800
ttggagtttc ctgcttctgc tagatcctct ccattgcaat ctggtttcga aattttggct 1860
tctgaattgg agagaactgc tatctactac caattctcta acgagtcttt ggttgttgat 1920
agatcccaaa cttctgctgc tgctcctact aacccaggtt tggattcttt tactgagtct 1980
ggtaaattga gattgttcga tgttatcgaa aacggtcaag aacaagttga gactttggat 2040
ttgactgttg ttgttgataa cgctgttgtt gaagtttacg ctaatggtag atttgctttg 2100
tctacttggg ctagatcctg gtacgataac tctactcaaa tcagattttt ccacaatggt 2160
gaaggagagg ttcaattcag aaacgtttct gtttctgagg gtttgtataa cgcttggcca 2220
gaaagaaatt ga 2232
<210> 15
<211> 2034
<212> DNA
<213> Artificial Sequence
<220>
<223> Alpha-factor_T (AT) of S. cerevisiae fused to modified nucleic
acid of beta-fructofuranosidase gene
<400> 15
atgagatttc cttcaatttt tactgctgtt ttattcgcag catcctccgc attagctctc 60
gagaagagaa tgaaattgac tactactact ttggctttgg ctactggtgc tgctgctgct 120
gaagcttctt accatttgga tactactgct ccacctccaa ctaatttgtc tactttgcct 180
aacaacactt tgtttcatgt ttggagacca agagcccata ttttgccagc tgaaggtcaa 240
attggagatc catgtgctca ctacactgat ccatctactg gtttgtttca tgttggtttc 300
ttgcacgatg gagatggtat tgctggtgct actactgcta atttggctac ttatactgat 360
acttctgata acggttcttt cttgattcaa ccaggtggta aaaacgatcc agttgctgtt 420
ttcgatggtg ctgttattcc tgttggtgtt aacaatactc caactttgtt gtacacttct 480
gtttctttct tgcctattca ttggtctatt ccatatacta gaggttctga aactcaatct 540
ttggctgttg ctagagatgg tggtagaaga ttcgataaat tggatcaagg tcctgttatt 600
gctgatcacc catttgctgt tgatgttact gctttcagag atccttttgt ttttagatcc 660
gctaagttgg atgttttgtt gtctttggat gaagaggttg ctagaaatga gactgctgtt 720
caacaagctg ttgatggttg gactgaaaag aacgctcctt ggtacgttgc tgtttctggt 780
ggtgttcatg gtgttggtcc agctcaattt ttgtatagac aaaacggtgg taatgcttct 840
gaattccaat actgggaata tttgggtgaa tggtggcaag aagctactaa ttcttcttgg 900
ggagatgagg gtacttgggc tggtagatgg ggttttaact tcgaaactgg taacgttttg 960
tttttgactg aagagggtca cgatccacaa actggagagg ttttcgttac tttgggtact 1020
gaaggttctg gtttgcctat tgttccacaa gtttcttcta ttcacgatat gttgtgggct 1080
gctggtgaag ttggtgttgg ttctgaacaa gagggtgcta aggttgaatt ttctccttct 1140
atggctggtt tcttggattg gggtttctct gcttacgctg ctgctggtaa agttttgcca 1200
gcttcttctg ctgtttctaa aacttctggt gttgaggttg atagatacgt ttcttttgtt 1260
tggttgactg gagatcaata tgaacaagct gatggtttcc ctactgctca acaaggttgg 1320
actggttctt tgttgttgcc aagagaattg aaagttcaaa ctgttgagaa cgttgttgat 1380
aatgaattgg ttagagaaga gggtgtttct tgggttgttg gagagtctga taatcaaact 1440
gctagattga gaactttggg tattactatt gctagagaaa ctaaggctgc tttgttggct 1500
aacggttctg ttactgctga agaggataga actttgcaaa ctgctgctgt tgttcctttc 1560
gctcaatctc catcttctaa gtttttcgtt ttgactgctc aattggagtt tcctgcttct 1620
gctagatcct ctccattgca atctggtttc gaaattttgg cttctgaatt ggagagaact 1680
gctatctact accaattctc taacgagtct ttggttgttg atagatccca aacttctgct 1740
gctgctccta ctaacccagg tttggattct tttactgagt ctggtaaatt gagattgttc 1800
gatgttatcg aaaacggtca agaacaagtt gagactttgg atttgactgt tgttgttgat 1860
aacgctgttg ttgaagttta cgctaatggt agatttgctt tgtctacttg ggctagatcc 1920
tggtacgata actctactca aatcagattt ttccacaatg gtgaaggaga ggttcaattc 1980
agaaacgttt ctgtttctga gggtttgtat aacgcttggc cagaaagaaa ttga 2034
<210> 16
<211> 2037
<212> DNA
<213> Artificial Sequence
<220>
<223> Alpha-amylase (AA) of Aspergillus niger fused to modified nucleic
acid of beta-fructofuranosidase gene
<400> 16
atggttgctt ggtggagtct tttcctatac ggtctacagg tggcagctcc agcccttgcc 60
ctcgagaaga gaatgaaatt gactactact actttggctt tggctactgg tgctgctgct 120
gctgaagctt cttaccattt ggatactact gctccacctc caactaattt gtctactttg 180
cctaacaaca ctttgtttca tgtttggaga ccaagagccc atattttgcc agctgaaggt 240
caaattggag atccatgtgc tcactacact gatccatcta ctggtttgtt tcatgttggt 300
ttcttgcacg atggagatgg tattgctggt gctactactg ctaatttggc tacttatact 360
gatacttctg ataacggttc tttcttgatt caaccaggtg gtaaaaacga tccagttgct 420
gttttcgatg gtgctgttat tcctgttggt gttaacaata ctccaacttt gttgtacact 480
tctgtttctt tcttgcctat tcattggtct attccatata ctagaggttc tgaaactcaa 540
tctttggctg ttgctagaga tggtggtaga agattcgata aattggatca aggtcctgtt 600
attgctgatc acccatttgc tgttgatgtt actgctttca gagatccttt tgtttttaga 660
tccgctaagt tggatgtttt gttgtctttg gatgaagagg ttgctagaaa tgagactgct 720
gttcaacaag ctgttgatgg ttggactgaa aagaacgctc cttggtacgt tgctgtttct 780
ggtggtgttc atggtgttgg tccagctcaa tttttgtata gacaaaacgg tggtaatgct 840
tctgaattcc aatactggga atatttgggt gaatggtggc aagaagctac taattcttct 900
tggggagatg agggtacttg ggctggtaga tggggtttta acttcgaaac tggtaacgtt 960
ttgtttttga ctgaagaggg tcacgatcca caaactggag aggttttcgt tactttgggt 1020
actgaaggtt ctggtttgcc tattgttcca caagtttctt ctattcacga tatgttgtgg 1080
gctgctggtg aagttggtgt tggttctgaa caagagggtg ctaaggttga attttctcct 1140
tctatggctg gtttcttgga ttggggtttc tctgcttacg ctgctgctgg taaagttttg 1200
ccagcttctt ctgctgtttc taaaacttct ggtgttgagg ttgatagata cgtttctttt 1260
gtttggttga ctggagatca atatgaacaa gctgatggtt tccctactgc tcaacaaggt 1320
tggactggtt ctttgttgtt gccaagagaa ttgaaagttc aaactgttga gaacgttgtt 1380
gataatgaat tggttagaga agagggtgtt tcttgggttg ttggagagtc tgataatcaa 1440
actgctagat tgagaacttt gggtattact attgctagag aaactaaggc tgctttgttg 1500
gctaacggtt ctgttactgc tgaagaggat agaactttgc aaactgctgc tgttgttcct 1560
ttcgctcaat ctccatcttc taagtttttc gttttgactg ctcaattgga gtttcctgct 1620
tctgctagat cctctccatt gcaatctggt ttcgaaattt tggcttctga attggagaga 1680
actgctatct actaccaatt ctctaacgag tctttggttg ttgatagatc ccaaacttct 1740
gctgctgctc ctactaaccc aggtttggat tcttttactg agtctggtaa attgagattg 1800
ttcgatgtta tcgaaaacgg tcaagaacaa gttgagactt tggatttgac tgttgttgtt 1860
gataacgctg ttgttgaagt ttacgctaat ggtagatttg ctttgtctac ttgggctaga 1920
tcctggtacg ataactctac tcaaatcaga tttttccaca atggtgaagg agaggttcaa 1980
ttcagaaacg tttctgtttc tgagggtttg tataacgctt ggccagaaag aaattga 2037
<210> 17
<211> 2031
<212> DNA
<213> Artificial Sequence
<220>
<223> Glucoamylase (GA) of Aspergillus awamori fused to modified
nucleic acid of beta-fructofuranosidase gene
<400> 17
atgtctttcc gatctctttt agccctatct ggacttgttt gttcaggttt ggctctcgag 60
aagagaatga aattgactac tactactttg gctttggcta ctggtgctgc tgctgctgaa 120
gcttcttacc atttggatac tactgctcca cctccaacta atttgtctac tttgcctaac 180
aacactttgt ttcatgtttg gagaccaaga gcccatattt tgccagctga aggtcaaatt 240
ggagatccat gtgctcacta cactgatcca tctactggtt tgtttcatgt tggtttcttg 300
cacgatggag atggtattgc tggtgctact actgctaatt tggctactta tactgatact 360
tctgataacg gttctttctt gattcaacca ggtggtaaaa acgatccagt tgctgttttc 420
gatggtgctg ttattcctgt tggtgttaac aatactccaa ctttgttgta cacttctgtt 480
tctttcttgc ctattcattg gtctattcca tatactagag gttctgaaac tcaatctttg 540
gctgttgcta gagatggtgg tagaagattc gataaattgg atcaaggtcc tgttattgct 600
gatcacccat ttgctgttga tgttactgct ttcagagatc cttttgtttt tagatccgct 660
aagttggatg ttttgttgtc tttggatgaa gaggttgcta gaaatgagac tgctgttcaa 720
caagctgttg atggttggac tgaaaagaac gctccttggt acgttgctgt ttctggtggt 780
gttcatggtg ttggtccagc tcaatttttg tatagacaaa acggtggtaa tgcttctgaa 840
ttccaatact gggaatattt gggtgaatgg tggcaagaag ctactaattc ttcttgggga 900
gatgagggta cttgggctgg tagatggggt tttaacttcg aaactggtaa cgttttgttt 960
ttgactgaag agggtcacga tccacaaact ggagaggttt tcgttacttt gggtactgaa 1020
ggttctggtt tgcctattgt tccacaagtt tcttctattc acgatatgtt gtgggctgct 1080
ggtgaagttg gtgttggttc tgaacaagag ggtgctaagg ttgaattttc tccttctatg 1140
gctggtttct tggattgggg tttctctgct tacgctgctg ctggtaaagt tttgccagct 1200
tcttctgctg tttctaaaac ttctggtgtt gaggttgata gatacgtttc ttttgtttgg 1260
ttgactggag atcaatatga acaagctgat ggtttcccta ctgctcaaca aggttggact 1320
ggttctttgt tgttgccaag agaattgaaa gttcaaactg ttgagaacgt tgttgataat 1380
gaattggtta gagaagaggg tgtttcttgg gttgttggag agtctgataa tcaaactgct 1440
agattgagaa ctttgggtat tactattgct agagaaacta aggctgcttt gttggctaac 1500
ggttctgtta ctgctgaaga ggatagaact ttgcaaactg ctgctgttgt tcctttcgct 1560
caatctccat cttctaagtt tttcgttttg actgctcaat tggagtttcc tgcttctgct 1620
agatcctctc cattgcaatc tggtttcgaa attttggctt ctgaattgga gagaactgct 1680
atctactacc aattctctaa cgagtctttg gttgttgata gatcccaaac ttctgctgct 1740
gctcctacta acccaggttt ggattctttt actgagtctg gtaaattgag attgttcgat 1800
gttatcgaaa acggtcaaga acaagttgag actttggatt tgactgttgt tgttgataac 1860
gctgttgttg aagtttacgc taatggtaga tttgctttgt ctacttgggc tagatcctgg 1920
tacgataact ctactcaaat cagatttttc cacaatggtg aaggagaggt tcaattcaga 1980
aacgtttctg tttctgaggg tttgtataac gcttggccag aaagaaattg a 2031
<210> 18
<211> 2025
<212> DNA
<213> Artificial Sequence
<220>
<223> Inulinase (IN) of Kluyveromyces maxianus fused to modified
nucleic acid of beta-fructofuranosidase gene
<400> 18
atgaagttgg cttattctct tcttcttcct ctggccggag tgtctgccct cgagaagaga 60
atgaaattga ctactactac tttggctttg gctactggtg ctgctgctgc tgaagcttct 120
taccatttgg atactactgc tccacctcca actaatttgt ctactttgcc taacaacact 180
ttgtttcatg tttggagacc aagagcccat attttgccag ctgaaggtca aattggagat 240
ccatgtgctc actacactga tccatctact ggtttgtttc atgttggttt cttgcacgat 300
ggagatggta ttgctggtgc tactactgct aatttggcta cttatactga tacttctgat 360
aacggttctt tcttgattca accaggtggt aaaaacgatc cagttgctgt tttcgatggt 420
gctgttattc ctgttggtgt taacaatact ccaactttgt tgtacacttc tgtttctttc 480
ttgcctattc attggtctat tccatatact agaggttctg aaactcaatc tttggctgtt 540
gctagagatg gtggtagaag attcgataaa ttggatcaag gtcctgttat tgctgatcac 600
ccatttgctg ttgatgttac tgctttcaga gatccttttg tttttagatc cgctaagttg 660
gatgttttgt tgtctttgga tgaagaggtt gctagaaatg agactgctgt tcaacaagct 720
gttgatggtt ggactgaaaa gaacgctcct tggtacgttg ctgtttctgg tggtgttcat 780
ggtgttggtc cagctcaatt tttgtataga caaaacggtg gtaatgcttc tgaattccaa 840
tactgggaat atttgggtga atggtggcaa gaagctacta attcttcttg gggagatgag 900
ggtacttggg ctggtagatg gggttttaac ttcgaaactg gtaacgtttt gtttttgact 960
gaagagggtc acgatccaca aactggagag gttttcgtta ctttgggtac tgaaggttct 1020
ggtttgccta ttgttccaca agtttcttct attcacgata tgttgtgggc tgctggtgaa 1080
gttggtgttg gttctgaaca agagggtgct aaggttgaat tttctccttc tatggctggt 1140
ttcttggatt ggggtttctc tgcttacgct gctgctggta aagttttgcc agcttcttct 1200
gctgtttcta aaacttctgg tgttgaggtt gatagatacg tttcttttgt ttggttgact 1260
ggagatcaat atgaacaagc tgatggtttc cctactgctc aacaaggttg gactggttct 1320
ttgttgttgc caagagaatt gaaagttcaa actgttgaga acgttgttga taatgaattg 1380
gttagagaag agggtgtttc ttgggttgtt ggagagtctg ataatcaaac tgctagattg 1440
agaactttgg gtattactat tgctagagaa actaaggctg ctttgttggc taacggttct 1500
gttactgctg aagaggatag aactttgcaa actgctgctg ttgttccttt cgctcaatct 1560
ccatcttcta agtttttcgt tttgactgct caattggagt ttcctgcttc tgctagatcc 1620
tctccattgc aatctggttt cgaaattttg gcttctgaat tggagagaac tgctatctac 1680
taccaattct ctaacgagtc tttggttgtt gatagatccc aaacttctgc tgctgctcct 1740
actaacccag gtttggattc ttttactgag tctggtaaat tgagattgtt cgatgttatc 1800
gaaaacggtc aagaacaagt tgagactttg gatttgactg ttgttgttga taacgctgtt 1860
gttgaagttt acgctaatgg tagatttgct ttgtctactt gggctagatc ctggtacgat 1920
aactctactc aaatcagatt tttccacaat ggtgaaggag aggttcaatt cagaaacgtt 1980
tctgtttctg agggtttgta taacgcttgg ccagaaagaa attga 2025
<210> 19
<211> 2034
<212> DNA
<213> Artificial Sequence
<220>
<223> Invertase (IV) of S.cerevisiae fused to modified nucleic acid of
beta-fructofuranosidase gene
<400> 19
atgcttttgc aggctttcct gttcttgctg gccggattcg ctgctaaaat ttccgctctc 60
gagaagagaa tgaaattgac tactactact ttggctttgg ctactggtgc tgctgctgct 120
gaagcttctt accatttgga tactactgct ccacctccaa ctaatttgtc tactttgcct 180
aacaacactt tgtttcatgt ttggagacca agagcccata ttttgccagc tgaaggtcaa 240
attggagatc catgtgctca ctacactgat ccatctactg gtttgtttca tgttggtttc 300
ttgcacgatg gagatggtat tgctggtgct actactgcta atttggctac ttatactgat 360
acttctgata acggttcttt cttgattcaa ccaggtggta aaaacgatcc agttgctgtt 420
ttcgatggtg ctgttattcc tgttggtgtt aacaatactc caactttgtt gtacacttct 480
gtttctttct tgcctattca ttggtctatt ccatatacta gaggttctga aactcaatct 540
ttggctgttg ctagagatgg tggtagaaga ttcgataaat tggatcaagg tcctgttatt 600
gctgatcacc catttgctgt tgatgttact gctttcagag atccttttgt ttttagatcc 660
gctaagttgg atgttttgtt gtctttggat gaagaggttg ctagaaatga gactgctgtt 720
caacaagctg ttgatggttg gactgaaaag aacgctcctt ggtacgttgc tgtttctggt 780
ggtgttcatg gtgttggtcc agctcaattt ttgtatagac aaaacggtgg taatgcttct 840
gaattccaat actgggaata tttgggtgaa tggtggcaag aagctactaa ttcttcttgg 900
ggagatgagg gtacttgggc tggtagatgg ggttttaact tcgaaactgg taacgttttg 960
tttttgactg aagagggtca cgatccacaa actggagagg ttttcgttac tttgggtact 1020
gaaggttctg gtttgcctat tgttccacaa gtttcttcta ttcacgatat gttgtgggct 1080
gctggtgaag ttggtgttgg ttctgaacaa gagggtgcta aggttgaatt ttctccttct 1140
atggctggtt tcttggattg gggtttctct gcttacgctg ctgctggtaa agttttgcca 1200
gcttcttctg ctgtttctaa aacttctggt gttgaggttg atagatacgt ttcttttgtt 1260
tggttgactg gagatcaata tgaacaagct gatggtttcc ctactgctca acaaggttgg 1320
actggttctt tgttgttgcc aagagaattg aaagttcaaa ctgttgagaa cgttgttgat 1380
aatgaattgg ttagagaaga gggtgtttct tgggttgttg gagagtctga taatcaaact 1440
gctagattga gaactttggg tattactatt gctagagaaa ctaaggctgc tttgttggct 1500
aacggttctg ttactgctga agaggataga actttgcaaa ctgctgctgt tgttcctttc 1560
gctcaatctc catcttctaa gtttttcgtt ttgactgctc aattggagtt tcctgcttct 1620
gctagatcct ctccattgca atctggtttc gaaattttgg cttctgaatt ggagagaact 1680
gctatctact accaattctc taacgagtct ttggttgttg atagatccca aacttctgct 1740
gctgctccta ctaacccagg tttggattct tttactgagt ctggtaaatt gagattgttc 1800
gatgttatcg aaaacggtca agaacaagtt gagactttgg atttgactgt tgttgttgat 1860
aacgctgttg ttgaagttta cgctaatggt agatttgctt tgtctacttg ggctagatcc 1920
tggtacgata actctactca aatcagattt ttccacaatg gtgaaggaga ggttcaattc 1980
agaaacgttt ctgtttctga gggtttgtat aacgcttggc cagaaagaaa ttga 2034
<210> 20
<211> 2055
<212> DNA
<213> Artificial Sequence
<220>
<223> Killer protein (KP) of S.cerevisiae fused to modified nucleic
acid of beta-fructofuranosidase gene
<400> 20
atgaccaaac caactcaagt tttggtgagg tctgtgtcaa tcctgttctt cattacttta 60
ctgcaccttg tagtcgcact cgagaagaga atgaaattga ctactactac tttggctttg 120
gctactggtg ctgctgctgc tgaagcttct taccatttgg atactactgc tccacctcca 180
actaatttgt ctactttgcc taacaacact ttgtttcatg tttggagacc aagagcccat 240
attttgccag ctgaaggtca aattggagat ccatgtgctc actacactga tccatctact 300
ggtttgtttc atgttggttt cttgcacgat ggagatggta ttgctggtgc tactactgct 360
aatttggcta cttatactga tacttctgat aacggttctt tcttgattca accaggtggt 420
aaaaacgatc cagttgctgt tttcgatggt gctgttattc ctgttggtgt taacaatact 480
ccaactttgt tgtacacttc tgtttctttc ttgcctattc attggtctat tccatatact 540
agaggttctg aaactcaatc tttggctgtt gctagagatg gtggtagaag attcgataaa 600
ttggatcaag gtcctgttat tgctgatcac ccatttgctg ttgatgttac tgctttcaga 660
gatccttttg tttttagatc cgctaagttg gatgttttgt tgtctttgga tgaagaggtt 720
gctagaaatg agactgctgt tcaacaagct gttgatggtt ggactgaaaa gaacgctcct 780
tggtacgttg ctgtttctgg tggtgttcat ggtgttggtc cagctcaatt tttgtataga 840
caaaacggtg gtaatgcttc tgaattccaa tactgggaat atttgggtga atggtggcaa 900
gaagctacta attcttcttg gggagatgag ggtacttggg ctggtagatg gggttttaac 960
ttcgaaactg gtaacgtttt gtttttgact gaagagggtc acgatccaca aactggagag 1020
gttttcgtta ctttgggtac tgaaggttct ggtttgccta ttgttccaca agtttcttct 1080
attcacgata tgttgtgggc tgctggtgaa gttggtgttg gttctgaaca agagggtgct 1140
aaggttgaat tttctccttc tatggctggt ttcttggatt ggggtttctc tgcttacgct 1200
gctgctggta aagttttgcc agcttcttct gctgtttcta aaacttctgg tgttgaggtt 1260
gatagatacg tttcttttgt ttggttgact ggagatcaat atgaacaagc tgatggtttc 1320
cctactgctc aacaaggttg gactggttct ttgttgttgc caagagaatt gaaagttcaa 1380
actgttgaga acgttgttga taatgaattg gttagagaag agggtgtttc ttgggttgtt 1440
ggagagtctg ataatcaaac tgctagattg agaactttgg gtattactat tgctagagaa 1500
actaaggctg ctttgttggc taacggttct gttactgctg aagaggatag aactttgcaa 1560
actgctgctg ttgttccttt cgctcaatct ccatcttcta agtttttcgt tttgactgct 1620
caattggagt ttcctgcttc tgctagatcc tctccattgc aatctggttt cgaaattttg 1680
gcttctgaat tggagagaac tgctatctac taccaattct ctaacgagtc tttggttgtt 1740
gatagatccc aaacttctgc tgctgctcct actaacccag gtttggattc ttttactgag 1800
tctggtaaat tgagattgtt cgatgttatc gaaaacggtc aagaacaagt tgagactttg 1860
gatttgactg ttgttgttga taacgctgtt gttgaagttt acgctaatgg tagatttgct 1920
ttgtctactt gggctagatc ctggtacgat aactctactc aaatcagatt tttccacaat 1980
ggtgaaggag aggttcaatt cagaaacgtt tctgtttctg agggtttgta taacgcttgg 2040
ccagaaagaa attga 2055
<210> 21
<211> 2055
<212> DNA
<213> Artificial Sequence
<220>
<223> Lysozyme (LZ) of Gallus gallus fused to modified nucleic acid of
beta-fructofuranosidase gene
<400> 21
atgctaggca aaaatgaccc tatgtgtttg gttctggttt tgcttggttt aaccgcttta 60
cttggtatct gtcaaggtct cgagaagaga atgaaattga ctactactac tttggctttg 120
gctactggtg ctgctgctgc tgaagcttct taccatttgg atactactgc tccacctcca 180
actaatttgt ctactttgcc taacaacact ttgtttcatg tttggagacc aagagcccat 240
attttgccag ctgaaggtca aattggagat ccatgtgctc actacactga tccatctact 300
ggtttgtttc atgttggttt cttgcacgat ggagatggta ttgctggtgc tactactgct 360
aatttggcta cttatactga tacttctgat aacggttctt tcttgattca accaggtggt 420
aaaaacgatc cagttgctgt tttcgatggt gctgttattc ctgttggtgt taacaatact 480
ccaactttgt tgtacacttc tgtttctttc ttgcctattc attggtctat tccatatact 540
agaggttctg aaactcaatc tttggctgtt gctagagatg gtggtagaag attcgataaa 600
ttggatcaag gtcctgttat tgctgatcac ccatttgctg ttgatgttac tgctttcaga 660
gatccttttg tttttagatc cgctaagttg gatgttttgt tgtctttgga tgaagaggtt 720
gctagaaatg agactgctgt tcaacaagct gttgatggtt ggactgaaaa gaacgctcct 780
tggtacgttg ctgtttctgg tggtgttcat ggtgttggtc cagctcaatt tttgtataga 840
caaaacggtg gtaatgcttc tgaattccaa tactgggaat atttgggtga atggtggcaa 900
gaagctacta attcttcttg gggagatgag ggtacttggg ctggtagatg gggttttaac 960
ttcgaaactg gtaacgtttt gtttttgact gaagagggtc acgatccaca aactggagag 1020
gttttcgtta ctttgggtac tgaaggttct ggtttgccta ttgttccaca agtttcttct 1080
attcacgata tgttgtgggc tgctggtgaa gttggtgttg gttctgaaca agagggtgct 1140
aaggttgaat tttctccttc tatggctggt ttcttggatt ggggtttctc tgcttacgct 1200
gctgctggta aagttttgcc agcttcttct gctgtttcta aaacttctgg tgttgaggtt 1260
gatagatacg tttcttttgt ttggttgact ggagatcaat atgaacaagc tgatggtttc 1320
cctactgctc aacaaggttg gactggttct ttgttgttgc caagagaatt gaaagttcaa 1380
actgttgaga acgttgttga taatgaattg gttagagaag agggtgtttc ttgggttgtt 1440
ggagagtctg ataatcaaac tgctagattg agaactttgg gtattactat tgctagagaa 1500
actaaggctg ctttgttggc taacggttct gttactgctg aagaggatag aactttgcaa 1560
actgctgctg ttgttccttt cgctcaatct ccatcttcta agtttttcgt tttgactgct 1620
caattggagt ttcctgcttc tgctagatcc tctccattgc aatctggttt cgaaattttg 1680
gcttctgaat tggagagaac tgctatctac taccaattct ctaacgagtc tttggttgtt 1740
gatagatccc aaacttctgc tgctgctcct actaacccag gtttggattc ttttactgag 1800
tctggtaaat tgagattgtt cgatgttatc gaaaacggtc aagaacaagt tgagactttg 1860
gatttgactg ttgttgttga taacgctgtt gttgaagttt acgctaatgg tagatttgct 1920
ttgtctactt gggctagatc ctggtacgat aactctactc aaatcagatt tttccacaat 1980
ggtgaaggag aggttcaatt cagaaacgtt tctgtttctg agggtttgta taacgcttgg 2040
ccagaaagaa attga 2055
<210> 22
<211> 2031
<212> DNA
<213> Artificial Sequence
<220>
<223> Serum albumin (SA) of Homo sapiens fused to modified nucleic acid
of beta-fructofuranosidase gene
<400> 22
atgaagtggg taacatttat ttccctactg tttctttttt cttcagctta ctctctcgag 60
aagagaatga aattgactac tactactttg gctttggcta ctggtgctgc tgctgctgaa 120
gcttcttacc atttggatac tactgctcca cctccaacta atttgtctac tttgcctaac 180
aacactttgt ttcatgtttg gagaccaaga gcccatattt tgccagctga aggtcaaatt 240
ggagatccat gtgctcacta cactgatcca tctactggtt tgtttcatgt tggtttcttg 300
cacgatggag atggtattgc tggtgctact actgctaatt tggctactta tactgatact 360
tctgataacg gttctttctt gattcaacca ggtggtaaaa acgatccagt tgctgttttc 420
gatggtgctg ttattcctgt tggtgttaac aatactccaa ctttgttgta cacttctgtt 480
tctttcttgc ctattcattg gtctattcca tatactagag gttctgaaac tcaatctttg 540
gctgttgcta gagatggtgg tagaagattc gataaattgg atcaaggtcc tgttattgct 600
gatcacccat ttgctgttga tgttactgct ttcagagatc cttttgtttt tagatccgct 660
aagttggatg ttttgttgtc tttggatgaa gaggttgcta gaaatgagac tgctgttcaa 720
caagctgttg atggttggac tgaaaagaac gctccttggt acgttgctgt ttctggtggt 780
gttcatggtg ttggtccagc tcaatttttg tatagacaaa acggtggtaa tgcttctgaa 840
ttccaatact gggaatattt gggtgaatgg tggcaagaag ctactaattc ttcttgggga 900
gatgagggta cttgggctgg tagatggggt tttaacttcg aaactggtaa cgttttgttt 960
ttgactgaag agggtcacga tccacaaact ggagaggttt tcgttacttt gggtactgaa 1020
ggttctggtt tgcctattgt tccacaagtt tcttctattc acgatatgtt gtgggctgct 1080
ggtgaagttg gtgttggttc tgaacaagag ggtgctaagg ttgaattttc tccttctatg 1140
gctggtttct tggattgggg tttctctgct tacgctgctg ctggtaaagt tttgccagct 1200
tcttctgctg tttctaaaac ttctggtgtt gaggttgata gatacgtttc ttttgtttgg 1260
ttgactggag atcaatatga acaagctgat ggtttcccta ctgctcaaca aggttggact 1320
ggttctttgt tgttgccaag agaattgaaa gttcaaactg ttgagaacgt tgttgataat 1380
gaattggtta gagaagaggg tgtttcttgg gttgttggag agtctgataa tcaaactgct 1440
agattgagaa ctttgggtat tactattgct agagaaacta aggctgcttt gttggctaac 1500
ggttctgtta ctgctgaaga ggatagaact ttgcaaactg ctgctgttgt tcctttcgct 1560
caatctccat cttctaagtt tttcgttttg actgctcaat tggagtttcc tgcttctgct 1620
agatcctctc cattgcaatc tggtttcgaa attttggctt ctgaattgga gagaactgct 1680
atctactacc aattctctaa cgagtctttg gttgttgata gatcccaaac ttctgctgct 1740
gctcctacta acccaggttt ggattctttt actgagtctg gtaaattgag attgttcgat 1800
gttatcgaaa acggtcaaga acaagttgag actttggatt tgactgttgt tgttgataac 1860
gctgttgttg aagtttacgc taatggtaga tttgctttgt ctacttgggc tagatcctgg 1920
tacgataact ctactcaaat cagatttttc cacaatggtg aaggagaggt tcaattcaga 1980
aacgtttctg tttctgaggg tttgtataac gcttggccag aaagaaattg a 2031
<210> 23
<211> 1965
<212> DNA
<213> Aspergillus niger
<400> 23
atgaagctca ccactaccac cctggcgctc gccaccggcg cagcagcagc agaagcctca 60
taccacctgg acaccacggc cccgccgccg accaacctca gcaccctccc caacaacacc 120
ctcttccacg tgtggcggcc gcgcgcgcac atcctgcccg ccgagggcca gatcggcgac 180
ccctgcgcgc actacaccga cccatccacc ggcctcttcc acgtggggtt cctgcacgac 240
ggggacggca tcgcgggcgc caccacggcc aacctggcca cctacaccga tacctccgat 300
aacgggagct tcctgatcca gccgggcggg aagaacgacc ccgtcgccgt gttcgacggc 360
gccgtcatcc ccgtcggcgt caacaacacc cccaccttac tctacacctc cgtctccttc 420
ctgcccatcc actggtccat cccctacacc cgcggcagcg agacgcagtc gttggccgtc 480
gcgcgcgacg gcggccgccg cttcgacaag ctcgaccagg gccccgtcat cgccgaccac 540
cccttcgccg tcgacgtcac cgccttccgc gatccgtttg tcttccgcag tgccaagttg 600
gatgtgctgc tgtcgttgga tgaggaggtg gcgcggaatg agacggccgt gcagcaggcc 660
gtcgatggct ggaccgagaa gaacgccccc tggtatgtcg cggtctctgg cggggtgcac 720
ggcgtcgggc ccgcgcagtt cctctaccgc cagaacggcg ggaacgcttc cgagttccag 780
tactgggagt acctcgggga gtggtggcag gaggcgacca actccagctg gggcgacgag 840
ggcacctggg ccgggcgctg ggggttcaac ttcgagacgg ggaatgtgct cttcctcacc 900
gaggagggcc atgaccccca gacgggcgag gtgttcgtca ccctcggcac ggaggggtct 960
ggcctgccaa tcgtgccgca ggtctccagt atccacgata tgctgtgggc ggcgggtgag 1020
gtcggggtgg gcagtgagca ggagggtgcc aaggtcgagt tctccccctc catggccggg 1080
tttctggact gggggttcag cgcctacgct gcggcgggca aggtgctgcc ggccagctcg 1140
gcggtgtcga agaccagcgg cgtggaggtg gatcggtatg tctcgttcgt ctggttgacg 1200
ggcgaccagt acgagcaggc ggacgggttc cccacggccc agcaggggtg gacggggtcg 1260
ctgctgctgc cgcgcgagct gaaggtgcag acggtggaga acgtcgtcga caacgagctg 1320
gtgcgcgagg agggcgtgtc gtgggtggtg ggggagtcgg acaaccagac ggccaggctg 1380
cgcacgctgg ggatcacgat cgcccgggag accaaggcgg ccctgctggc caacggctcg 1440
gtgaccgcgg aggaggaccg cacgctgcag acggcggccg tcgtgccgtt cgcgcaatcg 1500
ccgagctcca agttcttcgt gctgacggcc cagctggagt tccccgcgag cgcgcgctcg 1560
tccccgctcc agtccgggtt cgaaatcctg gcgtcggagc tggagcgcac ggccatctac 1620
taccagttca gcaacgagtc gctggtcgtc gaccgcagcc agactagtgc ggcggcgccc 1680
acgaaccccg ggctggatag ctttactgag tccggcaagt tgcggttgtt cgacgtgatc 1740
gagaacggcc aggagcaggt cgagacgttg gatctcactg tcgtcgtgga taacgcggtt 1800
gtcgaggtgt atgccaacgg gcgctttgcg ttgagcacct gggcgagatc gtggtacgac 1860
aactccaccc agatccgctt cttccacaac ggcgagggcg aggtgcagtt caggaatgtc 1920
tccgtgtcgg aggggctcta taacgcctgg ccggagagaa attga 1965
<210> 24
<211> 6
<212> PRT
<213> Artificial Sequence
<220>
<223> Conserved bioactive fragment of beta-fructofuranosidase of
Aspergillus niger (Position 57-62)
<400> 24
Gln Ile Gly Asp Pro Cys
1 5
<210> 25
<211> 14
<212> PRT
<213> Artificial Sequence
<220>
<223> Conserved bioactive fragment of beta-fructofuranosidase of
Aspergillus niger (Position 119-132)
<400> 25
Asp Gly Ala Val Ile Pro Val Gly Val Asn Asn Thr Pro Thr
1 5 10
<210> 26
<211> 10
<212> PRT
<213> Artificial Sequence
<220>
<223> Conserved bioactive fragment of beta-fructofuranosidase of
Aspergillus niger (Position 320-330)
<400> 26
Ser Gly Leu Pro Ile Val Pro Gln Val Ser
1 5 10
<210> 27
<211> 16
<212> PRT
<213> Artificial Sequence
<220>
<223> Conserved bioactive fragment of beta-fructofuranosidase of
Aspergillus niger (Position 401-416)
<400> 27
Gly Asp Gln Tyr Glu Gln Ala Asp Gly Phe Pro Thr Ala Gln Gln Gly
1 5 10 15
<---





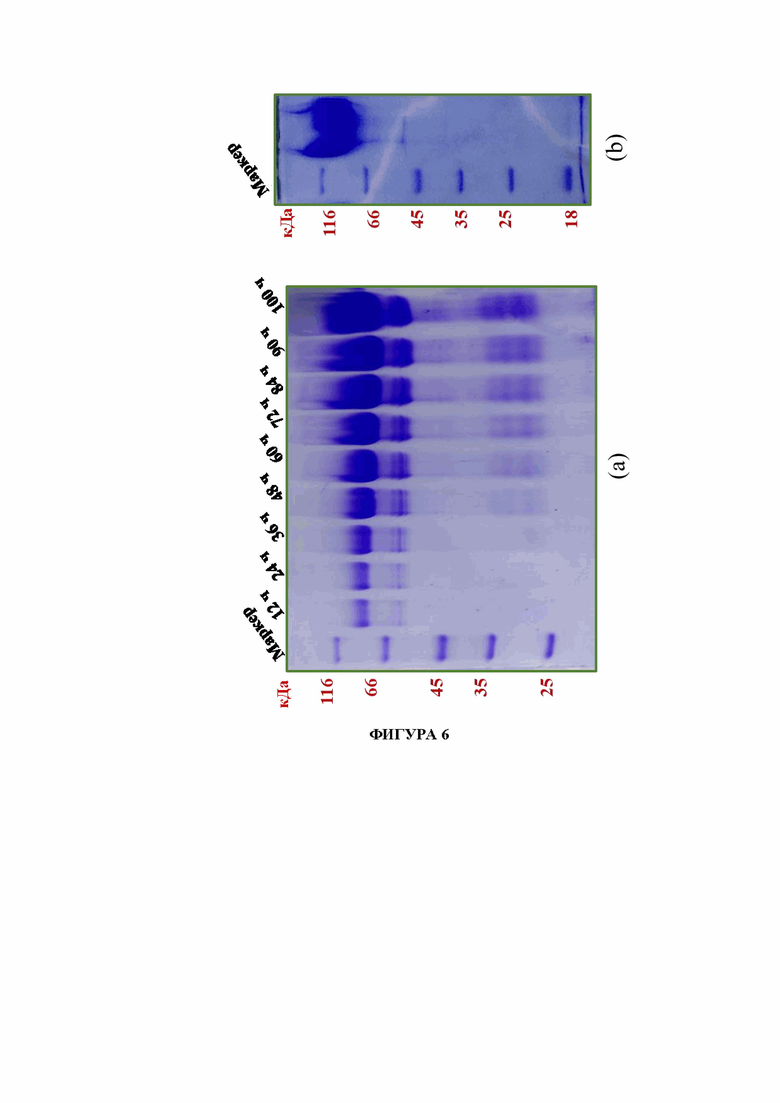

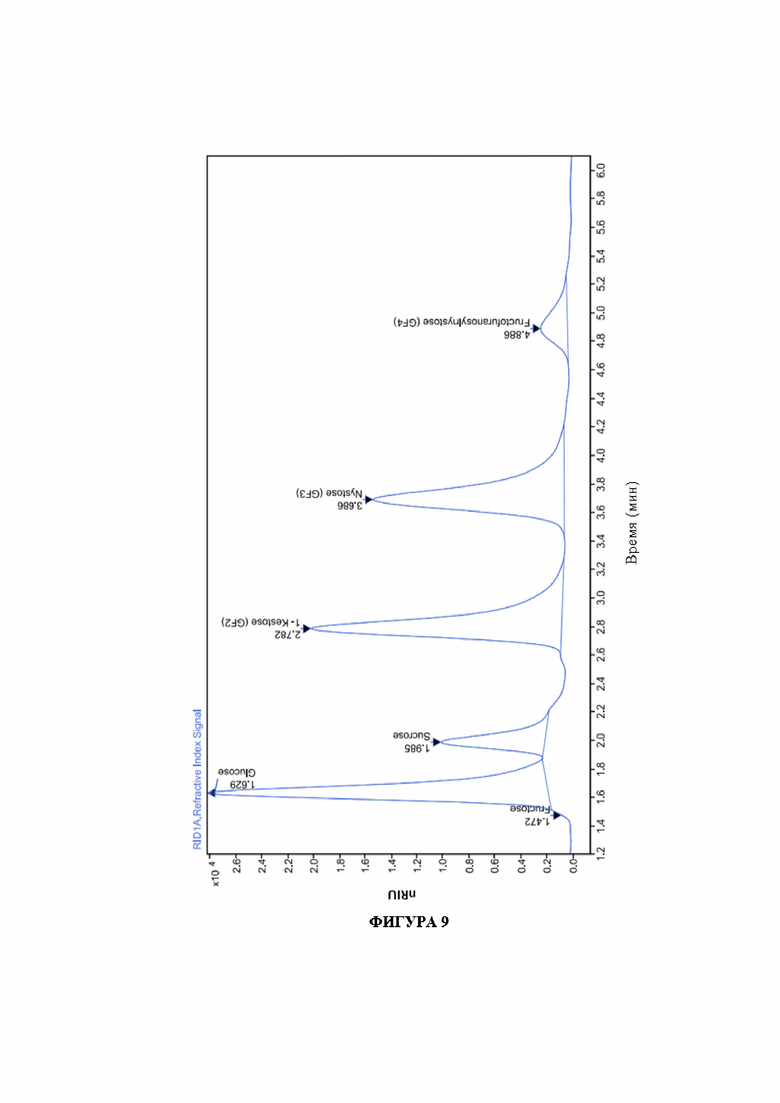
Изобретение относится к биотехнологии. Предложен модифицированный полипептид для получения фруктоолигосахаридов, в котором полипептид представляет собой β-фруктофуранозидазу Aspergillus niger, содержащую аминокислотную последовательность SEQ ID NO: 1, подвергнутую слиянию с сигнальным пептидом, выбранным из группы, включающей Альфа-фактор S. cerevisiae (FAK), Альфа-фактор полный S. cerevisiae (FAKS), Альфа-фактор_T S. cerevisiae (AT), Альфа-амилаза Aspergillus niger (AA), глюкоамилаза Aspergillus awamori (GA), Инулиназа Kluyveromyces maxianus (IN), Инвертаза S. cerevisiae (IV), киллерный белок S. cerevisiae (KP), лизоцим Gallus gallus (LZ) и сывороточный альбумин Homo sapiens (SA), причем сигнальный пептид содержит участок из четырех аминокислот LEKR. Также предложены модифицированная нуклеиновая кислота, кодирующая указанный полипептид, вектор экспрессии, клетка хозяина и применение указанного полипептида в получении фруктоолигосахаридов. Изобретение обеспечивает повышение выхода рекомбинантной β-фруктофуранозидазы Aspergillus niger. 6 н. и 5 з.п. ф-лы, 9 ил., 13 табл., 8 пр.
1. Модифицированный полипептид для получения фруктоолигосахаридов, в котором полипептид представляет собой β-фруктофуранозидазу Aspergillus niger, содержащую аминокислотную последовательность SEQ ID NO: 1, подвергнутую слиянию с сигнальным пептидом, выбранным из группы, включающей Альфа-фактор S. cerevisiae (FAK), Альфа-фактор полный S. cerevisiae (FAKS), Альфа-фактор_T S. cerevisiae (AT), Альфа-амилаза Aspergillus niger (AA), глюкоамилаза Aspergillus awamori (GA), Инулиназа Kluyveromyces maxianus (IN), Инвертаза S. cerevisiae (IV), киллерный белок S. cerevisiae (KP), лизоцим Gallus gallus (LZ) и сывороточный альбумин Homo sapiens (SA), причем сигнальный пептид содержит участок из четырех аминокислот LEKR.
2. Модифицированный полипептид по п. 1, в котором:
a. FAK содержит аминокислотную последовательность SEQ ID NO: 3;
b. FAKS содержит аминокислотную последовательность SEQ ID NO: 4;
c. AT содержит аминокислотную последовательность SEQ ID NO: 5;
d. AA содержит аминокислотную последовательность SEQ ID NO: 6;
e. GA содержит аминокислотную последовательность SEQ ID NO: 7;
f. IN содержит аминокислотную последовательность SEQ ID NO: 8;
g. IV содержит аминокислотную последовательность SEQ ID NO: 9;
h. KP содержит аминокислотную последовательность SEQ ID NO: 10;
i. LZ содержит аминокислотную последовательность SEQ ID NO: 11; и
j. SA содержит аминокислотную последовательность SEQ ID NO: 12;
и в котором сигнальные пептиды обеспечивают внеклеточную секрецию полипептида, содержащего аминокислотную последовательность SEQ ID NO: 1.
3. Модифицированная нуклеиновая кислота, содержащая нуклеотидную последовательность SEQ ID NO: 2, кодирующая полипептид по п. 1.
4. Модифицированная нуклеиновая кислота, кодирующая полипептид по п. 1.
5. Модифицированная нуклеиновая кислота по п. 4, в которой нуклеиновая кислота выбрана из группы, включающей SEQ ID NO: 13, SEQ ID NO: 14, SEQ ID NO: 15, SEQ ID NO: 16, SEQ ID NO: 17, SEQ ID NO: 18, SEQ ID NO:19, SEQ ID NO: 20, SEQ ID NO: 21, SEQ ID NO: 22.
6. Вектор экспрессии, содержащий нуклеиновую кислоту по п. 3 или 4, функционально связанную с промотором.
7. Вектор экспрессии по п. 6, в котором промотор гена β-фруктофуранозидазы выбран из группы, включающей AOX1, ADH3, DAS, FLD1, LRA3, THI11, GAP, YPT1, TEF1, GCw14 и PGK1.
8. Вектор экспрессии по п. 6, в котором вектор выбран из группы, включающей pPICZαA, pPICZαB, pPICZαC, pGAPZαA, pGAPZαB, pGAPZαC, pPIC3, pPIC3.5, pPIC3.5K, PAO815, pPIC9, PPIC9K, IL-D2, pHIL-S1, и векторы экспрессии сконфигурированы для секреторной или внутриклеточной экспрессии β-фруктофуранозидазы из Aspergillus niger, как указано в SEQ ID NO: 1.
9. Рекомбинантная клетка хозяина Pichia pastoris для получения модифицированного полипептида по любому из пп. 1 или 2, содержащая вектор экспрессии по п. 6.
10. Рекомбинантная клетка хозяина Pichia pastoris по п. 9, в которой клетка хозяина выбрана из группы, включающей Pichia pastoris Mut+, Mut S, Mut-, Pichia pastoris KM71H, Pichia pastoris KM71, Pichia pastoris SMD1168H, Pichia pastoris SMD1168, Pichia pastoris X33, Pichia pastoris GS115, или любого другого штамма-хозяина Pichia pastoris.
11. Применение модифицированного полипептида по п. 1 для получения фруктоолигосахаридов.
| WO 2016051386 A1, 07.04.2016 | |||
| Приспособление в пере для письма с целью увеличения на нем запаса чернил и уменьшения скорости их высыхания | 1917 |
|
SU96A1 |
| Bete-fructofuranosidase | |||
| Приспособление в пере для письма с целью увеличения на нем запаса чернил и уменьшения скорости их высыхания | 1917 |
|
SU96A1 |
| WО 2016073562 A1, 12.05.2016 | |||
| JUTURU V., WU J.C | |||
| Heterologous Protein Expression in Pichia pastoris: Latest Research Progress and Applications | |||
Авторы
Даты
2025-05-16—Публикация
2020-11-27—Подача