Изобретение относится к усовершенствованному способу получения глицидиловых эфиров α- или β-нафтолов, которые используют в качестве связующих для оптически прозрачных клеевых композиций, применяемых в электро- и радиотехнике, а также в волоконно-оптических линиях связи.
Известен способ получения глицидилового эфира α-нафтола взаимодействием его натриевой соли с эпихлоргидрином при комнатной температуре в течение 7 ч с последующей отмывкой от хлористого натрия и выделением целевого продукта фракционированием [1].
Недостатками этого способа являются низкий выход (65%) целевого продукта, а также его загрязнение окрашенным трудноотделимым в процессе очистки нафтохиноном, образующимся в присутствии щелочи, вводимой на стадии присоединения.
Наиболее близким техническим решением к данной задаче является способ получения глицидиловых эфиров α- или β-нафтолов путем взаимодействия их в кипящем растворе с эпихлоргидрином и 40%-ным раствором NaOH в течение 2,5 ч. Образующуюся в результате реакции воду отделяют, а эпихлоргидрин возвращает в реактор. Температуру реакционной смеси поддерживают в пределах 124 - 127oC. Через 0,5 ч после окончания прибавления щелочи желто-зеленый реакционный раствор охлаждают до 40 - 45oC, отфильтровывают выпавшую соль хлористого натрия, а остаток подвергают вакуумной перегонке. Выход глицидилового эфира α-нафтола 80%.
Глицидиловый эфир β-нафтола получают этим же способом, только после вакуумной отгонки эпихлоргидрина остаток подвергают перекристаллизации из метанола, выход 82% [2].
Процесс протекает по схеме I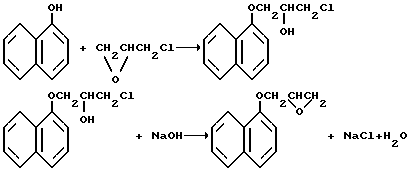
Недостатком этого способа также является загрязнение глицидиловых эфиров α- и β-нафтолов продуктами их окисления, а достигаемый в процессе синтеза сравнительно высокий выход (80%) не реализуется ввиду значительных потерь, обусловленных доведением целевых продуктов до оптической степени чистоты.
Целью изобретения является повышение выхода и качества целевого продукта.
Поставленная цель достигается предложенным способом получения глицидиловых эфиров α- или β-нафтолов взаимодействием соответствующего нафтола с эпихлоргидрином в присутствии катализатора - хлорида тетраалкиламмония формулы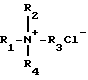
где R1= R2=R3=R4=C2H5, C3H7, н-C4H9,
при кипячении, а затем добавляют твердую щелочь и процесс ведут в бензоле или ацетоне.
Отличительной особенностью предложенного способа является то, что сначала процесс ведут в присутствии катализатора - хлорида тетраалкиламмония формулы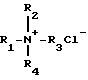
где R1=R2=R3=R4=C2H5, C3H7, н-C4H9,
а затем в присутствии твердой щелочи в среде бензола или ацетона.
Пример 1. В круглодонную литровую двугорлую колбу, снабженную термометром и обратным холодильником, помещают 100 г (0,7 моль) α-нафтола и 544 мл (10-кратный избыток) эпихлоргидрина. К образовавшемуся раствору темно-вишневого цвета добавляют 0,6 г тетраэтиламмонийхлорида. Реакционную массу нагревают до температуры 116 - 118oC и выдерживают при данной температуре 4 ч, поддерживая слабое кипение. При этом раствор постепенно светлеет и становится оранжевым.
Затем реакционную массу переносят в литровую одногорлую колбу, эпихлоргидрин отгоняют на роторном испарителе (водяная баня, водоструйный насос) и проводят дегидрохлорирование полученного продукта (густая жидкость темно-вишневого цвета) измельченной твердой щелочью. С этой целью продукт переносят в 0,5-литровую трехгорлую колбу, добавляют 150 мл бензола и при быстром механическом перемешивании вносят порциями 28 г (0,7 моль) NaOH при комнатной температуре в течение 25 мин. Затем реакционную массу выдерживают при 50oC в течение 2 ч (реакция среды должна быть щелочной). Горячий раствор отфильтровывают с отсасыванием, промывают осадок на фильтре бензолом. Затем бензол отгоняют на роторном испарителе (водная баня, водоструйный насос), а остаток перегоняют в вакууме (152oC/1 мм рт. ст.). Выход глицидилового эфира α-нафтола 130 г (96%), т. кип. 152oC/1 мм рт. ст.), эпоксидное число 19,7.
Пример 2. В круглодонную литровую двугорлую колбу, снабженную термометром и обратным холодильником, помещают 100 г (0,7 моль) 2-нафтола и 544 мл (10-кратный избыток) эпихлоргидрина. Смесь нагревают до 70 - 80oC в течение 10 - 15 мин до полного растворения β-нафтола. К образовавшемуся раствору желтого цвета добавляют 0,6 г тетраэтиламмонийхлорида. Реакционную массу нагревают до температуры 116 - 118oC и выдерживают при данной температуре в течение 4 ч, поддерживая слабое кипение. При этом раствор постепенно светлеет и становится бледно-оранжевым. Затем реакционную массу переносят в литровую одногорлую колбу, эпихлоргидрин отгоняют на роторном испарителе (водяная баня, водоструйный насос) и проводят дегидрохлорирование полученного продукта измельченной твердой щелочью. С этой целью продукт переносят в 0,5-литровую трехгорлую колбу, снабженную мешалкой, термометром и обратным холодильником, добавляют 150 мл ацетона и смесь нагревают до кипения. Затем в охлажденный до 25 - 30oC раствор при энергичном перемешивании вносят порциями 28 г (0,7 моль) NaOH. Затем реакционную массу кипятят в течение 1 ч и горячий раствор отфильтровывают с отсасыванием, промывают осадок NaCl на фильтре ацетоном, фильтрат охлаждают до комнатной температуры и выливают в 2 л холодной дистиллированной воды. Сырой продукт выделяется в виде масла, которое быстро затвердевает. Его фильтруют с отсасыванием, осадок на фильтре промывают водой до нейтральной реакции промывных вод, отжимают и сушат при температуре не выше 40oC. Готовый продукт перегоняют в вакууме (152oC/мм рт. ст. ) Выход глицидилового эфира β-нафтола 128 г (98%), т. пл. 65oC, эпоксидное число 19,9.
Пример 3. Реакцию проводят, как в примере 1, но в качестве катализатора используют тетрапропиламмонийхлорид, выход 97% от теоретического, эпоксидное число 19,8.
Пример 4. Реакцию проводят, как в примере 1, но в качестве катализатора используют тетрабутиламмонийхлорид, выход 96% от теоретического, эпоксидное число 19,8.
Пример 5. Реакцию проводят, как в примере 2, но в качестве катализатора используют тетрапропиламмонийхлорид, выход 98% от теоретического, эпоксидное число 19,7.
Пример 6. Реакцию проводят, как в примере 2, но в качестве катализатора используют тетрабутиламмонийхлорид, выход 97% от теоретического, эпоксидное число 19,8.
Данные по качеству целевого продукта представлены в таблице.
Предложенный способ повысит выход целевого продукта до 96 - 97% (α-нафтола) против 80% и до 97 - 98% (β-нафтола) против 82% в известном способе, улучшит качество целевого продукта и показатель преломления, что позволит использовать целевые продукты в композиционных эпоксидных материалах.
| название | год | авторы | номер документа |
|---|---|---|---|
| ГЛИЦИДИЛОВЫЙ ЭФИР 3-ОКСИФЕНАНТРЕНА В КАЧЕСТВЕ МОДИФИКАТОРА ОПТИЧЕСКИ ПРОЗРАЧНЫХ ЭПОКСИДНЫХ ПОЛИМЕРОВ | 1983 |
|
SU1157823A1 |
| СПОСОБ ПОЛУЧЕНИЯ 7,8(7,9)-ДОДЕКАГИДРОДИКАРБА-НИДО-УНДЕКАБОРАТОВ АЛКИЛАММОНИЯ И АЛКИЛГУАНИДИНИЯ | 2013 |
|
RU2537404C1 |
| СПОСОБ ПОЛУЧЕНИЯ НЕФТЕПОЛИМЕРНЫХ СМОЛ | 2008 |
|
RU2375380C1 |
| СПОСОБ ПОЛУЧЕНИЯ ГЛИЦИДИЛОВЫХ ЭФИРОВ ПОЛИ(ОКСИАЛКИЛЕН)ГЛИКОЛЕЙ | 1995 |
|
RU2084454C1 |
| 1-АЛКИЛ-2-АЦИЛИНДОЛЫ И СПОСОБЫ ИХ ПОЛУЧЕНИЯ | 1991 |
|
RU2047603C1 |
| СПОСОБ ПОЛУЧЕНИЯ 5-АРГИНИЛАМИНОНАФТАЛИН-1-СУЛЬФАМИДОВ | 1990 |
|
RU2043337C1 |
| СПОСОБ ПОЛУЧЕНИЯ ГЛИЦИДИЛОВЫХ ЭФИРОВ РАЗВЕТВЛЕННЫХ МОНОКАРБОНОВЫХ КИСЛОТ | 2010 |
|
RU2560877C2 |
| ВСЕСОЮЗНАЯn,;F>&HTHO-a?iJ(;'jr>&^^&-ШВ'-!БЛИОГГНА Авторы~ ^—М. Кл. С 07с 69/54 С 07с 67/00 | 1973 |
|
SU361169A1 |
| СПОСОБ ПОЛУЧЕНИЯ ГЛИЦИДИЛОВЫХ ЭФИРОВ РАЗВЕТВЛЕННЫХ МОНОКАРБОНОВЫХ КИСЛОТ | 2010 |
|
RU2515897C2 |
| СПОСОБ ПОЛУЧЕНИЯ 1,4-БИС(ДИАЛКИЛАЛЮМА) -ТРАНС-2,3-ДИАЛКИЛБУТАНОВ | 1992 |
|
RU2043356C1 |

Способ получения глицидиловых эфиров α- или β-нафтолов взаимодействием соответствующего нафтола с эпихлоргидрином и щелочью при кипячении и выделении целевого продукта, отличающийся тем, что, с целью повышения выхода и качества целевого продукта, сначала процесс ведут в присутствии катализатора - хлорида тетраалкиламмония формулы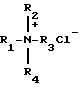
где R1=R2=R3=R4=C2H5, C3H7, н-C4H9,
а затем в присутствии твердой щелочи в среде бензола или ацетона.
Способ получения глицидиловых эфиров α- или β- нафтолов взаимодействием соответствующего нафтола с эпихлоргидрином и щелочью при кипячении и выделении целевого продукта, отличающийся тем, что, с целью повышения выхода и качества целевого продукта, сначала процесс ведут в присутствии катализатора-хлорида тетраалкиламмония формулы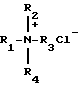
где R1=R2=R3=R4=C2H5, C3H7, H-C4H5,
а затем в присутствии твердой щелочи в среде бензола или ацетона.
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Эфендиев З.Б., Мегачев А.П | |||
| О получении и некоторых превращениях глицидиловых эфиров β-нафтола | |||
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| Сборник научных сообщений кафедры органической и физической химии | |||
Авторы
Даты
1999-02-20—Публикация
1983-01-31—Подача