Изобретение относится к ветеринарии, а именно к получению очищенных ферментных препаратов, и может быть использовано в научно-исследовательских целях в иммунологии, био химии, терапии. Известен способ выделения пропер дина из сыворотки крови путем осаждения его с фракцией эуглобулинов и дальнейшего фракционирования на колонке с ДЭАЭ-целлюлозой Л . Однако данный способ непригоден для получения высокоочищенного пропердина. Наиболее близким к предлагаемому является способ получения высокоочищенного фермента, заключающийся в специфической адсорбции пропердин на зимозан-полисахарид дрожжевых клеток (5 мг/мл) при 17°С в течение 1 ч; элюции его из комплекса зимозан-пропердин буфером с шлсокой ион ной силой; осаждении из элюата подкислением до рН 5,6iO,1 центрифугированием при 53000 1 ч; растворении осадка в Nа-фосфатном буфере рН 8,0, концентрация 0,005 М и отделении нерастворившихся белков центрифугированием при 105 000 rf 1 Далее следует фракционирование пропердинсодержащей фракции на ДЭАЭ-це люлозе, уравновешенной На-фоефатньм буфером рН 8,0, концентрация 0,005 М Активный пропердии не. сорбируется на анионите, элюцию его проводят стартовым буфером. Дальнейшая очист ка заключается в освобождении пропердина от примесей на колонке с катирнитом КМ-сефедекс С-50, уравно вешенньм На-фосфатным буфером рН5,9 концентрация 0,0002 М. В данных условиях пропердин сорбируется На сефадексе и затем элюируется линейным градиентом НаСб (0,1-0,4 М) в стартовом буфере. Выход фермента составляет 18% 2. Однако известный способ непригод для выделения пропердина из сьгаорот крови крупного рогатого скота, так как при фракционировании на ДЭАЭ-це люлозе частично очищенного препарат фермента не происходит сорбции активного пропердина и большинства пр месей на ионообменнике, поэтому на выходе из колонки получают части но очищенный, сильно разбавленный пропердин. Для получения высокоочищ ного пропердина необходимы дополни тельные стадии очистки, требующие наличия дорогостоящего и труднодоступного реагента. Цель изобретения - Получение более очищенного, концентрированного, активного и уммуногенного пропердина из сыворотки крови крупного рогатого скота и упрощение очистки. Поставленная цель достигается тем, что фракционирование пропердина на ДЭАЭ-целлюлозе-осуществляют в присутствии 0,02-0,05 М Ца-К-фосфатного буфера рН 7,1-7,8, а элюцию с ДЭАЭ-целлюлозы проводят градиентом 0,1-0,4 М NaCE в этом буфере. На фиг. t представлен характерный профиль элюции белков, адсорбировавшихся на зимозане в первом примере выполнения способа; на фиг. 2 - тоже, во втором примере выполнения. Изменение условий разделения элюата с зимозана на ДЭАЭ-целлюлозе исключает необходимость предварительного фракционирования его путем подкисления до рН 5,6iO,1 и центрифугирования при 53000 1 ч и 105000 1 ч, а также дополнительной очистки на КМ-сефадексе С-50. Способ выделения пропердина осуществляется следующим образом. 1,5-2,0 зИмозана, предварительно прокипяченного в физиологическом растворе НаСВ на водяной бане в течение 1 ч и осаженного центрифуги- , рованием при 1000-1500 об/мин на ЦЛС-3, смешивают с 300-400 мл бычьей сыворотки и инкубируют при 15-17 С 1 ч, постоянно перемепгавая. Затем частицы зимозана с адсорбировавшимися на нем белками отмывают центрифугированием при 1000 об/мин на ЦПС-З 10-15 мин лeдяньпv 0,0003 М веронал-мединаловым буфером рН 7,4 несколько раз общим объемом 500 мл. Отмытые частицы суспендируют в 6070 мл 0,002 М Nа-фосфатного буфера рН 7,3, содержащего 1 М КаСВ и 0,002 М ЭДТК. Элюцию белков с зимозана проводят при 37 С в течение 15-20 мин на магнитной мешалке. Частицы зимозана отделяют центрифугировянием в описанных условиях, а экстракцию повторяют снова. Элюаты соединяют и диализуют против 5 л 0,020,05 М Nа-К-фосфатного буфера рН 7j1-7,8 два раза в течение суток при 4 С. После диализа проводят концентрацию элюатов на полиэтиленгликоле ( мол. масса 35000) до коиечного объема 50-70 ыл: Центрифугированием при С и 3000. об/мин на ЦЛС-3 30 мин осаждают образовавшийся осадок денатурированных белков Надосадок, содержащий пропердин и 4-6 белков-примесей, служит материалом для нанесения на колонку (2,2-58 см) с ДЭАЭ-целлншозой, урав новешенной буфером для диализа. Материал наносят на колонку со скоростью 30 мл/ч. После того, как весь материал войдет в колонку, начинают пропускать стартовый буфер (1,52,0 объема колонки) для вьа в 1вания несвязавшихся с колонкой белков. Затем элюируют связанный с ионообмен ником пропердин стартовьм буфером, содержащим 0,1-0,5 М NaC. При содержании в буфере 0,3 и 0,4 М НаСВ последовательно элюируются обе фракции прюпердина, которые собирают в пробирки по 6-8 мл. П р и М е р 1. Берут 1,5 г предварительно измельченного в ступке зимозана, кипятят в tOO мл физиологического раствора МаСб на водяной бане в течение t ч, отмывают 200 мл того же раствора центрифугированием при 1000 об/мин, to мин на ЦЛС-3. 300 МП бычьей сыворотки крови, охлажденной до , смешивают с зимозановым осадком и инкубируют при той же температуре 1 ч, постоянно помешивая. Комплекс зимозана с белками осаждают центрифугированием при 4®С и 1000 об/мин на ЦЛС-3 20 мин. Часг ;тицы отмывает троекратно ледяным 0,0003 М веронал-мединаловым буфером рИ 7,4 (общим объемом 500 мл). Элюцню. белков с зимозана проводят ;следующим образом. Осажденные частицы зимозана суспе дируют в 60 мл нагретого до 0,002 М Na-фосфатного буфера рН 7,3 содержащего 1 М НаС;Е и 0,002 М ЭДТК :суспензию инкубируют при 37°С 1520 мин, перемешивая. Вновь частицы зимозана осаждают, надосадок сливают в отдельную посуду, а экстракцию белков Повторяют. Оба надосадка соединяют вместе, помещают в диализный мешочек, непроницаемый для белковых молекул, и диалйзуют против 5 л . 0,02 М На-К-фосфатного буфера рН7,1 два раза в течение 24 ч при 4С на магнитной мешалке. После этого проводят концентрацию материала йа :полиэтиленгликоле (мол.масса 35000) :до конечного объема 50 мл (5-6 ч при 4°С). Сконцентрированный материал, содержащий пропердин, центифугируют при 3000 об/мин и на КЯС-3 30 мин для осаждения денатурированных белков. Полученный раствор наносят на колонку (2, см) с ДЭАЭ-целлншозой, уравновешенной буфером для диализа. После того, как весь материал войдет в колонку, начинают пропускать стартовый буфер для вымывания несвязавшихся с анионитом белков. Выход белка контролируют измерением оптической плотности раствора при длине волны 280 нм на СФ-16 (спектрофотометр) . После выхода первого белкового пика (необходимо, чтобы равнялась Hyjm) начинают элюцию проперд на. Для зтаго через колонку пропускают около 300 нл: стартового буфера, содержащего 0,1 М NaCF, при этом выходит второй белковый пик, состоящий из небольвого количества функционально неактивных, но с сохраненной антигенной структурой фракций пропердина (иденти4я1кацию проводили юшунохимическим методом). Затем пропускают последовательно по 1,5-2,0 объема колонки стартового буфера, содержащего 0,3, 0,4 и 0,5 М МаСг. Характерный профиль злюцш{ белков, адсорбировавшихся на зимозане, из колонки с ДЭАЭ-целлюлозой представлен на фиг. 1. Скорость тока в колонке 35 нл/ч, объем собираемых фракций 6-8 мл. Идентификацию белковых циклов проводили титрованием пропердина зимозановым методом Пшшемера. В результате хроматографии получают гомоген ,. % Jf Формы у-пропердина(около 15 нл) и -пропердина (около 20 мл) с удельной активностью соответственно 6,32 и 11,7 ед/мг. Пример 2. Условия выделения пропердина аналогичны примеру 1. После того, как злюаты с зимозана сконцентрированы, проводят диализ против 5л 0,035 М Nа-К-фосфатного буфера рН 7,5 два раза в течение 24 ч при 4 С на магнитной мешалке. После этого материал концентрируют на полиэтиленгликоле (мол.масса 35000) до конечного объема 60 мл. Сконцентрированный материал, содержа щий пропердин. центрифугируют при Ас на 1ШС-3 30 мин при 3000 об/мин для осаждения денатурированных белков. Полученный раствор наносят на колонку (2,258 см) с ДЭАЭ-целлюлозой, уравновешенной буфером для iдиализа. После того, как весь мате|риал войдет в колонку, начинают пропускать стартовый буфер для вымываНИН несвязавшихся с ионнообменником белков. Выход белка контролируют измерением оптической плотности раствора при длине волны 280 им на приборе СФ-16 (спектрофбтометр). После выхода первого белковбго пика (необходимо, чтобы Д20л равнялась нулю) начитают элюцию пропердина. Для этого через колонку пропус кают около 300 мя стартового буфера родержащего 0,t М МаСС, при этом выход1нт второй белковый пик, состоящий из функционально неактивных, но с сохраненной антигенной структурой форм пропердина. Затем пропускают последовательно стартовый буфер, содержащий 0,3, 0,4 и 0,5 М НаСб. Характерный профиль белков, адсор бировавшихся на зимозане, из колонки с ДЭАЭ-целлюлозой приведен на фиг. 2.. Скорость тока а колонке 35 мл/ч, объем собираемых фракций 6-8 мл. Идентификацию белковых пиков проводили титрованием пропердииа зимозановым методом Пиллемера. В результат хроматографии получают гомогенные фракции формы У-пропердина (15-20 мл и ft-пропердина (20-25 мл) с удельной активностью соответственно 6,25 vi 13,0 ед/мг. Пример 3. Условия адсорбции пропердина на зимозан и злюции его с зимозановых частиц аналогичны примеру 1. Затем элюаты соединяют, поме щают в диализньй мешочек, непроницаемый для белковых молекул, и диализуют против 5 л 0,05 М Nа-К-фосфатног( буфера рН 7,8 два раза в течение , суток при на магнитной мешалке. После этого Проводят концентрацию материала на полиэтиленгликоле (мол.масса 35000) до конечного объема 70 мл. Сконцентрированный материал центрифугируют при 30UU об/мин и на ЦПС-3 30 мин для осаждения дена.турированных белко,в, Фракционирование частично очищенного пропердина проводят аналогично примеру 1, применяя 0,05 М На -К-фосфатный буфер рН 7,8. График злюции белков с ионообменника идентичен графику на фиг. 2. Скорость тока в колонке 35 мл/ч, объем собираемых фракций 6-8 мл, идентификацию пропердина проводят по методу Пиллемера. В результате получают У-пропердин (10-14 мл) с удельной активностью 6,25 ед/мг, Й-пропердин (15-20 мл) с удельной активностью 13,0 ед/мг. В табл. 1 дается характеристика предлагаемого способа вьщеления пропердина, а в табл. 2 - характеристика известного способа выделения. пропердина. По известному способу пропердин не удалось вьоделить в значимых количествах из сыворотки крови крупного рогатого скота. При этом полученный пропердин малоактивен и содержит примеси. Таким образом, известный способ не может быть использован для получения пропердина, пригодного для приготовления специфической антисыворотки, из сыворотки крови крупного рогатого скота. Предлагаемый способ позволяет получить высокоочищенные, концентрированные, активные и иммуногенные (получена антипропердиновая сыворотка) фракции пропердина в две стадии очистки .
Таблица 1



| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ ЭСТРОГЕНСВЯЗЫВАЮЩЕГО БЕЛКА, АССОЦИИРОВАННОГО СО ЗЛОКАЧЕСТВЕННЫМИ НОВООБРАЗОВАНИЯМИ | 2012 |
|
RU2489440C1 |
| СПОСОБ ПОЛУЧЕНИЯ ФЕРМЕНТА ПЕРОКСИДАЗЫ ИЗ КОРНЕЙ ХРЕНА | 2007 |
|
RU2353652C1 |
| Способ получения @ - @ -галактозидазы | 1982 |
|
SU1082812A1 |
| СПОСОБ ПОЛУЧЕНИЯ ДРОЖЖЕВОЙ АЛКОГОЛЬОКСИДАЗЫ | 1990 |
|
RU2032743C1 |
| СПОСОБ ВЫДЕЛЕНИЯ И ОЧИСТКИ ТРОФОБЛАСТИЧЕСКОГО БЕТА-1-ГЛИКОПРОТЕИНА | 2007 |
|
RU2325171C1 |
| СПОСОБ ПРИГОТОВЛЕНИЯ ОЧИЩЕННОГО ПРЕПАРАТА БОТУЛИНИЧЕСКОГО ТОКСИНА ТИПА А | 2002 |
|
RU2230325C2 |
| СПОСОБ ПОЛУЧЕНИЯ ХОЛЕСТЕРОЛЭСТЕРАЗЫ, ТРИПСИНА, ДЕЗОКСИРИБОНУКЛЕАЗЫ И РИБОНУКЛЕАЗЫ ИЗ ПОДЖЕЛУДОЧНОЙ ЖЕЛЕЗЫ КРУПНОГО РОГАТОГО СКОТА | 2005 |
|
RU2311455C2 |
| СПОСОБ ВЫДЕЛЕНИЯ И ОЧИСТКИ ТРОФОБЛАСТИЧЕСКОГО БЕТА-1-ГЛИКОПРОТЕИНА | 2008 |
|
RU2367449C1 |
| Способ получения ферментов 1.4.1.3,1-глутамат: АД( @ )+ -оксиредуктазы и 1.4.1.4,1-глутамат: АД( @ )+ -оксиредуктазы(дезаминирующих) | 1981 |
|
SU1044631A1 |
| СПОСОБ ПОЛУЧЕНИЯ α -ГЛОБУЛИНА ПУЗЫРНОЙ ЖИДКОСТИ, АССОЦИИРОВАННОГО С ИСТИННОЙ ПУЗЫРЧАТКОЙ | 1993 |
|
RU2043117C1 |
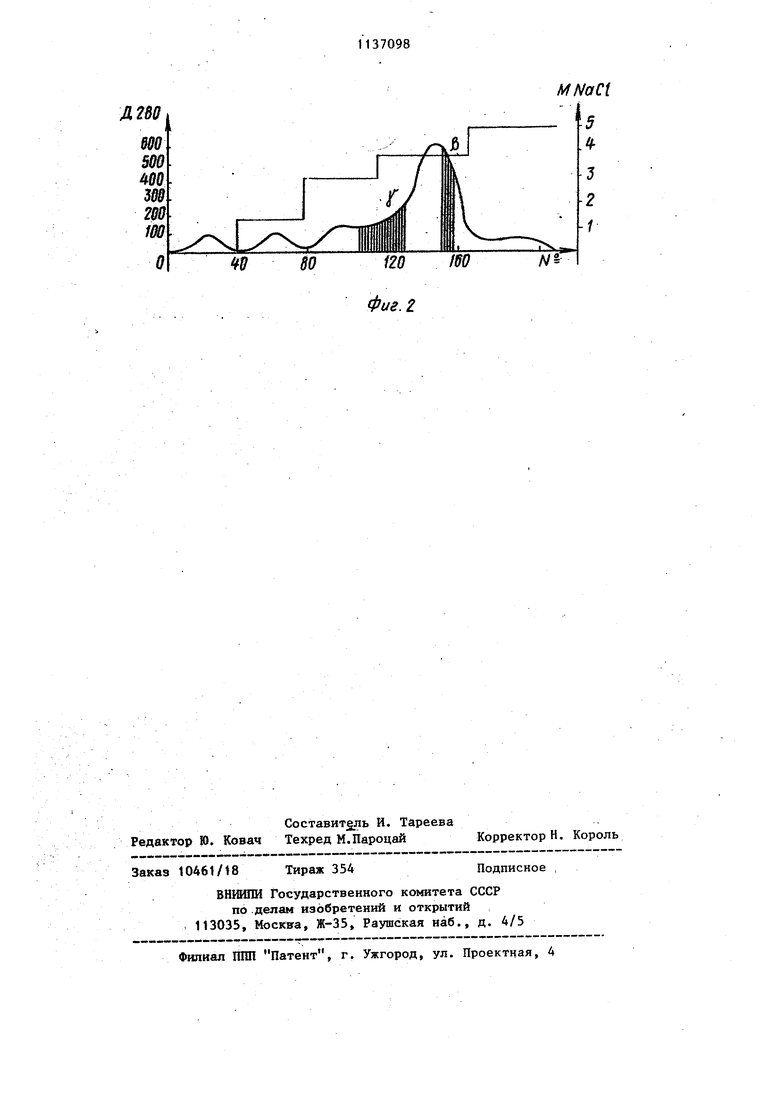
СПОСОБ ВЫДЕЛЕНИЯ ПРОПЕРДИНА ИЗ СШЮРОТКИ КРОВИ, включаиирЛ спе1 |ф|1ческую адсорбцио его на зююэан, элоцюо с зимозана, акционирование 1фоперда1на на ДЭАЭ-целлктозе и элюцмо его, о т л и чающийся тем,-что, с целью получения более очищенного концентриройвняаго, активного и {шмукогемяого щюпердина из сыворотки крови круякоро 1х гатого скота и упроцетмя очистки, ф1)а1с«1«)нировани€ пропердняа на ДЭАЭ-цеягаолоэе осуществлювт в присутствии 0,02-0,05 М Na-К-фосфвтного буфера рИ 7,1-7,8, a элкщяю с ЛЭАЭ-целлюлозы проводят градиенте 0,14),4 М NaC8 в этом буфере.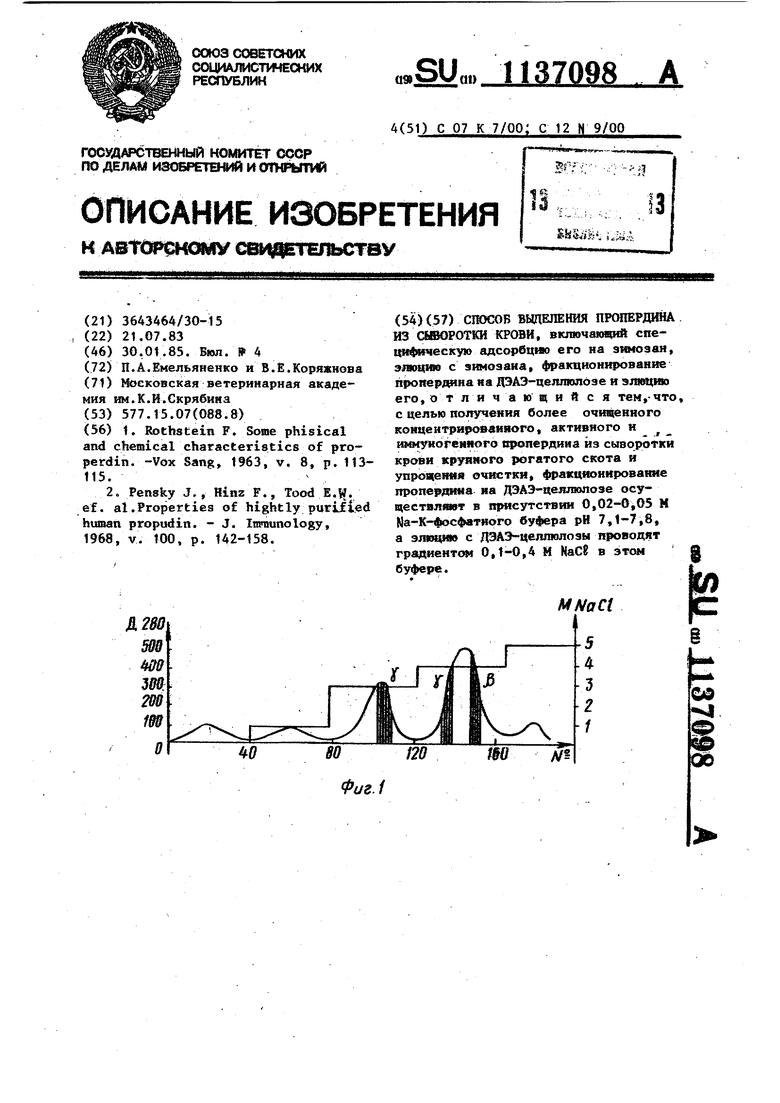
Бычья сыворотка 400 33600 2,80
Элюция белков 120 143 1,25 с зимозама
10
8 1,70
2 0,65 2 0,42 . 1,00
Таблица 2
0,03 100
1,05 13,4
35
70
2,10 . 1,5
1,00
3,10 0,2
103
160
Фиг. 2 MNaCi
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Rothstein F | |||
| Some phisical and chemical characteristics of properdin | |||
| -Vox Sang, 1963, v | |||
| Топка с несколькими решетками для твердого топлива | 1918 |
|
SU8A1 |
| Устройство для усиления слабых электрических токов | 1957 |
|
SU113115A1 |
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| Pensky J | |||
| , Hinz F., Tood E.ff | |||
| ef | |||
| al.Properties of hightly purified human propudin | |||
| - J | |||
| Immunology, 1968, V | |||
| Облицовка комнатных печей | 1918 |
|
SU100A1 |
| Рогульчатое веретено | 1922 |
|
SU142A1 |
Авторы
Даты
1985-01-30—Публикация
1983-07-21—Подача