Изобретение относится к способам получения ферментных препаратов, а именно алкогольоксидазы (АО), и может быть использовано в биотехнологии для получения АО, применяемой при ферментативном определении концентрации алкоголя в крови и других биологических жидкостях человека и животных.
Известен способ получения алкогольоксидазы путем культивирования в питательной среде метилотрофных каталазо- дефицитных дрожжей на смесях формиат-глюкоза или формальдегид глюкоза, при этом глюкоза служит источником углерода, а формиат и формальдегид энергетические субстраты. Используемые для получения АО метилотрофные дрожжи с дефицитным по каталазе штаммом не способны синтезировать каталазу, поэтому содержащуюся в них АО можно применять для количественного и качественного определения этанола [1]
Однако применение мутантного каталазо-дефицитного штамма ведет к удорожанию целевого продукта. Кроме того, известный способ характеризуется пониженным синтезом фермента АО, что делает способ экономически невыгодным.
Наиболее близким по технической сущности и достигаемому положительному эффекту (прототипом) является способ получения АО из метилотрофных дрожжей Hansenula polymorpha, включающий выращивание биомассы дрожжей на минеральной среде, выделение клеток из среды культивирования центрифугированием, трехкратное разрушение клеток в прессе высокого давления, осаждение белка в области 30-60% насыщения сульфатом аммония с последующим диализом (для удаления каталазы) белкового раствора против 20-кратного по объему буфера, содержащего 10 мМ ингибитор каталазы-3-амино-1,2,4 триазол и 0,05% Н2О2 метод химической модификации [2]
Выделенный по известному способу препарат (из 100 г дрожжей получают 6 г белка) имел удельную активность 10-12 Е/мг белка и хранился без потери активности в течение года при -40оС. Этого количества фермента было достаточно для 12000 колориметрических анализов при определении этанола.
Известный способ позволил добиться удаления значительного количества (около 90%) каталазы, однако довести процесс до конца, т.е. получить препарат АО, полностью лишенный примеси каталазы, известным способом не удалось, так как продолжение диализа приведет к тому, что оставшееся небольшое количество каталазы (около 10%) не окажет защитного эффекта на АО от Н2О2 и АО частично или полностью инактивируется. Наличие примеси каталазы в препарате АО вызывает необходимость при колориметрическом определении первичных алкоголей брать в инкубационную смесь большое количество фермента 500 мкг на одну пробу. Следовательно, учитывая высокие цены на ферментные препараты, использование полученной АО по известному способу для определения концентрации алкоголя в крови и других биологических жидкостях человека и животных делает этот анализ достаточно дорогим.
Целью изобретения является повышение чистоты ферментного препарата.
Изобретение заключается в том, что очистку белков ведут на ионообменнике ДЭАЭ-Тойоперл 650 М, уравновешенном 0,01-0,04 М трис-HCl буфером в присутствии 0,05 М NaCl, 0,1 мМ ЭДТА и 0,1 мМ дитиотрейтола при рН 7,6-8,2.
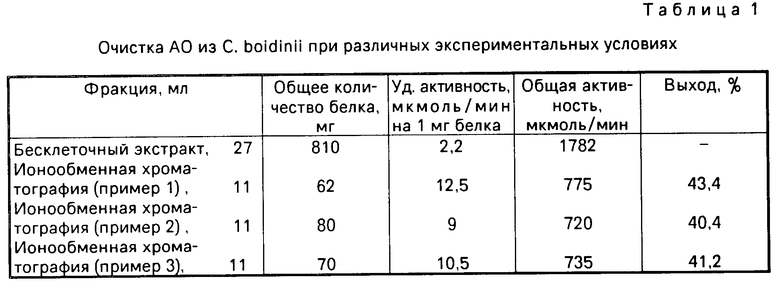
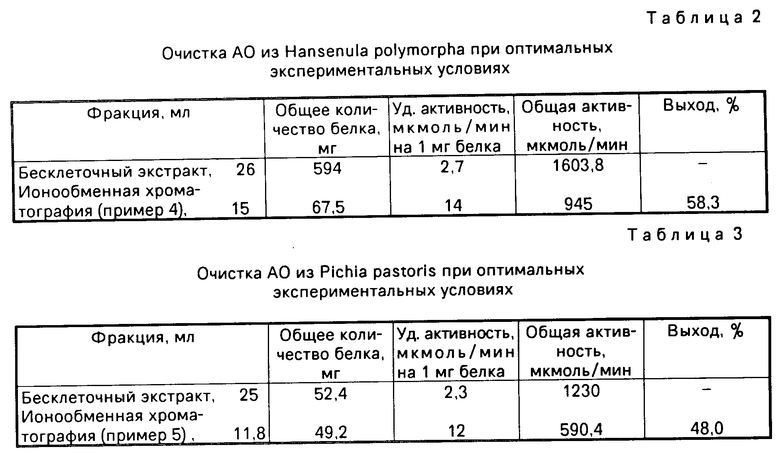
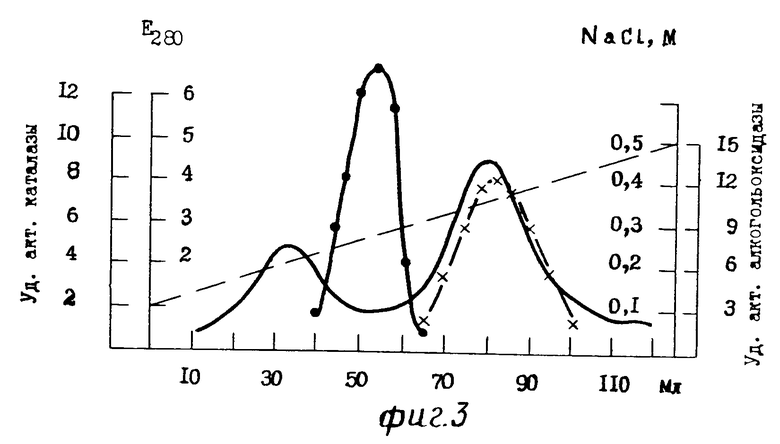
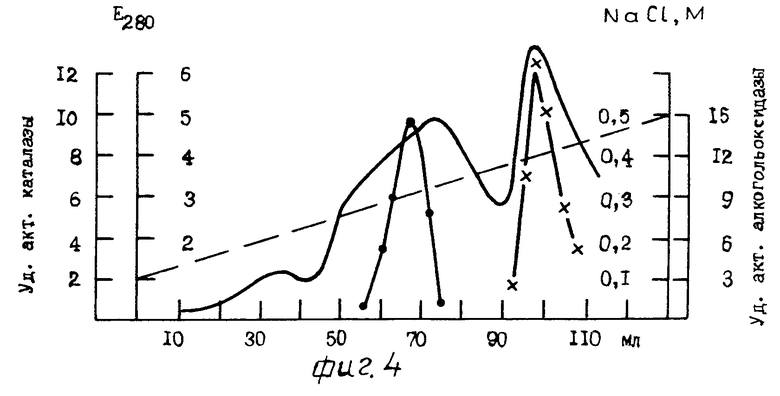
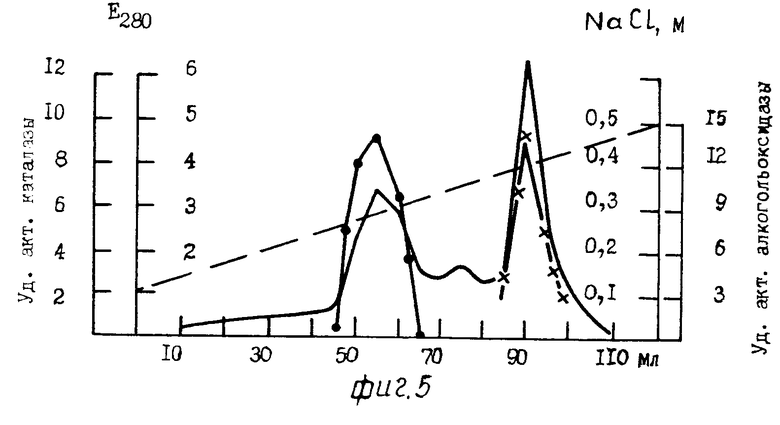
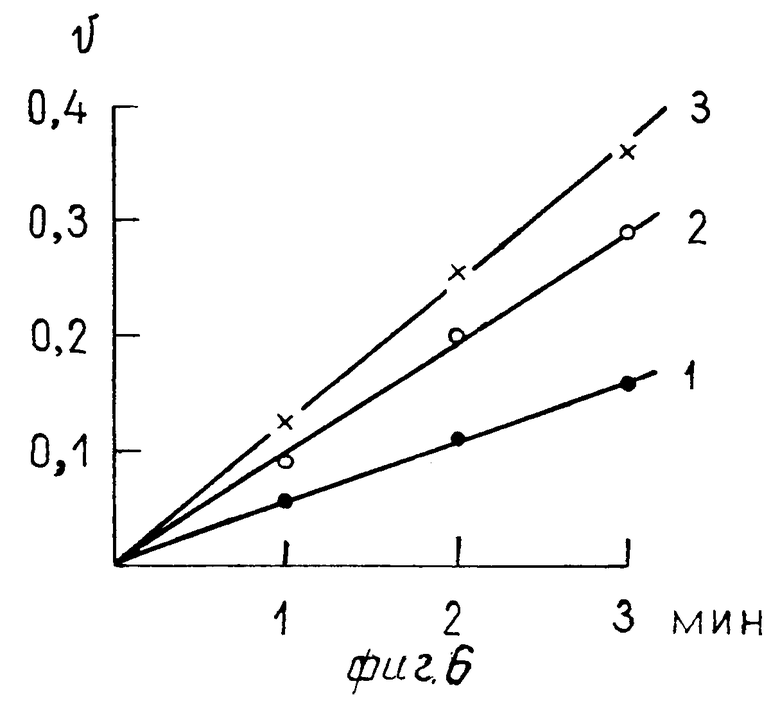
На фиг. 1 для примера 1 приведена хроматография белкового раствора на ДЭАЭ Тойоперл 650 М; на фиг.2 для примера 2; на фиг.3 для примера 3; на фиг. 4,5 соответственно примерам 4 и 5; на фиг.6 зависимость скорости реакции от времени, где содержание этанола: 1-10 мг/л; 2-20 мг/л, 3-40 мг/л.
Способ осуществляют следующим образом.
Культуру дрожжей boidinii выращивают на минеральной среде. Количество выращенной биомассы определяют спектрофотометрически, а чистоту культуры контролируют микроскопированием. Клетки собирают в логарифмической фазе роста. Собранные клетки суспендируют, суспензию дезынтегрируют в гомогенизаторе в присутствии кварцевого песка. Клеточный гомогенат центрифугируют с последующим удалением неразрушенных клеток. Надосадочную жидкость, включающую АО и каталазу, используют для последующей очистки.
Полученный бесклеточный центрифугат сорбируют на ДЭАЭ-Тойоперл 650М с последующим элюированием белка, получая на данной стадии очистки ферментный препарат АО, полностью свободный от примеси каталазы. Затем методом сульфоаммонийного фракционирования осуществляют стабилизацию АО.
В предлагаемом способе получения АО на этапе отработки оптимальных его параметров установлено, что наилучший эффект регистрировался при разделении экстрагируемых белков на ионообменнике ДЭАЭ-Тойоперл 650М, уравновешенном 0,01-0,04 М трис-HCl буфером в присутствии 0,05 М NaCl, 0,1 мМ ЭДТА и 0,1 мМ дитиотрейтола при 7,6-8,2. Снижение молярности трис-HCl буфера ниже 0,01 М ведет к потере стабильности препарата АО вследствие его диссоциации на субъединицы, а увеличение молярности выше 0,04М приводит к снижению степени сорбции белкового препарата. Снижение рН буфера ниже 7,6 дестабилизирует структуру АО, в то время как использование рН выше 8,2 ухудшает разделение каталазы и АО. Увеличение концентрации ЭДТА и дитиотрейтола, стабилизирующих структуру АО, не ведет к усилению эффекта по сравнению с применяемыми концентрациями. Используемая молярность NaCl 0,05 М подобрана экспериментально и является оптимальной для достижения начального прочного связывания белка с носителем ДЭАЭ-Тойоперл 650 М. При выборе ионообменника установлено, что ни ДЭАЭ-сефадекс, ни ДЭАЭ-целлюлоза не обеспечивали полного разделения алкогольоксидазы и каталазы. Экспериментально подтверждено, что лишь ДЭАЭ-Тойоперл 650 М обладает необходимой разрешающей способностью, позволяющей разделить эти два фермента.
П р и м е р 1. Культивирование дрожжей C.boidinii осуществляют при 29оС на минеральной среде следующего состава (г/л воды): (NH4)2SO4 5; KH2PO4 1; MgSO4 0,5; NaCl 0,1. В качестве источника углерода добавляют метанол в концентрации 0,5% по общему объему. Количество выращенной биомассы находят спектрофотометрически при 623 нм. Чистоту культуры контролируют микроскопированием. Клетки собирают в логарифмической фазе роста центрифуги- рованием при 5000g в течение 10 мин с последующей промывкой 0,02 М Nа-фосфатным буфером, рН 7,6 при 6оС. Культуру поддерживают на скошенном агаре следующего состава (г/л воды): глюкоза 20,0; пептон 20,0; дрожжевой автолизат 10,0; агар 20,0. Клетки хранят при -15оС в течение года.
Берут 10 г собранных клеток (размороженных) и суспендируют в 30 мл 0,02 М трис-HCl, буфера, рН 8,0 содержащего 0,05 М NaCl, 0,1 мМ ЭДТА и 0,1 мМ дитиотрейтол. Полученную суспензию дезынтегрируют в гомогенизаторе в присутствии 18 г кварцевого песка в течение 15 мин при 1000g. Клеточный гомогенат центрифугируют (30 мин, 20000g) с последующим удалением клеточного дебриса. Надосадочную жидкость, включающую смесь алкогольоксидазы и каталазы, используют для последующей очистки. Для этого берут 27 мл (810 мг) полученного бесклеточного центрифугата и наносят на колонку (2х20 см) с ДЭАЭ-Тойоперлом 650 М. Гель уравновешивают 0,02 М трис-HCl буфером, рН 8,0 в присутствии 0,05 М NaCl, 0,1 мМ ЭДТА и 0,1 мМ дитиотрейтола. После адсорбции белкового препарата колонку промывают 300 мл 0,02 М трис-HCl буфера, рН 8,0 содержащего 0,08 М NaCl, 0,1 мМ ЭДТА и 0,1 мМ дитиотрейтол, с последующей элюцией белка линейным градиентом NaCl 0,1-0,5 М в 0,02 М трис-HCl буфере, рН 8,0 с 0,1 мМ ЭДТА и 0,1 мМ дитиотрейтолом со скоростью 8 мл/ч, собирая фракции по 4 мл. Объем резервуара и смесителя по 150 мл в каждом сосуде. Катализа элюируется в области 0,22-0,27 М NaCl, а АО несколько позже, в области 0,30-0,34 М (см. фиг.1). В результате на данной стадии очистки получила ферментный препарат АО с максимальной удельной активностью 15 Е (среднее значение 12,5 Е), полностью свободный от примеси каталазы (фиг.1). Стабилизацию АО осуществляют методом сульфоаммонийного фракционирования. С этой целью наиболее активные фракции АО объединяют и к ферментному элюату с концентрацией белка 6,1 мг/мл добавляют при постоянном перемешивании мелкодисперсный сульфат аммония до конечного насыщения 70% После 2-часового выдерживания при 4оС cмеcь центрифугируют 20 мин при 20000g. Осадок АО хранят в виде пасты при -20оС. Конечный выход белка составляет 43,4% Существенной потери активности в течение года не наблюдалось. Все операции по выделению и очистке АО проводят при 6оС. Результаты суммированы в табл.1.
П р и м е р 2. Культивирование дрожжей C.boidinii и получение клеточного гомогената проводят способом, идентичным способу, описанному в примере 1.
27 мл (810 мг) бесклеточного центрифугата, полученного после разрушения клеток в гомогенизаторе, наносят на колонку (2х20 см) с ДЭАЭ-Тойоперлом 650 М. Гель уравновешивают 0,01М трис-HCl буфером рН 7,6, содержащим 0,05М NaCl, 0,1 мМ ЭДТА и 0,1 мМ дитиотрейтол. После связывания белка с ионообменником колонку промывают 300 мл 0,01М трис-HCl буфера, рН 7,6 содержащего 0,08 М NaCl, 0,1 мМ ЭДТА и 0,1 мМ дитиотрейтол, с последующей элюцией белка линейным градиентом NaCl 0,1-0,5 М в 0,01 М трис-HCl буфере, рН 7,6 с 0,1 мМ ЭДТА и 0,1 мМ дитиотрейтолом, со скоростью 8 мл/ч, собирая фракции по 4 мл. Объем резервуара и смесителя по 150 мл в каждом сосуде. Каталаза элюируется в области 0,21-0,26 М NaCl, а АО несколько позже, в области 0,28-0,33 М (см. фиг. 2). В результате на данной стадии очистки получили ферментный препарат АО с максимальной удельной активностью 12 Е (среднее значение 9Е), полностью свободный от примеси каталазы (фиг.2). Стабилизацию АО осуществляли способом, идентичным способу, описанному в примере 1. Конечный выход белка составляет 40,4% Существенной потери активности в течение года не наблюдалось. Результаты суммированы в табл.1.
П р и м е р 3. Культивирование дрожжей C.boidinii и получение клеточного гомогената проводят способом идентичным способу, описанному в примере 1.
27 мл (810 мг) бесклеточного центрифугата, полученного после разрушения клеток в гомогенизаторе, наносят на колонку (2х20 см) с ДЭАЭ-Тойоперлом 650М. Гель уравновешивают 0,04 М трис-HCl буфером, рН 8,2 содержащим 0,05 М NaCl, 0,1 мМ ЭДТА и 0,1 мМ дитиотрейтол. После связывания белка с ионообменником колонку промывают 300 мл 0,04 мМ трис-HCl буфера, содержащего 0,08М NaCl, 0,1 мМ ЭДТА и 0,1 мМ дитиотрейтол, с последующей элюцией белка линейным градиентом NaCl 0,1-0,5 М в 0,04 М трис-HCl буфере, рН 8,2 с 0,1 мМ ЭДТА и 0,1 мМ дитиотрейтолом со скоростью 8 мл/ч, собирая фракции по 4 мл. Объем резервуара и смесителя по 150 мл в каждом сосуде. Каталаза элюируется в области 0,24-0,29 М NaCl, а АО несколько позже, в области 0,33-0,37М (см. фиг. 3). В результате на данной стадии очистки получили ферментный препарат АО с максимальной удельной активностью 12,5 Е (среднее значение 10,5 Е), полностью свободный от примеси каталазы (фиг.3). Стабилизацию АО осуществляли способом, идентичным способу, описанному в примере 1. Конечный выход белка составляет 41,2% Значительной потери активности в течение года не наблюдалось. Результаты суммированы в табл.1.
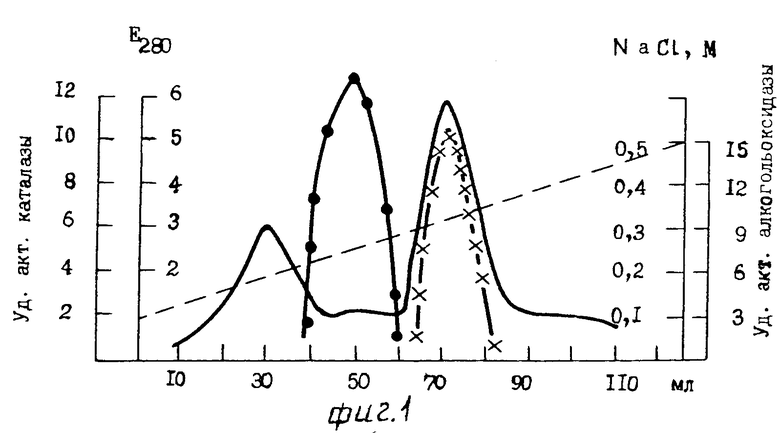
П р и м е р 4. Культивирование дрожжей Hansenula polymorpha осуществляют при 29оС на минеральной среде следующего состава (г/л): (NH4)2SO4 5; KH2PO4 1; MgSO4 0,5; NaCl 0,1. Минеральная среда рассчитана на 1 л воды. В качестве источника углерода добавляют метанол в концентрации 0,5% по общему объему. Количество выращенной биомассы находят спектрофотометрически при 623 нм. Чистоту культуры контролируют микроскопированием. Клетки собирают в логарифмической фазе роста центрифугированием при 5000g в течение 10 мин с последующей промывкой 0,02М Na-фосфатным буфером, рН 7,6 при 6оС. Культуру поддерживают на твердой питательной среде следующего состава (г/л): глюкоза 20,0; пептон 20,0; дрожжевой автолизат 10,0; агар 20,0. Клетки хранят при -15oС.
Берут 10 г собранных клеток (размороженных) и суспендируют в 30 мл 0,02 М трис-HCl буфере, рН 8,0, содержащего 0,05 М NaCl, 0,1 мМ ЭДТА и 0,1 мМ дитиотрейтола. Полученную суспензию дезынтегрируют в гомогенизаторе в присутствии 18 г кварцевого песка в течение 15 мин при 1000g. Клеточный гомогенат центрифугируют (30 мин, 20000g) с последующим удалением клеточного дебриса. Надосадочную жидкость, включающую смесь алкогольоксидазы и каталазы, используют для последующей очистки. Для этого берут 26 мл (594 мг) полученного бесклеточного центрифугата и наносят на колонку (2х20 см) с ДЭАЭ-Тойоперлом 650 М. Гель уравновешивают 0,02 М трис-HCl буфером, рН 8,0, в присутствии 0,05 М NaCl, 0,1 мМ ЭДТА, 0,01 мМ дитиотрейтола. После сорбции белкового препарата колонку промывают 300 мл 0,02 М трис-HCl буфера, pН 8,0 содержащего 0,08 М NaCl, 0,1 мМ ЭДТА и 0,1 мМ дитиотрейтола, с последующей элюцией белка линейным градиентом NaCl 0,1-0,5 М в 0,02 М трис-HCl буфере, рН 8,0 с 0,1 мМ ЭДТА и 0,1 мМ дитиотрейтолом со скоростью 8 мл/ч, собирая фракции по 4 мл. Объем резервуара и смесителя по 150 мл в каждом сосуде. Каталаза элюируется в области 0,29-0,34 М NaCl, а АО несколько позже в области 0,4-0,44 М (см. фиг. 1). В результате на данной стадии очистки получили ферментный препарат АО с максимальной удельной активностью 17 Е (среднее значение 14Е), полностью свободной от примеси каталазы (фиг.4). Стабилизацию АО осуществляют методом сульфоаммонийного фракционирования. С этой целью наиболее активные фракции АО объединяют и к ферментному элюату с концентрацией белка 4,5 мг/мл добавляют при постоянном перемешивании мелкодисперсный сульфат аммония до конечного насыщения 70% После 2-часового выдерживания при 4оС смесь центрифугируют 20 мин при 20000g. Осадок АО хранят в виде пасты при -20оС. Конечный выход белка составляет 58,5% Все операции по выделению и очистке АО проводят при 6оС. Результаты суммированы в табл.2.
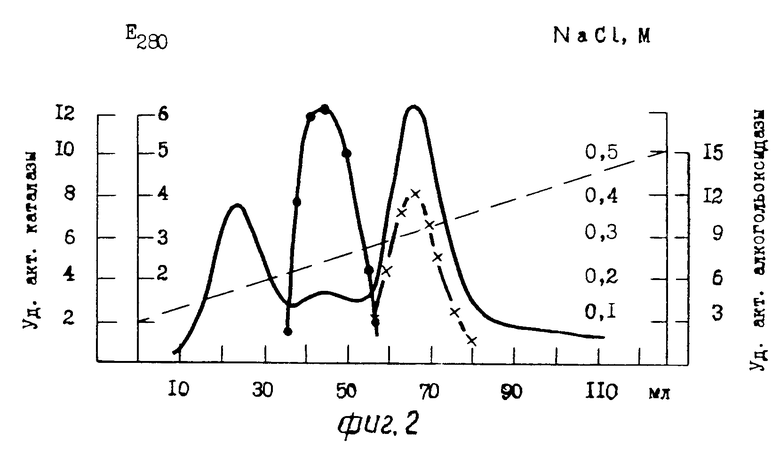
П р и м е р 5. Культивирование дрожжей Pichia pastoris и получение клеточного гомогената проводят способом, идентичным способу, описанному в примере 4.
25 мл (524 мг) бесклеточного центрифугата, полученного после разрушения клеток в гомогенизаторе, наносят на колонку (2х20 см) с ДЭАЭ-Тойоперлом 650 М. Гель уравновешивают 0,02 М трис-HCl буфером, рН 8,0, содержащим 0,05 М NaCl, 0,1 мМ ЭДТА и 0,1 мМ дитиотрейтола. После связывания белка с ионообменником колонку промывают 300 мл 0,02 М трис-HCl буфера, рН 8,0, содержащего 0,08 М NaCl, 0,1 мМ ЭДТА и 0,1 мМ дитиотрейтол, с последующей элюцией белка линейным градиентом NaCl 0,1-0,5 М в 0,02 М трис-HCl буфере, рН 8,0, с 0,1 мМ ЭДТА и 0,1 мМ дитиотрейтолом со скоростью 8 мл/ч, собирая фракции по 4 мл. Объем резервуара и смесителя по 150 мл в каждом сосуде. Каталаза элюируется в области 0,25-0,31 М NaCl, а АО несколько позже в области 0,37-0,41 М (см. фиг. 5). В результате на данной стадии очистки получили ферментный препарат АО с максимальной удельной активностью 13,5 Е (среднее значение 12 Е), полностью свободный от примеси каталазы (фиг.5). Стабилизацию АО осуществляли способом, идентичным способу, описанному в примере 4. Конечный выход белка составил 48,0% Результаты суммированы в табл.3.
Таким образом, как видно из графиков фиг.4 и 5, предлагаемый способ обеспечивает возможность достижения поставленной цели в случае использования в качестве источника алкогольоксидазы культуры дрожжей Hansenula polymorpha (прототип), а также и других видов метилотрофных дрожжей, например Pichia pastoris.
Способ предусматривает использование культур, хранящихся в каталоге культур Всесоюзной коллекции непатогенных микроорганизмов. Штаммы дрожжей, являющиеся продуцентами целевого продукта (алкогольоксидаза, АО), имеют следующие номера в официальной коллекции микроорганизмов: Candida boidinii 34 Hansenula polymorpha 1397 Pichia polymorpha 1392 Pichia pastoric 1379 Pichia angusta 2599 Pichia pinus 1616
Выделенный по способу ферментный препарат, при котором из 10 г дрожжевых клеток получили 62 мг белка, имеет среднюю удельную активность 12,5 Е (пример 1). Этого количества АО (62 мг) достаточно для 20000 колориметрических анализов при определении концентраций этанола, т.е. на один анализ используется 3 мкг фермента при длительности анализа 3 мин (см. фиг.6), отражающую зависимость скорости алкогольоксидазной реакции от времени при содержании этанола 10 мг/л 1; 20 мг/л 2; 40 мг/л 3. Инкубационная среда в 1 мл содержала: 0,06 мл 0,07% 2,6-дихлорфенолиндофенола, 30 мкг в 0,03 мл пероксидазы хрена, 3 мкг АО и 0,9 мл 0,02 М фосфатного буфера рН 7,6.
Следовательно, учитывая высокую стоимость ферментных препаратов, определение концентрации этанола с исполь- зованием полученной по данному способу АО, не содержащей примеси каталазы, значительно ускоряет время анализа и удешевляет его конечную стоимость по сравнению с прототипом.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ получения ферментного препарата для количественного определения тиаминдифосфата в биологических объектах | 1988 |
|
SU1620483A1 |
| Способ получения пируватдекарбоксилазы из пивных дрожжей | 1988 |
|
SU1541255A1 |
| ШТАММ БАКТЕРИИ DELCYA MARINA - ПРОДУЦЕНТ ЩЕЛОЧНОЙ ФОСФАТАЗЫ И СПОСОБ ПОЛУЧЕНИЯ ЩЕЛОЧНОЙ ФОСФАТАЗЫ | 1994 |
|
RU2077577C1 |
| Способ получения большого фрагмента ДНК-полимеразы I ЕSснеRIснIа coLI - фрагмента Кленова | 1988 |
|
SU1541256A1 |
| СПОСОБ ПОЛУЧЕНИЯ АЛКОГОЛЬОКСИДАЗЫ ВЫСШИХ СПИРТОВ | 1991 |
|
RU2016898C1 |
| СПОСОБ ВЫДЕЛЕНИЯ ДНК | 1991 |
|
RU2026864C1 |
| СПОСОБ ПОЛУЧЕНИЯ РЕКОМБИНАНТНОГО ГРАНУЛОЦИТАРНОГО КОЛОНИЕСТИМУЛИРУЮЩЕГО ФАКТОРА ЧЕЛОВЕКА | 2001 |
|
RU2201962C2 |
| Способ получения рестриктазы С @ I | 1988 |
|
SU1546485A1 |
| Способ получения РНК-лигазы | 1979 |
|
SU910762A1 |
| Способ получения карбоксипептидазы А и карбоксипептидазы В из поджелудочной железы свиньи | 1987 |
|
SU1551742A1 |
Использование: биотехнология и может быть использовано в микробиологической промышленности для получения алкогольоксидазы /АО/, применяемой при ферментативном определении концентрации алкоголя в крови и других биологических жидкостях человека и животных. Сущность изобретения: способ включает культивирование дрожжей - продуцента АО на минеральной среде. Собранные клетки из выращенной биомассы суспендируют, суспензию дезинтегрируют, клеточный гомогенат центрифугируют, а надосадочную жидкость, включающую АО и каталазу, очищают. Для этого бесклеточный центрифугат собирают на ДЭАЭ-Тойоперл 650 М, уравновешеном 0,01 - 0,04 М трис-HCl буфером в присутствии 0,05 М NaCl, 0,1 мМ ЭДТА и 0,1 мМ дитиотейтола при pH 7,6 - 8,2, с последующей элюцией белка линейным градиентом NaCl 0,1 - 0,5 М в 0,01 - 0,04 М трис-HCl буфере, pH 7,6 - 8,2 с 0,1 мМ ЭДТА и 0,01 мМ дитиотрейтолом, со скоростью 8 мл/ч, собирая фракции по 4 мл. На данной стадии очистки получают ферментный препарат АО, полностью свободный от примеси каталазы. Метод сульфоаммонийного фракционирования осуществляют стабилизацию АО. Выход алкогольоксидазы, свободной от примеси каталазы, составляет 43,4% с удельной активностью 12,5 Е. 6 ил., 3 табл.
СПОСОБ ПОЛУЧЕНИЯ ДРОЖЖЕВОЙ АЛКОГОЛЬОКСИДАЗЫ, предусматривающий культивирование продуцирующего микроорганизма, выделение клеточной биомассы, разрушение клеток с получением бесклеточного экстракта, очистку от каталазы, отличающийся тем, что, с целью повышения чистоты ферментного препарата, очистку бесклеточного экстракта ведут ионообменной хроматографией на ДЭАЭ-Тойоперл 650М, уравновешенном 0,01 0,04 М трис-HCl-буфером, в присутствии 0,05 М хлористого натрия, 0,1 ммоль ЭДТА и 0,1 ммоль дитиотрейтола при pH 7,6 8,2.
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| C.Verduyn, j.P.van Dijken, A.Scheffers "Colorimetric alcohol assays with alcohol oxidase." j.Microbiol.Methods, 1984, v.2, p.15-25. | |||
Авторы
Даты
1995-04-10—Публикация
1990-11-05—Подача