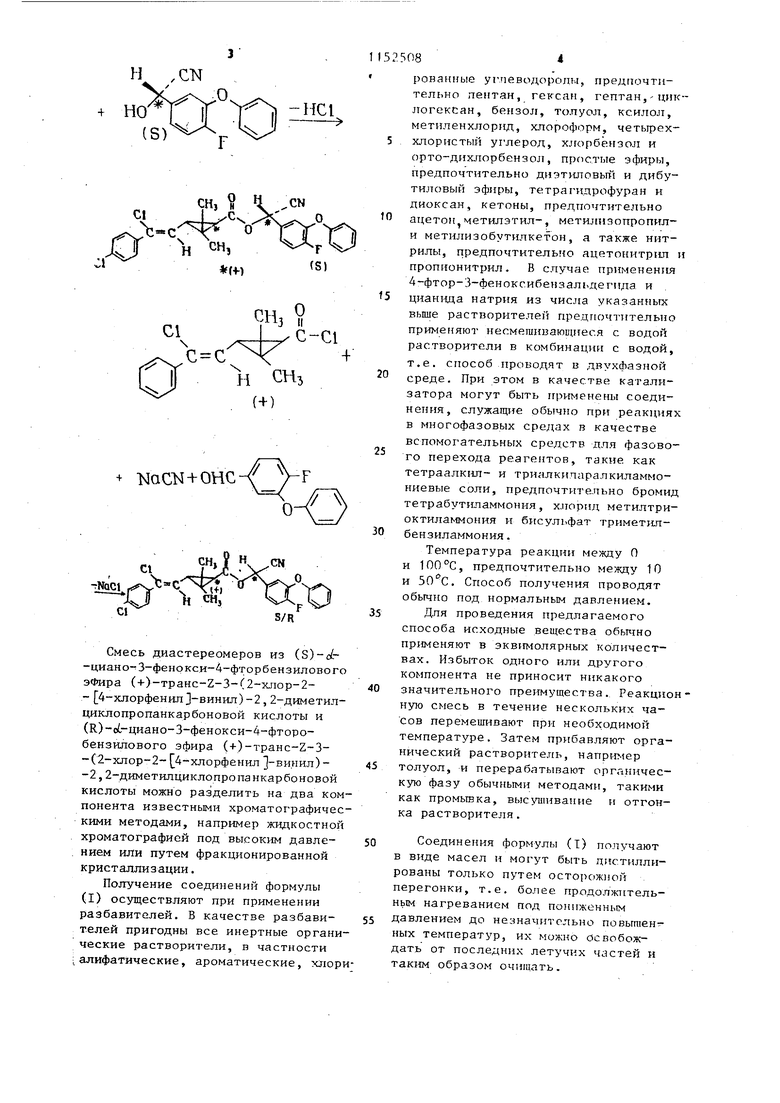
, Изобретение относится к химическим гхтедствлм защиты рястенни, конкретно, к акарицндному средству на основе оптически активных сложных с 1-циано-4-фтор- |-феноксибензиловых эфиров (+)3-(2-хлор 2 хлорфенил }-винил)-2,2-диметилциклопропаи-1-карбоновой кислоты. Известно акарицидное средство на основе производных циклопропанкарбоновой кислоты О. Наиболее близким к изобретению является акари1щдное средство в форме эмульгируемого концентрата на основе оптически активного слож ного о/-циано 4-фтор-3 феноксибен лового эфира (+)3-(2-хлор-2- 4-хл фенил -Бинил)-2,2-диметилциклопропан-1-карбоновой кислоты, орга ческого растворителя и эмульгатора - алкиларилполигликолевого эфи ра 2. Однако известные акарицидные средства обладают Недостаточной активностью при малых концентрациях . Целью изобретения является пов шение акарицидной активности сред ва. Поставленная цель достигается тем, что акарицидное средство в форме эмульгируемого концентрата содержит в качестве оптически активного сложного с -циано-А-фтор -3-феноксибензилоБого эфира (+)3-(2-хлор-2- А-хлорфенил -винш1)-2,2-диметил-циклопропан-1-карбоновой кислоты оптически активный сложньш о/. -циано-4-фтор-З-фенокс бензилового эфира (-f-)TpaHC-Z-3-(2-хлор- 4-хлорфенил -винил)-2,2 -димети.пциклоцропан-1 -карбоновой кислоты формулы НзС Н Н I СО-О-Ш (си в Которой конфигурация ot-C-атом является R и/или S, в качестве о нического растворителя - мономет ловый эфир этиленгликоля,а в качестве алкиларилполигликолевого эфира - нонилфенолполигликолевый 82 эфир при следующем соотношении компоненто.в, мас.%: Активньп ингредиент 30 Монометиловый эфир этиленгликоля35 Нонилфенолпо.лигликолевый эЛир35 Предлагаемое акарицидное cpe iтво приготовляют путем простого смешивания компонентов. Соединения формулы (I) получают взаимодействием соответствующих оптически активных изомеров ангидриа (+)транс-Е-3-(2-хлор-2- 4-х,г1оренил -винил)-2,2-диметилциклопропан-1-карбоновой кислоты формуНзС/г-л /xJ;z-CO-Cl ci-f т -/ СНз PJ) соответствующими изомерами -циано4-фтор-З-феНоксибензилового спирта ормулы , ( но-ш оЧ / в присутствии акцептора кислоты и/или в присутствии разбавителя, или с 4-фтор-З-феноксибензальдегидом формулы / // € в присутствии по меньшей мере эквимолярного количества -цианида щелочного металла, в присутствии катализатора и разбавителей. Если в качестве исходного вещества применять, например, ангидрид (+)-транс-г-3-(2-хлор-2- 4-хлорфенил1-винил)-2,2-диметилциклопропан- 1-карбоновой кислоты и (S)-ci-циано-4-фтор-3-феноксибензиловыйспирт соответственно 4-фтор-З-феноксибензальдегид и цианид натрия, тогда соответствующие реакции могут быть представлены с помощью следующей схемы формул п СН} CHi
Н ,CN
CN
гн о
ii3 II
c-ci
Ч
+ tvIaCN-bOHC-/ VF
CM
S/R
Смесь диастереомеров из (S)-(-циано-З-фенокси-4-фторбензиловогоэфира (+)-TpaHc-Z-3-(2-xJiop-2- 4-хлорфенилЗ-винил)-2,2-диметилциклопропанкарбоковой кислоты и (Е)-о(,-циано-3-фенокси-4-фторобензилового эфира (+)-TpaHC-Z 3(2-хлор-2- 4-хлорфенил -ви.нил)-2,2-диметилциклопропанкарбоновой кислоты можно разделить на два компонента известными хроматографическими методами, например жидкостной хроматографией под высоким давлением или путем фракционированной кристаллизации.
Получение соединений формулы (I) осуществляют при применении разбавителей. В качестве разбавителей пригодны все инертные органические растворители, в частности ;алифатические, ароматические, хлориронанные углеводороды, предпочтительно пентан, гексан, гептан,-циклогексан, бензол, толуо.п, ксилол, метиленхлорид, хлороформ, четыреххлористый углерод, х;горбензол и орто-дихлорбензол, простые эфиры, предпочтительно диэтиловый и дибутиловый эфиры, тетрагидрофуран и диоксан, кетоны, предпочтительно ацетон метилэтил-, нетилизопропили метилизобутилкетон, а также нитрилы, предпочтитель {о ацетонитрил пропионитрил. В случае применения 4-фтор-З-феноксибензальдегида и цианида натрия из числа указанных выше растворителей предпочтительно применяют ргесмешивающиеся с водой растворители в комбинации с водой, т.е. способ проводят в двухфазной среде. При этом в качестве катализатора могут быть применены соединения, служащие обычно при ре.чкция в многофазовых средах в качестве вспомогательных средств для фазового перехода реагентов, такие как тетраалкил- и триалкипаралкиламмониевые соли, предпочтительно броми тетрабутгшаммония, хлорид метилтриоктиламмония и бисульфат триметилбензиламмония.
Температура реакции между П и , предпочтительно между 10 и 50 С. Способ получения проводят обычно под нормальным давлением.
Для проведения предлагаемого способа исходные вещества обычно применяют в эквимолярных количествах. Избыток одного или другого компонента не приносит никакого значительного преимущества. Реакционую смесь в течение нескольких часов перемешивают при необходимой температуре. Затем прибавляют органический растворитель, например толуол, и перерабатывают органическую фазу обычными методами, такими как промывка, высушивание и отгонка растворителя.
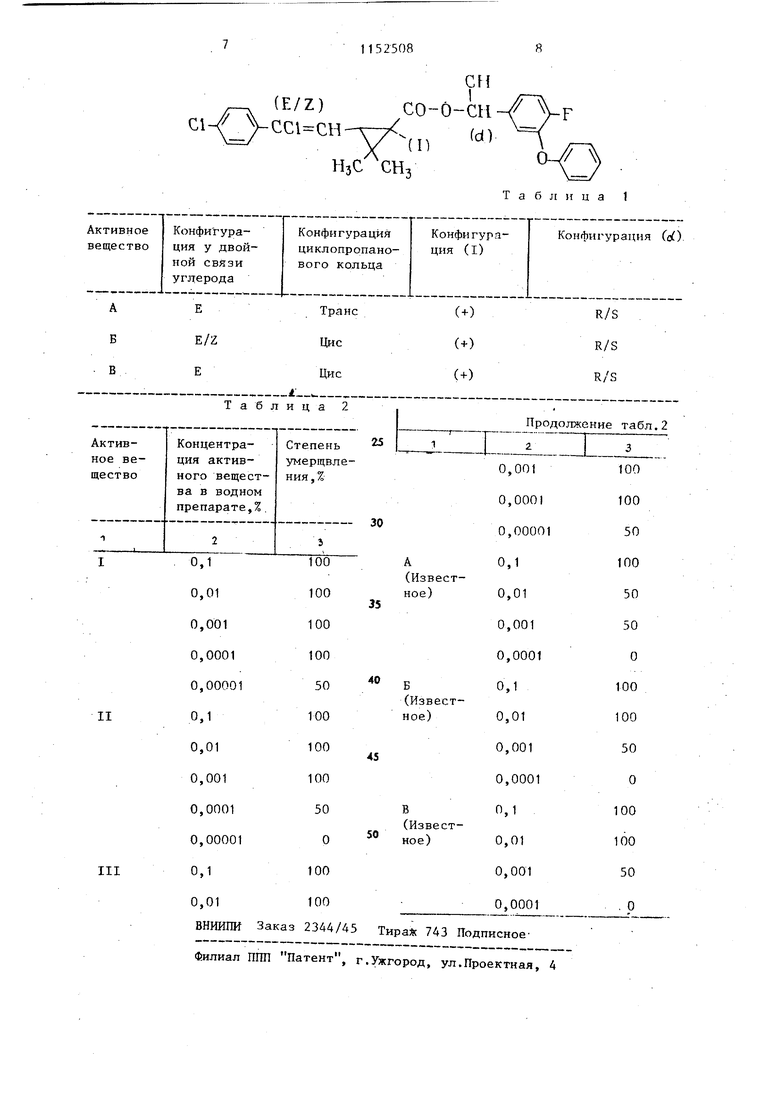
Соединения формулы (Т) получают в виде масел и могут быть дистиллированы только путем осторожной перегонки, т.е. более продолжнтельHbiM нагреванием под пониженным давлением до незначительно повыгаенг:ных температур, их можно освобождать от последних летучих частей и таким образом очищать. П р и м е р 1 . .«)-о4ГЛ-г /Ч Ji сн. в смесь 50 мл циклогексана, 0,87 г цианида натрия, 1,3 мл воды 2,42 г (0,0112 моль) З-фенокси-4-фторбензальдегида и 0,2 г тетрабутиламмонийбромида перемешивая при 20-25 С, П.О каплям прибавляют 3,4 г (0,0112 моль) ангидрида ( + )-транс-г-3-(2-хлор-2- 4-хлорфенил -винил)-2,2-диметш1-1-циклопропанкарбоновой кислоты, растворенной в. 10 мл циклогексана, и затем в течение 4 ч при 20-25°С пере мешивают . После чего в реакционную смесь добавляют 100 мл толуола и дважды встряхивают водой в количес ве 60 мл каждый раз. Органическую фазу отделяют, сушат над сульфатом магния и растворитель отгоняют в вакууме, получаемом с помощью водо струйного насоса. Остатки раствори теля удаляют путем непродолжительной осторожной отгонки при (1 торр). Получают 4,4 г (77% от теоретического) ()-о1-циано-3-фенокси-4-фторбёнзилового эфира (+)-тринс-2-3-(2-хлор-3- 4-хлорфенил}-винил)-2,2-диметш1ЦИКлопропан карбоновой кислоты в качестве вязкого масла, с показателем вращением Wi) +58, (с 100 м в 10 мл СНСез), ТН-ЯМР-спектр в CDCe,TMC t (част./млн.), бензил-Н 3,60 (с/1/2 Н) и 3,64 (с/1/2 Н), ВИНШ1-Н: 4,12 (д/1 Н) (соединение Разделение ci-R- и изомеров 5 г (Я5)-в6-циано-3-фенокси-4-фторобензилового эфира (+)-транс-Z-3-(2-ХЛОР-2- 4-хлор-фенил У-ВИнил)-2,2-диметилциклопропанкарбоновой кислоты подвергают разделен методом препаративной жидкостной хроматографии под высоким давлением. Колонна: 250 мм 21,2 мм, 7 и. ликагеля, растворитель: 47,6 об.% н-гексана, 47,6 об.% циклогексана и 4,8 об.% диэтилового эфира, скорость подачи 30 мл/мин количест во 30 мг, В результате получают две фракции, каждую фракцию в вакууме освобождают от растворителя. В фракции I (300 мл) содержится Oj9 г (К)-о(,-циано-3-фенокси-4-фторобензилового эфира (+)-TpaHC-Z-3-(2-хлор-2- 4-хлорфенил -винип)-2,2-диметилциклопропанкарбоновой кислоты в качестве бесцветного масла. о( +f,0°C (с 190 мг в 10 мл CHCEj), 1Н-ЯМР-спектр (СВСЕз/ТМС) сЛ(част./млн.) : -CHCN: :6,351 (с/1Н) диметил-Н: 1,37 (с/ЗН) и 1,26 (с/ЗН), (соединение II). В фракции II (330 мл) содержится 0,5 г (3)-о(.-циано-3-фенокси-4-фторобензилового эфира (+)-TpaHc-Z-3-(2-хлор-2)- 4-хлорфенил -винил)-2,2-диметилциклопропанкарбоновой кислоты в качестве бесцветного масла, Го +34, (с 120 мг в ЮмлСНССд) 1Н-ЯМР-спектр (СВС э/ТМСсГ(част./млн.) -СНСН: 6,377 (с/1Н) (соединение III), диметил-Н: 1,28 (с/ЗН) и 1,22 (с/ЗН). В табл.1 представлены соединения известных средств. Пример 2. Опыт с Boophilus microptus устойчивый (10 взрослых особей). В течение минуты погружают в водный препарат акарицидного средства из 3 мае.ч. (30 мас,%) активного вещества, (35 мас.%) монометилового эфира э тиленгликоля и 3,5 мае.ч. (35 мас.%) нонилфенолполигликолевого эфира. Потом их размещают в пластмассовых чашках и содержат в камере с кондиционированием воздуха в течение 24 ч. Затем определяют процентную степень умерщвления. Активные вещества в средстве и результаты опытов приведены в табл.2. Таким образом, предлагаемые акарицидные средства обладают высокой акарицидной активностью при малых концентрациях.
,, ,, (E/Z)СО-0-Ш-/Л-Г
С1-(/ЛУСС1 ::СН-у.(d)(
ИзС СНз
СИ
Таблица 1

| название | год | авторы | номер документа |
|---|---|---|---|
| Акарицидный состав | 1980 |
|
SU1009269A3 |
| АМИДЫ АЛКОКСИМИНОУКСУСНОЙ КИСЛОТЫ, ФУНГИЦИДНОЕ СРЕДСТВО НА ИХ ОСНОВЕ И СПОСОБ БОРЬБЫ С ГРИБКОВЫМИ ЗАБОЛЕВАНИЯМИ РАСТЕНИЙ | 1996 |
|
RU2167853C2 |
| Способ получения производных имидазола или их солей | 1975 |
|
SU552027A3 |
| Способ получения эфиров 2,2-диметилциклопропанкарбоновых кислот | 1980 |
|
SU1053744A3 |
| Способ получения производных 1,4-дигидропиридинлактона | 1985 |
|
SU1319785A3 |
| СЕЛЕКТИВНЫЕ ГЕРБИЦИДЫ НА ОСНОВЕ АРИЛСУЛЬФОНИЛАМИНОКАРБОНИЛТРИАЗОЛИНОНОВ | 2001 |
|
RU2277335C2 |
| ПРОИЗВОДНЫЕ БЕНЗИМИДАЗОЛА И ИХ СОЛИ, ОБРАЗОВАННЫЕ ПРИСОЕДИНЕНИЕМ КИСЛОТ, СПОСОБ ИХ ПОЛУЧЕНИЯ И МИКРОБИЦИДНОЕ СРЕДСТВО НА ИХ ОСНОВЕ | 1996 |
|
RU2159242C2 |
| Способ получения производных бензо (с) циннолина | 1972 |
|
SU492087A3 |
| Способ борьбы с нежелательной растительностью | 1978 |
|
SU1075943A3 |
| Способ получения производных имидазолила или их солей | 1975 |
|
SU540568A3 |
АКАРИ1ЩЦНОЕ СРЕДСТВО в форме эмульгируемого концентрата, содержащее активный ингредиент оптически активньй сложный d-диано-4-фтор-З-феноксибензилрвый эфир (+)3-
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| СИСТЕМА ВИБРОИЗОЛЯЦИИ С РЕГУЛИРУЕМОЙ ЖЕСТКОСТЬЮ | 2017 |
|
RU2658074C1 |
| Способ восстановления хромовой кислоты, в частности для получения хромовых квасцов | 1921 |
|
SU7A1 |
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| ПРОИЗВОДНЫЕ АМИНОКИСЛОТ И ИХ ИСПОЛЬЗОВАНИЕ | 2015 |
|
RU2730515C2 |
| Способ восстановления хромовой кислоты, в частности для получения хромовых квасцов | 1921 |
|
SU7A1 |
Авторы
Даты
1985-04-23—Публикация
1981-09-02—Подача