Изобретение относится к микробиологии, в частности к медицинской микробиологии, а также микробиологической промышленности, и может быть использовано для определения количества бактерий в препаратах.
Цель изобретения - повышение точности и чувствительности анализа.
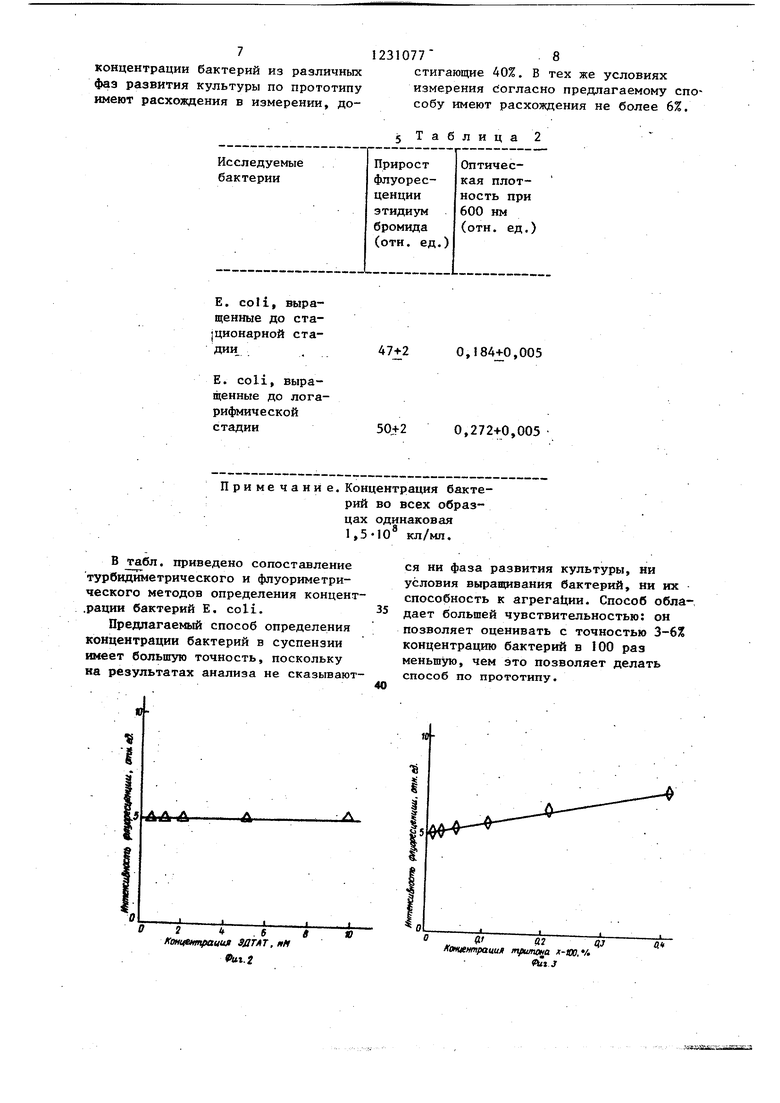
Предлагаемый способ поясняется фиг. 1-7.
Сущность способа заключается в приготовлении бактериальной суспен- ;ЗИН в дистиллированной воде, которая вносится в раствор (тр 1«-НС1, 100 ммоль, рН 7,2-7,5), добавляются растворы тритона Х-100 (до концентрации 0,03 - 0,05%), этилендиаминтетра- ацетата-триса (ЭДТАТ), рН 7,2-7,5 (до концентрации 0,3-3,0 j41) и эти- диум бромида (2-,7-диaминo-10-этил- -9-фeншlфeнaнтpидиyм бромида до кон - центрации 4-7 мкмоль). После 5-минутной инкубации измеряют интенсивность флуоресценции этидиум бромида в суспензии бактерий и в буфере. Разность между первой и второй величинами характеризует концентрацию бактерий в суспензии.
Способ основан на том, что флуоресцентный краситель этидиум бромид сйособён избирательно взаимодействовать с нуклеиновыми кислотами, при этом квантовый выход его флуорес- ценции увеличивается. Прирост флуоресценции красителя прямо пропорционален количеству нуклеиновых кислот. Для обеспечения проницаемости мембран грамотрицательных бактерий для флуорохрома клетки обрабатывают смесью детергента с хелатором (тритон Х-100 с этилендиаминтетраацета- том). Регистрация прироста флуоресценции этидиум бромида при взаимодействии с нуклеиновыми кислотами однозначно отражает количество бакте рий в препарате.
Возможны два варианта количествен ной характеризации препаратов бактерий по флуоресценции этидиум бромида. Согласно первому строится калибровочный график зависимости между приростом флуоресценции этидиум бромида в суспензии бактерий после кратных разведений и числом клеток, подсчитанных под микроскопом в счетной камере. Второй вариант предусмат ривает учет количества бактерий в УСЛОВНЫХ единицах прироста флуорес31077J
ценции красителя в присутствии бактерий по отношению к его флуоресценции без бактерий. Последний вариант целесообразно использовать для тех
5 видов бактерий, количественный учет которых под микроскопом невозможен.
Пример 1. В оптическую Кювету последовательно вносят 3 мл буферного раствора, содержащего
to 100 ммоль трис -НСЕ, рН 7,2, этидиум бромид до концентрации 0,1 мкмоль и измеряют интенсивность, флуоресценции при 600 нм с длиной волны возбуждающего света 322 нм на спектрофпуоJ5 риметре Перкин-Элмер, модель 1000. Эти операции повторяют при разных концентрациях красителя. Проведенные измерения (фиг. 1) свидетельствуют о том, что для исследования флуорес20 ценции красителя целесообразно ис- пользовать его концентрации, не превышающие 8 мкмоль, когда сохраняется линейная зависимость между его концентрацией и интенсивностью флуорес25 ценции.
Пример 2. В оптическую кювету последовательно вносят 3 мл буфера, указанного в примере 1, этидиум бромид до концентрации 6мкмоль
30 ЭДТАТ, рН 7,2 и регистрируют интен-, сивность флуоресценции, как описано в примере 1. Эту процедуру повторяют при разных концентрациях ЭДТАТ. Полученные результаты фиг. 2) означают,
35 что интенсивность флуоресценции этидиум бромида не зависит от концентрации ЭДТАТ в широком диапазоне.
Таким же образам исследуют влияние тритона Х-100 на флуоресценцию эти40 диум бромида. Результаты исследования (фиг. 3) -показьгоают, что тритон Х-100 при концентрациях больше ,0,05% вызывает увеличение интенсивности флуоресценции этидиум бромида более 45 чем на 5%. Поэтому использование более высоких концентраций детергента в ходе анализа нецелесообразно.
Культуру Escherichia coli К-12 выращивают на глюкозо-минеральной
50 среде до стационарной фазы роста. Клетки осаждают центрифугированием и один раз отмьшают дистиллированной водой. В оптическую кювету вносят 3 мл буфера по примеру 1 и этидиум
55 бромид до конечной концентрации
6 мкмоль. Измеряют интенсивность флуоресценции красителя, как описано в примере 1. В ту же кювету добавля3
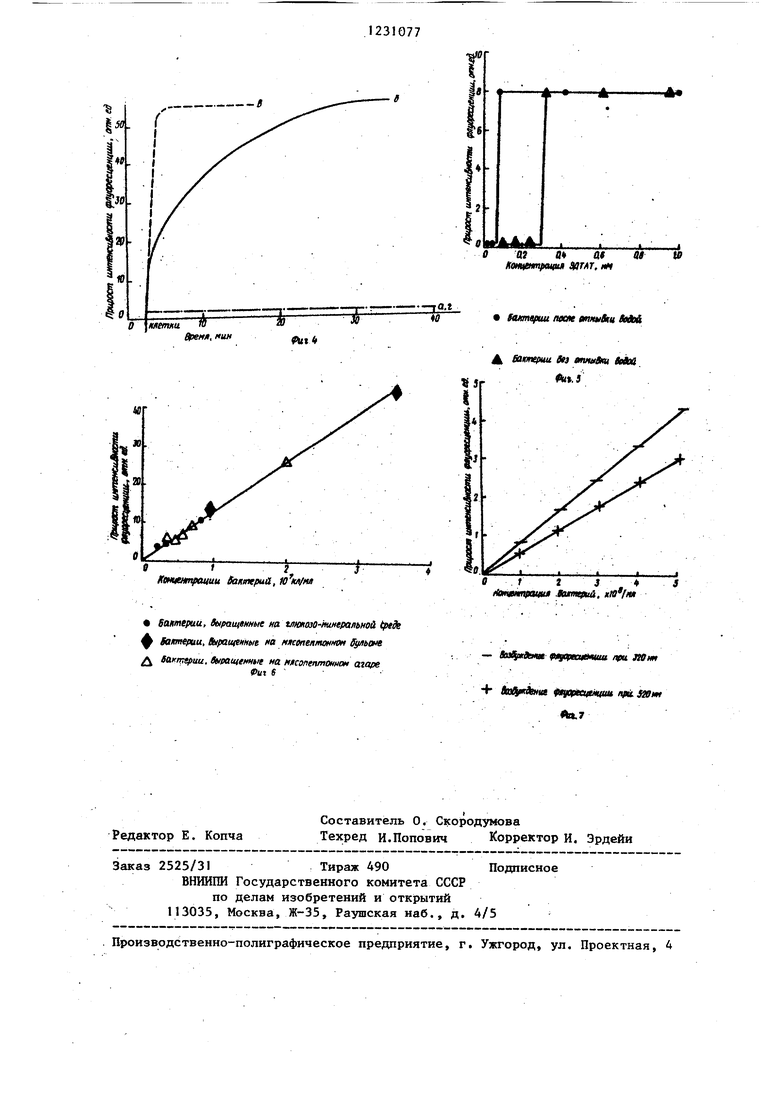
ют суспензию бактерий Е. coli до конечной концентрации, соответствующей оптической плотности образца при 600 нм 0,01 - 0,5 ед. Снова измеряют флуоресценцию. Результаты анализа показаны на фиг. 4, где а - ствие клеток в системе практически не влияет на флуоресценцию этидиум бромида, поскольку краситель не проникает через клеточную оболочку к нуклеиновым кислотам.
В оптическую кювету вносят буфер, этидиум бромид и суспензию бактерий в указанных концентрациях, добавляют раствор ЭДТАТ до конечной концентрации 0,3 ммоль и регистрируют прирост флуоресценции красителя во времени. Анализ результатов (фиг. 4, кривая б) показывает, что максимальный прирост флуоресценции красителя (максимальное связывание с нуклеиновыми кислотами) происходит через 30 мин инкубации.
В оптическую кювету вносят буфер, этидиум бромид, суспензию клеток, ЭДТАТ в указанных концентрациях, добавляют раствор тритона Х-100 до конечной концентрации 0,03% и регистрируют прирост флуоресценции красите :ля во времени. Как видно из представ ленных данных (фиг. 4, кривая Ь), присутствие тритона Х-100 существенно ускоряет проникновение красителя в бактерии Е. coli. Тритон Х-100 без ЭДТАТ не способствует проникновению этидиум бромида в клетки Е. со- .li (фиг. 4г ). Таким образом, именно комбинация ЭДТАТ с тритоном Х-100 способствует быстрому и полному связыванию этидиум бромида с нуклеино- вь1ми кислотами бактерий Е. coli.
Пример 3. Культуры трех грамположительных (Bacillus subti- lis, Staphylococcus aureus Streptococcus facealis) и трех грамотрица- тельных видов (Escherichia coli, Pseudomonas aeruginosa, Serratia marcescens) бактерий выращивают на мясопептонном агаре. Клетки смывают со среды 0,15 М раствором ЫаСГ и суспендируют. В оптическую кювету вносят 3 мл буфера т рис -НСЕ (100 ммоль, рН 7,5), зтидиум бромид (6 мкмоль) и измеряют интенсивность флуоресценции красителя nq примеру 1. В тот .же образец вносят суспензию одного из видов микроорганизмов в концентрации, соответствующей оптической
31077
плотности при 600 нм не более 0,5ед. и не менее 0,1 ед. Через 5-7 мин регистрируют прирост флуоресценции красителя. Аналогичные исследования 5 (фиг. 5) проводят после добавки в образцы ЭДТАТ (0,3 ммоль) вместе с тритоном Х-100 (0,03%), полз енные результаты представлены в табл. 1. Из данных табл. 1 следует, что
10 грамположительные виды бактерий связывают этидиум брЪмид и без ЭДТАТ с тритоном Х-100. В то же время эти соединения не влияют отрицательно на связывание красителя с исследованны15 ми видами. Для грамотрицательных видов бактерий обработка ЭДТАТ с тритоном Х-100 является необходимым условием проникновения бромистого этидия к нуклеиновым кислотам. Выбранные
20 концентрации хелатора и детергента являются эффективными для всех исследованных видов.
В табл. 1 показано наличие прирог- та флуоресценции этидиум бромида в
25 присутствии бактерий в зависимости от обработки хелатором с детергентом.
Т а б л и ц а I
30
35
Примечание. (+) - наличие прироста флуоресценции; (-) - отсутствие при- роста флуоресценции.
Пример 4. Клетки Е. coli К-12 выращивают на мясопептонном агаре, а также на жидких глюкозо- минеральной и мя.сопептонной средах до логарифмической и стационарной фазы роста. Бактерии, выращенные на агаре, смывают дистиллированной водой и готовят суспензию с оптическойплотностью при 600 нм 0,01-0,5 ед. Бактерии, выращенные на жидкой среде, разводят водой до такой же опг тической плотности. В опт1-гческую кювету с три с -НСЕ буфером (100 ммоль, рН 7,5) вносят тритон Х-100 до конечной концентрации 0,03%, ЭДТАТ (рЯ 7,5) до конечной концентрации 1,0 ммоль, этидиум бромид до конечной концентрации 7 мкмоль. Измеряют интенсивность флуоресценции, как указано в примере 1, Для дальнейших расчетов удобно уровень флуоресценции в этом образце (контрольном) принять за 0.
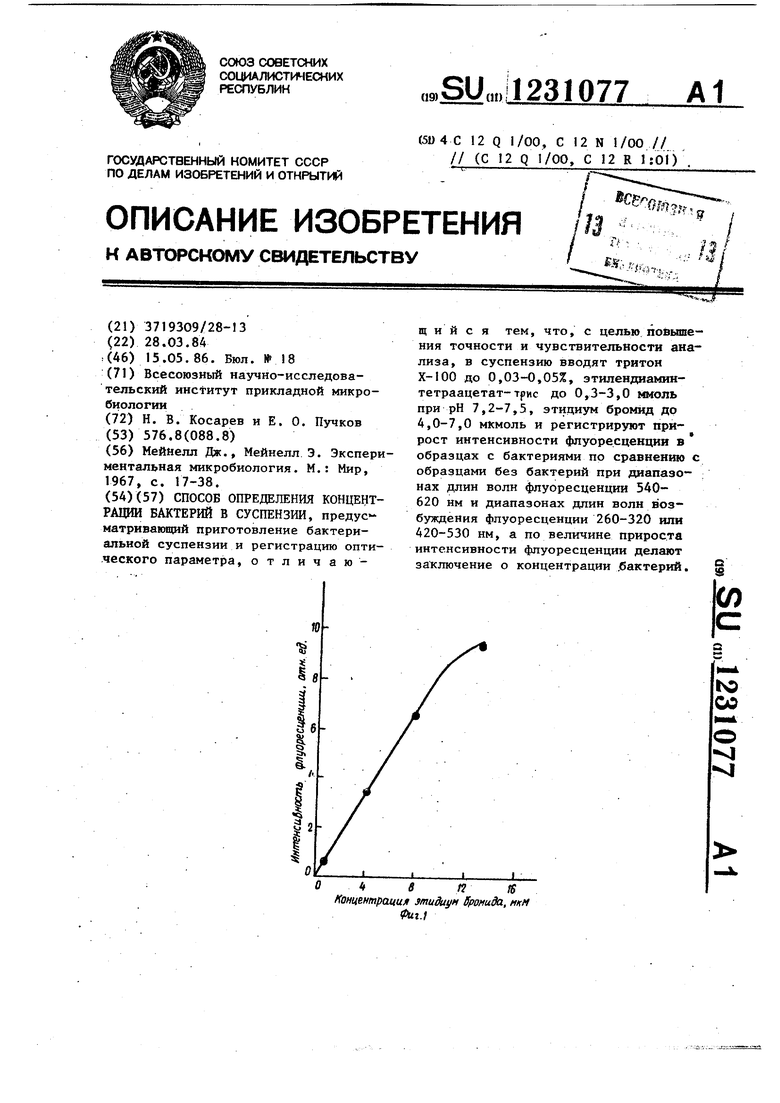
Те же соединения в такой же концентрации вносят в оптическую кювету, а затем добавляют бактериальную суспензию и через 5 мин измеряют уровень флуоресценции. Такие опера- ции проделывают с бактериальными суспензиями после кратных разведений. Параллельно подсчитывают концентрацию бактерий в образцах под фазово- контрастным микроскопом в камере Го- ряева. На основании полученных данных строят зависимость (фиг. 6) между приростом флуоресценции этидиум бромида (iF) и числом бактерий в 1 мл суспензии (N). Эта зависимость выражается формулой ,
где К - соответствует тангенсу угла наклона зависимости N ртДГ.
В полученной формуле коэффициент К одинаков для бактерий Е. coli, выращенных на разных питательных средах и не зависит от фазы развития культуры. Минимальная концентрация бактерий Е. coli в образце, которую можно определить с помощью данного метода с точностью 3-5%, равна 10 кл/мл, что соответствует оптической плотности при 600 нм 0,001 ед.
Аналогичные измерения проводят дл В. iubtilis, S. aureus, S. saecalis, F. aeruginosa, S. marcescehs. Bo Всех случаях прирост флуоресценции этидиум бромида линейно зависит от концентрации бактерий в образцах.
Пример 5. Культуру Е. coli К-12 выращивают и подготавливают к работе как указано в примере 3. В оптическую кювету вносят 3 млтрис-НС буфера (100 ммоль, рН 7,5), этидиум бромид (6 мкмоль), ЭДТАТ (0,3 ммоль) тритон Х-100 (0,03%) и суспензию бактерий в концентрации 10 кл/мл. После 5-минутной инкубации измеряют прирост флуоресценции при 590 нм в образце по отношению к пробе, не содержащей клеток. Измерени проводят при двух длинах волн возбуждающего света (320 и 520 нм), соответствующих двум основным полосам поглощения красителя. Полученные результаты (фиг. 7) свидетельствуют о линейной зависимости прироста флуоресценции этидиум бромида от концентрации бактерий при обеих длинах волн. Это позволяет определять концентрацию бактерий при возбуждении ф;.уоресцен- ции этидиум бромида в обеих основных полосах поглощения.
Пример 6. Инокулят культуры Е. coli К-12 делят на две порции. Одну выращивают на глюкозо-минераль- ной среде до логарифмической, а другую - на той же среде до стационарной фазы роста. Клетки осаждают центрифугированием и суспендируют в . С помощью камеры Горяева отдельно подсчитывают концентрацию бактерий в препаратах из логарифмической и стационарной фаз роста. Путем разведения водой доводят концентрацию бактерий в обоих препаратах до 4,6 Ю кл/мл. В оптическую кювету вносят 3 мл трис -НС буфера (100 ммоль) и 0,1 мл суспензии бактерий из лог.а- рифмической фазы роста. Измеряют оптическую плотность суспензии при 600 нм на спектрофотометре СФ-4. Такие же измерения проводят с бактериями из стационарной фазы роста.
В, оптическую кювету вносят 3 мл трис-НС буфера (100 ммоль, ), этидиум бромид (6 мкмоль), ЭДТАТ до концентрации 0,3 v&l (рН 7,5), тритон Х-100 (0,03%), 0,1 мл суспензии бактерий и логари4 1ической фазы роста и после 5-минутн6й инкубации измеряют прирост флуоресценции по сравнени с образцом без бактерий, как указано в примере 5. Такие же измерения выполняют с бактериями из стационарной фазы (данные этих измерений сведены в табл. 2).
Из данных табл. 2 следует, что бактериальные взвеси культуры Е. coli К-12 из логарифмической и стационарной фаз роста при одинаковой концентрации клеток имеют разную мутность (в табл.,2 приводятся данные в единицах оптической плотности) Таким образом, измерения одинаковой
71231077 8
концентрации бактерий из различных стигающие 40%. В тех же условиях фаз развития культуры по прототипу имеют расхождения в измерении, доизмерения Согласно предлагаемому собу имеют расхождения не более 6
Исследуемые бактерии
Е. соИ, выращенные до ста- ционарной стадии . . Е. coli, выращенные до логарифмическойстадии
Примечание. Концентрация бактерий во всех образцах одинаковая 1,5-10® кл/мл.
В табл. приведено сопоставление турбидаметрического и флуориметри- ческого методов определения концент- .рации бактерий Е. coli.
Предлагаеьай способ определения концентрации бактерий в суспензии имеет большую точность, поскольку на результатах анализа не сказываютстигающие 40%. В тех же условиях
измерения Согласно предлагаемому способу имеют расхождения не более 6%.
Таблица 2
.)
Оптическая плотность при 600 им (отн. ед.)
47+2 0,184+0,005
50+2 0,272+0,005
ся ни фаза развития культуры, ни условия выращивания бактерий, ни их способность к агрегации. Способ обладает большей чувствительностью: он позволяет оценивать с точностью 3-6% концентрацию бактерий в 100 раз меньшую, чем это позволяет делать способ по прототипу.


| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПРОГНОЗИРОВАНИЯ УСТОЙЧИВОСТИ КЛЕТОК ЧУМНОГО МИКРОБА ШТАММА EV К ЛИОФИЛИЗАЦИИ | 2007 |
|
RU2380420C2 |
| СПОСОБ ОПРЕДЕЛЕНИЯ КОЛИЧЕСТВА БАКТЕРИЙ В БИОПРЕПАРАТЕ | 1997 |
|
RU2117291C1 |
| СПОСОБ ВЫДЕЛЕНИЯ ХРОМОСОМНОЙ ДНК ИЗ БАКТЕРИАЛЬНЫХ КЛЕТОК ВОЗБУДИТЕЛЯ ЧУМЫ YERSINIA PESTIS | 2002 |
|
RU2232818C1 |
| СРЕДСТВО ДЛЯ ПЕРЕНОСА НУКЛЕИНОВЫХ КИСЛОТ ИЛИ ИХ ПРОИЗВОДНЫХ В КЛЕТКИ ЧЕЛОВЕКА ИЛИ ЖИВОТНЫХ | 1992 |
|
RU2113485C1 |
| СПОСОБ ПОЛУЧЕНИЯ ФРАКЦИИ ИЗ КЛЕТОК Escherichia coli, ОБЛАДАЮЩЕЙ ИНГИБИРУЮЩЕЙ ПРОТЕАЗЫ АКТИВНОСТЬЮ | 2010 |
|
RU2437934C1 |
| СПОСОБ ПОЛУЧЕНИЯ РЕКОМБИНАНТНОЙ ЭНДОНУКЛЕАЗЫ SERRATIA MARCESCENS | 2021 |
|
RU2795623C2 |
| СПОСОБ СПЕЦИФИЧЕСКОГО ВЫДЕЛЕНИЯ ПОЛНОГО ДНК-СОДЕРЖИМОГО БАКТЕРИАЛЬНЫХ ВОЗБУДИТЕЛЕЙ ИНФЕКЦИИ | 2010 |
|
RU2567809C2 |
| СПОСОБЫ ИДЕНТИФИКАЦИИ МИКРООРГАНИЗМОВ С ПОМОЩЬЮ СПЕКТРОСКОПИИ (ВАРИАНТЫ) | 2009 |
|
RU2531225C2 |
| ПЕПТИДЫ ЛАТАРЦИНЫ, ПРОЯВЛЯЮЩИЕ АНТИМИКРОБНУЮ АКТИВНОСТЬ | 2006 |
|
RU2319745C1 |
| ПЕПТИДЫ, ПРОЯВЛЯЮЩИЕ АНТИМИКРОБНУЮ АКТИВНОСТЬ | 2005 |
|
RU2302425C2 |

ААА
г . 6 в
конщечтраиия 9ДТАТ, нН fttt.r
а «гиз
Кониеитраиия mfumoMt х-юо, / лГ J
в
вреня, HUH
.д
gW4Ai4
о иг б м
Komtamfitufia затлг, нн
Ш №
ftuentfuu пвак вти/Ли Май
в 1-Г
KtHuemr nuuu Sanmtpuu, Ю м/н
Д Sannepitu It) аюшЛп МЛ .. Л, л
01 г -
Лтвтупщи Jtamtfuu, иЮ /н
Sanmepuu, StipauttttMie т итазв-нимераямой ф Sanmepuu, Киращенные на нкепеяяюпном Вуйызнк
д SuKtrafuu, выращенние на нисопептоннон агаре Фиг f
Редактор Е. Копча
Составитель О. Скородумова
Техред И.Попович Корректор И. Эрдейи
Заказ 2525/31Тираж 490Подписное
ВНИИПИ Государственного комитета СССР
по делам изобретений и открытий 113035, Москва, Ж-35, Раушская наб., д. 4/5
Производственно-полиграфическое предприятие, г. Ужгород, ул. Проектная, 4
- ueujorAxee «ы$фас«М(ш( при. ЛОт
+ tol firauiut luyofHeentMuau яри. ЗЯин Аа.7
| Мейнелл Дж., Мейнелл Э | |||
| Экспериментальная микробиология | |||
| М.: Мир, 1967, с | |||
| Печь для сжигания твердых и жидких нечистот | 1920 |
|
SU17A1 |
Авторы
Даты
1986-05-15—Публикация
1984-03-28—Подача