Изобретение относится к новым химическим соединениям, а именно к производным 5j 6-дигидро-11-Н-дибензо Ь,е азепин-6-она общей формулы
где R - водород или метил;
когда R j и R - водород, R означает окси- или этоксигруппу;
когда Rg метил, а R - водород, Rg означает оксигруппу;
когда R - NHCOCH , R и R вместе означают кислород;
После выдерживания при комнатной температуре в течение 30 мин добавляют 2,5 мл метилиодида и полученную смесь выдерживают при комнатной температуре
5 в течение 24 ч, после чего ее. выливают в воду, продукт отфильтровывают, сушат и кристаллизуют из этанола до получения продукта с т.пл. 199-201°С.
П р и м е р 3. 11-этокси-5-метил- обладающим противосудорожной активно- о 5,6-дигидро-11Н-дибензо Ь,е азепин6-он.
18 мл тионилхлорида добавляют к 7,1 г 11-окси-5-метил-5,6-дигидро- дибензо Ь,е 1 азепин-6-она в 180 мл хлороформа и полученную смесь оставляют выстаиваться при комнатной температуре на 12 ч. После удаления растворителя и избытка тионилхлорида в
стью.
Целью изобретения является поиск в ряду 5,6-дигидро-11Н-дибензо b,el азепин-6-онов новых соединений, обладающих ценными фармакологическими 25 свойствами, в частности высокой противосудорожной активностью при низкой токсичности.
Пример 1. 5,11-диметил-11167 ,..„ г, твакуумеостается продукт с т.пл.
окси-5,6-дигидро-11Н-дибензо Lb, ej ЗО
азепин-6-он.i onir,r,
1,20г этилата натрия в 100 мл аб10 мл метилиодида.в 50 мл безводного этилового эфира добавляют к 8,8 г стружек магния в безводном этиловом эфире с такой скоростью, чтобы поддерживать медленное кипение с обратным холодильником.
После окончания добавления смесь выдерживают еще в течение 1 ч при ки- пеции с обратным холодильником, после Q чего добавляют 10 г 5-метил-5,6-дигидро- 1 1 Н-дибензо Ь,еЗ азепин-6,11- диона, растворенного в 100 мл безводного ТГФ. После кипячения смеси с
солютированного этанола добавляют понемногу к 5,5 г полученного ранее неочищенного продукта в 56 мл диоксана. 35 После кипячения в течение 2 ч с обратным холодильником смесь оставляют остывать, фильтрзтот, полученный продукт выпаривают досуха и загружают в петролейный эфир.
Полученный продукт кристаллизуют из смеси гексан/циклогексан (3:1) и его т.пл. составляет 98-100 С.
Аналогично получены: 10-ацетамидо- 5,6-дигидро-1 1 Н-дибензо Ь,е азепин ™ ° Л J,6,n т„пл. 270-272-0; п-этокси-5,6-дигидро-11Н-дибензо СЬ,е азе- ПИН-6-ОН; 5-метил-11-окси-5,6-дигидро- 1 1Н С Ь,е 1 азепин-6-он; 11-окси-5, зуют из этанола до получения продукта ,-11 и сг i -
inn олоо,:6-дигидро-11 Н-дибензо b,ej азепинс т.пл. 200-202 С.50 6-он.
П р и м е р 2. 5-метил-10-ацетами- др-5,6-дигидро-11Н-дибеизо 11Ь,е азепин-6,11-дион.
2 мл уксусного ангидрида добавляют
к 2,5 г 10-амино-5,6-дигидро-11Н-ди- ,5 конвульсивно-седативньп. агентов. бензо Lb,e3 азепин-6,11-диона (полуПри введении в организм через рот предлагаемые соединения проявляют более высокую противосудорожную активее.выливают в воду, экстрагируют этиловым эфиром, эфир удаляют при пониженном давлении и продукт кристаллиБиологическая активность. Предлагаемые соединения представляют интерес для фармакологии, особенно в связи с их активностью в качестве античенного из 1-амино-антрахинона по способу Саголиа и Palazzo Car.Chim 83,533,1953) в 50 мл диоксана. После
кипячения 2 ч с обратным холодильником полученную смесь выпаривают почти досуха при пониженном давлении, затем остаток выливают в воду, фильтруют и
сушат до получения 2 г неочищенного продукта.
2 г полученного ранее неочищенного продукта суспензируют в 20 мл N, N-диметилформамида и добавляют 710 мг
метилата натрия в 10 мл метанола.
После выдерживания при комнатной температуре в течение 30 мин добавляют 2,5 мл метилиодида и полученную смесь выдерживают при комнатной температуре
в течение 24 ч, после чего ее. выливают в воду, продукт отфильтровывают, сушат и кристаллизуют из этанола до получения продукта с т.пл. 199-201°С.
167конвульсивно-седативньп. агентов.
Биологическая активность. Предлагаемые соединения представляют интерес для фармакологии, особенно в связи с их активностью в качестве анти31301830
ность, чем вальпроат натрия. Указанные соединения характеризуются таким действием в дозировках, в которых они не оказывают никаких побочных эффектов, свойственных вальпроату натрия.
Механизм действия некоторых из этих соединений включает ГАМК-эрги- ческую систему посредством ингибиро- вания нервной передачи, связанной с
5.Натриевая соль 2-пропиопентан вой кислоты.
6.7-Хлор-1,3-дигидро-1-метил-5- фенил-2Н-1,4-бензодиазепин-2-он.
7.11-Этокси-5,6-дигидро-11Н-ДИ- бензо Ь,е 1 азепин-6-он.
8.5-Метил-11-oкcи-5,6-дигидpo- 11H-дибeнзo Ь,е 1 азепин-6-он.
9.11-Окси-5,6-дигидро-11Н-дибен
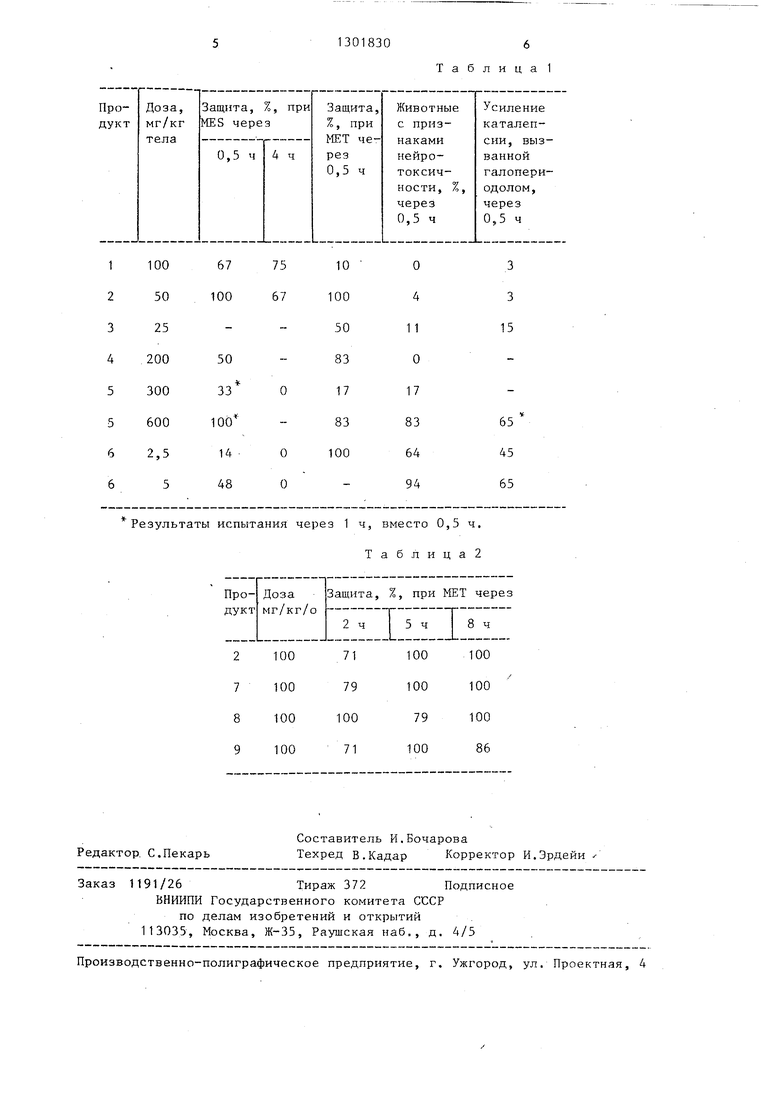
этим медиатором. Более конкретно дей-Ю зо b,el азепин-6-он. ствие таких соединений, как 5-метил- Из данных, приведенных в табл.1, 11-этокси-5,6-дигидро-11Н-дибен зо Ь,е азепин-6-она и 1О-ацетамидо-5метил-5,6-дигидро-11Н-дибензо b,е 1
видно, что предлагаемые продукты об ладают противоконвульсивным действи относительно MES и/или МЕТ (с.равним
азепин-6,11-диона, примерно в 10 раз f5 или превышающим действие сравниваемых
5.Натриевая соль 2-пропиопентано- вой кислоты.
6.7-Хлор-1,3-дигидро-1-метил-5- фенил-2Н-1,4-бензодиазепин-2-он.
7.11-Этокси-5,6-дигидро-11Н-ДИ- бензо Ь,е 1 азепин-6-он.
8.5-Метил-11-oкcи-5,6-дигидpo- 11H-дибeнзo Ь,е 1 азепин-6-он.
9.11-Окси-5,6-дигидро-11Н-дибензо b,el азепин-6-он. Из данных, приведенных в табл.1,
видно, что предлагаемые продукты обладают противоконвульсивным действием относительно MES и/или МЕТ (с.равнимым
сильнее, чем у вальпроата натрия.
продуктов) (соединения 5 и 6), но пр применении в активных дозах предлага емые соединения обладают почти нулевой нейротоксичностью в отличие от
причем это действие является к тому же более длительным.
Соединения испытаны на мьшах (табл.1) и крысах (табл.2) по спосо- 20 сравниваемых соединений (испытание-, бам, отдельно указанным для оденки связанное с протяжкой), их антагонизма против конвульсий, , вызванных MES.
В опытах на мышах и крысах установлено, что LDgp предлагаемых соеди-25 нений превьшает или равна 2000 мг/кг (ДЛЯ перорального введения. Для некоторых из указанных продуктов антагонизм выражается даже спустя 30 мин
после введения и длится несколько ча- Ю ствия сравниваемых продуктов, сов.
продукты демонстрируют активность и потенцирование каталепсии, вызванной галоперидолом.
Результаты испытаний, проведенных 35 зо b,el азепин-6-она общей формулы на мьщ1ах (швейцарские альбиносы), приведены в табл.1.
Результаты испытаний, проведенных на крысах (альбиносы Spraque -Dowly),JO приведены в табл.2.
Кроме того, как следует из табл. эти соединения не обостряют каталепсию, вызванную применением палоперио дола, т.е. они вероятно не обладают центральной антидопаминергической ак тивностью и, в общем случае, они име ют более продолжительное действие по сравнению с продолжительностью дейФормула изобретения Производные 5,б дигидро-11Н-дибен
В опытах используют следующие продукты.
1.5,11-Диметил-11-окси-5,6-дигидро- 1 1 Н-дибензо Ь,еТ азепин-6-он. 2. 5-Метил-11-этокси-5,6-дигидро- 11-Н-дибензоиЬ,el азепин-6-он.
3. 10-Ацетамидо-5-метил-5,6-дигидро- 1 1 Н-дибензо Ь,еЗ азепин-6,11-дион
А. 1О-Ацетамидо-5,6-дигидро-11Н- дибензо t Ь,е азепин-6,11-дион.
продуктов) (соединения 5 и 6), но при применении в активных дозах предлагаемые соединения обладают почти нулевой нейротоксичностью в отличие от
сравниваемых соединений (испытание-, связанное с протяжкой),
сравниваемых соединений (испытание-, связанное с протяжкой),
Кроме того, как следует из табл.1, эти соединения не обостряют каталепсию, вызванную применением палоперио- дола, т.е. они вероятно не обладают центральной антидопаминергической активностью и, в общем случае, они имеют более продолжительное действие по сравнению с продолжительностью дейзо b,el азепин-6-она общей формулы
Формула изобретения Производные 5,б дигидро-11Н-дибенRi Вз
где RJ - водород или метил; когда Rg и R - водород, чает окси- или этоксигруппу;
R озна
когда Rj, метил, а R - водород,.. R, означает оксигруппу;
когда R - NHCOCH, R ,j и R. вместе означают кислород;
обладающие противосудорожной активностью .
Доза, мг/кг тела
Защита, %, при MES через
0,5 ч
4 ч
Защита, %, при МЕТ через0,5 ч
100
50
25
200
300
600
2,5
5
67 100
50
33
100
14
48
75 67
О О
10
100 50 83 17 83
100
Результаты испытания через 1 ч, вместо 0,5 ч.
Таблица2
Про- Доза Защита, %, при МЕТ через
дукт мг/кг/о j1
2ч 5ч 8ч
210071100100
710079100100
810010079100
91007110086
Составитель И.Бочарова Редактор. С.ПекарьТехред В.Кадар Корректор И.Эрдейи
Заказ 1191/26Тираж 372 Подписное
ВНИИПИ Государственного комитета СССР
по делам изобретений и открытий 113035, Москва, Ж-35, Раушская наб., д. 4/5
Производственно-полиграфическое предприятие, г. Ужгород, ул. Проектная, 4
Таблица 1
е %,
Усиление каталепсии, вызваннойгалопери- одолом, через 0,5 ч
3
3
15
65 45 65

| название | год | авторы | номер документа |
|---|---|---|---|
| ТРИЦИКЛИЧЕСКИЕ ПРОИЗВОДНЫЕ, СПОСОБ ПОЛУЧЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, СПОСОБ ИНГИБИРОВАНИЯ ВАЗОПРЕССИНА | 1994 |
|
RU2149160C1 |
| Способ получения производных триазолазепина | 1973 |
|
SU475777A3 |
| Способ получения производных дибензодиазепинона или их кислотно-аддитивных солей | 1983 |
|
SU1301314A3 |
| Способ получения 5,11-дигидро-11- @ (1-метил-4-пиперидинил)-амино @ -карбонил @ -6 @ -дибенз ( @ , @ )азепин-6-она или его солей | 1985 |
|
SU1308196A3 |
| ПРОИЗВОДНЫЕ ЗАМЕЩЕННОГО ТЕТРАЦИКЛИЧЕСКОГО АЗЕПИНА, СПОСОБ ИХ ПОЛУЧЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, ПРОМЕЖУТОЧНЫЙ ПРОДУКТ И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 1995 |
|
RU2163240C2 |
| НЕСТЕРОИДНЫЕ СОЕДИНЕНИЯ, ПОЛЕЗНЫЕ В КАЧЕСТВЕ МОДУЛЯТОРОВ РЕЦЕПТОРОВ ГЛЮКОКОРТИКОИДОВ | 2006 |
|
RU2420528C2 |
| Способ получения -трициклических производных азетидина или их оптических изомеров или их солей | 1976 |
|
SU715020A3 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, ОБЛАДАЮЩАЯ АНТИПСИХОТИЧЕСКОЙ, АНТИДЕПРЕССАНТНОЙ ИЛИ ПРОТИВОЭПИЛЕПТИЧЕСКОЙ АКТИВНОСТЬЮ, СО СНИЖЕННЫМ ПОБОЧНЫМ ЭФФЕКТОМ | 2007 |
|
RU2440116C2 |
| НОВЫЕ ПРОИЗВОДНЫЕ 10,11-ДИГИДРО-10-ОКСО-5H-ДИБЕНЗ[B,F]АЗЕПИН-5-КАРБОКСАМИДА, СПОСОБЫ ИХ ПОЛУЧЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, СПОСОБ ЛЕЧЕНИЯ СУДОРОЖНЫХ СОСТОЯНИЙ | 1997 |
|
RU2187503C2 |
| АМИДЫ АМИНОКАРБОНОВЫХ КИСЛОТ, СПОСОБ ИХ ПОЛУЧЕНИЯ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 1994 |
|
RU2134683C1 |
Изобретение касается производных дибензо СЬ,еЗ азепинона, в частности 5,6-дигидро-11Н-дибензо Lb,ell азепин- 6-она (ДВА) общей формулы ,C--N 1 Г где R,-H, когда R и R - Н, окси- или этоксигруппа: -«огда R., - СИ и , R3 оксигруппа; когда R - NHC(0)CH, то R вместе - кислород, которые обладают противосу- дорожной активностью и могут быть использованы в медицине. Для создания веществ указанного класса с лучшими свойствами были получены новые ДВА. Их синтез ведут из Mg-метилйодида и, например, 5-метил-5,6-дигидро-11Н-дибензо Lb,e3 азепин-6,11-диона в среде тетрагидрофурана и эфира при кипячении с последующей кристаллизацией. Испытания ДВА показаывают, что они имеют низкую токсичность (LD 2000 мг/кг) и проявляют лучшее в 10 раз антисудорожное седативное действие, чем вальпроат натр ия, без побочных эффектов в отличие от палопе- риодола. 2 табл. и (Л loo СХ) со о

| Вудбери М., Пенри .К., Пип- пинчер С.Е | |||
| Antiep Drergs | |||
| - Равен пресс, 1982. |
Авторы
Даты
1987-04-07—Публикация
1983-03-14—Подача