1
Изобретение относится к способу получения новых замещенных 6-арил- -3(2Н)-пиридазинонов, обладающих кардиотоническими свойствами, и может найти применение в медицине.
Целью изобретения является синте новых замещенных 6-арил-3(2Н)-пири- дазинонов, обладающих улучшенными кардиотоническими свойствами.
.Пример 1. Получение метил 4-(1Н-имидазол-1-ил)-р-оксобензол- пропаноата.
Раствор 4-( 1Н-имидазол-1-ил)-аце тофенона (24,2 г; 0,13 моль) в тет- рагидрофуране (250 мл) добавляют к сусйензии 50%-ного NaOH (6,7 г) в тетрагидрофуране (70 мл) при перемешивании. Раствор перемешивают при комнатной температуре в течение 1 ч Добавляют даметилкарбонат (30 мл), после чего смесь нагревают с обратным холодильником в течение ночи. Твердое вещество отфильтровывают, остаток обрабатывают водой и нейтрализуют уксусной кислотой. Полученно таким образом твердое вещество отфильтровывают и выкристаллизовывают из смеси метанола-эфира, получив 15,0 г метйл-4-(lH-имидaзoл-l-ил)- -|l-oкcoбeнзoлпpoпaнoaтa .
Пример 2. Получение 4-(1Н- -имидазол-1-ил)- -оксобензолбутано- вой кислоты.
Раствор метилового эфира 4-(1Н- -имидазол-1-ил)-|3 оксобензолпропа- новой кислоты (6,1 г; 0,025 моль) в тетрагидрофуране (65 мл) медленно добавляют к перемащиваемой суспензии 50%-ного NaOH (1,2 г; 0,025 моль в тетрагидрофуране (20 мл) и раство перемащивают еще в течение 1 ч. Добавляют этиловый эфир бромуксусной кислоты (4,5 г), после чего смесь нагревают с обратным холодильником в течение 7-8 ч. Тетрагидрофуран удаляют, остаток обрабатывают водой и органический материал экстрагируют зфиром. Остаток, полученный после удаления эфира, гидролизуют путем нагревания с 6 н. НС1 в течение 8 ч. Неочищенную кислоту окончательно кристаллизуют из диметил- формамида, получив,,3,3 г 4-(1Н-ими- дазЬл-1-ил)- -оксобензолбутановой кислоты.
Пример 3. Получение 4,5- -дигидро-6- 4-(1Н-имидазол-1-ил)- -фенилЗ 3-(2Н)-пиридазинона.
13346 2
Раствор 4,5 г 4-(lH-имидaзoл-l- -ил)-X -oкcoбeнзoлбyтaнoвoй кислоты в этаноле (60 мл) нагревают с обратным холодильником с 85%-ным гидра- 5 зингидратом (2,5 мл) в течение 7 ч. Спирт выпаривают, остаток обрабатывают водой и отфильтровывают. Неочищенный продукт окончательно за- кристаллизовывают из этанола, полу- чив 3,5 г 4,5-дигидро-6- 4-(1Н-ИМИ- дазол-1-ил)-фенилЗ-3(2Н)-пиридази- нона; т. пл. 206-207°С (с разлож.).
Вычислено, %: С 65,00; Н 5,00; N 23,33.
15
С,, H,,N,0.
20
Найдено, %: С 65,06; Н 5,35; N 23,39.
Пример 4. Реакцией 4-(1Н- -бензимидазол-1-ил)-J-оксобензолбу- тановой кислоты с гидразингидратом по способу примера 1 получают 4,5- -дигидро-6- 4-(1Н-бензимидазол-1- -ил)-фенил -3(2Н)-пиридазинон (Зи), 2 т. пл. 262-264 с.
Пример 5. Получение 4,5- -дигидро-6- 4-(1Н-имидазол-1-ил)- -фенил -5-ме тил-3(2Н)-пиридазинона (ЗК).
Суспензию RCN (6,6 г в 8 мл воды) медленно добавляют к перемешиваемому раствору смеси 4-(1Н-имидазол-1-ил) бензальдегида (17,2 г), пара-толуол- сульфокислоты (19 г) и морфолина (11,4 г) в диоксане (100 мл). Смесь нагревают с обратным холодильником в течение 3 ч, концентрируют до половины ее объема и выливают в насыщенный раствор KjCOj. Масло экстрагируют с помощью экстракт промывают водой, высушивают и выпаривают, получив масло, которое фильтруют через силикагель. Масло окончательно кристаллизуют из простого эфира.
30
40
45
К перемещиваемому раствору указанного 4-(1Н-имидазол-1-ил)-фенил - -4-морфолинацетонитрила в Т€;трагидро- фуране (120 мл) добавляют 30 капель 30%-ного КОН в метаноле с последующим
медленным добавлением кротононитри- ла (4,2 г) в течение 15-минутного периода и полученную смесь перемешивают при комнатной температуре в течение 90 мин. Реакционную смесь
55 концентрируют под вакуумом, остаток обрабатывают водой и масло экстрагируют . Метилеихлоридный экстракт промывают водой, высуши:вают и
31
концентрируют, получив высоковяэкую смолу.
Ее растворяют в 30 мл 6н. HCI и нагревают на паровой бане в течение 6 ч. Красноватый раствор выпаривают досуха под вакуумом, остаток поглощают в 150 мл абсолютного спирта, нагревают на паровой бане в течение 15 мин и охлаждают. Неорганические соли отфильтровывают и фильтрат используют непосредственно в следующей стадии, Фильтрат нагревают с обратным холодильником с 85%-ны гидразингидратом (4 мп) в течение 4 ч. Раствор охлаждают, разбавляют водой и отфильтровывают. Твердое вещество закристаплизовывают из этано- латетрагидрофурана, получив 2,8 г 4,5-дигидро-6- 4-(1Н-имидазол-1-ил)- -фeнилJ-5-метил-3(2Н)-пиридазинона (Зк), т. пл, 197-198°С,
Вычислено,%: С 66,12; Н 5,55; N22,04.
c,,H,;N40.
Найдено,%: С 66,12; Н 5,54; N 21,05.
Пример 6. Пол.учение 4,5-ди- гидро-6-1 3- ( 1 Н-имидазод-1 -ил) -фенил -3(2Н)-пиридазинона.
Раствор 5,2 г 3-(lH-имидaзoл-l- -ил)-V-oкcoбeнзoлбyтaнoвoй кислоты в этаноле (60 мл) нагревают с обратным холодильником с 85%-ным гидразингидратом (1,8 г) в течение 4 ч. Спирт выпаривают, остаток обрабатывают водой и Отфильтровывают. Неочищенный продукт окончательно за- кристаллизовывают из этанола, получив 2,9 г 4,5-дигидро-6- з-(1Н-ими- дазол-1-ил)-фенил -3(2Н)-пиридазино иа, т. пл. 190-190, 5°С.
Вычислено,%: С 64,98; Н 5,03; N 23,39.
C,3H,2N40.
Найдено, %: С 65,02; Н 5,08; N 23,33,
Пример 7, Получение 4-(4,5 6,7-тетрагидро-Ш-бензимидазол-1- -ил)-Х -оксобензолбутановой кислоты.
Раствор 4-фторо-у-оксибензолбу- тановой кислоты (20 г; 0,1 моль) и 5,6,7,8-тетрагидробензимидазола (12,2 г; 0,1 моль) в ДМСО (50 мл) добавляют по каплям к суспензии 50% NaOH (9,6 ; 0,2 моль) в толуоле (20 мл) при перемешивании, причем температуру поддерживают около 30°С. В этот момент добавляют допол33464
нительное количество ДМСО (50 мл) и смесь перемешивают при комнатной температуре в течение ночи, после чего ее нагревают при 100-110 С в 5 течение 18 ч. Раствор охлаждают, экстрагируют эфиром и водный раствор доводят до рН 5, Полученное таким образом твердое вещество отфильтровывают, промывают водой и закристал- лизовывают из диметилформамида, получив 10 г 4-(4,5,6,7-тетрагидро- -1Н-бензимидазол-1-ил)-у-оксобензол- бутановой кислоты, т, пл, 234-235 С. Пример 8, Получение 4,5-ди- 5 гидро-6- 4-(4,5,6,7-тетрагидро-1Н- бензимидазол-1-ил)-фенил -3(2Н)-пи- ридазинона.
Смесь 9 г 4-(4,5,6,7-тeтpaгидpo- -Ш-бeнзимидaзoл-l-ил)-y-oкcoбeнзoл- 0 бутановой кислоты и 3,5 г гидразин- гидрата в 80 мл этанола нагревают с обратным холодильником в течение 6 ч. Реакционной смеси дают остыть и отфильтровывают. Неочищенный про- -5 дукт окончательно закристаллизовыва- ют из 2-метоксиэтанола, получив 4,5 г 4,5-дигидро-6- 4-(4,5,6,7-тетрагидро- 1Н-бензимидазол-1-ил -фенил -3(2Н)-пиридазинона, т, пл. 296- 0 297°С-.
Вычислено, %: С 68,88; Н 6,14; N 18,90.
, 0,1 .
.J5 Найдено, %: С 68,84; Н 6,40; N 18,50.
Пример 9. Получение -(1Н-имидазол-1-ил)-фенил -3(2Н)- пиридазинона (13а).
0 Бром (1,6 мл) по каплям добавляют к раствору 4,5-дигидpo-6-t4-(1Нимидазол-1-ил)-фенил -3(2Н)-пиридазинона (3,5 г) в уксусной кислоте (25 мл) при 80 С. Смесь нагревают в
5 течение 6 ч, чтобы завершить реакцию. Твердое вещество отфильтровывают, промывают эфиром и превращают в свободное основание, которое пере- кристаллизовывают из этанола, полу0 чив 1,1 г (Ш-имидазсл-1-ил - -фенил -3(2Н)-пиридазинона, т. пл. 244-245 с.
Вычислено,%: С 64,56; Н 4,30; N 23,17; HjO 1,39.
C,3H,oN40, 1/5 , Найдено, %: С 64,30; Н 4,36; N ,04; 1,11,
5 1
Пример 10, Получение -(1Н-имидазол-1-ил)-фенил -5-метил -3(2Н)-11Иридазинона (3и).
Раствор 3,6 г 4,5-дигидро-6- 4- -(IН-имидазол-1-ил)-фенил -5-метил- -3(2Н)-пиридазинона в смеси диокса- на (100 мл) и Ы,К-диметилформамида (25 мл) нагревают с 12 г МпО при ЭО Ь в течение ночи. Температуру по- вьшают до 105 С и поддерживают при ней в течение 4 ч. Неорганическое твердое вещество отфильтровывают и промывают тщательно горячим диокса- ном. Фильтрат и промывки смешивают под вакуумом и остаток закристалли- зовывают из метанола и тетрагидрофу- рана, получив 2,1 г ( Ш-имида- зол-1-ил)-фенил -5-метил-3(2Н)-пири- дазинона, т. пл, 284-286 С.
Вычислено, %: С 66,65; Н 4,79; N 22,21.
C,,H,,
Найдено, %: С 66,22; Н 4,59; N 22,06.
Пример 11. Получение -( Ш-имидазол- 1-ил)-фенил -3(2Н)- пиридазинона,
Раствор брома (0,7 мл) в уксусной кислоте (20 мл) добавляют по каплям к раствору 2,6 г 4,5-дигидро-6- з- -( Ш-имидазол- -ил)-фенил -3(2Н)-Г1и- ридазинона в уксусной кислоте (85 мл при 90-95 С. Реакционную смесь нагревают с обратным холодильником в течение 3,5 ч. После охлаждения твердое вещество отфильтровывают, промывают зфиром и превращают в свободное основание, которое закристалли- зовывают из этанола, получив 1,3 г 6- 3-(1Н-имидазол-1-ил)-фенилЗ -3(2Н) пиридазиНона, т, пл. 234,5-236,5°С,
Вычислено, %: С 65,53; Н 4,23; N 23,52.
C,jH,,N40.
Найдено, %: С 65,44; Н 4,66; N 23,73.
Пример 12. Получение -(4,5,6,7-тетрагидро-Ш-бензимида- зол-1-ил)-фенил -3(2Н)-пиридазинона
Раствор брома (1 г) в 10 мл уксусной кислоты добавляют по каплям к раствору 1,6 г 4,5-дигидро-6- 4-(4, 5,6., 7-тетрагидро-1 Н-бензимидазол-1- ил)-фенил -3(2Н)-пиридазинона в 40 мл уксусной кислоты при 86-88 С. Смесь затем нагревают при 100 С в течение 4-5 ч. Реакционную смесь охлаждают, твердое вещество отфильтро66
Бывают, промывают эфиром и высушивают на воздухе. Полученную таким образом бромистоводородную соль превращают в свободное основание,
которое закристаллизовывают из этанола, получив 0,6 г продукта -(4,5,6, 7-тетрагидро-1Н-бензимида- зол-1-ил)-фенил -3(2Н)-пиридазинона, т, пл. 266-267°С.
Вычислено, %: С 69,35; Н 5,50;
N 19,03.
С, HIS ,0,1 . Найдено, %: С 69,25; Н 5,36; N 19,03.
Тест для определения ьотокарди- альной инотронной активности в анестезированной собаке.
Этот способ проверки заключается в определении влияния возрастающих
внутривенных доз соединения на мио- кардиальную сократимость (dp/dt максимального кровяного давления левого желудочка), на частоту сердечных сокращений и на аортальное кровяное давление собаки, анестезированной пентобарбиталом.
Взрослых нечистокровных собак обоего пола анестезируют пентобарби- тапом--35 мг/кг внутривенно, а затем
поддерживают анестезию путем непрерывного вливания пентобарбитсша 3,5 мг/кг/ч. Трахея интубирована, но животные могут дышать самопроизвольно. В бедренную вену для введения исследуемых соединений вставляется канюля, В восходящую аорту через бедренную артерию для измерения аортального кровяного давления вставляется катетерный датчик давления
Миллара (MiElar) или заполненный
жидкостью кат€;тер. Катетерный датчик Миллара пропускают в левый желудочек через сонную артерию для измерения кровяного давления в левом желудочке. Игольчатые электроды вводят подкожно для записи хода II электрокардиограммы (ЭКГ).
Кровяное давление в левом желудочке и аортальное кровяное давление регистрируют на ленточном самописце. Также регистрируют частоту сердечных сокращений, используя биотахометр, запускающийся от R-вол- ны ЭКГ, и записывают первую произ- водную от кровяного давления в левом желудочке (dp/dt), полученную с помощью дифференциального усилителя, связанного с соответствующим уси-
7
лителем давления. Используют период не менее 30 мин для получения контрольных результатов перед введением исследуемого соединения,
В зависимости от растворимости соединения растворяют в 0,9%-ном солевом растворе или в разбавленной НС1 или в NaOH (0,1 или 1,0 н.) и разбавляют до нужного объема с помощью нормального солевого раствора Если нужно сделать соответствующие разбавления, то в качестве растворителей можно использовать этанол или диметилацетамид. Вводят соответствующие контрольные носители, когда это нужно,
Каждую дозу исследуемого соединения вводят в объеме 0,1 мл/кг в течение 1 мин.
В испытаниях с помощью описанной методики с анестезированной, собакой соединения по предлагаемому изобретению при внутривенном введении со скоростью примерно 0,01 - 0,31 кг/кг/мин вызыв.ают зависящее от дозы значительное возрастание кардинальной сократимости, которое сопровождается только небольшими или минимальными изменениями частоты сердечных сокращений и кровяного давления.
Результаты испытаний 4,5-дигидро- -6- 3-(1Н-имидазол-1-ил)-фенил - -3(2Н)-пиридазинона (А.) и (Ш- -имидазол-1-ил -фенил -3(2Н)-пирида- зинона (Б.) с помощью методики с анестезированной собакой представлены в таблице.
Активность по расширению периферийных сосудов CI-9I4 (таблица) анализировалась в сравнении с амрино- ном на анестезированных собаках с использованием метода префузии передних конечностей. CI-914 или амринон применялся локально в плечевую артерию, в которой поток крови поддерживается постоянным. Результаты этого исследования вызывали в зависимости от дозы снижение давления в плечевой артерии, в то время как не бьшо отмечено какого-либо значительного эффекта на давление крови в артериальной системе. Амринон приводил к аналогичным эффекя-ам, но он оказался приблизительно в 50-100 раз
133468
слабее по сравнению с соединениями по предлагаемому способу, что касается расширения периферийных сосудов.
Формула изобретения
Способ получения замещенных 6- -арил-3(2Н)-пиридазинонов общей формулы
R
15
(I)
где означает двойную или одинарную связь между двумя атомами углерода;
R - водород или метил; А - (lH-и fflдaзoл- -ил) в 3- или 4-положении фенила, или (4,5,6,7-тетрагидро-1Н-бенз- имидазол-1-ил) в 4-положении фенила,
отличающийся тем, что -оксобензолбутановую кислоту, общей формулы
30
(II)
35 где А и R имеют указанные значения, подвергают взаимодействию с гидразином формулы
HjN - NHj
(III)
в среде, органического растворителя при температуре кипения реакционной смеси и выделяют целевой продукт общей формулы (I), где означает одинарную связь между двумя атомами углерода,или далее проводят дегидрогенизацию и выделяют целевой продукт
общей формулы (I), где- означает двойную связь между двумя атомами углерода.
Приоритет по признакам:
17.09.81при R - водород или метил, А - (1Н-имидазол-1-ил);
27.07.82при R - водород или метил, А - (4 ,5,6,7-тeтpaгидpo-Ш- бензимидазол-1-ил),



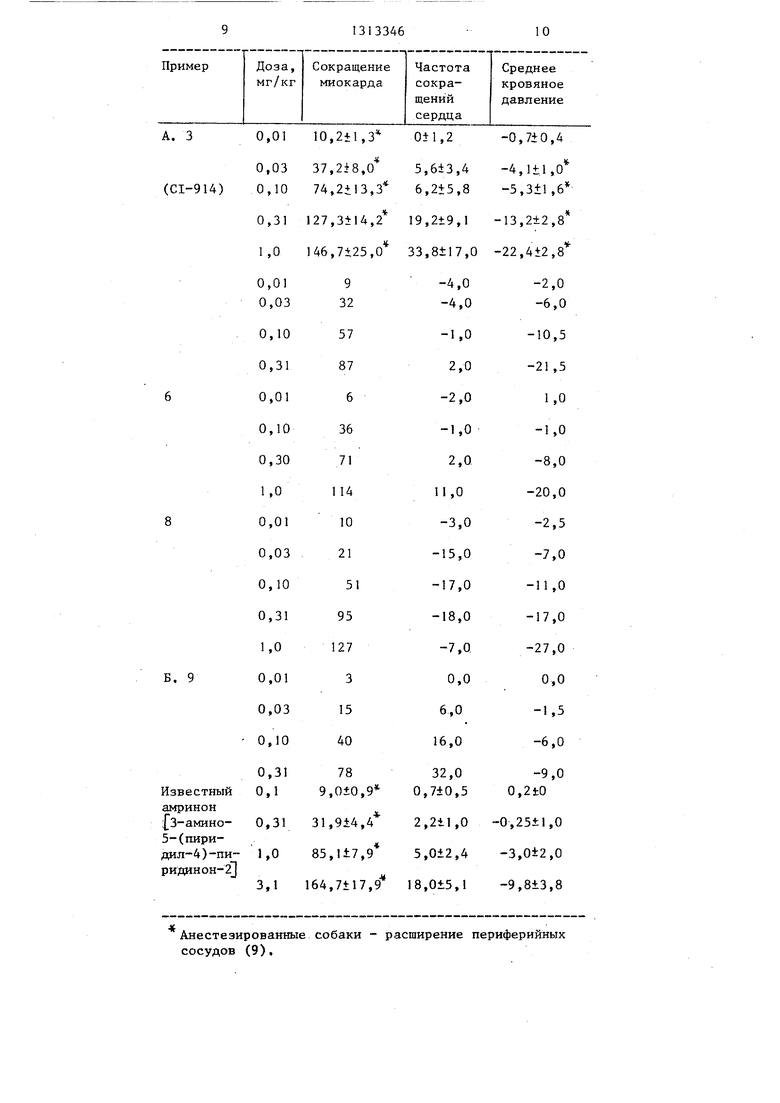
Изобретение касается замещенных пиридазинонов (ПЗ) , в частности получе- ния соединений общей формулы 1 : -C N-NH-C(0)-CHTTTCR, где (--т) означает двойную или одинарную связь между двумя атомами углерода; , CHj; А (Ш-имидазол-1-ил в 3-м или 4-м положении фенила или (4,5,6, 7-тетрагидро-1Н-бензимидазол-1-ил) в 4-м положении фенила, которые проявляют кардиотоническую активность и могут быть использованы в медицине. Цель - создание соединений с лучшей активностью. Получение ПЗ ведут из у-оксобензолбутановой кислоты с заместителем А, указанным вьппе, и гидразина в среде органического растворителя при кипении реакционной смеси с выделением ПЗ, где (ттт) означает одинарную связь. После дегидрогенизации выделяют ПЗ, где (ттт) означает двойную связь. Испытания ПЗ показывают, что они в сравнении с известным амриноном активнее по кардио- тоническому действию (в 50-100 раз). 1 табл. СУ с 1:0 САЭ С.О 4;: о:

| Патент США № 3658814, кл | |||
| Прибор для периодического прерывания электрической цепи в случае ее перегрузки | 1921 |
|
SU260A1 |
| Видоизменение пишущей машины для тюркско-арабского шрифта | 1923 |
|
SU25A1 |
Авторы
Даты
1987-05-23—Публикация
1982-09-15—Подача