Изобретение относится к получению функциональных ацетиленовых соединений, а именно к усовершенствованному способу получения метилового эфира 4-гидрокси-4-метил-2-пентиновой кислоты формулы 1
CH3-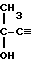 CCOOCH3 который может найти применение, например, в синтезе витаминов.
CCOOCH3 который может найти применение, например, в синтезе витаминов.
Целью изобретения является повышение выхода целевого продукта за счет использования нового вида сырья и режимов проведения процесса.
Метоксикарбонилирование 3-метил-1-бутин-3-ола проводят в среде метанола при атмосферном давлении, температура 20-25оС, обычно в течение 20-25 ч. Наиболее благоприятным для получения целевого продукта является молярное соотношение метанола, 3-метил-1-бутин-3-ола, CuCl2 и CH3COONa, равное 5: 0,02: (0-06-0,08): (0,06-0,08). Выход метилового эфира 4-гидрокси-4-метил-2-пентиновой кислоты 32-43% .
Изменение температуры не приводит к улучшению результатов. При ее понижении исходный спирт не вступает в реакцию, а при повышении происходит его окислительная димеризация с образованием диацетиленового гликоля.
С увеличением или уменьшением количества катализатора начинают преобладать побочные процессы и соответственно снижаются конверсия исходного и выход целевого продуктов.
Молярное соотношение метанола и ацетиленового спирта 5: 0,02 вызвано ограниченным растворением в метаноле СО. Известно, что в 100 мас. ч. метанола растворяется СО 20,4 г (при 0,25оС). В данном же случае на получение количественного выхода конечного продукта требуется 5,58 г СО (при 20оС). Кроме того, на растворение твердых компонентов (CuCl2 и CH3COONa) требуется определенное количество метанола. При использовании меньшего количества растворителя (100 мл) нарушается гомогенность среды и происходит полное осмоление целевого продукта. Увеличение количества метанола нецелесообразно, так как возникают затруднения при обработке реакционной смеси с целью выделения полученного продукта.
Контроль за ходом реакции осуществляют хроматографически методом внутреннего стандарта (использован хроматограф "ЛХМ-80", детектор-катарометр, колонка (5% Silicone DS-550 на хроматоне "N-AW-GMDS").
Строение метилового эфира 4-гидрокси-4-метил-2-пентиновой кислоты подтверждено данными ИК-спектроскопии и элементным анализом.
Изобретение иллюстрируется следующими примерами.
П р и м ер 1. В колбу, снабженную мешалкой, термометром и барботером для подачи СО, помещают 200 мл (5 моль) метанола и пропускают СО до полного насыщения растворителя. Прибавляют 9,38 г (0,07 моль) CuCl2, 5,74 г (0,07 моль) СН3СООNa и 1,68 г (0,02 моль) 3-метил-1-бутин-3-ола и продолжают припускать СО при 25оС в течение 20 ч.
Реакционную смесь выливают в 200 мл воды и экстрагируют серным эфиром (5-7 раз по 100 мл), эфирные вытяжки объединяют и промывают водой. Эфирный экстракт высушивают MgSO4. Перегонкой удаляют растворитель, затем выделяют 0,7 г исходного 3-метил-1-бутин-3-ола (фракция с т. кип. 103-105оС/720 мм рт. ст. ). Остаток перегоняют в вакууме и получают 0,65 г (выход 43% на прореагировавший спирт) соединения (1), т. кип. 83-85оС/1 мм рт. ст. , nD20 1,4555.
Найдено, % : С 59,22;
С7Н10О3.
Вычислено, % : С 59,15; Н 7,04.
ИК-спектр (см-1): 1720 (С= 0), 2235 (С≡С), 3370-3440 (ОН).
П р и м е р 2. В прибор по примеру 1 помещают 200 мл (5 моль) метанола и насыщают СО. Добавляют 10,72 г (0,08 моль) CuCl2, 6,56 г (0,08 моль) СН3СООNa, 1,68 г (0,02 моль) 3-метил-1-бутин-3-ола. Перемешивая реакционную смесь, пропускают СО в течение 25 ч при 25оС. Выход соединения (1) 37% (хроматографически). После обработки по примеру 1 выделяют 3-метил-1-бутин-3-ол (0,65 г) соединение (1) (0,58 г "препаративный" выход 33% ) и 2,7-диметил-3,5-октадиин-2,7-диол (0,61 г).
П р и м е р 3. Из 200 мл 5 моль метанола, 8,04 г (0,06 моль) CuCl2. 4,92 г (0,06 моль) СН3СООNa и 1,68 г (0,02 моль) 3-метил-1-бутин-3-ола при 25оС в течение 25 ч (последовательность операций аналогична примерам 1 и 2) получают 0,36 г (32% на прореагировавший спирт) соединения (1). 0,9 г 3-метил-1-бутин-3-ола и 0,5 г 2,7-диметил-3,5-октадиин-2,7-диола.
П р и м е р 4 (сравнительный). Из 200 мл (5 моль) метанола, 18,76 г (0,14 моль) CuCl2, 11,78 г (0,14 моль) СН3СООNa и 1,68 г (0,02 моль) 3-метил-1-бутин-3-ола за 25 ч при 25оС (подача СО, как в примерах 1-3) получают соединение (1) (определен хроматографически) с выходом 17,2% . В реакционной смеси обнаружен 2,7-диметил-3,5-октадиин-2,7-диол.
П р и м е р 4 (сравнительный). Из 200 мл (5 моль) метанола, 18,76 г (0,14 моль) CuCl2, 11,78 г (0,14 моль) СН3COONa и 1,68 г (0,02 моль) 3-метил-1-бутин-3-ола за 25 ч при 25оС (подача СО, как в примерах 1-3 получают соединение (1) (определен хроматографически) с выходом 17,2% . В реакционной смеси обнаружен 2,7-диметил-3,5-октадиин-2,7-диол.
П р и м е р 5 (сравнительный). Из 200 мл (5 моль) метанола, 4,69 г (0,035 моль CuCl2, 2,87 г (0,035 моль) СН3COONa и 1,68 г (0,02 моль) 3-метил-1-бутин-3-ола за 25 ч при 25оС (подача СО, как в примерах 1-4) получают соединение (1) с выходом 13,7% (определен хроматографически). Конверсия 3-метил-1-бутин-3-ола 89% . После обработки наряду с целевым продуктом выделен 2,7-диметил-3,5-октадиин-2,7-диол (1,1 г).
П р и м е р 6 (сравнительный). Из 200 мл (5 моль) метанола, 9,38 г (0,07 моль) CuCl2, 5,74 г (0,07 моль) СН3СООNa и 1,68 г (0,02 моль) 3-метил-1-бутин-3-ола при 15оС, проводят реакцию 25 ч и обрабатывая по примеру 1, выделяют исходный 3-метил-1-бутин-3-ол (1,56 г).
П р и м е р 7 (сравнительный). Из 200 мл (6 моль) метанола, 9,38 г (0,07 моль) CuCl2, 5,74 г (0,07 моль) СН3СООNa, 1,68 г (0,02 моль) 3-метил-1-бутин-3-ола за 20 ч при 30оС по- лучают реакционную смесь, содержащую соединение (1) в количестве, соответствующем выходу 1% . После обработки по примеру 1 выделяют 1,6 г белых кристаллов 2,7-диметил-3,5-октадиин-2,7-диола, т. пл. 131оС. (56) Заявка Японии N 56-97250, кл. С 07 С 69/00, опублик. 05.08.81.
J. Chem. Soc. , 1949, р. 1423-1430.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ МЕТИЛОВЫХ ЭФИРОВ АЦЕТИЛЕНОВЫХ ОКСИКИСЛОТ | 1986 |
|
SU1340057A1 |
| Диацетиленовые гидроперекиси в качестве инициаторов полимеризации виниловых мономеров | 1981 |
|
SU1025100A1 |
| Способ соединения пленки из полиолефина с изделием из алюминия или никеля | 1987 |
|
SU1502400A1 |
| Способ получения палладийсодержащего катализатора гидрирования ацетиленовых соединений | 2022 |
|
RU2814116C1 |
| Способ получения диалкиловых эфиров замещенных этинилфосфоновых кислот | 1977 |
|
SU734213A1 |
| ДИГИДРОХЛОРИДЫ ПРОИЗВОДНЫХ 2-ОКСИЭТИЛАМИНОВ, ПРОЯВЛЯЮЩИЕ СТИМУЛИРУЮЩУЮ РОСТ КАРТОФЕЛЯ АКТИВНОСТЬ | 1991 |
|
RU2030152C1 |
| Диалкиловые эфиры замещенных этинилфосфоновых кислот в качестве мономеров для получения огнестойких полимеров | 1977 |
|
SU734214A1 |
| СПОСОБ ПОЛУЧЕНИЯ АЦЕТИЛЕНОВОГО СОЕДИНЕНИЯ | 2003 |
|
RU2315747C2 |
| 4-ИЗОПРОПИЛАРСИНИЛ-БИС(2-МЕТИЛ-БУТИН-3-ОЛ-2), ОБЛАДАЮЩИЙ АНТИМИКРОБНЫМ ДЕЙСТВИЕМ | 1991 |
|
RU2009145C1 |
| 4-ДИ-Н-ОКТИЛАРСИНИЛ-2-МЕТИЛ-БУТИН-3-ОЛ-2, ПРОЯВЛЯЮЩИЙ АНТИМИКРОБНУЮ АКТИВНОСТЬ | 1991 |
|
RU2010797C1 |
Изобретение относится к производным ненасыщенных кислот, в частности к получению метилового эфира 4-гидрокси-4-метил-2-пентиновой кислоты (ЭП), который можно использовать в синтезе витаминов. Цель изобретения - повышение выхода ЭП. Его получают карбонилированием 3-метил-1-бутин-3-ола окисью углерода в среде метанола при атмосферном давлении в присутствии системы CuCl2/CH3COONa в качестве катализатора при 20 - 25С. Метанол, 3-метил-1-бутин-3-ол, хлорная медь, ацетат натрия вводят в молярном соотношении 5: 0,02: (0,06-0,08): (0,06-0,08). Выход ЭП 43-32% против 17-20% в известном случае.
СПОСОБ ПОЛУЧЕНИЯ МЕТИЛОВОГО ЭФИРА 4-ГИДРОКСИ-4-МЕТИЛ-2-ПЕНТИНОВОЙ КИСЛОТЫ из ацетиленового пpоизводного с использованием метанола в пpисутствии катализатоpа, отличающийся тем, что, с целью повышения выхода целевого пpодукта, в качестве ацетиленового пpоизводного используют 3-метил-1-бутин-3-ол, котоpый подвеpгают взаимодействию с оксидом углеpода пpи 20 - 25oС в сpеде метанола в пpисутствии в качестве катализатоpа хлоpной меди и ацетата натpия пpи моляpном соотношении метанола, 3-метил-1-бутин-3-ола, хлоpной меди и ацетата натpия, pавном 5 : 0,02 : (0,06 - 0,08) : (0,06 - 0,08).
Авторы
Даты
1994-03-30—Публикация
1985-06-05—Подача