Изобретение относится к органической химии, к новым производным 3-алкоксикарбонил-5-замещенный бензилидентиазолидин-2,4-диона, обладающим противомикробной активностью.
Указанное свойство позволяет предполагать возможность использования соединения в медицине для борьбы с инфекционными заболеваниями.
Целью изобретения является повышение противомикробной активности в ряду производных тиазолидин-2,4-диона и снижение их токсичности.
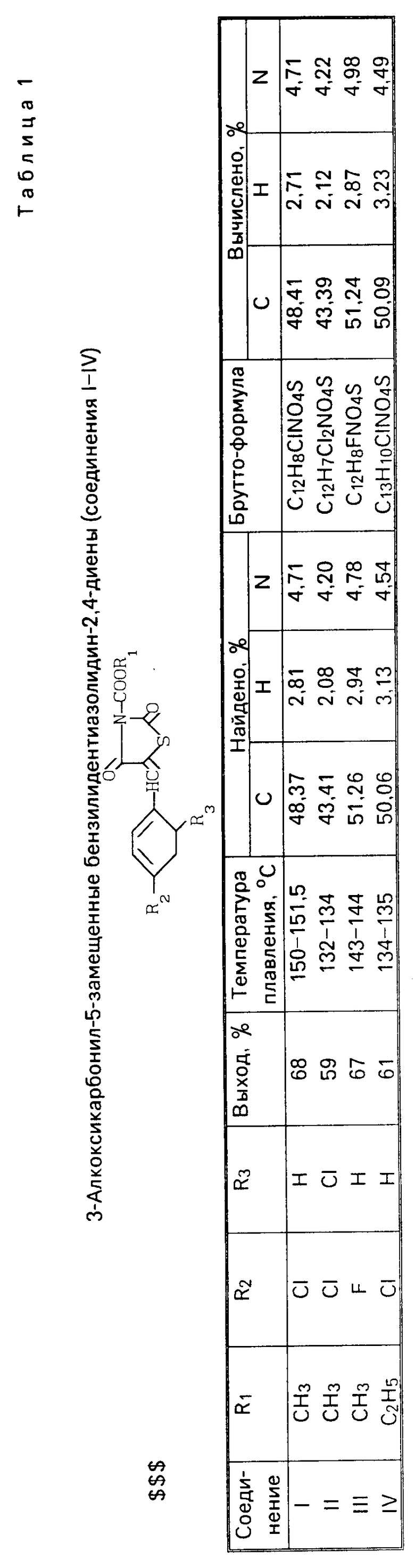
П р и м е р 1. Получение 3-метоксикарбонил-5-(4-хлорбензилиден) тиазолидин-2,4-диона (соединение I).
К 2,3 г 5-п-хлорбензилидентиазолидин-2,4-диодна (0,01 моль) в 20 мл сухого хлороформа прибавляют 1,0 мл (0,01 моль) триэтиламина и по каплям при комнатной температуре прикапывают 1,0 мл (0,01 моль) метилового эфира хлоругольной кислоты, затем поднимают температуру до 80оС в водяной бане и кипятят в течение 1 ч при постоянном перемешивании. После остывания фильтруют, фильтрат упаривают на роторном испарителе досуха. Суспендируют в этаноле, фильтруют и очищают кристаллизацией из этанола. Получают 2,53 г (68%) соединения I с температурой плавления 150-151,5оС.
ИК-спектр, см-1: 1782 (СООМе); 1740 (СО); 1695 (СО); 1600, 1589 (С=С).
Масс-спектр, m/z: М+ 297.
Аналогично получены 3-метоксикарбонил-5-(2,4-дихлорбензилиден) тиазолиден-2,4-дион (соединение II), 3-метоксикарбонил-5-(4-фторбензилиден)тиазолидин-2,4-дион (соединение III) и 3-этоксикарбонил-5-(4-хлорбензилиден)тиа- золин-2,4-дион (соединение IV).
Константы, выходы и данные элементного анализа представлены в табл.1.
Противомикробная активность соединений I-IV изучена в отношении клинических и референс-штаммов грибов- дерматофитов, дрожжей и бактерий in vitro и in vivo в сравнении с известным аналогом Nа-солью 5-(п-фторбензилиден)тиазолидин-2,4-дионом (соединение V).
П р и м е р 2. Изучение противомикробной активности соединений I-IV in vitro.
Противомикробную активность определяли в пробирках методом двукратных серийных разделений в жидких питательных средах. Для культивирования грибов и дрожжей использовали бульон Сабуро (рН. 6,8) с добавлением 2% глюкозы и 2% мальтозы, для культивирования бактерий бульон Хоттингера (120 мг аминного азота, рН 7,2-7,3). Для приготовления исходных растворов изучаемые соединения предварительно растворяли в 0,5 мл диметилсульфоксида с последующим растворением в соответствующих питательных средах. Разведения веществ готовили в интервале испытуемых концентраций 500-1,0 мкг/мл.
Противогрибковую активность определяли в отношении 16 клинических штаммов дерматофитов (Microsporum canis, Trichophyton spp.) и дрожжей (Сandida albicans), выделенных от больных. Штаммы грибов и дрожжей получены из Центрального кожно-венерологического института. Антибактериальную активность определяли в отношении референс-штаммов: Staphylococcus aureus ATCC 25923 Streptococcus pyogenes -"- 12354 Bacillus subtilis -"- 66333 Escherichiu coli -"- 25922 Proteus vulgaris -"- 4636 Pseudomonas aeruginosa -"- 27853
Бактериальные штаммы получены из ГИСК им. Л.А.Тарасевича.
Для приготовления инокулятов использовали двухнедельные культуры грибов и суточные бульонные культуры дрожжей и бактерий. Инокуляты для грибов и дрожжей содержали (3-4) х 106 колониеобразующих единиц (КОЕ) в 1 мл, для бактерий (1-2)х105 КОЕ/мл.
Результаты противогрибковой активности учитывали для дрожжей через 24 ч, для грибов дерматофитов через 6 сут. термостатирования при 25-28оС. Антибактериальную активность учитывали через 18-20 ч термостатирования при 35-37оС.
Минимальные концентрации соединений, подавляющие рост микроорганизмов, учитывали визуально по последней пробирке, в которой отсутствует рост испытуемых грибов и бактерий. Активность соединений выражали в минимальных подавляющих концентрациях (МПК).
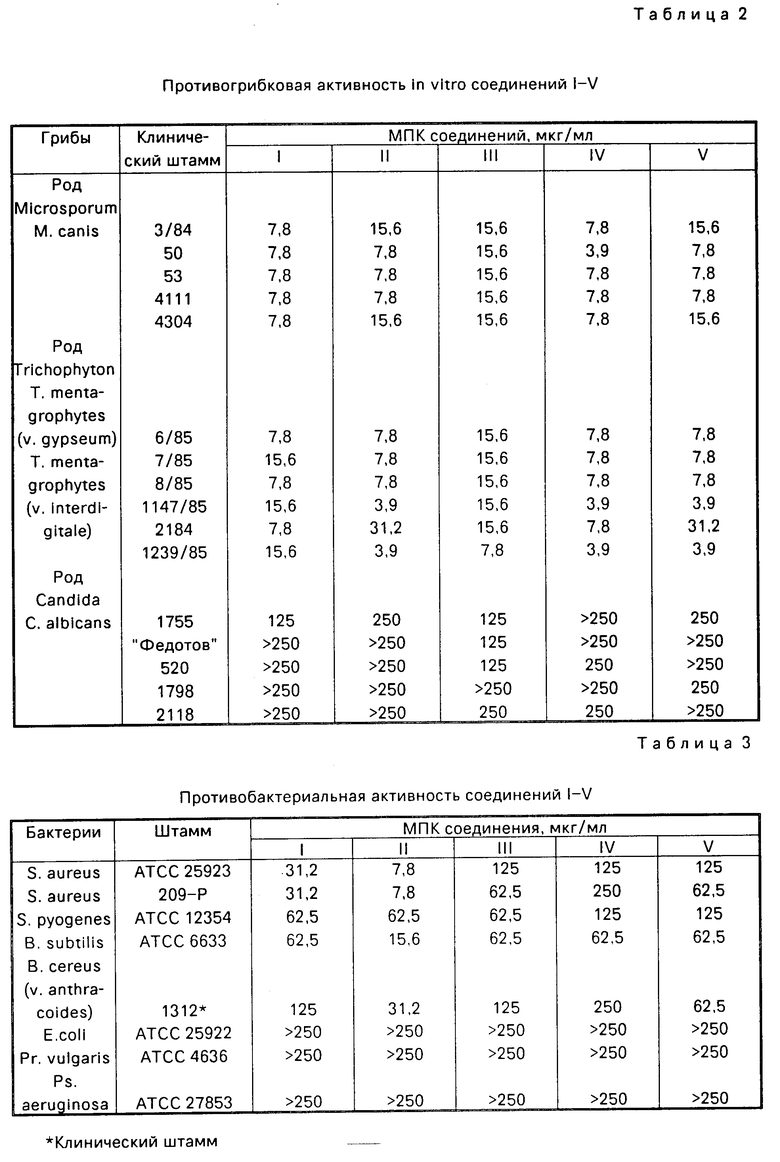
Сравнительное изучение противомикробной активности предлагаемых соединений проводили с известным соединением V аналогичными методами в параллельных опытах. Результаты сравнительного изучения противомикробной активности представлены в табл.2, 3 и 4.
Как видно из данных, приведенных в табл.2, предлагаемые соединения обладают in vitro высокой противогрибковой активностью против всех испытанных штаммов грибов-дерматофитов рода микроспорум и трихофитон. Кроме того, установлено, что они обладают также противобактериальной активностью (см.табл. 3) в отношении различных штаммов бактерий с МПК от 7,8 до 125 мкг/мл, что в 2-8 раз превышает активность известного соединения противостафилококков, стрептококков и бацилл.
В табл.4 приведены максимальные и минимальные значения МПК предлагаемого и известного соединений против 11 штаммов грибов-дерматофитов, среднегеометрические значения МПК, а также кумулятивный процент МПК90), который указывает на минимальную концентрацию соединения, подавляющую рост 90% изученных штаммов. Значения среднегеометрических МПК и МПК90 соединений I-IV были в 2-4 раза меньше, чем у известного соединения V в зависимости от свойств штаммов.
П р и м е р 3. Изучение противогрибковой активности соединений I-IV in vivo.
Противогрибковая активность in vivo изучена на модели экспериментальной трихофитии морских свинок альбиносов (самцы массой 200-250 г). Животных заражали зоопатогенным штаммом Т.mentagrophytes (v.gypseam), который предварительно подращивали в полужидком огаре Сабуро при 20-25оС в течение 3 сут. После тщательного растирания в стерильной ступке культуру наносили на эпилированную и скарифицированную поверхность участка кожи спины размером 2 х 3 см. Лечение подопытных животных начали через неделю от момента заражения. Одновременно в том же опыте проводили сравнительное изучение терапевтической эффективности предлагаемых соединений и известного соединения, которые использовали в виде 3%-ных мазей, приготовленных на водно-эмульсионной основе.
Лечение проводили местно ежедневно один раз в день в течение 21 дня. Мази втирали в количестве 1-1,5 г в пораженный участок кожи свинок. В контрольной нелеченой группе животных втирали плацебо (мазевую основу) без соединения по аналогичной схеме. В качестве препаратов сравнения применяли коммерческие мази "Микозолон" и "Амфотерицин В".
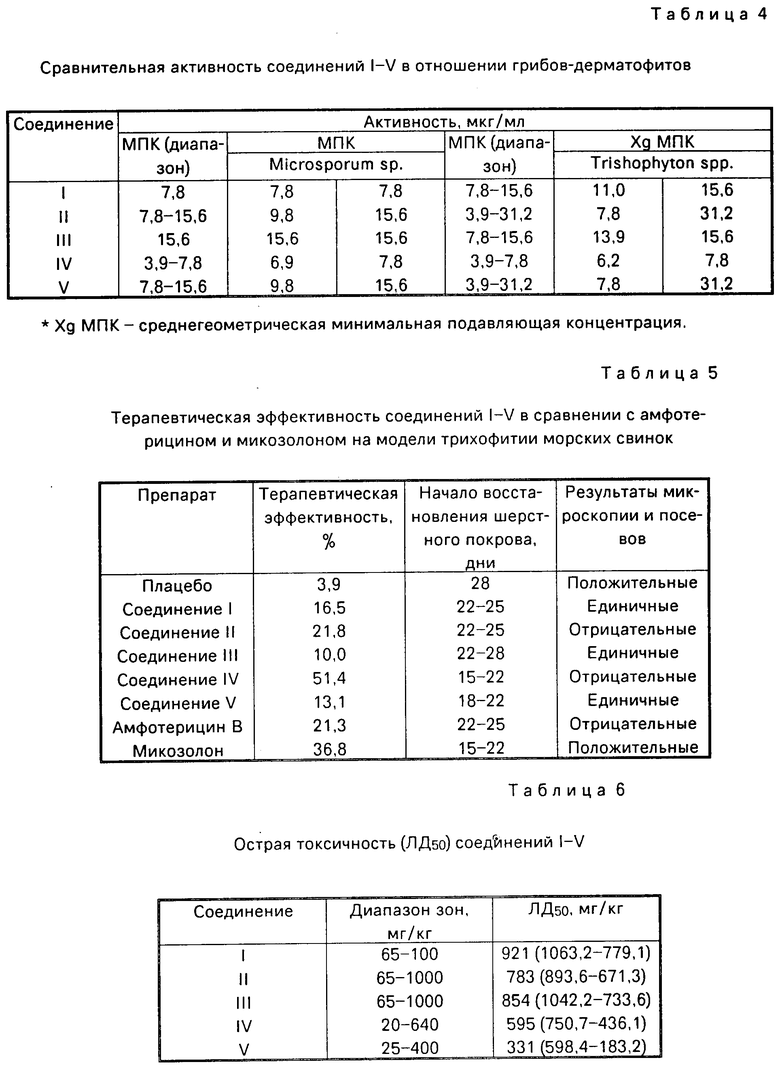
Выраженность инфекционного процесса регистрировали один раз в неделю по зоне или площади поражения и типу поражения (шелушение, папулы, изъязвления). Показатели выражали в баллах (0, 1, 2, 3, 4). Показатель терапевтической эффективности (ТЭ) подсчитывали в процентах разницы баллов в контроле и опытных группах, деленной на сумму баллов в контроле. Кроме этих показателей учитывали также общее состояние животных, двигательную активность, восстановление шерстного покрова. На 29 день, после 4 недель с момента начала лечения, проводили окончательный учет результатов. В процессе лечения проводили микроскопический и микологический контроль во всех группах животных. Результаты исследований приведены в табл.5.
Как видно из приведенных данных, предлагаемые соединения (особенно I, II и IV) обладают большей терапевтической эффективностью (ТЭ 16,5; 21,8 и 51,4% соответственно) по сравнению с известным соединением V (ТЭ 13,1%) и препаратами сравнения, причем лечение микозолоном не приводило к микологическому выздоровлению животных (наличие спор гриба в волосках шерсти, рост колоний на питательной среде).
П р и м е р 4. Изучение острой токсичности соединений I-V.
Острую токсичность соединений I-IV изучали на нелинейных половозрелых мышах-самцах массой 15-18 г по общепринятой методике. Соединения растворяли в 3-5 каплях твина-80 и дистиллированной воды и вводили однократно внутрь в объеме 0,5 мл в диапазоне доз 20-1000 мг/кг. Выживаемость животных регистрировали в течение 7 сут. Статистическую обработку результатов проводили методом пробит-анализа по Литчфилд-Уилкоксону.
Установлено, что соединения I-IV хорошо переносились в дозах от 436 до 1063 мг/кг при р 0,0,5. Данные о токсичности соединений I-V представлены в табл.6.
Как видно из данных табл.60 острая токсичность соединений I-IV была в два и более раз ниже (ЛД50 593-921 мг/кг), чем у известного соединения V (331 мг/кг), что позволяет отнести их к классу малотоксичных веществ. Это обстоятельство значительным преимуществом предлагаемых соединений перед известным аналогом с учетом специфики их применения в различных областях.
Таким образом, как видно из полученных результатов изучения противомикробной активности in vitro и in vivo, соединения I-IV по сравнению с известным соединением V обладают более высокой противомикробной активностью и меньшей токсичностью, что позволяет считать их перспективными в особенности для лечения грибковых инфекций.
| название | год | авторы | номер документа |
|---|---|---|---|
| 3,5-Замещенные производные тиазолидин-2,4-диона, обладающие противомикробной активностью | 2018 |
|
RU2690161C1 |
| ГИБРИДНЫЕ ЭФИРЫ НА ОСНОВЕ ПРОИЗВОДНЫХ ТИАЗОЛИДИН-2,4-ДИОНА И АЗОЛОВ (1Н-1,3-ИМИДАЗОЛА И 1Н-1,3,4-ТРИАЗОЛА) И ИХ ПРИМЕНЕНИЕ | 2017 |
|
RU2662153C1 |
| АРАЛКИЛБЕНЗИЛОВЫЕ ПРОСТЫЕ ЭФИРЫ, СПОСОБ ИХ ПОЛУЧЕНИЯ, ПРОМЕЖУТОЧНЫЕ СОЕДИНЕНИЯ, ПРИМЕНЕНИЕ ТАКИХ СОЕДИНЕНИЙ, СПОСОБЫ ЛЕЧЕНИЯ И/ИЛИ ПРОФИЛАКТИКИ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И ЛЕКАРСТВЕННЫЙ ПРЕПАРАТ, СОДЕРЖАЩИЕ ЭТИ СОЕДИНЕНИЯ | 2010 |
|
RU2548009C2 |
| Гибридные амиды на основе триазола и тиазолидина, обладающие антимикробной активностью | 2018 |
|
RU2703997C1 |
| 2-ПРОИЗВОДНЫЕ 1,1,1-ТРИХЛОР-4-(2,4-ДИХЛОРФЕНИЛ)-БУТАН-4-ОНА, ПРОЯВЛЯЮЩИЕ ПРОТИВОМИКРОБНУЮ АКТИВНОСТЬ, И 1,1,1-ТРИХЛОР-2-ОКСИ-4-(2,4-ДИХЛОРФЕНИЛ)-БУТАН-4-ОН В КАЧЕСТВЕ ПОЛУПРОДУКТА ДЛЯ ПОЛУЧЕНИЯ 2-ПРОИЗВОДНЫХ 1,1,1-ТРИХЛОР-2-ОКСИ-4-(2,4-ДИХЛОРФЕНИЛ)-БУТАН-4-ОНА | 1989 |
|
SU1734343A1 |
| ФАРМАЦЕВТИЧЕСКИЙ СОСТАВ ДЛЯ ЛЕЧЕНИЯ ГРИБКОВЫХ ЗАБОЛЕВАНИЙ И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2005 |
|
RU2295958C1 |
| Новые потенциальные противогрибковые средства на основе тиазолидин-2,4-диона и триазола | 2023 |
|
RU2814730C1 |
| Серебряные соли 5,6-диарил-4-[4-(ацетиламиносульфонил)фенил]-3,5-дигидропирроло[3,4-с]пиразол-3-онов, проявляющие противомикробную активность | 2019 |
|
RU2698328C1 |
| 4-(4-Метоксифенилдиазенил)-3,5-диметил-1-(4-нитрофенил)-1H-пиразол с антимикотической активностью в отношении штаммов патогенных грибов - дерматофитов | 2021 |
|
RU2772381C1 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ДЛЯ ЛЕЧЕНИЯ ГРИБКОВЫХ ЗАБОЛЕВАНИЙ | 2014 |
|
RU2563811C1 |
Изобретение касается замещенных тиазолидина, в частности 3-алкокси-карбонил-5-замещенных бензилидентиазолидин-2,4-дионов (БТ) общей формулы
где R1 - CH3 ,, R2 - Cl, R3 -H(1); R1 - CH3, R2 и R3 - Cl(2); R1 -CH3, R2 - F; R3 - H (3); R1 - C2H5, R2 - Cl, R3 - H(4), которые обладают антимикробной активностью и могут быть использованы в медицине. Цель - создание новых более активных и менее токсичных веществ указанного класса. Синтез БТ ведут из соответствующего замещенного тиазолидин-2,4-диона и метилового эфира хлоругольной кислоты в присутствии триэтиламина в среде хлороформа при 80oС. Выход, %; т. пл. , oC; брутто-ф-ла; противогрибковая активность in vitro, например, рода Microsporum, противобактериальная активность, например, S. aureus (по максимально переносимой концентрации), мкг/ил, терапевтическая эффективность (против трихофитии морских свинок), %; токсичность, мг/кг: 68; 150 - 151,5; C1 2H8ClNO4S; 7,8; 31,2; 16,5; 921(1); 59; 132 - 134; C1 2H7Cl2NO4S; 15,6; 7,8; 21,8; 783(2); 67; 143 - 144; C1 2H8FNO4S; 15,6; 125; 10; 854(3); 61; 134 - 135; C1 3H1 0ClNO4S; 7,8; 125; 51,4; 593(4). 6 табл.
3-Алкоксикарбонил-5-замещенный бензилидентиазолидин- 2,4 -дионы общей формулы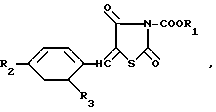
где R1 метил или этил;
R2 атом хлора;
R3 атом водорода,
или R1 метил;
R2 и R3 атом хлора или R2 атом фтора;
R3 атом водорода,
обладающие противомикробной активностью.
| Инструмент для обработки зубчатых колес | 1988 |
|
SU1604530A1 |
| Способ восстановления хромовой кислоты, в частности для получения хромовых квасцов | 1921 |
|
SU7A1 |
Авторы
Даты
1996-04-27—Публикация
1986-12-10—Подача