Изобретение относится к биохимии, а именно к способам определения активности ферментов, и может быть использовано в областях промьшшенности, изготавливающих или применяющих проте- олитические ферменты, а также в научно-исследовательских учреждениях, в медицинской диагностике.
Цель изобретения - расширение технологических возможностей способа и повышение его воспроизводимости.
В качестве субстрата сравнения используют электрофоретичесй чистый бе. лок - ti -казекн с блокированными аминогруппами, которьй расщепляется всеми известными протеазами, а различия скоростей протеодиза отдельных партий зтого белка варьируют в интервале 4-6%, что значительно повышает воспроизводимость способа
Значения активности ферментов, определенные предлагаемым способом, показывают количество гидролизованных пептидных связей в используемом суб- страте сравнения Такие Данные показысл
;о -и
:л
вают практическую ценность протеолити ческих ферментов„
Пример 1 „ Определение протео- литической активности химотрипсина
при помощи модифицированного казеина МКА-1о
В О,1 М фосфатном буфере (рН 7,6) готовят 2%-ньй раствор модифицированного казеина МКА-1, 2%-ный раствор Ы,Н-дикарбамидоэтил- /5 к зеина и раствор кристаллического химотрипсина (концентрация 1 мг/см) Делают пять разведений О,1 М фосфатным-буфером (рН 7,6+0,1) кристаллического химот- .рипсина А (концентрация 0,2 -.-V 1 мг/см) и проводят по пять параллельных опытов гидролиза модифицированного казеина MKA-I с каждой концентрацией химотрипсинао
В пробирки вместимостью 20-25 см наливают по 1 см 2%-ного раствора модифицированного казеина МКА-1 и термостатируют в ультратермостате при 5 миНо Наряду с ними термоста- тируют и ферментный раствор. В каждую пробирку с термостатированным раствором модифицированного казеина МКА-1 добавляют по 1 см термостатированного pacTjBopa фермента, содержи- мое перемешивают и вьщерживают при. 10 мино Через 10 мин пробирки переносят в кипящую водяную баню и выдерживают в ней 2 мино Затем в пробирки с инкубационной смесью добав- ляют по 10 см 0,1М боратного буферного раствора (рН 9,3) и по 1 см- 0,7%-ного раствора 2,4,6-тринитробен- .золсульфокислоты, реакционную смесь энергично взбалтывают и выдерживают при в течение 30 мин, после чего добавляют по 1 см 6М раствора формалина, перемешивают и определяют оптическую плотность на спектрофотометре при длине волны 420 нм про тив контрольной пробы
Контроль ную пробу готовят аналогич но опытному гидролизату, добавляя .вместо 1 см раствора исследуемого фермента 1 см раствора инактивиро- ванного (кипячением в водяной бане 3 мин) фермента. Параллельно тем же способом проводят гидролиз N,N-ди- карбамидоэтил- оСу-казеина одним из ра- створов кристаллического о/-химотрипсина и определяют его активность по формуле
(EM.
(1)
где ПА-- активность протеазы в междунаррдных единицах; D - оптическая плотность; 14 - разведение ферментного раст ора в ходе определения; ГЭ - глициновый зквивалент, определяемый по калибровочному графику; t - время гидролиза субстрата,
мин; m - количество фермента, взятое
на протеолиз, мг;
1000 - переводной коэффициент полученных единиц на 1 г ферментного препарата. По данным параллельного гидролиза модифицированного казеина МКА-1 и N,N-дикapбaмидoзтил-o(s-кaзeинa методом наименьших квадратов находят коэффициенты пересчета (табл. 1) по формуле
ПА 1 ( + KJ,
(2)
где ПА - активность протеазы в международных единицах; D - средняя оптическая плотность параллельных опытов гидролиза модифицированного белкового субстрата;
m - количество ферментного препарата, мг, взятое на анализ при помощи модифицированного белкового субстрата;
К, и К J- коэффициенты пересчета данной партии модифицированного белкового субстрата
Данные по определению коэффициента пересчета для модифицированного ка- зеина МКА-1 приведены в табл. 1. I„
.В 0,1 М фосфатном буфере (рН 7,6) готовят 2%-ньй раствор модифицированного казеина МКА-1 и раствор о; -химотрипсина (концентрация 3 мг/см). Проводят определение активности по описанной методике,.получая D 0,41с Используя значения коэффициентов К и К 2 по формуле (2) вычисляют активность ПА 1.68,01 ME/г.
Пример 2 о Определение протес-, литической активности протосубтилина ГЗх при помощи окрашенного казеина ОКА-АС.
В О,1 М фосфатном буфере (рН 7,2) готовят 0,8%-ный раствор окрашенного казеина ОКА-АС, 2%-ньй раствор N,N- -дикарбамидоэтил-о -казеина и раствор
очищенной нейтральной протеазы из В, Subtilis шт. 65 (0,15 мг/см). Делают пять разведений раствора очищенной нейтральной протеазы (концентрация 0,05 - 0,15 мг/см ) и проводят по пять параллельных опытов протеоли- за с каждой концентрацией фермента следующим образом. .К 5 см- 0,8%-ного раствора окрашенного казеина ОКА-АС, термостатированного при 30,0+0,, добавляют 1 см раствора ферментного препарата, перемешивают и инкубируют при 30,0+0,1 С. Через 10 мин добавля10
держивают в термостате еще 10 мин. Полученную смесь фильтруют через плотный бумажный фильтр (синяя лента) и определяют оптическую плотность фильтрата при 400+0,5 нм против контрольной пробы.
Контрольную пробу приготавливают аналогично опытному гидролизату, добавляя .1 см инактивированного (кипячением на водяной бане 3 мин) ферментного раствора о Получают D 0.415. Иг- пользуя значения К и К этой партии окрашенного казеина ОКА-АС по формуле
от 5 смЗ 0,5 М раствора трихлоруксус- is (2) вычисляют активность ,1 МЕ/г. ной кислоты, перемешивают и выдержива-П р и м е р 3. Определение протеоют в термостате еще 10 мин. Полученную смесь фильтруют через плотный бумажный фильтр (синяя лента) и определяют оптическую плотность фильтрата при Л 400tO,5 нм против контрольной пробыо
Контрольную пробу готовят аналогично опытному гидролизату, добавляя 1 см инактивированного (кипячением на водяной бане 2-3 мин) ферментного раствора.
Параллельно проводят гидролиз субПримерлитической активности щелочной протеазы в моющем средстве Биомаг при помощи окрашенного казеина ОАК-АС. 20 В О,1М карбокатном-бикарбонатном буфере (рН 10,5) готовят 0,4%-ньш раствор окрашенного казеина ОКА-АС, 1%-ный раствор К,К-дикарбамидозтил- - 0/5 казеина, раствор очищенной щелочной протеазы из В.Subtilis шт. 72
25
,-3
(концентрация 2,0-10 мг/см ). Делают пять разведений раствора очищенной щелочной протеазы (концентрация О, 510 - 2 10-- мг/см) и проводят по пять па-.
страта сравнения дикарбамидоэтил-о - -казеина при помощи очищенной нейтральной протеазы из В.subtil is шт.65 по методике примера 1 и по формуле (1) вычисляют активность в международных единицах.
По данным параллельного гидролиза очищенной нейтральной протеазой окрашенного казеина ОКА-АС и М,Ы-дикар- бамидоэтил-о -казеина (табл. 2) при помоищ уравнения (2) методом наименьших квадратов находят коэффициенты пересчета К и К для данной партии окрашенного казеина ОКА-АС;
Данные определения коэффициента пересчета для окрашенного казеина ОКА-АС приведены в табл. 2.
В 0,Ш фосфатном буфере (рН 7,2) готовят 0,8%-ный раствор окр аш,енного казеина ОКА-АС и раствор исследуемого ферментного препарата протосубтилина ГЗх (концентрация 8 мг/см). Далее проводят гидролиз окрашенного казеина ОКА-АС описанным образом, ТоВ. к 5 см- 0,8%-ного раствора окрашенного казеина ОКА-АС, термостатированного при , добавляют 1 см ферментного раствора, перемешивают и инкубируют при . Через 10 мин добавляют 5 см 0,5М раствора трихлор- уксусной кислоты, перемешивают и вы
держивают в термостате еще 10 мин. Полученную смесь фильтруют через плотный бумажный фильтр (синяя лента) и определяют оптическую плотность фильтрата при 400+0,5 нм против контрольной пробы.
Контрольную пробу приготавливают аналогично опытному гидролизату, добавляя .1 см инактивированного (кипячением на водяной бане 3 мин) ферментного раствора о Получают D 0.415. Иг- пользуя значения К и К этой партии окрашенного казеина ОКА-АС по формуле
(2) вычисляют активность ,1 МЕ/г. П р и м е р 3. Определение протео(2) вычисляют активность ,1 МЕ/г. П р и м е р 3. Определение протеоПримерлитической активности щелочной протеазы в моющем средстве Биомаг при помощи окрашенного казеина ОАК-АС. В О,1М карбокатном-бикарбонатном буфере (рН 10,5) готовят 0,4%-ньш раствор окрашенного казеина ОКА-АС, 1%-ный раствор К,К-дикарбамидозтил- - 0/5 казеина, раствор очищенной щелочной протеазы из В.Subtilis шт. 72
,-3
5
0
(концентрация 2,0-10 мг/см ). Делают пять разведений раствора очищенной щелочной протеазы (концентрация О, 510 - 2 10-- мг/см) и проводят по пять па-.
0 раллельных опьп-ов протеолиза-с каждой концентрацией фермента следующим образом. К 5 см 0,4%-ного раствора окрашенного казеина ОК.-АС, термостатированного при , добавляют 2 см ферментного раствора, переменашают и инкубируют при 40 Со Через 45 мин добавляют 5 см 1,2М раствора трихлор- уксусной кислоты, перемешивают и выдерживают в термостате еще 10 мин. Полученную смесь фильтруют через плотный бумажный фильтр (синяя лента) и определяют оптическую плотность фильтрата при / 400 нм против контрольной пробыо
5 Контрольную пробу готовят аналогично опытному гидролизату, добавляя 2 см инактивированного (кипячением на водяной базе 3 мин) ферментногЬ раствора.
0 Параллельно проводят гидролиз субстрата сравнения - N,N-дикapбaмидo- э тил-о(5 казеина при помощи очищенной щелочной протеазы из Б.Subtilis шт.72 В пробирки вместимостью 20-25 см на5 ливают по 1 см 1%-ного раствора
N,N-дикapбaмидoэтил-о -казеина и тер- мостатируют в ультратермостате при 40 С 5 мин. Наряду с ними термостатируют и ферментньй раствор. В каждую
1
пробирку с термостатированным раство
ром Н,Ы-дикарбамидоэтил-о(5-казеина добавляют по 1 -см термостатированного раствора фермента, содержимое перемешивают, вьщерживают при 10 мин. Через 10 мин пробирки переносят в кипяченую водяную бани и выдерживают в ней 2 мин. Затем в пробирки с инкуба1щонной смесью добавляют по 10 см 0,1М боратного буферного расвора (рН 9,3) и по 1 смЗ 0,7%-ного раствора 2,4,6-тринитробензолсульфо- кислоты, реакционную смесь энергично взбалтывают и вьщерживают при 30 мин, после чего добавляют по 1 см 6м формагшна, перемешивают и определяют оптическую плотность колоримет- рированием ни спектрофотометре при длине волны А - 420 нм против контрольной пробы.
Контрольную пробу готовят аналогино -опытному гидролизату, добавляя 1 см инактивированного кипячением на водяной бане 2-3 мин ферментного раствора.
Активность вычисляют по формуле
(Оо
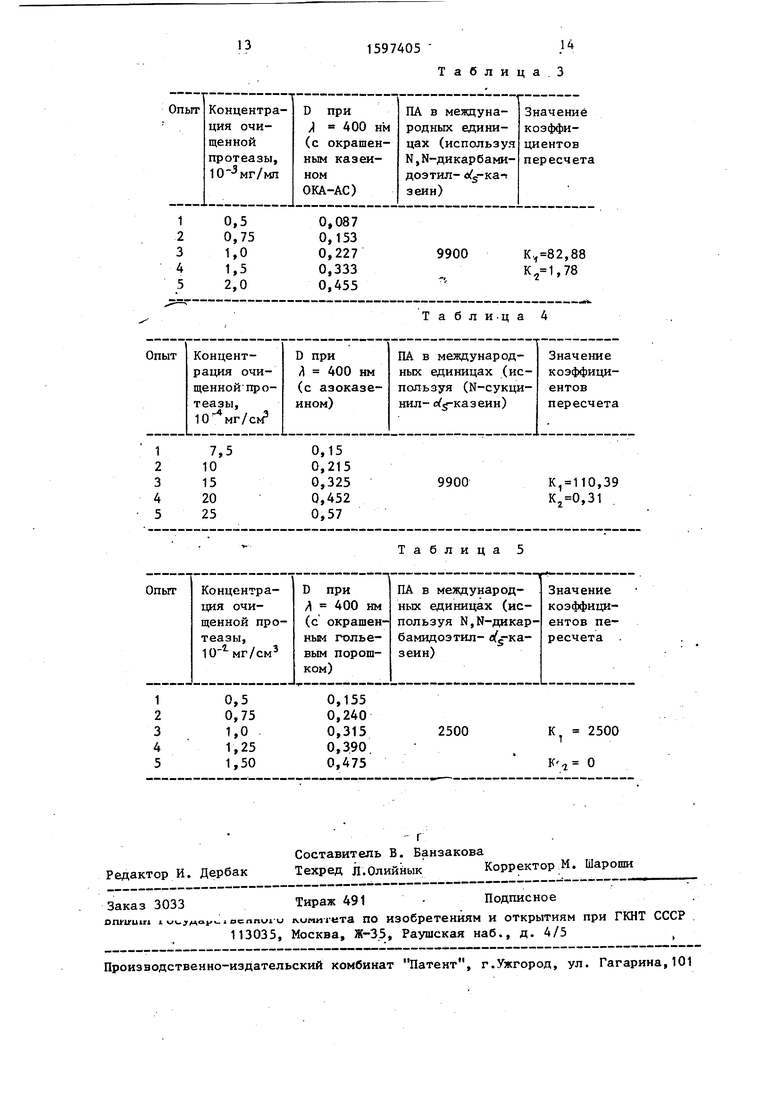
По данным параллельного гидролиза очищенной щелочной протеазой из В. Subtilis шт. 72 окрашенного казеина ОКЛ-АС и Ы,Ы-дикарбамидоэтил-о д- -казеина (табЛо 3) при помощи уравнения (2) методом наименьших квадратов находят коэффшщенты пересчета К. :и К 1 для данной партии окрашенного казеина ОКА-АС„
Данные опр еделения коэффициента пересчета для окрашенного казеина ОКА-АС приведены в табл„ 3„
В 0,Ш карбонатно-бикарбонатном буфере (рН 10,5) готовят 0,4%-ный.. раствор окрашенного казеина ОКА-СА и раствор исследуемого препарата Би омаг (концентрация 3 мг/мл), Далее проводят гидролиз окрашенного казеин ОКА-АС описанным образом, т.е. к 5 см 0,4%-ного раствора субстрата, термостатированного при , добавлют 2 см раствора Боимаг, перемешивают и инкубируют при Через 45 мин добавляют 5 см 1,2 М раствор трихлоруксусной кислоты, перевешиваю и ньщерживают в термостате ещё 10 мин Полученнзтю смесь фильтруют через плотный.бумажный фильтр (синяя лента и определяют оптическую плотность фильтрата при Л 400 нм против конрольной пробыо
8
0
5
0
5
0
05
5
0
5
Контрольную пробу готовят аналогично опытному гидролизату, добавляя 2 см инактивированного (кипячением на водяной бане 3 мин), раствора Био- маг. Получают D 0,320 Используя значения коэффициентов К;, и К,-г по формуле (2) вычисляют активность ПА 4,72 НЕ/Г.
. I р и м е р 4. Определение протео- литической активности протосубтилина ПОх при помощи азоказеинао
В О,1М карбонатно-бикарбонатном буфере (рН 10,5) готовят 0,3%-ный раствор азоказеина, 1%-ньш раствор Нсукцинил-о(з-казеина и раствор очищенной щелочной протеазы из В.Subtilis што 72 (концентрация 2,5-Ю мг/см-. Делают пять разведений раствора очищенной щелочной протеазы (концентрация 0,00075-0,0025 мг/см) и проводят по пять параллельных опытов протеоли- за с каждой концентрацией фермента следующим образом К 5 см Oj3%-Horo раствора азоказеина, термостатированного при 40 С, добавляют 2 см ферментного раствора, перемешивают и инкубируют при 40°Со Через 45 мин добавляют 5 см 1,2М раствора трихлоруксусной кислоты, перемешивают и выдерживают в термостате еще 10 мин„ Полученную смесь фильтруют через плотньтй бумажньй фильтр (синяя лента) и определяют оптическую плотность фильтрата при А 400 нм против контрольной пробы. Контрольную пробу готовят ана- логично опытному гидролизату, добавляют 2 см инактивированного кипячением на водяной бане 3 мин ферментного раствора о
Параллельно проводят гидролиз субстрата сравнения - -сукцинил-o j,- -казеина при помощи одного из растворов .очищенной протеазы из В.Subtilis шт. 72 по методу примера 3 и по формуле (1) вычисляют активность в между- : народных единицах
По данным параллельного гидролиза очищенной щелочной протеазой из В.Subtilis шТо 72 азоказеина и N-сук- цинил-о(,5-казеина (табл„ 4), используя уравнение (2), методом наименьших квадратов находят коэффициенты пере- счета К., и К для данной партии азоказеина. ,.
Данные определения коэффициентов пересчета для азоказеина приведены в табл„ 4 о
915
В О,Ш карбонатно-бикарбонатном буфере (рН 10,5) готовят 0,4%-ный раствор азоказеина и раствор прото- субтилина Г10Х (концентрация 0,03 мг/см)„ Далее проводят гидролиз азрказеина описанным образом, т,е« к 5 см 0,3%-ного раствора субстрата, термостатированного при , добавляют 2 СМ раствора протосубтилина Г10х и инкубируют при . Через 45 мин добавляют 5 см 1,2М раствора трихлогзгксусной кислоты, перемешивают и вьдерживают в термостате еще 10 мин
Полученную смесь фильтруют через плот- единицах.
Параллельно проводят гидролиз субстрата сравнения - НдЫ-диметил-«/ -казеина при помощи очищенной нейтральной протеазы из В,Subtil is шт. 65 по методике примера 1 и по формуле (1) вычисляют активность в международных
По данным параллельного гидролиза очищенной нейтральной протеазой окра- шенного гольевого порошка ОГП-0 и Н,М-диметил-«/5 казеина (табл. 5) при
ньй бумажный фильтр (синяя лента) и определяют оптическую плотность фермента при А 400 км против контрольной про.бы. Контрольную пробу готовят аналогично опытному гидролизату, 20 помощи уравнения (2) методом наимень- добавляя 2 см инактивированного кипячением на водяной бане 3 мин.,ферментного раствора Получают D 0,415. Используя значения коэффициентов К
ших квадратов находят коэффициенты пересчета К и К, для данной партии окрашенного гольевого порошка ОГП-0. Данные по опре,ц&пению коэффициента
ших квадратов находят коэффициенты пересчета К и К, для данной партии окрашенного гольевого порошка ОГП-0. Данные по опре,ц&пению коэффициент
и К по формуле (2) вычисляют актив- 25 пересчета для окрашенного гольевого
ность ПА 3075 МЕ/г.
II р и м е р 5. Определение протео- литической активности протосубтилина ГЗх при помощи окрашенного гольевого порошка
В 0,1 М фосфатном буфере (рН 7,2) готовят 2%-ный раствор Ы,Н-диметил- - У -казеина и раствор очищенной нейтральной протеазы из B,Subtilis шт,65 (концентрация 3 -Ю- мг/см), а в-ic
О,1М фосфатном буфере (рН 6,0) -. раствор очищенной нейтральней протеазы из В. Subtilis шт. 65 (концентрахщя 1,5-10- мг/смЗ),
порошка ОГП-О приведены в табл. 5.
В О,1М фосфатном буфере (рН 6,0) готовят раствор исследуемого препара 30 та протосубтилина ГЗх (концентрация 2 мг/см о Далее проводят гидролиз окрашенного гольевого порошка ОГП-0 описанным образом, т„ео в термостати руемую при кюветуj поставленную на магнитной мешалке, поме1ца)от 200 м субстрата, наливают 5 сн буферного раствора (рН S,0) и термостатируют 5 мин о При перемеамваш .и со скорость 300 обУмин добавляют 2 см раствора
ющим образом.
Делают пять разведений О,1М фосфат-40 протосубтилина ГЗх и выдерживают при ным буфером (рН 6,0) очищенной нейт- . 5 мин. По окончании инкубацион- ральной протеазы и проводят по пять |ного времени реакционную смесь..не}.ед- параллельных опытов гидролиза окра- ленно фильтруют через бумажный фильтр шенного головьевого порошка ОГП-0 с средней плотности. Опредепяют оптичес- каждой концентрацией фермента следу- 45 кую плотность фильтрата при 480 нм
против контрольной пробы.
Контрольную пробу готовят аналогично опытному гидролизату, добавляя вместо 2 см раствора исследуемого 5Q фермента 2 см- раствора инактивированного кипячением на водяной бане 3 мин фермента Получают U 0,37. Используя значения коэффициентов К и К ,j по формуле (2) вычисляют активВ терМОстатируемую при кювету, поставленную на магнитной мешалке, помещают 200 мг субстрата,- наливают 5 см буферного раствора (рН 6,0) и термостатируют 5 мин, При пе- ремеЩивании со скоростью 300 об/мин добавляют 2 см раствора очищенной нейтральной протеазы и вьдерживают
55 ность ПА 231,25 МЕ/г.
при 30 С 5 мино По окончании инкубационного времени реакционную смесь немедленно фильтруют через бумажный фильтр средней плотности Определяют
10
0
единицах.
оптическую плотность фильтрата при И 480-нм против контрольной пробы Контрольную пробу готовят аналогично опытному гидролизату, добавляя вместо 2 см раствора фермента 2 см раствор инактивированного кипяче1даем в водяной бане 3 мин фермента,
Параллельно проводят гидролиз субстрата сравнения - НдЫ-диметил-«/ -казеина при помощи очищенной нейтральной протеазы из В,Subtil is шт. 65 по методике примера 1 и по формуле (1) вычисляют активность в международных
По данным параллельного гидролиза очищенной нейтральной протеазой окра- шенного гольевого порошка ОГП-0 и Н,М-диметил-«/5 казеина (табл. 5) при
помощи уравнения (2) методом наимень-
помощи уравнения (2) методом наимень-
ших квадратов находят коэффициенты пересчета К и К, для данной партии окрашенного гольевого порошка ОГП-0. Данные по опре,ц&пению коэффициента
пересчета для окрашенного гольевого
порошка ОГП-О приведены в табл. 5.
В О,1М фосфатном буфере (рН 6,0) готовят раствор исследуемого препара- та протосубтилина ГЗх (концентрация 2 мг/см о Далее проводят гидролиз окрашенного гольевого порошка ОГП-0 описанным образом, т„ео в термостати- руемую при кюветуj поставленную на магнитной мешалке, поме1ца)от 200 мг субстрата, наливают 5 сн буферного раствора (рН S,0) и термостатируют 5 мин о При перемеамваш .и со скоростью 300 обУмин добавляют 2 см раствора
ность ПА 231,25 МЕ/г.
Формула изобр;е тения
t
1. Способ определения протеолити- ческой активности ферментов в междуна11
родных единицах, включающий- инкубацию исследуемого фермента с рабочим субстратом - модифицированным белком и регистрацию продуктов протеолиза путем определения оптической плотности анализируемой пробы отличающийся тем, что, с целыо расширения технологических возможностей способа и повышения его воспроизводимости, определяют коэффициенты пересчета измерением скоростей параллельного протеолиза стандартного фермента с рабочим субстратом и субстратом сравнения, в качестве которого исполь I - 15
г
зуют 6/5 -казеин .с блокированными ал- килиробанием или ахщлированием аминогруппами.
2.СпосоЬ поп. 1,oтличaю- щ и и с я тем, что в качестве рабочего белкового субстрата используют окрашенный казеин ОКА-АС, азоказе- ин, модифицированный казеин МКА-1, окрашенньй гольевой порошок ОГП-О
3.Способ по п, 1, отлича ю- щ и и с я тем, что в качестве субстрата сравнения используют Н,Ы-ди- карбамидоэтил-о( 5-казеин, NjN-диметил- - ofj-казеин, Ы-сукцинил-с/ -казеин.
Таблица1





| название | год | авторы | номер документа |
|---|---|---|---|
| Способ определения протеолитической активности ферментного препарата | 1981 |
|
SU1027141A1 |
| Способ получения окрашенных суб-CTPATOB для ОпРЕдЕлЕНия пРОТЕОлиТичЕС-КОй АКТиВНОСТи | 1979 |
|
SU810723A1 |
| СПОСОБ ПОЛУЧЕНИЯ ГИДРОЛИЗАТА ИЗ ГОЛЬЕВОГО СПИЛКА ШКУР КРУПНОГО РОГАТОГО СКОТА | 1992 |
|
RU2017431C1 |
| Способ получения препарата иммобилизованной протеазы BACILLUS SUBTILIS | 1977 |
|
SU686377A1 |
| СПОСОБ ПОЛУЧЕНИЯ ГЕТЕРОГЕННОГО ПРЕПАРАТА БРОМЕЛАЙНА, КОВАЛЕНТНО СВЯЗАННОГО С МАТРИЦЕЙ ХИТОЗАНА | 2018 |
|
RU2711786C1 |
| СПОСОБ ПОДГОТОВКИ КОЛЛАГЕНСОДЕРЖАЩЕГО СЫРЬЯ ДЛЯ ПРОИЗВОДСТВА КОЛБАСНОЙ ОБОЛОЧКИ | 1995 |
|
RU2096966C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ АКТИВНОСТИ ПРОТЕИНАЗ | 1973 |
|
SU397843A1 |
| СПОСОБ ПОЛУЧЕНИЯ ГЕТЕРОГЕННОГО ФЕРМЕНТНОГО ПРЕПАРАТА НА ОСНОВЕ ФИЦИНА И НИЗКОМОЛЕКУЛЯРНОГО ХИТОЗАНА | 2021 |
|
RU2769243C1 |
| СПОСОБ ПОЛУЧЕНИЯ ГЕТЕРОГЕННОГО ПРЕПАРАТА НА ОСНОВЕ ПАПАИНА | 2017 |
|
RU2677873C2 |
| СПОСОБ ПОЛУЧЕНИЯ ИММОБИЛИЗОВАННОГО ФЕРМЕНТНОГО ПРЕПАРАТА НА ОСНОВЕ ПАПАИНА, ГИАЛУРОНОВОЙ КИСЛОТЫ И ПОЛИСАХАРИДОВ, МОДИФИЦИРОВАННЫХ ВИНИЛОВЫМИ МОНОМЕРАМИ | 2020 |
|
RU2750378C1 |
Изобретение относится к биохимии, а именно к способам определения активности ферментов, и может быть использовано в отраслях промышленности, изготовляющих или применяющих протеолитические ферменты, а также в научно-исследовательских учреждениях, в медицинской диагностике. С целью расширения технологических возможностей способа и повышения его воспроизводимости в качестве субстрата сравнения используют 98аS-казеин с блокированными алкилированием или ацилированием аминогруппами (N1N-дикарбамидоэтил-αS-ованием аминогруппами (N1N-дикарбамидоэтил-αS- казеин, N1N-диметил-αS-казеин, N-сукцинил-αS-казеин), а в качестве "рабочего" белкового субстрата - модифицированные белки (окрашенный казеин ОКиА-АС, азоказеин, модифицированный казеин МКА-1, окрашенный гольевой порошок).
0,05 0,07 0,10 0,12 0,15
0,150 0,205 0,310 0,355 0,444
Таблица 2
2020,6
К,677,47 ,35
13
1597405 -j
Та блица. 3
| Hennrich N and Brummer W.- LO Bericht | |||
| All-gemeines zur Standardi- sierung und die Aktivitatsbestitnmung von Proteinasen - Pharmo I nd, 1973, V | |||
| Скоропечатный станок для печатания со стеклянных пластинок | 1922 |
|
SU35A1 |
| Экспресс-метод определения протеолитической активности ферментных препаратов о - В сб.: Производство и применение микробных ферментных препаратов„ - Вильнюс, 1985, с | |||
| Способ получения на волокне оливково-зеленой окраски путем образования никелевого лака азокрасителя | 1920 |
|
SU57A1 |
Авторы
Даты
1990-10-07—Публикация
1988-06-29—Подача