Изобретение относится к новым производным оксадиазолилалкилпурина формулы I:
оN-0
H-N-VNsA-Ч 1
oY
СНз
RI
где А - CHj-; .- ;
R t-CHjCHj; -CHjCl; )
PhCHj-; СНз(СН2)з-; CHj (CH ) |5
. а:Нз)гСН-, . .
-СНг -N НС1 ; НС1
Vf
20
СИ,
.ОСНз
QCHj (СН УзСООН; ;
ОН
носе
30
когда А (CHj), где п 1, 2
R, (CjHjNCHj) HCl; или когда А (CHz), где п - 2, 4
R, К(СН2)2НС135
ИЛИ когда А (CHj)., где п 3, 4 R, (C2Hf),N(CH,)2 HCl; или когда А (CHj), где п 1-4
СНз%. 10
проявляющие противокашлевую активность и которые- могут найти применение в медицине при заболевании органов дыхания.
Цель изобретения - изыскание в ря- ду производных оксадиазолилалкилпурина новых соединений, проявляющих более высокую противокашлевую активность.
П р и м е р 1.
а. 35, О f (0,25 моль) 3-метилксан- Q тина растворяют в 81,4 мл (0,25 моль) 10%-ного раствора гидроокиси натрия, кристаллизация происходит в течение нескольких минут. Воду отгоняют при пониженном давлении, а следы воды удаляют азеотропной перегонкой с толуо- лом. Остаток суспендируют в 350 мл диметилформамида,- после чего при 100 С при перемешивании добавляют по каплям
0
5
0
5
30
35
10
.
Q
раствор 19,0 г (0,25 моль) хлорацето- нитрила и 80 мл диметилформамида.. Реакционную смесь перемешивают еще 1 ч при 100 С, фильтруют в горячем состоянии, осадок (хлористый натрий) промывают горячим диметилформамидом и сое- диненные растворы сгущают досуха при пониженном давлении. Остаток растирают с 100 мл ацетона, кристаллы фильтруют и основательно промывают ацетоном-. Полученный таким путем 7-циано- метил-3-метилксантин можно непосредственно перерабатывать дальше, т.пл. 285-287 С.
b.К раствору 3,2 г гидроксиламин- гидрохлорида и 36 мл воды добавляют частями 2,5 г карбоната натрия. К полученному таким путем раствору добавляют 10,0 г 7-цианометил-З-метилксан- тина и 30 мл этанола. Реакционную смесь перемешивают 3 ч при 80 С и затем охлаждают. Осажденный 2-(3-метил- ксантин-7-ил)-ацетамидоксидоксим фильтруют и промывают небольшим количеством холодной воды. Выход 11,0 г (86%); т.пл. вьше 320 С.
Н-ЯМР (DMSO-d): 3,35 (s, ЗН, 3-Ме); 4,85 (s, 2Н, ); 8,08 (s, 1Н, 8-Н); 9,79 (s, 1Н, N-OH); 11,21 (bs, 1Н, 1-NH)..
c.Смесь, образованную из 6,76 г натрия и 290 мл безводного этанола, раствора этилата натрия, 35,0 г 2(3- -метилксантин-7-ил)ацетамидоксима и 43,0 мл этилацетата нагревают до кипения при перемешивании в течение 4 ч. Реакционную смесь фильтруют в горячем состоянии и фильтрат сщугают при пониженном давлении. Остаток растворяют в 200 мл воды. рН раствора устанавливают до 7 при помощи 10%-ной соляной кислоты. Осажденный продукт фильтруют и дважды кристаллизуют из воды. Получают 18,0 г 3,7-дигидро-З-метил- -7- (5-метш1-1,2,4-оксадиазол-З-ил)- -метил -1Н-пурин-2,6-диона, т.пл. 262-264 С.
Н-ЯМР (DMSO-dg): 2,57 (s, ЗН, 5-Ие); 3,37 (s, ЗН, 3-Ме); 5,66 (s, 2Н, -CHj); 8,18 (s, Ш; 6-Н); 11,19 (bs, 1Н, 1-NH).
Пример 2. Смесь 3,76 г (20 ммоль) 3-метилксантиннатрия, 1.00 мл диметилформамида и 2,60 г (19,6 ммоль) 3-хлорметил-5-метш1- . -1,2,4-оксадиазола перемешивают при 1,5 ч. Реак1що нную смесь фильтруют в горячем состоянии и к фильт-
рату добавляют 5 мл метанола. Получа- 3,7-дигидро-3-метил-7-(5-диэтиламино ют 3,65 г 3,7-диметил-3-метил-7-t(5- метил- 1.2,4-oкcaдиaзoл-3 ил)-мeтилJ- -мetил-1,2,4-oкcaдиaзoл-3-ил)-мeтил - -1H-пypин-2,6-диoнa, выход 69%, т.пл.
262г264 е.
Пример 3.
а. Раствор 2,38 г 2(3-метилксан- тин-7-ил)-ацетамидоксима и 45,0 мл уксусного ангидрида перемешивают при 140°С в течение 10 мин. Охлавденный
10
1Н-пурин-2,6-дионгидрохлоридэ.
Ь. 1,41 г 0-хлорацетил-2-(3-метш1- ксантин-7-ил) ацетамидоксима смешивают по каплям с 15 мл толуола, при сильном перемешивании с 1,5 мл диэтил- амина. Реакционную смесь нагревают до кипения в течение 8 ч и после этого сгущают. Остаток промывают водой. Гидрохлорид образуют в этаноле и кристал- лизуют из воды. Получают 1,2 г 3, гидро-З-метил-7- СЗ-диэтиламинометил
Ь. 1,41 г 0-хлорацетил-2-(3-метш1- ксантин-7-ил) ацетамидоксима смешивают по каплям с 15 мл толуола, при сильном перемешивании с 1,5 мл диэтил- амина. Реакционную смесь нагревают до кипения в течение 8 ч и после этого сгущают. Остаток промывают водой. Гидрохлорид образуют в этаноле и кристал- лизуют из воды. Получают 1,2 г 3, гидро-З-метил-7- СЗ-диэтиламинометил
раствор разбавляют водой до 10-кратного объема и перемешивают в течение 30 мин. Осажденный 0-ацетил-2-(3-метилксантин-7-ил)-ацетамидоксим филь- с -1,2,4-oкcaдиaзoл-3-ил)-мeтилl-1П-пy- тpyют и промывают небольшим количест- рин-2,6-дионгидрохлорида. Boft метанола. Получают 3,60 г продук- с. 2,38 г 2-(3-метилксантин-7-ил)-ацетамидоксима в 20 мл пиридина перемешивают с 3,0 г диэтиламиноацетил
та с т.пл. Bbmie (разл.).
Н-ЯМР (DMSO-d): 2,01 (s, ЗН, ОАс): 3,34 (s, ЗН, ЗМе); 4,У7.(з, 2Н, 20 « оРВДа п температуре, не превыNCH,-), 6,.70 (bs, 2Н, NH); 8,07 (s, 1Н; 6-Н); 11,24 (bs, 1Н, 1-NH).
Ь. 2,0 г 0-адетш1-2-(3-метилксан- тин-7-ил)-ацетамидоксима перемешивают в смеси 160 мл буферного раствора Бриттона-Робинсона (рН 7) и 200 мл ди- метилформамида при 95°С в течение 6 ч. Реакционную смесь сгущают при пониженном давлении. После кристаллизации остатка из воды получают 1,22 г 3,7- -дигидро-З-метил-7- (5-метил-1,2,4- -oкcaдиaзoл-3-ил)-мeтил -1H-пypин-2,6- -диoнa, т.пл. 262-264°С.
Пример 4. Раствор 2,38 г 2-(3-метилксантин--7-ил)-ацетамидокси- ма в 40 мл безводного ацетона ацили- руют в присутствии 0,86 г бикарбоната натрия при помощи раствора 1,13 г хлорацетилхлорида и 5,0 мл ацетона. Получают 2,1 г 0-хлорацетил-2-(3-мешающей 20 С. Реакционную смесь нагревают на водяной бане 2 ч и сгущ.ают. Остаток промывают водой. Гидрохлорид образуют с этаноловым хлористым водоjr родом и кристаллизуют из воды. Получают 2,1 г 3-Г(3-мeтилкcaнтин-7-ил)- -мeтилJ-5-диэтшIaминoмeтил-1 ,2,4-ок- садиазолгидрохлорида.
d. Смесь 2,38 г 2-(3-метилксантин- -7-ил)-ацетамидоксима, 200 мл толуола, 1,36 г этилата натрия и 3,46 г простого этилового эфира В -дизтил- амииопропионовой кислоты нагревают до кипения в течение 12 ч при перемеши- цании в снабженной водоотделителем
35 колбе. Реакционную смесь сгуи1ают при пониженном давлении, устанавливают рН до 7, осадок промывают водой и сушат. Г идрохлорид образуют в этаноле. Получают 2,0 г 3,7-дигидро-З-метилтилксантин-7-ил)-ацетамидоксима. Про- -7-(5-диэтилaм нoмeтил-1,2,4-oкcaди- aзoл-3-ил)-мeтилJ-1H-пypин-2,6-диoн- гидpoxлopидa.
Пример 6. 2,38 г 2-(3-ме- тилксантин-7-ил)-ацетамидоксима в
45 25 мл этанола нагревают до кипения в течение 20 ч при перемешивании с раствором 0,45 г натрия в 25 мл этанола и с 3,12 г сложного этилового эфира циклогексанкарбоновой кислоты.
50 Реакционную смесь сгущают, остаток смешивают с водой и устанавливают рН до 7. Остаток кристаллизуют из водного этанола. Получают 2,51 г 3,7- -дигидро-З-метил-7- (5-циклогексил55 1,2,4-оксатиазол-3-ил)-метил -1Н-пу- рин-2,6-диона с т.пл. 245-2480С.
Пример 7. 2,38 г 2-(3-метил- ксантин-7-ил)-ацетамидоксима обрабатывают как в примере 6 с 3,28 г слождукт сушат до постоянной массы при 105°С и при давлении 133 Па в течение 40 мин. Остаток кристаллизуют из метанола. Получают 1,6 г 3,7-дигидро-З- .-метил-7- (5-хлорметил-1 ,2,4-оксади- азол-3-ил)-метил1-1Н-пурин-2,6-диона.
Пример 5. а. Смесь 1,5 г 3- ((метилксантин-7-ил)-метил -5-хлор- метил-1,2,4-оксадиазола, 10 мл диэтил- амина и 10 мл толуола нагревают на водяной бане в течение 8 ч при перемешивании в снабженной магнитной мешалкой закрытой колбе. Реакционную смесь сгущают, остаток промывают водой, растворяют в 5 мл горячего этанола и осветляют при помощи активного угля. Гидрохлорид образуют при помощи этанолового хлористого водорода и кристаллизуют из воды. Получают 1,4 г
3,7-дигидро-3-метил-7-(5-диэтиламино метил- 1.2,4-oкcaдиaзoл-3 ил)-мeтилJ-
0
1Н-пурин-2,6-дионгидрохлоридэ.
Ь. 1,41 г 0-хлорацетил-2-(3-метш1- ксантин-7-ил) ацетамидоксима смешивают по каплям с 15 мл толуола, при сильном перемешивании с 1,5 мл диэтил- амина. Реакционную смесь нагревают до кипения в течение 8 ч и после этого сгущают. Остаток промывают водой. Гидрохлорид образуют в этаноле и кристал- лизуют из воды. Получают 1,2 г 3, гидро-З-метил-7- СЗ-диэтиламинометил
с -1,2,4-oкcaдиaзoл-3-ил)-мeтилl-1П-пy- рин-2,6-дионгидрохлорида. с. 2,38 г 2-(3-метилксантин-7-ил)« оРВДа п температуре, не превышающей 20 С. Реакционную смесь нагревают на водяной бане 2 ч и сгущ.ают. Остаток промывают водой. Гидрохлорид образуют с этаноловым хлористым водородом и кристаллизуют из воды. Получают 2,1 г 3-Г(3-мeтилкcaнтин-7-ил)- -мeтилJ-5-диэтшIaминoмeтил-1 ,2,4-ок- садиазолгидрохлорида.
d. Смесь 2,38 г 2-(3-метилксантин- -7-ил)-ацетамидоксима, 200 мл толуола, 1,36 г этилата натрия и 3,46 г простого этилового эфира В -дизтил- амииопропионовой кислоты нагревают до кипения в течение 12 ч при перемеши- цании в снабженной водоотделителем
колбе. Реакционную смесь сгуи1ают при пониженном давлении, устанавливают рН до 7, осадок промывают водой и сушат. Г идрохлорид образуют в этаноле. Получают 2,0 г 3,7-дигидро-З-метил-7-(5-диэтилaм нoмeтил-1,2,4-oкcaди- aзoл-3-ил)-мeтилJ-1H-пypин-2,6-диoн- гидpoxлopидa.
кого этилового эфира фенилуксусной кислоты и этилата-натрия в этаноле, получают 2,7 г 3,7-дйгидро-3-метшг-7-|(5-бензил-1,2,4 оксадиазол-3-ил)- ме Н пурин- 2,6-диона,
Пример 8. 2,52 г амидоксима 3-(3-метилксантин-7-ш1)Пропионовой кислоты в 4,0 мл этилацетата нагревают до -кипения в течение 5 ч с раство- ром 9,46 г натрия и 25 мл этанола. Реакционную смесь фильтруют в горячем состоянии, фильтрат выпаривают, остаток обрабатьгеают 20 мл воды и уста- навливаЬт рН до 7. Ос.адок кристалли33 ют из воды. Получают 1,7 г 3,7-дигид- ро-3-метил-7- 2-(5-метил-1,2,4-окса- диазол-3-)-ш1-этан-1-ш1 -1Н-пурин- -2,6-диона с т.пл. 258-260°.С.
Пример 9. Смесь 2,52 г амидоксима 3-(3-метилксантин-7-ил)-про- пионовой кислоты, 25 мл толуола, 1,12 г распьшенной гидроокиси калия и 3,70 г сложного этилового эфира р пиперидинопропионовой кислоты нагре ают до кипения в течение 10 ч при перемешивании в снабженной водоотде- лителем колбе. Реакционную смесь сгущают. Остаток обр абатывают водой, устанавливают рН до 7, осажденный осадок промывают водой, образуют гидрохлорид в этаноле. Получают 2,6 г 3,7-дигидро-3-метил-7-|2- 5-(2-пипе- ридино-этан-1-ил)-1,2,4-оксадиазол- -3-ил}-этан-1-ил|-1Н-пурин-2,6-дион- -гидрохлорида.
Пример 10. Раствор 2,66 г амидоксима 4-(3-метилксантин-7-ил)- -масляной кислоты в 4,0 мл этилацетата нагревают до кипения в течение 6 ч с раствором 0,4б г натрия и 25 мл этанола. Реакционную смесь обрабатывают описанным в примере 3 способом. Получают 1,8 г 3,7-дигидро-З-метил- (5-метил-1,2,4-оксадиазол-3-ил -пропан-1-ил |-1 Н-пурин-2,6-диона.
Примеры 11-31. Сведены в табл.- 1 и получены аналогично описанным примерам.
Определяют успокаивающее кашель действие, оказанное на вызванный впрскиванием 15%-ной лимонной кислоты морским свинкам кашель, через 1 ч после перорального назначения Тест- соединения, и полученные величины
ID
SO
(мг/кг) указаны в табл. 2.
Из данных табл. 2 видно, что при оральном назначении тест-соединение по абсолютной интенсивности успокаи0
с
д 5
5
дс
0
35
40
55
вающего кашель действия значительно превосходит примененные в качестве эталонного соединения тест-соединения 2-4 и 6. Производное ксантиниламидок- сима соединение 5 практически не имеет никаких успокаивающих кашель свойств.
Успокаивающее кашель действие, оказанное на вызванный впрыскиванием 15%-ной лимонной кислоты морским свинкам, кашель, при пероральном назначении 3,7-дигидро-3-метил-7-(5-метил- . -1,2,4-оксадиазол-3-ил)-метил -1Н-пу- рин-2,6-диона (I) следующее:
Период предшествую- Ю , мг/кг
щего лечения, ч
0,57,5
1,0 . 8,5 2,014,4
4,013,8
8,0 . 32,6
Измеренная на крысах острая токсичность (внутрибрюшинное назначение) тест-соединений следующая:
Тест-соединение Токсичность на
крысах LD , мг/кг 1700,0
Аналог 1529,7
Аналог 272,4
Соединение 1 - (3,7-дигидро-З-ме- тил-7-(5-метил-1, 2,4-оксадиазол-З- -ил)-метил -1Н-пурин-2,6-дион обладает не только при оральном применении, но и при внутривенозном очень сильной активностью, подавляющей кашель. Оно уменьшает в зависимости от дозы (0,5- 8,0 мг/кг i.v) каш.ель, вызываемый механическим стимулированием Trachea Bifureatio у наркотизированных нембу- талом .кроликов.
Через 2 мин после внутривенного введения ЕД р составляет 2,24 (1,85 - 2,72) мг/кг.
Терапевтический индекс соединения 1 в этом опыте в десять раз благоприятнее терапевтического индекса контрольных соединений.
Успокаивающее кашель, действие соединений формулы I Определяют на морских свинках при пероральном назначении. Скрипинговые испытания проводят внутримышечно на . Кашель вызывают ингаляцией спрея с содержа - нием 15%-ной лимонной кислоты. Величину ID 5о (ингибиторная доза 50) определяют по дозе, которая может прод- .лить период времени до первого приступа кашля в три раза на 50% тести-
руемых животных. Каждую дозу испытывают на 10 животных. Основной период времени измеряют 24 ч перед экспери- ментами.
Сравнение проводят с кодеин-гидро- хлоридом и 3,7- дигидро-1,3-диметил -7- (5-метшг-1,2,4-oкcaдиaзoJг-3-ил)- -мeтил - 1Н-пурин-2,6-дионом, содержащим пуриновую структуру и кольцо ок- садиазола. Токсичность определяют также на мьшах при внутрибрюшинном введении.
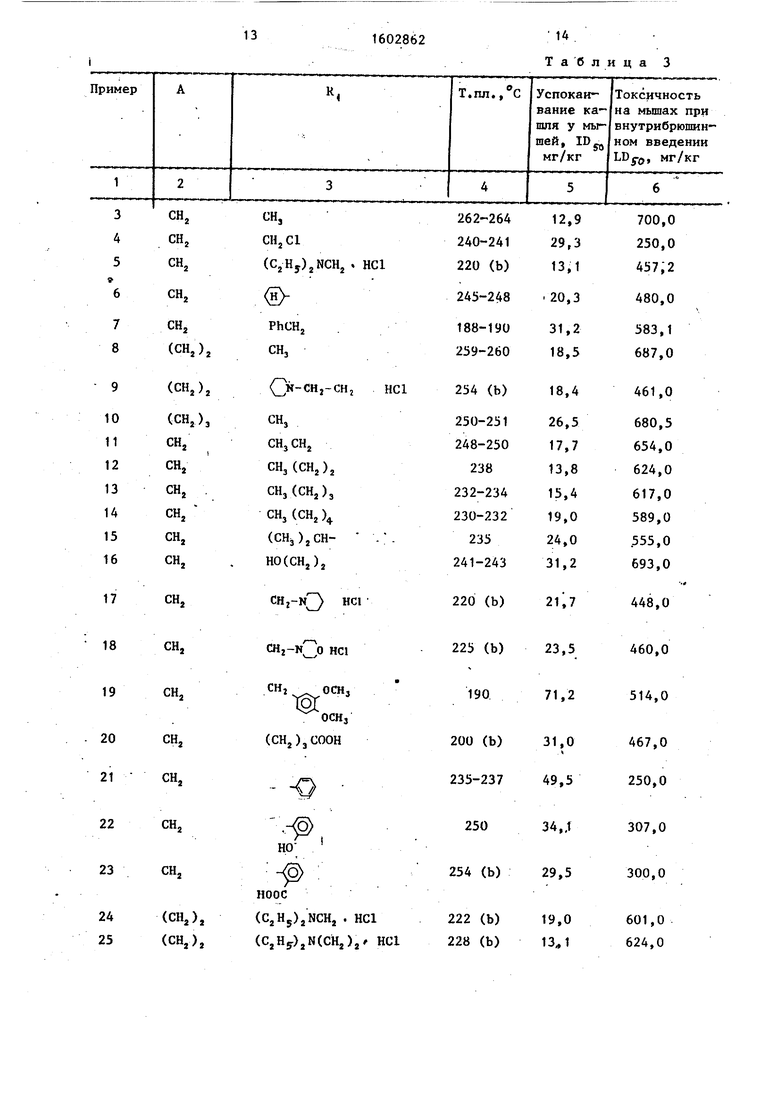
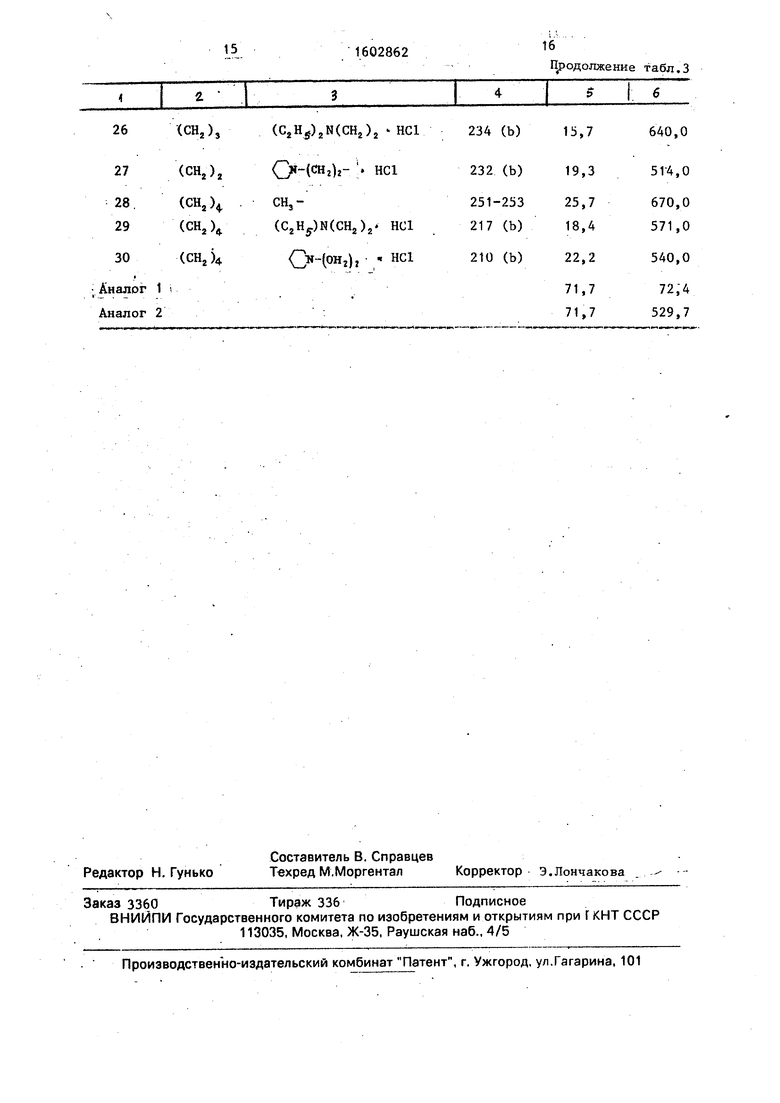
Результаты испытаний даны в табл. 3
Таким образом, производные оксадиазолшталкилпурина проявляют более высокую противокашлевую активность в меньшей дозе, чем известные и обладают при этом более низкой токсичностью. Соединения не оказывают никакого блокирующего дыхания действия, а значительно улучшают дыхание. Формула изобретения
Производные оксадиазолилалкилпурина общей формулы
О
H-N-V-N A -f I
АЛн N
А - СН,;
-CH,CHj; -СН,С1; , PhCH,; CH,(CHJ,; СН, (СН, ) ; (CHj),CH; ; CHj-NiQ) HCl; CHj
осн,
OCHj
(CHj),COOH; Hg
OH
HOOC
когда A
К
или когда A
(CHj), где п 1,2 (CjHj jNCHj НС1; (CHj), где n 2, 4
СИОН2)2 HCl;
или когда А (CHj), где п 3, 4 R (CjHy)j.N(CHj,)j. HCl или когда А (CHj) где п 1 - 4,




| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ ОКСАДИАЗОЛАЛКИЛПУРИНА ИЛИ ИХ ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМЫХ КИСЛОТНО-АДДИТИВНЫХ СОЛЕЙ (ЕГО ВАРИАНТЫ) | 1987 |
|
RU2007404C1 |
| Способ получения производных оксадиазолилалкилпурина или их фармацевтически приемлемых кислых аддитивных солей | 1988 |
|
SU1635901A3 |
| Производные теофиллина или их соли,обладающие успокаивающим кашель действием | 1983 |
|
SU1344756A1 |
| Способ получения производных теофиллина или их кислотно-аддитивных фармакологически приемлемых солей (его варианты) | 1983 |
|
SU1322981A3 |
| Способ получения производных ксантина или их солей | 1979 |
|
SU952105A3 |
| ГИДРОКСИПУРИНОВЫЕ СОЕДИНЕНИЯ И ИХ ПРИМЕНЕНИЕ | 2016 |
|
RU2685417C1 |
| СПОСОБ ПОЛУЧЕНИЯ ТРИАЗОЛО/4,3-А/ /1,4/ДИАЗЕПИНОВ | 1988 |
|
RU2071962C1 |
| ТРИАЗОЛО[4,3-А][1,4]-БЕНЗОДИАЗЕПИНЫ И ТИЕНО[3,2-F]-[1,2,4]-ТРИАЗОЛО[4,3-А] [1,4]ДИАЗЕПИНЫ, В СЛУЧАЕ НАЛИЧИЯ ПО МЕНЬШЕЙ МЕРЕ ОДНОГО АСИММЕТРИЧЕСКОГО ЦЕНТРА ИХ ЭНАНТИОМЕРЫ, РАЦЕМАТЫ И ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМЫЕ СОЛИ ПРИСОЕДИНЕНИЯ КИСЛОТ, СПОСОБ ИХ ПОЛУЧЕНИЯ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, ИНГИБИРУЮЩАЯ ФАКТОР АКТИВАЦИИ ТРОМБОЦИТОВ. | 1992 |
|
RU2094436C1 |
| ИНГИБИТОРЫ КАНАЛОВ С ТРАНЗИТОРНЫМ ПОТЕНЦИАЛОМ НА ОСНОВЕ ОКСАДИАЗОЛОВ | 2019 |
|
RU2818244C2 |
| АМИДОЗАМЕЩЕННЫЕ ПРОИЗВОДНЫЕ КСАНТИНА, ОБЛАДАЮЩИЕ ИНГИБИРУЮЩИМ ДЕЙСТВИЕМ ФОСФОЕНОЛПИРУВАТКАРБОКСИКИНАЗЫ (ФЕПКК), СПОСОБ ИХ ПОЛУЧЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И ПРИМЕНЕНИЕ | 2003 |
|
RU2295525C2 |
Изобретение касается гетероциклических веществ, в частности производных оксадиазолилалкилпурина общей ф-лы: N(CH3)-C(O)-NH-C(O)-C=C-N=CH-N- A -C=N-O-CR=N, где A=-CH2-
R=C2H5
CH2CL
- @ H
C6H5CH2
CH3-(CH2)3
CH3(CH2)4
(CH3)2-CH
CH2- @ N.HCL
-CH2-N @ O.HCL
CH2-C=CH-C(OCH3)=C(OCH3)-CH=CH
(CH2)3-C(O)-OH
C6H5
C6H4-2-OH или C6H4-2-C(O)-OH или, когда A=(CH2)N, то при а)N=1 или 2, R=(C2H5)2N-CH2.HCL
б) N=2 или 4 R= @ N-(CH2)2.HCL
в) N=3 или 4 R=(C2H5)2N-(CH2)2.HCL
г) N=1-4 R=CH3, проявляющих противокашлевую активность, что может быть использовано в медицине. Цель - создание новых более активных веществ указанного класса. Синтез, например, 3,7-дигидро-3-метил-7-[(5-хлорметил-1,2,4-оксадиазол-3-ил)метил]-1Н-пурин-2,6-диона ведут ацилированием 2-[3-метилксантин-7-ил]ацетамидооксима хлорацетилхлоридом в присутствии NA2CO3 в среде безводного ацетона. Новые соединения при токсичности ЛД50=250-700 мг/кг имеют более высокую противокашлевую активность при меньшей дозе, чем известные соединения, и они не оказывают блокирующего дыхание действия и значительно улучшают дыхание. 5 табл.
-CHj-CHj-CHj
1с
1с 1с
ii
160286:2
-CHj-CHj-CHj-CHj
-CHj-CHj
-(СН,)з
-(СН,)з
-CCH) -(2)4-(CH)OH
COOH (CjH,.)2NCH2.
(CjHpjNCCK,) (C,H5),N(OH2)
(C«2
CH,
(C.Hp NCCHj
(СНг
динение
Тест-соединение химическая номенклатура
3, 7-Дигидро 3-метйл-7-{(5-метил-1,2,4- -оксадиазол-3-ил) -метил; -1 Н-пурин-2,6- -дион
3,7-Дигидро-1,3-диметил-7- /(5-метил- -1,2,4гоксадиазол-3-ил/-метил// -1Н- -пурин-2,6-дион
3-(2,2-Дифенилэтан-1-ил)-5-(2-пипери- диноэтан-1-ил)-1,2,4-оксадиазол х X НС1 (преноксдиазин НС1)
(эталон) 5
Кодеин . НС1
2-(з-Метил-ксантин-7-ил)-ацетамидоксим При дозе 50 мг/кг при
пероральном назначении неэффективности
(этанол)
Декстрометорфан
Продолжение тдбл,1
OH
COOH (CjH,.)2NCH2.):
(CjHpjNCCK,)- (C,H5),N(OH2)j
(C«2)2(C.Hp NCCHj),
(СНг)гТаблица 2
Успокаивающее кашель действие на морских свинках, определенное через 1 ч после перо- рального назначения.
ID
SD
мг/кг
8,5
111,2
60,5
29,0
13
1602862
14 Таблица 3
15
1602862
16
11родолжение табд.З
| Arzne-imittel-Forschung, 617-621 .(1966) | |||
| J | |||
| Chen | |||
| Res (M), 1979, 801 | |||
| Производные теофиллина или их соли,обладающие успокаивающим кашель действием | 1983 |
|
SU1344756A1 |
| Способ восстановления хромовой кислоты, в частности для получения хромовых квасцов | 1921 |
|
SU7A1 |
Авторы
Даты
1990-10-30—Публикация
1988-02-19—Подача