Изобретение относится к превращению угля, торфа или древесины в целевые продукты превращения, такие, как углч водороды в жидкой или газообразной форме, путем взаимодействия угля в одну или более стадий со специальным реагентом, который может быть одинаковым или разным для каждой стадии, но на каждой стадии реагент находится в присутствии воды или пара и сероводорода
Цель изобретения - повышение выхода продуктов и упрощение способа.
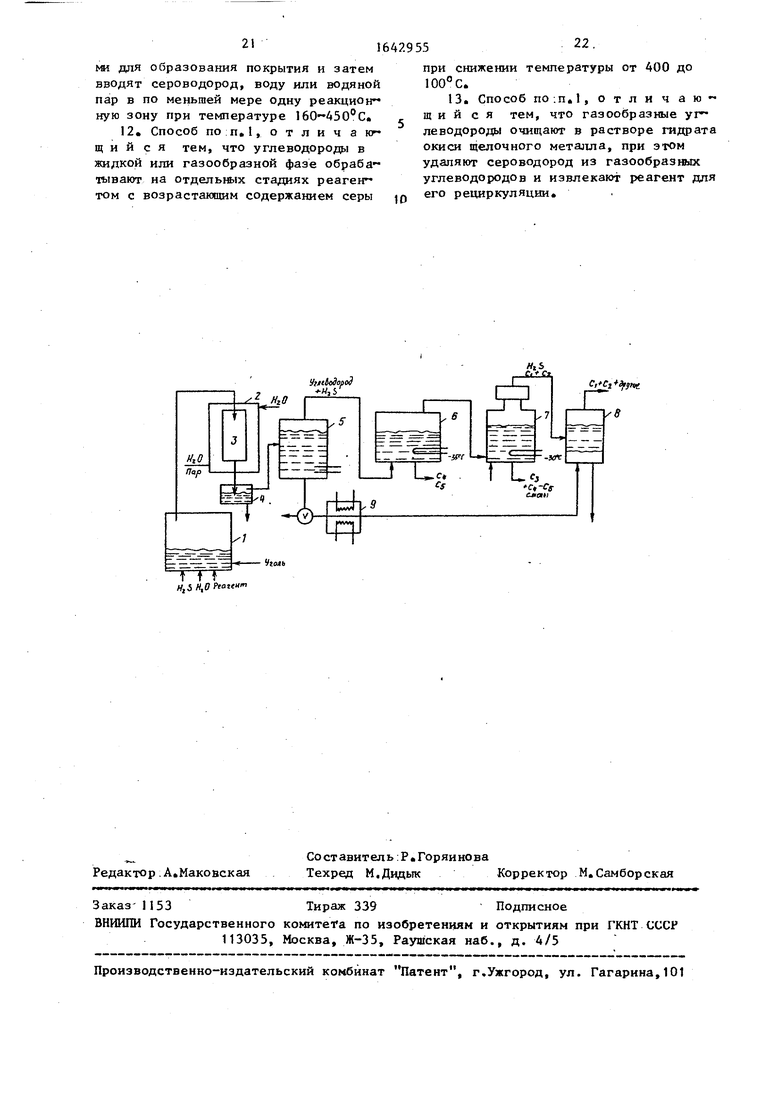
На чертеже представлена схема установки для осуществления способа.
В реактор 1, температура в котором обычно поддерживается от 350 до 390°С, загружают уголь, реагент в жидкой форме, воду в виде пара и гач зообразный сероводород Охлаждающая
рубашка 2, окружающая конденсатор 3, служит для охлаждения реакционных газод/ Первичные и низкокипящие про-, дукты удаляют через днище конденсатора 4. Газообразные продукты направляют в сосуд 5, где содержатся вода и алканол (метан или этан). Сосуд 5 принимает воду или алканол из реактора, если используют растворимый в алканоле реагент.Температуру смеси воды и спирта в сосуде 5 поддерживают более низкой, чем температура кипения смеси, и легколетучие газы, такие, как , и сероводород, проходят сквозь смесь.
В сосуде 6 содержимое охлаждают приблизительно до -35°С и при этой температуре удаляют жидкие Су. В сосуде 6 удаляют большинство фракций Сф и С, оставшиеся подают в со-
оэ
4 №
СО
сл
СП
см
суд 7, где при -30°С их удаляют вмес- те с фракцией Cj в этаноле или метаноле. Пористым стеклянным диском удаляют все оставшиеся в виде тумана компоненты. При этом в основном толь- ко HgS и фракции С4 и Cg присутствуют в потоке газа, который затем вводят в сосуд, содержащий КОН и спирт (обычно этанол или метанол в водном растворе) Сероводород восстанавливает реагент, который выделяется в виде осадка, в то время как легколе- тучие газовые фракции, состоящие в основном из С и С, проходят. При- близительно 97% и более выделяется в виде компонента реагента и может быть использовано повторно. Б воздух НдЗ не выбрасывается. Водно- спиртовая фракция из сосуда 5 используется для пополнения спирта, выводимого из сосуда 8 Эта смесь должна быть охлаждена в теплообменнике 9.
Сероводород можно вводить в реак- тор отдельным потоком или вместе с паром При введении с паром температура его равна приблизительно 135 С и выше, но обычно при использовании пара сероводород вводят при 170-190°C Пар не вводят в реакционный сосуд до тех пор, пока не будет удалена использованная для введения реагента смесь метанол-вода, поддерживающая в ходе перегонки температуру в опреде ленном интервалев Сероводород присутствует с начала реакции
После введения пара или пара одновременно с сероводородом различные бурые и суббитуминозные угли в зави- симости от своего состава обнаруживают различные температуры дистилляции при получении ощутимых количеств газообразного углеводорода.
Количество полученного газа значительно увеличивается при 360 С. При конечной температуре 380-450 С происходит очень быстрое выделение газа и некоторого количества водорода При температуре 360-380°С получают карбонилсульфид. В суббитуминозном угле содержание карбонилсульфида может составлять, например, 4,7 от общего углеводородного газа. При использовании сероводорода выделение карбонилсульфида, как оказалось, подавляется при прочих равных условиях
0
, Q 5
5 Q
5
5
0
5
Не связывая процесс с какой-либс теорией, можно сказать, что реакции через молекулы воды и сероводорода приводят к получению водорода, взаимодействующего с углем при температуре, при которой уголь деоксигене- зируется, десульфируется или де- нитрогенизируется. Таким образом, осуществляя предлагаемый способ, необходимо, чтобы в угле присутствовал кислород,желательно также присутствие серы и азота в виде органических соединений Кроме того, угли более высоких категорий, например, бути- минозные, нелегко превратить в газообразные углеводороды. Достичь этого можно при соответствующем изменении схемы процесса
Данное изобретение относится преимущественно к газификации бурого суббитуминозного угля, хотя все угли можно обрабатывать с получением газообразных или жидких продуктов; газифицировать можно даже древесину в форме стружек Кроме того можно превращать в газообразные или жидкие продукты древесину (целлюлозу, лигнин, сахар и пр.).
Антрацитовый уголь с содержанием углерода 92% можно легко превратить в жидкие или газообразные реакционные продукты после частичного окисления
Если калий в угольной золе превращают в гидросульфид, то потерь гидро- сульфида калия не происходит, баланс реагентов в реакции при циклическом и непрерывном процессе весьма удачен Кроме того, при стабилизации реагента сероводородом количество используемого реагента можно уменьшить, используя для получения реагента или сероводорода избыток серы и калия из угля.
Для поглощения удаляемой из реагента серы,- поглощения серы или кислорода в угле в процессе деоксигени- зации и предупреждения таким образом выделения серы в ходе дегидрогенизации угля при температуре выше 175° С требуется достаточное количество серы, сероводорода или полисульфида. Кроме того, температуру реагентов различных соединений необходимо поддерживать не выше 325°С, так как превышение этого уровня вызывает замедленную дегидрогенизацию угля расплавом гидроокиси щелочного металла. Так
J16
как сера вызывает образование полисульфидов, а полисульфиды щелочных металлов гидролизуются тем меньше, чем выше в них содержание серы, то предупреждается разложение паром (или другой формой воды) продукта гидролиза, т.е. гидросульфида; однако добавление сероводорода обеспечивает лучшую стабилизацию
Сероводород, выделяющийся при добавлении элементарной серы к спиртовому раствору гидросульфида щелочного металла и в ходе реакции вытеснения серы кислородом при превращении угля в углеводородную форму, используют для образования дополнительного количества гидросульфида щелочного металла из гидроокиси щелочного металла, циркулирующей в процессе; од- нако для стабилизации реагента сероводород вводят также в реактор (реакторы), вследствие чего он присутствует при реакции в избытке
Вследствие гидролиза некоторое ко- личество гидросульфида калия разлагается до гидроокиси калия и сероводорода Гидроокись калия создает при 360бС и выше такую среду, что известняковый карбонат кальция, содер- жащийся в золе угля, взаимодействует с сульфатом калия (из остатка реаген та) с образованием сульфата кальция и смеси гидроокиси калия и карбоната калия. Капиевые соединения угольной золы также переходят в гидроокись
Пар используют при температуре, при которой стараются проводить реакцию т.е. при температуре, зависящей от типа угля, степени его разложения, а также от целевых продуктов. Содержащаяся в угле вода также является источником воды и/или пара.
При повышении содержания серы в реагенте,т.е. серы в угле, добавлен- ной элементарной серы или серы из сероводорода, температура реакции понижается. Например, температура реакции понижается с 380 до 350°С, если баланс серы соответствует теоретичес- кому соединению , получаемому и поддерживаемому в условиях реакции. В результате получают молекулы большей величины, например пентан, изопентан и пентан.
I
Кроме того, на выход дистиллята
влияет качество угля, а именно: чем выше качество угля, тем больше доля
жидкого дистиллята при прочих равных условиях (например, при использовании теоретического соединения при одинаковых температурных условиях) ,
Естественно, что при изменении температуры изменяется состав продуктов Кроме того, состав продуктов изменяется при изменении содержания серы в реагенте.
Из сказанного следует, что при получении целевых продуктов разложения можно изменять температуру, содержание серы в реагенте, использовать смеси реагентов, например их жидкие или растворимые формы, менять качество угля и возвращать в цикл поглощенные спиртом дистилляты, соблюдая при этом следующие требования: интервал температуры до 425- 250йС (но дистилляцию начинают при 40-50°С); содержание серы в реагенте (например, по калию) соответствует но может быть повышено до добавка серы или сероводорода, смеси этих реагентов; жидкое или твердое состояние реагентов; контакт потока продукта с другим составом реагентов, включая сероводород; предпочтителен сорт угля в интервале от бурого до битуминозного. При использовании антрацита результаты менее удачны, однако дистиллят можно получить при +380°С, используя такой реагент, как 4. Реакции способствует также частичное окисление угля высокого качества.
Кроме того, можно изменять коли- чество возвращаемых в цикл соединений. Так, приблизительно до 280°С состав продукта можно приблизить к составу, представляющему собой жидкий дистиллят с температурой кипения ниже 180°С. При температуре реакции приблизительно до образуются парафиновые дистилляты, если использовать возвращение в реакционный сосуд спирта. Для успешного протекания реакции при возвращении в цикл должны присутствовать вода, т.е. пар при температуре приблизительно 135°С (и выше), и сероводород.
В начале реакции при условиях, приближенных к условиям окружающей среды (и повышении температуры), добавляют элементарную серу или (предпочтительно) сероводород для получе
ния выбранного содержания серы в реагенте, В этих условиях , образующийся в системе в ходе реакции взаимодействия серы и реагента, уда- ляют из газового потока для воеста- новления реагента При поддержании температуры без использования пара успех гидрогенизации угля зависит от содержания воды в угле или реагенте. Если желательно получить низкокипя- щие дистилляты, то пар можно добав- лять приблизительно при 135°С Обыч- но же пар добавляют при температуре начала перехода гидрата реагента в более низкий гидрат. При использова- . нии реагента на основе калия темпера тура вводимого пара выбирается при близительно равной 170°С.
При удалении кислорода, азота и органической серы вода или (в меньшей степени) сероводород, непрерывно образующийся при контакте воды с реагентами, образуют водород, вводимый в уголь, при температуре, когда уголь деоксигенизируется, десульфируется или денитрогенизируется; азот удаляется в основном в виде аммиака, сера - в форме полисульфида щелочного металла, например калия, и при более низких температурах образует меркаптаны со спиртовым растворителем. Меркаптаны поглощаются спиртом и раствором ЮН-спирт. Эта реакция протекает с восстановлением газообразного сероводорода до серы и воды с последующей реакцией серы с КОН и образованием тиосульфата калия и сульфида калия. Сульфид калия может затем связывать дополнительную серу из сероводорода с образованием поли- сульфида калия и становится реагентом, ислольэуемым в реакции.
Углеводородные смеси, т.е. газообразные фракции, полученные при различных уровнях температуры, могут, подвергаться дальнейшей обработке, например, в другом реакторе при другом составе реагента, а именно при более низкой температуре и более высоком содержании серы, переходя с первой стадии, где температура, например, 340-390°С, в следующую стадию, где температура может быть равна 280-340°С и где содержание серы в реагенте повышено, на третьей стадии температура может быть равна 225- 280°С или 180-225°С. Так как реак1642955 8
ция гидрогенизации конкурирует с ре
10
15
20
25
30
35
40
45
50
55
акцией дегидрогенизации, то повыше- ние содержания серы в реагенте и присутствие серы вызывает дегидрогенизацию первоначально газообразного потока продукта. Затем этот поток может быть обработан с получением целевого продукта, т.е. продукта с пред варительно выбранным числом по стандартам Американского института нефти Другими словами, газообразные первичные продукты переводятся в продукты, отвечающие потребностям.
Описанный способ можно усовершенствовать, добавив к реагенту сероводород на стадии гидрогенизации угля или продуктов из угля, т.е. к сульфидам щелочного металла, смесям сульфидов, например, в их гидратирован- ной форме и пр. Добавление сероводорода, по-видимому, поддерживает выбранный реагент.в стабильном состоянии, и, таким образом, реакция, первоначально инициированная данным ч реагентом или смесью реагентов, будет давать с немногими изменениями из тех же исходных соединений и при сохранении постоянными всех остальных условий в основном те же продукты или смеси продуктов. Следовательно, добавлением в описанную выше реакцию сероводорода можно улучшить подбор реагентов на соответствующих стадиях, их состав на каждой стадии, температурные условия и содержание воды, что расширяет набор продуктов и их смесей, обеспечивает более точную степень гидрогенизации (включая при необходимости дегидрогенизацию потока/потоков продукта).
Соответствующие сульфиды щелочных металлов, смеси сульфидод и смеси предшествующих гидратов сульфида (сульфидов) наряду с присутствием сероводорода дают стабильность реагента и целевой продукт. Таким образом, при поддержании реагента в активном состоянии с помощью добавления сероводорода можно снизить количество реагента, повысить выход и улучшить контроль над составом продукта.
Целесообразность добавления сероводорода вытекает из приведенных ниже реакций:
(1) 4КОН + 4KHS + 4Н2. Если присутствует сера из угля, то
0
5
0
5
0
5
0
5
0
5
акцией дегидрогенизации, то повыше- ние содержания серы в реагенте и присутствие серы вызывает дегидрогенизацию первоначально газообразного потока продукта. Затем этот поток может быть обработан с получением целевого продукта, т.е. продукта с предварительно выбранным числом по стандартам Американского института нефти. Другими словами, газообразные первичные продукты переводятся в продукты, отвечающие потребностям.
Описанный способ можно усовершенствовать, добавив к реагенту сероводород на стадии гидрогенизации угля или продуктов из угля, т.е. к сульфидам щелочного металла, смесям сульфидов, например, в их гидратирован- ной форме и пр. Добавление сероводорода, по-видимому, поддерживает выбранный реагент.в стабильном состоянии, и, таким образом, реакция, первоначально инициированная данным ч реагентом или смесью реагентов, будет давать с немногими изменениями из тех же исходных соединений и при сохранении постоянными всех остальных условий в основном те же продукты или смеси продуктов. Следовательно, добавлением в описанную выше реакцию сероводорода можно улучшить подбор реагентов на соответствующих стадиях, их состав на каждой стадии, температурные условия и содержание воды, что расширяет набор продуктов и их смесей, обеспечивает более точную степень гидрогенизации (включая при необходимости дегидрогенизацию потока/потоков продукта).
Соответствующие сульфиды щелочных металлов, смеси сульфидод и смеси предшествующих гидратов сульфида (сульфидов) наряду с присутствием сероводорода дают стабильность реагента и целевой продукт. Таким образом, при поддержании реагента в активном состоянии с помощью добавления сероводорода можно снизить количество реагента, повысить выход и улучшить контроль над составом продукта.
Целесообразность добавления сероводорода вытекает из приведенных ниже реакций:
(1) 4КОН + 4KHS + 4Н2. Если присутствует сера из угля, то
6КОН- Kj,S203+
2K4S
знго
(2)4S +
и, в свою очередь,
(3)KaS203 + ЗНгЗ - + 3H20, разложение K2S происходит следующим образом:
(4)4Кг5г+8НгО- 4KOH+4KHS+4S+4H20. Таким образом, если присутствует
HgS, то КОН превращается в KHS, и если КОН образует тиосульфат, то этот тиосульфат превращается затем в K2Sg..
Дальнейшие реакции протекают еле дующим образом:
(5) (6) (7) (8) (9)
2. . 4
2. 4 Z 3 KHS
K2S + КОН +
10
20
25
(выше 300°С) 15 (выше 460°С) + K2S + ЗНяр - ЗКОН +
KHS
KHS + НгО - + КОН (10) KHS + КОН - Кг8 . хН20 (х может быть равно в зависимости от температуры 2,5 и пр.).
Таким образом, необходимо доста- точное количество для поддержа- ния реакции в таком состоянии, при котором реагент стабилен, т.е. се- ра связывается при выделении как из угля, так из реагента, и серово- дород предохраняет реагент от гидро- лиза Тиосульфат, получаемый в ре- 30 зультате взаимодействия с кислородом из угля, восстанавливается в ходе реакции до целевого сульфата .. Таким образом с помощью H«S реагент поддерживают на нужном уровне гидро- 35 лиза
Из множества реагентов предпочти тельны в силу своей способности свя- зывать серу и стабильности следующие: KHS, NaHS, , KZSZ, ъ из этих 40 соединений предпочтительны KZS, K2S, а затем . Остальные сульфиды про являют нестабильность в точке плав ления (например при 445 С, Na2S при 275°С) или выделяют серу 45 при 760 мм рт.ст. (например при 300°С дает K4S4 +S; К при 460°С дает KZS3 + S; Кг5, при 780°С дает K.S, + S).
Перечисленные выше сульфиды ще
50
лочных металлов имеют следующие точ ки плавления: K2S 948°C; K2SZ 470°C; 279°C (точка затвердевания);
г°ь
,
145°С; KjSg206 С; 190°С.
Температуры плавления смесей сульфи дов (как чистых, так и эвтектических) имеют следующие значения: для Kj,S - K2S2 350°С,для Кг5г. - Кг8э
1642955
10
20
25
15
30 35
: 40 , 45
50
55
225°С, для K2S, 10Кг54
.ПО°С, для
K2S4 - K7Sy 183°C. Исходя из сказанного соответствующие температурные условия выбирают в зависимости от характеристических температур разложения и/или плавления так, чтобы можно было использовать твердый реагент или стабильный жидкий реагент, например, в случае применения для покрытия угля. Различные гидраты сульфидов щелочных металлов имеют различные температуры разложения и/или плавления, которые, естественно, справедливы и для эвтектических смесей. Указанные температуры можно легко определить термографическим методом, хорошо известным специалисту в данной области.
При осуществлении способа превращения угля отсутсвует явление нестабильности реагентов, Tie. явление нестабильности гидратов сульфидов щелочных металлов, поскольку гидрогенизация угля протекает предпочтительно с разложением реагента, а добавление сероводорода способствует стабилизации реагента. Поскольку уголь взаимодействует с адекватным количеством имеющегося реагента, при добавлении сероуглерода уменьшается количество реагента, необходимого для реакции, так как указанный реагент в данном случае присутствует в более стабильной форме. Следовательно предлагаемый способ позволяет регулировать данный параметр. В случае применения сероводорода выход продукта увеличивается по меньшей мере вдвое при сохранении прочих равных условий осуществления процесса.
I
В общем случае введение сероводорода регламентируется объемной скоростью введения, которая обычно ле жит в пределах 40-120 мл/мин/галлон (примерно 10-30 мп/мин/л) исходя из объема реактора; наиболее типичной является скорость -20 мл/мин/л объема реактора. При другом подходе до бавляют 0,5 г/моль и менее сероводорода на 1000 мл воды, удаляемой при реакции гидрогенизации.
При максимальной температуре, например 450°С, из Кд8 выделяется се-, ра, что можно рассматривать как полезное явление при дегидрогенизации получаемых потоков реагентов. Поскольку температура разложения пони жается при понижении давления, кон- версия угля при атмосферном давлении является вполне возможной, хотя и
имеются некоторые преимущества при проведении процесса при повышенных давлениях, например при давлении вьше 5 атм Однако увеличение стой- мости и пр. делают это условие менее предпочтительным. При практическом осуществлении способа конверсии угля возможны вариации давления ,5 до 5 атм, однако предпочтительным является нормальное атмосферное дав ление.
Уголь и реагент можно перемети вать, используя соответствующее уст ройство, однако предпочтительным является предварительное покрытие угля в отсутствие кислорода, поскольку в присутствии кислорода наблюдается тенденция к разложению реагента
Из указанных соображений целесо образнее использовать жидкий или
растворенный реагент Жидкие стабиль ные реагенты можно использовать для покрытия угля при температуре, рав ной или превышающей температуру плав ления выбранного реагента или эвтекти ческой смеси реагентов
Так, например, в случае использования смеси - К28ф для покрытия угля переход смеси в жидкое состоядше наблюдается при температуре выше 110 С В качестве растворителя указанного реагента можно с успехом .использовать глицерин Вообще можно использовать лиг бой растворитель,в котором растворяются сульфиды и который не влияет на их активность Для получения раствора в глицерине общим количеством око- ло 200 мл растворяют около 88 г KHS. При нагревании смеси до 75°С (глицерин разлагается при температуре выше 190°С) из смеси растворенного KHS выделяется вода, в результате чего смесь содержит теперь . Из реакционной смеси выводится также кислород Полученная смесь может ис- пользоваться для покрытия угля и, следовательно, может служить в качестве реагента
Поскольку активность в отношении серы, кислорода и азота на угле зависит от состава реагента и его коли чества, следует отметить следующие моменты Газовое превращение угля
с
5
0
5
о
О 5 0
5
5
сопровождается его разложением, т.е. в этом случае реагент является наиболее активным по отношению к углю. Распад в менее жестких условиях приводит к образованию более легких фракций дистиллятов. При 175°С начинается процесс дегидрогенизации под-влиянием серы, вследствие чего присутствие серы становится нежелательным с точки зрения процесса конверсии угля. Следовательно, при этих условиях следует применять стабильный реагент. Однако в случае рифор- минга, т.е. дегидрогенизации, и взаимодействия дегидрогенизирован- ных реагентов между собой указанная реакция имеет важное значение, поскольку позволяет избирательно получать жидкости с различными температурами кипения (или с определенным индексом АНИ (API) (Американский нефтяной институт). Газы, полученные из угля, представляют собой идеальное сырья для риформинга углеводородов. Тип угля также влияет на протекание реакций. В случае использования обедненного угля для достижения наименьшей степени разложения требуются реагенты с высоким содержанием серы. Для более полной газификации требуемое количество серы в реагенте уменьшается, например, используется , а при менее жестких условиях используется . Сказанное особенно важно в случае использования торфа, который в реакции с участием KgSj- дает практически только рольке нафталин.
Приме р-. 1 .Используют реактор емкостью 1 галлон (3,785л),оборудованный линией пара, устройством для нагрева и охлаждения, термопарой, мешалкой, а также выпускной магистралью для газов, образующихся в ходе реакции Сероводород вводят в реактор вместе с-паром, однако можно подавать его и отдельно. Продукты собирают в охлаждаемом соответствующим образом холодильнике, сбор газов осуществляют согласно способу, указанному при описании схемы процесса.
К 800 г угля (Кентукки $:9), находящегося в реакторе под гелиевой подушкой, добавляют жидкую смесь K2S2 и KjiSj- SHgO. Количество смеси введенных реагентов соответствует 2 моль, т.е. по 1 моль каждого из реагентов. I моль K2S э получают из смеси K,S и
13
KjSу в водном растворе,
состав которого соответствует эмпирической формуле . Затем к реакционной смеси добавляют 4 г КОН для вывода аммиака при условиях, в которых проводится процесс Смесь перемешивают так, что бы частицы угля покрылись реагентом. Затем в смесь вводят пар вместе с сероводородом, расходуя 80 мл/мин при 50°С. Реакция протекает экзотер мически; реакционной смеси не дают нагреться до температуры выше 450°С, поддерживая однако при этом температуру возможно более высокой в пределах от 350 до 390°С. Пар вводят при 135°С в количестве, равном количеству выводимых углеводородов, что составляет 130% от указанного количест2955U
Пар вводят при температуре выше 137°С в количестве, соответствующем 130% количества удаляемого конденса- с та, состоящего из углеводородов Путем введения КОН подавляются реакции с участием аммиака внутри реактора, а также достигается удаление аммиака. Реакция приобретает экзотермический характер при 390°С. До достижения экзотермического режима реакции при
температуре свыше 390 С собирают 252 л газа и 70 мл жидкого конденсата углеводородов
t5В случае использования лигнина
при добавлении сероводорода выход увеличивался более чем в 2 раза Прочие реагенты использовали в тех же количествах, что и в примере 1









| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ОБРАБОТКИ ВОДНОГО ПОТОКА, СОДЕРЖАЩЕГО ВОДОРАСТВОРИМОЕ НЕОРГАНИЧЕСКОЕ СУЛЬФИДНОЕ СОЕДИНЕНИЕ | 1993 |
|
RU2108302C1 |
| СПОСОБ ПОЛУЧЕНИЯ ОРГАНОСИЛАНОВ | 2006 |
|
RU2391291C2 |
| СПОСОБ ПОЛУЧЕНИЯ РАСТВОРОВ ПОЛИСУЛЬФИДА КАЛЬЦИЯ | 2012 |
|
RU2523478C1 |
| СПОСОБ ПОЛУЧЕНИЯ МЕТИЛМЕРКАПТАНА | 2004 |
|
RU2394023C2 |
| СПОСОБ ОЧИСТКИ ВОДЫ | 2014 |
|
RU2568484C1 |
| КАТАЛИЗАТОР ДЛЯ ПОЛУЧЕНИЯ МЕТИЛМЕРКАПТАНА | 2008 |
|
RU2497588C2 |
| Способ получения полиметиленсульфида | 2020 |
|
RU2747805C1 |
| СПОСОБ ОЧИСТКИ ПОПУТНОГО НЕФТЯНОГО ГАЗА ОТ СЕРОВОДОРОДА И УСТАНОВКА ДЛЯ ЕГО ОСУЩЕСТВЛЕНИЯ | 2008 |
|
RU2385759C2 |
| СПОСОБ ОЧИСТКИ ВОДЫ ОТ СЕРОВОДОРОДА, ИОНОВ СУЛЬФИДОВ И ГИДРОСУЛЬФИДОВ | 2015 |
|
RU2588221C1 |
| СПОСОБ ОБЕЗВРЕЖИВАНИЯ СУЛЬФИДНО-ЩЕЛОЧНЫХ ЖИДКИХ СТОКОВ | 2007 |
|
RU2326824C1 |
Изобретение относится к способам конверсии угля, торфа или древе сины в газообразные углеводороды или) летучие дистилляты, или их смеси и позволяет повысить выход продуктов и упростить способ. Способ включает взаимодействие угля, торфа или древесины и в качестве реагента гидро сульфида, сульфида или полисульфида щелочного металла, или их смесей в присутствии воды или водяного пара и сероводорода или серы при 50-450°С в одну или несколько стадий. Затем извлекают газообразные и жидкие углеводороды. Реагентом является спиртовой раствор гидросульфида, сульфида, полисульфида щелочного металла или их смесь. К реагенту добавляют элементарную серу. 12 э.п. , 1 ил. (Л
ва Получаемый при этом продукт пред- 20 Реакция преобретает экзотермический ставляет собой прозрачный янтарно- красный раствор, который после обработки при тех же условиях 19 г KHS полностью разгоняется до 240 С с получением не содержащего воды жидкого 25 дистиллята, состоящего из углеводородов (практически не содержащих воды), обладающего вязкостью, примерно равной вязкости воды Всего после первой стадии реакции получают 324 мл дис 30 тиллята, включая 12 л (при нормальных давлении и температуре) газа.
Анализ продукта дает следующий диапазон температур кипения (начальная температура кипения составляет 82°С):
10%
20%248°С
30%252°С
40%255°С
50%260°С
35
23 8° С
режим также при температуре свыше 390РС.
Для осуществления способа необходимо 3 моль сероводорода на 1 моль образующегося . Кроме того, используется 48 г кислорода (из угля при образовании I моль ,
В древесине содержится примерно 42%, а в антраците - примерно 2% кислорода. Максимальное количество добавляемого сероводорода обусловле- но указанными пределами с учетом количества, необходимого для целевой и других реакций, которые могут иметь место. На практике используют меньши количества сероводорода, так как при ципиально возможна побочная реакция двух атомов водорода с кислородом с образованием воды.
40
В случае использования KHS и/или NaHS получают значительные количест ва газов, реакция становится экзотермической при 390вС. При использовании K.SHjO + KZS (эмпирическое выражение, полученное при использовании эквимолярных количеств получают небольшие количества газов и значительные количества жидкого конденсата из того же исходного мате риала, однако при этом реакция ста новится экзотермической с чала, т.е. .
264°С
272°С 281°С 294°С 311°С 333°С
60%
70%
80%
90%
95%
98,6%
1,4% остатка - высококипящая жидкость. I
Пример 2 Для иллюстрации эффективности добавления сероводорода в описанном выше реакторе подвергают реакции ПО г (из расчета на вес сухой золы) битуминозного угля с твердым NaHS (технический) или KHS (в виде водного раствора) с введением в реактор сероводорода с расходом 80 мл/мин (и 200 мл гелия).
Реакция преобретает экзотермический
режим также при температуре свыше 390РС.
Для осуществления способа необходимо 3 моль сероводорода на 1 моль образующегося . Кроме того, используется 48 г кислорода (из угля) при образовании I моль ,
В древесине содержится примерно 42%, а в антраците - примерно 2% кислорода. Максимальное количество добавляемого сероводорода обусловле- но указанными пределами с учетом количества, необходимого для целевой и других реакций, которые могут иметь место. На практике используют меньшие количества сероводорода, так как принципиально возможна побочная реакция двух атомов водорода с кислородом с образованием воды.
0
В случае использования KHS и/или NaHS получают значительные количест ва газов, реакция становится экзотермической при 390вС. При использовании K.SHjO + KZS (эмпирическое выражение, полученное при использовании эквимолярных количеств ) получают небольшие количества газов и значительные количества жидкого конденсата из того же исходного мате риала, однако при этом реакция ста новится экзотермической с чала, т.е. .
способа протекать самопроизвольно при температуре 390°С при очень незначительной подаче тепла извне. KjSj (полученный из расплава К S-51UO и серы) смешивают с эквивалентным количеством (полученного из вод-
0
самого на- примерно при 50 С, и
5
15
него раствора KDH и серы, взятых в соотношении 6КОН + 4S) и используют в качестве реагента, получая в резул тате жидкий дистиллят и газ. Реакция становится экзотермической при 240°С Во всех трех отмеченных случаях в качестве исходного материала используют битуминозный уголь Кентукки № 9 с размером частиц 200 меш, а условия осуществления реакции, за исключенн- ем оговоренных, идентичны, Tie пар, сероводород и гелий используют так же, как было указано ранее
Приведенные выше примеры под-
тверждают возможность получения газа газа и дистиллятов и только дистил- лятов, кроме того, они иллюстрируют преимущества экзотермической реакции В процессе протекания экзотермичес- кой реакции образуются довольно малые количества СО и 002 В газовом потоке после выхода из скруббера сероуглерод не зарегистрирован Оче- видно, что при этом не образуется и COS.
Сказанное выше иллюстрируется следующими примерами
Пример .3. Используют еле- дующие реагенты вместе с углем Кен- тукки № 9:
(1)K2S « 5НгО + S Теоретически:
KЈS2 (К S + К S $
(2)Два слоя: (4S)x(0,83) +6KOH (водный).
При приготовлении реагента используют по 1/2 моль каждого из компонентов (1)и(2)..г
Результаты анализа угля приведены ниже.
Состав необработанного угля Кентукки № 9, %:
Влага2,58
Зола8,52
Летучие ком
поненты35,36
Углерод (фиксированный)53,54 Сера 2,62 Теплота сгорания, ккал/кг 7201 Углерод 71,60 Водород 4,87 Азот 1,59 Кислород 8,22 Хлориды 0,22 Конечный состав золы, %:
ь . JQ
f5
, 20 25
30
40
45
JQ
642955|6
Двуокись кремния54,15
Окись алюминия24,79
Окись железа (III)1 3; 72
Окись титана1,69
Окись кальция0,72
Окись магния0,85
Окись натрия0,35
Окись калия2,44
Окись лития0,0135
Пятиокись фосфора0,38
35
Характеристика продукта, полученного после реакции: Градусов API при 15,5°С16,9
Удельный вес
при 15,5°С0,9530
Содержание серы, %0,17
Теплота сгорания, ккал/кг10088
Содержание, %:
Углерод88,62
Водород10,19
Сера0,17
Азот0,19
Кислород0,83
Разгонка полученного продукта дала следующие результаты: Начальная температура кипения, °С
По фракциям,°С:
5%
10%
20%
30%
40%
50%
60%
70%
55
172
227 252 255 265 276 281 284 303 321
90%354
95% 37
Конечная температура кипения,°С377 Выделение фракции, % 96,0 Остаток, % 3,7 Потери, % 0,3 Результаты анализа дистиллята (фракции 0-50%): Градусов API при 15,5°С 20,9 Удельный вес
при 15,5°С0,9287
Содержание серы, %0,15
Теплота сгорания, ккал/кг10391
Содержание, %:
17
87,17
10,08
0,15
0,18
2,42
Результаты анализа дистиллята (фракции с 50% до конца отгонки):
Градусов API при
15,5°С16,4
Удельный вес
при 15,5°С0,9568
Содержание серы, %0,14
Теплота сгорания,
ккал/кг10314
Содержание, %:
Углерод90,45
Водород8,47
Сера0,14
Азот0,31
Кислород0,63
Пример 3 иллюстрирует типичные ре зультаты повышения ценности угля и его превращения в жидкие продукты.
Пример 4 Реагент, содержа- щий 0,25 г гидросульфида калия на миллилитр, смешали с элементарной серой 100 мл раствора этилового спита гидросульфида калия смешали с 8 г элементарной серы. Элементарную серу добавили к 50 г бурого угля, содержа щего 44% углерода, 2,68% водорода, 33% воды, 12% кислорода, 2% азота и 0,5% серы. Содержание золы (золь- ность) составило 6%.
Уголь и реагент смешали в реакционной колбе и перемешали при помо- щи магнитной мешалки. Максимальный размер частиц угля составил 1/4 меш.
Температуру повысили до 78°С, а затем до 95°С. Этиловый спирт подвергли дистилляции и конденсации в водоохлаждаемом конденсаторе и собрали в конденсационной колбе с бюреткой-краном на днище Этанольная част реагента перед добавлением серы составляла 72-/890ИОО или 80,09 мл возможного дистиллята этилового спирта (этанола). Определены и выделены 64 мл главным образом дистиллята этилового спирта.
Конденсационная колба позволила несконденсированным газам пройти в раствор гидрата окиси калия в этиловом спирте и раствор гидрата оки си натрия в воде Из раствора гидрата окиси натрия газы поступили в газо- вый хроматограф, затем прошли через .
64295518
расходомер и были направлены в вытяжной шкаф.
Перед началом опыта систему продули азотом Сероводород, выделенный в ходе реакции взаимодействия элементарной серы и гидросульфида калия в этиловом спирте, составил 7080 см3(7500 смЪ). Сероводород был поглощен раствором гидрата окиси калия в этиловом спирте При помощи расходомера измерен объем азота, вытесненного при выделении сероводорода.
В систему ввели при температуре
о,
10
15
20
25
35
105 С водяной пар, полученный путем кипячения 200 мл воды и пропускания водяного пара через трубку, обогреваемую нагревательной лентой, в основание реакционной колбы, в которой находились уголь и реагент Температура водяного пара составила 140°С, а реакционной колбы - 105°С и была снижена до Через несколько минут температура начала медленно повышаться. Когда она достигла 220, на расходомере было зарегистрировано дополнительно 3000 см потока При температуре 220-270°С на расходомере было зарегистрировано 2832 см 30 (30000 см ) газового потока, при температуре 270-320°С - 20256 см3 (24000 см) потока. В диапазоне 360- 400°С трубка с-внутренним диаметрпм 6 мм, отведенная в вытяжной шкаф, при периодическом зажигании могла поддерживать пламя, которое не могло быть задуто и имело яркий голубой цвет.
Опыт продолжался в течение 2 ч с момента начала подачи водяного пара в систему при температуре 105°С Через 2 ч в реакционной колбе оставалась 1/4 часть угля, представлявшая собой углеродсодержащий материал, который не содержал ни золу, ни вОду исходного образца
Экстракция карбонатного материала при промывке гидрата окиси калия и натрия показала, что при образовании карбонатов использовано углерода.
Газовый анализ указал на наличие смеси предельных и непредельных углеводородов с присутствием водорода.
Пример 5. 100 г бурого угля, содержащего 44% углерода, 33% воды, 12% кислорода, 2,8% водорода, 1,6% азота, 0,6% серы, смешали с 16 г
40
45
50
55
элементарной серы, после чего ввели в контакт с 200 мл гидросульфида калия в растворе этилового спирта; содержащем 0,24 г гидросульфида ка- лия на миллилитр раствора
Полученные в этом примере газы охлаждали до температуры окружающей среды, пропустили через 1 моль хлористого калия в 225 мл воды, затем через 3/4 моль хлорного железа (III в 300 мл воды, затем через сборную трубку газового хроматографа, а затем через расходомер. После этого гзы пропустили через стеклянную труб внутренним диаметром 8 мм и вывели 1 вытяжной шкаф.
Реакционную колбу с содержащимся в ней бурым углем и реагентом нагрели на горячей плите-мешалке. Стек лянной трубой соединили реакционную колбу с другой колбой, в которой находилось 300 мл кипящей воды. Соединительную трубку обмотали нагревательной лентой для перегрева водяного пара перед вводом его в донную часть реакционной колбы
Перед началом опыта систему продули азотом После реакции взаимодействия элементарной серы и реагента - гидросульфида калия - расходомер зарегистрировал 7080 м3(7500 см
Температуру в реакционной колбе повысили до 135°С с целью отгонки этилового спирта и снижения содержания воды в буром угле. При температуре 170°С получен темно-коричневый тяжелый дистиллят, который оставался в наиболее близкой к реакционной колбе части водоохлаждаемог конденсатора Водный конденсат имел янтарный цвет и запах непредельного углеводорода. Интенсивное газообразование началось при 220°С и продолжалось после . Пик газообразования наблюдался при 360-380°С.
Общее газообразование составило 303000 см Подвергнутые анализу газы представляли собой предельные и непредельные углеводороды с содержанием Cjj -Cg, Получен также водород Отводная трубка в вытяжной шкаф поддерживала непрерывное пламя. Через 4 ч в реакционной колбе осталось 3,5 г углеродсодержащего материала. Формула изобретени
0
водороды или летучие дистилляты, или их смеси путем взаимодействия угля, торфа или древесины и в каче- , стве реагента гидросульфида, сульфида или полисульфида щелочного металла, или их смесей, отлич а ю - щ и и с я тем, что, с целью повышения выхода продуктов и упрощения способа, реакцию конверсии осуществляют в присутствии воды или водяного пара и сероводорода, или серы при температуре 50-450°С в одну или несколько стадий, затем извлекают газообразные и жидкие углеводороды
5
0
0
$
0
4 Способ по .п.1, отличают щ и и с я тем, что щелочным металлом является натрий
6 Способ по п.1, отличающийся тем, что углем является бурый уголь, сублигнит, антрацит,
частично окисленный антрацит, битуминозный или полубитуминозный уголь.
7 Способ по п.1, отлич ающи и с я тем, что щелочным металлом является калий
8 Способ по , отлич ающи и с я тем, что часть дистиллята обрабатывают реагентом с более высоким содержанием серы в присутствии сероводорода
1 t т
Я, 5 Л, Ofiaten
при снижении температуры от 400 до 100° С.
C, Cz+jj t

| Сведения о прототипе заявителем не приведены | |||
| I |
Авторы
Даты
1991-04-15—Публикация
1981-04-14—Подача