Изобретение относится к электрохимическому анализу и может быть использовано для определения меди в разбавленных растворах, в том числе в сточных водах промышленных и сельскохозяйственных объектов, в пищевой промышленности и т.д.
К наиболее широко используемым для определения меди в разбавленных растворах методам относятся колориметрический диэтилдитиокарбаматный с пределом определения 10 М, предусматривающий применение токсичного реагента - хлороформа; полярографический с пределом определения 10 М, предусматривающий применение токсичного реагента - ртути; атомно-абсорбционный с пределом определения 10-10 М, осуществляемый на сложной дорогостоящей аппаратуре; потен- циометрический с медьселективным электродом с пределом определения 10 М; потенциометрический с платиновым индикаторным электродом с пределом определения .
Наиболее близким по технической сути к предлагаемому является потенциометрический метод с применением платинового индикаторного электрода и измерением ре- докс-потенциала в растворе, содержащем Kl.
Недостатком способа является относительно невысокая чувствительность определения меди.
Цель изобретения - повышение чувствительности и понижение предела определения.
Цель достигается путем введения в раствор роданид-иона, благодаря чему образуется редокс-система, потенциал которой изменяется с изменением концентрации меди. При .этом величина электродной функции достигает 50 мВ/pCU (выше, чем в известном способе), т.е. значительно увеличивается чувствительность. Нижний
44
га
00
о ю ю
«шс&
,-7
предел определения - 10 М значительно меньше, чем в известном способе ( М),
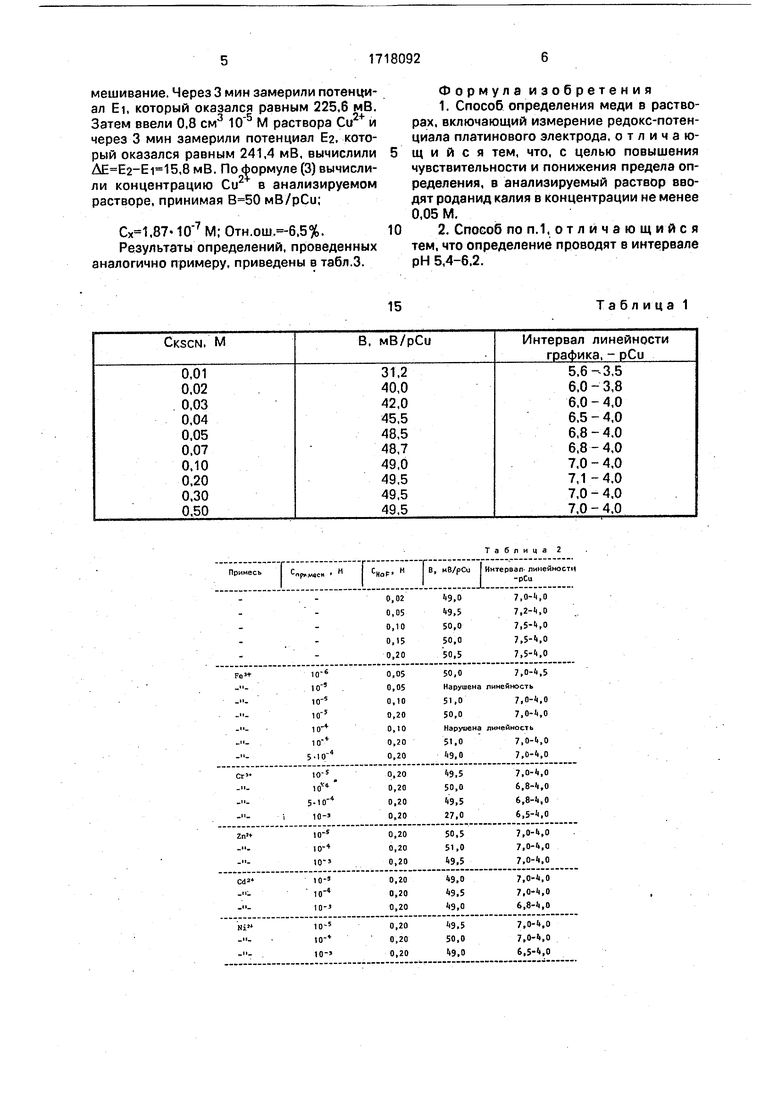
Экспериментально показано, что наилучшие характеристики калибровочного графика Си в роданидных растворах получаются в интервале рН 5,4-6,2. Граничные значения концентрации KSCN определены по результатам, приведенным в табл.1. Как следует из таблицы 1, наибольшие значения электродной функции и интервала линейности графика получаются при концентрации роданида выше 0,05 М. Таким образом, граничное значение концентрации KSCN - 0.05М. Значение электродной функции в этих условиях 49± 0,5 мВ/рСи, интервал линейности 7-4 - рСи.
Поскольку в анализируемых объектах часто присутствует Fe , для маскировки его вводили NaF в пределах 0,05-0,2 М в зависимости от содержания железа. В присутствии NaF интервал линейности калибровочного графика меди расширяется до 3- М (,5), а электродная функция увеличивается до 50±0,5 мВ/pCu Стабл.2).
Примеси Zn2, Cd2+, Ni2+, Fe3+, Cr3+ в количествах М практически не влияют на ход калибровочного графика меди. Варьируя объемы проб анализируемого раствора, можно определить концентрацию меди в интервале 10-10 М в присутствии 1000- кратного избытка примесей.
В табл.1 приведена зависимость наклона и интервала линейности калибровочного графика меди от концентрации роданид- иона (рН 5,6-5,8).
Зависимость наклона и интервала линейности калибровочного графика меди от концентрации NaF и примесей (Скзсы 0,1 М, ,6-5,8) приведена-в табл. 2.
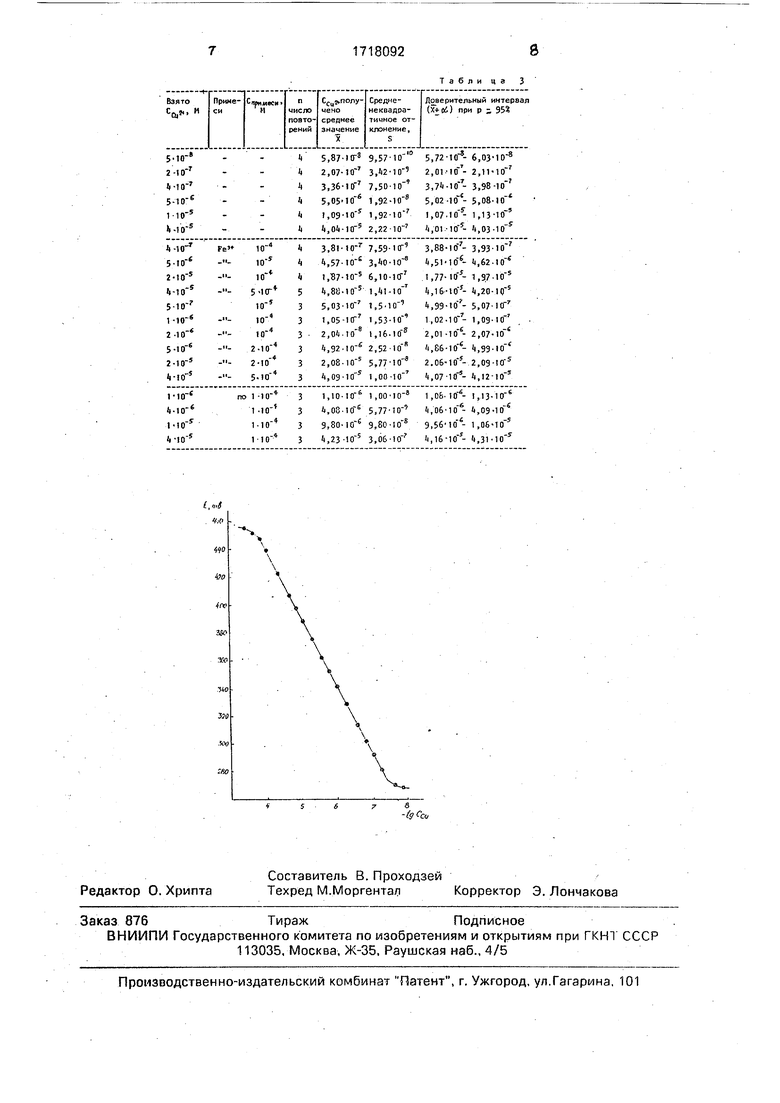
Наличие прямолинейного участка на калибровочном графике в интервале концентрации меди 4 М, наклон графика, приближающийся к теоретическому при одноэлектродной реакции, позволяют сделать следующие выводы о факторах, лежащих в основе способа: редокс- потенциал определяется парой Си2+/Си+; во всем указанном интервале концентрации меди степень протекания реакции
2Cu2++4SCN « ti CuSCN+SC№ (1)
незначительна; редокс-потенциал, благодаря незначительному смещению равновесия реакции (1) вправо, практически пропорционален исходной концентрации меди (И) в растворе:
Е Е°форм+В дСси2+ (2)
Несколько меньшая величина экспериментальной электродной функции («50 мВ/pCu) по сравнению с теоретической (59 мВ/pCu) обусловлена неполной обратимостью реакции.
Таким образом, по предлагаемому способу измеряется редокс-потенциал одно- электродной системы Cu2+/Cu+ электродная функция которой равна -50
мВ/pCu, т.е. в 1,7 раза больше, чем в известном случае, а следовательно, и чувствительность определения в 1,7 раза выше. Нижний предел определения меди понижен на два порядка.
Способ осуществляется следующим образом.
В мерную колбу на 50 см3 помещают определенный объем анализируемого раствора ( 40см из расчета, что общая концентрация будет в интервале М, а
суммарная концентрация примесей не пре высит 5 М. Вводят 5 см3 буферного
ацетатного раствора (HAc+NaOH) до рН 5,65,8: 0,5-2,0 см3 5 М раствора KSCN; 0,5-2,0
см 5 М раствора NaF, доводят водой до метки и переносят в стаканчик на 100 см , погружают в раствор платиновый электрод (точеный или пластину) и хлорсеребряный электрод сравнения, подключают к мономеру,
включают перемешивание и через три минуты замеряют потенциал EL Затем вводят определенный объем стандартного раствора Си + и через 3 мин замеряют потенциал Ё2- Концентрацию Си + в анализируемом растворе вычисляют по известной формуле
V,
ст
VX(10
ДЕ/В
-1)
(3)
где С - концентрация Си2+ в анализируемом растворе, М;
Сет - концентрация Си24 в стандартном растворе, М;
Vx-обьем анализируемого раствора, см3;
VCT - объем стандартного раствора, см3;
AE E2-Ei, мВ;
В - электродная функция, эксперимен- тально определяемая для каждой серии опытов, мВ/рСи.
Пример1.В мерную колбу на 50 см3 поместили 40 см3 раствора, содержащего 2- М Си2+ и М Fe3. Ввели 5 см3 буферного ацетатного раствора до рН 5,6- 5,8; 1 см3 5 М раствора KSCN, 2 см3 5 М раствора NaF, довели дистиллированной водой до метки, перенесли в стаканчик на 100 см3, туда же опустили якорек магнитной мешалки и электроды, включили перемешивзние. Через 3 мин замерили потенциал EI, который оказался равным 225,6 мВ. Затем ввели 0,8 см3 М раствора Си2+ и через 3 мин замерили потенциал Е2, который оказался равным 241,4 мВ, вычислили AE E2-Ei 15,8 мВ. По формуле (3) вычислили концентрацию Си2 в анализируемом растворе, принимая мВ/рСи;
.87107 М; Отн.ош.-6,5%. Результаты определений, проведенных аналогично примеру, приведены в табл.3.
0
Формула изобретения
1.Способ определения меди в растворах, включающий измерение редокс-потен- циала платинового электрода, о т л и ч a rout и и с я тем, что, с целью повышения чувствительности и понижения предела определения, в анализируемый раствор вводят роданид калия в концентрации не менее 0,05 М.
2.Способ по п. 1,отличающийся тем, что определение проводят в интервале рН 5,4-6.2.

| название | год | авторы | номер документа |
|---|---|---|---|
| Способ определения меди в растворах | 1989 |
|
SU1702282A1 |
| Способ определения иодидов в присутствии хлор-ионов, например, в поваренной соли | 1989 |
|
SU1762212A1 |
| Способ потенциометрического определения иодидов | 1984 |
|
SU1190249A1 |
| СПОСОБ ВОЛЬТАМПЕРОМЕТРИЧЕСКОГО ОПРЕДЕЛЕНИЯ КОНЦЕНТРАЦИИ ИОНОВ КОБАЛЬТА (II) В РАСТВОРАХ СУЛЬФАТА ЦИНКА | 2001 |
|
RU2216014C2 |
| Состав мембраны ионоселективного электрода для определения активности ионов рубидия | 1983 |
|
SU1133535A1 |
| Способ вольтамперометрического определения концентрации никеля в растворах сульфата цинка | 1991 |
|
SU1777065A1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ ВИТАМИНА В6 В БИОЛОГИЧЕСКИ АКТИВНЫХ ДОБАВКАХ | 2006 |
|
RU2322665C2 |
| Способ вольтамперометрического определения ионов тербия в водных растворах | 1990 |
|
SU1818580A1 |
| Способ определения концентрации общих и сахарных редуцирующих веществ в технологических растворах производств химической переработки растительного сырья | 1990 |
|
SU1742705A1 |
| Способ определения хлорсульфурона | 1988 |
|
SU1644017A1 |
Изобретение относится к электрохимическому анализу и может быть использовано для контроля несущих концентраций меди ( М) в сточных водах промышленных и сельскохозяйственных объектов и т.д. Способ основан на измерении редокс- потенциала одноэлектронной системы Cu2l7Cu+ в растворе, содержащем роданид-ион в концентрации не менее 0,05 М в интервале ,4-6,2 с применением индифферентного индикаторного электрода. Способ позволяет определять концентрацию меди в присутствии 1000-кратного избытка Zn2+, Cd2+. Ni2+, Fe34, Cr3+ 1з.п. ф-лы, 3 табл., 1 ил.
15
Таблица 1
Таблица 2
Т а б л и ц а
| Гуськова В.П | |||
| и др | |||
| ЖАХ, 1988, т | |||
| Зубчатое колесо со сменным зубчатым ободом | 1922 |
|
SU43A1 |
| Способ определения меди в растворах | 1987 |
|
SU1617354A1 |
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
Авторы
Даты
1992-03-07—Публикация
1989-11-28—Подача