Изобретение относится к биотехнологии и предназначено для производства монокло- нальных антител (МКАТ) против эпсилон-цепи иммуноглобулина Е (IgE), которые используются в иммунохймической диагностике аллергических заболеваний человека.
Содержание IgE в крови человека в 10- 50 тыс. раз меньше уровня иммуноглобулинов других классов (IgA, IgG, IgMJ. Селективность и чувствительность современных методов выявления аллергенспеци- фических lgE-антител (аллергосорбентный тест) или определения общего содержания IgE (двухдетерминатный иммунометриче- ский тест) обеспечиваются реализацией принципа твердофазного иммуноанализа, согласно которому IgE, содержащийся в исследуемом образце, связывается иммобилизованным на твердой фазе аллергеном или МКАТ, направленными к одной из антигенных детерминат эпсилон-цепи, после чего сформированный на твердой фазе иммунный комплекс выявляется с помощью вторых МКАТ, несущих ферментную, изотопную или флуоресцентную метку.
В связи с этим МКАТ, предназначенные для использования в аллергодиагностиче- ских методах твердофазного иммуноанализа, подвергаются отбору по критерию сохранения функциональной активности при иммобилизации на твердой фазе и при ковалентном связывании с маркерными молекулами. Кроме того, при этом отбирают МКАТ, специфичные к антигенным участкам эпсилон-цепи, которые, во-первых, не маскируются при формировании комплекса ал- лерген-lgE, а во-вторых, пространственно удалены друг от друга, что исключает конкуренцию между ними за связывание IgE при постановке двухдетерминантного иммуно- метрического теста. Перспективными для практического применения считаются
в
Х|
Ь
МКАТ, обладающие одним или несколькими из перечисленных свойств,
Известны гибридомные штаммы, вырабатывающие МКАТ против IgE человека табл, 1).
В числе аналогов описано семейство гибридомных клонов, при получении которых реализованы упомянутые выше принципы отбора продуцентов. Гибридомы получены на основе миеломной линии РЗХ63. Ад8.653 и лимфоцитов мышей линии BALB/C, иммуизированныхмиеломным IgE еловека. Пять штаммов этого семейства продуцируют МКАТ, относящиеся к lgG1, продукты двух других штаммов относятся к lgG2a. Среди описывземх штаммов большинство продуцирует МКАТ, которые взаиодействуют как с гомогенным (миеломным), ак и с поликлональным IgE человека, т.е. пецифичны к константным эпитопам молекул IgE. Продукты двух штаммов сохраняют нтигенсвязывающую активность при иммобилизации на твердой фазе. МКАТ, способных выявлять аллерген специфические lgE-антитела или служить основой меченого реагента для двухдетерминантного опредеения концентрации IgE, среди продуктов анного семейства гибридом не описано.
Недостаток известных гибридов состот в том, что для их получения в качестве родительских клеток использованы миелом- ные клеточные линии с низкой автономнотью роста, требующие для размножения ростовых факторов эмбриональной сыворотки, Высокая зависимость от ростовых факторов ограничивает возможности эксплуатации таких гибридом в качестве производственных штаммов, особенно при использовании метода массового культивирования в ферментерах, а также может служить причиной их недостаточной стабильности.
Цель изобретения - получение гибри- домного штамма, который не требует для размножения ростовых факторов эмбриональной сыворотки, синтезирует МКАТ, пригодные для выявления общего IgE и фракции аллергенспецифических IgE в сыворотке крови человека.
Поставленная цель достигается использование при получении гибридом клеток ми- еломного штамма 653.А (ВСКК/П/М7Д), размножение которого не требует ростовых факторе эмбриональной сыворотки, а также отбором среди полученных гибридом штамма Е/4Ф4, синтзирующего МКАТ, которые сохраняют антигенсвязывающую активность при иммобилизации на твердой фазе и при присоединении ферментной метки и направлены к антигенной детерминанте, экспрессированной как на свободном IgE. так и на IgE, связанном в иммунном комплексе с аллергеном.
Описываемый штамм Е/4Ф4 подобно
известному синтезирует МКАТ, специфичные к константной области эпсилон-цепи IgE человека и способные при адсорбции на твердой фазе извлекать IgE из раствора. Штамм Е/4Ф4 получен на основе мие0 ломной клеточной линии 653. А и не требует для размножения ростовых факторов эмбриональной сыворотки. Синтезируемые штаммом Е/4Ф4 МКАТ в составе конъюгата с ферментом позволяют выявлять аллерген5 специфические lgE-антитела, а также определять общее содержание IgE с помощью двухдетерминантного иммунометрического теста.
Кроме того, предлагаемый штамм отли0 чается от известного генотипом животных- доноров иммунных лимфоцитов (мыши линии SJL/J).
Штамм депонирован в ВСКК(П) под номером 402Д. Штамму присвоено наимено5 вание РИ-8-Е/4Ф4.
Получение гибридомного штамма. Донорами иммунных лимфоцитов служили мыши-самцы линии SJL/J, которых иммунизировали дважды с интервалом 1
0 нед. подкожно препаратом миеломного lgE/L(40 мкг) в полном адьюванте Фрейнда, на 11-й и 12-й дни после этого давали бустер-иммунизации внутрибрюшинно по 10 кг IgE в физиологическом растворе. Спленоци5 ты для слияния получали через 24 ч после последней бустер-иммунизации от мышей, у которых титр антиЧдЕ-антител превышал 1:20000. Партнерами для гибридизации служили клетки миеломного штамма 653.А,
0 выращенные на питательной среде, содержащей модифицированную Дюльбекко среду Игла (90%) и сыворотку крупного рогато го скота (10%). Для слияния использовали 100 млн клеток селезенки и 50 млн
5 клеток миеломы. Смесь клеток обрабатывали раствором полиэтиленгликоля (50%) с мол. м. 1000. Для выращивания гибридов использовали питающий слой из перитоне- альных макрофагов мышей и питательную
0 среду указанного состава, содержащую, мкг на 100 мл: аминоптерин 10; гипоксантин 500; тимидин 500.
Отбор и тестирование культуральных надосадков проводили трижды с 11-го по
5 28-й дни после слияния. Выявление МКАТ, специфичных к констан тной области эпсилон-цепи, вели с помощью твердофазного иммуноферментного анализа аналогично известному способу используя в качестве антигенов миеломные IgE, препараты IgG,
IgM, а также легкие цепи иммуноглобулинов человека каппа- и лямбда-типов (табл. 2).
Из 480 первичных культур 12 синтезировали антитепа, связывающиеся с IgE/L- иммуногеном. Среди них одна культура, продуцировала антитела, направленные к легкой цепи каппа-типа. Продукты синтеза пяти культур связывались с 1дЕ/1 -иммуно- геном, но не реагировали с миеломным lgE/Ю. Наконец, шесть культур синтезировали антитела, взаимодействующие как с IgE/L, так и с lgE/Ю. Эти шесть культур, обозначенные как семейство гибридомРИ- 8. были подвергнуты дальнейшему изучению.
Гибридомы клонировали 2-4 раза методом лимитирующих разведений на питающем слое из перитонеальных макрофагов мышей. Клоны, которые при двух последовательных клонированиях с плотностью посева 1 клетка на 1 или 2 ячейки давали более 95% субклонов, синтезирующих анти-lgE- антитела, переводили в массовую культуру. Выращенные в культуре клетки прививали внутрибрюшинно гистосовместимым мышам (по 5 млн клеток на мышь), которым за 7-18 дней до этого также внутрибрюшинно был введен пристан (по 0,5 мл).
От мышей с растущими опухолями на 14-21-й дни получали асцитические жидкости. МКАТ из асцитов адсорбировали на твердой фазе и исследовали их способность связывать IgE из раствора. Заменяя растворы IgE на образцы сыворотки крови здоровых людей и больных аллергией, выявляли МКАТ, которые связывают поликло- нальный сывороточный IgE, т.е. специфичны к константным эпитопам эпсилон-цепи. Таким образом было отобрано пять клонов, продуцирующих МКАТ, удовлетворяющих критериям селекции.
МКАТ, прошедшие предыдущие ступени отбора, исследовали на способность сохранять, иммунологическую активность при присоединении ферментной метки. Для этого МКАТ из асцитических жидкостей выделяли осаждением сульфатом аммония и методом периодатного окисления к ним присоединяли фермент - пероксидазу хрена. Иммунологическую активность полученных коньюгатов исследовали в твердофазном иммуноанализе, адсорбируя на твердой фазе миеломный tgE. Продукты всех пяти клонов после присоединения ферментной метки сохраняли антиген-связыва- ющую активность.
Способность МКАТ, меченных ферментом, выявлять аллергенспецифическую фракцию IgE, оценивали с помощью аллер- госорбентного теста. В качестве антигена
использовали экстракт пыльцы березы, IgE- антитела выявляли в стандартных сыворотках А, В, С и D, прилагаемых к набору ФАДЕЗИМ (Швеция). МКАТ клона 4Ф4,
коньюгированные с пероксидазой, выявляли фракцию IgE, специфичного к аллергену. МКАТ других клонов распознавали эпитопы, которые не экспрессируются на молекулах IgE, входящих в комплекс с аллергеном, и в
0 силу этого неэффективны в аллергосорбен- тном тесте.
Подбор антител для двухдетерминант- ного иммунометрического теста определения IgE проводили, испытывая поочередно
5 сорбированныена твердую фазу МКАТ в качестве подложки и меченные ферментом МКАТ в качеств выявляющих реагентов (табл. 3). Найдено несколько сочетаний иммобилизованных и меченных МКАТ, позво0 ляющих определять IgE в сыворотке крови. Оптимальный результат получен при захвате IgE адсорбированными на твердой фазе МКАТ клона Е/5Д4 и выявлении фиксированного в комплексе IgE с помощью мечен5 ных пероксидазой МКАТ клона Е/4Ф4. Удовлетворительный результат был получен также при использовании МКАТ Е/4Ф4 в качестве иммобилизованного на1 твердой фазе lgE-связывающего реагента.
0 Таким образом, в результате ступенчатого отбора был получен штамм Е/4Ф4, который обладает необходимой совокупностью свойств, т.е. способностью расти на среде, не содержащей эмбриональной сыворотки,
5 и продуцировать МКАТ. пригодные для определения содержания IgE в двухдетерми- нантном иммуноанализе в качестве меченого или иммобилизованного на твердой фазе lgE-связующего реагента, а также
0 для выделения lgE-антител в аллергосор- бентном тесте.
Характеристика штамма. Штамм Е/4Ф4 принадлежит к семейству гибридом РИ-8.
5 С момента получения из родительских клеток штамм прошел 23 пассажа в культуре, включая 3 цикла клонирования методом лимитирующих разведений на питающем слое из макрофагов мышей.
0
Стандартными условиями культивирования являются следующие: питательная среда состоит из среды Игла в оригинальной прописи или в модификации Дюльбекко
5 (90%) и сыворотки крупного рогатого скота (10%). Клетки выращивают при 37°С в герметично закрытых флаконах или в открытой системе - в планшетах, чашках Петри или флаконах в атмосфере с 7,5% углекислоты в воздухе при 100% влажности.
Оптимальная посевная доза составляет 200 тыс, клеток в 1 мл среды. Для поддержания клеток в пролиферирующем состоянии их рассевают 2 раза в неделю с коэффициентом 1:4-1:5 при использовании стандартного состава ростовой среды. Клетки сохраняют способность к пролиферации при снижении содержания сыворотки до 2,5%, при этом кратность рассева составляет 1:2, Максимальная плотность культуры с сохранением жизнеспособности 1.2-1,4 млн клеток в 1 мл.
Культура описываемого штамма представляет взвесь одиночных округлых прозрачных клеток, встречаются агрегаты из четырех или более клеток, которые легко суспендируются пипетированием,
Культура штамма Е/4Ф4, постоянно выращиваемая без антибиотиков, не содержит бактерий, грибов, дрожжей и микоплазмы.
Клетки штамма перевивают в виде асци- тических или солидных опухолей (в зависимости от способа прививки) на гистосовмес- тимых мышах-гибридах F1 (SJL/JxBALB/c). При внутрибрюшинной прививке 5 млн клеток животным в возрасте 1,5-3 мес, предоб- работанным за 7-18 дней до этого внутрибрюшинным введением пристана, асцит развивается в течение 14-21 дня. От одной мыши получают при первой пункции 4-10 мл, суммарно в результате повторных пункций от одного животного получают 7- 20 мл асцита.
Маркерные признаки штамма:
штамм синтезируют МКАТ против IgE человека, антитела выявляются в культу- ральной жидкости при поддержании клеток in vitro и в сыворотке или в асцитической жидкости при прививке животным;
штамм обладает онкогенностью, которая выражается в росте солидных или асци- тических опухолей у гистосовместимых мышей-гибридов F1(SJL/JxBALB/c) при прививке им клеток гибридомы.
Характеристика МКАТ, продуцируемых штаммов гибридомы Е/4Ф4,
Клетки гибридомы продуцируют МКАТ субкласса lgG2a. Антитела специфичны к константной области эпсилон цепи IgE человека. Специфичность МКАТ может быть проверена в твердофазном иммунофермен- тном анализе с помощью IgE, адсорбированного на твердой фазе. МКАТ связываются с белком /& стафилококка, что может быть использовано при их очистке. При адсорбции на твердой фазе МКАТ способны связывать сывороточный IgE и мог/т использоваться в качестве захватывающих антител в системе двухдетерминантного иммуноанализа (в паре с мечеными IgE специфичными антителами) или при афинном извлечении IgE из сывороточных препаратов. МКАТ Е/4Ф4, сохраняя антигенраспознающие свойства после присоединения ферментной метки,
могут также служить выявлющим реагентом в двухдетерминантном иммуноанализе для определения концентрации IgE, а также для выявления фракции аллергенспецифическо- го IgE с помощью аллергосорбентного тес0 та.
Продуцируемый штаммом иммуноглобулин выявляется в культуральной среде при культивировании клеток. Обратный титр МКАТ в переросших культурах при вы5 ращивании клеток в стандартных условия составляет 3000-2400. Такой же титр может быть получен при снижении содержания сыворотки в ростовой среде с 10 до 1,2 %. При росте гибридомных клеток в мышах обрат0 ный титр МКАТ в асцитической жидкости составляет 0,1-6 млн. Среднее содержание иммуноглобулина в асците составляет 10 мг/мл.
Стабильность продукции МКАТ оцени5 вали при пассировании клеток на мышах в течение 8 пассажей. За этот период клетки сохраняли исходную продуктивность. В культуре сохранение уровня МКАТ прослежено в течение 18 пассажей.
0 Условия криоконсервации.
Криосреда состоит из 45% среды Игла, 45% сыворотки крови крупного рогатого скота и 10% диметилсульфоксида. Ампулы, содержащие 1-10 млн клеток в криосреде,
5 помещают в пенопластовый контейнер с толщиной стенок 1,5 см и выдерживают в нем при -70°С в течение суток, затем хранят при той же температуре или переносят в жидкий азот. Для размораживания клеток
0 ампулы извлекают из низкотемпературного хранилища и на 3 мин погружают в воду с температурой 40° С. Затем центрифугируют 3 мин при 1000 об/мин, убирают надосадок, а клетки суспендируют в ростовой среде и
5 рассевают в платы при концентрации 500 тыс. клеток в 1 мл. Жизнеспособность клеток после криоконсервации составляет 70- 80% по данным пробы с 05%-ным трипановым синим. Через 1 сут клетки по0 вторно рассевают с концентрацией 200 тыс. клеток в 1 мл ростовой среды.
В табл. 1 приведены гибридомные штаммы-продуценты МКАТ против IgE человека, в табл. 2 - результат тестирования
5 специфичности антител, продуцируемых первичными культурами гибридом, в табл. 3 - выявление IgE с помощью двухдетерминантного твердофазного иммунофермент- ного анализа, в табл. 4 - титры МКАТ, продуцируемых клетками штамма 8Е/4Ф4
при выращивании в среде с низким содержанием сыворотки, в табл 5 - титры МКАТ, продуцируемых клетками штамма Е/4Ф4, в культуральной среде и в асцитической жидкости, в табл. 6 - содерджание IgE в образцах сыворотки крови человека, определенное в двухдетерминантном иммунометрическом тесте с помощью меченых МКАТ Е/4Ф4, в табл. 7 - содержание IgE в образцах сыворотки крови человека, определенное в двухдетерминантном иммунометрическом тесте с помощью МКАТ Е/4Ф4, иммобилизованных на твердой фазе, в табл. 8 - выявление lgE-антител против амброзии в аллергосор- бентном тесте с помощью меченых МКАТ Е/4Ф4, в табл. 9 - результаты выявления IgE с помощью двухдетерминантного имму- нометрического теста, в табл. 10 - выявления аллергенспецифического IgE с помощью аллерго-сорбентного теста.
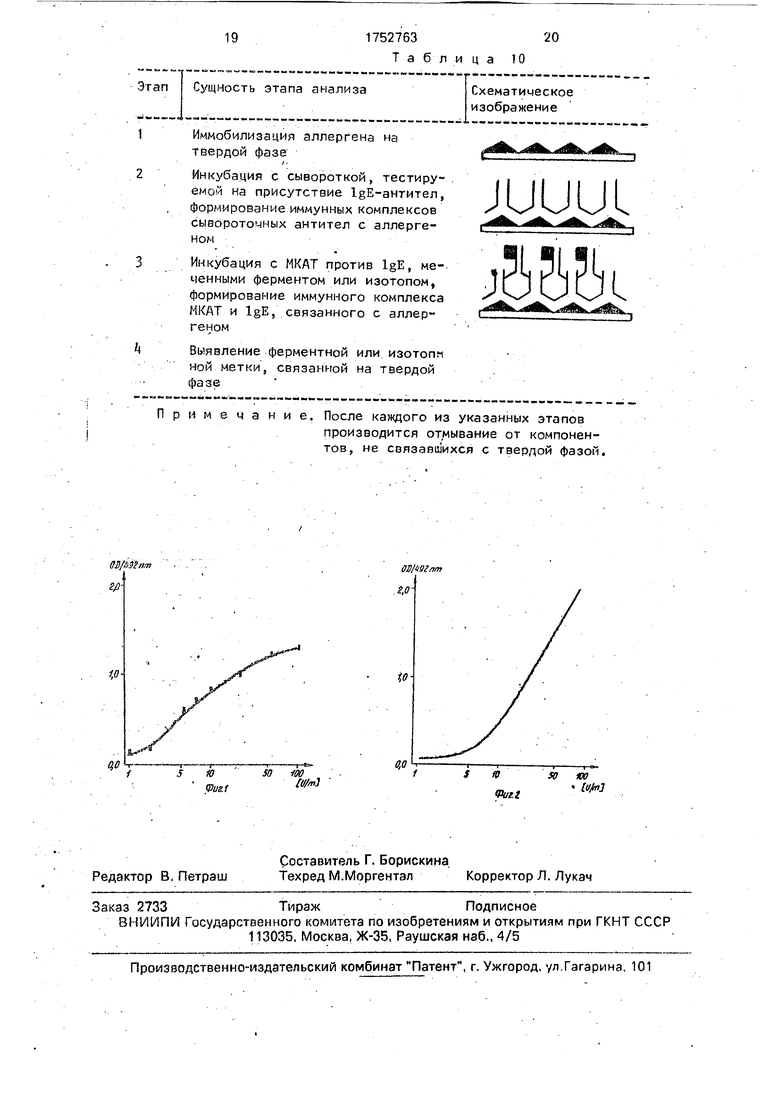
На фиг. 1 дана калибровочная кривая для определения содержания IgE в сыворотке крови человека в двухдетерминантном иммунометрическом тесте с помощью меченых МКАТ Е/4Ф4; на фиг. 2 - калибровочная кривая для определения содержания IgE в сыворотке крови человека в двухдетерминантном иммунометрическом тесте с помощью МКАТ Е/4Ф4, иммобилизованных на твердой фазе.
П р и м е р 1. Выращивание культуры гибридомы для последующей прививки мышам.
Посевным материалом служат гибри- домные клетки, хранящиеся в жидком азоте. Для размораживания пробирку, содержащую 5 млн клеток, извлекают из сосуда с жидким азотом, погружают на 3 мин в воду с температурой 40°С, после полного оттаивания пробирку центрифугируют 3 мин при 1000 об/мин, удаляют надосадок, клетки ре- суспендируют в 10 мл ростовой среды (модифицированная Дюльбекко среда Игла 90%, сыворотка крупного рогатого скота 10%) и помещают в культуральный флакон (объем 25 мл). Флакон помещают в инкубатор с температурой 37°С, 100% влажности и 7,5% углекислоты в воздухе. Через 1 сут проводят визуальный контроль состояния клеток с помощью инвертированного микроскопа и к содержимому флакона прибавляют 15 мл ростовой среды. На 4-е сутки после размораживания клетки пересевают в разведении 1:5 и переносят во флакон объемом 250 мл. Через 2 сут берут пробу для подсчета клеток -- в 1 мл суспензии содержится 800 тыс. гибридомных клеток. Суммарное содержание клеток в культуре 120 мин, что составляет 24 прививочные дозы. Клетки осаждают центрифугироаани
ем (1000 об/мин, 20 мин), суспендируют в среде Хенкса и вводят по 5 млн в объеме 2 мл внутрибрюшинно мышам - межлинейным гибридам F1(SJL/JxBALB/c), получив- шим за 11 дней до прививки внутрибрю- шинную инъекцию пристана.
П р и м е р 2. Получение гибридомных асцитических жидкостей и выделение из них глобулиновой фракции, содержащей МКАТ.
0 Накопление асцита в брюшной полости мышей начинается на 11-й день после прививки клеток. На 14-й день проводится первая пункция. При этом от каждых 10 мышей получатот 45-50 мл асцита. На 17-й день
5 повторно пунктируют оставшихся в живых мышей и получают от них еще 40-45 мл асцита. К 20-му дню остается в живых 50% привитых мышей. В результате третьей пун кции от них получают 10-15 мл асцита. 060 щее количество асцита, получаемое от 10 мышей, составляет 105-110 мл. После образования фибринового сгустка и отделения его и клеточной массы с помощью центрифугирования из 110 мл асцита получают 100
5 мл надосадочной жидкости, из которой выделяют глобулиновую фракцию. Для этого к жидкости приливают по каплям в условиях непрерывного перемешивания равный объем насыщенного раствора сульфата ам0 мония с рН 7,0. Осадок отделяют центрифугированием (6000 об/мин, 15 мин), надосадок отбрасывают, а осадок растао- . ряют в дистиллированной воде, доводя объем раствора до исходного. Процедуру
5 высаливания повторяют, полученный осадок суспендируют в половинном объеме полунасыщенного сульфата аммония и в таком виде хранят при 4°С.
П р и м е р 3, Получение содержащих
0 МКАТ культуральных жидкостей при выращивании клеток гибридом на среде с низким содержанием сыворотки.
Источники клеток служит гибридомный штамм, хранящийся в жидком азоте. Клетки
5 размораживают и высевают, как описано в примере 1. Через 1 сут контролируют состояние клеток с помощью инвертированного микроскопа и определяют их содержание в культуре с помощью камеры Горяева. Сус0 пензия содержит 400 тыс. клеток в 1 мл. При первом пересеве к. 10 мл культуры добавляют 10 мл ростовой среды, содержащей 10% сыворотки. Через 1 сут культуру разделяют на две части: первую оставляют без
5 пересевов до перероста для определения титра МКАТ, к второй прибавляют 10 мл бессывороточной среды, в результате концентрация сыворотки снижается до 5%. Через 2 сут взвесь клеток, выросших на среде с 5% сыворотки, разделяют на три части,
Первую оставляют без рассева до перероста для определения титра МКАТ. Вторую часть четырехкратно пересевают на среде с 5% сыворотки (каждые 3 дня с коэффициентом 1:4) и затем оставляют до перероста для определения титра МКАТ. Третью часть пересевают с одновременным снижением концентрации сыворотки до 2,5%. На 3-й сутки культуру разделяют на две части: первую оставляют до перероста, во второй содержание сыворотки снижают до 1,25% и спустя 6 дней из нее берут пробу для определения титра МКАТ.
Данные определения титров МКАТ на всех стадиях процесса приведены в табл. А.
П р и м е р А. Определение титра мышиных антител против IgE человека.
Источником мышиных антител против IgE служат: сыворотка крови мышей, иммунизированных IgE человека; культуральная жидкость от растущих гибридомных клеток; асцитическая жидкость мышей с растущими гибридомными опухолями; глобулиновая фракция содержащих МКАТ асцитических жидкостей.
Титр антител против IgE человека определяют с помощью твердофазного иммуно- ферментного анализа. Реакцию проводят в четыре этапа. На всех этапах для промывания и разбавления реагентов используют раствор, содержащий 0,85% хлористого натрия, 0,01 М фосфатного буфера с рН 7,4 и 0,05% твина-20.
На первом этапе на твердую фазу адсорбируют антиген. Для этого в ячейки планшетов для иммуноанализа вносят по 100 мкл раствора, содержащего 10 мкг IgE/L в 1 мл карбонат-бикарбонатного буфера (0,01 М, рИ 9,5). Инкубируют не менее 10 ч при 4°С. Удаляют антиген из ячеек и однократно промывают. На втором этапе в лунках планшетов готовят серийные разведения исследуемых образцов объемом по 100 мкл, инкубируют 1 ч при 37°С, лунки освобождают от проб и трижды промывают.
На третьем этапе к связанным на твердой фазе мышиным антителам присоединяют меченые пероксидазой кроличьи антитела против иммуноглобулинов мышей, В лунки вносят по 100 мкл рабочего разведения конъюгата, инкубируют 45 мин при 37°С, удаляют конъюгат и 5-кратно промывают.
На последнем этапе с помощью цветной реакции выявляют активность перокси- дазы, связавшейся с твердой фазой. В лунки вносят по 100 мкл субстратной смеси (1 мг ортофенилендиамина и 2 мкл 33%-ной перекиси водорода в 10 мл 0,05 М цитратного буфера с рН 4,7), инкубируют 30 мин при
комнатной температуре в темноте и затем реакцию останавливают добавлением 50 мкл 2н серной кислоты, Оптическую плотность проб регистрируют на фотометре
Мультискан-МС при длине волны 492 нм. Результаты представлены в табл. 5.
П р и м е р 5. Использование МКАТ Е/4Ф4 в качестве меченого реагента для количественного определения содержания
0 IgE в сыворотке крови человека.
Концентрацию IgE в сыворотке крови определяют с помощью двухдетерминант- ного твердофазного иммуноанализа. Для захвата IgE из раствора служат иммобили5 зованные на твердой фазе lgE-специфич- ные поликлональные антитела, производимые НПО Аллерген, (г. Ставрополь) или моноклональные антитела, синтезируемые гибридомным клоном РИ-8Е/5Д4. МКАТ
0 8Е/4Ф4, меченые пероксидазой, используют для выявления IgE, включенного в иммунный комплекс. Реакцию проводят в полистироловых планшетах фирмы NUNC. Для разбавления реагентов и отмывания
5 планшетов от несвязавшихся компонентов используют раствор того же состава, что в примере 4.
На первом этапе в лунки планшета вносят раствор МКАТ 8Е/5Д4 или поликлональ0 ных антител, содержащий 5 мкг белка в 1 мл 0,01 М карбонат-бикарбонатного буфера, рН 9,5. Инкубируют в течение ночи при 4°С, затем раствор удаляют и лунки однократного промывают.
5 На втором этапе в лунки вносятобрэзцы исследуемых сывороток и растворы с известным содержанием IgE, предназначенные для построения калибровочной кривой (калибраторы фирмы Pharmacia). Инкубируют
0 при 37°С 1 ч, образцы удаляют и лунки трехкратно промывают.
На третьем этапе в лунки вносят рабочее разведение конъюгата, МКАТ Е/4Ф4 с пероксидазой, инкубируют 1 ч при 37°С,
5 раствор удаляют, планшет промывают пятикратно.
На четвертом этапе в лунки вносят субстратную смесь для выявления активности пероксидазы. Состав смеси приведен в при0 мере 4.
Инкубируют 30 мин в темноте при комнатной температуре, реакцию останавливают серной кислотой и измеряют оптическую плотность проб при длине волны 492 нм (по
5 примеру 4).
На основании полученных данных строят калибровочную кривую. По оси абсцисс откладывают концентрацию IgE в МЕ/мл, по оси ординат - оптическую плотность проб (фиг. 1). Пользуясь калибровочной кривой и учитывая коэффициент разведения исследуемых сывороток, определяют содержание в них IgE (табл. 6).
П р и м е р 6. Использование иммобилизованных на твердой фазе МКАТ Е/4Ф4 для количественного определения содержания IgE в сыворотке крови человека.
Концентрацию IgE в сыворотке крови определяют с помощью двухдетерминант- ного иммунометрического анализа. МКАТ 8Е /4Ф4, иммобилизованные на твердой фазе, служат для захвата антигена из образца. Для выявления IgE, включенного в иммунный комплекс, используют меченные перок- сидазой lgE-специфичные поликлональные антитела, выпускаемые НПО Аллерген или моноклональные антитела, синтезируемые гибридомным клоном РИ-8Е/5Д4. Реакцию проводят в полистироловых планшетах фирмы NUNC. Для разбавления реагентов и отмывания планшетов от несвязавшихся компонентов используют раствор того же состава, что в примере 4
На первом этапе в лунки планшета вносят раствор МКАТ 8Е/4Ф4, содержащий 5 мкг белка в 1 мл 0,01 М карбонат-бикарбо- натного буфера, рН 9,5. Инкубируют в течение ночи при 4°С, затем раствор удаляют и лунки однократно промывают.
На втором этапе готовят разведение исследуемых сывороток (1:10 или 1:100 в данном примере) и растворы с известным содержанием IgE, предназначенные для построения калибровочной кривой (использовали калибратор фирмы Pharmacia). Вносят образцы (в дублях) в лунки планшетов и инкубируют при 37°С 1 ч, затем лунки освобождают от раствора и промывают трехкратно
На третьем этапе готовят рабочее разведение конъюгата МКАТ 8Е/5Д4 с перокси- дазой (1:10000) и вносят в лунки планшета. Инкубируют 1 ч при 37°С, раствор удаляют, планшет промывают пять раз.
На четвертом этапе в лунки вносят субстратную смесь для выявления активности пероксидазы. Состав смеси приведен в примере 4. Инкубируют 30 мин в темноте при комнатной температуре, останавливают реакцию добавлением серной кислоты и измеряют оптическую плотность проб при длине волны 492 нм (по примеру 4).
На основании полученных данных строят калибровочную кривую: по оси абсцисс (логарифмическая шкала) откладывают концентрацию IgE в МЕ/мл, а по оси ординат - оптическую плотность соответствующих проб (фиг. 2). Пользуясь калибровочной кривой и учитывая коэффициент разведения
исследуемых сывороток, определяют содержание в них IgE (табл. 7).
Пример. Выявление с помощью МКАТ Е/4Ф4 фракции аллергенспецифичного IgE в сыворотке крови человека.
Аллергенспецифичные антитела определяют с помощью аллергосорбентного теста, при котором вначале содержащиеся в сыворотке антитела вступают в соединение
с иммобилизованным на твердой фазе аллергеном, а затем включенные в иммунный комплекс анитела класса IgE выявляются с помощью меченых пероксидазой МКАТ Е/4Ф4 .
Раствор аллергена амброзии (НПО Аллерген) - 40 мкг в 1 мл 0,01 М карбонат7би- карбонатного буфера рН 9,5 вносят в лунки полистироловых планшетов фирмы NUNC и инкубируют 18ч при 4°С. Удаляют аллерген,
а лунки промывают раствором того хе состава, что приведен в примере 4.
Готовят разведения стандартных сывороток (выпускаемых НПО Аллерген). Стандартную позитивную сыворотку используют
цельной, а также в разведениях. 1:5, 1:25 и 1:50. Негативную сыворотку используют в цельном виде. Исследуемые сыворотки и образцы контрольных сывороток в обозначенных разведениях вносят по 200 мкл в лунки
планшета, в которые предварительно было внесено по 200 мкл разводящего раствора (например 4). Инкубируют 1 ч при 37°С. затем жидкость удаляют и лунки промывают 4 раза.
Рабочее разведение конъюгата пероксидазы и МКАТ вносят в объеме 200 мкл в лунки, инкубируют 1 ч при 37°С, отмывают 5-кратно, после чего в лунки вносят по200 мкл субстратной смеси (состав приведен в примере 4), инкубируют при комнатной температуре в темноте 30 мин. Остановку реакции и регистрацию оптической плотности проводят, как в примере 4. О содержании IgE, специфичного к аллергену, судят по оптической плотности исследуемых образцов в сравнении с оптической плотностью стандартных сывороток. На основе результатов, представленных в табл. 8, содержание специфического IgE в исследованных сыворотках оценено следующим образом: очень высокое (4-й класс) - в сыворотках 2 и 4; среднее (2-й класс)- в сыворотке 1; низкое (1-й класс) - в сыворотках 3 и 6; антитела не определяются в сыворотке 5.
Формула изобретения
Штамм гибридных культивируемых клеток животных Mus musculus L. ВСКК(П) Nk 402 D - продуцент моноклональных антител к IgE человека.
Таблице 1






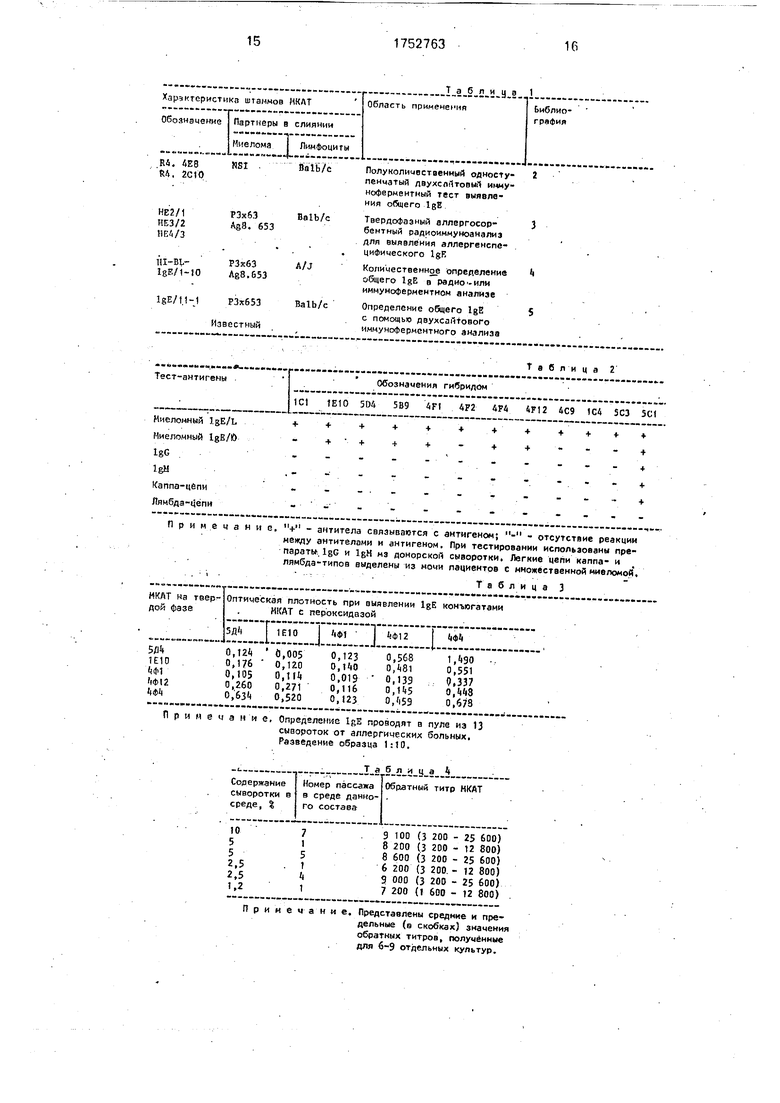

| название | год | авторы | номер документа |
|---|---|---|---|
| Штамм гибридных культивируемых клеток животных MUS мUSсULUS L, - продуцент моноклональных антител против J @ Е человека | 1991 |
|
SU1776691A1 |
| ШТАММ ГИБРИДНЫХ КУЛЬТИВИРУЕМЫХ КЛЕТОК ЖИВОТНЫХ Mus musculus L. - EN-4C9 - ПРОДУЦЕНТ МОНОКЛОНАЛЬНЫХ АНТИТЕЛ ПРОТИВ ЭНДОГЛИНА (CD105) ЧЕЛОВЕКА | 2015 |
|
RU2607029C1 |
| ШТАММ ГИБРИДНЫХ КУЛЬТИВИРУЕМЫХ КЛЕТОК ЖИВОТНЫХ MUS MUSCULUS L. EN-4E4 - ПРОДУЦЕНТ МОНОКЛОНАЛЬНЫХ АНТИТЕЛ ПРОТИВ ЭНДОГЛИНА (CD105) ЧЕЛОВЕКА | 2015 |
|
RU2604192C1 |
| ШТАММ ГИБРИДНЫХ КЛЕТОК ЖИВОТНОГО MUS MUSCULUS L. 9E2, ИСПОЛЬЗУЕМЫЙ ДЛЯ ПОЛУЧЕНИЯ МОНОКЛОНАЛЬНЫХ АНТИТЕЛ К БЕЛКУ E ВИРУСА ЗАПАДНОГО НИЛА ШТАММ WNV/LEIV-VIG99-27889 | 2004 |
|
RU2265658C2 |
| ШТАММ ГИБРИДНЫХ КУЛЬТИВИРОВАННЫХ КЛЕТОК ЖИВОТНЫХ MUS MUSCULUS ХТ 2Е5 - ПРОДУЦЕНТ МОНОКЛОНАЛЬНЫХ АНТИТЕЛ ИЗОТИПА G 1 К В-СУБЪЕДИНИЦЕ ХОЛЕРНОГО ТОКСИНА | 2015 |
|
RU2583306C1 |
| ШТАММ ГИБРИДНЫХ КУЛЬТИВИРОВАННЫХ КЛЕТОК ЖИВОТНЫХ MUS MUSCULUS ХТ 3Е5 - ПРОДУЦЕНТ МОНОКЛОНАЛЬНЫХ АНТИТЕЛ ИЗОТИПА G 2А К В-СУБЪЕДИНИЦЕ ХОЛЕРНОГО ТОКСИНА | 2015 |
|
RU2590587C1 |
| Штамм гибридных культивируемых клеток животных MUS мUSсULUS L. - продуцент моноклональных антител к инсулину человека | 1990 |
|
SU1710577A1 |
| ШТАММ 5А10 ПОСТОЯННОЙ ГИБРИДОМНОЙ ЛИНИИ КЛЕТОК МЫШИ Mus. musculus - ПРОДУЦЕНТ МОНОКЛОНАЛЬНЫХ АНТИТЕЛ К IgG КРУПНОГО РОГАТОГО СКОТА | 2008 |
|
RU2377299C1 |
| Штамм гибридных культивируемых клеток животных MUS мUSсULUS L. - продуцент моноклональных антител к холерному энтеротоксину биотипа эльтор | 1990 |
|
SU1742325A1 |
| ШТАММ ГИБРИДНЫХ КУЛЬТИВИРУЕМЫХ КЛЕТОК Rattus norvegicus 122Н9 - ПРОДУЦЕНТ ПЕРЕКРЕСТНО-РЕАКТИВНЫХ НЕЙТРАЛИЗУЮЩИХ МОНОКЛОНАЛЬНЫХ АНТИТЕЛ ПРОТИВ ОРТОПОКСВИРУСОВ, ПАТОГЕННЫХ ДЛЯ ЧЕЛОВЕКА | 2004 |
|
RU2281327C2 |
Использование: биотехнология, иммунология Штамм получают путем слияний лимфоцитов мышей SIL, иммунизированных IgE человека, с культивируемым клетками мышиной миеломы 653 А. Штамм обозначен Е/4Ф4 и депонирован под номером ВСКК(П) 402. Штамм культивируют на питательной среде, содержащей сыворотку крупного рогатого скота. Титр моноклональ- ных антител в культуральной жидкости достигается 1:20000. Моноклональные антитела используются для иммунохимиче- ского определения концентрации общего IgE и фракции аллергенспецифических антител lgE-класса в сыворотке крови человека, а также для контроля загрязненности окружающей среды аллергенами. 2 ил , 10 табл.
+ +
Примечание, V - антитела связываются с антигеном; - - отсутствие реакции между антителами и антигеном. При тестировании использованы препарата IgG и IgH мз донорской сыворотки. Легкие цепи каппа- и лямбда-типов выделены из мочи пациентов с множественной иивломой,
1ТаблицаЗ
Примечание, Определение IgE прочодят в пуле иэ 13 сывороток от аллергических больных, Разведение образца 1:10.
,3 - L
Примечание. Представлены средние и предельные (в скобках) значения обратных титров, полученные для 6-9 отдельных культур.
Таблица 2
Таблица 5
имечание.
Представлены средние показатели обратных титров НКАТ, полученные при анализе 4-6 образцов.
Этап
Сущность этапа анализа
1Иммобилизация МКАТ-1 против IgE на твердой фазе
2Инкубация с исследуемыми об- . разцами, содержащими IgE,
формирование иммунного комплекса МКАТ-1/IgE на твердой фазе
3Инкубация с МКАТ-11 против IgE, меченными ферментом, изотопом или флуорохромом
1) Проявление реакции - выявление метки, фиксированной на
Примечание. После каждого из указанных этапов
производится отмывание от компонентов не связавшихся с твердой фазбй.
Т а б л и
чание.
Определение содержания IgE в НЕ/мл в сыворотках проведено с помощью калибровочной кривой, представленной на фиг.2,
JLuJL-QJu-y.---Схематическоеизображение
X У Y
ЈЈi III
Инкубация с сывороткой, тестируемой на присутствие lgE-антител, формирование иммунных комплексов сывороточных антител с аллергеном
Инкубация с МКАТ против IgE, меченными ферментом или изотопом, формирование иммунного комплекса МКАТ и IgE, связанного с аллергеном
Выявление ферментной или изотопм ной метки, связанной на твердой фазе
Примечание. После каждого из указанных этапов
производится отмывание от компонентов, не связавшихся с твердой фазой.
ДД/А#/;да
г/
W
JUUUL
оп/ьягпт
2,0
w
| Биотехнология, 1988 | |||
| т, 4, № 3, с | |||
| Клапан | 1919 |
|
SU357A1 |
Авторы
Даты
1992-08-07—Публикация
1990-04-10—Подача