1
(21)4785927/04
(22)23 01.90
(46) 15.12.92, Бюл. Мг 45
(71)Институт тонкой органической химии им. А Л Мнджояна
(72)А.С.Аветисян, Э А Меркарян, О С.Медведев и О.С Норавян
(56) Negwer M. Organic-chemical drugs and their synonyms Berlin, Akademie-verlag, 1987, v. 2, p. 936
Патент ФРГ N«2032642, «л. С 07 С 103/29, 1971.
Chftion I.F и др. . Med Chero. 1982. 25(6), 670.
ПатентФРГ№3501582, кл С07С 103/29, 1986.
Gold EH. и др, . Med Chem , 1982, 25(11), 1363.
(54) СПОСОБ ПОЛУЧЕНИЯ ГИДРОХЛОРИДА 2-ГИДРОКСИ-5-{1-ГИДРОКСИ-2- М-(1- МЕТИЛ-3-ФЕНИППРОПИЛ)АМИНОЭТИЛ}- 5ЕНЗАМИДА
(57) Сущность изобретения: продукт - гидрохлорид 2-гидр Кси-5-{1-п/ дрокси-2- М-(1- метил-3-фенилпропчл)зминоэтил}бензам- ид, т пл. 191-193°С Rf 0,63, вых. 30,2%, Реагент 1: 5-бромацетил-2-бензилок- сибенззмид. Реагент. 2: NaH, Условия реакции: в срелс СНзОИ, полученный 2- бензшюкси-Б-эпок сибензамид подвергают взаимоцействию г Г -бензил-N- (1-метил-З- феьил)пропилаг . ном а среде СНзОН в присутствии каталитического количества воды с последующи л дебензилированием в присутствии 10% ного палладия нз угле и переподом полученного продукта в его гидрохлорид. 1 табл.
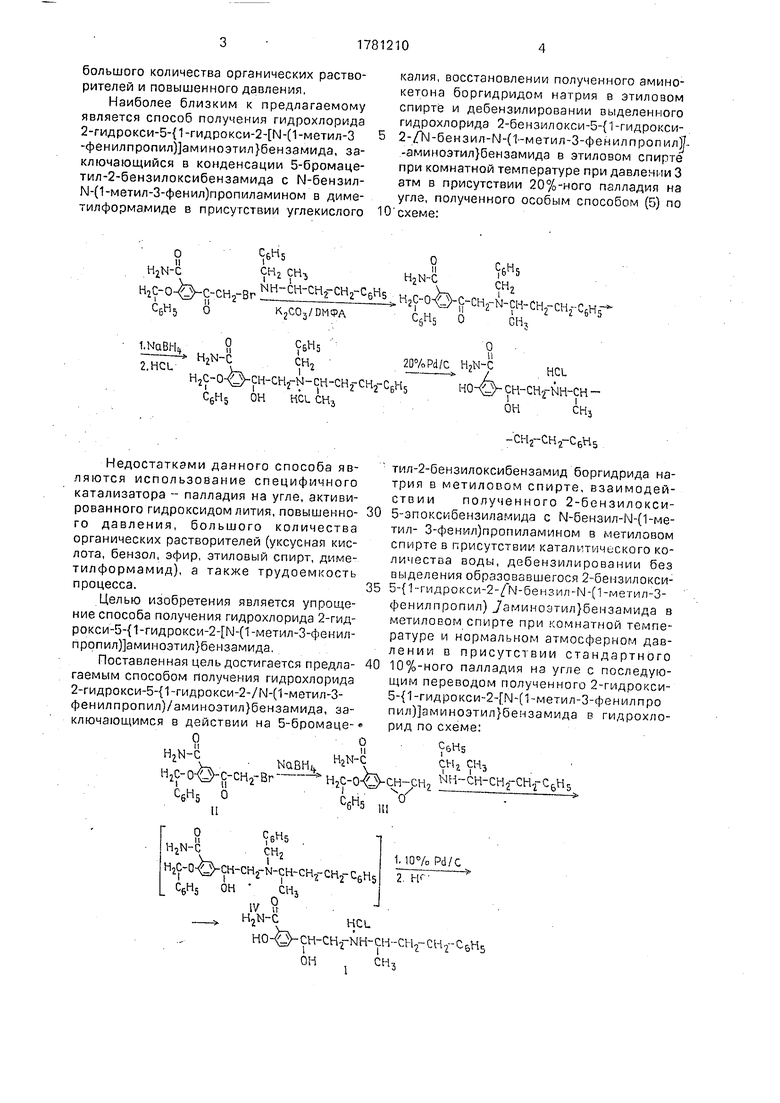



Изобретение относится к области органической химии, а именно к улучшенному способу получения гидрохлорида 2-гидро- кси-5-{1-гидрокси-2- М-(1-метмл 3-фенилпр- опил)аминоэтил}бензамида формулы
О
H2N НО
-с
/
HCL
сн-сн2-ш-сн
ОНСН3
-CH2-CH2-C& ris
используемого под названием лабеталол в медицимской практике при печении гипер- тсничсской болезни
Известные в литературе способы синтеза гидрохлорида 2-гидрокси-5-{1-гидрокси- (1-метил-3-фенилпропил)аминоэп1л} - бензамида предполагают в качестве полупродуктов для его получения производные 2-гидроксибеизамида, в частности, 5-брома- цетип-2-гидроксибензамид, 2-гидроксм 5- (Ы,М-дибензиламиноацетил)бензамид, либо 2-гидрокси-5-(2-амино-1-гидроксизтил)бен- замид
Однако известные методы синтеза имеют те или иные недостатки: применение дорогостоящих окиси платины и (или) палладия на угле, многоступенчатость промежуточных стадий, низкий выход целевого продукта, специфичные методы выделения промежуточных веществ, использование
большого количества органических растворителей и повышенного давления,
Наиболее близким к предлагаемому является способ получения гидрохлорида 2-гидрокси-5-{1-гидрокси-2- М-(1-метил-3 -фенил пропил)аминоэтил}бензамида, заключающийся в конденсации 5-бромаце- тил-2-бензилоксибензамида с N-бензил- (1-метил-3-фенил)пропиламином в диме- тилформамиде в присутствии углекислого
О и н2м-с
С6Н5 СН2 СНг
о
II H2N-C
С6Н5
сн,
2с-о-Ь-с-сн2-вг 1 н2с-оЪ-с-сн -снснгшг-с6н5- С6н5 окгссупмФАi5H5 о сн,
I.NaBH
О H2N-C
СБН5 СН,
20
н2с-о-О-сн-снг-ы-сн-снгсн2-с6н5
С6Н5 ОН HCL СН3
Недостатками данного способа являются использование специфичного катализатора - палладия на угле, активированного гидроксидом лития, повышенно- го давления, большого количества органических растворителей (уксусная кислота, бензол, эфир, этиловый спирт, диме- тилформамид), а также трудоемкость процесса.
Целью изобретения является упрощение способа получения гидрохлорида 2-гид- рокси-5-{1-гидрокси-2- Г -(1-метил-3-фенил- пропил)амииоэтил}бензамида,
Поставленная цель достигается предла- гаемым способом получения гидрохлорида 2-гидрокси-5-{1-гидрокси-2-/Ы-(1-метил-3- фенилпропил)/аминоэтил}бензамида, заключающимся в действии на 5-бромзцеО
H, 4 маьп
нгс-о-О-с-снг-Вг
о
NaBH
HS
и
калия, восстановлении полученного амино- кетона боргидридом натрия в этиловом спирте и дебензилировании выделенного гидрохлорида 2-бензилокси-5-{1-гидрокси2-/г 1-бензил-г -(1 Метил-3-фенилпроп|,1л|- -аминоэтил}беизамида в этиловом спирте при комнатной температуре при давлении 3 атм в присутствии 20%-ного палладия на угле, полученного особым способом (5) по
схеме:
о
II H2N-C
С6Н5
сн,
2с-оЪ-с-сн -снi5H5 о сн
о
||
H2N-C
НО
HCL СН-СНг-Щ-СНQH
СНч
-СНГСНГС6Н5
3035
40
О
II
C
-
5
тил-2-бензилоксибензамид боргидрида натрия в метилооом спирте, взаимодействии полученного 2-бензилокси- 5-эпоксибензиламида с Ы-бензил-М-(1 -метил- 3-фенил)пропиламином в метиловом спирте в присутствии каталитического количества воды, дебензилировании без выделения образовавшегося 2-бензилокси- 5-{1-гидрокси-2-/ Ы-бензил-М-(1-метил-3- фенилпропил) аминозтил}бензамида в метиловом спирте при комнатной температуре и нормальном атмосферном давлении в присутствии стандартного 10%-ного палладия на угле с последующим переводом полученного 2-гидрокси- 5-{1-гидрокси-2- ГЧ-(1-метил-3-фенилпро пил)аминоэтил}бензамида в гидрохлорид по схеме:
с&н5 си г СНэ -СН-СН, NH CH-CHrCHf С6Н5
V:
II
Отличительной особенностью предлагаемого способа является перевод 5-бромацетил- 2-бензилоксибензамида действием боргидрида натрия в ранее неописанный 2-бензилокси-5-эпоксибензамид, осуществ- ление процесса взаимодействия последнего с М-бензил-М-(1 -метил-3-фенил) пропиламином при китчении в метиловом спирте в присутствии каталитического количества РОДЫ, а также проведение дебензи- лиросзчия при нормальном атмосферном давлении с использованием в качестве катализатора стандартного 10%-ного палладия на угле.
Пример 1.2-Бензилокси-5-эпоксибен- замид (II). К суспензии 6.96 г (0,02 моль) 5-бромацетил-2-бензилоксибензамида (И) в 150 мл метилового спирта добавляют небольшими порциями при перемешивании в течение 70 минут 4,56 г (0,12 моль) боргид- рида натрия, поддерживая температуру реакционной среды в пределах 3-5°С. Продолжают перемешивание при комнатной температуре в течение 4 ч и оставляют на ночь, Добавляют 150 мл воды, перемеши- вают при комнатной температуре 40 минут и оставляют в холодильнике на 2-3 ч. Выпавшие кристаллы отфильтровывают, промывают холодной водой и сушат на воздухе. Выход4,1 г(76,2%),т.пл. 118-119°С. Rf 0,51.
Найдено, %: С 71,42. Н 580; N5,44.
CieHisNOa.
Вычислено, %: С 71,36; Н 5,61; N 5,20.
ИК-спектр (Р вазелиновом масле), V,CM 1i 1510, 1580, 1610 (С С аром); 1630, 1670 (СО); 3180, 3430 (МН2).
Спектр ПМР (СОС з-ТМС), б, м.д.: 8,29- 6,23 (ЮН, м, аром, протоны и МНд);5,01 (2Н, с, CHjzPh); 3,76(1 Н, м, СН); 3,18 и 2,73 (по 1 Н, д х д, СНа-О).
269 (масс-спектрометрически).
П р и м е р 2. Гидрохлорид 2-гидрокси- 5-{1-гидрокси-2- М-(1-метил-3-фенил пропил} аминоэтил}бензамида (I). Смесь 1,35 г(0,005 моль)2-бензилокси-5-зпоксибензамидз (ill), 1,18 г (0,005 моль) М-бензил-М-(1-метил-3- фенил)пропиламина, 1-2 капли воды кипятят с обратным холодильником в 40 мл метилового спирта 24-30 ч. Рзстворитель отгоняют, остаток кипятят 5-6 минут с 30 мл гексана, охлаждают и растворитель декантируют. Добавляют 100 мл метилового спирта, 2 г 10%-ного палладия на угле и гидрируют водородом при комнатной температуре и нормальном атмосферном давлении до насыщения. Фильтруют, растворитель отгоняют, остаток при легком нагревании растворяют в 100 мл этилового эфира уксусной кислоты и добавляют эфир-1.
ный раствор хлористого водорода. Фильтруют, промывают этиловым эфиром уксусной кислоты, кристаллы кипятят 5-10 минут в ацетоне. Охлаждают, фильтруют и промывают на фильтре ацетоном. Выход 0,55 г (30,2%), .лл. 191-193°С, Rf 0,63(Silufo UV- 254, подвижная фаза - бутиловый спирт:ук- сусиая кисло-.а:вода, 4:1:1).
Найдено, %; С 62,71; Н 6,98; N 7,95; СГ 10,20.
C19H25M203CI.
Вычислено, %; С 62,54; Н 6,85; N 7,68; СГ9.72.
ИК-спэктр (в вазелиновом масле), V,CM 1510, 1580, 1610 (С С аром,); 1650, 1680 (СО); 3190. 3350 (NH2. ОН).
М+ 328 (масс-спектрометрически).
Ранее меописанный 2-бензилокси-5-{1- гидроксм-2- М-бензил-М-(1-метил-3-фенил- лропил)аминоэтил}бензамид(1У) представляет собой маслообразное вещество светло- коричневого цвета, получаемое с выходом не менее 95%. Rf 0,68 (Silufo UV-254, подвижная фаза - бензол:ацетон, 4; 1 с парами аммиака).
М 508 (масс-спектрометрически).
Результаты сравнительных исследований по опрс/ютению биологической активности соединения формулы I, синтезированного предлагаемым способом, и ie- карственмсно средства лабеталол представлены в таблице. Сравнительные исследования проводили с препаратом лабеталол производства Allen and Haudburys (Англия).
О действии на а-адренорецепторы суди ли по блокирующему эффекту соединений прессорного эффекта селективного эгони- ста сл-адренорецепторов - фенипэфрина (Sigma США), Д-адреноблокирующее действие определялось по уменьшению испытуемыми соединениями положительного хронотропного и депрессорного эффектов агониста / здренорецептороз - изадрина (Sigma США),
Как видно из таблицы, по фармакологической экть сности соединение, синтезированное заявляемым способом, идентично известному.
Таким образом, предлагаемый способ позволяет ограничить использование органических растворителей до минимума, исключить применение специфичного катализатора - 20%-ного палладия на угле, активированного гидроксидом лития, избежать повышенного давления, чем достигается поставленная цель, а именно, упрощение процесса. При этом биологические свойства синтезированного предлагаемым способом
гидрохлорида 2-гидрокси-5-{1-гидрокси-2- Ы-(1-метил-3-фенилпропил)аминоэтил}бе- нзамида идентичны свойствам лекарственного препарата лабеталол.
Формула изобретения
Способ получения гидрохлорида 2-гид- рокси-5-{1-гидрокси-2- М-(1-метил-3-фени.л- пропил)аминоэтил бенззмида из 5-брома- цетил-2-бензшюксибензамида с использованием М-бензил-М-(1-метил-3-фенил) пропиламина и боргидрида натрия, включа- кщий дебензилирование полученного про- дукта в с.пиртог.ой среде при комнатной температуре в присутствии палладиевого
Блокирующее действие соединения I и лебеталола эффектов иэадринаи фенилэфрииа
Примечание. Количество животных в каждой группе равно 5.
катализатора, и перевод в гидрохлорид, отличающийся тем, что, с целью упрощения процесса, 5-бромацетил-2-бен- зилоксибензамид подвергают взаимодействию с боргидридом натрия в среде метилового спирта, полученный при этом 2-бензилокси-5-эпоксибензамид вводят в реакцию с М-бензил-1М-(1-метил-3-фе- нил)пропиламином в среде метилового
спирта в присутствии каталитического количества воды, при этом & качестве палладиевого катализатора при дебензилироваы.:и используют 10%-ный палладий на угле, а полученный продукт переводят к гидрохлорид.
Авторы
Даты
1992-12-15—Публикация
1990-01-23—Подача