Изобретение относится к усовершенствованному способу получения 5-(2,5-диметилфенокси)-2,2-диметилпентановой кислоты общей формулы I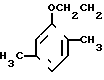 CH2-
CH2-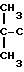 OOH
OOH
Соединение I известно под названием гемфиброзил и является ценным лекарственным препаратом, применяемым в медицинской практике для лечения атеросклероза.
Известен способ получения гемфиброзила с использованием изомасляной кислоты, включающий необходимость применения гидрида натрия, бутиллития, диизопропиламина и 2,5-ксиленола.
Недостатком способа является использование вышеперечисленных дорогостоящих реактивов - гидрида натрия и бутиллития, работа с которыми требует особого внимания и осторожности ввиду их высокой пожаро- и взрывоопасности.
Известен способ получения гемфиброзила, заключающийся в том, что 3-(2,5-ксилилокси)пропилбромид превращают в реагент Гриньяра в среде тетрагидрофурана (ТГФ), обрабатывают ацетоном и гидролизуют, выделяя 5-(2,5-диметилфенокси)-2-метил-2-пентанол, который затем хлорируют хлористым тионилом в пиридине. Образующийся 2-[(4-хлор-4-метилпентил)окси]-1,4-диметилбензол аналогично превращают в реагент Гриньяра и карбоксилируют углекислым газом, при этом целевой продукт 1 получают с выходом 88%, считая на 2-[(4-хлор-4-метилпентил)окси]-1,4-диметилбензол.
Недостатки способа связаны с неблагоприятными условиями труда. Прежде всего это касается использования в данном процессе вредных веществ: пиридина и хлористого тионила, являющегося лакриматором и аллергеном. Применение в схеме дважды синтеза Гриньяра также не упрощает его.
Наиболее близким по технической сущности и достигаемым результатам является способ получения 5-(2,5-диметилфенокси)-2,2-диметилпентановой кислоты (гемфиброзила), заключающийся в том, что изобутиловый эфир изомасляной кислоты (II) подвергают взаимодействию с диизопропиламидом лития в среде ТГФ, образующееся при этом металлопроизводное III вводят в реакцию с 1-бром-3-хлорпропаном при температуре, не превышающей 20оС, а желательно при 5-15оС, из синтезированного таким образом соединения IY реакцией алкилирования с натровой солью 2,5-диметилфенола при кипячении в течение 17 ч в среде диметилсульфоксида (ДМСО) и толуола в присутствии иодистого натрия получают 5-(2,5-диметилфенокси)-2,2-диметилпентановую кислоту (I) с выходом 80% .
Схема известного способа получения гемфиброзила
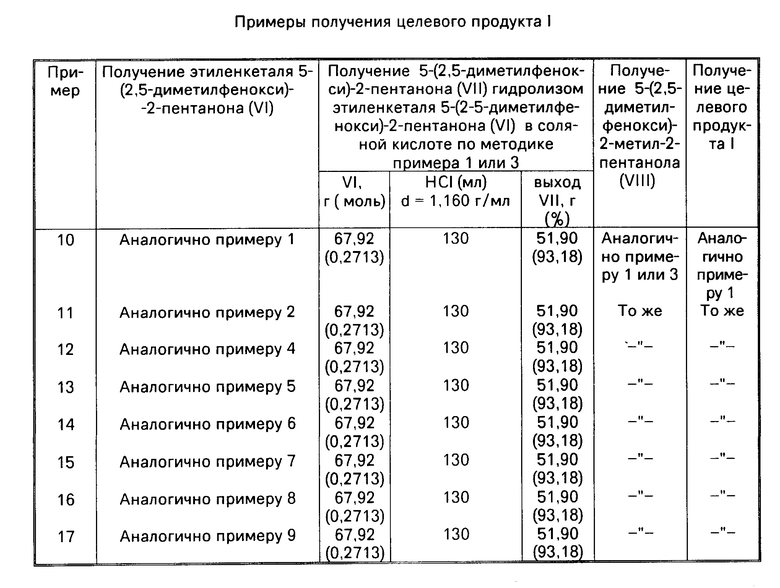
В описанном способе требуется предварительное приготовление диизопропиламида лития путем взаимодействия металлического лития с диизопропиламином в атмосфере аргона с одновременным добавлением в реакционную массу стирола при 35-42оС.
Недостатками этого способа являются:
- необходимость использования металлического лития в реакции с диизопропиламином, что делает процесс опасным и неблагоприятным с точки зрения условий труда;
- обязательное применение стирола, которое при воспроизведении этого способа часто приводит к процессам полимеризации и вытекающим отсюда техническим трудностям проведения реакции;
- использование крайне труднодоступного и дорогостоящего изобутилового эфира изомасляной кислоты. Хорошо известно, что изомасляная кислота сама является дорогостоящим продуктом и сильным лакриматором;
- необходимость применения в реакции алкилирования ДМСО;
- длительность проведения каждой стадии процесса (время выдержки на стадиях достигает 13, 17 ч и т.д.).
Цель изобретения заключается в упрощении и интенсификации процесса.
Поставленная цель достигается за счет способа получения 5-(2,5-диметилфенокси)-2,2-диметилпентановой кислоты (I) путем алкилирования 2,5-диметилфенола этиленкеталем 5-хлор-2-пентанона (Y) в среде полярного органического растворителя, в качестве которого используют как диметилформамид, так и диметилформамид или диметилсульфоксид в смеси с растворителем, образующим азеотропную смесь с водой, а также в присутствии щелочного агента, в качестве которого обычно используют карбонат калия или едкий натр, при кипячении реакционной массы, полученный при этиленкеталь 5-(2,5-диметилфенокси)-2-пентанона (YI) подвергают кислотному гидролизу с последующим взаимодействием образовавшегося 5-(2,5-диметилфенокси)-2-пентанона (YII) с метилмагнийиодидом и обработкой полученного 5-(2,5-диметилфенокси)-2-метил-2-пентанола (YIII) муравьиной кислотой в присутствии закиси меди при молярном соотношении компонентов 1:(12-18):(0,00175-0,0175) соответственно, при этом процесс проводят в растворе концентрированной серной кислоты при температуре не выше (-8)оС.
Отличительными признаками процесса являются использование в качестве алкилирующего агента этиленкеталя 5-хлор-2-пентанона, в качестве полярного органического растворителя как диметилформамида, так и диметилформамида или диметилсульфоксида в смеси с растворителем, образующим азеотропную смесь с водой, проведение кислотного гидролиза полученного этиленкеталя 5-(2,5-диметилфенокси)2-пентанона с последующим взаимодействием образовавшегося 5-(2,5-диметилфенокси)-2-пентанона с метилмагнийиодидом, обработка полученного 5-(2,5-диметилфенокси)-2-метил-2-пентанола (YIII) муравьиной кислотой в присутствии закиси меди в молярном соотношении компонентов 1:(12-18): (0,00175-0,0175) соответственно и проведение процесса в среде концентрированной серной кислоты при температуре не выше -8оС, что позволяет его упростить и интенсифицировать.
Реакция протекает за достаточно короткий отрезок времени и на нее требуется (для полного завершения) 1,5-2 ч.
Процесс протекает по схеме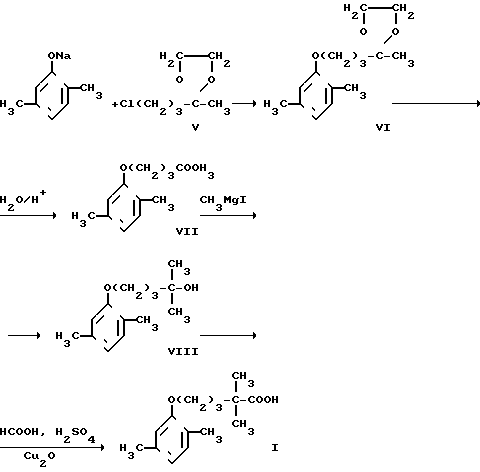
Продукт Y является доступным реагентом, легко получаемым из ацетопропилхлорида и этиленгликоля. В данном процессе проводится алкилирование калиевой или натриевой соли 2,5-диметилфенола этиленкеталем 5-хлор-2-пентанона без применения иодистого натрия. Алкилирование 2,5-диметилфенола 5-хлор-2-пентаноном, не защищенным по карбонильной группе, не проходит. Реакция карбонилирования 5-(2,5-диметилфенокси)-2-метил-2-пентанола (YIII) муравьиной кислотой в молярном соотношении менее чем 1:12 проходит с потерей выхода и ухудшением качества целевого продукта, увеличение соотношения реагентов более, чем 1: 18, нецелесообразно, т.к. не влияет ни на выход продукта, ни на скорость процесса.
Содержание в реакционной массе закиси меди по отношению к третичному спирту YIII в молярном соотношении менее, чем 0,00175:1 соответственно, ведет к снижению скорости реакции, уменьшению выхода и ухудшению качества целевого продукта. А присутствие в реакционной смеси закиси меди по отношению к YIII в количествах превышающих молярное соотношение 0,0175:1, нецелесообразно. При температуре реакции выше -8оС могут протекать побочные процессы, приводящие к ухудшению качества получаемого гемфиброзила и снижению его выхода. Выход на этой стадии 84-87%, считая на YIII.
Применение закиси меди в реакции карбонилирования третичного спирта YIII смесью концентрированных серной и муравьиной кислот позволило уменьшить время протекания реакции с 16 до 1,5 ч при постоянной температуре реакции (-8) - (-12)оС и достигнуть высокого выхода целевого продукта с высоким качеством.
Изобретение иллюстрируется следующими примерами.
П р и м е р 1. Получение этиленкеталя 5-(2,5-диметилфенокси)-2-пентанона (YI).
К раствору 31,5 г (0,2579 моль) 2,5-диметилфенола в 120 мл ДМФА при перемешивании прибавляют 73,46 г (0,5315 моль) поташа и медленно прикапывают 107,64 г (0,6539 моль) этиленкеталя 5-хлор-2-пентанона (Y). Реакционную массу кипятят 5 ч, охлаждают до комнатной температуры. Осадок отфильтровывают, промывают 30 мл ДМФА, фильтрат упаривают, осадок перегоняют в вакууме.
Получают 61,44 (95,18% , считая на 2,5-диметилфенол) YI. Т.кип. 133-137оС/1 мм рт.ст.
ИК-спектр, ν, см-1: 1610, 1580, 1500 (СН=СН аром., СН2), 1250 (Аr-O).
Масс-спектр, М+250, [М-СН3]+235.
 235-
235-  C-CH
C-CH 148, [129-(CH2)2O]+85. Спектр ПМР (СDCl3),δ , м.д.: 1,36 (с, 3Н, СН3); 1,85 (м, 4Н, (СН2)2-С); 2,17 (с, 3Н, СН3-Аr); 2,30 (с, 3Н, СН3-Аr); 3,95 (м, 6Н, СН2-O, O-(CH2)2-O); 6,62 (с, 1Н, СН аром.); 6,64 (д, 1Н, СН аром.); 6,99 (д, 1Н, СН аром.).
148, [129-(CH2)2O]+85. Спектр ПМР (СDCl3),δ , м.д.: 1,36 (с, 3Н, СН3); 1,85 (м, 4Н, (СН2)2-С); 2,17 (с, 3Н, СН3-Аr); 2,30 (с, 3Н, СН3-Аr); 3,95 (м, 6Н, СН2-O, O-(CH2)2-O); 6,62 (с, 1Н, СН аром.); 6,64 (д, 1Н, СН аром.); 6,99 (д, 1Н, СН аром.).
Получение 5-(2,5-диметилфенокси)-2-пентанона (YII).
82,58 г (0,3299 моль) этиленкеталя 5-(2,5-диметилфенокси)2-пентанона (YI) в 100 мл 52%-ной серной кислоты перемешивают при комнатной температуре 0,5 ч, охлаждают до 5оС. Осадок отфильтровывают, промывают водой, высушивают.
Получают 66,19 г (97,27%, считая на YI) YII. Т.пл. 34-34,5оС (из гексана).
ИК-спектр (вазелиновое масло), ν, см-1: 1700(С=O), 1610, 1580,1505 (СН= СН аром., СН2), 1260 (Аr-O).
Масс-спектр, М+206.
Спектр ПМР (СDCl3) δ, м.д.: 2,07 (м, 2Н, Н2С-СН2-СН2); 2,17 (с, 6Н, СOCH3, CH3-Аr); 2,30 (с, 3Н, СН3-Аr); 2,66 (тр, 2Н, СН2-С); 3,95 (тр, 2Н, СН2-O); 6,61 (с, 1Н, СН аром.); 6,66 (д, 1Н, СН аром.); 7,0 (д, 1Н, СН аром.).
Получение 5-(2,5-диметилфенокси)-2-метил-2-пентанола (YIII).
К 15,31 г (0,6298 моль) магниевой стружки в 120 мл абсолютного эфира при перемешивании медленно прикапывают раствор 93,68 г (0,6600 моль) иодистого метила в 185 мл абсолютного эфира. Реакционную смесь выдерживают 0,5 ч при перемешивании и медленно прикапывают раствор 61,89 г (0,30 моль) 5-(2,5-диметилфенокси)-2-пентанона (YII) в 265 мл абсолютного эфира. Реакционную массу перемешивают 2 ч. Затем медленно приливают 20 мл воды и 308 мл 10% -ной серной кислоты (d = 1,070 г/мл) до полного растворения осадка. Эфирный раствор отделяют от водного и последовательно промывают 200 мл воды, 200 мл 10% водного раствора метабисульфита натрия, 200 мл воды, сушат над Na2SO4. Неорганический осадок отфильтровывают, промывают 75 мл абсолютного эфира, упаривают.
Получают 66,15 г (99,1%, считая на YII) YIII в виде желтого масла.
ИК-спектр, ν, см-1: 3400 (OH), 1620, 1590, 1510 (СН=СН аром., СН2), 1265 (Аr-O).
Масс-спектр, М+222.
Спектр ПМР (СDCl3), δ, м.д.: 1,24 (с, 6Н, 2СН3-С); 1,66 (м, 2Н, -СН2-); 1,86 (м, 2Н, -СН2-С), 2,17 (с, 3Н, СН3-Аr); 2,29 (с, 3Н, СН3-Аr); 3,92 (тр, 2Н, СН2-O); 6,65 (м, 2Н, С4Н аром., С6Н аром.); 6,97 (д, 1Н, С3Н аром.).
Получение 5-(2,5-диметилфенокси)-2,2-диметилпентановой кислоты (гемфиброзила) (I).
К 1400 мл 98% -ной серной кислоты при -5оС прибавляют 2,5 г (0,0175 моль) закиси меди, затем прикапывают 30 мл 99,7% муравьиной кислоты и выдерживают 30 мин. Охлаждают до (-8)-(-12)оС и прибавляют 20 г (0,0900 моль) 5-(2,5-диметилфенокси)-2-метил-2-пентанола (YIII) в 30 мл муравьиной кислоты, поддерживая температуру (-8)-(-12)оС. Реакционную массу выдерживают при этой температуре 1,5 часа и вылавливают на 1,5 кг колотого льда. Раствор экстрагируют гексаном (3 х 300 мл). Гексановый экстракт промывают 300 мл воды, сушат над Na2SO4. Неорганический осадок отфильтровывают, промывают 50 мл гексана, упаривают.
Получают 19,6 г (87%, считая на YIII) I. Т.пл. 61-63оС (из гексана).
ТК-спектр (в таблетке КВr), ν, см-1: 3400 (OH), 1700 (С=O), 1610, 1580, 1505 (СН=СН аром., СН2), 1270 (Аr-O).
Масс-спектр М+250.
Спектр ПМР (CDCl3), δ, м.д.: 1,25 (с, 6Н, 2СН3); 1,76 (узкий м. 4Н), (СН2)2; 2,17 (с, 3Н); 2,30 (с, 3Н)(2СН3-Аr); 3,92 (тр, 2Н, СН2-O); 6,60 (с, 1Н, Н6); 6,65 (д, 1Н, Н4); 7,12 (д, 1Н, Н3); 11,25 (уш.сигн., 1Н, OH).
П р и м е р 2. Получение этиленкеталя 5-(2,5-диметилфенокси)-2-пентанона (YI).
К раствору 48,87 г (0,40 моль) 2,5-диметилфенола в 180 мл ДМФА и 60 мл толуола при перемешивании добавляют 60,77 г (0,4397 моль) поташа. Реакционную массу кипятят до прекращения азеотропной отгонки воды, охлаждают до 90оС и прибавляют 65,55 г (0,40 моль) этиленкеталя 5-хлор-2-пентанона (Y). Кипятят 2 ч, охлаждают до 90оС и прибавляют 16,5 г (0,10 моль) этиленкеталя 5-хлор-2-пентанона (Y). Кипятят 1 ч, охлаждают до комнатной температуры. Осадок отфильтровывают, промывают 30 мл толуола. Фильтрат упаривают. Остаток перегоняют в вакууме.
Получают 89,09 г (88,97%, считая на 2,5-диметилфенол) YI.
Получение 5-(2,5-диметилфенокси)-2-пентанона (YII) и далее по примеру 1.
П р и м е р 3. Получение этиленкеталя 5-(2,5-диметилфенокси)-2-пентанона (YI).
Аналогично примеру 2 или 1.
Получение 5-(2,5-диметилфенокси)-2-метил-2-пентанола (YIII) (без выделения 5-(2,5-диметилфенокси)-2-пентанона (YII).
52,70 г (0,2105 моль) этиленкеталя (5-(2,5-диметилфенокси)-2-пентанона (YI) в 50 мл 55% серной кислоты перемешивают при комнатной температуре 0,5 ч, добавляют 150 мл эфира и перемешивают до полного растворения осадка. Эфирный раствор последовательно промывают 100 мл воды, 75 мл 0,25%-ного водного раствора едкого натра, 100 мл воды до рН 7 и сушат над СаСl2. Неорганический осадок отфильтровывают, промывают 100 мл абсолютного эфира, получают 240 мл эфирного раствора YII. К 10,27 г (0,4225 моль) магниевой стружки в 80 мл абсолютного эфира при перемешивании медленно прикапывают раствор 61,46 г (0,4330 моль) иодистого метила в 130 мл абсолютного эфира. Реакционную смесь перемешивают 0,5 ч, медленно прикапывают 240 мл эфирного раствора 5-(2,5-диметилфенокси)-2-пентанона (YII) и выдерживают при перемешивании 1,5 ч. Затем прикапывают 175 мл 10%-ной серной кислоты до полного растворения осадка. Эфирный раствор последовательно промывают 100 мл воды, 175 мл 10%-ного водного раствора метабисульфита натрия, 100 мл воды, сушат над Na2SO4. Неорганический осадок отфильтровывают, промывают 50 мл абсолютного эфира, упаривают.
Получают 42,55 г (90,0%, считая на YI) YIII.
Получение 5-(2,5-диметилфенокси)-2,2-диметилпентановой кислоты (гемфиброзида) (I) аналогично примеру 1.
Пример 4. Получение этиленкеталя 5-(2,5-диметилфенокси)-2-пентанона (VI).
К раствору 12,22 г (0,10 моль) 2,5-диметилфенола в 75 мл ДМФА и 25 мл толуола при перемешивании добавляют 31,80 г (0,30 моль) карбоната натрия и кипятят до прекращения азеотропной отгонки воды. Реакционную массу охлаждают до 100оС, прибавляют 27,16 г (0,1654 моль) этиленкеталя 5-хлор-2-пентанона (Y) и кипятят 4,5 ч. Охлаждают до комнатной температуры, осадок отфильтровывают, промывают 30 мл толуола. Фильтрат упаривают, остаток перегоняют в вакууме.
Получают 22,01 г (87,91%, считая на 2,5-диметилфенол) YI.
Далее аналогично примеру 1 или 3.
П р и м е р 5. Получение этиленкеталя 5-(2,5-диметилфенокси)-2-пентанона (YI).
К раствору 15,75 г (0,1290 моль) 2,5-диметилфенола в 50 мл ДМФА при перемешивании прибавляют 41,02 г (0,3870 моль) карбоната натрия и медленно прикапывают 53,09 г (0,3225 моль) этиленкеталя 5-хлор-2-пентанона (Y). Реакционную массу кипятят 5 ч и охлаждают до комнатной температуры. Осадок отфильтровывают, промывают 20 мл ДМФА. Фильтрат упаривают, осадок перегоняют в вакууме.
Получают 28,28 г (88,62%, считая на 2,5-диметилфенол) YI.
Далее аналогично примеру 1 или 3.
П р и м е р 6. Получение этиленкеталя 5-(2,5-диметилфенокси)-2-пентанона (YI).
К раствору 48,87 г (0,40 моль) 2,5-диметилфенола в 180 г ДМФА и 60 мл бензола при перемешивании добавляют 60,77 г (0,4397 моль) поташа. Реакционную массу кипятят до прекращения азеотропной отгонки воды, охлаждают до 70оС и прибавляют 65,66 г (0,40 моль) этиленкеталя 5-хлор-2-пентанона (Y). Кипятят 3-3,5 г и охлаждают до комнатной температуры. Осадок отфильтровывают, промывают на фильтре 30 мл бензола. Фильтрат упаривают. Остаток перегоняют в вакууме. Получают 82,12 г (82,00%, считая на 2,5-диметилфенол) YI.
Далее аналогично примеру 1 или 3.
П р и м е р 7. Получение этиленкеталя 5-(2,5-диметилфенокси)-2-пентанона (YI).
К раствору 6 г (0,4912 моль) 2,5-диметилфенола в 50 мл ДМСО и 37,5 мл толуола при перемешивании добавляют 2,2 г (0,0550 моль) измельченного едкого натра и кипятят до прекращения азеотропной отгонки воды. Затем добавляют 8,2 г (0,0498 моль) этиленкеталя 5-хлор-2-пентанона (Y), 0,75 г (0,0050 моль) иодистого натрия и кипятят 3 ч. Охлаждают до комнатной температуры, осадок отфильтровывают, промывают 20 мл толуола. После отгонки растворителей остаток перегоняют в вакууме.
Получают 9,72 г (79%, считая на 2,5-диметилфенол) YI.
Далее аналогично примеру 1 или 3.
П р и м е р 8. Получение этиленкеталя 5-(2,5-диметилфенокси)-2-пентанона (YI).
К раствору 12,22 г (0,10 моль) 2,5-диметилфенола в 75 мл ДМСО и 25 мл толуола при перемешивании добавляют 31,80 г (0,30 моль) карбоната натрия и кипятят до прекращения азеотропной отгонки воды. Реакционную массу охлаждают до 70оС, прибавляют 27,16 г (0,1654 моль) этиленкеталя 5-хлор-2-пентанона (Y) и кипятят 2 ч. Охлаждают до комнатной температуры, осадок отфильтровывают, промывают 40 мл толуола. После отгонки растворителей остаток перегоняют в вакууме.
Получают 17,46 г (69,75%, считая на 2,5-диметилфенол) YI.
Далее аналогично примеру 1 или 3.
П р и м е р 9. Получение этиленкеталя 5-(2,5-диметилфенокси)-2-пентанона (YI).
К раствору 12,22 г (0,10 моль) 2,5-диметилфенола в 75 мл ДМСО и 25 мл толуола при перемешивании добавляют 41,46 г (0,30 моль) поташа и кипятят до прекращения азеотропной отгонки воды. Реакционную массу охлаждают до 90оС, прибавляют 27,16 г (0,1654 моль) этиленкеталя 5-хлор-2-пентанона (Y) и кипятят 2 ч. Охлаждают до комнатной температуры, осадок отфильтровывают, промывают 40 мл толуола. После отгонки растворителей остаток перегоняют в вакууме.
Получают 21,91 г (87,5%, считая на 2,5-диметилфенол) YI.
Далее аналогично примеру 1 или 3.
Таким образом, найден путь синтеза гемфиброзила, лишенный перечисленных выше недостатков известных способов и позволяющий получать ценный продукт высокого качества с использованием доступных исходных реагентов.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ 3-БРОМ-4-ГИДРОКСИБЕНЗАЛЬДЕГИДА | 1991 |
|
RU2024482C1 |
| 3-ФЕНИЛ-1ОН-4,5-ДИГИДРОПИРАЗОЛО[4,3-А]КАРБАЗОЛ, ОБЛАДАЮЩИЙ ПРОТИВООПУХОЛЕВОЙ И АНТИЛЕЙКОЗНОЙ АКТИВНОСТЬЮ | 1991 |
|
RU2007394C1 |
| 4-АЦЕТИЛ-7-БРОМИМИДАЗО (4,5-В)ИНДОЛ-2-ТИОН, ОБЛАДАЮЩИЙ СВОЙСТВОМ ВОССТАНАВЛИВАТЬ ФИЗИЧЕСКУЮ РАБОТОСПОСОБНОСТЬ, И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 1991 |
|
RU2024525C1 |
| N -ФОСФОРИЛИРОВАННЫЕ ПРОИЗВОДНЫЕ 3- β -ФЕНИЛИЗОПРОПИЛСИДНОНИМИНА, ОБЛАДАЮЩИЕ ПРОТИВООПУХОЛЕВОЙ АКТИВНОСТЬЮ | 1991 |
|
RU2036914C1 |
| СПОСОБ ПОЛУЧЕНИЯ 1-АЛКОКСИКАРБОНИЛМЕТИЛПИРРОЛИДОНОВ-2 | 1992 |
|
RU2032668C1 |
| СПОСОБ ПОЛУЧЕНИЯ 2,6-ДИХЛОРДИФЕНИЛАМИНА | 1992 |
|
RU2061676C1 |
| Способ получения 2-алкиламинометилен-3,9-диоксопирроло(1,2-а)индолов | 1990 |
|
SU1735285A1 |
| ПРОИЗВОДНЫЕ 4-АЦЕТИЛ-ИМИДАЗО(4,5-В)ИНДОЛ-2-ТИОНА, ОБЛАДАЮЩИЕ ПРОТИВОГИПОКСИЧЕСКОЙ АКТИВНОСТЬЮ И ВИРУСИНГИБИРУЮЩЕЙ АКТИВНОСТЬЮ В ОТНОШЕНИИ ВИРУСА ВЕНЕСУЭЛЬСКОГО ЭНЦЕФАЛОМИЕЛИТА ЛОШАДЕЙ И СПОСОБ ИХ ПОЛУЧЕНИЯ | 1991 |
|
RU2091382C1 |
| ПРОИЗВОДНЫЕ ПИРИДО (3,2-А)КАРБАЗОЛА, ОБЛАДАЮЩИЕ КАРДИОТОНИЧЕСКОЙ АКТИВНОСТЬЮ | 1991 |
|
RU2032685C1 |
| ПРОИЗВОДНЫЕ 5-ГИДРАЗОНОВ-ГЕКСАГИДРОЦИННОЛИН-3,5-ДИОНОВ, ОБЛАДАЮЩИЕ АНТИГИПЕРТЕНЗИВНОЙ И СПАЗМОЛИТИЧЕСКОЙ АКТИВНОСТЬЮ | 1990 |
|
SU1704421A1 |
Сущность изобретения: продукт - 5-(2,5-диметилфенокси)-2,2-диметилпентановой кислоты БФ C15H22O3 т.пл. 61 - 63°С (из гексана) 19 пр. Реагент 1: 2,5-диметилфенол. Реагент 2: этиленкеталь-5-хлор-2-пентанон. Условия реакции: полярный органический растворитель, в качестве которого используют диметилформамид или диметилформамид в смеси с растворителем, образующим азеотроп с водой, щелочной агент, кипячение реакционной массы с образованием этиленкеталя 5-(2,5-диметилфенокси)-2-пентанона, с гидролизом последнего в присутствии минеральной кислоты до 5-(2,5-диметилфенокси)-2-пентанона с последующим взаимодействием его с метилмагнийиодидом и обработкой полученного 5-(2,5-диметилфенокси)-2-метилпентанола-2-муравьиной кислотой в растворе концентрированной серной кислоты в присутствии закиси меди. 1 табл.
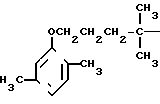

с использованием реакции 2,5-диметилфенола с алкилирующим агентом, в среде полярного органического растворителя в присутствии щелочного агента при кипячении, отличающийся тем, что, с целью упрощения и интенсификации процесса, в качестве алкилирующего агента используют этиленкеталь 5-хлор-2-пентанона, в качестве полярного органического растворителя диметилформамид или диметилформамид или диметилсульфоксид в смеси с растворителем, образующим азеотроп с водой, и полученный при этом этиленкеталь 5-(2,5-диметилфенокси)-2-пентанона подвергают кислотному гидролизу с последующим взаимодействием образовавшегося 5-(2,5-диметилфенокси)-2-пентанона с метилмагнийиодидом и обработкой полученного 5-(2,5-диметилфенокси)-2-метил-2-пентанола муравьиной кислотой в присутствии закиси меди при молярном соотношении компонентов 1 : (12 - 18) : (0,00175 - 0,0175) соответственно при этом процесс проводят в растворе концентрированной серной кислоты при температуре не выше -8oС.
| Патент США N 4665226, кл | |||
| Способ восстановления хромовой кислоты, в частности для получения хромовых квасцов | 1921 |
|
SU7A1 |
| Дверной замок, автоматически запирающийся на ригель, удерживаемый в крайних своих положениях помощью серии парных, симметрично расположенных цугальт | 1914 |
|
SU1979A1 |
Авторы
Даты
1994-10-15—Публикация
1990-08-22—Подача