Изобретение относится к экспериментальной и клинической медицине, а именно к гепатологии/
Целью изобретения является сокращение сроков восстановления функциональной активности поврежденной печени и увеличение длительности периода ремиссии за счет прекращения сорбции из крови факторов регенерации во время перфузии.
Поставленная цель достигается тем, что дополнительно проводят гемоперфузию со скоростью 20-40 мл/мин в течение 1,5-2 ч через фрагменты ткани криоконсервиро- ванной ксеноселезенки, взятой в весовом отношении к гепатоцитам 1:1 и общим расходом ткани селезенки 60-80 г.
До сих пор гемоперфузия через селезенку проводилась лишь с целью регуляции противоинфекционного иммунитета у больных. (Биогемосорбция путем экстракорпораль- ного подключения донорской селезенки/
/ Под ред. проф. А.Б.Цыпина (обзор ВНИИМ и МТИ). -М., 1987, вып. 6, fO с.).
Данный способ удовлетворяет критерию новизна и существенные отличия, поскольку не известно использование экс- тракорпоральной перфузии крови больного через смесь тканей селезенки и изолированных гепатоцитов с целью ускоренного восстановления функциональной активности поврежденной печени, а также предотвращения удаления из кровотока во время перфузии факторов, стимулирующих регенераторный процесс.
Способ осуществляется следующим образом.
После внутривенного введения больному (реципиенту) гепарина в дозе 0,03-0,05 мл/кг(10-15тыс. единиц) проводят пункцию двух локтевых вен для подключения перфу- зионной системы.
Коннекторы перфузионной системы заполняют физиологическим раствором с геСО
С
00
ы ел ы
паримом (400 мл 0,85% NaCI + 5 тыс. ед, гепарина), а съемную колонку этой системы заполняют гепатоцитами.
В качестве съемной колонки используют капельницу от системы для переливания крови ПК-22-02. Для ее заполнения вскрывают пакет со стерильной системой, отсекают приводящую и отводящую трубку и последовательно объем ее заполняют активированным углем, неорганическим кварце- вым стеклом, альбумином; в последнюю очередь колонку заполняют размороженными изолированными гепатоцитами (ИГ).
Приготовление колонки к работе нами- нают с ее полного заполнения стерильным физиологическим раствором. Затем в указанной последовательности через нее пропускают стерильные взвеси соответствующих веществ. В качестве основного сорбента ис- пользовали активированный уголь марки СКН-1К, выпускаемого заводом медицинских препаратов, г. Киев. Уголь должен полностью покрывать фильтр капельницы. Сверху уголь перекрывают слоем неоргани- ческого кварцевого стекла марки СМП-1- 1000 (или СМП-1м-2000); представляющего собой неорганическое кварцевое стекло, обработанное поливинилпирролидоном.Слой стекла имеет толщину примерно 1 см, соот- ношение уголь/стекло составляет 3:2. Предварительно стекло держат 3 ч в 8%-ном растворе бикарбоната натрия и стерилизуют в течение 2 ч в этиловом спирте. Отмывку от спирта производят стерильным раство- ром Рингера. Затем через колонку пропускают 50 мл 10%-ного человеческого или бычьего альбумина, что необходимо для лучшей фиксации гепатоцитов и предотвращения контакта крови со стеклом. В последнюю очередь в колонку подают взвесь размороженных ИГ. Для заполнения одной колонки достаточно 20 мл густой взвеси ИГ. Такая колонка готова к применению, Ток крови по ней должен иметь направление от гепатоци- тов к углю. Перед подключением сорбцион- ной колонки размороженные ИГ отмывают от криоп роте кто ра стерильным физиологическим раствором. Затем приступают к принудительной вено-венозной перфузии крови больного через ИГ с помощью непульсирующего насоса со скоростью 20-40 мл/мин в течение 25-30 мин. Через 25-30 мин перфузии производится смена колонки на свежезаполненную ИГ. Всего за время процедуры подключают в систему три-четыре колонки с ИГ, общим расходом бйоматери- ала 60-80 г, Затем приступают к принудительной вено-венозной перфузии по той же системе через фрагменты ткани криоконсервированной селезенки, которыми заполняют но вую съемную колонку от системы ПК-22-02,
Для заполнения капельницы фрагментами ткани ксеноселезенки вскрывают новый пакет со стерильной системой для переливания крови, отсекают коннекторы входа и выхода капельницы, заполняют ее физиологическим раствором, а затем засасывают в нее взвесь деконсервированных фрагментов ткани селезенки, фиксирующихся на сетке капельницы потоком жидкости и крови. Средний размер фрагментов ткани селезенки 1 х 1 мм3, количество ткани в одной капельнице до 15-20 г. Перед подключением капельницы с фрагментами ткани селезенки в перфузионную систему - размороженные фрагменты ткани селезенки отмывают от криопротектора стерильным физиологическим раствором. Скорость вено-венозной перфузии 20-40 мл/мин, длительность перфузии 1,5-2,0 ч, смена колонок производится через каждые 20-30 мин. Всего на одно подключение требуется три-четыре колонки с фрагментами ткани селезенки, при использовании которых у реципиента не возникает озноба, беспокойства или каких-либо других неприятных ощущений.
Всего на лечебную процедуру расходуется 60-80 г ИГ и 60-80 фрагментов ткани селезенки. Общий расход биоматериала составляет 120-160 г, а общее время процедуры 3-4 ч.
В указанной процедуре использовали, изолированные криоконсервированные ге- патоциты и фрагменты ткани селезенки, получение и хранение которых производилось следующим образом.
Взвесь изолированных гепатоцитов получают в стерильных условиях. После ла- паротомии отмывают и заполняют сосуды аллогенной или ксеногенной (свиной) печени охлажденным до 12-14°С раствором Ев- ро-Коллинз, затем следует иссечение и инкубация печени в этом же растворе в течение 15-18 ч при 4-6°С, Затем производят канюляцию воротной вены печени и в течение 10 мин нерециркуляторно перфузируют печень бескальциевым ЭДТА содержащим раствором при 37°С. После чего в течение 10 мин при 37°С производят рециркуляторную перфузию печени 0,12%-ным раствором очищенной коллагеназы. Все время перфу- зат оксигенируется 4% карбогеном. После этих манипуляций проводится мягкое механическое диспергирование печени, фильтрование полученной суспензии изолированных гепатоцитов (ИГ) через нейлоновое сито. Отфильтрованную массу трехкратно отмывают физиологическим раствором при 4°С. Затем успензию ИГ инкубируют в 10% растворе
криопротектора .Димексид в течение 10 мин при 4°С, после чего полученную массу разливают в пластиковые контейнеры обье- мом в 10 мл и замораживают согласно программе. Охлаждение производят со скоростью 1-2°С/мин до (-50) - (-60)°, а затем контейнеры погружают в жидкий азот-этап быстрого замораживания. Об окончании процесса замораживания судят по прекращению выделения паров азота. Контейнеры с замороженными ИГ быстро (в течение нескольких секунд) переносят для длительного хранения в низкотемпературный банк. Непосредственно перед клиническим использованием производят размораживание ИГ на водяной бане при 37°С с течение 5-10 мин.
Фрагменты ткани селезенки получают в стерильных условиях следующим образом. После лапаротомии иссекают селезенку, производят мягкое механическое измельчение ткани на холоду и затем продавливают ее через металлическое сито с размером пор 1 х 1 мм. Измельченную ткань трехкратно отмывают стерильным физиологическим раствором при температуре + 4°С. Затем производят инкубацию фрагментов селезенки в течение 30 мин при комнатной температуре в 13%-ном растворе криопротектора Димексид. Димексид разводится средой Хэнкса.. После инкубации взвесь фрагментов селезенки разливают в пластиковые контейнеры обьемом 10 мл и замораживают согласно программе. Охлаждение производят со скоростью 1-2°С до (-50) - (-60)°С, а затем контейнеры погружают в жидкий азот - этап быстрого замораживания. Об окончании процесса замораживания судят по прекращению выделения паров азота. Контейнеры с замороженными фрагментами селезенки быстро (в течение нескольких секунд) переносят для длительного хранения в низкотемпературный банк.
Непосредственно перед клиническим использованием производят размораживание взвеси фрагментов селезенки на водяной бане при 37°С в течение 5-10 мин.
Пример 1. Больной Семенихин А.П., история болезни № 683, поступил в больницу МПС № 4 им. Семашко 16.08,89 г. с диагнозом: смешанный цирроз печени с выраженной гепатоцеллюля рной недостаточностью, портальная гипертензия, асцит, печеночная энцефалопатия. В связи с отсутствием эффекта от проведения традиционной терапии печеночной недостаточности, включающей применение преднизолона - 180 мг. было решено 20.10.89 провести лечение методом экстракорпоральногр подключения клеток печени (изолированных гепатоцитов) в сочетании с фрагментами ткани селезенки. Для этого проводили гепаринизацию больного (10 тыс. ед. гепарина), проводили пункцию двух локтевых вен и подключали подготов- 5 ленную к работе перфузионную систему ПК- 22-02; капельница - колонка этой системы была заполнена 20 мл густой взвеси клеток печени по методике, описанной выше. Скорость гемоперфузии составляла 30 мл/мин;
0 через каждые 30 мин колонка с ИГ заменялась свежей. После подключения четырех колонок приступили к подключению колонок капельниц с фрагментами ткани селезенки, методика получения которых
5 описана выше. Каждая колонка содержала до 20 г ткани селезенки, время перфузии через колонку 30 мин, скорость перфузии кровью 30 мл/мин, всего было подключено четыре колонки с фрагментами ткани селе0 зенки. Общее время перфузии составило 4 ч. Перфузия прошла без осложнений, профилактически после завершения процедуры больному введено 2 мл супрастина. По завершении перфузии отмечено отчетливое
5 снижение общего и прямого билирубина, тенденция к снижению мочевины, щелочной фосфатазы, отсутствие изменения уровня у-глобулииов и повышение уровня лизоцима в плазме крови. Повышение уровня
0 лизоцима в плазме крови на фоне снижения билирубина и других показателей свидетельствует, по нашему мнению, о поступлении его из ткани селезенки, через которую проводилась перфузия. На следующий день по5 еле перфузии состояние больного субъективно стало лучше и эта положительная динамика постепенно нарастала (см. табл. 1), свидетельствуя о реализации восстановительного процесса в паренхиме поврежденной пече0 ни: достоверно снизился уровень общего и прямого билирубина, а также уровень мочевины крови. Из ферментов достоверно снизился уровень щелочной фосфатазы, Лизоцим поддерживался на более высоких
5 цифрах по сравнению с контролем.
П р и м е р 2. Выбор режимов гемоперфузии (скорость перфузии и длительность перфузии) через фрагменты криоконсерви- рованной ткачи ксеноселезенки.
0 Выбор режимов гемоперфузии осуществляли в опытах на собаках с экстракорпо- ральной принудительной вено-венозной гепоперфузией через фрагменты ткани селезенки свиньи по одноразовой системе
5 для переливания крови. Для этого капельницу перфузионной системы ПК-22-02, заполненную фрагментами ткани селезенки, (15 г), подключали через канюли к правой и левой бедренной вене. С помощью непульсирующего (роликового)насоса (р-р 1-05) создавали различные потоки перфузии, колеблющиеся от 10 до 50 мл/мин. Выбор оптимальной скорости перфузии через порцию фрагментов ткани ксеноселезенки осуществляли по вено-венозной разнице рН и р02 через, 40 мин с определенной заранее установленной скоростью. Результаты проведенных опытов представлены в табл. 2.
Сопоставляя ApH:i АрОг в зависимости от скорости вено-венозной перфузии, мы нашли, что скорость 20-40 мл/мин (средняя скорость 30 мл/мин) является оптимальной для поддержания жизнедеятельности изолированных фрагментов ткани селезенки, ибо при скорости потока 10 мл/мин достоверно выявляются признаки нарастающего метаболического ацидоза; при скорости 50 мл/мин и выше возникает переполнение капельниц, контролирующих поток перфузии..
Для определения длительности культивирования порции фрагментов ткани селезенки, в капельнице перфузионной системы (вес 15 г) мы исследовали динамику изменения АрН и Ар02 через каждые 10 мин вено-венозной перфузии через фрагменты ткани селезенки с постоянной скоростью 30 мл/мин. Результаты этих опытов представлены в табл. 3.
Из табл. 3 видно, что начиная с 40 мин начинает снижаться потребление кислорода тканью селезенки и усиливаться явления метаболического ацидоза, которые к 50-й мин перфузии становятся достоверно выраженными. На основании этих данных мы пришли к заключению, что оптимальным сроком перфузии через 15 г фрагментов ткани селезенки со скоростью 30 мл/мин (20-40 мл/мин) является 25-30 мин; 40-минутная перфузия через одну колонку является предельно допустимым сроком.
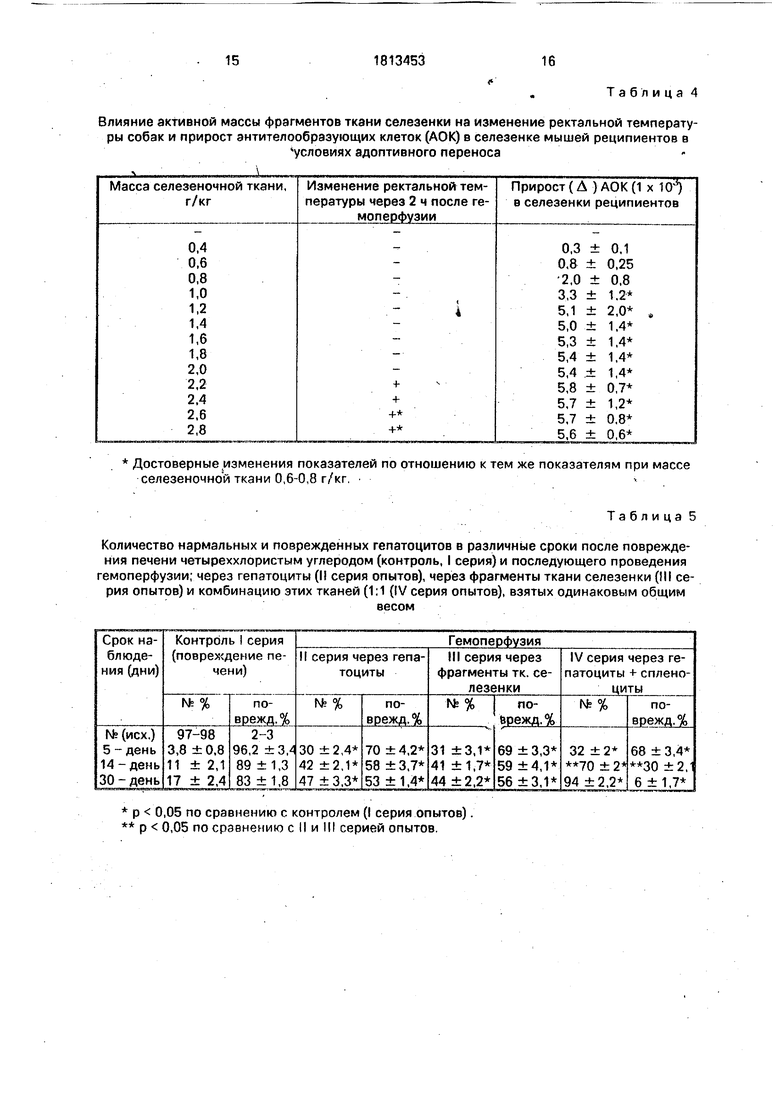
Пример 3. Определение активной массы фрагментов криоконсервированной ткани ксеноселезенки. Активная масса фрагментов криоконсервированной ткани селезенки определялась нами по биологическим реакциям животного: по изменению реактивной температуры у собак через 2 ч после завершения перфузии (определение уровня антигенной нагрузки) и по способности лимфоцитов стимулировать антителооб- разование на эритроциты барана в условиях адоптивного переноса. (Антителообразова- ние - важнейший показатель участия иммунной системы в регенераторных реакциях). Для этого проводили опыты на мышах линии С 57 В L/6. Выделенные из селезенки мышей-доноров лимфоциты - (спленоциты) в количестве 1 х 10 клеток переносили в организм летально облученных сингенных реципиентов через 17 ч после внутрибрюшин- ного введения донора 0,5 мл инкубата. В качестве инкубата использовали кровь сингенных животных, в которой в течение 2 ч
при 37°С, р02 80 - 100 мм рт. ст. и постоянном встряхивании выдерживали фрагменты криоконсервированной ткани селезенки различной массы; от 0,4 до 1,6 г/кг (или 0,4-1,6 мг на 1 мышь весом 10 г).
0 Через 7 суток ( Юдина Н.В. Реакция лимфоидной ткани на повреждение и восстановление органов с разной восстановительной реакцией: Автореф.дис. канд. 1980, 17с) после иммунизации и переноса лимфо5 идных клеток в селезенке реципиентов определяли число антителообразующих клеток (АОК) методом локального гемолиза на геле (Jerne, Nordin 1963).
Исследование показало (табл. 4), что ин0 тенсивный прирост АОК в селезенке реципиентов начинается после введения инкубата, где находилась селезеночная ткань массой 1,0 г/кг (л). При дальнейшем увеличении инкубируемой массы селезеночной ткани при5 рост АОК возрастал не достоверно (р 0,05). Было отмечено также, что при дозе криоконсервированной ткани ксеноселезенки 2,2-2,4 г/кг имеет место кратковременный подъем ректальной температуры у собак в течение
0 2 ч после перфузии, а при дозе ксеноселезенки 2,6-2,8 г/кг веса собаки достоверный подъем температуры на 0,5-1,0°С наблюдался свыше 2 ч после перфузии, что указывает на избыточную антигенную нагрузку на ор5 ганизм. На основании проведенных биологических тестов нами была установлена активная масса фрагментов криоконсервированной ткани селезенки, которая составила 1,0-1,2 : 2,2-2,4 г/кг.
0 П р и м е р 4. Выбор соотношений активной массы криоконсервированных гепа- тоцитов и фрагментов ксеноселезенки, способных ускорить регенерацию поврежденной печени.
5 Эту работу мы начали с определения минимальной биологической дозы гепато- цитов, не вызывающей после гемоперфузии выраженного и стойкого повышения температуры у собак.
0 Оказалось, что при снижении количества клеток печени с 2,8 до 1 г/кг веса животного) использовали густую взвесь гепатоцитов, содержащую в 1 мл 2 10е клеток печени) через 2 ч после завершения гемоперфузии (2
5 ч перфузии со скоростью 30 мл/мин) повышенная температура у собак наблюдалась при использовании гематоцитов в капельнице-резервуаре в дозе 2,8-2,6 г/кг. Начиная с дозы 2,4-2,2 г/кг температура у собак через 2 ч после гемоперфузии повышалась
не достоверно (р 0,05). Эта доза гепатоци- тов была признана нами оптимально допустимой.
Сопоставляя эти данные с результатами по определению оптимальной биологической дозы ткани селезенки (пример 3) мы пришли к заключению, что суммарная биологическая доза криоконсервировэнных ге- патоцитов так же как и фрагментов тканей селезенки не должна превышать 2,2-2,4 г/кг (для человека 160-190 г).
Установив оптимально допустимую суммарную дозу биологического материала (ге- патоциты и спленоциты), мы перешли к определению оптимального соотношения активной массы криоконсервированных ге- патоцитов и фрагментов ткани селезенки.
Эта работа проводилась на 26 беспородных кошках массой 2-3,5 кг с экспериментальным гепатитом, вызванным подкожным введением четыреххлористого углерода (0,2 мл 60%-ного раствора через день в течение 2-х недель).
В опытах использовали кошек, общий билирубин крови которых повышался с 0,7- 0,8 мг% до 2,0-3,6 мг%. Всего было поставлено четыре серии опытов. В I серии (5 кошек) животные не получали никакого лечения; во II серии (5 кошек) проводилась гемоперфузия через взвесь криоконсервированных клеток ксенопечени (доза 2,2 ± ±0,2 г/кг); срок перфузии 3,5 ±0,2 ч; скорость перфузии - 30 мл/мин; в 111 серии - (5 кошек) проводилась гемоперфузия через фрагменты криоконсервированной ткани ксеноселезенки (доза 2,2 ± 0,2 г/кг); срок перфузии 3,3 ± 0,4 ч; скорость перфузии 20- 40 мл/мин; в IV серии (5 кошек) -гемоперфу- зию проводили сначала через взвесь криоконсервированных клеток печени (доза 1,1 ±0,1 г/кг) срок перфузии 1,5-2 ч, скорость перфузии 20-40 мл/мин, а затем через фрагменты криоконсервированной ткани ксеноселезенки (доза 1,1 ±0,1 г/кг); срок перфузии 1,5-2,0 с, скорость перфузии 20-40 мл/мин; общая доза этих тканей составила 2,2 ± 0,2 г/кг и соотношение их 1; 1.
О влиянии гемоперфузии на восстановительные процессы в патологически измененной печени судили по динамике изменения гистологической картины в печени на 5-й, 14-й и 30-й день после проведения гемоперфузии. Для этого проводили биопсию кусочков печени. Кусочки печени фиксировали в 10%-ном формалине. Готовили парафиновые срезы толщиной 5 мкм и окрашивали их гематоксилин-зозином, по Шабадашу, кре- зиловым фиолетовым, проводили реакцию тетразониевого сочетания по ДаниеллиПирсу, На гистологических препаратах с использованием окулярной сетки для стерио- метрических измерений площадь 0,25 мм2 в 50 полях зрения подсчитывали общее коли- чество печеночных клеток с одновременным подсчетом количества нормальных гепатоцитов и гепатоцитов с признаками жировой и белковой дистрофии, общего количества печеночных ядер, нормальных и дегенери0 рующих.
Проведенные исследования показали, что у животных с экспериментальным гепа титом печень имела светло-коричневый цвет с хорошо выраженным рисунком до5 лек. Микроскопически выявлялась выраженная жировая, зернистая, гидролическая и баллонная дистрофия гепатоцитов, полиморфизм печеночных клеток, их ядер, вакуолизация ядер и пикноз. По ходу портальных
0 трактов и около центральных вен отмечалась лимфоидная инфильтрация. Через 5 дней.после гемоперфузии у всех животных печень имела более темный цвет, чем печень контрольных животных с токсическим
5 гепатитом. Гепатоциты с белковой и жировой дистрофией в контроле составили 96,2 ±3,4%; в опытных группах их было достоверно меньше (табл. 5), однако разницы между II, III и IV группами не было. Количе0 ство дегенерирующих ядер в гепатоцитах печени кошек также достоверно снизилось к 5-м суткам по сравнению с контролем, однако достоверной разницы II, III и IV группами также не было выявлено (табл. 6). Через
5 14 дней после гемоперфузии выраженность дистрофического процесса во всех группах достоверно уменьшалась по Сравнению с контролем (табл, 5 и 6). В группе IV, где применялась для гемоперфузии комбина0 ция гепатоцитов и спленоцитов 1:1, количество поврежденных клеток становилось достоверно меньше, чем во II и III группах (,05).
В еще большей степени положительное
5 влияние комбинации гепатоцитов и спленоцитов проявляется через 1 месяц после гемоперфузии: через 1 месяц содержание нормальных гепатоцитов в печени соответствует здоровым животным, тогда как в группах,
0 где применяли либо ге.патоциты (II гр.) либо
спленоциты (III rp.) количество нормальных
клеток вдвое меньше (табл. 5); содержание
поврежденных ядер в гепатоцитах печени
собак IV группы также близко к содержанию
5 поврежденных ядер в печени здоровых собак (табл. 6). Таким образом, проведенные эксперименты показали, что и гепатоциты и спленоциты в неаллергизирующих дозах усиливают восстановительный процесс в поврежденной печени; они показали также.
что комбинацией гепатоцитов и спленоци- тов в той же суммарной дозе можно способствовать достоверному усилению темпа регенерации печени и сокращению сроков завершения восстановительного процесса в ней.ч
Пример 5. Доказательства большей выраженности восстановительного процесса в печени у больных с поражением печени при комбинированном применении гепатоцитов и фрагментов ткани селезенки при гемоперфузии.
Комбинированная гемоперфузия через криоконсервированные гепэтоциты и фрагменты ткани селезенки проведена нами у 10 больных с хронической печеночной недостаточностью.
Результаты этих исследований представлены в табл. 7-9.
В табл. 7 представлены изменения некоторых показателей крови сразу после пер- фузии крови больного через изолированные гепатоциты и через гепатоциты в сочетании с фрагментами ткани селезенки. Из табл.7 видно, что существенные различия существуют в уровне лизоцима плазмы крови больных, который, как известно, выступает в роли гуморального регулятора регенерици- онных процессов в поврежденном органе (Бухарин О.В., Васильев А.В. Лизоцим и его роль в биологии и медицине, Томск, 1974).
Снижение лизоцима в крови больных, которым проводилась перфузия через изолированные гепатоциты (Irp) и отсутствие снижения лизоцима в крови больных, которым дополнительно проводилась перфузия через ткань селезенки (Игр), свидетельствует, очевидно о том, что у больных I группы имеет место сорбция лизоцима, а у больных II группы его секреция, балансирующая убыль этого вещества при сорбции его гепа- тоцитами.
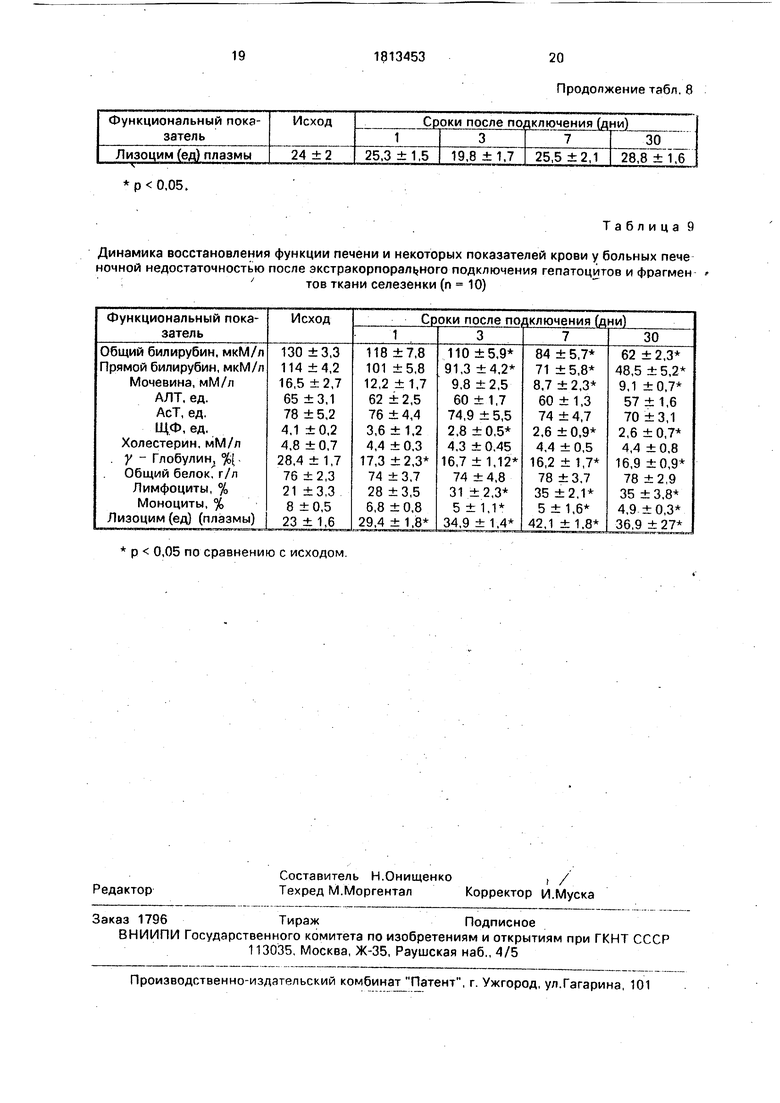
В табл. 8 представлены результаты лечения печеночной недостаточности в течение 1 месяца после сеанса перфузии по способу-прототипу.
Из табл. 8 видно, что при подключении лишь одних гепатоцитов на 1-е сутки после подключения происходило достоверное увеличение общего и прямого билирубина и не достоверное повышение лизоцима, на 7-е сутки наступало достоверное снижение общего и прямого билирубина, тогда как остальные показатели состояния печеночной функции и крови практически не изменялись (АлТ, АсТ, Ц.Ф., холестерин общий белок, у-глобулины, лимфоциты, моноциты, лизоцим).
На 30-е сутки.после подключения все показатели возвращались к исходному (патологическому) уровню.
После подключения ИГ в комбинации с
фрагментами ткани селезенки (табл. 9) уже на 1-е сутки наступало снижение показателей общего и прямого билирубина крови больных на фоне достоверного повышения уровня лизоцима в плазме; на 3-й сутки снижение общего и прямого билирубина становилось достоверным; на 3-й сутки наступало также достоверное снижение Щ.Ф. с 4,1 ±0,2 до 2,8 ±0;5 ед. у-глобулинов с 28,4 ±1,7% до 16,7 ± 1,12%, моноциты кровис8 ±0,6% до5 ±1,1%, лимфоциты крови - переносчики - регенерационной информации достоверно увеличились с 21 ± 3,3% до 31 ±2,3% на фоне достоверного увеличения лизоцима крови. На 7-е и 30-е сутки
положительная динамика усиливалась, либо
поддерживалась на достоверно лучших
цифрах по сравнению с прототипом. На 30-е
сутки общий билирубин был ниже в 2 раза,
прямой билирубин - более чем в 2 раза.
Имело место также достоверное снижение мочевины, Щ.Ф., у-глобулинов, моноцитов крови - косвенно характеризующих торможение неспецифического воспалительного процесса в стромальных структурах (печеночной ткани).
Предлагаемый способ позволяет достоверно снизить уровень связывания лизоцима во время перфузии; интенсифицировать почти в 2 раза восстановительный процесс
в печени без увеличения массы аллергези- рующего материала; добиться более длительной компенсации функции печени при ее хроническом повреждении.
Предлагаемый метод может найти применекие при острой и хронической недостаточности печени, для устранения недостаточной функции печени при перитонитах, сепсисе и других состояниях, связанных с ее повреждением.
Формула изобретения Способ лечения больных с печеночной недостаточностью путем медикаментозной терапии и экстракорпоральной гемоперфузии через суспензию изолированных гепа- цитов, отличающийся тем, что, с целью повышения эффективности способа, дополнительно проводят гемоперфузйю через фрагменты ткани криоконсервированной
селезенки, взятой в массовом соотношении к гепатоцитам 1:1 ив количестве 1,1 ±0,1 г/кг, при скорости перфузии 20-40 мл/мин в течение 1,5-2,0 ч.
Таблица
Динамика изменения показателей печеночной функции и некоторых показателей крови после экстракорпоральной гемоперфузии через взвесь изолированных гематоцитов и фрагменты ткани селезенки у больного Семенихина А.П. (и.б. N 683)







| название | год | авторы | номер документа |
|---|---|---|---|
| Способ оценки эффективности применения лекарственного препарата "Лаеннек" на фармакологической модели неалкогольной жировой болезни печени с перегрузкой железом у экспериментальных животных | 2024 |
|
RU2837019C1 |
| Способ нормализации биохимических показателей крови пациентов с необратимой печеночной недостаточностью | 2020 |
|
RU2797291C2 |
| СПОСОБ ЛЕЧЕНИЯ ХРОНИЧЕСКОГО ВИРУСНОГО ГЕПАТИТА С ГЕНОТИП-2 С УМЕРЕННОЙ АКТИВНОСТЬЮ | 2005 |
|
RU2293572C1 |
| СПОСОБ ЛЕЧЕНИЯ ХРОНИЧЕСКИХ ДИФФУЗНЫХ ЗАБОЛЕВАНИЙ ПЕЧЕНИ | 2004 |
|
RU2283113C2 |
| СПОСОБ ИММУНОКОРРЕКЦИИ ПРИ АУТОИММУННОМ ПРОЦЕССЕ | 1993 |
|
RU2098139C1 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ ТЕЧЕНИЯ ХРОНИЧЕСКИХ ГЕПАТИТОВ НА ФОНЕ НАРКОТИЧЕСКОЙ ИНТОКСИКАЦИИ | 2004 |
|
RU2267998C2 |
| Способ детоксикации организма при гнойно-септическом состоянии | 1990 |
|
SU1757679A1 |
| РАДИОНУКЛИДНЫЙ СПОСОБ ОПРЕДЕЛЕНИЯ ДИСФУНКЦИИ ПЕЧЕНИ ПОСЛЕ ОРТОТОПИЧЕСКОЙ ТРАНСПЛАНТАЦИИ | 2019 |
|
RU2718294C1 |
| ЛЕКАРСТВЕННОЕ СРЕДСТВО И СПОСОБ ЛЕЧЕНИЯ НАРУШЕНИЙ ФУНКЦИИ ГЕПАТОБИЛИАРНОЙ СИСТЕМЫ | 2001 |
|
RU2197265C1 |
| Способ лечения лимфостаза нижних конечностей | 1990 |
|
SU1816453A1 |
Предложен способ лечения больных с печеночной недостаточностью путем соче- танного применения гемоперфузии крови больного через взвесь криоконсервиров, ге- патоцитов и фрагментов ткани селезенки. Гепатоциты проявляют не только детокси- цирующую, но и сорбцию факторов регенерации. Для восполнения возникающего дефицита факторов регенерации при перфу- зии через гепатоциты и повышения интенсивности восстановительных процессов в поврежденной печени дополнительно в контур перфузии вводятся фрагменты ткани кри- оконсервированной селезенки, взятой в весовом отношении с гепатоцитом 1:1 ив количестве 1,1 ± 0,1 г/кг при скорости перфузии 20-40 мл/мин в течение 1,5-2 ч. 9 табл.
0 - сразу поссле подключения.
Таблица 2
Выбор скорости гемоперфузии через фрагменты криоконсервированной ткани ксеноселе- зенки (в капельнице 15 г фрагментов ткани селезенки)
Та бл и ца 3
Определение длительности гемоперфузии через фрагменты криоконсервированной ткани ксейоселезенки (в капельнице 15 г фрагментов ткани селезенки)
Таблица 4
Влияние активной массы фрагментов ткани селезенки на изменение ректальной температуры собак и прирост энтителообразующих клеток (АОК) в селезенке мышей реципиентов в
условиях адоптивного переноса
Достоверные изменения показателей по отношению к тем же показателям при массе селезеночной ткани 0,6-0,8 г/кг.
Таблица 5
Количество нармальных и поврежденных гепатоцитов в различные сроки после повреждения печени четыреххлористым углеродом (контроль, I серия) и последующего проведения
гемоперфузии; через гепатоциты (II серия опытов), через фрагменты ткани селезенки (III серия опытов) и комбинацию этих тканей (1:1 (IV серия опытов), взятых одинаковым общим
весом
р 0,05 по сравнению с контролем (I серия опытов).
р 0,05 по сравнению с II и III серией опытов.
Таблица б
Количество поврежденных ядер гепатоцитов (в %) в различные сроки после повреждения печени четыреххлористым углеродом (контроль, I серия) и последующего проведения гемоперфузии: через гепатоциты (II серия опытов), через фрагменты ткани селезенки (III серия опытов) и комбинацию этих тканей (1:1) (IV серия опытов), взятых одинаковым общим весом
р 0.05 по сравнению с контролем (I серия).
р 0,01 по сравнению с II и III серией опытов.
Изменение некоторых показателей крови сразу после проведения гемоперфузии через изолированные гепатоциты (ИГ), а также через ИГ в сочетании с фрагментами ткани селезенки
(ФТС) у больных печеночной недостаточностью
Примечание. - означает убыль вещества;
+ означает прирост вещества в крови.
Таблица 8
Динамика восстановления функции печени и некоторых показателей крови у больных печеночной недостаточностью после экстракорпорального подключения изолированных гепатоцитов (п 10)
Таблица 7
р 0,05.
Динамика восстановления функции печени и некоторых показателей крови у больных пене ночной недостаточностью после экстрзкорпораль,ного подключения гепатоцитов и фрагмен
тов ткани селезенки (п 10)
р 0,05 по сравнению с исходом.
Продолжение табл. 8
Таблица 9
| ШуМаков В.И и др | |||
| Способ получения и консервации клеток печени для экстра- корпорального лечения печеночной недостаточности | |||
| - М., 1990 |
Авторы
Даты
1993-05-07—Публикация
1991-02-20—Подача