Изобретение относится к иммунобио- технологии, именно к способам диагностики растительных вирусов, и может быть использовано в сельском хозяйстве для выявления заболеваний растений и в научных исследованиях.
Цель изобретения - повышение чувствительности способа и возможности многократного использования носителя.
Цель достигается тем, что в известном способе определения вируса табачной мозаики (ВТМ) путем нанесения антител на носитель, промывания, добавления ВТМ, конъюгированных с ферментом антител и субстрата с последующей регистрацией продуктов ферментативной реакции, в качестве носителя используют полиамидные плоские мембраны, обработанные 2-3%- ным раствором глутарового диальдегида (ГА) или 0,4-1,2%-ным раствором госсипола, в качестве фермента используют фосфо- липазу Аа, в качестве субстрата - яичный лецитин.
Существенные отличия заключаются в том, что в предлагаемом способе достигается ковалентное связывание антител с поверхностью активированной полиамидной микропористой мембраны с последующей адсорбционной иммобилизацией вируса, а затем конъюгата тех же антител и фермента за счет специфических иммунных связей и определения количества связанного вируса по продуктам ферментативной реакции.
Предлагаемое решение способствует обеспечению многократности использования носителя с иммобилизованными анти- тетелами и повышению чувствительности.
Пример. Полиамидную мембрану весом 9,6 мг заливают 1 мл 2,5 н.раствора соляной кислоты и инкубируют в течение 2 ч при температуре 45°С и перемешивания для активации поверхности носителя за счет ограниченного кислотного гидролиза. Избыток кислоты удаляют промыванием дистиллированной водой и 0,1 М боратным буфером, рН 9,0. К активированной поли00
ч о ю ел
амидной мембране добавляют 1 мл того же буфера, содержащего 0,1 мл 2,5%-ного раствора ГА и инкубируют в течение 2 ч при комнатной температуре для модификации функциональных групп носителя. Избыток ГА удаляют промыванием носителя 10-кратным количеством 0,05 М боратного буфера, рН 9,0. К модифицированному полиамиду приливают 1 мл 0,1 М бератного буфера с рН 9,0, содержащего 35 мкг (по бе,лку) антител, очищенных методом аффинной хрома- тографии из сыворотки кроликов, иммунизированных томатным штаммом вируса табачной мозаики. Инкубация идет в течение 48 ч при 4°С и непрерывном перемешивании. Несвязавшиеся антитела удаляют промыванием мембраны 0,05 М боратным буфером, рН 9,0 до исчезновения следов белка. К мембране с ковалентно иммобилизованными антителами добавляют 1 мл 0,1 М боратного буфера рН 9,0, содержащего глицина (из расчета 0,35 г.на 1 г носителя) и инкубируют в течение 2 ч для блокирования альдегидных групп, оставшихся после присоединения антител. Избыток глицина удаляют промыванием мембраны 5-кратным (по объему) количеством 0,05 М боратного буфера, рН 9,0 (4-5 раз).- ..-.
Мембраны с иммубилизованными антителами хранят в 0,1 М боратном буфере рН 9,0 или в высушенном состоянии в полиэтиленовых мешочках при температуре около 4°С.
Перед использованием для ИФА мембрану трижды промывают 0,05 М трис-НС буфером с рН 7,5. содержащего 0,05% Тви- на-20.
Для осуществления ИФА к мембране с иммобилизованными антителами приливают 0,5 мл 0,05 М трис-HCI буфера, рН 7,5, содержащего 30 ммоль хлористого кальция и 5% этиленгликоля (сорбирующий буфер) и 0,5 мл исследуемого на вирус образца. После инкубации 1 ч при 37°С мембрану промывают от несвязанного вируса и приливают 1 мл сорбирующего буфера, содержащего 5-10 мкг (по белку) конъюгата антител с фосфолипазой А2 и оставляют на 1 ч при 37°С и непрерывно перемешивают. Мембрану многократно отмывают от несвя занного коньюгата 0,05 М трис-HCI буфером с рН 7,5, содержащем 0,1%-ный тритон X- 100 для полного удаления неспецифически связанных белков.
Определение фосфолипазной активности проводят методом потенциометриче- ского титрования при постоянном значении рН, используя титрометрическую установку
рН-стат Т-108, состоящую из блока автоматического титрования (БАТ), блока сопряже-. ния (БС), электродной части, соединенной с рН-метром. Для поддержания постоянной
температуры используют водный ультратермостат УТ-15 с термостатированной отводной ячейкой, которую помещают на магнитную мешалку.
Реакционную смесь наливают в
стеклянный стаканчик объемом 15-20 мл мешают в ячейку. Общий объем субстратной смеси составляет 10 мл и содержит: 140 ммоль NaCI, Юммоль CaCte, б ммоль тритона Х-100, 0,5 ммоль трис-HCI
буфера с рН 8,5, 2,2 ммоль яичного лецитина, рН среды 8,5, температура 38°С.
В смесь опускают электроды и капилляр для подачи титрующего раствора с помощью автобюретки, включает титратор и,
доводя рН и температуру смеси до заданной точки, производят контрольное титрование субстрата в течение 5 мин. После этого в ячейку опускают мембрану - (массой 9-10 мг) после проведения ИФА и снова в течение 5 мин оттитровывают образующиеся кислотные продукты реакции. Титрующий раствор - 0,02 H.NaOH. Регистрацию изменения кислотности среды проводят на самописце во время или по показанию счетчика
дозатора.
Титрование выделившихся свободных жирных кислот проводится автоматически при постоянном значении рН.
Активность фосфолипазы AZ конъюгата
на мембране по скорости гидролиза субстрата выражают в микромолях жирных кислот, выделившихся за 1 мин в расчете на 1 г полиамида и вычисляют по формуле
А
(У-Уо) N
t п
1000
мкмоль ЖК мин г
45
V0 - конечный объем щелочи, мл (израсходованной на тирование продуктов реакции ферментов на мембране);
V - начальный объем щелочи, мл (израс- ходованный на титрование субстрата);
N - нормальность раствора щелочи в микромолях;
t - время, мин;
п - масса навески мембраны, мг. Для определения активности исходной фосфолипазы А2 или ее коньюгата с антителами в реакционную смесь добавляют 0,05- 0,2 мкг (по белку) фермента или 0,5-2,0 мкг конъЮгатз.
Удельная активность фермента или коньюгата выражают в мкмолях свободных жирных кислот, за 1 мин в расчете на 1 мг белка.
Чувствительность при определении активности фосфолипазы Аа титрометриче- ским методом составляет 0,02 мкг (по белку) фермента или 1 ммоль/мин по продуктам реакции. Ошибка метода 5%.
В данном примере на поверхности мембраны связалось 24,6 мкг (по белку) антител. При проведении ИФА на этой мембране в модельных опытах с чистым препаратом ТШ-ВТМ в количестве 3,0 нанограмм (нг) в пробе скорость реакции конъюгата, связанного с вирусом, составляет 85,25 ммоль/мин на 1 г носителя.
После ИФА мембрану регенерируют путем промывания 0,05 М трис-NaOH буфером, рН 10,5-11,0 с добавлением 1 М KCI и 0,015 М ЭДТА для удаления конъюгатэ и вируса с поверхности носителя с иммобилизованными антителами и после промывки вторично используют для ИФА ТШ-ВТМ,
Результат после повторного использования аналогичен данным первичного анализа. После 3-кратного пользования воспроизводимость результатов анализа составляет 98%, кратного 4-кратного 95%, 5-кратного 93%, 6-кратного 90%.
П р и м е р 2. Анализ осуществляют аналогично примеру 1. Для ковалентного связывания антител с поверхностью носителя применяют 2,0%-ный раствор глутаро- во го альдегида.
Результаты анализа: на поверхности мембраны связалось 23,0 мкг (по белку) антител, скорость реакции при ИФА ТШ- ВТМ - 80,3 мкмоль/мин на 1 г носителя.
П р и м е р 3. Анализ осуществляют аналогично примеру 1. Для ковалентного присоединения антител к носителю используют 3,0% ГА
Результаты анализа: на мембрану иммобилизовалось 22,8 мкг (по белку) антител, скорость реакции при ИФА ТШ-ВТМ - 78,1 мкмоль/мин.
Как видно из приведенных примеров, 2,5%-ный раствор ГА является оптимальным для иммобилизации антител на полиамидную мембрану.
При увеличении концентрации ГА в инкубационной среде наблюдается уменьшение количества иммобилизованных антител и соответственно занижение результатов ИФА. При уменьшении концентрации ГА в среде наблюдается такая же картина.
Возможно, при использовании 2,5%- ного раствора ГА на поверхности мембраны образуются цепи длиной, отвечающей наиболее равномерному образованию пространственных структуру, что обеспечивает оптимальные условия для проведения ИФА вируса табачной мозаики. 5Пример 4. Анализ осуществляют аналогично примеру 1. Для ковалентного связывания антител с поверхностью мембраны используют 0,8%-ный раствор госси- пола.
0 Результаты анализа: на мембрану иммобилизовалось 24,6 мкг (по белку) антител, скорость реакции при ИФА ТШ-ВТМ (3,0 нг) - 85,0 мкмоль/мин.
П р и м е р 5. Анализ осуществляют
5 аналогично примеру 1. Для ковалентного связывания антител с поверхностью мембраны используют 0,4%-ный раствор госси- пола.
Результаты анализа: на мембрану свя0 залось 15,3 мкг (по белку) антител, скорость реакции при ИФА ТШ-ВТМ - 48,5 мкмоль/мин.
П р и м е р 6. Анализ осуществляют аналогично примеру 1. Для ковалентного
5 связывания антител к поверхности мембраны используют 1,2%-ный раствор госсипо- ла.
Результаты анализа: на мембрану иммобилизовалось 24,5 мкг (по белку) антител,
0 скорость реакции при ИФА ТШ-ВТМ - 85,0 мкмоль/мин.
В табл.1 представлены результаты исследования по определению зависимости скорости ферментативной реакции при
5 ИФА от массы мембраны и количества антител, иммобилизованных на ней.
В целях экономии антител и носителя целесообразно использовать для иммобилизации антитела в количестве 15-35 мкг на
0 9-10 мг носителя. Мембраны массой 3,3 мг можно использовать только для ИФА разбавленных растворов при содержании ТШ- ВТМ от 0,003-3,0 нг в определяемой пробе. При идентификации вируса выше этих коли5 честв в пробе наблюдались искажения результатов.
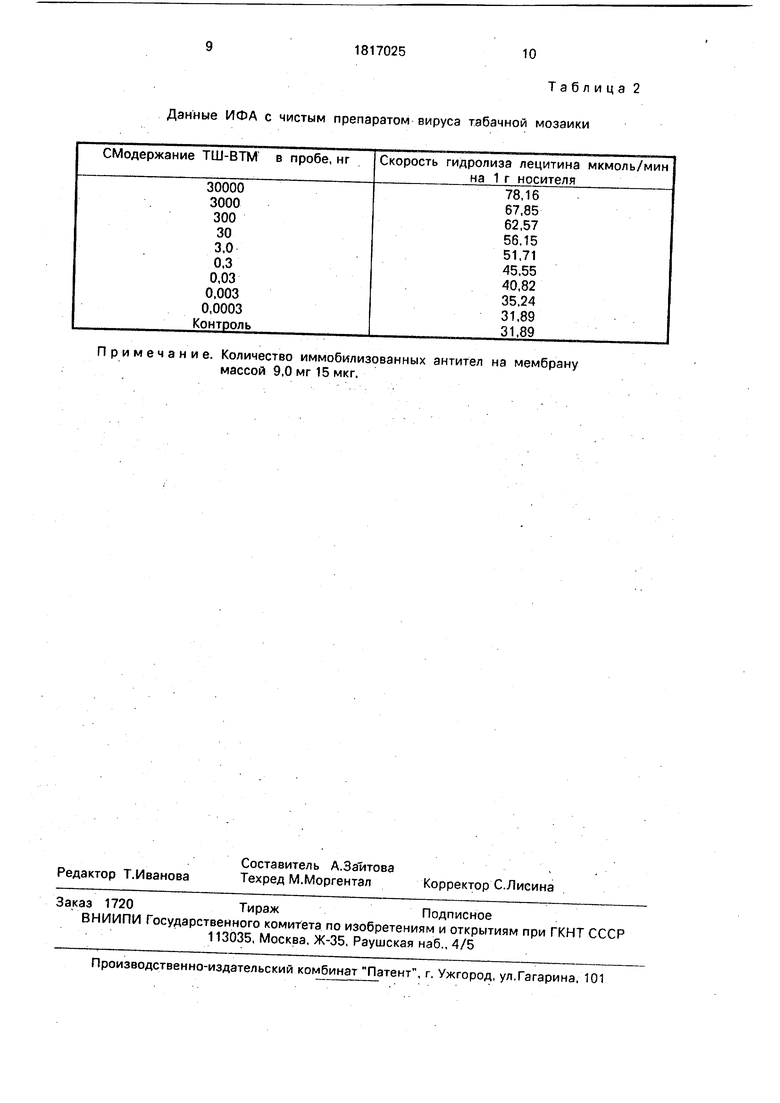
В табл.2 представлены результаты, из которых видно, что чувствительность составляет 0,003-0,030 нг ВТМ в пробе.
0 Данные приведенные втабл.2 получены без применения тритона Х-100 для промывочных операций. Использование 0,1-0,5%- ного тритона Х-100 для промывки мембран снижает фон в 2-3 раза.
5 Кроме того следует отметить, что имеющийся фон ниже по сравнению с адсорбционной иммобилизацией.
Предлагаемый способ имеет следующее преимущества по сравнению с прототипом: увеличивается чувствительно
(0,003 нг - 0,030 нг ВТМ в пробе против 1,0 нг) и повышается точность анализа, возрастает кратность использования носителя, а также расширяются возможности методов идентификации продуктов ферментивной реакции.
Формула изобретения Способ определения вируса табачной мозаики (ВТМ), включающий нанесение антител на носитель, промывание, добавление ВТМ, конъюгированных с ферментом анти0
тел и субстрата, с последующей регистрацией продуктов ферментативной реакции, отличающийся тем, что, с целью повышения чувствительности способа и возможности многократного использования носителя, в качестве носителя используют полиамидные плоские мембраны, образованные 2-3%-ным раствором глута- рового диальдегида ил и 0,4Н,2%-ный раствором госсипола и антителами, в качестве фермента используют фосфолипазу Аа, а в качестве субстрата -яичный лецитин,



| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ КОЛИЧЕСТВЕННОГО ОПРЕДЕЛЕНИЯ ВИРУСОВ | 1993 |
|
RU2065497C1 |
| СПОСОБ КОЛИЧЕСТВЕННОГО ОПРЕДЕЛЕНИЯ РАСТИТЕЛЬНЫХ ВИРУСОВ | 1994 |
|
RU2083986C1 |
| МЕМБРАНА ДЛЯ РАЗДЕЛЕНИЯ КОМПОНЕНТОВ ИММУНОЛОГИЧЕСКОЙ РЕАКЦИИ | 1992 |
|
RU2038600C1 |
| МОНОКЛОНАЛЬНОЕ АНТИТЕЛО К ВИРУСУ ТИПА А ГРИППА И УСТРОЙСТВО ДЛЯ ИММУННОГО АНАЛИЗА С ИСПОЛЬЗОВАНИЕМ АНТИТЕЛА | 2004 |
|
RU2366662C2 |
| БЕЛКИ ЛИЗИСА КЛЕТОК VERO, СПОСОБ ИХ ПОЛУЧЕНИЯ И НАБОР ДЛЯ ОПРЕДЕЛЕНИЯ БЕЛКОВ КЛЕТКИ-ХОЗЯИНА ДЛЯ КЛЕТОК VERO, СОДЕРЖАЩИЙ БЕЛКИ ЛИЗИСА | 2008 |
|
RU2526131C2 |
| УСТРОЙСТВО ДЛЯ ИММУННОГО АНАЛИЗА С ИСПОЛЬЗОВАНИЕМ АНТИТЕЛА К ВИРУСУ ГРИППА ТИПА B | 2004 |
|
RU2366663C2 |
| СПОСОБ ВЫЯВЛЕНИЯ АНТИГЕНА ИЛИ АНТИТЕЛА В ИММУНОФЕРМЕНТНОМ АНАЛИЗЕ | 2007 |
|
RU2376604C2 |
| ШТАММ ГИБРИДНЫХ КЛЕТОК ЖИВОТНЫХ Mus musculus 5G6 - ПРОДУЦЕНТ МОНОКЛОНАЛЬНЫХ АНТИТЕЛ, СПЕЦИФИЧНЫХ К V АНТИГЕНУ Yersinia pestis | 2011 |
|
RU2478703C1 |
| ШТАММ ГИБРИДНЫХ КЛЕТОК ЖИВОТНЫХ Mus musculus 2B8 - ПРОДУЦЕНТ МОНОКЛОНАЛЬНЫХ АНТИТЕЛ, СПЕЦИФИЧНЫХ К V АНТИГЕНУ Yersinia pestis | 2011 |
|
RU2478704C1 |
| Способ визуального иммуноферментного анализа биологически активных веществ | 1989 |
|
SU1718121A1 |
Использование: в сельском хозяйстве и в MMMyHo6nofexh orHH для диагностики растительных вирусов. Сущность изобретения: антитела связывают с носителем - плоскими полиамидными мембранами при помощи 2,0-3,0%-ного раствора глутарово- го диальдегида или 0,4-1,2%-ного раствора госсипола, добавляют вирус табачной мозаики и антитела, меченные фосфолипазой АЗ. В качестве субстрата используют яичный лецитин, регистрируют продукты ферментативной реакции потенциометрически. Способ позволяет повысить чувствительность анализа и многократно использовать носитель с иммобилизованными антителами. 2 табл.
Влияние массы мембраны и количества антител на скорость ферментативной реакции
Примечание. При проведении ИФА на мембране, содержание ТШ-ВТМ в пробе 3,0 нг.
15
Таблица 1
Данные ИФА с чистым препаратом вируса табачной мозаики
Примечание. Количество иммобилизованных антител на мембрану массой 9,0мг15мкг.
Таблица 2
| J.Gen.Virot, 1977, у 34, №2, р.475-483. |
Авторы
Даты
1993-05-23—Публикация
1991-09-21—Подача